TERBALIK PADA PEMISAHAN KLORAMFENIKOL DAN LIDOKAIN HIDROKLORIDA DALAM SEDIAAN TETES TELINGA COLME®
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Ilmu Farmasi
Oleh:
Winarti H. Wibowo NIM: 088114039
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
ii
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
iv
HALAMAN PERSEMBAHAN
“Kesuksesan itu jangan dilihat dari hasil yang dicapai tetapi lihatlah
dari proses hingga mendapatkan hasil yang dicapai tersebut”
“Looking your dream, it’s like looking place far away. The important thing is don’t ever think about giving up, STAND
UP again towards the dream you’ll meet someday”
“Orang yang pesimistik selalu menemukan kesulitan dalam
setiap kesempatan. Orang yang optimistik justru menemukan
peluang disetiap kesempatan” –Lawrence P.J.-
“Hidup itu keras, mampukan dirimu untuk bertahan di
setiap rintangan dan cobaan. Jadikan semua itu pengalaman yang berarti dalam hidupmu”
Karyaku ini kupersembahbahkan kepada:
Keluargaku tercinta
Sahabat-sahabat setiaku
Teman-teman seperjuangan
Almamaterku
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vi
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan anugrah yang diberikan sehingga penelitian dan penyusunan skripsi yang berjudul “Optimasi Metode Kromatografi Cair Kinerja Tinggi Fase Terbalik
pada Pemisahan Kloramfenikol dan Lidokain Hidroklorida dalam Sediaan Tetes Telinga Colme®” dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk meraih gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Dalam pelaksanaan penelitian hingga selesainya penyusunan skripsi ini, penulis mendapat banyak dukungan dan bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Bapak Ipang Djunarko, M.Sc., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu Christine Patramurti, M.Si., Apt. selaku Dosen Pembimbing yang telah membimbing dan memberikan pengarahan, masukan dan saran selama berjalannya penelitian hingga berakhirnya penyusunan skripsi.
3. Bapak Jeffry Julianus, M.Si. dan Ibu Dra. MM. Yetty Tjandrawati, M.Si. selaku Dosen Penguji yang telah memberikan saran dan kritik yang membangun dalam penyusunan skripsi.
4. Prof. Dr. Sudibyo Martono, M.S., Apt. dan Ibu Prof. Dr. Sri Noegrohati, Apt. selaku Dosen Pengajar yang telah bersedia menyediakan waktu untuk diskusi pribadi terkait penelitian ini.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
vii
memberikan ilmu yang bermanfaat demi kemajuan mahasiswa dan mahasiswi dalam berkarya dalam bidang farmasi.
6. PT. Interbat yang telah bersedia memberikan senyawa standar yang berguna bagi penelitian.
7. Seluruh staf kemananan, staf laboratorium kimia Fakultas Farmasi Universitas Sanata Dharma terutama Mas Bimo, Pak Parlan, Mas Kunto, Mas Otok, dan Pak Timbul yang telah banyak membantu selama penelitian di laboratorium dan menyediakan sarana untuk terselesaikannya seluruh kegiatan akademik dengan lancar.
8. Martha Herati sebagai sahabat terdekatku yang selalu menyemangatiku untuk belajar dan mengenal arti kehidupan.
9. Pakde, bude, mas sunu, mas damar, mas daru, mba vero yang menjadi keluargaku selama berada di Yogyakarta dan telah memberikan semangat, doa dan dukungan dalam penyusunan skripsi ini.
10.Efrida Lusia Sari Tambunan dan Theresia Wijayanti sebagai teman seperjuangan skripsi dan tempat saling berbagi suka dan duka. Terima kasih atas semangat, doa, kegigihan dan kebersamaannya selama ini. 11.Felicia, Prasilya dan Sasa sebagai teman seperjuangan skripsi satu tema
yang selalu membantu dan memberikan semangat.
viii
13.Teman kelompok bermainku: Dea, Siska, Yessi, Lia, Lala yang selalu menyemangatiku dan memberikan saran, doa dan tempat saling berbagi suka dan duka.
14.Semua teman-teman FST A yang telah menjadi teman terbaik selama berada di Fakultas Farmasi Universitas Sanata Dharma.
15.Seluruh teman-teman Farmasi angkatan 2008, terima kasih atas pengalaman dan kebersamaan selama ini.
16.Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu penulis dalam mewujudkan skripsi ini. Terima kasih atas dukungannya.
Penulis menyadari bahwa masih di dalam skripsi ini masih banyak kekurangan. Oleh karena itu, segala kritik dan saran yang membangun sangat penulis harapkan. Semoga skripsi ini membantu dan bermanfaat bagi pembaca dan dapat berguna bagi perkembangan ilmu pengetahuan.
Penulis
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
ix
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERSETUJUAN PUBLIKASI KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xix
INTISARI ... xxi
ABSTRACT ... xxii
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian... 3
3. Manfaat penelitian ... 4
B. Tujuan Penelitian... 4
BAB II. PENELAAHAN PUSTAKA ... 5
x
B. Lidokain Hidroklorida ... 6
C. Obat Tetes Telinga ... 6
D. Spektrofotometer UV ... 7
E. Kromatografi Cair Kinerja Tinggi ... 9
1. Pengenalan dan instrumentasi KCKT ... 9
2. Kromatografi partisi fase terbalik ... 12
3. Pemisahan puncak dalam kromatografi ... 13
F. Landasan Teori ... 20
G. Hipotesis ... 21
BAB III. METODE PENELITIAN ... 22
A. Jenis dan Rancangan Penelitian ... 22
B. Variabel Penelitian ... 22
1. Variabel bebas ... 22
2. Variabel tergantung ... 22
3. Variabel pengacau terkendali ... 22
C. Definisi Operasional ... 23
D. Bahan-bahan Penelitian ... 23
E. Alat-alat Penelitian ... 23
F. Tata Cara Penelitian ... 24
1. Pembuatan fase gerak ... 24
2. Pembuatan larutan baku kloramfenikol dan lidokain hidroklorida yang digunakan untuk untuk penentuan panjang gelombang pengamatan ... 24
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xi
yang digunakan untuk optimasi dengan metode KCKT ... 25
4. Pembuatan campuran kloramfenikol dan lidokain hidroklorida... 26
5. Penentuan panjang gelombang pengamatan kloramfenikol dan lidokain hidroklorida dengan spektrofotometer UV-Vis... 26
6. Preparasi sampel ... 26
7. Optimasi pemisahan kloramfenikol dan lidokain hidroklorida dengan metode KCKT fase terbalik ... 27
G. Analisis Hasil ... 29
1. Bentuk peak pemisahan kloramfenikol dan lidokain hidroklorida ... 29
2. Waktu retensi (tR) ... 30
3. Nilai resolusi ... 30
4. Nilai HETP ... 31
5. Reprodusibilitas ... 31
BAB IV. HASIL DAN PEMBAHASAN ... 32
A. Pemilihan Pelarut ... 32
B. Pembuatan Fase Gerak ... 32
C. Pembuatan Larutan Baku ... 34
D. Penentuan Panjang Gelombang Pengamatan Kloramfenikol dan Lidokain Hidroklorida dengan Spektrofotometer UV-Vis ... 36
xii
1. Fase gerak metanol:aquabides 75:25 dengan flow rate 0,8; 1,0;
dan1,2 mL/menit ... 46
2. Fase gerak metanol:aquabides 85:15 dengan flow rate 0,8; 1,0; dan 1,2 mL/menit ... 50
3. Fase gerak metanol:aquabides 95:5 dengan flow rate 0,8; 1,0; dan 1,2 mL/menit ... 54
BAB V. KESIMPULAN DAN SARAN ... 64
A. Kesimpulan ... 64
B. Saran ... 64
DAFTAR PUSTAKA ... 65
LAMPIRAN ... 68
BIOGRAFI PENULIS ... 139
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xiii
. ... Halaman Tabel I. Karakteristik beberapa pelarut pada KCKT ... 11 Tabel II. Komposisi fase gerak metanol p.a:aquabides ... 24 Tabel III. Indeks polaritas campuran fase gerak metanol:aquabides ... 33 Tabel IV. Waktu retensi baku kloramfenikol, baku lidokain
hidroklorida dan baku campuran kloramfenikol dan lidokain hidroklorida ... 40 Tabel V. Tekanan kolom (kgf/cm2=kPa) ... 44 Tabel VI. Hasil optimasi kloramfenikol dan lidokain hidroklorida
berdasar parameter Asymmetry Factor (AF) dengan fase gerak metanol:aquabides 75:25; 85:15; dan 95:5 pada flow rate 0,8; 1,0; dan 1,2 mL/menit ... 45
Tabel VII. Hasil optimasi flow rate baku campuran kloramfenikol dan lidokain hidroklorida dengan fase gerak metanol:aquabides 95:5 ... 58 Tabel VIII. Data hasil perhitungan %CV waktu retensi baku campuran
kloramfenikol dan lidokain hidroklorida ... 60 Tabel IX. Data hasil perhitungan %CV nilai resolusi baku campuran
kloramfenikol dan lidokain hidroklorida ... 61 Tabel XII. Data hasil perhitungan %CV waktu retensi dan nilai resolusi
xiv
DAFTAR GAMBAR
Halaman Gambar 1. Struktur Kloramfenikol (D-treo-(-)-2,2-Dikloro-N-(β
-hidroksi-α-(hidroksimetil)-p)nitrofenetilasetamida) ... 5
Gambar 2. Struktur Lidokain Hidroklorida (2-(Dietilamino)-2’,6’ -aetoksilidida monohidroklorida monohidrat) ... 6
Gambar 3. Instrumentasi KCKT ... 9
Gambar 4. Mekanisme pemisahan kromatografi partisi fase terbalik ... 13
Gambar 5. Perhitungan bilangan lempeng teoritik ... 14
Gambar 6. Difusi Eddy ... 15
Gambar 7. Transfer massa pada fase diam ... 17
Gambar 8. Transfer massa pada fase gerak ... 17
Gambar 9. Pemisahan dua senyawa ... 18
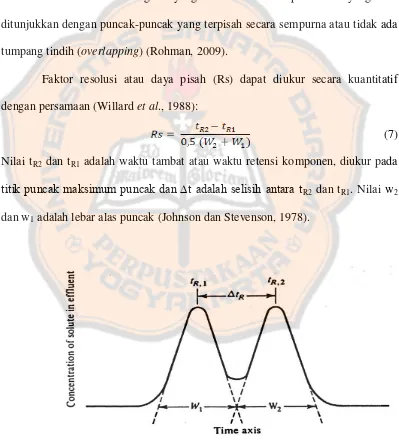
Gambar 10. Penentuan Peak Asymmetry dan Peak Tailing Factor ... 20
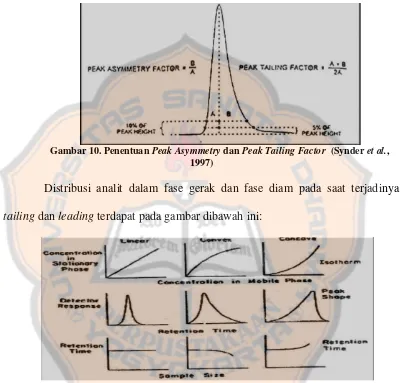
Gambar 11. Distribusi analit dalam fase diam dan fase gerak ... 20
Gambar 12. Gugus kromofor dan auksokrom pada kloramfenikol ... 37
Gambar 13. Gugus kromofor dan auksokrom pada lidokain hidroklorida . 37 Gambar 14. Spektra panjang gelombang maksimum kloramfenikol 13 ppm (A) dan lidokain hidroklorida 300 ppm (B) ... 37
Gambar 15. Spektra panjang gelombang maksimum kloramfenikol 19,5 ppm (A) dan lidokain hidroklorida 450 ppm (B) ... 38
Gambar 16. Spektra panjang gelombang maksimum kloramfenikol 26 ppm (A) dan lidokain hidroklorida 600 ppm (B) ... 38
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xv
18
(oktadesilsilan) melaluiinteraksi Van Der Waals... 41 Gambar18. Interaksi lidokain hidroklorida dengan fase diam C18
(oktadesilsilan) melalui interaksi Van Der Waals dan interaksi ion-dipol ... 41 Gambar 19. Interaksi hidrogen antara kloramfenikol dengan fase gerak
metanol:aquabides ... 42 Gambar 20. Interaksi hidrogen antara lidokain hidroklorida dengan fase
gerak metanol:aquabides ... 42 Gambar 21. Kromatogram kloramfenikol (A.1), lidokain hidroklorida
(A.2) dengan fase gerak metanol:aquabides 75:25 dan flow rate 0,8 mL/menit ... 46
Gambar 22. Kromatogram kloramfenikol (B.1), lidokain hidroklorida (B.2) dengan fase gerak metanol:aquabides 75:25 dan flow rate 1,0 mL/menit... 47
Gambar 23. Kromatogram kloramfenikol (C.1), lidokain hidroklorida (C.2) dengan fase gerak metanol:aquabides 75:25 dan flow rate 1,2 mL/menit... 48
xvi
Gambar 25. Kromatogram kloramfenikol (B.1), lidokain hidroklorida (B.2) dengan fase gerak metanol:aquabides 85:15 dan flow rate 1,0 mL/menit ... 51
Gambar 26. Kromatogram kloramfenikol (C.1), lidokain hidroklorida (C.2) dengan fase gerak metanol:aquabides 85:15 dan flow rate 1,2 mL/menit ... 52
Gambar 27. Kromatogram kloramfenikol (A.1), lidokain hidroklorida (A.2) dengan fase gerak metanol:aquabides 95:5 dan flow rate 0,8 mL/menit ... 54
Gambar 28. Kromatogram kloramfenikol (B.1), lidokain hidroklorida (B.2), baku campuran kloramfenikol dan lidokain hidroklorida (B.3) dengan fase gerak metanol:aquabides 95:5 dan flow rate 1,0 mL/menit ... 55 Gambar 29. Kromatogram kloramfenikol (C.1), lidokain hidroklorida
(C.2), baku campuran kloramfenikol dan lidokain hidroklorida (C.3) dengan fase gerak metanol:aquabides 95:5 dan flow rate 1,2 mL/menit ... 56 Gambar 30. Kromatogram kloramfenikol dan lidokain hidroklorida dalam
sediaan tetes telinga Colme® pada replikasi 1, replikasi 2, dan replikasi 3 dengan komposisi fase gerak dan flow rate hasil optimasi... 62
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvii
Halaman Lampiran 1. Sertifikat analisis kloramfenikol ... 69 Lampiran 2. Sertifikat analisis lidokain hidroklorida ... 70 Lampiran 3. Kromatogram hasil optimasi flow rate pada fase gerak
metanol:aquabides (75:25) ... 71 Lampiran 4. Nilai Asymmetry Factor (AF) peak kloramfenikol dan
lidokain hidroklorida pada fase gerak metanol:aquabides (75:25) dan contoh perhitungannya ... 77 Lampiran 5. Kromatogram hasil optimasi flow rate pada fase gerak
metanol:aquabides (85:15) ... 79 Lampiran 6. Nilai Asymmetry Factor (AF) peak kloramfenikol dan
lidokain hidroklorida pada fase gerak metanol:aquabides (85:15) dan contoh perhitungannya ... 85 Lampiran 7. Kromatogram hasil optimasi flow rate pada fase gerak
metanol:aquabides (95:5) ... 87 Lampiran 8. Nilai Asymmetry Factor (AF) peak kloramfenikol dan
lidokain hidroklorida pada fase gerak metanol:aquabides (95:5) dan contohperhitungannya ... 95 Lampiran 9. Nilai resolusi dan HETP pada fase gerak
metanol:aquabides (95:5) dan contoh perhitungannya ... 97 Lampiran 10. Reprodusibilitas: Kromatogram baku kloramfenikol, baku
xviii
lidokain hidroklorida pada fase gerak metanol:aquabides (95:5) flow rate 1,0 mL/menit ... 100 Lampiran11. Reprodusibilitas: Kromatogram kloramfenikol dan
lidokain hidroklorida dalam sediaan tetes telinga Colme® .. 127 Lampiran 12. Data hasil uji reprodusibilitas sistem dan perhitungan
%CV ... 130
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xix
Kloramfenikol dan lidokain hidroklorida merupakan zat aktif yang terdapat dalam sediaan tetes telinga Colme®. Dalam produk tetes telinga perlu adanya penjaminan mutu terkait kadar senyawa aktifnya sehingga semakin terjamin keamanan dan khasiatnya. Pada penelitian ini digunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik sebagai metode analisis kloramfenikol dan lidokain hidroklorida dalam sediaan tetes telinga Colme®.
Penelitian ini bertujuan untuk mengetahui kondisi optimum dari KCKT sehingga dapat digunakan sebagai penetapan kadar kloramfenikol dan lidokain hidroklorida dalam sediaan tetes telinga Colme®. Sistem KCKT fase terbalik menggunakan kolom C18 dengan fase gerak metanol:aquabides. Optimasi dilakukan dengan mengubah-ubah komposisi fase gerak metanol:aquabides (75:25), (85:15) dan (95:5) serta mengubah-ubah flow rate yaitu 0,8; 1,0; dan 1,2 mL/menit dengan detektor ultraviolet pada λmaks 265 nm.
Kondisi optimum sistem KCKT yang didapatkan adalah fase gerak metanol:aquabides (95:5) pada flow rate 1,0 mL/menit. Kondisi optimum ini telah memenuhi parameter pemisahan yang baik yaitu peak yang simetri, tR kurang dari 10 menit, nilai resolusi ≥ 1,5 yaitu 3,1819, dan nilai HETP yang paling kecil yaitu 0,0128.
xx
ABSTRACT
Chloramphenicol and lidocaine hydrochloride is the active substances contained in preparations Colme® ear drops. Ear drops needs the quality assurance of products related to levels of the active compounds, so security is ensured and usability. In this study using High Performance Liquid Chromatography (HPLC) reverse phase as a method of analysis of chloramphenicol and lidocaine hydrochloride in the preparation Colme® ear drops.
This study aims to determine the optimum conditions for HPLC can be used as a test of lidocaine hydrochloride and chloramphenicol in the preparation Colme® ear drops. Reverse phase HPLC system using C18 column with mobile phase methanol:aquabidest. Optimization is done by changing the composition of mobile phase methanol:aquabidest (75:25), (85:15) and (95:5) and varying the flow rate of 0,8; 1,0; and 1,2 mL/min with an ultraviolet detector at λmaks 265 nm.
The optimal conditions obtained by HPLC system is the mobile phase methanol: aquabidest (95:5) at flow rate of 1,0 mL/min. Optimal conditions in accordance with the parameters of a good separation of the peak of the symmetry, tR less than 10 minutes, the value of resolution ≥ 1,5 is 3,1819, and the lowest HETP is 0,0128.
Key words: chloramphenicol, lidocaine hydrochloride, ear drops, optimization methods, reversed-phase HPLC
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
1
BAB I
PENGANTAR
A. Latar Belakang
Guttae auricularies atau obat tetes telinga adalah bahan obat berbentuk
cairan yang cara penggunaanya dengan meneteskan ke dalam saluran telinga, kecuali dibuat dengan pembawa bukan air (Dirjen POM RI, 1974). Colme® adalah salah satu jenis obat tetes telinga yang beredar di Indonesia. Colme® mengandung senyawa antibiotik yaitu kloramfenikol 10% dan obat pemati rasa yaitu lidokain hidroklorida 4% (Anonim, 2006).
Kloramfenikol memiliki kelarutan 1 bagian di dalam 400 bagian air dan 1 bagian didalam 2,5 bagian etanol, sangat larut di eter dan kloroform (Clarke, 1969). Menurut Farmakope Indonesia edisi IV (1995), tetes telinga kloramfenikol adalah larutan steril kloramfenikol dalam pelarut yang sesuai, mengandung tidak kurang dari 90,0 % dan tidak lebih dari 130% C11H12Cl2N2O5 dari jumlah yang tertera pada etiket.
2
% dan tidak lebih dari 105,0% dari jumlah yang tertera pada etiket (Dirjen POM RI, 1995).
Dalam rangka menjamin kandungan mutu dari bentuk sediaan Colme®, dibutuhkan suatu metode yang sensitif dan selektif sehingga khasiat dan keamanannya benar-benar dapat dipertanggungjawabkan. Oleh karena itu, metode yang dipilih sebagai metode analisis dalam pemisahan kloramfenikol dan lidokain hidroklorida dalam sediaan tetes telinga Colme® adalah metode KCKT fase terbalik. Metode KCKT ini sering digunakan sebagai metode analisis kuantitatif atau penetapan kadar suatu senyawa tertentu di dalam suatu matriks yang kompleks atau terdapat banyak komponen lain di dalam matriks sampel (Khopkar, 1990). Detektor yang digunakan adalah detektor UV karena kloramfenikol dan lidokain hidroklorida memiliki spektrum absorbsi pada sinar ultraviolet. Kloramfenikol di dalam metanol memiliki spektrum absorbsi pada sinar ultraviolet yaitu pada 272 nm ( ) dan lidokain hidroklorida di dalam metanol memiliki spektrum absorbsi pada sinar ultraviolet pada 263 nm (
) dan 271 nm ( ) (Dibbern, Muller and Wirbitzki, 2002).
Penetapan kadar kloramfenikol dan benzokain dalam suatu bentuk sediaan dengan menggunakan kromatografi cair kinerja tinggi fase terbalik pernah dilakukan oleh Sadana dan Ghogare (1990). Fase diam yang digunakan adalah kolom µBondapak C18 (300 mm x 3,9 mm i.d; ukuran partikel 5µ m) dan fase gerak metanol:aquabides (36:65 v/v). Hal yang membedakan penelitian ini dengan penelitian Sadana dan Ghogare adalah senyawa yang akan dipisahkan, yaitu kloramfenikol dan lidokain hidroklorida. Selain itu kolom yang akan digunakan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
pada penelitian ini adalah Kromasil sedangkan Sadana dan Ghogare adalah kolom µBondapak. Adanya perbedaan tersebut maka diperlukan adanya suatu penelitian optimasi pemisahan kedua senyawa tersebut untuk mendapatkan kondisi optimal.
Optimasi metode KCKT bertujuan untuk mengetahui kondisi yang optimum pada metode KCKT sehingga dapat digunakan sebagai metode penetapan kadar campuran kloramfenikol dan lidokain hidroklorida pada obat tetes telinga Colme®. Kondisi yang optimum yang diharapkan adalah bentuk peak yang simetri, waktu retensi (tR) < 10 menit, nilai resolusi ≥ 1,5 terhadap peak terdekat, dan nilai HETP yang semakin kecil (Synder, Kirkland, and Glajh, 1997). Optimasi yang dilakukan adalah dengan mengubah komposisi fase gerak dan kecepatan alir atau flow rate sehingga parameter-parameter yang telah disebutkan tersebut dapat terpenuhi.
1. Permasalahan
Berdasarkan latar belakang, permasalahan yang diperoleh adalah bagaimanakah komposisi fase gerak dan flow rate yang optimum yang dapat menghasilkan pemisahan dengan peak yang simetri, waktu retensi (tR) < 10 menit, nilai resolusi ≥ 1,5 terhadap peak terdekat, dan nilai HETP yang semakin kecil
untuk penetapan kadar campuran kloramfenikol dan lidokain hidroklorida pada obat tetes telinga Colme® dengan menggunakan metode KCKT fase terbalik?
2. Keaslian penelitian
4
diam yang digunakan adalah kolom µBondapak C18 (300 mm x 3,9 mm i.d; ukuran partikel 5µ m) dan fase gerak metanol:aquabides (36:65 v/v). Akan tetapi, penelitian berupa optimasi campuran kloramfenikol dan lidokain hidroklorida dengan metode kromatografi cair kinerja tinggi fase terbalik belum pernah dilakukan sebelumnya.
3. Manfaat penelitian
a. Manfaat metodologis. Menjadi sumbangan karya ilmiah tentang metode penelitian dalam melakukan optimasi alat KCKT untuk penetapan kadar campuran kloramfenikol dan lidokain hidroklorida dalam sediaan topikal.
b. Manfaat praktis. Dapat digunakan sebagai metode awal untuk validasi dan penetapan kadar kloramfenikol dan lidokain hidroklorida yang nantinya dapat memberikan informasi bagi masyarakat mengenai penjaminan mutu pada obat tetes telinga yang mengandung kedua obat tersebut.
B. Tujuan Penelitian
Berdasarkan latar belakang dan permasalahan di atas, maka penelitian ini bertujuan untuk mengetahui komposisi fase gerak dan flow rate yang optimum yang dapat menghasilkan pemisahan dengan peak yang simetri, waktu retensi (tR) < 10 menit, nilai resolusi ≥ 1,5 terhadap peak terdekat, dan nilai HETP yang semakin kecil untuk validasi dan penetapan kadar campuran kloramfenikol dan lidokain hidroklorida pada obat tetes telinga Colme® dengan menggunakan metode KCKT fase terbalik.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
5
BAB II
PENELAAHAN PUSTAKA
A. Kloramfenikol
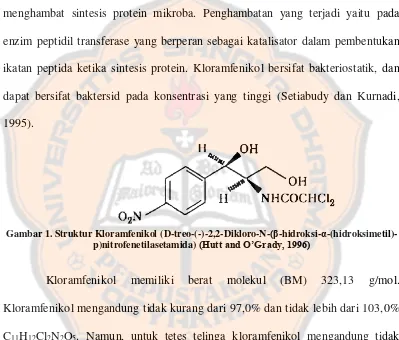
Kloramfenikol adalah senyawa antimikroba yang bekerja dengan cara menghambat sintesis protein mikroba. Penghambatan yang terjadi yaitu pada enzim peptidil transferase yang berperan sebagai katalisator dalam pembentukan ikatan peptida ketika sintesis protein. Kloramfenikol bersifat bakteriostatik, dan dapat bersifat baktersid pada konsentrasi yang tinggi (Setiabudy dan Kurnadi, 1995).
Gambar 1. Struktur Kloramfenikol (D-treo-(-)-2,2-Dikloro-N-(β-hidroksi-α -(hidroksimetil)-p)nitrofenetilasetamida) (Hutt and O’Grady, 1996)
6
( ) (Dibbern et al., 2002). Kloramfenikol memiliki pH antara 4,5 dan 7,5 (Dirjen POM RI, 1995), dan pKa 5,5 (Clarke, 1969).
B. Lidokain Hidroklorida
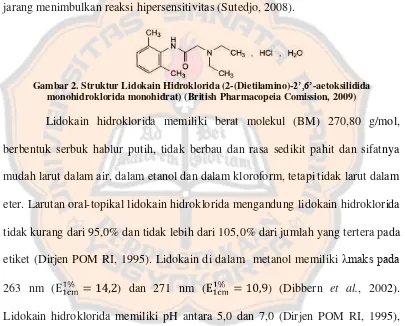
Lidokain memiliki daya kerja yang cepat dan merupakan obat anestesi lokal yang paling sering digunakan karena lebih stabil dalam pemanasan dan jarang menimbulkan reaksi hipersensitivitas (Sutedjo, 2008).
Gambar 2. Struktur Lidokain Hidroklorida (2-(Dietilamino)-2’,6’-aetoksilidida monohidroklorida monohidrat) (British Pharmacopeia Comission, 2009)
Lidokain hidroklorida memiliki berat molekul (BM) 270,80 g/mol, berbentuk serbuk hablur putih, tidak berbau dan rasa sedikit pahit dan sifatnya mudah larut dalam air, dalam etanol dan dalam kloroform, tetapi tidak larut dalam eter. Larutan oral-topikal lidokain hidroklorida mengandung lidokain hidroklorida tidak kurang dari 95,0% dan tidak lebih dari 105,0% dari jumlah yang tertera pada etiket (Dirjen POM RI, 1995). Lidokain di dalam metanol memiliki λmaks pada 263 nm ( ) dan 271 nm ( ) (Dibbern et al., 2002). Lidokain hidroklorida memiliki pH antara 5,0 dan 7,0 (Dirjen POM RI, 1995), dan pKa 7,9 (25°) (Clarke, 1969).
C. Obat Tetes Telinga
Tetesan (guttae) adalah sediaan cair yang mengandung bahan obat atau sediaan obat atau bahan obat dan sediaan obat terlarut, teremulsi, atau tersuspensi,
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
ditakar berdasar jumlah tetesan, digunakan untuk diminum dan diisikan ke dalam wadah bertakaran ganda. Untuk tetesan tertentu yang digunakan di telinga, dinamakan tetes telinga (otoguttae) (Voigt, 1994).
Menurut Farmakope Indonesia edisi IV, obat tetes telinga (guttae auriculares) adalah obat tetes yang digunakan dengan cara meneteskan ke dalam
telinga. Kecuali dinyatakan lain, dibuat dengan menggunakan pembawa bukan air. Pembawa pada obat tetes telinga harus mempunyai kekentalan yang cocok hingga obat mudah menempel. Pada umumnya digunakan gliseril dan propilenglikol, selain itu dapat juga menggunakan etanol, heksilenglikol, dan minyak lemak nabati (Dirjen POM RI, 1995).
D. Spektrofotometer UV
Teknik spektroskopik merupakan salah satu teknik analisis fisiko-kimia yang mengamati interaksi atom atau molekul dengan suatu radiasi elektromagnetik (REM) (Mulja dan Suharman, 1995). Metode analisis spektrofotometri ultraviolet didasarkan pada substitusi pada daerah panjang gelombang sekitar 190-380 nm (Khopkar, 1990).
8
Ada empat tipe transisi elektronik yang mungkin terjadi yaitu σ σ*, n
σ*, n π*, dan π π* (Mulja dan Suharman, 1995). Pada transisi σ σ*, elektron pada suatu orbital σ tereksitasi ke orbital σ*, dengan mengabsorbsi
radiasi. Anti-ikat Transisi n σ* terjadi dalam senyawa-senyawa jenuh dengan elektron tidak berpasangan. Transisi tersebut memerlukan energi yang lebih kecil dan terjadi dalam daerah 150-250 nm dengan є = 100-3000. Transisi n π* dan π π*mencakup sebagian besar senyawa organik. Energi yang diperlukan untuk
transisi menghasilkan absorbsi maksimum dalam daerah 200-700 nm. Dengan adanya orbital π berarti terdapat gugus fungsi tidak jenuh. Transisi n π*
memiliki є = 10-100 L/cm/mol sedangkan transisi π π* memiliki є = 1000 -10.000 L/cm/mol (Khopkar, 1990).
Kromofor merupakan suatu gugus fungsional tidak jenuh yang menyediakan orbital π yang dapat menyerap pada daerah ultraviolet (Skoog,
1985). Sedangkan auksokrom merupakan gugus jenuh yang bila terikat pada kromofor mengubah panjang gelombang dan intensitas serapan maksimum, cirinya adalah heteroatom yang langsung terikat pada kromofor (Sastrohamidjojo, 2001).
Spektrometer menghasilkan sinar dari spektrum panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau diabsorbsi. Sehingga, spektrofotometer digunakan untuk mengukur energi yang ditransmisikan, direfleksikan atau diemisikan sebagai fungsi dari panjang gelombang (Khopkar, 1990).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
E. Kromatografi Cair Kinerja Tinggi
1. Pengenalan dan instrumentasi KCKT
Kromatografi cair kinerja tinggi atau yang dikenal dengan HPLC (High Performance Liquid Chromatography) mulai dikembangkan akhir tahun 1960 dan
awal tahun 1970 (Rohman, 2009). Penggunaan High Performance Liquid Chromatography (HPLC) tidak terbatas untuk sampel yang bersifat volatil atau stabilitasnya yang mudah dipengaruhi oleh suhu. HPLC dapat memisahkan makromolekul, spesies ion, produk alami yang bersifat labil, polimer, dan lain-lain (Willard, Merrit, Dean, and Settle, 1988).
Pemisahan dengan KCKT dapat dilakukan dengan fase normal atau fase terbalik. Fase normal apabila fase diamnya lebih polar dibandingkan dengan fase geraknya dan fase terbalik apabila fase diamnya lebih non polar daripada fase geraknya. Dengan adanya kedua pemisahan ini, sering kali KCKT dikelompokkan menjadi KCKT fase normal dan KCKT fase terbalik (Gritter, 1991).
10
Bagian yang harus diperhatikan pada kromatografi partisi fase terbalik adalah kolom, fase gerak, dan detektor.
a. Kolom. Oktadesil silika (ODS atau C18) adalah fase diam yang paling umum digunakan pada KCKT fase terbalik karena mampu memisahkan senyawa dengan kepolaran rendah, sedang dan tinggi (Rohman, 2009).
Panjang kolom KCKT biasanya sekitar 5-25 cm, dengan tekanan yang sangat tinggi yaitu sampai 6000 psi (Gritter, 1991). Standar diameter kolom HPLC sekitar 4-5 mm. Diameter partikel berada pada kisaran 4 sampai 7 µ m untuk kolom pada umumnya (Dean, 1995).
b. Fase gerak. Selain susunan kimiawi dari fase gerak, ada empat hal pada fase gerak yang harus diperhatikan yakni harus murni secara kimia, harus bebas partikel yang dapat menyumbat kolom, harus bebas gas yang terlarut, dan jika dilakukan pencampuran, maka saat pencampuran harus dicampur dengan benar (Gritter, 1991).
Komposisi fase gerak yang digunakan dapat mempengaruhi variasi retensi analit untuk pemisahan yang optimal. Sehingga fase gerak disesuaikan komposisinya agar diperoleh kepolaran relatif yang mirip dengan sampel untuk memperoleh pemisahan yang optimal (Willard et al., 1998).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Tabel I. Karakteristik beberapa pelarut pada KCKT (Synder et al., 1997)
Dalam pemilihan fase gerak yang sesuai, parameter yang dilihat berdasarkan kepolaran campuran pelarut yang semakin linier dengan pelarut murni. Tingkat kepolaran suatu pelarut menunjukkan kemampuan pelarut dalam mengelusi suatu senyawa. Besarnya polaritas dapat dihitung dengan cara seperti dibawah ini:
P’camp:Ф1 P’1 + Ф2 P’2 + ... + Фn P’n (1)
Keterangan: P’= indeks polaritas
Ф = fraksi volume pelarut (Gritter, 1991).
Semakin besar nilai indeks polaritas campuran maka fase gerak yang digunakan semakin polar (Synder et al., 1997).
c. Detektor. Secara umum suatu detektor harus memiliki karakteristik tertentu yaitu memiliki respon cepat terhadap solut, reprodusibel, memiliki sensitifitas tinggi, stabil dalam pengoperasian, signal yang dihasilkan berbanding lurus dengan konsentrasi solut, tidak dipengaruhi suhu dan kecepatan alir fase gerak (Rohman, 2009).
12
1) Bulk property detectors
Detektor ini merupakan detektor yang mengukur perubahan sifat fisik fase gerak dan solut. Detektor ini cenderung relatif tidak sensitif dan menghendaki suhu yang terkendali. Contohnya yaitu detektor indeks bias.
2) Solute Property detectors
Detektor ini hanya dapat mengukur sifat fisik solut dan 1000 kali lebih sensitif serta mampu mengukur solut sampai satuan nanogram atau lebih kecil lagi. Contohnya yaitu detektor fluoresensi, detektor penyerapan (UV-Vis), dan detektor elektrokimia (Munson, 1991).
2. Kromatografi partisi fase terbalik
Konsep dasar kromatografi partisi yaitu perlakuan sampel dalam kondisi cair-cair tergantung pada kelarutannya di dalam kedua cairan yang terlibat (Gritter, Bobbit, and Schwarting, 1991). Partisi analit di antara dua fase yang tidak saling campur, karena adanya perbedaan koefisien distribusi dari masing-masing senyawa. Jika solut ditambahkan ke dalam sistem yang terdiri dari dua pelarut tidak saling campur dan keseluruhan sistem dibiarkan setimbang, maka solut akan tersebar di antara kedua fase menurut persamaan:
(2)
K = koefisien distribusi
Cs = konsentrasi solut dalam fase diam
Cm = konsentrasi solut dalam fase gerak (Johnson dan Stevenson, 1978).
Mekanisme pemisahan pada kromatografi partisi fase terbalik dapat digambarkan sebagai berikut:
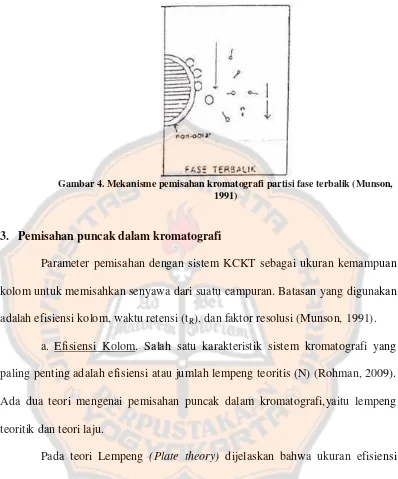
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Gambar 4. Mekanisme pemisahan kromatografi partisi fase terbalik (Munson, 1991)
3. Pemisahan puncak dalam kromatografi
Parameter pemisahan dengan sistem KCKT sebagai ukuran kemampuan kolom untuk memisahkan senyawa dari suatu campuran. Batasan yang digunakan adalah efisiensi kolom, waktu retensi (tR), dan faktor resolusi (Munson, 1991).
a. Efisiensi Kolom. Salah satu karakteristik sistem kromatografi yang paling penting adalah efisiensi atau jumlah lempeng teoritis (N) (Rohman, 2009). Ada dua teori mengenai pemisahan puncak dalam kromatografi,yaitu lempeng teoritik dan teori laju.
Pada teori Lempeng (Plate theory) dijelaskan bahwa ukuran efisiensi kolom adalah jumlah lempeng (plate number, N) yang didasarkan pada konsep lempeng teoritis (Rohman, 2009). Jumlah lempeng (N) dihitung dengan persamaan (Willard et al., 1988):
14
Nilai w adalah lebar alas, w1/2 adalah lebar alas puncak pada setengah tinggi puncak, dan tR adalah waktu retensi (Sastrohamidjojo, 2001). Persamaan dibawah ini menggambarkan hubungan anatra panjang kolom (L) dengan efisiensi kolom (H):
(4) Jumlah lempeng (N) yang tinggi disyaratkan untuk pemisahan yang baik yang nilainya sebanding dengan semakin panjang kolom (L) dan semakin kecilnya nilai H. H adalah tinggi ekivalen lempeng teoritis atau HETP (High Equivalent Theoritical Plate), merupakan panjang kolom yang dibutuhkan untuk
menghasilkan suatu lempeng teoritis. Kolom yang baik seharusnya memiliki jumlah plat teoritis (N) yang tinggi dan nilai H yang rendah. Ukuran partikel merupakan suatu hal yang berpengaruh pada nilai H, dimana semakin kecil ukuran partikel maka semakin tinggi bilangan lempeng teoritis (Rohman, 2009).
Gambar 5. Perhitungan bilangan lempeng teoritik (Willard et al., 1988)
Pada teori laju dapat diketahui adanya pengaruh variabel-variabel lain yang menyebabkan pelebaran peak, sedangkan teori lempeng hanya menggambarkan laju migrasi secara kuantitatif. Ketika migrasi, solut mengalami
N L HETP H
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
transfer pada fase diam dan fase gerak berkali-kali, solut bergerak bersama fase gerak sehingga migrasi di dalam kolom tidak teratur yang mengakibatkan laju rata-rata solut relatif terhadap fase gerak juga sangat bervariasi. Laju rata-rata solut relatif terhadap fase gerak bervariasi sehingga mengakibatkan pelebaran peak solut (Noegrohati, 1994).
Berdasarkan teori laju yang ada, efisiensi kolom dinyatakan dengan persamaan Van Deemter yang dinyatakan sebagai berikut:
(5)
(6)
Keterangan:
λ = tetapan ukuran ketidakteraturan kemasan dp = diameter rata-rata partikel penyangga D = kedifusian linarut dalam fase gerak k’ = Faktor kapasitas
µ = kecepatan alir
γ = faktor koreksi kelikuan saluran dalam kolom (Willard et al., 1988).
Berdasarkan persamaan Van Deemter di atas, hal-hal yang mempengaruhi efisiensi kolom yaitu Difusi Eddy, Difusi Longitudinal, dan Transfer Massa (Willard et al., 1988).
Difusi Eddy disebabkan oleh banyak kemungkinan pada kemasan kolom yang kurang baik.
16
Nomor 1 menunjukkan analit yang keluar lebih dahulu karena melewati kolom dengan partikel berukuran besar dan kurang kompak. Nomor 2 menunjukkan analit keluar lebih lambat dari nomor 1 karena ukuran partikel yang lebih kecil dan lebih kompak daripada nomor 1. Nomor 3, analit keluar paling akhir, hal ini terjadi karena melewati bagian kolom dengan ukuran partikel halus dan kompak (Noegrohati, 1994).
Menurut Willard (1988), difusi Eddy dinyatakan sebagai A (2λdp) yang menggambarkan ketidakhomogenan kecepatan alir dan panjang lintasan di sekitar partikel yang ter-packing. Lintasan alir yang tidak sama pasti ditemukan dalam setiap kolom ter-packing. Suatu molekul solut dapat melewati kolom dekat dinding kolom di mana kerapatan kolom rendah dengan cepat mencapai akhir kolom, khususnya pada kolom berdiameter kecil. Sedangkan suatu molekul solut yang melewati bagian tengah kolom menjadi lebih lambat untuk mencapai akhir kolom. Dengan demikian, laju tiap molekul melalui kolom berbeda-beda. Difusi Eddy dapat diminimalkan dengan memperkecil diameter rata-rata partikel dalam kolom hingga sekecil mungkin dan seseragam mungkin.
Difusi longitudinal dilambangkan dengan nilai B (2γD/µ) yang
menggambarkan pergerakan acak molekul dalam fase gerak. Pengaruh difusi longitudinal terhadap ketinggian lempeng menjadi signifikan pada kecepatan fase gerak yang rendah/lambat. Pada kecepatan difusi solut yang tinggi dalam fase gerak menyebabkan molekul solut terdispersi secara aksial dan lambat bermigrasi melalui kolom (Willard et al., 1988).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
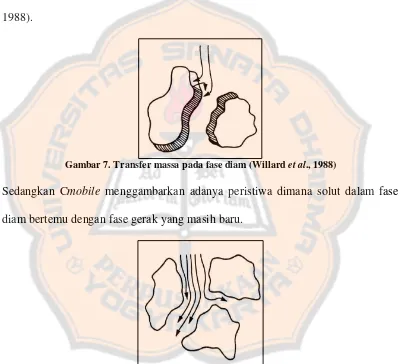
Transfer massa dinyatakan dengan nilai Cstasionary dan Cmobile. Cstasionery yang menunjukkan solut yang tertahan karena adanya fase diam. Suatu molekul bergerak lambat pada fase diam, sementara molekul lainnya bergerak melalui kolom bersama dengan fase gerak. Untuk mengatasi hal tersebut, dapat dibuat fase diam yang lebih encer (tidak terlalu kental) (Willard et al., 1988).
Gambar 7. Transfer massa pada fase diam (Willard et al., 1988)
Sedangkan Cmobile menggambarkan adanya peristiwa dimana solut dalam fase diam bertemu dengan fase gerak yang masih baru.
Gambar 8. Transfer massa pada fase gerak (Willard et al., 1988)
18
maka analit akan lebih banyak di dalam fase gerak atau (Cm > Cs) yang berarti analit akan lebih lama tinggal di dalam fase gerak dan memiliki waktu retensi lebih cepat(Mulja dan Suharman, 1995).
Kolom yang lebih efisien akan memiliki resolusi yang baik. Tingkat pemisahan komponen dalam suatu campuran dengan metode kromatografi direfleksikan dalam kromatogram yang dihasilkan. Hasil pemisahan yang baik ditunjukkan dengan puncak-puncak yang terpisah secara sempurna atau tidak ada tumpang tindih (overlapping) (Rohman, 2009).
Faktor resolusi atau daya pisah (Rs) dapat diukur secara kuantitatif dengan persamaan (Willard et al., 1988):
(7) Nilai tR2 dan tR1 adalah waktu tambat atau waktu retensi komponen, diukur pada titik puncak maksimum puncak dan ∆t adalah selisih antara tR2 dan tR1. Nilai w2 dan w1 adalah lebar alas puncak (Johnson dan Stevenson, 1978).
Gambar 9. Pemisahan dua senyawa (Willard et al., 1988)
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Pemisahan sempurna dari dua puncak dengan ukuran yang sama dikenal dengan base resolution dengan harga Rs ≥1,5. Dalam praktiknya, pemisahan dengan nilai Rs = 1,0 (kedua puncak berhimpit 2%) dianggap memadai (Pescok, Shields, and Cains, 1976).
Pada analisis dengan metode KCKT, kondisi percobaan yang dapat menghasilkan puncak simetris lebih disukai, hal ini dikarenakan puncak asimetris menghasilkan pengukuran bilangan lempeng teoritik dan faktor resolusi yang tidak akurat, perhitungan yang tidak teliti, penurunan derajat resolusi dan puncak minor pada ekor puncak tidak dapat terdeteksi, serta waktu retensi tidak reprodusibel (Synder et al., 1997). Peak yang tidak simetris sering dijumpai bila konsentrasi sampel dalam fase gerak terlalu besar. Apabila kapasitas kolom lebih besar pada konsentrasi yang lebih rendah, bagian eluen dengan konsentrasi yang lebih rendah akan bergerak lebih lambat dari pada bagian dengan konsentrasi solut lebih tinggi, sehingga peak yang terjadi tidak simetris dengan bidang bagian depan naik dengan tajam sedangkan bidang di bagian belakang turun dengan landai (tailing). Keadaan sebaliknya dikenal sebagai leading atau fronting. Penyebab tailing antara lain karena ketidaksesuaian antara analit dengan kolom, pengemasan kolom yang tidak seragam, dan faktor yang terjadi di luar kolom seperti pada injektor (Noegrohati, 1994).
Parameter yang digunakan untuk menilai bentuk puncak adalah peak asymmetry factor (As), yang diukur 10% tinggi puncak. Peak yang simetri
20
diukur pada 5% tinggi puncak (Synder et al., 1997). Sedangkan menurut Willard (1988), nilai asymmetry factor (AF) pada peak yang simetri dengan rentang 0,95-1,15.
Gambar 10. Penentuan Peak Asymmetry dan Peak Tailing Factor (Synder et al., 1997)
Distribusi analit dalam fase gerak dan fase diam pada saat terjadinya tailing dan leading terdapat pada gambar dibawah ini:
Gambar 11. Distribusi analit dalam fase diam dan fase gerak (Kuwana, 1980)
F. Landasan teori
Kloramfenikol merupakan senyawa antimikroba yang memiliki sifat stabil dalam larutan netral, larutan agak asam, sukar larut dalam air, mudah larut dalam etanol, dalam propilenglikol, aseton, etil asetat. Kloramfenikol di dalam
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
metanol memiliki λmaks pada 272 nm ( ). Senyawa ini memiliki pH antara 4,5 dan 7,5, dan pKa 5,5.
Lidokain hidroklorida merupakan obat anestesi yang memiliki sifat mudah larut dalam air, dalam etanol dan dalam kloroform, tetapi tidak larut dalam eter. Lidokain di dalam metanol memiliki λmaks pada 263 nm ( ) dan 271 nm ( ). Senyawa ini memiliki pH antara 5,0 dan 7,0, dan pKa 7,9 (25°).
Sediaan tetes telinga Colme® merupakan sedian tetes telinga yang mengandung kloramfenikol 10% dan lidokain hidroklorida 4%. Untuk menjamin kandungan mutu dari bentuk sediaan Colme® maka dibutuhkan metode yang sensitif dan selektif. Metode yang memiliki sensitifitas dan selektivitas yang tinggi adalah metode KCKT. Optimasi dengan KCKT fase terbalik dilakukan untuk memperoleh keadaan optimum pada pemisahan campuran kloramfenikol dan lidokain hidroklorida. Parameter pemisahan dengan metode KCKT yang menunjukkan kondisi optimum yaitu bentuk peak simetri, tR kurang dari 10 menit, nilai resolusi ≥ 1,5 dan nilai HETP yang semakin kecil.
G. Hipotesis
22
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang dilakukan merupakan jenis rancangan penelitian eksperimental analitik karena ada perlakuan pada subjek uji.
B. Variabel Penelitian
1. Variabel bebas
Jenis dan perbandingan fase gerak yaitu metanol:aquabides dan flow rate yang digunakan.
2. Variabel tergantung
Pemisahan peak dari tiap komponen yaitu kloramfenikol dan lidokain hidroklorida yang dilihat dari bentuk peak, waktu retensi (tR), nilai resolusi dan HETP tiap-tiap senyawa.
3. Variabel pengacau terkendali
a. Kemurnian pelarut. Oleh karena itu, digunakan pelarut yang memiliki kemurnian tinggi yaitu pelarut pro analysis.
b. Baku kloramfenikol dan lidokain hidroklorida. Oleh karena itu, digunakan baku dengan kemurnian tinggi yang disertai dengan Certificate of Analysis (CoA).
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
C. Definisi Operasional
1. Kloramfenikol dan lidokain hidroklorida yang dianalisis merupakan senyawa aktif dalam sediaan tetes telinga Colme® dengan perbandingan 5:2.
2. Lidokain HCl yang digunakan adalah lidokain hidroklorida monohidrat.
3. Sistem KCKT fase terbalik yang digunakan adalah seperangkat alat KCKT menggunakan kolom C18 dengan fase gerak metanol p.a:aquabides.
4. Optimasi dilakukan dengan mengubah komposisi fase gerak dan flow rate. 5. Parameter optimum dengan metode KCKT adalah bentuk peak, waktu retensi,
nilai resolusi dan HETP.
D. Bahan-bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah baku kloramfenikol (Chemo Lugano Branch, No. batch 8000225001, kemurnian 99,1%) dan baku lidokain hidroklorida (Megafine Pharma, No. batch ALH/449/10, kemurnian 99,20%) (PT. Interbat), metanol p.a (E.Merck), aqua bidestilata (PT. Ikapharmindo Putramas), tetes telinga Colme® (PT. Interbat) dengan volume 8 ml yang mengandung 10% kloramfenikol dan 4% lidokain hidroklorida.
E. Alat-alat Penelitian
24
RD01- D850 A03-0382 JP France S.A.S, printer HP Deskjet D2566 HP-024-000 625730), UV/Vis Spectrophotometer SP-3000plus merek OPTIMA dengan detektor silicon photo diode, timbangan analitik Ohaus Carat Series PAJ 1003 (max 60/120g, min 0,001g, d = 0,01/0,1 mg), millipore, alat ultrasonikasi Refsch., Tipe: T460 (Schwing.1 PXE, FTZ-Nr. C-066/83, HF-Frequ.:35 kHz), kertas saring Whatman 0,45 μm, alat vacuum, dan seperangkat alat gelas.
F. Tata Cara Penelitian
1. Pembuatan fase gerak
Fase gerak yang digunakan dalam penelitian ini adalah campuran metanol dan aquabides dengan komposisi tabel II.
Tabel II. Komposisi fase gerak metanol p.a:aquabides
No. Komposisi Fase gerak
Metanol Aquabides
1. 75 25
2. 85 15
3. 95 5
Masing-masing pelarut disaring dengan penyaring Whatman yang dibantu dengan pompa vakum dan didegassing selama 15 menit menggunakan ultrasonicator. Untuk mendapatkan komposisi fase gerak di atas, pencampuran
fase gerak dilakukan di dalam sistem KCKT.
2. Pembuatan larutan baku kloramfenikol dan lidokain hidroklorida yang
digunakan untuk penentuan panjang gelombang pengamatan
a. Pembuatan larutan baku kloramfenikol. Sebanyak kurang lebih 10,0 mg kloramfenikol ditimbang seksama dan dilarutkan dalam metanol hingga 10,0
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
mL. Kemudian dibuat larutan seri dengan 3 konsentrasi berbeda yaitu 13; 19,5; dan 26 ppm dengan mengencerkan 0,13; 0,195; dan 0,26 mL larutan stok tersebut dalam metanol hingga 10,0 mL.
b. Pembuatan larutan baku lidokain hidroklorida. Sebanyak kurang lebih 10,0 mg lidokain hidroklorida ditimbang seksama dan dilarutkan dalam metanol hingga 10 mL. Kemudian dibuat larutan seri dengan 3 konsentrasi berbeda yaitu 300; 450; dan 600 ppm dengan mengencerkan 3; 4,5; dan 6 mL larutan stok tersebut dalam metanol hingga 10,0 mL.
3. Pembuatan larutan baku kloramfenikol dan lidokain hidroklorida yang
digunakan untuk optimasi dengan metode KCKT
a. Larutan stok kloramfenikol. Lebih kurang 10,0 mg kloramfenikol baku ditimbang seksama, kemudian dilarutkan dalam metanol hingga 10,0 mL.
b. Larutan intermediet kloramfenikol. Larutan stok kloramfenikol 1000 ppm tersebut dipipet seksama sebanyak 1 mL kemudian diencerkan dengan metanol dalam labu ukur 10 mL hingga tanda batas, sehingga didapatkan konsentrasi sebesar 100 ppm. Saring dengan milipore dan didegassing selama 15 menit.
c. Larutan stok lidokain hidroklorida. Lebih kurang 20,0 mg lidokain hidroklorida baku ditimbang seksama, kemudian dilarutkan dalam metanol hingga 10,0 mL.
26
didapatkan konsentrasi sebesar 1000 ppm. Saring dengan milipore dan didegassing selama 15 menit.
4. Pembuatan larutan baku campuran kloramfenikol dan lidokain
hidroklorida
Campuran kloramfenikol dan lidokain hidroklorida yaitu dengan konsentrasi masing-masing 100 ppm dan 1000 ppm dibuat dengan mencampur 1 mL stok kloramfenikol dengan 5 ml stok lidokain hidroklorida dalam labu ukur 10 mL, lalu tambahkan dengan metanol hingga tanda. Campuran kloramfenikol dan lidokain hidroklorida tersebut disaring dengan milipore dan didegassing selama 15 menit.
5. Penentuan panjang gelombang pengamatan kloramfenikol dan lidokain
hidroklorida dengan spektrofotometer UV-Vis
Masing-masing seri konsentrasi baku kloramfenikol 13; 19,5; 26 ppm dan lidokain hidroklorida 300; 450; 600 ppm diukur absorbansinya pada panjang gelombang 200-400 nm dengan spektrofotometer UV-Vis. Dari spektra serapan dapat diketahui panjang gelombang yang dihasilkan pada masing-masing konsentrasi. Panjang gelombang yang akan digunakan pada sistem KCKT ditentukan yaitu panjang gelombang yang menghasilkan serapan optimum pada ketiga konsentrasi tersebut.
6. Preparasi Sampel
Sediaan tetes telinga Colme® (kloramfenikol 10% dan lidokain hidroklorida 4 %) digojog homogen, kemudian dipipet seksama sebanyak 0,1 mL dan diencerkan dengan metanol sampai 10 mL sehingga didapatkan konsentrasi
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
kloramfenikol 1000 ppm dan lidokain hidroklorida 400 ppm. Larutan tersebut kemudian dipipet seksama sebanyak 1 mL sehingga didapatkan konsentrasi kloramfenikol 100 ppm dan lidokain hidroklorida 40 ppm. Larutan ini kemudian ditambahkan 2,4 mL larutan stok lidokain hidroklorida 4000 ppm dan diencerkan dengan metanol dalam labu takar 10,0 mL hingga batas tanda, sehingga didapatkan konsentrasi kloramfenikol 100 ppm dan lidokain hidroklorida 1000 ppm. Larutan stok lidokain hidroklorida 4000 ppm disiapkan dengan menimbang seksama lebih kurang 2,0 mg lidokain hidroklorida yang diencerkan dengan metanol dalam labu takar 5,0 mL hingga batas tanda. Larutan sampel dengan konsentrasi kloramfenikol 100 ppm dan lidokain hidroklorida 1000 ppm disaring dengan milipore dan didegassing selama 15 menit.
7. Optimasi pemisahan kloramfenikol dan lidokain hidroklorida dengan
metode KCKT fase terbalik
a. Pengamatan nilai Asymmetry factor (AF) dan waktu retensi kloramfenikol. Larutan baku kloramfenikol dengan konsentrasi 100 ppm diinjeksikan sebanyak 16 µ L ke dalam sistem KCKT. Optimasi dilakukan pada panjang gelombang pengamatan dengan menggunakan fase gerak metanol:aquabides dengan perbandingan 75:25; 85:15; dan 95:5 pada flow rate 0,5; 1,0 dan 2,0 mL/menit. Dari berbagai perbandingan fase gerak dan flow rate tersebut dipilih yang nilai AF = 0,95-1,15 dan waktu retensinya kurang dari 10 menit.
28
diinjeksikan sebanyak 16 µ L ke dalam sistem KCKT. Optimasi dilakukan pada panjang gelombang pengamatan dengan menggunakan fase gerak metanol:aquabides dengan perbandingan 75:25; 85:15; dan 95:5 pada flow rate 0,5; 1,0 dan 2,0 mL/menit. Dari berbagai perbandingan fase gerak dan flow rate tersebut dipilih yang nilai AF = 0,95-1,15 dan waktu retensinya kurang dari 10 menit.
c. Pemisahan campuran kloramfenikol dan lidokain hidroklorida dengan fase gerak hasil optimasi. Baku campuran kloramfenikol dan lidokain hidroklorida dengan konsentrasi masing-masing yaitu 100 ppm dan 1000 ppm diinjeksikan sebanyak 16 µ L ke dalam sistem KCKT menggunakan perbandingan fase gerak dan flow rate hasil optimasi. Pemisahan dilakukan pada panjang gelombang pengamatan kemudian mengamati kromatogram yang terjadi. Setelah mendapat kromatogram dilanjutkan dengan menghitung nilai resolusi dan HETP dari hasil pemisahan campuran kloramfenikol dan lidokain hidroklorida.
d. Reprodusibilitas baku campuran kloramfenikol dan lidokain hidroklorida. Baku campuran kloramfenikol dan lidokain hidroklorida dengan konsentrasi masing-masing yaitu 100 ppm dan 1000 ppm direplikasi sebanyak 3 kali, kemudian diinjeksikan sebanyak 12; 16; dan 20 µL ke dalam sistem KCKT menggunakan perbandingan fase gerak dan flow rate hasil optimasi. Setelah mendapat kromatogram dilanjutkan dengan menghitung %CV resolusi dan waktu retensi dari hasil pemisahan campuran kloramfenikol dan lidokain hidroklorida.
e. Reprodusibilitas campuran kloramfenikol dan lidokain hidroklorida dalam sediaan tetes telinga Colme®. Sampel yang telah dipreparasi dengan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
konsentrasi kloramfenikol 100 ppm dan lidokain hidroklorida 1000 ppm direplikasi sebanyak 3 kali, kemudian diinjeksikan sebanyak 16 µL ke dalam sistem KCKT menggunakan perbandingan fase gerak dan flow rate hasil optimasi. Setelah mendapat kromatogram dilanjutkan dengan menghitung %CV resolusi dan waktu retensi dari hasil pemisahan campuran kloramfenikol dan lidokain hidroklorida
F. Analisis Hasil
Hasil optimasi komposisi fase gerak dan flow rate tertentu menghasilkan data kromatogram. Data kromatogram yang didapatkan yaitu kromatogram baku dan sampel diamati, sehingga dapat diketahui sistem KCKT fase terbalik yang memberikan pemisahan kloramfenikol dan lidokain hidroklorida paling baik yaitu dengan mengamati bentuk peak, waktu yang dibutuhkan untuk elusi, menghitung nilai resolusi dan HETP. Pemisahan yang baik adalah pemisahan dengan bentuk peak yang simetri (tidak tailing atau fronting), waktu retensi (tR) kurang dari 10 menit, memiliki nilai resolusi ≥ 1,5 terhadap peak terdekat dan nilai HETP yang semakin kecil.
1. Bentuk peak pemisahan kloramfenikol dan lidokain hidroklorida
Bentuk peak yang diharapkan adalah simetri. Sebagai parameternya yaitu Asymmetry Factor (AF) yang diukur 0,1 dari tinggi peak. Perhitungan AF melalui
30
(Willard et al., 1988)
2. Waktu retensi (tR)
Pengamatan waktu dilakukan untuk melihat waktu yang dibutuhkan untuk pemisahan senyawa. Apabila kurang dari 10 menit, maka pemisahan dikatakan efisien.
3. Nilai resolusi
Nilai resolusi pemisahan peak dihitung terhadap peak terdekat dengan rumus sebagai berikut:
Pemisahan yang baik menghasilkan nilai Rs ≥ 1,5.
(Willard et al., 1988) (8)
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
4. Nilai HETP
Nilai HETP dapat dihitung dengan rumus sebagai berikut:
(9) dimana “N” merupakan bilangan lempeng teoritik dengan persamaan sebagai
berikut:
Nilai HETP semakin kecil menandakan efisiensi kolom semakin baik dan pemisahan juga semakin baik.
(Willard et al., 1988)
5. Reprodusibilitas
Reprodusibilitas resolusi dan waktu retensi diketahui dengan menghitung nilai %CV dari nilai resolusi dan waktu retensi hasil pemisahan kloramfenikol dan lidokain hidroklorida pada baku campuran dan sediaan tetes telinga Colme®. Perhitungan %CV dengan persamaan sebagai berikut:
Reprodusibilitas yang baik apabila harga CV kurang dari 2% (Mulja dan Hanwar,
2003).
N L HETP H
(10)
32
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Pelarut
Pemilihan pelarut menjadi sangat penting karena hanya pelarut yang sesuailah yang dapat melarutkan analit yang akan dianalisis. Syarat utama dari pelarut yang akan dipilih adalah pelarut yang dapat melarutkan analit. Berdasarkan Farmakope Indonesia edisi IV, kelarutan kloramfenikol adalah 1:2,5 dalam etanol dan kelarutan lidokain hidroklorida adalah 1:1,5 dalam etanol. Namun dalam penelitian ini bukan menggunakan etanol, melainkan metanol. Metanol dipilih karena memiliki viskositas yang lebih rendah daripada etanol yaitu 0,54 cP, sehingga penggunaan metanol dapat mengurangi tekanan pada kolom. Metanol yang digunakan merupakan metanol pro analysis karena memiliki kemurnian yang tinggi sehingga hasil pengukuran lebih akurat. Syarat pelarut yang baik untuk digunakan pada KCKT adalah murni, inert, dapat melarutkan analit dan dapat bercampur dengan fase gerak.
B. Pembuatan Fase Gerak
Metode KCKT yang digunakan adalah KCKT fase terbalik dengan fase diam oktadesilsilan (C18) yang bersifat non polar dan fase gerak yang bersifat lebih polar yaitu campuran metanol dan aquabides. Sistem yang digunakan adalah sistem gradien yaitu pencampuran komposisi fase gerak berada di dalam alat KCKT untuk mendapatkan kepolaran fase gerak yang diinginkan dengan
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
mengubah-ubah komposisi fase gerak. Metanol dipilih karena memiliki solubilitas yang baik untuk garam, hal ini sangat menguntungkan karena pada penelitian ini menggunakan analit dalam bentuk garam yaitu lidokain hidroklorida. Metanol juga merupakan pelarut organik yang umum dan sering digunakan pada sistem KCKT fase terbalik. Selain itu digunakan aquabides untuk mendapatkan indeks polaritas yang sesuai sehingga dengan komposisi yang tepat pada campuran metanol dan aquabides akan dihasilkan profil kromatogram yang diinginkan dan memenuhi syarat. Menurut Kellner et al. (1998), pada metode KCKT fase terbalik sering kali digunakan solven seperti metanol, asetonitril yang dimodifikasi dengan air (aquabides). Pemilihan komposisi fase gerak ini juga mengacu pada Sadana dan Ghogare (1990) yang pernah memisahkan kloramfenikol dan benzokain dengan campuran metanol dan aquabides dengan perbandingan 35:65.
Komposisi fase gerak yang digunakan pada penelitian ini adalah metanol:aquabides dengan perbandingan 75:25 ; 85:15; dan 95:5. Menurut Synder et al. (1997), dengan meningkatnya jumlah metanol pada KCKT fase terbalik
34
Tabel III. Indeks polaritas campuran fase gerak metanol:aquabides
No Komposisi Fase Gerak Indeks Polaritas
Metanol Aquabides
1 75 25 6,375
2 85 15 5,865
3 95 5 5,355
Semakin kecil nilai indeks polaritas berarti semakin non polar fase gerak tersebut sehingga urutan kepolaran dari yang polar ke non polar adalah 75:25, 85:15, dan 95:5. Menurut Mulja dan Suharman (1995), dalam sistem KCKT fase terbalik, kemampuan elusi akan semakin meningkat dengan menurunkan indeks polaritas fase gerak. Komposisi fase gerak tersebut diubah-ubah agar hasil pemisahan kloramfenikol dan lidokain hidroklorida memenuhi parameter yang diinginkan yaitu peak yang runcing dan simetri, memenuhi nilai resolusi, dan HETP yang semakin kecil.
C. Pembuatan Larutan Baku
Baku kloramfenikol dan lidokain hidroklorida didapatkan dari PT. Interbat dan memiliki Certificate of Analysis (CoA) sehingga terjamin kemurniannya. Larutan baku ini dibuat dengan menggunakan pelarut metanol pro analysis dengan kemurnian 99,85%. Tujuan pembuatan larutan baku yaitu sebagai
pembanding atau reference standard yang dapat digunakan untuk memastikan di dalam sampel benar-benar terdapat analit yang dimaksud.
Dalam optimasi ini dibuat dua larutan baku masing-masing untuk kloramfenikol dan lidokain hidroklorida dengan tiga volume injeksi yang berbeda. Volume injeksi tersebut dibuat rendah, sedang, dan tinggi yaitu 12; 16; dan 20µL
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
dengan mengambil dari konsentrasi stok kloramfenikol 100 ppm dan stok lidokain hidroklorida 1000 ppm. Selain itu dibuat pula baku campuran untuk kloramfenikol dan lidokain hidroklorida yang juga dibuat dalam tiga volume injeksi yang berbeda dengan konsentrasi masing-masing 100:1000 ppm.
Pada optimasi ini digunakan perbandingan kloramfenikol dan lidokain hidroklorida 1:10, perbandingan ini dipilih karena kedua senyawa tersebut dapat dilihat pada respon yang sama yaitu 500mV. Kandungan kloramfenikol dan lidokain hidroklorida yang tertera pada sediaan tetes telinga Colme® masing-masing adalah 10% dan 4% sehingga perbandingannya adalah 10:4 atau 5:2. Namun, pada penelitian ini tidak digunakan perbandingan tersebut karena lidokain hidroklorida dalam metanol memiliki spektrum absorbsi pada sinar ultraviolet ( ) yang kecil yaitu 14,2 sedangkan kloramfenikol dalam metanol memiliki spektrum absorbsi pada sinar ultraviolet ( ) yang jauh lebih besar yaitu 297 (Dibbern et al., 2002), sehingga dengan perbandingan 5:2 kloramfenikol memiliki respon yang sangat besar sedangkan lidokain memiliki respon yang sangat kecil dan keduanya terpaut jauh maka keduanya sulit dilihat pada respon yang sama. Alasan tersebut yang mendasari digunakan perbandingan 1:10 karena dengan perbandingan tersebut kedua senyawa tersebut dapat dilihat di respon yang sama.
36
D. Penentuan Panjang Gelombang Pengamatan Kloramfenikol dan
Lidokain Hidroklorida dengan Spektrofotometer UV-Vis
Penentuan panjang gelombang pengamatan dilakukan dengan mengukur panjang gelombang masing-masing senyawa terlebih dahulu. Penentuan panjang gelombang ini dilakukan dengan menggunakan spektrofotometer ultraviolet-visibel. Secara teoritis kloramfenikol dan lidokain hidroklorida berada pada rentang 200-400 nm, oleh karena itu dilakukan pengamatan panjang gelombang pada daerah tersebut. Penentuan panjang gelombang pengamatan ini dilakukan dengan mengukur absorbansi kedua senyawa dengan konsentrasi rendah, sedang dan tinggi yaitu 13; 19,5; dan 26 ppm untuk kloramfenikol dan 300; 450; dan 600 ppm untuk lidokain hidroklorida. Penggunaan tiga seri konsentrasi ini bertujuan untuk meyakinkan bahwa panjang gelombang pengamatan yang didapatkan benar-benar berasal dari kloramfenikol dan lidokain hidroklorida. Selain itu, untuk memastikan bahwa panjang gelombang pengamatan dan bentuk pola spektra yang didapatkan sama.
Kloramfenikol dan lidokain hidroklorida memiliki gugus kromofor dan auksokrom sehingga dapat memberikan serapan pada panjang gelombang ultraviolet. Gugus kromofor bertanggung jawab dalam penyerapan cahaya ultraviolet dan gugus auksokrom adalah gugus yang melekat pada kromofor yang berperan dalam pergeseran panjang gelombang dan intensitas serapan maksimum kloramfenikol dan lidokain hidroklorida.
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
Gambar 12. Gugus kromofor dan auksokrom pada kloramfenikol
Gambar 13. Gugus kromofor dan auksokrom pada lidokain hidroklorida
Kurva serapan kloramfenikol dan lidokain hidroklorida dapat dilihat pada gambar dibawah ini:
Gambar 14. Spektra panjang gelombang maksimum kloramfenikol 13 ppm (A) dan lidokain hidroklorida 300 ppm (B)
A
B
38
Gambar 15. Spektra panjang gelombang maksimum kloramfenikol 19,5 ppm (A) dan lidokain hidroklorida 450 ppm (B)
Gambar 16. Spektra panjang gelombang maksimum kloramfenikol 26 ppm (A) dan lidokain hidroklorida 600 ppm (B)
Dari hasil spektra menunjukkan bahwa pada konsentrasi rendah, sedang dan tinggi, panjang gelombang maksimum kloramfenikol adalah 270 nm dan lidokain hidroklorida adalah 265 nm dan dihasilkan bentuk pola spektra yang sama. Menurut Dibbern et al. (2002) panjang gelombang maksimal kloramfenikol dalam metanol adalah 272 nm. Pergeseran panjang gelombang yang diijinkan
A A
B B
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
adalah 2 nm (Dirjen POM RI, 1995). Oleh karena itu panjang gelombang kloramfenikol ini dapat diterima karena bergeser 2 nm dari panjang gelombang teoritis. Berdasarkan Dibbern et al. (2002) panjang gelombang maksimal lidokain hidroklorida dalam metanol adalah 263 nm, sehingga panjang gelombang ini juga dapat diterima karena bergeser 2 nm dari panjang gelombang teoritis.
Berdasarkan pengamatan panjang gelombang maksimum yang ada dapat diketahui panjang gelombang overlapping kedua senyawa. Titik potong panjang gelombang kedua senyawa yang didapat adalah 267 nm.
Lidokain hidroklorida dalam metanol memiliki spektrum absorbsi pada sinar ultraviolet ( ) yang kecil yaitu 14,2 sedangkan kloramfenikol dalam metanol memiliki spektrum absorbsi pada sinar ultraviolet ( ) yang jauh lebih besar yaitu 297 (Dibbern et al., 2002). Sehingga, nilai lidokain hidroklorida yang kecil ini yang membuat lidokain hidroklorida lebih sukar terdeteksi daripada
kloramfenikol. Pada maks lidokain hidroklorida, serapan kloramfenikol masih
cukup tinggi, sedangkan serapan lidokain hidroklorida menjadi rendah pada maks kloramfenikol. Hal ini yang mendasari pemilihan panjang gelombang pengamatan yang digunakan dalam pemisahan kloramfenikol dan lidokain hidroklorida adalah 265 nm yang merupakan panjang gelombang lidokain hidroklorida, hal ini bertujuan agar kedua senyawa tersebut dapat memberikan serapan optimum.
40
E. Optimasi Kloramfenikol dan Lidokain Hidroklorida dengan Metode
KCKT Fase Terbalik
Optimasi dengan metode KCKT fase terbalik dilakukan dengan mengubah-ubah komposisi fase gerak dan flow rate untuk didapatkan pemisahan yang baik antara kloramfenikol dan lidokain hidroklorida. Komposisi fase gerak yang digunakan yaitu 75:25; 85;15; dan 95:5 dengan flow rate 0,8; 1,0; dan 1,2 mL/menit.
Berikut merupakan waktu retensi yang diperoleh dari kloramfenikol, lidokain hidroklorida, dan baku campuran kloramfenikol dan lidokain hidroklorida pada masing-masing komposisi fase gerak dan flow rate yang berbeda.
Tabel IV. Waktu retensi baku kloramfenikol, baku lidokain hidroklorida dan baku campuran kloramfenikol dan lidokain hidroklorida
Komposisi fase gerak
Analit
Waktu Retensi (tR) (menit)
Metanol Aquabides
0,8 (mL/min) 1,0 (mL/min) 1,2 (mL/min)
75 25
Kloramfenikol 3,703 2,919 2,475 Lidokain
Hidroklorida 8,409 6,868 5,653
85 15
Kloramfenikol 3,387 2,534 2,303 Lidokain
Hidroklorida 5,463 4,052 3,690
95 5
Kloramfenikol 3,173 2,527 2,158 Lidokain
Hidroklorida 4,096 3,308 2,956 Baku Campuran
(Kloramfenikol)
-
2,532 2,141
Baku Campuran (Lidokain Hidroklorida)
3,306 2,805
Dari masing-masing komposisi fase gerak tersebut menunjukkan bahwa dengan semakin meningkatnya metanol maka waktu retensi menjadi semakin
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
pendek atau singkat dan semakin meningkatnya flow rate pada masing-masing komposisi fase gerak juga menunjukkan waktu retensi yang semakin pendek.
Struktur kloramfenikol dan lidokain hidroklorida memiliki gugus polar dan non polar yang dapat berinteraksi dengan fase diam (oktadesilsilan) dan fase gerak (campuran metanol dan aquabides). Gugus non polar akan berinteraksi dengan fase diam melalui ikatan Van Der Waals sedangkan gugus polar akan berinteraksi dengan fase gerak melalui interaksi hidrogen. Berikut interaksi kloramfenikol dan lidokain hidroklorida dengan fase gerak dan fase diam:
Si CH3
H3C
O H3C
Interaksi Van Der Waals
Oktadesilsilan (C18)
N
H OH
H
H2
C O H
N H C O CHCl2 O o
Gambar 17. Interaksi kloramfenikol dengan fase diam C18 (oktadesilsilan) melalui interaksi Van Der Waals
Si
CH3
H3C
O H3C
CH3 H N CH3 C O H2 C NH
C2H5
C2H5
Cl Interaksi Van Der Waals Oktadesilsilan (C18)
Interaksi ion-dipol
42
Gambar 19. Interaksi hidrogen antara kloramfenikol dengan fase gerak metanol:aquabides CH3 N CH3 C O H2 C NH
C2H5
C2H5 H O H H H O CH3 H O
H OCH3
H
Cl
Gambar 20. Interaksi hidrogen antara lidokain hidroklorida dengan fase gerak metanol:aquabides
Gambar di atas menunjukkan bahwa interaksi kloramfenikol dengan fase diam lebih sedikit dibandingkan interaksi lidokain hidroklorida dengan fase diam oktadesilsilan. Oleh karena itu, kekuatan ikatan kloramfenikol pada fase diam lebih lemah sehingga waktu retensinya lebih pendek atau lebih cepat dibandingkan lidokain hidroklorida. Dengan adanya fase gerak yaitu campuran metanol dan aquabides akan berfungsi untuk membawa analit untuk keluar dari
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
kolom. Semakin banyak jumlah interaks