i
DALAM SEDIAAN CAIR OBAT HERBAL TERSTANDAR (OHT) KIRANTI®DENGAN METODE KROMATOGRAFI CAIR KINERJA
TINGGI (KCKT) FASE TERBALIK
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm.)
Program Studi Farmasi
Oleh:
Katiti Dwi Krisnayanti NIM: 078114069
FAKULTAS FARMASI
ii
iv
HALAMAN PERSEMBAHAN
Ujian bagi seseorang yang sukses bukanlah pada kemampuannya
untuk mencegah munculnya masalah,
Tetapi pada waktu menghadapi dan menyelesaikan setiap
kesulitan saat masalah itu terjadi
( David J. Schwartz )
Nothing is impossible in God
As long as we want to try,
there is a way in front of us...
Kepuasan terletak pada usaha, bukan pada hasil.
Berusaha dengan keras adalah
kemenangan yang hakiki.
(Mahatma Gandhi)
Karya ini kupersembahkan bagi:
Papa dan mamaku tercinta,
Kakakku termanis,
Kekasihku tersayang,
Teman-teman,
vii
Terima kasih kepada Tuhan Yang Maha Esa atas limpahan berkat sehingga penulis dapat menyelesaikan skripsi berjudul “Optimasi Metode Penetapan Kadar Kurkumin dalam Sediaan Cair Obat Herbal Terstandar (OHT) Kiranti®dengan Metode Kromatografi Cair Kinerja Tinggi (KCKT) Fase Terbalik sebagai tugas akhir untuk mencapai gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penyusunan skripsi ini tidak lepas dari bantuan banyak pihak, untuk itu penulis mengucapkan terima kasih yang tak terhingga kepada pihak-pihak yang telah membantu penulis selama penyusunan skripsi ini.
1. Ibu Christine Patramurti, M.Si., Apt selaku Dosen Pembimbing yang telah membimbing dan memberikan saran selama pembuatan tugas akhir ini. 2. Bapak Jeffry Julianus, M.Si selaku Dosen Penguji yang telah memberikan
saran dan kritik dalam penyusunan skripsi ini.
3. Bapak Yohanes Dwiatmaka, M.Si selaku Dosen Penguji yang telah memberikan saran dan kritik dalam penyusunan skripsi ini dan selaku Dosen Pembimbing Akademik yang telah membimbing serta memberikan saran dalam pengambilan mata kuliah setiap semester.
4. Bapak Prof. Dr. Sudibyo Martono, M.S., Apt selaku Dosen Pengajar yang telah bersedia memberikan senyawa standar yang berguna dalam penelitian. 5. Bapak Dr. C.J. Soegihardjo, Apt selaku Dosen Pengajar yang telah bersedia
viii
6. Bapak Ipang Djunarko, M.Sc., Apt selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
7. Mas Bimo, Mas Kunto, Mas Parlan dan Mas Wagiran selaku staff laboran yang turut membantu penulis selama penelitian.
8. Seluruh Dosen Fakultas Farmasi Universitas Sanata Dharma Yogyakarta yang telah memberikan ilmu yang bermanfaat dan bimbingan selama menimba ilmu di bangku kuliah.
9. Seluruh karyawan Fakultas Farmasi Sanata Dharma yang telah menyediakan sarana untuk terselesainya semua kegiatan akademik dengan lancar.
10. Pakde Toro, Cici Lala, Katrin Ke-ket, Pace “Wara”, Benny Nug-nug, Tere Dumere, Seno Wimbow, Yunita, Eliz, Lilis, dan Veny selaku teman skripsi satu tema, terima kasih atas kerjasama, semangat dan dukungan yang luar biasa.
11. Papa dan mama yang telah memberikan kehidupan yang indah, yang selalu memberikan doanya bagiku, semangat dan dukungan kepadaku.
12. Kakakku Kaeksi termanis yang selalu menemani hari-hariku dan Mas Lian, terima kasih telah menjadi kakak yang baik bagi penulis.
13. My Lovely HoneyPraska Magistra Windarta yang selalu menemaniku, terima kasih atas doa, semangat dan dukungan yang diberikan.
14. Mas Pungky dan Dika Othok yang telah meluangkan waktu untuk memberikan diskusi terkait penelitian.
ix
keceriaan, kebersamaan, senyuman dan semangat yang diberikan.
16. Puput, Mbokde Tika, Liana, dan Vivi Elvira selaku teman sekelas FST A 2007 yang sering kerjasama dalam satu tugas kelompok.
17. Semua teman-teman FST A 2007, terima kasih telah menjadi teman yang baik bagi penulis.
18. Seluruh teman-teman Farmasi angkatan 2007, terima kasih atas pengalaman dan kebersamaannya.
19. Semua pihak yang telah membantu penulis dan tidak tertulis di sini, terima kasih atas bantuan yang diberikan.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan skripsi ini, oleh karena itu penulis mengharapkan saran dan kritik yang membangun yang berguna bagi perkembangan penulis. Besar harapan penulis, semoga skripsi ini bermanfaat bagi pembaca dan bermanfaat dalam perkembangan ilmu pengetahuan.
x
DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ...v
LEMBAR PERSETUJUAN PUBLIKASI KARYA ... vi
PRAKATA... vii
BAB I PENGANTAR ...1
A. Latar Belakang ... 1
1. Permasalahan...4
2. Keaslian penelitian ...4
3. Manfaat penelitian...5
B. Tujuan Penelitian ...5
BAB II PENELAAHAN PUSTAKA...6
xi
C. Spektrofotometri Visibel...11
D. Kromatografi Cair Kinerja Tinggi (KCKT)...12
1. Definisi dan instrumentasi ...12
2. Kromatografi partisi fase terbalik ...17
3. Parameter pemisahan puncak dalam kromatografi ...18
E. Landasan Teori...26
F. Hipotesis...27
BAB III METODE PENELITIAN...28
A. Jenis dan Rancangan Penelitian ...28
B. Variabel Penelitian ...28
1. Variabel bebas ...28
2. Variabel tergantung...28
3. Variabel pengacau terkendali ...28
C. Definisi Operasional...29
D. Bahan-bahan Penelitian...29
E. Alat-alat Penelitian...29
F. Tata Cara Penelitian ...30
1. Pembuatan asam asetat glasial 2%... 30
2. Pembuatan pelarut ...30
3. Pembuatan fase gerak...30
4. Pembuatan seri larutan baku kurkumin...31
xii
6. Optimasi metode KCKT fase terbalik...32
G. Analisis Hasil Optimasi ...33
1. Analisis kualitatif ...33
2. Analisis pemisahanpeakkurkumin ...33
3. Reprodusibilitas ...35
BAB IV HASIL DAN PEMBAHASAN ...36
A. Pembuatan Pelarut...36
B. Pembuatan Fase Gerak...38
C. Pembuatan Seri Larutan Baku Kurkumin ...41
D. Preparasi Sampel ...42
E. Penentuan Panjang Gelombang Maksimum Kurkumin...43
F. Optimasi Pemisahan Kurkumin dengan Metode KCKT Fase Terbalik...46
G. Analisis KualitatifPeakKurkumin dalam Sampel ...48
H. Hasil Optimasi Pemisahan Kurkumin dalam Sampel Cair OHT Kiranti®...50
1. Fase gerak metanolp.a:asam asetat glasial 2% dengan perbandingan 70:30...50
2. Fase gerak metanolp.a:asam asetat glasial 2% dengan perbandingan 80:20...55
3. Fase gerak metanolp.a:asam asetat glasial 2% dengan perbandingan 90:10...58
BAB V KESIMPULAN DAN SARAN...66
A. Kesimpulan ...66
xiii
xiv
DAFTAR TABEL
Tabel I. Indeks polaritas beberapa pelarut pada KCKT ...15
Tabel II. Komposisi fase gerak metanolp.a:asam asetat glasial 2%...30
Tabel III. Hasil uji stabilitas kurkumin ...36
Tabel IV. Indeks polaritas campuran fase gerak metanolp.a:asam asetat glasial 2%...40
Tabel V. pH campuran fase gerak metanolp.a:asam asetat glasial 2% ...40
Tabel VI. Tekanan kolom ...47
Tabel VII. Hasil pemisahan kurkumin ...47
Tabel VIII. Waktu retensi senyawa kurkumin dalam sampel dan waktu retensi baku kurkumin ...48
Tabel IX. Hasil optimasi pemisahan kurkumin berdasar parameter Asymetry Factor(AF) ...51
Tabel X. Hasil optimasi pemisahan kurkumin pada komposisi fase gerak metanolp.a:asam asetat glasial 2% 90:10 ...60
xv
Gambar 1. Struktur kurkumin...6
Gambar 2. Reaksi degradasi kurkumin pada pH basa ...7
Gambar 3. Reaksi degradasi kurkumin oleh pengaruh cahaya...8
Gambar 4. Logo Obat Herbal Terstandar (OHT) ...9
Gambar 5. Instrumentasi KCKT...12
Gambar 6. Skema mekanisme pemisahan dalam kromatografi partisi fase terbalik ...17
Gambar 7. Perhitungan bilangan lempeng teoritik ...19
Gambar 8. Difusi Eddy ...21
Gambar 9. Transfer massa pada fase diam ...22
Gambar 10. Transfer massa pada fase gerak ...22
Gambar 11. Perhitungan faktor simetri ...23
Gambar 12. Perhitungan nilai resolusi pemisahan dua senyawa ...25
Gambar 13. Perhitungan nilai resolusi pemisahan dua senyawa dengan W1/2h ...25
Gambar 14. Reaksi hidrolisis kolom oktadesilsilan pada pH asam kurang dari 2 ...41
Gambar 15. Spektra serapan maksimum ...45
xvi
Gambar 17. a. baku kurkumin 3,0 ppm pada fase gerak metanolp.a:asam asetat glasial 2% 70:30...48 b. baku kurkumin 3,0 ppm pada fase gerak metanolp.a:asam asetat glasial 2% 70:30...48 Gambar 18. c. baku kurkumin 3,0 ppm pada fase gerak metanolp.a:asam asetat
glasial 2% 80:20...49 d. baku kurkumin 3,0 ppm pada fase gerak metanolp.a:asam asetat glasial 2% 80:20...49 Gambar 19. e. baku kurkumin 3,0 ppm pada fase gerak metanolp.a:asam asetat
glasial 2% 90:10...49 f. baku kurkumin 3,0 ppm pada fase gerak metanolp.a:asam asetat glasial 2% 90:10...50 Gambar 20. Kromatogram pemisahan kurkumin dalam sampel cair OHT Kiranti®
dengan komposisi fase gerak metanolp.a:asam asetat glasial 2% 70:30 ...51 Gambar 21. Kromatogram pemisahan kurkumin dalam sampel cair OHT Kiranti®
dengan komposisi fase gerak metanolp.a:asam asetat glasial 2% 80:20 ...55 Gambar 22. Kromatogram pemisahan kurkumin dalam sampel cair OHT Kiranti®
xvii
xviii
DAFTAR LAMPIRAN
Lampiran 1. Jaminan keaslian baku kurkumin hasil sintesis ...72 Lampiran 2. Kromatogram hasil optimasi flow rate pada fase gerak metanol
p.a:asam asetat glasial 2% (70:30) ...73
Lampiran 3. NilaiAsymetry Factor(AF)peakkurkumin pada fase gerak metanolp.a:asam asetat glasial 2% (70:30) dan contoh
perhitungannya ...83 Lampiran 4. Kromatogram hasil optimasiflow ratepada fase gerak metanol
p.a:asam asetat glasial 2% (80:20) ...84
Lampiran 5. NilaiAsymetry Factor(AF)peakkurkumin pada fase gerak metanolp.a:asam asetat glasial 2% (80:20) dan contoh
perhitungannya ...94 Lampiran 6. Kromatogram hasil optimasiflow ratepada fase gerak metanol
p.a:asam asetat glasial 2% (90:10) ...95
Lampiran 7. NilaiAsymetry Factor(AF)peakkurkumin pada fase gerak metanolp.a:asam asetat glasial 2% (90:10) dan contoh
perhitungannya ...105 Lampiran 8. Nilai resolusi dan HETP pada fase gerak metanolp.a:asam
asetat glasial 2% (90:10) ...106 Lampiran 9. Reprodusibilitas: Kromatogram pemisahan kurkumin dalam
xix
Replikasi 1 ...108 Lampiran 10. Reprodusibilitas: Kromatogram pemisahan kurkumin dalam
sampel cair OHT Kiranti®pada fase gerak metanolp.a:asam asetat glasial (90:10) denganflow rate0,5 mL/menit.
Replikasi 2 ...110 Lampiran 11. Reprodusibilitas: Kromatogram pemisahan kurkumin dalam
sampel cair OHT Kiranti®pada fase gerak metanolp.a:asam asetat glasial (90:10) denganflow rate0,5 mL/menit.
Replikasi 3 ...112 Lampiran 12. Data hasil uji reprodusibilitas sistem dan perhitungan %CV...114 Lampiran 13. Skema pembuatan seri larutan baku kurkumin ...115 Lampiran 14. Contoh kromatogram baku kurkumin pada fase gerak metanol
xx
INTISARI
Kurkumin merupakan senyawa alam yang memiliki banyak manfaat bagi kesehatan sehingga banyak dikembangkan salah satunya dalam bentuk sediaan cair Obat Herbal Terstandar (OHT) Kiranti®. Dalam produk OHT perlu adanya penjaminan mutu terkait kadar senyawa aktifnya sehingga semakin terjamin keamanan dan khasiatnya. Untuk itu dalam penelitian ini digunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik sebagai metode analisis kurkumin dalam sediaan cair OHT Kiranti®.
Penelitian ini bertujuan untuk mengetahui kondisi optimum dari KCKT sehingga dapat digunakan sebagai penetapan kadar kurkumin dalam sediaan cair OHT Kiranti®. Sistem KCKT fase terbalik menggunakan kolom C18 dengan fase gerak metanolp.a:asam asetat glasial 2%. Optimasi dilakukan dengan mengubah-ubah komposisi fase gerak metanol p.a:asam asetat glasial 2% (70:30), (80:20) dan (90:10) serta mengubah-ubah flow rate yaitu 0,5; 0,75; 1,0; 1,25; dan 1,5 mL/menit dengan detektor visibel padaλmaks432 nm.
Hasil penelitian ini menunjukkan kurkumin dalam sampel cair OHT Kiranti® dapat dipisahkan dengan metode KCKT fase terbalik. Kondisi optimum sistem KCKT yang diperoleh adalah fase gerak metanol p.a:asam asetat glasial 2% (90:10) pada flow rate 0,5 mL/menit. Kondisi optimum tersebut mampu menghasilkan bentukpeakyang simetri, tR6,005 menit, nilai resolusi 1,5070, dan HETP yang paling kecil yaitu 0,0070.
xxi
Curcumin is a natural compound that has many benefits for health so it is developed in many preparations such as Scientific Based Herbal Medicine (SBHM) liquid dosage form Kiranti®. In SBHM product, there should be quality assurance in relation to its active compound level that secures its safety and efficacy. Therefore, this research used reversed-phase High Performance Liquid Chromatography (HPLC) as analytical method for curcumin compound in liquid SBHM Kiranti®.
This research was aimed at identifying optimal condition of HPLC used to determine curcumin level in liquid SBHM Kiranti®. The reversed-phase HPLC used C18 column with methanol p.a:2% glacial acetate acid mobile phase. Optimization was done by changing composition of methanol p.a:2% glacial acetate acid mobile phase (70:30), (80:20) and (90:10) and changing flow rate 0,5; 0,75; 1,0; 1,25; and 1,5 mL/min with visible detector inmaxof 432 nm.
The results indicated that curcumin in liquid sample of SBHM Kiranti® can be separated with reversed-phase HPLC. The optimal condition of HPLC was methanol p.a:2% glacial acetate acid (90:10) mobile phase at flow rate 0,5 mL/min. The optimal condition can result in symmetric peak, tR 6,005 minute, resolution value 1,5070 and smallest HETP of 0,0070.
BAB I PENGANTAR
A. Latar Belakang
Semakin maraknya konsumsi terhadap obat herbal di kalangan masyarakat memacu pula perkembangan obat herbal itu sendiri. Penggunaan kunyit merupakan salah satu bentuk pengobatan tradisional yang secara turun-menurun digunakan oleh masyarakat Indonesia. Kunyit banyak digunakan sebagai obat herbal karena kandungan kurkuminnya yang berpotensi besar menyembuhkan banyak penyakit. Menurut Majeed, Badmaev, Shivakumar, and Rajendran (1995), kurkumin memiliki aktivitas sebagai anti-inflamasi, antioksidan, antialergi, analgesik, antispasmodik, antibakteri, antijamur, dan antitumor. Karena manfaatnya tersebut, kurkumin banyak dikembangkan salah satunya dalam bentuk sediaan cair Obat Herbal Terstandar (OHT) Kiranti®.
OHT merupakan bentuk pengembangan dalam pemanfaatan Obat Tradisional (OT) (Sarmoko, 2009). Tujuan pengembangan ini terutama mengarah untuk dijadikan sebagai sistem pelayanan kesehatan formal agar jamu/herbal diterima di kalangan medis (Ministry of Health Republic of Indonesia, 2010). Peningkatan grade dari OT menjadi OHT akan semakin meningkatkan pula kepercayaan masyarakat karena OHT diketahui telah melalui proses standardisasi sehingga lebih terjamin produknya (Sarmoko, 2009). Produk OHT telah ditunjang dengan adanya standarisasi terhadap bahan baku yang digunakan dan telah dilakukan uji praklinik yaitu uji kandungan berkhasiat terhadap hewan uji, uji toksisitas akut maupun kronis. Proses produkasi OHT juga berdasarkan cara
pembuatan obat tradisional yang higienis (Muaro, 2009). Salah satu produk OHT berupa sediaan cair yang mengandung kurkumin adalah Kiranti®. Bahan baku OHT Kiranti® berupa simplisia, bukan ekstrak. Dalam standarisasi simplisia belum dilakukan adanya penjaminan mutu terkait kadar bahan berkhasiat (Nadjeeb, 2009).
Berdasarkan alasan tersebut di atas, maka perlu dilakukan analisis terhadap kadar kurkumin dalam sediaan cair OHT Kiranti®. Penjaminan mutu terkait kadar bahan berkhasiat penting dilakukan terhadap produk OHT agar dapat diketahui bahwa kadar bahan berkhasiat dalam OHT yang telah melalui uji praklinik dapat memenuhi persyaratan kadar. Dengan demikian produk OHT pada umumnya dan produk OHT Kiranti® benar-benar dapat dipertanggungjawabkan khasiat dan keamanannya.
di dalam matriks sampel yang kompleks atau terdapat banyak komponen lain dalam suatu matriks sampel (Khopkar, 1990).
Analisis kurkumin dalam sediaan obat dapat dilakukan dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) fase terbalik (Tonnesen and Karlsen, 1983) dan untuk memperoleh hasil analisis yang baik, sebelumnya perlu dilakukan optimasi metode KCKT. Optimasi bertujuan untuk mengetahui kondisi optimum metode KCKT sehingga dapat digunakan sebagai metode penetapan kadar kurkumin dalam sediaan cair OHT Kiranti®. Kondisi optimum ditunjukkan dengan bentukpeaksimetri, waktu retensi (tR) kurang dari 10 menit, nilai resolusi
≥ 1,5 terhadap peak terdekat, serta nilai HETP yang semakin kecil (Snyder, Kirkland, and Glajh, 1997).
1. Permasalahan
Berdasarkan latar belakang yang ada, maka dapat disusun permasalahan sebagai berikut: Bagaimanakah komposisi fase gerak danflow rate yang optimum yaitu mampu menghasilkan pemisahan dengan bentukpeaksimetri, tRkurang dari 10 menit, nilai resolusi ≥ 1,5 terhadap peak terdekat, serta nilai HETP yang semakin kecil untuk penetapan kadar kurkumin dalam sediaan cair OHT Kiranti®?
2. Keaslian penelitian
Berbagai penelitian terhadap kurkumin telah dilakukan dari ekstraksi, sintesis, aktivitas farmakologisnya hingga penetapan kadarnya dalam suatu sediaan obat. Pemisahan kurkumin dengan RP-HPLC pernah dilakukan dengan komposisi fase gerak asetonitril:asam asetat 7,6% (55:45) (Yang, Pan, and Xu, 2006). Penelitian dengan judul “Curcumin Quantification in Dosage Forms using High Performance Liquid Chromatography” juga pernah dilakukan menggunakan
3. Manfaat penelitian
a. Manfaat Metodologis. Manfaat metodologis dari penelitian ini adalah dapat memberikan sumbangan ilmiah yaitu informasi mengenai metode penelitian dalam melakukan optimasi alat KCKT dan komposisi fase gerak untuk penetapan kadar kurkumin dalam sedian cair OHT.
b. Manfaat Praktis. Manfaat praktis dari penelitian tersebut adalah dapat digunakan sebagai metode optimasi dalam penetapan kadar kurkumin dari suatu sediaan cair OHT yang selanjutnya dapat memberikan informasi bagi masyarakat terkait penjaminan mutu pada OHT yang mengandung kurkumin.
B. Tujuan Penelitian
PENELAAHAN PUSTAKA
A. Kurkumin
Kurkumin merupakan senyawa yang secara alami banyak terdapat dalam Curcuma longa L. (kunyit). Kurkumin adalah bahan aktif yang penting dan bertanggung jawab atas aktivitas biologis pada Curcuma longa L. (Aggarwal et al., 2006). Kurkumin memiliki aktivitas sebagai anti-inflamasi, antioksidan,
antialergi, analgesik, antispasmodik, antibakteri, antijamur, dan aktivitas sebagai antitumor (Majeed, Badmaev, Shivakumar, and Rajendran, 1995).
Kurkumin berupa serbuk kristal berbentuk batang atau prisma, berwarna kuning orange, larut dalam alkohol dan aseton, tidak larut dalam air dan eter (Robinson, 1995). Kurkumin memiliki sifat yaitu rasanya yang sedikit pahit. Kurkumin juga larut dalam asam asetat glasial dan alkali hidroksida (Majeed et al., 1995).
Gambar 1. Struktur kurkumin (Aggarwalet al., 2006)
Kurkumin (C21H20O6) memiliki titik lebur 184-1850C, log P = 2,56, berat molekul 368,37 g/mol (Majeed et al., 1995). Secara spektrofotometri memiliki absorpsi maksimum pada panjang gelombang 430 nm dalam metanol (Aggarwal et al., 2006).
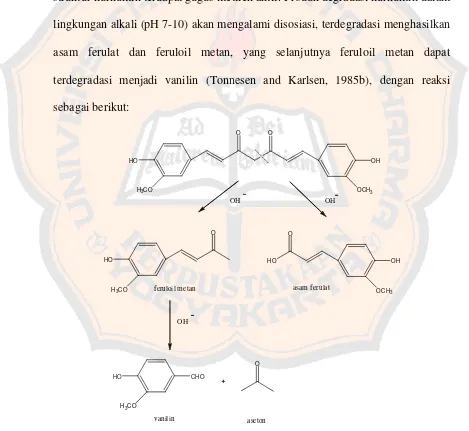
Stabilitas dari kurkumin dapat dipengaruhi oleh pH dan cahaya. Kurkumin akan mengalami hidrolisis di dalam air, tergantung pada pH lingkungan. Pada pH asam, kurkumin berwarna kuning sedangkan dalam pH basa (alkalis) akan menunjukkan larutan berwarna coklat kemerahan pekat hingga warna kuning muda (Tonnesen and Karlsen, 1985a). Kurkumin akan stabil di bawah pH 6,5 dan akan terdegradasi di atas pH 6,5. Hal tersebut dikarenakan pada struktur kurkumin terdapat gugus metilen aktif. Produk degradasi kurkumin dalam lingkungan alkali (pH 7-10) akan mengalami disosiasi, terdegradasi menghasilkan asam ferulat dan feruloil metan, yang selanjutnya feruloil metan dapat terdegradasi menjadi vanilin (Tonnesen and Karlsen, 1985b), dengan reaksi sebagai berikut:
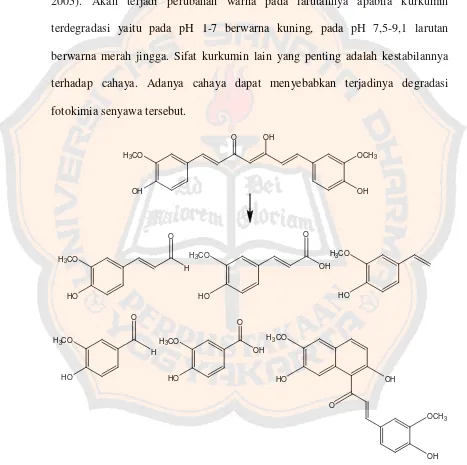
Degradasi kurkumin menjadi asam ferulat dan vanilin yang dapat menghambat glutation S-transferase (GST) yang sangat diperlukan bagi perlindungan tubuh melalui perannya sebagai katalis enzimatik pada detoksifikasi senyawa elektrofilik yang masuk ke dalam tubuh lewat konjugasi dengan GSH (Martono, 2005). Akan terjadi perubahan warna pada larutannya apabila kurkumin terdegradasi yaitu pada pH 1-7 berwarna kuning, pada pH 7,5-9,1 larutan berwarna merah jingga. Sifat kurkumin lain yang penting adalah kestabilannya terhadap cahaya. Adanya cahaya dapat menyebabkan terjadinya degradasi fotokimia senyawa tersebut.
Hal ini karena adanya gugus metilen aktif (-CH2-) diantara dua gugus keton pada senyawa tersebut (Tonnesen and Karlsen, 1985b).
B. Obat Herbal Terstandar (OHT)
Gambar 4. Logo Obat Herbal Terstandar (OHT)
Obat Herbal Terstandar adalah sediaan obat bahan alam yang telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik dan bahan bakunya telah distandarisasi. OHT harus memenuhi kriteria aman sesuai dengan persyaratan yang ditetapkan, klaim khasiat terbukti secara ilmiah/praklinik, dan telah dilakukan standarisasi terhadap bahan baku yang digunakan dalam produk jadi (BPOM RI, 2004). Obat Herbal Terstandar (OHT) berasal dari bahan alam dapat berupa tanaman obat, binatang, maupun mineral. Selain proses produksi dengan teknologi maju, jenis OHT ini pada umumnya telah ditunjang dengan pembuktian ilmiah berupa penelitian-penelitian praklinik uji kandungan berkhasiat terhadap hewan uji, uji toksisitas akut maupun kronis (Muaro, 2009).
simplisia yang digunakan dalam suatu produk jadi (Nadjeeb, 2009). Standarisasi simplisia sebagai wujud pemenuhan terhadap persyaratan bahan dan penetapan nilai berbagai parameter. Simplisia yang akan digunakan sebagai bahan baku harus memenuhi persyaratan yang tercantum dalam monografi terbitan resmi Departemen Kesehatan (Materia Medika Indonesia). Pengaturan syarat tumbuh tanaman, pedoman budidaya dimulai dari pembibitan, pemeliharaan hingga cara panen dan pengolahan pasca panen dilakukan untuk dapat menghasilkan simplisia dengan mutu yang baik . Standar mutu simplisia berdasarkan uji organoleptik dan uji kemurnian meliputi kadar air, kadar abu, kadar pasir (pengotor), kadar minyak atsiri, uji bahan organik asing, cemaran mikroba, cemaran residu pestisida, dan cemaran logam berat (Nadjeeb, 2009).
C. Spektrofotometri Visibel
Spektrofotometri visibel merupakan suatu teknik spektroskopik menggunakan sumber radiasi elektromagnetik sinar tampak (380-780 nm) dengan menggunakan spektrofotometer. Pengukuran absorbansi dalam spektrofotometri sinar tampak digunakan untuk analisis kualitatif dan kuantitatif (Khopkar, 1990). Sinar tampak memberikan energi yang cukup untuk terjadinya transisi elektronik. Transisi yang terjadi pada suatu molekul dengan struktur yang berbeda adalah tidak sama satu dengan molekul lain sehingga spektra absorpsinya juga berbeda. Dengan demikian dapat bermanfaat sebagai analisis kualitatif. Banyaknya sinar yang diabsorpsi pada panjang gelombang tertentu sebanding dengan banyaknya molekul yang menyerap radiasi sehingga dapat juga digunakan sebagai analisis kuantitatif (Rohman dan Gandjar, 2007).
Spektrum visibel yang merupakan korelasi antara absorbansi dan panjang gelombang bukan merupakan garis spektrum melainkan suatu pita spektrum. Terbentuknya pita spektrum visibel disebabkan oleh terjadinya eksitasi elektronik lebih dari satu macam pada gugus molekul yang sangat kompleks. Penyerapan radiasi sinar tampak oleh spesies molekul (M) dapat dipertimbangkan sebagai proses 2 langkah yaitu eksitasi partikel secara elektronik (M*) merupakan hasil dari reaksi M dengan foton (hv) yang ditunjukkan dengan persamaan M + hv
D. Kromatografi Cair Kinerja Tinggi
1. Definisi dan instrumentasi KCKT
Kromatografi Cair Kinerja Tinggi (KCKT) adalah teknik pemisahan campuran senyawa berdasarkan interaksi dengan fase diam di bawah aliran fase gerak, dimana fase gerak dialirkan dengan bantuan tekanan menuju kolom secara cepat dan dideteksi dengan detektor yang sesuai (Hendayana, 2006). Ada dua fase dalam kromatografi yaitu fase normal dan fase terbalik. Fase normal apabila fase diam lebih polar dari fase gerak, sedangkan fase terbalik yaitu apabila fase diam lebih non polar dari fase geraknya (Munson, 1991).
Sistem KCKT banyak digunakan untuk analisis karena sensitivitasnya mampu menghasilkan determinasi kuantitatif yang akurat. KCKT bertujuan untuk memperoleh hasil pemisahan senyawa yang baik dengan waktu yang relatif singkat (Mulja dan Suharman, 1995). KCKT ini ideal untuk analisis beragam obat dalam sediaan dan cairan biologi karena kepekaannya yang tinggi (Munson, 1991).
Berikut merupakan diagram instrumentasi KCKT menurut Levin (2010):
Ada tiga hal yang perlu diperhatikan dalam sistem KCKT menurut Gritter, Bobbit, and Schwarting (1991), yaitu fase diam, fase gerak dan detektor.
a. Fase Diam. Keberhasilan pemisahan senyawa dengan metode KCKT ini bergantung pada kondisi kolom yang digunakan (Mulja dan Suharman, 1995). Kolomnya dapat berupa gelas atau baja tidak berkarat. Kolom gelas dapat menahan tekanan hingga 600 psi. Panjang kolom bervariasi dari 15-150 cm. Sebagai pengisi kolom biasanya digunakan silika gel, alumina, dan elit (Khopkar, 1990).
Fase diam yang paling banyak digunakan adalah oktadesil silika (ODS) karena mampu memisahkan senyawa dengan kepolaran yang rendah, sedang maupun tinggi (Rohman dan Gandjar, 2007). Ukuran bahan pengisi pada kolom sangat berpengaruh terhadap resolusi. Apabila ukuran partikel bahan pengisi pada kolom semakin kecil maka HETP juga semakin kecil dan resolusi makin baik (Munson, 1991).
Fase gerak yang digunakan haruslah murni, tidak mempengaruhi kolom, sesuai dengan detektor, dapat melarutkan analit, memiliki viskositas yang rendah (tidak lebih dari 50 cP), tidak mudah terbakar dan memiliki toksisitas yang rendah, serta harganya yang wajar (Skoog, Holler, dan Nieman, 1985). Selain itu fase gerak harus bebas dari gelembung udara karena dapat mempengaruhi pembacaan oleh detektor sehingga memunculkan sinyal palsu dan dapat mempengaruhi kolom, untuk itu sebelumnya diperlukan alat degassing (Dean, 1995).
Pemilihan fase gerak yang digunakan adalah terutama berdasarkan kepolaran campuran pelarut yang semakin linier dengan pelarut murni. Tingkat kepolaran pelarut menggambarkan kekuatan pelarut dalam mengelusi suatu senyawa. Besarnya polaritas pelarut dapat dihitung dengan persamaan sebagai berikut:
P’camp = Φ1 P’1 +Φ2 P’2 + ... +Φn P’n (1)
Keterangan:
P’ = indeks polaritas
Tabel I. Indeks polaritas beberapa pelarut pada KCKT
Indeks polaritas pelarut lainnya yaitu asam asetat glasial adalah 6,2, etanol adalah 5,2 (Watson, 2003). Semakin besar nilai indeks polaritas campuran maka fase gerak yang digunakan semakin bersifat polar (Snyder et al., 1997). Kepolaran pelarut merupakan ukuran kekuatan atau kemapuan pelarut untuk mengelusi suatu senyawa. Ketika zat yang semakin mirip kepolarannya dengan pelarut, maka zat terlarut akan kuat berinteraksi dengan fase gerak dan teralusi lebih cepat (Munson, 1991).
1. Bulk property detectors
Bulk property detectors adalah detektor sebagai pengukur perubahan sifat fisik fase gerak dan solut. Detektor tipe ini cenderung relatif tidak sensitif dan menghendaki temperatur yang terkendali, contohnya detektor bias.
2. Solut property detectors
Solut property detectorsadalah detektor yang hanya mengukur sifat fisik solut. Solut property detectors 1000 kali lebih sensitif dan mampu mengukur solut sampai satuan nanogram atau lebih kecil lagi. Contoh detektor jenis ini yaitu detektor fluorensensi, detektor penyerapan (UV-Vis) dan detektor elektrokimia (Munson, 1991).
2. Kromatografi partisi fase terbalik
Konsep dasar kromatografi partisi yaitu perlakuan sampel dalam kondisi cair-cair tergantung pada kelarutannya di dalam kedua cairan yang terlibat (Gritter et al., 1991). Partisi analit di antara dua fase yang tidak saling campur, karena
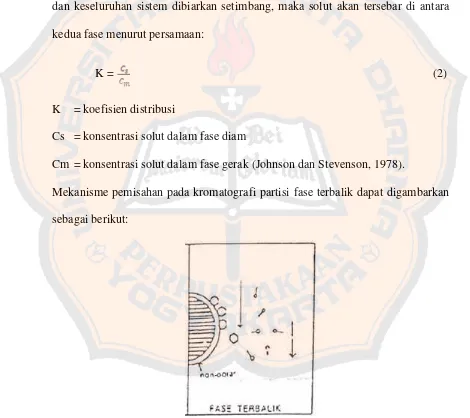
adanya perbedaan koefisien distribusi dari masing-masing senyawa. Jika solut ditambahkan ke dalam sistem yang terdiri dari dua pelarut tidak saling campur dan keseluruhan sistem dibiarkan setimbang, maka solut akan tersebar di antara kedua fase menurut persamaan:
K = (2)
K = koefisien distribusi
Cs = konsentrasi solut dalam fase diam
Cm = konsentrasi solut dalam fase gerak (Johnson dan Stevenson, 1978).
Mekanisme pemisahan pada kromatografi partisi fase terbalik dapat digambarkan sebagai berikut:
Dalam kromatografi partisi fase terbalik biasanya digunakan kolom dengan kemasan fase terikat yang memiliki sifat stabil karena fase diamnya terikat secara kimia pada penyangga, sehingga tidak mudah terbawa oleh fase gerak. Penyangga pada kemasan fase terikat biasanya terbuat dari silika yang sudah diseragamkan, berpori, dan umumnya partikel mempunyai diameter 3,5 atau 10
μm (Skooget al.,1998).
Pada fase terbalik, kandungan yang selalu ada dalam fase geraknya adalah air. Pelarut yang dapat campur dengan air seperti metanol, etanol, asetonitril, dan tetrahidrofuran ditambahkan untuk mengatur kepolaran fase gerak (Snyderet al., 1997).
3. Parameter pemisahan puncak dalam kromatografi
Parameter pemisahan dengan sistem KCKT sebagai ukuran kemampuan kolom untuk memisahkan senyawa dari suatu campuran. Batasan yang digunakan adalah efisiensi kolom, waktu retensi (tR), dan faktor resolusi (Munson, 1991).
a. Efisiensi kolom. Pemisahan dalam kromatografi erat kaitannya dengan efisiensi kolom. Ada dua teori mengenai pemisahan puncak dalam kromatografi, yaitu lempeng teoritik dan teori laju.
n = 5,54 2 (3)
Gambar 7. Perhitungan bilangan lempeng teoritik (Jasco, 2004)
Semua bilangan tersebut memiliki satuan yang sama karena “n” merupakan bilangan tak bersatuan (Munson, 1991). Suatu ukuran yang tergantung pada panjang kolom kromatografi adalah tinggi lempeng (H) atau yang biasa disebut dengan tinggi setara pelat teori (HETP = Heigth Equivalent Theoritical Plate). HETP dapat dihitung dari “n” dan panjang kolom (L):
HETP = (4)
Kolom yang memberikan jumlah lempeng (n) yang besar dan nilai HETP yang kecil akan mampu memisahkan komponen-komponen dalam suatu campuran yakni memiliki efisiensi kolom yang besar (Rohman dan Gandjar, 2007).
Sedangkan perlunya mempelajari teori laju karena dengan teori laju dapat diketahui adanya pengaruh variabel-variabel lain yang menyebabkan pelebaran peak, sedangkan teori lempeng hanya menggambarkan laju migrasi secara
gerak berkali-kali. Solut bergerak bersama fase gerak sehingga migrasi di dalam kolom tidak teratur yang mengakibatkan laju rata-rata solut relatif terhadap fase gerak juga sangat bervariasi. Laju rata-rata solut relatif terhadap fase gerak yang sangat bervariasi inilah yang mengakibatkan pelebaran peak solut (Noegrohati, 1994).
Berdasarkan teori laju ini, efisiensi kolom dirumuskan dalam persamaan Van Deemter yaitu:
H = + + Csu + Cmu1/2 (5)
Cs= (6)
Cm= (7)
Keterangan:
H = efisiensi kolom, semakin kecil semakin efisien u = kecepatan alir dari fase gerak
A = difusi eddy
B = difusi longitudinal
Cs = transfer massa pada fase diam
d2thickness= kuadrat dari ketebalan lapisan fase diam Ds = koefisien difusi analit pada fase diam Cm = transfer massa pada fase gerak
d2packing = kuadrat dari diameter partikel fase diam
Berdasarkan persamaan Van Deemter di atas, ada tiga variabel yang mempengaruhi efisiensi kolom yaitu Difusi Eddy, Difusi Longitudinal, dan Transfer Massa (Willard, Merritt, Dean, and Settle, 1988).
Difusi Eddy menggambarkan ketidakhomogenan kecepatan alir dan panjang lintasan di sekitar partikel yang ter-packing. Lintasan alir yang tidak sama pasti ditemukan dalam setiap kolom ter-packing. Suatu molekul solut dapat melewati kolom dekat dinding kolom di mana kerapatan kolom rendah dengan cepat mencapai akhir kolom, khususnya pada kolom berdiameter kecil. Sedangkan suatu molekul solut yang melewati bagian tengah kolom menjadi lebih lambat untuk mencapai akhir kolom. Dengan demikian laju tiap molekul melalui kolom berbeda-beda. Difusi Eddy dapat diminimalkan dengan memperkecil diameter rata-rata partikel dalam kolom hingga sekecil mungkin dan seseragam mungkin (Willardet al., 1988).
Gambar 8. Difusi Eddy (Watson, 2003)
solut terdispers secara aksial dan lambat bermigrasi melalui kolom (Willardet al., 1988).
Transfer massa dinyatakan dengan nilai Cstasionary dan Cmobile. Cstasionery merupakan solut yang tertahan karena adanya fase diam. Suatu molekul bergerak lambat dalam fase diam, sementara molekul lainnya bergerak bersama dengan fase gerak. Hal ini dapat diatasi dengan fase diam yang lebih encer (tidak terlalu kental).
Gambar 9. Transfer massa pada fase diam (Willardet al., 1988)
Sedangkan Cmobile menggambarkan adanya peristiwa dimana solut dalam fase diam bertemu dengan fase gerak yang masih baru. Hal ini dapat digambarkan sebagai berikut:
Pada analisis secara KCKT, bentukpeak yang diharapkan adalah bentuk peak yang simetri karena bentuk peak yang asimetris dapat mempengaruhi pengukuran bilangan lempeng teoritik dan faktor resolusi menjadi tidak akurat, perhitungan yang tidak teliti, penurunan derajat resolusi dan puncak-puncak minor yang tidak terdeteksi pada ekor puncak, serta menyebabkan waktu retensi menjadi tidak reprodusibel (Snyderet al., 1997). Menurut Watson (2003), parameter yang digunakan untuk menilai bentuk peak adalah peak asymmetry factor (AF), yang diukur 0,1 dari tinggipeak, dirumuskan sebagai berikut:
AF = b/a (8)
Gambar 11. Perhitungan faktor simetri (Watson, 2003)
Peak yang dihasilkan simetri (tidak tailing/fronting) apabila memiliki nilai AF = 1, namunpeakdengan nilai AF pada rentang 0,95-1,15 masih dikatakan baik.
b. Waktu retensi (tR) dan faktor resolusi. Waktu tambat atau waktu retensi merupakan selang waktu yang diperlukan oleh analit mulai saat injeksi hingga keluar dari kolom dan sinyalnya ditangkap oleh detektor dan dinyatakan sebagai tR (Mulja dan Suharman, 1995). Menurut Snyder et al (1997) waktu retensi yang diinginkan dalam suatu prosedur analisis secara KCKT adalah kurang dari 10 menit. Apabila harga D (koefisien distribusi) kecil maka analit akan lebih banyak di dalam fase gerak atau (Cm > Cs) yang berarti analit akan lebih lama tinggal di dalam fase gerak dan memiliki waktu retensi lebih cepat (Mulja dan Suharman, 1995). Analisis kualitatif dilakukan dengan cara membandingkan waktu retensi senyawa murni dan waktu retensi senyawa yang dimaksud dalam sampel (Noegrohati, 1994).
Faktor resolusi adalah ukuran pemisahan relatif dari dua puncak. Resolusi didefinisikan sebagai selisih waktu tambat satu puncak dengan waktu tambat puncak terdekat dibagi rerata lebar puncak yang diukur pada dasar puncak, yang dapat dirumuskan sebagai berikut:
Rs= atau Rs= (9)
Gambar 12. Perhitungan nilai resolusi pemisahan dua senyawa (Jasco, 2004)
Menurut Munson (1991), resolusi juga dapat dihitung dari lebar puncak pada tinggi paro seperti ditunjukkan pada persamaan berikut ini:
Rs= x (10)
Pemisahan yang baik Rs harus ≥ 1,5 yang berarti pemisahan kedua senyawa ≥ 99,7% dan dapat dikatakan memiliki pemisahan yang tuntas (Sastrohamidjojo, 2002). Dalam praktiknya, pemisahan dengan nilai R = 1,0 yang berarti kedua puncak berhimpit lebih kurang 2% sudah dianggap memadai (Pescok, Shields, and Cains, 1976).
E. Landasan Teori
Kurkumin merupakan senyawa alam yang terdapat dalam Curcuma longa L. Kurkumin berwarna kuning orange yang tidak larut dalam air dan eter, larut dalam alkohol dan asam asetat glasial. Stabilitas kurkumin dipengaruhi oleh pH dan cahaya. Kurkumin stabil pada pH di bawah 6,5.
OHT Kiranti®merupakan OHT cair yang mengandung kurkumin sebagai pereda nyeri haid pada wanita. Produk OHT telah terjamin keamanan dan khasiatnya secara ilmiah dengan uji praklinik dan bahan bakunya telah distandarisasi. Namun dalam produk OHT belum dilakukan penjaminan mutu terkait kadar bahan aktif.
yaitu bentuk peak simetri, tR kurang dari 10 menit, nilai resolusi ≥ 1,5 dan nilai HETP yang semakin kecil. Pemisahan yang baik memiliki bantuk peak yang runcing dan simetri, resolusi ≥1,5 terhadap peak terdekat serta nilai HETP yang semakin kecil. Semakin kecil nilai HETP maka akan memperbanyak jumlah lempeng teoritik yang dapat meningkatkan efisiensi kolom dan menghasilkan pemisahan yang lebih baik.
F. Hipotesis
28
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Jenis dan rancangan penelitian ini adalah eksperimental karena terdapat perlakuan terhadap subyek uji.
B. Variabel Penelitian
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah komposisi fase gerak metanol p.a:asam asetat glasial 2% danflow rateyang digunakan.
2. Variabel tergantung
Variabel tergantung dalam penelitian ini adalah pemisahan peak dari kurkumin yang dapat dilihat berdasarkan bentuk peak, waktu retensi (tR), nilai resolusi dan HETP.
3. Variabel pengacau terkendali
a. Kemurnian pelarut yang digunakan, dapat diatasi dengan menggunakan pelarutpro analysisyang memiliki kemurnian tinggi.
b. pH pelarut yang dapat mempengaruhi stabilitas kurkumin, dapat diatasi dengan menggunakan pelarut metanol pH 4.
C. Definisi Operasional
1. Kurkumin yang dianalisis merupakan senyawa aktif yang berada dalam sampel cair OHT Kiranti®.
2. Sistem KCKT fase terbalik yang digunakan adalah seperangkat alat KCKT menggunakan kolom C18 dengan fase gerak metanol p.a:asam asetat glasial 2%.
3. Optimasi dilakukan dengan mengubah-ubah komposisi fase gerak dan flow rate.
4. Parameter pemisahan komponen dengan metode KCKT adalah bentuk peak, nilai resolusi dan HETP.
D. Bahan-bahan Penelitian
Bahan yang digunakan dalam penelitian adalah baku kurkumin hasil sintesis Prof. Dr. Sudibyo Martono, M.S., Apt. yang telah dikonfirmasi strukturnya dengan metode spektroskopi 1H-NMR dan Mass Spectra (titik lebur 181,2-182,40C), metanol p.a. EMSURE® ACS, ISO, Reag. Ph Eur (E. Merck), asam asetat glasial p.a, aquabidestilata for HPLC, sediaan cair Obat Herbal Terstandar (OHT) Kiranti®yang mengandung kurkumin.
E. Alat-alat Penelitian
x 4,6 mm), seperangkat komputer (merk Dell B6RDZ1SConnexant Sistem RD01-D850 A03-0382 JP France S.A.S, printer HP Deskjet D2566 HP-024-000 625 730),seperangkat alat spektrofotometri UV-Vis merkMilton Ray Spectronic 3000 Arrayyang dihubungkan dengan printer merkEpson LQ-1170, timbangan analitik Ohaus Carat Series PAJ 1003 (max 60/120g, min 0,001g, d = 0,01/0,1 mg), millipore, alat ultrasonikasi Refsch., Tipe: T460 (Schwing.1 PXE, FTZ-Nr.
C-066/83, HF-Frequ.:35 kHz), kertas saring Whatman 0,45 µm, alat vacuum, dan seperangkat alat gelas.
F. Tata Cara Penelitian
1. Pembuatan asam asetat glasial 2%
Sebanyak 2,0 mL asam asetat glasial dimasukkan ke dalam labu ukur 100,0 mL, ditambahkan aquabides hingga batas tanda.
2. Pembuatan pelarut
Metanol p.a ditambah dengan asam asetat glasial 2% tetes demi tetes hingga metanol memiliki pH 4. Setiap kali penetesan asam asetat glasial 2% dilakukan cek pH dengan pH indikator.
3. Pembuatan fase gerak
Campuran fase gerak yang digunakan untuk optimasi dalam penelitian ini adalah metanolp.adan asam asetat glasial 2%.
Tabel II. Komposisi fase gerak metanolp.a:asam asetat glasial 2%
Komposisi fase gerak No.
Metanolp.a Asam asetat glasial 2%
1. 70 30
2. 80 20
Masing-masing pelarut disaring menggunakan kertas saring Whatman dengan bantuan alat vacuum dan di-degassing selama 15 menit. Untuk memperoleh komposisi fase gerak seperti pada tabel II di atas, pencampuran fase gerak dilakukan di dalam sistem KCKT.
4. Pembuatan seri larutan baku kurkumin
a. Pembuatan larutan stok. Kurkumin baku ditimbang lebih kurang 10 mg serbuk kurkumin dan dilarutkan dengan metanol p.a pH 4 dalam labu takar 10,0 ml hingga batas tanda.
b. Pembuatan larutan intermediet. Sebanyak 1,0 ml larutan stok baku kurkumin diencerkan dengan metanol p.apH 4 dalam labu takar 10,0 mL hingga batas tanda.
c. Pembuatan seri larutan baku kurkumin. Untuk mendapatkan konsentrasi seri larutan baku kurkumin 1,5; 2,0; 2,5; 3,0; 3,5; 4,0 dan 4,5 ppm, sebanyak 0,15; 0,20; 0,25; 0,30; 0,35; 0,40 dan 0,45 ml larutan intermediet diencerkan dengan metanol p.a pH 4 dalam labu takar 10,0 mL hingga batas tanda. Larutan disaring denganmilliporedan di-degassingselama 15 menit.
5. Preparasi sampel
6. Optimasi metode KCKT fase terbalik
a. Penentuan panjang gelombang maksimum kurkumin. Penentuan panjang gelombang maksimum dilakukan dengan cara merekam spektra larutan baku kurkumin 1,5; 3,0; dan 4,5 ppm pada rentang panjang gelombang 200-500 nm terhadap blanko metanol p.a pH 4. Dari spektra serapan dapat diketahui panjang gelombang yang menghasilkan serapan maksimum pada masing-masing konsentrasi, kemudian ditentukan panjang gelombang yang akan digunakan dalam optimasi hingga penetapan kadar kurkumin pada sistem KCKT yaitu panjang gelombang dimana ketiga konsentrasi tersebut menghasilkan serapan yang maksimum. Pengerjaan larutan kurkumin harus terlindung dari cahaya.
b. Optimasi pemisahan kurkumin dari sediaan cair OHT. Detektor pada alat KCKT diatur pada panjang gelombang maksimum. Sebanyak 20 µl larutan baku kurkumin 3,0 ppm dan larutan A yang sudah disaring dengan milliporedan di-degassing selama 15 menit diinjeksikan pada sistem KCKT fase terbalik menggunakan fase gerak yang telah dibuat seperti pada langkah F.2 di atas. Sistem operasi KCKT fase terbalik dilakukan dengan mengubah-ubah komposisi fase gerak metanol p.a dan asam asetat glasial 2% dengan perbandingan (70:30), (80:20), dan (90:10) serta mengubah-ubah flow rate 0,5; 0,75; 1,0; 1,25; dan 1,5 mL/menit untuk masing-masing komposisi fase gerak.
G. Analisis Hasil Optimasi
Data kromatogram yang diperoleh baik pada baku maupun sampel diamati sehingga dapat diketahui sistem KCKT fase terbalik yang memberikan pemisahan kurkumin paling baik yaitu dengan mengamati bentuk peak yang dihasilkan, waktu yang dibutuhkan untuk elusi, menghitung nilai resolusi dan HETP. Pemisahan yang baik adalah pemisahan dengan bentuk peak yang simetri (tidak tailing atau fronting), waktu retensi (tR) kurang dari 10 menit, memiliki nilai resolusi≥1,5 terhadappeakterdekat dan nilai HETP yang semakin kecil.
1. Analisis kualitatif
Analisis kualitatif dilakukan dengan cara membandingkan waktu retensi baku kurkumin dan waktu retensi kurkumin dalam sampel cair OHT Kiranti®. Apabila tRsenyawa dalam sampel sama atau mendekati tRbaku kurkumin maka senyawa tersebut merupakan senyawa kurkumin.
2. Analisis pemisahanpeakkurkumin
a. Bentukpeakpemisahan kurkumin
Bentuk peak yang diharapkan adalah simetri. Sebagai parameternya yaitu Asymmetry Factor (AF) yang diukur 0,1 dari tinggi peak.Perhitungan AF melalui persamaan: AF = b/a.
b. Waktu retensi (tR)
Amati waktu yang dibutuhkan untuk pemisahan senyawa. Apabila kurang dari 10 menit, maka pemisahan dikatakan efisien.
c. Nilai resolusi
Nilai resolusi pemisahan peak dihitung terhadap peak terdekat dengan rumus: Rs=
Pemisahan yang baik menghasilkan nilai Rs≥1,5.
d. Nilai HETP
Nilai HETP dihitung dengan rumus: HETP = , dimana “n” merupakan
bilangan lempeng teoritik dengan persamaan: n = 5,54 x 2. Apabila
3. Reprodusibilitas
BAB IV
HASIL DAN PEMBAHASAN
A. Pembuatan Pelarut
Pelarut metanolp.adibuat dalam pH 4 berdasarkan orientasi uji stabilitas kurkumin pada pH di bawah 6,5. Berikut merupakan data hasil uji stabilitas kurkumin pada rentang panjang gelombang UV-Vis 200-500 nm:
Tabel III. Hasil uji stabilitas kurkumin
Menurut Tonnesen and Karlsen (1985b), kurkumin stabil di bawah pH 6,5. Namun pada uji stabilitas kurkumin ini hanya dilakukan pada 3 variasi pH yaitu pH 3, 4 dan 5. Hal ini berdasarkan pH Kiranti® yaitu berkisar antara pH 4-5. Uji tidak dilakukan di bawah pH 3 terkait dengan stabilitas kolom yang rusak pada pH kurang dari 2.
Stabilitas kurkumin ditinjau berdasarkan 2 parameter yaitu kesesuaian antara panjang gelombang maksimum teoritis dengan hasil pengukuran dan berdasarkan panjang gelombang maksimum yang tetap pada nilai pH tertentu dalam pengukuran ketiga seri baku. Berdasarkan hasil uji stabilitas kurkumin di atas maka dapat diketahui bahwa kurkumin lebih stabil pada pH 4 terkait dengan
sifat kurkumin yaitu asam lemah. Pada pH 4 panjang gelombang kurkumin pada ketiga level konsentrasi hanya berkisar dari 432-435 nm, berbeda dengan panjang gelombang pada pH 3 dan 5, dimana panjang gelombang maksimumnya lebih bervariasi. Hal ini menunjukkan bahwa kurkumin kurang stabil pada pH 3 maupun pH 5.
metanol yang volatile, dikhawatirkan metanol menguap dan mempengaruhi pH pelarut.
B. Pembuatan Fase Gerak
Metode KCKT fase terbalik pada penelitian ini menggunakan sistem gradien yaitu pencampuran komposisi fase gerak berada di dalam alat KCKT untuk memperoleh kepolaran yang diinginkan dengan mengubah-ubah komposisi fase gerak yang digunakan selama elusi. Fase gerak dalam penelitian ini adalah campuran metanol p.a dan asam asetat glasial 2%. Dipilih metanol karena metanol diketahui memiliki sifat yang mirip dengan asetonitril yang telah banyak digunakan dalam pemisahan kurkumin pada penelitian sebelumnya (Taylor and McDowell, 1992; Yang et al., 2006; Musfiroh et al.,2007). Kemiripan antara metanol dengan asetonitril yaitu antara keduanya memiliki indeks polaritas yang hampir sama (asetonitril = 5,8 dan metanol = 5,1). Penggunaan campuran asam asetat glasial 2% karena sifat kurkumin yang larut dalam asam asetat glasial. Asam asetat glasial 2% dalam fase gerak ini juga berperan dalam mengatur kepolaran fase gerak seperti pada penelitian Musfiroh et al (2007) dan berfungsi dalam pengaturan pH fase gerak pada pH 4.
2006) digunakan fase gerak asetonitril:asam asetat 7,6% dalam air (55:45) dengan indeks polaritas 7,5816 ≈ 7,6. Sedangkan pada penelitian Musfiroh et al (2007) dengan judul “Curcumin Quantification in Dosage Forms using High Performance Liquid Chromatography” digunakan fase gerak asetonitril:asam
Tabel IV. Indeks polaritas campuran fase gerak metanolp.a:asam asetat glasial 2%
Komposisi fase gerak No.
Metanolp.a Asam asetat
glasial 2%
Semakin kecil indeks polaritas maka fase gerak semakin bersifat non polar. Penurunan indeks polaritas ini bertujuan untuk memperoleh kesesuiaan dengan kepolaran kurkumin. Namun kepolaran fase gerak tetap diatur supaya tidak terlalu bersifat non polar. Apabila fase gerak terlalu bersifat non polar, dapat menyebabkan elusi kurkumin tanpa adanya interaksi dengan fase diam. Hal tersebut dapat mengakibatkan pemisahan senyawa menjadi tidak sempurna.
Pemilihan ketiga komposisi fase gerak tersebut juga berdasar pertimbangan pH.
Tabel V. pH campuran fase gerak metanolp.a:asam asetat glasial 2%
Komposisi fase gerak No.
Metanolp.a Asam asetat
glasial 2%
pH fase gerak
1. 70 30 4
2. 80 20 4
3. 90 10 4
Penggunaan asam asetat glasial 2% supaya dengan penambahan beberapa tetes tidak akan menyebabkan fase gerak terlalu asam. Sebab bila fase gerak terlalu asam (pH≤ 2) dapat menyebabkan gangguan pada keutuhan kolom dalam KCKT. Pada pH asam (pH ≤ 2), oktadesilsilan akan melepaskan kembali oktadesilnya sehingga akan mempengaruhi kepolaran dari kolom (menjadi semakin polar) yang dapat mempengaruhi elusi senyawa analit karena dengan semakin polarnya fase diam maka akan mempengaruhi interaksi senyawa analit terhadap fase gerak dan fase diam. Penggunaan asam asetat yang mempengaruhi pH menjadi pH asam kurang dari 2, maka oktadesilsilan akan mengalami hidrolisis sehingga kembali ke bentuk silanol. Berikut ini gambaran reaksinya:
Si OH HO Si (CH3)17CH2
Gambar 14. Reaksi hidrolisis kolom oktadesilsilan pada pH asam kurang dari 2
C. Pembuatan Seri Larutan Baku Kurkumin
Kurkumin yang digunakan sebagai baku merupakan baku kurkumin hasil sintesis Prof. Dr. Sudibyo Martono, M.S., Apt yang telah dikonfirmasi strukturnya dengan metode spektroskopi 1H-NMR dan Mass Spectra, kurkumin hasil sintesis tersebut memiliki titik lebur 181,2-182,40C. Dengan demikian baku kurkumin yang digunakan telah terjamin kepastian senyawa dan kemurniannya.
(99,85%). Pembuatan konsentrasi baku berdasarkan hasil orientasi karena dalam kemasan produk OHT Kiranti® tidak dicantumkan kadar dari kurkumin. Larutan seri baku kurkumin yang digunakan dalam optimasi adalah konsentrasi rendah 1,5 ppm, konsentrasi tengah 3,0 ppm, dan konsentrasi tinggi 4,5 ppm. Penggunaan 3 level konsentrasi larutan baku kurkumin ini untuk memastikan respon yang muncul dalam sistem KCKT. Skala respon diatur 1-125 mV (detector attenuation 4).Detector attenuationini disesuaikan dengan respon oleh detektor dalam sistem KCKT terhadap baku kurkumin. Peak yang terlalu kecil bisa disebabkan karena detector attenuationyang terlalu besar, begitu sebaliknyapeak yang terlalu besar dapat disebabkan karena detector attenuationyang terlalu kecil (Simpson, 2008). Maka perlu dilakukan pengaturandetector attenuation ini. Denganattenuation 4, respon baku kurkumin tidak terlalu kecil dan tidak terlalu besar serta tidak melebihi skala respon tersebut. Hal ini akan mempermudah dalam pengamatan dan analisis pemisahan peak. Dengan demikian dapat dipastikan peakpemisahan kurkumin dalam sampel cair OHT Kiranti® juga tidak akan terlalu kecil atau terlalu besar dan tidak akan melebihi skala respon karena kadar kurkumin dalam sampel cair OHT Kiranti® telah diperhitungkan berada dalam range konsentrasi larutan baku kurkumin.
D. Preparasi Sampel
Kaempferiae Rhizoma (3 g),Arengae pinnata Fructose(3 g),Zingiberis Rhizoma (0.8 g), Paullinia cupana (0.23 g), Cinnamomi Cortex (0.1 g), dan air (sampai dengan 150 mL). Karena banyaknya campuran senyawa di dalam sampel cair OHT Kiranti®, maka perlu dilakukan ekstraksi kurkumin dengan metanol p.apH 4. Digunakan metanol p.a pH 4 sebagai pelarut dan cairan pengekstraksi karena kurkumin larut dalam metanol. Ekstraksi bertujuan meminimalkan campuran senyawa dalam sampel, maka hanya senyawa-senyawa yang larut dalam metanol dan senyawa-senyawa yang memiliki kemiripan dengan metanol yang akan terekstraksi (like disolve like). Untuk memaksimalkan ekstraksi kurkumin, larutan di-ultrasonikasi selama 15 menit. Kemudian larutan disaring sehingga senyawa-senyawa yang tidak larut dalam metanol akan terpisahkan, tertinggal di kertas saring. Kemudian filtrat ditambah pelarut hingga volume 10,0 mL. Larutan diambil 1 mL dan diencerkan dengan pelarut hingga tanda dalam labu takar 10,0 mL. Pengenceran ini dilakukan terkait respon yang muncul dalam sistem KCKT. Apabila sampel tidak diencerkan lagi maka respon akan tinggi peak melebihi skala respon 1-125 mV.
E. Penentuan Panjang Gelombang Maksimum Kurkumin
Gambar 15. Spektra serapan kurkumin
Keterangan: A = konsentrasi 1,5ppm (konsentrasi rendah) λmaks 432nm; B = konsentrasi 3,0ppm (konsentrasi tengah) λmaks 433nm; dan C = konsentrasi 4,5
ppm (konsentrasi tinggi) λmaks 432nm
Dalam literatur disebutkan bahwa panjang gelombang maksimum kurkumin dalam metanol adalah 430 nm (Aggarwal et al., 2006). Sedangkan dalam Chan et al (1995), disebutkan bahwa pengukuran panjang gelombang maksimum visibel dikatakan memenuhi syarat jika tepat atau dalam batas ± 3 nm dari panjang gelombang maksimum yang ditentukan. Berdasarkan data hasil pengukuran λmaks kurkumin, diketahui bahwa panjang gelombang hasil pengukuran yaitu λmaks 432 nm dan 433 nm menyimpang 2-3 nm dari panjang gelombang maksimum teoritis. Dengan demikian kedua λmaks kurkumin hasil pengukuran tetap dapat dikatakan sesuai denganλmaksteoritis sehingga dipastikan bahwa senyawa tersebut adalah kurkumin. Namun dari kedua λmaks tersebut, dipilihλmaks 432 nm sebagai panjang gelombang detektor pada sistem KCKT fase terbalik karena merupakan panjang gelombang maksimum yang paling sering
A B
muncul (dari ketiga level konsentrasi, pada konsentrasi rendah dan tinggi menghasilkanλmaks432 nm).
Suatu senyawa yang dapat dianalisis dengan spektrofotometri visibel adalah senyawa yang memiliki kromofor dan auksokrom, serapannya antara 380-780 nm (Rohman dan Gandjar, 2007). Gugus kromofor bertanggung jawab dalam penyerapan radiasi ultraviolet, sedangkan gugus auksokrom berperan dalam pergeseran panjang gelombang dan intensitas serapan maksimum dari kurkumin.
Gambar 16. Gugus kromofor dan auksokrom pada kurkumin Keterangan: kromofor
Auksokrom
F. Optimasi Pemisahan Kurkumin dengan Metode KCKT Fase Terbalik
oktadesilsilan digunakan batas tekanan kolom dari 0 kPa hingga 380 kPa. Peningkatan flow rate akan meningkatkan tekanan pompa sehingga dapat melebihi batas, hal ini menyebabkan kerusakan kolom oktadesilsilan. Penggunaan kecepatan alir 1,5 ml/menit dilakukan untuk menjaga agar tekanan pompa tidak lebih dari 380 kPa.
Tabel VI. Tekanan kolom (kgf/cm2=kPa)
Flow rate
70:30 92 130 170 206 242
80:20 81 114 147 178 210
90:10 61 86 112 135 157
*Komposisi fase gerak metanolp.a:asam asetat glasial 2%
Berikut merupakan hasil pemisahan kurkumin dengan metode KCKT fase terbalik menggunakan fase gerak metanolp.a:asam aseatat glasial 2%:
Tabel VII. Hasil pemisahan kurkumin
Komposisi fase gerak Flow rate(mL/menit)
MeOH
*baku 16,453 10,999 8,355 6,719 5,688
70 30
Sampel 16,492 10,990 8,290 6,695 5,691
*baku 8,236 5,516 4,243 3,400 2,872
80 20
*baku 6,002 4,041 3,045 2,439 2,048
90 10
*Baku kurkumin konsentrasi 3,0 ppm
Berdasarkan tabel VI maka dapat diketahui bahwa pada baku kurkumin hanya memunculkan 1 peak, sedangkan pada sampel secara keseluruhan terdapat 3-4 peak. Hal ini menunjukkan di dalam baku hanya terdapat senyawa kurkumin,
G. Analisis KualitatifPeakKurkumin dalam Sampel
Tabel VIII. Waktu retensi senyawa kurkumin dalam sampel dan waktu retensi baku kurkumin
Komposisi fase gerak Flow rate(mL/menit)
MeOH
*baku 16,453 10,999 8,355 6,719 5,688
70 30
Sampel 16,492 10,990 8,290 6,695 5,691
*baku 8,236 5,516 4,243 3,400 2,872
80 20
sampel 8,256 5,536 4,253 3,396 2,867
*baku 6,002 4,041 3,045 2,439 2,048
90 10
Sampel 6,005 4,050 3,049 2,439 2,056
*Baku kurkumin konsentrasi 3,0 ppm
Berikut merupakan kromatogram baku kurkumin konsentrasi 3,0 ppm dan senyawa senyawa kurkumin dalam sampel cair OHT Kiranti® pada ketiga komposisi fase gerak (70:30), (80:20), (90:10):
Gambar 17. a = baku kurkumin 3,0 ppm; b = sampel cair OHT Kiranti®pada fase gerak metanolp.a:asam asetat glasial 2% 70:30
a
Gambar 18. c = baku kurkumin 3,0 ppm; d = sampel cair OHT Kiranti®pada fase gerak metanolp.a:asam asetat glasial 2% 80:20
c
d
Gambar 19. e = baku kurkumin 3,0 ppm; f = sampel cair OHT Kiranti®pada fase geral metanolp.a:asam asetat glasial 2% 90:10
Berdasarkan tabel VIII, diperoleh waktu retensi (tR) dari peak senyawa kurkumin dalam sampel cair OHT Kiranti® mirip bahkan sama dengan tR kurkumin pada baku, juga berdasarkan gambar 17, 18, dan 19 bahwa antara peak senyawa kurkumin dalam sampel dibandingkan dengan peak baku kurkumin pada setiap komposisi fase gerak memiliki profil yang sama (bentuk peak yang sama). Dengan demikianpeaktersebut benar merupakanpeaksenyawa kurkumin.
H. Hasil Optimasi Pemisahan Kurkumin dalam Sampel Cair OHT Kiranti®
Berikut merupakan hasil optimasi pemisahan kurkumin dalam sampel cair OHT Kiranti®dengan fase gerak metanolp.a:asam asetat glasial 2%:
Tabel IX. Hasil optimasi pemisahan kurkumin berdasar paramaterAsymmetry Factor(AF)
No.
*Komposisi
fase gerak Flow rate (mL/min)
a. 0,5 6,005 1 Peaksimetri
b. 0,75 4,050 1 Peaksimetri
c. 1,0 3,049 1,25
*Komposisi fase gerak metanolp.a:asam asetat glasial 2%
1. Fase gerak metanol p.a:asam asetat glasial 2% dengan perbandingan
70:30
B
C
Gambar 20. Kromatogram pemisahan kurkumin dalam sampel cair OHT Kiranti® dengan komposisi fase gerak metanolp.a:asam asetat glasial 2% 70:30. Keterangan: A= padaflow rate0,5 mL/menit, B= padaflow rate0,75 mL/menit, C= padaflow rate
1,0 mL/menit, D=flow rate1,25 mL/menit dan E= padaflow rate1,5 mL/menit
Penggunaan fase gerak metanol p.a:asam asetat glasial 2% 70:30 pada flow rate 0,5 mL/menit yang tampak pada gambar 20A menunjukkan bahwa pemisahan tidak optimal. Peak yang dihasilkan asimetri dengan nilai AF= 2,57. Peak yang dihasilkan kecil namun lebar. Bahkan waktu yang dibutuhkan untuk elusi kurkumin pada flow rate 0,5 mL/menit ini terlalu lama yaitu mencapai 16,492 menit dan ini tidak efisien. Dalam analisis dengan KCKT, waktu retensi yang diharapkan kurang dari 10 menit (Snyder et al., 1997). Begitu juga pemisahan dengan fase gerak metanol p.a:asam asetat glasial 2% 70:30 pada flow rate 0,75 mL/menit yang ditunjukkan oleh gambar 20B. Pemisahan tidak optimal,peakyang dihasilkan asimetri dengan nilai AF= 3 dan profil atau bentuk peak yang sama dengan gambar 20A yaitu kecil tapi tampak lebar. Waktu yang dibutuhkan untuk elusi kurkumin juga masih lebih dari 10 menit yaitu 10,990 menit. Sedangkan pada flow rate 1,0; 1,25; dan 1,5 mL/menit dapat mempersingkat waktu retensi dari peak kurkumin menjadi kurang dari 10 menit yaitu berturut-turut 8,290 menit, 6,695 menit, dan 5,691 menit (gambar 20C, 20D,
dan 20E). Namun seiring dengan peningkatanflow rate, semakin besar pulau nilai AF daripeak yang dihasilkan yaitu padaflow rate 1,0 mL/menit AF= 3,flow rate 1,25 mL/menit AF= 4, dan padaflow rate1,5 mL/menit AF= 4.
2. Fase gerak metanol p.a:asam asetat glasial 2% dengan perbandingan
80:20
A
B
Gambar 21. Kromatogram pemisahan kurkumin dalam sampel cair OHT Kiranti® dengan komposisi fase gerak metanolp.a:asam asetat glasial 2% 80:20 Keterangan: A= padaflow rate0,5 mL/menit, B= padaflow rate0,75 mL/menit, C=
padaflow rate1,0 mL/menit, D= padaflow rate1,25 mL/menit dan E= padaflow rate1,5 mL/menit
Pada penggunaan fase gerak metanol p.a:asam asetat glasial 2% 80:20 padaflow rate0,5 mL/menit yang tampak pada gambar 21A menunjukkan bentuk peak yang tidak ramping, terlalu lebar dan tidak simetri dengan nilai AF= 1,67. Waktu yang dibutuhkan untuk elusi kurkumin pada flow rate 0,5 mL/menit ini sudah memenuhi waktu retensi yang diharapkan kurang dari 10 menit yaitu mencapai 8,256 menit. Begitu juga pemisahan dengan fase gerak metanol p.a:asam asetat glasial 2% 80:20 padaflow rate0,75 mL/menit yang ditunjukkan oleh gambar 21B. Pemisahan tidak optimal, peak yang dihasilkan semakin
D
ramping namun semakin tampak tidak simetri dengan nilai AF = 1,75. Waktu yang dibutuhkan untuk elusi kurkumin pada flow rate 0,75 yaitu 5,536 menit. Dengan peningkatan flow rate 1,0; 1,25; dan 1,5 mL/menit semakin mempersingkat waktu retensi dari peak kurkumin menjadi semakin efisien yaitu berturut-turut 4,253 menit, 3,396 menit, dan 2,867 menit. Bentuk peak juga semakin ramping dan dapat dikatakan bentuk peak lebih runcing, namun seiring dengan peningkatan flow rate, semakin besar pulau nilai AF dari peak yang dihasilkan yaitu pada flow rate 1,0 mL/menit AF= 2, flow rate 1,25 mL/menit AF= 2,5, dan padaflow rate1,5 mL/menit AF= 3, tampak pada gambar 21C, 21D, dan 21E pada bagian kananpeakmengekor.
parameter awal dalam pemisahan senyawa dengan metode KCKT. Optimasi dilanjutkan dengan tujuan menurunkan kepolaran fase gerak kembali menjadi lebih non polar yaitu dengan menggunakan komposisi fase gerak metanol p.a:asam asetat glasial 2% 90:10 yang bertujuan untuk semakin meningkatkan
kemampuan elusi kurkumin.
3. Fase gerak metanol p.a:asam asetat glasial 2% dengan perbandingan
90:10
A
Gambar 22. Kromatogram pemisahan kurkumin dalam sampel cair OHT Kiranti® dengan komposisi fase gerak metanolp.a:asam asetat glasial 2% 90:10 Keterangan: A= padaflow rate0,5 mL/menit, B= padaflow rate0,75 mL/menit, C=
padaflow rate1,0 mL/menit, D= padaflow rate1,25 mL/menit dan E= padaflow rate1,5 mL/menit
Pada fase gerak metanol p.a:asam asetat glasial 2% 90:10 semakin tampak terjadinya pemisahan senyawa kurkumin dengan senyawa lain dalam sampel yang larut juga dalam metanol bahkan dengan fase gerak ini diperoleh
pemisahan dengan bentuk peak yang runcing, tidak melebar serta waktu yang dibutuhkan untuk elusi senyawa kurkumin kurang dari 10 menit pada semuaflow rate. Pada gambar 22, dapat diamati ada 2peak dari senyawa lain yang berada di depan peak kurkumin. Berikut merupakan tabel hasil analisis pemisahan kurkumin pada komposisi fase gerak metanolp.a:asam asetat glasial 2% (90:10):
Tabel X. Hasil optimasi pemisahan kurkumin pada komposisi fase gerak metanol
p.a:asam asetat glasial 2% 90:10
Flow rate
0,5 6,005 1 Peaksimetri 1,5070 0,0070
0,75 4,050 1 Peaksimetri 1,2508 0,0093
1,0 3,049 1,2 1,1960 0,0121
1,25 2,439 1,25 1,1116 0,0131
1,5 2,056 1,25
Peakasimetri
1,0803 0,0201
Pada penggunaan fase gerak methanol p.a:asam asetat glasial 2% 90:10 dengan flow rate 0,5 mL/menit yang tampak pada gambar 22A menunjukkan bentuk peak yang simetri dengan nilai AF = 1. Pemisahan yang terjadi, apabila diamati pada gambar 22A antara peak kurkumin dengan peak terdekat di depannya tidak memisah sempurna. Namun melalui perhitungan nilai resolusi dan HETP sebagai parameter pemisahan senyawa dengan KCKT, diperoleh nilai resolusi pemisahan 1,5070 dan nilai HETP yang paling kecil yaitu 0,0070.
peningkatan flow rate lebih lanjut yaitu flow rate 1,0; 1,25; dan 1,5 mL/menit menunjukkan bentukpeakyang semakin tidak simetri, nilai resolusi yang semakin kecil, dan nilai HETP yang semakin besar.
Hal ini menunjukkan bahwa peningkatan flow rate pada komposisi fase gerak 90:10 tidak semakin memberikan profil pemisahan kurkumin yang baik selain waktu retensi yang semakin singkat. Peningkatan flow rate semakin memperkecil nilai resolusi menjadi semakin kurang dari 1,5 sehingga pemisahan kurkumin semakin tidak baik. Peningkatan flow rate juga semakin memperbesar nilai HETP, semakin besar nilai HETP maka efisiensi kolom semakin rendah yang mempengaruhi pemisahan menjadi semakin tidak sempurna.
Dengan demikian dapat diketahui kondisi optimum untuk pemisahan kurkumin dalam sampel cair OHT Kiranti® yaitu pada komposisi fase gerak metnaol p.a:asam asetat glasial 2% 90:10 dengan flow rate0,5 mL/menit dimana menghasilkan bentuk peak yang simetri yang menunjukkan bahwa laju analit seragam, tR kurang dari 10 menit, nilai resolusi 1,5070 lebih besar dari 1,5, dan memiliki nilai HETP yang paling kecil dimana semakin kecil HETP maka akan meningkatkan jumlah lempeng teoritik sehingga efisiensi kolom juga meningkat dan pemisahan semakin baik.
non polar akan tertambat lebih kuat pada fase diam sehingga terelusi lebih lama dalam fase diam. Berikut merupakan gugus polar dan non polar dari kurkumin:
OH
Gambar 23. Gugus polar dan gugus non polar pada kurkumin
Berikut merupakan interaksi antara kurkumin dengan fase diam C18 dan fase gerak metanol p.a:asam asetat glasial 2% sehingga kurkumin dapat terelusi bersama fase gerak:
Gambar 24. Interaksi kurkumin dengan fase gerak membentuk interaksi hidrogen
Gugus non polar
OH
Oktadesilsilan (C18) Kurkumin
Interaksi Van der Waals
Interaksi Van der Waals (Watson, 2003)
Gambar 25. Interaksi kurkumin dengan fase diam melalui interaksi Van der Waals
Berdasar gambar 24 dan gambar 25, dapat diketahui bahwa antara kurkumin dengan fase diam dan fase gerak terjadi interaksi. Gugus polar dari kurkumin akan berinteraksi dengan fase gerak, sedangkan gugus non polar kurkumin akan berinteraksi dengan fase diam. Kurkumin dengan fase gerak berinteraksi melalui interaksi hidrogen dan interaksi antara kurkumin dengan fase diam terjadi interaksi Van der Waals. Secara keseluruhan dapat diketahui bahwa interaksi kurkumin dengan fase gerak lebih kuat dibandingkan interaksi kurkumin dengan fase diam karena sifat interaksi hidrogen lebih kuat daripada interaksi Van der Waals maka analit dapat terelusi dari kolom C18.
membuktikan reliabilitasnya. Reliabilitas pada penelitian ini dilihat dari reprodusibilitas pemisahan yang dapat diketahui melalui penghitungan CV nilai resolusi dari hasil pemisahan. Nilai CV kurang dari 2% dapat dikatakan bahwa resolusi pemisahan memenuhi syarat presisi yang baik (Mulja dan Suharman, 1995). Dari hasil diperoleh nilai CV kurang dari 2% yaitu 0,5818 %.
Tabel XI. Data hasil perhitungan %CV nilai resolusi pada fase gerak metanol
p.a:asam asetat glasial 2% 90:10 Replikasi Repetisi Rata-rata
Resolusi SD CV (%)
1.1
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Kondisi yang optimum untuk pemisahan kurkumin dalam sediaan cair OHT Kiranti® dengan metode KCKT fase terbalik adalah menggunakan komposisi fase gerak metanol p.a:asam asetat glasial 2% (90:10) pada flow rate 0,5 mL/menit, dengan spesifikasi alat KCKT sebagai berikut:
Instrument : Shimadzu model LC-2010, HT Serial No. C21254706757LP, CAT No. 228-46703-38)
Kolom : Oktadesilsilan (C18) merk KNAUER C-18 (No. 25EE181KSJ (B115Y620), Dimensi 250 x 4,6 mm)
Attenuation : 4
Detektor : Visibel pada 432 nm
B. Saran
1. Perlu dilakukan validasi metode penetapan kadar kurkumin dalam sampel cair OHT Kiranti®dengan metode KCKT fase terbalik dalam kondisi optimum. 2. Perlu dilakukan penetapan kadar sampel cair OHT Kiranti® dengan metode
KCKT fase terbalik.