PENDAHULUAN
Radikal bebas dan spesies oksigen reaktif (SOR) seperti radikal hidroksil (OH•), anion superoksida (O2•), dan radikal peroksil (ROO•) di dalam tubuh dihasilkan melalui reaksi-reaksi biokimia normal dan juga berasal dari lingkungan (Kevin et al. 2007). Radikal bebas sangat berbahaya karena dapat menyerang lemak di dalam membran sel, protein dalam jaringan atau enzim, karbohidrat, dan DNA yang menginduksi oksidasi sehingga menyebabkan kerusakan membran, modifikasi protein (termasuk enzim), dan kerusakan DNA. Kerusakan oksidatif ini berperan sebagai penyebab penuaan dini dan beberapa penyakit degeneratif seperti penyakit jantung, katarak, disfungsi kognitif, dan kanker (Pietta 2000). Kerusakan oksidatif karena radikal bebas dapat dikurangi oleh antioksidan yang diproduksi oleh tubuh (antioksidan enzim seperti superoksida dismutase, glutation peroksidase, katalase) dan antioksidan yang diperoleh secara eksogenus yang dijumpai banyak dalam bahan pangan seperti vitamin C vitamin E, karotenoid, polifenol (Pietta 2000; Papas 1998).
Antosianin, yang termasuk kelompok polifenol, telah banyak diteliti dan dilaporkan menunjukkan kemampuan sebagai senyawa antioksidan (Wang et al. 1997; Ghiselli et al. 1998; Heinonen et al. 1998; Seeram & Nair 2002; Hu et al. 2003; Kähkönen & Heinonen 2003; Bao et al. 2005; Kano et al. 2005; Brown & Kelly 2007; Watanabe 2007; Kim et al. 2009). Buah duwet yang mengandung antosianin juga telah dilaporkan oleh Lestario et al. (2005a); Lestario et al. (2005b); Banerjee et al. (2005); Veigas et al. (2007) menunjukkan adanya aktivitas antioksidan. Lestario et al. (2005a); Lestario et al. (2005b) menguji aktivitas antioksidan buah duwet pada beberapa tingkat kemasakan buah duwet dan pada beberapa perlakuan ekstraksi (jenis pelarut, lama dan suhu ekstraksi). Banerjee et al. (2005) menguji aktivitas antioksidan dari bagian kulit buah duwet dengan perlakuan pengeringan selama 7 hari dan 6 bulan. Veigas et al. (2007) melakukan identifikasi komposisi antosianin buah duwet, menguji aktivitas antioksidan dari bagian kulit buah duwet, serta menguji stabilitas warna antosianin kulit buah duwet untuk tujuan farmaseutikal untuk produk antitusif yang mengandung salbutamol.
Untuk melengkapi penelitian yang telah dilakukan oleh beberapa peneliti sebelumnya maka pada bagian penelitian disertasi ini dilakukan penelitian lanjutan dengan tujuan untuk mengevaluasi kontribusi senyawa antosianin yang terkandung dalam buah duwet terhadap peranannya sebagai antioksidan dan membandingkan efektifitas aktivitas antioksidan dari antosianin yang terkandung dalam ekstrak dan isolat antosianin dengan senyawa antioksidan standar flavonoid (katekin dan kuersetin), asam askorbat serta ekstrak antosianin kubis ungu yang secara komersial telah digunakan sebagai pewarna untuk pangan. Ekstrak dan isolat antosianin buah duwet dapat digunakan sebagai pewarna untuk pangan yang memiliki aktivitas antioksidan. Selain itu juga dilakukan pengujian aktivitas antioksidan pada minuman model yang ditambahkan antosianin buah duwet sebagai pewarna. Pengujian aktivitas antioksidan dilakukan untuk memberikan tambahan informasi peranan antosianin buah duwet selain dapat digunakan sebagai pewarna pada pangan, juga dapat memberikan manfaat untuk kesehatan terutama sebagai antioksidan. Dari hasil penelitian ini diharapkan antosianin buah duwet dapat dikembangkan sebagai pewarna pangan fungsional berbasis antosianin.
BAHAN DAN METODE
Tempat Penelitian
Penelitian dilakukan di Laboratorium Kimia Pangan SEAFAST Center, IPB; Laboratorium Biokimia Pangan, Departemen ITP, FATETA, IPB; serta Laboratorium Terpadu Mikrobiologi Medik, Fakultas Kedokteran Hewan, IPB.
Bahan dan Alat Penelitian
Bahan utama yang digunakan pada penelitian ini adalah buah duwet matang berwarna ungu kehitaman yang diperoleh dari hutan di Probolinggo, Jawa Timur. Sampel buah duwet telah mendapat pengesahan determinasi jenis tanaman dari LIPI Biologi, Bogor. Bahan lain yang digunakan adalah kubis merah diperoleh dari supermarket di Bogor, Jawa Barat.
Bahan kimia yang digunakan berspesifikasi pro analisis. Metanol, asam klorida (HCl), etil asetat, kalium klorida, natrium asetat, folin ciocalteau, natrium karbonat (Na2CO3), etanol, natrium fosfat monobasis (NaH2PO4), natrium fosfat dibasis (Na2HPO4.7H2O), asam tetraasetat etilendiamin (EDTA), besi amonium
sulfat ((NH4)2Fe(SO4)2.6H2O), hidrogen peroksida (H2O2), asam trikloroasetat (TCA), natrium klorida (NaCl), natrium hidroksida (NaOH), CuSO4, dan kalium tartrat diperoleh dari Merck (Darmstadt, Jerman). Asam askorbat, katekin,
kuersetin, 2,2-difenil-1-pikrilhidrasil (DPPH), 2-deoksi-D-ribosa, asam 2-tiobarbiturat (TBA), hipoxantin, asam dietilentriaminpentaasetat, nitro blue
tetrazolium, xantin oksidase, lipoprotein densitas rendah (LDL), bufer fosfat salin (PBS), bovine serum albumin (BSA), dan 1,1,3,3-tetrametoksipropana (TMP) diperoleh dari Sigma-Aldrich (St. Louis, MO). Gas nitrogen diperoleh dari suplier bahan kimia di Bogor.
Peralatan yang digunakan adalah pisau baja tahan-karat, hand blender, pengering beku, timbangan analitik, pengaduk/stirer, batang stirer, sentrifugasi, kertas Whatman no 1, pompa vakum, vakum evaporator putar, pH-meter, pipet mikrometer, vortek, spektrofotometer UV-Vis, SPE (solid-phase extraction), C18 Sep-Pak cartridge, kantong dialisis 3500 MWCO, penangas air, lemari pendingin, dan alat-alat kaca.
Metode Penelitian
Persiapan sampel
Buah duwet matang (warna ungu kehitaman) disortasi, dicuci dengan air bersih, lalu ditiriskan. Buah duwet dipisahkan dari bijinya dengan menggunakan pisau baja tahan-karat sehingga diperolah bagian pulp (buah duwet utuh tanpa biji). Sebagian buah duwet lainnya diambil kulitnya saja dengan cara dikupas menggunakan pisau baja tahan-karat sehingga diperoleh bagian kulit buah. Kedua sampel yaitu bagian pulp dan kulit buah secara terpisah diblansir selama 3 menit dengan menggunakan uap panas (80oC), kemudian dihancurkan dengan menggunakan hand blender dan dikeringkan dengan menggunakan pengering beku. Masing-masing sampel kering beku dikemas dalam kantong plastik polietilen (PE) dan disimpan pada suhu -20oC untuk digunakan pada tahapan penelitian selanjutnya.
Ekstraksi senyawa polifenol
Senyawa polifenol termasuk antosianin dalam buah duwet diekstraksi secara maserasi dengan diaduk (stirer) menggunakan pelarut 0,1% HCl-metanol (v/v) dengan nisbah sampel dan pelarut 1:25 (b/v). Ekstraksi dari masing-masing
sampel dilakukan selama 30 menit pada suhu ruang, kemudian disentrifus dengan kecepatan 3552 g untuk memisahkan filtrat dan residu. Ekstraksi diulang kembali dengan menggunakan pelarut yang sama sebanyak 3 kali. Filtrat hasil keseluruhan ekstraksi digabung dan disaring secara vakum, kemudian pelarut dievaporasi dengan rotavapor pada suhu 40oC sehingga diperoleh ekstrak pekat. Ekstrak dikeringkan dengan pengering beku lalu ditimbang untuk mengetahui berat serta diukur kadar air. Untuk penentuan kontribusi senyawa antosianin terhadap aktivitas antioksidan, ekstrak yang diperoleh (setelah evaporasi) selanjutnya ditera dengan labu takar menjadi volume 25 ml untuk pemakaian sampel kering sebanyak 2 g.
Ekstrak dianalisis kandungan total polifenol (metode folin-ciocalteau; Slinkard & Singleton 1977), total antosianin monomerik (metode perbedaan pH; Giusti & Wrolstad 2001), serta aktivitas antioksidan. Total polifenol dinyatakan sebagai ekuivalen asam galat dan antosianin sebagai ekuivalen sianidin-3-glukosida.
Fraksinasi senyawa polifenol
Fraksinasi senyawa polifenol dalam ekstrak dilakukan dengan menggunakan solid-phase extraction (SPE), C-18 Sep-Pak cartridge, yang telah diaktivasi. Ekstrak dilewatkan pada mini kolom C-18 Sep-Pak Cartridge, lalu dicuci dengan 0,01% HCl-akuades (v/v). Selanjutnya mini kolom C-18 Sep-Pak Cartridge dielusi menggunakan pelarut etil asetat untuk mengelusi senyawa polifenol non-antosianin (fraksi polifenol non-antosianin). Fraksi polifenol antosianin yang masih terserap dalam mini kolom dielusi dengan 0,01% HCl-metanol (v/v). Kedua fraksi yang diperoleh yaitu fraksi polifenol non-antosianin dan fraksi polifenol antosianin dihilangkan pelarut organiknya dengan menggunakan rotavapor pada suhu 40oC (Kim & Lee 2002). Fraksi-fraksi polifenol yang diperoleh lalu dianalisis kandungan total polifenol secara spektrofotometri (metode Follin-Ciocalteau, Slinkard & Singleton 1977) dan total antosianin monomerik (metode pH-diferensial; Giusti & Wrolstad 2001), serta aktivitas antioksidan.
Pengukuran kandungan total antosianin monomerik
Kandungan total antosianin monomerik diukur berdasarkan metode perbedaan pH (Giusti & Wrolstad 2001). Sampel dalam jumlah tertentu
dimasukkan ke dalam 2 buah tabung reaksi. Tabung reaksi pertama ditambah larutan bufer kalium klorida (0,025 M) pH 1 hingga volume menjadi 5 mL. Tabung reaksi kedua ditambahkan larutan bufer natrium asetat (0,4 M) pH 4,5 hingga volume menjadi 5 mL. Absorbans dari kedua perlakuan pH diukur dengan spektrofotometer pada panjang gelombang 520 nm dan 700 nm setelah didiamkan selama 15 menit. Nilai absorbans dihitung dengan rumus: A = [(A520 - A700)pH 1 - (A520 - A700)pH 4,5]. Kandungan antosianin dihitung sebagai sianidin-3-glikosida menggunakan koefisien ekstingsi molar sebesar 29 600 dan bobot molekul sebesar 448,8. Kandungan antosianin (mg/L) = (A x BM x FP x 1000) / (ε
x 1), A adalah absorbans, BM adalah berat molekul, FP adalah faktor pengencer, dan ε adalah koefisien ekstingsi molar. Kandungan total antosianin monomerik dinyatakan sebagai mg CyE/g sampel.
Pengukuran kandungan total polifenol
Sampel dianalisis kandungan total polifenol secara spektrofotometri dengan metode follin-ciocalteau (Slinkard & Singleton 1977). Sampel dengan konsentrasi tertentu dimasukkan dalam tabung reaksi, kemudian ditambahkan akuades hingga volume menjadi 5 mL. Selanjutnya sebanyak 0,5 mL follin ciocalteu ditambahkan ke dalam tabung reaksi, lalu divortek dan didiamkan selama 5 menit. Kemudian ditambahkan Na2C03 (7%) sebanyak 1 mL, divortek, dan didiamkan selama 60 menit ditempat gelap. Nilai absorbans diukur dengan spektrofotometer pada panjang gelombang 765 nm. Kandungan total polifenol dalam sampel dihitung dengan menggunakan kurva standar yang dibuat dari asam galat (GA) pada beberapa konsentrasi. Total polifenol dinyatakan sebagai mg GAE/g sampel.
Pengujian aktivitas scavenging radikal (secara in vitro)
Aktivitas scavenging diuji terhadap radikal 1,1-difenil-2-pikrilhidrazil (DPPH), anion superoksida (O2•), dan hidroksil (OH•). Radikal anion superoksida (O2•) dan hidroksil (OH•) dihasilkan dari reaksi hipoxantin (HPX)-xantin oksidase (XOD) dan hidrogen peroksida-ferrous sulfat (reaksi Fenton).
Aktivitas scavenging terhadap radikal DPPH
Aktivitas antioksidan dianalisa berdasarkan kemampuan menangkap radikal bebas (radical scavenging ability/RSA) DPPH menurut metode yang
dikembangkan oleh Chen et al. (2006) dengan modifikasi. Sebanyak 3 mL DPPH (100 μM) dimasukkan kedalam tabung reaksi, setelah itu ditambah etanol dan sampel/senyawa standar (seri konsentrasi) dimana total keseluruhan volume etanol dan sampel adalah 1 mL. Campuran reaksi dalam tabung reaksi divortek dan didiamkan selama 15 menit. Absorbans diukur pada panjang gelombang 517 nm. Absorbans dari larutan radikal DPPH tanpa sampel diukur sebagai kontrol. Aktivitas scavenging terhadap radikal DPPH dinyatakan sebagai % penghambatan terhadap radikal DPPH, AEAC (ascorbic acid equivalent antioxidant capacity), dan IC50-DPPH (μg/mL). Persen penghambatan dihitung sesuai rumus : [(Ao–As)/Ao] x 100, Ao = absorbans tanpa penambahan sampel/standar, As = absorbans dengan penambahan sampel/standar.
Aktivitas scavenging terhadap radikal hidroksil (OH•)
Aktivitas scavenging radikal hidroksil (OH•) diuji menggunakan metode deoksiribosa (Halliwel et al. 1987). Larutan sampel/senyawa standar dalam beberapa seri konsentrasi dimasukkan kedalam tabung reaksi, ditambahkan 690
μL deoxyribose 2,5 mM (dalam 10 mM bufer fosfat pH 7,4), 100 μL campuran EDTA (1,04 mM)-iron amonium sulfat (1,0 mM). Kemudian campuran larutan tersebut divortek. Reaksi dimulai dengan menambabkan 100 μL asam askorbat (1 mM) dan 10 μL H202 (0,1 M), lalu divortek kembali. Campuran diinkubasi pada penangas air suhu 37oC selama 10 menit, kemudian ditambahkan 1 mL TCA (2,8%) dan 0,5 mL TBA (1%). Campuran reaksi dipanaskan pada penangas air berisi air mendidih (99oC) selama 8 menit lalu didinginkan. Selanjutnya campuran diukur dengan spektrofotometer pada panjang gelombang 532 nm. Untuk kontrol dibuat dengan cara yang sama tanpa penambahan sampel. Faktor koreksi dibuat dengan cara yang sama tanpa penambahan TBA untuk semua seri konsentrasi sampel yang diujikan. Aktivitas scavenging radikal hidroksil (OH•) dinyatakan sebagai % penghambatan terhadap radikal hidroksil dan IC50 (μg/mL). Persen penghambatan dihitung sesuai rumus : [(Ao–As)/Ao] x 100, Ao = absorbans tanpa penambahan sampel/standar, As = absorbans dengan penambahan sampel/ standar (Abs 532+TBA–Abs 532-TBA).
Aktivitas scavenging terhadap radikal superoksida (O2•)
Pengujian aktivitas scavenging radikal anion superoksida (O2•) dilakukan dengan metode yang dikembangkan oleh Wettasinghe dan Shahidi (1999),
radikal superoksida dihasilkan dari reaksi enzimatis. Sampel/senyawa standar dalam beberapa seri konsentrasi yang disiapkan dalam bufer fosfat (0,1 M pH 7,4); 0,3 mL hipoxanthine (3 mM); 0,3 mL diethylenetriaminepentaacetic acid (12 mM); 0,3 mL nitro blue tetrazolium (178 μM); 0,3 mL xanthine oxidase (mengandung 150 mIU) direaksikan dalam tabung reaksi selama 15 menit. Selanjutnya reaksi campuran diukur dengan spektrofotometer pada panjang gelombang 560 nm. Aktivitas scavenging radikal anion superoksida (O2•) dinyatakan sebagai % penghambatan terhadap anion superoksida (O2•) dan IC50 (μg/mL). Persen penghambatan dihitung sesuai rumus: [(Ao–As)/Ao] x 100, dimana Ao = absorbans tanpa penambahan sampel/standar, As = absorbans dengan penambahan sampel/standar.
Pengujian aktivitas penghambatan oksidasi lipoprotein LDL Persiapan LDL manusia
LDL yang digunakan adalah LDL komersial (Sigma) yang diisolasi dari darah manusia. LDL dalam bentuk liofil dilarutkan menggunakan larutan 0,01 M
phosphate-buffered saline (PBS) pH 7,4 mengandung 0,15 M NaCl (Kähkönen & Heinonen 2003), kemudian didialisis menggunakan kantong dialisis 3500 MWCO dalam larutan 0,01 M PBS-0,15 M NaCl; pH 7,4 pada suhu 5oC selama 48 jam (Ghiselli et al. 1998). Larutan LDL dianalisa kadar protein dengan metode Lowry (Lowry et al. 1951) dan diencerkan dengan PBS (0,01 M; pH 7,4) sehingga diperoleh larutan LDL yang mengandung 200 μg protein/mL. Larutan LDL disimpan dalam vial dan diembus gas nitrogen (N2) untuk mencegah oksidasi.
Pengukuran kandungan protein LDL
Kandungan protein LDL dianalisa menggunakan metode Lowry (Lowry et al. 1951). Pereaksi-pereaksi yang digunakan untuk analisis meliputi (1) pereaksi A: 2% Na2CO3 dalam 0,1% NaOH, pereaksi ini disimpan dalam lemari pendingin; (2) pereaksi B: 0,5% CuSO4.5H2O dalam 1% kalium tartrat, campuran ini dibuat segar setiap kali melakukan analisis; (3) pereaksi C: 200 mL pereaksi A di tambah 4 mL pereaksi B; (4) pereaksi Folin Ciocalteau: pereaksi folin ditambah air bebas ion dengan perbandingan 1:1; (5) larutan 0,9% NaCl, 0,01% EDTA pH 7,4; (6) larutan standar bovine serum albumin (BSA) 1 mg/mL, dibuat dalam beberapa seri konsentrasi menggunakan larutan NaCl 0,9%, EDTA 0,01% pH 7,4; (7) larutan LDL (larutan LDL diencerkan sampai volume 0,5 mL
menggunakan larutan NaCl 0,9% EDTA, 0,01% pH 7,4); (8) larutan blanko (0,5 mL larutan NaCl 0,9%, EDTA 0,01% pH 7,4).
Sebanyak 0,5 mL sampel LDL atau standar BSA (seri konsentrasi) dipipet ke dalam tabung reaksi. Setiap tabung ditambah dengan 2 mL pereaksi C kemudian divortek dan didiamkan selama 10 menit. Masing-masing tabung ditambah 0,2 mL pereaksi Folin Ciocalteau, divortek dan didiamkan selama 1 jam. Selanjutnya dibaca nilai absorbansnya pada panjang gelombang 700 nm. Hasil pembacaan absorbans standar BSA kemudian diplotkan dalam kurva standar antara nilai absorbans dengan konsentrasi protein BSA. Persamaan kurva standar digunakan untuk menentukan kandungan protein yang terdapat pada sampel LDL. Berdasarkan kadar protein LDL yang diperoleh kemudian dilakukan pengenceran terhadap sampel LDL sehingga kandungan protein
menjadi sebesar 200 μg protein/mL.
Oksidasi LDL
Oksidasi LDL dilakukan sesuai metode gabungan yang dilakukan oleh Ghiselli et al. (1998); Hu et al. (2003). LDL yang telah didialisis (375 μL,
mengandung 75 μg protein) dioksidasi menggunakan 5 μM CuSO4 pada suhu 37oC (dalam penangas air) selama 4 jam. Oksidasi LDL dilakukan dalam PBS dengan perlakuan penambahan sampel (LDL + CuSO4 + sampel), kontrol oksidasi (LDL + CuSO4), dan penambahan EDTA (LDL + CuSO4 + EDTA 500 μM). Penambahan sampel dilakukan sebelum reaksi oksidasi dimulai (0 menit) dan dilakukan inkubasi selama 15 menit. Reaksi oksidasi dihentikan dengan penambahan 100 μM EDTA. Oksidasi modifikasi LDL dievaluasi setelah 4 jam inkubasi dengan mengukur kandungan malonaldehid dengan metode yang dilakukan Buege dan Aust (1978) menggunakan standar TMP (1,1,3,3-tetrametoksipropana).
Pengukuran kandungan malonaldehid
Pengukuran kandungan malonaldehid (MDA) dilakukan mengikuti prosedur Buege dan Aust (1978) dengan modifikasi. Pereaksi yang digunakan adalah pereaksi TBA (asam tiobarbiturat) yang dibuat dengan melarutkan TCA (15 g) menggunakan aquades lalu ditambahkan TBA (0,375 g) dan 1 N HCl (25 mL). Volume campuran ditera sampai 100 mL dengan aquades.
Sampel maupun standar TMP yang dibuat dalam beberapa seri konsentrasi dimasukkan dalam tabung reaksi (total volume 0,5 mL) lalu ditambahkan 1 mL pereaksi TBA. Campuran dalam tabung reaksi dipanaskan dalam penangas air bersuhu 99oC selama 15 menit. Setelah didinginkan, ditambahkan 0,5 mL etanol lalu divortek dan diukur absorbansnya pada panjang gelombang 535 nm. Konsentrasi malonaldehid dihitung dari kurva standar hubungan antara konsentrasi standar TMP yang dibuat dari beberapa seri konsentrasi dan nilai pembacaan absorbans.
Minuman model
Minuman model dibuat dari bufer sitrat (0,1 M; asam sitrat-natrium sitrat) pada pH 3 yang mengandung ekstrak antosianin buah duwet. Penambahan pigmen dilakukan sehingga diperoleh pembacaan nilai absorbans pada kisaran nilai ~0,6 (λvis-maks, 516 nm). Campuran didiamkan selama 60 menit pada suhu ruang untuk mencapai kesetimbangan dan disebut sebagai minuman model tanpa kopigmentasi (native). Selain itu, minuman model yang mengandung antosianin buah duwet juga ditambahkan kopigmen asam sinamat (asam sinapat, asam kafeat, asam ferulat) dan ekstrak polifenol rosemary, masing-masing dengan konsentrasi 1 mg/mL. Larutan campuran diaduk dan diinkubasi selama 60 menit pada suhu ruang agar terjadi reaksi dan disebut sebagai minuman terkopigmentasi intermolekular. Minuman model (tanpa kopigmentasi dan terkopigmentasi intermolekular) dianalisis kandungan total polifenol (metode folin-ciocalteau; Slinkard & Singleton 1977), total antosianin monomerik (metode perbedaan pH; Giusti & Wrolstad 2001), serta aktivitas antioksidan berdasarkan kemampuan scavenging radikal DPPH (Chen et al. 2006). Total polifenol dinyatakan sebagai ekuivalen asam galat dan antosianin sebagai ekuivalen sianidin-3-glukosida. Aktivitas antioksidan dinyatakan sebagai nilai kapasitas antioksidan AEAC, ascorbic acid equivalent antioxidant capacity, (μg AA/mL).
Analisa data secara statistik
Data hasil pengujian dianalisis secara statistika dengan menghitung nilai rata-rata dan standar deviasi menggunakan aplikasi Microsoft Office EXCEL 2007 serta analisis sidik ragam (uji ANOVA) satu arah kemudian dihitung nilai bedanya dengan uji beda Duncan Multiple Range Test pada taraf 5% (p < 0,05) menggunakan aplikasi SPSS 17.0.
HASIL DAN PEMBAHASAN
Kontribusi Antosianin Buah Duwet sebagai Antioksidan
Ekstraksi senyawa polifenol dalam buah duwet (termasuk antosianin) dilakukan secara maserasi menggunakan pelarut metanol mengandung 0,1% HCl. Untuk fraksinasi senyawa polifenol dilakukan dengan metode solid-phase extraction (SPE) menggunakan C18 Sep-Pak cartridge. Proses fraksinasi dilakukan untuk tujuan mengetahui kontribusi antosianin buah duwet sebagai senyawa antioksidan. Hasil fraksinasi senyawa polifenol diperoleh 2 fraksi yaitu fraksi polifenol antosianin dan fraksi polifenol non-antosianin (Gambar 6.1). Fraksi polifenol non-antosianin berwarna kuning, yang mengandung senyawa polifenol selain grup antosianin, sedangkan fraksi antosianin berwarna merah yang mengandung hanya senyawa polifenol antosianin.
Gambar 6.1 Ekstrak polifenol (A), fraksi polifenol antosianin (B), dan fraksi polifenol non-antosianin (C) dari buah duwet.
Hasil identifikasi senyawa yang terkandung dalam fraksi antosianin diperoleh bahwa komposisi antosianin dalam fraksi antosianin buah duwet terdiri dari delfinidin-3,5-diglukosida (41%), petunidin-3,5-diglukosida (28%), malvidin-3,5-diglukosida (26%), sianidin-3,5-diglukosida (4%), dan peonidin-3,5-diglukosida (1%), sesuai hasil penelitian sebelumnya (Sari et al. 2009). Senyawa polifenol yang terkandung dalam fraksi polifenol non-antosianin tidak diidentifikasi jenis-jenis polifenolnya. Dalam fraksi polifenol non-antosianin dapat mengandung senyawa polifenol netral dari grup flavonoid (seperti flavanols, flavonols, flavons, isoflavones, flavanones, dan turunannya) dan senyawa polifenol asam seperti asam hidroksibensoat, hidroksifenilasetat, dan hidroksisinamat. Data sekunder yang diperoleh dari Faria et al. (in press) menyebutkan bahwa buah duwet mengandung asam fenolik (galoil-glukosa ester, asam galat), flavanonol (dihidromirisetin diglukosida, dihidrokuersetin
diglukosida, metil-dihidromirisetin diglukosida, dimetil-dihidromirisetin diglukosida), dan flavonol (mirisetin glukosida, mirisetin pentosida, mirisetin ramnosida, mirisetin asetil-ramnosida, mirisetin).
Kandungan polifenol dan antosianin dalam ekstrak dan fraksi dilaporkan sebagai data spektrofotometrik yang dinyatakan sebagai ekuivalen asam galat untuk kandungan polifenol dan ekuivalen sianidin-3-glukosida untuk kandungan antosianin (Tabel 6.1). Kandungan polifenol dalam ekstrak polifenol sebesar 25,92 mg GAE/g, sedangkan pada fraksi antosianin dan fraksi non-antosianin masing-masing sebsar 21,57 mg GAE/g dan 2,15 mg GAE/g. Polifenol jenis antosianin mendominasi kandungan polifenol di dalam buah duwet sebesar 83,25% sedangkan senyawa polifenol lain selain antosianin hanya mengandung 8,30% dalam buah duwet. Kontribusi utama senyawa polifenol dalam buah duwet berasal dari antosianin, yang termasuk dalam kelompok flavonoid, sebesar ~83% (b/b). Kandungan polifenol dalam ekstrak menunjukkan nilai yang lebih tinggi dibandingkan gabungan kandungan polifenol dalam fraksi antosianin dan non-antosianin, kemungkinan karena dalam ekstrak mengandung gula yang tinggi dan juga asam askorbat dengan level yang rendah. Buah-buahan diketahui mengandung gula cukup tinggi. Menurut Waterhouse (2002), kandungan gula, asam askorbat, dan protein dalam bahan dengan level yang tinggi dapat mempengaruhi pengukuran polifenol menggunakan metode folin ciocalteau.
Tabel 6.1 Kandungan total polifenol dan antosianin dalam ekstrak dan fraksi
Kandungan polifenol Kandungan antosianin
Sampel
mg GAE/g % Berat mg CyE/g % Berat
Ekstrak polifenol 25,92 ± 0,20c 100,00 15,13 ± 0,09b 100,00
Fraksi polifenol :
- Antosianin 21,57 ± 0,05b 83,25 14,44 ± 0,20a 95,43
- Non-antosianin 2,15 ± 0,07a 8,30 - -
Angka yang diikuti oleh huruf yang berbeda pada kolom yang sama menunjukkan hasil uji berbeda nyata (p<0,05). Kandungan polifenol dinyatakan sebagai miligram ekuivalen asam galat per gram sampel (berat kering). Kandungan antosianin dinyatakan sebagai miligram ekuivalen sianidin-3-glukosida per gram sampel (berat kering). % berat didasarkan pada kandungan senyawa dalam ekstrak.
Data spektrofotometrik lainnya menunjukkan kandungan antosianin dalam ekstrak lebih tinggi (15,13 mg CyE/g) dibandingkan dalam fraksi antosianin (14,44 mg CyE/g) dengan kontribusi sebesar 95.43%. Adanya perbedaan kandungan antosianin dalam ekstrak dan fraksi antosianin, karena pada proses fraksinasi ada sebagian kecil antosianin yang terikat didalam gum yang
terkandung dalam ekstrak buah duwet yang tidak terikut dalam proses pemisahan (fraksinasi).
Gambar 6.2 menunjukkan aktivitas scavenging terhadap radikal DPPH dari ekstrak, fraksi polifenol antosianin dan fraksi polifenol non-antosianin buah duwet. Aktivitas scavenging radikal DPPH, dinyatakan sebagai nilai kapasitas antioksidan/AEAC (AEAC=ascorbic acid equivalent antioxidant capacity), dari ekstrak polifenol, fraksi polifenol antosianin dan fraksi polifenol non-antosianin berturut-turut sebesar 25,21; 28,52; dan 2,62 mg AA/g, AA=asam askorbat. Fraksi polifenol antosianin menunjukkan aktivitas scavenging lebih tinggi dibandingkan dengan ekstrak polifenol dan fraksi polifenol non-antosianin. Fraksi polifenol non-antosianin menunjukkan aktivitas yang paling rendah karena kandungan senyawa polifenol dalam fraksi non-antosianin hanya 8,30%. Aktivitas antioksidan buah duwet utamanya dikontribusi oleh senyawa antosianin. Kontribusi aktivitas antioksidan dari polifenol non-antosianin relatif sangat kecil.
25,21b 28,52c 2,62a 0 5 10 15 20 25 30 35 Ekstrak Fraksi polifenol antosianin Fraksi polifenol
non-antosianin
Kapasitas Antioksidan AEAC (mg AA/g)
Gambar 6.2 Aktivitas scavenging radikal DPPH dari ekstrak polifenol, fraksi polifenol antosianin dan fraksi polifenol non-antosianin buah duwet. AEAC, ascorbic acid equivalent antioxidant capacity; AA, asam askorbat. Angka yang diikuti oleh huruf yang berbeda
menunjukkan hasil uji berbeda nyata (p<0,05).
Aktivitas Antioksidan Ekstrak dan Isolat Antosianin Buah Duwet
Pada penelitian ini, aktivitas antioksidan dianalisa menggunakan beberapa metode pengujian yang berbeda seperti pengujian kemampuan
scavenging terhadap radikal DPPH, radikal hidroksil (OH•), radikal superoksida (O2•), dan pengujian kemampuan menghambat peroksidasi lipid menggunakan
lipoprotein LDL. Semua pengujian dilakukan secara in vitro. Sampel dari buah duwet yang diujikan meliputi ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), dan isolat antosianin duwet (IAD). Ekstrak pulp duwet (EPD) diperoleh dengan mengekstrak senyawa polifenol (termasuk antosianin) dalam buah utuh yang telah dibuang bijinya (hanya bagian daging dan kulit), sedangkan ekstrak kulit duwet (EKD) diperoleh dengan mengekstrak senyawa polifenol yang terkandung dalam bagian kulit buah. Isolat antosianin duwet (IAD) diperoleh dengan mengisolasi antosianin yang terkandung dalam buah duwet menggunakan metode solid-phase extraction (SPE) sehingga dalam isolat hanya mengandung 5 jenis antosianin. Ekstrak dan isolat antosianin duwet mengandung senyawa polifenol utama yaitu antosianin, sehingga bisa dikatakan senyawa antosianin memberikan kontribusi utama terhadap aktivitas antioksidan. Ekstrak dan isolat antosianin buah duwet dapat digunakan sebagai pewarna yang dapat memberikan warna pada pangan dan sekaligus dapat memberikan manfaat kesehatan sebagai antioksidan.
Kandungan Total Polifenol
Kandungan polifenol dalam ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), dan ekstrak kubis merah (EKM) disajikan pada Tabel 6.2. Ekstrak pulp duwet mengandung polifenol paling rendah, sedangkan isolat antosianin duwet mengandung polifenol yang paling tinggi sebesar 379,69 mg GAE/g. Kandungan polifenol ini berpengaruh terhadap aktivitas antioksidan sesuai yang dinyatakan oleh Pietta (2000), senyawa polifenol berperanan sebagai senyawa antioksidan termasuk didalamnya senyawa flavonoid. Senyawa polifenol dalam ekstrak duwet yang berperanan utama sebagai antioksidan adalah antosianin yang dapat memberikan kontribusi sebesar 83%, sesuai hasil dari penelitian sebelumnya.
Tabel 6.2 Kandungan polifenol dalam ekstrak dan isolat antosianin buah duwet, serta kubis merah
Sampel Kandungan polifenol (mg GAE/g)
Ekstrak pulp duwet 15,86 ± 0,10a Ekstrak kulit duwet 33,57 ± 1,42b
Isolat antosianin duwet 379,69 ± 12,32c
Ekstrak kubis merah 27,70 ± 0,48b
Angka yang diikuti oleh huruf yang berbeda menunjukkan hasil uji berbeda nyata (p<0,05). Kandungan polifenol dinyatakan sebagai miligram ekuivalen asam galat per gram ekstrak/isolat (berat kering).
Aktivitas Scavenging terhadap Radikal DPPH
Pada pengujian ini, aktivitas antioksidan dari sampel diukur berdasarkan kemampuannya mendonorkan atom hidrogen atau kemampuannya scavenging
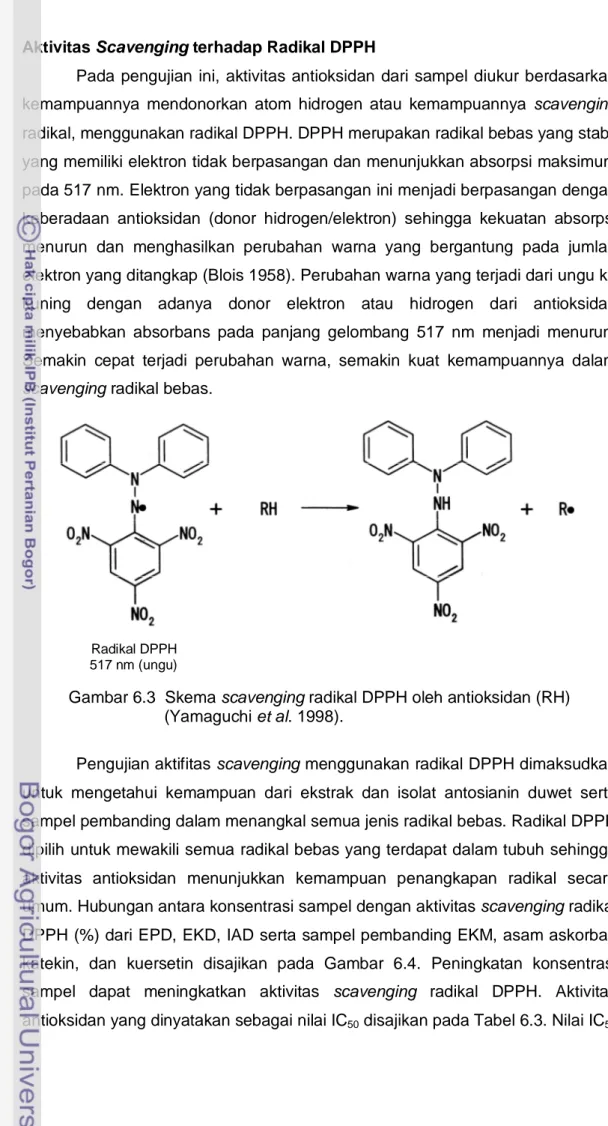
radikal, menggunakan radikal DPPH. DPPH merupakan radikal bebas yang stabil yang memiliki elektron tidak berpasangan dan menunjukkan absorpsi maksimum pada 517 nm. Elektron yang tidak berpasangan ini menjadi berpasangan dengan keberadaan antioksidan (donor hidrogen/elektron) sehingga kekuatan absorpsi menurun dan menghasilkan perubahan warna yang bergantung pada jumlah elektron yang ditangkap (Blois 1958). Perubahan warna yang terjadi dari ungu ke kuning dengan adanya donor elektron atau hidrogen dari antioksidan menyebabkan absorbans pada panjang gelombang 517 nm menjadi menurun. Semakin cepat terjadi perubahan warna, semakin kuat kemampuannya dalam
scavenging radikal bebas.
Radikal DPPH 517 nm (ungu)
Gambar 6.3 Skema scavenging radikal DPPH oleh antioksidan (RH) (Yamaguchi et al. 1998).
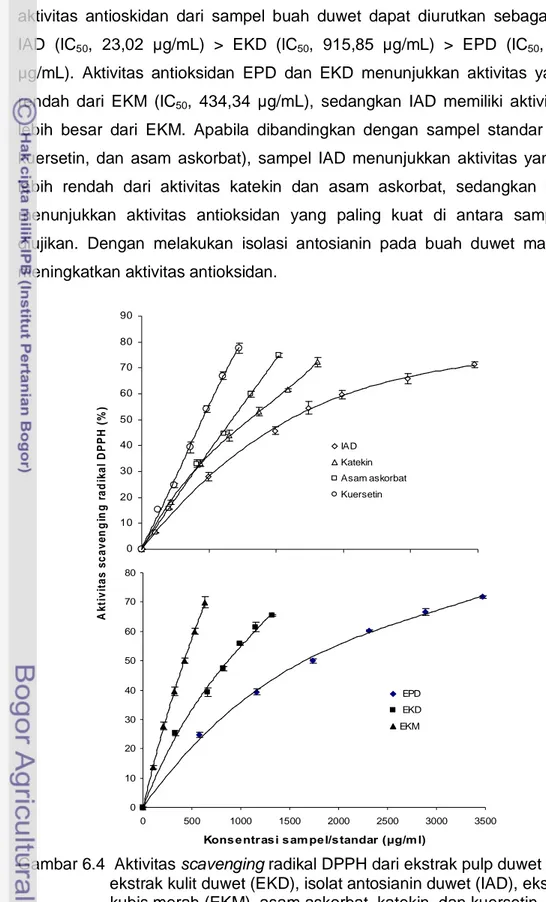
Pengujian aktifitas scavenging menggunakan radikal DPPH dimaksudkan untuk mengetahui kemampuan dari ekstrak dan isolat antosianin duwet serta sampel pembanding dalam menangkal semua jenis radikal bebas. Radikal DPPH dipilih untuk mewakili semua radikal bebas yang terdapat dalam tubuh sehingga aktivitas antioksidan menunjukkan kemampuan penangkapan radikal secara umum. Hubungan antara konsentrasi sampel dengan aktivitas scavenging radikal DPPH (%) dari EPD, EKD, IAD serta sampel pembanding EKM, asam askorbat, katekin, dan kuersetin disajikan pada Gambar 6.4. Peningkatan konsentrasi sampel dapat meningkatkan aktivitas scavenging radikal DPPH. Aktivitas antioksidan yang dinyatakan sebagai nilai IC50 disajikan pada Tabel 6.3. Nilai IC50
menunjukkan konsentrasi sampel yang dibutuhkan untuk scavenger atau menangkap 50% radikal bebas. Nilai IC50 yang lebih rendah menunjukkan aktivitas antioksidan yang lebih besar. Berdasarkan nilai IC50 secara berurutan aktivitas antioskidan dari sampel buah duwet dapat diurutkan sebagai berikut: IAD (IC50, 23,02 μg/mL) > EKD (IC50, 915,85 μg/mL) > EPD (IC50, 1756,88 μg/mL). Aktivitas antioksidan EPD dan EKD menunjukkan aktivitas yang lebih rendah dari EKM (IC50, 434,34 μg/mL), sedangkan IAD memiliki aktivitas yang lebih besar dari EKM. Apabila dibandingkan dengan sampel standar (katekin, kuersetin, dan asam askorbat), sampel IAD menunjukkan aktivitas yang sedikit lebih rendah dari aktivitas katekin dan asam askorbat, sedangkan kuersetin menunjukkan aktivitas antioksidan yang paling kuat di antara sampel yang diujikan. Dengan melakukan isolasi antosianin pada buah duwet maka dapat meningkatkan aktivitas antioksidan.
Gambar 6.4 Aktivitas scavenging radikal DPPH dari ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), asam askorbat, katekin, dan kuersetin.
0 10 20 30 40 50 60 70 80 90 0 10 20 30 40 50 IAD Katekin Asam askorbat Kuersetin 0 10 20 30 40 50 60 70 80 0 500 1000 1500 2000 2500 3000 3500
Konsentrasi sam pel/standar (μg/m l)
EPD EKD EKM A k ti v it a s s c a v e n g in g r a d ik a l D P P H ( % )
Tabel 6.3 Nilai IC50 dari ekstrak duwet, isolat antosianin, dan senyawa pembanding
Nilai IC50 (μg/mL)
Sampel Scavenging Scavenging radikal Scavenging
radikal DPPH anion superoksida radikal hidroksil
Ekstrak plup duwet 1756,88 ± 11,73e 35,06 ± 0,88e 446,48 ± 16,12e
Ekstrak kulit duwet 915,85 ± 8,52d 22,16 ± 0,49d 357,19 ± 10,48d Isolat antosianin duwet 23,02 ± 0,88b 1,85 ± 0,04a 257,27 ± 4,32b Ekstrak kubis merah 434,34 ± 11,34c 20,67 ± 0,23c 332,65 ± 14,14c Katekin 16,69 ± 0,20ab 1,27 ± 0,04a 167,52 ± 2,63a Kuersetin 9,30 ± 0,25a - - Asam askorbat 13,48 ± 0,06ab 6,59 ± 0,08b -
Angka yang diikuti oleh huruf yang berbeda pada kolom yang sama menunjukkan hasil uji berbeda nyata (p<0,05). IC50, konsentrasi sampel yang diperlukan untuk scavenger atau menangkap 50%
radikal bebas.
Aktivitas IAD lebih kecil dari sampel standar (katekin, kuersetin, dan asam askorbat) karena struktur antosianin yang tersubstitusi gula dapat menyebabkan penurunan aktivitas. Katekin dan kuersetin merupakan senyawa polifenol (flavonoid) bentuk aglikon sehingga memiliki aktivitas yang lebih besar dibandingkan antosianin. Menurut Bravo (1998), efisiensi antioksidan flavonoid berkorelasi dengan menurunnya keberadaan gugus gula (glikosida bukan antioksidan sedangkan aglikon adalah antioksidan). Lebih lanjut Seeram dan Nair (2002) menyatakan bahwa jumlah gugus gula berperanan dalam aktivitas antioksidan, aktivitas menurun dengan meningkatnya jumlah gugus gula. Hasil penelitian yang dilakukan juga menunjukkan bahwa antosianin mempunyai aktivitas antioksidan yang lebih rendah dibandingkan dengan antosianidin (aglikon), epikatekin, dan katekin. Senyawa kuersetin merupakan senyawa antioksidan yang paling kuat karena struktur kimianya, kuersetin (flavonol) memiliki ketiga struktur dasar utama yang terlibat dalam aktivitas antiradikal/scavenging radikal (Gambar 2.10).
Aktivitas Scavenging terhadap Spesies Oksigen Reaktif (SOR)
Spesies oksigen reaktif seperti anion superoksida (O2•) dan hidroksil radikal (OH•) berperanan penting dalam kesehatan manusia dan penyakit. Reaktifitas dari senyawa flavonoid terhadap radikal superoksida dan hidroksil telah dipelajari secara intensif. Pada penelitian ini, ekstrak dan isolat antosianin duwet diuji kemampuannya dalam scavenger radikal hidroksil dan anion superoksida.
Aktivitas Scavenging terhadap Radikal Hidroksil
Diantara spesies oksigen reaktif, radikal hidroksil adalah yang paling reaktif dan menyebabkan kerusakan berat pada biomolekul. Radikal hidroksil lebih reaktif dari radikal anion superoksida, oleh karena itu lebih berbahaya (Gutteridge 1984; Shi et al. 2001). Pada penelitian ini, aktivitas scavenging
radikal hidroksil diuji menggunakan metode deoksiribosa. Pada metode ini, radikal hidroksil dihasilkan melalui reaksi antara kompleks besi-EDTA dengan H2O2 dengan keberadaan asam askorbat (reaksi fenton). Radikal hidroksil menyerang deoksiribosa membentuk produk (fragmen-fragmen), kemudian campuran reaksi dipanaskan pada kondisi asam. Ketika malonaldehid (MDA) dibentuk dapat dideteksi melalui kemampuannya bereaksi dengan TBA (asam tiobarbiturat) yang dapat membentuk kromagen berwarna merah. Reaksi yang terjadi dapat dijelaskan sebagai berikut:
Fe2+-EDTA + H2O2 OH- + OH• + Fe3+-EDTA OH• + deoksiribosa fragmen MDA 2TBA + MDA kromogem (Halliwell et al. 1987).
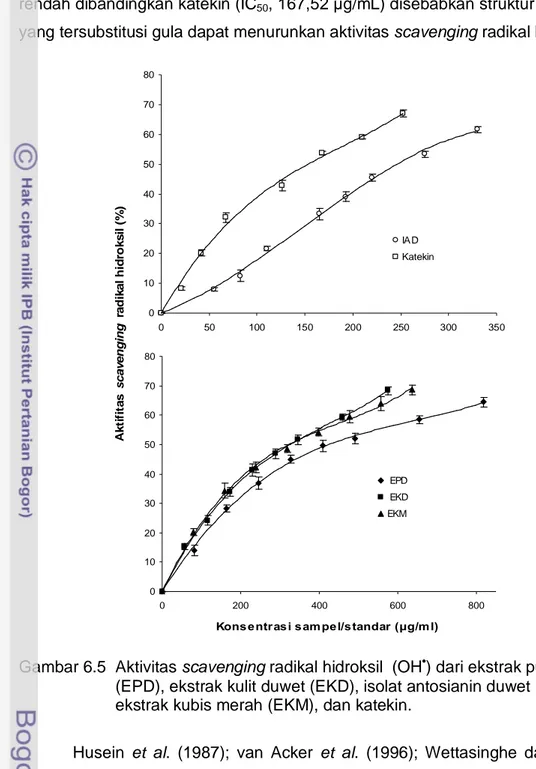
Dalam sistem pengujian menggunakan metode deoksiribosa, antioksidan berkompetisi dengan deoksiribosa untuk bereaksi dengan radikal hidroksil dan mengurangi pembentukan kromogen. Hubungan antara konsentrasi sampel dengan aktivitas scavenging radikal hidroksil (%) dari ekstrak, isolat antosianin duwet, dan sampel pembanding disajikan pada Gambar 6.5. Peningkatan konsentrasi sampel dapat meningkatkan aktivitas scavenging radikal hidroksil. Selain itu, aktivitas scavenging radikal hidroksil juga dinyatakan sebagai nilai IC50. Nilai IC50 dari aktivitas scavenging radikal hidroksil pada kisaran nilai dari 167,52 sampai 446,48 μg/mL (Tabel 6.3). EPD (IC50, 446,48 μg/mL) menunjukkan aktivitas paling rendah di antara sampel, hal ini berhubungan dengan kandungan polifenol yang paling rendah (15,86 mg GAE/g). Aktivitas
scavenging radikal dari EKD (IC50, 357,19 μg/mL) sebanding dengan aktivitas EKM (IC50, 332,65 μg/mL) yang memiliki nilai IC50 tidak jauh beda. IAD (IC50, 257,27 μg/mL), isolat antosianin yang mengandung 5 jenis antosianin duwet, menunjukkan aktivitas lebih kuat dibandingkan EPD, EKD, dan EKM. Bentuk isolat antosianin dapat meningkatkan aktivitas scavenging radikal yang terlihat pada penurunan nilai IC50 sebesar ~100 μg/ml dibandingkan dalam bentuk
ekstrak EKD. Kemampuan aktivitas scavenging radikal hidroksil dari IAD lebih rendah dibandingkan katekin (IC50, 167,52 μg/mL) disebabkan struktur antosianin yang tersubstitusi gula dapat menurunkan aktivitas scavenging radikal hidroksil.
Gambar 6.5 Aktivitas scavenging radikal hidroksil (OH•) dari ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), dan katekin.
Husein et al. (1987); van Acker et al. (1996); Wettasinghe dan Shahidi (1999) melaporkan bahwa flavonoid adalah scavenger radikal hidroksil (OH•) dan keefektifan senyawa flavonoid meningkat dengan meningkatnya jumlah gugus hidroksil pada cincin aromatik B (B-ring). Seperti pada kebanyakan radikal bebas lainnya, radikal hidroksil dapat dinetralkan apabila dilengkapi dengan atom hidrogen. Jadi polifenol dalam EPD, EKD, dan IAD sampel duwet, utamanya antosianin, mempunyai kemampuan untuk menyumbangkan atom hidrogen ke radikal hidroksil. Lebih lanjut dijelaskan oleh Shi et al. (2001), reaktivitas dari
0 10 20 30 40 50 60 70 80 0 200 400 600 800 EPD EKD EKM A k ti fi ta s s c a v e n g in g r a d ik a l h id ro k s il ( % ) 0 10 20 30 40 50 60 70 80 0 50 100 150 200 250 300 350 IAD Katekin
flavonoid terhadap radikal hidroksil umumnya lebih tinggi daripada terhadap radikal anion superoksida.
Aktivitas Scavenging terhadap Radikal Anion Superoksida
Radikal anion superoksida merupakan spesies yang juga dihasilkan melalui reaksi biokimia normal di dalam tubuh (Kevin et al. 2007). Dalam sistem pengujian ini, radikal anion superoksida dihasilkan melalui reaksi enzimatis. Aktivitas scavenging radikal anion superoksida ditentukan menggunakan sistem hipoxantin/xantin oksidase sebagai sumber anion superoksida. Xanthin oksidase dapat mengkatalisa melalui 2 reaksi:
a) Hipoxantin + H2O + 2O2 Xantin + 2O2•- + 2H+
b) Xantin + H2O + 2O2 asam urat + 2O2•- + 2H+ (Lu & Foo 2000).
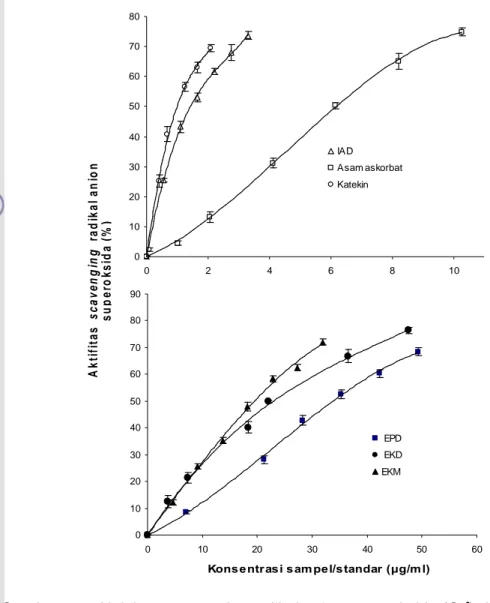
Gambar 6.6 menyajikan hubungan antara konsentrasi sampel dengan aktivitas scavenging radikal anion superoksida (%) dari ekstrak, isolat antosianin duwet, dan sampel pembanding. Peningkatan konsentrasi sampel dapat meningkatkan aktivitas scavenging radikal anion superoksida. Aktivitas
scavenging radikal anion superoksida menunjukkan pola yang sama dengan aktivitas scavenging radikal hidroksil. Aktivitas antioksidan dari sampel yang dinyatakan sebagai nilai IC50 disajikan pada Tabel 6.3. Aktivitas scavenging radikal anion superoksida dari IAD IAD (IC50, 1,85 μg/mL) menunjukkan aktivitas yang lebih tinggi dibandingkan EPD (IC50, 35,06 μg/mL) dan EKD (IC50, 22,16 μg/mL). Aktivitas scavenging radikal dari EKD sebanding dengan aktivitas EKM EKM (IC50, 20,67 μg/mL) yang memiliki nilai IC50 tidak jauh berbeda. Bentuk isolat antosianin dapat meningkatkan aktivitas scavenging terhadap radikal anion superoksida sehingga mempunyai aktivitas yang sebanding dengan sampel standar (katekin dan asam askorbat). IAD menunjukkan aktivitas yang lebih tinggi dibandingkan asam askorbat (IC50, 6,59 μg/mL) dan aktivitasnya sebanding dengan katekin (IC50, 1,27 μg/mL).
Xantin oksidase Xantin oksidase
Gambar 6.6 Aktivitas scavenging radikal anion superoksida (O2•) dari ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), asam askorbat, dan katekin.
Katekin, termasuk kelompok flavonoid, dan IAD, utamanya mengandung 5 jenis antosianin, menunjukkan aktivitas scavenging radikal anion superoksida lebih besar dari asam askorbat kemungkinan karena katekin dan IAD mempunyai dua mode reaksi yaitu sebagai inhibitor xanthin oksidase dan scavenger radikal superoksida. Pada asam askorbat kemungkinan hanya memiliki satu mode reaksi yaitu hanya sebagai scavenger radikal superoksida sehingga aktivitas menjadi lebih rendah. Alasan ini juga diperkuat oleh Lu dan Foo (2000) yang menyatakan polifenol dapat mempunyai lebih dari satu mode reaksi pada sistem pengujian ini: 1) dapat berperan sebagai inhibitor xanthin oksidase dan/atau 2) sebagai scavenger radikal superoksida. Lebih lanjut dijelaskan oleh Shi et al. (2001), apabila sistem/reaksi enzimatis yang digunakan dalam pengujian maka
0 10 20 30 40 50 60 70 80 0 2 4 6 8 10 IAD Asam askorbat Katekin 0 10 20 30 40 50 60 70 80 90 0 10 20 30 40 50 60 (% ) EPD EKD EKM 10 20 30 40 50 60 70 A k ti fi ta s s c a v e n g in g r a d ik a l a n io n s u p e ro k s id a ( % )
efek scavenging radikal superoksida kemungkinan berasal dari efek quenching
radikal atau/dan efek inhibisi enzim. Lebih lanjut dijelaskan hubungan antara aktivitas dan struktur flavonoid sebagai inhibitor xantin oksidase dan scavenger
radikal anion superoksida. Gugus hidroksil pada C-5 dan C-7 serta ikatan rangkap antara C-2 dan C-3 adalah penting/esensial untuk menghambat aktivitas xantin oksidase. Gugus hidroksil pada C-3’ cincin B dan pada C-3 merupakan gugus yang penting untuk aktivitas scavenging anion superoksida. Aucamp et al. (1997) juga melaporkan bahwa katekin dalam teh mungkin beraksi pada tahapan awal reaksi dengan menghambat produksi radikal superoksida melalui aksi menghambat aktivitas xantin oksidase dan menetralkan radikal superoksida yang telah terbentuk.
Penghambatan Peroksidasi Lipid (Lipoprotein LDL)
Aktivitas penghambatan peroksidasi lipid dari antosianin buah duwet diuji secara in vitro dalam sistem model yang mengandung lipoprotein LDL yang diisolasi dari manusia. Lipoprotein LDL mengandung protein sebanyak 21% dan lipid 79% (Marinetti 1990), sehingga mudah mengalami oksidasi. Banyak fakta ilmiah yang mendukung keterlibatan LDL termodifikasi (modified LDL), melalui reaksi oksidasi, pada patogenesis dari ateroklerosis. Untuk itu pada bagian penelitian ini dilakukan pengujian kemampuan antosianin buah duwet dalam menghambat oksidasi lipoprotein LDL.
Hasil penelitian menunjukkan bahwa ekstrak (EPD dan EKD) serta isolat (IAD) buah duwet yang mengandung senyawa utama antosianin menunjukkan aktivitas penghambatan terhadap oksidasi lipoprotein LDL menggunakan logam Cu2+, Gambar 6.7 dan Tabel 6.4. Penelitian dari Hu et al. (2003); Kano et al. (2005); Ghiselli et al. (1998); Heinonen et al. (1998), Kähkönen dan Heinonen (2003), Brown dan Kelly (2007); juga menunjukkan bahwa antosianin memiliki kemampuan dalam menghambat oksidasi lipoprotein LDL.
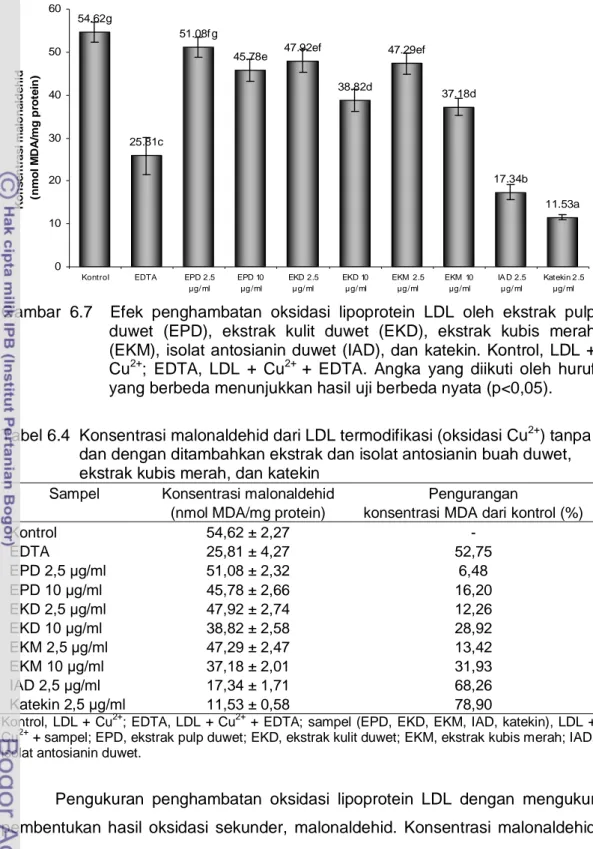
54.62g 51.08f g 47.92ef 47.29ef 45.78e 38.82d 37.18d 25.81c 17.34b 11.53a 0 10 20 30 40 50 60
Kontrol EDTA EPD 2.5
μg/ ml EPD 10 μg /ml EKD 2.5 μg/ ml EKD 10 μg/ ml EKM 2.5 μg /ml EKM 10 μg /ml IA D 2.5 μg/ ml Katekin 2 .5 μg/ ml K o n s e n tr a s i m a lo n a ld e h id ( n m o l M DA /m g p ro te in )
Gambar 6.7 Efek penghambatan oksidasi lipoprotein LDL oleh ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), ekstrak kubis merah (EKM), isolat antosianin duwet (IAD), dan katekin. Kontrol, LDL + Cu2+; EDTA, LDL + Cu2+ + EDTA. Angka yang diikuti oleh huruf yang berbeda menunjukkan hasil uji berbeda nyata (p<0,05). Tabel 6.4 Konsentrasi malonaldehid dari LDL termodifikasi (oksidasi Cu2+) tanpa dan dengan ditambahkan ekstrak dan isolat antosianin buah duwet, ekstrak kubis merah, dan katekin
Sampel Konsentrasi malonaldehid Pengurangan
(nmol MDA/mg protein) konsentrasi MDA dari kontrol (%)
Kontrol 54,62 ± 2,27 - EDTA 25,81 ± 4,27 52,75 EPD 2,5 μg/ml 51,08 ± 2,32 6,48 EPD 10 μg/ml 45,78 ± 2,66 16,20 EKD 2,5 μg/ml 47,92 ± 2,74 12,26 EKD 10 μg/ml 38,82 ± 2,58 28,92 EKM 2,5 μg/ml 47,29 ± 2,47 13,42 EKM 10 μg/ml 37,18 ± 2,01 31,93 IAD 2,5 μg/ml 17,34 ± 1,71 68,26 Katekin 2,5 μg/ml 11,53 ± 0,58 78,90
Kontrol, LDL + Cu2+; EDTA, LDL + Cu2+ + EDTA; sampel (EPD, EKD, EKM, IAD, katekin), LDL + Cu2+ + sampel; EPD, ekstrak pulp duwet; EKD, ekstrak kulit duwet; EKM, ekstrak kubis merah; IAD, isolat antosianin duwet.
Pengukuran penghambatan oksidasi lipoprotein LDL dengan mengukur pembentukan hasil oksidasi sekunder, malonaldehid. Konsentrasi malonaldehid dari ekstrak EPD dan EKD buah duwet (51,08 nmol MDA/mg protein dan 47,92 nmol MDA/mg protein) menunjukkan nilai lebih besar dari isolat antosianin buah duwet, IAD (17,34 nmol MDA/mg protein) pada konsentrasi pengujian 2,5 μg/mL. IAD memiliki kemampuan menghambat oksidasi lipoprotein LDL lebih besar dibandingkan dengan ekstrak EPD dan EKD. Pembentukan malonaldehid
dengan penambahan ekstrak EKD dan EKM menunjukkan konsentrasi malonaldehid yang hampir sama pada kedua konsentrasi pengujian, 2.5 dan 10
μg/mL. Hal ini menunjukkan bahwa EKD memiliki aktivitas penghambatan terhadap oksidasi lipoprotein LDL yang sebanding dengan EKM. Sedangkan aktivitas penghambatan oksidasi LDL untuk isolat antosianin buah duwet (IAD) sedikit lebih rendah dibandingkan dengan katekin. Katekin menunjukkan aktivitas penghambatan terhadap oksidasi LDL yang paling tinggi diantara sampel yang diujikan, dimana pembentukan malonaldehid kecil sebesar 11,53 nmol MDA/mg protein pada kosentrasi pengujian 2,5 μg/mL. Pengurangan kadar malonaldehid dari kontrol untuk sampel buah duwet yaitu EPD, EKD, dan IAD berturut-turut sebesar 6,48-16,20%; 12,26-28,92%; dan 68,26%. Isolat antosianin duwet dapat mengurangi pembentukan malonaldehid di atas nilai 50% pada konsentrasi pengujian 2,5 μg/mL.
Pada tahapan reaksi oksidasi lipid dihasilkan radikal lipid seperti radikal peroksil (ROO•), alkoksi (RO•), dan alkil (R•) (Hamilton et al. 1997; Gordon 1990). Radikal lipid juga dihasilkan pada oksidasi lipoprotein LDL menggunakan logam Cu2+. Menurut Aviram dan Fuhram (2003), flavonoid dapat menghambat oksidasi LDL melalui beberapa mekanisme diantaranya: sebagai scavenging radikal bebas dengan mendonorkan elektron atau atom hidrogen ke radikal bebas serta mengkelasi (chelating agents) ion logam transisi (Gambar 6.8). Huang et al. (2005) memaparkan tahapan autooksidasi, inisiasi dengan senyawa azo, dan aksi penghambatan dari antioksidan sebagai berikut :
inisiasi R2N2 2R• + N2 R• + O2 ROO• ROO• + LH ROOH + L• propagasi L• + O2 LOO• LOO• + LH LOOH + L• inhibisi LOO• + AH LOOH + A• terminasi
A• + (n-1)LOO• produk-produk nonradikal LOO• + LOO• produk-produk nonradikal
(R2N2 = senyawa azo; LH = substrat asam lemak; ROO• = radikal peroksil; AH = antioksidan).
Lebih lanjut dijelaskan oleh Gordon (1990) dan Bravo (1998), mekanisme antioksidan primer fenolik (antioksidan pemutus rantai reaksi oksidasi) dalam proses autooksidasi adalah dengan cepat menyumbangkan atom hidrogen ke
radikal lipid dan mengubah radikal lipid menjadi produk yang lebih stabil, seperti diilustrasikan pada reaksi berikut :
ROO• + AH ROOH + A• RO• + AH ROH + A•
(ROO• = radikal peroksil; RO• = radikal alkoksi; AH = antioksidan)
Menurut Bravo (1998), radikal fenoksil relatif stabil, oleh karena itu reaksi berantai baru tidak mudah diinisiasi. Radikal fenoksil distabilisasi melalui delokalisasi elektron tidak berpasangan mengelilingi cincin aromatik. Selain itu, radikal fenoksi juga berperan sebagai terminator (penghenti reaksi berantai) pada tahapan propagasi yang bereaksi dengan radikal bebas lain :
ROO• + A• ROOA RO• + A• ROA
Mekanisme aktivitas antioksidan antosianin dalam menghambat oksidasi lipid (lipoprotein LDL) utamanya berkaitan dengan keberadaan gugus hidroksil pada cincin B (Seeram dan Nair 2002; Kähkönen dan Heinonen 2003; Brown dan Kelly 2007). Jumlah dan posisi gugus OH pada cincin B sangat berpengaruh pada aktivitas penghambatan oksidasi lipid lipoprotein LDL. Mekanismenya adalah melalui pemutusan rantai propagasi dari radikal bebas (free radikal chain-breaking), dimana semua gugus hidroksil (cincin B) dapat menyumbangkan atau berperan sebagai donor elektron atau hidrogen sehingga terjadi pembersihan (scavenging) atau pencegatan (inteceptor) terhadap radikal bebas.
Keseluruan antosianin buah duwet dalam bentuk 3,5-diglukosida dan tidak memiliki struktur 4-okso sehingga kemampuan kelasi antosianin terhadap logam Cu2+ terletak pada struktur katekol (o-difenolik) pada cincin B, juga untuk struktur katekin (Gambar 6.8). Brown dan Kelly (2007) menjelaskan bahwa keberadaan o-dihidroksifenol memberikan kontribusi kelasi ion Cu2+ yang dapat memberikan peningkatan kemampuan penghambatan oksidasi lipid yang diinduksi oleh ion logam.
Aktivitas Antioksidan Minuman Model yang Mengandung Antosianin Buah Duwet
Ekstrak antosianin buah duwet yang telah diuji memiliki aktivitas antioksidan selanjutnya diaplikasikan ke dalam minuman model yang dibuat dari bufer sitrat (pH 3) sebagai pewarna. Minuman model yang diberi warna antosianin buah duwet baik tanpa kopigmentasi dan terkopigmentasi
intermolekular diuji kandungan total antosianin, total polifenol, serta aktivitas antioksidan berdasarkan kemampuan scavenging radikal DPPH. Pengujian aktivitas antioksidan pada minuman model yang diberi warna antosianin buah duwet bertujuan untuk memberikan informasi tambahan peranan antosianin buah duwet selain sebagai pewarna, juga sekaligus dapat memberikan manfaat kesehatan terutama sebagai antioksidan. Pewarna berbasis antosianin dari buah duwet dapat dikategorikan sebagai pewarna pangan fungsional.
Gambar 6.8 Pengikatan trace logam oleh senyawa polifenol (flavonoid).
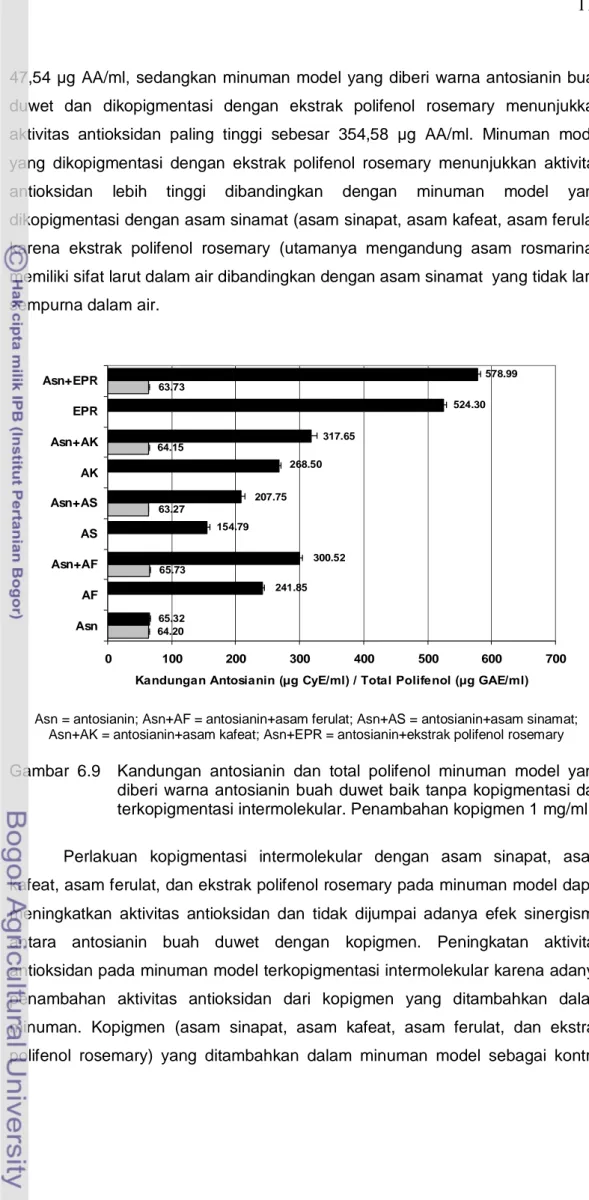
Minuman model yang diberi warna antosianin buah duwet baik tanpa kopigmentasi dan terkopigmentasi intermolekular mengandung antosianin pada kisaran nilai 63,27-65,73 μg CyE/ml, CyE = cyanidin equivalent dan kandungan total polifenol pada kisaran nilai 65,32-578,99 μg GAE/ml, GAE = gallic acid equivalent (Gambar 6.9). Penambahan kopigmen asam sinapat, asam kafeat, asam ferulat, dan ekstrak polifenol rosemary meningkatkan kandungan polifenol minuman model. Asam sinapat, asam kafeat, dan asam ferulat merupakan senyawa polifenol termasuk kelompok asam fenolik (asam sinamat), sedangkan ekstrak polifenol rosemary mengandung utamanya senyawa polifenol larut air asam rosmarinat (Basaga et al. 1997; Brenes et al. 2005).
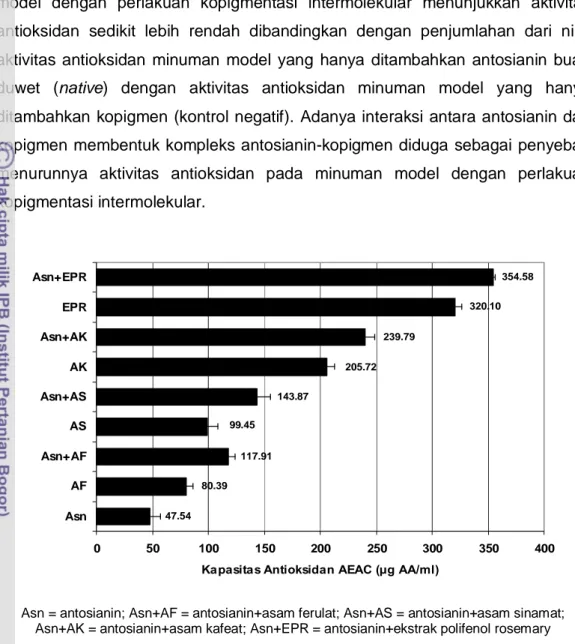
Aktivitas antioksidan minuman model yang mengandung antosianin buah duwet baik tanpa kopigmentasi dan terkopigmentasi intermolekular, dinyatakan sebagai nilai kapasitas antioksidan AEAC (ascorbic acid equivalent antioxidant capacity), ditampilkan pada Gambar 6.10. Kapasitas antioksidan minuman model pada kisaran nilai 47,54-354,58 μg AA/ml, AA = asam askorbat. Minuman model yang hanya diberi warna antosianin buah duwet (tanpa perlakuan kopigmentasi/native) menunjukkan aktivitas antioksidan paling rendah sebesar
47,54 μg AA/ml, sedangkan minuman model yang diberi warna antosianin buah duwet dan dikopigmentasi dengan ekstrak polifenol rosemary menunjukkan aktivitas antioksidan paling tinggi sebesar 354,58 μg AA/ml. Minuman model yang dikopigmentasi dengan ekstrak polifenol rosemary menunjukkan aktivitas antioksidan lebih tinggi dibandingkan dengan minuman model yang dikopigmentasi dengan asam sinamat (asam sinapat, asam kafeat, asam ferulat) karena ekstrak polifenol rosemary (utamanya mengandung asam rosmarinat) memiliki sifat larut dalam air dibandingkan dengan asam sinamat yang tidak larut sempurna dalam air.
63.73 64.15 63.27 65.73 64.20 300.52 154.79 207.75 268.50 317.65 524.30 578.99 65.32 241.85 0 100 200 300 400 500 600 700 Asn AF Asn+AF AS Asn+AS AK Asn+AK EPR Asn+EPR
Kandungan Antosianin (μg CyE/ml) / Total Polifenol (μg GAE/ml)
Asn = antosianin; Asn+AF = antosianin+asam ferulat; Asn+AS = antosianin+asam sinamat; Asn+AK = antosianin+asam kafeat; Asn+EPR = antosianin+ekstrak polifenol rosemary
Gambar 6.9 Kandungan antosianin dan total polifenol minuman model yang diberi warna antosianin buah duwet baik tanpa kopigmentasi dan terkopigmentasi intermolekular. Penambahan kopigmen 1 mg/ml. Perlakuan kopigmentasi intermolekular dengan asam sinapat, asam kafeat, asam ferulat, dan ekstrak polifenol rosemary pada minuman model dapat meningkatkan aktivitas antioksidan dan tidak dijumpai adanya efek sinergisme antara antosianin buah duwet dengan kopigmen. Peningkatan aktivitas antioksidan pada minuman model terkopigmentasi intermolekular karena adanya penambahan aktivitas antioksidan dari kopigmen yang ditambahkan dalam minuman. Kopigmen (asam sinapat, asam kafeat, asam ferulat, dan ekstrak polifenol rosemary) yang ditambahkan dalam minuman model sebagai kontrol
negatif menunjukkan aktivitas antioksidan (Gambar 6.10). Selain itu, minuman model dengan perlakuan kopigmentasi intermolekular menunjukkan aktivitas antioksidan sedikit lebih rendah dibandingkan dengan penjumlahan dari nilai aktivitas antioksidan minuman model yang hanya ditambahkan antosianin buah duwet (native) dengan aktivitas antioksidan minuman model yang hanya ditambahkan kopigmen (kontrol negatif). Adanya interaksi antara antosianin dan kopigmen membentuk kompleks antosianin-kopigmen diduga sebagai penyebab menurunnya aktivitas antioksidan pada minuman model dengan perlakuan kopigmentasi intermolekular. 205.72 239.79 320.10 354.58 143.87 99.45 117.91 80.39 47.54 0 50 100 150 200 250 300 350 400 Asn AF Asn+AF AS Asn+AS AK Asn+AK EPR Asn+EPR
Kapasitas Antioksidan AEAC (μg AA/ml)
Asn = antosianin; Asn+AF = antosianin+asam ferulat; Asn+AS = antosianin+asam sinamat; Asn+AK = antosianin+asam kafeat; Asn+EPR = antosianin+ekstrak polifenol rosemary
Gambar 6.10 Kapasitas antioksidan minuman model yang diberi warna antosianin buah duwet (tanpa dan dengan perlakuan kopigmentasi). Penambahan kopigmen 1 mg/ml.
Ekstrak dan isolat antosianin buah duwet mengandung senyawa polifenol utama yaitu antosianin, sehingga kontribusi utama terhadap aktivitas antioksidan berasal dari antosianin. Mekanisme aktivitas antioksidan dari antosianin buah duwet diantaranya sebagai scavenging radikal bebas (DPPH, hidroksil, superoksida, dan radikal lipid) dengan mendonorkan elektron atau atom hirogen, mengkelasi logam Cu2+ yang berperan dalam oksidasi lipid, serta inhibisi enzim xantin oksidase yang berperan dalam pembentukan radikal anion superoksida.
Antosianin termasuk kelompok flavonoid sehingga memiliki mekanisme aktivitas antioksidan yang sama dengan kebanyakan senyawa flavonoid lainnya. Aktivitas antioksidan senyawa flavonoid sangat bergantung pada jumlah dan lokasi gugus fenolik (-OH) yang berperan untuk menetralkan radikal bebas dengan menyumbangkan atom hidrogen (donor elektron/atom hidrogen). Flavonoid berperan mengurangi radikal bebas seperti radikal superoksida, peroksil, alkoksil, dan hidroksil dengan menyumbangkan atom hidrogennya: Fl-OH + R● Fl-O● + RH, dimana Fl-OH adalah flavonoid dan R● adalah radikal superoksida, peroksil, alkoksil, dan hidroksil. Aroksil radikal (Fl-O●) beraksi dengan radikal lainnya membentuk struktur kuinon yang stabil (Pietta 2000).
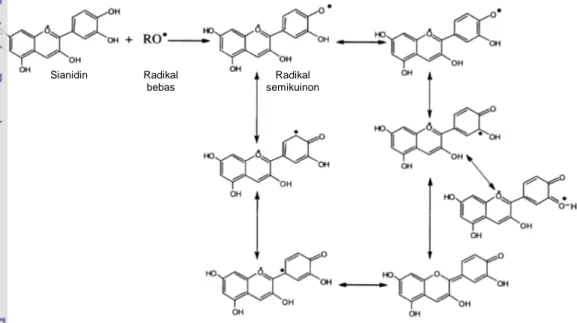
Green (2007) melengkapi penjelasan diatas bahwa radikal antioksidan fenolik setelah melakukan fungsi antioksidannya akan berubah menjadi radikal fenoksil yang relatif stabil. Hal ini karena (1) delokalisasi elektron yang tidak berpasangan dari radikal fenoksil yang terjadi pada cincin aromatik, Gambar 6.11; (2) radikal fenoksil kurang reaktif karena tidak mempunyai cukup energi untuk reaksi oksidasi lebih lanjut; dan (3) radikal fenoksil dapat bereaksi dengan radikal lainnya membentuk senyawa yang stabil. Lebih spesifik Castañeda-Ovando et al. (2009) menjelaskan bahwa dalam struktur katekol, oksidasi yang terjadi melalui radikal bebas membentuk radikal semikuinon yang stabil. Gambar 6.12 menyajikan mekanisme stabilisasi radikal semikuinon dari sianidin.
Gambar 6.11 Delokalisasi elektron tidak berpasangan di sekitar cincin aromatik pada radikal fenol (Gordon 1990).
Kähkönen dan Heinonen (2003) juga menjelaskan bahwa aktivitas/kemampuan antioksidan dari antosianin berhubungan dengan a) struktur konjugasi dari antosianin yang mengambil bagian dalam delokalisasi elektron yang menghasilkan produk radikal yang stabil, b) jumlah atau tingkat dan posisi hidroksilasi dan metoksilasi pada cincin B, c) pola glikosilasi, dimana kekuatan antioksidan dari antosianidin umumnya lebih tinggi dibandingkan bentuk glikosida (antosianin). Lebih lanjut Castañeda-Ovando et al. (2009) menjelaskan bahwa sianidin, delfinidin, dan petunidin yang mengandung substitusi o-dihidroksil
merupakan senyawa yang mudah mengalami oksidasi, sedangkan pelargonidin, petunidin, dan malvidin tidak mudah mengalami oksidasi karena strukturnya tidak disubstitusi o-dihidroksil. Sianidin, delfinidin, dan petunidin terkandung dalam buah duwet sebesar ~73% memberikan kontribusi aktivitas antioksidan yang lebih kuat, dibandingkan peonidin dan malvidin yang memberikan kontribusi sebesar ~27%. Antosianin buah duwet menunjukkan aktivitas antioksidan yang lebih rendah dibandingkan katekin dan kuersetin karena antosianin buah duwet mengandung 2 gugus gula, keberadaan gugus gula yang berikatan pada antosianin menurunkan aktivitas antioksidan. Satué-Gracia et al. (1997); Wang et al. (1997); Kähkönen dan Heinonen (2003), menyatakan bahwa kekuatan antioksidan dari antosianidin umumnya lebih tinggi dibandingkan bentuk glikosida (antosianin). Hal ini juga didukung penelitian Rice-Evan et al. (1996) yang menunjukkan tren penurunan nilai TEAC (trolox equivalent antioxidant capacity) dengan adanya glikosilasi pada senyawa flavonoid.
Gambar 6.12 Mekanisme stabilisasi radikal semikuinon dari sianidin (resonansi) (diusulkan oleh Castañeda-Ovando et al. 2009).
SIMPULAN
Kontribusi utama senyawa polifenol dalam buah duwet berasal dari antosianin sebesar ~83% (b/b) sehingga antosianin merupakan kontributor utama aktivitas antioksidan buah duwet. Ekstrak dan isolat antosianin buah duwet menunjukkan aktivitas antioksidan terutama dalam kemampuan
Sianidin Radikal bebas
Radikal semikuinon
scavenging radikal DPPH dan spesies oksigen reaktif/SOR serta kemampuan dalam menghambat oksidasi lipoprotein LDL.
Isolat antosianin duwet (IAD) menunjukkan aktivitas antioksidan yang lebih tinggi dibandingkan ekstrak antosianin buah duwet (ekstrak pulp duwet/EPD dan ekstrak kulit duwet/EKD) dan ekstrak kubis merah (EKM), serta memiliki aktivitas antioksidan sedikit lebih rendah dibandingkan dengan sampel standar (kuersetin, katekin, dan asam askorbat). Perkecualian pada pengujian
scavenging radikal anion superoksida, isolat antosianin duwet menunjukkan aktivitas yang lebih tinggi dibandingkan asam askorbat. Ekstrak kulit duwet (EKD) memiliki aktivitas antioksidan sedikit lebih rendah dibandingkan dengan ekstrak kubis merah (EKM), ekstrak kubis merah telah digunakan secara komersial untuk pewarna pangan.
Minuman model yang ditambahkan antosianin buah duwet baik tanpa kopigmentasi dan terkopigmentasi intermolekular menunjukkan aktivitas antioksidan. Kopigmentasi antosianin buah duwet dalam minuman model dengan asam sinapat, asam kafeat, asam ferulat, dan ekstrak polifenol rosemary meningkatkan kandungan total polifenol dan aktivitas antioksidan minuman. Tidak ada efek sinergisme antara antosianin buah duwet dengan kopigmen terhadap aktivitas antioksidan.
Antosianin yang terkandung dalam buah duwet memiliki potensi untuk dikembangkan sebagai pewarna alami fungsional untuk pangan. Antosianin buah duwet selain berfungsi sebagai pewarna untuk pangan juga dapat sekaligus berfungsi sebagai antioksidan yang dapat memberikan efek positif untuk kesehatan manusia.