LAPORAN AKHIR PELAKSANAAN PENELITIAN HIBAH BERSAING TAHUN ANGGARAN 2015
JUDUL PENELITIAN
PEMANFAATAN RHIZOBAKTERIA DARI TANAMAN SOLANACEAE UNTUK MEMACU PERTUMBUHAN BAKTERI RHIZOBIUM SP DALAM
PEMBENTUKAN BINTIL AKAR DAN MENGINDUKSI KETAHANAN SISTEMIK TANAMAN KEDELAI (GLYCINE MAX L. MERRIL) TERHADAP HAMA DAN
PENYAKIT DI LAHAN SAWAH
Oleh
Prof.Dr. Ir. Made Sudana, MS (NIDN. 0018065401) Dr. IGN. Alit Susanta Wirya, MP.MAgr (NIDN. 0015016802
Ir. Gusti Ngurah Raka, MS
(
NIDN. 0021085502 )Dibiayai oleh
Direktorat Penelitian dan Pengabdian kepada Masyarakat Direktorat Jendral Pendidikan Tinggi
Kementerian Pendidikan dan Kebudayaan
Sesuai dengan Surat Perjanjian Penugasan Pelaksanaan Penelitian Nomor: 10/UN14.2/PNL.01.03.00/2015, tanggal 3 Maret 2015
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS UDAYANA
Juni 2015
DAFTAR ISI Halaman BAB I. PENDAHULUAN……….. Latar Belakang... Tujuan Penelitian... Keutamaan penelitian……….
BAB II. TINJAUAN PUSTAKA……… Bakteri Rhizobium………. Induksi ketahanan Sistemik……… Bakteri Pelarut Fosfat………. Bakteri Penghasil Fitohormon………
BAB III. METODELOGI... Penelitian Tahun I...
A. Isolasi Rhizobakteria dari permukaan akar solanaceae………... B. Seleksi Bakteri Rhizobium pembentuk bintil akar kedelai……… C. Uji Pengaruh Rhizobakteria solanaceae terhadap pertumbuhan tanaman
Kedelai……….. 1. Uji kemampuan meningkatkan pertumbuhan tanaman kedele………... 2. Uji kemampuan Rhizobakteria menginduksi ketahanan sistemik
tanaman kedelai terhadap serangan Hama dan Penyakit……… D. Identifikasi Spesies Rhizobakteia secara moekular……….. BAB IV. HASIL PENELITIAN
A. Isolasi Rhizobakteria dari permukaan akar solanaceae………... 1. Isolasi Rhizobacteria dari Tanaman Solanacearum dan Leguminose 2. Pengujian Rhizobakteria sebagai Mikroba Pelarut Fosfat
B. Seleksi Bakteri Rhizobium pembentuk bintil akar kedelai……… C. Uji Pengaruh Rhizobakteria solanaceae terhadap pertumbuhan tanaman
Kedelai………. BAB V. KESIMPULAN` DAFTAR PUSTAKA... 3 3 4 5 5 6 7 8 8 9 9 9 10 11 11 11 11 12 12 12 12 15 16 17 17
BAB I. PENDAHULUAN Latar Belakang
Di Indonesia kedelai digunakan uintuk bahan makanan dalam bentuk tahu, tempe, tauco, kecap, dan tauge, sedangkan bungkilnya dapat digunakan untuk campuran pakan ternak ( Samsudin dan Djakamiharja, 1985). Kebutuhan kedelai secara nasional saat ini mencapai 2,2 juta ton per tahun, sementara produksi dalam negeri baru mampu memenuhi kebutuhan 35-40%, sehingga kekurangannya dipenuhi dari import (Hapsoh, 2008)
Naiknya harga kedelai di pasaran dunia akhir-akhir ini berdampak pada kenaikan harga kedelai di dalam negeri. Keadaan ini membuat banyak industri-industri olahan kedelai terutama industri-industri kecil seperti pengrajin tempe dan tahu menjadi gulung tikar, karena ketidak mampuan membeli bahan baku (Hapsoh 2008) . Untuk dapat meningkatkan produksi kedelai dalam negeri maka perlu dilakukan upaya-upaya seperti peningkatan luas areal pertanaman (ekstensifikasi) dan juga penerapan teknologi budidaya kedelai yang dapat meningkatkan produktivitasnya (intensifikasi)
Selain itu rendahnya produksi kedelai dalam negeri disebabkan oleh adanya serangan hama dan penyakit serta tanaman kurang mendapat pemiliharan dari petani, dan biasanya tanaman kedelai di tanam di sawah setelah padi dipanen dan tampa pengolahan tanah terlebih dahulu, akibatnya pertumbuhan akar dan tanaman kedelai kurang baik karena tanah bekas tanaman padi strukturnya padat, kurang oksigen, populasi mikrofloranya rendah, dan sebagian unsur hara masih terikat dalam butiran tanah dan sulit diserap oleh akar tanaman. Selain itu tanaman kedelai yang di tanam di lahan sawah, peka terhadap serangan penyakit, karena tanaman kurang cukup mendapat hara untuk memproduksi metabolit sekunder yang dapat melindungi tanamn dari serangan patogen penyakit dan serangga hama (Hidayat dan Mulyani, 2002)
Peningkatan produtivitas tanaman sering dilakukan dengan pemberian pupuk dan pestisida sintetis. Pupuk sintetis N P dan K serta pupuk kimia lainnnya, namun pemberian pupuk sintetis akan menambah kerusakan struktur, kimia dan biologi tanah, menyebabkan tanah mencadi keras dan sulit diolah, kandungan oksigen dalam tanah rendah, sehingga akar kekurangan oksigen untuk bernafas, berkurangnya mikroflora tanah dan berkurangnya hara yang bisa diserap oleh tanaman. Sedangkan pemakaian pestisida sintetis menyebabkan mikroflora tanah rusak dan keseimbangan hara dalam tanah terganggu, sehingga proses dekomposisi bahan organik dalam tanah untuk menjadi humus sangat terhambat, akibatnya
tanaman sangat sedikit mendapat asupan hara terutama mikroelement. Dengan kekurangan mikro elemen, proses metabolisme dalam tubuh terganggu, sehingga tanaman sedikit menghasilkan metabolit sekunder yang dapat membunuh hama dan penyakit tanaman (Hoerussalam el al 2013)
Tanaman kedelai dapat mencukupi kebutuhan nitrogennya dengan mengadakan simbiosis dengan bakteri penambat nitrogen dari udara yaitu bakteri Rhizobium, namun namun mekanisme simbiosis antara tanaman kedelai dengan Rhizobium sering terganggu oleh kondisi fisik, kimia dan biologi tanah (Sprent, 1976). Dalam keadaan lingkungan yang memenuhi persyaratan tumbuh, simbiosis yang terjadi mampu memenuhi 50% atau bahkan seluruh kebutuhan nitrogen tanaman yang bersangkutan dengan cara menambat nitrogen bebas (Saono, 1981). Di samping itu bakteri Rhizobium tersebut mempunyai dampak yang positip baik langsung maupun tidak langsung terhadap sifat fisik dan kimia tanah, sehingga mampu meningkatkan kesuburan tanah (Alexander, 1977).
Dalam tanah sawah umumnya Fosfat tersedia untuk tanaman rendah, maka untuk mencukupi ketersediaan fosfat dalam tanah maka diperlukan rhizobakteria dari solanaceae yang mampu melarutkan fosfat yang terikat pada butiran bahan organik tanah, namun mampujuga merangsang pertubuhan bakteri Rhizobium
Maka untuk meningkatkan pertumbuhan Rhizobium dalam tanah, perlu dicari bakteri yang hidup dipermukaan akar tanaman (Rhizobakteria) dan mampu memacu pertumbuhan bakteri Rhiobium, sehingga bakteri Rhizobium semakin banyak membentuk bintil bintil akar dan tanaman semakin banyak mendapat asupan nitrogen dari udara sehingga pertumbuhan tanaman menjadi subur dan sehat. Dengan bagusnya pertumbuhan tanaman maka tanaman akan menghasilkan eksudat pada permukaan akar tanaman, eksudat tersebut kaya akan protein, karbohidrat dan vitamin yang di butuhkan untuk kelangsungan hidup Rhizobakteria pada akar kedelai.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan;
1. Menghasilkan Biofertilizer berupa Bakteri penghuni permukaan akar (Rhizobakteria) yang mampu meningkatkan populasi Rhirobium di sekitar akar, dan meningkatkan kemampuan Rhizobium untuk untuk mempenetrtasi akar kedelai, sehingga jumlah bintil akar pada tanaman kedelai tinggi, dan kebutuhan Nitrogen pada tanaman kedelai mencukupi.
2. Menghasilkan Biofertilizer Nitrogen (pupuk hayati Nitrogen), yaitu bakteri Rhizobium yang mampu bersimbiosis dengan tanaman kedelai, bakteri tersebut mampu menambat Nitrogen dari udara dan menyediakan Nitrogen pada tanaman kedelai
3. Menghasilkan Biofertilizer Fosfat, ada beberapa Rhizobakteria pada akar tanaman kedelai merupakan Bakteri pelarut Fosfat, yang mampu melarutkan fosfat yang terikat pada butiran tanah dengan memakai enzym, sehingga fosfat tersedia bagi tanaman kedelai 4. Menghasilkan Biopestisida (Pestisita hayati), beberapa bakteri pada akar tanaman kedele
bersifat sebagai penginduksi ketahanan sistemik, dengan menghasilkan Protein PR. Protein ini mampu menginduksi setiap sel tanaman untuk mengaktifkan metabolisme sekunder hingga sel menghasilkan senyawa senyawa yang beracun terhadap patogen dan hama tanaman
Keutamaan Penelitian
Penelitian ini dilaksanakan dengan harapan :
1. Menambah pengetahuan ilmiah tentang perkembangan bakteri Rhizobium pada akar tanaman kedelai selain dipengaruhi oleh sifat fisik dan kimia tanah, juga dipengaruhi oleh hubungan antara Rhizobium dengan bakteri penghuni permukaan akar tanaman, dan beberapa diantaranya dapat memacu pertumbuhan populasi Rhizobium dan meningkatkan kemampuan Rhizobium menginfeksi akar tanaman
2. Penelitian ini dapat memberikan informasi tentang adanya mikroba selain Rhizobium yang dapat digunakan sebagai pupuk dan pestisida hayati, dalam hal menunjang pertanian organik kedelai 3. Dari penelitian ini diharapkan akan dapat terwujudnya formulasi biopestisida dan Biofertilizer
yang dapat di komersilkan untuk perkembangan pertanian Organik
4. Kegiatan ini akan memberikan pengetahuan praktis pada petani untuk dapat memproduksi kedelai bergizi, sehat dan aman bagi konsumen serta aman bagi kelestrarian lingkungan yang dibudidayakan secara organik
BAB II. Tinjauan Pustaka
Kedelai merupakan tanaman asli Daratan Cina dan telah dibudidayakan oleh manusia sejak 2500 SM. Sejalan dengan makin berkembangnya perdagangan antar negara yang terjadi pada awal abad ke-19, menyebabkan tanaman kedalai juga ikut tersebar ke berbagai negara tujuan perdagangan tersebut, yaitu Jepang, Korea, Indonesia, India, Australia, dan Amerika. Kedelai mulai dikenal di Indonesia sejak abad ke-16. Awal mula penyebaran dan pembudidayaan kedelai yaitu di Pulau Jawa,kemudian berkembang ke Bali, Nusa Tenggara, dan pulau pulau lainnya (Rukmana,dan Yuniarsih. 1996)
Kebutuhan kedelai (Glycine max L. Merril) di Indonesia setiap tahun selalu meningkat seiring dengan pertambahan penduduk dan perbaikan pendapatan perkapita. Kedelai digunakan uintuk bahan makanan dalam bentuk tahu, tempe, tauco, kecap, dan tauge, sedangkan bungkilnya dapat digunakan untuk campuran pakan ternak ( Samsudin dan Djakamiharja, 1985). Kebutuhan kedelai secara nasional saat ini mencapai 2,2 juta ton per tahun, sementara produksi dalam negeri baru mampu memenuhi kebutuhan 35-40%, sehingga kekurangannya dipenuhi dari import. Rata-rata produktivitas kedelai nasional masih rendah, yakni hanya 1,1 ton/ ha. Angka produktivitas itu sebetulnya masih dapat ditingkatkan menjadi 2,0 – 2,5 ton/ha, untuk itu perlu dilakukan penelitian yang mendalam agar dapat meningkatkan produksi kedelai di Indonesia (Adisarwanto, dan Wudianto. 1999). Salah satunya adalah dengan memperbaiki pertumbuhan bakteri Rhizobium, agar bakteri ini dapat berkembang dengan baik di dekat akar tanaman dan mempunyai kamampuan tinggi untuk melakukan penetrasi kedalam akar tanaman, di dalam jaringan akar bakteri akan membentuk bintil akar sebagai tempat tinggal bakteri Rhizobium, dan dalam bintil akar itulah bakteri mampu memfiksasi Nitrogen dari Udara untuk tanaman, dan bakteri hidup dalam bintil akar akan mendapat makanan dari tanaman baik berupa protein, karbohidrat dan vitamin( Surtiningsih, et al,2009)
Perbaikan kondisi lingkungan Rhizobium, yaitu dilakukan perbaikan secara biologis dengan cara meningkatkan populasi bakteri yang bermanfaat di sekitar bakteri Rhizobium, bakteri tersebut menguntungkan bagi Rhizobium, baik dalam memacu peningkatan populasi Rhizobium dan kemampuannya menginfeksi akar tanaman kedelai, tetapi juga bakteri tersebut mampu meningkatkan kesuburan tanaman baik sebagai pengyedia nutrisi maupun hormon tumbuh tanaman serta mikroba tersebut mampu menginduksi ketahanan sistemik tanaman sehingga tanaman tahan terhadap serangan hama dan penyakit tanaman. Bakteri yang menguntungkan bagi bakteri Rhizobium akan memproduksi protein dan karbohidrat yang berguna bagi Rhizobium, dan meranggsang pertumbuhan rambut akar tempat masuknia Rhizobium ke dalam jaringan akar.
Bakteri Rhizobium
Rhizobium adalah bakteri gram negatif yang merupakan bakteri penghuni tanah,
bersifat aerob, bentuk batang, koloninya berwarna putih berbentuk sirkular, merupakan penambat nitrogen yang hidup di dalam tanah dan berasosiasi simbiotik dengan sel akar tanaman leguminoceae. Bakteri ini masuk melalui bulu-bulu akar tanaman berbuah polongan dan menyebabkan jaringan akar agar tumbuh berlebih-lebihan hingga menjadi kutil-kutil. Bakteri ini hidup dalam kutil pada akar tanaman dan memperoleh makanannya dari sel-sel
akar tanaman. Biasanya beberapa spesies Actinomycetes kedapatan bersama-sama dengan Rhizobium sp. dalam satu sel, untuk itu perlu diteliti fungsi keberadaan Actinomycetes terhadap pertumbuhan Rhizobium dalam bintil akar (Surtiningsih,et al. 2009)
Rhizobium masuk ke dalam akar kedelai salah satunya melalui rambut akar atau secara langsung ke titik munculnya akar lateral. Rhizobium menginfeksi akar leguminoceae melalui ujung-ujung bulu akar yang tidak berselulose, karena bakteri Rhizobium tidak dapat menghidrolisis selulose. Pada mulanya tanaman menghasilkan senyawa seperti flavonoids, sebagai akibat sekresi lipochitooligosaccharides (LCOs) oleh bakteri Rhizobium. Tahap berikutnya, LCOs membentuk nodul pada akar tanaman inang dan memicu proses infeksi sehingga sel berkembang abnormal sehingga membentul Nodul tempat hidup Rhizobium dalam hal bersimbiosa dengan tanaman dimana Rhizobium menambat nitrogen dari udara untuk tanaman dan Rhizobium mendapat makanan dar i sel tanaman disekitarnya
Induksi Ketahanan Sistemik oleh Rhizobakteria
Rhizobakteria dapat melakukan Indusi ketahanan sistemik atau Systemic acquired resistance (SAR) pada tanaman, yang mengakibatkan tanaman tahan terhadap serangan pathogen. Dalam hal ini, bakteri yang berada disekitar akar dapat memacu sel akar untuk menghasilkan senyawa yang mampu menghambat pertumbuhan pathogen, selanjutnya sel mengirimkan signyal ke sel lainnya agar menghasilkan senyawa toksik sehingga seluruh sel tanaman dikatakan tahan terhadap penyakit (Kuc, J. 1983, Hanuddin dan B. Marwoto. 2003). Ciri khas terjadinya peristiwa Systemic acquired resistance (SAR) pada tanaman, yaitu terjadinya akumulasi senyawa asam salisilat, asam jasmonik. ethylene serta pathogenesis related-protein (PR-protein) dalam tanaman yang sangat berperan dalam peningkatan ketahanan tanaman terhadap hama atau penyakit (Ryals et al, 1996; Zhang, et al. 2002)..
Ketahanan sistemik yang diinduksi oleh infeksi mikroorganisme baik yang patogenik maupun non patogenik telah banyak dipelajari pada tanaman Cucurbitae. Tanaman mentimun atau tanaman lain dari suku Cucurbitae dapat memperoleh ketahanan sistemik setelah sebelumnya diinfeksi dengan jamur Colletotrichum lagenarium terhadap patogen yang sama (Kloepper, dan Tuzun, S. 2004). Selain itu infeksi daun pertama dengan Tobacco Necrosis Virus (TNV) atau Cladosporium cucumerinum Ell. Et Arth. akan dapat melindungi tanaman dari serangan C. lagenarium. Perendaman benih semangka ke dalam suspensi inokulum
Pseudomonas sp dapat mengurangi kerusakan tanaman karena penyakit antraknose.
Demikian pula perlakuan benih mentimun ke dalam suspensi Pseudomonas mycophaga selama 24 jam dapat mengurangi antraknose sebesar 52-63 % (Caruso dan Kuc, 1979). Infeksi C. lagenarium atau TNV pada mentimun dapat pula menimbulkan ketahanan tanaman
terhadap serangan layu oleh Fusarium oxysporum f.sp. cucumerinum Snyder et Hansen (Gessler & Kuc, 1982).
Bakteri Pelarut Fosfat
Alternatif untuk meningkatkan efisiensi pemupukan Fosfat (P) dan untuk mengatasi rendahnya fosfat tersedia atau kejenuhan fosfat dalam tanah dapat dilakukan dengan memanfaatkan kelompok mikroorganisme pelarut fosfat sebagai pupuk hayati. Mikroorganisme pelarut fosfat adalah mikroorganisme yang dapat melarutkan fosfat sukar larut menjadi larut, baik yang berasal dari dalam tanah maupun dari pupuk, sehingga dapat diserap oleh tanaman. Ketersediaan P didalam tanah sangat rendah, karena P terjerap oleh mineral tanah dan senyawa organik serta terfiksasi Al,Fe,Mn,Ca dan dalam proses pelapukan bagan organic yang rendah. Bakteri Pelarut Fospat merupakan salah satu pupuk hayati yang dapat berperansebagai amelioran,penyedia unsur hara dan tidak terjadi pencemaran lingkungan. Berbagai spesies mikroba pelarut fosfat, antara lain Pseudomonas, Microccus,
Azotobacter, Bacillus, Flavobacterium, Penicillium, Sclerotium, Fusarium, dan Aspergillus,
berpotensi tinggi dalam melarutkan fosfat terikat menjadi fosfat tersedia dalam tanah, karena mikroba tersebut menghasilkan enzim fosfatase dan enzim fitase. Enzim fosfatase dapat memutuskan fosfat yang terikat oleh senyawa-senyawa organik menjadi bentuk yang tersedia bagi tanaman (Marista et al 2013)
Bakteri Penghasil Fitohormon
Bakteri akar tanaman dapat menghasilkan fitohormon, misalnya, Azotobacter sp dan
Azospirillum sp. Sebagai penghasil fitohormon, bakteri ini sangat berguna bagi tumbuhan
karena dengan adanya fitohormon tersebut maka tanaman akan tumbuh dengan cepat. Fitohormon adalah hormon tumbuhan yang berupa senyawa organik yang dibuat pada suatu tempat dibagian tanaman dan kemudian diangkut ke bagian lain, yang dengan konsentrasi rendah menghasilkan suatu dampak fisiologis pada sel tanaman yang signifikan. Peran suatu hormon adalah merangsang pertumbuhan, pembelahan sel, pemanjangan sel, dan ada yang menghambat pertumbuhan (Doke 1982; Istamar Syamsuri, 2007). Fitohormon yang dihasilkan bakteri ini adalah auksin, sitokinin, giberelin dan etilen. Hormon-hormon ini berperan penting dalam pertumbuhan tanaman dan masing-masing memiliki fungsi yang berbeda-beda pada suatu fase pertumbuhan suatu tanaman. Jika bakteri tersebut menghasilkan hormon tumbuh di sekitar akar, maka akan merang pembentukan bulu akar di permukaan akar sehingga bakteri Rhizobium mudah mempenetrasi untuk masuk ke sel akar tanaman.
BAB III. METODA PENELITIAN
Penelitian dilaksanakan di Laboratorium Ilmu penyakit Tumbuhan, rumah kaca Fakultas pertanian unud dan di lapangan di desa Peguyangan kangin, Denpasar, Penelitian lapangan dilakukan untuk mengamati kemampuan mikroba dalam merangsang bakteri Rhizobium membentuk bintil akar pada tanaman dan tahan terhadap serangan hama atau penyakit di lahan sawah , tahap-tahap penelitian meliputi;
Penelitian Tahun I
A. Isolasi Rhizobacteria Perangsang Bakteri Rhizobium dalam membentuk bintil akar kedele dan sebagai Pelarut Fosfat
Isolasi Rhizobakteria diambil dari permukaan akar (Rhizosfer) tanaman solanaceae, dan sebagai Pelarut Fosfat
Akar tanaman Solanaceae di gali hingga mendapatkan jaringan akar serabut, kemudian akar dicuci dengan air bersih hingga bebas dari tanahnya. Selanjutnya dikeringkan dengan kertas tissu dalam petri steril, setelah kering, akar dimasukan dalam tabung berisi air steril dan mengandung 10 % MgCl2, sambil di kocok kocok guna melepaskan lapisan eksudat tanaman yang ada dipermukaan akar, selanjutnya air yang berisi eksudat dan akar diambil untuk mendapatkan mikroba.
Isolasi dari kulit akar tanaman dilakukan dengan cara ; Akar dicuci kembali dengan air steril, selanjutnya dikeringakan dengan tissu steril. Kulit akar di kupas, dipotong kecil kecil. Potongan potongan akar ini diinokulasi secara terpisah antara kulit akar pada petri berisi media NA untuk mendapatkan biakan bakteri, biakan diinkubasi pada suhu kamar selama 2 – 4 hari. Setelah masa inkubasi berakhir, mikroba yang tumbuh di isolasi berdasarkan perbedaan bentuk, warna, bentuk tepi, dan bentuk permukaan koloni dan disimpan dalam media miring pada tabung reaksi.
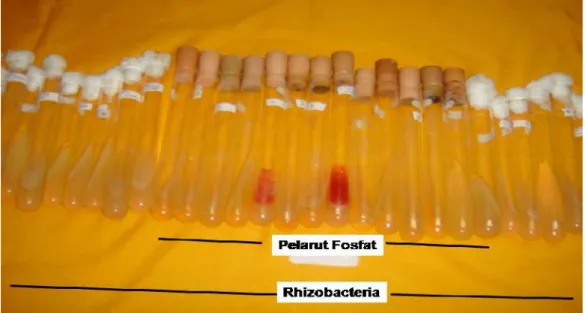
Selanjutnya untuk menguji bakteri tersebut sebagai pelarut fosfat, maka bakteri tersebut ditumbuhkan kembali pada media Pikovskaya + PCNB. Rhizobakteria yang tumbuh dengan membentuk zona bening mengelilingi koloni adalah Rhizobakteria pelarut Fosfat yang di cari pemurnian dilakukan mengikuti metoda Fein dan Coffly (1983). mikroba yang sudah murni di simpan pada agar miring dalam tabung reaksi dan di simpan pada ruang dingin –40C untuk Penelitian lebih lanjut
B. Seleksi Bakteri Rhizobium pembentuk Bintil Akar pada Tanaman Kedele
Untuk mendapatkan bakteri Rhizobium, dilakukan isolasi bakteri dalam bintil akar tanaman kedele. Untuk itu sampel tanaman kedele diperoleh dari seluruh lahan tanaman kedele sekabupaten di Bali. Tanaman kedele yang telah berumur sekitar 2 – 3 bulan di cabut sehingga seluruh akar yang mengandung bintil akar di peroleh. Di laboratorium akar di cuci bersih agar tanah yang melekat hilang sehingga tampak jelas bintil bintil akar. Selanjutnya akar di keringkan dalam kertas tissu steril, kemudian bintil bintil akar dilepas dari akar dan dimasukan dalam tabung reaksi berisi alkohol 75%, selama 5 menit, guna mensterilkan permukaan bintil akar dari mikroba, kemudian bintil akar kembali dikeringkan pada kertas tissu. Selanjutnya bintil bintil akar di belah memakai pisau skapel steril, dan diinokulasikan kedalam petri berisi media khusus untuk Rhizobium yaitu medium YEMA (Yeast Extract
Mannitol Agar) (Vincent, 1970) yang terdiri dari:
K2HPO40,5 g, MgSO47H2O 0,2 g, NaCl 0,1 g, CaCO3g, Mannitol 10 g, Yeast extract 3 g, PCNB 2 g, Agar 20 g, aquades 1.000 ml, dengan pH 6,8.
Biakan diinkubasi selama 2 – 4 hari pada suhu kamar dan dalam ruangan gelap, bakteri yang tumbuh diisolasi dan dibiakan kembali dalam media YEMA tanpa PCNB. Untuk mendapatkan bakteri Rhizobium pembentuk bintil akar pada tanaman kedele dilakukan uji Postulat Koch,
Uji Postulat Koch bakteri Rhizobium
Pengujian ini dilakukan dengan cara, menyiapkan biakan bakteri Rhizobium dalam media YEMA cair pada erlenmeyer, biakan diinkubasi dalam shaker selama 3 hari hingga biakan berwarna keruh hingga konsentrasi bakteri mencapai 106cfu/ml. Bersaam dengan itu disiapkan bak plastik ukuran tinggi 15 cm dan luas 250 cm2berisi tanah dicampur pasir 2 : 1 dan steril, tanah dilembabkan denagn air steril hingga mencapai kapasitas lapang dan ditauangkan biakan bakteri Rhizobium sebanyak 10 ml/ 5 cm2, dituangkan dalam tanah dan diaduk rata, kemudian tanah dalam bok diratakan dan ditanami dengan biji kedele dengan jarak tanam 5 cm. Tanaman di pelihara hingga berumur 15 atau 20 hari, setelah itu tanaman dicabut dan diamati apakah ada bintil akarnya, bakteri Rhizobium yang membentuk bintil akar adalah bakteri yang akan digunakan sebagai inokulum untuk penelitian selanjutnya.
C. Uji Pengaruh Rhizobakteria dari tanaman Solanaceae Pada tanaman kedelai
Mikroba Rhizobakteria hasil isolasi dari tanaman leguminosae diuji kemampuannya dalam memacu pembentukan senyawa penginduksi ketahanan sistemik pada tanaman kedele, dan pertumbuhan tanaman kedele serta hasil tanaman kedele di rumah kaca dilakukan dengan cara;
a. Disiapkan Sumber inokulum Rhizobakteria dari tanaman leguninosae
Ke tiga belas isolate Rhizobakteria dari tanaman leguninosae, masing masing di biakan pada media Potato pepton glukosa (PPG) cair dan diinkubasi selama 2 hari hingga media tampak keruh dan penuh ditumbuhi bakteri, selanjutnya larutan bakteri tersebut diencerkan sebanyak tiga kali hingga mendapatkan konsentrasi bakteri 106cfu/ml,
b. Disiapkan Sumber inokulum bakteri Rhizobium
Bakteri Rhizobium isolate Btl 8, dibiakan pada media YEM (Yeast Extract Mannitol) cair yang terdiri atas K2HPO40,5 g, MgSO47H2O 0,2 g, NaCl 0,1 g, CaCO3g, Mannitol 10 g, Yeast extract 3 g, PCNB 2 g, aquades 1.000 ml. dan di inkubasi selama 2 hari. selanjutnya larutan bakteri tersebut diencerkan sebanyak tiga kali hingga mendapatkan konsentrasi bakteri Rhizobium 106cfu/ml
c. Perlakuan benih
Disiapkan media humus yang bahan bakunya berasal dari limbah pembuatan biogas kotoran sapi. Media humus dikemas dalam kantong plastik masing-masing sebanyak 150 g dan disterilisasi memakai autoclave. Setelah media humus dingin, media diinokulasikan masing masing dengan 1 ml biakan Rhizobakteria dari tanaman leguninosae, perlakuan ini di ulang sebanyak 3 kali sehingga diperoleh 39 kantong inokulum dan satu kantong sebagai control. Kemudian media yang sudah berisi Rhizobakteria diinokulasi kembali dengan 1 ml biakan bakteri Rhizobium Btl 8. Selanjutnya media humus yang sudah diinokulasikan dengan Rhizobakteria dari tanaman leguninosae dan bakteri Rhizobium Btl 8 diinkubasi selama 30 hari, sambil setiap hari biakan di kocok. Benih kedelai sebelum ditanam terlebih dahulu diimbibisi pada media humus selama 24 jam sebanyak 50 biji kedele dalam 1 kantong humus mengandung Rhizobakteria.
d. Penanaman benih
Setelah benih kedele mendapatkan perlakuan Imbibisi Rhizobakteria dari tanaman leguninosae, benih kedele ditanam pada 2 kg media tanah campuran, tanah : pupuk kandang sapi (2 : 1) di dalam pot, dan humus bekas media imbibisi dicampurkan secara merata ke media tanam. Setiap pot di Tanami 4 benih kedele nantinya akan di perjarang
menjadi 2 tanaman. yang masing masing sudah mendapatkan perlakuan benih dengan Rhizobakteria pelarut fosfat sesuai dengan perlakuan yang di uji. Perlakuan yang di uji adalah 14 perlakuan yang terdiri dari 13 isolat Rhizobakteria dari tanaman leguninosae, dan satu control tampa perlakuan bakteri, yaitu dengan perlakuan air saja. Rancangan yang di gunakan adalah Rancangan Acak Lengkap (RAK).
Tanaman dipelihara hingga berbuah hingga bijinya siap panen tetapi tanaman belum kering dan dipanen.
Pada saat tanaman berumur 2 minggu, tanaman diinokulasi dengan virus penyebab penyakit mosaic, inokulasi dilakukan secara mekanis dengan memakai air perasan tanaman kedele sakit terserang penyakit Mosaic. Tanaman sebagai sumber inokulum di ambil dilapangan karena pada saat ini tanamn kedele petani banyak yang tersrang penyakit Mosaic. Metode inokulasi virus adalah;
Inokulasi virus dilakukan sat tanaman berumur 30 hari setelah tanam. Inokulum yang digunakan diperoleh dari tanaman kedelai yang ada di areal sawah Subak Angantaka, Desa Angantaka Kecamatan Abiansemal, Kabupaten Badung, yang menunjukkan gejala serangan CMV. Tanaman kedelai yang akan diinokulasi, daunnya yang masih muda dan sudah membuka sempurna (daun kedua dan ketiga dari ujung tunas) ditaburi dengan celite secara merata. Inokulasi dilakukan secara mekanik dengan menggunakan cotton bud. Konsentrasi inokulum yang digunakan adalah 1 mg/10 ml phosphate buffer pH 7. Inokulasi dilakukan antara pukul 17.00 sampai 18.00. Sehari setelah inokulasi, permukaan daun tanaman disiram dengan air untuk membersihkan celite
Selama pemeliharaan dilakukan pengamatan: 1. Tinggi tanaman,
2. Jumlah daun, 3. jumlah khlorofil
4. Gejala penyakit yang muncul pada tanaman, di uji dengan metode Elisa 5. jumlah Polong, jumlah biji dan Berat biji, pertanaman
6. Kemudian diamati juga kandungan senyawa Fenol, asam salisilat dan senyawa Peroksidase
Rhizobakteri yang mampu menghasilkan bintil akar dengan jumlah dan berat terbesar, serta mampu memberikan pertumbuhan tanaman kedele terbaik dan mampu melindungi tanaman dari serangan penyakit virus mosaic adalah Rhizobakteri pelarut fosfat terbaik
D. Identifikasi Spesies Rhizobakteria Pemacu Rhizobium membentuk Bintil akar terbaik
Identifikasi Spesies mikroba Bakteri sebagai penyebab Pemacu Rhizobium membentuk Bintil akar terbaik dan Spesies Rhizobium pembentuk bintil akar di lakukan dengan mengikuti metoda Bergeys manual, dengan mengamati sifat sifat kimiawi mikroba. Juga dilakukan dengan menggunakan KIT Mikrobac dilakukan di Lab. Ilmu Penyakit Tumbuhan FP Unud. Kemudian identifikasi di lalakukan secara molekuler menggukan PCR (Polymerase Chain Reaction) dengan menggunakan primer spesifik Prokaryot dilakukan di lab. Biologi Molekuler LIPI, Bogor, dengan memanfaatkan program BLAST-N (Basic Local Alignment Search Tool-Nucleotide) dan merunut ke Gen Bank NCBI
IV. HASIL PENELITIAN A. Isolasi Rhizobacteri
1. Isolasi Rhizobacteria dari Tanaman Solanacearum dan Leguminosae
Bakteri ini diisolasi dari berbagai daerah di Bali, yang bertujuan untuk mendapat rhizobakateria terbaik, mampu melarutkan fosfat dalam tanah dan mampu merangsang pertumbuhan bintil akar pada tanaman kedele. Diharapkan nantinya Rhizobakteria ini mampu menyediakan Unsur Nitrogen dan Fosfat bagi tanaman, isolate bakteri ada pada table 1
Tabel 1. Rhizobacteria dari Tanaman Solanacearum dan Leguminosae No Kode Isolat
Rhizobakteria
Jenis Solanaceae/ Leguminosae
Bahas Latin Tanaman Asal Tanaman daerah/Kabupaten
1 Rhi 1 Kacang Kara Mucuna pruriens Sading, Badung
2 Rhi 2 Gereng-gereng Crotalaria juncea Darmasaba, Badung
3 Rhi 3 Subya Stylosanthes
guianensis.
Gerih, Badung
4 Rhi 4 Kemerakan Caesalpinia
pulcherrima
Perang, Badung
5 Rhi 5 Turi Besar Sesbania grandiflora Perang, Badung
6 Rhi 6 Turi kecil Sesbania rostrata Perang, Badung
7 Rhi 7 Kacang panjang Vigna sinensis Darmasaba, Badung
8 Rhi 8 Gamal Gliricidia sepium Gerih Badung
9 Rhi 9 Lamtoro Leucaena glauca Perang, Badung
10 Rhi 10 Dapdap Erythrina variegate. Sading, Badung
11 Rhi 11 Kecipir Psophocarpus
tetragonolobus
Sading, Badung
12 Rhi 12 Kacang tanah Arachis hypogaea Sading, Badung
13 Rhi 13 Putri Malu Mimosa pudica Celuk Gianyar
14 Rhi 14 Lamtoro-1 Leucaena glauca Kediri, Tabana
15 Rhi 15 Lamtoro 2 Leucaena glauca Penitih, Denpasar
16 Rhi16 Gereng gereng Crotalaria juncea Tembau,Denpasar
17 Rhi17 Mirif Kecipir (Saga) Abrus precatorius Pegok, Denpasar
18 Rhi 18 Kembang Telang Clitoria ternatea Ubung, Denpasar
19 Rhi 19 Gamal Gliricidia sepium Sanur, Denpasar
20 Rhi 20 Kacang Sangketan Arachis pintoi Kerta, Gianyar
21 Rhi 21 Kacang Tanah akar Arachis hypogaea Antosari, Tabanan
22 Rhi 22 Undis akar, kerta Cajanus cajan Kerta, Gianyar
23 Rhi 23 Terung Kokak Solanum torvum Pedungan, Denpasar
24 Rhi 24 Undis akar, Cajanus cajan Sukasada Buleleng
25 Rhi 25 Terung Kokak, Solanum torvum Kediri, Tabanan
26 Rhi 25 Undis akar, grogak Cajanus cajan Grokgak Singaraja
27 Rhi 26 Terung Ranti 1 Solanum nigrum Kerta, Gianyar
28 Rhi 27 Terung rantil 2 Solanum nigrum Marga, Tabanan
29 Rhi 28 Kacang tanah D Arachis hypogaea Mendoyo Negara
31 Rhi 30 Undis akar c Cajanus cajan Kalibugbug, Singaraja
32 Rhi 32 Kacang Tanah A Arachis hypogaea Beraban, Tabanan
33 Rhi 33 Cabe 5 Capsicum annum Canggu, Badung
34 Rhi 34 Terong ranti4 Solanum nigrum Pegok, Denpasar
35 Rhi 35 Undis 4 Cajanus cajan Mayong, Singaraja
36 Rhi 36 Undis 3 Cajanus cajan Kubu, Singaraja
37 Rhi 37 Kaliandra Calliandra
calothrysus
Jagaraga, Singaraja
38 Rhi 38 Undis F Cajanus cajan Bondalem,Singaraja
39 Rhi 39 Kacang Panjang akar Vigna sinensis Mendoyo, Negara 40 Rhi 40 Kacang Tanah akar Arachis hypogaea Celuk, Gianyar
41 Rhi 41 Cabe 2 Capsicum annum Batu Bulan, Gianyar
42 Rhi 42 Buncis akar P Phaseolus vulgaris Payangan, Gianyar
43 Rhi 43 K. Panjang akar P Vigna sinensis Pemogan, Denpasar
44 Rhi 44 Buncis akar H Phaseolus vulgaris Padang Sambian
45 Rhi 45 Buncis akar B Phaseolus vulgaris Krambitan,Tabanan
46 Rhi 46 Kokak 2 Solanum torvum Sesetan, Denpasar
47 Rhi 47 Cabe 1 Capsicum annum Penebel, Tabanan
48 Rhi 48 Undis 2 Cajanus cajan Gitgit, Singaraja
49 Rhi 49 Kacang panjang Vigna sinensis Pupuan, Tabanan
50 Rhi 50 Kacang sangketan Arachis pintoi Kerta, Gianyar
51 Rhi 51 Undis 5 Cajanus cajan Jagaraga, Singaraja
52 Rhi 52 Terung ranti Solanum nigrum Tuak Ilang Tabanan
53 Rhi 53 Undis 1 Cajanus cajan Beratan Sukasada
54 Rhi 54 Terung ranti Solanum nigrum Desa Tunjuk Marga
55 Rhi 55 Kacang . Panjang X Vigna sinensis Sempidi, Tabanan
56 Rhi 56 Akasia Acacia auriculiformis Antosari, Tabanan
57 Rhi 57 Petai Parkia speciosa Desa Baha, Badung
58 Rhi 58 Kacang Panjang M Vigna sinensis Badjra, Tabanan
2. Pengujian Rhizobakteria sebagai Mikroba Pelarut Fosfat
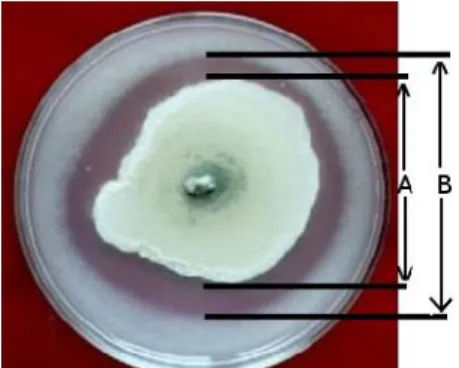
Isolat Rhizobakteria yang telah terkoleksi dari berbagai jenis tanaman solanaceae dibiakan pada media petri berisi media Pikovskaya + PCNB untuk mendapatkan biakan bakteri yang mampu melepaskan ikatan fosfat dari dalam tanah sehingga tersedia bagi tanaman biakan diinkubasi pada suhu kamar selama 2 – 4 hari. Setelah masa inkubasi berakhir, mikroba yang tumbuh dan membentuk zona bening yag melingkar disekeliling koloni adalah Rhizobakteria pelarut Fosfat, dari hasil pengujian diperoleh bahwa dari 58 isolat Rhizobakteria ternyata hanya 16 isolat Rhizobakteria sebagai pelarut Fosfat, hal ini dapat dilihat pada table 2. Sedangkan indeks efisiensi pelarutan fosfat (IEP), oleh Rhizobakteria dapat di ukur dengan menggunakan rumus sebagai berikut (Hefdiyah dan Maya Shovitri, 2014);
Diameter zona bening (B-A)
IEP = --- X 100 Dimeter koloni (A)
IEP = Indeks efisiensi pelarutan
Tabel 2. Rhizobakteria yang membentuk Zona bening mengelilingi koloni yang dibiakan pada media Pikovskaya + PCNB (Rhizobakteria pelarut fosfat) No Jenis Rhizobakteri pelarut fosfat Diameter Total (B) mm Diameter Koloni (A) mm Diameter Zona Bening (B-A) mm Indeks Efisiensi Pelarut Fosfat 1 Rhi 53 30,34 5,25 24,75 471 2 Rhi 26 23,75 11,50 12,25 107 3 Rhi 52 29,25 27,50 1,75 6,36 4 Rhi 55 37,25 6,50 30,75 473 5 Rhi 46 20,50 12,00 8,50 70,83 6 Rhi 38 66,25 60,00 6,25 10,42 7 Rhi 7 61,25 6,50 54,75 842 8 Rhi 36 61,25 6,25 55,00 880 9 Rhi 35 52,50 6,00 46,50 775 10 Rhi 51 39,50 6,75 32,75 485 11 Rhi 5 11,00 4,50 6,50 144 12 Rhi 58 11,00 8,00 3,00 37,50 13 Rhi 9 12,75 10,00 2,75 27,50 14 Rhi 6 14,25 11,00 3,25 29,55 15 Rhi 8 13,50 9,25 4,25 45,95 16 Rhi 48 14,50 5,75 8,75 152
Pada table 2, dapat dilihat bahwa Rhizobakteria terbaik adalah isolate Rhi 36 dan Rhi 35 (Rhizobakteri akar tanaman undis) diikuti oleh Rhi 51 dan Rhi 53 yang juga berasal dari tanaman Undis. Dari penelitian ini ternyata Rhizobakteria yang diambil dari akar tanaman undis sangat potensial berfungsi melarutkan fosfat dalam tanah dan di harapkan nantinya mampu meningkatkan produtivitas tanaman kedele
Gambar 1 Rhizobakteria di peroleh dari berbagai tanaman Lebuminosae dan Solanaceae
Gambar 2. Rhizobakteria yang merangsang pertumbuhan akar di gunakan untuk penelitian
B. Koleksi bintil akar dari tanaman kedele asal berbagai daerah penamana kedele, Penelitian ini dilakukan guna memperoleh Isolat bakteri Rhizobium yang dapat bersimbiose dengan tanaman kedelai dalam hal penyediaan Nitrogen, untuk itu dilakukan koleksi bintil akar pada tanamn kedele dari berbagai daerah yang merupakan lokasi tanaman kedele, selanjutnya akar di bersihkan dan di ambil bintil akar yang telah dilakukan strilisasi permukaan bintil, selanjutnya bintil akar di belah dan diinokulasikan pada media YEMA
(Yeast Extract Mannitol Agar), bakteri yang tumbuh kemudian di murnikan dan di simpan dalam media agar miring dalam tabung reaksi untuk penelitian lebih lanjut.
Untuk mengetahui apakah bakteri yang diperoleh tersebut dapat membentuk bintil akar serta kemampuannya membentuk bintil akar pada tanaman kedele, maka benih kedele di rendam dalam larutan bakteri rhizobium selama 10 menit kemudian di tanam pada media tanah dalam polybag, kemudian diamati setelah tanaman berumur 3 minggu jumlah dan berat bintil akar yang terbentuk pada akar tanamn kedele. Isolat yang membentuk bintil akar terbaik akan digunakan pada penelitian lebih lanjut. Koleksi tanaman kedele dapat dilihat pada table 3, dan hasil uji kemampuan rhizobium membentuk bintil akar dapat dilihat pada table 4
Tabel 3. Koleksi Rhizobium sp (dalam bintil akar) dari tanaman kedele asal berbagai daerah penanaman kedele,
No Kode Isolat Rhzobium
Jenis Solanaceae/ Leguminosae
Asal Tanaman Kedele daerah/Kabupaten
1 Btl 1 Kedele Kediri, Tabanan
2 Btl 2 Kedele Canggu, Badung
3 Btl 3 Kedele Beraban, Tabanan
4 Btl 4 Kedele Penatih, Denpasar
5 Btl 5 Kedele Kerobokan, Badung
6 Btl 6 Kedele Celuk, Gianyar
7 Btl 7 Kedele Uluwatu, Jimbaran
8 Btl 8 Kedele Pedungan, Denpasar
9 Btl 9 Kedele Pekutatan, Negara
10 Btl 10 Kedele Yeh embang, Negara
11 Btl 11 Kedele Antosari, Tabanan
Uji Postulat Koch, bakteri yang di duga Rhizobium dalam hal membentuk bintil akar pada tanaman kedele
Pada table 4, dapat dilihat bahwa semua isolate Rhizobium mampu membentuk bintil akar pada tanaman kedele, namun isolate Btl 8 mempunyai kemampuan lebih tinggi dalam pembentukan bintil akar di bandingkan isolate lainnya, isolate Btl 8, juga mampu meningkatkan pertumbuhan tanaman kedede di bandingkan dengan isolate lainnya. Selanjutnya isolate ini akan digunakan dalam penelitian berikutnya, dan diharapkan nantinya ada isolate Rhizobakteria yang mampu merangsang Rhizobium isolate Btl 8 agar mampu berasosiasi dengan akar tanaman kedele dalam hal menyediakan unsure Nitrogen bagi tanaman kedele
Tabel 4. Pertumbuhan tanaman kedelai dan kemampuan Rhizobium membentuk bintil akar (umur tiga minggu)
Jenis rhizobium
akar batang daun bintil akar
Berat basah (g) Berat kering (g) Berat basah (g) Berat kering (g) Berat basah (g) Berat kering (g) Jumlah (bh) Berat basah (g) Berat kering (g) Btl 1 0,79 0,11 2,80 0,45 3,44 0,54 26 0,22 0,05 Btl 2 0,77 0,10 2,36 0,34 3,35 0,45 24 0,18 0,04 Btl 3 0,66 0,11 2,73 0,42 3,44 0,53 22 0,18 0,04 Btl 4 1,09 0,12 2,87 0,45 3,68 0,55 32 0,21 0,04 Btl 5 0,48 0,08 2,68 0,39 2,82 0,43 26 0,11 0,02 Btl 6 1,19 0,14 3,30 0,51 4,45 0,64 31 0,21 0,05 Btl 7 0,96 0,11 2,76 0,43 3,61 0,51 26 0,17 0,04 Btl 8 1,50 0,17 2,58 0,40 4,34 0,64 26 0,24 0,05 Btl 9 1,19 0,12 2,68 0,38 4,46 0,61 27 0,27 0,06 Btl 10 1,10 0,15 2,67 0,38 4,34 0,61 34 0,20 0,05 Btl 11 1,30 0,12 2,69 0,38 4,08 0,57 36 0,19 0,04
Gambar 3. Perlakuan BTL 8 (Rhizobium 8), mempunyai kemampuan besimbiose dengan tanaman lebih baik adri perlakuan lainnya
C. Uji Pengaruh Rhizobakteria dari tanaman Solanaceae terhadap pertumbuhan tanaman kedelai
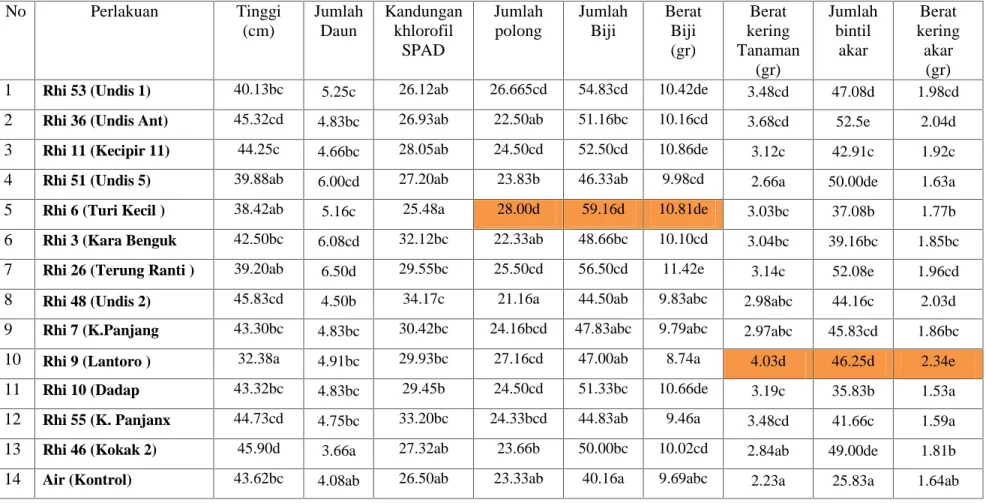
Penelitian ini merupakan penelitian rumah kaca yang sedang berjalan sampai saat ini yang penanamannya di lakukan pada tanggal 30 Juni 2015 adapun perlakuannya adalah 13 isolat Rhizobakteria pelarut fosfat sebagai hasil isolasi dari berbagai tanaman solanaceae, dan pemberiannya di campur dengan Isolat bakteri Rhizobium Btl 8. Cara kerjanya adalah, isolate Rhizobakteria pelarut fosfat, diinkubasi bersama isolate Rhizobium Btl8 dalam media tanah Humus selama 30 hari, setelah itu benih tanaman kedele dimasukan dalam campuran humus tersebut dan diinkubasi selama 1 hari. Setelah masa inkubasi berakhir, benih di tanam dalam pot plastic berisi media tanah. Pengamatan pertumbuhan vegetative tanaman di lakukan setiap minggu, sedangkan pembentukan bintil akar dilakukan pada saat akan panen. Hasil pengamatan pengaruh pemberian Rhizobacteria terhadap pertumbuhan tanaman kedele dapat dilihat pada table 5.
Tabel. 5. Pertumbuhan tanaman kedele setelah di berikan Rhizobakteria pelarut Fosfat dan Bakteri Rhizobium No Perlakuan Rhizobakteria dari tanaman Tinggi (cm) Jml. Daun Trifoliate (bh) Kandungan khlorofil SPAD 1 Rhi 53 (Undis 1) 40.13bc 5.25c 26.12ab 2 Rhi 36 (Undis Ant) 45.32cd 4.83bc 26.93ab 3 Rhi 11 (Kecipir 11) 44.25c 4.66bc 28.05ab 4 Rhi 51 (Undis 5) 39.88ab 6.00cd 27.20ab 5 Rhi 6 (Turi Kecil ) 38.42ab 5.16c 25.48a 6 Rhi 3 (Kara Benguk ) 42.50bc 6.08cd 32.12bc 7 Rhi 26 (Terung Ranti ) 39.20ab 6.50d 29.55bc 8 Rhi 48 (Undis 2) 45.83cd 4.50b 34.17c 9 Rhi 7 (K.Panjang y) 43.30bc 4.83bc 30.42bc 10 Rhi 9 (Lamtoro ) 32.38a 4.91bc 29.93bc 11 Rhi 10 (Dadap ) 43.32bc 4.83bc 29.45b 12 Rhi 55 (K. Panjang x) 44.73cd 4.75bc 33.20bc 13 Rhi 46 (Kokak 2) 45.90d 3.66a 27.32ab 14 Air (Kontrol) 43.62bc 4.08ab 26.50ab
Pada table 5, tampak bahwa Rhizobakteri isolate Rhi 46 berasal dari tanaman Terung Kokak, mampu meningkatkan pertumbuhan tanaman tertinggi di bandingkan dengan perlakuan lainnya kemudian diikuti oleh Rhi 36 (undis) dan isolate Rhi 48 yang juga berasal dari tanaman undis, dan terendah pada perlakuan Rhi 9 (dari lamtoro). Sedangkan jumlah daun yang dihasilkan paling tinggi pada perlakuan Rhi 26 (dari terung ranti) namun jumlah daun terendah di hasilkan oleh perlakuan Rhi 46 ( dari terung kokak). Jumlah klorofil pada
daun tanaman kedele tertinggi dihasilkan oleh perlakuan Rh 48 (dari Undis) dan jumlah kolrofil terendah pada perlakuan Rhi 6 (turi kecil). Kemudian pengaruh pemberian Rhizobakteria terhadap berat kering tanaman, berat kering akar dan jumlah bintil akar dapat dilihat pada table 6.
Pada table 6, walaupun peralakuan Rhi 46, menghasilkan tanaman tertinggi namun berat kering tanaman pada perlakuan itu ternyata cukup rendah, ini menandakan kandungan Air pada tanaman dengan perlakuan Rhi 46 (terung kokak) cukup tinggi, dibandingkan dengan pemberian perlakuan Rhi 9 (dari lamtoro) tanaman nya tidak begitu tinggi namun berat kering tanaman paling berat.
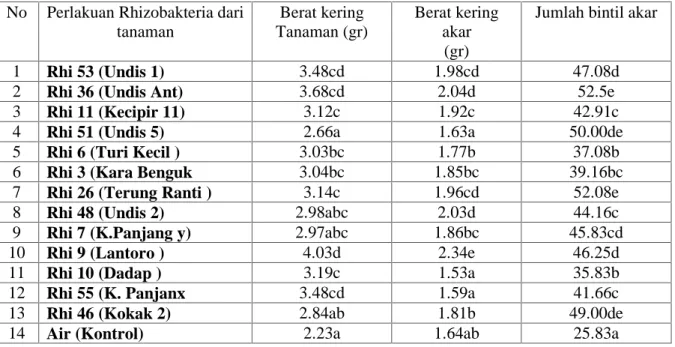
Tabel 6. Pengaruh Rhizobakteria pelarut fosfat dan bakteri Rhizobium terhadap berat kering tanaman, berat kering akar dan jumlah bintil akar tanaman kedele
No Perlakuan Rhizobakteria dari tanaman Berat kering Tanaman (gr) Berat kering akar (gr)
Jumlah bintil akar
1 Rhi 53 (Undis 1) 3.48cd 1.98cd 47.08d 2 Rhi 36 (Undis Ant) 3.68cd 2.04d 52.5e 3 Rhi 11 (Kecipir 11) 3.12c 1.92c 42.91c 4 Rhi 51 (Undis 5) 2.66a 1.63a 50.00de 5 Rhi 6 (Turi Kecil ) 3.03bc 1.77b 37.08b 6 Rhi 3 (Kara Benguk 3.04bc 1.85bc 39.16bc 7 Rhi 26 (Terung Ranti ) 3.14c 1.96cd 52.08e 8 Rhi 48 (Undis 2) 2.98abc 2.03d 44.16c 9 Rhi 7 (K.Panjang y) 2.97abc 1.86bc 45.83cd 10 Rhi 9 (Lantoro ) 4.03d 2.34e 46.25d
11 Rhi 10 (Dadap ) 3.19c 1.53a 35.83b
12 Rhi 55 (K. Panjanx 3.48cd 1.59a 41.66c 13 Rhi 46 (Kokak 2) 2.84ab 1.81b 49.00de
14 Air (Kontrol) 2.23a 1.64ab 25.83a
Pada table 6, tampak perlakuan Rhi 9 (dari lamtoro) dan Rhi 53 dari undis mampu merangsang akar tanaman kedele dan diikuti oleh perlakuan Rhi 53, serta Rhi 26.
Namun pengaruh Rhizobakteria terhadap pertumbuhan bakteri membentuk bintil akar pada tanaman kedele tampak bahwa perlakuan Rhi 26 (dari terung Ranti) dan Rhi 46 ( dari terung kokak) memacu pertumbuhan bintil akar terbanyak pada akar tanaman kedele, dan pembentukan bintil akar terendah dihasilkan oleh perlakuan Kontrol, yaitu tampa aplikasi rhizobakteria. Jika diamati dari penelitian pengaruh Rhizobakteria pelarut fosfat terhadap pertumbuhan begetatif tanaman kedele adalah perlakuan Rhi 9 ( Rhizobakteria dari tanaman lamtoro). Pengaruh aplikasi Rhizobakteria terhadap produksi tanaman kedele dapat dilihat pada Tabel 7.
Pengaruh aplikasi Rhizobakteria terhadap produksi tanaman kedele, pada table 7 tam pak jelas bahwa perlakuan Kontrol ( tanaman tidak diberikan Rhizobakteria ) menghasilkan produksi panen terendah di bandingkan dengan tanaman yang mendapatkan aplikasi Rhizobakteria pelarut Fosfat
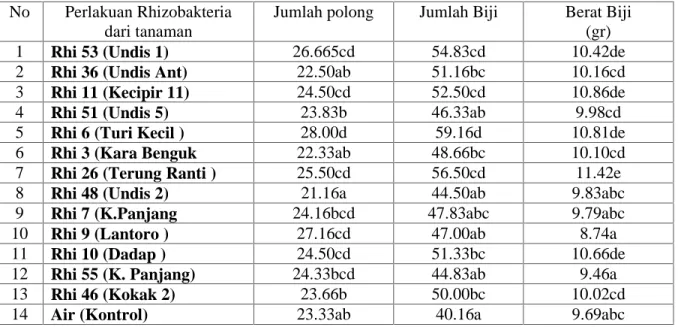
Tabel 7. Produksi tanaman kedele setelah di berikan Rhizobakteria pelarut Fosfat dan Bakteri Rhizobium
No Perlakuan Rhizobakteria dari tanaman
Jumlah polong Jumlah Biji Berat Biji (gr) 1 Rhi 53 (Undis 1) 26.665cd 54.83cd 10.42de 2 Rhi 36 (Undis Ant) 22.50ab 51.16bc 10.16cd 3 Rhi 11 (Kecipir 11) 24.50cd 52.50cd 10.86de 4 Rhi 51 (Undis 5) 23.83b 46.33ab 9.98cd 5 Rhi 6 (Turi Kecil ) 28.00d 59.16d 10.81de 6 Rhi 3 (Kara Benguk 22.33ab 48.66bc 10.10cd 7 Rhi 26 (Terung Ranti ) 25.50cd 56.50cd 11.42e 8 Rhi 48 (Undis 2) 21.16a 44.50ab 9.83abc 9 Rhi 7 (K.Panjang 24.16bcd 47.83abc 9.79abc 10 Rhi 9 (Lantoro ) 27.16cd 47.00ab 8.74a 11 Rhi 10 (Dadap ) 24.50cd 51.33bc 10.66de 12 Rhi 55 (K. Panjang) 24.33bcd 44.83ab 9.46a 13 Rhi 46 (Kokak 2) 23.66b 50.00bc 10.02cd 14 Air (Kontrol) 23.33ab 40.16a 9.69abc
Pada table 7 tampak perlakuan Rhi 6 (dari turi kecil) menghasilkan jumlah polong terbanyak, jumlah biji terbanyak dan berat biji terbesar di bandingkan dengan perlakuan lainya, jadi di sini tampak jelas bahwa rhizobakteri pelarut fosfat yang berasaal dari tanaman turi kecil perpotensi untuk digunakan sebagai pupuk biologi untuk tanaman kedele. Namun juga tampak bahwa Rhi 26 (terung ranti) dan Rhi 46 (terung kokak), walaupun menghasilkan jumlah polong yang lebih rendah, namun mampu juga menghasilkan berat biji yang lebih besar.
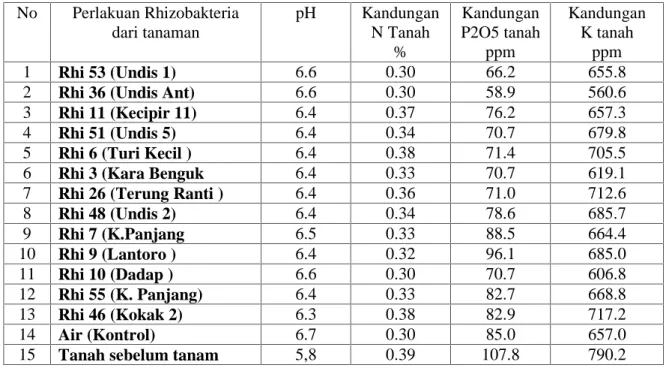
Pada table 8, tampak pengaruh Rhizobakteria pelarut fosfat sudah bekerja, hal ini dapat dilihat pada perlakuan Rhi 53 dan Rhi 36 yang semuanya rizobakteri berasal dari tanaman undis berasil melarutkan fosfat yang terikat dalam tanah dan di serap oleh tanaman, maka kandungan P dalam tanah pada kedua perlakuan itu lebih rendah dari perlakuan lainnya. Rhizo bacteria dari tanaman lamtoro Rhi 9 dan dari tanaman kacang panjang Rhi 7, posfatnya lebih sedikit yang bisa diserap tanaman karena kandungan fosfat dalam tanah pada perlakuan ini masih tinggi.
Tabel 8. Produksi tanaman kedele setelah di berikan Rhizobakteria pelarut Fosfat dan Bakteri Rhizobium No Perlakuan Rhizobakteria dari tanaman pH Kandungan N Tanah % Kandungan P2O5 tanah ppm Kandungan K tanah ppm 1 Rhi 53 (Undis 1) 6.6 0.30 66.2 655.8 2 Rhi 36 (Undis Ant) 6.6 0.30 58.9 560.6 3 Rhi 11 (Kecipir 11) 6.4 0.37 76.2 657.3 4 Rhi 51 (Undis 5) 6.4 0.34 70.7 679.8 5 Rhi 6 (Turi Kecil ) 6.4 0.38 71.4 705.5 6 Rhi 3 (Kara Benguk 6.4 0.33 70.7 619.1 7 Rhi 26 (Terung Ranti ) 6.4 0.36 71.0 712.6 8 Rhi 48 (Undis 2) 6.4 0.34 78.6 685.7 9 Rhi 7 (K.Panjang 6.5 0.33 88.5 664.4 10 Rhi 9 (Lantoro ) 6.4 0.32 96.1 685.0 11 Rhi 10 (Dadap ) 6.6 0.30 70.7 606.8 12 Rhi 55 (K. Panjang) 6.4 0.33 82.7 668.8 13 Rhi 46 (Kokak 2) 6.3 0.38 82.9 717.2 14 Air (Kontrol) 6.7 0.30 85.0 657.0
15 Tanah sebelum tanam 5,8 0.39 107.8 790.2
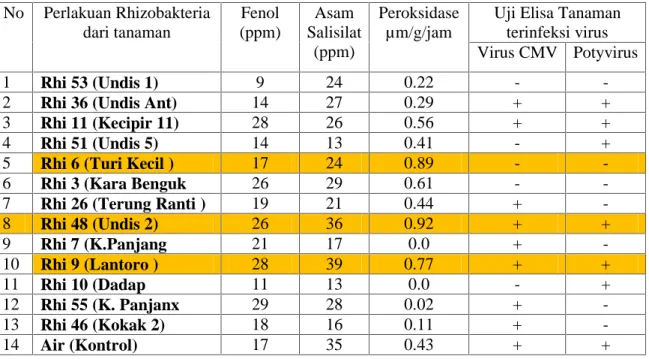
Dengan pemberian Rhizobakteria diharapkan tanaman dapat menghasilkan senyawa senyawa fenol yang dapat menghambat perkembangan pathogen dan sertangga hama pada tanaman kedele. Jumlah senyawa fenol, asam salisilat dan senyawa peroksidase yang mengakibat tanaman tahan terhadap pathogen dapat dilihat pada table 9. Pada table 9, tampak perlakuan Rhi 6 ( dari tanaman turi kecil) dan Rhi 48 ( dari tanamn undis) menghasilkan senyawa peroksidase tertinggi ini menandakan tanaman itu akan tahan terhadap serangan pathogen, kemudian diikuti oleh perlakuan Rhi 9 (dari tanaman lamtoro) dan Rhi 11 (dari tanaman kecipir). Pada penelitian ini tampak bahwa perlakuan Rhi 7 (K.Panjang), tidak menghasilkan peroksidase, tetapi menghasilkan asam salisilat dan senyawa fenol yang tinggi.
Pada table 9, tampak perlakuan Rhi 6 ( dari tanaman turi kecil) dan Rhi 48 ( dari tanamn undis) menghasilkan senyawa peroksidase tertinggi ini menandakan tanaman itu akan tahan terhadap serangan pathogen, kemudian diikuti oleh perlakuan Rhi 9 (dari tanaman lamtoro) dan Rhi 11 (dari tanaman kecipir). Namun pada penelitian ini juga tampak bahwa kontrol juga menghasilkan senyawa peroksidase, senyawa fenol dan asam salisilat yang cukup tinggi. Mungkin disebabkan karena akar tanaman tidak terganggu oleh bakteri, di bandingkan dengan Rhi 53 (Undis 1), Rhi 36 (Undis Ant) dan Rhi 7 (K.Panjang).
Tabel 9. Kadungan senyawa Fenol, asam Salisilat, Peroksidase serta tanaman terserang Virus CMV dan Potyvirus pada tanaman kedele setelah diaplikasi dengan Rhizobakteria pelarut Fosfat. No Perlakuan Rhizobakteria dari tanaman Fenol (ppm) Asam Salisilat (ppm) Peroksidase µm/g/jam
Uji Elisa Tanaman terinfeksi virus Virus CMV Potyvirus
1 Rhi 53 (Undis 1) 9 24 0.22 -
-2 Rhi 36 (Undis Ant) 14 27 0.29 + +
3 Rhi 11 (Kecipir 11) 28 26 0.56 + +
4 Rhi 51 (Undis 5) 14 13 0.41 - +
5 Rhi 6 (Turi Kecil ) 17 24 0.89 -
-6 Rhi 3 (Kara Benguk 26 29 0.61 -
-7 Rhi 26 (Terung Ranti ) 19 21 0.44 +
-8 Rhi 48 (Undis 2) 26 36 0.92 + + 9 Rhi 7 (K.Panjang 21 17 0.0 + -10 Rhi 9 (Lantoro ) 28 39 0.77 + + 11 Rhi 10 (Dadap 11 13 0.0 - + 12 Rhi 55 (K. Panjanx 29 28 0.02 + -13 Rhi 46 (Kokak 2) 18 16 0.11 + -14 Air (Kontrol) 17 35 0.43 + +
Jika di amati pengaruh senyawa senyawa yang terbentuk pada saat reaksi penginduksi ketahanan sistemit, ternyata senyawa fenol, asam salisilat dan peroksidase, tidak mempengaruhi tanaman taham terhadap virus, hal ini dapat dilihat pada table 9, bahwa perlakuan Rhi 9 (dari lamtoro) dan Rhi 48 (dari Undis) memproduksi ketiga senyawa tersebut dalam jumlah yang cukup tinggi, namun tanaman terserang virus CMV dan Potyvirus, Sedangkan pada perlakuan Rhi 6 (dari tanamn turi) menghasilkan peroksidase tinggi demikian juga fenol dan asam salisilat, tahana terhadap kedua virus tersebut, jadi dari pengamatan ini bisa dikatakan ada suatu senyawa lain yang dibentuk oleh tanaman yang terinduksi oleh Rhizobakteria, dan senyawa tersebut perlu diteliti lebih lanjut. Pengaruh perlakuan Rizobakteria terhadap pertumbuhan tanaman dapat dilihat pada table 9
Virus Potyvirus Virus CMV
Gambar. 4. Tanaman sakit karena Virus Mosaic
27
Tabel 9. Pengaruh pemberian Rhizobakteria terhadap pertumbuhan tanaman kedele (rata rata/ per tanaman)
No Perlakuan Tinggi (cm) Jumlah Daun Kandungan khlorofil SPAD Jumlah polong Jumlah Biji Berat Biji (gr) Berat kering Tanaman (gr) Jumlah bintil akar Berat kering akar (gr) 1 Rhi 53 (Undis 1) 40.13bc 5.25c 26.12ab 26.665cd 54.83cd 10.42de 3.48cd 47.08d 1.98cd 2 Rhi 36 (Undis Ant) 45.32cd 4.83bc 26.93ab 22.50ab 51.16bc 10.16cd 3.68cd 52.5e 2.04d 3 Rhi 11 (Kecipir 11) 44.25c 4.66bc 28.05ab 24.50cd 52.50cd 10.86de 3.12c 42.91c 1.92c 4 Rhi 51 (Undis 5) 39.88ab 6.00cd 27.20ab 23.83b 46.33ab 9.98cd 2.66a 50.00de 1.63a 5 Rhi 6 (Turi Kecil ) 38.42ab 5.16c 25.48a 28.00d 59.16d 10.81de 3.03bc 37.08b 1.77b 6 Rhi 3 (Kara Benguk 42.50bc 6.08cd 32.12bc 22.33ab 48.66bc 10.10cd 3.04bc 39.16bc 1.85bc 7 Rhi 26 (Terung Ranti ) 39.20ab 6.50d 29.55bc 25.50cd 56.50cd 11.42e 3.14c 52.08e 1.96cd 8 Rhi 48 (Undis 2) 45.83cd 4.50b 34.17c 21.16a 44.50ab 9.83abc 2.98abc 44.16c 2.03d 9 Rhi 7 (K.Panjang 43.30bc 4.83bc 30.42bc 24.16bcd 47.83abc 9.79abc 2.97abc 45.83cd 1.86bc 10 Rhi 9 (Lantoro ) 32.38a 4.91bc 29.93bc 27.16cd 47.00ab 8.74a 4.03d 46.25d 2.34e
11 Rhi 10 (Dadap 43.32bc 4.83bc 29.45b 24.50cd 51.33bc 10.66de 3.19c 35.83b 1.53a
12 Rhi 55 (K. Panjanx 44.73cd 4.75bc 33.20bc 24.33bcd 44.83ab 9.46a 3.48cd 41.66c 1.59a 13 Rhi 46 (Kokak 2) 45.90d 3.66a 27.32ab 23.66b 50.00bc 10.02cd 2.84ab 49.00de 1.81b
KESIMPULAN
Dari hasil penelitian ini di peroleh beberapa kesimpulan yang cukup ber manfaat untuk mengembangkan kedele di lahan sawah yaitu;
1. Rhizobakteria yang diperoleh berbagai akar tanaman Solanaceae dan tanaman Leguminosae di jumpai 16 isolate bakteri yang bersifat pelarut fosfat pelarut fosfat dalam tanah.
2. Rhizobakteria yang di isolasi dari akar tanaman Undis mempunya kemampuan yang tinggi sebagai pelarut fosfat di bandingkan dengan isolate lainnya
3. Bakteri yang mampu membentuk bintil akar dan hidup bersimbiosis dengan tanaman kedele adalah isolate Rhizobium Btl 8, isolate ini berasal dari akar tanaman kedele yang tumbuh di daerah Pedungan denpasar.
4. Untuk memacu pertumbuhan vegetative isolate terbaik adalah Rhizobakteria Rhi 6 (dari turi kecil), Untuk memacu pertumbuhan Generatif terbaik adalah isolate Rhizobakteria Rhi 9 ( dari lamtoro)
5. Rhizobakteri pelarut fosfat yang berpotensi sebagai penginduksi ketahanan sistemik tanaman kedele terhadap pathogen virus CMV dan Potyvirus adalah Rhi 6 dari tanaman turi kecil, Rhi 53 dari tanamn undis dan Rhi 6 dari tanaman kara benguk. Diduga ketiga isolate tersebut menginduksi tanaman dengan membentuk senyawa kimia yang bukan senyawa fenol, asam salisilat dan peroksidase
DAFTAR PUSTAKA
Alexander, M. 1977. Introduction to Soil Microbiology. John Willey and Son.New York. Adisarwanto, T. dan R. Wudianto. 1999. Meningkatkan Hasil Panen Kedelai di Lahan
Sawah-Kering-Pasang Surut. Penebar Swadaya. Bogor. 86 hal
Etha Marista, S. Khotimah, R. Linda. 2013 Bakteri Pelarut Fosfat Hasil Isolasi dari Tiga Jenis Tanah Rizosfer Tanaman Pisang Nipah (Musa paradisiaca var. nipah di Kota Singkawang. Protobiont, 2013. Vol 2 (2): 93 – 101
Doke, N., K. Tomiyama and N. Furuichi. 1982. Elicitation and supression of hypersensitive
response in host-parasite specificity. pp 79-96 Dalam Yasuji Asada, W.R.
Bushnell, Seiji Ouchi, and C.P. Vance (Eds.) Plant infection, The Physiological
and biochemical basis. Japan Scientific Societies Press, Tokyo
Hanuddin, W. Nuryani, E. Silfia, I. Jadnika dan B. Marwoto 2010. Formulasi biopestisida berbahan aktif Bacillus subtilis dan Pseudomonas flourescens dan Corynebacterium sp nonpatogenik untuk mengendalikan penyakit karat pada krisan. J. Hort. 20(3). 247-261. 2010
Hanuddin dan B. Marwoto. 2003. Pengendalian penyakit layu bakteri dan akar gada pada tomat dan Caisim menggunakan Pseudomonas florescens. J. Hort. 13 (2); 58-66.2003.
Hapsoh, 2008. Pidato pengukuhan Guru Besar, Universitas Sumatra Utara, 14 Juni 2008 Hidayat A, Mulyani A. 2002. Lahan Kering untuk Pertanian. Di dalam:
Adimihardja A, Mappaona, Saleh A (Penyunting). Teknologi Pengelolaan Lahan Kering Menuju Pertanian Produktif dan Ramah Lingkungan. Bogor: Puslitbangtanak. hlm 1-34.
Hoerussalam, Aziz Purwantoro, dan Andi Khaeruni 2013. Ketahanan tanaman jagung (zea
mays l.) terhadap penyakit bulai melalui seed treatment serta pewarisannya pada
generasi S1. Ilmu Pertanian Vol. 16 No.2, 2013 : 42 – 59
Gaur, A.C. 1981. Phosphomicroorganism and Varians Transformation in Compost Technology. FAO Project Field Document 13 : 106-111.
Good, RN, Z. Kiraly and KR Wood. 1986. The biochemistry and physiology of plant disease. University of Mssouri, Press. Columbus
Kuc, J. 1983. Induced systemic resistance in plant caused by fungi and bacteria, pp: 192-221
dalam B.J. Deveral (Eds.), The dynamics host devence. Acad. Press, Sydney, New
York, London
Kloepper, J.W., Wei, L., Tuzun, S. 2004. Induced systemic resistance to cucumber diseases and increased plant growth by plant growth promoting rhizobacteria under field conditions. Phytopathology. 86: 221-224.
Purwaningsih, 2003. Pengaruh mikroba tanah terhadap pertumbuhan dan hasil panen kedelai (Glycine max L). Berita Biologi 5; 373-378
Rachman. S, (2002), Penerapan Pertanian Organik, Penerbit Kanisius, Yogyakarta.
Rao, N.S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Edisi Kedua. Jakarta: UI-Press.
Rukmana, S. K. dan Y. Yuniarsih. 1996. Kedelai, Budidaya Pasca Panen. Penerbit Kanisius. Yogyakarta. 92 hal
Susanto, R. 2002. Penerapan Pertanian Organik. Kanisius. Yogyakarta
Surtiningsih, T; Farida dan T. Nurhayati. 2009. Biofertilisasi Rhizobium pada tanaman kedelai (Glycine max (L). MERR). Berk.Penel. Hayati. 15 (1-5. 2009.
Taufik. M, A, Rahman, A. Wahab, dan SH.Hidayat . 2010. Mekanisme ketahanan terinduksi oleh plant growth promoting rhizobakteria (PGPR) pada tanaman cabai terinfeksi cucumber mosaic virus (CMV). J. Hort. 20(3). 274-283
Tomiyama, K. 1982. Hypersensitive cell death. Its significance and physiology, pp. 329-344
dalam Yasuji Asada, W.R. Bushnell, Seiji Ouchi, and C.P. Vance (Eds.) Plant infection, the pysiological and biochemical basis. Japan Scientific Societies Press,
Tokyo
Waluyo, L., 2008, Teknik Metode Dasar Mikrobiologi, Universitas Muhamadiyah Malang Press, Malang. Widawati, S. dan Suliasih, 2006, Populasi Bakteri
Zhang, S., Reddy M.S., Klopper J.W. 2002. Development of assay for assessing induced systemic resistance by plant growth-promoting rhizobacteria against blue mold of tobacco. Biol Control. 23: 79-86.
LOGBOOK PENELITIAN TAHAP I
HIBAH BERSAING TAHUN ANGGARAN 2015PEMANFAATAN RHIZOBAKTERIA DARI TANAMAN SOLANACEAE UNTUK MEMACU PERTUMBUHAN BAKTERI RHIZOBIUM SP DALAM
PEMBENTUKAN BINTIL AKAR DAN MENGINDUKSI KETAHANAN SISTEMIK TANAMAN KEDELAI (GLYCINE MAX L. MERRIL) TERHADAP HAMA DAN
PENYAKIT DI LAHAN SAWAH
Peneliti Utama
Prof.Dr.Ir. Made Sudana, MS Anggota Peneliti
1. Dr. Gst. Ngr. Alit Susanta Wirya, SP. MAgr 2. Ir. I Gusti Ngurah Raka, MS
.
Dibiayai olehDirektorat Penelitian dan Pengabdian kepada Masyarakat Direktorat Jendral Pendidikan Tinggi
Kementerian Pendidikan dan Kebudayaan
Sesuai dengan Surat Perjanjian Penugasan Pelaksanaan Penelitian Nomor: 10/UN14.2/PNL.01.03.00/2015, tanggal 3 Maret 2015
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS UDAYANA
Juni 2015
34 Judul Penelitian:
Pemanfaatan rhizobakteria dari tanaman solanaceae untuk memacu pertumbuhan bakteri rhizobium sp dalam pembentukan bintil akar dan menginduksi ketahanan sistemik tanaman kedelai (glycine max l. merril) terhadap hama dan penyakit di lahan sawah
Kegiatan Penelitian yang telah di Lakukan hingga bulan Juni 2015 adalah;
No. Tanggal Uraian/Kegiatan Hasil kegiatan Keterangan
(1) (2) (3) (4) (5)
1 17 Maret 2015
Persiapan penelitian, menyiapan peralatan laboratorium dipelukan serta membersihkan mensterilisasi peralatan dan ruangan laboratorium,
Peralatan ruangan laboroatorium telah bersih dan siap di gunakan,
19 Maret 2015
Membeli bahan bahan dan peralatan untuk pengambilan sampel di lapangan
Peralatan untuk pengambilan sampel telah siap
2 23 April 2015
Membeli bahan kimia untuk membuat media PDA, NA, YME dan media Pikovskaya + PCNB dan bahan kimia untuk reagen penelitian
Senyawa kimia untuk membuat media biakan dan untuk reagen penelitian tersedia
3 26 April 2015
Membuat media PDA, NA, YME dan media Pikovskaya + PCNB Dan mempersiapkan media miring untuk penyimpanan biakan mikroba
Memperoleh media biakan steril untuk memperbanyak miroba 4 11-15 Mei
2015
Pencarian akar tanaman solanaceae dan leguminosae serta koleksi bintil akar tanaman kedele di seluruh bali selama 4 hari,
Akar tanaman solanacae terkoleksi dan bintil akar kedele tersedia untuk bahan penelitian 5 18 – 19 Mei Membersihkan sampel di laboratorium dan pengeringan udara untuk Sampel tanaman telah bersih dan
35
2015 sampel siap untuk digunakan penelitian
6 20 Mei – 3 Juni 2015
Isolasi Rhizobacteria dari tanah disekitar perakaran tanaman Solanaceae
Diperoleh biakan mikroba dari masing masing tanaman Solanaceae
7 5 -11 Juni 2015
Koleksi Rhizobakteria hasil isolasi pada media NA untuk penelitian lebih lanjut
Memperoleh mikroba
Rhizobacteria segar yang dapat digunakan dalam penelitian 8 12 -17 Juni
2015
Seleksi Bakteri Rhizobium pembentuk Bintil Akar pada Tanaman Kedele Diperoleh biakan yang mamapu tumbuh di media YME yang diduga Rhizobium
9 18-25 Juni 2015
Uji Postulat Koch kemampuan Rhizobium hasil isolasi untuk membentuk bintil akar pada tanaman kedele
Diperoleh bakteri Rhizobium yang mampu membentuk bintil akar pada tanaman sehingga mampu menyediakan unsur N bagi tanaman
10 30 Juni 2015 Uji Pengaruh Rhizobakteria dalam hal memacu pertumbuhan tanaman kedele, dengan cara penanaman benih kedele yang sudah mendapat perlakuan Rhizobakteria