IKAN BUDIDAYA
INDRA LESMANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2010
Dengan ini saya menyatakan bahwa tesis dengan judul ”Produksi Dan Bioaktivitas Protein Rekombinan Hormon Pertumbuhan Dari Tiga Jenis Ikan Budidaya” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Juni 2010
Indra Lesmana NRP.C151070191
INDRA LESMANA. Production and Bioactivity of Recombinant Protein for Growth Hormone of Three Cultured Fish Species. Under direction of AGUS OMAN SUDRAJAT, and ODANG CARMAN
This study was aim to produce the growth hormone recombinant protein (rGH) of giant grouper (Epinephelus lanceolatus), giant gouramy (Osphronemus gouramy), and common carp (Cyprinus carpio) and compare their bioactivity by using of Nile tilapia (Oreochromis niloticus) injecting their product. Fragment DNA encoding mature GH protein of giant grouper (El-mGH), giant gouramy (Og-mGH) and common carp (Cc-mGH) was amplified by PCR method and PCR products were then ligated to pCold 1 to generate pCold/El-mGH, pCold/Og-mGH, and pCold/Cc-mGH protein expression vector, respectively. Each of those expression vectors was transformed into the Escherichia coli BL21. E. coli BL21 was cultured using LB medium and protein production was induced by cold shock at 15±1oC for overnight. The inclusion bodies of E. coli transformants containing protein expression vector were isolated by sonication method, and rGH production was analyzed by SDS-PAGE. Juvenile of Nile tilapia in average body weight of 11±1g was intramuscularly injected once a week for 4 weeks with rGH solution containing of 1 μg inclusion body of bacterial per gram fish body weight. The results showed that rGH in molecular weight of about 25 kDa was obtained. Fish injected with rGH of El-mGH, Cc-mGH and Og-mGH grew 20.94%, 18.09% and 16.99% faster, respectively, compared with control. This result indicated that all rGH produced in E. coli possessed biological activity when tested in Nile tilapia, and it may be useful to improve growth of other aquaculture fish species. Keywords: Production, Bioactivity, Recombinant Proteins, Growth Hormone, Fish Aquacultures
INDRA LESMANA. Produksi Dan Bioaktivitas Protein Rekombinan Hormon Pertumbuhan Dari Tiga Jenis Ikan Budidaya. Dibimbing oleh AGUS OMAN SUDRAJAT, dan ODANG CARMAN.
Pertumbuhan merupakan salah satu faktor penting dalam keberhasilan usaha budidaya perikanan. Pertumbuhan yang lambat akan menyebabkan lamanya waktu pemeliharaan dan besarnya biaya yang harus dikeluarkan, lamanya waktu pemeliharaan juga akan meningkatkan resiko-resiko dalam pemeliharaan, seperti terserang penyakit, kematian massal, dan sebagainya. Berdasarkan hal tersebut maka penelitian ini dilakukan dengan menggunakan metode pemberian protein rekombinan hormon pertumbuhan (rGH) untuk meningkatkan laju pertumbuhan.
Pada penelitian ini, protein rGH dari ikan kerapu kertang (Epinephelus lanceolatus), ikan gurame (Osphronemus gouramy) dan ikan mas (Cyprinus carpio) diproduksi dengan teknologi protein rekombinan melalui bakteri E. coli. Bioaktivitas rGH diuji dengan mengamati pertumbuhan ikan nila (Oreochromis niloticus) yang diinjeksi dengan rGH tersebut dibandingkan dengan ikan yang hanya diinjeksi dengan PBS atau protein dari pCold 1 tanpa fragmen DNA GH. Hasil penelitian ini diharapkan dapat menjadi salah satu solusi untuk meningkatkan laju pertumbuhan ikan-ikan budidaya.
Tahapan dalam memproduksi rGH dari ikan kerapu kertang, ikan gurame, dan ikan mas adalah fragmen DNA penyandi protein GH mature (mGH) dari masing-masing ikan diamplifikasi dengan PCR dengan cetakan plasmid pGEM-T Easy yang mengandung cDNA yang telah diisolasi dari ikan kerapu kertang (Mulyadi et al. 2008), ikan gurame (Nugroho et al. 2007), dan ikan mas berdasarkan database Bank Gen no. akses M27000. Primer yang digunakan untuk amplifikasi mGH ikan kerapu kertang (El-mGH) adalah primer forward El-mGH-F 5’- ctcgag cag cca atc aca gac ggc cag - 3’ dan primer reverse El-mGH-R 5’- aagctt cta cag ggt aca gtt ggc ctc agg - 3’ yang masing-masing dilengkapi dengan situs restriksi XhoI dan HindIII (digaris bawahi dan dicetak tebal). Primer untuk amplifikasi fragmen DNA GH mature ikan gurame (Og-mGH) adalah primer forward mGH-F 5’- ggatcc cag cca atc aca gac agc cag - 3’ dan reverse Og-mGH-R 5’- gaattc cta cag agt gca gtt agc ttc tgg - 3’ yang dilengkapi dengan situs restriksi BamHI dan EcoRI. Selanjutnya primer untuk amplifikasi fragmen DNA GH mature ikan mas (Cc-mGH) adalah primer forward Cc-mGH-F 5’- ggatcc tca gac aac cag cgg ctc ttc - 3’ dan reverse Cc-mGH-R 5’- gtcgac cta cag ggt gca gtt gga atc cag - 3’ yang dilengkapi dengan situs restriksi BamHI dan SalI.
Fragmen DNA produk PCR diligasi (disambungkan) ke vektor kloning pGEM-T Easy menggunakan T4 DNA ligase, dan plasmid yang dihasilkan disebut sebagai pT-mGH. pT-mGH produk ligasi ditransformasikan ke sel kompeten bakteri E. coli DH5α. Bakteri E. coli DH5α yang mengandung plasmid pT-mGH diseleksi menggunakan metode cracking (Alimuddin et al. 2008), dan selanjutnya bakteri tersebut dikultur pada media padat 2xYT (+Ampisilin).
Plasmid pT-mGH diekstraksi dari bakteri E. coli DH5α menggunakan kit GF-1 Plasmid DNA Extraction Kit (Vivantis) dengan prosedur yang sesuai dengan manual kit yang digunakan. pT-mGH dipotong dengan enzim restriksi
yang sama dengan yang digunakan memotong pT-mGH. Produk ligasi yang disebut dengan pCold-mGH ditransformasi ke dalam bakteri E. coli DH5α untuk diperbanyak secara in vivo. Plasmid pCold-mGH hasil perbanyakan selanjutnya ditransformasi ke bakteri E. coli BL21 untuk memproduksi protein rGH.
Bakteri E. coli BL21 yang mengandung plasmid pCold-mGH dikultur pada media 2xYT (+Ampisilin), dan diinduksi dengan IPTG pada suhu inkubasi 15oC selama 24 jam. Bakteri hasil kultur dipanen dan disentrifugasi untuk mengendapkan sel bakteri. Pelet bakteri yang dihasilkan disonikasi untuk memecah dinding selnya. Protein dari 1 µg pelet bakteri dianalisis menggunakan metode SDS-PAGE dengan konsentrasi gel poliakrilamid 10%, dan protein divisualisasi menggunakan pewarna Coomassie Blue. Ukuran protein rGH diprediksi berdasarkan konsensus bahwa 10 kDa protein sama dengan 270 bp DNA.
Hasil amplifikasi PCR dengan primer spesifik untuk mGH ikan gurame (Og-mGH), ikan mas (Cc-mGH) dan ikan kerapu kertang (El-mGH) menghasilkan pita DNA dengan panjang fragmen masing-masing sekitar 576 bp, 579 bp, dan 576 bp. Masing-masing fragmen DNA mGH tersebut diligasi ke vektor kloning pGEM-T Easy (plasmid yang dihasilkan disebut sebagai pT-mGH), selanjutnya ditransformasi ke bakteri E. coli DH5α, dan hasil cracking menunjukkan bahwa sebagian besar bakteri E. coli tersebut membawa plasmid pT-mGH.
Hasil ligasi DNA mGH dengan pCold 1 untuk menghasilkan vektor ekspresi protein rekombinan pCold-mGH ditransformasikan ke dalam bakteri E. coli DH5α untuk diperbanyak secara in vivo. Ukuran plasmid yang dihasilkan menjadi lebih besar dibandingkan dengan ukuran plasmid pCold 1. Plasmid-plasmid pCold-mGH tersebut selanjutnya disekuensing untuk mengetahui klon bakteri yang membawa mGH dengan sekuens DNA yang menyandikan asam amino lengkap dan sesuai dengan yang dilaporkan peneliti-peneliti sebelumnya. Dari hasil sekuensing, diperoleh 1 klon untuk pCold/Og-mGH, 2 klon untuk pCold/El-mGH dan 2 klon untuk pCold/Cc-pCold/El-mGH. Selanjutnya plasmid-plasmid pCold-mGH dengan sekuens yang benar tersebut diisolasi untuk ditransformasikan ke dalam bakteri ekspresi E. coli BL21, dari hasil cracking didapatkan sebagian besar klon membawa plasmid pCold-mGH.
Hasil PCR untuk mengetahui klon bakteri E. coli BL21 yang membawa plasmid pCold-mGH dengan arah ligasi mGH yang benar menunjukkan bahwa pita DNA produk PCR dengan ukuran sekitar 0,65 kb (sekitar 0,6 kb fragmen DNA mGH dan 0,05 kb fragmen DNA pCold 1) yang berarti bahwa klon bakteri tersebut mengandungkan plasmid pCold-mGH dengan orientasi ligasi mGH benar. Dari hasil uji orientasi arah ligasi didapatkan 10 klon untuk pCold/Og-mGH, 10 klon untuk pCold/El-mGH dan 6 klon untuk pCold/Cc-mGH
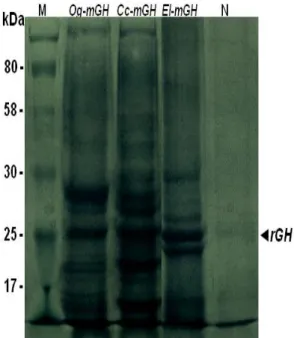
Protein rGH ikan gurame (Og-mGH), ikan mas (Cc-mGH) dan ikan kerapu kertang (El-mGH) pada bakteri E. coli BL21 menggunakan vektor ekspresi pCold 1 berhasil diproduksi, sebanyak 200 ml media kultur 2xYT cair (+Ampisilin) dapat menghasilkan ±0,93 gram pelet bakteri yang mengandung rGH. Tingkat produksi protein rGH diperkirakan 8 - 12.04% (diprediksi menggunakan software Totallab TL 120) dari total protein yang dihasilkan sel E. coli BL21.
yang dihasilkan oleh bakteri BL21 yang hanya membawa pCold 1 tanpa fragmen mGH adalah tidak memproduksi protein rGH dan protein yang lainnya seperti halnya pada BL21 yang membawa pCold-mGH. Selanjutnya, ukuran protein rGH adalah 25 kDa, yang terdiri dari 22 kDa prediksi ukuran rGH berdasarkan panjang fragmen DNA dan sisanya berasal dari vektor pCold 1, yaitu His-tag dan Factor Xa site.
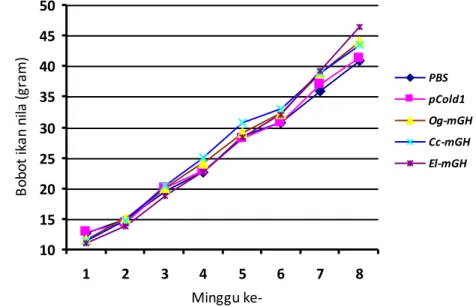
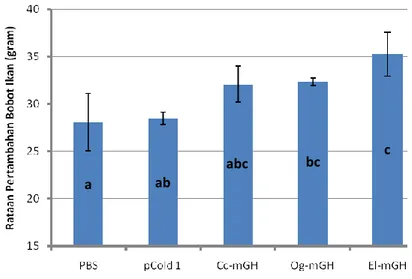
Pertambahan bobot ikan nila yang diinjeksi dengan rGH lebih tinggi (P<0.1) dibandingkan dengan kontrol (PBS dan pCold 1). Hal ini menandakan bahwa protein rGH yang dihasilkan tersebut ikut berperan dalam meningkatkan pertumbuhan ikan. Pertambahan bobot ikan nila yang diinjeksi dengan rGH El-mGH (20,94%) terlihat sedikit lebih tinggi dibandingkan dengan kedua rGH lainnya (18,09% untuk Cc-mGH dan 16,99% untuk Og-mGH). Hal ini diduga karena respons ikan nila dalam menerima rGH dari ikan kerapu kertang lebih baik dari rGH ikan gurame dan ikan mas. Pertambahan bobot ikan nila yang diberi perlakuan injeksi rGH terlihat cukup tinggi setelah penyuntikan keempat. Respons yang lambat tersebut diduga terjadi karena reseptor memerlukan faktor intermediet atau waktu untuk mengenali rGH yang diinjeksikan. Selanjutnya, secara umum ikan yang diberi perlakuan rGH menunjukkan peningkatan nafsu makan yang ditunjukkan dengan tingkah laku yang agresif pada saat pemberian pakan. Hal yang sama juga dilaporkan pada ikan mas yang diinjeksikan rGH ikan giant catfish (Promdonkoy et al. 2004).
Banyak penelitian tentang pemanfaatan rGH ikan untuk memacu laju pertumbuhan ikan budidaya seperti rGH ikan giant catfish oleh Promdonkoy et al. (2004), rGH ikan yellowfin porgy oleh Tsai et al. (1997) dan yang lainnya menyatakan bahwa sintesis protein rGH di dalam bakteri E. coli yang diuji aktivitas biologinya mempunyai potensi yang sama dengan GH alami yang dimiliki oleh spesies tersebut, walaupun kita belum mampu membandingkan aktivitas rGH yang kita cobakan dengan hormon alaminya. Namun dari hasil penelitian ini menunjukkan bahwa rGH yang diproduksi di dalam bakteri E. coli mempunyai aktivitas biologi, sehingga dapat diaplikasikan dalam kegiatan budidaya perikanan secara luas.
Pada penelitian ini, deliveri rGH dilakukan menggunakan metode injeksi. Dengan pertimbangan teknis dan efisiensi aplikasi rGH dalam budidaya ikan, penelitian lebih lanjut perlu dilakukan untuk mengetahui metode pemberian rGH yang cocok serta apakah bioktivitas rGH yang diberikan mulai pada fase larva. Hasil penelitian Tsai et al. (1997) menunjukkan peningkatan laju pertumbuhan hingga 60% pada juvenil ikan kakap hitam yang diberikan rGH melalui pakan.
Selain itu hasil penelitian Acosta et al. (2007) pada ikan nila merah menunjukkan respons yang sangat signifikan (lebih dari 100% dibandingkan kontrol) dengan memberikan rGH dari ikan nila melalui perendaman pada larva. Pemberian rGH melalui pakan yang dicampur rGH serta melalui perendaman larva dalam media mengandung rGH secara teknis lebih praktis untuk diaplikasikan dibandingkan dengan metode injeksi.
Kata kunci: Produksi, Bioaktivitas, Protein Rekombinan, Hormon Pertumbuhan, Ikan Budidaya
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
INDRA LESMANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2010
NRP : C151070191
Disetujui Komisi Pembimbing
Dr. Ir. Agus Oman Sudrajat, M.Sc. Ketua
Dr. Ir. Odang Carman, M.Sc. Anggota
Diketahui
Ketua Program Studi Ilmu Akuakultur
Prof. Dr. Ir. Enang Harris, M.S.
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Puji dan syukur penulis ucapkan kehadirat Allah SWT yang maha luas ilmu dan pengetahuanNya, sehingga dengan rahmat dan karuniaNya penulis dapat menyelesaikan penelitian ini. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2009 ini ialah Peningkatan laju pertumbuhan ikan budidaya dengan memanfaatkan teknologi protein rekombinan, sehingga diharapkan dapat memberikan solusi dalam peningkatan produksi perikanan Indonesia. Penelitian ini berjudul “Produksi dan Bioaktivitas Protein Rekombinan Hormon Pertumbuhan dari Tiga Jenis Ikan Budidaya”.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Agus Oman Sudrajat, M.Sc dan Bapak Dr. Ir. Odang Carman, M.Sc selaku pembimbing, serta Bapak Dr Alimuddin, S.Pi, M.Sc yang telah banyak memberikan saran, masukan dan dana dalam penelitian dan penulisan tesis ini. Disamping itu, penghargaan penulis sampaikan kepada staf dan teman-teman mahasiswa S1, S2, dan S3 yang juga sedang melakukan penelitian di Laboratorium Reproduksi dan Genetik Organisme Akuatik Departemen BDP FPIK-IPB, yang telah banyak membantu selama penelitian. Selain itu, ucapan terima kasih penulis sampaikan kepada Ibu Ika Malikha, STP staf Laboratorium Molekuler dan Biokimia PAU IPB atas bantuan dan pelajarannya dalam analisis protein rGH.
Terima kasih juga penulis sampaikan kepada Dekan Sekolah Pascasarjana IPB beserta staf, Ketua Mayor beserta staf dan Bapak/Ibu Dosen di Ilmu Akuakultur, atas segala ilmu dan layanan yang diberikan kepada penulis selama studi. Disamping itu, penghargaan penulis sampaikan kepada Pemerintah Provinsi Riau dan Pemerintah Kabupaten Kampar-Riau atas beasiswa yang diberikan, serta Yayasan R.v.G. Van Deventer Maas atas bantuan studi selama 12 bulan.
Ungkapan terima kasih juga disampaikan kepada Ibunda Hj Murniati dan Ayahanda H. Chaidir atas dukungan moril maupun materil serta do’a yang diberikan selama ini. Juga kepada saudara-saudaraku; kakanda Herlina Susanti, STP dan keluarga, Nita Andriani, S.Pd dan keluarga, adinda Deni Fitrah, S.Pt, Al Hidayati, AMd.Keb, dan Mar’atus Soleha atas do’a dan kasih sayangnya selama ini. Serta seluruh keluarga besarku di Salo-Riau. Penghargaan penulis sampaikan kepada teman-teman S2 AKU 07 atas kebersamaan, kekompakan, dan kerjasama yang baik serta bantuannya selama perkuliahan sampai penyusunan dan penyelesaian tugas akhir ini, serta teman-teman HIMMPAS (Himpunan Mahasiswa Muslim Pascasarjana) IPB atas kebersamaannya selama ini. dan ungkapan terima kasih kepada semua pihak yang tidak sempat disebutkan satu persatu.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2010
Penulis dilahirkan di Riau pada tanggal 26 Maret 1984 dari ayah H Chaidir dan ibu Hj Murniati. Penulis merupakan anak ketiga dari enam bersaudara. Tahun 2001 penulis lulus dari SMA Muhammadiyah Bangkinang dan pada tahun yang sama penulis diterima sebagai mahasiswa di Universitas Riau pada Jurusan Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan melalui jalur UMPTN (Ujian Masuk Perguruan Tinggi Negeri) dan menamatkannya pada tahun 2006.
Pada tahun 2007 penulis melanjutkan pendidikan program Magister sains di Institut Pertanian Bogor pada program studi Ilmu Akuakultur, dengan mendapatkan beasiswa dari Pemerintah Provinsi Riau dan Pemerintah Kabupaten Kampar serta penulis juga mendapatkan bantuan studi selama 12 bulan dari Yayasan R.v.G. Van Deventer Maas.
Selama menempuh pendidikan S2 penulis aktif pada organisasi Himpunan Mahasiswa Muslim Pascasarjana (HIMMPAS IPB) dan pernah menjadi Ketua Umum pada periode 2008/2009.
Halaman
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Hormon Pertumbuhan (Growth Hormone) ... 4
Teknologi DNA Rekombinan ... 4
Protein Rekombinan Hormon Pertumbuhan (rGH) ... 7
BAHAN DAN METODE ... 11
Produksi Protein Rekombinan Hormon Pertumbuhan (rGH) ... 11
Kloning Fragmen DNA Penyandi Protein GH Mature (mGH) ... 11
Pembuatan Vektor Ekspresi Protein rGH ... 15
Produksi Protein rGH... 16
Uji Bioaktivitas Protein rGH ... 17
Analisis Data ... 17
HASIL DAN PEMBAHASAN ... 19
Vektor Kloning Protein rGH ... 19
Vektor Ekspresi Protein rGH ... 22
Produksi Protein rGH ... 26
Uji Bioaktivitas Protein rGH pada Ikan Nila dengan Cara Injeksi... 27
KESIMPULAN DAN SARAN ... 31
Kesimpulan ... 31
Saran ... 31
DAFTAR PUSTAKA ... 32
Halaman 1. Peta vektor kloning pGEM®-T Easy ... 9 2. Peta vektor ekspresi pCold 1 DNA ... 9 3. Hasil isolasi plasmid pGEM-T Easy yang mengandung Cc-cDNA GH,
Og-cDNA GH, dan El-cDNA GH. M: marka panjang fragmen DNA (2-lod ladder, BioLabs Inc., New England); angka di sebelah kiri: ukuran fragmen DNA marka; angka 1-2 adalah nomor klon bakteri hasil isolasi plasmid cDNA GH ... 19 4. Produk PCR fragmen GH mature; Og-mGH, Cc-mGH, dan El-mGH ... 20 5. Hasil cracking pGEM-T Easy/El-mGH, pGEM-T Easy/Og-mGH, dan
pGEM-T Easy/Cc-mGH dari bakteri konstruksi E. coli DH5α. T pada Gambar: marka ukuran plasmid pGEM-T Easy (3 kb) dan nomor 1-5 adalah nomor sampel klon bakteri ... 21 6. bakteri konstruksi E. coli DH5α yang mengandung pT-mGH ... 21 7. Isolasi plasmid pT-mGH dari bakteri konstruksi E. coli DH5α ... 22 8. Pemotongan pT-mGH dengan enzim restriksi untuk mengeluarkan mGH . 22 9. Pemotongan vektor ekspresi pCold1 DNA dengan enzim restriksi. M:
marka panjang fragmen DNA; angka 1: pCold 1 yang belum didigesti, angka 2: pCold 1 yang didigesti dengan enzim restriksi BamHI dan SalI, angka 3: pCold 1 yang didigesti dengan enzim restriksi XhoI dan HindIII, dan angka 4: pCold 1 yang didigesti dengan enzim restriksi BamHI dan EcoRI ... 23 10. Klon bakteri E. coli DH5α yang mengandung pCold-mGH ... 24 11. Elektroforesis hasil cracking pCold-mGH dari bakteri E. coli BL21. M:
marka panjang fragmen DNA; angka di sebelah kiri dan kanan: ukuran fragmen DNA marka; angka 1-16 adalah nomor klon bakteri hasil transformasi pCold-mGH; Gambar (a) hasil transformasi pCold/El-mGH; Gambar (b) hasil transformasi pCold/Og-pCold/El-mGH; dan Gambar.(c) hasil transformasi pCold/Cc-mGH ... 25
fragmen DNA marka ... 26 13. Hasil kultur klon bakteri E. coli BL21 yang telah diseleksi positif
mengandung pCold-mGH dengan arah orientasi ligasi mGH yang benar .. 26 14. SDS-PAGE protein rekombinan hormon pertumbuhan (rGH) ikan
gurame (Og-mGH), ikan mas (Cc-mGH) dan ikan kerapu kertang (El-mGH). M: marka ukuran protein (Prestained protein marker, Broad range 7-175; Biolabs-P7708S); angka di sebelah kiri gambar merupakan ukuran marka protein; dan N: protein dari bakteri BL21 yang membawa pCold 1 tanpa fragmen DNA mGH ... 27 15. Laju pertumbuhan bobot ikan nila per minggu yang disuntik dengan
PBS dan pCold 1 (sebagai kontrol) dan protein rGH ikan kerapu kertang (El-mGH), ikan gurame (Og-mGH) dan ikan mas (Cc-mGH)... 28 16. Pertambahan bobot (g) ikan nila yang disuntik protein rGH ikan gurame
(Og-mGH), ikan mas (Cc-mGH) dan ikan kerapu kertang (El-mGH). Protein total dari 1 µg bakteri per gram ikan nila disuntikkan sekali seminggu selama 4 minggu, dan pertumbuhan ikan diukur setiap minggu selama 2 bulan. PBS kontrol: ikan nila disuntik dengan PBS; dan pCold 1: ikan nila disuntik dengan protein dari bakteri BL21 yang mengandung plasmid pCold 1 tanpa fragmen DNA mGH ... 29
Halaman 1. Sekuens cDNA yang mengkodekan hormon pertumbuhan (GH) ikan
kerapu kertang berdasarkan data Genbank EU280321 ... 37
2. Sekuens cDNA yang mengkodekan hormon pertumbuhan (GH) ikan mas berdasarkan data Genbank M27000 ... 38
3. Sekuens nukleotida dan hasil prediksi asam amino GH ikan kerapu kertang menggunakan program GENETYX versi 7 ... 40
4. Sekuens nukleotida dan hasil prediksi asam amino GH ikan mas menggunakan program GENETYX versi 7 ... 42
5. Sekuens nukleotida dan hasil prediksi asam amino GH ikan gurame menggunakan program GENETYX versi 7 ... 44
6. Prediksi daerah signal peptida pada CDS GH ikan kerapu kertang ... 46
7. Prediksi daerah signal peptida pada CDS GH ikan mas ... 48
8. Prediksi daerah signal peptida pada CDS GH ikan gurame ... 50
9. Hasil sekuensing plasmid pCold/El-mGH ... 52
10. Hasil sekuensing plasmid pCold/Cc-mGH ... 54
11. Alignment urutan nukleotida plasmid pCold/El-mGH hasil sekuensing dengan sekuens mGH dari data Genbank EU280321 ... 56
12. Alignment urutan nukleotida plasmid pColdCcGH hasil sekuensing dengan sekuens mGH dari data Genbank M27000 ... 57
13. Data uji bioaktivitas protein rGH dengan penyuntikan ... 58
14. Hasil analisis sidik ragam pertumbuhan ikan nila dengan lama pemeliharaan selama 2 bulan ... 59
15 Hasil analisis sidik ragam tingkat kelulus hidupan (SR) ikan nila diakhir pemeliharaan ... 60
Latar Belakang
Pertumbuhan merupakan salah satu faktor penting dalam keberhasilan usaha budidaya perikanan. Pertumbuhan yang lambat akan menyebabkan lamanya waktu pemeliharaan dan besarnya biaya yang harus dikeluarkan, lamanya waktu pemeliharaan juga akan meningkatkan resiko-resiko dalam pemeliharaan, seperti terserang penyakit, kematian massal, dan sebagainya.
Berbagai upaya penelitian telah dilakukan untuk meningkatan laju pertumbuhan ikan budidaya, khususnya ikan-ikan yang pertumbuhannya lambat, seperti rekayasa lingkungan budidaya dan rekayasa pemberian pakan (Johnston et al. 2008) atau dengan meningkatkan kandungan protein pakan hingga 58% seperti yang dilakukan oleh Gauquelin et al. (2007) pada pakan udang. Namun kandungan protein pakan yang tinggi dapat meningkatkan kadar amoniak dalam perairan, sehingga dapat mempengaruhi pertumbuhan ikan budidaya.
Selain dengan rekayasa lingkungan dan pemberian pakan, penelitian rekayasa genetika juga telah dilakukan untuk meningkatkan pertumbuhan ikan budidaya; seperti seleksi, hibridisasi, triploidisasi dan transgenesis. Aplikasi metode seleksi membutuhkan waktu yang relatif lama untuk mencapai hasil yang signifikan karena peningkatan kecepatan tumbuh yang dihasilkan per generasi relatif rendah, seperti yang dilaporkan oleh Bolivar et al. (2002) pada ikan nila yang dilakukannya selama 10 tahun untuk menghasilkan 12 generasi dengan kecepatan tumbuh 12,4% per generasi. Penerapan teknologi hibridisasi dan triploidisasi terbatas pada ikan-ikan budidaya yang sudah diketahui teknik pemijahan buatannya secara baik.
Metode transgenesis juga sudah banyak dikembangkan seiring dengan kemajuan ilmu pengetahuan dan teknologi di bidang molekuler. Kajian-kajian rekayasa genetika dalam bidang akuakultur sudah banyak diaplikasikan sejak tahun 1980-an dengan produk ikan transgenik yang pertama kali dilaporkan di Cina pada tahun 1985 (Dunham 2004). Kemudian hingga saat ini teknologi transgenesis terus berkembang dengan memberikan banyak keuntungan dan kelebihan, di antaranya adalah gen yang diintroduksi dapat terintegrasi dengan genom resipien dan selanjutnya dapat ditransmisikan ke keturunannya (Khoo 2000).
Selain memberikan banyak keuntungan dan kelebihan yaitu salah satunya dapat meningkatkan laju pertumbuhan ikan 30 kali lebih cepat dari ikan normal, seperti yang dilakukan oleh Nam et al. (2001) dengan mengintroduksi gen penyandi hormon pertumbuhan (GH) ke ikan mud loach (Misgurnus mizolepis). Namun demikian, saat ini teknologi transgenesis masih menimbulkan kontroversi dan kekhawatiran akan keamanan dalam mengkonsumsi organisme transgenik tersebut (foodsafety) atau disebut juga dengan GMO (Genetically Modified Organism), sehingga perlu ada cara lain untuk mengatasi masalah tersebut.
Penggunaan protein rekombinan hormon pertumbuhan (rGH) ikan diduga sebagai salah satu metode alternatif untuk meningkatkan pertumbuhan ikan budidaya, penggunaan protein rGH ikan dalam meningkatkan produktivitas atau pertumbuhan ikan budidaya dilakukan dengan prosedur yang aman (Willard 2006 dalam Acosta et al. 2007), sehingga ikan yang diberikan rGH bukan merupakan organisme GMO (Acosta et al. 2007) dan rGH tersebut tidak ditransmisikan ke keturunannya.
Pada ikan, seperti juga pada hewan-hewan vertebrata lainnya, pertumbuhan sel somatik diatur oleh adanya poros pertumbuhan, pituitari sebagai tempat penghasil hormon pertumbuhan (GH) merupakan suatu komponen pengatur yang penting dalam poros ini (Reinecke et al. 2005). GH memainkan peranan yang penting dalam mengatur banyak aspek fisiologi, termasuk pertumbuhan (Cavri et al. 1993), metabolisme (Rousseau and Dufour. 2007), osmoregulasi (Sakamoto et al. 1997), fungsi kekebalan tubuh (Yada et al. 1999) dan reproduksi (McLean et al. 1993).
Penggunaan hormon pertumbuhan dalam berbagai aplikasi sudah banyak dilakukan, namun prosedur yang ada untuk mendapatkan hormon tersebut sangatlah rumit, selain itu hanya diperoleh dalam jumlah yang sedikit (Kawauchi et al. 1986; Yasuda et al. 1992). Hal ini disebabkan karena konsentrasi hormon pertumbuhan yang dihasilkan secara biologi oleh sel khusus pada kelenjer pituitari sangat kecil. Oleh sebab itu perlu dikembangkan metode yang efisien untuk menghasilkan hormon ini dalam jumlah besar melalui teknologi protein rekombinan.
Hormon pertumbuhan (GH) merupakan hormon pituitari di bawah pengaturan hipotalamus (Bjo’rnsson et al. 2004), GH diproduksi dalam jumlah
sedikit kemudian dengan mekanisme autocrine dan paracrine (Vong et al. 2003 dalam Dong et al. 2008) dihantarkan ke organ target melalui peredaran darah untuk merangsang banyak aspek fisiologi tubuh. Selain itu juga GH dapat merangsang hati untuk menghasilkan insulin-like growth factors I (IGF-I) yang dapat merangsang metabolisme asam amino dan lipid di dalam tubuh (Cao et al. 1989; Kelley et al. 1992 dalam Roberts et al. 2004).
Bioaktivitas protein rGH dalam meningkatkan pertumbuhan telah dilaporkan pada beberapa jenis ikan seperti ikan rainbow trout (Onchorhynchus mykiss) dengan menggunakan rGH ikan salmon (Moriyama et al. 1993), ikan flounder (Paralichtys olivaceus) dengan menggunakan rGH juga dari ikan flounder (Jeh et al. 1998), dan ikan mas dengan menggunakan rGH ikan giant catfish (Pangasianodon gigas) (Promdonkoy et al. 2004).
Pada penelitian ini, protein rGH dari ikan kerapu kertang (Epinephelus lanceolatus), ikan gurame (Osphronemus gouramy) dan ikan mas (Cyprinus carpio) diproduksi dengan teknologi protein rekombinan melalui bakteri E. coli. Bioaktivitas rGH diuji dengan mengamati pertumbuhan ikan nila (Oreochromis niloticus) yang diinjeksi dengan rGH tersebut dibandingkan dengan ikan yang hanya diinjeksi dengan PBS atau protein dari pCold 1 tanpa fragmen DNA GH.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk menghasilkan protein rekombinan hormon pertumbuhan (rGH) ikan kerapu kertang, ikan gurame, dan ikan mas dan membandingkan bioaktivitasnya dalam meningkatkan laju pertumbuhan ikan nila (Oreochromis niloticus). Selanjutnya penelitian ini diharapkan dapat menjadi salah satu solusi untuk meningkatkan laju pertumbuhan ikan-ikan budidaya dalam upaya peningkatan produksi perikanan Indonesia.
TINJAUAN PUSTAKA
Hormon Pertumbuhan (Growth Hormone)
Hormon pertumbuhan (GH) merupakan hormon polipeptida penting dengan ukuran sekitar 22 kDa yang diproduksi dari somatotropin di dalam kelenjar anterior pituitari yang berperan dalam mengontrol pertumbuhan somatik setelah kelahiran, perkembangan (Nicoll et al. 1999), metabolisme (Kaplan et al. 1999), reproduksi (Van der Kraak et al. 1990; Le Gac et al. 1993 dalam Li et al. 2005) dan osmoregulasi (Sakamoto et el. 1993; Tatsuya dan Hirano. (1993) dalam Li et al. 2005). Fungsi kelenjar pituitari sebagai pengontrol pertumbuhan sudah dijelaskan pertama kali pada tahun 1921 (Evans dan Long 1921 dalam Venugopal et al. 2002) dan yang pertama kali diisolasi dan dikarakterisasi adalah cDNA yang mengkode hormon pertumbuhan pada manusia.
Hormon pertumbuhan mempunyai peranan yang penting pada proses transfer asam amino ekstraselluler melewati membran sel, khususnya ke dalam sel-sel otot dan menahan asam amino tersebut agar tetap berada di dalam sel. Selain itu hormon ini dapat memacu retensi tubuh terhadap berbagai mineral dan elemen esensial untuk pertumbuhan normal (Walsh 2002). Hormon pertumbuhan dapat menunda katabolisme asam-asam amino dan memacu inkoporasinya ke dalam protein-protein tubuh. Kerja hormon ini dipermudah oleh pankreas, korteks adrenal dan tiroid yang bekerja bersama-sama dalam memacu metabolisme lemak dan karbohidrat (Calduch-Giner et al. 2000; Walsh 2002). Kemudian Matty (1985) mengatakan bahwa GH dapat meningkatkan nafsu makan, konversi pakan, sintesis protein, menurunkan ekskresi (loading) nitrogen, merangsang metabolisme dan oksidasi lemak, serta memacu sintesis dan pelepasan insulin.
Teknologi DNA Rekombinan
Teknologi DNA rekombinan, disebut juga dengan kloning gen atau molekuler kloning adalah penyisipan DNA atau gen tertentu ke vektor, untuk membentuk molekul DNA baru yang dapat diperbanyak pada sel inang (Glick dan Pasternak 2003). Kloning gen dapat dilakukan melalui beberapa tahap, yaitu: isolasi gen, penyisipan gen ke dalam sistem vektor untuk membentuk vektor
rekombinan, dan introduksi atau memasukkan vektor rekombinan yang membawa sisipan gen kedalam sel inang (Suharsono 2000)
Isolasi gen. Gen dapat diisolasi dengan berbagai cara yaitu:
Pemotongan dengan enzim restriksi
Gen yang sudah diketahui ukuran dan situs restriksinya dapat diisolasi secara langsung dari gel setelah dilakukan pemotongan DNA dan migrasi di dalam gel. Untuk gen yang berada pada organisme dengan genom besar dapat dilakukan dengan pembuatan pustaka genom. Genom suatu individu dipotong dengan enzim restriksi, disisipkan ke vektor rekombinan kemudian di- introduksikan ke sel inang.
Pembuatan cDNA
DNA komplementer (cDNA) adalah DNA yang dibuat berdasarkan mRNA (messenger RNA). mRNA spesifik digunakan sebagai cetakan bagi sintesis enzimatik DNA komplementer dengan menggunakan enzim reverse transcriptase sebagai katalisator. Pada metoda ini memerlukan primer DNA (Brown 1991). Pada mRNA ini ditambahkan politimin yang bersifat komplementer dengan terminal 3 poliadenilasi. Politimin ini berperan sebagai inisiasi bagi reverse transcriptase yang melakukan transkriptasi mRNA untuk membuat untai komplementer cDNA dari campuran dNTP sehingga menghasilkan untai tunggal cDNA yang direplikasi oleh DNA polimerase I sehingga menghasilkan cDNA untai ganda. cDNA tersebut bersifat spesifik bagi protein yang gennya sedang diteliti.
Pembentukan vektor rekombinan. Pembentukan vektor rekombinan adalah penyisipan gen atau DNA yang telah diisolasi ke dalam vektor, atau disebut juga dengan DNA rekombinan yang dapat bereplikasi dalam sel inang (bakteri). Beberapa jenis vektor yang dapat digunakan dalam kloning gen yaitu plasmid, fage, kromosom buatan dari khamir (YAC: yeast artificial chromosome) dan kosmid (cosmid). Penggunaan vektor sangat tergantung dari tujuan pengklonan, pembuatan pustaka cDNA dapat menggunakan plasmid sebagai vektornya, sedangkan pustaka genom yang mengandung fragmen besar biasanya menggunakan fage, cosmid atau YAC (Suharsono 2000).
Menurut Voet dan Voet (1994) mengatakan bahwa pembentukan DNA rekombinan disebut juga dengan proses ligasi yaitu memasukkan sekuens DNA yang diinginkan ke dalam elemen genetik yang dapat bereplikasi sendiri yaitu plasmid, bakteriofage, atau yeast artificial chromosome. Enzim yang digunakan dalam mengkatalisasi reaksi ligasi disebut dengan DNA ligase.
Introduksi vektor rekombinan ke dalam sel inang. Vektor rekombinan yang membawa sekuens DNA diintroduksikan ke dalam sel bakteri agar dapat mengalami replikasi (penggandaan). Proses introduksi vektor rekombinan dapat dibedakan menjadi dua macam yaitu transformasi dan transfeksi. Istilah transformasi dipakai apabila vektor yang digunakan adalah plasmid, sedangkan transfeksi menggunkan vektor virus dan turunannya. Sel yang digunakan dalam proses transformasi disebut dengan sel kompeten (Darmawan 2004).
Keberhasilan proses transformasi dipengaruhi oleh sifat kompeten bakteri dalam pengambilan molekul DNA asing (Glick dan Pasternak 2003). Sifat kompeten dapat terjadi secara alami pada beberapa bakteri, seperti pada genus Bacillus atau Streptococcus yang mempunyai mekanisme pengikatan dan pengambilan molekul DNA secara efisien (Suharsono 2000). Sifat kompeten tidak dimiliki oleh E. coli, sehingga perlu dilakukan induksi dengan beberapa bahan kimia dan kejutan suhu. Sel pada fase mid-log disuspensikan pada kalsium klorida (CaCl2), kemudian dipertahankan pada suhu -70oC hingga akan digunakan. Pada saat dilakukan transformasi, sel yang membeku dicairkan (thawing) di atas es dan dilakukan kejutan suhu 42oC selama 1-2 menit. DNA dapat masuk ke dalam bakteri melalui pori-pori dinding dan membran yang terbuka. Bahan kimia lain yang digunakan adalah Mg atau detergen (triton-X) (Suharsono 2000). Metode lain dalam transformasi adalah menggunakan kejutan listrik yang dikenal dengan elektroporasi (Sambrook et al. 1989). Kejutan suhu pada tegangan tertentu dalam waktu singkat dapat membuka pori-pori sel inang.
Seleksi transforman. Sel inang (bakteri) yang membawa DNA sisipan dapat diketahui dengan penanda seleksi, yaitu berupa sifat ketahanan terhadap antibiotika. Bakteri yang membawa vektor rekombinan (mengandung DNA sisipan) akan resisten terhadap antibiotik tertentu dan yang bukan vektor rekombinan akan mati. Sedangkan untuk mengetahui sel inang yang membawa vektor rekombinan atau membawa DNA sisipan atau tidak, dapat diketahui
dengan mengamati ekspresi gen penanda yang dibawa oleh vektor tersebut. Kobolak & Muller (2003) mengatakan bahwa penggunaan vektor pGEM-T Easy pada bakteri E. coli yang memiliki marker gen lacZ dan marker gen resisten ampisilin, diamana lacZ sebagai gen pelapor (reporter gene). Dengan penambahan IPTG (Isopropil thiogalaktosida) dan X-gal (5-bromo-4-cloro-3-indolylbeta-D-galactopyranocide) pada media tumbuh, gen lacZ pada vektor kloning yang menyandikan β-galactosidase akan mengubah molekul X-gal menjadi galaktosa dan 5-bromo-4-kloronigo, sehingga menghasilkan koloni bakteri berwarna biru.. Apabila terjadi insersi gen atau fragmen DNA pada MCS, maka gen lacZ tidak dapat berfungsi sebagai mana mestinya sehingga tidak terjadi penguraian X-gal menjadi galaktosa yang menyebabkan koloni bakteri tetap berwarna putih.
Protein Rekombinan Hormon Pertumbuhan (rGH)
Protein merupakan komponen penyusun kehidupan yang disintesis melalui metabolisme alami di dalam tubuh selama hidup. Beberapa protein, seperti enzim berperan sebagai biokatalisator untuk meningkatkan reaksi metabolisme di dalam tubuh, sedangkan yang lain berbentuk cytoskeleton. Protein memainkan peranan penting dalam memberikan isyarat sel, respons kekebalan, siklus dan adhesi sel. Demain dan Vaishnav 2009 mengatakan bahwa salah satu protein yang berperan dalam tubuh adalah protein hormon pertumbuhan (GH).
Sejak diketahuinya fungsi kelenjar pituitari yang memproduksi GH sebagai pengontrol pertumbuhan tahun 1921 oleh Evans dan Long dalam Venugopal et al. (2002) dan kemudian diketahui bahwa GH hewan mamalia mampu meningkatkan laju pertumbuhan ikan maka penelitian tentang penggunaan GH ikan mulai banyak dikembangkan dalam perikanan budidaya. Dengan menggunakan teknologi DNA rekombinan, protein rekombinan hormon pertumbuhan (rGH) ikan diproduksi dan diaplikasikan untuk meningkatkan laju pertumbuhan ikan budidaya seperti yang dilakukan oleh Jeh et al. (1998) dengan menggunakan rGH dapat meningkatkan laju pertumbuhan 24% lebih cepat dibanding kontrol pada benih ikan flounder setelah pemeliharaan 7 minggu. Pada ikan gilthead seabream pemberian rGH dapat meningkatkan laju pertumbuhan 55-65% setelah pemeliharaan 38 hari yang diberikan pada ukuran larva (Ben-Atia et al. 1999),
60% pada ikan kakap hitam setelah pemeliharan 12 minggu (Tsai et al. 1997), dan 171% pada ikan nila (Acosta et al. 2007) yang diberikan pada ukuran larva setelah pemeliharaan 6 minggu.
Metode Pembuatan Protein rGH. Metode pembuatan protein rGH mengacu kepada metode teknologi DNA rekombinan atau kloning gen. Tahapan kloning gen berdasarkan Glick dan Pasternak. (2003) yaitu: isolasi gen, dalam hal ini DNA yang mengkode hormon pertumbuhan (GH), penyisipan gen ke dalam sistem vektor untuk membentuk vektor rekombinan, dan selanjutnya vektor rekombinan yang membawa sisipan gen GH tersebut diintroduksikan ke dalam sel inang (bakteri atau ragi). Dan kemudian di dalam sel inang GH rekombinan tersebut akan diekspresikan dan diperbanyak dengan cepat sesuai dengan kecepatan sel inang membelah diri.
Beberapa peneliti telah berhasil mengisolasi dan memproduksi rGH dari beberapa jenis ikan diantaranya adalah Fine et al. (1993); Anathy et al. (2001); Cheng et al. (1995). Beberapa gen GH ikan-ikan budidaya lainnya juga telah diisolasi namun belum diproduksi rekombinan GHnya, seperti ikan nila Oreochoromis niloticus (Kobayashi et al. 2007), ikan kerapu tikus Cromileptes altivelis (Syaifudin et al. 2007), ikan gurame Osphoronemus gouramy (Nugroho et al. 2008), dan ikan kerapu kertang Epinephelus lanceolatus (Mulyadi et al. 2008)
Plasmid sebagai vektor kloning dan vektor ekspresi. Plasmid merupakan molekul DNA sirkular yang terdapat bebas dalam sel bakteri (Brown 1991). Dewasa ini dari hasil-hasil penelitian diketahui bahwa plasmid dihasilkan oleh banyak spesies Eubacteria, tetapi ada juga yang dari Archaea dan sebagian kecil dari Eukarya.
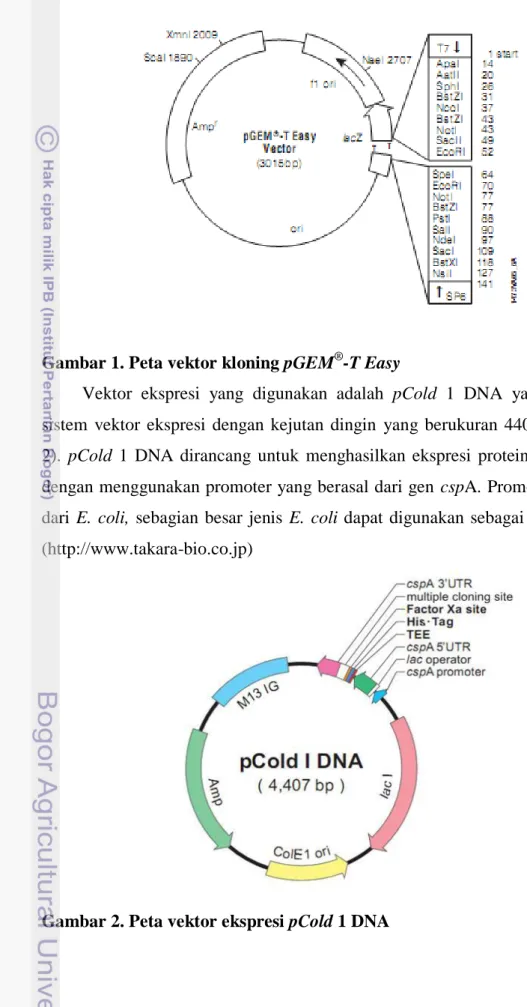
Pada penelitian ini vektor kloning yang digunakan adalah pGEM-T Easy yang berukuran 3015 bp (Gambar 1). Plasmid pGEM-T Easy merupakan plasmid sirkular terbuka memiliki dua buah ori dan gen ketahanan terhadap ampisilin (AmpR) serta mengandung multi cloning site. Karena memiliki kelebihan Timin yang menggantung di ujung terbuka, plasmid ini sering dipakai sebagai vektor dari produk PCR yang selalu terdapat kelebihan Adenin (A) pada ujungnya, sehingga penempelan gen insert tidak perlu menggunakan enzim restriksi (Old & Primrose 1994). Selain itu, plasmid pGEM-T Easy termasuk plasmid high copy
number yang cocok untuk menyimpan gen insert dalam bakteri sebagai suatu inang.
Gambar 1. Peta vektor kloning pGEM®-T Easy
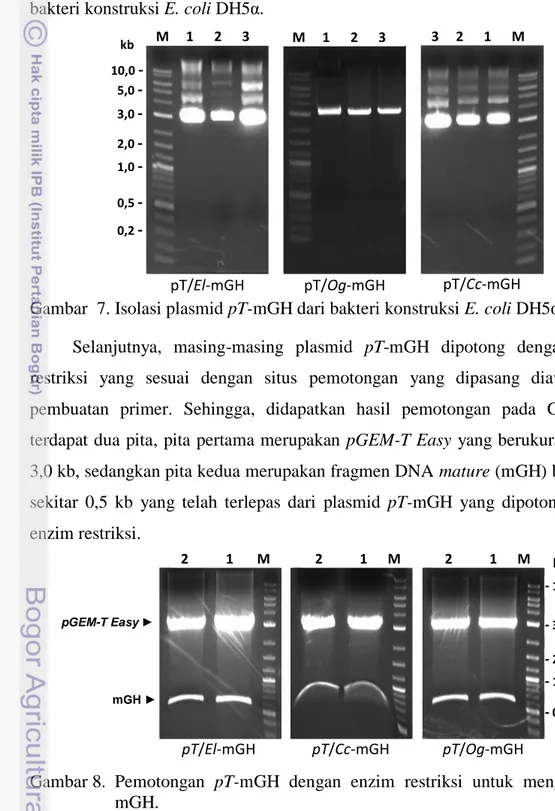
Vektor ekspresi yang digunakan adalah pCold 1 DNA yang merupakan sistem vektor ekspresi dengan kejutan dingin yang berukuran 4407 bp (Gambar 2). pCold 1 DNA dirancang untuk menghasilkan ekspresi protein secara efisien dengan menggunakan promoter yang berasal dari gen cspA. Promoter ini berasal dari E. coli, sebagian besar jenis E. coli dapat digunakan sebagai inang ekspresi (http://www.takara-bio.co.jp)
Teknik Pengujian Aktivitas Protein rGH. Teknik pengujian aktivitas protein rGH dapat dilakukan dengan memberikan protein rGH yang telah diproduksi kepada ikan budidaya. Metode yang digunakan untuk memberikan protein rGH untuk memacu pertumbuhan atau meningkatkan kinerja banyak aspek fisiologi tubuh dapat dilakukan dengan beberapa cara yaitu; injeksi (penyuntikan), immersi (perendaman) dan pakan.
Metode pemberian protein rGH melalui pakan, baik melalui pakan alami maupun pakan buatan telah banyak dilakukan diantaranya; Moriyama et al. (1993), Ben-Atia et al. (1999) dengan memberikan rGH ikan gilthead seabream pada larva, Tsai et al. (1997) pada juvenil ikan kakap hitam yang diberikan 2 kali sehari selama 12 minggu, Jeh et al. (1998) pada ikan flounder dengan frekuensi 1 kali seminggu selama 4 minggu, dan Promdonkoy et al. (2004) dengan memberikan protein rGH ikan giant catfish pada benih ikan mas umur 2 bulan. Pemberian rGH melalui pakan buatan merupakan metode yang cukup praktis, karena tidak perlu menangani ikan satu per satu (Jeh et al. 1998). Namun penggunaan pakan buatan terbatas pada benih ikan yang sudah memiliki sistem dan enzim pencernaan yang lengkap.
Metode pemberian protein rGH dengan perendaman atau immersi juga bisa dilakukan yaitu dengan merendam ikan pada larutan rGH dengan dosis 30 mg/l selama 60 menit dengan interval 7 hari sekali kemudian di ukur pertumbuhannya, seperti yang dilakukan oleh Moriyama dan Kawauchi (2004), serta oleh Acosta et al. (2007).
Metode lain yang juga bisa dilakukan adalah dengan injeksi atau menyuntikkan protein rGH ke dalam tubuh ikan. Metode injeksi seperti yang dilakukan oleh Promdonkoy et al.(2004) dengan menyuntikkan protein rGH ikan giant catfish ke benih ikan mas dengan dosis 0,1 dan 1 µg per 10 µl PBS per g bobot tubuh. Dengan metode injeksi dapat dipastikan bahwa protein rGH masuk ke tubuh melalui peredaran darah.
BAHAN DAN METODE
Penelitian ini terdiri atas 2 tahapan utama, yaitu produksi protein rekombinan hormon pertumbuhan (rGH) dari ikan kerapu kertang, ikan gurame, dan ikan mas, dan uji bioaktivitas protein rGH pada ikan nila.
Produksi Protein Rekombinan Hormon Pertumbuhan (rGH) Kloning Fragmen DNA Penyandi Protein GH Mature (mGH)
Isolasi Plasmid cDNA GH. Isolasi plasmid dilakukan menggunakan kit FlexiPrep dari Amersham Pharmacia Biotech dengan prosedur sesuai dengan manual. cDNA GH masing-masing ikan; kerapu kertang (Mulyadi et al. 2008), gurame (Nugroho et al. 2007) dan mas (berdasarkan database Bank Gen no. akses M27000) dalam bentuk plasmid pada vektor kloning pGEM-T Easy telah tertransformasi dalam bakteri konstruksi E.coli DH5α. Bakteri konstruksi diinkubasi pada suhu 37°C dalam media 2xYT (+Ampisilin) cair 8 ml di tabung L sampai warnanya pekat (± 20 jam). Bakteri dari setiap tabung kultur dituang ke dalam tabung mikro 1,5 ml, selanjutnya bakteri diendapkan dengan cara spin down 30 detik 12000 rpm pada suhu 4°C kemudian supernatannya dibuang.
Selanjutnya ke dalam tabung mikro berisi pelet bakteri ditambahkan larutan 1 sebanyak 200 µl, divortex hingga pelet bakteri lepas dari dasar tabung. Kemudian ditambahkan larutan 2 sebanyak 200 µl, tabung mikro dibolak-balik sekitar 10 kali sebelum ditambahkan dengan larutan 3 sebanyak 200 µl. Tabung dibolak-balik hingga terbentuk gumpalan-gumpalan putih, dilanjutkan dengan sentrifugasi pada kecepatan 13.000 rpm pada suhu ruang selama 5 menit. Supernatan dipindahkan ke tabung mikro yang baru, disentrifugasi sekali lagi dengan kecepatan dan lama waktu yang sama dengan sebelumnya. Supernatan dipindahkan ke tabung mikro berisi isopropanol 420 µl. Dihomogenasi dengan vortex selama sekitar 1 menit dan dilanjutkan dengan inkubasi pada suhu ruang selama 10 menit selanjutnya dilakukan sentrifugasi 13000 rpm selama 15 menit. Setelah isopropanol (supernatannya) dibuang dengan bantuan aspirator, ke dalam tabung mikro berisi pelet DNA ditambahkan sephaglass 150 µl, dihomogenasi dengan vortex selama 1 menit selanjutnya sentrifugasi 13.000 rpm selama 30
detik. Supernatan dibuang dan ke dalam tabung ditambahkan 200 µl larutan Wash Buffer dihomogenasi dengan vortex selama 1 menit dan kemudian disentrifugasi 13.000 rpm selama 30 detik. Supernatan dibuang, dan diganti dengan etanol 70% dingin sebanyak 300 µl kemudian dihomogenasi dengan vortex selama 1 menit dan kemudian disentrifugasi 13.000 rpm selama 30 detik.
Setelah semua etanol dibuang, tabung mikro dibiarkan kering udara selama sekitar 10 menit, selanjutnya plasmid DNA dilarutkan dengan SDW sebanyak 30-50 µl, dihomogenasi dengan vortex dan tabung mikro yang berisi plasmid dibiarkan selama 5 menit pada suhu ruang. Selanjutnya disentrifugasi 13.000 rpm selama 1-2 menit. Selanjutnya supernatan yang berisi plasmid DNA dipindahkan ke tabung yang baru menggunakan mikropipet. Sebanyak 1 µl hasil isolasi digunakan untuk elektroforesis dan selanjutnya diamplifikasi dengan PCR.
Amplifikasi PCR. Untuk mendapatkan fargmen GH mature (mGH) masing-masing ikan dilakukan amplifikasi degan PCR. Primer yang digunakan untuk amplifikasi mGH ikan kerapu kertang (mGH) adalah primer forward El-mGH-F 5’- ctcgag cag cca atc aca gac ggc cag - 3’ dan primer reverse El-mGH-R 5’- aagctt cta cag ggt aca gtt ggc ctc agg - 3’ yang masing-masing dilengkapi dengan situs restriksi XhoI dan HindIII (digaris bawahi dan dicetak tebal). Primer untuk amplifikasi fragmen DNA GH mature ikan gurame (Og-mGH) adalah primer forward Og-mGH-F 5’- ggatcc cag cca atc aca gac agc cag - 3’ dan reverse Og-mGH-R 5’- gaattc cta cag agt gca gtt agc ttc tgg - 3’ yang dilengkapi dengan situs restriksi BamHI dan EcoRI. Selanjutnya primer untuk amplifikasi fragmen DNA GH mature ikan mas (Cc-mGH) adalah primer forward Cc-mGH-F 5’- ggatcc tca gac aac cag cgg ctc ttc - 3’ dan reverse Cc-mGH-R 5’- gtcgac cta cag ggt gca gtt gga atc cag - 3’ yang dilengkapi dengan situs restriksi BamHI dan SalI.
Reaksi PCR dilakukan dengan volume 10 µl yang mengandung 1 µl plasmid cDNA GH masing-masing ikan dari hasil isolasi, 1 µl primer GH mature forward maupun reverse (10 pmol/µl), 1 µl dNTP, 1 µl Ex Taq buffer, 0.05 µl Ex Taq polymerase (TAKARA) kemudian sisanya ditambahkan SDW. Selanjutnya proses PCR dijalankan pada suhu 94°C selama 3 menit (Pra PCR); (Denaturasi 94° C selama 30 detik; Annealing 67° C selama 30 detik; Extension 72° C selama 1
menit) sebanyak 35 siklus; dan Pasca PCR 72° C selama 3 menit: dan 4oC (tak hingga), untuk amplifikasi El-mGH dan Cc-mGH menggunakan suhu annealing 67°C, sedangkan Og-mGH menggunkan suhu annealing 69°C.
Ligasi ke vektor kloning. Fragmen DNA produk PCR diligasi (disambungkan) ke vektor kloning pGEM-T Easy menggunakan T4 DNA ligase (TAKARA). Vektor pGEM-T Easy disentrifugasi agar kandungannya terkumpul pada dasar tabung, selanjutnya reaksi ligasi dicampur pada tabung mikro dengan komposisi: 6,5 µl 2x buffer ligasi; 0,5 µl Vektor pGEM-T Easy (50 ng); 1 µl T4 DNA ligase sebanyak; produk PCR sebanyak 5 µl; dan SDW 5,2 µl. Inkubasi dilakukan selama 2 jam pada suhu ruang dan dilanjutkan semalaman di dalam refrigerator (suhu 4°C).
Pembuatan Sel Kompeten. Sel kompeten adalah sel bakteri yang digunakan dalam proses transformasi, untuk kloning (perbanyakan) digunakan bakteri Escherichia coli DH5α, sedangkan untuk ekspresi digunakan bakteri Escherichia coli BL21 (DE3). Pembuatannya adalah; koloni tunggal bakteri E. coli DH5α atau BL21 (DE3) dikultur dalam 25 ml LB (komposisinya adalah 1 gram tryptone 1%, 0,59 gram yeast exstract 0,5%, dan 1 gram NaCl 1% di dalam 100 ml SDW ) kemudian diinkubasi (shaker) pada suhu 37oC selama 16-18 jam. Selanjutnya 1% kultur E. coli diambil untuk dilakukan sub kultur dengan memasukkan ke dalam 25 ml LB yang baru kemudian selanjutnya diinkubasi selama 3 jam (peremajaan bakteri), selanjutnya kultur bakteri tersebut disimpan dalam wadah yang berisi es selama 30 menit.
Kemudian, kultur bakteri sebanyak 1,5 ml dimasukkan ke dalam tabung mikro dan disentrifugasi pada 5000 rpm selama 2 menit, supernatan yang terbentuk kemudian dibuang (dilakukan sebanyak 2 kali). Pelet yang ada dalam tabung mikro selanjutnya dicuci dengan menggunakan 1 ml NaCl mix dingin dan disentrifugasi selama 2 menit pada 5000 rpm, supernatan yang terbentuk dibuang dan kemudian ditambahkan CaCl2 mix dingin sebanyak 1 ml, selanjutnya di biarkan selama 20 menit dalam wadah yang berisi es, kemudian disentrifugasi kembali selama 2 menit pada 5000 rpm, selanjutnya supernatannya dibuang. Kemudian pelet yang terbentuk disuspensikan dengan 200 µl CaCl2 mix, selanjutnya campuran tersebut diinkubasi dalam es selama 20 menit hingga 1 jam, kemudian siap digunakan sebagai sel kompeten.
Transformasi. Transformasi merupakan proses memasukkan plasmid yang mengandung fragmen DNA insersi ke dalam bakteri E. coli DH5α sebagai wahana kloning plasmid atau ke dalam bakteri E. coli BL21 sebagai wahana ekspresi protein. Sebanyak 6,5 µl plasmid hasil ligasi dimasukkan ke dalam tabung mikro yang berisi sel kompeten. Kemudian, campuran ini didiamkan selama 20 hingga 30 menit di dalam wadah yang berisi es. Transformasi dilakukan dengan cara diberikan kejutan suhu 42oC selama 45 detik. Setelah itu tabung mikro diinkubasi on-ice selama 2-3 menit. Selanjutnya, sebanyak 200 µl LB ditambahkan ke dalam tabung mikro. (Larutan LB mengandung 1 gram tryptone 1%, 0,59 gram yeast extract 0,5%, 1 gram NaCl 1% dengan pelarut 100 ml SDW). Selanjutnya diinkubasi pada shaker dengan suhu 37oC selama 1,5 jam pada 200 rpm. Kemudian bakteri disebar di dalam media agarosa 2xYT yang mengandung IPTG, X-gal dan ampisilin, sehingga disingkat menjadi 2xYT (I, X, A). 2xYT mengandung tryptone 1,6%, yeast extract 1%, NaCl 0,5%, Bacto agar dalam SDW). Kemudian diinkubasi pada suhu 37oC selama 16-18 jam.
Identifikasi Transforman. Identifikasi dilakukan dengan metode cracking (Alimuddin et al. 2008). Koloni putih hasil transformasi yang tumbuh di atas agarosa 2xYT diambil menggunakan tusuk gigi steril dan dioleskan ke ujung tabung mikro dan dilanjutkan dengan pembuatan master plate agarosa 2xYT (I, X dan A). Master plate kemudian diinkubasi pada suhu 37oC sekitar 8 jam. Ke dalam tabung mikro yang telah dioleskan bakteri ditambahkan 10 µl cracking buffer, 10 µl EDTA 1 M dan 1 µl loading buffer cracking berisi KCl 1 M dengan perbandingan volume 1:1. (Cracking buffer mengandung 0,2 gram saccharosa, 40 µl NaOH 5 M, 50 µl SDS 10% dan sisanya SDW hingga volume larutan menjadi 1 ml). Selanjutnya tabung mikro di Spin down pada 5000 rpm selama 2 hingga 3 detik kemudian divortex. Larutan tersebut disentrifugasi pada 12.000 rpm selama 5 menit. Selanjutnya dielektriforesis sebanyak 10 µl supernatan yang terbentuk dengan gel agarose 0,7% untuk mengidentifikasi apakah bakeri yang sudah ditransformasi membawa plasmid yang berisi gen yang kita insersikan dan membandingkannya dengan kontrol, vektor pGEM-T Easy tanpa insersi fragmen DNA mGH.
Pembuatan Vektor Ekspresi Protein rGH
Isolasi Fragmen GH Mature. Plasmid pGEM-T Easy yang mengandung mGH (El-mGH, Og-mGH dan Cc-mGH) yang telah dikloning di dalam bakteri E coli DH5α kemudian diisolasi menggunakan kit GF-1 Plasmid DNA Extraction Kit (Vivantis) dengan prosedur yang sesuai dengan manual kit yang digunakan. Selanjutnya vektor pGEM-T Easy yang mengandung El-mGH (kerapu kertang) dipotong dengan menggunakan enzim restriksi XhoI dan HindIII, vektor pGEM-T Easy yang mengandung Og-mGH (gurame) dipotong dengan menggunakan enzim restriksi BamHI dan EcoRI, sedangkan vektor pGEM-T Easy yang mengandung Cc-mGH (mas) dipotong dengan menggunakan enzim restriksi BamHI dan SalI. Untuk mengeluarkan fragmen GH mature dari vektor pGEM-T Easy, pereaksinya adalah 5 µl masing-masing plasmid pGEM-T Easy yang mengandung mGH dimasukkan kedalam tabung mikro selanjutnya di tambahkan 5 µl Buffer (El-mGH: 10x M Buffer; Og-(El-mGH: 10x K Buffer; Cc-(El-mGH: 10x T Buffer), kemudian ditambahkan enzim restriksi masing-masing 1 µl, selanjutnya ditambahkan SDW sebanyak 38 µl. Fragmen mGH terpotong dan siap diligasikan ke vektor ekspresi protein.
Preparasi Vektor Ekspresi. Vektor ekspresi yang akan digunakan adalah
pCold 1 DNA (Takara-bio). Vektor ekspresi sebanyak 2 μl dimasukkan masing-masing ke dalam tabung mikro lalu dicampurkan dengan 5 µl 10x Buffer. Untuk El-mGH ditambahkan enzim restriksi XhoI dan HindIII, untuk Og-mGH menggunakan enzim BamHI dan EcoRI, dan untuk Cc-mGH menggunakan enzim BamHI dan SalI masing-masing 1 µl, kemudian ditambah SDW sebanyak 30 μl. Campuran ini diinkubasi pada suhu 37° C selama 2 hingga 4 jam. Selanjutnya, vektor yang sudah dipotong kemudian disimpan pada suhu -20° C hingga akan digunakan.
Ligasi mGH ke Vektor Ekspresi. Reaksi ligasi yang dilakukan meliputi 5 µl larutan mGH masing-masing El-mGH, Og-mGH, dan Cc-mGH; kemudian 0,5 µl pCold 1 DNA yang telah dipotong menggunakan enzim restriksi; 6,5 µl 5x buffer ligasi, dan 1 µl enzim T4 DNA ligase (TAKARA). Selanjutnya larutan diinkubasi selama 2 jam pada suhu ruang, kemudian inkubasi dilanjutkan semalaman direfrigerator (suhu sekitar 4oC).
Transformasi ke E. coli BL21. Bakteri yang digunakan untuk mengekspresikan protein rekombinan rGH adalah bakteri E. coli BL21 yang sebelumnya sudah dibuat menjadi kompeten. Sebanyak 6,5 µl plasmid hasil ligasi yang sudah diinsersikan gen dimasukkan ke dalam tabung mikro yang berisi sel kompeten. Kemudian, campuran ini didiamkan selama 20 hingga 30 menit di dalam wadah yang berisi es. Transformasi dilakukan dengan cara diberikan kejutan suhu 42oC selama 45-55 detik. Setelah itu tabung mikro diinkubasi on-ice selama 2-3 menit. Kemudian ditambahkan LB sebanyak 200 µl ke dalam tabung mikro. Selanjutnya diinkubasi pada shaker dengan suhu 37oC selama 1,5 jam pada 200 rpm, kemudian bakteri disebar di dalam media agarosa 2xYT yang ditambahkan ampisilin. Kemudian diinkubasi pada suhu 37oC selama 16-18 jam.
Identifikasi dan Peremajaan Transforman. Bakteri E. coli BL21 yang membawa plasmid pCold 1 DNA yang telah disisipi fragmen mGH ikan kerapu kertang (El-mGH), ikan gurame (Og-GH), dan ikan mas (Cc-mGH) dicracking kemudian diidentifikasi untuk membuktikan bahwa bakteri tersebut membawa plasmid yang berisi gen yang telah kita insersikan. Selanjutnya bakteri tersebut diremajakan dan dikultur secara massal untuk memproduksi protein rekombinan yang diekspresikan oleh plasmid pCold-mGH di dalam bekteri tersebut.
Produksi Protein rGH
Ekspresi protein rGH di dalam E. coli BL21. Klon bakteri E. coli BL21 yang positif mengandung pCold-mGH dikultur selama 16-18 Jam dengan dishake pada tabung erlenmeyer dengan media 2xYT cair 200 ml tambah ampisilin, selanjutnya subkultur selama 2 jam pada suhu 37oC dengan dishake. Selanjutnya kultur bakteri diberi kejutan dingin pada suhu 15oC selama 30 menit. Kemudian ditambahkan 200 µl IPTG 100 mM, kultur dilanjutkan selama 24 jam dengan dishake pada suhu 15oC, kemudian pelet bakteri dikoleksi dengan disentrifugasi 4000 rpm selama 5 menit, selanjutnya pelet bakteri E. coli BL21 yang mengandung protein rekombinan hormon pertumbuhan (rGH) dianalisis dengan teknik SDS-PAGE.
Analisis protein rGH. Pelet BL21 hasil ekspresi kemudian diresuspensi dengan PBS (16 mM Na2HPO4-2H2O, 4 mM NaH2 PO4·2H2O, 120 mM NaCl, pH
7.4) ditambah 0.1% (w/v) Triton X-100 kemudian dilisis dengan alat sonikasi 6 siklus dengan kekuatan penuh menggunakan probe 9 mm, dengan perlakuan 1 menit dihidupkan dan 1 menit dimatikan sambil suspensinya dibenamkan di dalam es. Kemudian disentrifugasi untuk memisahkan material yang tidak larut dalam homogenate sel, protein rGH akan terikat di dalam pelet dan supernatannya dibuang, selanjutnya pelet yang terbentuk dicuci dua kali dengan 1 M NaCl yang berisis 1% (w/v) Triton X-100 dan terakhir dibilas dengan PBS, selanjutnya pelet bakteri yang mengandung protein rGH ikan kerapu kertang, ikan gurame dan ikan mas dianalisis dengan teknik SDS-PAGE.
SDS-PAGE atau sodium dodecyl sulfate polyacrylamide gel elektroforesis merupakan teknik yang secara luas digunakan dalam bidang biokimia, forensik, genetika, dan biologi molekuler untuk memisahkan protein berdasarkan berat molekulnya dengan memigrasikannya pada gel elektroporesis atau SDS-PAGE berfungsi mengikat polipeptida sehingga terbentuk protein kompleks yang tereduksi sesuai dengan berat molekulnya. Protein dari 1 µg pelet bakteri dianalisis menggunakan metode SDS-PAGE dengan konsentrasi gel poliakrilamid 10%, dan protein divisualisasi menggunakan pewarna Coomassie Blue. Ukuran protein rGH diprediksi berdasarkan konsensus bahwa 10 kDa protein sama dengan 270 bp DNA.
Uji Bioaktivitas Protein rGH
Bioaktivitas protein rGH ditentukan dengan menganalisis pertumbuhan ikan nila yang diinjeksi dengan rGH dan dibandingkan dengan ikan nila yang hanya disuntik dengan PBS atau protein dari pCold 1 tanpa fragmen DNA mGH. Juvenil ikan nila ukuran ±11 g/ekor diinjeksi dengan protein total (inclusion body) dengan dosis 1 µg pelet bakteri yang dilarutkan dalam 10 μl PBS per gram ikan. Injeksi dilakukan secara intramuscular seminggu sekali selama 4 minggu. Bobot ikan diukur seminggu sekali selama 2 bulan pengamatan dan diakhir dihitung kelulus hidupannya
Analisis Data
Vektor kloning dan vektor ekspresi yang dihasilkan serta produksi protein rekombinan hormon pertumbuhan (rGH) ikan kerapu kertang (El-mGH), ikan
gurame (Og-mGH), dan ikan mas (Cc-mGH) disajikan dalam bentuk gambar kemudian dianalisis dan dijabarkan secara deskriptif. Selanjutnya data hasil uji bioaktivitas di analisis ragam dan jika terjadi perbedaan antar perlakuan dilanjutkan dengan uji beda nyata terkecil.
HASIL DAN PEMBAHASAN
Vektor Kloning Protein rGH
Isolasi Plasmid cDNA GH. Plasmid pGEM-T Easy yang mengandung cDNA; El-mGH, Og-mGH dan Cc-mGH berhasil diisolasi dari bakteri konstruksi E. coli DH5α dengan menggunakan kit FlexiPrep. Hal ini ditunjukkan dengan terbentuknya pita DNA dengan ukuran sekitar 3953 bp untuk pGEM-T Easy yang mengandung cDNA; El-GH, 3858 bp untuk Og-GH, dan 3648 bp untuk Cc-GH. Pita ini menunjukkan jumlah ukuran vektor pGEM-T Easy yang berukuran 3015 bp ditambah dengan cDNA GH masing-masing ikan; kerapu kertang, ikan gurame dan ikan mas (Gambar 3).
Gambar 3. Hasil isolasi plasmid pGEM-T Easy yang mengandung Cc-cDNA GH, Og-cDNA GH, dan El-cDNA GH. M: marka panjang fragmen DNA (2-lod ladder, BioLabs Inc., New England); angka di sebelah kiri: ukuran fragmen DNA marka; angka 1-2 adalah nomor klon bakteri hasil isolasi plasmid cDNA GH.
Analisis Fragmen GH Mature. Sekuens cDNA yang mengkodekan hormon pertumbuhan (GH) ikan kerapu kertang berdasarkan data Genbank EU280321 berukuran sekitar 938 bp yang menyandikan 205 asam amino dan dilengkapi dengan signal peptida (Lampiran 1). Untuk ikan mas sekuens cDNA yang mengkode hormon pertumbuhannya berukuran sekitar 1164 bp yang menyandikan 211 asam amino berdasarkan data Genbank M27000 (Lampiran 2), namun yang tersambung dalam plasmid pGEM-T Easy hanya bagian CDSnya yang berukuran sekitar 633 bp. Dan cDNA yang mengkode hormon pertumbuhan ikan gurame belum terdapat di data Genbank, namun berdasarkan penelitian Nugroho et al. (2008) sekuens cDNA yang mengkode hormon pertumbuhan ikan gurame berukuran sekitar 843 bp yang menyandikan 205 asam amino.
Prediksi asam amino gen GH menggunakan program GENETYX version 7 pada ikan kerapu kertang (Lampiran 3), ikan mas (Lampiran 4), dan ikan gurame (Lampiran 5), sehingga dapat ditentukan gen target atau disebut juga dengan GH
M 1 2 1 2 1 2 El-cDNA GH ◄pGEM-T Easy/ cDNA GH Og-cDNA GH 3,0 -2,0 -5,0 kb -Cc-cDNA GH ◄pGEM-T Easy/ cDNA GH
mature (mGH) yang digunakan dalam pembuatan protein rekombinan GH. Untuk ikan kerapu kertang (El-mGH) berukuran sekitar 576 bp, ikan mas (Cc-mGH) berukuran sekitar 579 bp, dan ikan gurame (Og-mGH) berukuran sekitar 576 bp yang masing-masing diambil dari daerah yang ditranslasikan atau CDS dengan menghilangkan signal peptidanya.
Signal peptida biasanya terdiri dari 16 hingga 50 asam amino yang diprediksi dengan memasukkan sekuens yang ditranslasi ke dalam program SignalP 3.0 Server pada website http://www.cbs.dtu.dk/services/signalP sehingga diketahui kemungkinan besar signal peptida CDS GH ikan kerapu kertang terdapat pada posisi 17 dan 18 (Lampiran 6), ikan mas terdapat pada posisi 22 dan 23 (Lampiran 7), pada ikan gurame terdapat pada posisi 17 dan 18 (Lampiran 8).
Amplifikasi PCR. Amplifikasi PCR cDNA GH masing-masing ikan; ikan gurame , ikan mas, dan ikan kerapu kertang dengan menggunakan primer spesifik menghasilkan pita DNA yang masing-masing berukuran sekitar 576 bp, 579 bp, dan 576 bp setelah dimigrasikan pada gel elektroforesis (Gambar 4)
Gambar 4. Produk PCR fragmen GH mature; Og-mGH, Cc-mGH, dan El-mGH. Kloning ke Vektor pGEM-T Easy dan Transformasi ke E. coli DH5α. Fragmen mGH ikan gurame (Og-mGH), ikan mas (Cc-mGH), dan ikan kerapu kertang (El-mGH) yang telah diamplifikasi dengan PCR kemudian disambungkan (ligasi) ke vektor kloning pGEM-T Easy untuk diperbanyak secara in vivo di dalam bakteri konstruksi E. coli DH5α. Plasmid yang dihasilkan disebut sebagai pT-mGH.
Keberhasilan dalam penyambungan (ligasi) sekuens GH mature ikan kerapu gurame (Og-mGH), ikan mas (Cc-mGH), dan ikan kerapu kertang (El-mGH) ke vektor kloning pGEM-T Easy dapat diketahui dengan cara mengidentifikasi masuknya plasmid tersebut pada bakter konstruksi E. coli DH5α (transforman). Koloni bakteri yang mengandung vektor yang tersisipi mGH akan tumbuh berwarna putih, sedang koloni bakteri yang mengandung vektor yang tidak tersisipi dengan mGH akan berwarna biru. Hal ini dikarenakan vektor pGEM-T
M 1 2 3 1 2 3 1 2 3 El-mGH Og-mGH Cc-mGH ◄mGH 0,3 -0,8 -0,5 -kb
Easy memiliki marker gen LacZ sebagai gen pelapor (Kobolak & Muller 2003). Selanjutnya Suharsono (2000) mengatakan bahwa dengan penambahan IPTG (Isopropil thiogalaktosida) dan X-gal (5-bromo-4-cloro-3-indolylbeta-D-galactopyranocide) pada media tumbuh, maka gen LacZ yang mengkode enzim β-galaktosidase dapat menguraikan X-gal menjadi galaktosa dan 5-bromo-4-kloroindigo, sehingga menghasilkan koloni berwarna biru. Namun, apabila terjadi insersi gen (rGH) pada MCS, maka gen LacZ tidak dapat berfungsi untuk menguraikan X-gal menjadi galaktosa sehingga koloni bakteri berwarna putih.
Gambar 5. Hasil cracking pGEM-T Easy/El-mGH, pGEM-T Easy/Og-mGH, dan pGEM-T Easy/Cc-mGH dari bakteri konstruksi E. coli DH5α. T pada gambar: marka ukuran plasmid pGEM-T Easy (3 kb) dan nomor 1-5 adalah nomor sampel klon bakteri.
Proses ligasi dan transformasi telah berhasil dilakukan. Hal ini dapat dilihat dari hasil cracking yang menunjukkan bahwa sebagian besar bakteri E. coli tersebut membawa plasmid pT-mGH (Gambar 5). Keberhasilan ligasi ditunjukkan dengan bertambah besarnya ukuran plasmid dibandingkan dengan ukuran pGEM-T Easy (pGEM-T= 3 kb). (Gambar 5). Selanjutnya koloni bakteri konstruksi E. coli DH5α yang positif mengandung plasmid rekombinan GH dikoleksi kemudian diremajakan dan ditumbuhkan pada media 2xYT + Ampisilin untuk diperbanyak secara in vivo (Gambar 6).
Gambar 6. Klon bakteri konstruksi E. coli DH5α yang mengandung pT-mGH.
DH5α: pT/El-mGH DH5α: pT/Og-mGH DH5α: pT/Cc-mGH pGEM-T Easy/El-mGH T 1 2 3 4 5 T pGEM-T Easy/Og-mGH T 1 2 3 4 5 T pGEM-T Easy/Cc-mGH T 1 2 3 4 5 T ◄3 kb
Vektor Ekspresi Protein rGH
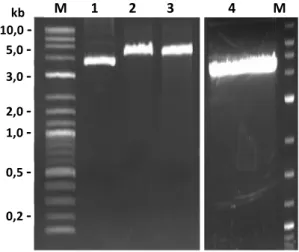
Isolasi Plasmid Fragmen GH Mature. Hasil elektroforesis plasmid pT-mGH (El-pT-mGH, Og-pT-mGH, dan Cc-pT-mGH) terdapat pita yang masing-masing berukuran sekitar 3,5 kb (Gambar 7). Hal ini menunjukkan bahwa plasmid pGEM-T Easy yang mengandung fragmen DNA mature berhasil diisolasi dari bakteri konstruksi E. coli DH5α.
Gambar 7. Isolasi plasmid pT-mGH dari bakteri konstruksi E. coli DH5α.
Selanjutnya, masing-masing plasmid pT-mGH dipotong dengan enzim restriksi yang sesuai dengan situs pemotongan yang dipasang diawal pada pembuatan primer. Sehingga, didapatkan hasil pemotongan pada Gambar 8 terdapat dua pita, pita pertama merupakan pGEM-T Easy yang berukuran sekitar 3,0 kb, sedangkan pita kedua merupakan fragmen DNA mature (mGH) berukuran sekitar 0,5 kb yang telah terlepas dari plasmid pT-mGH yang dipotong dengan enzim restriksi.
Gambar 8. Pemotongan pT-mGH dengan enzim restriksi untuk mengeluarkan mGH. pT/El-mGH pT/Og-mGH pT/Cc-mGH 0,5 M 1 2 3 M 1 2 3 3 2 1 M 0,2 -1,0 -3,0 -2,0 -10,0 -5,0 -kb pT/El-mGH pGEM-T Easy ► mGH ► - 0,5 - 1,0 - 3,0 - 10,0 - 2,0 pT/Cc-mGH pT/Og-mGH 2 1 M 2 1 M 2 1 M kb