GAMBARAN HISTOPATOLOGI HATI DAN GINJAL TIKUS
PADA PEMBERIAN FRAKSI ASAM AMINO NON-PROTEIN
LAMTORO MERAH (Acacia villosa)
PADA UJI TOKSISITAS AKUT
LILIS SUYANTI
B04103164
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRAK
LILIS SUYANTI. B04103164.
Gambaran Histopatologi Hati dan Ginjal Tikus pada Pemberian Fraksi Asam Amino Non-Protein Lamtoro Merah (Acaciavillosa) pada Uji Toksisitas Akut. Dibawah bimbingan EVA HARLINA dan WIWIN WINARSIH.
Acacia villosa adalah leguminosa yang potensial sebagai pakan ternak
karena mengandung protein tinggi (22-28%). Namun pemanfaatan A. villosa terkendala karena mengandung senyawa sekunder yang bersifat toksik. Penelitian ini bertujuan untuk mengetahui gambaran histopatologi organ hati dan ginjal tikus yang telah dicekok fraksi asam amino non-protein A. villosa dengan dosis 3.2, 8.0 dan 20 g/kg BB pada uji toksisitas akut fraksi asam amino-protein A. villosa. Sebanyak 10 ekor tikus putih (Rattus rattus) dari jenis Sprague-Dawley berumur empat minggu dibagi menjadi 4 kelompok yang terdiri dari kelompok kontrol dan 3 kelompok perlakuan dengan 3 kali pengulangan yang diberi fraksi AANP. Perlakuan diberikan secara intragastrik dengan dosis tunggal 3.2, 8.0 dan 20 g/kg BB. Hasil pengamatan histopatologi menunjukkan bahwa ginjal dan hati tikus pasca pemberian AANP dosis 20 g/kg BB mengalami perubahan yang lebih berat dibandingkan dosis 3.2 dan 8.0 g/kg BB. Secara umum ginjal mengalami degenerasi hidropis, apoptosis, endapan protein pada tubulus dan edema pada glomerulus, sedangkan hati mengalami degenerasi hidropis, degenerasi lemak dan apoptosis. Berdasarkan hasil evaluasi histopatologi disimpulkan bahwa dosis 20 g/kg BB lebih toksik dibandingkan dosis 3.2 dan 8.0 g/kg BB.
Kata kunci: Acacia villosa, ginjal, hati, asam amino non-protein, uji toksisitas akut
GAMBARAN HISTOPATOLOGI HATI DAN GINJAL TIKUS
PADA PEMBERIAN FRAKSI ASAM AMINO NON-PROTEIN
LAMTORO MERAH (Acacia villosa)
PADA UJI TOKSISITAS AKUT
LILIS SUYANTI
B04103164
SKRIPSI
Sebagai salah satu syarat memperoleh gelar Sarjana Kedokteran Hewan di
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul penelitian : Gambaran Histopatologi Hati dan Ginjal Tikus pada Pemberian Fraksi Asam Amino Non-Protein Lamtoro Merah (Acacia villosa) pada Uji Toksisitas Akut
Nama : Lilis Suyanti
NRP : B04103164
Disetujui oleh,
Dr. drh. Eva Harlina, MSi Dr. drh. Wiwin Winarsih, MSi
Ketua Anggota
Diketahui,
Dr. Nastiti Kusumorini Wakil Dekan
PRAKATA
Bismillahirrahmanirrahim
Alhamdulillah, puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini. Skripsi yang berjudul Gambaran Histopatologi Hati dan
Ginjal Tikus pada Pemberian Fraksi Asam Amino Non-Protein Lamtoro Merah (Acacia villosa) pada Uji Toksisitas Akut merupakan salah satu syarat
untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Sebuah penghargaan yang tak terlupakan penulis ingin mengucapkan rasa terima kasih kepada :
• Kedua orangtua tercinta Dedi Supriadi dan Sudiwati, yang selalu memberikan do’a, dukungan, semangat dan kasih sayangnya kepada penulis, serta adikku tersayang Desi Anggraeni
• Dr. Drh. Eva Harlina, MSi sebagai dosen pembimbing pertama atas segala bimbingan, didikan, perhatian, waktu serta kesabaran yang telah diberikan kepada penulis.
• Dr. Drh. Wiwin Winarsih, MSi sebagai dosen pembimbing kedua atas segala waktu, bimbingan, perhatian serta kesabaran yang telah diberikan kepada penulis.
• Drh. Ekowati Handharyani, MS. Ph.D sebagai dosen penguji atas segala masukan yang diberikan kepada penulis.
• Dr. Razak Achmad Hamzah, MS atas segala bimbingan, masukan dan nasihat yang diberikan kepada penulis.
• Keluarga besar Cimanggu (wa Neni, wa Yati, wa Edi, Tante Mari) yang telah memberikan bantuan baik materil maupun moral
• Teman seperjuangan penelitian Acacia villosa team (Lia, Wiwik, Faiq), Patology’s crew dan tim asisten Patsis 2 (Pritta, Lia, Ramlah, Ochie, Triono, Elvita, Mudya, Ayu, Ais)
• Pondok Sakha’s crew (Pritta, Widia, Lia, Ramlah, Elia, Qq dan Siti) yang telah menjadi rumah kedua setelah rumah keluarga, Love you All.
• Seluruh ”Keluarga kecilku”(mba-mba, teman-teman serta adik-adikku) • DKM An-Nahl atas dukungan dan semangat yang diberikan kepada penulis. • Ikhwahfillah IPB umumnya dan khususnya FKH, terimakasih untuk ukhuwah
yang sebelumnya tidak saya dapatkan ditempat lain. Semoga Allah SWT mempertemukan kita di lain waktu. Keep fighting, sabar, semangat, dan istiqomah.
• Teman-teman angkatan 40 “Gymnolaemata”(Indra dan Triono terimakasih atas bantuannya) serta semua yang tidak bisa saya sebutkan satu persatu. • Adik-adik angkatan 41, 42 dan 43.
Terima kasih atas segala dukungan, semangat dan doa yang diberikan. Semoga Allah SWT membalas segala kebaikan. Penulis menyadari bahwa dalam penulisan banyak kekurangan, oleh karena itu saran dan kritik sangat diharapkan. Semoga karya ilmiah ini dapat bermanfaat bagi kita semua.
Bogor, Januari 2008
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 09 Februari 1985, anak pertama dari dua bersaudara dari Ayah Dedi Supriadi dan Ibunda Sudiwati. Pada tahun 1997 penulis lulus dari Sekolah Dasar Negeri (SDN) Loji 1 Bogor, Jawa Barat dan tahun 2000 lulus Sekolah Lanjutan Tingkat Pertama (SLTP) Kornita, Bogor. Pada tahun 2003 penulis lulus dari Sekolah Menengah Umum (SMU) Rimba Madya, Bogor dan kemudian tahun 2003 penulis diterima menjadi mahasiswa di Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Penulis aktif di kelembagaan DKM An-Nahl (tahun 2005-2007) dan Himpro Ruminansia tahun 2005 dan 2006. Penulis juga pernah menjadi asisten Pendidikan Agama Islam (PAI) pada semester 6-7 tahun ajaran 2006-2007 dan asisten praktikum Patologi Sistemik II pada tahun ajaran 2007-2008.
DAFTAR ISI
Halaman
DAFTAR TABEL... .
viii
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN... . x
PENDAHULUAN
Latar Belakang... 1 Tujuan Penelitian... 2 Manfaat Penelitian... 2TINJAUAN PUSTAKA
Acacia villosa... 3Uji Toksisitas Akut... 5
Hati... 6
Ginjal... 9
Asam Amino Non-Protein... 12
BAHAN DAN METODE
Waktu dan Tempat... … 15Bahan dan Alat... … 15
Metode Penelitian... 15
HASIL DAN PEMBAHASAN
Hasil Evaluasi Histopatologi Hati... 18Hasil Evaluasi Histopatologi Ginjal... 22
KESIMPULAN DAN SARAN...
28
DAFTAR PUSTAKA...
29
DAFTAR TABEL
Halaman
1. Komposisi nutrisi Acacia villosa……….. 5 2. Parameter skoring evaluasi tubulus dan glomerulus organ hati pada10 lapang pandang di sekitar vena sentralis... 16 3. Parameter skoring evaluasi tubulus dan glomerulus organ ginjal pada
10 lapang pandang ... 17 4. Rataan peringkat Kruskal Wallis skor histopatologi hati pasca pemberian
fraksi asam amino non-protein (AANP) A..villosa pada Uji Toksisitas Akut... 18 5. Rataan peringkat Kruskal Wallis skor histopatologi ginjal pasca pemberian
fraksi asam amino non-protein (AANP) A. villosa pada Uji Toksisitas Akut... 23
DAFTAR GAMBAR
Halaman
1. A. villosa... 4
2. Struktur kimia asam amino non-protein... 14
3. Degenerasi hidropis pada hati………... 19
4. Degenerasi lemak dan apoptosis pada hati……….…… 21
5. Degenerasi hidropis dan apoptosis pada ginjal... 24
6. Endapan protein pada ginjal……….. 26
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Penyediaan pakan secara berkesinambungan, berkualitas tinggi, ekonomis dan praktis diupayakan para peternak untuk memperoleh hasil yang lebih baik. Di Indonesia, penyediaan pakan umumnya dihadapkan pada beberapa kendala antara lain: 1) kualitas pakan yang rendah, 2) keterbatasan sumber pakan serta 3) jarak antara sumber pakan dan peternakan (Trisyulianti et al. 2001). Untuk itu diperlukan sumber pakan baru yang diharapkan dapat mengatasi kendala-kendala di atas.
Hijauan merupakan bahan pakan yang mengandung serat kasar tinggi dan memegang peranan penting bagi herbivora. Ternak memerlukan hijauan dalam jumlah yang besar yaitu sekitar 90% (Sugeng 1992). Hijauan di Indonesia umumnya bersumber dari sisa hasil pertanian, rumput-rumputan, semak-semak, serta dedaunan yang kualitas dan kuantitasnya sangat bervariasi. Rumput sebagai pakan tunggal kurang mencukupi kebutuhan ternak akan nutrisi karena kualitas protein yang rendah, yaitu 3-10 % protein kasar. Untuk meningkatkan produksi ternak di Indonesia dapat dilakukan antara lain dengan memilih jenis hijauan yang memadai baik secara kualitas maupun kuantitasnya.
Hijauan leguminosa pohon kaya akan nitrogen dan tidak bergantung pada kondisi nitrogen dalam tanah atau pemberian pupuk karena sifatnya dapat memanfaatkan nitrogen dari udara melalui bintil-bintil akar. Leguminosa yang biasa digunakan sebagai pakan ternak antara lain Caliandra tetragona (kaliandra bunga putih), Sesbania grandiflora (turi), Leucaena leucocephala (lamtoro), dan yang sedang dalam penelitian adalah Acacia villosa.
Acacia villosa memiliki kandungan protein yang cukup tinggi (22%-28%),
sehingga A. villosa sangat berpotensi untuk digunakan sebagai sumber protein bagi ternak ruminansia (Wina dan Tangendjaja 2000). Namun Acacia villosa mengandung senyawa yang bersifat toksik, diantaranya senyawa tanin dan asam amino non-protein. Kandungan senyawa sekunder A. villosa meliputi total phenol
sebesar 15.24% berat kering, asam amino non-protein sebesar 5.64% dan kandungan tanin terkondensasi sebesar 12.51% (Bansi 2001).
Pemberian A. villosa sebagai pakan ternak pada taraf 30% menghasilkan palatabilitas dan kecernaan yang rendah (Sugiarto 2002). Pakan tikus yang mengandung 15% A. villosa menyebabkan kerusakan ringan pada ginjal dan hati (Fajar 2004; Herdiana 2004). Pemberian A. villosa pernah dilakukan pada ayam, namun menunjukkan dampak negatif berupa penurunan palabilitas, konversi pakan dan bobot badan serta kerusakan pada organ ginjal dan hati (Santoso 2002). Pemberian A. villosa 70% dari total pakan dengan masa adaptasi juga pernah dilakukan pada domba Garut, namun menimbulkan kelemahan umum, dan pada dosis 100% menimbulkan efek toksik bahkan kematian (Bariata 2001).
Pengujian toksisitas akut (LD50) adalah pengujian terhadap suatu bahan yang dapat menimbulkan kematian 50% hewan percobaan. Pengujian ini diperlukan untuk mengetahui efek toksik dan perkiraan jumlah maksimum A.
villosa yang dapat diberikan pada hewan coba sebagai pakan ternak. Penelitian ini
menggunakan tikus sebagai hewan percobaan karena tikus tidak mempunyai rumen sehingga aktivitas mikroba rumen yang diduga dapat berperan dalam proses pencernaan A. villosa dapat dihilangkan. Selain itu tikus lebih sensitif terhadap toksin tanaman (Smith et al. 2001).
Tujuan
Penelitian ini bertujuan untuk mengetahui gambaran histopatologi organ hati dan ginjal tikus yang dicekok fraksi asam amino non-protein Acacia villosa dengan dosis 3.2, 8.0 dan 20 g/kg BB pada uji toksisitas akut
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai gambaran histopatologi hati dan ginjal tikus akibat pemberian fraksi asam amino non-protein Acacia villosa dosis 3.2, 8.0 dan 20 g/kg BB secara intragastrik sehingga dapat dijadikan acuan dalam penggunaanya sebagai pakan ternak.
TINJAUAN PUSTAKA
Acacia villosa
Acacia villosa merupakan perdu yang tidak berduri atau tanaman kecil,
tegak, tinggi 1-3 m bahkan mencapai 5 m dengan batang dan cabang yang berwarna merah tua. Memiliki batang yang banyak dengan sistem perakaran yang dangkal dan kuat. Daun dicirikan majemuk dan bersirip ganda, sirip terdiri atas 2-10 pasang, panjang 4-9 cm, berbunga pendek yang terdiri atas 20-40 butir bunga. Bunga berkelamin dua, berwarna putih, kemudian berubah menjadi kekuningan. Buahnya berbentuk polong, pipih, berwarna cokelat mengkilap dengan dengan ukuran 1.5 x 0.5-2 cm. Setiap buah polong berisi 1-8 buah biji yang berbentuk telur juga berwarna cokelat (Jukema dan Danimihardja 1997).
Acacia berasal dari Amerika tropik, umumnya dijumpai di Amerika tengah
bagian selatan dan pulau-pulau hindia barat terutama Curacao dan Barbados. Tahun 1920 diperkenalkan di Jawa dengan nama wata pana (Bansi 2001), dan berkembang secara alami di Yogyakarta. Di Hindia barat A. villosa menyebar sangat mudah dan tidak pernah ditanam. Disamping tidak berbahaya bagi rumput liar di Indonesia, A. villosa dapat digunakan sebagai tanaman alternatif Leucaena
leucocephala.
Acacia villosa termasuk dalam famili leguminose dengan subfamili
Mimosidae (Perez et al. 1999). Genus Acacia villosa memiliki banyak jenis, diantaranya A. villosa dan A. angussitima. Sinonim dari Acacia villosa adalah
Mimosa glauca, Acacia glauca, dan Acaciella villosa. Di Indonesia biasa disebut
mlanding merah, mlanding sebrang (Jawa), petes merah (Timor barat). Di negara lain dikenal dengan nama wild dividivi, redwood, watapana (Inggris), acacia (Amerika), dan amourette (Perancis). Acacia villosa lebih menyukai iklim agak kering, tetap tumbuh dengan baik pada pertengahan curah hujan tahunan 200-500 mm dan kelembaban nisbi 55-70%. Tanaman ini kurang tumbuh dengan baik pada temperatur rendah. A. villosa ditemukan pada vegetasi sekunder, terutama pada kawasan batu berkapur dan tanah tidak berbatu (Jukema dan Danimihardja 1997).
Gambar 1 Acacia villosa. Sumber: Perez et al. 1999
Di Indonesia, A. villosa digunakan untuk merehabilitasi tanah tererosi dan hutan gundul serta dijadikan tanaman hias dan pupuk hijau. Selain itu dapat juga digunakan sebagai kayu bakar dan bahan dasar pembuat peralatan rumah tangga. Di Karibia, infus akar atau daun dalam cuka serta kulit batang dalam air digunakan sebagai obat kumur untuk menyembuhkan sakit tenggorokan dan radang mulut, rebusan ranting yang dicampur cuka daan gula dapat menyembuhkan batuk. Di Timor Barat, pohon ini telah digunakan sebagai pakan ternak. Di Jawa, ternak tidak begitu menyukai tanaman ini (Jukema dan Danimihardja 1997). Di Indonesia terdapat dua varietas A. villosa, yaitu yang berdaun kecil dan berdaun besar. Perbedaan kualitas tersebut berdasarkan atas jumlah sirip yang dimiliki A. villosa varietas daun kecil memiliki jumlah sirip 6-12 pasang, sedangkan varietas daun besar memiliki sirip sampai 16 pasang.
Acacia villosa mengandung protein yang tinggi yaitu 22-28%, sehingga
sangat potensial sebagai sumber protein ternak. Namun pemberian A. villosa dalam jumlah besar terkendala karena mengandung senyawa asam amino non-protein (AANP) dan tanin yang bersifat toksik dan anti nutrisi (Wina dan Tangendjaja 2000).
A. villosa memiliki kandungan senyawa antinutrisi yang meliputi senyawa
2.88% (Jukema dan Danimihardja 1997). Komposisi nutrisi A. villosa disajikan pada Tabel 1.
Tabel 1 Komposisi nutrisi Acacia villosa
Kandungan Persentase Protein 26-28 Ekstrak Ether 4-5 DNF 20-28 ADF 12-19 Selulosa 7-9 Lignin 5-9 Ash 3-4 Phosphat 0,2-0,4 Kalsium 0,6-0,7
Sumber : Lowry et al. (1992)
Menurut Jukema dan Danimihardja (1997), analisis per 100 gram daun kering Acacia villosa yang berasal dari Indonesia mengandung 27 gram protein kasar, 4.8 gram ekstrak ether, 24 gram serat kasar yang tidak tidak dapat dicerna, 12.6 polifenol dan 6 gram tanin.
Uji Toksisitas Akut
Penelitian mengenai LD50 atau Lethal Dose 50 biasa dilakukan sebagai uji toksisitas akut. Uji toksisitas akut dilakukan dengan memberikan suatu bahan yang akan diuji sebanyak satu kali, atau beberapa kali dalam jangka waktu 24 jam (Lu 1995). Uji toksisitas akut dapat memberikan petunjuk mengenai organ sasaran, efek toksik dan dosis yang akan digunakan untuk pengujian yang lebih lama.
Dosis lethal median (LD 50) didefinisikan sebagai dosis tunggal suatu zat yang dapat menyebabkan kematian 50% hewan coba (Lu 1995). Nilai LD50 yang diperoleh secara statistika menggambarkan estimasi paling baik dari dosis yang menimbulkan kematian pada 50% hewan uji dan selalu disertai probabilitas
kisaran nilainya. Penentuan nilai LD50 secara tepat diperlukan untuk pemilihan dosis lain yang akan menimbulkan kematian lebih dari 50% dan kurang dari 50% hewan coba. Nilai LD50 dipengaruhi oleh spesies hewan coba, cara pemberian toksikan, dosis toksikan dan faktor lingkungan. Senyawa-senyawa yang digunakan pada pengujian LD50 dapat memberikan efek toksisitas pada sistem otonom tubuh, sensorik, neuromuskuler, kardiovaskuler, pernafasan dan gastrointestinal. Pemeriksaan histopatologis dilakukan pada semua organ yang menunjukan lesi yang jelas antara lain jantung, otak, paru-paru, thymus, hati, ginjal, usus halus, usus besar, kelenjar adrenal, pankreas dan limpa (Lu 1995).
Kemungkinan Target Organ Senyawa AANP Acacia villosa Hati
Anatomi dan Fisiologi Hati
Hati merupakan kelenjar terbesar dari tubuh. Hati terdiri atas sel-sel hati (hepatosit) yang tersusun radial ke arah luar vena sentralis. Sel hati berbentuk polihedral dengan inti bulat dan terletak di tengah (Delman dan Brown 1992). Pada beberapa sinusoid akan ditemukan sel Kuppfer, yang merupakan sel makrofag normal yang ditemukan di hati.
Permukaaan hati diliputi oleh lapisan jaringan ikat padat, dan ditutupi oleh peritoneum. Hati tersusun dalam lobulus yang didalamnya mengalir darah melewati sel-sel hati melalui sinusoid dari cabang vena porta hepatika ke dalam vena sentralis tiap lobulus. Setiap lobulus hati terbangun dari berbagai komponen, yaitu sel-sel parenkim hati (hepatosit), vena sentralis, sinusoid, cabang-cabang vena porta, cabang-cabang arteri hepatika, sel Kupffer dan kanalikuli billiaris. Sel-sel Kupffer yang berada dalam lumen sinusoid bertindak sebagai makrofag yang memiliki fungsi fagositik (Ganong 2003).
Hati mendapat vaskularisasi ganda, yaitu melalui vena porta dan vena hepatika. Melalui vena porta masuk darah yang berasal dari saluran pencernaan dan organ abdomen lain yaitu limpa, pankreas dan kantung empedu. Darah yang masuk mengandung berbagai nutrisi yang baru diserap dan siap untuk diproses lebih lanjut oleh hati. Selain nutrisi, turut masuk berbagai bakteri, darah merah
Sebanyak 75-80 % darah pada organ hati berasal dari vena porta sedangkan dari arteri hepatika mengalir sekitar 20-25 % darah yang kaya oksigen ( MacLachan dan Cullen 1995).
Hati adalah organ terbesar dan mempunyai fungsi metabolisme paling kompleks di dalam tubuh. Organ ini terlibat dalam metabolisme zat makanan serta sebagian besar obat dan toksikan. Hepatosit merupakan sel utama yang bertanggung jawab terhadap peran sentral hati dalam metabolisme. Sel-sel ini terletak diantara sinusoid yang terisi darah dan empedu. Hati mendapat darah dari vena porta dan arteri hepatika, kemudian disalurkan melalui vena sentralis dan vena hepatika kedalam vena cava. Hati sering menjadi organ sasaran kerusakan karena beberapa hal. Sebagian besar toksikan memasuki tubuh melalui sistem gastrointestinal, dan setelah diserap toksikan dibawa oleh vena porta ke hati. Hati memiliki enzim yang mampu memetabolisme xenobiotik (terutama sitokrom P-450). Hal ini menyebabkan sebagian besar toksikan menjadi kurang toksik dan mudah larut air, sehingga lebih mudah dieksresikan. Toksikan dapat menyebabkan berbagai perubahan pada berbagai organel sel hati, sehingga mengakibatkan perlemakan hati, nekrosis hati, kolestasis dan sirosis (Lu 1995).
Fungsi detoksikasi pada substansi yang larut dalam air akan lebih mudah dieksresikan melalui ginjal. Fungsi detoksikasi sangat berhubungan erat dengan fungsi ekresi, karena hati mempunyai kemampuan untuk mengeksresikan berbagai macam subtansi sederhana, seperti logam berat yang tidak diubah lewat empedu (Kelly 1993). Hati adalah lokasi yang paling penting dalam sintesis protein. Hampir semua protein serum disintesis di hati, termasuk protein yang kritis seperti albumin dan faktor pembekuan darah (Cunningham 2002).
Dalam kaitannya dengan suplai oksigen dan nutrisi, hati terdiri dari tiga zona yaitu, zona pertama adalah zona yang terletak paling dekat dengan vena sentralis. Pada zona ini suplai oksigen dan nutrisi paling banyak. Zona kedua adalah midzona atau zona yang terletak di tengah lobulus yang mendapat suplai oksigen dan nutrisi sedang. Zona ketiga adalah zona yang letaknya paling jauh dari vena sentralis. Zona ketiga adalah zona yang paling sedikit mendapatkan suplai oksigen sehingga pada zona ini mudah mengalami hipoksia. Pada zona pertama terjadi sintesis glukosa dan glikogenolisis. Zona ini merupakan daerah
yang penting tempat terjadinya metabolisme konjugasi obat-obatan. Zona kedua merupakan tempat penyimpanan glikogen, lemak, formasi pigmen dan tempat metabolisme obat-obatan serta racun. Zona ketiga menunjang fungsi lainnya (MacFarlane et al. 2000).
Patologi Hati
Pada gangguan fungsi hati sering terjadi peningkatan bilirubin total hati. Kegagalan dalam proses detoksikasi ditandai dengan peningkatan kadar enzim-enzim transminase, yaitu Serum Glutamate Oxaloacetat Transminase (SGOT) dan
Serum Glutamat Pyruvat Transminase (SGPT). Enzim-enzim tersebut merupakan
enzim yang dapat digunakan untuk mendeteksi kelainan hati secara dini. Enzim SGOT (Serum Glutamate Oxaloacetat Transminase) tidak hanya terdapat pada sel hati saja tetapi juga pada jaringan lain yaitu jantung, pankreas, ginjal, tulang dan otot (Girinda 1994).
Gangguan fungsi hati dapat menyebabkan kadar protein plasma (albumin dan globulin) mengalami penurunan, sedangkan pada uji koagulasi, waktu protombin dapat memanjang. Hal ini terjadi karena faktor-faktor pembeku akan berkurang karena adanya gangguan yang terjadi di hati (Corwin 2001).
Hati sering menjadi organ sasaran kerusakan karena beberapa hal. Sebagian besar bahan toksik masuk ke tubuh melalui sistem gastrointestinal dan setelah diserap, toksin akan dibawa oleh vena porta ke hati. Toksikan dapat menyebabkan berbagai perubahan pada berbagai organel sel hati, sehingga mengakibatkan perlemakan hati, nekrosis, kolestasis, dan sirosis (Lu 1995).
Hati adalah organ yang paling umum mengalami kerusakan karena racun. Hal ini disebabkan hati menerima suplai darah dari vena porta sekitar 80%, yang mengalir dari saluran pencernaan. Bahan-bahan toksik dari saluran cerna seperti yang berasal dari tumbuhan, fungi dan produk bakteri akan diabsorbsi kedalam pembuluh darah portal dan ditransfer ke hati, karena hati merupakan organ detoksikasi (MacLachlan dan Cullen 1995).
Hati dapat mengalami beberapa perubahan, kerusakan pada hati dapat bersifat irreversible (tetap) dan reversible (sementara). Degenerasi merupakan
Penyebab degenerasi sel bermacam-macam antara lain gangguan metabolisme, toksin dan trauma. Apabila degenerasi sel berlangsung terus-menerus, maka dapat menyebabkan kematian sel (nekrosa).
Degenerasi sel dapat berupa degenerasi berbutir, degenerasi hidropis dan degenerasi lemak. Degenerasi terjadi karena adanya gangguan biokimawi yang disebabkan oleh iskemia, anemia, metabolisme abnormal dan zat kimia yang bersifat toksik. Degenerasi yang berlangsung terus-menerus akan menyebabkan kematian sel yang bersifat menetap (irreversible). Kematian sel dapat terjadi melalui proses apoptosis dan nekrosa sel. Apoptosis merupakan mekanisme biologi yang merupakan salah satu jenis kematian sel terencana. Apoptosis digunakan oleh organisme multisel untuk membuang sel yang sudah tidak diperlukan oleh tubuh. Apoptosis berbeda dengan nekrosis. Apoptosis pada umumnya berlangsung seumur hidup dan bersifat menguntungkan bagi tubuh, sedangkan nekrosis adalah kematian sel yang disebabkan oleh kerusakan sel secara akut. Keputusan untuk melakukan apoptosis berasal dari sel itu sendiri, dari jaringan yang mengelilinginya, atau dari sel yang berasal dari sistem imun (Anonim 2006).
Pada penelitian yang dilakukan oleh Pujian (2007), perubahan yang terjadi pada hepatosit akibat pemberian fraksi AANP dan fraksi polifenol daun A. villosa berupa degenerasi dan nekrosa sel. Degenerasi yang dialami adalah degenerasi berbutir dan degenerasi hidropis.
Ginjal
Anatomi dan Fisiologi Ginjal
Ginjal merupakan organ utama yang berperan terhadap homeostatis air dan elektrolit. Ginjal juga merupakan organ utama yang terkena efek toksisitas jika tubuh terpapar zat toksik. Fungsi utama ginjal adalah mengeluarkan limbah metabolisme, memusnahkan bahan toksik, mengatur cairan, garam, keseimbangan asam basa, serta mengatur tekanan darah (Dellman dan Brown 1992). Selain itu ginjal berfungsi memekatkan toksikan pada filtrat dan membawa toksikan melalui tubulus. Ginjal juga memiliki fungsi sebagai penyingkir buangan metabolisme normal dan mengeksresikan xenobiotik dan metabolitnya (Lu 1995). Ginjal juga
memiliki fungsi sebagai organ endokrin yang dapat menghasilkan hormon-hormon eritropoetin, renin dan prostaglandin (Huminto et al. 1995).
Ginjal terletak di retroperitoneum vertebralis lumbalis, dibungkus oleh kapsula yang normalnya dapat bergerak bebas pada permukaanya (Maxie 1993), berpasangan dan berwarna merah kecoklatan. Pada umumnya ginjal berbentuk seperti kacang dengan hillus renalis yaitu tempat masuknya pembuluh darah dan keluarnya ureter (Hartono 1992). Ginjal terbagi menjadi dua bagian, yaitu korteks dan medulla, dengan perbandingan rata-rata 1 banding 2 atau 1 banding 3 (Maxie 1993), dan ukuran ginjal dalam berbagai spesies sangat ditentukan oleh jumlah nefron (Ganong 2003).
Unit fungsional ginjal yaitu nefron. Nefron memiliki enam segmen yaitu: (1) Kapsula glomerulus yang merupakan ujung buntu yang meluas pada nefron, (2) Tubuli konvoluti dan (3) Tubuli rekti proksimalis, (4) Segmen tipis, (5) Segmen tebal pada nefron dan (6) Tubuli konvoluti distalis (Delman dan Brown 1992). Nefron memiliki fungsi dasar membersihkan plasma darah dari substansi yang tidak diinginkan oleh tubuh. Biasanya substansi tersebut berasal dari hasil metabolisme urea, kreatinin, asam urat, dan ion-ion natrium, kalium, klorida, serta ion-ion hidrogen dalam jumlah yang berlebihan (Guyton 1994).
Glomerulus tersusun secara kompleks atas kapiler-kapiler dalam suatu matriks glikoprotein yang disebut mesangium. Aliran darah yang masuk melalui kapiler menjadi sumber bagi terbentuknya filtrat glomerulus. Kerusakan pada barrier filtrasi glomerulus menyebabkan berbagai manifestasi klinis pada penyakit ginjal. Bentuk utama dari manifestasi klinis tersebut adalah lolosnya protein berberat molekul kecil pada filtrat glomerulus dan urin. Selain itu, aliran darah abnormal pada kapiler juga dapat menyebabkan edema ginjal (Confer dan Panciera 1995).
Reaksi ginjal terhadap rangsangan dari luar serupa dengan organ tubuh lainnya, yaitu sesuai dengan mekanisme patologi pada umumnya. Bagian ginjal yang berfungsi sebagai alat penyaring adalah glomerulus yang bekerja berdasarkan faktor-faktor hemodinamika dan osmotik. Glomerulus dibentuk oleh tumpukan kapiler yang dilayani oleh arteriola afferens dan dialirkan oleh arteriola efferens (Ganong 2003).
Pada keadaan normal glomerulus tidak dapat dilalui oleh protein yang bermolekul besar, tetapi pada keadaan patologis protein tersebut dapat lolos (Junquera et al. 1998). Sel tubuli selain berfungsi mereabsorbsi, juga menambahkan zat-zat kimiawi seperti yodium, amonia dan hippuric acid. Pada disfungsi glomerulus, bahan-bahan asing tiba di tubulus dalam kadar yang abnormal melalui ruang Bowman. Hal ini menyebabkan sel epitel tubulus mengalami degenerasi bahkan kematian jika terlalu banyak bahan-bahan yang harus diserap kembali.
Tubulus proksimalis memiliki fungsi utama yaitu menyerap kembali natrium, albumin, glukosa dan air, dan juga bermanfaat dalam penggunaan kembali bikarbonat. Epitelium tubulus proksimalis paling sering terserang iskemia atau rusak akibat toksin, karena kerusakan yang terjadi akibat laju metabolisme yang tinggi.
Patologi Ginjal
Ginjal merupakan organ yang mempunyai fungsi utama dalam mengeksresikan nitrogenous wastes seperti ureum, uric acid, kreatinin, dan ammonium. Pada studi toksisitas, fungsi ginjal dapat dievaluasi melalui urinalisis dan serum darah. Serum darah yang diperiksa adalah kreatinin dan ureum (Seely 1999). Ureum disintesis dari ammonia selama proses katabolisme protein. Kadar ureum bergantung pada jumlah asam amino yang yang dikatabolis. Jumlah ureum bervariasi dalam urin sesuai dengan jumlah ureum yang difiltrasi dan masukan protein diet (Ganong 1995). Kadar ureum yang tinggi diakibatkan oleh faktor gangguan ginjal, diet tinggi protein dan proses katabolisme jaringan (Meyer et al. 1992). Kadar ureum rendah dikarenakan kurangnya asupan protein akibat kurang makan, gangguan penyerapan dan akibat insufiensi hati.
Parameter lain yang digunakan untuk mengetahui fungsi ginjal adalah kadar kreatinin. Kreatinin merupakan hasil degradasi dari kreatin dan merupakan produk akhir dari metabolisme otot. Kreatinin disintesis dari asam amino arginin dan glisin di dalam hati dan ginjal. Penurunan laju filtrasi glomerulus dapat meningkatkan konsentrasi kreatinin dalam serum (Meyer et al. 1992). Kadar
kreatinin tidak dipengaruhi oleh umur, jenis kelamin, aktifitas dan diet, dan kreatinin dieksresikan melalui urin.
Kerusakan yang terjadi pada ginjal dapat bersifat akut (bersifat sementara) atau kronis karena kerusakan permanen (Huminto et al. 1995). Gangguan pada ginjal seperti infeksi ginjal atau masuknya bahan-bahan racun, polutan dan obat-obatan yang merusak ginjal dapat menyebabkan terhambatnya proses pembentukan urin. Gangguan yang paling jelas pada kasus gagal fungsi ginjal adalah kemampuan filtrasi glomerulus menurun. Akibatnya, jumlah urin berkurang, tekanan darah meningkat dan timbul racun metabolisme dalam darah, terutama limbah metabolisme nitrogen seperti urea dan kreatinin.
Salah satu bagian ginjal yang sering mengalami kelainan adalah glomerulus. Menurut Confer dan Panciera (1995), kerusakan yang terjadi sering disebabkan oleh adanya deposisi immun kompleks, trombosis, emboli, dan inveksi virus pada komponen glomerulus. Kerusakan dapat menyebabkan berbagai dampak baik secara morfologi maupun fungsional. Secara morfologis, kerusakan glomerulus ditandai dengan terjadinya nekrosa dan ploriferasi dari sel membran serta infiltrasi leukosit. Rusaknya glomerulus secara fungsional ditandai dengan berkurangnya perfusi aliran darah, lolosnya protein dan makromolekul lain dalam jumlah yang besar pada filtrat glomerulus. Kerusakan pada glomerulus juga dapat berupa atrofi dan fibrosis sehingga menyebabkan atrofi sekunder pada tubulus renalis.
Menurut Himawan (1973), Acacia sp mengandung senyawa kimia yang termasuk toksin eksogen yang dapat menyebabkan nefrosis toksik. Nefrosis merupakan istilah morfologik untuk kelainan ginjal degeneratif terutama yang mengenai tubulus. Kelainan tubulus dapat menyebabkan albuminuria dan sedimen abnormal di urin. Secara mikroskopis kelainan dijumpai pada tubulus kontortus proksimal berupa degenerasi hidropis, degenerasi lemak, nekrosis dan kalsifikasi.
Asam Amino Non-Protein
Asam Amino Non-Protein (AANP) merupakan asam amino yang bukan pembangun protein. Asam Amino Non-Protein (AANP) adalah asam amino yang memiliki komponen yang sederhana yang analog dengan amino penyusun protein.
Salah satu asam amino non-protein yang terkandung pada lamtoro adalah 3, 4- dihidroxyprydin yang merupakan metabolit mimosin, yang dapat mengganggu fungsi tirosin (Bansi 2001). Hampir 300 AANP telah diisolasi dari tumbuhan yang umumnya terakumulasi pada biji dan daun.
Asam amino non-protein yang terkandung dalam Acacia villosa adalah 2- amino- 4- acetylamino butyric acid (ADAB), 2, 4- diamino butyric acid (DABA) dan oxalylabiziine (Smith et al. 2001). ADAB (2-amino-acetyl butyric acid) adalah kandungan tertinggi pada tanaman A. villosa, yang strukturnya mirip dengan DABA (2,4-diamino butyric acid) yang teridentifikasi dalam tanaman
Lathyrus sp. Senyawa ADAB diduga tidak toksik, namun selama proses
pencernaan ADAB dikonversikan menjadi DABA yag bersifat toksik. Pemberian DABA secara intragastrik pada tikus Sherman jantan menyebabkan kelemahan kaki pada hari ke 48 dan menunjukan gejala tremor, konvulsi, dan berakhir dengan kematian (Foster 1990; Anonim 2001).
Gejala keracunan yang diamati pada domba yang diberi pakan A.
angustissima mirip seperti keracunan pada pemberian Lathyrus, diantaranya yaitu
terjadi penurunan yang besar dalam konsumsi pakan; kerusakan sistem syaraf pusat akut dan diikuti dengan kematian lebih dari 50%; kolaps; mulut berbusa; terjadi kerusakan hati; paru-paru tersumbat dengan adanya busa putih dan bronkhi terlihat membesar; paru-paru mengalami edema serta perdarahan submukosa pada duodenum, ileum dan sekum (Odenyo et al. 1997).
Mimosine dan 3, 4- dihidroxypyridine (3, 4- DHP) merupakan asam amino aromatik yang secara signifikan bersifat toksik dari leguminosa Leucaena
leucocephalla (lamtoro), dan Mimosa pudica (putri malu) (D’ Mello 1991).
Mimosine memiliki struktur analog dengan tyrosin dan fenilalanin dan diketahui dapat menggantikan asam amino tersebut sehingga mengakibatkan hilangnya enzim dan aktifitas fungsional protein (Widyastuti 2001). Senyawa mimosin juga dapat meyebabkan gangguan pada organ reproduksi, bersifat teratogenik serta efek kehilangan rambut dan wool bahkan kematian. Asam amino non-protein 3, 4- dihidroxypyridine (3, 4- DHP) dapat menyebabkan kehilangan nafsu makan, goiter dan reduksi konsentrasi tyrosin dalam darah. Mimosine banyak terkandung pada Leucaena muda (Cheeke 2000). Goitrogen yang lain dan isomer dari 3, 4-
DHP adalah 2, 3 DHP yang dapat juga disintesis di rumen (D’ Mello 1991). Pada Gambar 2 disajikan struktur asam amino non-protein ADAB dan DABA.
NH2 NH2
CH3 – CO – NH – CH2 – CH – COOH NH2 – CH2 – CH2 – CH - COOH
(1) (2)
Gambar 2 Struktur asam amino non-protein (1) ADAB (2-amino- acetyl
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan di Bagian Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor selama empat bulan, mulai dari Februari hingga Mei 2007. Penelitian ini adalah penelitian lanjutan yang telah dilakukan oleh Wahyuni (2006).
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah mikroskop cahaya binokuler. Bahan penelitian adalah sediaan histopatologi organ hati dan ginjal tikus yang berasal dari uji toksisitas akut fraksi asam amino non-protein Acacia
villosa. Daun A. villosa diperoleh dari Balai Penelitian Ternak (BPT) Ciawi. Tikus
yang digunakan adalah tikus putih (Rattus rattus) dari jenis Sparague-Dawley berumur empat minggu dengan berat badan 50-70 gram yang diperoleh dari Badan POM, Jakarta.
Metode
1. Ekstraksi fraksi asam amino non-protein A. villosa (Wahyuni 2006)
Daun A. villosa segar digiling halus menggunakan blender, ditambahkan 0,1 N HCl dengan perbandingan 1:10, dan disaring. Filtrat dialirkan ke dalam kolom cation excange chromatography. Kolom kemudian dielusi dengan 2 N NH4OH hingga diperoleh fraksi asam amino. Fraksi kemudian diuapkan menggunakan rotary evaporator bersuhu 40°C hingga terbentuk massa kental yang kering.
2. Disain Penelitian
Sebanyak 10 ekor tikus putih (Rattus rattus) jenis Sprague-Dawley dibagi menjadi 4 kelompok yang terdiri dari kelompok kontrol dan 3 kelompok perlakuan yaitu: kelompok kontrol diberi aquades dosis 1 cc sebanyak 1 ekor; kelompok yang diberi fraksi AANP A. villosa dosis 3.2 g/kg BB sebanyak 3 ekor; kelompok yang diberi fraksi AANP A. villosa dosis 8.0 g/kg BB sebanyak 3 ekor
dan kelompok yang diberi fraksi AANP A. villosa dosis 20 g/kg BB sebanyak 3 ekor
Sebelum dicekok tikus dipuasakan terlebih dahulu selama 24 jam, dan pemberian fraksi asam amino dilakukan secara intragastrik dengan dosis tunggal. Pengamatan dilakukan terhadap kemungkinan gejala keracunan yang timbul selama 24 jam hingga satu minggu (168 jam). Semua hewan coba baik yang ditemukan mati maupun yang hidup pada akhir penelitian dinekropsi, untuk pengambilan organ hati dan ginjal guna dibuat sediaan histopatologi.
2. Evaluasi Histopatologi
Evaluasi histopatologi dilakukan pada sediaan organ hati dan ginjal tikus di bawah mikroskop dengan menggunakan perbesaran 10x10 hingga 40x10. Berdasarkan pengamatan histopatologi tersebut dibuat skala skor dan hasil evaluasi histopatologi disajikan secara deskriptif. Parameter skoring yang digunakan untuk sediaan hati dan ginjal disajikan pada Tabel 2. Pada organ ginjal diamati pada 10 lapang pandang, sedangkan pada hati pengamatan dilakukan pada 10 lapang pandang disekitar vena sentralis.
Tabel 2. Parameter skoring evaluasi hati pada 10 lapang pandang di sekitar vena sentralis
Nilai skor
Perubahan HP
0 Jika <25% hati mengalami degenerasi hidropis, degenerasi lemak dan apoptosis di sekitar vena sentralis.
1 Jika 25-50% hati mengalami degenerasi hidropis, degenerasi lemak dan apoptosis yang meluas hingga ke daerah midzona.
2 Jika 50-75% hati mengalami degenerasi hidropis, degenerasi lemak dan apoptosis yang meluas hingga ke perilobuler.
3 Jika >75% hati mengalami degenerasi hidropis, degenerasi lemak dan apoptosis yang meluas yang hingga zona perilobuler.
Tabel 3 Parameter skoring evaluasi tubulus dan glomerulus ginjal pada 10 lapang pandang
Nilai skor
Perubahan HP
0 Jika <25% ginjal mengalami degenerasi hidropis, apoptosis, endapan protein pada tubulus dan edema glomerulus
1 Jika 25-50% ginjal mengalami degenerasi hidropis, apoptosis, endapan protein pada tubulus dan edema glomerulus.
2 Jika 50-75% ginjal mengalami degenerasi hidropis, apoptosis, endapan protein pada tubulus dan edema glomerulus.
3 Jika >75% ginjal mengalami degenerasi hidropis, apoptosis, endapan protein pada tubulus dan edema glomerulus.
3. Analisis Data
Hasil skoring histopatologi dianalisis menggunakan metode statistik non parametrik Kruskal Wallis untuk melihat pengaruh perlakuan.
HASIL DAN PEMBAHASAN
Gambaran Histopatologi Hati Tikus Pasca Pemberian Fraksi Asam Amino Non-Protein Acacia villosa
Hasil pengamatan histopatologi hati kelompok kontrol maupun kelompok perlakuan ditemukan adanya perubahan pada interstitium maupun parenkim. Kongesti merupakan perubahan yang ditemukan pada interstitium hati, sedangkan pada parenkim ditemukan adanya degenerasi hidropis, degenerasi lemak dan apoptosis di seluruh bagian hati. Rataan peringkat Kruskal-Wallis skor histopatologi hati disajikan pada Tabel 4.
Tabel 4 Rataan peringkat Kruskal-Wallis skor histopatologi hati pasca pemberian fraksi asam amino non-protein A. villosa pada uji toksisitas akut
Keterangan :
K : Kontrol; 3.2 : Dosis 3.2 g/kg BB; 8 : Dosis 8 g/kg BB; 20 : Dosis 20 g/kg BB;
Huruf superskrif yang berbeda pada kolom yang sama menunjukan berbeda nyata (p<0.05).
Dari Tabel 4 terlihat bahwa rataan Kruskal-Wallis degenerasi hidropis kelompok dosis 3.2 dan 8.0 g/kg BB tidak berbeda nyata (p>0.05) dengan kelompok kontrol, namun berbeda nyata (p<0.05) dengan kelompok dosis 20 g/kg. Rataan degenerasi hidropis kelompok dosis 20 g/kg BB lebih sedikit karena sebagian besar mengalami degenerasi lemak dan apoptosis. Degenerasi hidropis merupakan perubahan lanjutan dari degenerasi berbutir namun lebih ringan dibandingkan degenerasi lemak maupun apoptosis.
Seluruh kelompok perlakuan maupun kontrol mengalami degenerasi hidropis. Degenerasi hidropis disebabkan oleh adanya gangguan metabolisme pada organ hati. Selain degenerasi, pada kontrol juga ditemukan adanya kongesti.
Kelompok Perubahan Histopatologi
Degenerasi Hidropis Degenerasi lemak Apoptosis
K 6.00.b 1.00a 1.50.a
3.2 5.50.b 4.33.b 2.83.a
8 7.67.b 4.67.b 6.00.b
darah maupun euthanasia, karena eter merupakan anastetik kuat yang dapat menyebabkan vaodilatasi pada pembuluh darah.
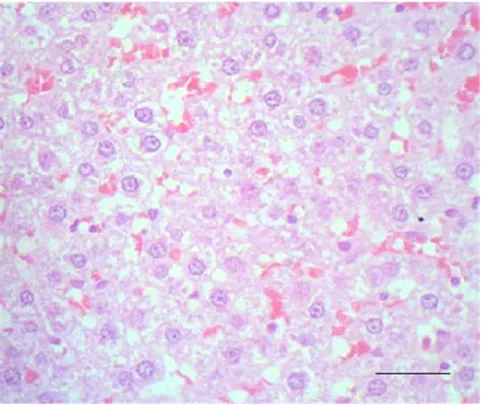
Pemberian senyawa asam amino non-protein yang bersifat toksik menyebabkan reaksi adaptasi berupa degenerasi. Degenerasi hidropis merupakan suatu keadaan dimana sitoplasma sel mengandung air. Secara mikroskopis pada sel-sel yang mengalami degenerasi hidropis terlihat adanya ruangan-ruangan jernih di sitoplasma tetapi tidak sejernih kolagen maupun lemak (Carlton dan McGavine 1995). Degenerasi hidropis adalah perubahan yang bersifat reversible, sehingga apabila paparan bahan toksik dihentikan, sel yang mengalami kerusakan akan kembali normal. Apabila keracunan terus berlanjut maka akan menyebabkan sel mati (irreversibble). Pada Gambar 3 disajikan degenerasi hidropis hati pasca pemberian fraksi asam amino non-protein A. villosa.
Gambar 3 Hepatosit yang mengalami degenerasi hidropis pasca pemberian fraksi asam amino non-protein A. villosa, dosis 8 g/kg BB. Pewarnaan HE, bar 20 µm.
Penyebab degenerasi sel biasanya adalah akibat tidak cukup makanan, ketuaan umur jaringan, kekurangan oksigen dalam jaringan serta adanya intoksikasi. Sel menggunakan oksigen untuk mentransport natrium ke dalam sitoplasma. Pada saat kekurangan oksigen, air dan natrium akan masuk berlebihan melalui membran sel, dan menyebabkan hilangnya jumlah kalium yang melampaui batas. Pada keadaan ini retikulum endoplasma mengambil cairan dalam volume yang besar. Oleh karena itu pada sitoplasma sel yang mengalami degenerasi hidropis akan terlihat ruang kosong yang jernih dan mendorong sitoplasma yang berwarna suram ke daerah tepi dari sel (Corwin 2001). Degenerasi hidropis pada sel-sel hati dan ginjal juga ditemui pada hewan yang mengalami keracunan akibat mengkonsumsi Lupinus sp dan Lantana camara.
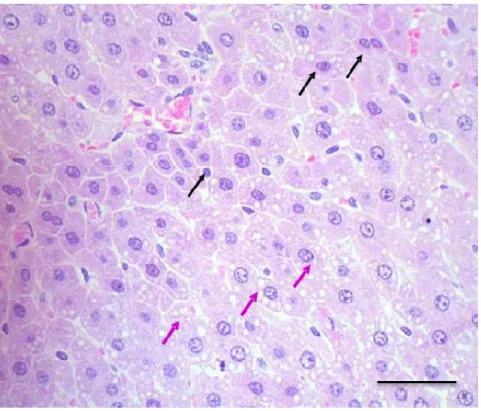
Kelanjutan dari degenerasi hidropis sebelum mengalami kerusakan yang bersifat irreversible adalah degenerasi lemak. Pada Tabel 4, rataan Kruskal-Wallis degenerasi lemak kelompok dosis 3.2 tidak berbeda nyata (p>0.05) dibandingkan dengan dosis 8.0 g/kg BB namun kedua kelompok tersebut terlihat berbeda nyata (p<0.05) dibandingkan dengan kelompok kontrol dan kelompok dosis 20 g/kg BB. Semakin tinggi dosis fraksi AANP, semakin berat derajat keparahan degenerasi lemak hati. Hasil pengamatan histopatologi ini mengindikasikan bahwa fraksi AANP bersifat hepatotoksik. Hal ini sesuai dengan pendapat Donatus (2001), bahwa degenerasi lemak dapat terjadi pada kondisi iskemia, anemia dan gangguan bahan toksik. Degenerasi lemak hepatosit disajikan pada Gambar 4.
Degenerasi yang berlangsung terus-menerus akan menyebabkan kematian sel. Kematian sel merupakan kerusakan yang bersifat irreversible (menetap), sehingga hepatosit tidak dapat kembali kebentuk normal. Kematian sel dapat terjadi melalui proses apoptosis dan nekrosa sel. Apoptosis merupakan proses kematian sel yang terencana atau terprogram yang dipicu oleh fragmen DNA, sedangkan nekrosa sel dicirikan dengan adanya sel radang. Nekrosa dapat bersifat lokal atau difus, yang disebabkan oleh keadaan iskemia, anemia, kekurangan oksigen, bahan-bahan radikal bebas, gangguan sintetis DNA dan peptida (Lu 1995).
Gambar 4 Hati tikus yang mengalami degenerasi lemak (panah ungu) dan apoptosis (panah hitam) pasca pemberian fraksi asam amino non-protein A. villosa, dosis 20 g/kg BB. Pewarnaan HE, bar 20 µm. Pada Tabel 4 memperlihatkan rataan Kruskal Wallis apoptosis kelompok dosis 3.2 g/kg BB tidak berbeda nyata (p>0.05) dibandingkan dengan kelompok kontrol, dan kedua kelompok tersebut berbeda nyata (p<0.05) dibandingkan dengan kelompok dosis 8.0 dan 20 g/kg BB. Rataan apoptosis kelompok dosis 8 g/kg BB tidak berbeda nyata (p>0.05) dibandingkan dengan kelompok dosis 20 g/kg BB. Semakin tinggi dosis fraksi AANP A. villosa yang diberikan, maka semakin banyak sel hati yang mengalami apoptosis. Hal ini mengindikasikan bahwa fraksi AANP A. villosa bersifat hepatotoksik. Penelitian Raharjo (2002), Santoso (2002) dan Herdiana (2004), memperlihatkan adanya nekrosa hepatosit ringan pada pemberian pakan tikus yang mengandung 15% A. villosa. Perbedaan kerusakan ini erat hubungannya dengan efektifitas toksin yang sangat bergantung pada tiga faktor yaitu jenis bahan kimia, konsentrasi dan jaringan yang terlibat. Sel-sel hepatosit yang mengalami apoptosis disajikan pada Gambar 4.
Apoptosis dapat terjadi bila sel mengalami kerusakan yang sudah tidak dapat diperbaiki lagi. Keputusan untuk melakukan apoptosis berasal dari sel itu
sendiri, dari jaringan yang mengelilinginya, atau dari sel yang berasal dari sistem imun. Apoptosis pada umumnya berlangsung seumur hidup dan bersifat menguntungkan bagi tubuh (Anonim 2006). Apoptosis terjadi pada dua kondisi, yaitu kondisi normal (fisiologis) atau abnormal (patologis). Apoptosis fisiologis terjadi pada proses pertumbuhan dan involusi organ pada pertumbuhan embrional, proses hormonal pada organ reproduksi betina, sentra germinal dan folikel limfoid. Apoptosis patologis biasanya terjadi pada kerusakan akibat agen infeksius atau toksin. Apoptosis tidak melibatkan sel radang, tetapi badan apoptosis akan difagosit oleh makrofag Penyebab terjadinya apoptosis antara lain: kekurangan suplai oksigen (biasanya pada penyakit respiratori, kardiovaskular dan anemia), agen fisik, terjadi pada trauma mekanik dan radiasi, agen kimia (biasanya berkaitan dengan hasil proses suatu industri), toksin (bakteria, tanaman, dan hewan), virus, kelainan reaksi immunologi (hipersensitifitas, glomerulonefritis), kekurangan nutrisi (kekurangan vitamin dan sindrom malabsorbsi), serta kelainan genetik (MacFarlen et al. 2000).
Gambaran Histopatologi Ginjal Tikus Pasca Pemberian Fraksi Asam AminoNon-Protein Acacia villosa
Pemberian fraksi asam amino non-protein A. villosa mengakibatkan perubahan histopatologi baik pada parenkim maupun interstitial. Secara umum perubahan yang ditemukan pada interstitial adalah adanya pembendungan (kongesti) baik pada kontrol maupun pada kelompok perlakuan. Kongesti pada kelompok control disebabkan oleh penggunaan sediaan ether sewaktu anesthesia dan euthanasia.
Perubahan yang terjadi pada glomerulus adalah edema yang dicirikan oleh adanya endapan protein pada mesangium hingga ke ruang Bowman, dan adanya perluasan ruang Bowman, sedangkan perubahan pada tubulus adalah berupa degenerasi hidropis, apoptosis dan adanya endapan protein di lumen. Perubahan histopatologi ini disebabkan oleh senyawa asam amino non-protein A. villosa yang bersifat nefrotoksik. Hasil evaluasi histopatologi tubulus dan glomerulus disajikan pada Tabel 5.
Tabel 5 Rataan peringkat Kruskal-Wallis skor histopatologi ginjal tikus pasca pemberian fraksi asam amino non-protein A. villosa pada uji toksisitas akut
Keterangan :
K : Kontrol; 3.2 : Dosis 3.2 g/kg BB; 8 : Dosis 8 g/kg BB; 20 : Dosis 20 g/kg BB;
Huruf superskrif yang berbeda pada kolom yang sama menunjukan berbeda nyata (p<0.05).
Dari Tabel 5 dapat diketahui bahwa kerusakan pada tubulus berupa degenerasi hidropis, terjadi baik pada kelompok kontrol maupun perlakuan. Rataan Kruskal-Wallis degenerasi hidropis kelompok dosis 3.2 g/kg BB tidak berbeda nyata (p>0.05) dibandingkan dengan kelompok kontrol, dan kedua kelompok tersebut berbeda nyata (p<0.05) dibandingkan dengan kelompok dosis 8 dan 20 g/kg BB. Rataan Kruskal-Wallis kelompok dosis 8 g/kg BB tidak berbeda nyata (p>0.05) dibandingkan dengan kelompok dosis 20 g/kgBB. Hal ini memperlihatkan bahwa semakin tinggi dosis fraksi AANP yang diberikan maka menyebabkan degenerasi hidropis yang semakin berat. Degenerasi hidropis pada kelompok kontrol kemungkinan disebabkan adanya gangguan metabolisme pada organ ginjal yang disebabkan oleh hal lain. Hal ini mungkin saja terjadi karena tikus yang digunakan bukan dari kelompok SPF (Specific Pathogen Free).
Degenerasi hidropis ginjal diakibatkan oleh senyawa sekunder AANP A.
villosa yang bersifat toksik. Akibat paparan zat toksik tersebut menyebabkan
hilangnya pengaturan volume pada bagian-bagian sel. Agar kestabilan lingkungan internal terjaga, sel harus mengeluarkan energi metabolik untuk memompa ion natrium keluar dari membran dan ion kalium masuk ke dalam membran. Hal yang dapat mengganggu metabolisme energi dalam sel atau sedikit saja melukai membran sel menyebabkan sel tidak mampu memompa natrium dengan baik. Hal
Kelompok Perubahan Histopatologi
Tubulus Glomerulus Degenerasi Hidropis Apoptosis Endapan Protein Edema K 1.50 a 6.50b 2.00a 3.50 a 3.2 2.83 a 2.17a 4.00a 3.50 a 8 6.00 b 5.00b 4.83a 4.67 a 20 9.00 b 9.00c 8.83b 9.00 b
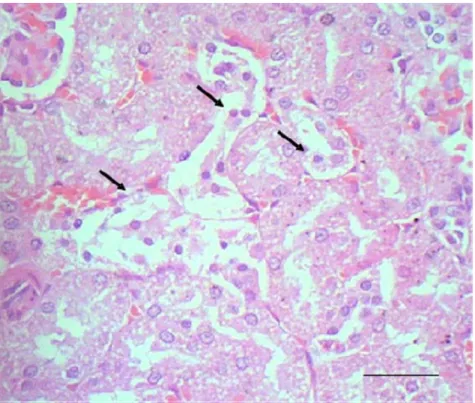
ini menyebabkan kenaikan konsentrasi natrium dan influks air ke dalam sel. Mekanisme ini menyebabkan perubahan yang disebut pembengkakan sel. Perubahan ini menjelaskan bahwa sewaktu air terakumulasi dalam sitoplasma, organel sitoplasma juga menyerapnya sehingga menyebabkan pembengkakan di mitokondria dan pembesaran retikulum endoplasma (Cheville 1999). Menurut Confer dan Panciera (1995), degenerasi hidropis merupakan gambaran utama dari perubahan sel akut dimana sel kehilangan kontrol terhadap air sehingga menyebabkan sel bengkak. Kerusakan akut terjadi akibat gangguan pada epitel tubulus oleh infeksi, efek toksin secara langsung atau iskhemia. Respon kerusakan setelah degenerasi hidropis diikuti oleh nekrosa dan deskuamasi sel epitel tubulus. Degenerasi hidropis tubuli ginjal disajikan pada Gambar 5.
Gambar 5 Tubulus ginjal tikus yang mengalami apoptosis (panah) yang dikelilingi tubuli yang mengalami degenerasi hidropis pasca pemberian fraksi asam amino non-protein A. villosa, dosis 20 g/kg BB. Pewarnaan HE, bar 20 µm.
Panciera 1995). Degenerasi juga dapat diartikan sebagai gangguan mekanisme pemompaan natrium sehingga terjadi penimbunan cairan intraseluler. Degenerasi menunjukkan gangguan biokimiawi sel yang dapat disebabkan oleh iskhemi, metabolisme abnormal, zat kimia.
Dari Tabel 5, dapat dilihat bahwa rataan Kruskal-Wallis apoptosis kelompok dosis 3.2 berbeda nyata (p<0.05) dibandingkan dengan kelompok kontrol, 8 dan 20 g/kg BB, dan kelompok dosis 8 g/kg BB juga berbeda nyata (p<0.05) dibandingkan dengan kelompok dan 20 g/kg BB. Rataan Kruskal-Wallis apoptosis tertinggi terjadi pada kelompok dosis 20 g/kg BB. Hal ini semakin memperjelas bahwa fraksi AANP A. villosa bersifat nefrotoksik, dimana semakin tinggi dosis yang diberikan menyebabkan perubahan histopatologi yang semakin berat.
Kejadian apoptosis juga diikuti dengan adanya endapan protein di lumen tubulus. Dari Tabel 5 terlihat bahwa rataan Kruskal-Wallis endapan protein di tubulus seluruh kelompok perlakuan tidak berbeda nyata (p>0.05) dibandingkan dengan kelompok control, kecuali kelompok dosis 20 g/kg BB. Hal ini juga memperlihatkan bahwa kerusakan terberat dialami kelompok dosis 20 g/kg BB. Keadaan ini kemungkinan disebabkan menurunnya kemampuan absorbsi tubulus atau terlalu banyaknya protein yang harus diserap kembali oleh tubulus. Menurunnya kemampuan absorbsi tubulus dikarenakan epitel tubulus telah mengalami degenerasi hingga apoptosis yang disebabkan oleh fraksi AANP A.
villosa yang bersifat toksik. Bahan toksik tersebut juga menyebabkan
berkurangnya jumlah tubuli yang sehat sehingga menurunkan daya absorbsinya. Adanya endapan protein dalam tubuli juga mengindikasikan fraksi AANP A.
villosa bersifat nefrotoksik.
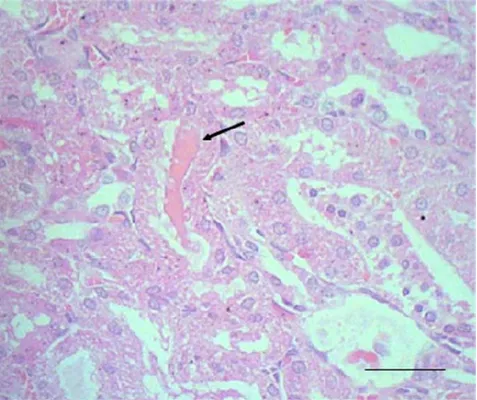
Menurut Corwin (2001), adanya endapan protein di tubulus disebabkan peningkatan tekanan osmotik koloid cairan interstitium sehingga mengganggu filtrasi glomerulus dan reabsorbsi tubulus. Menurut Carlton dalam McGavine 1995, protein yang lolos dari glomerulus tidak dapat diserap dengan sempurna oleh epitel-epitel tubulus sehingga terjadi penumpukan protein di lumen tubulus. Endapan protein di lumen tubulus ginjal tikus pasca pemberian fraksi AANP A.
Gambar 6. Endapan protein di lumen tubulus ginjal tikus pasca pemberian fraksi asam amino non-protein A. villosa, dosis 20 g/kg BB. Pewarnaan HE, bar 20 µm.
Perubahan lain yang terlihat pada ginjal tikus adalah edema glomerulus. Dari Tabel 5 terlihat rataan Kruskal-Wallis edema glomerulus seluruh kelompok perlakuan tidak berbeda nyata (p>0.05) dibandingkan dengan kelompok kontrol, kecuali kelompok dosis 20 g/kg BB. Hal ini menunjukkan bahwa fraksi AANP A.
villosa tidak hanya bersifat toksik terhadap tubulus namun juga terhadap
glomerulus. Bahan toksik tersebut mengganggu permeabilitas kapiler mesangium sehingga menyebabkan edema glomerulus.
Edema glomerulus merupakan perubahan pertama yang terjadi pada toxic glomerular nephritis. Menurut Cunningham (1992), edema glomerulus terjadi karena adanya peningkatan permeabilitas kapiler mesangium sehingga kapiler glomerulus menjadi permeabel terhadap plasma protein. Proses selanjutnya menyebabkan terjadinya akumulasi massa atau endapan protein pada mesangium hingga ke ruang Bowman. Penyusun massa protein di mesangium maupun di
ruang Bowman adalah glikoprotein yang terlihat berwarna merah pada pewarnaan PAS dan berwarna merah muda pada pewarnaan HE (Maxie dan Prescott 1993).
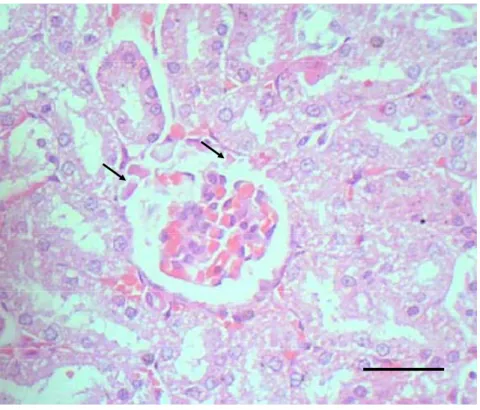
Penyebab lain dari edema glomerulus adalah adanya kerusakan pada barrier filtrasi glomerulus yang dapat menyebabkan berbagai macam manifestasi klinis pada penyakit ginjal. Bentuk utama dari manifestasi itu adalah lolosnya protein berberat molekul kecil pada filtrat glomerulus di urin. Selain itu, aliran darah yang abnormal pada kapiler juga dapat menyebabkan edema ginjal (Confer dan Panciera 1995). Edema glomerulus pada ginjal tikus pasca pemberian fraksi AANP A. villosa pada uji toksisitas akut disajikan pada Gambar 7.
Gambar 7 Edema glomerulus pada ginjal tikus yang dikelilingi oleh tubulus yang mengalami degenerasi hidropis pasca pemberian fraksi asam amino non-protein A. villosa, dosis 20 g/kg BB. Pewarnaan HE, bar 20 µm.
KESIMPULAN DAN SARAN
Kesimpulan
1. Pemberian fraksi AANP Acacia villosa mengakibatkan perubahan histopatologi pada organ hati tikus berupa degenerasi hidropis, degenerai lemak, apoptosis dan pada ginjal berupa degenerasi hidropis, apoptosis, endapan protein pada tubulus dan edema pada glomerulus.
2. Dosis 20 g/kg BB merupakan dosis yang mengakibatkan perubahan
histopatologi paling berat.
Saran
Perlu dilakukan uji toksisitas kronik fraksi AANP A. villosa untuk mengetahui batas toksisitas penggunaan A. villosa sebagai pakan ternak.
DAFTAR PUSTAKA
Anonim.2001.Acacia angustissima.
http://www.ansci.cornel.edu/courses/as625/2001term/robertson/. [25 agustus 2007].
Anonim. 2006. Apoptosis. http://id.wikipedia.org/wiki/Apoptosis. [ 28 November 2007)
Bansi H. 2001. Potensi lamtoro merah (Acacia villosa) dan kaliandra putih (Caliandra tetragona) sebagai sumber pakan baru dari ternak ruminansia. [skripsi]. FKH IPB. Bogor.
Bariata NC. 2001. Gambaran histopatologi toksisitas hijauan mlanding sabrang (Acacia villosa) dosis tinggi pada domba garut. [skripsi]. FKH-IPB. Bogor. Cunningham. 2002. Texbook of Phisiology. Ed ke-3. W.B. Saunders Company.
Philadelphia.
Chekee PR. 1989. Toxicants of Plant Origin. Vol 3. Proteins and Amino Acids. United States: CRC Press.
Cheville NF. 1999. Introduction to Veterinary Pathology. Ed ke-2. Iowa: Iowa State University Press.
Confer AW dan Panciera RJ. 1995. Thomson’s Special Veterinary Pathology. Edisi ke-2. Edited by: Carlton WW dan McGavin MD. Mosby.
Corwin EJ. 2001. Buku Saku Patofisiologi. Penerbit Buku Kedokteran. EGC. Jakarta.
Dellman HD & Brown E. 1992. Buku Teks Histologi Veteriner II dan III. Penerbit Universitas Indonesia. Jakarta.
D’Mello JPF. 1991. Amino Acids in Animal Nutrition. Ed ke-2. London. CABI Publishing. UK.
Donatus IA. 2001. Toksikologi Dasar. Yogyakarta: Universitas Gadjah mada Fadjar R. 2004. Pengaruh pemberian lamtoro merah (Acacia villosa) terhadap
histopatologi ginjal tikus (Rattus rattus). [skripsi]. FKH IPB. Bogor.
Foster JG. 1990. Flatpea (Lathyrus sylvestris. A Comphrehensive Review,
Advances in Agronomy. Volume 43. hlm 241-313.
Ganiswara SG. 1995. Farmakologi dan Terapi. Fakultas Kedokteran UI. Edisi ke-4. Jakarta.
Girinda A. 1994. Biokomia Patologi Hewan. Bogor. Pusat Antar Universitas dan LSI-IPB. Bogor.
Ganong WF. 1995. Buku Ajar Fisiologi Kedokteran (Review of Medical Physiology). Edisi ke-14. Alih Bahasa : Adrianto P. EGC. Jakarta.
Ganong WF. 2003. Buku Ajar Fisiologi Kedokteran. Penerbit Buku Kedokteran. EGC. Jakarta.
Guyton AG. 1994. Buku Ajar Fisiologi Kedokteran. Edisi ke-7. Penerbit Buku Kedokteran. ECG. Jakarta.
Jukema J dan Danamihardja. 1997. Acacia. Di dalam: Hanum IF, Van der Maesen LJG, editor. Auxiliary Plants. Plants Resources of South-East Asia. Prosea. No. 11. halaman 56- 60. Bogor. Indonesia.
Junquera LC, Carneiro J, Robert OK. 1998. Histologi Dasar. Ed ke-8. Penerbit Buku Kedokteran Hewan. Jakarta.
Hartono. 1992. Histologi Veteriner. FKH-IPB. Bogor.
Herdiana E. 2004. Pengaruh pemberian lamtoro merah (Acacia villosa) terhadap histopatologi hati tikus (Rattus rattus). [skripsi]. FKH-IPB. Bogor.
Himawan S. 1973. Kumpulan Kuliah Patologi. Bagian Patologi Anatomi. FK-UI. Depok.
Huminto H, Bahagia S, Estuningsih S, Koesharto FX. 1995. Patologi Gizi. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Dasar dan Menengah Kejuruan. Proyek Peningkatan Pendidikan dan Kejuruan Non Teknik II. Jakarta.
Lowry JB, Petheram RJ and Tangendjaja B. 1992. Plants Fed to Village Ruminants in Indonesia. ACIAR. Technical Report No. 22. Canberra.
Lu FC. 1995. Toksikologi Dasar. Edisi ke-2. UI Press. Jakarta.
MacFarlane PS, Reid R, Callander R. 2000. Pathology Ilustrated. Ed ke-4. London-New York-Toronto: Hurchill Livingstone.
MacLachan NJ, Cullen JM. 1995. Liver, Billiary System and Exocrine Pankreas. Di dalam: Carlton MW, McGavin MD. Editor. Thomson’s Special Veterinary
Maxie MG. 1993. Pathology of Domestic Animals. Di dalam: Jubb KVF, Kennedy PC, Palmer N. Fourth Edition. Vol. 4. California. USA: Academic Press.
Maxie MG dan Prescott JT. 1993. The Hematopotik System. Di dalam: Jubb KVF, Kennedy PC, Palmer N. Pathology of Domestic Animals. Fourth Edition. Vol. 3. California. USA: Academic Press.
Meyer JD, Coles EH, Rich LJ. 1992. Veterinary Medicine Interpretation and Diagnosis. Philadelphia: WB Saundeers Company.
Odenyo AA, P. O. Osuji, and O. Karanfil. 1997. Microbiological evaluation of
Acacia angustissima as a protein supplement for sheep. Animal Feed Science and Technology 65: 99-112.
Perez D, Chavaria R. Espinoza and Guadamuz. 1999. Acacia villosa. http//www.acqunacaste.ac.cr. [Februari 2007].
Pujian A. 2007. Pengaruh pemberian fraksi asam amino non-protein dan fraksi polifenol daun lamtoro merah (Acacia villosa) terhadap gambaran histopatologi hati tikus (Rattus rattus).[skripsi]. FKH-IPB. Bogor.
Raharjo. 2002. Pengaruh pemberian pakan yang mengandung berbagai fraksi dan konsentrasi Acacia villosa serta imbuhan PEG terhadap penampilan dan histopatologi organ ayam. [skripsi]. FKH-IPB. Bogor.
Santoso G. 2002. Pengaruh pemberian dua varietas Acacia villosa (Lamtoro Merah) terhadap pertumbuhan histopatologi organ ayam. [skripsi]. FKH-IPB. Bogor.
Seely JC. 1999. Pathology of The Mouse. Edited by: Maronpot RR. Associate Editors: Boorman GA and Gaul BW Cache. River Press. Vienna. USA.
Smith AH, Odenyo AA, Osuji PO, Wallig MA, Kandil FE, Seigler DS and Mackie RI. 2001. Evaluation of toxicity of Acacia angustissima in rat bioassay. Anim Feed Sci Tech. 91:41-58
Smith AH, Wally MA, Seigler DS, Odenyo AA, McSweeney CS, Mackie RT. 2003. Amelirating the toxic effect of Acacia anguitissima with polyethylene glycol in rats. Anim Feed Sci Teech.
Spector WG dan Spector TD. 1993. Pengantar Patologi Umum.. Ed ke-3 Soetipto NS, Harsoyo, Hana A, Astuti P. Penerjemah, Yogyakarta: Gadjah Mada University Press. Terjemahan dari: An Introduction to General
Pathology.
Sugiarto. 2002. Konsumsi, kecernaan (in vivo) dan protein gas (in vitro) pakan kering campuran Acacia villosa, Calliandra calothyrsus atau Leucaena
diversivolia dengan rumput gajah pada domba. [skripsi]. Fakultas Peternakan
Institut Pertanian Bogor. Bogor
Trisyulianti EJ, Jack dan Jayusmar. 2001. Pengaruh Suhu dan Tekanan Pengempaan terhadap Sifat Fisik Flafer Ransum dari Limbah Pertanian Sumber Serat dan Leguminosa untuk Ternak ruminansia. Media Peternakan.
Jurnal Ilmu pengetahuan dan Teknologi. Bogor.
Wahyuni A. 2006. Uji toksisitas akut senyawaan asam amino non-protein daun lamtoro merah (Acacia villosa) pada tikus. [skripsi]. FKH-IPB. Bogor.
Wina E dan Tangendjaja. 2000. The Possibility of Toxic Coumpounds Present in
Acacia villosa. Buletin Peternakan. Vol 24 (1). 34-42
Widyastuti T. 2001. Detoksifikasi daun lamtoro (Leucaena leucephala) secara fisik dan kimia serta pemanfaatanya sebagai sumber pigmentasi dalam ransum ayam broiler. [tesis]. Institut Pertanian Bogor. Bogor.
Statistik Non Parametrik Kruskal-Wallis
Ranks
Dosis N Mean rank
respon degenerasi hidropis ginjal 3,2 3 2.83
8 3 6.00
20 3 9.00
kontrol 1 1.50
Total 10
respon apoptosis ginjal 3,2 3 2.17
8 3 5.00
20 3 9.00
kontrol 1 6.50
Total 10
respon endapan protein ginjal 3,2 3 4.00
8 3 4.83
20 3 8.83
kontrol 1 2.00
Total 10
respon edema ginjal 3,2 3 3.50
8 3 4.67
20 3 9.00
kontrol 1 3.50
Total 10
respon degenerasi hidropis hati 3,2 3 5.50
8 3 7.67
20 3 3.17
kontrol 1 6.00
Total
10
respon degenerasi lemak hati 3,2 3 4.33
8 3 4.67
20 3 9.00
kontrol 1 1.00
Total 10
respon apoptosis hati 3,2 3 2.83
8 3 6.00
20 3 9.00
kontrol 1 1.50
Test Statistics(a,b) respon deg hidropis ginjal respon apoptosis ginjal respon endapan protein ginjal respon edema ginjal respon deg hidropis hati respon degenerasi lemak hati respon apoptosis hati Chi-Square 8.315 7.933 6.192 7,651 3.450 6,891 8.264 Df 3 3 3 3 3 3 3 Asymp. Sig. .040 .047 .103 .054 .327 ,075 .041
a Kruskal Wallis Test b Grouping Variable: DOSIS