PENGARUH TEKANAN OSMOTIK MEDIA TERHADAP TINGKAT KELANGSUNGAN HIDUP DAN PERTUMBUHAN
BENIH IKAN PATIN (Pangasius sp.) PADA SALINITAS 5 PPT
KLORY ADI NUGRAHANINGSIH
SKRIPSI
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
ERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGARUH TEKANAN OSMOTIK MEDIA TERHADAP TINGKAT KELANGSUNGAN HIDUP DAN PERTUMBUHAN BENIH IKAN PATIN (Pangasius sp.) PADA SALINITAS 5 PPT
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skirpsi ini.
Bogor, Oktober 2008
KLORY ADI NUGRAHANINGSIH C 14104009
RINGKASAN
KLORY ADI NUGRAHANINGSIH. Pengaruh Tekanan Osmotik Media terhadap Tingkat Kelangsungan Hidup dan Pertumbuhan Benih Ikan Patin (Pangasius sp.) pada Salinitas 5 ppt. Dibimbing oleh D. DJOKOSETIYANTO
Benih ikan patin dapat tumbuh dan hidup dengan baik pada kisaran salinitas 3 sampai 7 ppt. Salinitas dan tekanan osmotik berhubungan erat, yaitu tekanan osmotik disebabkan oleh perbedaan konsentrasi antara cairan yang satu dengan yang lainnya yang dibatasi oleh membran semipermeabel, dalam hal ini larutan yang satu adalah media pemeliharaan bersalinitas 5 ppt dan larutan lainnya adalah cairan tubuh ikan. Namun pengaruh tekanan osmotik terhadap tingkat kelangsungan hidup serta pertumbuhan belum diketahui dengan jelas. Oleh karena itu, dalam penelitian ini dilakukan penambahan kalsium hidroksida (Ca(OH)2) yang berfungsi sebagai osmoregulator (pengaturan), pengaturan permeabilitas dinding sel dan dapat meningkatkan tekanan osmotik. Tujuan penelitian ini adalah untuk mengetahui pengaruh tekanan osmotik media terhadap tingkat kelangsungan hidup dan pertumbuhan benih ikan patin pada media pemeliharaan bersalinitas 5 ppt dengan penambahan kalsium hidroksida.
Penelitian ini dilaksanakan pada bulan Juni sampai Juli 2008, di Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Hewan uji yang digunakan adalah benih ikan patin dengan bobot 0,311±0,08 gram dan panjang 2,74±0,26 cm, ditebarkan pada kepadatan 5 ekor/l ke dalam akuarium berukuran 50x33x30 cm sebanyak 15 buah selama 30 hari. Pakan yang digunakan berupa pelet dengan kandungan protein sebesar 40 %, diberikan pada pagi, siang, dan sore hari dengan
feeding rate (FR) sebesar 8 %. Jumlah pakan disesuaikan dengan biomassa hasil
sampling yang dilakukan setiap 10 hari sekali. Untuk mempertahankan kualitas air dalam media pemeliharaan dilakukan penggantian air setiap dua hari sekali sebanyak 40 % dari total volume air.
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan lima perlakuan yang masing-masing diulang tiga kali. Perlakuan yang diberikan meliputi Kontrol tanpa penambahan Ca(OH)2, A dengan penambahan 10 mg/l Ca(OH)2, B dengan penambahan 20 mg/l Ca(OH)2, C dengan penambahan 30 mg/l Ca(OH)2, serta D dengan penambahan 40 mg/l Ca(OH)2. Parameter yang diamati antara lain tingkat kelangsungan hidup, laju pertumbuhan harian, pertumbuhan bobot, pertumbuhan panjang, dan kualitas air.
Hasil penelitian menunjukkan, bahwa diantara Kontrol dan empat perlakuan penambahan 10 mg/l, 20 mg/l, 30 mg/l, dan 40 mg/l Ca(OH)2, perlakuan dengan penambahan Ca(OH)2 sebanyak 20 mg/l menghasilkan media pemeliharaan yang paling baik. Pada akhir penelitian, perlakuan tersebut menghasilkan benih ikan patin dengan pertumbuhan yang baik yaitu memiliki bobot 1,58±0,19 gram, laju pertumbuhan harian 6,13 %, dan panjang 4,84 cm. Secara umum, kualitas air selama masa pemeliharaan berada dalam kisaran optimal bagi pertumbuhan benih ikan patin.
PENGARUH TEKANAN OSMOTIK MEDIA TERHADAP TINGKAT KELANGSUNGAN HIDUP DAN PERTUMBUHAN
BENIH IKAN PATIN (Pangasius sp.) PADA SALINITAS 5 PPT
KLORY ADI NUGRAHANINGSIH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
SKRIPSI
Judul Skripsi : Pengaruh Tekanan Osmotik Media terhadap Tingkat Kelangsungan Hidup dan Pertumbuhan Benih Ikan Patin (Pangasius sp.) pada Salinitas 5 ppt
Nama Mahasiswa : Klory Adi Nugrahaningsih Nomor Pokok : C 14104009 Disetujui, Pembimbing Dr. D. Djokosetiyanto NIP. 130 536 671 Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc. NIP. 131 578 799
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT karena hanya izin, rizki, dan kasih sayang-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh Tekanan Osmotik Media terhadap Tingkat Kelangsungan Hidup dan Pertumbuhan Benih Ikan Patin (Pangasius sp.) pada Salinitas 5 ppt” sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis menyampaikan ucapan terima kasih kepada : 1. Kedua orang tua, Ayahanda (Drs. Koesnandar), Ibunda (Suharmi) yang sangat penulis sayangi dan banggakan. Karya kecil ini merupakan persembahan yang tak sebanding dengan pengorbanan, cinta, dan doa yang selalu mengiringi langkah penulis selama ini.
2. Bapak Dr. D. Djokosetiyanto, selaku dosen pembimbing skripsi, yang telah banyak memberikan bimbingan, saran, motivasi, dan bantuan selama penelitian dan penyusunan skripsi.
3. Bapak Harton Arfah, M.Si, selaku dosen pembimbing akademik dan penguji tamu atas kesediaan, saran, masukan, bimbingan, dan arahan selama penulis menyelesaikan studi dan untuk kesempurnaan dalam penyusunan skripsi. 4. Bapak Dr. Tatag Budiardi, selaku dosen penguji tamu atas kesediaan, saran,
dan masukan terhadap kesempurnaan dalam penyusunan skripsi.
5. My nice brother n sister (Mas Suluh dan Mbak Citra, Mas Bara dan Mbak Dian, serta Mas Intan) atas doa, semangat, dan kasih sayangnya.
6. Bapak Jajang, Mas Abe, Mbak Yuli, Bapak Umar, dan Mas Asep atas bantuan teknisnya dan proses administrasinya.
7. AnkLing crew’s (Yuly, Phyto, Ema, Bayu, dan Mawan) yang telah memberikan arahan, masukan, kerjasama, dan persahabatan selama ini.
8. Firly Utami Putri Hasibuan, S.TP, atas segala dukungan, bantuan, semangat, dan persahabatan selama ini.
9. My sweet family (Firly, S.TP, Ida, S.TP, Iswi, Mely, S.TP, Tien, Inay, Hikmah, S.Pi, Putri, Eni dan Nissa) dan sahabat-sahabat terbaik (Deedee, S.Pi, Iswi, Widia, Ucha, S.Pi, Uwi, Esse, Asri) serta teman-teman BDP’41 atas
bantuan, semangat, kebersamaan, peta hidup, dan silaturahmi yang terjalin tulus.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, akan tetapi penulis berusaha menyelesaikan dengan sebaik-baiknya dengan harapan dapat bermanfaat bagi yang memerlukannya.
Bogor, Oktober 2008
RIWAYAT HIDUP
Penulis dilahirkan di Rembang pada tanggal 11 September 1986 dari ayah Koesnandar dan ibu Suharmi. Penulis adalah anak keempat dari empat bersaudara. Pendidikan formal penulis ditempuh di SDN Kutoharjo 2 Rembang (1992-1998), SLTPN 1 Rembang (1998-2001), dan SMUN 1 Rembang (2001-2001).
Pada tahun 2004 penulis masuk IPB melalui Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Untuk menambah ketrampilan di bidang Budidaya Perairan, penulis pernah melakukan praktek lapang pembenihan di Balai Benih Ikan (BBI) Punten, Batu, Jawa Timur dengan spesifikasi komoditas Koi (Cyprinus carpio) dan pembesaran di Balai Besar Air Payau (BBAP) Situbondo, Jawa Timur dengan spesifikasi komoditas udang vaname (Litopeneaus vannamei). Di luar kegiatan perkuliahan, penulis pernah aktif menjadi pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) periode 2005/2006 sebagai bendahara, Dewan Perwakilan Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (DPM C) periode 2006/2007 sebagai bendahara. Selama menjadi mahasiswa, penulis juga pernah menjadi asisten laboratorium mata kuliah fisika kimia perikanan.
Untuk menyelesaikan studi, penulis melakukan penelitian yang berjudul “Pengaruh Tekanan Osmotik Media Terhadap Tingkat Kelangsungan Hidup dan Pertumbuhan Benih Ikan Patin (Pangasius sp.) Pada Salinitas 5 ppt”.
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan dan Manfaat ... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Ikan Patin (Pangasius sp.) ... 3
2.2 Tingkat Kelangsungan Hidup ... 4
2.3 Pertumbuhan ... 5
2.4 Osmoregulasi dan Salinitas ... 6
2.5 Kualitas Air... 8 2.5.1 Suhu ... 8 2.5.2 Oksigen Terlarut ... 8 2.5.3 Nilai pH ... 9 2.5.4 Amonia ... 10 2.5.5 Alkalinitas ... 11 2.5.6 Kesadahan ... 11
III. METODE PENELITIAN ... 12
3.1 Waktu dan Tempat ... 12
3.2 Rancangan Percobaan ... 12
3.3 Alat dan Bahan ... 13
3.4 Prosedur Penelitian ... 13
3.5 Parameter yang Diamati ... 14
3.5.1 Tingkat Kelangsungan Hidup ... 14
3.5.2 Laju Pertumbuhan Harian ... 15
3.5.3 Pertumbuhan Panjang Mutlak... 15
3.5.4 Kualitas Air ... 15
3.6 Analisis Data ... 16
IV. HASIL DAN PEMBAHASAN... 17
4.1 Hasil ... 17
4.2 Pembahasan ... 22
V. KESIMPULAN DAN SARAN ... 27
5.1 Kesimpulan... 27
5.2 Saran ... 27
DAFTAR PUSTAKA ... 28
DAFTAR TABEL
Halaman 1. Persentase amonia tak terionisasi (NH3) pada pH dan temperatur yang
berbeda ... 10 2. Klasifikasi nilai kesadahan perairan ... 11 3. Kisaran parameter kualitas air benih ikan patin pada setiap perlakuan ... 21
DAFTAR GAMBAR
Halaman 1. Ikan Patin (Pangasius sp.) ... 3 2. Skema susunan akuarium percobaan ... 12 3. Rata-rata tingkat kelangsungan hidup (%) benih ikan patin
(Pangasius sp.) pada setiap perlakuan selama masa pemeliharaan ... 17 4. Rata-rata laju pertumbuhan harian (%) benih ikan patin (Pangasius sp.)
pada setiap perlakuan selama masa pemeliharaan ... 18 5. Grafik rata-rata bobot (gram) benih ikan patin (Pangasius sp.) pada
setiap perlakuan selama masa pemeliharaan ... 19 6. Grafik rata-rata panjang mutlak (cm) benih ikan patin (Pangasius sp.)
pada setiap perlakuan selama masa pemeliharaan ... 20 7. Grafik tekanan osmotik pada awal dan akhir selama masa
DAFTAR LAMPIRAN
Halaman 1. Data analisis ragam (ANOVA) tingkat kelangsungan hidup (%) benih
ikan patin (Pangasius sp.) ... 32 2. Data analisis ragam (ANOVA) laju pertumbuhan harian (%) benih
ikan patin (Pangasius sp.) ... 33 3. Data pertumbuhan panjang (cm) benih ikan patin (Pangasius sp.)
selama masa pemeliharaan ... 34 4. Data pertumbuhan bobot (gram) benih ikan patin (Pangasius sp.)
selama masa pemeliharaan ... 34 5. Data analisis ragam (ANOVA) pertumbuhan panjang mutlak (cm)
benih ikan patin (Pangasius sp.) ... 35 6. Data osmolaritas awal dan akhir masa pemeliharaan ... 35 7. Data hasil pengukuran pH air media pada Kontrol dan semua
perlakuan ... 36 8. Data hasil pengukuran DO air media pada Kontrol dan semua
perlakuan... 36 9. Data hasil pengukuran amonia air media pada Kontrol dan
semua perlakuan... 37 10. Data hasil pengukuran alkalinitas air media pada Kontrol dan semua
perlakuan ... 38 11. Data data hasil pengukuran kesadahan Ca2+ air media pada
Kontrol dan semua perlakuan ... 39 12. Pengenceran air laut ... 40
I. PENDAHULUAN
1.1 Latar Belakang
Ikan pangasius (Pangasius sp) di Indonesia dikenal dengan sebutan ikan patin. Ikan tersebut termasuk ke dalam famili Pangasidae dan merupakan salah satu golongan catfish yang banyak terdapat di beberapa negara terutama di negara-negara Asia (Anonimous, 1996). Pangasius pertama kali masuk ke Indonesia pada tahun 1972 dan diintroduksi dari Bangkok (Hardjamulia et al., 1986). Ikan ini memiliki nilai ekonomis tinggi di negara asalnya yaitu Siam, Vietnam, dan Kamboja.
Tolok ukur keberhasilan budidaya ikan adalah tercapainya pertumbuhan ikan yang cepat serta tingkat kelangsungan hidup yang tinggi. Dengan demikian produksi ikan pun akan tinggi. Untuk dapat mencapai hal tersebut, terdapat beberapa faktor yang perlu mendapat perhatian antara lain sistem penanganan kualitas air. Dalam masalah penanganan kondisi lingkungan, faktor kualitas air termasuk didalamnya salinitas media, merupakan faktor yang sangat dominan. Hal ini sesuai yang dikemukakan oleh Quines (1988), bahwa pengaruh lingkungan terhadap produksi hewan air adalah bersifat ganda, sedangkan sifat genetik dan faktor lainnya bersifat tunggal serta faktor-faktor tersebut bersifat interaktif dan akumulatif.
Salinitas mempunyai pengaruh osmotik yang dapat mempengaruhi aktivitas fisiologi organisme secara langsung, baik terhadap osmoregulasi maupun bioenergetik (Kinne, 1964; Gilles dan Pequeux, 1983). Meskipun berdasarkan hasil penelitian Hardjamulia et al. (1986) bahwa benih ikan patin dapat bertahan hidup dan tumbuh baik pada tingkat salinitas 3 sampai 7 ppt. Namun pengaruh tekanan osmotik terhadap tingkat kelangsungan hidup serta pertumbuhan belum diketahui dengan jelas.
Salinitas berhubungan erat dengan tekanan osmotik dan ionik air, baik air sebagai media internal maupun eksternal. Agar sel-sel organ tubuh ikan dapat berfungsi dengan baik maka sel-sel tersebut harus berada dalam cairan media dengan komposisi dan konsentrasi ionik yang sesuai dengan kebutuhannya. Oleh karena itu diperlukan pengaturan (osmoregulasi) agar tercipta komposisi dan
konsentrasi ionik cairan dalam sel (intraseluler) dengan cairan luar sel (ekstraseluler) yang hampir sama.
Cole (1988) mengemukakan bahwa perairan yang miskin akan kalsium biasanya juga miskin akan kandungan ion-ion yang sangat dibutuhkan oleh organisme akuatik. Kalsium termasuk unsur yang sangat penting bagi semua makhluk hidup, unsur ini berperan dalam pembentukan tulang dan pengaturan permeabilitas dinding sel. Kalsium juga berperan dalam pembangunan struktur sel tumbuhan serta perbaikan struktur tanah. Kadar kalsium yang tinggi di perairan relatif tidak berbahaya, bahkan dapat menurunkan toksisitas beberapa senyawa kimia.
Kalsium sangat dibutuhkan bagi organisme akuatik untuk melanjutkan kelangsungan hidup dan pertumbuhannya melalui perannya dalam pembentukan tulang, pengaturan permeabilitas dinding sel, serta dalam peningkatan tekanan osmotik. Melihat kepentingan tersebut, maka perlu dilakukan penelitian tentang hubungan konsentrasi kalsium hidroksida Ca(OH)2 didalam media pemeliharaan terhadap kelangsungan hidup dan pertumbuhan benih ikan patin.
1.2 Tujuan
Penelitian ini bertujuan untuk menentukan pengaruh tekanan osmotik media terhadap tingkat kelangsungan hidup dan pertumbuhan benih ikan patin pada salinitas 5 ppt dengan penambahan kapur Ca(OH)2.
II. TINJAUAN PUSTAKA
2.1 Ikan Patin (Pangasius sp.)
Budidaya ikan patin semakin berkembang pesat setelah pemijahan berhasil dilakukan pada tahun 1958 dengan teknik hipofisa (Potaros dan Sitasit dalam Suseno et al.,1992). Di Indonesia ikan patin berhasil dipijahkan dengan teknik hipofisa pada tahun 1977 (Hardjamulia dan Atmawinata dalam Suseno et al., 1992).
Klasifikasi ikan patin ini menurut Lagler (1972) dan Saanin (1984) adalah sebagai berikut :
Klas : Pisces Sub Kelas : Teleostei Ordo : Ostariophysi Sub Ordo : Siluroidea Famili : Pangasidae Genus : Pangasius Spesies : Pangasius sp.
Gambar 1. Ikan Patin (Pangasius sp.)
Secara umum ikan patin memiliki bentuk badan sedikit memipih, tidak bersisik, mulut sub terminal dengan empat sungut peraba (barbels), terdapat patil pada sirip punggung dan sirip dada, sirip analnya panjang mulai dari belakang anal sampai pangkal sirip ekor dan berwarna putih dengan garis hitam ditengahnya serta memiliki sirip tambahan (adipose fin). Ikan ini juga memiliki garis lengkung dari kepala sampai pangkal sirip ekor, sirip ekornya bercagak dengan tepian berwarna putih. Warna badan ikan patin kelabu kehitaman dan hidup bebas di sungai dan danau (Sumantadinata, 1983).
Sifat biologis ikan patin yaitu nokturnal atau lebih aktif pada malam hari seperti golongan catfish lainnya, termasuk golongan ikan pemakan segala (omnivora) dan sesekali muncul ke permukaan air untuk mengambil oksigen dari udara langsung. Ikan patin mempunyai beberapa sifat yang menguntungkan untuk dibudidayakan, seperti ukuran yang besar per individunya, mempunyai fekunditas yang cukup tinggi, kebiasaan makan yang omnivora, serta mutu daging yang lezat dan gurih sehingga digemari oleh masyarakat luas (Arifin, 1991).
2.2 Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup adalah persentase organisme yang hidup pada akhir pemeliharaan dari jumlah seluruh organisme awal yang dipelihara dalam suatu wadah (Effendi, 1978). Mortalitas menurut Royce (1973) adalah kematian yang terjadi pada suatu populasi organisme yang dapat menyebabkan turunnya jumlah populasi. Mortalitas yang terjadi dapat digunakan sebagai parameter bagi kelangsungan hidup suatu organisme dalam hubungannya dengan ketahanan terhadap lingkungan, penyakit, dan parasit. Lebih lanjut dikatakan bahwa tingkat kelangsungan hidup dipengaruhi oleh faktor dalam dan faktor luar. Faktor luar meliputi kondisi abiotik, kompetisi antar spesies, tingginya jumlah populasi dalam ruang gerak yang sama, dan kurangnya makanan yang tersedia akibat adanya penanganan yang kurang baik. Sedangkan faktor dalam dipengaruhi oleh umur dan daya penyesuaian diri terhadap lingkungan.
Kelangsungan hidup dan metabolisme ikan akibat perubahan salinitas bergantung pada dua hal, yaitu : (1) Kemampuan cairan tubuh untuk berfungsi seminimal mungkin dengan waktu yang singkat pada kisaran osmotik internal dan konsentrasi ion tidak normal yang tumbuh secara mendadak, serta (2) Kemampuan cairan tubuh yang bekerja seminimal mungkin dan pengembalian tekanan osmotik kembali ke normal (Holliday, 1969). Kelangsungan hidup ikan air tawar di dalam lingkungan berkadar garam bergantung pada jaringan insang, luas permukaan insang, laju konsumsi oksigen, dan daya tahan (toleransi) jaringan terhadap garam-garam dan kontrol permeabilitas (Black, 1957 dalam Wulandari, 2006).
2.3 Pertumbuhan
Pertumbuhan merupakan proses bertambahnya ukuran volume dan berat suatu organisme, yang dapat dilihat dari perubahan ukuran panjang dan berat dalam satuan waktu (Effendi, 1979). Selanjutnya dinyatakan, bahwa pertumbuhan terdiri dari pertumbuhan mutlak dan pertumbuhan relatif. Pertumbuhan mutlak adalah pertumbuhan panjang atau berat yang dicapai dalam periode waktu tertentu. Pertumbuhan relatif adalah pertambahan panjang atau berat ikan dalam periode waktu tertentu, dihubungkan dengan panjang atau berat ikan pada awal periode tersebut. Effendi (1978) menyatakan bahwa pertumbuhan terjadi bila ada kelebihan masukan energi dan asam amino dari pakan. Energi pakan ini akan digunakan oleh tubuh untuk metabolisme dasar, pergerakan, produksi organ seksual, perawatan bagian-bagian tubuh serta menggantikan sel-sel yang telah rusak dan kelebihannya untuk pertumbuhan.
Faktor-faktor yang mempengaruhi pertumbuhan ikan meliputi faktor eksternal dan internal. Faktor internal merupakan faktor-faktor yang berhubungan dengan keadaan ikan itu sendiri seperti umur dan sifat genetik ikan yang meliputi keturunan, kemampuan untuk memanfaatkan makanan, dan ketahanan terhadap penyakit. Sedangkan faktor eksternal merupakan faktor yang berkaitan dengan lingkungan tempat hidup ikan yang meliputi sifat fisik dan kimia air yaitu suhu air, oksigen terlarut, karbondioksida bebas, dan lain sebagainya. Ruang gerak dan ketersediaan makanan dari segi kualitas dan kuantitas juga termasuk dalam faktor eksternal (Huet, 1971).
Faktor lingkungan yang mempengaruhi laju pertumbuhan dan pakan yang dikonsumsi antara lain suhu, oksigen terlarut, dan salinitas (Peter, 1979 dalam Lesmono, 2006). Ikan yang dipelihara pada salinitas mendekati konsentrasi ion dalam darah (isoosmotik), menggunakan energi lebih banyak untuk pertumbuhan dan lebih sedikit untuk osmoregulasi (Stickney, 1979). Hal ini sesuai dengan Holliday (1969) yang menyatakan pemeliharaan ikan pada kondisi isoosmotik merupakan efek yang menguntungkan karena adanya penyimpanan energi yang disebabkan menurunnya energi untuk proses osmosis dan efek ionik sehingga pertumbuhan meningkat.
2.4 Osmoregulasi dan Salinitas
Osmoregulasi merupakan pengaturan tekanan osmotik cairan tubuh yang layak bagi kehidupan ikan sehingga proses-proses fisiologi berjalan normal (Anonimous, 1989). Hewan-hewan vertebrata air, di dalam tubuhnya mengandung konsentrasi garam yang berbeda dari media lingkungannya (Stickney, 1979). Proses-proses fisiologi dalam tubuh ikan akan berjalan normal apabila keseimbangan konsentrasi garam cairan tubuh dengan lingkungannya dapat dipelihara dan dijaga. Untuk mempertahankan keseimbangan tersebut, maka ikan melakukan proses pengaturan tekanan osmotik cairan tubuh yang layak dan disebut dengan sistem osmoregulasi (Rahardjo, 1980).
Ikan air laut mempunyai cairan tubuh yang hipotonik terhadap lingkungan luarnya, sehingga ikan cenderung kehilangan air melalui kulit dan insang serta kemasukan garam-garam. Untuk mengatasinya, ikan “minum” air laut yang menyebabkan peningkatan kandungan garam dalam cairan tubuh, namun kelebihan ini dikeluarkan kembali melalui permukaan tubuh yang semipermeabel secara difusi (Black, 1957 dalam Wulandari, 2006).
Berbeda dengan ikan air laut, ikan air tawar mempunyai konsentrasi osmotik darah yang lebih tinggi dari lingkungannya sehingga jumlah garam yang ada di dalam tubuh akan hilang melalui permukaan jaringan insang dan kulit pada proses difusi, juga melalui feses dan urin. Untuk menjaga agar garam-garam tubuh hilang seminimal mungkin, maka dilakukan penyerapan kembali garam-garam dalam pembuluh proksimal ginjal. Kehilangan garam-garam ini akan digantikan oleh garam-garam yang terdapat dalam pakan dan penyerapan aktif ion-ion garam yang berasal dari lingkungan perairan melalui insang (Spotte, 1970 dalam Lesmono, 2006).
Berdasarkan penelitian Grafflin et al., dalam Black (1957) dalam Wulandari (2006), ikan air tawar yang dipindahkan ke media yang bersalinitas lebih tinggi akan kemasukan garam-garam, dan sebaliknya ikan air laut yang dipindahkan ke media yang bersalinitas lebih rendah akan kemasukan air secara terus-menerus pada kecepatan yang tidak normal dan mendapat keseimbangan kembali setelah 10-48 jam. Ikan air tawar yang menambah garam secara bertahap, memperlihatkan perubahan konsentrasi garam tubuh secara berangsur-angsur
akibat kontrol permeabilitas oleh hormon dan sistem saraf terhadap lingkungan baru dan pengaruh langsung sel-sel permukaan tubuhnya (Brown, 1957 dalam Lesmono, 2006).
Salinitas merupakan salah satu faktor yang ada dalam sifat kimia air dan keberadaannya di dalam air dapat menjadi faktor penghambat atau pemacu pertumbuhan ikan. Selain itu, salinitas juga merupakan faktor penting yang menunjang kelangsungan hidup, konsumsi pakan, laju pertumbuhan, metabolisme, dan distribusi ikan (Kinne, 1964 dalam Lesmono, 2006). Salah satu aspek fisiologis ikan yang dipengaruhi oleh salinitas adalah tekanan dan konsentrasi osmotik serta konsentrasi ion dalam cairan tubuh (Holliday, 1969). Ikan yang dipelihara pada kondisi salinitas yang sama dengan konsentrasi ion dalam darah akan lebih banyak menggunakan energi untuk pertumbuhan (Stickney, 1979).
Untuk media hidup ikan, salinitas secara tidak langsung berpengaruh terhadap perubahan gas-gas terlarut, berat jenis dan densitas media (Person et al., 1984), salinitas juga secara tidak langsung mempengaruhi kesadahan, serta alkalinitas dan daya racun amoniak (Bower dan Bidwell, 1978). Person et al. (1984) juga menyatakan, makin tinggi salinitas maka semakin kecil kapasitas maksimum kejenuhan oksigen dalam air, sedangkan daya racun amoniak biasanya meningkat pada salinitas rendah dan temperatur tinggi (Bower dan Bidwell, 1978).
Salinitas berhubungan dengan tekanan osmotik air. Semakin tinggi salinitas akan semakin tinggi pula tekanan osmotik air. Tingkat tekanan osmotik yang diperlukan oleh ikan akan berbeda-beda menurut jenisnya sehingga toleransi terhadap salinitasnya berbeda-beda (Cholik dan Daulay, 1985). Suresh dan Lin (1992) menyatakan bahwa faktor-faktor yang mempengaruhi toleransi organisme terhadap salinitas air media hidupnya adalah spesies, temperatur, mekanisme aklimatisasi, umur, serta ukuran tubuh.
Pengaruh tekanan osmotik yang merupakan fungsi fisiologis memerlukan energi. Energi akan lebih banyak digunakan untuk pertumbuhan dan lebih sedikit untuk proses metabolisme pada ikan yang dipelihara pada salinitas yang mendekati konsentrasi ion dalam darahnya (Stickney, 1979). Setiap organisme
mempunyai daya tahan pada batas tertentu terhadap perubahan lingkungan. Jika keadaan lingkungannya ada pada tingkat diluar batas kisaran daya tahan, maka pertumbuhannya akan terhambat dan bahkan dapat menyebabkan kematian secara perlahan-lahan atau kematian mendadak (Black, 1957 dalam Wulandari, 2006).
Channel catfish yang tumbuh normal di air tawar, dapat menyesuaikan diri sampai
salinitas 14 ppt dapat dipelihara di perairan payau (Black, 1957 dalam Wulandari, 2006). Hasil penelitian Hardjamulia et al. (1986) menunjukkan bahwa kadar garam dalam air berpengaruh terhadap kelangsungan hidup dan pertumbuhan larva ikan jambal siam (Pangasius sutchi). Kelangsungan hidup dan pertumbuhan ikan jambal siam meningkat sampai kadar garam 3,2 ppt dan larva mati semua pada kadar 12,8 ppt dalam waktu dua hari.
2.5 Kualitas Air 2.5.1 Suhu
Suhu adalah pengatur utama dalam proses-proses alami di lingkungan perairan. Daya toleransi ikan terhadap suhu sangat bervariasi bergantung pada spesies dan stadia hidupnya (Pescod dan Okun, 1973). Suhu air optimal bagi ikan patin adalah 28°C-32°C. Pada kisaran tersebut konsumsi oksigen cukup tinggi sehingga nafsu makan tinggi sementara pada suhu dibawah 20°C nafsu makan menurun.
2.5.2 Oksigen Terlarut
Pada lingkungan perairan, kandungan oksigen dalam air dapat dilihat melalui kandungan oksigen terlarut. Berdasarkan hasil penelitian kualitas air dan kontaminasi polutan membuktikan bahwa oksigen terlarut (dissolved oxygen, DO) merupakan parameter paling penting sebagai penunjang kehidupan organisme akuatik. Oksigen digunakan oleh organisme akuatik untuk proses respirasi. Ketersediaan oksigen sangat berpengaruh terhadap metabolisme dalam tubuh dan untuk kelangsungan hidup suatu organisme. Oksigen terlarut dalam air dapat berasal dari difusi dengan udara dan adanya proses fotosintesis dari tanaman air (Novotny dan Olem, 1994). Kelarutan oksigen di air menurun dengan semakin meningkatnya salinitas, setiap peningkatan salinitas sebesar 9 mg/l mengurangi kelarutan oksigen sebanyak 5 % dari yang seharusnya di air tawar (Boyd, 1982).
Kebutuhan organisme akan oksigen sangat bervariasi bergantung pada umur ikan, ukuran ikan, dan kondisi ikan (Boyd dan Lichkoppler, 1979). Menurut Brett (1979), jika kandungan oksigen terlarut dalam air pada wadah budidaya kurang dari 3 mg/l dan suhu air berkisar antara 20°C-32°C dapat menyebabkan laju pertumbuhan, efisiensi pakan, dan jumlah pakan yang diberikan menurun. Penurunan kadar oksigen terlarut hingga dibawah 5 mg/l dapat menyebabkan gangguan pada sistem reproduksi, pertumbuhan, dan kematian organisme budidaya (Swingle, 1969 dalam Boyd, 1982).
2.5.3 Nilai pH
Nilai pH mengekspresikan konsentrasi molar dari ion hidrogen yang berupa logaritma negatif (pH= -log[H+]) adalah indikator utama yang digunakan untuk mengevaluasi kualitas dari air permukaan dan kecocokan untuk pemanfaatan tertentu. Kebanyakan biota akuatik sensitif terhadap perubahan pH. Kematian, reduksi, dan perubahan dari spesies terjadi ketika pH berubah diluar limit toleransi biota itu. Sebagian besar spesies akuatik lebih menyukai pH mendekati netral tetapi dapat bertahan juga pada rentang 6 sampai 8,5 (Novotny dan Olem, 1994). Dekomposisi bahan organik dan respirasi dalam perairan akan menurunkan kandungan oksigen terlarut dan menaikkan kandungan CO2 yang akan berpengaruh terhadap penurunan nilai pH. Penurunan nilai pH dapat mengakibatkan terlepasnya logam berat dari tanah sebagai subsrat, peningkatan kandungan amonia, dan CO2 yang bersifat racun (toksik) bagi organisme akuatik (Boyd, 1982).
Kisaran pH yang dapat diterima untuk pemeliharaan ikan dan produktivitas perairan adalah 6,5-8,5 (Pescod dan Okun, 1973; Boyd dan Lichkoppler, 1979). Walaupun kebanyakan perairan alami tidak mengandung bahan kimia pada konsentrasi yang cukup besar diatas batas ketahanan ikan, menurut Ness dalam Bennet (1969), pada pH 5,5 perkembangan ikan sangat sensitif terhadap bakteri parasit dan biasanya mati dalam waktu singkat pada kondisi pH lebih rendah atau sama dengan 4,5.
2.5.4 Amonia
Pada perairan, nitrogen berupa nitrogen anorganik dan nitrogen organik. Nitrogen anorganik terdiri dari amonium (NH4+), nitrit (NO2-), dan nitrat (NO3-). Nitrogen organik berupa protein, asam amino, dan urea. Amonia (NH3) dan garam-garamnya bersifat mudah larut dalam air. Sumber amonia di perairan adalah pemecahan nitrogen organik (protein dan urea) dan nitrogen anorganik di dalam tanah dan air yang berasal dari dekomposisi bahan organik (tumbuhan dan biota akuatik yang telah mati) oleh mikroba dan jamur (Effendi, 2003).
Dua produk utama hasil metabolisme adalah CO2 dan NH3, yaitu produksi amonia berjumlah sekitar 1/10 dari jumlah produksi karbondioksida. Amonia diekskresikan oleh banyak organisme akuatik dan terus diproduksi sebagai hasil dari dekomposisi ekskresi dari organisme mati. Persentase amonia bebas meningkat dengan meningkatnya nilai pH dan suhu perairan. Selain terdapat dalam bentuk gas, amonia membentuk kompleks dengan beberapa ion logam. Amonia juga dapat terserap ke dalam bahan-bahan tersuspensi dan koloid sehingga mengendap di dasar perairan. Amonia di perairan dapat menghilang melalui proses volatisasi karena tekanan parsial amonia dalam larutan meningkat dengan semakin meningkatnya pH. Hilangnya amonia ke atmosfer juga dapat ditingkatkan oleh kecepatan angin dan suhu. Konsentrasi amonia dipengaruhi pH, suhu air, salinitas, konsentrasi oksigen, dan konsentrasi natrium serta kesadahan (Wedemeyer, 1996).
Tabel 1. Persentase amonia tak terionisasi (NH3) pada pH dan temperatur yang berbeda (Boyd, 1982) Temperatur (°C) pH 24 28 32 7 0.5 0.7 1.0 8 5.0 6.6 8.8 8.2 7.7 10 13.2
Menurut Boyd (1982), tingkat keracunan amonia tiap spesies berbeda-beda tetapi pada kadar 0,6 mg/l dapat membahayakan organisme tersebut.
Kandungan NH3-H di perairan tropika tidak lebih dari 1 mg/l, agar kehidupan menjadi normal.
2.5.5 Alkalinitas
Alkalinitas adalah gambaran kapasitas air untuk menetralkan asam atau dikenal dengan sebutan acid-neutralizing capacity (ANC) atau kuantitas anion di dalam air yang dapat menetralkan kation hidrogen. Alkalinitas juga diartikan sebagai kapasitas penyangga (buffer capacity) terhadap perubahan pH perairan.
Kalsium karbonat merupakan senyawa yang memberi kontribusi terhadap nilai alkalinitas dan kesadahan di perairan tawar. Kelarutan kalsium karbonat menurun dengan meningkatnya suhu dan karbondioksida (Effendi, 2003). Satuan alkalinitas dinyatakan dengan mg/l kalsium karbonat (CaCO3) atau mili-ekuivalen/l. Selain bergantung pada pH, alkalinitas juga dipengaruhi oleh komposisi mineral, suhu, dan kekuatan ion. Nilai alkalinitas yang baik berkisar 30-500 mg/l (Effendi, 2003).
2.5.6 Kesadahan
Kesadahan menggambarkan kandungan Ca2+ dan Mg2+ serta ion logam polivalen lainnya. Kesadahan air yang paling banyak adalah akibat hadirnya ion Ca2+ dan Mg2+ sehingga dalam pengukurannya hanya diarahkan pada penetapan kadar Ca2+ dan Mg2+ dalam air (Boyd, 1982). Swingle (1968) dalam Effendi (2003) menyatakan, kesadahan yang kurang dari 15 mg/l CaCO3 ekuivalen, akan menyebabkan pertumbuhan organisme perairan menjadi lambat dan bahkan akan menyebabkan kematian. Kesadahan yang berkisar 20-150 mg/l CaCO3 ekuivalen dalam perairan baik untuk menunjang kehidupan organisme perairan.
Tabel 2. Klasifikasi nilai kesadahan perairan
Kesadahan (mg/l) CaCO3 Klasifikasi
0-75 Rendah 75-100 Moderat 150-300 Sadah
>300 Sangat Sadah
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juni 2008 sampai dengan bulan Juli 2008 selama 30 hari di Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Rancangan Percobaan
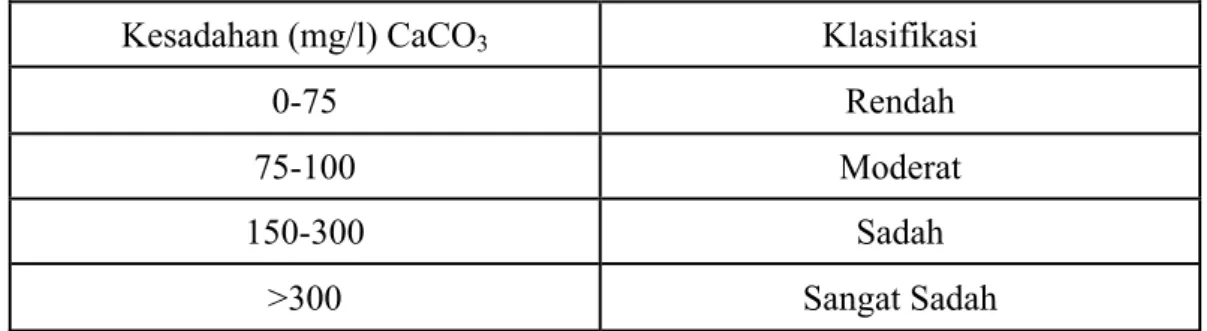
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL) dengan lima perlakuan yang masing-masing diulang tiga kali, yaitu Kontrol (0 mg/l Ca(OH)2), A (10 mg/l Ca(OH)2), B (20 mg/l Ca(OH)2), C (30 mg/l Ca(OH)2), dan D (40 mg/l Ca(OH)2). Penempatan unit percobaan dilakukan secara acak (Gambar 2). Model rancangan yang digunakan adalah :
ij
i
Yij
=
μ
+
β
+
ε
Keterangan :Yij = nilai pengamatan; i = 1, 2, 3, ...n µ = nilai tengah umum
βi = pengaruh perlakuan ke-i; i = 1, 2, 3, ... n
Εij = pengaruh galat dari perlakuan ke-i yang mendapat ulangan ke-j
K
K
C
A
B
D
A
D
B
C
B
K
A
D
C
3.3 Alat dan Bahan
Alat yang digunakan meliputi akuarium ukuran 100x50x50 cm3 untuk tandon dan akuarium perlakuan ukuran 50x33x30 cm3 sebanyak 15 buah, aerator, jangka sorong, timbangan digital 200 gram dengan ketelitian 0,01, termometer, DO-meter, pH-meter, bekker glass, buret, pipet volumetrik, pipet tetes, erlenmenyer, spektrofotometer, refraktometer, osmometer, seperangkat alat titrasi, selang, ember, baskom, saringan, gunting, dan alat tulis.
Bahan yang digunakan adalah benih ikan patin dengan ukuran panjang 2,74±0,26 cm/ekor dan bobot 0,311±0,08 gram/ekor, air laut dengan salinitas 30 gr/l, air tawar, kapur Ca(OH)2, pakan buatan komersial dengan protein 40 %, akuades dan pereaksi yang digunakan untuk uji kimia seperti alkalinitas menggunakan HCl dan BCG (Bromcresol Green), amonia (NH3) menggunakan MnSO4, Clorox, dan Phenat, serta kesadahan menggunakan EDTA (Ethylen-Diamine Tetraacetic) dan Murexide.
3.4 Prosedur Penelitian
3.4.1 Perlakuan dan Pemeliharaan Ikan Uji
Akuarium yang telah disiapkan diisi air bersalinitas 5 ppt dengan volume 33 liter kemudian diberikan perlakuan dengan penambahan kapur Ca(OH)2 yang terdiri dari Kontrol (0 mg/l Ca(OH)2), A (10 mg/l Ca(OH)2), B (20 mg/l Ca(OH)2), C (30 mg/l Ca(OH)2), dan D (40 mg/l Ca(OH)2) masing-masing terdiri dari tiga ulangan. Kemudian ikan uji dimasukkan kedalamnya dengan kepadatan 5 ekor/l dan dipelihara selama 30 hari. Aklimatisasi dan adaptasi terhadap lingkungan pemeliharaan dan pakan dilakukan selama tujuh hari untuk mendapatkan air dengan salinitas 5 ppt dengan kisaran suhu 26°C-28°C. Pakan yang digunakan pakan komersil, persentase pakan yang diberikan pada awal pemeliharaan adalah 8 % biomassa setelah sampling kedua menggunakan persentase sebesar 4 % biomassa. Pemberian pakan dilakukan dengan frekuensi tiga kali dalam sehari yaitu pagi, siang dan sore hari. Untuk mempertahankan kualitas air dalam media pemeliharaan dilakukan penggantian air setiap dua hari sekali sebanyak 40 % dari total volume air. Kemudian dilakukan pengisian kembali air yang terbuang dengan air yang berasal dari tandon sesuai dengan
perlakuan masing-masing. Pengukuran parameter kualitas air dilakukan setiap seminggu sekali, sedangkan untuk pengukuran pertumbuhan dilakukan setiap 10 hari sekali.
3.4.2 Pembuatan Air Salinitas 5 ppt
Air dengan salinitas 5 ppt (Lampiran 12) didapatkan dengan pengenceran air laut bersalinitas 30 ppt dengan menambahkan air tawar sesuai perhitungan dengan menggunakan rumus pengenceran sebagai berikut :
2 2 1 1xV M xV M = Keterangan:
M1 = salinitas air yang diinginkan
V1 = volume air pada salinitas yang diinginkan M2 = salinitas air laut
V2 = volume air laut yang ditambahkan
3.4.3 Pembuatan Air Kapur 10, 20, 30, dan 40 mg/l Ca(OH)2
Bahan yang digunakan untuk memperoleh penambahan kapur sesuai dengan perlakuan adalah kalsium hidroksida (Ca(OH)2) dalam bentuk bubuk yang diperoleh dari toko bahan kimia. Akuarium sebanyak 15 buah yang telah disiapkan dengan air dengan salinitas 5 ppt dengan volume 33 liter kemudian ditambahkan kapur Ca(OH)2 sesuai dengan perlakuan penambahan 10 mg/l Ca(OH)2, 20 mg/l Ca(OH)2, 30 mg/l Ca(OH)2, dan 40 mg/l Ca(OH)2.
3.5 Parameter Yang Diamati 3.5.1 Tingkat Kelangsungan Hidup
Pada akhir penelitian, dihitung jumlah benih udang yang masih hidup kemudian dibandingkan dengan jumlah awal benih udang yang ditebar, maka akan didapatkan persentase tingkat kelangsungan hidup dengan rumus menurut Effendi (2003) sebagai berikut :
% 100 0 x N N SR = t Keterangan: SR = kelangsungan hidup (%) N0 = jumlah ikan pada saat awal (ekor)
Nt = jumlah ikan pada saat akhir (ekor) 3.5.2 Laju Pertumbuhan Harian
Laju pertumbuhan harian adalah laju pertumbuhan bobot individu dalam persen (%). Parameter pertambahan bobot diukur dengan menimbang sampel dari setiap perlakuan menggunakan timbangan digital 200 gram dengan ketelitian 0,01 gram (Lampiran 2). Laju pertumbuhan harian dinyatakan dalam persamaan sebagai berikut : % 100 1 0 x t t ⎥ ⎦ ⎤ ⎢ ⎣ ⎡ − = ω ω α Keterangan:
α = laju pertumbuhan harian (%)
ωt = bobot rata-rata ikan pada waktu ke-t pemeliharaan (gram) ω0 = bobot rata-rata ikan pada awal pemeliharaan (gram) t = waktu pemeliharaan (hari)
3.5.3 Pertumbuhan Panjang Mutlak
Pertumbuhan panjang mutlak adalah selisih panjang total tubuh ikan. Parameter pertumbuhan panjang yang diukur dalam penelitian ini adalah panjang total yaitu jarak antara ujung kepala terdepan dengan ujung sirip ekor yang paling belakang (Effendi, 1979). Pengukuran dilakukan dengan menggunakan jangka sorong dengan ketelitian 0,1 mm (Lampiran 5). Dirumuskan dalam persamaan sebagai berikut : 0 P P Pm = t − Keterangan :
Pm = panjang mutlak ikan (cm) Pt = panjang ikan pada hari ke-t (cm) P0 = panjang ikan pada hari ke-0 (cm)
3.5.4 Parameter Kualitas Air
Pengukuran suhu pada media dengan pemeliharaan menggunakan termometer air raksa (Hg) dengan satuan °C.
Oksigen terlarut adalah jumlah mg/l gas oksigen yang terlarut dalam air. Kadar oksigen dalam air dapat ditentukan dengan menggunakan DO-meter. Pengukuran oksigen terlarut menggunakan metode membran elektro.
Nilai pH di lingkungan dipengaruhi oleh kadar CO2 terlarut dan alkalinitas. Alat yang digunakan adalah pH-meter dengan metode membran elektro.
Amonia (NH3) dan garam-garamnya bersifat mudah larut dalam air. Amonia bebas tak terionisasi bersifat toksik terhadap organisme akuatik. Metode yang digunakan dalam pengukuran amonia adalah metode Indophenol. Nilai TAN yang terukur bergantung pada nilai pH dan suhu pada saat pengukuran. Persamaan yang digunakan dalam pengukuran amonia adalah :
[ ]
std x blanko abs std abs blanko abs sampel abs liter NH mg − − = / 3Alkalinitas adalah gambaran kapasitas air untuk menetralkan asam (Effendi, 2003). Pengukuran alkalinitas menggunakan metode acidimetri dan dinyatakan dalam persamaan sebagai berikut :
sampel ml x x titran N x titran ml liter CaCO mg 3/ = 100 /2 1000
Kesadahan (hardness) adalah gambaran kation logam divalen (Effendi, 2003). Kesadahan diukur dengan menggunakan metode acidimetri dan dinyatakan dalam persamaan sebagai berikut :
sampel ml x x titran N x titran ml liter CaCO mg 3 / = 100 ,1 1000 3.6 Analisis Data
Data yang diperoleh dianalisis dengan menggunakan analisis ragam (ANOVA) dan uji-F pada selang kepercayaan 95 %. Untuk melihat perbedaan antar perlakuan dilakukan dengan uji lanjut BNJ (Beda Nyata Jujur).
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Kelangsungan Hidup
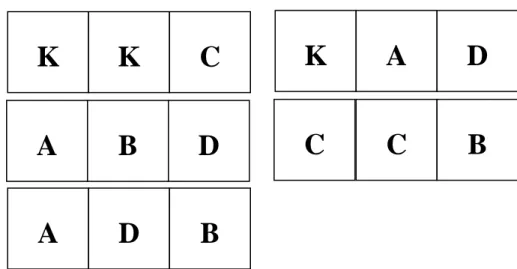
Tingkat kelangsungan hidup benih ikan patin selama masa pemeliharaan untuk setiap perlakuan dan Kontrol disajikan pada Gambar 3 berkisar antara 70,10 % - 85,45 %. Data selengkapnya terdapat pada Lampiran 1. Dengan masa pemeliharaan 30 hari didapatkan hasil bahwa tingkat kelangsungan hidup tertinggi terdapat pada Kontrol yaitu sebesar 85,45 % dan tidak berbeda nyata dengan perlakuan D yaitu sebesar 82,02 %, sedangkan tingkat kelangsungan hidup terendah adalah pada perlakuan B yaitu sebesar 70,10 %.
85,45 77,17 70,1 77,57 82,02 y = 2,8571x2 - 17,789x + 100,4 R2 = 0,8848 0 20 40 60 80 100 120 Kontrol A (10 mg/l) B (20 mg/l) C (30 m g/l) D (40 mg/l) Ca(OH)2 (mg/l) K e la ng sung a n H idup ( % ) a a a a a
Gambar 3. Rata-rata tingkat kelangsungan hidup (%) benih ikan patin (Pangasius sp.) pada setiap perlakuan selama masa pemeliharaan
Dari analisis statistika (ANOVA) dinyatakan, bahwa tingkat kelangsungan hidup pada kontrol dan perlakuan tidak berbeda nyata (p<0,05), namun memiliki kecenderungan meningkat dari perlakuan A (10 mg/l Ca(OH)2) ke D (40 mg/l Ca(OH)2) (Lampiran 1). Semakin meningkatnya tingkat penambahan kapur Ca(OH)2 (x) menyebabkan tingkat kelangsungan hidup benih ikan patin (y) berbentuk kuadratik (Gambar 3) mengikuti persamaan y = 2,8571 x2-17,789 x + 100,4 dengan nilai determinasi (R2) sebesar 0,8848. Nilai determinasi yang didapat menunjukkan bahwa garis dugaan dari percobaan yang dilakukan mendekati keadaan yang sebenarnya sebesar 88,48 %.
4.1.2 Laju Pertumbuhan Harian
Laju pertumbuhan harian didapatkan dari data bobot benih ikan patin pada saat pengambilan contoh setiap 10 hari selama masa pemeliharaan yang tertera pada Lampiran 2. Laju pertumbuhan harian selama pemeliharaan pada setiap perlakuan dan Kontrol dapat dilihat pada Gambar 4.
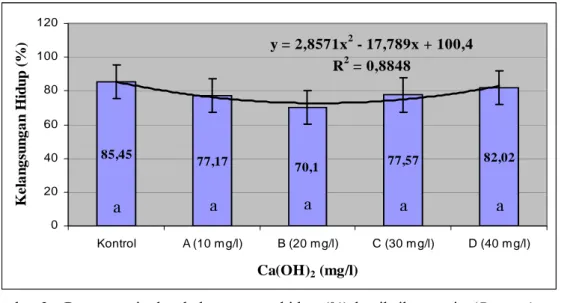
5,84 5,99 6,13 5,86 5,99 5,65 5,7 5,75 5,8 5,85 5,9 5,95 6 6,05 6,1 6,15 6,2 Kontrol A (10 mg/l) B (20 mg/l) C (30 mg/l) D (40 mg/l) Ca(OH)2 (mg/l) L a ju P e r tum bu ha n H a r ia n (% ) c
Gambar 4. Rata-rata laju pertumbuhan harian (%) benih ikan patin (Pangasius sp.) pada setiap perlakuan selama masa pemeliharaan
Laju pertumbuhan harian benih ikan patin selama 30 hari pemeliharaan berkisar antara 5,84 % - 6,13 %. Nilai laju pertumbuhan harian pada semua perlakuan selama masa pemeliharaan selalu mengalami peningkatan setiap minggunya. Dari hasil analisis statistika (ANOVA) diperoleh hasil bahwa laju pertumbuhan harian pada kontrol dan perlakuan (Lampiran 2) tidak berbeda nyata pada selang kepercayaan 95 % (p<0,05). Pada akhir masa pemeliharaan laju pertumbuhan harian tertinggi dicapai pada perlakuan B (20 mg/l Ca(OH)2) sebesar 6,13 %, sedangkan nilai terendah pada kontrol sebesar 5,84 %.
4.1.3 Bobot
Hasil pengamatan terhadap bobot selama penelitian pada Kontrol dan perlakuan penambahan kapur Ca(OH)2 berturut-turut 10 mg/l, 20 mg/l, 30 mg/l, dan 40 mg/l terlihat dari grafik bobot (gram) benih ikan patin pada Gambar 5.
0,00 0,50 1,00 1,50 2,00 0 10 20 30 Hari ke-B o b o t (g r a m ) Kontrol A (10 mg/l) B (20 mg/l) C (30 mg/l) D (40 mg/l)
Gambar 5. Grafik rata-rata bobot (gram) benih ikan patin pada setiap perlakuan selama masa pemeliharaan
Bobot benih ikan patin selama 30 hari pemeliharaan mengalami peningkatan. Pada akhir penelitian, bobot rata-rata tertinggi dicapai pada perlakuan B (20 mg/l Ca(OH)2), yaitu sebesar 1,89 gram/ekor. Sedangkan bobot terendah dicapai pada perlakuan Kontrol 1,74 gram/ekor.
4.1.4 Panjang Mutlak
Hasil pengamatan panjang mutlak selama penelitian pada Kontrol dan perlakuan penambahan kapur Ca(OH)2 berturut-turut 10 mg/l, 20 mg/l, 30 mg/l, dan 40 mg/l terlihat pada Gambar 6.
0 1 2 3 4 5 6 0 10 20 30 Hari ke -P an jan g ( c m ) Kontrol A (10 mg/l) B (20 mg/l) C (30 mg/l) D (40 mg/l)
Gambar 6. Grafik rata-rata panjang mutlak (cm) benih ikan patin pada setiap perlakuan selama masa pemeliharaan
Panjang benih ikan patin selama 30 hari pemeliharaan mengalami peningkatan. Pada akhir penelitian, panjang rata-rata tertinggi dicapai pada perlakuan B (20 mg/l Ca(OH)2), yaitu sebesar 4,84 cm. Sedangkan panjang rata-rata terendah dicapai pada Kontrol sebesar 4,52 cm.
4.1.5 Tekanan Osmotik Awal dan Akhir Masa Pemeliharaan
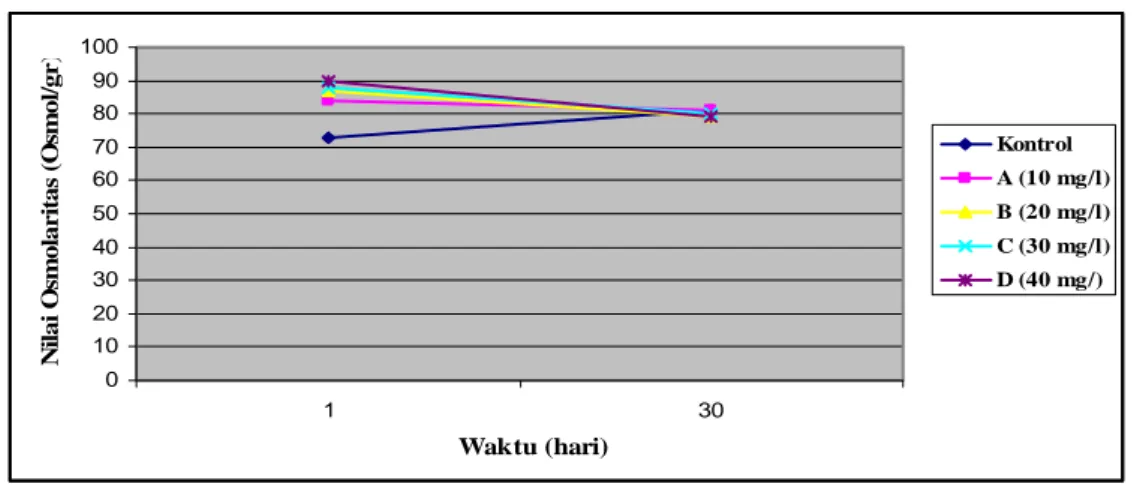
Hasil pengamatan tekanan osmotik di awal dan akhir penelitian pada Kontrol dan perlakuan penambahan kapur Ca(OH)2 berturut-turut 10 mg/l, 20 mg/l, 30 mg/l dan 40 mg/l terlihat pada Gambar 7. Pada Gambar 7 terlihat bahwa pada media air dengan salinitas 5 ppt, grafik cenderung menurun dengan penambahan kapur Ca(OH)2 diakhir perlakuan. Pada awal sampai akhir pemeliharaan nilai osmotik media terbesar pada perlakuan D (40 mg/l Ca(OH)2 sebesar 90 Osmol/g. Sedangkan nilai osmotik media yang pada akhir pemeliharaan terdapat menunjukkan akan yang sama pada kisaran 79-81 Osmol/g pada Kontrol dan perlakuan A sampai D dapat dilihat pada Lampiran 6.
0
Gambar 7. Grafik tekanan osmotik awal dan akhir masa pemeliharaan
4.1.6 Kualitas Air
Kualitas air merupakan faktor kimia dan fisika yang dapat mempengaruhi lingkungan media pemeliharaan dan secara tidak langsung akan mempengaruhi proses metabolisme benih ikan patin. Parameter kualitas air selama perlakuan ini adalah pH, suhu, oksigen terlarut, amonia, alkalinitas, dan kesadahan Ca2+. Pengukuran dilakukan pada awal perlakuan kemudian setiap seminggu sekali selama masa pemeliharaan. Data hasil pengukuran yang dilakukan selama perlakuan dapat dilihat pada Tabel 3.
10 20 30 40 50 60 70 80 90 100 1 30 Waktu (hari) N ila i O sm o la r ita s (O sm o l/g r ) Kontrol A (10 mg/l) B (20 mg/l) C (30 mg/l) D (40 mg/)
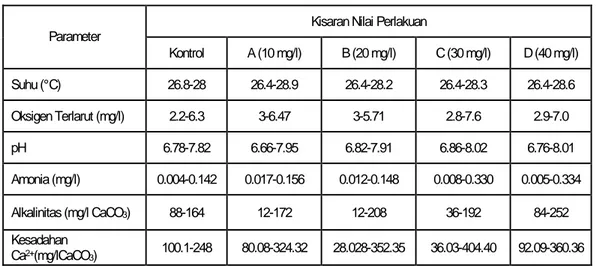
Tabel 3. Kisaran parameter kualitas air benih ikan patin pada setiap perlakuan
Kisaran Nilai Perlakuan Parameter Kontrol A (10 mg/l) B (20 mg/l) C (30 mg/l) D (40 mg/l) Suhu (°C) 26.8-28 26.4-28.9 26.4-28.2 26.4-28.3 26.4-28.6 Oksigen Terlarut (mg/l) 2.2-6.3 3-6.47 3-5.71 2.8-7.6 2.9-7.0 pH 6.78-7.82 6.66-7.95 6.82-7.91 6.86-8.02 6.76-8.01 Amonia (mg/l) 0.004-0.142 0.017-0.156 0.012-0.148 0.008-0.330 0.005-0.334 Alkalinitas (mg/l CaCO3) 88-164 12-172 12-208 36-192 84-252 Kesadahan Ca2+(mg/lCaCO3) 100.1-248 80.08-324.32 28.028-352.35 36.03-404.40 92.09-360.36
Pada Tabel 3 terlihat, parameter kualitas air selama pemeliharaan yang meliputi suhu (°C), oksigen terlarut (mg/l), pH, amonia (mg/l), alkalinitas (mg/l CaCO3), dan kesadahan Ca2+(mg/l CaCO3) masih berada dalam kisaran optimal bagi pertumbuhan benih ikan patin. Kualitas fisika dan kimia air ini akan mempengaruhi kelangsungan hidup dan pertumbuhan.
4.2 Pembahasan
Benih ikan patin yang dipelihara selama 30 hari pemeliharaan dengan penambahan kapur Ca(OH)2 yang berbeda konsentrasinya ternyata menghasilkan kelangsungan hidup, laju pertumbuhan harian, pertumbuhan bobot, dan panjang mutlak yang tidak signifikan pada selang kepercayaan 95 % (P>0.05). Namun demikian, masing-masing parameter memiliki kecenderungan meningkat dari perlakuan A (10 mg/l Ca(OH)2) ke D (40 mg/l Ca(OH)2).
Kelangsungan hidup selama penelitian berkisar antara 70,10 % - 85,45 % (Gambar 3). Kematian yang terjadi selama pemeliharaan disebabkan karena pada awal pemeliharaan ikan masih beradaptasi dengan lingkungannya, yaitu dengan keadaan salinitas 5 ppt dengan penambahan kapur Ca(OH)2 dengan dosis yang berbeda-beda. Dalam hal ini dengan penambahan dosis kapur Ca(OH)2 akan meningkatkan tekanan osmotik media serta sebagai osmoregulator. Salinitas media yang diekspresikan dalam bentuk tekanan osmotik media merupakan faktor lingkungan yang sangat berpengaruh dalam kehidupan organisme akuatik (termasuk di dalamnya ikan) sebagaimana yang diungkapkan oleh Kinne dalam
Holiday (1969) bahwa salinitas berpengaruh terhadap pemanfaatan pakan dan pertumbuhan ikan.
Pengaruh tekanan osmotik terhadap pertumbuhan ikan dapat terjadi melalui osmoregulasi. Dalam hal ini akan terjadi pemanfaatan energi untuk keperluan osmoregulasi yang sendirinya akan berpengaruh terhadap pemanfaatan energi untuk pertumbuhan. Penggunaan energi untuk keperluan osmoregulasi tersebut berkaitan erat dengan tingkat kerja osmotik yang dilakukan ikan dalam upayanya untuk melakukan respon terhadap adanya perubahan tekanan osmotik medianya. Tingkat kerja osmotik yang semakin rendah akan mengakibatkan semakin rendahnya energi yang digunakan untuk osmoregulasi sehingga proses pertumbuhan akan semakin besar, hal ini terjadi pada kondisi media yang mendekati isoosmotik (Ballarin dan Haller, 1982 dalam Devily, 2008).
Pada kondisi hipoosmotik dan hiperosmotik, tingkat kerja osmotik yang semakin besar akan menyebabkan besarnya energi yang digunakan untuk osmoregulasi sehingga porsi energi untuk pertumbuhan akan semakin kecil (Holliday, 1969). Pendapat yang sama juga disampaikan oleh Frank dan Leffler (1975) dalam Wulandari (2006), bahwa semakin tinggi gradien osmotik dapat mengakibatkan pembelanjaan energi untuk osmoregulasi yang semakin tinggi.
Laju pertumbuhan harian selama pemeliharaan berkisar 5,84 % - 6,13 %. Laju tersebut mengalami peningkatan mulai dari Kontrol sebesar 5,84 % dilanjutkan perlakuan A (10 mg/l Ca(OH)2) sebesar 5,99 % kemudian perlakuan B (20 mg/l Ca(OH)2) sebesar 6,13 % selanjutnya turun pada perlakuan C (30 mg/l Ca(OH)2) sebesar 5,86 % kemudian meningkat kembali pada perlakuan D (40 mg/l Ca(OH)2) sebesar 5,99 %. Yang ditunjukkan pada Gambar 3 yang memberikan pola kuadratik terhadap laju pertumbuhan harian. Dengan laju pertumbuhan harian tertinggi pada perlakuan B (20 mg/l Ca(OH)2), hal ini disebabkan pada perlakuan tersebut mendekati kondisi media yang isoosmotik, sehingga energi yang dihasilkan lebih banyak digunakan untuk pertumbuhan dibandingkan dengan osmoregulasi. Hal ini sesuai dengan pernyataan Jobling (2002) bahwa pembelanjaan energi untuk osmoregulasi dapat ditekan apabila ikan dipelihara pada media isotonik, sehingga pemanfaatan pakan menjadi efisien serta pertumbuhan ikan dapat tinggi.
Hasil pengolahan data bobot menunjukkan bahwa perlakuan B (20 mg/l Ca(OH)2) memiliki bobot tertinggi yaitu 1,89 gram/ekor selama pemeliharaan yaitu 30 hari. Sedangkan untuk perlakuan lainnya yaitu 1,82 gram, 1,82 gram, 1,75 gram, dan 1,74 gram berurutan dari perlakuan A (10 mg/l Ca(OH)2), D (40 mg/l Ca(OH)2), C (30 mg/l Ca(OH)2), dan Kontrol. Hal ini menunjukkan bahwa laju pertumbuhan harian berbanding lurus dengan bobot. Sesuai dengan pendapat Effendi (1979) yang menyatakan bahwa pertumbuhan dapat didefinisikan sebagai perubahan ukuran panjang, berat dan volume dalam jangka waktu tertentu.
Sama seperti bobot, panjang benih ikan patin juga mengalami kecenderungan meningkat yaitu masing-masing berkisar antara 4,84-4,52 cm. Panjang benih ikan patin tertinggi yaitu perlakuan B (20 mg/l Ca(OH)2) sebesar 4,84 cm. Berturut-turut selanjutnya adalah 4,83 cm, 4,69 cm, 4,58 cm, dan 4,52 cm pada perlakuan A (10 mg/l Ca(OH)2), D (40 mg/l Ca(OH)2), C (30 mg/l Ca(OH)2), dan Kontrol. Dari hasil pengamatan, diketahui bahwa terjadi peningkatan pertumbuhan panjang ikan dari awal pemeliharaan sampai hari ke-30. Hal ini juga menunjukkan bahwa laju pertumbuhan harian berbanding lurus dengan pertumbuhan panjang. Pertumbuhan merupakan proses bertambahnya ukuran volume dan berat suatu organisme, yang dapat dilihat dari perubahan ukuran panjang dan berat dalam satuan waktu (Weatherley, 1997 dalam Effendi, 1979). Dari hasil pertumbuhan panjang dan bobot keduanya menunjukkan perlakuan B (20 mg/l Ca(OH)2) yang paling tinggi hal ini menunjukkan pada perlakuan tersebut mendekati kondisi isoosmotik, sehingga energi yang didapat dari pakannya lebih banyak digunakan untuk pertumbuhan dibandingkan energi untuk osmoregulasi. Hal ini sesuai dengan pendapat Holliday (1985) dalam Holliday (1969) yang menyatakan pemeliharaan ikan pada kondisi isoosmotik merupakan efek yang menguntungkan karena adanya penyimpanan energi yang disebabkan menurunnya energi untuk proses osmosis dan efek ionik, sehingga pertumbuhan meningkat.
Kisaran nilai osmolaritas selama masa pemeliharaan yaitu 73-90 Osmol/gr. Dimana nilai osmolaritas tertinggi pada perlakuan D (40 mg/l Ca(OH)2), hal ini disebabkan karena pada perlakuan tersebut penambahan kapur Ca(OH)2 paling besar. Kalsium termasuk unsur yang paling penting dalam pengaturan
permeabilitas dinding sel. Sedangkan pada akhir pemeliharaan nilai osmolaritasnya menurun, hal ini disebabkan karena ikan air tawar berada pada kondisi yang hipoosmotik, pada kondisi seperti ini ion-ion cenderung keluar tubuh secara difusi dan cairan internal akan kekurangan ion karena ekskresi, dan air dari media atau lingkungan hidup akan mempunyai kecenderungan untuk menembus masuk ke dalam bagian tubuh ikan yang mempunyai dinding tipis seperti permukaan insang, rongga mulut, dan kulit.
Secara umum kualitas air yang diperoleh (Tabel 3) selama masa pemeliharaan masih berada di dalam kisaran optimal benih ikan patin untuk tumbuh. Kualitas fisika dan kimia air ini akan mempengaruhi kelangsungan hidup dan pertumbuhan.
Suhu selama masa pemeliharaan berkisar antara 26,4°C-28,9°C pada semua perlakuan dan Kontrol. Hal ini sangat mendukung kehidupan benih ikan patin. Sesuai dengan Potaros dan Sitasit (1976) dalam Hardjamulia dkk (1986) yang menyatakan suhu tersebut berada dalam kisaran optimal suhu benih ikan patin yaitu 24°C-32°C.
Kesuburan perairan ditentukan oleh pH, dimana perairan yang alkalis atau netral lebih produktif jika dibandingkan dengan perairan asam (Hickling, 1971 dalam Devily, 2008). Nilai pH selama masa pemeliharaan berkisar antara 6,66-8,02. Kisaran nilai pH-nya masih berada dalam kisaran layak untuk kehidupan benih ikan patin. Sesuai dengan Arifin dan Tupang (1983) dalam Zaelani (2006) yang menyatakan pH yang cocok untuk ikan patin adalah 6,5-8,0. Sedangkan nilai alkalinitas selama pemeliharaan meningkat sebanding dengan nilai pH yang meningkat. Kisaran nilai alkalinitas selama pemeliharaan yaitu 12-252 mg/l CaCO3. Menurut Effendi (2003), nilai alkalinitas yang baik berkisar antara 30-500 mg/l CaCO3. Alkalinitas berperan sebagai sistem penyangga (buffer) agar perubahan pH tidak terlalu besar.
Kandungan oksigen terlarut selama masa pemeliharaan berkisar antara 2,2-7,6. Hal ini menunjukkan nilai oksigen terlarut pada media berada pada kisaran yang layak untuk kehidupan ikan. Sesuai dengan NTAC (1968) dalam Dongoran (2006), menyatakan bahwa oksigen terlarut nilainya tidak boleh kurang dari 4 mg/l. Kandungan oksigen terlarut cenderung mengalami penurunan. Hal ini
menunjukkan bahwa benih ikan patin masih dapat mentolerir kandungan oksigen terlarut sampai di bawah 4 mg/l. Kandungan oksigen yang semakin menurun diakibatkan oleh semakin besarnya benih yang dipelihara sehingga kebutuhan oksigennya semakin tinggi dan semakin tingginya bahan organik yang ada sebagai hasil masukan pakan secara terus menerus sehingga terjadi proses dekomposisi bahan organik. Kandungan oksigen yang rendah juga dapat menyebabkan kematian pada ikan karena pada kandungan oksigen rendah maka daya toksik amonia semakin tinggi.
Kandungan amonia yang terjadi berkisar antara 0,004-0,334 mg/l. Senyawa ini berasal dari perombakan bahan organik yang berasal dari sisa pakan dan sisa metabolisme ikan. Menurut Forteath et al. (1993) dalam Dongoran (2006), konsentrasi amonia di perairan yang dapat ditoleransi oleh ikan berada dibawah 0,5 mg/l. Kandungan amonia yang tinggi dapat menyebabkan kematian pada ikan. Pada penelitian ini kandungan amonia masih berada dibawah ambang batas sehingga tidak mengganggu kehidupan ikan. Kandungan amonia tertinggi terdapat pada perlakuan D (40 mg/l Ca(OH)2) pada akhir penelitian. Hal ini disebabkan oleh banyaknya buangan metabolisme ikan di dalam media pemeliharaan yang sudah semakin besar sehingga sisa metabolisme semakin banyak sebagai akibat dari asupan pakan yang lebih banyak sekresi ikan, sedangkan kualitas airnya semakin menurun walaupun dilakukan pergantian air setiap 2 hari sekali.
Berdasarkan Tabel 2, diketahui bahwa nilai kesadahan pada media pemeliharaan berada pada dua kisaran, yaitu kesadahan menengah dan sangat sadah. Perairan sangat sadah kandungan kalsium, magnesium, karbonat, dan sulfat biasanya sangat tinggi (Brown, 1987 dalam Effendi, 2003). Keadaan yang terus-menerus mengakibatkan terjadinya ketidaknyamanan sehingga mempengaruhi laju pertumbuhan dan tingkat kelangsungan hidup.
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian dapat disimpulkan, bahwa perlakuan dengan penambahan 20 mg/l Ca(OH)2 pada media pemeliharaan menghasilkan media pemeliharaan yang paling baik. Perlakuan tersebut menghasilkan pertumbuhan yang baik yaitu memiliki bobot 1,58±0,19 gram dan kelangsungan hidup sebesar 70,10 %.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut dengan penambahan kapur Ca(OH)2 dengan dosis yang berbeda dan lebih besar, serta penambahan waktu pemeliharaan.
DAFTAR PUSTAKA
Anonimous. 1989. Iktiologi. Laboratorium Iktiologi. Jurusan Manajemen Sumberdaya Perairan, Fakultas Perikanan, IPB, Bogor.
_________. 1996. Perikanan Indonesia I, Bidang Budidaya Perairan. JICA, Jakarta. hlm. 272-273.
Arifin Z. 1991. Hasil Penelitian Komoditas Patin. Balai Penelitian dan Pengembangan Pertanian, Balitkanwar Bogor. Tidak Dipublikasikan.
Bennet GW. 1969. Management of Lakes and Pond. Second Edition. New York. Boyd CE, Lichkoppler F. 1979. Water Quality Management in Pond Culture.
Auburn University, Albama.
Boyd CE. 1982. Water Quality Management for Fish Culture. Elsevier Scientific Publishing Co., Amsterdam.
Bower CE, Bidwell JP. 1978. Ionization of amonia in seawater effect of temperature, pH and salinity. J. Fish. Res. Bd. Can. (35): 1012-1016.
Brett JR. 1979. Enviromental Factors and Growth, Fish Physiology Vol. VIII. Academic Press, New York. hlm. 559-679.
Cholik F, Daulay, 1985. Artemia salina (Kegunaan, Biologi dan Kulturnya). INFISH Manual Seri No.12.
Cole GA. 1988. Textbook of Limnology. Third edition. Waveland Press, Inc., Illinois, USA.
Devily DS. 2008. Pengaruh Medan Listrik pada Pemeliharaan terhadap Kelangsungan Hidup dan Pertumbuhan Ikan Gurame Osphronemous
gouramy Lac. Skripsi. Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor, Bogor.
Dongoran RK. 2006. Pengaruh Alkalinitas Total dari Kalsium Karbonat (CaCO3) terhadap Kelangsungan Hidup dan Pertumbuhan Benih Ikan Patin,
Pangasius sp. Skripsi. Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor, Bogor.
Effendi I. 1979. Metode Biologi Perikanan. Yayasan Dewi Sri, Bogor.
Effendi I. 1978. Biologi Perikanan, Bag. I. Study Natural History. Fakultas Perikanan IPB, Bogor.
Effendi H. 2003. Telaah Kualitas Air: Bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Kanisius, Yogyakarta.
Gilles R, Pequeux A. 1983. Interactions of Chemical and Osmotic Regulation with Environment. Di dalam: Vernberg FJ, Venberg WB, editor. The Biology of Crustacea Vol. 8, Environmental Adaptation. Academic Press, NewYork. hlm. 109-177.
Hardjamulia A, Prihadi TH, Subagyo. 1986. Pengaruh salinitas terhadap pertumbuhan dan daya kelangsungan hidup benih ikan jambal siam (Pangasius sutchi F.). Bul. Penelitian Perikanan Darat, 5(1): 111-117.
Holliday FGT. 1969. The Effect of Salinity on The Eggs and Larvae of Teleostei. Di dalam: Hoar WS and Randall DJ, editor. Fish Physiology, vol. I. Academic Press, New York. hlm. 293-309.
Huet M. 1971. Text Book of Fish Culture, Breeding and Cultivation of Fish. Fishing News (Book) Ltd., London.
Jobling M, Gomes E, Diaz J. 2002. Feed types manufacturer and ingredient. Di dalam: Houlihan D, Boujard T, Jobling M (editor). Food Intake in Fish. Blackwell Science Ltd. Osney Mead. Oxford. hlm. 31-39
Kinne O. 1964. The Effect of Temperature and Salinity on Marine and Brackishwater Animal. II. Salinity. Oceanography Marine Biology Annual Review, 2: 281-339.
Lagler KF. 1972. Freshwater Fisheries Biology. Win. C. Brawn Company Publ. Dubuque, Iowa.
Lesmono DP. 2006. Pengaruh Teknik Adaptasi Salinitas terhadap Kelangsungan Hidup dan Pertumbuhan Benih Ikan Patin, Pangasius sp. Skripsi. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor.
Novotny V, Olem H. 1994. Water Quality: Prevention, Identification, and Management of Diffuse Pollution. Van Nostrand Reinhold, New York. Pescod MP, Okun DA. 1973. Water Supply and Wastewater Disposal in
Developing Countries. Asian Institute of Tecnology, Bangkok.
Persons TR, Maita Y, Lalli CM. 1984. A Manual of Chemical and Biologycal Methods for Seawater Analysis. Pergamon Press, London.
Quines OD. 1988. Fish Parasitism: Its Effect in Aquaculture and Measures for its Prevention and Control. Central Luzon State University Munoz, Phillipines. Rahardjo MF. 1980. Ichtyology. System Urogenital. Fakultas Perikanan, IPB,
Bogor.
Royce WF. 1973. Introduction to the Fisheries Science. Academic Press, New York.
Sumantadinata K. 1983. Pengembangbiakan Ikan-ikan Peliharaan di Indonesia. Cetakan II. Sastra Budaya, Bogor.
Suresh AV, Lin CR. 1992. Tilapia Culture in Saline Waters. Aquaculture (106). Suseno D, Suyono, Dharma L. 1992. Pengaruh Penambahan Udara dalam
Penyimpanan Sperma terhadap Derajat Pembuahan Telur Ikan Jambal Siam (Pangasius hypophtalmus). Bul. Pen. Perik. Darat, 2(2): 31-37.
Stickney R. 1979. Principles of Warmwater Aquaculture. Department of Wildlife and Fisheries Sciences, A and M University, Texas.
Wedemeyer GA. 1996. Fish Hatchery Management. Western Fisheries Research Center, New York.
Wulandari AR. 2006. Peranan Salinitas terhadap Kelangsungan Hidup dan Pertumbuhan Benih Ikan Bawal Air Tawar Colossoma macropomum. Skripsi. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor.
Zaelani DA. 2006. Pengaruh Penambahan CaCO3 dengan dosis 50-200 mg/l pada Media Pemeliharaan terhadap Pertumbuhan Cherax quadricarinatus. Skripsi. Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor.
Lampiran 1. Data analisis ragam (ANOVA) tingkat kelangsungan hidup (%) benih ikan patin (Pangasius sp.)
Perlakuan Ulangan Kontrol A B C D 1 85,45 78,79 72,12 79,39 86,67 2 77,58 67,27 56,97 78,18 70,91 3 93,33 85,45 81,21 75,15 88,48 Total 256,36 231,51 210,3 232,72 246,06 Rata-rata 85,45 77,17 70,1 77,57 82,02 ANOVA Sumber
Keragaman JK db KT F P-value F crit
Perlakuan 401,76 4 100,44 1,27 0,34 3,48
Galat 789,46 10 78,95
Lampiran 2. Data analisis ragam (ANOVA) laju pertumbuhan harian (%) benih ikan patin (Pangasius sp.)
Perlakuan Ulangan Kontrol A B C D 1 5.89 5.77 6.00 5.93 5.94 2 6.02 6.34 6.52 5.76 6.21 3 5.60 5.86 5.86 5.90 5.83 Total 17.51 17.97 18.38 17.59 17.98 Rata-rata 5.84 5.99 6.13 5.86 5.99 ANOVA Sumber
Keragaman JK db KT F P-value F crit
Perlakuan 0,16 4 0,04 0,66 0,63 3,48
Galat 0,62 10 0,06
Lampiran 3. Data panjang (cm) benih ikan patin (Pangasius sp.) selama masa pemeliharaan Hari ke- Ulangan 0 10 20 30 Kontrol 2,74 3,51 3,98 4,52 A 2,74 3,44 4,12 4,83 B 2,74 3,49 4,12 4,84 C 2,74 3,56 4,12 4,58 D 2,74 3,57 4,05 4,69
Lampiran 4. Data bobot (gram) benih ikan patin (Pangasius sp.) selama masa pemeliharaan Hari ke- Ulangan 0 10 20 30 Kontrol 0,31 0,72 1,11 1,74 A 0,31 0,79 1,18 1,82 B 0,31 0,72 1,20 1,89 C 0,31 0,76 1,15 1,75 D 0,31 0,76 1,10 1,82
Lampiran 5. Data analisis ragam (ANOVA) pertumbuhan panjang mutlak (cm) benih ikan patin (Pangasius sp.)
Perlakuan Ulangan Kontrol A B C D 1 1,74 2,09 1,94 1,85 2,16 2 1,92 2,38 2,52 1,80 1,92 3 1,69 1,80 1,85 1,87 1,77 Total 5,35 6,27 6,31 5,52 5,84 Rata-rata 1,78 2,09 2,10 1,84 1,95 ANOVA Sumber
Keragaman JK db KT F P-value F crit
Perlakuan 0,25 4 0,06 1,14 0,40 3,48
Galat 0,55 10 0,05
Total 0,80 14
Lampiran 6. Data osmolaritas awal dan akhir masa pemeliharaan
Hari ke- Perlakuan 1 30 Kontrol 73 81 A 84 81 B 87 79 C 87.7 80 D 90 79
Lampiran 7. Data hasil pengukuran pH air media pada Kontrol dan semua perlakuan Minggu ke- Perlakuan Ulangan 1 2 3 4 1 7.50 7.58 7.49 7.06 2 7.34 7.60 7.82 6.78 Kontrol (0 mg/l Ca(OH)2) 3 7.56 7.47 7.69 6.98 1 7.52 7.93 7.71 6.97 2 7.55 7.70 7.95 6.84 A (10 mg/l Ca(OH)2) 3 7.73 7.54 7.85 6.66 1 7.54 7.83 7.78 6.98 2 7.57 7.78 7.91 6.83 B (20 mg/l Ca(OH)2) 3 7.57 7.71 7.91 6.82 1 7.08 7.43 7.99 7.14 2 7.50 7.62 7.76 6.94 C (30 mg/l Ca(OH)2) 3 7.82 7.62 8.02 6.86 1 7.48 7.66 7.82 7.10 2 7.65 7.90 8.01 7.14 D (40 mg/l Ca(OH)2) 3 7.81 7.28 7.90 6.76
Lampiran 8. Data hasil pengukuran DO air media pada Kontrol dan semua perlakuan Minggu ke- Perlakuan Ulangan 1 2 3 4 1 5.46 4.75 4.50 2.60 2 4.81 5.63 4.40 6.30 Kontrol (0 mg/l Ca(OH)2) 3 5.48 5.49 4.40 2.20 1 5.91 5.11 4.20 4.90 2 5.34 6.38 6.50 2.90 A (10 mg/l Ca(OH)2) 3 5.26 6.47 3.00 4.70 1 5.06 4.88 3.30 3.50 2 5.46 5.79 3.00 4.30 B (20 mg/l Ca(OH)2) 3 5.71 5.26 3.20 3.90 1 4.37 6.39 4.90 4.70 2 4.63 4.53 7.60 2.80 C (30 mg/l Ca(OH)2) 3 6.30 5.52 3.30 2.90 1 4.23 4.67 4.90 4.00 2 7.00 5.49 4.00 4.80 D (40 mg/l Ca(OH)2) 3 5.29 5.15 3.40 2.90
Lampiran 9. Data hasil pengukuran amonia air media pada Kontrol dan semua perlakuan Minggu ke- Perlakuan Ulangan 1 2 3 4 1 0.020 0.051 0.093 0.004 2 0.017 0.089 0.142 0.659* Kontrol (0 mg/l Ca(OH)2) 3 0.025 0.048 0.225 0.497* 1 0.053 0.080 0.090 0.431* 2 0.017 0.098 0.113 0.426* A (10 mg/l Ca(OH)2) 3 0.029 0.084 0.156 0.639* 1 0.012 0.051 0.148 0.513* 2 0.053 0.059 0.146 0.487* B (20 mg/l Ca(OH)2) 3 0.066 0.045 0.130 0.975* 1 0.008 0.045 0.161 0.008 2 0.064 0.043 0.279 0.548* C (30 mg/l Ca(OH)2) 3 0.066 0.044 0.330 0.426* 1 0.042 0.056 0.229 0.005 2 0.064 0.075 0.222 0.006 D (40 mg/l Ca(OH)2) 3 0.047 0.042 0.334 0.472*
Tanda (*) mengartikan bahwa ammonia dalam air berada dalam bentuk TAN (non toksik) bukan NH3 karena pH di bawah 7.
Lampiran 10. Data hasil pengukuran alkalinitas air media pada Kontrol dan semua perlakuan Minggu ke- Perlakuan Ulangan 1 2 3 4 1 136 128 116 132 2 136 88 100 124 Kontrol (0 mg/l Ca(OH)2) 3 164 116 110 160 1 164 172 112 128 2 172 152 108 104 A (10 mg/l Ca(OH)2) 3 12 100 112 148 1 12 208 130 192 2 176 152 126 164 B (20 mg/l Ca(OH)2) 3 132 152 124 160 1 52 88 156 184 2 184 188 160 192 C (30 mg/l Ca(OH)2) 3 36 180 144 180 1 136 120 152 252 2 84 148 140 220 D (40 mg/l Ca(OH)2) 3 168 112 164 220
Lampiran 11. Data hasil pengukuran kesadahan Ca2+ air media pada Kontrol dan semua perlakuan
Minggu ke- Perlakuan Ulangan 1 2 3 4 1 172.17 172.17 240.24 216.22 2 200.20 164.00 196.19 184.18 Kontrol (0 mg/l Ca(OH)2) 3 100.10 248.00 184.18 220.22 1 80.08 324.32 192.19 296.29 2 200.20 180.18 288.29 268.27 A (10 mg/l Ca(OH)2) 3 104.10 256.26 192.19 256.27 1 28.03 328.33 180.18 296.29 2 136.14 232.23 156.16 316.32 B (20 mg/l Ca(OH)2) 3 148.15 352.35 220.22 304.30 1 216.22 388.39 176.18 260.26 2 40.04 288.29 148.15 404.40 C (30 mg/l Ca(OH)2) 3 36.04 240.24 216.22 404.40 1 180.18 240.24 144.14 264.26 2 92.09 196.19 208.21 360.36 D (40 mg/l Ca(OH)2) 3 96.09 220.22 196.19 328.33
Lampiran 12. Pengenceran air laut Rumus pengenceran : 2 2 1 1xV M xV M = Keterangan :
M1 = salinitas air yang diinginkan
V1 = volume air pada salinitas yang diinginkan M2 = salinitas air laut
V2 = volume air laut yang ditambahkan
Perhitungan : M1 = 5 gr/l V2 = 33 liter M2 = 30 gr/l 2 2 1 1xV M xV M = 2 / 30 33 / 5gr l x l= gr l xV V2= 5,5 l air laut Air tawar = 33 l -5,5 l = 27, 5 l air tawar