EFEKTIVITASNYA DALAM MENGHAMBAT PERTUMBUHAN JAMUR AKAR PUTIH
(Rigidoporus microporus)
SKRIPSI
KARTINATRA PURBA 130822003
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
EFEKTIFITASNYA DALAM MENGHAMBAT PERTUMBUHAN JAMUR AKAR PUTIH
(Rigidoporus microporus)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
KARTINATRA PURBA 130822003
PROGRAM STUDI S1 KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2018
ANALISIS KOMPONEN MINYAK ATSIRI TUMBUHAN EPAZOTE (Dysphania ambrosioides L.) DAN UJI EFEKTIFITASNYA DALAM
MENGHAMBAT PERTUMBUHAN JAMUR AKAR PUTIH (Rigidoporus microporus)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing - masing disebutkan sumbernya.
Medan, Februari 2018
KARTINATRA PURBA
130822003
PENGESAHAN SKRIPSI
Judul : Analisis Komponen Minyak Atsiri Tumbuhan Epazote (Dysphania ambrosioides L.) dan Uji Efektifitasnya dalam Menghambat Pertumbuhan Jamur Akar Putih (Rigidoporus microporus)
Kategori : Skripsi
Nama : Kartinatra Purba
Nomor Induk Mahasiswa : 130822003
Program Studi : Sarjana(S1) Kimia
Fakultas : MIPA - Universitas Sumatera Utara
Disetujui di Medan, Februari 2018
Komisi Pembimbing Pembimbing 2
Dr. Mimpin Ginting, M.S NIP. 195510131986011001
Pembimbing 1
Dr. Cut Fatimah Zuhra, M.Si NIP. 19740405 199903 2 001
Ketua Program Studi
Dr. Cut Fatimah Zuhra, M.Si NIP. 197404051999032001
ANALISIS KOMPONEN MINYAK ATSIRI TUMBUHAN EPAZOTE (Dysphania ambrosioides L.) DAN UJI EFEKTIFITASNYA DALAM
MENGHAMBAT PERTUMBUHAN JAMUR AKAR PUTIH (Rigidoporus microporus)
ABSTRAK
Minyak atsiri tumbuhan epazote (Dysphania ambrosioides L.) diisolasi dengan metode hidrodestilasi menggunakan alat Stahl. Daun epazote yang didestilasi menghasilkan minyak atsiri sebanyak 0,25 %(b/b). Komponen minyak atsiri yang dianalisa menggunakan GC-MS terdiri dari 31 senyawa dimana diantaranya sebanyak 5 senyawa yang dapat diidentifikasi, yaitu : 1,3 difenilpropana 40,94%);
1,3 difenil1-butena (13,05%); 2-metil-1,1-difenil-1-propena (7,15%); α- terpinen (5,92%) dan 9,10-dihidro-9,10 dimetil-antracene (4,9 %). Hasil pengujian minyak atsiri epazote efektif untuk menghambat pertumbuhan jamur akar putih (Rigidoporus microporus) sebanyak 60,24 % pada konsentrasi 1000 ppm.
Kata Kunci : epazote, hidrodestilasi, jamur Rigidoporus microporus, Minyak Atsiri
ambrosioides L.) AND ITS EFFECTIVENESS TEST IN INHIBITING FUNGAL GROWTH OF Rigidoporus microporus
ABSTRACT
Essential oils of epazote (Dysphania ambrosioides L.) had been isolated with hydrodestilation methods using Stahl apparatus. Epazote’s leaves that had destilated produce 0,38 % (b/b) of essential oils. The chemical component of essential oils was determined with GC-MS shown 31 compounds, major compounds were : 1,3 diphenilpropana (40,94%); 1,3 diphenyl1-butene (13,05%); 2-methyl-1,1- diphenyl-1-propene (7,15%); α- terpinene (5,92%); 9,10-dyhidro-9,10 dimethil- antracene (4,94%). The essential oils of epazote (Dysphania ambrosioides L.) shown its effectivity in inhibited the growth of Rigidoporus microporus up to 60,24 % in added 1000 ppm of essential oil .
Keywords : epazote, Essential oils, hydrodestilation, Rigidoporus microporus
Segala puji dan syukur penulis sampaikan kepadaa Allah SWT dengan limpah karunianya penilis dapat menyelesaikan skripsi ini sebagai salah satu syarat menyelesaikan pendidikan Sarjana Sains di Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam USU.Judul dari skripsi ini adalah ―Analisis Komponen Minyak Atsiri Tumbuhan Epazote (Dysphania ambrosioides L.) Dan Uji Efektifitasnya Dalam Menghambat Pertumbuhan Jamur Akar Putih (Rigidoporus microporus)”.
Terimakasih penulis sampaikan kepada dosen Pembimbing 1 Ibu Dr. Cut Fatimah Zuhra, MS dan dosen Pembimbing 2 Bapak Dr. Mimpin Ginting, M.S yang telah banyak membimbing dan memberi masukan yang sangat bermanfaat sehingga penulis dapat menyelesaikan skripsi ini. Terimakasih kepada Ibu Dr. Cut Fatimah Zuhra, MS dan Ibu Dr. Sovia Lenny, M.Si selaku Ketua dan Sekretaris Program Studi Kimia FMIPA USU, kepada Bapak Dekan dan wakil dekan, kepada seluruh staff pegawai dan dosen di Program Studi Kimia Organik FMIPA USU.
Terimakasih kepada Ayahanda R. Purba dan Ibunda N. Sitanggang dan juga kepada saudara penulis, Bang Jeffri, Kak Krisna, Bang Dani, Jennis atas doa, dukungan dan semangat yang diberikan dalam proses penelitian dan penulisan skripsi ini. Terimakasih kepada rekan – rekan di Laboratorium BBPPTP Medan, seluruh sahabat penulis atas semua dukungannya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, karena masih banyak terdapat kekurangan baik dari segi isi maupun penyusunan kata. Oleh karena itu penulis mengharapkan saran yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi semua.
Medan, Februari 2018
DAFTAR ISI
PERNYATAAN i
PENGESAHAN SKRIPSI ii
ABSTRAK iii
ABSTRACT iv
PENGHARGAAN v
DAFTAR ISI vi
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
DAFTAR SINGKATAN xii
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan
1.3 Hipotesis 3
1.4 Pembatasan Masalah 3
1.5 Tujuan Penelitian 3
1.6 Manfaat Penelitian 3
1.7 Metodologi Percobaan 4
BAB 2 TINJAUAN PUSTAKA
2.1 Epazote 5
2.1.1. Manfaat Epazote (Dysphania ambrosioides) 6
2.2 Jamur Akar Putih 6
2.2.1. Gejala Serangan Jamur Akar Putih 8
2.2.2. Pengendalian Jamur Akar Putih 8
2.3 Minyak Atsiri 9
2.3.1. Isolasi Minyak Atsiri dengan Destilasi 9
2.3.2. Komponen Kimia Minyak Atsri 10
2.3.3. Biosintesa Pembentukan Minyak Atsiri 10 2.4 Analisa Komponen Minyak Atsiri dengan GC-MS 13
2.4.1. Analisa Kromatografi Gas 14
2.4.2. Analisa Spektrometri Massa 16
2.5 Pestisida 17
2.5.1. Fungisida 18
BAB 3 METODE PENELITIAN
3.2.2. Bahan 21
3.3 Prosedur Penelitian 21
3.3.1. Penyediaan Sampel 21
3.3.2. Isolasi Minyak Atsiri epazote dengan alat Destilasi 21 3.3.3. Analisa Minyak Atsiri epazote dengan GC-MS 22 3.3.4. Uji Daya Hambat Minyak Atsiri epazote
terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus microporus)
3.3.4.1. Pembuatan Media (PDA+ Minyak Atsiri) 23 3.3.4.2. Inokulasi Jamur Akar Putih 24
(Rigidoporus microporus) ke Media
3.3.5. Parameter Pengamatan 24
3.3.5.1 Diameter Pertumbuhan Jamur 24 Akar Putih Rigidoporus microporus
3.3.5.2 Persentase Zona Hambatan Miselium 24 Jamur Akar Putih
3.3.5.3 Pengamatan Miselium Jamur Akar Putih 24 Rigidoporus microporus
3.4 Bagan Penelitian 25
3.4.1. Isolasi Minyak Atsiri Tumbuhan epazote
dengan alat Stahl 25
3.4.2 Analisa Minyak Atsiri dengan GC-MS 25 3.4.3 Uji Daya Hambat Minyak Atsiri Dysphania
ambrosioides terhadap Pertumbuhan Jamur
Akar Putih Rigidoporus microporus 26
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian 27
4.1.1. Penentuan Kadar Minyak Atsiri 27
4.1.2. Hasil Analisis GC-MS 27
4.1.3. Diameter Pertumbuhan Rigidoporus microporus 30 4.1.4. Zona Hambatan Diameter Pertumbuhan Rigidoporus 31
microporus
4.1.5. Pengamatan Kerusakan miselium 32 Rigidoporus microporus
4.2 Pembahasan 33
4.2.1. Minyak Atsiri dari Hasil Destilasi dengan Alat Stahl 33 4.2.2. Analisis Minyak Atsiri Dysphania ambrosioides 33 4.2.3. Uji efektifitas Minyak Atsiri epazote 40 (Dysphania ambrosioides) dalam Menghambat Pertumbuhan jamur Rigidoporus microporus
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 42
5.2 Saran 42
DAFTAR TABEL
Nomor Tabel
Judul Halaman
4.1 Hasil Hidrodestilasi Minyak Atsiri Daun Dysphania ambrosioides
27 4.2. Senyawa Hasil Analisis GC-MS Minyak Atsiri Dysphania
ambrosioides
29 4.3.
4.4.
4.5.
Hasil Analisa GC-MS Minyak Atsiri Dysphania
ambrosioides yang dapat Diinterpretasi sebanyak 10 buah senyawa berdasarkan Standart Library Willey dan NIST (>4%)
Rataan Diameter Pertumbuhan jamur Rigidoporus microporus pada pengamatan 1 HSI – 8 HSI Rataan Hambatan pertumbuhan jamur Rigidoporus microporus pada pengamatan 1 HSI – 8 HSI
30
30 31
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Foto Tumbuhan epazote 5
2.2 Tubuh Buah Rigidoporus microporus 7
2.3 Biosintesa Terpenoid 11
2.4 Perubahan Senyawa Monoterpen 12
4.1 4.2
Kromatogram Hasil Analisa GC Minyak Atsiri Dysphania ambrosioides
Spektrum Massa 1,3 difenil propana
28 34 4.3 Pola fragmentasi senyawa 1,3 difenil propana 35
4.4 Spektrum Massa 1,3 difenil1butena 36
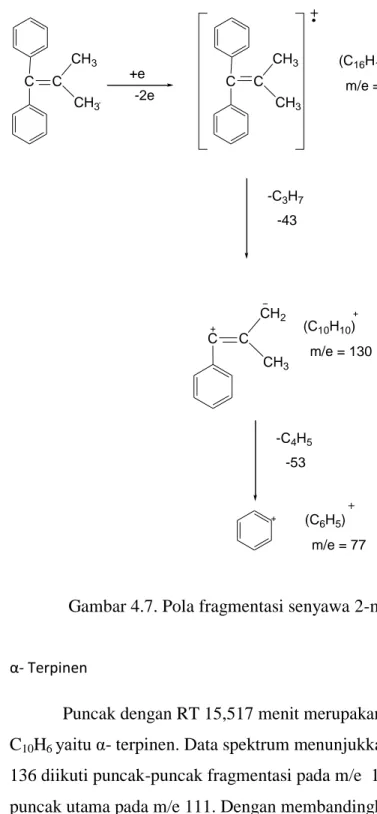
4.5 Pola fragmentasi senyawa 1,3 difenil1butena 36 4.6 Spektrum Massa 2-metil-1,1-difenil-1-propena 37 4.7 Pola fragmentasi senyawa 2-metil-1,1-difenil-1-
propena
38
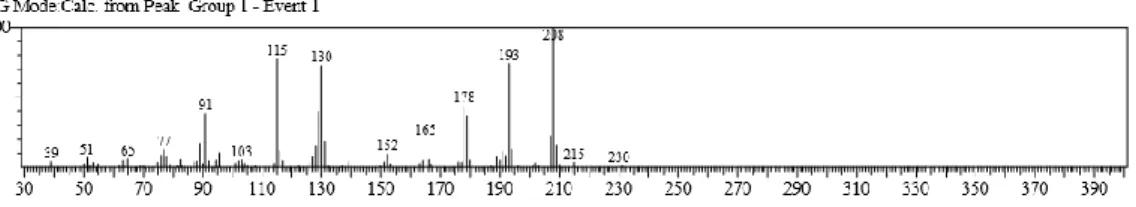
4.8 Spektrum Massa α-terpinen 39
4.9 Pola Fragmentasi Senyawa α-terpinen 39
4.10 Spektrum Massa 9,10-dihidro-9,10 dimetil antracene 40 4.11 Pola Fragmentasi Senyawa 9,10-dihidro-9,10 dimetil
antracene
41
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1. Rataan persentase Zona Hambatan Pertumbuhan Miselium Rigidoporus microporus 1 HSI (%)
47 2. Sidik Ragam Persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 1 HSI
47 3. Rataan persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 2 HSI (%)
48 4. Sidik Ragam Persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 2 HSI
48 5. Rataan persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 3 HSI (%)
49 6. Sidik Ragam Persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 3 HSI
49 7. Rataan persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 4 HSI (%)
50 8. Sidik Ragam Persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 4 HSI
50 9. Rataan persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 5 HSI (%)
51 10. Sidik Ragam Persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 5 HSI
51 11. Rataan persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 6 HSI (%)
52 12. Sidik Ragam Persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 6 HSI
52 13. Rataan persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 7 HSI (%)
53 14. Sidik Ragam Persentase Zona Hambatan Pertumbuhan
Miselium Rigidoporus microporus 7 HSI
53 15. Rataan persentase Zona Hambatan Pertumbuhan 54
17.
18.
19
Hasil Pengamatan Miselium Jamur Rigidoporus
microporus secara Mikroskopik pada setiap Perlakuan Hasil Identifikasi Tumbuhan
Foto – foto Penelitian
54 60 61
DAFTAR SINGKATAN
GC-MS = Gas Chromatography – Mass Spectra HSI = Hari Sesudah Inokulasi
PDA = Potato Dextrose Agar SK = Standar Keragaman DB = Derajat Bebas JK = Jumlah Kuadrat KT = Kuadrat Total
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Penyakit jamur akar putih (JAP) yang disebabkan oleh jamur Rigidoporus microporus merupakan penyakit utama pada tanaman karet yang dapat mengakibatkan kematian pada tanaman. Penyakit ini menimbulkan kerusakan pada akar tanaman. Gejala pada daun terlihat pucat kuning dan tepi atau ujung daun terlipat ke dalam kemudian daun gugur diikuti ujung ranting menjadi mati.
Adakalanya terbentuk daun muda, atau bunga dan buah lebih awal. Pada perakaran tanaman sakit tampak benang-benang jamur berwarna putih dan agak tebal (rizomorf) (Fairuzah dkk,2014).
Pengendalian yang lebih efektif saat ini untuk perkebunan besar dan perkebunan rakyat dilakukan secara kimiawi dengan menggunakan pestisida.
Sinulingga dkk (1991) menyebutkan bahwa penggunaan fungisida kimia untuk mengendalikan jamur akar putih tidak akan efektif. Banyak hasil penelitian menunjukkan bahwa penggunaan pestisida sintetik seperti fungisida yang kurang bijaksana ternyata lebih banyak merugikan manusia dan agroekosistem, misalnya terstimulasinya pembentukan baru ras patogen, musnahnya musuh alami dan agen antagonis, serta keracunan operator fungisida sintetik membuat permasalahan menjadi kompleks.
Oleh karena itu banyak peneliti dan praktisi pertanian yang menyadari bahwa pengendalian penyakit tanaman harus dilakukan dengan cara – cara yang ramah lingkungan. Cara yang ramah lingkungan diantaranya penggunaan pestisida alami.
Penggunaan ekstrak alami sebagai fungisida alami mempunyai beberapa keuntungan, antara lain tanaman telah tersedia di alam, ramah lingkungan, dan mempunyai efek negatif rendah bagi organisme non target. Selain itu penggunaan ekstrak tanaman tidak membutuhkan biaya yang mahal, serta pengaruh negatif terhadap pertumbuhan tanaman (Sinulingga dkk, 1991).
Berbagai penelitian menggunakan pestisida nabati sebagai alternatif pengendalian terhadap serangan jamur akar putih pada tanaman karet sudah banyak dilakukan diantaranya penggunaan ekstrak daun bangun - bangun (Coleus ambonicus) yang mengandung senyawa flavonoid, glikosida dan saponin, senyawa tersebut dapat menghambat pertumbuhan jamur akar putih (Rigidoporus microporus) pada konsentrasi 5% ekstrak n-heksan dengan persentase daya hambat di atas 75%
(Dalimunthe dkk, 2016).
Penggunaan ekstrak rimpang kunyit dalam menghambat pertumbuhan jamur Rigidoporus microporus juga telah dilakukan. Senyawa pada ekstrak rimpang kunyit mempunyai aktifitas antifungi terhadap jamur patogen Rigidoporus microporus . Pemberian ekstrak rimpang kunyit dengan konsentrasi 1,5% mampu menekan pertumbuhan diameter jamur sebesar 90,19 %, serta menyebabkan kerusakan miselium Rigidoporus microporus terberat (penelitian dilakukan dengan variasi konsentrasi 0,4 % - 1,5 % (Darwis,2015).
Minyak atsiri yang diekstraksi dari daun Dysphania ambrosioides Linn diuji terhadap strain uji aflatoksigenik Aspergillus flavus Linn. Minyak benar-benar menghambat pertumbuhan miselium pada 100 ug / ml. Minyak tersebut menunjukkan spektrum fungitoksik luas terhadap Aspergillus niger, Aspergillus fumigatus pada 100 ug / ml. Minyak menunjukkan keampuhan yang signifikan dalam menghambat produksi aflatoksin B1 oleh strain aflatoksigenik A. Flavus. (Kumar, 2006).
Penelitian yang dilakukan oleh Tripathi dkk (2007), menggunakan beberapa minyak atsiri sebagai fungisida nabati dalam pengendalian pasca panen buah Anggur terhadap kapang kelabu (Botrytis cinerea). Diantaranya pengendalian dengan menggunakan minyak atsiri Dysphania ambrosioides (Hambatan Pertumbuhan 100 %) dengan Konsentrasi Hambatan minimum (MIC=Minimum Inhibitory Concentration 100 ppm.
Berdasarkan uraian diatas, penulis tertarik untuk melakukan analisis komponen minyak atsiri hasil isolasi tumbuhan epazote (Dysphania ambrosioides l.) dan uji efektifitas minyak atsiri dalam menghambat pertumbuhan jamur Rigidoporus microporus. Isolasi minyak atsiri dilakukan dengan menggunakan metode destilasi
air (hidrodestilasi) dan dilakukan uji efektifitasnya dalam menghambat pertumbuhan jamur Rigidoporus microporus.
1.2. Permasalahan
1. Komponen senyawa kimia apakah yang terkandung dalam minyak atsiri tumbuhan epazote (Dysphania ambrosioides L.)?
2. Bagaimanakah efektivitas minyak atsiri tumbuhan epazote (Dysphania ambrosioides L.) dalam menghambat pertumbuhan jamur Rigidoporus microporus?
1.3. Hipotesis
Senyawa kimia yang terkandung dalam minyak atsiri tumbuhan epazote (Dysphania ambrosioides L.) efektif dalam menghambat pertumbuhan jamur akar putih (Rigidoporus microporus).
1.4. Pembatasan Masalah
1. Daun tumbuhan epazote (Dysphania ambrosioide L.) diperoleh dari desa Pematang Sidamanik, Kec. Pematang Sidamanik, Kab. Simalungun.
2. Pengujian efektifitas Minyak atsiri yang diperoleh dari hasil hidrodestilasi tumbuhan Dysphania ambrosioides L.dalam menghambat pertumbuhan jamur Rigidoporus microporus dilakukan di laboratorium 1.5. Tujuan Penelitian
2. Untuk menentukan komponen senyawa kimia yang terkandung dalam minyak atsiri tumbuhan epazote (Dysphania ambrosioides L.)
3. Untuk menentukan efektivitas minyak atsiri tumbuhan epazote (Dysphania ambrosioides L). dalam menghambat pertumbuhan jamur Rigidoporus microporus.
1.6. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi di bidang kimia organik mengenai komponen kimia yang terdapat dalam minyak atsiri dan
potensi minyak atsiri tumbuhan epazote (Dysphania ambrosioides L.) dalam menghambat pertumbuhan jamur.
1.7. Metodologi Penelitian
Penelitian ini dilakukan secara eksperimen laboratorium dan sebagai objek penelitian adalah tumbuhan epazote (Dysphania ambrosioides L.) yang diperoleh dari Desa Pematang Sidamanik, Kab. Simalungun. Tumbuhan epazote (Dysphania ambrosioides L.) segar ditimbang, kemudian dilakukan hidrodestilasi menggunakan alat Stahl untuk mendapatkan minyak atsirinya. Perlakuan yang diuji dalam menentukan efektifitasnya untuk menghambat pertumbuhan jamur terdiri dari :
C0 = kontrol (tanpa menggunakan minyak atsiri) C50 = konsentrasi 50 ppm minyak atsiri
C100 = konsentrasi 100 ppm minyak atsiri C250 = konsentrasi 250 ppm minyak atsiri C500 = konsentrasi 500 ppm minyak atsiri C1000 = konsentrasi 1000 ppm minyak atsiri
Data yang diperoleh dianalisis dengan menggunakan analisis sidik ragam.
Selanjutnya bila hasil analisis sidik ragam menunjukkan hasil yang nyata maka akan dilanjutkan dengan uji DMRT ( Duncan Multiple Range Test) (Sastrosupadi, 2000).
BAB 2
TINJAUAN PUSTAKA
2.1 Epazote (Dysphania ambrosioides L.)
Dysphania ambrosioides, yang dikenal sebagai teh Yesuit, teh Meksiko, payqu (paico), epazote, atau herba sancti Mariæ (Duke, J.A, dkk, 2009). Merupakan tumbuhan semusim, bentuknya mudah berubah, tegak, sering bercabang banyak, terna yang harum, asli di Amerika tropis, ada forma yang berbulu dengan kelenjar yang banyak di permukaan bawah daun, banyak tumbuh liar di pegunungan Jawa Barat pada ketinggian ± 1600 meter di atas permukaan laut. Dari biji jenis tumbuhan ini dapat disuling minyak chenopodium atau amerikaanse wormzadoolie, obat khusus untuk pengobatan cacing tambang yang merusak kesehatan masyarakat, penyakit ini selama perang dunia banyak terdapat di Indonesia
Gambar 2.1 Foto tumbuhan epazote
Adapun klasifikasi tanaman epazote adalah sebagai berikut : Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Caryophyllales Famili : Amaranthaeae Genus : Dyspania
Species : Dysphania ambrosioides L.
Nama lokal : cia-cia
Tanaman ini ditemukan di seluruh daerah tropis dan subtropis di dunia, namun kebanyakan di Amerika Selatan. Ditemukan di berbagai habitat yang terganggu, kebun, ladang yang dibudidayakan, tanah bekas tapi paling sering di atas pasir oleh sungai. Ketinggian yang disukai berkisar antara 550-1620 m. Di Kenya, ditemukan di Tsavo East National Park, di Nyeri, Limuru, Thika, Machakos dan Laikipia (Heyne,1987).
Komposisi kimia minyak esensial daun dihidrodestilasi dari Dysphania ambrosioides L. yang tumbuh liar di Yaman ditentukan oleh analisis GC-MS, dan potensi antioksidan sitotoksik dan umum dievaluasi. Senyawa utama minyak D.
ambrosioides adalah ascaridole, isoascaridole dan p-cymene (Al Kaf dkk, 2016).
2.1.1 Manfaat Epazote (Dysphania ambrosioides L)
Daun rebusan digunakan sebagai pestisida yaitu fumigan terhadap nyamuk dan lalat dan membunuh siput. Juga digunakan sebagai racun jamur dalam perlindungan biji pasca panen. Ditambah pupuk untuk menghambat larva serangga.
Minyak digunakan sebagai pelindung butiran pascapanen sebagai racun jamur. Daun bubuk dapat ditambahkan ke gandum yang disimpan sekitar 0,5% b / b untuk mengendalikan Bruchid dalam kacang atau sampai 5% b / b untuk mengendalikan hama penyimpanan jagung termasuk Sitophilus zeamais. Konsumsi bubuk daun harus dihindari karena potensi efek berbahaya dari ramuan ramuan aktif meskipun senyawa ini mudah menguap dan secara alami akan terlepas dari produk yang tersimpan. Sebagai makanan, daun digunakan sebagai bumbu dalam sup atau teh.
Biji yang direndam dan dimasak dikonsumsi secukupnya.
Dysphania ambrosioides bertindak sebagai diuretik dan anthelmintik, dan digunakan untuk mengobati luka, masalah pernapasan, proses inflamasi dan nyeri,
bronkitis, tuberkulosis, dan rematik . sebagai obat luar, telah digunakan sebagai pencuci untuk wasir, sebagai bahan untuk mendetoksifikasi gigitan ular dan racun lainnya dan dianggap memiliki sifat penyembuhan luka (Al Kaf dkk, 2016).
2.2 Jamur Akar Putih
Menurut Alexopoulus, dkk, (1996) penyakit jamur akar putih (JAP) dapat diklasifikasikan sebagai berikut:
Kingdom : Fungi
Filum : Basidiomycota Kelas : Basidiomycetes Ordo : Aphylloporales Famili : polyporaceae Genus : Rigidoporus
Spesies : Rigidoporus microporus
JAP membentuk tubuh buah berbentuk kipas tebal agak berkayu, mempunyai zona – zona pertumbuhan, sering mempunyai struktur serat yang radier, mempunyai tepi yang tipis. Warna permukaan tubuh buah dapat berubah tergantung dari umur dan kandungan airnya. Pada permukaan tubuh buah benang – benang jamur berwarna kuning jingga, tebalnya 2,8 – 4,5 µm, mempunyai banyak sekat (septum) yang tebal. Pada waktu masih muda berwarna jingga jernih sampai merah kecokelatan dengan zona gelap yang agak menonjol. Permukaan bawah berwarna jingga, tepinya berwarna kuning jernih atau putih kekuningan. Jika menjadi tua atau kering tubuh buah menjadi suram, permukaan atasnya cokelat kekuningan pucat dan permukaan bawahnya cokelat kemerahan.
Pada permukaan tubuh buah benang – benang jamur berwarna kuning jingga, tebalnya 2,8 – 4,5 µm, mempunyai banyak sekat (septum) yang tebal.
Kadang – kadang jamur akar putih membentuk tubuh buah seperti kerak yang melekat datar (resupinat) pada permukaan kulit batang atau akar (Semangun, 2008).
Gambar 2.2 Foto tubuh buah Rigidoporus microporus
2.2.1 Gejala Serangan Jamur Akar Putih
Tanaman yang terinfeksi jamur akar putih mula – mula daunnya tampak kusam, kurang mengkilat, dan melengkung ke bawah ( daun yang sehat berbentuk seperti perahu). Setelah itu daun – daun menguning dan rontok. Pada pohon dewasa gugurnya daun yang disertai dengan matinya ranting, menyebabkan pohon memiliki mahkota yang jarang. Pohon yang terinfeksi kadang – kadang membentuh buah dan bunga sebelum masanya. Akar – akar busuk, sehingga pohon mudan rebah. Jamur akar putih sering membentuk tubuh buah pada leher akar tanaman sakit, pada tunggul, pada akar sawit yang terbuka (Semangun, 2008).
Gejala serangan jamur akar putih pada tanaman karet ditandai dengan adanya perubahan warna pada daun – daun muda. Daun berwarna hijau kusam, permukaan daun lebih tebal dari yang normal, ada kalanya tanaman membentuk bunga/buah lebih awal. Jamur akar putih termasuk jamur yang bersifat parasit fakultatif artinya patogen dapat hidup sebagai saprofit kemudian parasit. Patogen ini tidak dapat bertahan hidup tanpa adanya sumber makanan, hal ini menunjukkan bahwa timbulnya jamur akar putih sangat ditentukan oleh adanya sisa – sisa tunggul dan akar di lapangan (Rahayu dkk,2006)
2.2.2 Pengendalian Jamur Akar Putih
Pengendalian penyakit dengan jamur akar putih dengan cara pencegahan meliputi pembersihan tunggul dan sisa akar sebagai sumber infeksi, peracunan dan pembakaran tunggul yang terinfeksi (Situmorang, 2004). Pengendalian jamur akar putih pada tanaman karet dilakukan dengan melaksanakan sejumlah kegiatan secara terpadu. Pengendalian dapat dibagi menjadi dua kelompok yaitu membersihkan sumber infeksi sebelum dan sesudah penanaman tanaman karet dan mencegah meluasnya penyakit. (Semangun, 2008)
Penggunaan ekstrak alami sebagai fungisida alami mempunyai beberapa keuntungan, antara lain tanaman telah tersedia di alam, ramah lingkungan, dan mempunyai efek negatif rendah bagi organisme non target. Selain itu penggunaan
ekstrak tanaman tidak membutuhkan baiaya yang mahal, serta pengaruh negatif terhadap pertumbuhan tanaman (Sinulingga dkk, 1991)
2.3 Minyak Atsiri
Minyak atsiri adalah salah satu kandungan tanaman yang sering disebut minyak terbang. Minyak atsiri dinamakan demikian karena minyak tersebut mudah menguap. Selain itu, minyak atsiri juga disebut essential oil (dari kata essence) karena minyak tersebut memberikan bau pada tanaman (Koensoemardiyah, 2010).
Minyak atsiri dapat dibagi menjadi dua kelompok. Pertama, minyak atsiri yang dengan mudah dapat dipisahkan menjadi komponen-komponen atau penyusunan murninya. Biasanya komponen utama yang terdapat dalam minyak atsiri tersebut dipisahkan atau diisolasi dengan penyulingan bertingkat atau dengan proses kimia yang sederhana. (Sastrohamidjojo, 2004).
2.3.1 Isolasi Minyak Atsiri dengan Destilasi
Destilasi merupakan metode yang paling berfungsi untuk memisahkan dua zat yang berbeda, tetapi tergantung beberapa faktor, termasuk juga perbedaan tekanan uap air (berkaitan dengan perbedaan titik didihnya) dari komponen- komponen tersebut. Destilasi melepaskan uap air pada sebuah zat yang tercampur yang kaya dengan komponen yang mudah menguap daripada zat tersebut (Pasto,1992). Dalam pengertian industri minyak atsiri dibedakan tiga tipe destilasi, yaitu:
1. Penyulingan Air
Pada metode ini, bahan tanaman yang akan disuling mengalami kontak langsung dengan air mendidih. Bahan dapat mengapung di atas air atau terendam secara sempurna, tergantung pada berat jenis dan jumlah bahan dan air mendidih (Lutony, 2002).
2. iPenyulingan Uap dan Air
Bahan tanaman yang akan diproses secara penyulingan uap dan air ditempatkan dalam suatu tempat yang bagian bawah dan tengah berlubang-lubang yang akan
ditopang di atas. Bahan tanaman yang akan disuling hanya terkena uap dan tidak terkena air yang mendidih (Sastrohamidjojo, 2004).
3. Penyulingan Uap
Penyulingan uap disebut juga penyulingan tak langsung. Didalam proses penyulingan dengan uap ini, uap dialirkan melalui pipa uap berlingkar yang berpori dan berada di bawah bahan tanaman yang akan disuling. Kemudian uap akan bergerak menuju ke bagian atas melalui bahan yang disimpan di atas saringan (Lutony, 1994).
2.3.2 Komponen Kimia Minyak Atsiri
Minyak atsiri biasanya terdiri dari berbagai campuran persenyawaan kimia yang terbentuk dari unsur karbon (C), Hidrogen (H), dan oksigen (O). pada umumnya komponen kimia minyak atsiri dibagi menjadi dua golongan, yaitu:
1. Hidrokarbon yang terutama terdiri dari persenyawaan terpen
Persenyawaan yang termasuk golongan ini terbentuk dari unsur karbon (C), dan hidrogen (H). Jenis Hidrokarbon yang terdapat dalam minyak atsiri sebagian besar terdiri dari monoterpen (2 unit isopren), dan politerpen.
2. Hidrokarbon teroksigenasi
Komponen kimia dari golongan ini terbentuk dari unsur karbon (C), Hidrogen (H), dan oksigen (O). persenyawaan yang tewrmasuk dari golongan ini adalah persenyawaan alkohol, aldehid, ester, fenol. Ikatan karbon yang terdapat dalam molekulnya dapat terdiri dari ikatan tunggal, dan ikatan rangkap dua dan ikatan rangkap tiga.
Terpen mengandung ikatan tunggal dan ikatan rangkap dua. Senyawa terpen memiliki aroma kurang wangi, sukar larut dalam alkohol encer dan jika disimpan dalam waktu lama akan terbentuk resin. Golongan hidrokarbon teroksigenasi merupakan senyawa yang penting dalam minyak atsiri karena umumnya aroma yang lebih wangi. Fraksi terpen perlu dipisahkan untuk tujuan tertentu, misalnya untuk pembuatan parfum, sehingga didapatkan minyak atsiri yang bebas terpen (Ketaren, 1985).
2.3.3. Biosintesa Pembentukan Minyak Atsiri
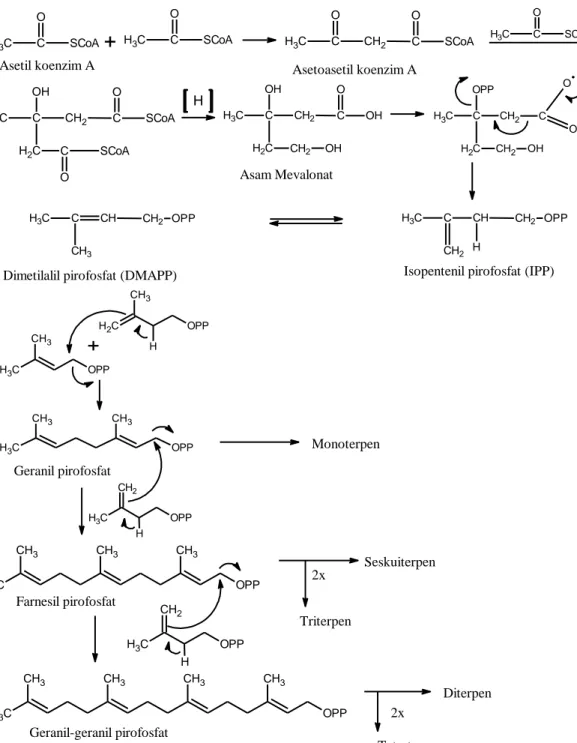
Berdasarkan proses biosintesinya atau pembentukan komponen minyak atsiri di dalam tumbuhan, minyak atsiri dapat dibedakan menjadi dua golongan: golongan pertama adalah turunan terpena yang terbentuk dari asam asetat melalui jalur biosintesis asam mevalonat. Golongan kedua adalah senyawa aromatik yang terbentuk dari biosintesis asam siklamat melalui jalur fenil propanoid (Agusta, 2000).
Senyawa yang dihasilkan ini dengan asetil koenzim A melakukan kondensasi jenis aldol menghasilkan rantai karbon bercabang sebagaimana ditemukan pada asam mevalonat. Reaksi-reaksi berikutnya ialah fosforilasi, eliminasi asam fosfat dan dekarboksolasi menghasilkan IPP (Isopentenil Pirofosfat) yang selanjutnya berisomerisasi menjadi DMAPP (Dimetil Pirofosfat) oleh enzim isomerase. IPP sebagai unit merupakan langkah pertama dari polimerisasi isoterpen untuk menghasilkan terpenoid. Penggabungan ini terjadi karena serangan elekron diikuti oleh penyingkiran ion pirofosfat. Serangan ini menghasilkan Geranil Pirofosfat (GPP) yakni senyawa antara bagi semua senyawa monoterpen. Penggabungan selanjutnya antara satu unit IPP dan GPP, dengan mekanisme yang sama seperti antara IPP dan DMAPP menghasilkan Farnesil Pirofosfat (FPP) yang merupakan senyawa antara bagi semua senyawa seskuiterpen.
Senyawa-senyawa diterpen dari Geranil-geranil Pirofosfat (GGPP) yang berasal dari kondensasi antara satu unit IPP dan FPP dengan mekanisme yang sama.
Sintesa terpenoid sangat sederhana sifatnya. Ditinjau dari segi teori reaksi organik sintesa ini hanya menggunakan beberapa jenis reaksi dasar. Reaksi-reaksi selanjutnya dari senyawa antara GPP, FPP, GGPP untuk menghasilkan senyawa- senyawa terpenoid satu per satu hanya melibatkan beberapa jenis reaksi sekunder.
Reaksi-reaksi sekunder ini lazimnya adalah hidrolisa, siklisasi, oksidasi, reduksi, dan reaksi-reaksi spontan yang dapat berlangsung dengan mudah dalam suasana netral dan pada suhu kamar, seperti isomerisasi, dehidrasi, dekarbosilasi dan sebagainya.
Berikut ini adalah gambar biosintesa terpenoid yang dapat dilihat pada Gambar 2.3
C
H3 C SCoA O
C
H3 C SCoA O
+ H3C C CH2
O
C SCoA O
C
H3 C SCoA O
C
H3 C CH2 OH
C SCoA O
C
H2 C SCoA O
H C
H3 C CH2 OH
C OH O
C
H2 CH2 OH
C
H3 C CH2 OPP
C C
H2 CH2 OH O O
C
H3 C CH CH2 OPP
CH2 H C
H3 C CH CH2 OPP
CH3
C H2
H
OPP CH3
C
H3 OPP
CH3
+
C H3
CH3 CH3
OPP
C H3
CH2
OPP H
Monoterpen
C H3
CH3 CH3
OPP CH3
C H3
CH2
OPP H
2x Seskuiterpen
Triterpen
C H3
CH3
CH3 CH3
OPP CH3
Diterpen
Tetraterpen 2x
Asetil koenzim A Asetoasetil koenzim A
Asam Mevalonat
Isopentenil pirofosfat (IPP) Dimetilalil pirofosfat (DMAPP)
Geranil pirofosfat
Farnesil pirofosfat
Geranil-geranil pirofosfat
Gambar 2.3. Biosintesa Terpenoid (Achmad, 1986)
Untuk menjelaskan dapat diambil beberapa contoh monoterpen. Dari segi biogenetik, perubahan geraniol, nerol dan linalool dari yang satu menjadi yang lain
berlangsung sebagai akibat reaksi isomerisasi. Ketiga alkohol ini, yang berasal dari hidrolisa geranil pirofosfat (GPP) dapat menjalanireaksi-reaksi sekunder berikut, misalnya dehidrasi menghasilkan mirsena, oksidasi menjadi sitral dan oksidasi reduksi menghasilkan sitronelal. Berikut ini adalah contoh perubahan senyawa monoterpen, dapat dilihat pada Gambar 2.4.
CH3
C
H3 CH3
CH2OH
C
H3 CH3
CH2 OH CH3
C
H3 CH3
CH2 CH2
C
H3 CH3
CHO CH3
C
H3 CH3
CHO CH3
C
H3 CH3
CH2OH CH3
Geraniol (trans)
Mirsen
Linalool Sitronelal
Sitral Nerol
(cis)
- H2O
H ,
O O
Gambar 2.4 Perubahan Senyawa Monoterpen (Achmad, 1986)
2.4. Analisa Komponen Minyak Atsiri dengan GC-MS
Minyak Atsiri yang diperoleh di analisis komponen-komponen yang dikandungnya dengan GC-MS yang mana dalam hal ini akan diperoleh spektra GC
yang merupakan total ion kromatogram atau puncak-puncak kromatogram dari komponen senyawa yang ada dalam minyak atsiri sedangkan spektra MS akan diperoleh Massa Molekul Relatif dari komponen-komponen senyawa dalam minyak atsiri serta fragmentasi ion-ionnya (Silverstein, 1981).
Pada penggunaan GC, efek penguapan dapat dihindari bahkan dihilangkan sama sekali. Perkembangan teknologi instrumentasi yang pesat akhirnya dapat menghasilkan suatu alat yang merupakan gabungan dua sistem dengan prinsip dasar yang berbeda satu sama lain tetapi saling melengkapi, yaitu gabungan antara kromatografi gas dan spektrometer massa. Kromatografi gas berfungsi sebagai alat pemisah berbagai campuran komponen dalam sampel sedangkan spektrometer massa berfungsi untuk mendeteksi masing-masing komponen yang telah dipisahkan pada kromatografi gas (Agusta, 2000).
2.4.1 Analisa Kromatografi Gas
Kromatografi gas digunakan untuk memisahkan komponen campuran kimia dalam suatu bahan berdasarkan perbedaan polaritas campuran. Fase gerak akan membawa campuran sampel menuju kolom. Campuran dalam fase gerak akan berinteraksi dengan kecepatan yang berbeda dimana interaksi komponen dengan fase diam dengan waktu yang paling akhir (Eaton, 1989). Pemisahan tercapai dengan partisi sampel antara fase gas bergerak dan fase diam berupa cairan dengan titik didih tinggi (tidak mudah menguap) yang terikat pada zat padat penunjangnya (Khopkar, 2003).
Komponen utama dalam Kromatografi Gas 1. Gas pembawa
Pemilihan gas pembawa sampai taraf tertentu bergantung pada detektor yangdipakaihantar hambang, ionisasi nyala, tangkap elektron, atau khas terhadap unsur. Nitrogen, Helium, Argon, Hidrogen, dan Karbon dioksida adalah gas yang paling sering dipakai sebagai gas pembawa karena mereka tidak reaktif serta dapat dibeli dalam keadaan murni dan kering dalam kemasan tangki bervolume besar dan bertekanan tinggi. Hal yang menentukan ialah bahwa kita harus memakai gas paling murni (Gritter, 1991).
2. Sistem Injeksi
Lubang injeksi didesain untuk memasukkan sampel secara cepat dan efisien.
Pada dasarnya, ada 4 jenis injektor pada kromatografi gas, yaitu :
a. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan diuapkan dalam injektor yang panas dan 100% masuk menuju kolom.
b. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan dalam injektor yang panas dan selanjutnya dilakukan pemecahan.
c. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel diuapkan dalam injektor yang panas dan dibawa ke dalam kolom karena katup pemecah ditutup.
d. Injeksi langsung ke kolom (on coloum injection), yang mana ujung semprit dimasukkan langsung ke dalam kolom.
Teknik injeksi langsung ke dalam kolom digunakan untuk senyawa-senyawa yang mudah menguap, karena kalau penyuntikkannya melalui lubang suntik, dikwatirkan akan terjadi peruraian senyawa tersebut karena suhu yang tinggi (Rohman, 2009).
3. Kolom
Kolom merupakan tempat terjadinya proses pemisahaan karena didalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen sentral pada kromatografi gas (Rohman, 2009).
4. Fase Diam
Fase diam dibedakan berdasarkan kepolarannya, yaitu nonpolar, semi polar dan polar. Berdasarkan minyak atsiri yang nonpolar sampai sedikit polar, maka untuk keperluan analisis sebaiknya digunakan kolom fase diam yang bersifat nonpolar (Agusta, 2000).
5. Suhu
Suhu merupakan salah satu faktor utama yang menentukan hasil analisis Kromatografi Gas dan Spektrometri Massa. Umumnya yang sangat menentukan adalah pengaturan suhu injektor dan kolom (Agusta, 2000).
6. Detektor
Detektor yang digunakan pada sistem GC-MS harus stabil dan tidak merusak senyawa yang dideteksi. Pada systemGC-MS ini, yang berfungsi sebagai detektor adalah spektrometer massa itu sendiri yang terdiri atas sistem ionisasi dan sistem analisis (Agusta, 2000).
2.4.2 Analisis Spektrometri Massa
Spektrometer massa adalah suatu alat berfungsi untuk mendeteksi masing- masing molekul komponen yang telah dipisahkan pada sistem kromatografi gas yang terdiri dari sistem analisis dan sistem ionisasi dan sistem molekul. Prinsip spektrometri massa (MS) ialah senyawa organik (sampel) ditembak dengan berkas elektron dan menghasilkan ion bermuatan positif yang mempunyai energi yang tinggi karena lepasnya elektron dari molekul yang dapat pecah menjadi ion positif yang lebih kecil (ion fragmen). Spektrum massa merupakan grafik antara limpahan relatif lawan perbandingan massa/muatan (m/z). Terpisah fragmen ion positif didasarkan pada massanya. Kejadian tersederhana adalah tercampaknya satu elektron dari molekul dalam fasa gas oleh sebuah elektron dalam berkas elektron dan membentuk suatu kation radikal (M•+
) M + e → M•+
+ 2e
Satu proses yang disebabkan oleh tabrakan elektron pada kamar pengion spektrometer massa adalah ionisasi dari molekul yang berupa uap dengan kehilangan satu elektron dan terbentuk ion molekul bermuatan positif, karena molekul senyawa organik mempunyai elektron berjumlah genap maka proses pelepasan satu elektron menghasilkan ion radikal yang mengandung satu elektron tidak berpasangan.
M M•+
Proses lain molekul yang berupa uap tersebut menangkap sebuah elektron membentuk ion radikal bermuatan negatif dengan kemudian terjadi jauh lebih kecil (10-2) dari pada ion radikal bermuatan positif (Sudjadi, 1983).
Informasi yang diperoleh dari kedua teknik ini yang digabung dalam intrument GC- MS adalah hasil dari masing-masing spektra. Untuk spektra GC, informasi terpenting yang didapat adalah waktu retensi untuk tiap-tiap senyawa dalam sampel. Sedangkan
-1e
untuk spektra MS bias diperoleh informasi mengenai massa molekul relatif dari sampel tersebut (Skoog, 1991).
2.5 Pestisida
Secara umum dampak negatif dari pemakaian pestisida sintetis, sebagai berikut : 1. Pencemaran air dan tanah yang akhirnya akan kembali lagi kepada manusia
dan makhluk hidup lainnya dalam bentuk makanan dan minuman yang tercemar
2. Matinya musuh alami dari organisme pengganggu tanman 3. Kemungkinan terjadinya serangan hama sekunder
4. Kematian organisme yang menguntungkan, seperti lebah yang sangat berperan dalam penyerbukan bunga
5. Timbulnya kekebalan OPT terhadap pestisida sintetis
Kelemahan pestisida sintetis seperti yang dikemukakan di atas membuat para ilmuwan khawatir pestisida sintetis tidak lagi mampu menanggulangi masalah hama dan penyakit tanaman, tetapi justru mendatangkan malapetaka bagi umat manusia.
Karena itu, berbagai penelitian, dari yang sederhana hingga yang rumit seperti rekayasa genetika mulai dikembangkan untuk mencari sumber – sumber yang lebih aman untuk manusia dan lingkungan. Sumber – sumber tersebut tersedia di alam dalam jumlah yang sangat besar. Pestisida alami yang berasal dari bahan – bahan yang terdapat di alam tersebut diekstraksi, diproses, atau dibuat menjadi konsentrat dengan tidak mengubah struktur kimianya. Berbeda dengan pestisida sintetis yang umumnya bersumber dari bahan dasar minyak bumi yang diubah struktur kimianya untuk memperoleh sifat – sifat tertentu sesuai dengan keinginan.
Pestisida alami yang kini dikenal dapat dikelompokkan menjadi 3 golongan, sebagai berikut :
1. Pestisida botani (botanical pesticides) yang berasal dari ekstrak tanaman.
Seperti diketahui, berbagai jenis tanaman memproduksi senyawa kimia untuk melindungi dirinya dari serangan OPT. Senyawa inilah yang kemudian diambil dan dipakai untuk melindungi tanaman lain.
2. Pestisida biologis (biological pesticide) yang mengandung mikroorganisme pengganggu OPT, seperti bakteri patogenik, virus dan jamur.
Mikroorganisme ini secara alami memang merupakan musuh OPT, yang kemudian dikembangbiakkan untuk keperluan perlindungan tanaman. Proses manufacture dari organisme ini telah memungkinkan petani memakainya
Pestisida berbahan dasar mineral anorganik yang terdapat pada kulit bumi.
Biasanya bahan mineral ini berbentuk kristal, tidak mudah menguap, dan bersifat stabil secara kimia, seperti belerang dan kapur. Minyak bumi atau minyak nabati dan sabun pun dapat dipakai untuk mengendalikan OPT. Pada pertanian organik, minyak dan sabun sangat lazim dipakai (Novizan,2002) Macam – macam pestisida diantaranya:
- Fungisida = Pengendali cendawan
- Insektisida = pengendali insecta/serangga dewasa - Herbisida = pengendali gulma
- Nematisida = pengendali nematoda
- Akarisida = pengendali pengendali tungau
- Ovasida = pengendali telur serangga dan telur tungau - Bakterisida = pengendali bakteri
- Larvasida = pengendali larva - Rodentisida = pengendali tikus - Avisida = pengendali burung
- Mollussida = pengendali bekicot (Djafaruddin, 2008)
2.5.1. Fungisida
Fungisida (fungicide), berasal dari kata bahasa Yunani : ―fungus‖ = cendawan, dan ―caedo‖ = membunuh. Fungisida dlam arti yang luas didefenisikan sebagai suatu senyawa yang dapat membunuh atau menghambat pertumbuhan, tepatnya mengendalikan cendawan/fungi. Senyawa – senyawa yang menghambat pertumbuhan tanpa membunuh tersebut lebih tepat dikatakan ―fungistatik‖. Ada beberapa tipe fungisida, diantaranya:
- Proteksi (protective), yaitu tipe yang memberikan perlindungan terhadap infeksi pada tempat dimana ia dipakai, atau dapat juga bereaksi, dimana infeksi belum terjadi (protectant)
- Eradikasi (eradicant), yaitu tipe yang mengobati atau menyembuhkan infeksi, yang telah terjadi serta memusnahkan patogen pada tempat dimana ia dipakai
- Sistemik (sistemic), yaitu tipe yang dapat mencegah perkembangan penyakit di tempat – tempat atau bagian – bagian di sleuruh tubuh tanaman yang berasal dari mana atau pada tempat di mana ia dipakai.
Sifat – sifat fungisida, yaitu :
- Fungisidal, berarti fungisida itu membunuh cendawan (fungi)
- Fungistatik, berarti tidak membunuh cendawan tersebut, tetapi hanya menghambat pertumbuhannya atau memperlambat pertumbuhannya
- Genestatik berarti mencegah sporulasi atau pembentukan spora dari cendawan tersebut. Oleh karena itu fungisida yang genestatik dapat pula disebut ―eradicant‖.
Sebaiknya atau yang ideal, fungisida mempunyai sifat – sifat sebagai berikut : - Dapat meracun patogen (toksid yang tinggi)
- Tidak merusak tanaman (fitotoksid)
- Tidak meracun manusia (tidak toksid pada manusia) - Tidak meracun ternak (tidak toksid pada ternak) - Murah dan mudah didapat
- Tidak mudah terbakar - Tahan disimpan lama - Tidak merusak alat – alat
- Mudah dibuat dan mudah pemakaiannya - Dapat merata dan melekat kuat
- Dapat aktif dalam waktu yang lama setelah dipakai
Tetapi boleh dikatakan belum ada fungisida yang ideal, yang memenuhi semua syarat – syarat tersebut diatas. Fungisida yang sudah umum dipakai hanya mempunyai sebagian dari syarat – syarat dan sifat sifat baik tersebut (Djafaruddin, 2008).
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Proses penelitian ini dilakukan dari bulan Mei sampai Oktober 2017.
Penyulingan minyak atsiri tumbuhan epazote (Dysphania ambrosioides L) dilakukan di Laboratorium Kimia Organik FMIPA USU Medan, untuk uji analisa spektroskopi GC-MS dilakukan di Laboratorium Kimia Organik FMIPA UGM, dan untuk uji efektifitas terhadap jamur akar putih (Rigidoporus microporus) dilakukan di Laboratorium Lapangan Agensia Pengendali Hayati Balai Besar perbenihan dan Proteksi Tanaman Perkebunan (BBPPTP) Medan.
3.2 Alat dan Bahan 3.2.1 Alat
Alat Stahl
Beaker glass 100 ml Pyrex
Botol aquadest
Botol vial
Corong pisah Pyrex
Gelas Erlenmeyer 250 ml Pyrex
GC-MS Shimadzu
Kain kasa
Kertas label
Labu ukur 50 ml Pyrex
Labu destilasi 1000 ml Pyrex
Lemari pendingin Toshiba
Neraca analitis Mettler AE 2000
Pipet tetes
Pompa air
Sarung tangan
Selang
Spatula
Statif dan klem
Teflon
Cawan petri diameter = 9 cm
Inkubator
Plastik wrap
Bor gabus diameter = 0.8 cm
Mikroskop
Jarum inokulasi
Autoklaf
3.2.2 Bahan
Aquadest
PDA (Potato Dextrose Agar)
etanol
Dietil eter p.a Merck
Na2S04 anhidrous p.a Merck
Tumbuhan epazote (Dysphania ambrosioides L)
Tween 80 p.aMerck
3.3 Prosedur Penelitian 3.3.1. Penyediaan Sampel
Bahan yang digunakan dalam penelitian ini adalah
Daun tumbuhan epazote yang diperoleh dari desa Pematang Sidamanik, Kec. Pematang Sidamanik, Kab. Simalungun
Isolat jamur akar putih Rigidophorus microporus koleksi Balai Penelitian Karet, Sungai Putih
3.3.2. Isolasi Minyak Atsiri Epazote. Dengan Alat Destilasi Stahl
Sebanyak 150 gram daun tumbuhan epazote dimasukkan kedalam labu alas bulat volume 1000 mL ditambahkan air sampai sampel terendam, dipasang pada alat penyuling Stahl, dan dididihkan selama ± 5-6 jam hingga minyak atsiri menguap sempurna. Destilat yang diperoleh merupakan campuran minyak dengan air.
Kemudian lapisan minyak dimasukkan kedalam beaker glass, ditambahkan dietil eter, ditambahkan Na2SO4 anhidrous pada botol vial untuk mengikat air yang mungkin masih tercampur, disaring,kemudian filtratnya di uapkan dan minyak atsiri yang diperoleh dimasukkan ke dalan botol vial,disimpan ditempat sejuk dan ditutup rapat. Minyak atsiri yang diperoleh dianalisis kandungan kimianya menggunakan alat GC-MS dan dilanjutkan pengujian daya hambat terhadap jamur akar putih (Rigidoporus miroporus)(Shara, 2012).
3.3.3. Analisa Minyak Atsiri Dysphania ambrosioides L. Dengan GC-MS Cuplikan dimasukkan kedalam gerbang suntik pada sebuah alat GC-MS.
Selanjutnya kondisi disesuaikan dengan kondisi dibawah ini kemudian diamati kromatogram yang dihasilkan oleh recorder serta mass spektra masing-masing senyawa.Kondisi alat GC-MS, yaitu:
GC-MS-QP2010S SHIMADZU
Kolom : Rtx sil-5
Panjang kolom : 30 meter
Gas Pembawa : Helium
Pengion : EI 70 Ev
GC-2010
Column Oven Temperature : 60.0 oC Injection Temperature : 250oC
Injection Mode : Split
Flow Control Mode : Pressure
Pressure : 40.0 kPa
Total Flow : 31.3 mL/min
Column Flow : 0.76 mL/min
Linear Velocity : 31.9 cm/sec
Purge Flow : 3.0 mL/min
Split Ratio : 36.0
Equlibrium Time : 1.0 min
GC Program GCMS-QP2010
Ion Source Temperature : 250.00 oC Interface Temperature : 250.00 oC
Solvent Cut Time : 3.60 min
Detector Gain Mode : Relative
Detector Gain : +0.00 kV
MS
Start Time : 3.80 min
End Time : 70.00 min
ACQ Mode : Scan
Even Time : 0.50 sec
Scan Speed : 1250
Start m/z : 29.00
End m/z : 600.00
3.3.4. Uji Daya Hambat Minyak Atsiri Tumbuhan Epazote (Dysphania Ambrosioides) Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus microporus)
3.3.4.1. Pembuatan Media (PDA + Minyak Atsiri)
Disiapkan media PDA pada labu ukur 100 ml. Selanjutnya media dicairkan dengan menggunakan water bath. Pada saat PDA masih cair (45oC) variasi konsentrasi minyak atsiri dibuat dengan melarutkan sejumlah minyak atsiri yang diperlukan ( 5 µl ; 10 µl ; 25 µl; 50 µl; 100 µl) dalam 5 ml 0.1 % tween 80 dan kemudian mencampurkan dengan 95 ml media PDA. Dihomogenkan dengan menggunakan shaker. Konsentrasi minyak atsiri yang diperoleh yaitu 50 ppm; 100 ppm; 250 ppm; 500 ppm; dan 1000 ppm. Kemudian masing masing dituang ke cawan petri dan diinkubasikan selama 24 jam untuk mengetahui ada tidaknya kontaminasi. Dilakukan hal yang sama untuk kontrol kecuali penambahan minyak atsiri. (Tripathi P., dkk, 2007).
3.3.4.2 Inokulasi Jamur Akar Putih (Rigidoporus microporus) ke Media
Biakan murni dari patogen Rigidoporus microporus berumur 7 hari dipotong dengan alat bor gabus kemudian diambil dengan jarum inokulasi dan ditumbuhkan dalam cawan petri yang berisi PDA sesuai dengan perlakuan. Bagian yang diambil adalah dari tepi koloni yang diletakkan tepat ditengah – tengah cawan petri. Lalu cawan petri diinkubasikan dalam kotak inkubator pada suhu ruangan (Darwis, 2015).
3.3.5 Parameter Pengamatan
3.3.5.1 Diameter Pertumbuhan Jamur Akar Putih (Rigidoporus microporus) Pengukuran diameter pertumbuhan patogen dilakukan pada umur biakan 1 HSI (Hari Sesudah Inokulasi) sampai dengan perlakuan kontrol memenuhi cawan petri. Pengukuran dilakukan setiap 24 jam. Pengukuran dilakukan dengan alat penggaris dengan satuan millimeter yaitu dengan mengukur koloni pertumbuhan patogen (Darwis, 2015).
3.3.5.2 Persentase Zona Hambatan Miselium Jamur Akar Putih (Rigidoporus microporus)
Perhitungan persentase zona hambatan misellium Rigidoporus microporus menggunakan rumus Pandey et al., dalam Darwis 2015., sebagai berikut :
Keterangan :
ZH = Zona Hambatan Akar Putih (Rigidoporus microporus) (%)
a = Diameter miselium Akar Putih (Rigidoporus microporus) pada kontrol (cm)
b = Diameter miselium Akar Putih (Rigidoporus microporus) pada perlakuan (cm)
3.3.5.3 Pengamatan Miselium Jamur Akar Putih (Rigidoporus microporus) Pengamatan miselium jamur secara mikroskopis dengan menggunakan mikroskop. Pengamatan dilakukan pada hari terakhir pengamatan, yaitu dengan
dimasukkan kedalam labu alas bulat 1 Liter ditambahkan aquadest
dididihkan selama 5-6 jam hingga keluar uap air bersama minyak
Destilat
dimasukkan kedalam beaker glass ditambahkan dietil eter
ditambahkan Na2SO4 anhidrous
residu filtrat
diuapkan untuk menghilangkan pelarut eter
Minyak atsiri
Analisa GC-MS Analisa uji hambatan jamur
ditimbang
disaring
dirangkai alat Stahl 150 gram daun epazote
mengamati perbedaan miselium jamur Rigidoporus microporus antara perlakuan kontrol dengan perlakuan lainnya ( Darwis, 2015).
3.4. Bagan Penelitian
3.4.1. Isolasi Minyak Atsiri tumbuhan epazote Dengan Alat
Stahl
3.4.2. Analisis Minyak Atsiri Dengan GC-MS
Cuplikan ±
diinjeksikan kedalam GC-MS diamati kromatogram yang dihasilkan Hasil
3.4.3. Uji Daya Hambat Minyak Atsiri Dysphania Ambrosioides Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus microporus)
Media PDA cair
ditambahkan minyak atsiri Dysphania ambrosioides
ditambahkan 5 ml 0,1 % tween 80 dikocok hingga rata
dituang ke dalam petridisk dibiarkan hingga mengeras media PDA padat
diinokulasikan jamur dengan ukuran 0.8 cm pada bagian tengah
diukur zona hambat pertumbuhan miselium hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1 Penentuan Kadar minyak Atsiri
Hasil isolasi minyak atsiri daun epazote diperoleh dengan metode hidrodestilasi menggunakan alat Stahl. Dari hasil destilasi daun epazote segar sebanyak 150 gram dengan 7 kali perlakuan diperoleh rata-rata 0,38 gram (b/b) dan rata – rata kadar minyak atsiri sebesar 0,25 % seperti pada Tabel 4.1.
Tabel 4.1 Hasil Hidrodestilasi Minyak Atsiri minyak atsiri daun epazote
No. Sampel
(gram)
Minyak Atsiri (gram)
Persentase (%)
1. 150 0,36 0,24
2. 150 0,36 0,24
3. 150 0,38 0,25
4. 150 0,38 0,25
5. 150 0,37 0,25
6. 150 0,39 0,26
7. 150 0,39 0,26
Rata-rata 150 0,38 0,25
4.1.2. Hasil Analisis GC-MS
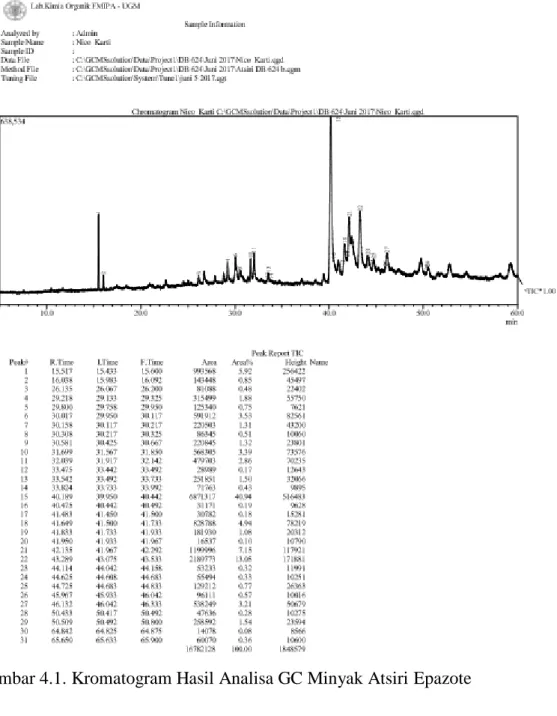
Minyak atsiri yang dihasilkan secara hidrodestilasi dianalisis dengan Gas Chromatography - Mass Spectroscopy (GC-MS). Kromatogram hasil analisis GC menunjukkan terdapatnya 31 puncak senyawa (Gambar 4.1 ) yang menunjukkan adanya 31 senyawa yang terkandung dalam minyak atsiri tersebut (Tabel 4.2)
Gambar 4.1. Kromatogram Hasil Analisa GC Minyak Atsiri Epazote
Tabel 4.2. Senyawa Hasil Analisis GC-MS Minyak Atsiri Epazote No. RT
(Menit)
Massa Relatif Senyawa
Rumus
Molekul Nama Senyawa %
Area
1. 15,517 136 C10H16 α- terpinen 5,92
2. 16,038 134 C10H14 Para cymen 0,85
3. 26,135 142 C11H10 1-metil naftalen 0,45
4. 29,218 204 C10H18O α-guaiene 1,88
5. 29,800 222 C15H26 Ledol 0,75
6. 30,017 167 C13H12O Difenilmetan 3,53
7. 30,158 204 C15H24 Seychellene 1,31
8. 30,308 207 C10H13N3O2 5-nitro-2-piridil Piperidine 0,51
9. 30,581 204 C15H24 α-patkoulen 1,32
10. 31,699 204 C15H24 Delta guaiena 3,39
11. 32,039 182 C14H14 1,1 difeniletana 2,86
12. 33,475 170 C13H27NO 4 asetamido-4-propiloktana 0,17
13. 33,542 182 C14H14 bibenzil 1,50
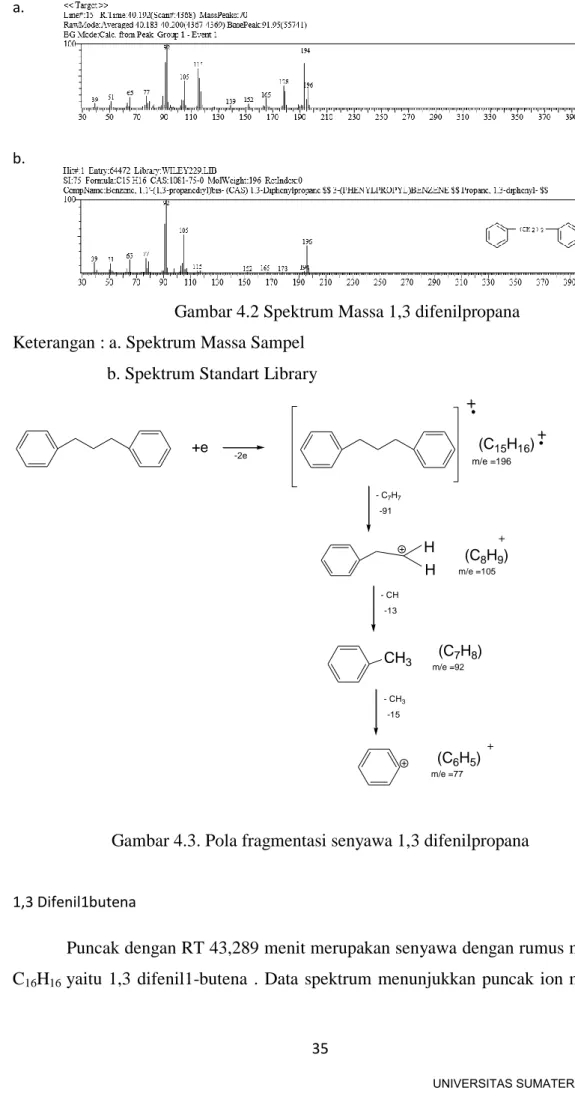
14. 33,824 182 C9H10S2 2-fenill, 1,3 ditiolene 0,43 15. 40,189 196 C15H16 1,3 difenilpropana 40,94 16. 40,475 194 C21H18N2 1-fenyl-N,N-bis(fenylmetilen)
Metandiamin 0,19
17. 41,483 194 C13H22O Trans-1,1,10-trimetildekalona 0,18 18. 41,649 208 C16H16 9,10-dihidro-9,10 dimetil-
antracene 4,94
19. 41,833 210 C16H18 1,3 difenilbutana 1,08
20.. 41,950 246 C18H30 1-fenyldodekana 0,10
21. 42,135 208 C16H16 2-metil-1,1-difenyl-1-propena 7,15 22. 43,289 208 C16H16 1,3 difenil1-butene 13,05 23. 44,114 208 C21H22N2O
2-(3,3-dimetil-4,4-difenyl-2- oxtanylidene)amino-2—metil Propanenitril,
0,32 24. 44,625 208 C16H16 1-metil tetraline 0,33 25. 44,725 222 C17H18 1,5 difenil pentena 0,77 26. 45,967 303 C19H29NO2
Mentil N—1-fenyletil-
karbamat 0,57
27. 46,132 194 C15H14 1,2,4,5-dibenzosikloheptana 3,21 28. 50,433 193 C14H11N 9-metilacridine 0,28 29. 50,509 207 C12H14ClN 1-metil-4,4-klorofenil 1,2,3,6-
tetrahidropiridin 1,54
30. 64,842 182 C8H7NO4 3-metil-6-nitrobenzoiacid 0,08 31. 65,650 158 C9H16Cl2 1,1-dikloro-2,2,3-trietil
siklopropane 0,36
Senyawa dari hasil interpretasi yang dapat diindentifikasi sebanyak 5 buah senyawa berdasarkan standart library Willey dan NIST (>4%) seperti pada Tabel 4.3.
Tabel 4.3. Hasil Analisa GC-MS Minyak Atsiri epazote yang dapat Diinterpretasi
No. RT (Menit)
Massa Relatif Senyawa
Rumus
Molekul Nama Senyawa %
Area 1. 40,189 196 C15H16 1,3 difenilpropana 40,94 2. 43,289 208 C16H16 1,3 difenil1butena 13,05 3. 42,135 208 C16H16 2-metill-1,1-difenil-1-
propena 7,15
4. 15,517 136 C10H16 α- terpinen 5,92
5. 41,649 208 C16H16
9,10-dihidro-9,10
dimetil-antracene 4,94
4.1.3. Diameter Pertumbuhan Jamur Akar Putih (Rigidoporus Microporus) Diameter pertumbuhan jamur Rigidoporus microporus diukur setiap hari mulai dari 1 HSI sampai dengan 8 HSI. Dari 3 ulangan setiap perlakuan (kontrol;
50 ppm; 100 ppm; 250 ppm; 500 ppm; dan 1000 ppm), maka diperoleh rataan diameter pertumbuhan jamur Rigidoporus microporus yang disajikan pada tabel 4.4. berikut:
Tabel 4.4. Rataan diameter Pertumbuhan jamur Rigidoporus microporus pada pengamatan 1 HSI – 8 HSI
Perlakuan Pengamatan (cm)
1 HSI 2HSI 3HSI 4 HSI 5 HSI 6 HSI 7 HSI 8 HSI
KONTROL 1,87 2,93 3,80 5,10 5,80 6,77 7,97 8,73 50 ppm 1,77 2,70 3,73 4,75 5,25 6,20 7,30 8,10 100 ppm 1,77 2,67 3,43 4,60 5,45 6,33 7,17 8,07 250 ppm 1,70 2,50 3,33 4,50 5,30 6,27 6,80 7,50 500 ppm 1,40 2,17 3,17 3,60 4,30 5,13 6,00 6,73 1000 ppm 0,80 1,17 1,60 2,10 2,90 3,67 4,90 5,37 Keterangan: HSI = Hari Sesudah Inokulasi
Berdasarkan Tabel 4.4. di atas dapat diketahui bahwa diameter pertumbuhan jamur Rigidoporus microporus tercepat pada pengamatan 1 HSI – 8 HSI yaitu pada kontrol dan diameter pertumbuhan terlama pada konsentrasi 1000 ppm. Semakin tinggi konsentrasi minyak atsiri yang diberikan maka diameter pertumbuhan jamur Rigidoporus microporus semakin kecil. Hal ini terlihat nyata pada konsentrasi 500 ppm dan 1000 ppm.
4.1.4. Zona Hambatan Diameter Pertumbuhan Rigidoporus Microporus
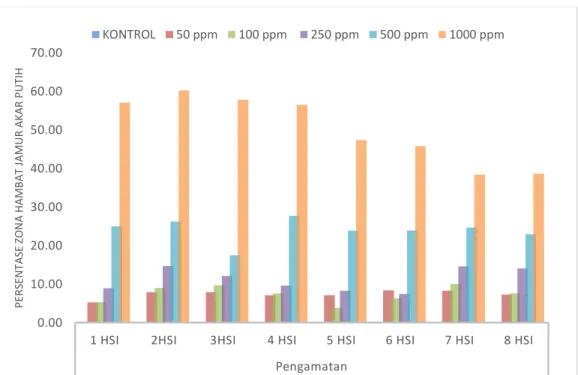
Hasil analisis sidik ragam dan uji jarak Duncan (DMRT) pada taraf 5 % dan 1
% menunjukkan bahwa pemberian minyak atsiri berpengaruh nyata terhadap persentase zona hambatan pertumbuhan miselium Rigidoporus microporus pada pengamatan 1 HSI sampai 8 HSI (HSI = Hari Sesudah Inokulasi). Rataan persentase zona hambatan pertumbuhan miselium Rigidoporus microporus terhadap pemberian minyak atsiri dapat dilihat pada tabel 4.5.
Tabel 4.5. Rataan Hambatan Pertumbuhan jamur Rigidoporus microporus pada pengamatan 1 HSI – 8 HSI
Perlakuan Pengamatan (%)
1 HSI 2HSI 3HSI 4 HSI 5 HSI 6 HSI 7 HSI 8 HSI KONTROL 0,00A 0,00A 0,00A 0,00A 0,00A 0,00A 0,00A 0,00A 50 ppm 5,26AB 7,86B 1,73A 7,12AB 7,09A 8,36B 8,30AB 7,26B 100 ppm 5,26AB 8,97B 9,71B 7,60AB 3,80A 6,35B 10,02B 7,61B 250 ppm 8,87B 14,68B 12,07B 9,58B 8,31A 7,41B 14,63B 14,08B 500 ppm 24,95C 26,19C 16,64B 27,73C 23,89B 23,92C 24,68C 22,94C