TRIAMIN SERTA PENGUJIAN ADSORPSI TERHADAP ION LOGAM Cu
2+, Zn
2+dan Fe
2+TESIS
DEWI REGINA SILITONGA 177006004
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
TRIAMIN SERTA PENGUJIAN ADSORPSI TERHADAP ION LOGAM Cu
2+, Zn
2+dan Fe
2+TESIS
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Magister Sains
DEWI REGINA SILITONGA 177006004
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2019
SINTESIS TURUNAN KITOSAN MELALUI REAKSI ANTARA KITOSAN DENGAN EPIKLOROHIDRIN DAN DIETILEN
TRIAMIN SERTA PENGUJIAN ADSORPSI TERHADAP ION LOGAM Cu
2+, Zn
2+dan Fe
2+TESIS
Saya menyatakan bahwa tesis ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebut kan sumbernya.
Medan, 21 Oktober 2019
Dewi Regina Silitonga 177006004
Sebagai sivitas akademia Universitas Sumatera Utara, saya yang bertandatangan dibawah ini :
Nama : Dewi Regina Silitonga
NIM : 17700604
Program Studi : Magister Ilmu Kimia Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive Royalty Free Right) atas tesis saya yang berjudul :
SINTESIS TURUNAN KITOSAN MELALUI REAKSI ANTARA KITOSAN DENGAN EPIKLOROHIDRIN DAN DIETILEN TRIAMIN SERTA
PENGUJIAN ADSORPSI TERHADAP ION LOGAM Cu2+, Zn2+ dan Fe2+
Beserta perangkat yang ada (jka diperlukan), dengan Hak Bebas Royalti Non- Ekslusif ini, Universitas Sumatera Utara berhak menyimpannya, mengalih media, memformat, mengelola dalam bentuk data-base, merawat dan mempublikasikan Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya sebagai penulis dan sebagai pemegang dan atau sebagai pemegang dan atau sebagai penulis dan sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarmya.
Medan, 21 Oktober 2019
Dewi Regina Silitonga
Telah diuji pada Tanggal
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Jamaran Kaban, M.Sc Anggota : 1. Dr. Mimpin Ginting, MS
2. Dr. Adil Ginting, M.Sc
3. Dr. Emma Zaidar Nasution, M.Si 4. Dr. Lamek Marpaung,M.Phil
SINTESIS TURUNAN KITOSAN MELALUI REAKSI ANTARA KITOSAN DENGAN EPIKLOROHIDRIN DAN DIETILEN SERTA PENGUJIAN
ADSORPSI TERHADAP ION LOGAM Cu2+, Zn2+ dan Fe2+
ABSTRAK
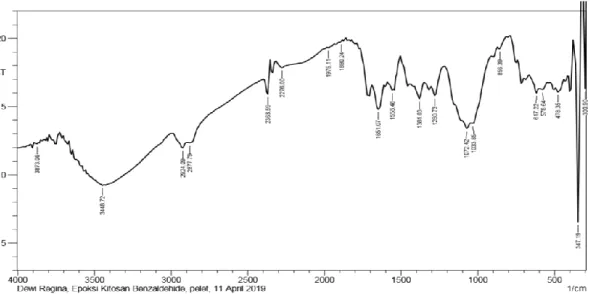
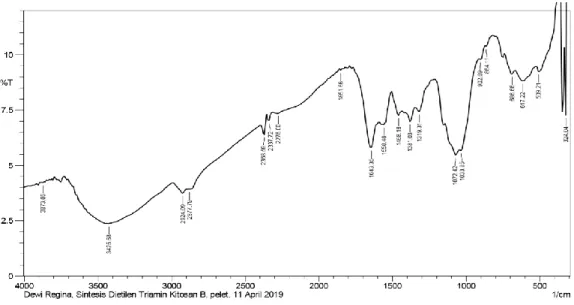
Dalam penelitian ini dilakukan sintesis turunan kitosan yang dilakukan dengan dua cara yatu grafting dietilen triamin kitosan benzaldehid dan grafting dietilen triamin kitosan. Grafting dietilen triamin kitosan benzaldehid disintesis melalui pembentukan imina kitosan dengan benzaldehid diikuti dengan reaksi alkilasi dengan epiklorohidrin dan aminasi dengan dietilen triamin. Terbentuknya grafting kitosan benzaldehid didukung pada hasil FT-IR dengan munculnya bilangan gelombang 1558,48 cm-1 yang menunjukkan gugus C=C aromatik pada benzaldehid dan bilangan gelombang 1458,18 cm-1 yang menunjukkan vibrasi gugus C-N-C amin sekunder. Grafting dietilen triamin kitosan(tanpa penambahan benzaldehid) disintesis melalui alkilasi kitosan dengan epiklorohidrin dan diikuti dengan aminasi dengan dietilen triamin. Terbentuknya grafting dietilen triamin kitosan didukung pada hasil FT-IR dengan munculnya bilangan gelombang 1581,63 cm-1 yang menunjukkan gugus C-N-C amin sekunder.Hasil analisis morfologi menggunakan SEM juga menunjukkan perubahan morfologi menjadi lebih halus. Penelitian juga menunjukkan bahwa grafting dietilen triamin yang dihasilkan dapat mengadsorpsi logam pada konsentrasi 200 ppm untuk ion logam Cu sebesar 72,008 ppm, untuk ion logam Zn sebesar 67,000 ppm dan untuk ion logam Fe sebesar 63,900 ppm. Untuk adsorpsi grafting dietilen triamin kitosan benzaldehid konsentrasi 200 ppm untuk logam Cu sebesar 45,503 ppm, untuk ion logam Zn sebesar 31,300 dan untuk ion logam Fe sebesar 46,400 ppm.
Kata Kunci : Kitosan, Dietilen Triamin, Dietilen Triamin Kitosan, Adsorpsi, logam.
Synthesis a New Chitosan Derivatives with Epichlorohydrin and Diethylene Triamine and its application for Cu2+, Zn2+and Fe2+ Adsorption
ABSTRACT
The chitosan derivatives were synthesized through Schiff base formation and alkylation using diethylene triamine and epichlorohydrin, with and without the presence of benzaldehyde. The first derivative product was chitosan benzaldehyde grafted diethylene triamine, that obtained by Schiff base formation between chitosan and benzaldehyde that followed by alkylation using epichlorohydrin and amination with diethylene triamine. The formation of chitosan benzaldehyde grafted diethylene triamine was supported by the FT-IR result with the presence of several bands at 1558 and 1458 cm-1 which assigned to vibration of C=C aromatic groups (benzaldehyde) and C-N-C secondary amine groups, respectively. While the second derivative product was synthesized in the similar way as the first derivative but without the Schiff base formation. The FT-IR spectrum confirmed the successful of synthesizing chitosan grafted diethylene triamine by the presence of specific band at 1581 cm-1 that assigned to the vibration of C-N-C groups. The morphological analysis showed the film’s surfaces become smoother. As an adsorbent, the first derivative product exhibited a lower adsorption capacity for three kind of metal ions, i.e. Cu2+ 45,503 ppm, Zn2+ 31,300 ppm, and Fe2+ 46,400 ppm. While for the second derivative product was 72,008 ppm, 67,000 ppm, and 63,900 ppm for Cu2+, Zn2+, and Fe2+, respectively.
Keywords: Chitosan, Diethylene Triamine, Chitosan grafted Diethylene Triamine, Adsorption, metals.
PRAKATA
Puji dan syukur penulis sampaikan kepada Tuhan Yang Maha Esa buat semua kasih karuniaNya sehingga penulis dapat menyelesaikan penyusunan tesis ini dengan baik. Adapun tesis ini dengan judul “ Sintesis Turunan Kitosan melalui Reaksi antara Kitosan dengan Epiklorohidrin dan Dietilen Triamin serta Pengujian Adsorpsi terhadap ion logam Cu2+, Zn2+ dan Fe2+” merupakan salah satu syarat untuk untuk memperoleh gelar Magister Sains pada Program Pasca Sarjana Kimia FMIPA USU.
Keberhasilan dari penelitian dan penulisan tesis ini tidak terlepas dari bantuan berbagai pihak yang terlibat secara langsung maupun tidak langsung. Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada :
1. Rektor Universitas Sumatera Utara,Prof.Dr.RuntungSitepu S.H, M.Hum atas kesempatan yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program Magister Sains.
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara, Prof.Dr.Kerista Sebayang M.S atas kesempatan yang diberikan kepada penulis untuk menjadi mahasiswa Program Magister Sains pada Sekolah Pasca Sarjana Universitas Sumatera Utara.
3. Bapak Prof.Dr.Jamaran Kaban M.Sc dan Bapak Dr.Mimpin Ginting M.S selaku Komisi Pembimbing yang dengan begitu sabar membimbing dan memberikan arahan kepada penulis sehingga dapat menyelesaikan penelitian dan tesis ini.
4. Ketua Program Studi Magister,Prof.Dr.Thamrin,M.Sc dan Sekretaris Program Studi Magister Dr.Andriyani M.Si serta seluruh Staf Pengajar Program Studi Magister Kimia Sekolah Pasca Sarjana Universitas Sumatera Utara atas ksempatan dan bantuan selama mengikuti Program Pendidikan Magister.
5. Suami penulis, Dykson Enrico Manahara Hutapea serta anak kami yang sangat kami kasihi, Jose Isaac Martuahara Hutapea yang selalu memberikan semangat dan cinta yang luar biasa besar dalam menyelesaikan penelitian dan tesis ini serta orangtua penulis yang tidak henti hentinya mendoakan anaknya dalam menyelesaikan tesis ini.
6. Rekan-Rekan Mahasiswa Magister Sekolah Pasca Sarjana Kimia stambuk 2017 : Putri Rizky, Rina Ridara, Fani, Kak Intan, Kak Ayu dan seluruh teman-teman yang sama-sama berjuang dalam menyelesaikan perkuliahan, penelitian dan penulisan tesis ini. Serta kepada Dr.I Putu Mahendra yang selalu meluangkan waktunya untuk berdiskusi demi kebaikan tesis ini.
7. Adek-adek asisten di Laboratorium Organik yang membantu penyelesaian penelitian ini dengan baik. Terimakasih buat semuanya.
Penulis berharap dan berdoa kepada Tuhan Yang Maha Esa agar dapat membalas segala kebaikan yang telah Bapak/Ibu berikan kepada penulis. Penulis menyadari bahwa tesis ini masih banyak kekurangan. Oleh karena itu, diharapkan kritik dan saran yang bersifat membangun demi kesempurnaan tesis ini. Akhir kata, semoga tesis ini bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan di masa yang akan datang.
Medan, 21 Oktober 2019
Dewi Regina Silitonga
DAFTAR ISI
Halaman
PENGESAHAN TESIS i
PENETAPAN PANITIA PENGUJI ii
ABSTRAK iii
ABSTRACT iv
PRAKATA v
DAFTAR ISI vii
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xiii
DAFTAR SINGKATAN xiv
BAB 1 PENDAHULUAN
1.1 Latar Belakang 1
1.2 Perumusan Masalah 3
1.3 Tujuan Penelitian 3
1.4 Manfaat Penelitian 3
1.5 Lokasi Penelitian 4
1.6 Metodologi Penelitian 4
BAB 2 TINJAUAN PUSTAKA
2.1 Kitin 5
2.2 Kitosan 7
2.2.1 Sifat-Sifat Kitosan 8
2.2.1.1 Sifat Fisika 8
2.2.1.2 Sifat Kimia 9
2.2.2 Manfaat Kitosan 15
2.3 Epoksida 16
2.4 Dietilen Triamin 18
2.5 Adsorpsi 19
2.5.1 Faktor-Faktor yang mempengaruhi Adsorpsi 19
2.5.2 Proses Adsorpsi 21
2.6 Logam Berat 22
2.6.1 Logam Tembaga (Cu) 24
2.6.2 Logam Seng (Zn) 25
2.6.3 Logam Besi (Fe) 26
2.7 Senyawa Kompleks 27
2.8 Grafting (Polimer Cangkok) 29
2.8.1 Metode-Metode Grafting 30
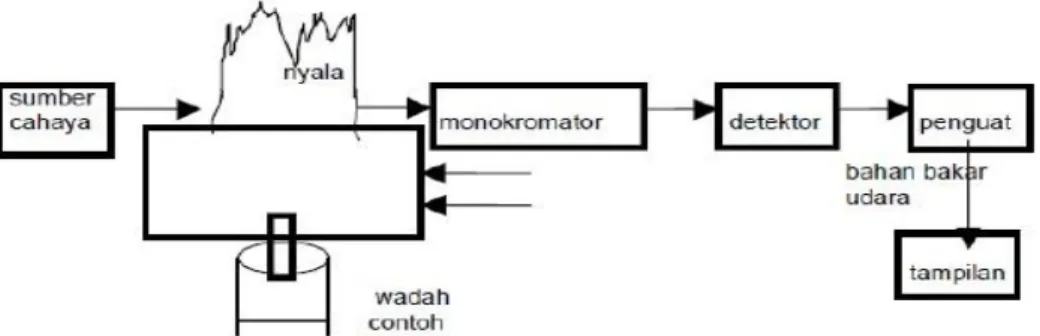
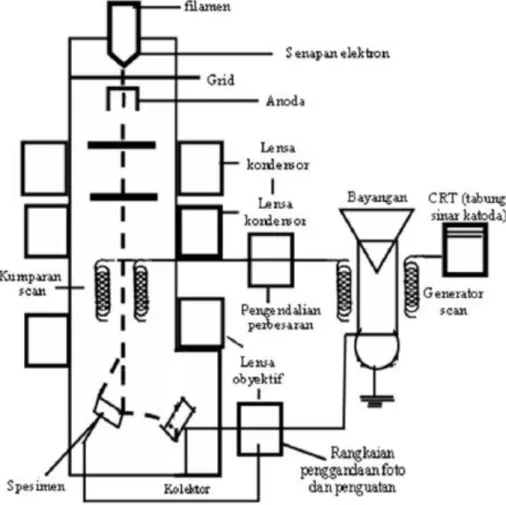
2.9 Spektrofotometer Serapan Atom (SSA) 32 2.10 Analisa Morfologi dan Pengujian SEM 35
BAB 3 METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian 37
3.2 Alat dan Bahan 37
3.2.1 Alat-Alat 37
3.2.2 Bahan-Bahan 37
3.3 Prosedur Penelitian 38
3.3.1 Sintesis Kitosan Benzaldehid 38 3.3.2 Sintesis Epoksi Kitosan Benzaldehid 38 3.3.3 Kitosan Benzaldehid Grfating Dietilen 38
Triamin
3.3.4 Sintesis Epoksi Kitosan (tanpa penambahan 38 Benzalehid
3.3.5 Kitosan grafting Dietilen Triamin (tanpa 39 penambahan benzaldehid)
3.3.6 Karakterisasai Hasil Reaksi 39 3.3.6.1 Analisis dengan Spektrofotometer FT-IR 39
3.3.6.2 Analisis SEM 39
3.3.7 Pengujian Adsorpsi terhadap ion logam 39 3.3.7.1 Adsorpsi ion logam tembaga (Cu) 39 3.3.7.2 Adsorpsi ion logam Seng (Zn) 40 3.3.7.3 Adsorpsi ion logam Besi (Fe) 40
3.4 Bagan Penelitian 41
3.4.1 Sintesis Kitosan Benzaldehid 41 3.4.2 Sintesis Epoksi Kitosan Benzaldehid 42 3.4.3 Kitosan Benzaldehid Grafting DETA melalui 43
reaksi aminasi dengan dietilen triamin
3.4.4 Sintesis Epoksi Kitosan 44 3.4.5 Kitosan grafting DETA melalui reaksi 45
aminasi dengan dietilen triamin (tanpa penambahan benzaldehid)
3.4.6 Pengujian Adsorpsi terhadap ion logam 46 3.4.6.1 Adsorpsi ion logam tembaga (Cu) 46 3.4.6.2 Adsorpsi ion logam seng (Zn) 47 3.4.6.3 Adsorpsi ion logam besi (Fe) 48
BAB IV HASIL DAN PEMBAHASAN
4.1 Kitosan Benzaldehid Grafting Dietilen Triamin 49 4.2 Kitosan Grafting Dietilen Triamin 55
4.3 Analisis Morfologi SEM 60
4.4 Pengujian Adsorpsi terhadap ion logam 62 4.4.1 Adsorpsi ion logam Tembaga (Cu) 62 4.4.2 Adsorpsi ion logam Seng (Zn) 65 4.4.3 Adsorpsi ion logam besi (Fe) 68 BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan 74
5.2 Saran 75
DAFTAR PUSTAKA 76
LAMPIRAN 83
DAFTAR TABEL
Nomor Judul Halaman
Tabel
2.1 Serapan FT-IR karakteristik kitin dan kitosan 8 2.2 Pencemaran utama dari logam dan sumbernya di 23
alam
4.1 Data absoransi larutan seri standard ion tembaga (Cu) 59 4.2 Hasil pengukuran adsorpsi terhadap ion logam tembaga 60
(Cu)
4.3 Data absorbansi larutan seri standard seng (Zn) 62 4.4 Hasil pengukuran adsorpsi terhadap ion logam seng (Zn) 63 4.5 Data absorbansi larutan seri standard ion besi (Fe) 66 4.6 Hasil pengukuran adsorpsi terhadap ion logam besi (Fe) 67
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
2.1 Struktur kitin 5
2.2 Struktur kitosan 7
2.3 Reaksi pembentukan N-Suksinil kitosan 9
2.4 Reaksi pembentukan O-Laurat kitosan 10
2.5 Reaksi pembentukan N,O asilasi kitosan 11
2.6 Reaksi alkilasi kitosan 11
2.7 Reaksi pembentukan N,O kitosan sulfat 12
2.8 Reaksi pembentukan karboksimetil kitosan 12 2.9 Reaksi pembentukan basa Schiff kitosan 13
2.10 Reaksi pembentukan aldimin kitosan 13
2.11 Reaksi pembentukan kitosan fosfat 14
2.12 Reaksi pembentukan epoksida 16
2.13 Sintesa epiklorohidrin melalui jalur alil klorida dan jalur 17 dikloropropanol
2.14 Tahapan umum atomisasi yang terjadi pada SSA 30
2.15 Skema umum komponen pada alat SSA 31
2.16 Skema peralatan SEM 33
4.1 Spektrum FT-IR kitosan benzaldehid 45
4.2 Spektrum FT-IR epoksi kitosan benzaldehid 46 4.3 Spektrum FT-IR kitosan grafting dietilen triamin 47 4.4 Mekanisme reaksi pembentukan kitosan benzaldehid 48 4.5 Mekanisme reaksi pembentukan epoksi kitosan 49
benzaldehid
4.6 Mekanisme reaksi pembentukan kitosan benzaldehid 50 grafting dietilen triamin
4.7 Spektrum FT-IR epoksi kitosan 51
4.8 Mekanisme reaksi pembentukan epoksi kitosan 52 4.9 Spektrum FT-IR kitosan grafting 0,5 Dietilen triamin 53 4.10 Spektrum FT-IR kitosan grafting 1,0 Dietilen triamin 53 4.11 Spektrum FT-IR kitosan grafting 1,5 Dietilen triamin 54 4.12 Grafik spektrum FT-IR kitosan, kitosan benzaldehid, 55
epoksi kitosan benzaldehid, kitosan benzaldehid grafting dietilen triamin, epoksi kitosan, kitosan grafting 0,5 DETA kitosan grafting 1,0 DETA dan kitosan grafting 1,5 DETA
4.13 Mekanisme reaksi pembentukan grafting dietilen triamin 55 kitosan.
4.14 Hasil SEM dengan perbesaran 1000 kali dan 2000 kali 57 4.15 Kurva kalibrasi larutan seri standard Cu2+ 58 4.16 Kurva % terserap terhadap ion logam tembaga (Cu2+) 60 4.17 Struktur kompleks grafting DETA dengan ion logam Cu2+ 60 4.18 Struktur kompleks kitosan benzaldehid grafting DETA 61
dengan logam Cu2+
4.19 Kurva kalibrasi larutan seri standard Zn2+ 62 4.20 Kurva % terserap terhadap ion logam seng (Zn2+) 63 4.21 Struktur kompleks grafting DETA dengan ion logam Zn2+ 64 4.22 Struktur kompleks kitosan benzaldehid grafting DETA 64
dengan logam Zn2+
4.23 Kurva kalibrasi larutan seri standard Fe2+ 64 4.24 Kurva % terserap terhadap ion logam besi (Fe2+) 66 4.25 Struktur kompleks grafting DETA dengan ion logam Fe2+ 67 4.26 Struktur kompleks kitosan benzaldehid grafting DETA 68
dengan logam Fe2+
4.27 Kurva perbandingan % terserap terhadap ion logam Cu2+, 69 Zn2+ dan Fe2+
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
1 Perhitungan pembuatan larutan induk dan 81 larutan seri standard Cu2+, Zn2+ dan Fe2+
2 Perhitungan % terserap dari kitosan, kitosan 82 benzaldehid grafting dietilen triamin dan
kitosan grafting dietien triamin (DETA)
3 Spektrum FT-IR kitosan 83
4 Spektrum FT-IR kitosan benzaldehid 84 5 Spektrum FT-IR epoksi kitosan benzaldehid 85 6 Spektrum FT-IR kitosan benzaldehid grafting 86
dietilen triamin
7 Spektrum FT-IR epoksi kitosan 87 8 Spektrum FT-IR kitosan grafting dietilen 88
Triamin 0,5
9 Spektrum FT-IR kitosan grafting dietilen 89 Triamin 1,0
10 Spektrum FT-IR kitosan grafting dietilen 90 Triamin 1,5
DAFTAR SINGKATAN
FT-IR = Fourier Transform Infrared Spectrorcopy SSA = Spektrofotometer Serapan Atom
SEM = Scanning Electron Microscopy DETA = Dietilen Triamin
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan salah satu negara berkembang dimana sektor industri dijadikan prioritas oleh pemerintah.Meningkatnya pertumbuhan pabrik-pabrik ini tidak jarang memberikan dampak negatif bagi lingkungan yakni menghasilkan limbah yang berupa polutan padat dan cair diperairan yang berbahaya bagi kehidupan (Cahayaningrum et al.,2011). Pada penelitian Laksono et al (2008) di dalam limbah biasanya dijumpai lebih dari satu macam logam misalnya limbah industri pengecetan logam (perchrom) menghasilkan limbah cair yang mengandung ion logam tembaga (Cu), besi (Fe), kromium (Cr), nikel (Ni) dan Seng (Zn).
Tembaga (Cu) merupakan salah satu jenis logam berat yang berbahaya karena dapatmenyebabkan gangguan saluran pernafasan khususnya menimbulkan kerusakan pada selaput lendir yang berhubungan dengan hidung (Palar,2004).
Berdasarkan sudut pandang toksikologi, logam Zn termasuk jenis logam berat esensial yang dalam jumlah tertentu dibutuhkan oleh manusia. Akan tetapi dalam jumlah yang berlebihan akan menimbulkan racun(Ariyani et al.,2018). Besi merupakan unsur yang terdapat dalam hemoglobin, 5% diantaranyaterdapat dalam otot (mioglobin) dan kurang dari 1% terdapat dalam sel tubuh sebagai bagian dari oksido-reduktase.Namun apabila organ dalam manusia terpapar logam besi (Fe) pada konsentrasi tinggi dapat menyebabkan kerusakan pada usus, iritasi mukosa lambung utamanya pada saat perut dalam keadaan kosong (Syntia et al.,2012).
Beberapa metode yang dapat digunakan untuk menurunkan konsentrasi ion logam dalam limbah cair diantaranya adalah pengendapan, resin penukar ion, filtrasi dan adsorpsi (Tangio, 2013). Metode adsorpsi merupakan salah satu metode yang sering digunakan karena adsorpsi merupakan metode yang lebih efektif karena operasinya mudah, efisiensi tinggi, biaya rendah dan regenerasinya mudah (Nisyafati et al., 2017). Adsorpsi adalah teknik fisika-kimia yang melibatkan perpindahan massa antara fase cair dan padat (Chen dan Wang, 2011). Metode tersebut dapat dilakukan dengan memanfaatkan polimer alam (biopolimer) sebagai adsorben dengan salah satunya yaitu kitosan (Schumul et al., 2001).
Kitosan adalah polisakarida biokompatibel yang diperoleh dari deasetilasi kitin dan poli [β-(1,4)-2-amino-2-deoksi-D-glukopironosa]. Material ini telah banyak digunakan dalam bidang biomedis dan farmasetika karena sifatnya yang biodegradabel, biokompatibel dan tidak beracun (Adriana et al.,2003). Kitosan merupakan polimer alami yang memiliki gugus aktif yaitu gugus amina (– NH2) dan gugus hidroksil (–OH) (Sugita et al., 2009). Gugus amina bebas pada kitosan bersifat polikationik inilah yang mempunyai kemampuan untuk mengikat logam (Lasindrang, 2014). Berbagai modifikasi kimia terhadap amina dan hidroksil pada kitosan dapat meningkatkan stabilitas dalam media asam terutama mengurangi kelarutan dalam asam organik dan mineral (Guibal, 2004).
Penggunaan kitosan secara langsung sebagai adsorben kurang efektif karena mudah larut dalam asam asetat dan terlarut sebagian dalam HNO3, HCl dan lain sebagainya. Untuk mengatasinya maka dilakukan modifikasi terhadap kitosan.
Penggunaan kitosan yang telah dimodifikasi akan memberikan keuntungan diantaranya kitosan dapat digunakan secara berulang pada proses adsorpsi dan kestabilan kitosan menjadi lebih tinggi. Apabila senyawa aminaditambahkan ke dalam kitosan maka akan membentuk struktur ganda senyawa kitosan dan amina.
Turunan kitosan ini akan memiliki lebih banyak gugus aminadanhal ini berdampak pada adsorpsi yang lebih kuat karena adanya ikatan baru sehingga selektivitas dan stabilitas adsorpsi dapat meningkat (Hirosi et al., 2008). Turunan kitosan ini akan memiliki aplikasi luas dalam proses pemisahan dan penurunan konsentrasi ion logam dari larutan.
Beberapa peneliti sebelumnya yaitu Yi et al.,(2006) mensintesis epoksi dietilen triamin (DETA) kitosan serta membandingkan kapasitas dari kitosan ikat silang dan epoksi dietilen triamin kitosan dalam mengadsorpsi ion logam Pd2+, Ag+, Ni2+, Cu2+, Cd2+dan Co2+. Yan et al (2013) melakukan preparasi dan sifat adsorpsi kitosan butiran yang dimodifikasi dengan dietilen triamin untuk adsorpsi pewarna asam. Nisfayati et al (2017) melakukan ikat silang epiklorohidrin dengan kitosan untuk menguji sifat mekanik dan daya serap sebagai adsorben. Sirumapea et al (2015) melakukan sintesis dan karakterisasi senyawa antibakteri dari kompleks Fe (III) dengan derivat basa Schiff.
Berdasarkan uraian diatas, pada penelitian ini telah dilakukan sintesis senyawa kitosan yang tergrafting dengan dietilen triamin (DETA) yang terjadi melalui alkilasi dengan epiklorohidrin dan aminasi dengan dietilen triamin (DETA) serta pengujian adsorpsi terhadap ion logam Cu2+, Fe2+ dan Zn 2+.
1.2 Perumusan Masalah
1. Bagaimana melakukan sintesis senyawa kitosan grafting dietilen triamin yang dihasilkan melalui pembentukan imina terhadap kitosan dengan benzaldehid diikuti alkilasi dengan epiklorohidrin dan aminasi dengan dietilen triamin?
2. Bagaimana melakukan sintesis senyawa kitosan grafting dietilen triamin melalui alkilasi dengan epiklorohidrin diikuti aminasi dengan dietilen triamin.
3. Bagaimana hasil uji adsorpsi dari kitosan grafting dietilen triamin yang diperoleh melalui tahap alkilasi dengan epiklorohidrin diikuti dengan aminasi dengan dietilen triamin dan kitosan grafting dietilen triamin yang terbentuk dari pembentukan imina terhadap kitosan dengan benzaldehid diikuti dengan alkilasi dan aminasi terhadap ion logam Cu2+, Zn2+ dan Fe2+.
1.3 Tujuan Penelitian
1. Untuk melakukan sintesis terhadap kitosan melalui pembentukan imina kitosan dengan benzaldehid diikuti dengan alkilasi dengan epiklorohidrin dan aminasi dengan dietilen triamin?
2. Untuk melakukan sintesis terhadap kitosan melalui alkilasi kitosan dengan epiklorohidrin diikuti dengan aminasi dengan dietilen triamin.
3. Untuk mengetahui hasil adsorpsi senyawa kitosan grafting dietilen triaminyang dihasilkan melalui tahap alkilasi dengan epiklorohidrin diikuti dengan aminasi dengan dietilen triamin dan kitosan grafting dietilen triaminyang terbentuk dari pembentukan imina terhadap kitosan dengan benzaldehid diikuti dengan alkilasi dan aminasi terhadap ion logam Cu2+, Zn2+ dan Fe2+.
1.4. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat dijadikan sebagai sumber informasi mengenai reaksi sintesis pembentukan kitosan grafting dietilen triamin melalui rekasi alkilasi dengan epiklorohidrin dan diikuti dengan aminasi dengan dietilen triamin sehingga dapat dimanfaatkan sebagai pengadsorpsi terhadap logam berat.
1.5. Lokasi Penelitian
Penelitian ini dilakukan dilabratorium Kimia Organik FMIPA USU. Analisis gugus fungsi menggunakan spektrofotometer FT-IR dilakukan dilaboratorium Organik FMIPA UGM. Analisis morfologi permukaan menggunakan Scanning Electron Microscopy (SEM) dilakukan dilaboratorium Fisika Unimed. Uji adsorpsi dilakukan di Balai Riset dan Standarisasi Industri Medan (Baristan).
1.6. Metodologi Penelitian
Adapun metodologi pada penelitian ini adalah
1. Penelitian ini dilakukan secara eksperimen didalam laboratorium.
2. Pembentukan imina kitosan dilakukan dengan mereaksikan kitosan dengan benzaldehid dan hasilnya diuji dengan spektrofotometer FT-IR.
3. Alkilasi dilakukan dengan mereaksikan kitosan benzaldehid yang terbentuk dengan epiklorohidrin dan hasilnya diuji dengan spektrofotometer FT-IR 4. Sintesa senyawa kitosan grafting DETA dilakukan dengan mereaksikan hasil
alkilasi kitosan dengan dietilen triamin dan hasilnya diuji dengan spektrofotometer FT-IR.
5. Uji morfologi permukaan dari kitosan grafting DETA menggunakan SEM (Scanning Electron Microscopy).
6. Uji adsorpsi dari kitosan grafting DETA terhadap ion logam Cu2+, Zn2+ dan Fe2+menggunakan spektrofotometer serapan atom ( SSA).
BAB 2
TINJAUAN PUTAKA
2.1 Kitin
Kitin pertama kali ditemukan oleh Henry Bracanot pada tahun 1811 dalam residu ekstrak jamur yang dinamakan fungi. Kemudian Odiers pada tahun 1823, mengisolasi suatu zat dari sari kutikula serangga jenis elytra dan mengusulkan nama kitin. Kata kitin berasal dari bahasa Yunani, yaitu “kiton” yang berarti baju rantai besi (Rudall dan Kenchington ,1973). Penamaan ini sesuai dengan fungsinya sebagai jaket pelindung untuk hewan-hewan golongan invertebrata. Kitin merupakan polimer alam terbanyak di dunia setelah selulosa (Yanming et al., 2001), yang banyak terdapat di eksoskeleton atau kutikula pada kelompok hewan crustacea, serangga, fungi, dan moluska (Kusumaningsih, 2004). Keberadaan kitin di alam umumnya tidak berdiri sendiri tetapi bergabung dengan senyawa lain seperti protein, mineral dan pigmen.
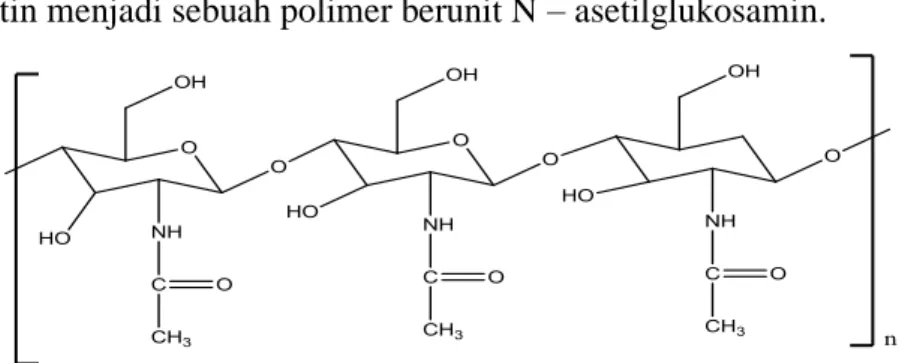
Kitin adalah kelompok karbohidrat yang tergolong struktural homoglicans yang tersusun atas monomer-monomer N-asetil glukosamin (2-asetamida-2-deoksi- D-Glukosa) (Hortonet al., 2002). Monomer-monomer kitin ini terikat oleh ikatan glikosida pada posisi β (1-4). Struktur molekul kitin berupa rantai lurus panjang yang mirip dengan selulosa dan hanya berbeda pada gugus yang terikat di posisi atom karbon nomor 2. Pada selulosa, gugus yang terikat pada atom karbon nomor 2 adalah gugus hidroksil (OH), sedangkan pada kitin adalah gugus asetamida (NHOCH3) sehingga kitin menjadi sebuah polimer berunit N – asetilglukosamin.
Gambar 2.1. Struktur Kitin (Murray et a.l, 2003)
Kitin merupakan suatu polisakarida yang dapat terdegradasi dan bersifat tidak beracun sehingga banyak dimanfaatkan pada berbagai bidang (Purwanti, 2014).
Kandungan kitin dari limbah udang yang terdiri dari (kepala, kulit dan ekor) mencapai 50% dari berat udang. Limbah kulit udang mengandung tiga komponen utama yaitu protein (25%- 44%), kalsium karbonat (45%-50%), dan kitin (15%-20%) (Azharet al., 2010). Produksi kitin biasanya dilakukan dalam tiga tahap yaitu deproteinasi, demineralisasi dan depigmentasi.
1.Tahap Deproteinasi
Deproteinasi merupakan tahap awal dari isolasi kitin. Deproteinasi bertujuan mengurangi kadar protein dengan menggunakan larutan alkali encer dan pemanasan yang cukup (Yunizal et al., 2001). Larutan alkali encer yang digunakan seperti NaOH dan KOH. Namun lebih sering digunakan NaOH karena lebih mudah dan efektif. Larutan NaOH digunakan untuk melarutkan protein yang terkandung di dalam kulit udang (Eka, 2007) Efektifitas prosesnya tergantung pada suhu dan konsentrasi NaOH yang digunakan.
2.Tahap Demineralisasi
Demineralisasi dimaksudkan untuk mengurangi kadar mineral (CaCO3) dengan menggunakan asam konsentrasi rendah seperti asam klorida, untuk mendapatkan kitin (Yunizal et al., 2001). Mineral organik yang terikat pada bahan dasar, yaitu CaCO3 sebagai mineral utama dan Ca3(PO4)2 dalam jumlah minor.
Menurut Hartati (2002) pada proses demineralisasi perbandingan antara pelarut dan cangkang udang adalah 6 : 1. Selanjutnya diaduk sampai merata dan didiamkan selama 13 jam. Kemudian dipanaskan pada suhu 90°C selama satu jam. Larutan lalu disaring dan didinginkan sehingga diperoleh residu padatan yang kemudian dicuci dengan air sampai pH netral dan dikeringkan pada suhu 80°C selama 24 jam atau dijemur sampai kering. Kitin dari hasil isolasi berbentuk serbuk maupun serpihan.
Menurut (Fernandez, 2004), proses demineralisasi dapat dijalankan dengan melakukan ekstraksi memakai larutan asam klorida 1N pada suhu ruangan selama 30 menit dengan perbandingan antara kulit atau cangkang yang diproses dengan larutan HCl adalah 1:15 (g/mL). Efektivitas penghilangan mineral pada proses demineralisasi ini dapat dilihat menggunakan parameter kadar abu. Pada penelitiannya, proses demineralisasi menghasilkan produk dengan kadar abu 31 – 36%.
3.Tahap Depigmentasi
Tahap depigmentasi yaitu tahap penghilangan warna terjadi setelah tahap demineralisasi. Hasil dari proses depigmentasi disebut kitin. Tahap depigmentasi ini dapat dilakukan dengan mengekstrak endapan hasil demineralisasi dengan acton dan dibleaching dengan 0.315 NaOCl (w/v) selama 5 menit pada suhu kamar.
Perbandingan solid : solven 1 : 10 (w/v) (Hargono et al., 2008). Tahap ini dapat dilewati karena sangat dipengaruhi oleh jenis udang, apabila produk yang dihasilkan pada tahap demineralisasi sudah mengalami penghilangan warna akibat dari proses pemisahan mineral oleh HCl. Penghilangan warna ditunjukkan dengan adanya perubahan warna dari merah orange mendekati putih.Untuk mengubah kitin menjadi kitosan dilakukan deasetilasi (Emma et al.,2010).
2.2.KITOSAN
Kitosan adalah suatu rantai linear dari D-Glukosamin dan N-Asetil D- glukosamin yang terangkai pada posisi β(1-4).Kitosan dihasilkan dari deasetilasi kitin. Karena dalam bentuk kationik, bentuk kitosan yang tidak larut dalam air akan membentuk polielektronik dengan anion polielektrolit. Kitosan telah digunakan dalam bidang biomedikal dan farmasi karena kitosan bersifat biokompatibel,biodegradasi dan tidak beracun (Adriana et al.,2003).
Gambar 2.2. Struktur Kitosan (Murray et al., 2003)
Proses deasetilasi kitin menggunakan larutan NaOH pekat bertujuan untuk mengubah gugus asetil dari kitin menjadi gugus amina pada kitosan. Perubahan ini dapat dideteksi dengan melihat perubahan spektrum IR kitin dengan hasil deasetilasinya pada panjang gelombang tertentu yang karakteristik. Gugus fungsi yang karakteristik dari spektra FT-IR kitin dan kitosan dapat dilihat pada Tabel 2.1 (Gyliene et al., 2003)
Tabel 2.1. Serapan FT-IR karakteristik untuk kitin dan kitosan
Jenis Vibrasi Bilangan Gelombang (cm-1) Kitin Kitosan
OH streching 3500 3345, 3340
NH (-NH2) streching - 3400
NH (-NHCOCH3) streching 3265,3100 -
CH(CH3) streching 2961(lemah) -
CH(-CH2-) streching asym 2928 2926
CH(-CH2-) streching sym 2871 2864
C=O (-NHCOCH3) streching 1655 1650 (lemah)
NH (-NHCOCH3-) bending 1560 -
CN (-NHCOCH3-) streching 1310 -
NH (R-NH2) bending - 1596
CN streching - 1200-1020
CH (-CH2-) bending asym 1426 1418
CH (-CH2-) bending sym 1378 1377
C-O (-C-O-C-) streching asym 1077 1082
C-O (-C-O-C-) streching sym 1024 1033
2.2.1. Sifat- Sifat Kitosan 2.2.1.1. Sifat Fisika
Secara fisik kitosan tidak berbau, berupa padatan amorf berwarna putih kekuningan dengan rotasi sfesifik [α]D 11 -3 hingga -10o (pada konsentrasi asam astat 2 %). Kitosan tidak larut dalam air, alkohol dan aseton. Polimer kitosan dengan berat molekul tinggi, didapati memiliki viskositas yang baik dalam asam. Bersifat hidrofilik, menahan air dalam strukturnya dan membentuk gel secara spontan.
Pembentukan gel berlangsung pada pH < 6 dan sedikit asam, disebabkan bersifat polielektrolit kationik dari kitosan. Viskositas gel kitosan meningkat dengan meningkatnya berat molekul atau jumlah polimer. Penurunan pH akan meningkatkan viskositas, yang disebabkan konformasi kitosan yang telah mengembang, karena daya repulsive di antara gugus-gugus amino bermuatan positif. Viskositas juga meningkat dengan meningkatnya derajat deasetilasi. Gel kitosan teregradasi secara berangsur-angsur, sebagai mana halnya kitosan melarut (Muzarelli et al., 1997).
Kitosan hasil dari deasetilasi kitin, larut dalam asam encer seperti asam asetat dan asam formiat. Sifat fisik yang khas dari kitosan yaitu mudah dibentuk menjadi
spons, larutan, gel, pasta, membran dan serat yang sangat bermanfaat dalam aplikasinya (Kaban, 2007). Kelarutan kitosan sangat dipengaruhi oleh bobot molekul, derajat deasetilasi, dan rotasi sfesifiknya.Beragamnya rotasi sfesifik bergantung pada sumber dan metode isolasi serta transformasinya. Dalam bentuk netralnya, kitosan mampu mengkompleks ion logam berat berbahaya seperti Cu, Cr, Cd, Mn, Co, Pb, Hg, Zn, dan Pd (Sugitaet al., 2009).
2.2.1.2 Sifat Kimia
Kitosan mempunyai reaktifitas kimia yang baik karena mempunyai sejumlah gugus hiroksil (-OH) dan gugus amina (-NH2) pada rantainya yang merupakan polisakarida bersifat basa. Kebanyakan polisakarida yang terdapat didalam alam bersifat netral dan asam seperti selulosa, dekstran, peptin, asam alginat , agar dan agarose (Kumar dan Majeti, 2000).
a. N-Asil
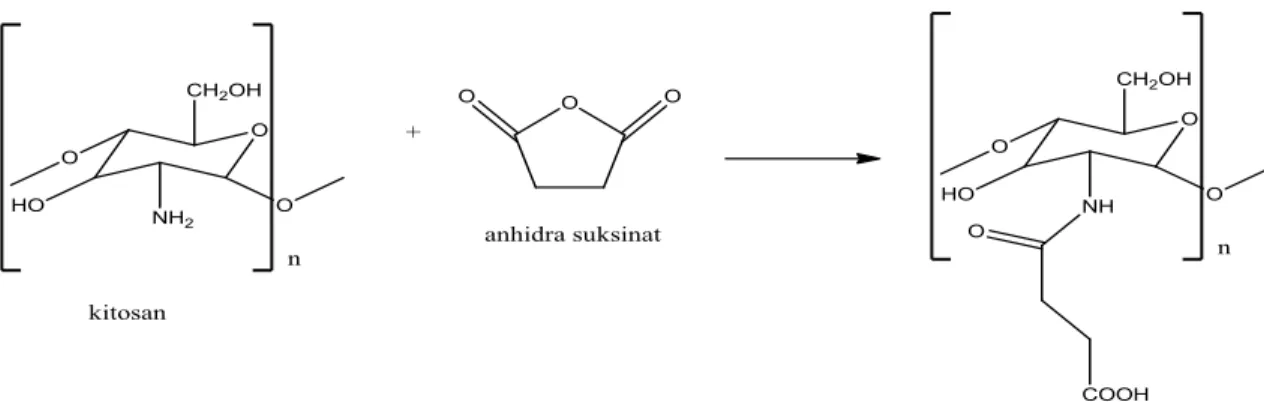
Metode yang paling sederhana adalah dengan mereaksikan asam karboksilat dengan kitosan. Pemanasan larutan kitosan dalam asam formiat 100% pada suhu 90oC dengan penambahan piridin sedikit demi sedikit untuk menghasilkan N- formilatosan serta N-Asetil dalam asetat 20%. Pereaksi yang paling banyak digunakan untuk N-Asilasi kitosan adalah asil anhidrida,baik dalam kondisi homogen dan heterogen. Sebagai contoh dapat diperoleh dari reaksi amidasi antara kitosan dan anhidrida suksinat dalam pelarut asam laktat (Kamoun, 2015).
Gambar 2.3. Reaksi pembentukan N-suksinil kitosan (Kamoun, 2015)
anhidrida suksinat
b. O-Asilasi
Gugus amino kitosan lebih reaktif daripada gugus hidroksilnya. Gugus amino perlu diproteksi selama proses asilasi untuk menghasilkan O-asil kitosan. Metode proteksi yang dilakukan antara lain melalui pembuatan basa Schiff disusul O- Asetilasi menggunakan larutan untuk mencegah hidrolisis asam dan basa Schiff.Pembuatan O-Asetil kitosan dapat juga dilakukan dengan melarutkankitosan terasetilasi dalam asam formiat 90% yang mengandung asetat anhidrida dengan HClO4 dengan asumsi protonasi akan mencegah terjadinya N-Asetilasi. N- dan O- asetilasi kitosan juga dapat diperoleh bersamaan dengan menggunakan asil klorida.
Caranya dengan merefluks kitosan dalam dodekanoil klorida berlebih-piridin- kloroform dan ditambah asam klorida sesudah direfluks selama 5 jam. Produk yang diperoleh sesudah 9 jam larut dalam kloroform, benzene, dietil eter dan piridin (Gambar 2.4)
Gambar 2.4. Reaksi Pembentukan O-Laurat Kitosan (Manalu, 2008)
c. N-O-Asilasi
N-dan O-Asilasi kitosan juga dapat diperoleh bersamaan dengan menggunakan anhidrit asam suksinat (Gambar 2.5). Dapat berlangsung dengan cara mencampurkan suksinat anhidrit kedalam campuran kitosan dalam asetat 2% dan metanol 1:1 (v/v). Dilakukan pengadukan selama 3 jam kemudian dibiarkan selama 30 menit.
O
O O
HOH2C
NH2
HO
O
O O
*
H2C
HO NH O
O
O
23 jam H2O
C O O
O
HO
O n
n 2n
kitosan
N,O-suksinil kitosan suksinat anhidrit
HO O
+
Gambar 2.5. Reaksi Pembentukan N,O-Asilasi Kitosan (Zoubi et al.,2011) d. N-Alkilasi
Metode yang paling mudah untuk N-alkilasi kitosan adalah reaksi antara kitosan dan alkil halida (Gambar 2.6) yaitu metode yang menyelidiki reaksi kitosan dengan metil-etil iodida dalam keberadaan beberapa amina tersier, piridin, dimetil piridin, trimetil piridin, dan trietilamin (Roberts, 1992).
O
O O
HOH2C
NH2
Cl
O O
*
HOH2C
NH
nHCl
n n
kitosan
2-kloro butana
N-metil etil kitosan
pyridine
OH OH *O
n CH
Gambar 2.6. Reaksi Alkilasi Kitosan (Roberts, 1992)
e. Sulfonasi
Kitosan sulfat diperoleh dengan mereaksikan kitosan dengan kloro sulfat(ClSO3H) dalam piridin (Gambar 2.7) yang dicampur selama 1 jam pada suhu 100oC. Hasil yang diberikan mengandung dua gugus sulfat setiap satu D-glukosamin anhidrid. Perlakuan lain adalah dengan menggantikan piridin dengan DMF, karena kompleks SO3-DMF melebihi DMF maka reaksi dibuat pada suhu kamar. Hasil yang diberikan mengandung satu gugus N-sulfat dan satu gugus O-sulfat dalam setiap D -glukosamin (Ginting, 2004).
O
O O
HOH2C
NH2
HO
2 nClSO3H O
O O
OH2C
HO NH HO3S
HO3S
2n HCl
n kitosan n
N,O-kitosan sulfat
Gambar 2.7. Reaksi pembentukan N,O-Kitosan Sulfat (Ginting, 2004).
f. Alkoksilasi
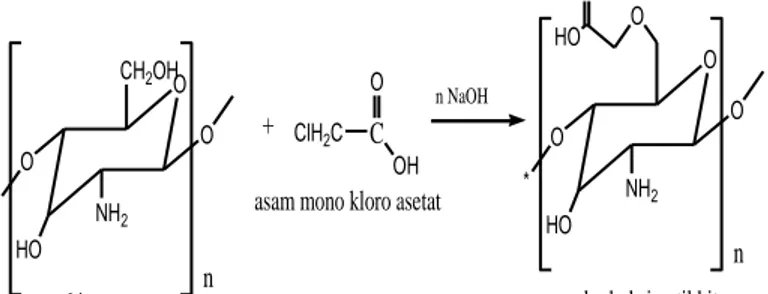
Karboksimetil kitosan diperoleh dengan mereaksikan kitosan dengan asam monokloro asetat dengan katalis natrium hidroksida (Gambar 2.8). Karboksimetil kitosan merupakan produk hasil sintesis yang diperoleh dengan cara substitusi gugus karboksimetil pada rantai glukosamin pada struktur kitosan. Senyawa ini memiliki kelarutan yang lebih tinggi dalam air daripada kitosan akibat pertambahan muatan ionik. Penelitian (Patale dan Patravale, 2011) menunjukkan selain memperbaiki kelarutan kitosan, karboksilasi juga mampu meningkatkan sifat fungsional kitosan.
Karboksimetil kitosan terbagi dalam 4 jenis senyawa yaitu N-, O-, N-O, dan N-N- KMK (Hardi et al, 2017)
CH2OHO
O
HO NH2
*
O
n
+ C
O ClH2C
OH n NaOH
O
O
HO NH2
*
O
n
O O HO
+ n H2O + NaCl
karboksimetil kitosan kitosan
asam mono kloro asetat
Gambar 2.8. Reaksi pembentukan Karboksimetil kitosan (Chen dan Park, 2003)
g. Kondensasi
Aldimin kitosan disebut juga sebagai basa Schiff kitosan. Aldimin kitosan merupakan hasil reaksi antara aldehida dengan kitosan, dimana aldehida terikat dengan gugus amina (-NH2) kitosan yang akan membentuk suatu gugus imina (- C=N) yang merupakan ciri khas terbentuknya aldimin. Aldimin juga dapat dibuat dengan mereaksikan aldehida dengan senyawa yang mengandung gugus amina siklik maupun alifatis. (Gintinget al .,2016).Turunan basa Schiff dapat diperoleh dari reaksi film kitosan dengan aldehid alifatik, bukan saja yang linear-asetaldehid kedekanal juga yang bercabang dan aldehid aromatik (Zoubi et al., 2011).
o
NH2 OH
o o
*
+ OH
O
CH3COOH 1%
55oC
o
N OH
o o
*
OH
kitosan salisilaldehid
aldimin kitosan (basa Schiff)
Gambar 2.9.Reaksi pembentukan basa Schiff kitosan (Ginting et al, 2016) Mereaksikan aldehida campuran yang merupakan hasil ozonolisis dari asam tidak jenuh dari minyak kemiri dengan anniline yang merupakan sumber amina siklik. Aldimin kitosan juga dapat dihasilkan dengan mereaksikan kitosan dengan campuran aldehida yang berasal dari hasil ozonolisis minyak kelapa sawit dengan kondisi refluks pada suhu 60oC selama 6 jam (Parry, 2013).
.
O
O O
HOH2C
NH2
HO
n
CH3COOH 1% O
O O
HOH2C
HO N
HC kitosan
aldimin kitosan (basa Schiff)
n n
CH3CHO
CH3
+ n H2O asetaldehid
Gambar 2.10. Reaksi pembentukan aldimin kitosan (Parry, 2013)
h. Kitosan posfat
Dapat dilakukan dengan melarutkan kitosan kedalam larutan NaOH 45%
selama 2 jam. Kemudian direaksikan dengan dietil kloroposfat 97%, dan diperoleh O-dietil posfat kitosan (Ginting, 2004).
O
O O
HOH2C
NH2 HO
O
O O
NaOH2C
NH2 NaO
O
O O
OH2C
NH2
O
n NaOH
n Cl-P(OCH2CH3)2 O
P O
OCH2CH3 OCH2CH3
P
H3CH2CO OCH2CH3
O
n n
n
n NaCl kitosan
o- dietil fospat kitosan
Gambar 2.11. Reaksi Pembentukan Kitosan Posfat (Ginting, 2004)
Karena kitin dan kitosan merupakan bahan alam maka keduanya lebih bersifat biokompatibel dan biodegradabel dibanding dengan polimer sintetik. Kitin dan kitosan serta senyawa turunannya telah banyak diaplikasikan dalam berbagai industri. Nilai total perdagangan bahan-bahan tersebut pada tahun 2002 mencapai 112 trilyun rupiah (Toharisman, 2007).
Kitosan merupakan kerangka heksosa yang memiliki gugus amin bermuatan, sehingga menunjukkan sifat yang unik yaitu bermuatan positif, berlainan dengan polisakarida alam lainnya yang bermuatan negatif atau netral. Boddu dan Smith (1999) menyatakan bahwa muatan positif pada polimer kitosan mengakibatkan afinitas atau daya tarik menarik yang sangat baik dengan suspense dalam cairan selulosa dan polimer glikoprotein. Mengingat banyak bahan memiliki gugus negatif misal protein, anion polisakarida, asam nukleat dan lain-lain. Maka gugus kitosan berpengaruh kuat dengan gugus negatif sehingga membentuk ion netral. Kekuatan ion berpengaruh terhadap struktur kitosan, dengan kata lain peningkatan kekuatan
ion meningkatkan sifat kekakuan matriks kitosan, daya gembung dan ukuran pori- pori matriks. Sementara porositas granula dari kitosan berpengaruh terhadap peningkatan keaktifan grup-grup amino terhadap kitosan(Suhartono, 2006).
2.2.2. Manfaat Kitosan
Kitin dan kitosan memiliki kegunaan yang sangat luas dalam kehidupan sehari-hari misalnya sebagai adsorben limbah logam berat dan zat warna, pengawet, anti jarnur, kosmetik, farmasi, flokulan, anti kanker dan anti bakteri (Prashanth dan Tharanathan, 2007). Selain itu kitosan sendiri memiliki beberapa manfaat bagi manusia, sehingga merupakan bahan perdagangan yangmemiliki nilai ekonomi yang tinggi. Manfaat kitosan antara lain adalah :
1. Dalam bidang pertanian, kitosan menawarkan alternatif alami dalam penggunaan baban kimia yang terkadang berbahaya bagi lingkungan dan manusia. Kitosan membuat mekanisme pertabaoan pada tumbuhan (seperti vaksin bagi manusia), menstimulasi pertumbuhan dan merangsang enzim tertentu (sintesa fitoaleksin kitinase, pectinase, glucanase dan lignin): Pengontrol organik baru ini menawarkan pendekatan sebagai alat biokontrol
2. Dalam bidang pengolahan air, kitosan dapat dimanfaatkan sebagai baban baku pembuatan membran ultrafiltrasi
3. Dalam bidang makanan, kitosan sudah banyak digunakan dalam komposisi makanan di Jepang, Bropa dan Amerika Serikat, sebagai perangkap lemak yang merupakan terobosan dalam bidang diet.
4. Dalam bidang kesehatan, kitosan digunakan untuk bakteriostatik, immunologi, anti tumor, cicatrizant, homeostatic dan anti koagulan, obat salep untuk luka, ilmu pengobatan mala, ortopedi dan penyembuban jahitan akibat pembedahan (Kusumawati,2009)
Sifat polikationik kitosan menjadi dasar pemanfaatan kitosan dalam berbagai bidang. Kitosan dimanfaatkan dalam bidang pertanian karena sifatnya yang biodegradable. Tanaman yang diperlakukan dengan kitosan memiliki ketahanan yang baik terhadap serangan jamur. Dalam bidang kesehatan, kitosan bermanfaat dalam program diet karena kemampuannya menurunkan jumlah kolesterol, antikoagulan dalam darah serta digunakan sebagai agen antibakteri. Bidang bioteknologi
memanfaatkan kitosan sebagai zat yang berperan dalam imobilisasi enzim, pemisahan protein dan regenerasi sel. Dalam industri makanan, kitosan digunakan sebagai antioksidan, pengawet alami, penyerap zat warna dan pengemulsi (Pratiwi, 2014). Selain pemanfataan kitosan dalam bidang medis dewasa ini kitosan sudah dapat diaplikasikan dalam bidang lingkungan. Dengan aplikasi terbaru tersebut kitosan telah membawa keuntungan yang sangat signfikan. Salah satu pemanfataan kitosan dalam bidang lingkungan tersebut adalah sebagai adsorben atau atom penyerap logam berat, seperti timbal (Pb), krom (Cr) dan raksa (Hg) yang terdapat pada air yang tercemar (Sri dan Yeti, 2013).
2.3. EPOKSIDA
Epoksida (atau oksirana) adalah eter siklik, yaitu cincin beranggota tiga termasuk satu atom oksigen. Dua macam bahan baku yang digunakan dalam pembuatan resin-resin epoksi adalah epiklorohidrin dan bisfenol-A ( Hart, 2003).
Metode yang umum digunakan untuk mensintesis epoksida adalah reaksi alkena dengan asam peroksida dan prosesnya dinamakan epoksidasi.
RCH CHR + R'-C-O-OH RCH CHR + R'C-OH
O O
O asam peroksida suatu epoksida oksirana
Gambar 2.12. Reaksi pembentukan epoksida (Riswiyanto, 2002)
Asam peroksida mentransfer oksigennya ke alkena menjadi siklik, dimana mekanisme ini berlangsung satu tahap. Hasilnya merupakan sin adisi oksigen ke ikatan rangkap dua dan menghasilkan epoksida serta asam karboksilat (Riswiyanto, 2002).
Epiklorohidrin merupakan senyawa organoklorin dan epoksida, banyak digunakan sebagai bahan baku pembuatan epoksi, penoksi, resin-resin poli amida, karet poli eter, surfaktan, elastomer, pengemulsi minyak, lubrikan, dan cat. Selain itu, epiklorohidrin juga digunakan sebagai stabilizer pada senyawa-senyawa yang mengandung klorin seperti karet, pestisida, dan solven (Bijsterbosch et al., 1994).
Menurut Nagato et al.,(1987) secara konvensional epiklorohidrin disintesa dengan dehidroklorinasi alil klorida yang diperoleh dengan klorinasi propilen pada
suhu tinggi. Tetapi metode ini memiliki beberapa kelemahan seperti pembentukan hasil samping klorin dalam jumlah besar dan konsumsi energi yang tinggi karena reaksi berlangsung pada suhu tinggi, hal ini diperkuat dengan pendapat Siano et al., (2006). Saat ini gliserol sebagai hasil samping produksi biodisel tersedia melimpah.
Hal ini memberkan peluang untuk sintesa epiklorohidrin dari gliserol dengan menambahkan sejumlah larutan basa. Sintesa epiklorohidrin dari gliserol melalui dua tahap reaksi (Santacesariaet al., 2010)
Cl propylene
+ HCl
OH HO
OH
OH HCl
catalyst Cl
Cl
+ H2O
+
Cl Cl
OH
dichloropropanal NaOH
O
Cl
+ HCl
epiklorohidrin
Gambar 2.13Sintesa epiklorohidrin melalui jalur alil klorida dan jalur dikloropropanol (Lee et al., 2007)
Tahap pertama adalah reaksi hidroklorinasi antara gliserol dengan hidrogen klorida menghasilkan dikloropropanol.Tahap kedua adalah reaksi dehidroklorinasi dikloropropanol dan larutan basa menghasilkan epiklorohidrin (Herliati, 2017).
Epiklorohidrin merupakan salah satu pengikat silang pada polimer yang juga dapat meningkatkan kemampuan adsorpsi, seperti beberapa penelitian yang telah dilakukan yaitu penambahan epiklohidrin dapat meningkatkan stabilitas kimianya dalam suasana asam serta membentuk pori kitosan menjadi lebih besar yang menyebabkan daya adsorpsinya lebih besar (Madjid et al, 2015), kitosan berikatan silang epiklorohidrin dan tripospat juga dapat meningkatkan daya adsorpsinya (Laus
etal, 2010) modifikasi polisakarida (kulit pisang) dengan pengikat silang epiklorohidrin untuk meningkatkan sifat kimia dan sifat fisika untuk meningkatkan serapan terhadap ion logam (Suhartini, 2013).
2.4. DIETILEN TRIAMIN
Dietilen triamin adalah senyawa organik dengan rumus HN(CH2CH2NH2)2 dan analog struktural dari dietilen glikol. Sifat kimianya mirip dengan etilendiamin, dan merupakan produk sampingan dari produksi etilendiamin dari etilen diklorida.
Dietilentriamin adalah agen pengawet umum untuk resin epoksi pada epoksi perekat dan termoset lainnya yaitu N-alkilasi pada reaksi dengan kelompok-kelompok epoksida membentuk ikatan silang. Dalam kimia koordinasi, dietilen triamin berfungsi sebagai kompleks pembentukan ligan tridentat seperti Co(dien)(NO2)3.
Dietilen triamin pada suhu kamar berbentuk cair berwarna kuning dan berbau menyengat dan merupakan cairan higroskopis. Larut dalam air dan hidrokarbon.
Selain itu dietilen triamin digunakan sebagai bahan intermediet dalam industri lem, pelembut serat kain dan lain sebagainya.
2.4.1. Sifat Fisis Dietilen Triamin
Rumus Molekul : C4H13N3
Bentuk (pada 25oC) : Cair Berat molekul, [gr/mol] : 103,167 Titik didih (pada 1 atm), [oK] : 482,25 Titik beku (pada 1 atm), [oK] : 234,15 Densitas (pada 25oC), [gr/mL ] : 0,954 Viskositas gas (pada 25oC), [µp] : 62,73 Tekanan kritis, [bar] : 42,20
Temperatur kritis, [oK] : 676,0 (Yaws, 1999) 2.4.2. Sifat Kimia Dietilen Triamin
1. Dietilen Triamin beraksi secara eksotermal dengan aldehid menghasilkan imidazolidine.
2. Dietilen Triamin bereaksi dengan etilen oksida atau propilen oksida membentuk campuran turunan hidroksi alkil.
3. Dietilen Triamin bereaksi dengan aziridin membentuk epoksida.
4. Dietilen Triamin bereaksi dengan asam, ester, asam anhidrida menghasilkan amida amin dan poliamida. (Kirk dan Othmer,1983)
2.5. ADSORPSI
Adsorpsi merupakan suatu proses penyerapan oleh padatan tertentu terhadap zat tertentu yang terjadi pada permukaan zat padat karena adanya gaya tarik atom atau molekul pada permukaan zat padat tanpa meresap kedalam. Pada Adsorpsi ada yang disebut Adsorben dan Adsorbat. Adsorben adalah zat penyerap, sedangkan adsorbat adalah zat yang diserap (Giyatmi, 2008).
Adsorpsi dapat terjadi karena adanya gaya tarik-menarik. Ada 2 tipe adsorpsi, yaitu:
1. Adsorpsi fisis atau Van der Waals
Molekul-molekul yang diadsorpsi secara fisika tidak terikat kuat pada permukaan, dan biasanya terjadi proses balik cepat, sehingga mudah diganti dengan molekul yang lain. Adsorpsi fisika didasarkan pada gaya Van Der Waals dan dapat terjadi pada permukaan yang polar dan non polar. Adsorpsi juga mungkin terjadi dengan mekanisme pertukaran ion.Oleh karena itu ion pada gugus senyawa permukaan padatan adsorbennya dapat bertukar dengan ion-ion adsorbat.Mekanisme pertukaran ini merupakan penggabungan dari kemisorpsi dan fisisorpsi, karena mengikat ion-ion dengan ikatan secara kimia tetapi ikatan mudah dilepas kembali untuk terjadinya pertukaran ion.Besarnya energi adsorpsi fisika sekitar 10 kj/mol.
2. Adsorpsi kimia
Adsorpsi jenis ini menyebabkan terbentuknya ikatan secara kimia sehingga diikuti dengan reaksi kimia, maka akan menghasilkan produksi reaksi berupa senyawa baru. Ikatan kimia yang terjadi pada kemisorpsi sangat kuat mengikat molekul gas atau cairan dengan permukaan padatan sehingga sulit untuk dilepaskan kembali. Pada adsorpsi kimia hanya satu lapisan gaya yang terjadi. Besarnya energi adsorpsi kimia sekitar 100 kj/mol (Barrow, 1979).
2.5.1.Faktor-Faktor yang Mempengaruhi Adsoprsi
Dalam proses adsorpsi banyak faktor yang dapat mempengaruhi laju proses adsorpsi dan banyaknya adsorbat yang dapat diserap. Adapun faktor-faktor yang mempengaruhi proses adsorpsi sebagai berikut:
1. Agitasi
Agitasi adalah keadaan bergolak atau bisa disebut turbulen. Laju proses adsorpsi dikendalikan oleh difusi lapisan dan difusi pori, tergantung pada keadaan larutan, tenang atau bergolak/turbulen.
2. Karakteristik Adsorben
Karakteristik adsorben yang mempengaruhi laju adsorpsi adalah ukuran dan luas permukaan partikel. Semakin kecil adsorben maka laju adsorpsi akan semakin cepat, sementara semakin luas permukaan adsorben maka jumlah partikel adsorbat yang diserap akan semakin banyak.
3. Kelarutan Adsorbat
Proses adsorpsi terjadi saat adsorbat terpisah dari larutan dan menempel di permukaan adsorben. Partikel adsorbat yang terlarut memiliki afinitas yang kuat.
Tetapi ada pengecualian, beberapa senyawa yang sedikit larut sulit untuk diserap, sedangkan ada beberapa senyawa yang sangat larut namun mudah untuk diserap (Hassler, 1974).
4. Ukuran Pori Adsorben
Ukuran pori merupakan salah satu faktor penting dalam proses adsorpsi, karena senyawa adsorbat harus masuk ke dalam pori adsorben. Proses adsorpsi akan lancar apabila ukuran pori dari adsorben cukup besar untuk dapat memasukan adsorbat ke dalam pori adsorben. Kebanyakan air limbah mengandung berbagai ukuran partikel adsorbat. Keadaan ini dapat merugikan, karena partikel yang lebih besar akan menghalangi partikel kecil untuk dapat masuk ke dalam pori adsorben.
Akan tetapi gerakan konstan dari partikel adsorbat dapat mencegah terjadinya penyumbatan. Gerakan partikel kecil yang cepat membuat partikel adsorbat yang lebih kecil akan terdifusi lebih cepat ke dalam pori (Culp dan Culp, 1986).
5. pH
pH memiliki pengaruh yang besar terhadap tingkat proses adsorpsi, disebabkan ion hidrogen dapat menjerap dengan kuat, selain itu pH juga dapat mempengaruhi ionisasi. Senyawa organik asam lebih mudah diadsorpsi pada suasana pH rendah, sedangkan senyawa organik basa lebih mudah diadsorpsi pada suasana pH tinggi. Nilai optimum pH bisa ditentukan dengan melakukan pengujian di laboratorium.
6.Temperatur
Temperatur dapat mempengaruhi laju adsorpsi. Laju adsorpsi akan meningkat dengan meningkatnya temperatur, begitu pula sebaliknya. Proses adsorpsi merupakan proses eksotermik, maka derajat adsorpsi akan meningkat saat temperatur rendah dan turun pada temperatur tinggi.
7. Waktu Kontak
Waktu kontak mempengaruhi banyaknya adsorbat yang terserap, disebabkan perbedaan kemampuan adsorben dalam menyerap adsorbat berbeda-beda (Lowet al., 1995).
2.5.2.Proses Adsorpsi
Permukaan padatan yang kontak dengan suatu larutan cenderung untuk menghimpun lapisan dari molekul molekul zat terlarut pada permukaannya akibat ketidakseimbangan gaya-gaya pada permukaan. Adsorpsi kimia menghasilkan pembentukan lapisan monomolekular adsorbat pada permukaan melalui gaya-gaya dari valensi sisa dari molekul-molekul pada permukaan. Adsorpsi fisika diakibatkan kondensasi molecular dalam kapilerkapiler dari padatan. Secara umum, unsur-unsur dengan berat molekul yang lebih besar akan lebih mudah diadsorpsi. Terjadi pembentukan yang cepat sebuah kesetimbangan konsentrasi antarmuka, diikuti dengan difusi lambat ke dalam partikel-partikel karbon. Laju adsorpsi keseluruhan dikendalikan oleh kecepatan difusi dari molekul-molekul zat terlarut dalam pori-pori kapiler dari partikel karbon (Malkoc et al., 2006).
Kecepatan itu berbanding terbalik dengan kuadrat diameter partikel, bertambah dengan kenaikan konsentrasi zat terlarut, bertambah dengan kenaikan temperatur dan berbanding terbalik dengan kenaikan berat molekul zat terlarut.
Morris dan Weber menemukan bahwa laju adsorpsi bervariasi seiring dengan akar pangkat dua dari waktu kontak dengan adsorben. Kecepatan ini juga meningkat dengan menurunnya pH sebab perubahan muatan pada permukaan karbon. Kapasitas adsorpsi dari karbon terhadap suatu zat terlarut tergantung pada dua-duanya, karbon dan zat terlarutnya (Malkoc et al., 2006)
Kebanyakan limbah cair adalah kompleks dan bervariasi dalam hal kemampuan adsopsi dari campurancampuran yang ada. Struktur molekul, kelarutan,
2.6. LOGAM BERAT
Logam adalah zat dengan konduktivitas tinggi listrik, kelenturan, dan kilau, yang secara sukarela kehilangan trons pemilu mereka untuk membentuk kation.
Distribusi logam di atmosfer dipantau oleh sifat dari logam yang diberikan dan oleh berbagai faktor lingkungan (Connel dan Miller, 1995)
Logam terbagi dua, yakni logam berat yang mempunyai berat 5 gram atau lebih untuk tiap cm3 dan logam ringan yang beratnya kurang dari 5 gram tiap cm3. Ada istilah logam trace yakni logam yang dalam keadaan alami berjumlah sangat sedikit (Darmono,2001).
Logam berat tergolong kriteria yang sama dengan logam lainnya. Hal yang membedakan adalah pengaruh yang dihasilkan saat logam berat berikatan dan atau masuk ke dalam organisme hidup. Contoh ketika unsurlogam besi atau Fe masuk ke dalam tubuh walaupun dengan kadar berlebihan, seringkali tidak menimbulkan dampak negatif bagitubuh.Karena sejatinyaunsur besi(Fe) diperlukan dalam darah untuk mengikat oksigen. Lain hal dengan unsur logam berat, baik itulogamberat beracun yang dipentingkan seperti tembaga atau Cu, bila masuk kedalam tubuh dengan kadar yang berlebih akan menimbulkan dampak negatif terhadap fungsi fisiologitubuh. Ketika unsur logam berat beracun seperti hidragyrum(Hg) atau disebut air raksa, masuk kedalam tubuh organisme hidup maka dapat dipastikan organisme tersebut akan langsung keracunan (Palar, 1994).
Logam berat sejatinya unsur penting yang dibutuhkan setiap makhluk hidup.Logam berat yang termasuk elemen mikro merupakan kelompok logam berat yang non-esensial yang tidak mempunyai fungsi sama sekali dalam tubuh. Logam tersebut bahkan sangat berbahaya dan dapat menyebabkan keracunan (toksik) pada manusia (Agustina, 2010).
Logam berat biasanya bernomor atom 22 sampai 92.Terletak pada perioda 4 sampai 7 dalam sistem periodik unsur dan berbeda dengan logam biasa. Logam berat biasanya menimbulkan efek-efek khusus pada makhluk hidup. Dapat dikatakan bahwa semua logam berat dapat menjadi racun bagi tubuh makhluk hidup. Proses alam seperti perubahan siklus alamiah, memberikan kontribusi yang sangat besar ke lingkungan (Tabel 2.2).
Tabel 2.2 Pencemaran Utama dari logam dan sumbernya dialam (Suhendrayatna, 2001)
Unsur Sumber logam dialam
Antimoni Stritbit (Sb2O3), sumber panas bumi, drainase tambang Arsenik Logam arsenida dan arsenat, arsenoprit dan arsenit
(HasO2)
Berilium Beril (Be3Al2Si6O16), fenasit (Be2SiO4)
Kadmium Zink karbonat, tembaga karbonat, dan bijih besi Kromium Kromit (FeCr2O4), krom oksida (Cr2O3)
Nikel Mineral besi magnesia, besi sulfida, nikel oksida, pentladit ([Fe,Ni]9S8, nikel hidroksida (Ni(OH)3)
Perak Perak bebas (Ago), perak klorida, argentida (Ag2S), tembaga, timbal, bijizink
Raksa Raksa bebas (Hgo), sinabar (HgS)
Selen Selen bebas (Seo), feroselit (FeS2), deposit uranium, deposit kalkoprit- pentaldit-pirotit
Talium Residu tembaga, timbal, perak
Tembaga Tembaga bebas (Cuo), tembaga sulfida, kalkoprit (CuFeS2)
Timbel Galena (PbS)
Zink Zink sulfida, willemit (ZnSiO4), kalamit (ZnCO3), drainase tambang
Logam berat dapat mencemari lingkungan udara, tanah maupun air.
Masuknya logam berat ke dalam badan air dapat melalui proses alami maupun diakibatkan oleh perbuatan manusia (Mulia,2005). Logam berat dapat menyebabkan pencemaran lingkungan dan berpengaruh pada kesehatan manusia karena bersifat toksik, dapat terakumulasi pada rantai makanan dan bersifat persisten (Igwe dan Abia, 2006). Logam berat dapat menimbulkan gangguan terhadap kesehatan karena mampu menghalangi kerja enzim sehingga mengganggu metabolisme tubuh, menyebabkan alergi, bersifat mutagen, teratogen atau karsinogen bagi manusia maupun hewan.