SKRIPSI
KEMAMPUAN DEGRADASI ISOLAT BAKTERI
LIGNOSELULOLITIK ASAL CACING TANAH
(
Lumbricus rubellus
) TERHADAP BERBAGAI
SUBSTRAT LIGNOSELULOSA
I KADEK SLAMET
FAKULTAS PETERNAKAN
UNIVERSITAS UDAYANA
2
SKRIPSI
KEMAMPUAN DEGRADASI ISOLAT BAKTERI
LIGNOSELULOLITIK ASAL CACING TANAH
(
Lumbricus rubellus
) TERHADAP BERBAGAI
SUBSTRAT LIGNOSELULOSA
I KADEK SLAMET NIM. 1207105005
PROGRAM STUDI PETERNAKAN
FAKULTAS PETERNAKAN
UNIVERSITAS UDAYANA
DENPASAR
3
KEMAMPUAN DEGRADASI ISOLAT BAKTERI
LIGNOSELULOLITIK ASAL CACING TANAH
(
Lumbricus rubellus
) TERHADAP BERBAGAI
SUBSTRAT LIGNOSELULOSA
Skripsi Untuk Memperoleh Gelar Sarjana Peternakan Pada Program
Studi Peternakan, Fakultas Peternakan, Universitas Udayana,
Denpasar
I KADEK SLAMET NIM. 1207105005
PROGRAM STUDI PETERNAKAN
FAKULTAS PETERNAKAN
UNIVERSITAS UDAYANA
DENPASAR
4
RINGKASAN
KEMAMPUAN DEGRADASI ISOLAT BAKTERI LIGNOSELULOLITIK ASAL CACING TANAH (Lumbricus rubellus) TERHADAP BERBAGAI
SUBSTRAT LIGNOSELULOSA
I KADEK SLAMET
Fakultas Peternakan, Universitas Udayana, Denpasar
dek_amet@yahoo.com
Pemanfaatan pakan non konvensional sebagai pakan alternatif mempunyai berbagai keterbatasan salah satunya adalah tingkat kecernaan yang rendah akibat tingginya kandungan lignoselulosa sehingga tidak dapat dimanfaatkan secara optimal. Lignoselulosa merupakan komponen utama dinding sel tanaman yang sulit untuk didegradasi. Lignoselulosa pada tanaman terdiri dari senyawa lignin, selulosa dan hemiselulosa yang saling berikatan dan sulit untuk didegradasi. Senyawa lignoselulosa dapat didegradasi secara sempurna oleh aktivitas sinergis kompleks enzim lignoselulase yang dihasilkan mikroba tertentu, antara lain bakteri lignoselulolitik. Penelitian ini bertujuan untuk mengetahui kemampuan degradasi dari isolat bakteri lignoselulolitik asal cacing tanah terhadap substrat murni (asam tanat, CMC, xylan) dan substrat alami (eceng gondok, dan daun apu). Penelitian ini dilakukan di Laboratorium Nutrisi dan Makanan Ternak Fakultas Peternakan Universitas Udayana selama 2 bulan, menggunakan rancangan acak lengkap (RAL) dengan 4 perlakuan dan 3 ulangan. Hasil penelitian menunjukkan bahwa, pada substrat asam tanat isolat bakteri EB3LC
menghasilkan nilai yang lebih tinggi (secara kuantitatif) dan secara statistik menunjukkan berbeda nyata (P<0,05) terhadap EB2LC, namun berbeda tidak
nyata (P>0,05) terhadap EB1LC dan EB4LC. Pada substrat CMC isolat bakteri
EB3LC menghasilkan nilai yang lebih tinggi dan secara statistik menujukan
berbeda nyata (P<0,05) terhadap EB1LC dan EB4LC, namun berbeda tidak nyata
(P>0,05) terhadap EB2LC. Pada substrat xylan dan eceng gondok, isolat bakteri
EB3LC menunjukkan nilai yang lebih tinggi secara kuantitaif, namun secara
statistik menunjukkan berbeda tidak nyata (P>0,05) terhadap EB1LC, EB2LC, dan
EB4LC. Pada substrat Daun Apu isolat bakteri EB3LC menghasilkan nilai yang
lebih tinggi dan secara statistik berbeda nyata (P<0,05) terhadap EB1LC, EB2LC,
dan EB4LC (1,532 cm, 1,536 cm, dan 1,529 cm). Hasil uji kemampuan degradasi
menunjukkan bahwa isolat bakteri EB3LC menunjukkan hasil tertinggi pada
semua substrat uji.
5
SUMMARY
DEGRADATION ABILITY BACTERIA ISOLATE LIGNOSELULOLITIK FROM EARTHWORM (Lumbricus rubellus) ON VARIOUS OF
SUBSTRATE LIGNOCELLULOSE
I KADEK SLAMET
Faculty of Animal Science, Udayana University, Denpasar
dek_amet@yahoo.com
Non-conventional feed utilization as an alternative feed has many limitations one of them is the level of digestibility is low due to the high content of lignocellulose so can not be used optimally. Lignocellulose is a major component of plant cell walls that are difficult to be degraded. Lignocellulose in plants consist of a compound of lignin, cellulose and hemicellulose are linked to each other and it is difficult to be degraded. Lignocellulose compounds can be degraded completely by the synergistic activity of the enzyme complex produced lignoselulase certain microbes, such as bacteria lignoselulolitik. This research aimed to determine the ability of bacterial isolates lignoselulolitik degradation from earthworm to pure substrates (tannic acid, CMC, xylan) and the natural substrate (hyacinth, and apu leaves). This research was conducted at the Laboratory of Animal Nutrition and Feed Faculty of Animal Science, Udayana University for 2 months, using a completely randomized design (CRD) with 4 treatments and 3 replications. The results showed that, on the substrate EB3LC tannic acid bacteria produce a higher value (quantitatively) and statistically showed significantly different (P<0.05) against EB2LC, but had no significant
(P>0.05) against EB1LC and EB4LC. At CMC substrates EB3LC bacteria produce
higher value and addressing different statistically significant (P<0.05) to EB4LC
and EB1LC, but had no significant (P>0.05) against EB2LC. In xylan substrate
and hyacinth, EB3LC bacterial isolates showed higher values quantitative, but
statistics show no significant (P>0.05) on EB1LC, EB2LC, and EB4LC. Apu
leaves on a substrate EB3LC bacteria produce higher grades and were statistically
significantly different (P<0.05) against EB1LC, EB2LC, and EB4LC (1.532 cm,
1.536 cm and 1.529 cm). The test results showed that the degradation ability EB3LC bacterial isolates showed the highest results in all test substrate.
6
Lembar Pengesahan
JUDUL SKRIPSI : Kemampuan Degradasi Isolat Bakteri Lignoselulolitik Asal Cacing Tanah (Lumbricus rubellus) terhadap Berbagai Substrat Lignoselulosa NAMA MAHASISWA : I Kadek Slamet
NIM : 1207105005
PROGRAM STUDI : Peternakan
SKRIPSI INI TELAH DISETUJUI PADA TANGGAL ………..
Mengetahui Pembimbing I
Dr. Ir. I Gusti Lanang Oka Cakra, M. Si NIP. 196012311987031012
Pembimbing II
I Made Mudita,S.Pt.,MP NIP. 197405102005011004
Dekan Fakultas Peternakan Universitas Udayana
7
Skripsi Ini Telah Diuji Pada
Tanggal
13 Juni 2016
Ketua
: Dr. Ir. I Gusti Lanang Oka Cakra, M.Si
Sekretaris
: Prof. Dr. Ir. G. A. M. Kristina Dewi, MS
Penguji Utama
: I Made Mudita, S.Pt., MP
Penguji Anggota
: 1. Dr. Ir. Ni Nyoman Suryani, M.Si
8
RIWAYAT HIDUP
Penulis dilahirkan pada 16 Februari 1994 di Dusun Selat, Desa Banjarangkan, Kabupaten Klungkung, Provinsi Bali, dan merupakan anak keenam dari enam bersaudara dari pasangan I Wayan Linggih (Ayah) dan Ni Wayan Tublen (Ibu). Penulis memulai pendidikan Sekolah Dasar (SD) tahun 2000-2006 di SD N 1 Banjarangkan, Sekolah Menengah Pertama (SMP) tahun 2006-2009 di SMP N 1 Banjarangkan, Sekolah Menengah Atas (SMA) tahun 2009-2012 di SMA N 1 Banjarangkan. Pada tahun yang sama, penulis melanjutkan pendidikan dan diterima di Program Studi Peternakan, Fakultas Peternakan, Universitas Udayana melalui jalur undangan dan mendapatkan Beasiswa Bidikmisi.
9
UCAPAN TERIMAKASIH
Puji syukur penulis panjatkan ke hadapan Ida Sang Hyang Widhi Wasa/Tuhan Yang Maha Esa karena atas berkat dan rahmat Beliau, Skripsi yang berjudul “Kemampuan Degradasi Isolat Bakteri Lignoselulolitik Asal Cacing Tanah (Lumbricus rubellus) terhadap Berbagai Substrat Lignoselulosa” ini dapat
terselesaikan tepat pada waktunya.
Laporan ini tidak lepas dari peran dan partisipasi beberapa pihak. Oleh karena itu penulis ingin menyampaikan terima kasih kepada :
1. Dr. Ir. I Gusti Lanang Oka Cakra, M.Si selaku pembimbing utama (I) dan I Made Mudita, S.Pt., M.Si selaku pembimbing kedua (II) yang penuh perhatian telah memberikan dorongan, semangat, bimbingan, dan saran selama penulis penelitian, khususnya dalam menyelesaikan Skripsi ini. 2. Bapak Prof. Dr. dr. Ketut Suastika, Sp.PD-KEMD selaku Rektor
Universitas Udayana dan Bapak Dr. Ir. Ida Bagus Gaga Partama, MS Dekan Fakultas Peternakan, Universitas Udayana atas kesempatan dan fasilitas yang diberikan untuk mengikuti dan menyelesaikan pendidikan Program Studi Peternakan, Fakultas Peternakan, Universitas Udayana. 3. Dr. Ir. Ni Nyoman Suryani, M.Si selaku pembahas I dan Ir. Sri Anggreni
Lindawati, M.Si selaku pembahas II yang sudah memberikan masukan dan saran kepada penulis.
10
6. PT. Charoen Phokphand atas dukungan materi (Beasiswa) yang diberikan selama penulis melakukan penelitian serta dalam proses penyusunan skripsi.
7. Seluruh dosen Fakultas Peternakan, Universitas Udayana yang selalu memberikan ilmu, nasehat, saran serta motivasi selama menempuh perkuliahan dari awal kuliah hingga skripsi ini dapat terselesaikan.
8. Teman–teman kelompok penelitian yaitu I Komang Geria Suardita, I Komang Juliartawan, I Komang Dodi Kusumajaya, Ni Luh Dewi Antari, Ni Wayan Riandani, dan Marna Rohani Banurea yang ikut memberikan masukkan dan motivasi kepada penulis.
9. Teman-teman kelompok PKM (Praktek Kerja Mahasiswa) yaitu Ni Putu Yundari Melati, Ni Kade Ari Wulan Pebri Yanti, I Kadek Gunung Suyasa, I Gusti Putu Agus Adi Saputra, dan I Wayan Duaja Jaya yang memberikan saran dan motivasi kepada penulis.
11 langsung maupun tidak langsung selama penulis menjadi mahasiswa Fakultas Peternakan, Universitas Udayana.
11.Semua pihak lain yang tidak dapat disebutkan satu persatu yang ikut berpartisipasi dalam penulisan Skripsi ini.
Semoga Ida Sang Hyang Widhi Wasa selalu melimpahkan anugerah-Nya kepada semua pihak yang secara nyata maupun tidak nyata membantu penulis dalam penyelesaian Skripsi ini.
12
BAB I PENDAHULUAN ...Error! Bookmark not defined.
1.1. Latar Belakang ...Error! Bookmark not defined.
1.2. Rumusan Masalah ...Error! Bookmark not defined.
1.3. Tujuan Penelitian ...Error! Bookmark not defined.
1.4. Hipotesis ...Error! Bookmark not defined.
1.5. Manfaat Penelitian ...Error! Bookmark not defined. BAB II TINJAUAN PUSTAKA ...Error! Bookmark not defined.
2.1. Pakan Ternak Sumber Lignoselulosa ...Error! Bookmark not defined.
2.2. Lignoselulosa Sebagai Faktor Pembatas Pemanfaatan PakanError! Bookmark not defined
2.2.1. Komponen Selulosa ...Error! Bookmark not defined.
2.2.2. Komponen Hemiselulosa ...Error! Bookmark not defined.
2.2.3. Komponen Lignin ...Error! Bookmark not defined.
2.3. Bakteri Perombak Senyawa LignoselulosaError! Bookmark not defined.
2.3.1. Karakteristik bakteri ...Error! Bookmark not defined.
2.3.2. Peranan bakteri dalam perombakan lignoselulosaError! Bookmark not defined.
2.4. Cacing Tanah (Lumbricus rubellus) Sebagai Sumber Isolat Bakteri Lignoselulolitik ...Error! Bookmark not defined. BAB III MATERI DAN METODE ...Error! Bookmark not defined.
3.1. Materi...Error! Bookmark not defined.
3.1.1. Tempat dan waktu penelitian ...Error! Bookmark not defined.
13 3.2. Metode ...Error! Bookmark not defined.
3.2.1. Rancangan percobaan ...Error! Bookmark not defined.
3.2.2. Persiapan penelitian ...Error! Bookmark not defined.
3.2.3. Pelaksanaan penelitian ...Error! Bookmark not defined.
3.2.4. Variabel yang diamati ...Error! Bookmark not defined.
3.2.5. Analisis data ...Error! Bookmark not defined. BAB IV HASIL DAN PEMBAHASAN...Error! Bookmark not defined.
4.1. Hasil ...Error! Bookmark not defined.
4.2. Pembahasan ...Error! Bookmark not defined. BAB V SIMPULAN DAN SARAN ...Error! Bookmark not defined.
5.1. Simpulan ...Error! Bookmark not defined.
14
DAFTAR TABEL
No Teks Halaman
2.1. Kandungan senyawa lignoselulosa beberapa bahan pakan ... 9 2.2. Ciri-ciri bakteri Gram positif dan Gram negatif ... 17 4.3. Kemampuan degradasi dari isolat bakteri lignoselulolitik asal cacing tanah
15
DAFTAR GAMBAR
No Teks Halaman
2.1. Hubungan antara lignin, selulosa dan hemiselulosa pada senyawa
lignoselulosa ... 8
2.2. Jenis ikatan antara lignin dan polisakarida ... 8
2.3. Konfigurasi dinding sel tanaman ... 10
2.4. Bangun dasar selulosa ... 11
2.5. Bangun molekul hemiselulosa ... 13
2.6. Senyawa penyusun lignin ... 14
2.7. Bangun struktur lignin ... 15
2.8. Skema sistem degradasi lignin ... 17
2.9. Pemotongan ikatan cα-cβ molekul lignin dan pembentukan senyawa intermediet ... 17
2.10. Siklus katalitik pada li-p ... 18
2.11. Siklus katalitik mn-p ... 19
2.12. Skema pembentukan co2 dari struktur aromatik lignin oleh mn-p ... 20
2.13. Proses degradasi selulosa menjadi glukosa ... 23
2.14. Biodegradasi hemiselulosa ... 25
16
DAFTAR LAMPIRAN
No Teks Halaman
1. Analisis substrat xylan ... 53
2. Analisis substrat CMC ... 55
3. Analisis substrat asam tanat ... 57
4. Analisis substrat eceng gondok ... 59
BAB I
PENDAHULUAN
1.1. Latar Belakang
Pakan merupakan salah satu faktor yang mempengaruhi biaya produksi dalam suatu usaha peternakan, sehingga diperlukan pakan alternatif untuk menekan biaya pakan. Upaya pemanfaatan pakan non konvensional merupakan salah satu solusi alternatif yang sangat mungkin untuk dilakukan dalam mengatasi masalah biaya pakan. Pakan non konvensional mempunyai potensi untuk dapat dimanfaatkan sebagai bahan penyusun pakan ternak ditinjau dari kandungan nutrien yang cukup memadai, harga yang relatif murah, mudah didapat, serta tidak bersaing dengan kebutuhan manusia. Pakan non konvensional yang dapat digunakan sebagai pakan alternatif diantaranya eceng gondok dan daun apu. Eceng gondok dan daun apu merupakan bahan pakan non konvensional yang memiliki kelebihan yaitu populasi yang berlimpah, kandungan nutrien yang cukup tinggi, mudah didapatkan dan tidak perlu biaya yang tinggi untuk memperolehnya.
pada eceng gondok dan daun apu menjadi indikasi bahwa pakan non konvensional sangat berpotensi digunakan sebagai pakan alternatif.
Walaupun pakan non konvensional memiliki kandungan nutrient yang cukup tinggi sebagai pakan alternatif, namun pemanfaatan pakan non konvensional sebagai pakan alternatif mempunyai berbagai keterbatasan salah satunya adalah tingkat kecernaan yang rendah akibat tingginya kandungan lignoselulosa yang mengakibatkan kandungan nutrien tidak dapat dimanfaatkan secara optimal (Krause et al., 2003). Lignoselulosa merupakan komponen utama dinding sel tanaman yang sulit untuk didegradasi (Howard et al., 2003). Lignoselulosa pada tanaman terdiri dari senyawa lignin, selulosa dan hemiselulosa yang saling berikatan (Howard et al., 2003; Perez et al., 2002).
yaitu Carboxy Methyl Cellulose (CMC) (mencerminkan selulosa), asam tanat (mencerminkan lignin), dan xilan (mencerminkan hemiselulosa) karena diduga mempunyai struktur kimia yang hampir sama. Senyawa lignoselulosa dapat didegradasi secara sempurna oleh aktivitas sinergis kompleks enzim lignoselulase
yang dihasilkan mikroba tertentu, antara lain bakteri lignoselulolitik (Sarkar et al., 2011).
Bakteri lignoselulolitik merupakan bakteri yang mampu mendegradasi lignoselulosa (bakteri pendegradasi lignin, selulosa dan/atau hemiselulosa). Bakteri ini mampu menghasilkan kompleks enzim lignoselulase yang terdiri dari enzim lignase, enzim selulase, dan atau enzim hemiselulase. Di alam, bakteri lignoselulolitik banyak terdapat pada lahan pertanian, tanah gambut, saluran pencernaan ruminansia, sel tubuh maupun saluran pencernaan rayap, saluran pencernaan hewan invertebrata dan berbagai sumber bakteri lainnya (Mudita et al., 2009; Purwadaria et al., 2003ab; Sarkar et al., 2011; Watanabe et al., 1998).
Cacing tanah (Lumbricus rubellus) merupakan salah satu hewan invertebrata yang mampu mendegradasi berbagai bahan organik dan mempunyai peranan penting dalam proses dekomposisi bahan organik tanah. Hasil penelitian Juliartawan (“Unpublished”) telah menunjukkan bahwa dari cacing tanah (Lumbricus rubellus) berhasil diisolasi bakteri lignoselulolitik, bakteri lignolitik, bakteri selulolitik dan bakteri xylanolitik. Palungkun (2010) melaporkan bahwa dari berbagai hasil penelitian diperoleh data bahwa cacing tanah mengandung
sejalan dengan Pathma dan Sakthivel (2012) menyatakan bahwa cacing tanah (Lumbricus rubellus) mampu mendegradasi senyawa antinutrisi dan lignoselulosa. Berbagai hasil penelitian telah melaporkan bahwa tingkat degradasi senyawa lignoselulosa dari bahan pakan akan menentukan ketersediaan jumlah nutrien bagi ternak (Mudita et al., 2009; Wibawa et al., 2009-2011; Dewi et al., 2014). Berdasarkan hal tersebut evaluasi kemampuan degradasi isolat bakteri lignoselulolitik asal cacing tanah (Lumbricus rubellus) dilakukan untuk menggali potensinya sebagai sumber isolat dalam formulasi konsorsium bakteri lignoselulolitik dalam optimalisasi pemanfaatan pakan non konvensional yang mengandung lignoselulosa sebagai pakan alternatif.
1.2. Rumusan Masalah
Rumusan masalah pada penelitian ini yaitu:
1. Apakah isolat bakteri lignoselolitik asal cacing tanah (Lumbricus rubellus) mempunyai kemampuan degradasi terhadap berbagai substrat lignoselulosa?
2. Manakah keempat isolat yang mempunyai kemampuan degradasi tertinggi?
1.3. Tujuan Penelitian
Tujuan yang ingin dicapai dalam penelitian ini yaitu:
2. Untuk mengetahui kemampuan degradasi tertinggi dari keempat isolat bakteri lignoselolitik asal cacing tanah (Lumbricus rubellus) terhadap berbagai substrat lignoselulosa.
1.4. Hipotesis
Hipotesis dalam penelitian ini yaitu:
1. Isolat bakteri lignoselulolitik asal cacing tanah (Lumbricus rubellus) mempunyai kemampuan degradasi senyawa lignoselulosa.
2. Isolat yang mempunyai degradasi tertinggi yaitu isolat EB3LC yang
didasarkan pada uji morfologis (pengecatan gram).
1.5. Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1. Pakan Ternak Sumber Lignoselulosa
Pakan mempunyai peranan yang sangat penting dalam mendukung perkembangan usaha peternakan di Indonesia. Pemanfaatan pakan menjadi salah satu solusi terbaik guna mengurangi biaya produksi. Disamping itu, pemanfaatan non konvensional maupun konvensional sebagai pakan akan dapat mengurangi dampak negatif dari produk utama itu sendiri. Pakan non konvensional memiliki kandungan nutrient yang cukup tinggi sebagai pakan alternatif, namun pemanfaatan pakan non konvensional sebagai pakan alternatif mempunyai berbagai keterbatasan salah satunya adalah tingkat kecernaan yang rendah akibat tingginya kandungan lignoselulosa yang mengakibatkan kandungan nutrien tidak dapat dimanfaatkan secara optimal (Krause et al., 2003). Lignoselulosa merupakan komponen utama dinding sel tanaman yang sulit untuk didegradasi (Howard et al., 2003). Lignoselulosa pada tanaman terdiri dari senyawa lignin, selulosa dan hemiselulosa yang saling berikatan (Howard et al., 2003; Perez et al.,
2002).
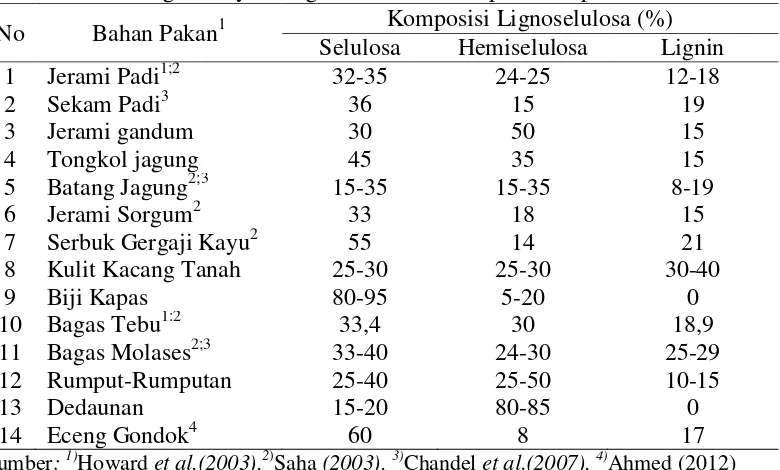
kandungan serat kasar yang tinggi akan mengakibatkan tingkat kecernaan pakan menurun serta nutrien yang terkandung tidak dapat dimanfaatkan secara optimal oleh ternak. Hal ini disinyalir diakibatkan oleh kandungan serat kasar dari enceng gondok yang tinggi. Ahmed et al. (2012) melaporkan bahwa eceng gondok memiliki serat kasar yang tinggi dengan komposisi yakni 60% selulosa, 8% hemiselulosa dan 17% lignin. Hasil penelitian Radjiman et al. (1999) melaporkan bahwa kandungan nutrien eceng gondok yaitu protein kasar sebesar 13%, lemak kasar 1%, serat kasar 21,30% dan energi termetabolis 2.096,92 kkal/kg. Hasil penelitian Sumaryono (2003) melaporkan bahwa daun apu yang bersumber dari sawah mengandung protein kasar sebesar 14,00%; serat kasar 19,71%; lemak kasar 1,54%; abu 19,70% dan kandungan energi termetabolisnya 1444,47 kkal/kg. Meskipun demikian berbagai penelitian telah menunjukkan pemanfaatan serat oleh ternak menjadi lebih optimal dan mampu meningkatkan kualitas karkas melalui penurunan kadar kolesterol darah, telur maupun daging melalui aplikasi teknologi biofermentasi.
kandungan serat kasar yang tinggi serta kandungan protein dan tingkat kecernaan yang rendah. Kendala pemanfaatan bahan pakan asal limbah atau hasil sisa tanaman dsebabkan oleh adanya kandungan berbagai senyawa kimiawi yang bersifat penghambat (inhibitor).
Disamping itu, bahan pakan non konvensional asal limbah juga dapat dimanfaatkan sebagai sumber karbon/energi bagi mikroorganisme yang akan meningkatkan viabilitas dan efektivitas mikroba. Hal ini diakibatkan bahan-bahan tersebut dapat menyediakan kebutuhan nutrien bagi mikroba pendegradasi serat maupun probiotik dalam produk suplemen.
2.2. Lignoselulosa Sebagai Faktor Pembatas Pemanfaatan Pakan
Lignoselulosa merupakan komponen utama tanaman yang menggambarkan jumlah sumber bahan organik yang dapat diperbaharui yang terdiri dari selulosa, hemiselulosa, lignin dan beberapa bahan ekstraktif lain (Howard et al., 2003). Semua komponen lignoselulosa terdapat pada dinding sel tanaman. Peres et al. (2002) mengungkapkan bahwa lignin secara kimia berikatan dengan komponen karbohidrat struktural (selulosa dan/atau hemiselulosa) dan secara fisik bertindak sebagai penghalang proses perombakan dinding sel bahan pakan oleh mikroba (Gambar 2.2). Semakin tinggi kandungan lignin dari suatu bahan pakan semakin sulit bahan pakan tersebut terdegradasi/tercerna (Peres et al., 2002). Tabel 2.3 menunjukkan kandungan komponen lignoselulosa beberapa bahan pakan asal limbah pertanian. Pada tabel tersebut tampak bahwa bahan pakan asal limbah pertanian mengandung lignin yang jauh lebih tinggi daripada rerumputan/dedaunan, sehingga tingkat kecernaannya juga lebih rendah (Howard
Gambar 2.1. Hubungan antara Lignin, Selulosa dan Hemiselulosa pada Senyawa Lignoselulosa (Sumber: Boudet et al., 2003)
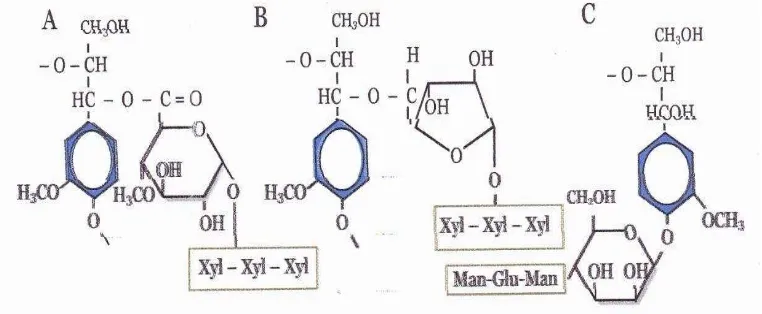
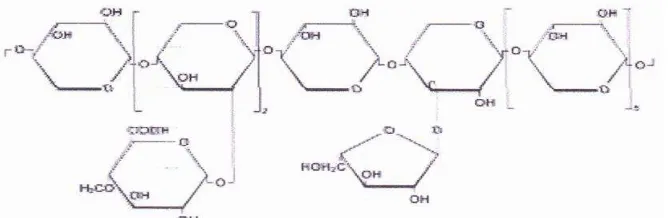
Gambar 2.2. Jenis Ikatan Antara Lignin dan Polisakarida.
A= Bensil ester, B=Bensil ether, C=Fenil Glikosida (Sumber: Perez et al., 2002)
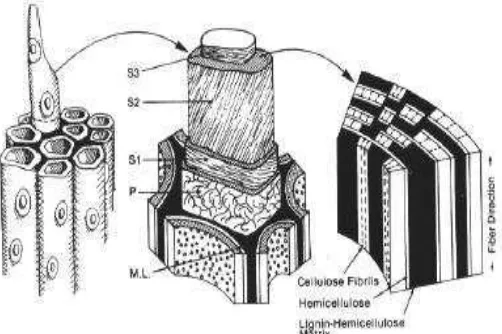
Lignoselulosa merupakan komponen pembangun dinding sel tanaman yang terbentuk seiring dengan perkembangan dan umur tanaman (Howard et al., 2003). Dinding sel tanaman muda terdiri dari selulosa, hemiselulosa dan pektin. Perkembangan dan peningkatan umur tanaman akan diikuti dengan terjadi kristalisasi selulosa dan pengerasan fibril selulosa oleh lignin membentuk suatu senyawa lignoselulosa yang keras (Howard et al., 2003; Perez et al., 2002).
mempunyai ketebalan 0,1-0,2µm dan mengandung jaringan mikrofibril selulosa yang mengelilingi dinding sekunder yang relatif lebih tebal (Chahal dan Chahal 1998).
Tabel 2.1. Kandungan senyawa lignoselulosa beberapa bahan pakan No Bahan Pakan1 Komposisi Lignoselulosa (%)
Selulosa Hemiselulosa Lignin
Gambar 2.3. Konfigurasi Dinding Sel Tanaman (Sumber: Perez et al., 2002)
2.2.1. Komponen Selulosa
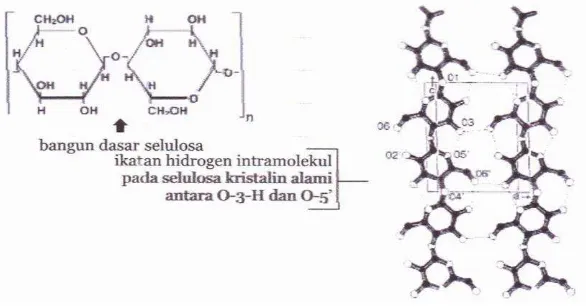
Selulosa adalah komponen utama penyusun dinding sel tanaman yang merupakan polimer linier D-glukosa yang terikat pada ikatan β-1,4 glikosida (Gambar 2.4). Selulosa merupakan komponen utama penyusun dinding sel tanaman dan hampir tidak pernah ditemui dalam keadaan murni di alam, melainkan berikatan dengan bahan lain, yaitu lignin dan hemiselulosa membentuk suatu lignoselulosa (Lynd et al., 2002). Carboxy Methyl Cellulose (CMC) merupakan selulosa murni yang berbentuk amorphous, sehingga aktivitas enzim
selulase pada substrat CMC merupakan aktivitas enzim endo-1,4-β-glukanase
Ikatan β-1,4 glukosida pada serat selulosa dapat dipecah menjadi monomer glukosa dengan hidrolisis asam atau enzimatis. Kesempurnaan pemecahan selulosa pada saluran pencernaan ternak tergantung pada ketersediaan kompleks enzim selulase. Saluran pencernaan manusia dan ternak non ruminansia tidak mempunyai enzim yang mampu memecah ikatan ß-1,4 glukosida sehingga tidak dapat memanfaatkan selulosa (Perez et al., 2002).
Gambar 2.4. Bangun Dasar Selulosa (Sumber: Perez et al., 2002)
Ternak ruminansia dengan bantuan enzim yang dihasilkan mikroba rumen dapat memanfaatkan selulosa sebagai sumber energi. Pencernaan selulosa dalam sel merupakan proses yang kompleks yang meliputi penempelan sel mikroba pada selulosa, hidrolisis selulosa dan fermentasi yang menghasilkan asam lemak terbang/Vollatile Fatty Acids/VFA (Arora, 1995).
Efisiensi pemanfaatan selulosa sebagai sumber energi bagi ruminansia sangat tergantung pada kemampuan ternak untuk memutus ikatan yang memproteksi selulosa dari serangan enzim selulase. Selulosa dan hemiselulosa pada lignoselulosa tidak dapat dihidrolisis secara sempurna oleh enzim selulase
2.2.2. Komponen Hemiselulosa
Hemiselulosa merupakan kelompok polisakarida heterogen dengan berat molekul rendah yang merupakan polimer dari pentosa (xylosa, arabinosa), heksosa (mannose, glukosa, galaktosa) dan asam-asam gula (Perez al., 2002; Saha, 2003). Jumlah hemiselulosa biasanya antara 15-30% dari berat kering bahan lignoselulosa (Taherzadeh, 1999). Hemiselulosa mengikat lembaran serat selulosa membentuk mikrofibril yang meningkatkan stabilitas dinding sel. Hemiselulosa juga berikatan silang dengan lignin membentuk jaringan kompleks lignoselulosa (lignohemiselulosa) dan memberikan struktur yang kuat (Howard et al., 2003).
Hemiselulosa relatif lebih mudah dihidrolisis dengan asam menjadi monomer yang mengandung glukosa, mannosa, galaktosa, xilosa, arabinosa dan 4-0 methyl-glukoronik, D-galacturonic dan D-glukoronik (Gambar 2.5). Gula– gula tersebut terikat oleh ikatan β-1,4 dan β-1,3 glukosida (Perez et al., 2002).
Gambar 2.5. Bangun Molekul Hemiselulosa (Sumber: Perez et al., 2002)
Berbeda dengan selulosa, hemiselulosa bukan polimer homogenous. Komponen hemiselulosa dari bahan berkayu yang keras sebagian besar terdiri dari xylan. Sedangkan bahan berkayu yang lunak, komponen hemiselulosanya lebih banyak mengandung glukomannan (Saha, 2003).
Disamping xylosa, xylan juga mengandung arabinosa, asam glucoronik atau 4-0-methyl ether, asetat, ferulik dan asam p-coumarin. Sedangkan xylan dari sumber yang lain, seperti rumput-rumputan, biji-bijian, kayu lunak maupun kayu keras mempunyai komposisi yang berbeda (Saha, 2003). Xylan dari dedak mengandung 46% xylosa, 44,9% arabinosa, 1,4% glukosa, dan 8,3% asam anhidrouronik (Shibuya dan Iwasaki, 1985). Arabinoxylan dari gandum mengandung 65.8% xylosa, 33.5% arabinose, 0,1 % mannose, 0,1 % galaktose, dan 0,3% glucose (Gruppen et al., 1992). Xylan serat jagung mengandung 48-54%xylosa, 33-35% arabinosa, 5-11 % galaktosa, dan 3-6% asam glucuronic (Doner dan Hicks, 1997).
2.2.3 Komponen Lignin
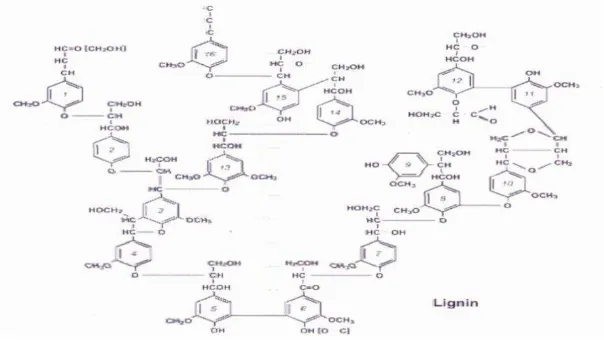
Lignin merupakan polimer dengan struktur aromatik yang terbentuk melalui unit-unit penilpropan (Sjorberg, 2003) yang berhubungan secara bersama oleh beberapa jenis ikatan yang berbeda (Perez et al., 2002). Lignin sulit didegradasi karena strukturnya yang kompleks dan heterogen yang berikatan dengan selulosa dan hemiselulosa dalam jaringan tanaman. Lebih dari 30% tanaman tersusun atas lignin yang memberikan bentuk yang kokoh dan memberikan proteksi terhadap serangga dan patogen (Orth et al., 1993). Howard
et al., (2003) maupun Perez et al., (2002) mengungkapkan bahwa lignin merupakan faktor pembatas utama degradasi lignoselulosa suatu bahan organik. Lebih lanjut dijelaskan bahwa lignin juga membentuk ikatan yang kuat dengan polisakarida yang melindungi polisakarida dari degradasi mikroba dan membentuk struktur lignoselulosa.
1998; Steffen 2003). Lignin tidak hanya mengeraskan mikrofibril selulosa, tetapi juga berikatan secara fisik dan kimia dengan hemiselulosa. Lignin terbentuk melalui polimerasi tiga dimensi derivat dari sinamil alkohol terutama ρ-kumaril, coniferil dan sinafil alkohol dengan bobot molekul mencapai 11.000 (Gambar 2.6) (Perez et al. 2002; Rahikainen et al., 2013). Lignin bersifat tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter (Gambar 2.7) (Rahikainen
et al., 2013).
Para Kumaril Alkohol Koniferil Alkohol Sinapil Alkohol Model Kerangka C Gambar 2.6. Senyawa Penyusun Lignin (Sumber: Perez et al., 2002)
Gambar 2.7. Bangun Struktur Lignin (Sumber: Perez et al., 2002)
secara kovalen dengan hemiselulosa. Hubungan antara lignin-karbohidrat tersebut berperan dalam mencegah hidrolisis polimer selulosa (Rahikainen et al., 2013).
2.3. Bakteri Perombak Senyawa Lignoselulosa
2.3.1. Karakteristik bakteri
a. Morfologis Bakteri
Ada beberapa bentuk dasar bakteri, yaitu bulat (tunggal: coccus; jamak: cocci), batang atau silinder (tunggal: bacillus, jamak: bacilli),dan spiral yaitu berbentuk batang melengkung atau melingkar-lingkar (Pratiwi, 2008). Satuan ukuran bakteri adalah mikrometer (μm), yang setara dengan 1/1000 mm atau 10-3 mm. bakteri yang paling umum berukuran kira-kira 0,5-1,0 x 2,0-5,0 μm (pelczar, 1986). Pratiwi (2008) menyatakan bahwa struktur sel bakteri terdiri dari dua bagian yaitu struktur eksternal dan struktur internal sel bakteri.
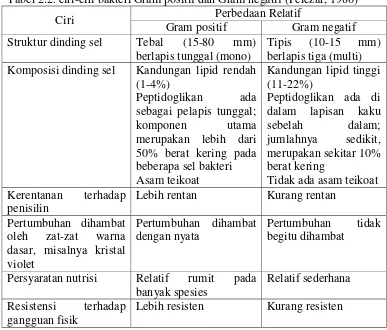
Tabel 2.2. ciri-ciri bakteri Gram positif dan Gram negatif (Pelczar, 1986)
Ciri Perbedaan Relatif Komposisi dinding sel Kandungan lipid rendah
(1-4%)
Persyaratan nutrisi Relatif rumit pada banyak spesies
Relatif sederhana Resistensi terhadap
gangguan fisik
a. Struktur eksternal sel bakteri
Glikokaliks (selubung gula)/kapsul
Slime (lapisan lendir)
Flagela
Fibria (jamak: fibriae)
Pili (tunggal: pilus)
Dinding sel
b. Struktur internal sel bakteri
Sitoplasma: substansi yang menempati ruangan sel bagian dalam. Di dalam sitoplasma terdapat berbagai enzim, air (80%), protein, karbohidrat, asam nukleat, dan lipid yang membentuk sistem koloid yang secara optik bersifat homogen.
Membran plasma.(inner membrane): struktur tipis yang terdapat di sebelah dalam dinding sel dan menutup sitoplasma sel berfungsi untuk memecah nutrien dan memproduksi energi.
Daerah inti (daerah nukleoid): mengandung kromosom bakteri.
Ribosom: berperan pada sintesis protein.
Badan inklusi: organel penyimpan nutrisi.
Endospora: struktur dengan dinding tebaldan lapissan tambahan pada sel bakteri yang berbentuk disebelah dalam membran sel. Endospora berfungsi sebagai pertahanan sel bakteri terhadap panas ekstrem, kondisi kurang air, dan paparan bahan kimia serta radiasi.
Enzim yang memecah makromolekul pada umumnya bersifat ekstraseluler yaitu setelah di produksi di dalam sel kemudian dikeluarkan dari sel ke substrat di sekelilingnya. Mikroba yang memproduksi enzim ekstraseluler jika ditumbuhkan pada medium pada yang mengandung substrat yang dapat dihidrolisa akan mengeluarkan enzim tersebut di sekeliling koloninya dan akan menghidrolisa substrat di sekeliling koloni. Perubahan di sekeliling koloni tersebut dapat dilihat misalnya dengan areal yang bening pada hidrolisa protein oleh enzim proteolitik, atau dapat dilihat dengan penambahan indikator yodium pada hidrolisa pati oleh enzim amilolitik (Fardiaz, 1988).
Enzim enzim ekstraseluler pada umumnya bersifat terinduksi, dimana produksinya akan meningkat jika ada substrat yang sesuai di sekelilingnya. Tanpa induksi, enzim tetap diproduksi tetapi dalam jumlah kecil. Enzim ekstraseluler akan menghidrolisa makromolekul di luar sel menjadi komponen yang lebih larut, sehingga dapat diserap ke dalam sel dengan sistem transport tertentu. Komponen komponen makromolekul tersebut pada umumnya digunakan sebagai sumber karbon dan enersi (Fardiaz, 1988).
2.3.2. Peranan bakteri dalam perombakan lignoselulosa
a. Perombakan lignin
Lignin merupakan senyawa/polimer yang sulit didegradasi dan hanya sedikit mikroorganisme yang mampu mendegradasi lignin secara efektif. Degradasi lignin membutuhkan enzim ekstraseluler yang tidak spesifik karena lignin mempunyai struktur acak dengan berat molekul tinggi (Howard et al., 2003).
Beberapa kelompok bakteri mempunyai kemampuan mendegradasi lignin. Bakteri dari genus Aeromonas, Bacillus, Flavobacterium, Pseudomonas maupun
Streptomyces memiliki kemampuan enzimatis dalam menggunakan senyawa cincin aromatik (aromatic ring) dan rantai samping yang ada pada lignin (Hernandes et al., 1994). Disamping itu bakteri berperanan dalam perombakan lebih lanjut senyawa intermediet hasil degradasi jamur (Ruttiman et al., 1991). Degradasi lignin dari komplek lignoselulosa secara sempurna merupakan respon dari aktivitas tiga kelompok utama enzim ekstraseluler yaitu lignin-peroksidase/Li-P, mangan-peroksidase/Mn-P, dan lakase/Lac (Perez et al., 2002).
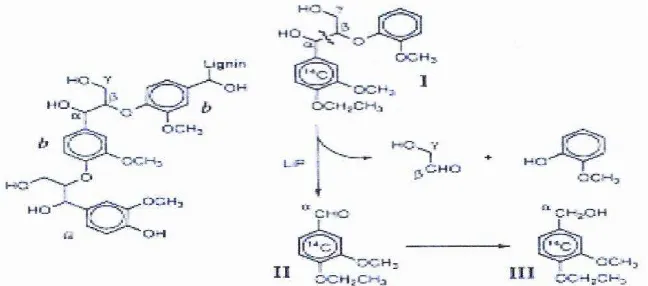
Lignin Peroksidase (EC 1.11.1.14, Li-P, Ligninase) merupakan enzim lignolitik yang bertugas mengkatalisis oksidasi sebuah elektron dari cincin aromatik lignin (fenolik dan non-fenolik) yang akan membentuk radikal kation dan fenoksi (Akhtar et al., 1997). Senyawa radikal ini secara spontan atau bertahap melepaskan ikatan antar molekul dan beberapa diantaranya melepaskan inti pada cincin aromatik. Oksidasi substruktur lignin yang dikatalisis oleh Li-P
postenzymatic. Li-P memotong ikatan Cα-Cβ molekul lignin (Gambar 2.8). Pemotongan ikatan pada Cα-Cβ merupakan jalur utama perombakan lignin (Gambar 2.9) (Hammel, 1997). Disamping itu, Li-P juga merupakan oksidan yang kuat yang mempunyai kemampuan mengoksidasi senyawa fenolik, amina, eter aromatik, dan senyawa aromatik polisiklik. Li-P adalah enzim peroksidase ekstraseluler yang mengandung heme yang aktivitasnya bergantung pada H2O2,
yang mempunyai potensial redoks yang sangat besar dan pH optimum yang rendah (Gold dan Alic, 1993).
Gambar 2.8. Skema Sistem Degradasi Lignin (Sumber: Hammel, 1997)
Gambar 2.9. Pemotongan ikatan Cα-Cβ molekul lignin dan pembentukan senyawa intermediet (Sumber: Hammel, 1997)
pereduksinya (Steffen, 2003). Mn-P mengoksidasi Mn2+ menjadi Mn3+ dan H2O2
sebagai katalis untuk menghasilkan gugus peroksida. Mn3+yang dihasilkan dapat berdifusi ke dalam substrat dan mengaktifkan proses oksidasi yang mengubah struktur fenolik menjadi radikal fenoksil. Mn3+ yang terbentuk sangat reaktif dan membentuk kompleks dengan chelating asam organik seperti asam oksalat atau malat (Kishi et al., 1994). Ion Mn3+ distabilkan dan dapat menembus kedalam jaringan substrat dengan bantuan chelator (Steffen, 2003). Hal ini didukung pula oleh aktivitas kation radikal dari veratril alkohol dan enzim penghasil H2O2.
Proses ini diakhiri dengan bergabungnya O2 ke dalam struktur lignin (De Jong et al., 1994). Radikal fenoksil yang dihasilkan lebih lanjut bereaksi yang akhirnya melepaskan CO2.
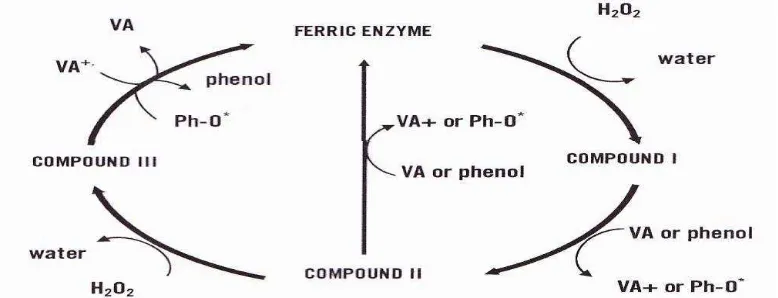
Siklus katalitik dari Li-P dan Mn-P hampir sama. Produk utama reaksi Li-P dengan H2O2 adalah senyawa I 2-elektron (Li-P I) teroksidasi (Gambar 2.10).
Li-P I direduksi kembali menjadi enzim asal melalui langkah 2 elektron tunggal dengan senyawa II (Li-P II). Perbedaan utama Li-P dan Mn-P adalah asal substrat pereduksi. Li-P mengkatalis oksidasi senyawa lignin non-fenolik serupa dengan perubahan veratril alkohol menjadi veratril aldehide (Perez et al., 2002).
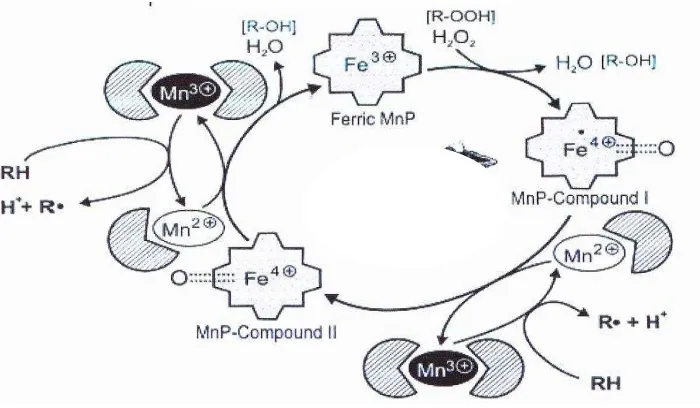
Gambar 2.11. Siklus katalitik Mn-P (Sumber: Perez et al., 2002)
Oksidasi lignin dan senyawa fenolik lain oleh Enzim Mn-P tergantung pada ion Mn bebas. Substrat pereduksi utama dalam siklus katalitik Mn-P adalah Mn2+ yang secara efesien mereduksi senyawa I (Mn-P compound I) menjadi senyawa II (Mn-P compound II), menghasilkan Mn3+ yang selanjutnya mengoksidasi substrat organik. Mn2+ berikatan dengan chelator asam organik untuk menstabilkan Mn3+. Siklus katalitik Mn-P dimulai dengan pengikatan H2O2
atau peroksida organik dengan enzim Ferric alami dan pembentukan kompleks besi peroksida (Gambar 2.11)(Perez et al., 2002).
Gambar 2.12. Skema pembentukan CO2 dari struktur aromatik lignin oleh
Mn-P(Perez et al., 2002).
Reaksi awal Mn3+ dengan cincin fenolik adalah suatu oksidasi 1 elektron menjadi radikal fenoksil yang terdapat dalam mesomer yang berbeda (Gambar 2.12). Secara simultan chelat asam organik dioksidasi menjadi feroksil dan radikal lain yang mungkin menghasilkan superoksida yang cendrung bereaksi dengan radikal berpusat karbon menjadi bentuk eter peroksida yang mengalami pembelahan cincin yang dihasilkan dalam pembentukan struktur alifatik. Selanjutnya sistem enzim Mn-P membelah gugus ini menjadi CO2 dan radikal
alifatik yang selanjutnya mengalami reaksi dengan dioksida menghasilkan CO2
lebih banyak dan bahan organik dengan berat molekul rendah seperti asam format(Perez et al., 2002).
Enzim Laccase/Lac (EC 1.10.3.2, benzenediol:oxygen oxidoreductase) merupakan fenol oksidasi mengandung tembaga yang tidak membutuhkan H2O2
tetapi menggunakan molekul oksigen (Thurston, 1994). Laccase berperan mengoksidasi gugus fenol menjadi kuinon. Ishihara (1980) menyatakan Laccase
metoksi menjadi methanol. Disamping itu terdapat kelompok enzim fenol oksidase (laccase dan tirosinase) yang mengoksidasi gugus δ dan p-fenol serta gugus amina menjadi kuinon dan memberi perubahan warna terhadap substansi fenolik 1-naftol dan p-kresol. Kersten et al. (1990) menyatakan laccase mereduksi O2 menjadi H2O dalam substrat fenolik melalui reaksi satu elektron membentuk
radikal bebas. Dengan adanya elektron seperti ABTS ( 2.2-azinobis/3-ethylbenzthiozoline-6-sulphonate) atau HBT (Hydroxybenzotriazole), Laccase
mampu mengoksidasi senyawa nonfenolik tertentu dan veratryl alcohol.
b. Pendegradasi selulosa
Degradasi selulosa merupakan proses pemecahan polimer anhidroglukosa menjadi molekul yang lebih sederhana. Proses ini menghasilkan oligo, tri atau disakarida seperti selobiosa, selotriosa, monomer glukosa, CO2 dan H2O.
Degradasi selulosa dapat dilakukan secara biologis (aktivitas enzim mikroba), fisik maupun kemis. Sejumlah mikroba mampu menghidrolisis selulosa sampai taraf tertentu. Maranatha (2008) menyebutkan mikroba selulolitik dari kelompok bakteri mempunyai tingkat pertumbuhan cepat dan aktivitas selulolitik tinggi.
Mikroba selulolitik khususnya bakteri banyak ditemukan pada tanah tanah pertanian, hutan, jaringan hewan, saluran pencernaan herbivora baik rumen, sekum maupun kolon, rayap (air liur, sel tubuh, saluran pencernaan maupun sarangnya) serta pada tumbuhan yang membusuk/mati. Bakteri di alam yang bersifat selulolitik antara lain; Clostridium (C. acetobutylicum, C. thermocellum), Bacillus sp., Acidothermus, Pseudomonas (P. cellulosa), Rhodothermus
Gandjar, 2006), Fibrobacter succinogenes, Ruminococcus albus, Ruminococcus flavefaciens, Butytrivibrio fibrisolvens (Lynd et al., 2002)
Lynd et al. (2002) mengungkapkan bahwa perombakan selulosa oleh kelompok bakteriselulolitik berlangsung melalui beberapa tahapan. Tahap pertama adalah menguraikan polimer selulosa secara random/acak oleh enzim
carboxymethilcelulase/CMC-ase atau endo β-1,4 glukanase dengan cara memecah ikatan hidrogen yang ada di dalam struktur kristalin/amorf selulosa (ikatan internal α-1,4-glukosida) sehingga terbentuk rantai-rantai individu selulosa (oligodekstrin). Adanya sekresi enzim endo-β-1,4-glukanase (CMC-ase) yang dihasilkan oleh bakteri selulotik dapat memutuskan ikatan β-1,4 glikosida (Teather dan Wood, 1982 dalam Lema, 2008). Tahap kedua adalah penguraian selulosa dari ujung pereduksi dan non pereduksi oleh eksoglukanase
(selodektrinase dan selobiohydrolase) melalui pemotongan ujung-ujung rantai individu selulosa (ujung pereduksi dan non-pereduksi) sehingga menghasilkan disakarida dan tetrasakarida (misal selobiosa). Hidrolisis bagian berkristal selulosa hanya dapat dilakukan secara efisien oleh enzim eksoglukanase. Tahap ketiga (terakhir) adalah tahap penguraian selobiosa menjadi glukosa oleh enzim β -glukosidase/glukohydrolase (Gambar 2.13).
Kemampuan degradasi selulosa berbagai bakteri bervariasi yang dipengaruhi oleh jenis/spesies, substrat maupun lingkungan. Chen dan Weimer (2001) mengungkapkan bakteri selulolitik akan dominan dalam rumen ruminansia apabila ternak diberikan pakan hijauan atau pakan kaya serat. Lebih lanjut diungkapkan bahwa dalam kondisi jumlah substrat cukup tersedia, populasi
Ruminococcus flavifaciens, Fibrobacter succinogenes dan Ruminococcus albus
terdapat dalam jumlah hampir seimbang tetapi bila jumlah substrat terbatas populasi Ruminococcus flavifaciens akan lebih tinggi dibandingkan Fibrobacter succinogenes dan Ruminococcus albus. Namun hasil penelitian Berra-Maillet et al. (2004) menunjukkan bahwa populasi Fibrobacter succinogenes adalah paling besar di dalam rumen sapi dan domba.
c. Pendegradasi hemiselulosa
Degradasi hemiselulosa merupakan proses pemecahan polimer hetero polisakarida menjadi molekul yang lebih sederhana. Proses ini menghasilkan monomer yang mengandung glukosa, mannosa, galaktosa, xilosa, arabinosa dan
4-0 methyl-glukoronik, D-galacturonic dan D-glukoronik (Perez et al., 2002). Degradasi hemiselulosa dapat dilakukan secara biologis (aktivitas enzim mikroba), fisik maupun kemis. Berbagai mikroba di alam mampu menghasilkan enzim pendegradasi hemiselulosa (hemiselulase), antara lain Trichoderma, Aspergillus, Bacillus sp, Aeromonascaviae, Neurospora sitophila, Cryptococcus,
Degradasi hemiselulosa oleh bakteri hemiselulolitik merupakan hasil dari aktivitas komplek enzim hemiselulaseyang terdiri atasendo-β-1,4-xylanase,
ekso-β-1,4-xylosidase, endo-arabinase, α-L-arabinofuranosidase, endo- β
-1,4-mananase, dan ekso- β-1,4-mannosidase (Gambar 2.14). Mengingat komponen utama dari hemiselulosa adalah xilan dan mannan, maka enzim yang berperanan utama mendegradasi hemiselulosa adalah kompleks enzim xylanase dan kompleks enzim mananase (Howard et al., 2003; Perez et al., 2002).
a b
Gambar 2.14. Biodegradasi Hemiselulosa (Sumber: Howard et al.,2003; Perez et al.,
2002)
(a:Degradasi Xilan, b: Degradasi Mannan)
Degradasi sempurna dari xilan membutuhkan enzim-enzim yang bekerja secara sinergis, seperti endo-1,4-β-xilanase, 1,4-β-xilosidase, α-glukuronidase, α -L-arabinofuranosidase, asetil, furoloil, p-kumaril-esterase dan asetil-esterase
(Coughlan and Hazlewood, 1993; Olempska-Beer, 2004) (Gambar 2.14a). Enzim
endo-1,4-β-xylanase bertugas menghidrolisis ikatan β-1,4 dalam rantai silan menghasilkan silooligomer pendek yang selanjutnya akan dihidrolisis menjadi unit silosa tunggal oleh β-silosidase. Enzim α-D-glukorosidase menghidrolisis ikatan α-1,2-glikosidik dari asam 4-O-metil-D-glukoronik rantai samping silan.
Asetil esterase menghidrolisis substitusi asetil pada silosa dan feruloil esterase
Feruloil esterase dapat melepaskan hemiselulosa dari lignin dan sehingga lebih mudah didegradasi oleh hemiselulase lain.
Degradasi sempurna dari senyawa mannanosa membutuhkan adanya kompleks enzim mananase yang terdiri dari; endo-β-D-mananase, ekso-β
-D-mananase, α-D-manosidase, dan D-glukosidase (Gambar 2.14b). Enzim β
-D-mananase menghidrolisis bagian tengah rantai manan,galaktomanan dan glukomanan, sedangkan β-D-glukosidase menghidrolisisi rantai sampingnya. Aktivitas hidrolisis dari kompleks enzim tergantung pada tife enzim dan struktur mannan sebagai substrat.
2.4. Cacing Tanah (Lumbricus rubellus) Sebagai Sumber Isolat Bakteri
Lignoselulolitik
Cacing tanah (Lumbricus rubellus) merupakan hewan tidak bertulang belakang (Invertebrata) yang digolongkan ke dalam filum Annelida, ordo
Oligochaeta, dan kelas Chaetopoda yang hidup dalam tanah. Penggolongan ini didasarkan pada bentuk morfologinya karena tubuhnya tersusun atas segmen-segmen yang berbentuk cincin (annulus), setiap segmen memiliki beberapa pasang seta, yaitu struktur berbentuk rambut yang berguna untuk memegang substrat dan bergerak (Khairuman dan Khairul, 2009).
organik, serta berbagai asam amino) dan hormon. Lebih lanjut dikemukakan bahwa cacing tanah (Lumbricus rubellus) juga mampu mendegradasi senyawa antinutrisi dan lignoselulosa, memproduksi antibiotika, chitinase dan glucanase, pigmen fluorescent siderophores, serta berbagai growth promotor melalui pelarutan mineral dan menekan mikroba patogen, serta memproduksi hormon 1-aminocyclopropane-1carboxylate (ACC) deaminase, dan menekan mikroba patogen.
Owa et al., (2013) menunjukkan dari saluran pencernaan cacing tanah
Libyodrilus violaceus berhasil diisolasi bakteri Acinobacter sp, Kiebsiella sp, Bacillus sp., B. brevis, B. cereus, B. lalerosporus, B. lichenoform, P. vulgaris,
Pseudomonas s, Alcaligans faecalis, Corynebacterium sp., E. cloacae, Erwinia
salicie, Flavobacterium sp., F. aquartile, Micrococcus inteus, M. kristinae, M.
Varians dan Proteus rennvi. Hasil penelitian yang dilakukan oleh Susanti (2007) juga menyatakan bahwa dalam saluran pencernaan cacing tanah terdapat bakteri selulolitik.
Beberapa jenis cacing tanah telah dilaporkan mengandung zat aktif yang bersifat anti bakteri patogen seperti Eisinia foetida (Lange et al., 1999 disitasi Julendra et al., 2007), Theromyzon tessulatum (Tasiemski et al., 2004 disitasi Julendra et al., 2007), Lumbricusrubellus (Cho et al., 1998 disitasi Julendra et al., 2007) dan dapat menstimulasi sistem kekebalan (Liu et al., 2004; Engelmann et al., 2005 disitasi Julendra et al., 2007). Cacing tanah jenis Allolobophora rosea