ENZIM
LAPORAN RESMI PRAKTIKUM
BIOKIMIA
Disusun oleh : Nama : William Kristiandi
NIM : 14.I1.0094 Kelompok F6
PROGRAM STUDI TEKNOLOGI PANGAN
FAKULTAS TEKNOLOGI PERTANIAN
UNIVERSITAS KATOLIK SOEGIJAPRANATA
SEMARANG
1. PENDAHULUAN
2.1. Tinjauan Pustaka
Enzim adalah substansi yang dihasilkan oleh sel-sel hidup dan beperan sebagai katalisator pada reaksi kimia yang berlangsung dalam organisme. Katalisator adalah substansi yang mempercepat reaksi tetapi pada hasil reaksi, substansi tersebut tidak berubah (Gaman & Sherrington, 1994). Molekul-molekul dalam sitoplasma yang mengubah gula menjadi alkohol disebut enzim. Enzim adalah molekul protein yang sangat besar (Volk & Wheeler, 1993). Enzim proteolitik merupakan salah satu enzim yang diproduksi oleh mikroba dan secara ekonomi mempunyai banyak kegunaan, misalnya dalam bidang industri baik industri makanan, minuman, farmasi, ataupun industri kimia lainnya (Poernomo, 2004). Beberapa enzim hanya terdiri atas protein, tetapi kebanyakan enzim mengandung komponen non protein tambahan seperti karbohidrat, lipid, logam, fosfat, atau beberapa organ lain (Winarno, 1997).
Enzim dikatakan mempunyai sifat sangat khas karena hanya bekerja pada substrat dan bentuk reaksi tertentu. Fungsi enzim adalah sebagai berikut :
1. Merendahkan energi aktivasi suatu zat A akan berubah menjadi zat B jika sekurang-kurangnya sebagian dari zat A mendapatkan cukup energi sehingga dapat berada dalam keadaan aktif atau dalam keadaan transisi yang kemudian bisa berubah menjadi zat B. Energi itu dinamakan energi aktivasi.
2. Mempercepat reaksi pada suhu dan tekanan tetap tanpa mengubah tetapan seimbangnya.
3. Mengendalikan reaksi. (Martoharsono, 1991).
Aktivitas enzim sangat dipengaruhi oleh beberapa hal sebagai berikut : 1. Spesifitas
Aktivitas enzim sangat spesifik. Pada umumnya enzim tertentu hanya akan mengkatalisis satu reaksi saja. Sebagai contoh, laktase menghidrolisis gula laktosa tetapi tidak berpengaruh terhadap disakarida yang lain (Gaman & Sherrington, 1994). Enzim hanya dapat bekerja pada substrat tertentu karena enzim mempunyai spesifitas substrat yang tinggi. Pada konsentrasi substrat yang rendah maka
kecepatan reaksinya juga rendah dan kecepatan reaksi akan meningkat dengan meningkatnya konsentrasi substrat. Namun pada suatu saat akan tercapai suatu titik batas sehingga jika melampaui titik itu maka akan menunjukkan peningkatan yang kecil dengan bertambahnya konsentrasi substrat dan titik batas tersebut disebut titik optimum. Kecepatan reaksi katalitik enzim dapat mencapai kecepatan maksimal jika semua enzim menjadi bentuk enzim substrat dan konsentrasi enzim berkurang (Tranggono & Sutardi, 1990).
2. Pengaruh suhu
Aktivitas enzim sangat dipengaruhi oleh suhu. Pengaruh suhu terhadap aktivitas enzim yaitu pada suhu rendah sekitar –10˚C sampai –20˚C aktivitas enzim akan berlangsung sangat lambat. Kebanyakan enzim menunjukkan aktivitas optimal pada kisaran suhu 30–40˚C. Dalam kisaran suhu 45–50˚C, enzim mulai mengalami denaturasi (Tranggono & Sutardi, 1990). Pada suhu 100°C semua enzim rusak. Pada suhu yang sangat rendah, enzim tidak benar-benar rusak tetapi aktivitasnya sangat berkurang (Gaman & Sherrington, 1994).
Enzim sebagai protein akan mengalami denaturasi jika suhunya dinaikkan, akibatnya daya kerja enzim menurun (Gaman & Sherrington, 1994). Peningkatan temperatur dapat meningkatkan kecepatan reaksi karena molekul atom mempunyai energi yang lebih besar dan mempunyai kecenderungan untuk berpindah. Ketika temperatur meningkat, proses denaturasi juga mulai berlangsung dan menghancurkan aktivitas molekul enzim. Hal ini dikarenakan adanya rantai protein yang tidak terlipat setelah pemutusan iktatan yang lemah sehingga secara keseluruhan kecepatan reaksi akan menurun (Lee, 1992). Makin tinggi suhu maka makin besar pula laju reaksinya meskipun pada reaksi yang tidak dikatalis enzim apalagi yang dikatalis enzim, namun tetap tidak boleh melampaui batas ambang suhu maksimum enzim (Tranggono & Sutardi, 1990).
3. Pengaruh pH
juga menyebabkan denaturasi enzim dan mengakibatkan hilangnya aktivitas enzim. Beberapa enzim aktif pada pH asam yang agak rendah, pH 3 atau 4, dan yang lain mungkin aktif pada harga pH bisa setinggi 11 atau 12 tetapi kebanyakan enzim menunjukkan aktivitas maksimum pada kisaran netral pH 6-8 (Volk & Wheeler, 1993). Jika medium menjadi sangat asam atau sangat alkalis enzim mengalami inaktivasi. Akan tetapi beberapa enzim hanya beroperasi dalam keadaan asam atau alkalis. Enzim pada umumnya aktif pada pH 4-8 atau sekitar pH 6. Kebanyakan enzim mempunyai pH optimal sekitar 7 atau netral, dan jika medium menjadi sangat asam atau sangat alkalis enzim mengalami inaktivasi (Gaman & Sherrington, 1994).
Optimum pH suatu enzim adalah penting untuk penentuan karakteristik enzim. Jika enzim memiliki lebih dari satu substrat, maka pH optimumnya akan berbeda untuk setiap substrat. Juga beberapa enzim dapat mempertahankan aktivitasnya dengan adanya substrat atau koenzim (Tranggono & Sutardi, 1990). Alasan kecepatan reaksi enzim dipengaruhi pH adalah :
- Enzim merupakan protein yang terdiri dari residu asam amino.
- Residu asam amino memiliki kelompok sisi basa, netral atau asam yang mana dapat berubah pada pH yang ada.
- Enzim dapat aktif untuk mengkatalis saat residu setiap asam amino memiliki sisi aktif.
(Volk & Wheeler, 1993).
4. Pengaruh substrat
Substrat adalah senyawa yang terhadapnya mengeluarkan pengaruh katalisnya. Laju ativitas enzim akan meningkat dengan meningkatnya kadar substrat sampai titik tertentu. Pada saat enzim jenuh dengan substrat, penambahan kadar substrat tidak mempengaruhi kecepatan reaksi (Volk & Wheeler, 1993). Pada konsentrasi substrat yang rendah kecepatan reaksi juga rendah, dan kecepatan reaksi akan meningkat dengan meningkatnya konsentrasi substrat namun akan tercapai suatu titik batas sehingga bila melampaui titik itu maka kecepatan reaksinya hanya akan menunjukkan peningkatan yang kecil dengan bertambahnya konsentrasi substrat (Tranggono, 1989).
Enzim seringkali memerlukan bantuan substansi lain agar berfungsi secara efektif. Koenzim adalah substansi bukan protein yang mengaktifkan enzim. Beberapa vitamin B berfungsi sebagai koenzim. Beberapa ion anorganik misalnya ion kalsium dan klorida menaikkan aktivitas beberapa enzim dan dikenal sebagai aktivator (Gaman & Sherrington, 1994).
Larutan buffer atau disebut juga sebagai larutan penyangga, merupakan larutan yang tahan terhadap perubahan pH, baik itu karena penambahan asam atau basa, dan membutuhkan pH yang terkontrol dan tepat (Fardiaz, 1992). Buffer dapat mempertahankan kondisi enzim presipitat agar tidak terjadi perubahan pH dan mencegah agar enzim tidak mengalami inaktivasi (Winarno, 1995). Aktivitas enzim biasanya akan terjadi pada kisaran pH yang sempit, oleh karena itu buffer digunakan untuk memelihara media enzim agar pH-nya tidak banyak berubah. Amilase akan memperlihatkan aktivitas maksimumnya pada pH 4,8. Apabila tidak ditambah buffer, namun enzim berada pada kisaran pH-nya maka aktivitas enzim dapat ditentukan secara langsung. Jika ada enzim yang memiliki lebih dari satu substrat, maka pH optimumnya akan berlaku untuk setiap substrat (Tranggono & Sutardi, 1989). Fosfat bersifat inhibitor terhadap beberapa enzim atau bahkan sebagai metabolit dalam beberapa percobaan. Logam berat mudah mengendap sebagai fosfat dalam larutan, dan ini mempunyai aksi buffer sangat kecil pada pH diatas 7,5 (Tranggono et al., 1989). Adanya garam dapat mempengaruhi aktivitas enzim, karena garam bisa mengikat air sehingga kelarutan enzim sebagai protein akan berkurang dan selanjutnya kompleks enzim substrat sulit terbentuk (Noor, 1990).
Aktivitas enzim spesifik adalah jumlah unit aktivitas enzim dibagi dengan jumlah kandungan protein, biasanya memiliki satuan milligram. Untuk pengukuran aktivitas spesifik, tingkat reaksi enzim diukur pada saat substrat mengalami kejenuhan, jadi kecepatan maksimumnya dapat ditentukan. Standart unit aktivitas adalah unit aktivitas enzim internasional (IU), dimana merupakan jumlah µmol dari substrat yang dikeluarkan tiap menit. Pada SI unit aktivitas 1 µkat = 1 IU (Reed & Rehm, 1995). Untuk mengetahui aktivitas enzim amilase dapat digunakan 4 metoda diantaranya : 1. Penurunan pada viskositas
2. Kehilangan kemampuan untuk memproduksi warna biru dengan iodine (jika direaksikan dengan iodine tidak membentuk warna biru)
3. Adanya kelompok-kelompok pereduksi
4. Peningkatan kandungan maltosa, glukosa, atau dekstrin (Whittaker,1994).
Pengelompokan yang berdasarkan akhiran pada nama enzim tersebut, yaitu :
o Akhiran ase, semua enzim yang memakai akhiran ini memiliki fungsi mengkatalisis hidrolisis substrat tertentu.
o Akhiran in, semua enzim yang memakai akhiran ini berarti menerangkan substrat apa yang diuraikan oleh enzim tersebut (Martoharsono,1994).
Amilase adalah enzim golongan glikosida hidrolase yang paling penting. Enzim pengurai pati ini dapat dipilah ke dalam 2 kelompok, ada yang disebut enzim percabangan yang secara khas menghidrolisis ikatan (1,6) antara rantai-rantai, dan enzim-enzim yang memutuskan ikatan (1,4) antara satuan glukosa pada rantai lurus. Alfa amilase (α-1,4-Glukosa 4-glukanohidrolase) merupakan endoenzim yang menghidrolisis ikatan α-1,4-glukosida secara acak sepanjang rantai. Enzim ini menghidrolisis amilopektin menjadi oligosakarida yang mengandung 2-6 satuan glukosa. Beta amilase (α-1,4-Glukan maltohidrolase) hanya ditemukan dalam tumbuhan tinggi (deMan, 1997).
Pati dapat dihidrolisa dengan penambahan enzim amilase disertai pemanasan. Proses peruraiannya adalah pati menjadi dekstrin, dekstrin menjadi maltosa, maltosa menjadi glukosa. Secara kuantitatif, terjadinya reaksi hidrolisis pati oleh enzim amilase dapat diketahui dengan tes iodine. Karbohidrat golongan polisakarida seperti amilum yang diuji dengan iodine menghasilkan warna biru keunguan, sedangkan glikogen dan dekstrin menghasilkan warna merah coklat. Monosakarida atau disakarida yang diuji dengan iodine tidak menghasilkan warna tertentu atau tidak berwarna. Hasil hidrolisis akan mengalami perubahan warna dari biru menjadi ungu kemudian merah jambu dan terakhir menjadi tidak berwarna (Pattison, 1992).
Proses pemanasan mempunyai tujuan untuk menghidrolisis amilum sehingga struktur spiral pada pati merenggang dan pati terurai menjadi molekul-molekul yang sederhana (Pattison, 1992). Renggangnya struktur molekul pati tersebut akan menyebabkan molekul-molekul iodin ketika bereaksi dengan pati menjadi terlepas sehingga warna biru keruh dapat hilang (Winarno, 1995). Semakin tinggi suhu, reaksi semakin cepat berlangsung sampai pada titik tertentu akan terjadi perubahan struktur enzim sehingga sifat katalitiknya akan hilang (Hartati et al. 2003).
Penyimpanan enzim yang dilakukan di dalam pendingin sebelum digunakan dalam percobaan aktivitas enzim adalah untuk mencegah terjadinya kehilangan aktivitas akibat denaturasi enzim atau hilangnya kofaktor yang penting. Dimana dengan perlakuan ini akan menjamin kehilangan aktivitas enzim lebih minimal. Dan aktivitas dari enzim berfungsi sebagai pelunak bahan dengan melakukan pemecahan protein (Gaman & Sherrington, 1994). Sentrifugasi adalah pemisahan antara 2 komponen yaitu cairan yang tidak saling melarutkan atau cairan dengan padatan yang terdispersi di dalamnya (Suyitno, 1989). Tujuan sentrifugasi adalah untuk memisahkan enzim. Dengan proses sentrifugasi dihasilkan 2 fase yaitu endapan dan cairan (Wirahadikusumah, 1977).
Beberapa metode untuk menentukan aktivitas enzim adalah metode yang berdasarkan perbedaan nilai absorbansi, perbedaan elektrometri, dan perbedaan fluorometri. Metode absorbansi dipengaruhi oleh konsentrasi dan kejernihan larutan. Semakin pekat dan keruh suatu larutan, absorbansinya semakin tinggi. Nilai absorbansi berbanding terbalik dengan aktivitas enzimnya (Fox, 1991). Aktivitas enzim dapat diukur dengan cara kualitatif dan cara kuantitatif. Secara kualitatif adalah cara pengukuran dengan menggunakan substrat tertentu yang bisa dikatalis oleh enzim yang bersangkutan. Sedangkan secara kuantitatif adalah cara mengukur laju reaksi antara enzim dengan suatu substrat tertentu (Tranggono & Sutardi, 1990).
Spektrofotometri merupakan pengukuran jauhnya penyerapan energi cahaya oleh suatu sistem kimia itu sebagai fungsi dari panjang gelombang radiasi (Day & Underwood, 1992). Kesalahan-kesalahan dalam spektrofotometer yaitu :
Kuvet kotor atau tergores
Ukuran kuvet yang tidak seragam
Penempatan kuvet yang tidak tepat
Adanya gelembung udara dalam larutan
Panjang gelombang yang dihasilkan tidak sesuai dengan yang tertera pada alat
Kurang sempurna dalam penyiapan larutan sampel dan blanko (Pomeranz & Meloan, 1994).
Absorbasi merupakan nilai konstan dari intensitas penyerapan. Harga dari absorbasi ini akan dipengaruhi oleh yang utama adalah konsentrasi, tebal dan intensitas penyinaran. Dapat ditemukan tanda-tanda bahwa ada akibat lainnya yaitu suhu, zat yang terlarut dan panjang gelombang. Suhu sebagai penyebab pengaruh pada konsentrasi perubahan volume. Jika konsentrasi semakin meningkat, maka besar nilai absorbasinya juga akan semakin meningkat pula (Wilford, 1987). Tingkat kejadian absorbsi juga akan bergantung pada jarak radiasi melewati larutan itu. Serapan juga tergantung pada panjang gelombang radiasi dan sifat dasar spesies molekul dalam larutan (Day & Underwod, 1992).
Enzim protease atau proteolitik dapat digolongkan menjadi 2 macam, yaitu : enzim eksopeptidase dan enzim endopeptidase. Golongan enzim eksopeptidase digolongkan menjadi karbosil (ekso) peptidase dan amino (ekso) peptidase yang berturut – turut memotong peptida dari arah gugus karboksil termal dan gugus amino terminal. Sedangkan endopeptidase memecah protein atau ikatan ke dalam atau memecah protein dari dalam (Winarno, 1995). Suatu kelompok enzim proteolitik mempunyai peranan yang besar dalam memecah molekul protein dengan cara hidrolisa ikatan peptida. Enzim proteolitik dapat berfungsi untuk membuat daging lebih empuk. Degradasi ini dapat ditingkatkan dengan pemanasan seperti yang dilakukan dalam proses pemasakan (Tranggono & Sutardi, 1990).
2. Tujuan Praktikum
Tujuan dilakukannya praktikum ini yaitu untuk mengetahui aktivitas enzim pada berbagai bahan pangan dan cara mengekstrak enzim amilase dan protease pada bahan pangan tersebut, dan mengetahui faktor-faktor yang mengetahui aktivitas enzim tersebut.
3. MATERI DAN METODE
3.1. Materi 3.1.1. Alat
Alat-alat yang digunakan dalam praktikum ini yaitu mortar, alu, beker glass, pengaduk, baskom, gelas ukur, kain kasa, tabung sentrifuge, sentrifuge, tabung reaksi, rak tabung reaksi, pipet volume, pompa Pilleus, waterbath, vortex, spektrofotometer, hotplate, dan timer. 3.1.2. Bahan
Bahan-bahan yang digunakan dalam praktikum ini antara lain pepaya muda, larutan buffer sitrat fosfat pH 4 yang mengandung NaCl 2%, es batu, buffer sitrat pH 5 yang mengandung amilum 1%, iodine 0,01 N, aquades, buffer sitrat fosfat pH 4, buffer sitrat fosfat pH 6, buffer sitrat fosfat pH 8, amilum 1%, azokasein, larutan asam trikloroasetat 10%, dan NaOH 0,5 M.
3.2. Metode
3.1.1. Ekstraksi Enzim
Dalam ekstraksi enzim ini menggunakan pepaya muda sebagai sampelnya. Sampel diambil sebanyak 12,5 gram dan dihancurkan di dalam 50 ml larutan buffer sitrat fosfat pH 4 yang mengandung NaCl 2%. Kemudian sampel tersebut diaduk di dalam baskom berisi es batu selama 30 menit, lalu disaring dengan kain kasa. Selanjutnya sampel dimasukkan dalam tabung sentrifuge dan di sentrifuge dengan kecepatan 2000 rpm selama 10 menit. Kemudian supernatan (bagian jernih) diambil dan disimpan pada tabung reaksi, sedangkan ekstrak enzim disimpan pada suhu dingin untuk selanjutnya digunakan pada metode yang lain. 3.1.2. Pengukuran Aktivitas Amilase
Buffer sitrat pH 5 yang mengandung amilum 1% diambil sebanyak 1 ml dan diinkubasi pada suhu 370C selama 2 menit. Kemudian ditambahkan 0,1 ml ekstrak enzim dan diinkubasi pada suhu 370C selama 10 menit, lalu ditambahkan 0,5 ml iodine 0,01 N pada waktu akhir inkubasi. Selanjutnya diencerkan dengan 9,4 ml aquades dan di-vortex sampai homogen. Larutan yang diperoleh kemudian diukur absorbansinya dengan menggunakan spektrofotometer dengan panjang gelombang 620 nm. Untuk kontrol digunakan 1 ml buffer sitrat fosfat yang mengandung amilum 1% dengan 0,5 ml iod 0,01 N dan diencerkan dengan 8,5 ml aquades. Sedangkan untuk blankonya digunakan 0,5 ml iod 0,01 N dengan 9,5 ml aquades. Setelah diukur absorbansinya, dapat dihitung aktivitas enzim amilase dan enzim spesifiknya dengan rumus :
Aktivitas enzim amilase = 3.1.3. Pengaruh pH terhadap Aktivitas Enzim Amilase
Dalam metode ini digunakan 3 tabung reaksi. Tabung 1 diisi dengan 1 ml buffer sitrat fosfat pH 4, tabung 2 diisi dengan 1 ml buffer sitrat fosfat pH 6, dan tabung 3 diisi dengan 1 ml buffer sitrat fosfat pH 8. Kemudian tabung reaksi tersebut diinkubasi dalam waterbath pada suhu 370C selama 2 menit. Lalu ditambahkan 0,1 ml ekstrak enzim dan diinkubasi lagi selama 10 menit dengan suhu yang sama. Selanjutnya ditambahkan iodine 0,01 N sebanyak 0,5 ml pada akhir waktu inkubasi dan diencerkan dengan 9,4 ml aquades, lalu di-vortex
hingga homogen. Kemudian absorbansi diukur dengan spektrofotometer pada panjang gelombang 620 nm.
3.1.4. Pengaruh Suhu terhadap Aktivitas Enzim Amilase
Disiapkan 3 tabung reaksi yang masing-masing diisi dengan 1 ml buffer sitrat fosfat pH 5 yang mengandung amilum 1%, lalu diinkubasi pada suhu 370C selama 2 menit. Kemudian ditambahkan 0,1 ml ekstrak enzim pada masing-masing tabung reaksi. Tabung 1 menit dibiarkan pada suhu kamar (300C) selama 30 menit, tabung 2 dipanaskan dalam waterbath pada suhu 400C selama 10, sedangkan tabung 3 menit dipanaskan pada hotplate dengan suhu 1000C selama 10. Selanjutnya ditambahkan 0,5 ml iodine 0,01 N pada akhir waktu inkubasi, dan diencerkan dengan 9,4 ml aquades lalu di-vortex hingga homogen. Lalu absorbansinya diukur dengan spektrofotometer pada panjang gelombang 620 nm.
3.1.5. Pengukuran Aktivitas Protease
Dalam metode ini mula-mula tabung reaksi diisi dengan 1,2 ml azokasein dan 1,8 ml buffer sitrat fosfat pH 6. Lalu ditambahkan 0,6 ml ekstrak enzim dan diinkubasi dalam waterbath
pada suhu 370C selama 2 menit. Kemudian dari larutan tadi diambil 1,2 ml dan dimasukkan dalam tabung sentrifuge yang sudah diisi dengan 0,8 ml larutan asam trikloroasetat 10%. Selanjutnya disentrifuge dengan kecepatan 3000 rpm selama 10 menit. Supernatan yang diperoleh diambil sebanyak 1,6 ml dan ditambahkan dengan 1,6 ml NaOH 0,5 M dan
di-vortex. Lalu absorbansinya diukur dengan spektrofotometer pada panjang gelombang 440 nm. Untuk larutan blanko digunakan 3,6 ml aquades. Aktivitas enzim protease dan enzim spesifik dapat dihitung dengan menggunakan rumus :
Aktivitas enzim spesifik =
aktivitas protease(unit)
kadar protein(ppm)
3.1.6. Pengaruh pH terhadap Aktivitas Enzim Protease
Disiapkan 3 tabung reaksi yang masing-masing diisi dengan 1,2 ml azokasein. Pada tabung 1 ditambahkan 1 ml buffer sitrat fosfat pH 4, tabung 2 ditambahkan 1 ml buffer sitrat fosfat pH 6, dan tabung 3 ditambahkan 1 ml buffer sitrat fosfat pH 8. Lalu ditambahkan 0,6 ml ekstrak enzim dan diinkubasi dalam waterbath selama 2 menit pada suhu 370C. Dari larutan ini diambil 1,2 ml dan dimasukkan dalam tabung sentrifuge yang sudah diisi dengan 0,8 ml larutan trikloroasetat 10%, lalu disentrifuge dengan kecepatan 3000 rpm selama 10 menit. Supernatan yang diperoleh diambil sebanyak 1,6 ml dan ditambahkan dengan 1,6 ml NaOH 0,5 M dan di-vortex. Absorbansinya diukur dengan spektrofotometer pada panjang gelombang 440 nm. Untuk larutan blanko digunakan 1,2 ml azokasein dan 2,4 ml buffer sitrat fosfat pH 6.
3.1.7. Pengaruh Suhu terhadap Aktivitas Enzim Protease
Pada metode ini, disiapkan 3 tabung reaksi yang masing-masing diisi dengan 1,2 ml azokasein dan 1,8 ml buffer sitrat fosfat pH 6, lalu ditambahkan 0,6 ml ekstrak enzim. Tabung 1 dibiarkan pada suhu kamar (300C) selama 30 menit, tabung 2 dipanaskan dalam
4. HASIL PENGAMATAN
4.1. Pengujian Aktivitas Enzim Amilase
Data hasil pengujian dari aktivitas enzim amilase dapat dilihat pada Tabel 1.
Tabel 1. Pengujian Aktivitas Enzim Amilase
Kel Bahan Absorbansi Aktivitas (mg/menit) Akt. Enzim Spesifik
F1
Blanko 0,000 -
-Kontrol 0,1311 -
-Papaya Muda 0,1370 -3,150 x 10 – 3 -1,500 x 10 – 7
Dari tabel diatas dapat diketahui bahwa nilai aktivitas sampel papaya muda sebesar -3,150 x 10 – 3mg/menit dengan nilai aktivitas enzim spesifik sebesar -1,500 x 10 – 7 .
4.2. Pengaruh pH terhadap Aktivitas Enzim Amilase
Data hasil pengujian pengaruh pH terhadap aktivitas enzim amilase dapat dilihat pada Tabel 2.
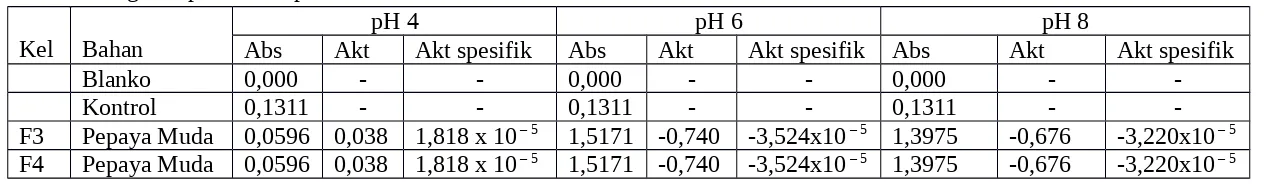
Tabel 2. Pengaruh pH terhadap Aktivitas Enzim Amilase
Kel Bahan Abs AktpH 4Akt spesifik Abs AktpH 6Akt spesifik Abs AktpH 8 Akt spesifik
Blanko 0,000 - - 0,000 - - 0,000 -
-Kontrol 0,1311 - - 0,1311 - - 0,1311 -
-F3 Pepaya Muda 0,0596 0,038 1,818 x 10 – 5 1,5171 -0,740 -3,524x10 – 5 1,3975 -0,676 -3,220x10 – 5 F4 Pepaya Muda 0,0596 0,038 1,818 x 10 – 5 1,5171 -0,740 -3,524x10 – 5 1,3975 -0,676 -3,220x10 – 5
Pada pengaruh pH terhadap aktivitas enzim amilase hanya dilakukan oleh kelompok F3 dan F4. Dari data di atas diketahui bahwa absorbansi dari aktivitas enzim amilase dengan pengaruh pH lebih tinggi pada sampel pepaya muda yaitu 1,5171 (pH 6); 1,3975 (pH 8); dan 0,0596 (pH 4). Sedangkan aktivitas enzim amilase dan enzim spesifiknya setelah hanya pada sampel pH 4 yang menghasilkan data yang bernilai positif.
4.3. Pengaruh Suhu terhadap Aktivitas Enzim Amilase
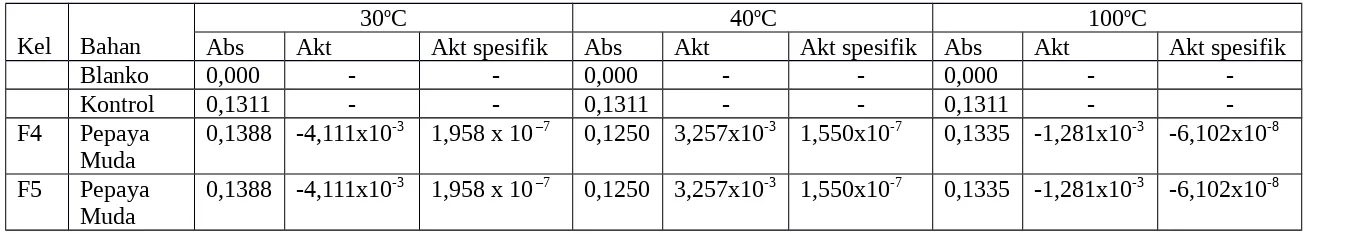
Data yang diperoleh dari pengujian pengaruh suhu terhadap aktivitas enzim dapat dilihat pada Tabel 3. Tabel 3. Pengaruh Suhu terhadap Aktivitas Enzim Amilase
Kel Bahan
30oC 40oC 100oC
Abs Akt Akt spesifik Abs Akt Akt spesifik Abs Akt Akt spesifik
Blanko 0,000 - - 0,000 - - 0,000 -
-Kontrol 0,1311 - - 0,1311 - - 0,1311 -
-F4 Pepaya Muda
0,1388 -4,111x10-3 1,958 x 10 –7 0,1250 3,257x10-3 1,550x10-7 0,1335 -1,281x10-3 -6,102x10-8
F5 Pepaya Muda
0,1388 -4,111x10-3 1,958 x 10 –7 0,1250 3,257x10-3 1,550x10-7 0,1335 -1,281x10-3 -6,102x10-8
Pada pengaruh suhu terhadap aktivitas enzim hanya dilakukan oleh kelompok F4 dan F5. Suhu yang digunakan yaitu 300C, 400C, dan 1000C. Pada absorbansi suhu 300C yaitu 0,1388; suhu 400C yaitu 0,1250, dan pada 1000C absorbansinya 0,1335.
4.4. Pengujian Aktivitas Enzim Protease
Data hasil pengujian aktivitas enzim protease terhadap bahan papaya muda dapat dilihat pada Tabel 4. Tabel 4. Pengujian Aktivitas Enzim Protease
Kel Bahan Absorbansi Aktivitas (mg/menit) Akt. Enzim Spesifik
F6 Blanko 0,000 -
-Papaya Muda 0,2023 0,202 9,633 x 10 – 6
4.5. Pengaruh pH terhadap Aktivitas Enzim Protease
Data yang diperoleh dari hasil pengujian pengaruh pH terhadap aktivitas enzim protease dari buah papaya muda dapat dilihat pada Tabel 5. Tabel 5. Pengaruh pH terhadap Aktivitas Enzim Protease
Kel Bahan Abs AktpH 4Akt spesifik Abs AktpH 6Akt spesifik Abs AktpH 8 Akt spesifik
Blanko 0,000 - - 0,000 - - 0,000 -
-F7 Pepaya Muda 0,0670 0,067 3,190x10-6 0,1096 0,1096 5,219x10-6 0,0862 0,086 4,105x10-6 F8 Pepaya Muda 0,0670 0,067 3,190x10-6 0,1096 0,1096 5,219x10-6 0,0862 0,086 4,105x10-6
Pada pengaruh pH terhadap aktivitas enzim amilase hanya dilakukan oleh kelompok F7 dan F8. Dari data di atas diketahui bahwa absorbansi dari aktivitas enzim protease dengan pengaruh pH lebih tinggi pada sampe pepaya muda yaitu 0,670 (pH 4); 0,1096 (pH 6); dan 0,0862 (pH 8). Sedangkan aktivitas enzim amilase dan enzim spesifiknya setelah dihitung memuncak pada pH 6.
4.6. Pengaruh Suhu terhadap Aktivitas Enzim Protease
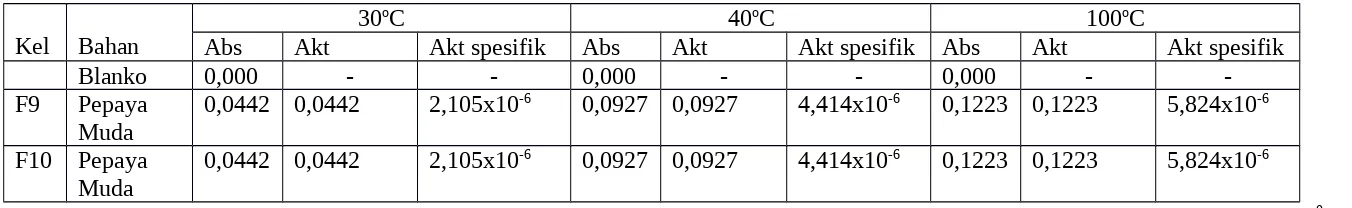
Data hasil pengujian pengaruh suhu terhadap aktivitas enzim protease dari buah papaya muda dapat dilihat pada Tabel 6. Tabel 6. Pengaruh Suhu terhadap Aktivitas Enzim Protease
Kel Bahan
30oC 40oC 100oC
Abs Akt Akt spesifik Abs Akt Akt spesifik Abs Akt Akt spesifik
Blanko 0,000 - - 0,000 - - 0,000 -
-F9 Pepaya
Muda 0,0442 0,0442 2,105x10
-6 0,0927 0,0927 4,414x10-6 0,1223 0,1223 5,824x10-6
F10 Pepaya
Muda 0,0442 0,0442 2,105x10
-6 0,0927 0,0927 4,414x10-6 0,1223 0,1223 5,824x10-6
5. PEMBAHASAN
Dalam praktikum ini dilakukan 6 percobaan yaitu pengukuran aktivitas amilase, pengaruh pH terhadap aktivitas enzim amilase, pengaruh suhu terhadap enzim amilase, pengukuran aktivitas protease, pengaruh pH terhadap aktivitas enzim protease, dan pengaruh suhu terhadap enzim protease. Menurut Gaman & Sherrington (1994), enzim adalah substansi yang dihasilkan oleh sel-sel hidup dan beperan sebagai katalisator pada reaksi kimia yang berlangsung dalam organisme. Katalisator adalah substansi yang mempercepat reaksi tetapi pada hasil reaksi substansi tersebut tidak berubah / tidak membentuk produk samping. Enzim memiliki spesifitas tinggi terhadap substrat, yaitu hanya mengkatalis reaksi tertentu dengan substrat tertentu saja. Kelebihan enzim sebagai pengkatalis adalah dapat mempercepat reaksi kimia spesifik tanpa pembentukan produk samping (Winarno, 1995). Enzim menurut Martoharsono (1991), enzim mempunyai beberapa fungsi yaitu :
- merendahkan energi aktivasi
- mempercepat reaksi pada suhu dan tekanan tetap tanpa mengubah tetapan seimbangnya
- mengendalikan reaksi
Dalam percobaan ini, aktivitas enzim yang terdapat dalam bahan dihitung berdasar pada pengukuran absorbansi / dengan analisa spektrofotometri. Spektrofotometri menyiratkan pengukuran jauhnya penyerapan energi cahaya oleh suatu sistem kimia itu sebagai fungsi dari panjang gelombang radiasi (Day & Underwood, 1992). Hal ini didukung teori bahwa prinsip analisa kuantitatif secara spektroskopi yaitu membandingkan absorbsi energi radiasi pada panjang gelombang tertentu dari larutan sample terhadap larutan standar dimana dalam analisa spektroskopi, panjang gelombang yang digunakan disesuaikan dengan kemampuan zat tersebut mengabsorbsi energi radiasi pada panjang gelombang tersebut (DeMan, 1997). Absorbansi yang diukur dalam percobaan merupakan nilai konstan dari intensitas penyerapan. Harga dari absorbansi ini akan dipengaruhi oleh tebal, intensitas penyinaran, dan yang utama
adalah konsentrasi (Wilford, 1987). Makin tinggi nilai absorbansi, maka akan makin kecil nilai transmittancenya (DeMan, 1997).
Pada proses ekstraksi enzim dilakukan dengan cara bahan sebanyak 25 gram dihancurkan dengan 50 ml larutan buffer sitrat fosfat pH 4 yang mengandung NaCl 2% dan diaduk di dalam es (suhu rendah) selama 1 jam. Bahan dengan bahan yang digunakan sebagai sampel adalah papaya muda. Bahan ini sebelumnya dikupas terlebih dahulu bagian kulitnya dan dihaluskan untuk memudahkan dalam pengekstraksian. Hal ini sesuai dengan pendapat Fox (1991) bahwa pada kulit yang sering kontak dengan lingkungan mengakibatkan sulitnya mengekstraksi enzim tersebut, selain itu juga banyak bercampur dengan kotoran. Oleh karena itu digunakan bagian daging buahnya karena terdapat enzim dalam jumlah yang tidak terlalu banyak, namun lebih mudah diekstrak dan hasilnya lebih baik karena kotoran ataupun bahan lain jumlahnya sedikit. Bahan tersebut dihancurkan dengan diblender, tujuannya yaitu untuk memudahkan dalam pengekstraksian karena dengan adanya proses penghalusan bahan, maka luas permukaan bahan tersebut akan menjadi semakin luas sehingga enzim yang terdapat dalam bahan tersebut akan mudah bereaksi dengan buffer dan enzim tidak akan mengalami inaktivasi. Bahan juga dihancurkan dalam larutan buffer sitrat fosfat, karena dapat mempertahankan kondisi enzim presipitat agar tidak terjadi perubahan pH dan mencegah agar enzim tidak mengalami inaktivasi (Winarno, 1995). Fosfat pada ekstraksi ini bersifat inhibitor terhadap beberapa enzim atau bahkan sebagai metabolit (Tranggono et al., 1989). Sedangkan adanya garam pada buffer dapat mempengaruhi aktivitas enzim, karena garam bisa mengikat air sehingga kelarutan enzim sebagai protein akan berkurang dan selanjutnya kompleks enzim substrat sulit terbentuk (Noor, 1990). Aktivitas enzim biasanya akan terjadi pada kisaran pH yang sempit, oleh karena itu buffer digunakan untuk memelihara media enzim agar pH-nya tidak banyak berubah (Tranggono & Sutardi, 1989). Selain itu sampel juga harus disimpan pada suhu yang rendah untuk mencegah terjadinya kehilangan aktivitas akibat denaturasi enzim atau hilangnya kofaktor yang penting (Gaman & Sherrington, 1994).
cairan (Wirahadikusumah, 1977). Menurut Suyitno (1989), sentrifugasi adalah pemisahan antara 2 kompenen yaitu cairan yang tidak saling melarutkan atau cairan dengan padatan yang terdispersi di dalamnya. Lalu supernatan yang diperoleh dari hasil sentrifugasi disimpan pada suhu yang dingin untuk digunakan pada analisa selanjutnya.
Pada pengukuran aktivitas amilase digunakan buffer sitrat pH 5 yang mengandung amilum 1% diinkubasi dalam waterbath pada suhu 370C selama 2 menit. Larutan buffer yang mengandung amilum berfungsi untuk memelihara media yang ada sehingga aktivitas enzim dapat terjadi optimal. Suhu yang digunakan untuk inkubasi adalah 37oC. Hal ini sesuai dengan teori bahwa enzim akan menunjukkan aktivitas optimal pada kisaran suhu 30 – 40oC (Tranggono & Sutardi, 1990). Dalam percobaan ini juga digunakan larutan Iodin karena dapat membantu mengetahui aktivitas amilolitik melalui warna biru yang dihasilkan pati dengan larutan Iodin yang disebabkan oleh terabsorbsinya Iodin karena amilosa yang merupakan komponen utama pada pati sehingga dapat terbaca spektrofotometer (Sudarmadji et al., 1989). Larutan yang diperoleh diukur dengan spektrofotometer pada panjang gelombang 620 nm, tetapi sebelumnya diencerkan terlebih dahulu dengan aquades.
Pada percobaan ini dilakukan perhitungan terhadap aktivitas enzim amilase dan aktivitas enzim spesifik. Tujuan menentukan aktivitas sebuah enzim adalah untuk mengukur seberapa banyak enzim yang ada pada preparasi. Aktivitas spesifik memberikan sebuah ukuran dari konsentrasi relatif pada preparasi enzim. Dengan mengetahui aktivitas spesifik, dapat dikatakan bahwa preparasi sebuah enzim lebih terkonsentrasi daripada yang lain. Semua enzim merupakan protein, oleh sebab itu, faktor yang mempengaruhi stabilitas dari enzim sekaligus berpengaruh pada struktur sekunder, tersier, dan kuartener dari protein (Stanbury & Whitaker, 1984).
Menurut Whittaker (1994), untuk mengetahui aktivitas enzim amilase dapat digunakan 4 metoda diantaranya :
1. Penurunan pada viskositas
3. Adanya kelompok-kelompok pereduksi
4. Peningkatan kandungan maltosa, glukosa, atau dekstrin
Aktivitas enzim spesifik adalah jumlah unit aktivitas enzim dibagi dengan jumlah kandungan protein, biasanya memiliki satuan milligram. Untuk pengukuran aktivitas spesifik, tingkat reaksi enzim diukur pada saat substrat mengalami kejenuhan, jadi kecepatan maksimumnya dapat ditentukan. Standart unit aktivitas adalah unit aktivitas enzim internasional (IU), dimana merupakan jumlah µmol dari substrat yang dikeluarkan tiap menit. Pada SI unit aktivitas 1 µkat = 1 IU (Reed & Rehm, 1995). Dari pernyataan di atas, diperoleh perhitungan aktivitas enzim amilase dan aktivitas enzim spesifiknya dari nilai absorbansi yang diperoleh. Sedangkan aktivitas enzim spesifik nilainya sebanding dengan aktivitas enzimnya. Aktivitas enzim spesifik dapat dihitung dari aktivitas amilase (unit) dibagi dengan kadar proteinnya (ppm). Kadar protein pada singkong yaitu pepaya muda 21000 ppm.
Nilai absorbansi pada blanko yaitu 0.0000 sedangkan kontrol 0.1311. Dari bahan yang digunakan, nilai absorbansi dihasilkan dari bahan pepaya muda sebesar 0.1370. Sedangkan nilai aktivitas enzim yang dihasilkan sebesar -3,150 x 10 – 3 dengan aktivitas enzim spesifik -1,500 x 10 – 7. Hal ini sesuai dengan pendapat Fox (1991), nilai absorbansi berbanding terbalik dengan aktivitas enzimnya. Metode absorbansi ini dipengaruhi oleh konsentrasi dan kejernihan larutan. Semakin pekat dan keruh suatu larutan, absorbansinya semakin tinggi. Pada perhitungan aktivitas enzim amilase ada yang bernilai negatif, hal ini tidak mungkin terjadi. Kesalahan ini dapat disebabkan karena kesalahan dalam pembacaan absorbansi dengan spektrofotometer yang dapat disebabkan karena :
Kuvet kotor atau tergores
Ukuran kuvet yang tidak seragam
Penempatan kuvet yang tidak tepat
Adanya gelembung udara dalam larutan
Panjang gelombang yang dihasilkan tidak sesuai dengan yang tertera pada alat
Pada percobaan pengaruh pH terhadap aktivitas enzim amilase digunakan buffer sitrat fosfat dengan pH 4, 6, dan 8 yang diinkubasi pada suhu 370C selama 2 menit. Sedangkan untuk substratnya digunakan amilum 1% sebanayk 0.5 ml. Pada prinsipnya perlakuan dan kegunaan berbagai larutan pada percobaan ini sama dengan pada pengujian aktivitas enzim amilase. Yang membedakan yaitu pH dari larutan buffer sitrat fosfat yang digunakan. Buffer yang mengandung amilum adalah larutan penyangga yaitu larutan yang tahan panas terhadap perubahan pH dengan penambahan asam atau basa (Fardiaz, 1992). Larutan buffer yang mengandung amilum berfungsi untuk memelihara media yang ada sehingga aktivitas enzim dapat terjadi optimal. Suhu yang digunakan untuk inkubasi adalah 37oC. Hal ini sesuai dengan teori bahwa enzim akan menunjukkan aktivitas optimal pada kisaran suhu 30 – 40oC (Tranggono & Sutardi, 1990). Kecepatan reaksi enzim dipengaruhi pH karena :
- Enzim merupakan protein yang terdiri dari residu asam amino.
- Residu asam amino memiliki kelompok sisi basa, netral atau asam yang mana dapat berubah pada pH yang ada.
- Enzim dapat aktif untuk mengkatalis saat residu setiap asam amino memiliki sisi aktif.
(Volk & Wheeler, 1993).
terjadinya perubahan tingkat ionisasi pada enzim atau substrat sebagai akibat perubahan pH.
Percobaan selanjutnya yaitu pengaruh suhu terhadap aktivitas enzim amilase. Mula-mula disiapkan 3 tabung reaksi masing-masing diisi dengan buffer sitrat fosfat pH 5 yang mengandung amilum 1% sebanyak 1 ml dan diinkubasi pada suhu 370C selama 2 menit, kemudian ditambahkan ekstrak enzim masing-masing 0.1 ml. Pada percobaan ini dilakukan 3 pemanasan yaitu pada suhu 400C selama 10 menit pada waterbath, 1000C pada hotplate selama 10 menit, dan 300C (suhu kamar) selama 30 menit. Tahap-tahap selanjutnya sama dengan percobaan sebelumnya.
Percobaan ini menggunakan suhu pemanasan yang berbeda-beda untuk membuktikan bahwa aktivitas enzim sangat dipengaruhi oleh suhu. Peningkatan temperatur dapat meningkatkan kecepatan reaksi karena molekul atom mempunyai energi yang lebih besar dan mempunyai kecenderungan untuk berpindah. Ketika temperatur meningkat, proses denaturasi juga mulai berlangsung dan menghancurkan aktivitas molekul enzim. Hal ini dikarenakan adanya rantai protein yang tidak terlipat setelah pemutusan ikatan yang lemah sehingga secara keseluruhan kecepatan reaksi akan menurun (Lee, 1992).
Dari hasil pengamatan yang diperoleh, percobaan ini hanyak dilakukan oleh kelompok F4 dan F5 dengan bahan yang sama yaitu papaya muda. Nilai absorbansinya paling tinggi pada suhu 300C, lalu 1000C, dan paling rendah pada suhu 400C. Hal ini sesuai dengan teori bahwa enzim menunjukkan aktivitas optimal pada kisaran suhu 30 – 40˚C. Sedangkan aktivitas enzim pada suhu 100oC lebih besar daripada pada suhu 40oC karena enzim mengalami denaturasi dan rusak. Dalam kisaran suhu 45 – 50˚C, enzim mulai mengalami denaturasi (Tranggono & Sutardi, 1990) sedangkan pada suhu 100°C semua enzim rusak (Gaman & Sherrington, 1994).
Enzim amilase adalah enzim yang dapat menghidrolisis pati. Ada dua jenis enzim amilase, yakni : α-amilase dan β-amilase. Biasanya amilase terdapat pada tepung dan biji yang berkecambah (serealia). Jika enzim amilase terdapat pada produk-produk tersebut, maka enzim itu dikenal dengan diastase. Amilase adalah enzim yang dapat mengkatalisis pemecahan pati menjadi maltosa (Gaman & Sherrington, 1994). Biji-bijian yang tidak rusak mengandung α-amilase sangat sedikit tetapi mengandung β-amilase nisbi yang tinggi. Jika biji ini berkecambah, jumlah β-amilase hampir tidak berubah, tetapi kandungan α-amilase dapat meningkat seribu kali lipat. Kerja gabungan α dan β-amilase dalam biji yang berkecambah dapat meningkatkan aktivitas amilase. Kerja dan tujuan enzim amilase pada bahan makanan khususnya bahan makanan berbentuk serealia atau biji-bijian adalah mengubah pati menjadi dekstrin, gula dan meningkatkan penyerapan air (deMan, 1997).
Pati dapat dihidrolisa dengan penambahan enzim amilase disertai pemanasan. Proses peruraiannya adalah pati menjadi dekstrin, dekstrin menjadi maltosa, maltosa menjadi glukosa. Secara kuantitatif, terjadinya reaksi hidrolisis pati oleh enzim amilase dapat diketahui dengan tes iodine. Karbohidrat golongan polisakarida seperti amilum yang diuji dengan iodine menghasilkan warna biru keunguan, sedangkan glikogen dan dekstrin menghasilkan warna merah coklat. Monosakarida atau disakarida yang diuji dengan iodine tidak menghasilkan warna tertentu atau tidak berwarna. Hasil hidrolisis akan mengalami perubahan warna dari biru menjadi ungu kemudian merah jambu dan terakhir menjadi tidak berwarna (Pattison, 1992). Oleh karena itu pada pengukuran aktivitas amilase, pengaruh suhu dan pengaruh pH terhadap amilase digunakan larutan iodin untuk menimbulkan reaksi hidrolisis pati.
Percobaan selanjutnya yaitu pengukuran aktivitas enzim protease, pengaruh pH terhadap aktivitas enzim protease dan pengaruh suhu terhadap aktivitas enzim protease. Pada pengukuran aktivitas enzim protease digunakan azokasein dan buffer sitrat fosfat pH 6 yang diinkubasi dalam waterbath pada suhu 370C selama 2 menit. Prinsip penggunaan larutan dan fungsinya serta perlakuan pada pengukuran enzim protease ini sama dengan enzim amilase. Suhu yang digunakan untuk inkubasi adalah 37oC. Hal ini sesuai dengan teori bahwa enzim akan menunjukkan aktivitas optimal pada kisaran suhu 30 – 40oC (Tranggono & Sutardi, 1990). Kemudian larutan tersebut dicampur dengan larutan asam trikloroasetat 10% dan disentrifuge dengan kecepatan 3000 rpm selama 20 menit. Supernatan yang diperoleh diambil sebanyak 1.6 ml dan ditambahkan dengan NaOH 0.5 M dan divortex. Selanjutnya absorbansi diukur dengan spektrofotometer pada panjang gelombang 440 nm.
Dari hasil pengamatan yang diperoleh, nilai absorbansi yang terdapat pada pada pepaya muda sebesar 0.0618. Aktivitas enzim protease sama dengan nilai absorbansinya (unit). Sedangkan aktivitas enzim spesifik dapat dihitung dari aktivitas enzim protease dibagi dengan kadar proteinnya masing-masing. Aktivitas enzim spesifik paling tinggi pada nanas, sedangkan paling rendah pada singkong.
Dari hasil pengamatan pengaruh pH terhadap aktivitas enzim protease, nilai absorbansinya palig tinggi pada pH 6 dan paling rendah pada pH 4. Hal ini sesuai dengan pendapat Volk & Wheeler (1993), bahwa kebanyakan enzim menunjukkan aktivitas maksimum pada kisaran netral pH 6-8. Jika medium menjadi sangat asam atau sangat alkalis enzim mengalami inaktivasi (Gaman & Sherrington, 1994). Aktivitas enzim protease sama dengan nilai absorbansinya, dan aktivitas enzim spesifik sebanding dengan aktivitas enzim protease sehingga paling tinggi pada pH 8 dan paling rendah pada pH 4. Sedangkan dari hasil pengamatan pengaruh suhu terhadap aktivitas enzim protease, nilai absorbansinya paling tinggi pada suhu 1000C dan paling rendah pada suhu 300C. Hal ini dikarenakan pada suhu 100°C semua enzim rusak (Gaman & Sherrington, 1994). Dan enzim mulai mengalami denaturasi pada suhu 45–50˚C, sedangkan aktivitas optimal enzim pada kisaran suhu 30– 40˚C (Tranggono & Sutardi, 1990).
5. KESIMPULAN
Enzim adalah substansi yang dihasilkan oleh sel-sel hidup dan beperan sebagai katalisator pada reaksi kimia yang berlangsung dalam organisme dan dapat mempercepat reaksi kimia spesifik tanpa pembentukan produk samping.
Aktivitas enzim yang terdapat dalam bahan dihitung berdasar pada pengukuran absorbansi.
Bahan yang digunakan dihancurkan dengan blender untuk memudahkan dalam pengekstraksian karena luas permukaan bahan semakin luas sehingga enzim dalam bahan mudah bereaksi dengan buffer.
Larutan buffer sitrat dapat mempertahankan kondisi enzim presipitat agar tidak terjadi perubahan pH dan mencegah agar enzim tidak mengalami inaktivasi.
Sampel yang digunakan harus disimpan pada suhu yang rendah untuk mencegah terjadinya kehilangan aktivitas akibat denaturasi enzim atau hilangnya kofaktor yang penting.
Enzim akan menunjukkan aktivitas optimal pada kisaran suhu 30 – 40oC.
Tujuan menentukan aktivitas sebuah enzim adalah untuk mengukur seberapa banyak enzim yang ada pada preparasi.
Dengan mengetahui aktivitas spesifik, dapat dikatakan bahwa preparasi sebuah enzim lebih terkonsentrasi daripada yang lain.
Aktivitas enzim spesifik adalah jumlah unit aktivitas enzim dibagi dengan jumlah kandungan protein, biasanya memiliki satuan milligram.
Pada buah nanas terdapat enzim bromelin yaitu pada bagian kulit, bonggol dan daging buah.
Nilai absorbansi berbanding terbalik dengan aktivitas enzimnya.
Pada perhitungan aktivitas enzim amilase ada yang bernilai negatif dapat disebabkan karena kesalahan pada spektrofotometernya.
Amilase akan memperlihatkan aktivitas maksimumnya pada pH 4,8.
Proses pemanasan dalam waterbath mempunyai tujuan untuk menghidrolisis amilum sehingga struktur spiral pada pati merenggang dan pati terurai menjadi molekul-molekul yang sederhana.
Semakin tinggi suhu, reaksi semakin cepat berlangsung sampai pada titik tertentu akan terjadi perubahan struktur enzim sehingga sifat katalitiknya akan hilang.
Dalam kisaran suhu 45 – 50˚C, enzim mulai mengalami denaturasi sedangkan pada suhu 100°C semua enzim rusak.
Amilase adalah enzim yang dapat mengkatalisis pemecahan pati menjadi maltosa.
Proses peruraiannya adalah pati menjadi dekstrin, dekstrin menjadi maltosa, maltosa menjadi glukosa.
Digunakan buffer fosfat sitrat pH 7 karena kebanyakan enzim mempunyai pH optimal sekitar 7 atau netral, dan jika medium menjadi sangat asam atau sangat alkalis enzim mengalami inaktivasi.
Enzim proteolitik dapat berfungsi untuk membuat daging lebih empuk.
Enzim yang mempunyai aktifitas proteolitik seperti papain dan bromelin dapat ditemukan di bagian buah, daging, kulit maupun bonggolnya.
Semarang, 29 Septmeber 2015 Asisten Dosen : -
6. DAFTAR PUSTAKA
Day, R. A & A. L. Underwood. (1992). Analisa Kimia Kuantitatif Edisi Kelima. Erlangga. Jakarta.
deMan, M. J. (1997). Kimia Makanan, 2nd Edition. ITB. Bandung.
Fardiaz, S. (1992). Mikrobiologi Pangan 1. Gramedia Pustaka. Jakarta.
Fox, P. F. (1991). Food Enzymologi Volume 1. Elsevier Applied Sciences. London.
Gaman, P. M & K. B. Sherrington. (1994). Ilmu Pangan, Pengantar Ilmu Pangan, Nutrisi dan Mikrobiologi. Universitas Gadjah Mada press. Yogyakarta.
Hartati, L.; L. M. Yusiati.; Z. Bachrudin. (2003). Karakterisasi Protease dan Isolat Bakteri Pendegradasi Tepung Bulu. Agrosains. Vol 16, Januari 2003.
Indrati, R.; D. W. Marseno; & Y. Ohta. (1999). Properties of Immobilized Lipase From
Rhizopus delemar on Polypropylene Membrane. Agritech, Vol. 19, No. 4.
Lee, J. M. (1992). Biochemical Engineering. Prentice Hall Inc. Englewood Cliffs, New York.
Martoharsono, S. (1991). Biokimia jilid 1. UGM Press. Yogyakarta.
Martoharsono, S. (1994). Biokimia jilid 1. Gadjah Mada University press. Yogyakarta.
Noor, Z. (1990). Biokimia Nutrisi. Pusat Antar Universitas Pangan dan Gizi. Jakarta.
Pattison, S. (1992). College Chemistry : An Introduction a General, Organic and Biochemistry. Cole Publishing Company. California.
Poernomo, A. T. (2004). Produksi Enzim Proteolitik Sel Amobil Streptomyces griseus ATCC 10137. Majalah Farmasi Airlangga Vol.4 No.69 2, Agustus 2004.
Pomeranz, Y & C. E. Meloan. (1994). Food Analysis Theory and Practice, 3rd Ed. Publishing Company Inc. USA.
Reed, G. & H. J. Rehm. (1995). Biotechnology Volume 9. VCH Verlagsge Sellschaft. New York.
Santoso, H. B. (1998). Sari Buah Nanas. Kanisius. Yogyakarta.
Stanbury, P. F. & Whitaker. (1984). Principles of Fermentation Technology. Pergamon Press. New York.
Suyitno. (1989). Petunjuk Laboratorium Rekayasa Pangan Pusat Antar Universitas Pangan & Gizi. UGM Press. Yogyakarta.
Tranggono, B. S. & B. Sutardi. (1990). Biokimia dan Teknologi Pasca Panen. Pusat Antar Universitas Pangan dan Gizi. Gadjah Mada University Press. Yogyakarta.
Tranggono, B. S. (1989). Petunjuk Laboratorium Biokimia Pangan. Pusat Antar Universitas Pangan dan Gizi. Yogyakarta.
Volk, W. A. & M. F. Wheeler. (1993). Mikrobiologi Dasar Jilid 1 dan 2. Erlangga, Jakarta.
Whittaker, J. R. (1994). Principle of Enzimology for the Food Science. Marcel Dekker. New York.
Wilford, L. D. R. (1987). Chemistry for First Examinations. Blackie. London.
Winarno, F.G. (1995). Enzim Pangan. PT Gramedia Pustaka Utama. Jakarta.
Winarno, F.G. (1997). Kimia Pangan dan Gizi. PT. Gramedia Pustaka Utama. Jakarta.