BAB I
PENDAHULUAN
A. Latar Belakang
Kata alkali berasal dari bahasa arab yang berarti abu, air abu bersifat basa.Kata alkali ini menunjukkan bahwa kecenderungan sifat logam alkali dan alkali tanahadalah membentuk basa.Alkali dan alkali tanah merupakan unsure logam yang sangat reaktif.
Logam alkali adalah logam golongan IA yang terdiri dari Litium (Li), Natrium (Na), Kalium(K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr). Sedangkan logam alkali tanahterdiri dari Berilium (Be), Magnesium (Mg), Kalsium (Ca), Stronsium (Sr), Barium(Ba), dan Radium (Ra). Radium kadang tidak dianggap sebagai alkali tanah karenasifat radioaktif yang dimilikinya.Unsur pada golongan IA dan IIA ini memiliki sifat yang hamper sama, yaknisuatu reduktor, pembentuk basa, dan mempunyai warna nyala yang indah, sehinggadigunakan sebagai kembang api.
Semua unsur pada kelompok ini sangat reaktif sehingga secara alami tak pernah ditemukan dalam bentuk tunggal. Untuk menghambat reaktivitas, unsur-unsur logam alkali harus disimpan dalam medium minyak.
B. Tujuan
BAB II
PEMBAHASAN
A. Definisi Alkali Tanah
Logam alkali tanah terdiri dari 6 unsur yang terdapat di golongan IIA. Yang termasuk ke dalam golongan II A yaitu : Berilium (Be), Magnesium (Mg), Calcium (Ca), Stronsium (Sr), Barium (Ba), dan Radium (Ra). Di sebut logam karena memiliki sifat sifat seperti logam.Disebut alkali karena mempunyai sifat alkalin atau basa jika direaksikan dengan air.Dan istilah tanah karena oksidasinya sukar larut dalam air, dan banyak ditemukan dalam bebatuan di kerk bumi.Oleh sebab itu, istilah “alkali tanah” biasa digunakan untuk menggambarkan kelompok unsur golongan IIA.
Tiap logam memiliki konfigurasi elektron sama seperti gas mulia atau golongan VIII A, setelah di tambah 2 elektron pada lapisan kulit S paling luar. Contohnya konfigurasi elektron pada Magnesium (Mg) yaitu : 1s22s22p63s2 atau
(Ne) 3s2. Ikatan yang dimiliki kebanyakan senyawa logam alkali tanah adalah
ikatan ionik. Karena, elektron paling luarnya telah siap untuk di lepaskan, agar mencapai kestabilan.
Unsur alkali tanah memiliki reaktifitas tinggi, sehingga tidak ditemukan dalam bentuk monoatomik , unsur ini mudah bereaksi dengan oksigen, dan logam murni yang ada di udara, membentuk lapisan luar pada oksigen.
B. Sifat-Sifat Logam Alkali Tanah
Sifat alkali tanah secara umum di sajikan dalam tabel berikut:
Beberapa Sifat Umum Logam Alkali Tanah
Sifat Umum Be Mg Ca Sr Ba
Nomor Atom 4 12 20 38 56
Konfigurasi Elektron [He] 2s2 [Ne] 3s2 [Ar] 4s2 [Kr] 5s2 [Xe] 6s2
Titik Leleh 1553 923 1111 1041 987
Titik Didih 3043 1383 1713 1653 1913
Jari-jari Atom (Angstrom) 1.12 1.60 1.97 2.15 2.22
Jari-jari Ion (Angstrom) 0.31 0.65 0.99 1.13 1.35
Energi Ionisasi I (KJ mol-1) 900 740 590 550 500
Elektronegativitas 1.57 1.31 1.00 0.95 0.89 Potensial Elektrode (V)
M2+ + 2e à M
-1.85 -2.37 -2.87 -2.89 -2.90
Massa Jenis (g mL-1) 1.86 1.75 1.55 2.6 3.6
Berdasarkan Tabel diatas dapat diamati juga hal-hal sebagai berikut,
1. Konfigurasi elektronnya menunjukan bahwa logam alkali tanah
mempunyai elektron valensi ns2. Selain jari-jari atomnya yang lebih kecil
dibandingkan logam alkali, kedua elektron valensinya yang telah berpasangan mengakibatkan energi ionisasi logam alkali tanah lebih tinggi daripada alkali.
2. Meskipun energi ionisasinya tinggi, tetapi karena energi hidrasi dari ion
M2+ dari alkali tanah lebih besar daripada energi hidrasi ion M+ dari alkali,
mengakibatkan logam alkali tetap mudah melepaskan kedua electron valensinya, sehingga lebih stabil sebagai ion M2+.
3. Jari-jari atomnya yang lebih kecil dan muatan intinya yang lebih besar
mengakibatkan logam alkali tanah membentuk kristal dengan susunan yang lebih rapat, sehingga mempunyai sifat yang lebih keras daripada logam alkali dan massa jenisnya lebih tinggi.
4. Berilium mempunyai energi ionisasi yang sangat tinggi dan
keelektronegatifan yang cukup besar, kedua hal ini menyebabkan berilium dalam berikatan cenderung membentuk ikatan kovalen.
5. Potensial elektrode (reduki) standar logam alkali tanah menunjukkan harga
yang rendah (negatif). Hal ini menunjukkan bahwa logam alkali tanah merupakan reduktor yang cukup kuat, bahkan kalsium, stronsium, dan barium mempunyai daya reduksi yang lebih kuat daripada natrium.
6. Titik didih dan titik leleh logam alkali tanah lebih tinggi daripada suhu
ruangan. Oleh karena itu, unsur-unsur logam alkali tanah berwujud pada pada suhu ruangan.
a. Sifat-sifat fisis logam alkali tanah
Potensial elektroda juga meningkatkan dari kalsium ke barium, akan tetapi berilium menunjukan penyimpangan karena potensial elektrodanya relatif kecil. Hal itu disebabkan energi ionisasi berilium (tingkat pertama + tingkat kedua ) yang relatif besar. Titik cair dan titik didih cenderung menurun dari atas ke bawah. Sifat-sifat fisis, seperti titik cair, rapatan, dan kekerasan logam alkali tanah lebih besar jika dibandingkan dengan logam alkali seperiode. Hal itu disebabkan logam alkali tanah mempunyai 2 elektron valensi sehingga ikatan logamnya lebih kuat.
b.Sifat-sifat kimia logam alkali tanah
Kereaktifan logam alkali tanah meningkat dari berilium ke barium. Fakta ini sesuai dengan yang diharapkan . Oleh karena, dari berilium ke barium jari-jari atom bertambah besar sehingga energi ionisasi serta keelektronegatifan berkurang. Akibatnya, kecendrungan untuk melepas elektron membentuk senyawa ion makin besar. Semua senyawa dari kalsium, strontium, dan barium, yaitu logam alkali tanah yang bagian bawah, berbentuk senyawa ion, tetapi magnesium membentuk beberapa senyawa kovalen sedangkan senyawa-senyawa berilium bersifat kovalen.
Sifat kimia logam alkali tanah bermiripan dengan logam alkali, tetapi logam alkali tanah kurang reaktif dari logam alkali seperiode. Jadi, berilium kurang reaktif dibandingkan litium, magnesium kurang reaktif dibandingkan terhadap natrium, dan seterusnya. Hal itu disebabkan jari-jari atom logam alkali tanah lebih kecil sehingga energi pengionan lebih besar. Lagi pula logam alkali tanah hanya satu.Kereaktifan kalsium, stronsium,dan barium dan tidak terlalu berbeda dari logam alkali, tetapi berilium dan magnesium jauh kurang aktif.
Logam alkali tanah memiliki jari-jari atom yang besar dan harga ionisasi yang kecil. Dari Berilium ke Barium, nomor atom dan jari-jari atom semakin besar. Selain itu semua logam alkali tanah juga mempunyai kecenderungan teratur mengenai keelektronegatifan yang semakin kecil dan daya reduksi yang semakin kuat dari Berilium ke Barium.
c. warna nyala logam alkali tanah
Uji nyala adalah suatu pengujian terhadap suatu unsur mengenai warna nyalanya. Tujuannya agar dapat mengidentifikasi suatu zat secara kualitatif. Uji nyala dapat diamati dari larutan yang jumlahnya sangat sedikit dengan menggunakan kawat nikrom. Dengan mencelupkan kawat nikrom ke dalam larutan kemudian membakarnya pada nyala yang panas (api biru) lalu amati warna nyala dari unsur tersebut. Setiap unsur akan memberikan warna nyala yang berbeda. Adapun warna nyala masing-masing logam-logam alkali tanah adalah :
Berillium (putih) Magnesium (putih)
Kalsium (jingga - merah / sindur merah) Stronsium (merah)
Barium (hijau muda/kuning muda)
C. Struktur Atom dan Unsur-Unsur Logam Alkali Tanah
Sebagaimana telah disebutkan di atas, golongan alkali tanah terdiri atas Berilium (Be), Magnesium (Mg), Kalsium (Ca), Stronsium (Sr), Barium (Ba), dan Radium (Ra). Pada bab ini kami akan membahas semua unsur tersebut secara satu persatu.
Berilium adalah unsur kimia yang mempunyai simbol Be dan nomor atom 4. Unsur ini beracun, bervalensi 2, berwarna abu-abu baja, kukuh, ringan tetapi mudah pecah. Berilium adalah logam alkali tanah, yang kegunaan utamanya adalah sebaga i bahan penguat dalam aloy (khususnya tembaga berilium).
1. Sejarah
Nama berilium berasal dari bahasa Yunani beryllos, beril. Berilium pernah
dinamakan glucinium (dari Yunani glykys, manis), karena rasa manis garamnya.
Unsur ini ditemukan oleh Louis Vauquelin dalam tahun 1798 dalam bentuk oksida dalam beril dan dalam zamrud. Friedrich Wöhler dan A. A. Bussy masing-masing berhasil mengasingkan logam pada tahun 1828 dengan mereaksikan kalium dengan berilium klorida.
2. Sifat-sifat Berilium
Berilium mempunyai titik lebur tertinggi di kalangan logam-logam ringan. Modulus kekenyalan berilium kurang lebih 1/3 lebih besar daripada besi baja. Berilium mempunyai konduktivitas panas yang sangat baik, tak magnetik dan tahan karat asam nitrat. Berilium juga mudah ditembus sinar-X, dan neutron dibebaskan apabila ia dihantam oleh partikel alfa (seperti radium dan polonium [lebih kurang 30 neutron-neutron/juta partikel alfa]). Pada suhu dan tekanan ruang, berilium tak teroksidasi apabila terpapar udara (kemampuannya untuk menggores kaca kemungkinan disebabkan oleh pembentukan lapisan tipis oksidasi).
Berilium di alam terdapat sebagai senyawa-senyawa berikut :
A. Berilium Oksida (BeO)
Berilium oksida berwujud bubuk putih yang dapat dibuat menjadi berbagai bentuk. Hal ini diinginkan sebagai insulator listrik karena dapat menghantarkan panas dengan baik, namun sangat buruk dalam mehantarkan arus listrik. Hal ini digunakan dalam kecepatan tinggi komputer, sistem otomatis pengapian, laser, oven microwave, dan sistem yang dirancang untuk menyembunyikan dari sinyal radar.
2Be(s) + O2(g) ---> 2BeO(s)
Berilium memiliki lapisan berilium oksida yang tipis tetapi kuat pada
permukaannya, yang mencegah oksigen baru untuk bereaksi dengan berilium dibawah lapisan tersebut.
B. Berilium Klorida (BeCl2)
Ikatan antara berilium dengan klorida membentuk senyawa berilium klorida (BeCl2). Berilium klorida juga merupakan molekul linear dengan ketiga atom
dalam garis lurus dengan pemakaian electron bersamaan (kovalen). Berilium klorida dikenal sebagai senyawa elektron-kekurangan karena memiliki dua orbital
kosong pada tingkat ikatan.
BeCl2 dapat membentuk senyawa polimer. Tanda panah pada rantai panjang diatas
menunjukkan ikatan koordinasi yang terbentuk antara Cl pada molekul BeCl2
yang satu dengan Be pada molekul BeCl2 yang lain. Be ternyata masih mampu
menarik pasangan elektron dari Cl yang terikat pada molekul BeCl2 yang lain.
Karena kemampuan itulah maka BeCl2 tidak hanya mampu membentuk dimer,
C. Be(OH)42- (senyawa logam yang bersifat amfoter)
Berilium dan oksida logamnya bersifat amfoter. Keduanya larut dengan asam dan basa. Sebagai contoh, dalam basa logam dan oksida logamnya bereaksi sebagai berikut:
Be + 2H2O + 2OH- ---> Be(OH)42- + H2(g)
BeO + H2O + 2OH- ---> Be(OH)4
2-Logam alkali tanah lainnya dan oksida logamnya tidak bersifat amfoter. Jadi, berilium secara kimia kurang bersifat logam daripada logam-logam lainnya dalam
golongan ini.
Bentuk lain dari berilium yang bersifat kurang logam daripada unsur lainnya yang ada dalam golongan IIA adalah derajat kovalen dari senyawa-senyawanya. Tidak ada bukti sama sekali bahwa berilium terdapat dalam bentuk Be2+ atau dalam bentuk senyawa yang mengandung ion tersebut, semua senyawa berilium memperlihatkan sifat ikatan kovalen.
D. Berilium dan oksida logamnya bersifat amfoter. Keduanya larut dengan asam dan basa. Sebagai contoh, dalam basa logam dan oksida logamnya bereaksi sebagai berikut:
Be + 2H2O + 2OH- ---> Be(OH)42- + H2(g)
BeO + H2O + 2OH- ---> Be(OH)4
2-1. Proses Pembuatan Berilium
Berilium dijumpai dalam 30 jenis garam galian berbeda, diantaranya, yang paling penting adalah bertrandit, beril, krisoberil, dan fenasit.Jenis batu permata beril berharga akuamarin dan jamrud.Kebanyakan penghasilan logam ini diselesaikan dengan mengurangkan (kimia) berilium fluorida dengan logam
magnesium.Logam berilium tidak mudah sebelum tahun 1957.
1. Metode Reduksi
Pada metode ini diperlukan berilium dalam bentuk BeF2 yang dapat
diperoleh dengan cara memanaskan beryl dengan Na2SiF6 pada suhu 700-750oC.
Setelah itu dilakukan leaching(ekstraksi cair-padat) terhadap flour dengan air kemudian dilakukan presipitasi (pengendapan) dengan Ba(OH)2 pada PH 12
Reaksi yang terjadi adalah :
BeF2 + Mg --> MgF2 + Be
2. Metode Elektrolisis
Untuk mendapatkan berilium juga dapat dilakukan dengan cara elektrolisis dari lelehan BeCl2yang telah ditambah NaCl. Karena BeCl2 tidak dapat
mengahantarkan listrik dengan baik, sehingga ditambahkan NaCl. BeCl2 tidak
dapat menghantarkan listrik karena BeCl2 bukan merupakan larutan elektrolit.
Reaksi yang terjadi adalah :
Katoda : Be2+ + 2e- Be
Anode : 2Cl- Cl2 + 2e
-5. Kegunaan Be dan senyawa Be
1. Berilium digunakan untuk memadukan logam agar lebih kuat, akan tetapi
bermasa lebih ringan. Biasanya paduan ini digunakan pada kemudi pesawat Zet.
2. Berilium digunakan pada kaca dari sinar X.
3. Berilium digunakan untuk mengontrol reaksi fisi pada reaktor nuklir.
4. Campuran berilium dan tembaga banyak dipakai pada alat listrik, maka
Berilium sangat penting sebagai komponen televisi.
5. Berilium digunakan sebagai agen aloy di dalam pembuatan tembaga
6. Karena ketegaran, ringan, dan kestabilan dimensi pada jangkauan suhu yang lebar, Alloy tembaga-berilium digunakan dalam industri angkasa-antariksa dan pertahanan sebagai bahan penstrukturan ringan dalam pesawat berkecepatan tinggi, peluru berpandu, kapal terbang dan satelit komunikasi.
7. Kepingan tipis berilium digunakan bersama pemindaian sinar-X untuk menepis cahaya tampak dan memperbolehkan hanya sinaran X yang terdeteksi.
8. Dalam bidang litografi sinar X, berilium digunakan untuk pembuatan litar
bersepadu mikroskopik.
9. Karena penyerapan panas neutron yang rendah, industri tenaga nuklir menggunakan logam ini dalam reaktor nuklir sebagai pemantul neutron dan moderator.
10.Berilium digunakan dalam pembuatan giroskop, berbagai alat komputer,
pegas jam tangan dan peralatan yang memerlukan keringanan, ketegaran dan kestabilan dimensi.
11.Berilium oksida sangat berguna dalam berbagai kegunaan yang
memerlukan konduktor panas yang baik, dan kekuatan serta kekerasan yang tinggi, dan juga titik lebur yang tinggi, seterusnya bertindak sebagai perintang listrik.
12.Campuran berilium pernah pada satu ketika dahulu digunakan dalam lampu floresens, tetapi penggunaan tersebut tak dilanjutkan lagi karena pekerja yang terpapar terancam bahaya beriliosis.
Magnesium adalah unsur kimia dalam tabel periodik yang memiliki simbol Mg dan nomor atom 12 serta berat atom 24,31. Magnesium adalah elemen terbanyak kedelapan yang membentuk 2% berat kulit bumi, serta merupakan unsur terlarut ketiga terbanyak pada air laut. Logam alkali tanah ini terutama digunakan sebagai
zat campuran (alloy) untuk membuat campuran alumunium-magnesium yang
sering disebut "magnalium" atau "magnelium”
1.Sejarah
Nama magnesium berasal dari bahasa Yunani untuk sebuah daerah di Thessaly disebut magnesium oksida. Hal ini terkait dengan magnetite dan mangan, yang juga berasal dari daerah ini, dan diperlukan diferensiasi sebagai zat terpisah.
Magnesium merupakan unsur ketujuh paling berlimpah dalam kerak bumi oleh massa dan kedelapan oleh molarity. Hal ini ditemukan dalam jumlah besar dari deposito magnesite, dolomit, dan mineral, dan air mineral, di mana magnesium ion yang larut. Joseph Black dari England mengenal pasti magnesium sebagai sejenis unsur pada tahun 1755.
Kemudian pada tahun 1808, Sir Humphrey Davy mengasingkan logam magnesium secara elektrolisis dari campuran magnesia dan HgO dan berhasil menemukan unsur magnesium. Sementara A.A.B.Bussy telah juga berhasil menyediakannya dalam bentuk koheren pada tahun 1831.
Magnesium merupakan logam yang ringan, putih keperak-perakan dan cukup kuat. Ia mudah ternoda di udara, dan magnesium yang terbelah-belah secara halus dapat dengan mudah terbakar di udara dan mengeluarkan lidah api putih yang menakjubkan.
3. Senyawa dari Magnesium
Magnesium di alam terdapat sebagai senyawa-senyawa berikut :
a. Sebagai karbonat, magnesit (MgCO3), dolomit (MgCO3.CaCO3)
b. Sebagai sulfat, kiserit (MgSO4.H2O), kainit (KCl. MgSO4. 3H2O) garam Epsom
(MgSO4. 7H2O) (disebut juga garam Inggris)
c. Sebagai silikat, olivine (Mg2SiO4), asbestos (CaMg2(SiO3)s)
4. Pembuatan Magnesium
Cara yang paling murah untuk membuat magnesium adalah dengan proses elektrolitik. Pada masa Perang Dunia II, magnesium dibuat juga dengan dua proses lain, yaitu proses silikotermik atau proses ferosilikon dan proses reduksi karbon. Proses reduksi karbon ternyata tidak pernah dapat beroperasi secara memuaskan, sehingga sejak lama tidak lagi dipakai. Proses silikotermik masih banyak digunakan saat ini.
a. Elektrolisis Magnesium Klorida
menyaringnya dan direaksikan dengan asam klorida yang dibuat dengan klor yang keluar dari sel. Dari sini terbentuk larutan magnesium klorida yang lalu diuapkan menjadi magnesium klorida padat di dalam evaporator dengan pemanasan langsung dan diikuti dengan pengeringan di atas rak. Klorida ini cenderung terdekomposisi pada waktu pengeringan. Setelah dehidrasi (proses penghilangan air), magnesium klorida tersebut diumpankan ke sel elektrolisis, dimana bahan ini terdekomposisi menjadi logam dan gas klor.
b. Proses Silikotermik atau Proses Ferosilikon
Langkah-langkah proses silikotermik terdiri dari pencampuran dolomit gilingan yang dijadikan slake dengan ferosilikon sebanyak 70-80% dan fluorspar 1% dan kemudian dijadikan pelet. Pelet itu diumpankan ke dalam tanur. Tanur kemudian divakumkan dan dipanaskan sampai 1170 derajat celsius. Kalsium oksida (CaO) yang terdapat di dalam dolomit bakaran itu membentuk dikalsium silikat yang tak melebur dan dikeluarkan dari reaktor pada akhir proses. Reaksi pokok proses silikotermik ini adalah sebagai berikut.
2(MgO.CaO) + 1/6FeSi6 --> 2Mg + (CaO)2SiO2 + 1/6Fe
Pada akhir proses, tanur didinginkan sedikit dan magnesium dikeluarkan dari kondensor dengan suatu prosedur yang berdasarkan atas perbedaan kontraksi antara magnesium dan baja.
5. Kegunaan Mg dan Senyawa Mg
Membuat logam campur, misalnya paduan Mg dan Al yang sering disebut
magnelium sebagai komponen pesawat terbang, rudal, baik truk dan sebagainya. Membuat kembang api dan lampu blitz.
Melapisi tanur dan pembakaran semen. Bahan obat maag.
Untuk menggabungkan di alloys, dimana logam ini sangat penting untuk pesawat dan peluru konstruksi.
Dalam bentuk turnings atau kendali, untuk mempersiapkan Grignard reagents, yang berguna dalam sintesis organik.
Alloying sebagai agen, meningkatkan mekanis, pemalsuan dan welding karakteristik aluminium.
Kalsium (Ca)
1. Sejarah
(Latin: calx, kapur) Walau kapur telah digunakan oleh orang-orang Romawi di abad kesatu, logam kalsium belum ditemukan sampai tahun 1808. Setelah mempelajari Berzelius dan Pontin berhasil mempersiapkan campuran air raksa dengan kalsium (amalgam) dengan cara mengelektrolisis kapur di dalam air raksa, Davy berhasil mengisolasi unsur ini walau bukan logam kalsium murni.
2. Sifat-sifat unsur Ca
reaktif dibandingkan logam alkali tanah lainnya. Pada lingkup rumah tangga, ion kalsium yang berasal dari pipa biasanya turut larut dalam air minum. Air dianggap mejadi “keras” saat mengandung terlalu banyak kalsium atau magnesium. Kondisi ini bisa dihindari dengan memberikan pelunak air.
3. Senyawa Ca
Senyawa alami dan senyawa buatan kalsium banyak sekali kegunaannya.
Kalsium, dikombinasikan dengan fosfat untuk bentuk hydroxylapatite, adalah bagian mineral tulang manusia dan hewan dan gigi. Bagian mineral karang beberapa juga akan berubah menjadi hydroxylapatite.
Kalsium hidroksida (kapur) digunakan dalam berbagai proses kimia kilang dan dibuat oleh pemanasan kapur pada suhu tinggi (di atas 825 ° C) dan kemudian dengan hati-hati menambahkan air untuk itu. Ketika kapur dicampur dengan pasir, itu mengeras menjadi sebuah mortir dan berubah menjadi plester oleh penyerapan karbon dioksida.
Dicampur dengan senyawa lainnya, kapur membentuk bagian penting dari semen.
Kalsium karbonat (CaCO3) adalah salah satu senyawa umum kalsium. Dipanaskan
untuk bentuk quicklime (CaO), yang kemudian ditambahkan ke air (H2O). Ini
membentuk bahan lain yang dikenal sebagai kapur (Ca(OH)2), yang merupakan
bahan dasar murah yang digunakan di seluruh industri kimia. Kapur, marmer dan batu kapur adalah semua bentuk kalsium karbonat.
Ketika air percolates melalui batu kapur atau karbonat larut lain batu, melebur sebagian batu dan penyebab gua pembentukan dan karakteristik stalaktit dan stalagmit dan juga bentuk air keras. Senyawa kalsium penting lainnya adalah kalsium nitrat, kalsium sulfida, kalsium klorida, kalsium karbida, kalsium cyanamide dan kalsium hipoklorit.
Beberapa senyawa kalsium dalam keadaan oksidasi + 1 telah juga telah diselidiki baru-baru ini. Terbaik belajar ini proses adalah fractionation massa tergantung kalsium isotop yang menyertai pengendapan kalsium mineral, seperti calcite, aragonite dan apatit, dari solusi. Kalsium isotopically cahaya lebih dimasukkan ke dalam mineral, meninggalkan solusi yang dipercepat mineral kalsium isotopically berat diperkaya dalam.
Pada suhu kamar besarnya fractionation ini adalah kira-kira 0.25‰ (0.025%) per satuan massa atom (AMU). Perbedaan komposisi isotop kalsium
Kalsium isotop fractionation selama pembentukan mineral telah menyebabkan beberapa aplikasi kalsium isotop. Khususnya, pengamatan 1997 oleh Skulan dan DePaolo mineral kalsium yang isotopically lebih ringan daripada solusi mineral memicu adalah dasar dari analog aplikasi dalam kedokteran dan
paleooceanography.
Dalam hewan dengan kerangka mineralized dengan kalsium kalsium komposisi isotopik jaringan lunak mencerminkan tingkat yang relatif pembentukan dan pembubaran mineral tulang. Pada manusia perubahan dalam komposisi isotopik kalsium urin telah menunjukkan berkaitan dengan perubahan dalam
keseimbangan mineral tulang. Ketika laju pembentukan tulang melebihi tingkat resorpsi, jaringan lunak 44Ca /40Ca naik. Jaringan lunak 44Ca /40Ca jatuh ketika resorpsi melebihi pembentukan tulang. Karena hubungan ini, kalsium isotopik pengukuran urin atau darah mungkin berguna dalam deteksi dini penyakit metabolik tulang seperti osteoporosis.
Ada sistem serupa di Samudra, di mana air laut 44Ca /40Ca cenderung naik ketika tingkat penghapusan Ca2+ dari air laut dengan curah hujan mineral melebihi input
kalsium baru ke laut, dan jatuh ketika kalsium masukan melebihi mineral curah hujan. Maka itu naik44Ca /40Ca yang berkaitan dengan air laut yang jatuh Ca2+ konsentrasi, dan jatuh 44Ca /40Ca sesuai dengan air laut naik
Ca2+ konsentrasi. Pada tahun 1997 Skulan dan DePaolo disajikan bukti pertama
tentang perubahan dalam air laut 44Ca /40Ca sepanjang sejarahnya, bersama dengan penjelasan teoretis mengenai perubahan ini.
Karya-karya yang lebih baru telah mengkonfirmasi pengamatan ini, menunjukkan bahwa air laut Ca2+ konsentrasi tidak konstan, dan bahwa Samudera mungkin
pernah berada dalam "keadaan tetap" sehubungan dengan kalsium input dan output. Hal ini memiliki implikasi bagi yang penting, seperti siklus laut kalsium erat dengan siklus karbon .
4. Pembuatan unsur Ca
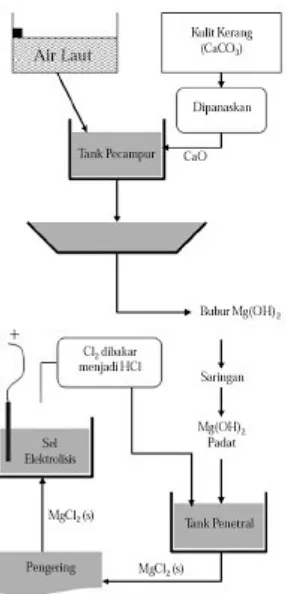
Gambar 1. Pembuatan logam magnesium dari air laut.
Pembuatan logam magnesium dari air laut telah dikembangkan oleh berbagai industri kimia. Oleh karena garam-garam alkali tanah menghasilkan nyala beraneka warna, sering dipakai sebagai bahan untuk membuat kembang api.
Jika rumah tiram dipanaskan, CaCO3 terurai membentuk oksida:
∆
CaCO3(s) → CaO(s) + CO2(g)
5. Kegunaan
Kalsium adalah mineral yang amat penting bagi manusia, antara lain bagi metabolisme tubuh, penghubung antar saraf, kerja jantung, dan pergerakan otot.
Mengaktifkan saraf
Melancarkan peredaran darah Melenturkan otot
Menormalkan tekanan darah
Menyeimbangkan tingkat keasaman darah
Menjaga keseimbangan cairan tubuh
Mencegah osteoporosis (keropos tulang )
Membantu mineralisasi gigi dan mencegah pendarahan akar gigi
Stronsium (Sr)
Strontium adalah unsur kimia yang termasuk golongan alkali tanah dengan simbol Sr dan nomor atom 38. Strontium adalah logam halus berwarna perak putih atau logam kuning yang sangat reaktif secara kimiawi. Logam strontium berubah menjadi kuning jika terpapar udara. Di alam biasanya terdapat sebagai mineral celestit dan strontianit. Isotopnya yang 90Sr terdapat sebagai jatuhan radioaktif dan memiliki waktu paruh 29,1 tahun. Isotop 90Sr dinamakan strontian, yang sebenarnya merupakan nama sebuah desa di Skotlandia, karena ditemukan di dekat desa tersebut.
Mineral strontianit dinamakan setelah penduduk desa Strontian di desa Skotlandia menemukannya di sebuah tambang terpencil pada tahun 1787. Adair Crawford mengenali bahwa mineral tersebut berbeda dengan mineral-mineral barium lainnya pada tahun 1790. Strontium itu sendiri baru ditemukan pada tahun 1798 oleh Thomas Charles Hope, dan logam strontium berhasil dipisahkan oleh Sir Humphry Davy pada tahun 1808 menggunakan elektrolisis dan diumumkan olehnya sendiri pada sebuah acara perkuliahan Royal Society pada tanggal 30 Juni 1808.
2. Sifat-sifat
Strontium lebih lunak dibanding kalsium dan terdekomposisi dalam air secara cepat. Ia tidak menyerap nitrogen dibawah suhu 380 derajat Celcius. Elemen ini harus direndam dalam minyak tanah (kerosene) untuk menghindari oksidasi. Logam strontium yang baru terbelah memiliki warna keperak-perakan, tapi dapat dengan cepat menjadi kuning jika teroksidasi. Logam ini jika terbelah secara halus dapat terbakar di udara secara spontan. Garam-garam strontium memberikan warna yang indah pada lidah api dan digunakan di pertunjukan kembang api dan produksi flares. Strontium alami merupakan campuran dari 4 isotop yang stabil.
3. Senyawa Sr
Berikut adalah senyawa- senyawa strontium yang diketahui:
4.Pembuatan unsur Sr
logam Stronsium dapat dibuat dengan elektrolisisdari mencair strontium klorida dicampur dengan kalium klorida:
Sr2 + + 2 e - → Sr
2 Cl - → Cl2 (g) + 2 e–
Atau dibuat dengan mengurangi
strontium oksida dengan aluminium dalam vakum pada suhu di mana strontium meleleh. Ada tiga alotropi logam Sr, dengan titik transisi pada 235 dan 540 °C.
5. Kegunaan
Strontium titanat memiliki indeks bias dan penyebaran optikal yang jauh lebih
baik dari pada berlian, membuatnya memiliki banyak kegunaan dalam berbagai jenis alat-alat optik.
Strontium karbonat, strontium nitrat, dan strontium sulfat biasanya digunakan
dalam pembuatan kembang api untuk menghasilkan warna merah.
Strontium klorida biasanya digunakan dalam pasta gigi untuk gigi sensitive.
Strontium oksida terkadang digunakan untuk menambah kualitas lapisan
keramik.
Strontium ranelat digunakan dalam penyembuhan osteoporosis
Barium adalah unsur kimia dengan simbol Ba, dan nomor atom 56. Barium bersifat lunak dan termasuk unsur golongan alkali tanah. Barium murni tidak pernah ditemukan di alam karena dapat bereaksi dengan udara. Oksidanya dikenal sebagai baryta, tetapi dapat bereaksi dengan air dan karbon dioksida dan tidak ditemukan sebagai mineral. Mineralnya yang paling banyak ditemukan di alam
adalah barium sulfat (BaSO4) yang sangat susah untuk dilarutkan, dan barium
karbonat (BaCO3). Benitoite adalah sebuah permata langka yang mengandung
barium.
Logam barium digunakan dalam keperluan insutri. Senyawa barium memberikan nyala api yang berwarna hijau dan sering digunakan untuk membuat kembang api. Barium sulfat digunakan karena beratnya, memiliki sifat tidak mudah larut, dan tidak dapat ditembus oleh sinar-X. Salah satu kegunaan barium sulfat adalah untuk pengeboran minyak. Senyawa barium yang dapat larut bersifat racun karena melepas ion-ion barium, dan digunakan sebagai racun tikus. Telah ditemukan fungsi barium yang baru: yaitu sebagai bahan esensial pada pembuatan superkonduktor YBCO.
ini dapat dilihat dari barium sulfat yang memiliki tingkat densitas yang tinggi (4.5 g/cm3).
1. Sejarah
Barium (Yunani bary, yang berarti "berat") pertama kali diidentifikasi pada tahun1774 oleh Carl Scheele dan berhasil diekstraksi pada tahun 1808 oleh Sir Humphry Davy di Inggris. Oksida barium pertama kali disebut barote, yang mana kemudian diganti menjadi barita oleh Antoine Lavoisier dari kata barium untuk menjelaskan sifat logamnya.
2. Sifat unsur Ba
Barium merupakan unsur metalik, lunak, dan barium murni bewarna perak keputih-putihan seperti timbal. Ia masuk golongan grup alkali dan mirip kalsium secara kimia. Logam ini teroksida dengan mudah dan harus disimpan dalam bensin atau bahan cair lainnya yang tidak mengandung oksigen. Barium terdekomposisi oleh air atau alkohol.
3. Senyawa Ba
Dibandingkan logam yang lain, kelimpahan Barium di alan sangatlah sedikit. Senyawa penting dari barium adalah BaSO4. Senyawa ini digunakan pada
penggilingan minyak dalam bentuk bubur, berfungsi sebagai perekat gurdi penggilingan. BaSO4 juga tidak dapat di tembus sinar-X sehingga senyawa ini
digunakan untuk diagnosa sinar-X. Senyawa barium yang larut dalam air tidak dapat digunakan sebab bersifat racun, tetapi suspensi BaSO4 yang terdapat
sebagai ion barium, racunnya dapat diabaikan.
mineral yang berat/lebat tidak metalik. kepadatan Yang tinggi adalah bertanggung jawab untuk nilai nya di dalam banyak aplikasi. Barit secara kimiawi tidak dapat larut tanpa daya. Kebanyakan barit ditambang dari lapisan sedimentary batu karang yang membentuk ketika barit mempercepat ke alas/pantat dari samudra. Beberapa tambang/ranjau/aku lebih kecil menggunakan barit dari pembuluh darah, yang membentuk ketika barium sulfate dipercepat dari perairan di bawah tanah panas. Dalam beberapa hal, barit adalah suatu hasil sampingan pekerjaan
tambang, seng, perak, atau bijih metal lain.
Kenggunaan utama Barit adalah sebagai “ agen menimbang” dalam gas-alam dan minyak [yang] mengebor;drill. Di dalam proses ini, barit dihancurkan dan bergaul dengan air dan material lain. Berat/Beban dari campuran ini yang kekuatan dari minyak dan gas ketika bebas dari landasan. Ini mengijinkan minyak dan gas rig (minyak) operator untuk mencegah bahan peledak melepaskan dari minyak dan gas dari landasan. Sekarang ini, mayoritas konsumsi barit di Amerika Serikat adalah untuk ini mengebor drill aplikasi. Bagaimanapun, konsumsi dalam pengeboran " lumpur" berubah-ubah dari tahun ke tahun, karena adanya bergantung pada jumlah explorasi yang mengebor drill untuk minyak dan gas, yang mana pada gilirannya tergantung pada minyak dan gas harga. Di luar ini, barit digunakan sebagai suatu aditip ke cat, email, dan plastik, dalam produksi yang disebut "petunjuk/ ujung/ laju-awal" kristal atau "leaded" gelas/kaca, radiasi perhentian dari komputer memonitor dan tabung televise, dan seperti sebagai
ketika sumber bahan kimia barium.
4. Pembuatan
Barium dibuat dalam skala kecil dengan elektrolisis leburan barium klorida. Barium juga dapat diperoleh dari reduksi BaO dengan Al
6BaO + 2Al 3Ba + Ba3Al2O6
Barium sulfat secara umum diproduksi dari hasil samping industri hidrogen peroksida (H2O2 ), pengolahan tambang barite, proses pengendapan (blanc
5. Kegunaan
Barium memiliki beberapa fungsi dalam bidang industri:
Senyawa barium, khususnya barit (BaSO4), memiliki peran yang sangat penting
dalam industri minyak bumi. Barit digunakan dalam pengeboran sumur minyak.
Barium karbonat dapat digunakan untuk racun tikus dan juga dapat digunakan dalam pembuatan batu bata. Berbeda dengan sulfat, karbonat akan melarut di dalam perut, sehingga menjadi racun bagi tubuh. .
Barium oksida digunakan untuk melapisi elektroda pada lampu fluoresensi, yang dapat melepaskan elektron.
Barium karbonat digunakan dalam pembuatan kaca. Karena beratnya, barium dapat meningkatkan indeks bias dan kilau kaca.
Barit digunakan secara ekstensif dalam pembuatan karet.
Radium (Ra)
`
Radium termasuk jenis radioaktif alam yang mempunyai isotop Ra-226, Ra-224 dan Ra-228. Radium adalah radionuklida yang terbentuk dari peluruhan uranium dan thorium. Sebagian besar Ra-226 berasal dari peluruhan uranium alam (U-238), sedangkan Ra-228 dan Ra-224 berasal dari peluruhan Th-232. Radium-226 merupakan isotop yang biasa dimanfaatkan, memancarkan radiasi alfa dan gama dengan waktu paro 1600 tahun, sedangkan Ra-228 merupakan pemancar beta dengan waktu paro 5,75 tahun dan Ra-224 mempunyai waktu paro 3,66 hari. Isotop-isotop radium meluruh menjadi isotop-isotop radon yang berlainan, misalnya Ra-226
meluruh menjadi Ra-222 dan Ra-228 meluruh menjadi Ra-224 sebelum akhirnya membentuk gas radon (Ra-220).
Ra-226 merupakan radionuklida berumur panjang dan dalam masa peluruhannya mengeluarkan gas radon yang berbahaya bagi kesehatan. Kondisioning sumber bekas Ra-226 diawali dengan reduksi volume, dilanjutkan dengan immobilisasi dalam kontainer khusus untuk mengatasi masalah emanasi gas radon yang timbul dari peluruhan Ra-226. Dipilih kontainer Stainless Steel berbentuk kapsul yang ditutup dengan cara dilas. Kapsul ini kemudian dimasukkan ke dalam Long Term Storage Shield (LTSS) yang terbuat dari Pb untuk meminimalkan paparan radiasi yang cukup tinggi.
1. Sejarah
Pada tahun 1902, Curie dan Andre-Louis Debierne berhasil memisahkan radium sebagai logam murni, dengan cara mengelektrolisis radium klorida murni menggunakan katoda merkuri, kemudian didistilasi pada atmosphere gas hidrogen.
2. sifat-sifat
Radium merupakan logam alkali tanah terberat dengan intensitas radioaktivitas besar, dan mirip dengan barium secara kimiawi. Sejumlah kecil logam ini terdapat pada bijih-bijih uranium, dan berbagai jenis mineral uranium lainnya. Radium menghasilkan tiga jenis radiasi yaitu, partikel alfa, partikel beta, dan sinar gamma.
Logam radium murni berwarna putih bersih, tapi berubah menjadi hitam jika terpapar udara (kemungkinan dikarenakan adanya pembentukan nitrida). Radium bereaksi hebat dengan air dan minyak membentuk radium hidroksida, dan sedikit lebih mudah menguap dibandingkan dengan barium. Fase radium adalah padat pada suhu normal.
3. Senyawa
Karena waktu paruhnya yang pendek dan intensitas radioaktifitasnya yang besar, senyawa radium cukup jarang ditemukan, kebanyakan terdapat di dalam bijih uranium. Adapun senyawa-senyawa radium antara lain:
a. Radium fluorida (RaF2) b. Radium klorida (RaCl2) c. Radium bromide (RaBr2)
d. Radium iodide (RaI2)
e. Radium oksida (RaO) f. Radium nitride (Ra3N2)
Dimasa yang lampau Indonesia banyak menggunakan Radium-226 sebagai sumber radiasi yang dipakai dalam brachyteraphy. Brachyteraphy adalah suatu radioterapi dengan zat radioaktif sebagai sumber radiasinya. Brachyteraphy dilakukan dengan cara penyinaran pada jarak sangat dekat bahkan pada kondisi tertentu sumber radiasi dimasukkan kedalam tubuh pasien. Biasanya digunakan untuk terapi kanker leher rahim.
Untuk keperluan medis, radium yang digunakan mempunyai aktivitas maksimum 4 GBq (100 mg) dengan aktivitas rata-rata sumber sekitar 200 MBq (5,6 mg) untuk yang berbentuk jarum dan sekitar 260 MBq (7mg) untuk yang berbentuk kapsul. Sedangkan untuk pemakaian non medis, radium digunakan dalam aktivitas yang lebih tinggi, misalnya sumber nuetron Ra-Be mempunyai aktivitas sekitar 20 GBq (5000 mg) dan pemakaian lainnya sekitar 40 GBq (1000 mg).
Selain dalam bidang kedokteran, Radium -226 juga dimanfaatkan sebagai penangkal petir. Di negara maju sudah sejak sekitar tahun 1960 an pemakaian Ra-226 baik dalam bidang kedokteran maupun dalam penangkal petir sudah dihentikan, namun demikian di beberapa negara lain sumber Ra-226 hingga saat ini masih ada dengan pemakaian yang sudah mulai berkurang.
D. Reaksi – Reaksi Logam alkali tanah
Kemiripan sifat logam alkali tanah disebabkan oleh kecenderungan melepaskan dua elektron valensi. Oleh karena itu senyawanya mempunyai bilangan oksidasi +2, sehingga logam alkali tanah diletakkan pada golongan II A. Alkali tanah termasuk logam yang reaktif, namun Berilium adalah satu-satunya unsur alkali tanah yang kurang reaktif, bahkan tidak bereaksi dengan air. Logam alkali tanah bersifat pereduksi kuat. Semakin ke bawah, sifat pereduksi ini semakin kuat. Hal ini ditunjukkan oleh kemampuan bereaksi dengan air yang semakin meningkat dari Berilium ke Barium. Selain dengan air unsur logam alkali tanah juga bisa bereaksi dengan Oksigen, Nitrogen, dan Halogen.
a. Reaksi dengan air
Stronsium, Barium, dan Radium bereaksi sangat cepat dan dapat bereaksi dengan air dingin. Contoh reaksi logam alkali tanah dan air berlangsung sebagai berikut,
Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)
b. Reaksi dengan Oksigen atau udara
Adanya pemanasan yang kuat menyebabkan logam alkali tanah terbakar di udara membentuk oksida dan nitrida.Logam alkali tanah, kecuali Be dan Mg dengan udara juga dapat berlangsung, tetapi terjadinya korosi yang berlanjut dapat dihambat karena lapisan oksida yang terbentuk melekat kuat pada permukaan logam. Dengan pemanasan, Berilium dan Magnesium dapat bereaksi dengan oksigen. Oksida Berilium dan Magnesium yang terbentuk akan menjadi lapisan pelindung pada permukaan logam.Barium dapat membentuk senyawa peroksida (BaO2)
2Mg(s) + O2 (g) → 2MgO(s)
Ba(s) + O2(g) (berlebihan) → BaO2(s)
Pembakaran Magnesium di udara dengan Oksigen terbatas pada suhu
tinggi akan dapat menghasilkan Magnesium Nitrida (Mg3N2)
4Mg(s) + ½ O2(g) + N2 (g) → MgO(s) + Mg3N2(s)
Bila Mg3N2 direaksikan dengan air maka akan didapatkan gas NH3 Mg3N2(s) + 6H2O(l) → 3Mg(OH)2(s) + 2NH3(g)
c. Reaksi dengan hidrogen
Adanya pemanasan menyebabkan logam allkali tanah dapat bereaksi dengan hidrogen membentuk senyawa hidrogen.
M(s) + H2(g) MH2(s)
d. Reaksi dengan Nitrogen
Logam alkali tanah yang terbakar di udara akan membentuk senyawa oksida dan senyawa Nitrida dengan demikian Nitrogen yang ada di udara bereaksi juga dengan Alkali Tanah. Contoh,
e. Reaksi Logam Alkali Tanah Dengan Halogen
Semua logam Alkali Tanah bereaksi dengan halogen dengan cepat membentuk garam Halida, kecuali Berilium.Lelehan halida dari berilium mempunyai daya hantar listrik yang buruk .Hal itu menunjukkan bahwa halida
berilium bersifat kovalen.Oleh karena daya polarisasi ion Be2+ terhadap pasangan
elektron Halogen kecuali F-, maka BeCl
2 berikatan kovalen. Sedangkan alkali
tanah yang lain berikatan ion. Contoh, Ca(s) + Cl2(g) → CaCl2(s) f. Reaksi dengan Asam dan Basa
Semua logam dan alkali tanah bereaksi dengan asam kuat ( seperti HCl) membentuk garam dan gas hidrogen.Reaksi makin hebat dari Be ke Ba.
M(s) + 2HCl(aq) MCl2(aq) + H2(g)
Salah satu unsur logam alkali tanah yaitu Be, memiliki sifat amfoter. Berilium selain dapat bereaksi dengan asam kuat juga dapat bereaksi dengan basa kuat.
Be(s) + 2NaOH (aq) + H2O(l) Na2Be(OH)4 + H2 (g)
BeO(s) + 2NaOH(aq) + H2O(l) Na2Be(OH)4(aq)
Be(OH)2(s) + 2NaOH(aq) Na2Be(OH)4(aq) g. Reaksi dengan belerang
Reaksi logam alkali tanah dengan belerang menghasilkan senyawa sulfida. M(s) + S(s) MS (s)
E. Ekstraksi Logam Alkali Tanah
Ekstraksi adalah pemisahan suatu unsur dari suatu senyawa.Logam alkali tanah dapat di ekstraksi dari senyawanya. Untuk mengekstraksinya kita dapat menggunakan dua cara, yaitu metode reduksi dan metode elektrolisis.
BeF2 + Mg MgF2 + Be b) Metode Elektrolisis
Untuk mendapatkan berilium juga kita dapat mengekstraksi dari
lelehan BeCl2 yang telah ditambah NaCl.Karena BeCl2 tidak dapat
mengahantarkan listrik dengan baik, sehingga ditambahkan NaCl.
dolomit [MgCa(CO3)2] karena dolomite merupakan salah satu sumber
yang dapat menhasilkan magnesium. Dolomite dipanaskan sehingga terbentuk MgO.CaO.lalu MgO.CaO. dipanaskan dengan FeSi sehingga menhasilkan Mg.
2[ MgO.CaO] + FeSi 2Mg + Ca2SiO4 + Fe
b) Metode Elektrolisis
Selain dengan ekstraksi dolomite magnesium juga bisa didapatkan dengan mereaksikan air alut dengan CaO. Reaksi yang terjadi : CaO + H2O Ca2+ + 2OH
-Setelah mendapatkan lelehan MgCl2 kita dapat mengelektrolisisnya
CaCO3 dengan HCl agar terbentuk senyawa CaCl2. Reaksi yang terjadi
:
CaCO3 + 2HCl CaCl2 + H2O + CO2
Setelah mendapatkan CaCl2, kita dapat mengelektrolisisnya agar
mendapatkan kalsium (Ca). Reaksi yang terjadi : Katoda ; Ca2+ + 2e- Ca
Anoda ; 2Cl- Cl 2 + 2e
-b) Metode Reduksi
Logam kalsium (Ca) juga dapat dihasilkan dengan mereduksi CaO
oleh Al atau dengan mereduksi CaCl2 oleh Na. Reduksi CaO oleh Al
6CaO + 2Al 3 Ca + Ca3Al2O6
dengan elektrolisis lelehan SrCl2. Lelehan SrCl2 bisa didapatkan dari
senyawa selesit [SrSO4].Karena Senyawa selesit merupakan sumber
utama Strontium (Sr). Reaksi yang terjadi ; katode ; Sr2+ +2e- Sr
anoda ; 2Cl- Cl 2 + 2e
- Ekstraksi Barium (Ba)
a) Metode Elektrolisis
Barit (BaSO4) adalah sumber utama untuk memperoleh Barium (Ba).
Setelah diproses menjadi BaCl2 barium bisa diperoleh dari elektrolisis
lelehan BaCl2. Reaksi yang terjadi :
katode ; Ba2+ +2e- Ba
anoda ; 2Cl- Cl 2 + 2e
Selain dengan elektrolisis, barium bisa kita peroleh dengan mereduksi BaO oleh Al. Reaksi yang terjadi :
6BaO + 2Al 3Ba + Ba3Al2O6.
F. Pembuatan Logam Alkali Tanah
Logam-logam alkali tanah diproduksi melalui proses elektrolisis lelehan garam halida (biasanya klorida) atau melalui reduksi halida atau oksida. Magnesium diproduksi melalui elektrolisis lelehan MgCl2. Air laut mengandung sumber ion Mg2+ yang tidak pernah habis.Rumah tiram yang banyak terdapat di laut mengandung kalsium karbonat sebagai sumber kalsium. Pembuatan logam magnesium dari air laut telah dikembangkan oleh berbagai industri kimia seperti ditunjukkan pada gambar berikut
Pembuatan logam magnesium dari air laut
CaCO3(s)⎯→CaO(s) + CO2(g)
Penambahan CaO ke dalam air laut dapat mengendapkan magnesium menjadi hidroksidanya:
Mg2+
(aq) + CaO(s) + H2O⎯⎯→Mg(OH)2(s) + Ca2+(aq)
Selanjutnya, Mg(OH)2 disaring dan diolah dengan asam klorida menjadi magnesium klorida.
Mg(OH)2(s) + 2HCl(aq)⎯⎯→MgCl2(aq) + 2H2O )((((((((((((( (
Setelah kering, garam MgCl2 dilelehkan dan dielektrolisis: MgCl2(((((((((((((() ⎯E⎯lek⎯troli⎯sis 1⎯.700⎯→Mg ) + Cl((((((((((((( ( 2(g)
Kulit kerang/tiram merupakan sumber kalsium.
Magnesium dapat juga diperoleh dari penguraian magnesit dan dolomit membentuk MgO.Kemudian, direduksi dengan ferosilikon (paduan besi dan silikon).Logam magnesium banyak digunakan sebagai paduan dengan aluminium, bertujuan untuk meningkatkan kekerasan dan daya tahan terhadap korosi. Oleh karena massa jenis paduan Mg–Al ringan maka paduan tersebut sering digunakan untuk membuat kerangka pesawat terbang atau beberapa bagian kendaraan. Sejumlah kecil magnesium digunakan sebagai reduktor untuk membuat logam lain, seperti berilium dan uranium. Lampu blitz pada kamera analog menggunakan kawat magnesium berisi gas oksigen menghasilkan kilat cahaya putih ketika logam tersebut terbakar.
Kalsium dibuat melalui elektrolisis lelehan CaCl2, juga dapat dibuat
melalui reduksi CaO oleh aluminium dalam udara vakum.Kalsium yang dihasilkan dalam bentuk uap sehingga dapat dipisahkan.
3CaO(s) + 2Al ) ((((((((((((( ( ⎯1⎯.200⎯⎯→3Ca(g) + Al2O3(s)
Jika logam kalsium dipadukan dengan timbel akan menghasilkan paduan yang cukup keras, digunakan sebagai elektrode pada accu. Elektrode ini tahan terhadap elektrolisis air selama proses isi-ulang, sehingga accu dapat diperbarui. Kalsium juga digunakan sebagai zat pereduksi dalam pembuatan beberapa logam yang kurang umum, seperti thorium.
ThO2(s) + 2Ca )((((((((((((( ( ⎯1⎯.000⎯⎯→Th(s) + 2CaO(s)
Berilium diperoleh dari elektrolisis berilium klorida, BeCl2.Natrium
klorida ditambahkan untuk meningkatkan daya hantar listrik lelehan BeCl2.Selain
itu, berilium juga dapat dibuat melalui reduksi garam fluoridanya oleh logam magnesium.
BeF2((((((((((((((((((((((((((() + Mg )( ⎯9⎯50⎯C→MgF2(((((((((((((() + Be(s)
Berilium merupakan logam mahal.Ini disebabkan manfaatnya tinggi. Jika sejumlah kecil tembaga ditambahkan ke dalam berilium, akan menghasilkan paduan yang kerasnya sama dengan baja. Adapun, barium dihasilkan melalui reduksi oksidanya oleh aluminium. Walaupun stronsium sangat sedikit digunakan secara komersial, stronsium dapat diproduksi melalui proses yang serupa.
G. Keberadaan Di Alam
Logam alkali tanah memilii sifat yang reaktif sehingga di alam hanya ditemukan dalam bentuk senyawanya. Berikut keberadaan senyawa yang mengandung logam alkali :
Berilium.
Berilium tidak begitu banyak terdapat di kerak bumi, bahkan hampir bisa dikatakan tidak ada. Sedangkan di alam berilium dapat bersenyawa menjadi Mineral beril [Be3Al2(SiO 6)3], dan Krisoberil [Al2BeO4].
Magnesium.
Magnesium Klorida [MgCl2], Senyawa Karbonat [MgCO3], Dolomit
[MgCa(CO3)2], dan Senyawa Epsomit [MgSO4.7H2O]
Kalsium
Kalsium adalah logam alkali yang paling banyak terdapat di kerak bumi. Bahkan kalsium menjadi nomor 5 terbanyak yang terdapat di kerak bumi, dengan 3,4% keberadaanya. Di alam kalsium dapat membentuk senyawa karbonat
[CaCO3], Senyawa Fospat [CaPO4], Senyawa Sulfat [CaSO4], Senyawa Fourida
[CaF]
Stronsium.
Stronsium berada di kerak bumi dengan jumlah 0,03%. Di alam strontium
dapat membuntuk senyawa Mineral Selesit [SrSO4], dan Strontianit
Barium.
Barium berada di kerak bumi sebanyak 0,04%. Di alam barium dapat
membentuk senyawa : Mineral Baritin [BaSO4], dan Mineral Witerit [BaCO3].
radium
Logam ini ditemukan dalam jumlah kecil dalam bijih uranium dan thorium dalam batu pitchblende.Diperkirakan bahwa setiap kilometer persegi permukaan bumi (hingga kedalaman 40 cm) berisi 1 gram radium.Jumlah radium dalam bijih uranium bervariasi antara 150 dan 350 mg/ton.Dan juga terkandung dalam bijih Zaire.
Radium dapat ditemukan dalam berbagai matriks lingkungan, seperti batu-batuan, tanah, air (air tanah, air laut, air mineral, dan air dari sumber air panas), tanaman (tanaman darat dan tanaman air), hewan (hewan darat dan hewan air), udara, dan manusia.
Masuknya radium dari dalam tanah ke air, dapat secara alami, yaitu dengan migrasi seperti yang telah dijelaskan di atas, di samping itu juga dapat berasal dari atmosfer akibat dari kegiatan manusia yang memanfaatkan sumber-sumber alam dari dalam tanah, misalnya kegiatan penambangan, terutama tambang fosfat termasuk limbah pabrik pembuatan pupuk fosfat, PLTU batubara (coal fly ash), bahan-bahan bangunan (gipsum, semen, dan pasir). Akibat
lepasan 226Ra ke lingkungan karena kegiatan manusia, menurut Dickson
Kadar 226Ra dalam lapisan troposfer berkurang dengan ketinggian dan
kadarnya sangat rendah di lapisan atmosfer atas. Distribusi vertikal dalam lapisan
untuk lapisan stratosfer rendah sama dengan kadar 238U, 210 Pb, dan Pb (stabil),
yang semua bersumber pada permukaan bumi. Kejadian alami dan kegiatan manusia memberi kontribusi cemaran radium di lapisan atmosfer, yang
akhirnya 226Ra dapat jatuh ke bumi bersama-sama dengan air hujan.
Kontribusi 226Ra di lingkungan yang berasal dari atmosfer relatif kecil, sedangkan
kontribusi paling besar berasal dari air buangan akibat kegiatan penambangan, terutama penambangan batubara sampai mencapai kadar ratusan Bq/kg. Pernah dilaporkan di Rusia (1983), hasil penggalian batubara 2,8 х 103 ton dapat
menghasilkan lepasan 226Ra total tahunan ke lingkungan (sungai) mendekati 6 х
1012 Bq. Sehingga kemungkinan terjadinya pencemaran lingkungan oleh 226Ra
baik yang berasal dari kegiatan manusia maupun secara alami perlu dikendalikan
secara sungguh-sungguh. Jejak radionuklida 226Ra dari bermacam-macam sumber
pencemar melalui berbagai media dan masuk ke dalam tubuh manusia.
H. Aplikasi dan Kegunaan Logam Alkali Tanah
Berilium (Be)
1. Berilium digunakan untuk memadukan logam agar lebih kuat, akan tetapi
bermasa lebih ringan. Biasanya paduan ini digunakan pada kemudi pesawat Zet.
2. Berilium digunakan pada kaca dari sinar X.
3. Berilium digunakan untuk mengontrol reaksi fisi pada reaktor nuklir.
4. Campuran berilium dan tembaga banyak dipakai pada alat listrik, maka
Berilium sangat penting sebagai komponen televisi.
5. Berilium digunakan sebagai agen aloy di dalam pembuatan tembaga
6. Karena ketegaran, ringan, dan kestabilan dimensi pada jangkauan suhu yang lebar, Alloy tembaga-berilium digunakan dalam industri angkasa-antariksa dan pertahanan sebagai bahan penstrukturan ringan dalam pesawat berkecepatan tinggi, peluru berpandu, kapal terbang dan satelit komunikasi.
7. Kepingan tipis berilium digunakan bersama pemindaian sinar-X untuk menepis cahaya tampak dan memperbolehkan hanya sinaran X yang terdeteksi.
8. Dalam bidang litografi sinar X, berilium digunakan untuk pembuatan litar
bersepadu mikroskopik.
9. Karena penyerapan panas neutron yang rendah, industri tenaga nuklir menggunakan logam ini dalam reaktor nuklir sebagai pemantul neutron dan moderator.
10.Berilium digunakan dalam pembuatan giroskop, berbagai alat komputer,
pegas jam tangan dan peralatan yang memerlukan keringanan, ketegaran dan kestabilan dimensi.
11.Berilium oksida sangat berguna dalam berbagai kegunaan yang
memerlukan konduktor panas yang baik, dan kekuatan serta kekerasan yang tinggi, dan juga titik lebur yang tinggi, seterusnya bertindak sebagai perintang listrik.
12.Campuran berilium pernah pada satu ketika dahulu digunakan dalam lampu floresens, tetapi penggunaan tersebut tak dilanjutkan lagi karena pekerja yang terpapar terancam bahaya beriliosis.
Pengaruh Berilium bagi Kesehatan
1. Berilium adalah sangat berbahaya jika terhirup. Keefektivannya tergantung
kepada kandungan yang dipaparkan dan jangka waktu pemaparan. Jika kandungan berilium di udara sangat tinggi (lebih dari 1000 μg/m³), keadaan akut dapat terjadi. Keadaan ini menyerupai pneumonia dan disebut penyakit berilium akut. Penetapan udara komunitas dan tempat kerja effektif dalam menghindari kerusakan paru-paru yang paling akut.
2. Sebagian orang (1-15%) akan menjadi sensitif terhadap berilium.
Keadaan ini disebut penyakit berilium kronik (CBD), dan dapat terjadi setelah pemamparan bertahun-tahun terhadap tingkat berilium diatas normal (diatas 0.2 μg/m³). Penyakit ini dapat menyebabkan rasa lemah dan keletihan, dan juga sasak nafas. CBD dapat menyebabkan anoreksia, penyusutan berat badan, dan dapat juga menyebabkan pembesaran bagian kanan jantung dan penyakit jantung dalam kasus-kasus peringkat lanjut. Sebagian orang yang sensitif kepada berilium mungkin atau mungkin tidak akan mendapat simptom-simptom ini. Jumlah penduduk pada umumnya jarang mendapat penyakit berilium akut atau kronik Karena kandungan berilium dalam udara biasanya sangat rendah (0.00003-0.0002 μg/m³).
3. Menelan berilium tidak pernah dilaporkan menyebabkan efek kepada
manusia Karena berilium diserap sangat sedikit oleh perut dan usus. Berilium yang terkena kulit yang mempunyai luka atau terkikis mungkin akan menyebabkan radang.
4. United States Department of Health and Human Services (DHHS) dan
International Agency for Research on Cancer (IARC) telah memberi kepastian bahawa berilium adalah karsinogen. EPA menjangkakan bahawa pemamparan seumur hidup kepada 0.04 μg/m³ berilium dapat menyebabkan satu perseribu kemungkinan untuk mengidap kanker.
5. Tidak terdapat kajian tentang efek pemamparan berilium terhadap
anak-anak. Kemungkinan, pengaruh kesehatan yang dilihat pada kanak-kanak yang terpapar terhadap berilium sama dengan efeknya terhadap orang dewasa. Masih belum diketahui perbedaan dalam efek berilium antara orang dewasa dan kanak-kanak.
6. Masih belum diketahui juga apakah pemamparan terhadap berilium dapat
menyebabkan kecacatan sejak lahir atau efek-efek lain yang berlanjutan kepada orang ramai. Kajian terhadap kesan lanjutan terhadap hewan tidak dapat dipastikan.
7. Berilium dapat diukur dalam air kencing atau darah. Kandungan berilium
darah, yaitu beryllium lymphocyte proliferation test (BeLPT), mengukur pasti kesensitifan terhadap berilium dan memberikan jangkaan terhadap CBD. Batas Kandungan berilium yang mungkin dilepaskan ke dalam udara dari kawasan perindustrian adalah 0.01 μg/m³, Dirata-ratakan pada jangka waktu 30 hari, atau 2 μg/m³ dalam ruang kerja dengan shift kerja 8 jam.
Magnesium (Mg)
1. Magnesium digunakan untuk memberi warna putih terang pada kembang
api dan pada lampu Blitz.
2. Senyawa MgO dapat digunakan untuk melapisi tungku, karena senyawa
MgO memiliki titik leleh yang tinggi.
3. Senyawa Mg(OH)2 digunakan dalam pasta gigi untuk mengurangi asam
yang terdapat di mulut dan mencagah terjadinnya kerusakan gigi, sekaligus sebagai pencegah maag
4. Mirip dengan Berilium yang membuat campuran logam semakin kuat dan
ringan sehingga biasa digunakan pada alat alat rumah tangga.
Kalsium (Ca)
1. Kalsium digunakan pada obat obatan, bubuk pengembang kue dan plastic.
2. Senyawa CaSO4 digunakan untuk membuat Gips yang berfungsi untuk
membalut tulang yang patah.
3. Senyawa CaCO3 biasa digunakan untuk bahan bangunan seperti
komponen semen dan cat tembok.Selain itu digunakan untuk membuat kapur tulis dan gelas.
4. Kalsium Oksida (CaO) dapat mengikat air pada Etanol karena bersifat
dehidrator,dapat juga mengeringkan gas dan mengikat Karbondioksida pada cerobong asap.
5. Ca(OH)2 digunakan sebagai pengatur pH air limbah dan juga sebagai
sumber basa yang harganya relatif murah
6. Kalsium Karbida (CaC2) disaebut juga batu karbit merupakan bahan untuk
7. Kalsium banyak terdapat pada susu dan ikan teri yang berfungsi sebagai
16.Mengatasi kram, sakit pinggang, wasir, dan reumatik
17.Mengatasi keluhan saat haid dan menopause
18.Meminimalkan penyusutan tulang selama hamil dan menyusui
19.Membantu mineralisasi gigi dan mencegah pendarahan akar gigi
20.Mengatasi kering dan pecah-pecah pada kulit kaki dan tangan
21.Memulihkan gairah seks yang menurun/melemah
22.Mengatasi kencing manis (mengaktifkan pankreas)
Stronsium (Sr)
1. Stronsium dalam senyawa Sr(no3)2 memberikan warna merah apabila
digunakan untuk bahan kembang api.
2. Stronsium sebagai senyawa karbonat biasa digunakan dalam pembuatan
kaca televisi berwarna dan komputer.
3. Untuk pengoperasian mercusuar yang mengubah energi panas menjadi
listrik dalam baterai nuklir RTG (Radiisotop Thermoelectric Generator).
Barium (Ba)
a. BaSO4 digunakan untuk memeriksa saluran pencernaan karena mampu
menyerap sinar X meskipun beracun.
b. BaSO4 digunakan sebagai pewarna pada plastic karena memiliki kerapatan
yang tinggi dan warna terang.
c. Ba(NO3)2 digunakan untuk memberikan warna hijau pada kembang api.
a. Radium pernah digunakan dalam kandungan cat kuku. Ketika kebiasaan orang-orang yang menggunakan cat kuku umumnya adalah wanita yang terkadang menggigit jarinya berisiko terkena penyakit anemia.
b.
Setelah tahun 1960-an, cat radium pertama kali diganti dengancat prometium, dan kemudian oleh tritium botol yang terus digunakan hari
ini. Meskipun radiasi beta daritritium yang secara potensial berbahaya jika
ditelan, itu telah menggantikan radium dalam aplikasi ini.
c.
Radium juga dimasukkan ke dalam beberapa makanan untukmempertahankan rasa dan sebagai pengawet, namun dampaknya banyak orang terkena radiasi. Radium pernah menjadi aditif dalam produk seperti pasta gigi, krim rambut, dan bahkan makanan. Produk semacam itu dilarang oleh pemerintah di beragai negara, setelah ditemukan dapat menimbulkan efek kesehatan yang sangat serius karena dapat merugikan.
(Lihat misalnyaRadithor.) Di AS, radium digunakan untuk mencegah
masalah telinga tengah atau pembesaran tonsil pada anak-anak dari akhir 1940-an hingga awal 1970-an.
d.
Pada tahun 1909, yang terkenal percobaan Rutherford yaitu radium yangdigunakan sebagai sumber alpha untuk menyelidiki struktur atom emas. Percobaan ini menyebabkan model Rutherford atom dan merevolusionerkan bidang fisika nuklir.
e.
Radium (biasanya dalam bentuk radium klorida) digunakan dalamobat-obatan untuk menghasilkan gas radon yang digunakan sebagai pengobatan kanker, misalnya beberapa sumber radon ini digunakan di
Kanada pada 1920-an dan 1930-an. Isotop 223 Ra saat ini sedang diselidiki
untuk digunakan dalam obat sebagai kanker pengobatan tulangmetastasis.
f. Pemanfaatan radium untuk memenuhi kebutuhan hidup, mendorong orang
Joanchimsthal. Antara 1913 dan 1922, persediaan radium dunia telah dikuasai oleh produksi Amerika Serikat dan negara penyalur radium di negara-negara Eropa. Berkaitan dengan hal tersebut distribusi radium beserta anak luruhnya ke lingkungan perlu ditangani secara sungguh-sungguh. Distribusi radium beserta anak luruhnya (radon, polonium, timbal, dan bismuth) dalam bentuk partikel debu kemungkinan dapat memberikan resiko terhadap kesehatan manusia dan lingkungan, terutama para pekerja tambang.
g.
Radium digunakan dalam senyawa api warna merah tua merah (kayamerah atau warna merah dengan warna ungu) dan memberikan karakteristik spektrum. Karena pendek yang secara geologis setengah hidup dan intens radioaktivitas, radium merupakan senyawa cukup langka, terjadi hampir secara eksklusif dalam bijih uranium.
F Fluorida radium (RaM2)
h.
Radium memiliki sifat pendar (luminescent), yang ada kaitannya dengansuatu zat pendar padat, seperti seng sulfit, dapat digunakan pada angka-angka pada jam tangan sehingga dapat bercahaya dalam gelap. Daya pengionannya telah dimanfaatkan untuk keelektrikan statik eliminator dan klep elektronik. Radium bersama dengan berilium dapat dipakai sebagai sumber neutron .
Pengaruh Logam Radium bagi Tubuh
226Ra bersifat radioaktif dengan waktu paroh 1622 tahun dan memancarkan
radiasi alfa dengan energi 4,79 MeV. Anak luruh dari 226Ra adalah gas radon
(222Rn).keberadaann gas radon di lingkungan mencapai jumlah sangat besar,
bahaya radiologik terhadap saluran pernafasan.Adapun 226Ra sendiri bersifat
seperti unsur kalsium (Ca) yang mudah terakumulasi di dalam tulang.
Tidak ada bukti bahwa secara alami terdapat hubungan ke tingkat radium memiliki efek yang merugikan pada kesehatan manusia.Namun, hubungan ke tingkat yang lebih tinggi radium dapat mengakibatkan efek kesehatan, seperti gigi fraktur, anemia dan katarak.Ketika pemaparan berlangsung selama jangka waktu yang panjang radium bahkan menyebabkan kanker dan eksposur pada akhirnya dapat menyebabkan kematian.Efek ini dapat berlangsung bertahun-tahun untuk berkembang dan biasanya disebabkan oleh radiasi gamma radium, yang mampu melakukan perjalanan cukup jauh melalui udara.
Manusia merupakan media terakhir dari jejak kritik radium di lingkungan.Misalnya radium masuk ke dalam tubuh dapat melalui pernafasan
maupun sistem pencernaan (makan dan minum). Umumnya kadar 226Ra dalam
tulang relatuf tinggi berkisar dari 0,059 sampai 1,2 Bq/kg kering, dengan rata-rata 0,31 Bq/kg. Adapun untuk organ lain, seperti paru-paru, gonad, sumsum merah dan sumsum kuning, masing-masing sekitar 0,005 Bq/kg.
Kadar 226Ra dalam organ tubuh sangat bergantung dari usia, tempat
tinggal, dan pola makanan/minuman atau rantai makanan. Harga kadar 226Ra
dalam tubuh manusia yang tinggal di daerah latar tinggi umumnya lebih tinggi, jika dibandingkan dengan orang yang bertempat tinggal di daerah latar normal.
Sebagai contoh, kadar 226Ra dalam tubuh manusia yang bertempat tinggi di Karala
BAB III
PENUTUP
KesimpulanA. Unsur alkali tanah memiliki reaktifitas tinggi, sehingga tidak ditemukan dalam bentuk monoatomik , unsur ini mudah bereaksi dengan oksigen, dan logam murni yang ada di udara, membentuk lapisan luar pada oksigen.
B. Sifat-Sifat Alkali Tanah
C. Di alam unsur-unsur alkali tanah terdapat dalam bentuk senyawa.Magnesium
dan kalsium terdapat dalam batuan silikat dan aluminosilikat sebagai kationiknya.
D. Adapun warna nyala masing-masing logam-logam alkali tanah adalah : Berillium (putih)
Magnesium (putih)
Kalsium (jingga - merah / sindur merah) Stronsium (merah)
Barium (hijau muda/kuning muda)
E. Kegunaan :
Berilium dapat diukur dalam air kencing atau darah.
Magnesium digunakan untuk memberi warna putih terang pada kembang
api dan pada lampu Blitz. Kalsium (Ca)
Kalsium digunakan pada obat obatan, bubuk pengembang kue dan plastic
Stronsium sebagai senyawa karbonat biasa digunakan dalam pembuatan
BaSO4 digunakan untuk memeriksa saluran pencernaan karena mampu
menyerap sinar X meskipun beracun
Radium pernah digunakan dalam kandungan cat kuku. Ketika kebiasaan
DAFTAR PUSTAKA
Cotton, Albert. Wilkinson, Geofrey. 1989. Kimia Anorganik Dasar. Jakarta : Universitas Indonesia.
http://doddysetiagraha.blogspot.com/2012/10/radium.html
http://kimia-gonzaga.blogspot.com/2013/07/pembuatan-dan-manfaat-unsur.html
http://miellahsmartflower.blogspot.com/2011/04/barium.html
Keenan. Kleinferter. Wood. 1993. Kimia untuk Universitas. Jakarta : Erlangga.