BAB II LANDASAN TEORI
A. Tinjauan Pustaka
1. Tokisitas Pestisida Pada Manusia
Toksisitas atau daya racun adalah sifat bawaan pestisida yang menggambarkan potensi pestisida untuk menimbulkan kematian langsung maupun bahaya lainnya pada hewan tingkat tinggi, termasuk manusia. Toksisitas dibedakan menjadi toksisitas akut, toksisitas kronik, dan toksisitas sub-kronik (Djojosumarto, 2008).
Toksisitas akut dinyatakan dalam angka LD50, yaitu dosis yang biasa
mematikan (lethal dose) 50% dari binatang uji yang dihitung dalam mg/kg berat badan. Toksisitas kronik adalah pengaruh merugikan yang timbul akibat pemberian takaran harian berulang dari pestisida, bahan kimia, atau bahan lainnya, maupun pemaparan dengan bahan-bahan tersebut yang berlangsung cukup lama, biasanya lebih dari 50% rentang hidup (Djojosumarto, 2008).
2. Residu Pestisida
Residu merupakan semua senyawa kimia dalam makanan serta komoditas petanian atau pakan ternak yang bersumber dari penggunaan produk perlindungan tanaman. Pengertian residu meliputi bahan aktif asal (parent compound), senyawa hasil perubahan dari bahan aktif metabolit, produk hasil reaksi dengan senyawa lain, serta impurities (bahan cemaran yang terdapat dalam pestisia) yang memiliki kepentingan secara toksikologis. Asupan residu suatu pestisida dalam makanan adalah jumlah residu dalam tiap satuan berat makanan (mg/kg) dikalikan dengan jumlah makanan yang dikonsumsi (Djojosumarto, 2008).
Residu yang terdapat dalam tanaman dapat berasal dari pestisida yang langsung diaplikasikan pada tanaman maupun yang diaplikasikan melalui tanah dan air. Selain itu residu dapat berasal dari kontaminasi melalui hembusan angin, debu
yang terbawa hujan dari daerah penyemprotan yang lain, dan juga penanaman pada tanah yang mengandung pestisida persisten (Nugrohati, 1986).
Tinggi rendahnya residu pestisida pada tanaman ditentukan oleh jenis pestisida, dosis dan frekuensi aplikasi, serta waktu aplikasi. Pengaruh jenis pestisida terhadap tingkat residu tergantung pada sifat-sifat fisika dan kimia-nya (Nugrohati, 1986). Menurut European Commission, batas maksimum residu (BMR) pestisida didefinisikan sebagai konsentrasi maksimum residu pestisida yang dapat diterima secara legal pada hasil pertanian dan makanan (European Commission, 2008). Terdapatnya tetapan mengenai BMR suatu negara dapat melindungi kesehatan masyarakat dari produk pertanian atau perkebunan yang membahayakan (Refindra, 2009).
3. Pestisida
Pestisida adalah substansi kimia yang digunakan untuk membunuh atau mengendalikan berbagai hama. Kata pestisida berasal dari kata pest yang berarti hama, dan sida yang berarti pembunuh, jadi artinya pembunuh hama. Pestisida didefinisikan juga sebagai semua zat kimia dan bahan lain serta jasad renik dan virus yang dipergunakan untuk (Sastroutomo, 1992) :
1) Memberantas atau mencegah hama penyakit yang merusak tanaman, bagian-bagian tanaman atau hasil-hasil pertanian
2) Memberantas rerumputan
3) Mengatur atau merangsang pertumbuhan yang tidak diinginkan
4) Memberantas atau mencegah hama-hama pada hewan peliharaan dan ternak 5) Memberantas atau mencegah hama-hama air
6) Memberantas atau mencegah binatang-binatang yang dapat menyebabkan penyakit pada manusia dan binatang yang perlu dilindungi
7) Memberantas atau mencegah binatang-binatang yang dapat menyebabkan penyakit pada manusia dan binatang yang perlu dilindungi.
di dalam meningkatkan produksi pertanian. Selain menguntungkan bagi bidang pertanian, pemakaian pestisida berlebihan dapat menjadi sumber pencemaran bagi bahan pangan, air dan lingkungan hidup. Sejumlah bahan kimia yang ditinggalkan melalui berbagai siklus langsung atau tidak langsung (Atmawidjaja, 2004).
Pestisida dibagi ke dalam dua klasifikasi utama yaitu pestisida kimia dan bio-pestisida. Pada pestisida kimia digunakan material sintetik yang langsung menghambat pertumbuhan maupun membunuh hama. Pestisida kimia dibagi menjadi lima golongan berdasarkan target hamanya yaitu insektisida, herbisida, fungisida, rodentisida, dan nematisida. Insektisida sendiri meliputi organofosfat, karbamat, organoklorin dan pestisida botani. Sedangkan, biopestisida diperoleh dari bahan-bahan alami seperti hewan, tumbuhan, bakteri, dan mineral. Sebagai contohnya yaitu minyak kanola dan baking soda (Sastroutomo, 1992).
Pestisida kimia atau sintesis pada prosesnya tidak hanya tertinggal pada organisme, namun juga pada lingkungan terutama tanah, dan air tanah permukaan. Pestisida sintetis mempengaruhi pertumbuhan tanaman. Komponen kimia di dalam pestisida bersifat tidak mudah mengalami biodegradasi. Disamping masalah lingkungan yang ditimbulkan, pestisida juga menghasilkan resiko serius bagi kemanusiaan. Pestisida menimbulkan bahaya kesehatan tergantung pada jenisnya (Bhadekar et.al., 2011).
4. Insektisida
Insektisida adalah senyawa kimia yang digunakan untuk membunuh serangga. Insektisida yang pertama kali dikenal adalah sulfur sebagai fumigant. Kini jenis insektisida telah bertambah banyak berkat penemuan senyawa kimia sintetis (Sastroutomo, 1992).
Senyawa-senyawa insektisida terdiri dari beberapa golongan, berdasarkan sususan rumus bangunnya dibagi atas (Hay, 1976) :
a. Golongan Organoklorin
Organoklorin adalah insektisida yang mengandung atom karbon, klor, dan hidrogen dan kadangkala oksigen. Senyawa ini sering kali disebut sebagai hidrokarbon klorinat, klorinat organik atau klorinat sintesis.
Sifat insektisida golongan ini antara lain (Sudarmo, 1992): 1) Stabil, tidak mudah terurai dan tidak mudah rusak,
2) Efek residu yang timbul lebih dari 15 hari sampai lama sekali. Sebuah penelitian melaporkan residu masih ada di alam setelah lebih dari 15 tahun pemakaian (Iljas, 1986),
3) Residunya dapat menimbulkan akumulasi dalam tubuh, 4) Keracunannya terjadi secara lambat,
5) Belum ditemukan antidotnya.
b. Golongan Organofosfat
Insektisida organofosfat (seperti chlorpyrifos, methyl chlorpyrifos, atau
chlorfenvinphos) dan herbisida triazine (seperti atrazine, simazine, dan metribuzine) merupakan jenis pestisida yang paling banyak digunakan di seluruh
dunia. Residu pestistida beserta metabolitnya ini masih banyak terdeteksi di lingkungan, walaupun peredaran beberapa diantaranya telah dilarang (Goncalves, 2005). Senyawa parathion merupakan senyawa golongan organofosfat yang paling toksik, sedangkan senyawa yang paling rendah sifat toksiknya adalah
malathion. Pestisida golongan ini dapat meracuni manusia melalui kulit, mulut,
atau pernafasan (Satroutomo, 1992).
Insektisida organofosfat atau lebih dikenal senyawa OP adalah insektisida penghambat cholinesterase dan bekerja melalui perut, racun kontak, sistemik atau fumigasi. Senyawa OP berupa aril atau alifatik (rantai lurus). Arilfosfat adalah ester dari fenol dengan gugus asam fosfat atau thiofosfat (Satroutomo, 1992). Spektrum dari insektisida ini bermacam-macam seperti Parathion dan Tetraethyl
Senyawa insektisida golongan ini mempunyai sifat (Sudarmo, 1992) : 1) Mudah terurai di alam,
2) Residu mempunyai daya bunuh lebih kurang 15 hari setelah penyemprotan dilakukan,
3) Mempunyai daya merusak fungsi enzim kolinesterase dalam darah atau plasma sehingga asetikolinnya tidak dapat dihidrolisis dan akibatnya menjadi berlebihan. Kondisi ini menyebabkan serangga menjadi hiperaktif kemudian menggelepar, lumpuh lalu mati (Satroutomo, 1992),
4) Efek keracunannya terjadi dengan cepat. 5) Mempunyai antidot,
6) Tidak terjadi akumulasi di dalam tubuh.
Senyawa golongan ini pada umumya bersifat sangat toksik untuk mamalia dibandingkan seyawa lain yang juga diketahui toksik bagi mamalia. Senyawa golongan ini lebih tidak stabil dibandingkan golongan organoklorin, ketahanan senyawa ini bermacam-macam dari yang hanya beberapa hari hingga berbulan-bulan. Sistematika dari insektisida ini adalah setelah terserap ke dalam tanaman senyawa ini akan bertranslokasi ke targetnya sebagai racun perut membunuh serangga yang memakannya. Insektisida ini akan bertahan selama beberapa minggu di dalam tanaman sebelum terdegradasi dengan reaksi hidrolisis atau melalui aktifitas enzim tanaman lain (Kumar, 1984).
Sebanyak 229 bahan aktif insektisida organofosfat yang terdaftar di komisi pestisida pada tahun 2005, 23 bahan aktif dan lebih dari 40% diantaranya termasuk bahan Extremely Hazardous dan Highly Hazardous menurut klasifikasi WHO (Manuwoto, 2000). Insektisida organofosfat (seperti chlorpyrifos, metil
chlorpyrifos, atau chlorfenvinphos) merupakan jenis pestisida yang paling banyak
digunakan di seluruh dunia. Residu pestistida jenis ini terbukti masih banyak terdeteksi di lingkungan, walaupun beberapa jenis diantaranya telah dilarang peredarannya (Goncalves, 2005).
Berikut senyawa pestisida golongan organofosfat yang digunakan pada penelitian ini :
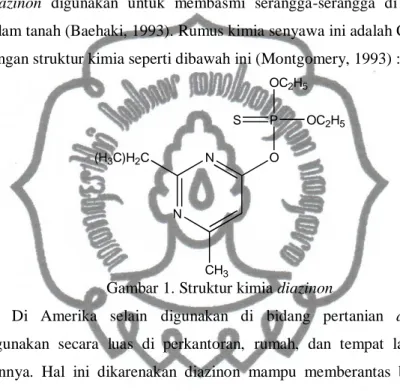
1) Diazinon
Merupakan senyawa pertama dari golongan organofosfat yang diperkenalkan pada tahun 1952. Diazinon mempunyai daya larut sebesar 40 mg/L dan kelarutannya semakin tinggi dalam minyak petrol. Struktur cincinya terbentuk dari enam atom yang dua di antaranya adalah atom nitrogen.
Diazinon digunakan untuk membasmi serangga-serangga di daun dan di
dalam tanah (Baehaki, 1993). Rumus kimia senyawa ini adalah C12H12N2O3PS
dengan struktur kimia seperti dibawah ini (Montgomery, 1993) :
N N (H3C)H2C CH3 O P OC2H5 S OC2H5
Gambar 1. Struktur kimia diazinon
Di Amerika selain digunakan di bidang pertanian diazinon juga digunakan secara luas di perkantoran, rumah, dan tempat layanan publik lainnya. Hal ini dikarenakan diazinon mampu memberantas berbagai jenis serangga seperti lalat, nyamuk, kumbang, kecoa, kepindang, kutu, dan laba-laba (WHO, 1998).
Senyawa insektisida ini dapat larut dengan sejumlah pelarut organik seperti minyak tanah dan air. Diazinon memiliki kelarutan yang tinggi dalam air, yaitu sekitar 40 ppm dengan suhu 20oC. Senyawa ini berbau menyengat dapat mengalami oksidasi dan dekomposisi pada suhu tinggi. Diazinon dapat terhidrolisis dengan cepat pada kondisi asam kuat dan basa. Hidrolisis berjalan lambat pada kondisi netral. Oksidasi sinar UV dapat menyebabkan penurunan derajat toksisitasnya (Ramulu, 1979).
Corporation 1956 dan mempunyai LD50 melalui mulut tikus sebesar 300-580
mg/kg, sedangkan melalui kulit tikus adalah 2.150 mg/kg (Baehaki, 1993).
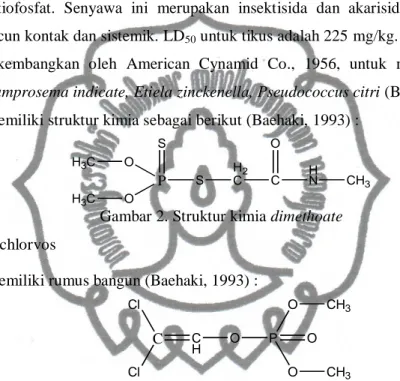
2) Dimethoate
Dimethoate merupakan insektisida golongan organofosfat prototipe asam
ditiofosfat. Senyawa ini merupakan insektisida dan akarisida OP sebagai racun kontak dan sistemik. LD50 untuk tikus adalah 225 mg/kg. Insektisida ini
dikembangkan oleh American Cynamid Co., 1956, untuk mengendalikan
Lamprosema indicate, Etiela zinckenella, Pseudococcus citri (Baehaki, 1993).
Memiliki struktur kimia sebagai berikut (Baehaki, 1993) :
P S O O H3C H3C S H2 C C HN CH3 O
Gambar 2. Struktur kimia dimethoate 3) Dichlorvos
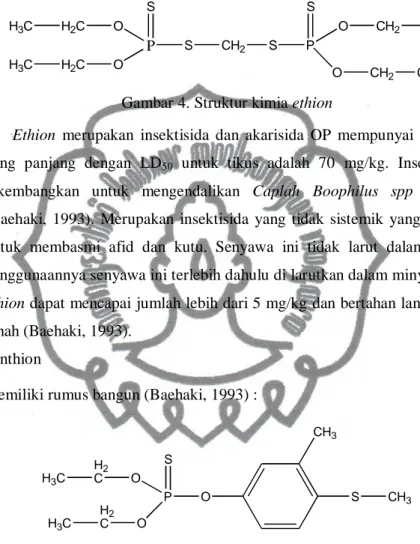
Memiliki rumus bangun (Baehaki, 1993) :
C C H O P O Cl Cl O O CH3 CH3
Gambar 3. Struktur kimia dichlorvos
Insektisda ini dapat juga dipergunakan sebagai akarisida yang merupakan racun perut dan racun kontak dan dapat juga sebagai fumigant. LD50 melalui
mulut tikus adalah 56 mg/kg, sedangkan melalui kulit adalah 75 mg/kg. Pemakaian insektisida secara langsung tidak menyebabkan fitotoksik.
Dichlorvos dapat dipergunakan untuk mengendalikan Paralebeda plagifera, Sama Cynthia, Plutella xyllostella, Crosidolomia binotalis, Prodenia litura
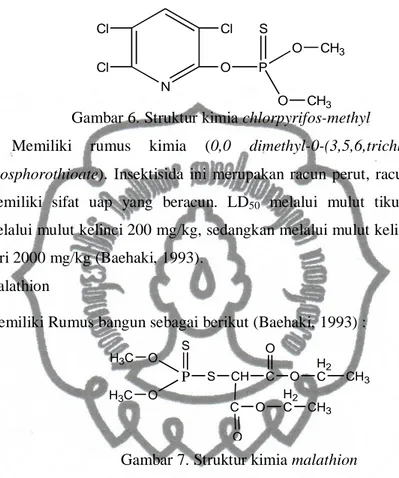
4) Ethion
Memiliki rumus bangun (Baehaki, 1993) :
P S O O S H2C H2C CH2 H3C H3C S P S O O CH2 CH2 CH3 CH3
Gambar 4. Struktur kimia ethion
Ethion merupakan insektisida dan akarisida OP mempunyai efek residu
yang panjang dengan LD50 untuk tikus adalah 70 mg/kg. Insektisida ini
dikembangkan untuk mengendalikan Caplah Boophilus spp pada sapi (Baehaki, 1993). Merupakan insektisida yang tidak sistemik yang digunakan untuk membasmi afid dan kutu. Senyawa ini tidak larut dalam air, pada penggunaannya senyawa ini terlebih dahulu di larutkan dalam minyak. Residu
ethion dapat mencapai jumlah lebih dari 5 mg/kg dan bertahan lama di dalam
tanah (Baehaki, 1993). 5) Fenthion
Memiliki rumus bangun (Baehaki, 1993) :
S CH3 O P O O S H2 C H2 C H3C H3C CH3
Gambar 5. Struktur kimia fenthion
Fenthion adalah fosfat organik insektisida dan akarisida mempunyai
aktivitas residu yang panjang, merupakan racun perut dan racun kontak. Insektisida ini berupa cairan tidak berwarna, bila digunakan menurut anjuran tidak menimbulkan fitotoksik. LD50 melalui mulut tikus adalah 190 mg/kg,
6) Chlorpyrifos-methyl
Mempunyai rumus bangun sebagai berikut (Baehaki, 1993) :
N Cl Cl O P S O O Cl CH3 CH3
Gambar 6. Struktur kimia chlorpyrifos-methyl
Memiliki rumus kimia (0,0 dimethyl-0-(3,5,6,trichloro-2-pyridyl)
phosphorothioate). Insektisida ini merupakan racun perut, racun kontak, dan
memiliki sifat uap yang beracun. LD50 melalui mulut tikus 941 mg/kg,
melalui mulut kelinci 200 mg/kg, sedangkan melalui mulut kelinci lebih besar dari 2000 mg/kg (Baehaki, 1993).
7) Malathion
Memiliki Rumus bangun sebagai berikut (Baehaki, 1993) :
P S O O S H3C H3C CH C O O H2 C C CH3 O O H2 C CH3
Gambar 7. Struktur kimia malathion
Malathion merupakan insektisida dengan sifat racun yang paling rendah
dan aman terhadap hewan mamalia. Aktivitasnya bukan sistemik dan tidak meracuni tumbuhan kecuali pada jenis-jenis tertentu (Sastroutomo, 1992).
Malathion merupakan insektisida dan akarisida dengan LD50 untuk tikus
adalah 1375 mg/kg (Baehaki, 1993)
Malathion termasuk golongan organofosfat parasimpatomimetrik, yang berikatan irreversible dengan enzim kolinesterase pada sistem syaraf serangga. Akibatnya otot tubuh serangga mengalami kejang, kemudian lumpuh, dan akhirnya mati, malathion digunakan dengan cara pengasapan (Kasumbogo, 2004).
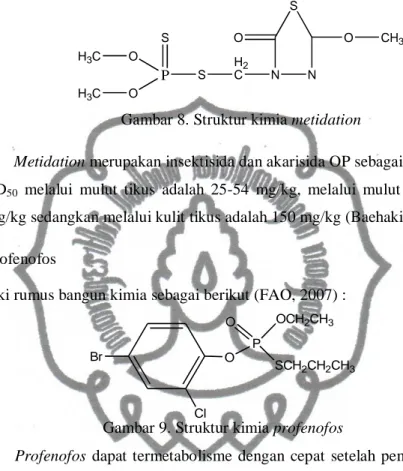
8) Metidation.
Memiliki rumus bangun sebagai berikut (Baehaki, 1993) :
P S O O S H2 C N N S O O CH3 H3C H3C
Gambar 8. Struktur kimia metidation
Metidation merupakan insektisida dan akarisida OP sebagai racun kontak.
LD50 melalui mulut tikus adalah 25-54 mg/kg, melalui mulut kelinci 63-80
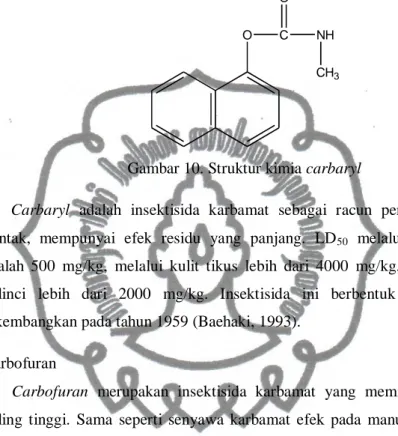
mg/kg sedangkan melalui kulit tikus adalah 150 mg/kg (Baehaki, 1993). 9) Profenofos
Memiliki rumus bangun kimia sebagai berikut (FAO, 2007) :
Br O Cl P SCH2CH2CH3 OCH2CH3 O
Gambar 9. Struktur kimia profenofos
Profenofos dapat termetabolisme dengan cepat setelah pemberian secara
oral untuk hewan. Setelah diberikan secara oral, profenofos menjalani hidrolisis ester fosfat dan kemudian menjadi bentuk sulfat ataupun glukuronida-nya. Residu profenofos dapat bertahan stabil selama satu hingga dua tahun (FAO, 2007).
Profenofos dapat menyebabkan penghambatan pada cholinesterase
manusia, menstimulasi sistem syaraf, menyebabkan mual, pusing, kebingungan, dan pada paparan yang lebih tinggi dapat menyebabkan paralisis pernapasan dan kematian (Toxicology Data Network, 2014).
c. Golongan Organosulfur
Senyawa golongan ini secara umum mempunyai rumus bangun yang mengandung atom sulfur di tengah-tengahnnya. Insektisida organosulfur mempunyai toksisitas yang sangat rendah terhadap serangga, sehingga sangat cocok digunakan untuk membasmi telur-telur serangga. Karena itu golongan ini dikenal dengan sebutan ovisida. Salah satu contoh senyawa golongan ini adalah tetradifuran. Senyawa ini boleh digunakan untuk beberapa macam buah-buahan. d. Golongan Karbamat
Sejak 1960 sevin berhasil mengenalkan penggunaan kormesil dari senyawa ini untuk perkebunan kapas, buah, sayur, sereal (gandum, jagung, padi), dan pertanian umum lainnya. Semenjak itu pula ditemukan kegunaannya yang lebih banyak untuk melawan gangguan hama pertanian dan berhasil melawan hama di perkebunan kakao. Insektisida karbamat atau yang biasa disebut Carb ini berasal dari asam karbamat NH2COOH. Umumnya senyawa ini stabil walaupun
formulasinya mudah terurai dilingkungan. Penggunaannya dipercaya menghasilkan ketahanan bagi insektisida tipe lain seperti organofosfat. Selama 20 tahun terakhir, penelitian besar mengenai insektisida N-methyl-carbamate terus dikembangkan (Kumar, 1984).
Senyawa karbamat merupakan turunan dari asam karbamat (HO-CO-NH2).
Mekanisme kerja senyawa ini adalah menghambat kerja enzim kolinesterase. Beberapa dari senyawa ini cukup dikenal oleh petani diantaranya carbofuran dan
propoxur (Sastroutomo, 1992). Asam karbamat bebas tidak dikenal di alam,
beberapa esternya berkemampuan digunakan sebagai obat. Hanya turunan indol dari asam metil karbamat yaitu physostigmine atau eserine yang terdapat di alam. Insektisida karbamat pada umumnya adalah turunan dari physostigmine dengan struktur umum adalah (Baehaki, 1993) :
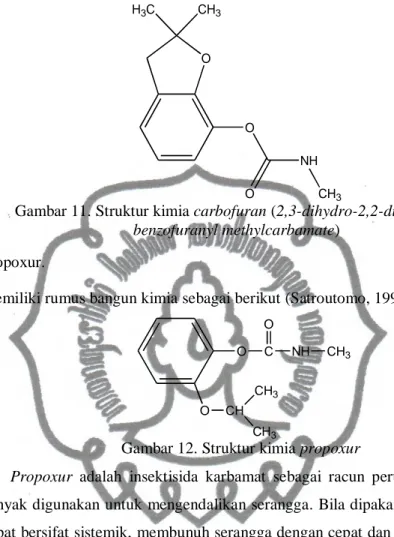
Senyawa pestisida golongan karbamat yang digunakan pada penelitian ini adalah : 1) Carbaryl
Merupakan senyawa karbamat pertama yang diperkenalkan ada tahun 1956. Mempunyai aktivitas kontak dan sedikit sistemik. Semasa dalam
penyimpanan, senyawa ini sangat stabil, masa paruhnya di permukaan daun ialah 3-4 hari dan di dalam tanah selama 7-9 hari (Satroutomo, 1992).
Memiliki rumus kimia sebagai berikut (Sastroutomo, 1992) :
O C NH
O
CH3
Gambar 10. Struktur kimia carbaryl
Carbaryl adalah insektisida karbamat sebagai racun perut dan racun
kontak, mempunyai efek residu yang panjang. LD50 melalui mulut tikus
adalah 500 mg/kg, melalui kulit tikus lebih dari 4000 mg/kg, melalui kulit kelinci lebih dari 2000 mg/kg. Insektisida ini berbentuk kristal putih dikembangkan pada tahun 1959 (Baehaki, 1993).
2) Carbofuran
Carbofuran merupakan insektisida karbamat yang memiliki toksisitas
paling tinggi. Sama seperti senyawa karbamat efek pada manusia umumnya menyebabkan penghambatan cholinesterase dengan efek yang cepat. Gejala keracunan carbofuran ditunjukkan dengan mual, muntah, keram perut, berkeringat, diare, lemas, keseimbangan terganggu, pandangan kabur, sulit bernafas, dan tekanan darah naik. Dosis yang tinggi dapat menyebabkan kematian disebabkan kerusakan sistem pernafasan. Carbofuran larut dalam air dan memiliki ketahanan yang sedang di lingkungan. Carbofuran diketahui sangat toksik terhadap burung, organisme perairan dan organisme lainnya termasuk lebah. (Toxipedia, 2014).
O O CH3 H3C NH CH3 O
Gambar 11. Struktur kimia carbofuran
(2,3-dihydro-2,2-dimethyl-7-benzofuranyl methylcarbamate)
3) Propoxur.
Memiliki rumus bangun kimia sebagai berikut (Satroutomo, 1992) :
O O CH CH3 CH3 C NH CH3 O
Gambar 12. Struktur kimia propoxur
Propoxur adalah insektisida karbamat sebagai racun perut dan kontak,
banyak digunakan untuk mengendalikan serangga. Bila dipakai melalui tanah dapat bersifat sistemik, membunuh serangga dengan cepat dan efek residunya panjang. Kompatibel bila dicampur dengan berbagai insektisida, dan harus segera dipakai apabila telah dicampur dengan insektisida alkalin. LD50 melalui
mulut tikus adalah 90-128 mg/kg, melalui kulit tikus adalah 800-1000 mg/kg, sangat toksik terhadap lebah (Baehaki, 1993).
Merupakan senyawa insektisida yang sangat efektif untuk membasmi lipas yang resisten terhadap senyawa-senyawa organoklorin dan organofosfat.
Propoxur banyak digunakan oleh perusahaan-perusahaan pembasmi serangga
di rumah-rumah dan perkantoran, juga restoran dan dapur-dapur umum. Di Indonesia, propoxur digunakan untuk mengendalikan hama serangga pada tanaman coklat, kelapa, dan padi (Sastroutomo, 1992).
e. Insektisida Botani Golongan Nikotinoid
Insektisida golongan nikotinoid merupakan insektisida yang relatif baru, digunakan selama 20 tahun terakhir untuk mengontrol berbaga jenis serangga. Nikotinoid merupakan pestisida sistematik. Tidak seperti kontak pestisida pada umumnya yang hanya tersisa pada permukaan daun, pada sistemik akan terbawa dan terangkut ke seluruh bagian jaringan (daun, bunga, akar, dan batang). Racun insektisida ini dapat aktif di tanaman selama berminggu-minggu. Di Amerika Serikat terdapat lima nikotinoid yang telah disahkan untuk digunakan pada pertanian adalah : acetamiprid, clothianidin, imidachlorpid, thiachlorpid, dan
thiamethoxam (Pesticide Action Network UK - Bees, 2014).
Nikotinoid, terutama imidachlorpid dan clothianidin menjadi perhatian utama
selama beberapa tahun terakhir bagi para peneliti dan para pemerhati lebah madu. Kedua senyawa nikotinoid ini dicurigai ada hubungannya dengan penurunan jumlah lebah madu. Perhatian ini menyebabkan larangan penggunaan beberapa senyawa nikotinoid di negara-negara Eropa pada umumnya, seperti Perancis, Jerman, Itali, dan Slovenia (Pesticide Action Network UK - Bees, 2014).
Senyawa Insektisida golongan nikotinoid yang digunakan dalam penelitian ini adalah :
Imidachlorpid
Imidachlorpid adalah insektisida nikotinoid dengan nama IUPAC 1-(6-chloro-3-pyridylmethyl)-N-nitroimidazolidin-2-ylideneamine. Struktur kimia dari
imidaklorpid sebagai berikut (National Pesticide Information Center, 2014) :
N N N Cl HN N+ O O
Imidachlorpid pertama kali diperkenalkan untuk dipergunakan pada tahun
1994 di Amerika Serikat. Imidachlorpid termasuk ke dalam golongan nikotinoid, senyawa kimia yang mirip dengan bahan kimia tembakau, nikotin. Senyawa ini bekerja dengan mengganggu transmisi rangsangan di sistem saraf serangga menyebabkan penyumbatan irreversible reseptor asetilkolin. Imidachloprid diklasifikasikan ke dalam pestisida kelas toksisitas II dan kelas III (dengan skala I sampai IV) oleh Environmental Protection Agency (EPA). Sehingga harus diberi
Warning Caution Beyond Pesticides, 2014).
Gejala akut setelah terpapar imidachlorpid akan sama dengan yang diberikan senyawa nikotin, yaitu diare, lesu, kejang, liur berlebih, keram, otot melemah termasuk otot di area pernafasan. Toksisitas jangka kronis atau panjang
imidachlorpid berkaitan dengan reproduksi dan efek mutagenik pada dosis yang
tinggi (Beyond Pesticides, 2014).
f. Insektisida Botani Golongan Pyrazole
Senyawa Insektisida golongan pyrazole yang digunakan dalam penelitian ini adalah :
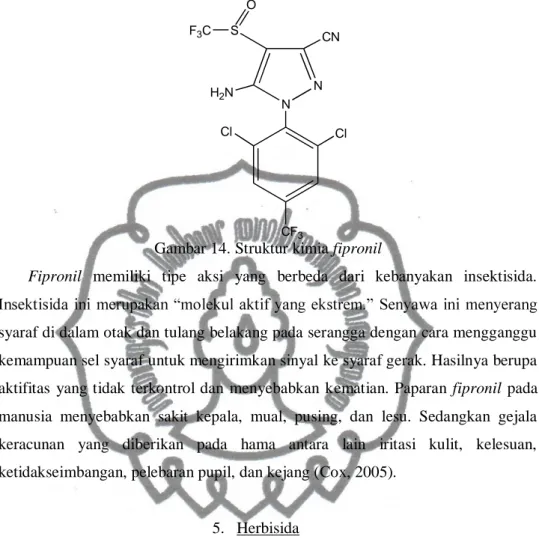
Fipronil
Fipronil pertama kali diperkenalkan di Amerika Serikat pada tahun 1996
untuk mengontrol rumput komersil dan hama dalam ruangan. Fipronil merupakan bagian dari insektisida generasi baru (Beyond Pesticide, 2014). Memiliki struktur kimia sebagai berikut (Cox, 2005) :
Cl Cl N CF3 N S CN F3C O H2N
Gambar 14. Struktur kimia fipronil
Fipronil memiliki tipe aksi yang berbeda dari kebanyakan insektisida.
syaraf di dalam otak dan tulang belakang pada serangga dengan cara mengganggu kemampuan sel syaraf untuk mengirimkan sinyal ke syaraf gerak. Hasilnya berupa aktifitas yang tidak terkontrol dan menyebabkan kematian. Paparan fipronil pada manusia menyebabkan sakit kepala, mual, pusing, dan lesu. Sedangkan gejala keracunan yang diberikan pada hama antara lain iritasi kulit, kelesuan, ketidakseimbangan, pelebaran pupil, dan kejang (Cox, 2005).
5. Herbisida
Herbisida berarti senyawa kimia yang digunakan untuk membunuh atau mengendalikan gulma. Herbisida merupakan bahan kimia dalam pengendalian gulma, serta memberikan keuntungan lebih dalam pemakaiannya. Adapun keuntungan yang diberikan oleh herbisida adalah dapat mengendalikan gulma sebelum mengganggu, dapat mencegah kerusakan perakaran tanaman, lebih efektif membunuh gulma tahunan, dalam dosis rendah dapat sebagai hormon tumbuh (Sukman et.al., 2002).
Penggunaan herbisida yang tidak terkontrol sering menimbulkan permasalahan atas bahaya residu yang ditinggalkan di lingkungan. Residu herbisida yang berada di dalam tanah akan berinteraksi dengan partikel tanah dan
akar tanaman. Herbisida yang jatuh sampai ke tanah, selain diabsorbsi oleh partikel tanah juga berada dalam larutan tanah dan bergerak ke segala arah termasuk diserap akar tanaman (Rukmana, 1997). Herbisida yang digunakan pada penelitian ini adalah :
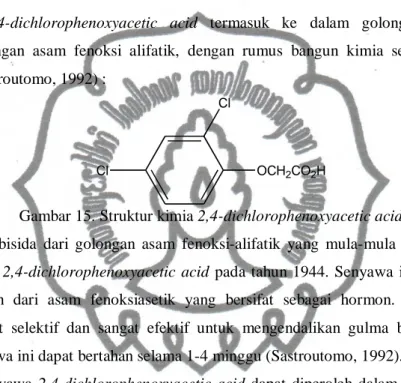
a. 2,4-D (2,4-dichlorophenoxyacetic acid)
2,4-dichlorophenoxyacetic acid termasuk ke dalam golongan herbisida
golongan asam fenoksi alifatik, dengan rumus bangun kimia sebagai berikut (Sastroutomo, 1992) :
Cl
Cl
OCH2CO2H
Gambar 15. Struktur kimia 2,4-dichlorophenoxyacetic acid
Herbisida dari golongan asam fenoksi-alifatik yang mula-mula diperkenalkan adalah 2,4-dichlorophenoxyacetic acid pada tahun 1944. Senyawa ini merupakan turunan dari asam fenoksiasetik yang bersifat sebagai hormon. Herbisida ini bersifat selektif dan sangat efektif untuk mengendalikan gulma berdaun lebar. Senyawa ini dapat bertahan selama 1-4 minggu (Sastroutomo, 1992).
Senyawa 2,4-dichlorophenoxyacetic acid dapat diperoleh dalam bentuk garam atau esternya. Mempunyai sifat sistemik dan digunakan secara luas untuk mengendalikan gulma berdaun lebar pada tanaman pangan dengan dosis 0,28-2,3 kg/ha. Akar gulma akan menyerap garam 2,4-dichlorophenoxyacetic acid sementara daun menyerap bentuk esternya. Daun yang terkena semprotan dapat menyerap 2,4-dichlorophenoxyacetic acid dalam waktu 4,6 jam sekiranya tidak ada hujan dalam waktu tersebut. Senyawa 2,4-dichlorophenoxyacetic acid dalam bentuk ester sukar dicuci dari permukaan daun karena senyawa ini akan diubah ke dalam bentuk asamnya oleh tumbuhan. Senyawa 2,4-dichlorophenoxyacetic acid yang diserap daun akan diangkat ke bagian tubuh yang lain melalui jaringan floem sementara yang diserap oleh akar akan diangkat melalui proses transpirasi.
Penimbunan dari senyawa ini akan berada di bagian meristem ujung dan akar. Senyawa ini juga menyebabkan pertumbuhan batang menjadi tidak normal, disamping mempengaruhi pernafasan, persediaan makanan, dan pembelahan sel (Sastroutomo, 1992).
b. Ametryn
Memiliki rumus bangun sebagai berikut (Sastroutomo, 1992) :
N N N S NH NH CH CH3 CH3 C2H3 H3C
Gambar 16. Struktur kimia ametryn
Ametryn termasuk ke dalam herbisida golongan triazin senyawa heterosiklik
nitrogen seperti juga piridazin dan piridin yang mengandung enam unsur dalam rantai cincinnya dengan tiga atom nitrogen. Triazin bersifat menghambat proses fotosintesa. Senyawa ini bersifat selektif karena tumbuhan yang toleran mempunyai kemampuan untuk menguraikan struktur triazin, sedangkan tumbuhan yang peka atau rentan tidak (Sastroutomo, 1992).
Amteryn pertama kali diperkenalkan pada tahun 1964 dan digunakan untuk
mengendalikan gulma pada peringkat pra dan pasca tumbuh. Ametryn mempunya sifat selektif dan boleh mengendalikan gulma berdaun lebar serta rerumputan. Dosis yang digunakan berbeda-beda tergantung tanaman budidayanya. Seperti pada acrazine, ametryn menghambat proses fotosintesa, ametryn dapat diserap akar dan daun. Penyerapan melalui daun cukup cepat dan tidak mudah dicuci oleh air hujan. Ametryn diangkut melalui xylem dan terkumpul di bagian meristem pucuk (Sastroutomo, 1992).
c. Diuron.
Diuron termasuk ke dalam herbisida golongan urea dengan rumus bangun sebagai
berikut (Sastroutomo, 1992) : Cl
Cl NHCN(CH3)2
O
Gambar 17. Struktur kimia diuron
Senyawa pengganti urea terbentuk sebagai akibat penggantian atom hidrogen oleh rantai karbon atau sulfur berbentuk cincin sehingga terbentuk senyawa yang bersifat sebagai herbisida. Kebanyakan herbisida golongan urea memiliki sifat yang tidak selektif dan sering digunakan melalui tanah. Senyawa golongan urea bersifat fitotoksik kepada tanaman dan akan menyebabkan khlorosis pada daun (Satroutomo, 1992).
Senyawa herbisida yang termasuk ke dalam golongan urea ini mempunyai daya larut yang rendah dalam air (42 mg/L). Diuron dengan dosis yang rendah dapat mengendalikan gulma berdaun lebar dan rumput, tetapi pada dosis yang tinggi dapat membunuh semua jenis tumbuhan. Dosis yang digunakan untuk mengendalikan gulma dalam tanaman adalah 0,7-7,2 kg/ha dan untuk mengendalikan gulma umum dosisnya ialah 4,5-18,0 kg/ha untuk gulma semusim dan 18-54 kg/ha untuk gulma menahun. Diuron mudah diserap melalui akar dan sedikit diserap melalui daun dan batang. Pengaruh dari senyawa ini ialah menghambat reaksi fotosintesa (Sastroutomo, 1992).
6. Fungisida
Fungisida adalah pestisida yang membunuh atau mencegah pertumbuhan jamur dan sporanya. Fungisida dapat digunakan untuk mengontrol jamur yang mengganggu tanaman, termasuk warna kecoklatan, lumut, dan penyakit yang menyebabkan tanaman membusuk. Fungisida bekerja dengan berbagai macam cara, tetapi kebanyakan dari fungisida menghancurkan sel membran jamur atau
mengganggu energi produksi dari dalam sel jamur (National Pesticide Information Centre, 2014).
Secara umum terdapat tiga alasan utama mengapa fungisida dipergunakan (McGrath, 2004) :
a. Mengontrol penyakit selama permulaan hingga perkembangan dari tanaman. b. Meningkatkan produktivitas tanaman dan untuk mengurangi kerusakan. Penyakit
pada tanaman untuk makanan sebagian kecil berada pada daun yang diperlukan untuk fotosintesis. Kerusakan dapat berpengaruh terhadap bagian tanaman yang akan dikonsumsi atau pada kasus tanaman yang digunakan sebagai hiasan dapat mempengaruhi keindahan tanaman, dimana kedua kasus tersebut dapat berakibat kepada nilai jual tanaman.
c. Meningkatkan lamanya masa simpan dan kualitas dari tanaman hasil panen. Beberapa penyakit terbesar merugikan terjadi setelah panen. Fungisida digunakan untuk mengurangi kontaminasi mikotoksin.
Fungisida yang digunakan pada penelitian ini adalah :
Propiconazol
Propiconazol merupakan fungisida dan antimikroba pertama kali didaftarkan
pada tahun 1981. Propiconazol berada pada fungisida golongan triazol. Propiconazol diperdagangkan dalam bentuk konsentrat emulsi, konsentrat cair, larutan siap pakai, konsentrat untuk dilarutkan, bubuk padat, dan halus. Memiliki struktur kimia sebagai berikut (Toxipedia, 2014) : Cl Cl O O N N N
Propiconazol ditujukan untuk mengendalikan jamur, bakteri, dan virus
pengganggu tanaman. Propiconazol secara umum memiliki toksisitas akut yang rendah, LD50 oral untuk tikus sebesar 1517 mg/kg. ketika terjadi paparan dengan
mata propiconazol menyebabkan kornea tidak dapat menangkap cahaya yang dapat terjadi selama 72 jam. Toksisitas kronis yang diujikan terhadap mencit dan tikus ditemukan sebagai tumor jinak, dan tumor hati yang ganas pada dosis dibawah 3,6 mg/kg perhari. Tes toksisitas terhadap reproduksi dengan dosis dibawah 30 mg menunjukkan hasil perubahan bentuk kerangka tulang pada anak anjing yang baru lahir (Toxipedia, 2014).
Propiconazol mengganggu pembentukan egosterol, organik molekul yang
diperlukan dalam pembentukan dinding sel jamur. Hal ini menyebabkan secara perlahan jamur berhenti tumbuh (Toxipedia, 2014).
7. Metode QuEChERS a. Sejarah QuEChERS
Metode QuEChERS dikembangkan oleh Anastassiades di tahun 2001 dan 2002 selama kunjungannya ke USDA/ARS-ERRC di Wynfmoor/Pennsylvania (AS) dalam kelompok penelitian Steven Lehotay. Awalnya metodologi ini dikembangkan untuk analisis obat hewan (anthelmintics dan thyreostats) dalam jaringan hewan, tetapi setelah menyadari potensi besar dalam ekstraksi senyawa polar dan senyawa dasar metode tersebut juga diuji pada analisis residu pestisida dalam bahan tanaman (CVUA Sttutgart, 2011).
Metode baru untuk analisis residu pestisida ini pertama kali diterbitkan pada tahun 2003. Laboratorium residu pestisida CVUA Stuttgart telah menggunakan QuEChERS (versi asli) untuk analis pestisida rutin buah dan sayuran sejak awal 2002 dan telah digunakan untuk pertama kalinya di Uni Eropa-PT 4 pada matriks jeruk dengan hasil yang sangat baik (CVUA Sttutgart, 2011). Kelompok penelitian banyak bekerja dengan menggunakan QuEChERS dan memperluas ruang lingkup penerapan analisis dan metode dalam tahun-tahun terakhir.
Misalnya untuk kontaminan alami, obat-obatan hewan, mikotoksin dan bidang lainnya (CVUA Sttutgart, 2011).
b. Pengertian QuEChERS
Metode QuEChERS merupakan singkatan dari metode yang Cepat (Quick), Mudah (Easy), Murah (Cheap), Efektif (Effective), Kokoh (Rugged), dan Aman (Safe). Merupakan pengembangan dari teknik ekstraksi mikro menggunakan asetonitril dan memurnikan ekstrak menggunakan dispersive solid-phase
extraction (d-SPE). Metode ini mengeluarkan biaya yang minim dibanding
metode konvensional dengan jumlah pelarut yang digunakan lebih sedikit dan juga aman bagi laboran, meski begitu nilai perolehan kembali (recovery) tetap besar (Anastassiades et. al., 2003).
Metode QuEChERS memiliki beberapa keuntungan dibanding metode analisis residu pestisida tradisional, diantaranya (Lehotay et. al., 2005) :
1) Menghasilkan recovery tinggi (>85) untuk banyak pestisida dengan polaritas dan volatilitas tertentu, termasuk analit yang sulit dianalisis,
2) Menghasilkan hasil yang sangat akurat karena menggunakan internal standar (ISTD) untuk membenarkan perbedaan komoditas-komoditas kandungan dan fluktuasi volume,
3) Memungkinkan pengukuran sampel banyak dalam waktu yang singkat, 4) Menggunakan pelarut dengan jumlah sedikit dan menghasilkan limbah yang
sedikit pula, serta tidak menggunakan pelarut berbahan chlor, 5) Bisa dikerjakan oleh satu orang tanpa banyak latihan dan teknik, 6) Sangat sedikit menggunakan peralatan laboratorium,
7) Metode ini cukup kokoh karena ekstrak dari pembersihan dapat menghilangkan asam-asam organik,
8) Memerlukan sangat sedikit ruang untuk melakukan metode ini,
9) Asetonitril ditambahkan ke dalam wadah yang tidak mudah rusak dan segera ditutup, sehingga dapat meminimalkan pencemaran pelarut pada laboran,
11) Membutuhkan alat yang sedikit untuk preparasi sampel.
Pengembangan metode baru memerlukan sejumlah masalah yang harus ditangani, misalnya pemilihan pelarut ekstraksi. Pelarut yang biasa digunakan untuk menentukan residu pestisida dalam matriks makanan adalah aseton, etil asetat, dan asetonitril, karena pelarut-pelarut tersebut dapat memberikan recovery analit yang besar. Meskipun aseton mudah larut dengan air tetapi pemisahan air dari pelarut ini tidak mungkin tanpa menggunakan pelarut non-polar. Sedangkan pada etil asetat hanya sebagian yang dapat larut dengan air, sehingga untuk memisahkannya dari air memerlukan penambahan pelarut non-polar yang berlebihan, selain itu menyebabkan pestisida yang sangat polar tidak terpisah di dalamnya. Asetonitril digunakan untuk ekstrak dari makanan (buah dan sayuran) mengandung zat pengganggu lebih sedikit dari etil asetat dan aseton, asetonitril dapat dipisahkan dengan mudah dari air (salting out), oleh karena itu asetonitril merupakan pelarut yang lebih disukai dalam metode QuEChERS (Wilkowska, 2011).
c. Perkembangan QuEChERS
Metode QuEChERS asli dalam proses ekstraksi menggunakan garam yang merupakan campuran dari MgSO4 dan NaCl. MgSO4 digunakan dalam proses
ekstraksi atau pemisahan dikarenakan kemampuannya yang dapat mengikat air dalam jumlah besar, sedangkan NaCl digunakan karena mampu memisahkan air dari sampel tanpa memerlukan pelarut nonpolar. Sedangkan proses d-SPE
clean-up menggunakan primary secondary amine (PSA) karena efektif menghilangkan
banyak senyawa matriks polar, seperti asam organik, kandungan polar pigmen, dan gula (Anastassiades et. al., 2003).
Metode QuEChERS semakin mengalami revolusi dan optimasi, buffer diikutsertakan selama ekstraksi sampel untuk meningkatkan kestabilan analit dan kualitas ekstrak. Saat ini secara garis besar terdapat dua jenis metode perkembangan QuEChERS yaitu AOAC Official Method 2007.01 dan Europan Comitte Standar Method EN 15662. Metode QuEChERS EN sering disebut juga
sebagai metode asli dari QuEChERS. Perbedaan keduanya terletak pada jenis
buffer yang digunakan. QuEChERS AOAC menggunakan buffer asam asetat
sedangkan metode QuEChERS EN menggunakan buffer sitrat. Metode modifikasi dengan menggunakan buffer ini diperuntukan untuk menguji ratusan pestisida dalam sampel sayur dan buah (Lehotay et. al., 2010).
Metode QuEChERS AOAC menggunakan buffer kuat asetat pada rentang pH 4-8, sedangkan QuEChERS EN 15662 menggunakan buffer lemah sitrat pada rentang pH 5-5,5. Metode original dengan kedua metode modifikasi ini telah dibandingkan untuk penentuan 32 jenis pestisida dalam sampel buah dan sayur (apel, blueberry, lemon, dan buncis) menggunakan instrumen GC-MS dan LC-MS/MS. Hasil penelitian tersebut menunjukkan ketiga metode QuEChERS menghasilkan recovery di atas 98%. Namun metode QuEChERS yang telah dimodifikasi dengan adanya penambahan buffer menghasilkan perolehan recovery yang lebih baik dibanding QuEChERS asli tanpa buffer (Lehotay et. al., 2010).
Pemilihan metode QuEChERS harus memperhatikan komoditi yang dianalisis. Adanya perbedaan buffer yang digunakan maka rentang pH pestisida yang dikendalikan dengan kedua metode ini berbeda. Metode EN dengan buffer sitratnya digunakan pada analisis pestisida yang lebih bersifat basa dengan pH 8, sedangkan metode AOAC dengan buffer asetatnya lebih efektif pada sampel hasil pertanian dengan pestisida yang lebih bersifat asam dengan pH 5 (Lehotay et. al., 2010).
Anastassiades et. al., (2007) memodifikasi metode QuEChERS yang selanjutnya disebut sebagai QuEChERS EN 15662. Modifikasi dilakukan dengan penambahan disodium hydrogen citrate sesquihydrate dan trisodium citrate
dehydrate sebagai buffer pada proses ekstrasi. Hal ini dilakukan dengan
memperhatikan pH degradasi pestisida yang signifikan, pestisida asam pada pH yang tinggi dan pestisida basa pada pH yang rendah. Namun pemilihan buffer juga harus memperhatikan pegaruhnya terhadap degradasi pestisida pada ekstrak
sorbent seperti PSA. Oleh karena itu buffer yang dipilih yang tidak mempunyai
pengaruh terhadap cleanup dari PSA yaitu pada area pH 5-5,5. Campuran dari
disodium dan trisodium citrate merupakan pilihan terbaik untuk menyesuaikan
pH pada area yang dimaksud tersebut (Anastassiades et. al., 2007).
8. Kromatografi Cair Sprektroskopi Massa/ Spektroskopi Massa (LC-MS/MS). Sejak tahun 1970-an, instrumen Gas Chromatography - Mass Spectrometry (GC-MS) telah populer dalam penelitian di bidang ilmu pengetahuan kimia dan bidang terkait lainnya. Namun, pengetahuan akan teknik ionisasi yang lebih spesifik seperti ionisasi tekanan atmosfer (atmospheric pressure ionization / API) dan metode analisis ion lainnya yang lebih unggul membuat sebagian besar ilmuan sepakat untuk menggunakan spektrofotometri massa yang lebih spesifik (Vogeser, 2008).
Liquid Chromatography Tandem Mass Spectrometry (LC-MS/MS)
merupakan teknik kromatografi cair dengan detektor spektrofotometer massa. Penggunaan LC/MS-MS untuk penelitian bio-analisis dimulai pada akhir 1980-an. Kelebihan dari teknologi LC/MS-MS meliputi (Vogeser, 2008) :
1) Spesifisitas, hasil analisis yang khas dan spesifik diperoleh dari penggunaan spektrofotometer massa sebagai detektor.
2) Aplikasi yang luas dengan sistem yang praktis. Berbeda dengan GC-MS sebagai penerapan LC-MS/MS tidak terbatas untuk molekul volatil (biasanya dengan berat dibawah 500 Da). LC-MS/MS mampu mengukur analit yang sangat polar, selain itu persiapan sampel cukup sederhana tanpa adanya teknik derivatisasi.
3) Fleksibilitas, pengujian yang berbeda dapat dikembangkan dengan tingkat fleksibilitas yang tinggi dan waktu yang singkat.
4) Kaya informasi, sejumlah data kuantitatif maupun kualitatif dapat diperoleh. Hal ini disebabkan seleksi ion yang sangat cepat dengan banyak parameter.
Spektrofotometer massa bekerja dengan molekul pengion yang kemudian akan memilah dan mengidentifikasi ion menurut massa, sesuai rasio fragmentasi
mereka (m/z). Dua komponen kunci dalam proses ini adalah sumber ion (ion source) yang akan menghasilkan ion, dan analisis massa (mass analyzer) yang mendeteksi ion. Sistem LC-MS/MS umumnya menggunakan beberapa jenis ion source dan mass
analyzer yang dapat disesuaikan dengan kepolaran senyawa yang akan dianalisis.
Masing-masing ion source dan mass analyzer memiliki kelebihan dan kekurangan sehingga harus disesuaikan dengan jenis informasi yang dibutuhkan (Agilent Technologies, 2001).
Liquid Chromatography Tandem Mass Spectrometry - Triple Quadrupole
(LC-MS/MS) merupakan teknik analisis kimia yang menggabungkan kemampuan pemisahan dari kromatografi cair dengan kemampuan analisis massa dari spektroskopi massa. Sistem triple quadrupole mengandung tiga quadrupole. Q1 dan Q3 berkerja sebagai filter massa sedangkan Q2 bertindak sebagai collision cell (Harmoko, 2012).
Analisis menggunakan Liquid Chromatography (LC) tandem Mass
Spectrometry (MS/MS) untuk pestisida di dalam ekstrak makanan bersifat sangat
selektif dan sensitif. Terdapat 2 mode yang dapat digunakan untuk mengionisasi analit (M) yaitu, mode electro spray ionization (ESI) dan mode atmospheric pressure
chemical ionization (APCI) tergantung polaritas yang dipilih dari ionisasi, protonasi,
atau deprotonasi ion molekul yang menghasilkan [M+H]+ atau [M-H]- (European
Comitte for Standardization, 2007).
Berikut penjelasan mengenai bagian dari LC-MS/MS : a. Sumber Ion (Ion Source)
Selama sepuluh tahun terakhir banyak kemajuan pada LC-MS/MS dalam pengembangan sumber ion dari teknik untuk mengionisasi dan memisahkan ion molekul analit dari fase geraknya. Sebelumnya LC-MS/MS menggunakan sistem antar muka yang kurang baik dalam memisahkan molekul fase gerak dari molekul analit. Molekul-molekul analit yang terionisasi dalam spektrofotemer massa berada pada kondisi vakum, peristiwa semacam ini sering terjadi pada ionisasi elektron tradisional. Teknik ini berhasil hanya untuk jumlah senyawa
Pengenalan teknik ionisasi tekanan atmosfer (atmospheric pressure
ionization / API) sangat memperluas jumlah senyawa yang dapat dianalisis
dengan LC-MS/MS. Teknik ionisasi tekanan atmosfer, molekul analit terionisasi terlebih dahulu pada tekanan atmosfer. Ion-ion analit tersebut kemudian secara mekanis dan elektrostatis terpisah dari inti molekul. Teknik ionisasi tekanan atmosfer umumnya adalah (Agilent Technologies, 2001) :
1) Ionisasi elektrospray (electrospray ionization / ESI),
2) Ionisasi kimia tekanan atmosfer (atmosphere pressure chemical ionization / APCI),
3) Foto-ionisasi tekanan atmosfer (atmosphere pressure photo-ionization / APPI),
Gambar 19. Aplikasi dari berbagai teknik ionisasi LC-MS/MS (Agilent Technologies, 2001)
Sifat analit dan kondisi pemisahan memiliki pengaruh kuat untuk memberikan hasil terbaik dalam setiap pengukuran menggunakan teknik ionisasi pada elektrospray, APCI maupun APPI. Teknik yang paling efektif tidak selalu mudah untuk diprediksi (Agilent Technologies, 2001).
b. Ionisasi Elektrospray (electrospray ionization / ESI)
Ionisasi elektrospray bergantung pada pelarut yang digunakan untuk memungkinkan analit mampu mengion dengan baik sebelum mencapai spektrofotometer massa. Eluen LC disemprotkan bersamaan dengan gas nebulizer ke dalam bagian elektrostatik pada tekanan atmosfer yang akan menyebabkan disosiasi lebih lanjut terhadap molekul analit (Agilent Technologies, 2001).
Gambar 20. Sumber ion electrospray (Agilent Technologies, 2001) Gas yang dipanaskan menyebabkan menguapnya pelarut sehingga tetesan analit menyusut, dan konsentrasi muatan dalam tetesan meningkat pada saat yang bersamaan. Keadaan ini akan memaksa ion untuk bermuatan melebihi kekuatan kohesif atau ion akan dikeluarkan ke dalam bentuk fasa gas. Kemudian ion-ion yang tertarik akan melewati pipa kapiler yang selanjutnya akan diteruskan ke dalam penganalisis massa (Agilent Technologies, 2001).
Elektrospray sangat berguna untuk menganalisis molekul besar seperti protein, peptida, dan oligonukleotida. Namun dapat juga menganalisis molekul kecil seperti benzodiazepin dan sulfat terkonjugasi (Agilent Technologies, 2001).
c. Analisis Massa (mass analyzers)
Meskipun dalam teori semua jenis analisis massa dapat digunakan untuk LC-MS/MS, namun pada kenyataannya ada empat jenis analisis massa yang paling sering digunakan, yaitu quadrupole, time-of-flight, perangkap ion, fourier
transform - ion cyclotron resonance (FT-ICR). Masing-masing memiliki
kelebihan dan kekurangan tergantung pada persyaratan dari analisis yang akan digunakan (Agilent Technologies, 2001).
1) Quadrupole
Sebuah analisis massa quadrupole terdiri dari empat batang paralel diatur dalam persegi. Ion analit diarahkan ke bagian tengah persegi. Tegangan yang dialirkan pada batang menghasilkan bidang elektromagnetik. Bidang ini menentukan rasio massa m/z yang dapat melewati filter pada waktu teretentu.
Quadrupole cenderung merupakan analisis massa yang paling sederhana dan
murah (Agilent Technologies, 2001).
Gambar 22. Analisis massa quadrupole (Agilent Technologies, 2001) Analisis massa quadrupole dapat beroperasi dengan dua mode, yaitu memindai (scan) dan pemantaun ion terpilih (selected ion monitoring / SIM) (Agilent Technologies, 2001).
Gambar 23. Modus scan dan SIM (Agilent Technologies, 2001)
Analisis massa memantau berbagai rasio m/z dalam metode scan. Sedangkan dalam modus SIM analisis massa hanya memantau beberapa rasio m/z. Modus SIM jauh lebih sensitif dibandingkan modus memindai tetapi memberikan informasi tentang fragmentasi ion yang lebih sedikit. Modus pindai biasanya digunakan untuk analisis kualitatif atau untuk kuantisasi ketika semua massa analit tidak diketahui sebelumnya. Modus SIM digunakan untuk kuantisasi dan pemantauan senyawa target (Agilent Technologies, 2001).
2) Penangkap ion
Analisis massa perangkap ion massa terdiri dari elektroda melingkar cincin dua penutup di kedua ujungnya yang bersama-sama membentuk sebuah ruang. Ion memasuki ruang tersebut dan terjebak oleh medan elektromagnetik. Bidang lain digunakan untuk mengeluarkan dengan selektif dari dalam perangkap. Perangkap ion memiliki kelebihan dapat melakukan beberapa tahapan pengukuran spektrofotometer massa tanpa analisis massa tambahan (Agilent Technologies, 2001).
Gambar 24. Analisis massa perangkap ion
d. Penggabungan Analisis Massa dengan Metode Liquid Chromatography
Teknik ionisasi tekanan atmosfir yang dibahas umumnya menghasilkan (Agilent Technologies, 2001) :
a. Molekul ion M+ atau M -b. Molekul terprotonasi [M+H]+ c. Ionisasi molekul sederhana [M+Na]+
d. Ion yang mewakili kehilangan molekul sederhana seperti hilangnya air [M+H-H2O]+.
Berat molekul yang dihasilkan memberikan informasi sangat berharga, tetapi pelengkap informasi struktural seringkali juga dibutuhkan. Untuk memperoleh informasi struktural, ion analit terfragmentasi karena molekul bertabrakan dengan netral yang dikenal sebagai disosiasi tabrakan induksi (collision induced
dissociaton / CID) atau disosiasi tabrakan diaktifkan (collisionally activated dissociation / CAD). Tegangan diberikan kepada ion-ion analit untuk menambah
energi agar mampu melakukan tabrakan sehingga menciptakan fragmentasi lagi (Agilent Technologies, 2001).
e. CID pada dua tahap MS
Beberapa tahap MS atau disebut juga tandem MS atau MS/MS adalah cara yang ampuh untuk mendapatkan informasi struktural. Triple quadrupole menggunakan quadrupole pertama untuk memilih ion prekusor. CID mengambil tempat di tahap kedua dimana terjadi proses tabrakan. Tahap ketiga akan menghasilkan spektrum produk ion, serta terjadi seleksi ion, dimana hanya ion produk yang memenuhi kuantitas dan kualitas senyawa target yang akan ditampilkan dalam spektrum (Agilent Technologies, 2001).
Gambar 25. MS/MS pada spektrofotometer massa quadrupole (Agilent Technologies, 2001)
Awal kemunculannya sistem LC-MS/MS banyak keterbatasan pada masalah dasar seperti jumlah eluen LC spektrofotometer massa yang dapat diterima. Perubahan yang signifikan terhadap metode LC diperlukan untuk dapat disesuaikan dengan detektor MS (Agilent Technologies, 2001).
Sistem modern LC-MS/MS lebih fleksibel. Spektrofotometer massa dapat menerima kecepatan alir eluen hingga 2 ml/menit. Sumber ion dengan ortogonal (off-acts) nebulizer lebih toleran terhadap non volatile buffer dan hanya memerlukan sedikit penyesuaian pada perbedaan komposisi pelarut dan kecepatan alir (Agilent Technologies, 2001).
Perubahan metode LC modern yang diperlukan untuk sistem LC-MS/MS umumnya berupa persiapan sampel dan pelarut kimia yang berguna untuk memastikan konsentrasi analit yang memadai, memaksimalkan proses ionisasi melalui pemilihan pelarut dan buffer, serta meminimalkan keberadaan senyawa yang mengganggu proses ionisasi (Agilent Technologies, 2001).
9. Validasi Metode
Validasi metode merupakan suatu proses penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi syarat untuk penggunaannya. Validasi metode diperlukan dalam suatu proses analisis untuk memastikan hasil analisis dapat dipertanggungjawabkan. Suatu metode analisis perlu divalidasi apabila metode tersebut baru dikembangkan untuk suatu permasalahan khusus. Validasi juga dilakukan jika ada revisi dari metode yang sudah ada untuk memecahkan suatu permasalahan analisis yang baru (Harmita, 2006).
Validasi metode analisis residu pestisida di dalam makanan menggunakan regulasi komisi Eropa SANCO sebagai acuan. Menurut dokumen SANCO/12495/2011, validasi dilakukan setelah pengembangan metode atau sebelum metode yang belum pernah digunakan sebelumnya akan diperkenalkan untuk analisis rutin. Validasi dibedakan antara validasi untuk metode analisis kuantitatif yang akan diterapkan di laboratorium untuk pertama kalinya dengan validasi untuk perluasan ruang lingkup metode pada analit dan matriks baru. Parameter-parameter validasi menurut dokumen SANCO ialah efek matriks, linearitas, presisi (RSDr), akurasi,
LOQ, dan spesifisitas (European Commission, 2011).
Penjelasan tentang parameter-parameter tersebut adalah sebagai berikut: a. Spesifisitas
Spesifisitas suatu metode adalah kemampuan metode tersebut untuk mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel. Spesifisitas seringkali dinyatakan sebagai derajat penyimpangan (degree of bias) metode yang dilakukan terhadap sampel yang mengandung bahan yang ditambahkan berupa cemaran, hasil urai, senyawa sejenis, senyawa asing lainnya, dan dibandingkan terhadap hasil analisis sampel yang tidak mengandung bahan lain yang ditambahkan (Harmita, 2006).
Dokumen ICH (International Conference on Harmanization) mendefinisikan spesifisitas sebagai kemampuan suatu metode untuk mengukur analit yang dituju secara tepat dan spesifik dengan adanya komponen-komponen matriks.
Spesifisitas metode ditentukan dengan membandingkan hasil analisis sampel yang mengandung cemaran, hasil urai, senyawa sejenis, senyawa asing, atau pembawa placebo dengan hasil analisis sampel tanpa penambahan bahan-bahan tersebut. Penyimpangan hasil jika ada selisih dari hasil uji keduanya (Validation of Compendial Methods, 2008).
Spesifisitas adalah kemampuan dari ekstraksi, clean-up, pemisahan dan khususnya kemampuan detektor untuk membedakan antara analit dengan senyawa lainnya. GC-ECD (Gas Chromatography - Electron Capture Detektor) merupakan sistem pemisahan yang selektif namun tidak memiliki sifat spesifisitas. Sedangkan spesifisitas adalah kemampuan detektor (mendukung selektifitas dari ekstraksi, clean-up, pemisahan) untuk menyediakan sinyal yang efektif mengindentifikasi analit. Detektor resolusi tinggi massa MS dan MS dapat juga gabungan keduanya memiliki spesifisitas yang tinggi. Kriteria spesifisitas yang ditetapkan di dokumen SANCO kurang atau sama dengan 30% dari Reporting Limit (RL). RL adalah level atau konsentrasi terendah residu yang dapat terukur, nilainya dapat lebih besar dari LOQ (European Commission, 2013).
b. Keseksamaan (Presisi)
Keseksamaan atau Presisi adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur ditetapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen. Presisi diukur sebagai simpangan baku atau simpangan baku relatif (koefisien variasi). Dokumen ICH merekomendasikan uji presisi dilakukan minimal 6 kali pengukuran pada konsentrasi uji 100% (Validation of Compendial Methods, 2008).
Keseksamaan dapat dinyatakan sebagai keterulangan (repeatability) atau ketertiruan (reproducibility) (Harmita, 2006). Presisi yang ditentukan pada peneltian ini adalah RSDr, ditentukan dari Repeatibility. Kriteria presisi yang
(Relative Standart Deviation) atau koefisien variasi (CV) (European Commission, 2011).
c. Akurasi
Akurasi adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Akurasi dinyatakan sebagai persen perolehan kembali analit yang ditambahkan (Validation of Compendial Methods, 2008).
Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Terdapat dua cara penentuan akurasi, yaitu metode simulasi (spiked-placebo recovery) dan metode penambahan (standar addition method). Metode simulasi dilakukan dengan menambahkan sejumlah analit senyawa murni ke dalam campuran bahan pembawa kemudian dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya). Metode penambahan baku diakukan dengan menganalisis sampel, lalu sejumlah tertentu analit yang diperiksa ditambahkan ke dalam sampel, untuk dicampur dan dianalisis kembali. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (Harmita, 2004). Penelitian ini menggunakan cara yang kedua, yaitu metode adisi, dengan kriteria recovery 70%-120% (European Commission, 2011).
d. Batas Kuantisasi
Batas kuantisasi adalah konsentrasi terendah analit dalam sampel yang masih dapat memenuhi kriteria akurasi dan presisi (Validation of Compendial Methods, 2008). Limit Of Quantitation (LOQ) konsentrasi atau massa terendah dari analit yang tervalidasi dengan nilai akurasi yang dapat diterima setelah menerapkan metode analitik dengan lengkap (European Commision, 2011).
LOQ ditentukan berdasarkan rasio signal per noise (S/N) dari instrument. Kriteria LOQ jika S/N sama dengan 10. Besar LOQ dihitung menggunakan persamaan, LOQ = 10 x RSD x Konsentrasi (S/N = 10) (Pizzutti, et. al., 2009).
e. Efek Matriks
Efek matriks adalah perubahan efisiensi ionisasi (respon spektroskopi massa dari analit) oleh adanya senyawa-senyawa co-elute. Perubahan efisiensi diasumsikan terjadi pada ion source. Proses ini terjadi sebelum ion-ion mencapai spektroskopi massa. Efek matriks menyebabkan signal enhancement atau
supression sehingga hasil analit dapat di atas atau di bawah estimasi nilai benar.
Mekanismenya dapat terjadi melalui penuruan efisiensi evaporasi karena tingginya konsentrasi senyawa-senyawa matriks yang menyebabkan analit tidak dapat mencapai fase gas. Sebagai konsekuensinya, efek matriks dapat mempengaruhi sensitivitas melalui penurunan intensitas signal, repeatibility intensitas signal, rasio ion, linearity, recovery, dan kuantifikasi (Harmoko, 2013). Efek matriks dikenal sebagai masalah dalam analisis residu pestisida menggunakan LC-MS/MS dan GC-MS. Ion Suppression dapat terjadi pada ion
source yang menyebabkan berkurangnya sinyal ketika matriks co-elute dengan
puncak dari analit. Selain itu, adanya kemungkinan kesalahan estimasi terhadap konsentrasi sampel menyebabkan pentingnya evaluasi terhadap efek matriks selama proses pengembangan metode atau validasi. Efek matriks dapat dievaluasi dengan membandingkan respon masing-masing pestisida yang diperoleh dari larutan standar yang dipreparasi dalam solvent dan dalam blangko sampel yang tidak mengandung residu pestisida. Efek matriks dapat dihitung menggunakan persamaan (de Sousa. et.al., 2012) :
Presentase antara -20% dan 20% dinyatakan sebagai tidak ada efek matriks, karena variasi ini dekat dengan nilai repeatibility. Efek matriks medium terjadi ketika nilainya berada diantara -50% dan -20% atau 20% dan 50%, dan efek matriks kuat apabila nilainya di bawah ataupun di atas 50% dan -50%.
f. Linearitas
Linearitas adalah kemampuan metode analisis memberikan respon secara langsung atau dengan bantuan transformasi matematik yang baik, proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat ditetapkan dengan kecermatan, keseksamaan, dan linearitas yang dapat diterima (Harmita, 2006).
Sebagai parameter adanya hubungan linear digunakan koefisien korelasi (r) pada analisis regresi linier y = a + bx. Hubungan linear yang ideal dicapai bila nilai b = 0 dan r = +1 atau -1 tergantung pada arah garis. Sedangkan nilai a menunjukkan kepekaan analisis terutama instrumen yang digunakan. Parameter lain yang harus dihitung yaitu simpangan baku residual (Sy), sehingga nantinya akan diperoleh standar deviasi fungsi regresi (Sxo) dan koefisien fungsi regresi
(Vxo) (Harmita, 2006).
Syarat-syarat dari kelinearan garis yaitu (Harmita, 2006) : 1) Koefisien korelasi (r)
2) Jumlah kuadrat sisa masing-masing titik temu (ri) mendekati nol (0), (ri)2 sekecil mungkin 0. ri diperoleh dari :
ri = yi (bxi + a) 3) Koefisien fungsi regresi (Vxo
untuk sediaan biologi. 4)
g. Manfaat Validasi Metode (Persulessy, 2005).
1) Memenuhi kebutuhan akan pengukuran analitik, jutaan pengukuran analitik dilakukan setiap hari dalam ribuan laboratorium diseluruh dunia. Terdapat banyak sekali alasan untuk melakukan pengukuran, diantaranya untuk mengevaluasi barang atau produk untuk kepentingan perdagangan,
mendukung perawatan kesehatan, menguji kualitas air minum. Analisis forensik cairan tubuh dalam investigasi kriminal. Analisis komposisi unsur suatu alloy untuk mengkonfirmasikan kecocokannya dalam konstruksi pesawat terbang.
2) Menentukan batasan suatu metode, misalnya akurasi, presisi, limit deteksi, dan lain-lain
3) Memberikan kepercayaan terhadap hasil, laboratorium mempunyai suatu tingkat keahlian yang tidak dimiliki pelanggan. Pelanggan diharapkan mampu mempercayai hasil yang dilaporkan oleh laboratorium dan apabila ada keraguan analisis maka laboratorium dan stafnya mempunyai tanggung jawab untuk memberi jawaban yang benar bahwa hasil analisis tersebut mempunyai kehandalan fitness for purpose
Suatu keputusan hendaknya didasarkan pada batas kepercayaan (confidence) yang ditetapkan agar suatu hasil analitik menjadi handal untuk tujuan yang diinginkan. Ketidakpastian pada hasil analisis hendaknya diestimasi pada suatu tingkat kepercayaan yang diberikan. Bagaimanapun baiknya suatu metode dan keterampilan seorang analis menggunakannya suatu masalah analitik belum tentu dapat dipecahkan jika sampel tersebut tidak sesuai dengan metode yang dipakai (Persulessy, 2005).
h. Penyebab Metode Perlu divalidasi
Suatu metode perlu divalidasi bila diperlukan untuk membuktikan ketepatan kinerja parameternya untuk digunakan dalam kasus analitik tertentu. Contohnya : 1) Pengembangan metode baru untuk kasus tertentu,
2) Memutakhirkan metode yang direvisi untuk penambahan perbaikan atau diperluas ke suatu problem atau kasus baru,
3) Bila kendali mutu mengindikasikan suatu metode yang mutakhir berubah bersama waktu,
4) Metode mutakhir digunakan pada laboratorium yang berbeda, atau analis yang berbeda atau pada instrument yang berbeda,
5) Memperlihatkan ekuivalensi diantara dua metode, misalnya metode baru dan metode standar.
Validasi metode memberikan jaminan kepercayaan selama penggunaan normal dan kadang-kadang dilukiskan sebagai proses yang memberikan bukti yang terdokumentasi bahwa metode benar-benar siap digunakan. Ada beberapa tahapan yang dilakukan dalam validasi metode dan beberapa tahapan utama yang harus dipenuhi dalam validasi adalah akurasi, presisi, LOD/LOQ, dan linearitas (Persulessy, 2005).
B. Kerangka Pikir
Metode QuEChERS (Quick, Easy, Cheap, Effective, Rugged, and Safe) merupakan metode analisis muti residu yang didesain untuk penentuan kadar residu pestisida pada buah dan sayuran (Anastassiades et. al., 2003). Metode original QuEChERS telah mengalami modifikasi dengan adanya penambahan buffer pada proses ekstraksinya. Metode QuEChERS dengan buffer sitrat pada rentang pH 5-5.5 dinamakan QuEChERS EN 15662. Penggunaan buffer campuran disodium citrate dan trisodium citrate meminimalisir adanya interaksi antara senyawa pestisida dengan PSA pada proses d-SPE cleanup. Proses ekstraksi pada metode ini dilakukan dengan menggunakan pelarut asetonitril serta penambahan garam NaCl, MgSO4, dan
campuran buffer sitrat. Sedangkan untuk proses cleanup disesuaikan dengan jenis matriks (Anastassiades et. al., 2007).
Metode analisis pestisida pada matriks berlemak dapat dilakukan menggunakan metode MSDP (Matrix Solid-Phase Dispersion) selain menggunakan metode QuEChERS (Lozowicka, et. al., 2011). Metode ini memiliki kelemahan bila dibandingkan dengan metode QuEChERS. Lehotay et. al., (2005) melakukan penelitian untuk mengevaluasi dua metode cepat dan mudah tersebut pada analisis pestisida dalam matriks berlemak. Dua metode tersebut dievaluasi dan dibandingkan terhadap 32 senyawa pestisida yang mewakili berbagai sifat fisikokimia. Ekstrak dari
kedua metode dianalisis menggunakan GC-MS (Gas Chromatography - Mass
Spectrometry) dan LC-MS (Liquid Chromatography - Mass Spectrometry). Hasil
validasi dari kedua metode ini menunjukkan metode QuEChERS memberikan
recovery yang lebih baik bila dibandingkan dengan MSDP. Metode QuEChERS
dengan fatty d-SPE clean-up merupakan metode yang dapat mengatasi matriks lemak namun tetap memperhatikan sifat pestisida yang dianalisis (Lehotay et. al., 2005).
Sampel kakao sendiri memiliki kandungan lemak rata-rata 10-12%. Menurut Wilkowska (2011) Makanan yang mengandung lemak 2% - 20% biasanya memiliki kandungan residu pestisida yang bersifat lipofilik dan hidrofilik. Metode QuEChERS merupakan metode yang mampu menganalisis sekaligus analit dengan jenis kepolaran bermacam-macam tersebut (Wilkowska et. al., 2011).
Proses preparasi sampel dengan matriks berlemak menggunakan metode QuEChERS EN, proses clean-up dilakukan dengan menggunakan campuran MgSO4/PSA/C18 (Anastassiades et. al., 2007). Matriks lemak saat melalui proses
ekstraksi dengan asetronitril akan sulit larut sehingga sejumlah lemak masih akan ditemukan pada hasil ekstraksi, oleh sebab itu pada langkah cleanup digunakan
Primary Secondary Amine (PSA) untuk menghilangkan asam lemak, dan C18 untuk
menghilangkan zat pengganggu polar seperti lipid sebelum dianalisis dengan LC-MS/MS (Wilkowska et. al., 2011).
Penelitian sebelumnya yang dilakukan oleh Rajski dan Na Li (2013) menunjukkan matriks lemak sebagian besar dapat diminimalisir dengan menggunakan metode QuEChERS, dengan parameter-parameter validasi menunjukkan hasil yang memenuhi syarat keberterimaan. Matriks lemak yang ada tidak sepenuhnya dapat di hapus dengan proses clean-up sehingga menimbulkan efek matriks yang dapat mengganggu hasil analisis. Cara terbaik sebagai kompensasi terhadap efek matriks adalah penggunaan isotop internal standard, namun pada banyak pestisida senyawa tersebut tidak tersedia sehingga pendekatan yang terbaik adalah dengan menggunakan matrix-matched calibration (Harmoko, 2013).
Penelitian ini dilakukan terhadap 18 senyawa pestisida yang merupakan jenis insektisida, herbisida, dan fungisida yang amenable untuk di deteksi menggunakan LC-MS/MS (Kmellar, 2008). Pengembangan metode QuEChERS yang dilakukan yaitu terhadap lamanya ekstraksi, banyaknya jumlah garam, jumlah adsorben dalam proses cleanup, serta jenis matriks yang dianalisis. Metode QuEChERS yang asli diperuntukan untuk menganalisis buah dan sayuran yang mempunyai perbedaan matriks dengan sampel kakao, maka perlu dilakukan validasi untuk perluasan ruang lingkup metode pada analit dan matriks baru. Penelitian ini bertujuan untuk memvalidasi metode QuEChERS EN 15662 pada analisis multi residu pestisida di sampel kakao dengan parameter validasinya ialah linearitas, presisi (RSDr), akurasi,
batas kuantisasi (LOQ), dan spesifisitas (European Commision, 2011).
C. Hipotesis
QuEChERS EN 15662:2008 yang telah dikembangkan dengan fatty d-SPE dapat mengatasi matriks lemak pada sampel kakao, selain itu efek matriks yang berasal dari sampel dapat dikompensasi dengan menggunakan matrix-matched
calibration. QuEChERS EN 15662:2008 yang telah dikembangkan merupakan
metode analisis multi residu yang dapat diterapkan untuk menganalisis pestisida pada sampel kakao hal ini dibuktikan dengan parameter validasi metode yang dapat memenuhi persyaratan dokumen SANCO 12495/2011.