PENGARUH WAKTU PENYADAPAN DAN PEMBERIAN ETEFON
TERHADAP EKSPRESI GEN HbACO3 PADA LATEKS DAN
KULIT BATANG Hevea brasiliensis
FAMI RIZALIA
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ABSTRAK
FAMI RIZALIA. Pengaruh Waktu Penyadapan dan Pemberian Etefon terhadap
Ekspresi Gen HbACO3 pada Lateks dan Kulit Batang Hevea brasiliensis. Dibimbing
oleh DJAROT SASONGKO HAMI SENO dan TETTY CHAIDAMSARI.
Lateks
dari
Hevea brasiliensis merupakan salah satu sumber devisa nonmigas
terbesar di Indonesia. Banyaknya lateks yang dihasilkan antara lain dipengaruhi oleh
keberadaan etilena baik etilena endogenous, maupun etilena eksogenous yang
ditambahkan sebagai stimulan untuk memperlama aliran lateks. Salah satu enzim yang
berperan dalam biosintesis etilena adalah ACC Oksidase yang mengkatalisis perubahan
ACC menjadi etilena, di dalam tanaman karet disandi oleh gen HbACO1,
HbACO2,
dan
HbACO3 yang ekspresinya dipengaruhi oleh keadaan lingkungan disekitarnya.
Penelitian ini bertujuan mempelajari pengaruh waktu penyadapan dan pemberian etefon
terhadap ekspresi gen HbACO3
pada lateks dan kulit batang tanaman karet melalui
deteksi ekspresi gen HbACO3 dengan cara RNA lateks dan kulit batang diisolasi
kemudian dikarakterisasi menggunakan spektrofotometer dan elektroforesis gel agarosa,
serta diamplifikasi mengunakan RT-PCR. Hasil penelitian menunjukkan gen HbACO3
berekspresi pada kulit batang tanaman karet namun tidak pada lateks. HbACO3
berekspresi maksimum pada hari ke-6 baik pada perlakuan pelukaan maupun pada
perlakuan pemberian etefon. Nilai ekspresi terbesar terjadi pada pemberian etefon 6 kali
dalam setahun namun secara keseluruhan ekspresi gen HbACO3 pada kulit batang
tanaman karet lebih diinduksi oleh penyadapan dibandingkan dengan pemberian etefon.
ABSTRACT
FAMI RIZALIA. The Effect of Tapping and Ethephon Stimulation to Expression
of
HbACO3 Gene from Latex and Bark of Hevea brasiliensis. Under the direction of
DJAROT SASONGKO HAMI SENO and TETTY CHAIDAMSARI.
Latex derived from Hevea brasiliensis is one of the important currencies for
Indonesia. The yield of latex is influenced by several things, such as the existence of
ethylene. Either endogenous ethylene or exogenous ethylene is a stimulant to enhance
latex flow. One of the enzyme that involve ethylene biosynthesis is ACC Oksidase
which catalyzed ACC to ethylene and in rubber tree encoded by HbACO1,
HbACO2,
and HbACO3 and their expression affected by environmental factors. This research aim
is to study the effect of tapping and ethylene stimulation to expression of HbACO3 gene
from latex and bark of Hevea brasiliensis. RNA was isolated from latex and bark,
characterized with spectrophotometer and agarose gel electrophoresis, and than
amplified using technique of RT-PCR. HbACO3 is expressed in bark, but not in latex.
Expression of HbACO3 was maximal 6 days after stimulation and the highest
expression was from six times a year stimulated ethephon sample. The expression of
HbACO3 is more inducted by tapping rather than the application of ethephon.
PENGARUH WKTU PENYADAPAN DAN PEMBERIAN ETEFON
TERHADAP EKSPRESI GEN HbACO3 PADA LATEKS DAN
KULIT BATANG Hevea brasiliensis
FAMI RIZALIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul
: Pengaruh Penyadapan dan Pemberian Etefon terhadap
Ekspresi Gen HbACO3 pada Lateks dan Kulit Batang
Hevea brasiliensis.
Nama
: Fami Rizalia
NIM :
G44104032
Disetujui
Komisi Pembimbing
Diketahui
Dr drh Hasim DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Tanggal lulus
Anggota
Dr Tetty Chaidamsari, MSi
Drs Djarot Sasongko Hami Seno, MS
PRAKATA
Alhamdulillah penulis panjatkan atas karunia yang diberikan oleh Allah
SWT sehingga penulis dapat menyelesaikan skripsi ini yang berjudul Pengaruh
Penyadapan dan Pemberian Etefon terhadap Ekspresi Gen HbACO3 pada Lateks
dan Kulit Batang Hevea brasiliensis. Penelitian dilaksanakan pada bulan Februari
2008 sampai Mei 2008 yang dilakukan di Laboratorium Biologi Molekuler dan
Rekayasa Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia, Jalan
Taman Kencana No. 1 Bogor.
Penulis mengucapkan terimakasih kepada Bapak Drs Djarot Sasongko Hami
Seno, MSc sebagai pembimbing utama, Dr Tetty Chaidamsari, MSi. selaku
pembimbing anggota, Bapak Dr Darmono Taniwiryono, MSc. sebagai Kepala
Balai Penelitian Bioteknologi Perkebunan Indonesia dan seluruh staf di
Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian
Bioteknologi Perkebunan Indonesia serta kepada Febrimarsa, Ssi atas
masukkannya.
Terima kasih penulis ucapkan kepada teman yang selalu bersama dalam
penelitian ini dan para sahabat Chairunisa, David T, dan Arlyny F, Resti A,
Agustine A, Alfinia A, Paramitha W, Wiena R terima kasih selalu memberi
dukungan, perhatian dan semangatnya selama ini. Terima kasih juga penulis
sampaikan kepada Laela A, Fitrianur, dan Miko A atas bantuannya dalam
menyelasaikan penelitian ini. Tak lupa penulis ucapkan terima kasih kepada kedua
orang tua serta kakak-kakak yang selau memberi perhatian, dukungan dan bantuan
baik secara moril maupun materil dan seluruh pihak yang tidak bisa penulis
sebutkan satu per satu. Penulis menyadari masih banyak kekurangan dalam usulan
penelitian ini, namun penulis berharap semoga skripsi ini dapat memberi manfaat
bagi yang membacanya.
Bogor, Agustus 2008
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, 17 Februari 1986 sebagai anak ketujuh dari
pasangan Fatekurrachman dan Iis Suminarsih. Tahun 2004 penulis lulus dari
SMUN 3 Bogor dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur
Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama menjadi mahasiswa aktif di IPB, penulis menjadi anggota Himpro
IMASIKA periode 2004-2005 sebagai staf PSDM, anggota PSDM CREBs
periode 2005-2006, dan anggota Infokomtari CREBs periode 2006-2007.
Bersama-sama tim basket FMIPA IPB menjadi juara kedua kompetisi bola basket
Olimpiade Mahasiswa IPB pada tahun 2006 dan 2007 serta menjadi juara ketiga
dalam kompetisi yang sama pada tahun 2008. Penulis berpartisipasi dalam
kejuaraan Liga Basket Mahasiswa tingkat Jawa Barat pada tahun 2008 juga
mengikuti perlombaan Program Kreatifitas Mahasiswa pada tahun yang sama.
Pengalaman lain yang pernah dialami oleh penulis selama menjalani
perkuliahan adalah menjadi asisten praktikum pada mata kuliah Kimia Umum
(2006), Biokimia Umum (2007) dan Biokimia untuk mahasiswa Akademi
Keperawatan serta Akademi Kebidanan (2008). Penulis melakukan praktik lapang
di PT Indolakto, Sukabumi pada divisi Quality Control bagian susu UHT.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR TABEL... ix
DAFTAR LAMPIRAN... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Hevea brasiliensis... 1
Lateks... 2
Etilena... 3
ACC Oksidase... 4
Etefon... 4
Reverse Transcriptase Polimerase Chain Reaction (RT-PCR) ... 4
BAHAN DAN METODE ... 4
Bahan dan Alat ... 4
Metode Percobaan ... 5
HASIL DAN PEMBAHASAN... 7
Analisis RNA hasil isolasi dengan Spektrofotometer... 7
Analisis RNA hasil isolasi dengan Elektroforesis ... 7
Ekspresi Gen HbACO3... 8
SIMPULAN DAN SARAN ... 10
Simpulan ...
10
Saran...
11
DAFTAR PUSTAKA ... 11
DAFTAR GAMBAR
Halaman
1 Struktur poliisoprena... 3
2 Pohon karet yang disadap ... 3
3 Biosintesis etilena pada tanaman... ... 3
4 Contoh hasil elektroforesis RNA kulit batang hasil isolasi dengan beragam
konsentrasi ... 8
5 Contoh hasil elektroforesis RNA lateks hasil isolasi dengan beragam
konsentrasi ... 8
6 Contoh hasil elektroforesis RNA kulit batang hasil isolasi dengan beragam
kemurnian... 8
7 Ekspresi gen HbACO3 pada beberapa sampel kulit batang dengan berbagai
stimulasi ... 8
8 Perbandingan ekspresi gen HbACO3 dengan waktu penyadapan pada waktu
tertentu ... 9
9 Perbandingan ekspresi gen HbACO3 dengan pemberian etefon pada waktu
tertentu ... 10
10 Hasil uji ekspresi gen HbACO3 dengan menggunakan aktin... 10
DAFTAR TABEL
Halaman
1 Contoh data konsentrasi RNA kulit batang dan lateks hasil isolasi dengan
menggunakan spektrofotometer... 7
2 Data konsentrasi secara semikuantitatif ekspresi gen HbACO3 kulit batang
pada berbagai perlakuan penyadapan... 9
3 Data konsentrasi secara semikuantitatif ekspresi gen HbACO3 kulit batang
DAFTAR LAMPIRAN
Halaman
1 Alur penelitian... 14
2 Pembuatan larutan sediaan... 14
3 Prosedur elektroforesis gel agarosa (Sambrook et al 1989)... 16
4 Analisis hasil isolasi RNA kulit batang dengan spektrofotometer... 17
5 Analisis hasil isolasi RNA lateks dengan spektrofotometer ... 19
6 Analisis hasil isolasi RNA kulit batang dan lateks dengan elektroforesis ... 21
7 Hasil uji ekspresi gen HbACO3 dalam kulit batang tanaman karet... 24
8 Hasil uji ekspresi gen HbACO3 dalam lateks tanaman karet ... 23
9 Data konsentrasi secara semikuantitatif ekspresi gen HbACO3 kulit batang
pada berbagai perlakuan pelukaan ... 24
10 Data konsentrasi secara semikuantitatif ekspresi gen HbACO3 kulit batang
pada berbagai stimulasi etefon... 25
PENDAHULUAN
Tanaman karet (Hevea brasiliensis)
merupakan sumber utama penghasil karet alam (lateks) dan penghasil devisa negara, baik dalam menambah pemasukan dan juga dalam penyerapan tenaga kerja. Indonesia negara ke 2 terbesar, penghasil lateks di dunia (Budiman 2005). Saat ini permintaan lateks terus meningkat, oleh karena itu diperlukan usaha untuk meningkatkan produksi karet alam. Usaha untuk meningkatkan produksi karet alam antara lain penggunaan klon-klon unggul baru yang berdaya hasil tinggi, pemilihan umur tanaman karet yang baik untuk disadap, dan pemberian stimulan dalam penyadapan tanaman karet.
Jenis stimulan yang sering digunakan adalah etefon (asam 2-kloro-etil-fosfat) yang merupakan salah satu kelompok penghasil etilena (Tim Penyusun Penebar Swadaya 1998). Etilena meningkatkan lama aliran lateks dan meningkatkan aktivitas regenerasi
lateks in situ pada tanaman karet (d’Audzac
1989). Hasil penelitian sebelumnya (Kuswanhadi 2006) menunjukkan bahwa etefon meningkatkan tekanan internal dalam pembuluh lateks dan meningkatkan kondisi fisiologis yang berkaitan dengan aliran lateks dan perubahan dalam pembuluh lateks yang menyebabkan lambatnya penyumbatan aliran lateks. Lama aliran lateks berbanding lurus dengan jumlah lateks yang dihasilkan. Etefon juga menginduksi biosintesis etilena endogenus.
Etilena endogenus merupakan salah satu komponen yang berperan dalam pembentukan lateks dan di dalam tanaman tingkat tinggi pembentukannya dikatalisis oleh 2 enzim penting, yaitu enzim aminosiklopropana-1-karboksilat (ACC) sintase (ACS) dan ACC oksidase (ACO). Enzim-enzim tersebut dikode oleh beberapa gen. Penelitian sebelumnya telah berhasil mengisolasi 1 gen
pengkode ACS, yaitu Hevea brasiliensis ACC
sintase 1 (HbACS1), dan 3 gen pengkode
ACO, yaitu Hevea brasiliensis ACCoksidase
1 (HbACO1), HbACO2, dan HbACO3.
Susunan basa secara lengkap dari gen-gen
tersebut telah diketahui. Walaupun HbACO1,
HbACO2, dan HbACO3 sama-sama
mengkode enzim ACO, struktur genom dan ekspresi ketiga gen tersebut berbeda-beda. Pada beberapa spesies, ekspresi gen-gen tersebut sangat dipengaruhi hal-hal yang berhubungan dengan perkembangan dan lingkungan luar seperti pemberian stimulan, pemberian senyawa-senyawa pertumbuhan, serangan penyakit dan pelukaan.
Penggunaan etefon sebagai stimulan yang berlebihan dapat menginduksi penyimpangan proses metabolisme, seperti penebalan kulit batang, nekrosis, terbentuknya retakan pada kulit, dan timbulnya bagian tidak produktif pada irisan sadap (Paranjothy et. al.
1979). Pemakaian etefon yang berlebihan juga mengakibatkan berhentinya aliran lateks yang disebabkan oleh koagulasi partikel karet yang dikenal dengan istilah kering alur sadap (KAS) (Tistama & Siregar, 2005). Pengaruh etefon terhadap biosintesis etilena, produksi dan degenerasi jaringan menunjukkan terlibatnya etilena endogenus tidak hanya dalam mekanisme molekuler dalam pembuluh lateks, tetapi juga dalam pembuluh kulit
(Siwei et. al. 1986) Untuk memahami
permasalahan tersebut, telah banyak diteliti tentang efek etilena yang berasal dari luar dan efek pelukaan terhadap biosintesis etilena endogenus, namun belum sampai pada pengaruh efek-efek tersebut terhadap ekspresi gen-gen pengkode ACO dan ACS sebagai enzim yang berperan dalam biosintesis etilena endogenus.
Penelitian yang dilakukan bertujuan mempelajari pengaruh penyadapan dan pemberian etefon terhadap ekspresi gen
HbACO3 pada lateks dan kulit batang Hevea Brasiliensis dan penelitian ini bermanfaat
mengetahui pola ekspresi gen HbACO3
sebagai salah satu gen pengkode enzim ACO sehingga dapat dibuat marka seleksi untuk
Hevea brasiliensis yang berkualitas tinggi.
Hipotesisnya adalah penyadapan dan pemberian etefon akan mempengaruhi
ekspresi gen HbACO3 dalam lateks dan kulit
batang Hevea brasiliensis klon PB260.
TINJAUAN PUSTAKA
Hevea brasiliensis
Hevea brasiliensis adalah tanaman karet
yang berasal dari negara brasil (Cornish et. al.
1993, Tim Penulis Penebar Swadaya 1998) dan merupakan sumber utama bahan karet
alam di dunia (Cornish et. al. 1993, Tim
Penulis Penebar Swadaya 1998, Dornelast & Rodriguez 2005). Tanaman dikotil ini merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Batang tanaman ini mengandung getah, yaitu lateks yang merupakan bahan dasar dari karet alam dan
menjadi alasan utama Hevea brasiliensis
dibudidayakan secara besar-besaran (Tim
Penulis Penebar Swadaya 1998). Hevea
2
dapat menghasilkan lateks yang paling baik dibandingkan dengan tanaman yang menghasilkan lateks lainnya. Hasil dari pengolahan lateks sangat beragam dan telah banyak dimanfaatkan dalam kehidupan sehari-hari khususnya untuk kendaraan bermotor, alas kaki, dan barang industri. Indonesia merupakan negara ke-2 terbesar penghasil
lateks yang berasal dari Hevea brasiliensis
(Budiman 2005).
Hevea brasiliensis merupakan tanaman
tahunan (perennial) dari famili Euphorbiaceae, pertumbuhannya cepat, batangnya lurus, sedikit bercabang, kulit batangnya biasanya berwarna kelabu dengan permukaan yang agak halus. Karet alam liar dapat tumbuh dengan tinggi mencapai 40 m dan hidup lebih dari 100 tahun. Namun untuk tanaman karet alam yang dibudidayakan biasanya hanya berukuran sekitar 25 m karena pertumbuhannya terhambat dengan adanya penyadapan. Selain itu umur karet alam budidaya relatif lebih singkat daripada yang liar, yaitu sekitar 25-35 tahun, karena pada usia tersebut karet alam tidak produktif lagi untuk menghasilkan lateks atau nilai ekonomisnya menurun, sehingga harus dilakukan penanaman kembali (Webster & Baukwil 1989 dalam Putri 2005). Pembudidayaan tanaman karet ini bertujuan menghasilkan lateks dengan mutu dan jumlah yang lebih baik. Tanaman karet budidaya hasil kultur jaringan sering disebut sebagai klon. Klon tanaman karet telah banyak ditemukan, klon yang digunakan dalam penelitian ini adalah klon PB 260 yang memiliki laju metabolisme lateks yang tinggi tetapi kurang responsif terhadap stimulan. Klon yang berasal dari Malaysia ini menurut
Lasminingsih et. al. (1994) merupakan klon
anjuran perkebunan skala kecil, yaitu klon-klon yang berpotensi untuk dipromosikan menjadi klon skala besar setelah diuji daya adaptasinya secara luas dan dapat ditanam secara terbatas sebesar 20-40% dari areal penanaman.
Lateks
Lateks merupakan getah yang larut dalam lemak, terdapat pada beberapa tanaman, umumnya lengket, dan berwarna putih seperti susu namun ada juga yang berwarna jingga dan kuning bahkan tidak berwarna, bergantung pada jenis tanaman yang memproduksinya. Lateks diproduksi melalui proses penyadapan atau pelukaan kulit batang sebuah tanaman yang menghasilkan zat tersebut. Lateks dapat diproduksi oleh
beberapa tanaman, seperti Castila elastica,
Partheium argentatum (Meksiko), Funtumina elastica (Afrika), Ficus elastica (India), Taraxacum kokbsaghyz (India), dan tanaman
karet Hevea brasiliensis (Brasil). Pada saat ini
lateks sebagian besar diperoleh dari Hevea
brasiliensis hingga mencapai 98% dari total
lateks yang diproduksi di seluruh dunia (Tim Penulis Penebar Swadaya 1998), oleh karena itu lateks dalam tulisan ini mengacu pada lateks yang berasal dari Hevea brasiliensis.
Lateks diproduksi di dalam pembuluh
laticifer,pembuluh tersebut terdapat di bawah
permukaan kulit batang di dalam jaringan
floem (Cornish et. al. 1993; Nicole et. al.
1986). Sintesis lateks berlangsung melalui siklus asam mevalonat dan merupakan suatu sistem yang sangat kompleks. Lateks terdiri hidrokarbon (poliisoprena), karbohidrat, protein, lipid, karotenoid, garam-garam mineral, enzim, dan berbagai bahan lainnya (De Boer 1950; Barney 1973 dalam Putri 2005).
Komponen-komponen dalam lateks dapat dipisahkan dengan cara sentrifugasi pada kecepatan 17.000 rpm selama 45 sampai 60 menit yang akan memisahkan lateks menjadi tiga bagian utama, yaitu fraksi karet, fraksi serum, dan fraksi dasar (Putri 2005). Fraksi karet merupakan lapisan yang paling atas. Fraksi ini berwarna putih susu dan mengandung sekitar 36% hidrokarbon berupa molekul cis-1,4-poliisoprena yang berbentuk bulat berukuran 5 nm - 3 µm (d’Auzac & Jacob 1989). Partikel karet tersebut dikelilingi oleh fosfolipoprotein membran yang bermuatan negatif dan berperan menjaga stabilitasnya. Fraksi ini juga mengandung bahan bukan karet seperti fosfolipida, lemak, lilin, protein, logam-logam (Ca, Mg, dan Cu), dan enzim rubber transferase yang berfungsi dalam pembentukkan partikel karet (poliisoprena). Struktur poliisoprena dapat dilihat pada Gambar 1. Fraksi tengah adalah fraksi serum C (serum sitosol) yang berupa cairan bening, kaya akan protein dan mudah teroksidasi sehingga warnanya dapat berubah menjadi coklat bila disimpan dalam wadah terbuka. Dalam fraksi dasar, terdapat partikel lutoid yang bersifat kental seperti gelatin dan diselubungi oleh membran semipermeabel yang berisi cairan serum B. Cairan B ini mengandung ion-ion kalsium dan magnesium yang bermuatan positif. (d’Auzac & Jacob 1989 dalam Putri 2005)
Lateks didapat dengan cara menyadap atau melukai kulit batang tanaman karet hingga pembuluh latificer terbuka dan lateks dapat mengalir ke tempat penampungan
3
seperti yang terlihat pada Gambar 2. Jumlah lateks yang keluar dipengaruhi oleh beberapa faktor, salah satunya adalah etilena endogenus dan gen-gen penyusunnya. Etilena ini mempengaruhi lama aliran lateks. Etilena yang berasal dari luar pun sering ditambahkan karena etilena yang berasal dari luar pun dapat memperlama aliran lateks, namun pemakaian etilena dari luar dapat berdampak buruk bagi produksi lateks, dan dapat mempengaruhi ekspresi dari gen-gen penyusun etilena baik yang berada pada lateks maupun yang berada
pada kulit batang karet. (Sumarmadji et. al.
2004)
ETILENA
ACC Oksidase
fosfatase
Gambar 1 Struktur poliisoprena (Wang et al
2002).
Gambar 2 Pohon karet yang disadap (www.flikr.com).
Etilena
Senyawa ini merupakan modulator yang potensial bagi pertumbuhan dan
perkembangan sebuah tanaman. Etilena akan dikeluarkan apabila terdapat cekaman dari luar tumbuhan. Etilena juga mempengaruhi berbagai siklus kehidupan suatu tanaman termasuk perkecambahan, pembentukan akar,
root nodulation, pemekaran bunga, abscission, dan pematangan buah (Wang et. al. 2002, Michelle et. al. 1999, Salisbury &
Ross 1995; Jones et al 1999; Bleecker et al
2000).Etilena juga mempengaruhi lama aliran
lateks pada tanaman karet (Li N et. al. 1996).
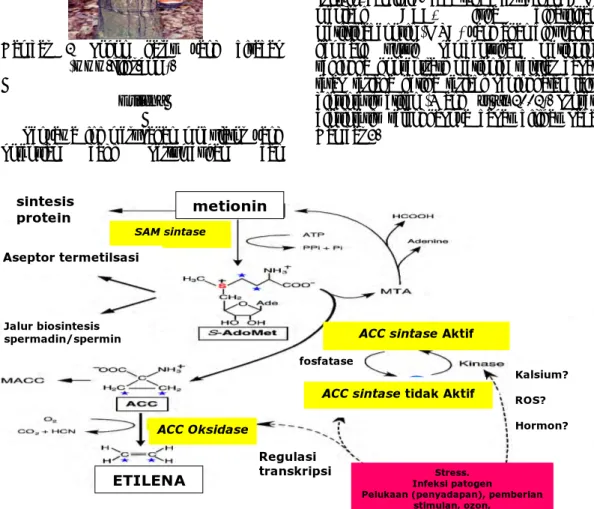
Biosintesis etilena pada tanaman umumnya melalui tiga tahap utama, yaitu perubahan metionin menjadi S-adenosil metionin (SAM) yang dikatalisis oleh SAM sintetase (EC 2.5.1.6), tahap ini membutuhkan 1 molekul ATP. Tahap selanjutnya adalah perubahan SAM menjadi ACC yang dikatalisis oleh ACC sintase (EC 4.4.1.14). Tahap terakhir adalah oksidasi ACC menjadi etilena yang dipercepat oleh enzim ACC
oksidase (Moeder W 2002; Wang et. al.
2002). SAM merupakan prekursor dalam lintasan biosintesis poliamin (spermidin atau spermin) dan juga donor bagi molekul-molekul selular contohnya asam nukleat, protein, dan lipid. Pada tahap perubahan SAM menjadi ACC, juga dihasilkan metiltioadenosin (MTA) yang akan digunakan kembali untuk pembentukan metionin, sehingga konsentrasi metionin selular dapat tetap terjaga ketika terjadi peningkatan laju
biosintesis etilen (Wang et al 2002). Proses
biosintesis selengkapnya dapat dilihat pada Gambar 3. sintesis protein metionin SAM sintase Aseptor termetilsasi Jalur biosintesis
spermadin/spermin ACC sintase Aktif
Kalsium? ACC sintase tidak Aktif ROS?
Hormon?
Regulasi
transkripsi Stress.
Infeksi patogen
Pelukaan (penyadapan), pemberian stimulan, ozon,
UV-B, dll
ACC Oksidase
Enzim ACO merupakan enzim yang mengkatalisis oksidasi ACC menjadi etilena, oleh karena itu enzim ini disebut juga ethylene forming enzyme (EFE). Selain menghasilkan
etilena, ACO juga memproduksi sianida, sianida yang terbentuk didetoksifikasi dengan
mengubahnya menjadi asam β-sianoalanin
yang dapat berubah menjadi asparagin
(Moeder W 2002; Wang et. al. 2002).
Enzim ACO dikode oleh beberapa gen. Telah banyak penelitian yang dilakukan untuk mengetahui gen-gen penyusun ACO pada berbagai tanaman, salah satunya pada
tanaman karet Hevea brasiliensis. Penelitian
sebelumnya yang dilakukan oleh Kuswanhadi
et. al. (2006) telah berhasil mengisolasi 3 gen
pengkode ACO yang berasal dari Hevea
brasiliensis, yaitu HbACO1, HbACO2, dan HbACO3. Susunan basa secara lengkap dari
gen-gen tersebut adalah 1115 bp untuk
HbACO1, 1183 bp untuk HbACO2 dan 1348
bp untuk HbACO3, dengan open reading
frames (ORF) yang mengkode polipeptida
dengan jumlah asam amino 312 untuk
HbACO1, 318 untuk HbACO2 dan 318 untuk HbACO3. Walaupun HbACO1, HbACO2, dan HbACO3 sama-sama mengkode enzim ACO,
struktur genom dan ekspresi ketiga gen tersebut berbeda-beda. Pada beberapa spesies, ekspresi gen-gen tersebut sangat dipengaruhi hal-hal yang berhubungan dengan perkembangan dan lingkungan luar seperti pemberian stimulan, pemberian senyawa-senyawa pertumbuhan, serangan penyakit dan
pelukaan (Wang et. al . 2002). Ekspresi ACO
ini dapat diamati dengan dengan
menggunakan teknik Reverse Transcriptase
Polimerase Chain Reaction (RT-PCR).
Etefon
Salah satu stimulan yang digunakan pada penyadapan lateks dari tanaman karet adalah etefon (asam 2-kloroetilfosfat, CEFA)
(Sumarmadji et. al. 2004, Li N 1996).
Penggunaan etefon sebagai stimulan yang berlebihan dapat menginduksi penyimpangan proses metabolisme, seperti penebalan kulit batang, nekrosis, terbentuknya retakan pada kulit, dan timbulnya bagian tidak produktif
pada irisan sadap (Paranjothy et. al. 1979).
Pemakaian etefon yang berlebihan juga mengakibatkan berhentinya aliran lateks yang disebabkan oleh koagulasi partikel karet yang dikenal dengan istilah kering alur sadap (KAS) (Tistama R & Siregar, 2005). Pengaruh etefon terhadap biosintesis etilena, produksi
dan degenerasi jaringan menunjukkan terlibatnya etilena endogenus tidak hanya dalam mekanisme molekuler dalam pembuluh lateks, tetapi juga dalam pembuluh kulit (Siwei W et. al. 1986).
Reverse Transcriptase Polimerase Chain Reaction (RT-PCR)
Teknik RT PCR merupakan suatu pengembangan dari teknik PCR untuk melakukan analisis terhadap RNA hasil transkripsi yang hanya terdapat dalam jumlah yang sedikit di dalam sel. Teknik RT PCR yang dikembangkan sangat spesifik, sehingga dapat digunakan walaupun jumlah RNA yang akan dianalisis sedikit (O’Connell 2002). Teknik PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan, oleh karena itu pada RT PCR terlebih dahulu
dilakukan transkripsi balik (reverse
transcription) terhadap molekul RNA
sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA
tersebut selanjutnya digunakan sebagai cetakan untuk proses PCR selanjutnya
(Sambrook et al 1989). Kegunaan teknik RT
PCR antara lain untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan cloning dan analisis, diagnosis agensia infektif maupun penyakit genetik (Yowono T 2006 dalam Farieh 2007).
Teknik RT PCR memerlukan enzim transkriptase balik. Enzim transkriptase balik adalah enzim yang digunakan untuk mensintesis cDNA dengan menggunakan RNA sebagai cetakan. cDNA yang disintesis akan bersifat komplementer dengan RNA cetakan. Beberapa enzim transkriptase balik
yang sering digunakan antara lain mesophilic
viral reverse transcriptase (RTase) yang
dikode oleh avian myoblastosis virus (AMV)
dan oleh moloney murine leukemia virus
(M-MuL V), dan Tth DNA polymerase
(Sambrook et al 1989).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang akan digunakan untuk isolasi RNA adalah sampel lateks dan kulit
batang tanaman karet klon PB260, N2 cair,
polifinilpirolidon (PVP), buffer ekstrak,
ddH2O.DEPC, β-Merkaptoetanol, fenol, LiCl,
Na-asetat, etanol absolut, kloroform :
isoamilalkohol (CH:IAA) (24:1), fenol :
kloroform : isoamilalkohol (PH:CH:IAA)
5
Bahan-bahan yang digunakan untuk elektroforesis gel agarosa adalah bubuk
agarosa, TBE 0.5x, loading buffer, dan EtBr.
Sedangkan bahan bahan yang digunakan
untuk RT-PCR adalah marker SL 1000kb air
khusus untuk penelitian biologi molekuler (molecular waterTM), kit RT-PCR (
Roche)
yang terdiri atas buffer RT-PCR, inhibitor RNAse, dNTP, enzim transkriptase balik dan
MgCl2. Kit PCR (Roche) yang terdiri atas
complete bufferTM, dNTP, dan enzim Taq polimerase dan grade waterTM.
Peralatan yang digunakan untuk isolasi RNA adalah tabung sentrifus, pipet Mohr, mikropipet, tabung mikro, penangas air,
sentrifus Eppendorf 5417R, sentrifus
Beckmann Allegra 64R, pipet Eppendorf,
freezer Sansio -20°C, freezers Decby -40°C,
dan spektrofotometer UV-VIS Beckmann
Coulter-DU 530.
Peralatan yang digunakan untuk elektroforesis adalah piranti elektroforesis gel agarosa, adaptor 100 volt, autoklaf,
microwave, dan Erlenmeyer. Sedangkan
peralatan untuk RT-PCR adalah tabung mikro, pipetmikro, penangas es, dan mesin PCR GeneAmp PCR sistem 2400 serta
seperangkat alat GeldocCanon.
Metode Percobaan
Pemilihan Sampel Kulit Batang Tanaman Karet (Hevea brasiliensis)
Sampel dipilih berdasarkan metode yang dilakukan oleh Balai Penelitian Perkebunan Sembawa (1982) yang telah dimodifikasi. Sampel lateks dan kulit batang tanaman karet yang digunakan berasal dari
tanaman karet (Hevea brasiliensis) klon
PB260 yang diberi 6 perlakuan yang berbeda berdasarkan atas waktu penyadapan dan pemberian stimulan etefon dengan konsentrasi 2.5%. Lebar pelukaan batang pada setiap penyadapan adalah setengah lingkaran batang pohon karet tersebut (s2).
Perlakuan pertama, Hevea brasiliensis
tidak diberi etefon dan disadap 2 hari sekali
(s2/d2). Dalam perlakuan kedua, Hevea
brasiliensis tidak diberi etefon dan disadap 4
hari sekali (s2/d4). Dalam perlakuan ketiga,
Hevea brasiliensis tidak diberi etefon dan
disadap 6 hari sekali dengan (s2/d6).
Perlakuan keempat dilakukan dengan pemberian etefon 3 kali dalam setahun dan disadap 4 hari sekali (s/2 E3/d4). Perlakuan kelima dilakukan dengan pemberian etefon 12 kali dalam setahun dan disadap 4 hari sekali
(s/2 E12/d4). Perlakuan terakhir dilakukan dengan pemberian etefon 6 kali dalam setahun dan disadap 4 hari sekali (s2 E6/d4).
Isolasi RNA Kulit Batang Tanaman Karet (Hevea brasiliensis)
RNA kulit batang tanaman karet diisolasi
dengan metode Chaidamsari et al (2005). 1,5
gram sampel digerus sampai halus dengan
mortar yang ditambah N2 cair serta PVP 1,5 %
kemudian dimasukkan ke dalam tabung sentrifus yang berisi 15 mL buffer ekstrak
bersuhu 65°C yang telah ditambah 150 µl β
-merkaptoetanol lalu dikocok dengan kuat. Suspensi tersebut diinkubasi selama 1 jam pada suhu 65°C dan setiap 15 menit dikocok kuat. Setelah itu didiamkan hingga mencapai
suhu ruang, lalu diekstrak dengan CH:IAA
sebanyak 15 mL kocok perlahan sampai terbentuk emulsi selanjutnya. Campuran itu kemudian disentrifugasi dengan kecepatan 19621 g selama 15 menit pada suhu 25°C, supernatan dipindahkan ke dalam tabung sentrifus baru kemudian diekstrak kembali
berturut-turut dengan PH:CH:IAA, CH:IAA
dan CH:IAA dengan kecepatan yang sama dan
perbandingan volume PH:CH:IAA atau
CH:IAA dengan supernatan adalah 1:1.
Supernatan yang dihasilkan diambil lalu ditambah LiCl 10 M sampai konsentrasi 2 M dan disimpan dalam suhu 4°C selama satu malam.
Sampel selanjutnya disentrifugasi dengan kecepatan 15300 g, 4°C, selama 30 menit. Pelet kemudian dilarutkan dalam
ddH2O.DEPC sebanyak 750 µl kemudian
diekstrak dengan fenol, PH:CH:IAA, CH:IAA,
dengan perbandingan volume 1:1, disentrifugasi dengan kecepatan 15300 g, 15 menit, dan suhu 4°C. Supernatan lalu ditempatkan dalam tabung mikro dan ditambahkan 0,1 volume Na-asetat 3 M, pH 5,8 dan 3 volum etanol absolut dan disimpan pada suhu -40°C selama 3 jam. Selanjutnya supernatan tersebut disentrifugasi kembali dengan kecepatan 15300 g, 4°C, selama 30 menit. Pelet yang dihasilkan kemudian dicuci dengan etanol 70% dan disentrifus kembali 15300 g, 4°C, selama 5 menit, etanol dibuang lalu disentrifugasi kembali 15300 g selama 2 menit kemudian dikeringanginkan. RNA yang
didapat ditambah 30µl ddH2O.DEPC. RNA
yang dihasilkan dianalisis kemurnian dan konsentrasinya.
Isolasi RNA Lateks Tanaman Karet (Hevea brasiliensis)
RNA lateks diisolasi dengan metode
6
6 ml lateks yang telah disuspensikan dengan 6 mL buffer ekstrak dipanaskan selama 1 jam pada suhu 50°C, setelah itu disentrifugasi dengan kecepatan 19621 g selama 30 menit pada suhu 20°C. Supernatan dari hasil sentrifugasi tersebut kemudian diekstrak
dengan PH:CH:IAA sebanyak 1 volume,
kemudian disentrifugasi kembali dengan kecepatan 15300 g selama 10 menit pada suhu 4°C, kemudian lapisan atas hasil sentrifugasi
diekstrak dengan CH:IAA dan disentrifugasi
kembali dengan kecepatan 19621 g selama 10 menit pada suhu 4°C. Supernatan dari sentrifugasi yang ke tiga kemudian ditambahkan LiCl 8M hingga LiCl tersebut memiliki konsentrasi 2M. Kemudian disimpan dalam suhu 4°C selama satu malam.
Sampel selanjutnya disentrifugasi dengan kecepatan 15300 g selama 30 menit pada suhu 4°C. Pelet yang dihasilkan disuspensikan
kembali dengan 750 µl ddH2O.DEPC dan
diekstrak berturut-turut dengan PH:CH:IAA
dan CH:IAA, setiap pengekstrakan dilakukan
sentrifugasi dengan kecepatan 15300 g selama 10 menit pada suhu 4°C. Supernatan yang dihasilkan ditambah dengan natrium asetat sebanyak 1/10 volume supernatan yang dihasilkan dan etanol absolut sebanyak 3 volume yang dihasilkan kemudian didiamkan selama 3 jam pada suhu -40°C. Setelah didiamkan, campuran itu disentrifugasi dengan kecepatan 15300 g selama 30 menit pada suhu 4°C. RNA lateks yang terdapat dalam pelet kemudian dicuci dengan etanol 70% dengan cara disentrifugasi selama 5 menit dengan kecepatan dan suhu yang sama seperti di atas. RNA kemudian dikeringanginkan dan disuspensikan dengan
30µl ddH2O.DEPC. RNA yang dihasilkan
dianalisis kemurnian dan konsentrasinya.
Penentuan Konsentrasi dan Kemurnian RNA hasil Isolasi
Konsentrasi RNA baik RNA lateks maupun RNA kulit batang hasil isolasi ditentukan dengan cara mengukur absorbansinya dengan menggunakan spektrofotometer UV pada panjang gelombang 260 nm sesuai dengan yang
disampaikan oleh Sambrook et al (1989).
Konsentrasi RNA dihitung dengan perbandingan nilai 1 serapan pada panjang gelombang 260 nm sama dengan konsentrasi RNA 40 µg/mL. Konsentrasi RNA dapat juga ditentukan secara kualitatif dengan cara RNA dielektroforesis dalam gel agarosa 1% pada tegangan listrik 25 volt selama 2 jam dan
intensitas ketebalan pita yang dihasilkan diamati.
Kemurnian RNA hasil isolasi ditentukan dengan dua cara. Cara pertama adalah membandingkan absorbansi RNA sampel tersebut pada panjang gelombang 260 nm dengan 280 nm dan juga dengan panjang gelombang 230 nm. Kemurnian RNA dilihat dari perbandingan A260/280 dan A260/230
yang berkisar 1,8-2,0 ( Sambrook et al 1989).
Cara kedua adalah dengan dielektroforesis dalam gel agarosa 1% pada tegangan listrik 25 volt selama 2 jam dan diamati jumlah pita yang terbentuk. Bila dari pengamatan dengan elektroforesis gel agarosa 1% masih terdapat DNA, maka DNA yang ada tersebut dihilangkan dengan cara menambahkan enzim DNAse ke dalam sampel RNA yang telah diisolasi dan diinkubasi pada suhu dan waktu optimum untuk enzim DNAse.
Sintesis Utas Pertama cDNA
Sintesis utas pertama cDNA dilakukan
sesuai dengan metode yang tercantum pada kit Roche yang digunakan pada penelitian ini.
RNA hasil isolasi digunakan sebagai cetakan
dengan konsentrasi 2 µg/mL, kemudian ditambah 1 µl oligo dT sebagai primer dan
grade waterTM hingga volume campuran sebanyak 13 µl. Campuran tersebut dipanaskan 65°C selama 10 menit pada mesin PCR dan segera dimasukkan ke dalam es lalu
ditambah campuran yang berisi complete
bufferTM 4 µl, 2 µl dNTPs sebagai substrat, 1 µl inhibitor RNAse, dan ditambahkan 1 µl
enzim transkriptase baliklaludiinkubasi pada
suhu 55°C selama 30 menit yang dilanjutkan dengan inkubasi pada suhu 85°C untuk inaktivasi enzim dan mendenaturasi RNA selama 5 menit.
Uji Ekspresi gen HBACO3 dengan RT-PCR
Uji ekspresi gen menggunakan teknik PCR
dengan gen HbACO O48 sebagai primer
dengan metode PCR kit Roche. Sebanyak 1 µl cDNA sampel yang telah dihasilkan ditambah dengan 2,5 µl complete bufferTM, 1 µl dNTPs, 1 µl primer S, 1 µl primer R, 1 µl enzim Taq
polimerase dan 17,5 µl molecular waterTM.
Campuran kemudian dimasukkan ke dalam mesin PCR dengan pengaturan suhu 94°C selama 30 detik untuk denaturasi, 55°C selama 1 menit untuk annealing, 72°C selama 1 menit untuk mengaktifkan enzim Taq polimerase dan 7 menit untuk proses polimerasi. Proses tersebut diulang sebanyak 35 siklus, setelah itu disimpan pada suhu 10°C.
7
Hasil PCR kemudian dielektroforesis menggunakan elektroforesis gel agarosa 1%
(Sambrook et. al. 1989) dengan tegangan
listrik 100 volt selama 1-1,5 jam. Pita yang dihasilkan diamati dan dibandingkan dengan marker yang telah dielektroforesis bersama-sama dengan sampel dengan menggunakan
Geldoc. Konsentrasi gen yang terekspresi
diukur secara semi kuantitatif menggunakan
program UN-SCAN-IT gel 6.1.
HASIL DAN PEMBAHASAN
Analisis RNA Hasil Isolasi dengan Spektrofotometer
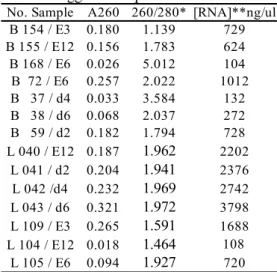
Tabel 1 menunjukkan bahwa konsentrasi RNA kulit batang sangat bervariasi antara 104
hingga 1028 ng/μl. Perbedaan rendemen
RNA kulit batang yang dihasilkan antara lain disebabkan oleh perbedaan kehalusan bubuk kulit batang yang dibuat. Semakin halus bubuk kulit batang, maka semakin besar luas permukaannya sehingga semakin mudah untuk mengekstrak RNA dari batang tersebut. Konsentrasi RNA yang rendah dapat juga disebabkan oleh tidak maksimalnya proses ekstraksi seperti proses pengocokkan yang kurang kuat pada saat ekstraksi dengan buffer ekstrak sehingga tidak seluruh isi sel dapat dikeluarkan kerena sel tidak lisis dengan sempurna.
Rendemen RNA lateks lebih baik bila dibandingkan dengan RNA yang diisolasi dari kulit batang walaupun konsentrasi hasil pengukuran dengan spektrofotometer bervariasi juga, yaitu antara 108 sampai 3798
ng/μl yang dapat dilihat juga pada Tabel 1.
Kemudahan mendapatkan RNA dari lateks dapat disebabkan oleh bentuk lateks yang cair sehingga mudah untuk dilisis oleh buffer ekstrak. Nilai konsentrasi yang kecil dari RNA lateks dikarenakan sampel tersebut lebih cair dibandingkan dengan sampel yang lain.
Perbandingan absorban yang terukur pada panjang gelombang 260 nm dan 280 nm digunakan untuk menunjukkan kemurnian RNA terhadap protein. RNA dikatakan cukup murni dan hanya sedikit mengandung kontaminan protein apabila nilai perbandingannya antara 1.80 sampai 2.00. Bila perbandingannya kurang dari 1.8, maka dikatakan bahwa terdapat kontaminan protein pada ekstrak RNA yang telah diisolasi (Boyer 1986). Bila perbandingannya lebih dari 2.00, maka dapat diperkirakan bahwa larutan hasil isolasi tersebut masih terkontaminasi oleh DNA (Holme & Peck 1993). Ekstrak RNA
yang didapat dari sampel kulit batang maupun lateks memiliki perbandingan absorban antara 1.100 sampai 5.012. Hal tersebut menunjukkan bahwa beberapa ekstrak RNA yang diisolasi dari sampel masih memiliki kemurnian yang kurang baik. Kemurnian yang kurang baik tersebut dapat disebabkan oleh terbawanya fase fenolik pada proses pengekstrakkan yang berarti terbawanya kontaminasi-kontaminasi yang tidak diinginkan. Secara umum kualitas RNA lateks terhadap kontaminan protein lebih baik dibandingkan dengan RNA kulit batang apabila dilihat dari hasil perbandingan antara absorban pada 260 nm dan 280 nm karena rata-rata nilai perbandingannya lebih besar dari 1.50 dan tidak lebh dari 2.
Tabel 1 Contoh data konsentrasi RNA kulit batang dan lateks hasil isolasi dengan menggunakan spektrofotometer No. Sample A260 260/280* [RNA]**ng/ul
B 154 / E3 0.180 1.139 729 B 155 / E12 0.156 1.783 624 B 168 / E6 0.026 5.012 104 B 72 / E6 0.257 2.022 1012 B 37 / d4 0.033 3.584 132 B 38 / d6 0.068 2.037 272 B 59 / d2 0.182 1.794 728 L 040 / E12 0.187 1.962 2202 L 041 / d2 0.204 1.941 2376 L 042 /d4 0.232 1.969 2742 L 043 / d6 0.321 1.972 3798 L 109 / E3 0.265 1.591 1688 L 104 / E12 0.018 1.464 108 L 105 / E6 0.094 1.927 720
B: kulit batang; L: lateks; A260: panjang
gelombang untuk konsentrasi RNA; E3, E6,
E12: disadap 3, 6, 12 kali dalam setahun; d2,d4,d6: disadap 2, 4, 6, hari sekali; *Kemurnian RNA dari kontaminan protein; **Konsentrasi RNA hasil perhitungan; Data lengkap pada lampiran 4 dan 5.
Analisis RNA Hasil Isolasi dengan Elektroforesis
Konsentrasi yang dihasilkan juga dapat diperkirakan dengan menggunakan elektroforesis gel agarosa dengan cara membandingkan intensitas cahaya yang dihasilkan dari interaksi antara pewarna EtBr dengan sinar UV. Konsentrasi larutan RNA yang digunakan pada proses elektroforesis ini dibuat sama, yaitu sebesar 250 ng/mL. Dengan konsentrasi yang dibuat sama, diharapkan agar intensitas cahaya yang dihasilkan dari seluruh sampel sama. Hasil
8
Ekspresi Gen HbACO3
elektroforesis menunjukkan bahwa isolasi RNA yang dilakukan berhasil karena terdapat 2 pita yang menunjukkan RNA pada ukuran 28 S dan 18 S, namun hasil elektroforesis yang dapat dilihat pada Gambar 4 dan Gambar 5 menunjukkan intensitas yang berbeda-beda, seperti pada sampel nomor 154, intensitas sampel tersebut lebih rendah dibandingkan dengan intensitas cahaya yang dihasilkan oleh sampel lainnya. Hal ini dapat diartikan bahwa konsentrasi RNA sebenarnya dari sampel nomor 154 tersebut lebih kecil dari konsentrasi yang terukur oleh spektrofotometer. Perbedaan konsentrasi terukur yang dihasilkan oleh metode spektrofotometri dan metode elektroforesis dapat disebabkan oleh spektrofotometer pada panjang gelombang 260 nm tidak hanya mengukur RNA, tapi juga mengukur DNA sehingga hasil pengukuran dengan spektrofotometer dapat lebih besar daripada konsentrasi yang dapat diamati dari hasil elektroforesis gel agarosa.
Ekspresi Gen HbACO3 pada Kulit Batang Tanaman Karet
Hasil penelitian Kuswanhadi (2006)
menunjukkan bahwa gen HbACO3 hanya
berekspresi pada kulit batang dan lateks tanaman karet untuk sementara waktu saja, yaitu pada 2, 8, dan 24 jam setelah pemberian stimulan etefon dan tidak terekspresi kembali setelah penyadapan apapun jenis stimulasinya.
Namun gen HbACO3 pada penelitian ini
terekspresi pada kulit batang tanaman karet.
Gen HbACO3 masih terekspresi setelah lebih
dari 48 jam pemberian stimulan walaupun hasil uji ekspresi dengan RT-PCR masih menunjukkan adanya kontaminan karena pita yang terekspresi tidak hanya berada pada 524 kb saja, tetapi juga pada berat yang lebih besar (Gambar 6). Perbedaan hasil antara penelitian ini dengan penelitian yang dilakukan oleh Kuswanhadi (2006) dapat disebabkan oleh adanya kontaminasi DNA atau perbedaan jumlah siklus yang digunakan pada saat RT-PCR. Pada penelitian ini digunakan 35 siklus sedangkan dalam penelitian Kuswanhadi (2006) silkus yang digunakan sebanyak 30
siklus sehingga ekspresi gen HbACO3 belum
teramati. Banyaknya pita yang dihasilkan dapat disebabkan oleh kontaminasi DNA atau primer yang digunakan kurang spesifik, oleh karena itu perlu diuji kembali cara isolasi dan spesifikasi primer yang digunakan.
28 S RNA
Hasil elektroforesis juga menunjukkan bahwa RNA yang bershasil diisolasi tidak terdegradasi, namun masih terdapat kontaminan DNA (Gambar 6). Sampel RNA yang masih mengandung DNA dibersihkan dengan menambahkan DNAse agar tidak mengganggu proses PCR. 28 S RNA 18 S RNA 18 S RNA 28 S RNA 18 S RNA
Gambar 4 Contoh hasil elektroforesis RNA kulit batang hasil isolasi dengan beragam konsentrasi.
154 155 156 166 167 168 72 152 (No Sampel)
Gambar 5 Contoh hasil elektroforesis RNA
lateks hasil isolasi dengan beragam konsentrasi.
40 41 42 43 102 109 104 105 (No Sampel)
524kb
Gambar 7 Ekspresi gen HbACO3 pada
beberapa sampel kulit batang dengan berbagai stimulasi.
Gambar 6 Contoh hasil elektroforesis RNA
kulit batang hasil isolasi dengan beragam kemurnian.
Pengaruh Penyadapan terhadap Ekspresi gen HbACO3 dalam Kulit Batang
DNA
Gen HbACO3 yang terekspresi
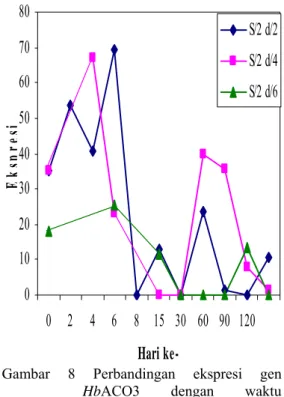
dihitung konsentrasinya secara semikuantitatif. Hasil perhitungan gen yang terekspresi pada berbagai perlakuan penyadapan dapat dilihat pada Tabel 2, dan divisualisasikan pada Gambar 8. Pola ekspresi
gen HbACO3 kulit batang hampir sama antara
9
ketiga variasi penyadapan. Persamaannya
adalah gen HbACO3 dalam kulit batang
berekspresi setelah dilakukan penyadapan yang pertama (hari ke-0) dan cenderung meningkat setelah dilakukan penyadapan yang kedua kalinya (Gambar 8). Ekspresi tertinggi tercapai pada hari keenam dengan metode penyadapan 2 hari sekali (d/2) dengan konsentrasi 69.4564 ng/ul yang diikuti oleh hari keempat pada penyadapan 4 hari sekali (d/4) (Tabel 2). Setelah hari keenam, gen
HbACO3 hanya sedikit berekspresi dengan
pola yang tidak beraturan diseluruh variasi
penyadapan (Gambar 8). Gen HbACO3 pada
perlakuan penyadapan 2 hari sekali dan 4 hari sekali kembali berekspresi cukup tinggi pada hari ke-60 penyadapan dan kembali sedikit berekspresi hingga hari ke-150 sedangkan
pada penyadapan 6 hari sekali gen HbACO3
tiak berekspresi setelah hari ke-15 penyadapan dan hanya sedikit berekspresi pada hari ke-120 serta kembali tidak berekspresi pada hari ke-150. Data ini menunjukkan bahwa ekspresi
gen HbACO3 cenderung lebih tinggi bila
sampel disadap 2 hari sekali atau 4 hari sekali.
Gen HbACO3 terekspresi lebih rendah bila
sampel disadap 6 hari sekali. Hal tersebut sesuai dengan hipotesis bahwa semakin sering
pohon karet disadap, maka gen HbACO3
cenderung berekspresi lebih tinggi karena cekaman dari luar yang lebih sering akan meningkatkan produksi etilena endogenous dan salah satu gen yang berperan dalam memproduksi etilena tersebut adalah gen
HbACO3
0
10
20
30
40
50
60
70
80
0 2 4 6 8 15 30 60 90 120
Hari
ke-E
k
sp
r
e
si
S/2 d/2
S/2 d/4
S/2 d/6
Gambar 8 Perbandingan ekspresi gen
HbACO3 dengan waktu
penyadapan pada waktu tertentu.
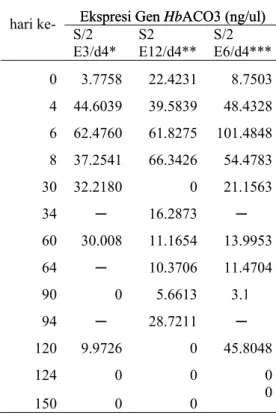
Pengaruh Pemberian Etefon terhadap Ekspresi gen HbACO3 dalam Kulit Batang
Sampel pertama kali diberi etefon pada 2 hari setelah penyadapan pertama, kemudian sampel diambil 48 jam setelah pemberian etilena tersebut (hari ke-4 pada Tabel 3 dan Gambar 9). Pohon yang diberi perlakuan etefon disadap 4 hari sekali karena metode penyadapan ini yan paling umum digunakan pada perkebunan karet di Indonesia. Hasil uji yang dapat diamati pada Tabel 3 dan Gambar
8 menunjukkan bahwa ekspresi gen HbACO3
meningkat pada 48 jam setelah pemberian etefon, walaupun ekspresinya masih dibawah ekspresi ketika sampel hanya disadap 4 hari sekali tanpa diberi etefon. Ekpresi gen
HbACO3 kembali meningkat pada hari ke-6
pengambilan sampel atau 72 jam setelah pemberian etefon yang pertama dan ekspresi tertinggi dicapai pada sampel yang diberi etefon 6 kali dalam setahun dengan konsentrasi ekspresi mencapai 101.4848 ng/ul.
Tabel 2 Data konsentrasi secara
semikuantitatif ekspresi gen HbACO3
kulit batang pada berbagai perlakuan penyadapan
Ekspresi Gen HbACO3 (ng/ul)
hari ke- S2 d/2 S2 d/4 S2 d/6 0 35.3009 35.3009 18.0275 2 53.8344 ─ ─ 4 40.4680 67.0795 ─ 6 69.4564 22.9141 25.5179
Setelah hari ke-6 gen ini tidak lagi berekspresi dengan konsentrasi yang tinggi pada ketiga perlakuan etefon walaupun telah diberi etefon untuk kedua dan ketiga kalinya. Hal ini dapat disebabkan oleh pohon yang diberi etefon untuk kedua dan ketiga kalinya tidak terlalu merespon stimulasi etefon tersebut sebagai suatu kecaman sehingga gen
HbACO3 sebagai penyandi etilena tidak
berekspresi dengan tinggi lagi. Ekspresi gen
HbACO3 pada ketiga stimulasi etefon tidak
8 0 ─ ─ 15 12.9095 0 11.5795 30 0 0 0 60 23.6584 39.7507 0 90 1.3431 35.6106 0 120 0 7.7543 13.5734 150 10.7310 1.3021 0
S2 d/2: disadap 2 hari sekali; S2 d/4: disadap 4 hari sekali; S2 d/6 disadap 6 hari sekali.
10
Ekspresi Gen HbACO3 pada Lateks Tanaman Karet
berbeda jauh kontrol yang hanya disadap 4 hari sekali, bahkan ekspresi gen pada sampel yang diberi stimulasi etefon cenderung lebih rendah setelah hari ke-30 dibandingkan dengan kontrol (Gambar 9). Hal tersebut menunjukkan bahwa pada hasil penelitian ini
ekspresi gen HbACO3 lebih dipengaruhi oleh
penyadapan dibandingkan dengan pemberian stimulasi etefon.
berbeda jauh kontrol yang hanya disadap 4 hari sekali, bahkan ekspresi gen pada sampel yang diberi stimulasi etefon cenderung lebih rendah setelah hari ke-30 dibandingkan dengan kontrol (Gambar 9). Hal tersebut menunjukkan bahwa pada hasil penelitian ini
ekspresi gen HbACO3 lebih dipengaruhi oleh
penyadapan dibandingkan dengan pemberian stimulasi etefon.
Gen HbACO3 pada penelitian ini tidak
berekspresi pada lateks baik diberi perlakuan penyadapan maupun diberi etefon. Untuk memastikan bahwa tidak terlihatnya ekspresi
gen HbACO3 pada RT-PCR bukan
disebabkan oleh sampel RNA yang digunakan tidak ada, proses RT-PCR diulangi dengan menambahkan primer aktin. Hasil RT-PCR yang telah divisualisasi menggunakan elektroforesis agarosa menunjukkan pita pada 200kb, yaitu ukuran aktin yang telah berikatan dengan RNA yang ada dan RNA pada setiap sampel konsentrasinya sama karena intensitas warna yang dihasilkan sama. Hal tersebut menunjukkan bahwa tidak adanya ekspresi
gen HbACO3 bukan disebabkan oleh tidak
adanya RNA sampel. Diduga tidak
terekspresinya gen HbACO3 dalam lateks
disebabkan oleh gen HbACO3 dalam lateks
merupakan gen transient seperti yang telah dilaporkan oleh Kuswanhadi (2007). Hasil uji
ekspresi gen HbACO3 dengan menggunakan
aktin dapat dilihat pada Gambar 10.
30 26 27 28 29 40 41 42 43 44 M
*diberi etefon 3 kali dalam setahun; **diberi etefon 12 kali dalam setahun; ***diberi etefon 6 kali dalam setahun.
on 3 kali dalam setahun; **diberi etefon 12 kali dalam setahun; ***diberi etefon 6 kali dalam setahun.
Gambar 9 Perbandingan ekspresi gen
HbACO3 dengan pemberian
etefon pada waktu tertentu.
Gambar 9 Perbandingan ekspresi gen
HbACO3 dengan pemberian
etefon pada waktu tertentu.
Tabel 3 Data konsentrasi secara
semikuantitatif ekspresi gen HbACO3
kulit batang pada berbagai stimulasi etefon
Tabel 3 Data konsentrasi secara
semikuantitatif ekspresi gen HbACO3
kulit batang pada berbagai stimulasi etefon
Ekspresi Gen HbACO3 (ng/ul)
Ekspresi Gen HbACO3 (ng/ul)
0 20 40 60 80 100 120 0 4 6 8 30 34 60 64 90 94 120 124 150 Hari ke-e S/2 E3/d4 S2 E12/d4 S/2 E6/d4 i re s S/2 d/4 ps k hari ke- S/2
E3/d4* S2 E12/d4** S/2 E6/d4*** 0 3.7758 22.4231 8.7503
Nomor: nomor sampel; M: marker. 4 44.6039 39.5839 48.4328
Gambar 10 Hasil uji ekspresi gen HbACO3
dengan menggunakan aktin. 6 62.4760 61.8275 101.4848
8 37.2541 66.3426 54.4783
30 32.2180 0 21.1563
SIMPULAN DAN SARAN
34 ─ 16.2873 ─ 60 30.008 11.1654 13.9953 Simpulan 64 ─ 10.3706 11.4704 90 0 5.6613 3.1606 94 ─ 28.7211 ─ 120 9.9726 0 45.8048 124 0 0 0
Gen HbACO3 berekspresi pada kulit
batang tanaman karet namun tidak pada
lateks. HbACO3 berekspresi maksimum pada
hari ke-6 baik pada perlakuan pelukaan maupun pada perlakuan pemberian etefon dan terbesar pada pemberian etefon 6 kali dalam
setahun. Ekspresi gen HbACO3 pada kulit
batang tanaman karet lebih diinduksi oleh penyadapan dibandingkan dengan pemberian etefon.
0 150 0 0
11
Lasminingsih et al. 1994. Deskripsi Klon
Karet Anjuran pada Tanaman Muda.
Palembang: Balai Penelitian Sembawa.
Saran
Perlu diteliti lebih lanjut pengaruh penyadapan dan pemberian etefon pada kulit batang dan lateks dengan waktu pengambilan sampel kurang dari 48 jam setelah perlakuan untuk menetahui kemungkinan gen transient
dari gen HbACO3.
Li N et al. 1996. A Novel bifunctional fusion
enzyme catalyzing ethylen synthesis via
1-aminocyclopropane- 1-carboxylic acid. J
Biol and Chem 271(42): 25738–25741.
Mesquita AC, Oliveira LEM de, Mazzafera P, Del, Delú-Filho N. 2006. Anatomical characteristic and enzymes of the sucrose metabolism and their relationship with
latex yield in the rubber tree (Hevea
brasiliensis Muell. Arg.). Braz J Plant Physiol 18(2): 263-268.
DAFTAR PUSTAKA
Bleecker AB, Kende H. 2000. Ethylene: a gaseous signal molecule in plants
[abstrak]. Di dalam: Annual Review Cell
Division Biology; Wisconsin. Hlm 16.
abstr no PMID: 11031228.
Michelle L, Jones R, William R, Woodson.
1999. Budiman AFS. 2005. Perkembangan global
karet alam dan tantangan bagi Indonesia.
Wrt Perkrt 24 (2): 1-7.
Differential expression of three members of the 1-aminocyclopropane-1-carboxylate synthase gene family in carnation. J Plant Physiol 119: 755-764.
Chaidamsari T. 2005. Biotechnology for
Cacao Pod Borer Resistance in Cacao. Plant Research International. The
Netherlands: Wagenigen University.
Moeder W et al. 2002. Ethylene synthesis
regulated by biphasic induction of 1-aminocyclopropane-1-carboxylic acid synthase and 1-aminocyclopropane-1-carboxylic acid oxidase genes is required for hydrogen peroxide accumulation and
cell death in ozone-exposed tomato. Plant
Physiol December 2002, 130:1918–1926.
.
Cornish K, Pan Z, Backhaus RA. 1993.
Engineering New Domestic Sources of Natural Rubber. New york: Willey.
Dornelast MC, Rodriguez APM. 2005. The
rubber tree (Hevea brasiliensis Muell.
Arg.) homologue of the leafy/floricaula gene is preferentially expressed in both
male and female floral meristems. J of
Experimental Botany 56(417):1965-1974.
Nicole M, Geiger JP, Nandris D. 1986. Ultrastructure of laticifers modifications in
Hevea brasiliensis infected with root rot
fungi. J Phytopathol 116: 259-268
.
O’Connell J. 2002. Method in Molecular
Biologi: RT-PCR Protocols. Totowa:
Humana Pr. Jones ML, Woodson WR. 1999. Differential
expression of three members of the 1-aminocyclopropane-1-carboxylate
synthase gene family in carnation. Plant
Physiol 199:755-764. Putri FDRS. 2005. Optimasi penetapan kadar protein antigen lateks karet alam (Hevea brasiliensis) dan produk jadinya [Skripsi].
Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kuswanhadi et al. 2005. Isolation and
Characterization of Three Members of the Multigenic Family Encoding ACC Oxidase from H brasilensis During Plant
Development. Montpeller: Cedex. Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan Jilid 3. Ed ke-4. R. Lukman
dan Sumaryono, penerjemah. Bandung:
Penerbit ITB. Terjemahan dari: Plant
Phsiology, 4th Edition.
Kuswanhadi. 2006. Isoelement et caractèrisation des gènes ACS et ACO impliqués dans la biosynthèse de l’éthylène ches Hevea brasiliensis. [tesis].
Montpellier : Scienes et Techniques du
Languedoc, Universite Montpeller II. Sambrook et al. 1989. Laboratory Manual. New York : Cold Molecular Cloning : Spring Harbour Laboratory Pr.
12
Sumarmadji, Tistama R, Siswanto. 2004. Protein-protein spesifik yang diinduksi oleh etefon pada beberapa klon tanaman karet. J Pnlit Krt 22 (2): 57-69.
Tistama R, Siregar THS. 2005. Perkembangan penelitian stimulan untuk pengakiran lateks Hevea brasiliensis. Wrt Perkrt 24
(2): 45-57.
Tim Penulis Penebar Swadaya. 1998. Karet:
Strategi Pemasaran tahun 2000, Budidaya dan Pengolahan. Jakarta: Penebar
Swadaya.
Wang KLC, Li H, Ecker JR. 2002. Ethylene
biosynthesis and signaling networks. Plant
13
14
Lampiran 1 Alur penelitian
Isolasi RNA Bark Tanaman Karet
Karakterisasi RNA Hasil Isolasi (Spektofotometri,Elektroforesis Gel Agarosa 1%)
Uji ekspresi gen HbACO3 melalui deteksi keberadaan RNA HbACO3
(RT-PCR dan Elektroforesis Gel Agarosa 1%)
15
Lampiran 2 Pembuatan larutan sediaan
Bufer ekstraksi DNA. (50 mL):
CTAB 10%
10 mL
EDTA 0.5 M pH 8.0
2 mL,
tris-HCl 1M pH 8.0
5 mL,
NaCl 5 M
12.6 mL
ddH O DEPC
220.4 mL
Bufer TBE 5X (500mL):
Tris-Base
27gram
Asam borat
13.75 gram
EDTA 0.5 M pH 8.0
10 mL
dan ditepatkan dengan ddH O hingga 500 mL.
2Saat pemakaian dalam pembuatan gel agarosa, bufer TBE 5X ini diencerkan
menjadi 0.5X.
16
Lampiran 3 Prosedur elektroforesis gel agarosa (Sambrook et al 1989)
0.3 gram agarosa ditimbang dan dilarutkan dalam 30 mL bufer TBE 0.5X
dengan bantuan oven microwave
selama satu menit 110
0C.
Setelah larut, larutan dibiarkan pada suhu kamar sebentar hingga cukup hangat
dan segera ditambahkan EtidiumBromida sebanyak 1.5
μ
L dan dipindahkan
kedalam cetakan gel yang telah disusun bersama sisirnya.
Gel ditunggu hingga memadat dan sisirnya diangkat.
DNA dilarutkan dengan loading bufer dengan perbandingan 1 : 5 dan
dimasukkan ke dalam sumur yang terbentuk pada gel. Demikian juga dengan
marker yang diperlakukan dengan cara yang sama
Gel diletakkan dalam bak elektroforesis yang telah diisi dengan bufer TBE 0.5X.
Kemudian dihubungkan dengan adaptor dengan potensial listrik sebesar 100 Volt.
Setelah loading bufer berada + 1 cm dari dasar gel adaptor dimatikan dan gel
diangkat. Gel diletakkan dibawah sinar UV untuk melihat ada tidaknya pita yang
17
Lampiran 4 Analisis hasil isolasi RNA kulit batang dengan spektrofotometer
No. Sample 260 280 260/280 [ ]ng/ul * Total (ul)**
53 0.220 0.198 1.110 880 30 67 0.094 0.079 1.183 376 30 68 0.111 0.091 1.227 444 30 69 0.205 0.171 1.200 820 30 70 0.106 0.085 1.177 424 30 72 0.253 0.181 1.397 1012 30 85 0.144 0.113 1.269 576 30 86 0.136 0.115 1.182 544 30 87 0.128 0.101 1.259 512 30 88 0.126 0.106 1.187 504 30 120 0.054 0.036 1.487 216 30 121 0.049 0.027 1.829 196 30 71 0.035 0.024 1.487 140 30 130 0.082 0.046 1.784 328 30 131 0.079 0.046 1.726 316 30 132 0.105 0.067 1.574 420 30 106 0.031 0.020 1.541 124 30 107 0.063 0.052 1.287 252 30 108 0.088 0.073 1.200 352 30 109 0.096 0.060 1.612 384 30 110 0.151 0.097 1.559 604 30 111 0.164 0.076 1.358 416 30 89 0.176 0.133 1.322 704 30 90 0.162 0.123 1.318 648 30 98 0.236 0.135 1.749 944 30 143 0.233 0.128 1.814 932 30 133 0.078 0.050 1.567 312 30 134 0.116 0.066 1.763 464 30 135 0.159 0.083 1.907 636 30 151 0.111 0.075 1.478 444 30 152 0.049 0.035 1.402 196 30 153 0.068 0.041 1.665 272 30 154 0.180 0.158 1.139 729 30 155 0.156 0.088 1.783 624 30 156 0.120 0.072 1.674 480 30 166 0.079 0.044 1.790 316 30 167 0.073 0.047 1.568 292 30 168 0.026 0.005 5.012 104 30 172 0.108 0.048 2.244 432 20 173 0.141 0.068 2.067 564 20 174 0.109 0.063 1.730 436 20 175 0.120 0.064 1.885 480 20 176 0.111 0.056 2.000 444 20 177 0.127 0.065 1.951 508 20 178 0.147 0.059 2.497 588 20
260 = Panjang gelombang untuk konsentrasi RNA; 280 = Panjang gelombang
untuk konsentrasi protein; 260/280 = Kemurnian RNA dari kontaminan protein; *
= Konsentrasi RNA hasil perhitun; ** = Volume total larutan RNA hasil isolasi
18
Lanjutan lampiran 4
No. Sample 260 280 260/280 [ ]ng/ul Total (ul)
179 0.128 0.071 1.794 512 30 180 0.110 0.073 1.620 440 30 181 0.101 0.108 1.678 404 30 182 0.080 0.043 1.869 320 30 183 0.122 0.080 1.530 488 30 190 0.074 0.060 1.233 296 30 191 0.079 0.050 1.586 316 30 16 0.045 -0.017 -2.611 180 30 17 0.087 0.036 2.448 348 30 18 0.116 0.053 2.175 464 30 19 0.049 0.017 2.893 196 30 20 0.073 0.039 1.847 292 30 21 0.083 0.041 2.022 332 30 24 0.107 0.054 1.976 428 30 35 0.052 0.027 1.933 208 30 36 0.082 0.028 2.974 328 30 37 0.033 0.009 3.584 132 30 38 0.068 0.033 2.037 272 30 39 0.068 0.034 2.016 272 30 40 0.188 0.097 1.935 752 30 43 0.173 0.100 1.734 692 30 54 0.074 0.056 1.335 296 30 56 0.200 0.135 1.487 800 30 57 0.186 0.111 1.682 744 30 59 0.182 0.103 1.794 728 30
260 = Panjang gelombang untuk konsentrasi RNA; 280 = Panjang gelombang
untuk konsentrasi protein; 260/280 = Kemurnian RNA dari kontaminan protein; *
= Konsentrasi RNA hasil perhitun; ** = Volume total larutan RNA hasil isolasi
19
Lampiran 5 Analisis hasil isolasi RNA lateks dengan spektrofotometer
No. Sampel A260 A280 (260/280) [RNA](ng/ul)*
1 0.235 0.116 2.026 1410 2 0.352 0.176 2.000 2112 10 0.309 0.159 1.943 1854 4 0.354 0.176 2.132 2124 12 0.247 0.121 2.041 1482 6 0.328 0.165 1.988 1968 14 0.294 0.153 1.921 1764 X1 0.092 0.050 1.840 552 22 0.207 0.111 1.865 1242 30 0.304 0.158 1.924 1824 26 0.249 0.126 1.976 1494 27 0.239 0.114 2.096 1434 28 0.459 0.243 1.888 2754 29 0.560 0.278 2.014 3360 40 0.367 0.187 1.962 2202 41 0.396 0.204 1.941 2376 42 0.457 0.232 1.969 2742 43 0.633 0.321 1.972 3798 44 0.257 0.132 1.947 1542 45 0.126 0.066 1.909 756 58 0.236 0.114 2.065 944 67 0.364 0.220 1.658 1456 68 0.475 0.308 1.546 1.900 63 0.373 0.198 1.881 1492 64 0.091 0.046 1.986 364 65 0.383 0.206 1.864 1532 66 0.479 0.297 1.615 1916 79 0.278 0.159 1.750 1112 80 0.348 0.202 1.723 1392 81 0.274 0.154 1.775 1096 82 0.267 0.147 1.814 1068 83 0.334 0.194 1.715 1336 84 0.168 0.088 1.918 672 97 0.043 0.031 1.382 172 100 0.278 0.149 1.859 1112 101 0.315 0.179 1.762 1260 102 0.280 0.170 1.651 1120 109 0.422 0.265 1.591 1688 104 0.027 0.018 1.464 108 105 0.180 0.094 1.927 720
260 = Panjang gelombang untuk konsentrasi RNA; 280 = Panjang gelombang
untuk konsentrasi protein; 260/280 = Kemurnian RNA dari kontaminan protein; *
= Konsentrasi RNA hasil perhitun; ** = Volume total larutan RNA hasil isolasi
20
Lanjutan lampiran 5
No. Sampel A260 A280 (260/280) RNA(ng/ul)*
118 0.055 0.029 1.918 220 121 0.062 0.032 1.916 248 124 0.264 0.150 1.761 1056 125 0.126 0.068 1.845 504 126 0.330 0.195 1.694 1320 127 0.336 0.192 1.752 1344 128 0.353 0.210 1.679 1412 129 0.317 0.178 1.782 1268 142 0.288 0.167 1.725 1152 145 0.257 0.135 1.895 1028 146 0.189 0.096 1.966 756 147 0.173 0.093 1.854 692 148 0.264 0.145 1.824 1056 155 0.141 0.076 1.861 564 156 0.240 0.128 1.875 960 163 0.066 0.035 1.893 264 164 0.207 0.108 1.918 828 165 0.171 0.090 1.909 684
260 = Panjang gelombang untuk konsentrasi RNA; 280 = Panjang gelombang
untuk konsentrasi protein; 260/280 = Kemurnian RNA dari kontaminan protein; *
= Konsentrasi RNA hasil perhitun; ** = Volume total larutan RNA hasil isolasi
21
Lampiran 6 Analisis hasil isolasi RNA kulit batang dan lateks dengan
elektroforesis
•
RNA kulit batang
No. sampel 53 67 68 69 70 72 85 86 87 88 120 121 71 130 131 132 106 107 108 109 110 111 89 90 No. Sampel 98 143 133 134 135 151 152 153 154 155 156 166 167 168 172 173 174 175 176 177 No. Sampel 179 180 181 182 183 190 191 16 17 18 19 20 21 24 35 36 37 38 39 40 43 54 56 57 59
•
RNA Lateks
No. Sampel1 2 10 4 12 6 14 X1 22 30 26 27 28 29 40 41 42 43 44 45 No. Sampel 58 67 68 63 64 65 66 79 80 81 82 83 84 97 100 101 102 109 104 105 No. Sampel 118 121 124 125 126 127 128 129 142 145 146 147 148 155 156 163164 165
*RNA hasil isolasi tidak ada yang terdegradasi dan konsentrasi RNA yang
dihasilkan cukup baik untuk digunakan untuk analisis berikutnya
22
Lampiran 7 Hasil uji ekspresi gen HbACO3 dalam kulit batang tanaman karet
8 9 10 11 12 13 14 X3 23 30 31 32 33 34 46 47 48 49 50 51 M
d/2 E/6 d/2 d/3 d/6 E/3 E/12 d/2 E/6 d/2 d/4 E/3 E/12 E/6 d/2 d/4 d/6 E/3 E/12
58 61 62 63 64 65 66 79 80 81 82 M
d2 d2 d4 d6 E/3 E/12 E/4 d2 d4 d6 E/3
84 97 100 101 102 103 104 105 118 119 M
E/6 E/12 d2 d4 d6 E/3 E/12 E/6 E/12 E/6
124 125 126 127 128 129 142 145 146 147 148 149 M 150 163 164 165 172 173 174 175 176 177
d2 d4 d6 E/3 E/12 E/6 E/12 d2 d4 d6 E/3 E/12 E/6 E/3 E/12 E/6 d2 d4 d6 E/3 E/12 E/6
Keterangan : Nomor = nomor sampel X3 = Control positif
M = Marker
d/2, d/4, d/6 = disadap 2 hari sekali, 4 hari sekali, dan 6 kali sehari E4, E12, E6 = perlakuan dengan etefon 4 kali, 12 kali dan 6 kali dalam setahun Jumlah siklus = 35
23
Lampiran 8 Hasil uji ekspresi gen HbACO3 dalam lateks tanaman karet
1
2 10 4 12 6 14 X1 22 30 26 27 28 29 40 41 42 43 44 M
Keterangan : Nomor = nomor sampel
X1 = Control positif
M = Marker
Jumlah siklus = 35
Suhu Denaturasi, annealing, dan polimerisasi = 95ºC, 55ºC, dan 72ºC
Menggunakan promer aktin
Pita yang terlihat adalah pita RNA total yang terekspresi karena
berikatan dengan primer aktin, namun HbACO3 tidak terekspresi
dalam lateks.
24
Lampiran 9 Data konsentrasi secara semikuantitatif ekspresi gen HbACO3 kulit
batang pada berbagai perlakuan pelukaan
Ekspresi pada perlakuan S/2 d/2
no
sampel
(ng/ul)
[ ]
0 10 20 30 40 50 60 70 80 0 4 8 15 30 60 90 120 150 Hari ke-ek spre si treatment d/4 0 5 10 15 20 25 30 0 8 15 30 60 90 120 150 Hari ke-ek sp resi treatment d/6hari
ke-
10 0
35.30095
23 2
53.83443
31 4
40.46807
47 6
69.45641
58 8
0
61 15
12.9095
79 30
0
100 60
23.65847
124 90
1.343168
145 120 0
172 150
10.73108
Ekspresi pada perlakuan S/2 d/4
no sampel hari ke- [ ] (ng/ul) 11 0 35.30095 32 4 67.07957 48 8 22.91412 62 15 0 80 30 0 101 60 39.75079 125 90 35.61066 146 120 7.754373 173 150 1.302173Ekspresi pada perlakuan S/2 d/6
Keterangan : S/2 = pohon disadap dengan diameter setengah lingkaran batang
d/2, d/4, d/6 = disadap 2 hari sekali, 4 hari sekali, dan 6
kali sehari
no sampel hari ke- [ ] (ng/ul) 12 0 18.02757 49 8 25.51799 63 15 11.5795 81 30 0 102 60 0 126 90 0 147 120 13.57342 174 150 0 0 10 20 30 40 50 60 70 80 0 2 4 6 8 15 30 60 90 120 150 Hari ke -eksp re si ( ng/ ul ) treatment d/225
Lampiran 10 Data konsentrasi secara semikuantitatif ekspresi gen HbACO3 kulit
batang pada berbagai stimulasi etefon
Ekspresi pada perlakuan E3 d/4
nosampel
hari ke-
Ekspresi pada perlakuan E12 d/4
Ekspresi pada perlakuan E6 d/4
Keterangan : E4, E12, E6 berturut-turut = perlakuan dengan etefon 4 kali, 12 kali
dan 6 kali dalam setahun
[ ] (ng/ul) 0 10 20 30 13 0 3.775822 33 4 44.60399 50 8 62.47604 64 15 37.25415 82 30 32.21806 103 60 30.0087 127 90 0 148 120 9.972672 163 124 0 175 150 0 no sampel hari ke- [ ] (ng/ul) 14 0 22.42313 34 4 39.58392 51 6 61.82754 65 8 66.34263 83 30 0 97 34 16.28734 104 60 11.16541 118 64 10.37063 128 90 5.661336 142 94 28.72117 149 120 0 164 124 0 176 150 0 no sampel hari ke- [ ] (ng/ul) 9 0 8.750365 30 4 48.43288 46 8 101.4848 66 15 54.4783 84 30 21.15638 105 60 13.99532 119 64 11.47048 129 90 3.160625 150 120 45.80481 165 124 0 177 150 0 0 10 20 30 40 50 60 70 0 4 6 8 30 34 60 64 90 94 120 124 150 Hari E12 d/4 ekspresi 40 50 60 70 0 4 8 15 30 60 90 120 124 150 Hari E3 d/4 ekspresi 0 20 40 60 80 100 120 0 4 8 15 30 60 64 90 120 124 150 Hari E6 d/4 ekspresi