11 BAB II
TINJAUAN PUSTAKA
A. Tinjauan Teori
1. Patologi Anatomi
Patologi anatomi adalah cabang kedokteran yang mempelajari efek penyakit pada struktur organ tubuh, baik secara makroskopis maupun secara mikroskopis. Peran utama pemeriksaan patologi anatomi adalah untuk mengidentifikasi kelainan yang terdapat dalam tubuh sehingga dapat membantu mendiagnosis penyakit serta menentukan pengobatan yang tepat.
Ada dua subdivisi utama dalam patologi anatomi, yaitu histopatologi (histologi) dan sitopatologi (sitologi):
a. Histopatologi atau histologi adalah ilmu yang mempelajari tentang struktur jaringan secara detail menggunakan mikroskop pada sediaan jaringan yang dipotong tipis. Histologi sangat berguna dalam mempelajari fungsi fisiologi sel-sel dalam tubuh, baik manusia, hewan, dan tumbuhan, serta berguna dalam penegakan diagnosis penyakit yang melibatkan perubahan fungsi fisiologi dan deformasi organ (Khristin dan Inderiati, 2017).
12
b. Sitopatologi atau sitologi adalah pemeriksaan sel tunggal atau kelompok sel kecil dari cairan atau jaringan di bawah mikroskop. Secara sederhana, prosedur ini dilakukan dengan mengoleskan cairan sampel atau jaringan pasien pada kaca slide kemudian diperiksa di bawah mikroskop untuk melihat jumlah sel, jenisnya, dan bagaimana rinciannya. Sitopatologi umumnya digunakan sebagai alat skrining untuk mencari penyakit dan memutuskan apakah perlu dilakukan tes lanjutan. Contoh umum dari sitopatologi adalah pap smear, sputum, dan gastric washing.
2. Hewan Coba
Hewan coba adalah hewan yang sengaja dipelihara untuk digunakan sebagai hewan model yang berkaitan untuk pembelajaran dan pengembangan berbagai macam bidang ilmu dalam skala penelitian atau pengamatan laboratorium. Hewan coba banyak digunakan sebagai penunjang dalam melakukan pengujian-pengujian terhadap obat, vaksin, atau dalam penelitian biologi.
Syarat hewan coba secara umum yaitu:
a. Bebas dari mikroorganisme patogen. Berdasarkan tingkatan kontaminasi mikroorganisme patogen, hewan coba digolongkan
13
menjadi hewan percobaan konvensional, Specified Pathogen Free (SPF), dan gnotobiotic;
b. Mempunyai kemampuan dalam memberikan reaksi imun yang baik;
c. Kepekaan terhadap suatu penyakit;
d. Performa hewan percobaan yang dikaitkan dengan sifat genetikanya.
3. Mencit
Mencit (Mus musculus) adalah salah satu anggota kelompok kingdom animalia. Hewan ini ditandai dengan ciri-ciri, jinak, takut cahaya, aktif pada malam hari, mudah berkembangbiak, siklus hidup yang pendek, dan tergolong poliestrus (Fransius, 2008).
Mencit (Mus musculus) merupakan hewan yang paling umum digunakan pada penelitian laboratorium sebagai hewan percobaan, yaitu sekitar 40-80% (Aditya, 2006). Mencit memiliki banyak keunggulan sebagai hewan percobaan, khususnya digunakan dalam penelitian biologi, yaitu siklus hidup yang relatif pendek, jumlah anak per kelahiran banyak, variasi sifat-sifatnya tinggi dan mudah dalam penanganannya (Fransius, 2008).
Klasifikasi mencit (Mus musculus) menurut Animal Diversity Web Universitas Michigan (2020) sebagai berikut:
14
Kingdom : Animalia
Filum : Chordata
Kelas : Mammalia
Ordo : Rodentia
Famili : Muridae
Genus : Mus
Spesies : Mus musculus
Gambar 2.1 Mencit (Mus musculus)
Sumber : Animal Diversity Web Universitas Michigan (2020)
4. Anatomi dan Histologi Hepar
Hati (hepar, hati) adalah kelenjar pencernaan terbesar dari struktur tubular kompleks pada mamalia. Hati memiliki warna coklat merah, konsistensi elastis, bentuk cembung pipih dan struktur lobular.
Unit utama fungsional-morfologis dari organ hepar adalah hepar lobules
15
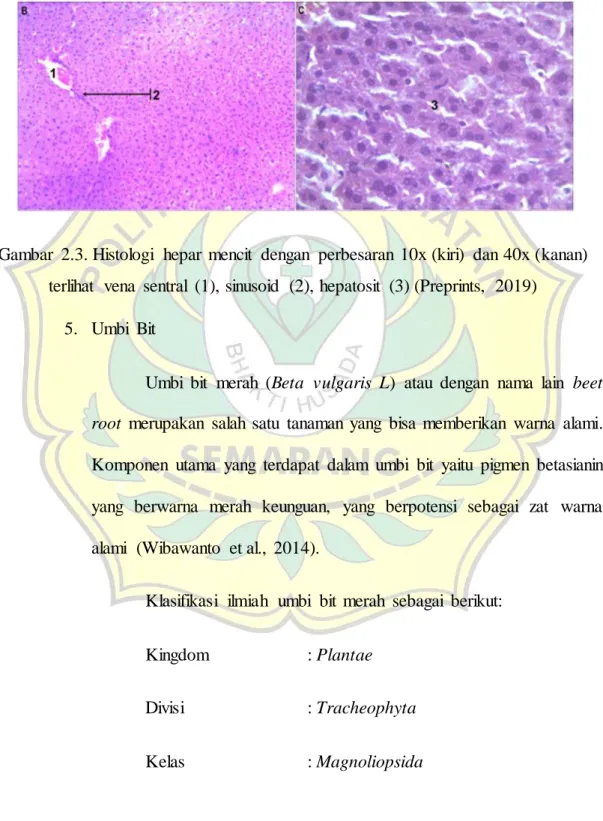
yang bergabung bersama membentuk kompleks lobulus. Lobulus hati memiliki berbagai bentuk, yaitu oval, polihedral, dalam bentuk prisma multilateral dimana vena sentral lewat.
Gambar 2.2 Anatomi hepar mencit terdiri dari lobus lateral kiri (1), lobus kaudatus (2), lobus lateral kanan (3), lobus tengah kanan (4), kandung empedu (5) (Preprints,
2019)
Hati mencit terdiri dari empat lobus utama yang bersatu secara dorsal, yaitu lobus tengah besar (dibagi lagi oleh celah di bagian kiri dan kanan), lobus lateral kanan (dibagi secara horizontal menjadi bagian anterior dan posterior), lobus lateral kiri dan lobus caudal terdiri dari dua bagian dengan bentuk seperti tulang daun dan satu lagi di bagian perut ke esofagus di lekukan lambung terkecil, permukaannya membentuk prosesus papiler. Darah disuplai ke hati melalui cabang interlobular arteri hepatika dan vena hepatika yang terbuka untuk sinusoid. Vesikel bilier terletak di dasar percabangan mendalam dari lobulus tengah di sebelah titik asal ligamen falsiformis. Hepatosit (sel
16
parenkim) terletak pada lempeng yang menyebar dari vena sentral ke perifer lobular.
Gambar 2.3. Histologi hepar mencit dengan perbesaran 10x (kiri) dan 40x (kanan) terlihat vena sentral (1), sinusoid (2), hepatosit (3) (Preprints, 2019)
5. Umbi Bit
Umbi bit merah (Beta vulgaris L) atau dengan nama lain beet root merupakan salah satu tanaman yang bisa memberikan warna alami.
Komponen utama yang terdapat dalam umbi bit yaitu pigmen betasianin yang berwarna merah keunguan, yang berpotensi sebagai zat warna alami (Wibawanto et al., 2014).
Klasifikasi ilmiah umbi bit merah sebagai berikut:
Kingdom : Plantae
Divisi : Tracheophyta
Kelas : Magnoliopsida
17
Ordo : Caryophyllales
Famili : Amaranthaceae
Genus : Beta L.
Spesies : Beta vulgaris L
Gambar 2.4. Umbi Bit Merah (Wibawanto et al., 2014) 6. Betasianin
Coultate (1996) menyatakan bahwa betalain dibagi menjadi dua kelompok yaitu betasianin dengan warna pigmen merah keunguan dan betaxantin dengan warna pigmen kuning. Peningkatan intensitas warna tersebut terjadi disertai dengan degradasi betasianin yang berkaitan dengan formasi warna kuning pada kerusakan produk (Herbach et al., 2006).
Betasianin adalah zat warna yang berfungsi memberikan warna merah dan berpotensi menjadi pewarna alami. Betasianin dapat
18
digunakan sebagai pewarna alami dalam bentuk ekstrak, akan tetapi penggunaan pelarut air dalam proses pemekatan dengan panas dapat mengakibatkan kerusakan karena titik didih air cukup tinggi (100°C) sedangkan stabilitas betasianin semakin menurun pada pemanasan suhu 70 dan 80°C (Havlikova et al., 1983).
7. Histoteknik
Histoteknik adalah metoda untuk membuat sediaan histologi dari spesimen tertentu melalui suatu rangkaian proses hingga menjadi sediaan yang siap untuk diamati atau dianalisis. Sediaan histologi yang dibuat harus memberikan gambaran tentang bentuk dan ukuran serta susunan sel, seperti inti sel dan sitoplasma; badan inklusi; susunan serat jaringan ikat; otot dan lain sebagainya sesuai dengan gambaran jaringan tubuh dalam kondisi hidup.
Tahapan pembuatan sediaan histologi antara lain:
a. Isolasi atau Pengambilan Jaringan Tubuh 1) Pembiusan
Untuk membius hewan yang akan diambil jaringan tubuhnya dapat dilakukan dengan 3 cara yaitu pembiusan inhalasi dengan menggunakan eter dan bantuan alat sungkup muka, pembiusan dengan
19
menyuntikkan zat anestesi, serta campuran yaitu pembiusan inhalasi yang diikuti dengan pembiusan lewat suntikan.
2) Pembedahan dan Isolasi Jaringan
Setelah hewan terbius sempurna, proses selanjutnya adalah melakukan pembedahan dan mengisolasikan jaringan tubuh yang diinginkan.
Jaringan tubuh lalu dipotong-potong di dalam cairan fisiologis (NaCl 0.9%) untuk mendapatkan ukuran yang lebih kecil agar cairan fiksasi dapat masuk ke dalam jaringan dengan mudah. Potongan jaringan kemudian dimasukkan ke dalam wadah-wadah kecil berisi cairan fiksasi kemudian disimpan di tempat yang sesuai hingga tahap pemerosesan jaringan selanjutnya.
b. Fiksasi
Dasar dari pembuatan sediaan histologi yang baik adalah melakukan fiksasi yang benar. Kesalahan yang dilakukan pada tahap fiksasi tidak akan bisa diperbaiki lagi pada tahapan selanjutnya.
20
Tujuan dari fiksasi adalah untuk mempertahankan susunan jaringan agar mendekati kondisi seperti sewaktu hidup dan untuk mengeraskan jaringan terutama jaringan lunak agar memudahkan pembuatan irisan tipis.
Hal-hal yang harus diperhatikan pada tahapan fiksasi dalam pembuatan jaringan histologis adalah:
1) Tebal irisan jaringan 3 – 5 mm sehingga cairan fiksasi dapat dengan cepat memfiksasi seluruh jaringan. Jika irisannya terlalu tebal maka hanya permukaan luarnya saja yang terfiksasi dengan cukup baik, sedangkan bagian tengah jaringan akan membusuk sebelum cairan fiksasi bisa masuk.
2) Volume cairan fiksasi sekurang-kurangnya harus 15 – 20 kali lebih banyak dari volume jaringan yang akan difiksasi. Besarnya volume jaringan menentukan volume fiksasi yang diperlukan sedangkan tebal jaringan menentukan kecepatan fiksasi.
3) Jenis cairan fiksasi yang akan digunakan bergantung pada unsur jaringan yang akan diamati dan jenis pewarnaan yang akan digunakan. Cairan yang sering digunakan yaitu NBF 10% atau formalin 40%.
21 c. Dehidrasi
Dehidrasi merupakan tahap untuk mengeluarkan seluruh cairan yang terdapat dalam jaringan yang telah difiksasi sehingga jaringan nantinya dapat diisi dengan parafin atau zat lainnya yang dipakai untuk membuat blok preparat. Hal ini perlu dilakukan karena air tidak dapat bercampur dengan cairan parafin atau zat lainnya yang dipakai untuk membuat blok preparat.
Setelah jaringan selesai difiksasi jaringan dipindahkan ke dalam alkohol dengan konsentrasi yang makin meningkat secara lebih perlahan, yaitu alkohol 70%, 80%, 90%, 95%, dan 100%.
d. Clearing
Clearing atau pembeningan adalah suatu tahap untuk mengeluarkan alkohol dari jaringan dan menggantinya dengan suatu larutan yang dapat berikatan dengan parafin. Jaringan tidak dapat langsung dimasukkan ke dalam parafin karena alkohol dan parafin tidak bisa saling melarutkan. Proses mengeluarkan alkohol dari jaringan ini sangat krusial karena jika di dalam jaringan masih tertinggal sedikit alkohol maka
22
parafin tidak bisa masuk ke dalam jaringan sehingga menyebabkan jaringan menjadi sulit untuk dipotong dengan mikrotom.
Bahan atau reagen pembening yang paling sering dipakai adalah xylene/xylol.
e. Embedding
Embedding atau pembenaman (impregnasi) adalah proses untuk mengeluarkan cairan pembening (clearing agent) dari jaringan dan diganti dengan parafin. Pada tahap ini, jaringan harus benar-benar bebas dari cairan pembening karena sisa cairan pembening dapat mengkristal dan ketika dipotong dengan mikrotom akan menyebabkan jaringan menjadi mudah robek.
Zat pembenam (impregnasi agent) yang sering digunakan yaitu paraffin histotek khusus dengan suhu 56°C.
f. Blocking
Pengecoran (Blocking) adalah proses pembuatan blok preparat agar dapat dipotong dengan mikrotom. Untuk membuat blok preparat dilakukan dengan cara, histoplate dari plastik diletakkan di atas piringan logam (seperti cetakan membuat es batu). Tuangkan sedikit cairan parafin ke dalam cetakan
23
tersebut. Secepatnya masukkan jaringan dengan menggunakan pinset yang telah dipanaskan (agar parafin tidak beku) dan atur posisinya di dalam cetakan. Parafin cair kemudian dituangkan kembali hingga menutupi seluruh cetakan tersebut. Selama tindakan ini cetakan histoplate dari plastik dan piringan logam harus diletakkan di atas hotplate.
g. Sectioning
Pemotongan (sectioning) adalah proses pemotongan blok preparat dengan menggunakan mikrotom. Sebelum melakukan pemotongan, persiapan yang harus dilakukan adalah
1) Persiapan pisau mikrotom 2) Persiapan Kaca Objek
3) Persiapan Waterbath atau wadah berisi air hangat dengan temperatur 37-40°C;
4) Persiapan sengkelit atau kuas.
h. Staining
Pewarnaan adalah proses pemberian warna pada jaringan yang telah dipotong sehingga unsur jaringan menjadi kontras dan dapat diamati dengan mikroskop. Pewarnaan dapat
24
memperlihatkan struktur dan morfologi jaringan, keberadaan dan prevalensi sel-sel jaringan tertentu.
Sebelum melakukan pewarnaan, persiapan yang harus dilakukan adalah sebagai berikut:
1) Peralatan gelas harus dibersihkan terlebih dahulu dan dibilas dengan aquades;
2) Timbang zat warna dengan cermat dan tepat;
3) Larutkan zat warna dalam pelarut yang benar dengan memperhatikan urutan pencampurannya ;
4) Aduk zat warna agar seluruh partikel zat warna terlarut dengan baik;
5) Tuangkan larutan zat warna ke dalam wadah yang sesuai untuk proses pewarnaan dengan menyaringnya menggunakan kertas saring;
6) Siapkan juga larutan-larutan lain yang diperlukan untuk proses pewarnaan dan tuangkan dalam wadah yang sesuai;
7) Atur urutan larutan-larutan tersebut sesuai dengan prosedur proses pewarnaan;
25
8) Zat warna beralkohol harus ditutup rapat untuk mencegah penguapan alkohol yang akan menyebabkan pengendapan zat warna.
Pewarnaan rutin yang biasanya digunakan untuk histopatologi adalah pewarnaan Hematoxylin Eosin (HE). Pada pewarnaan HE digunakan 2 macam zat warna yaitu Hematoxylin yang berfungsi untuk mewarnai inti sel dan memberikan warna biru (basofilik) serta Eosin yang merupakan counterstaining Hematoxylin, digunakan untuk mewarnai sitoplasma sel dan jaringan penyambung dan memberikan warna merah muda dengan nuansa yang berbeda.
Senyawa Hematoxylin yang digunakan adalah bentuk oksidasinya yaitu hematein. Selama proses oksidasi berlangsung kemampuan Hematoxylin utuk mewarnai inti sel akan terus berlangsung dan akan berkurang jika proses oksidasi telah selesai. Untuk memperpanjang proses ini, larutan Hematoxylin dapat disimpan dalam wadah tertutup dan disimpan dalam ruangan gelap. Dalam kondisi terpapar oleh cahaya sebaiknya larutan diganti sekurangnya seminggu sekali. Beberapa larutan Hematoxylin yang digunakan adalah Hematoxylin Erlich,
26
Hematoxylin Delafield, Hematoxylin Mayer, dan Hematoxylin Harris.
Eosin adalah pewarna sintetis yang termasuk golongan xanthene. Eosin bersifat asam dan akan mengikat molekul protein yang bermuatan positif di sitoplasma dan jaringan ikat.
Eosin adalah counterstain yang dapat mewarnai sitoplasma dan jaringan ikat menjadi bernuansa merah dan oranye. Eosin juga mewarnai inti sel yang telah terwarnai Hematoxylin dari biru menjadi berwarna ungu. Eosin yang tersedia dalam bentuk komersial diantaranya adalah Eosin Y (Eosin berwarna kekuningan dan larut di dalam air) C.I. No. 45380, Etil Eosin (Eosin S, larut dalam alkohol) C.I. No. 45386 dan Eosin B (Eosin kebiruan, eritrosin B) C.I. No.45400. Namun yang paling banyak digunakan dan digabungkan dengan Hematoxylin adalah Eosin Y.
Prinsip pewarnaan menggunakan reagen Hematoxylin Eosin yaitu kromatin dalam inti akan mengikat warna yang bersifat basa (Hematoxylin) dan protein sitoplasma akan mengikat warna yang bersifat asam (Eosin) sehingga sel-sel akan berwarna merah muda dengan inti sel berwarna biru keunguan.
27
Senyawa betasianin yang terdapat pada umbi bit merupakan senyawa fenol yang tersubstitusi oleh gugus glikosida pada posisi orto dan mempunyai gugus kromofor.
Gugus-gugus fungsional yang ada dapat berinteraksi dengan anion yang mampu menghasilkan perubahan warna. Menurut penelitian Livia et al (2019) inti sel berwarna merah pekat dan sitoplasma berwarna merah muda.
Larutan ekstrak umbi bit dengan pelarut aquades memiliki pH sedikit asam yaitu 5,5 karena adanya asam betalamic yang memungkinkan pewarnaan struktur dasar seperti sitoplasma, serabut saraf, serat otot, musin, keratin, dan sel darah merah. Menurut Mfoniso et al (2018) betalains, terutama betanin (bertanggung jawab atas warna merah dan konsentrasi tertinggi dalam ekstrak), memiliki serapan maksimum mendekati Eosin yaitu antara 515 dan 518 nm. Dengan demikian, ekstrak umbi bit bertindak sebagai pewarna sitoplasma yang mirip dengan reagen Eosin.
8. Faktor yang Mempengaruhi Kualitas Sediaan Histologi a. Waktu fiksasi
Fiksasi merupakan bagian terpenting dalam pembuatan sediaan histologi. Fiksasi harus dilakukan dengan
28
memperhatikan waktu yang tepat agar tidak terlalu lama maupun terlalu cepat sehingga bisa mendapatkan detail histologi jaringan yang baik (Khristian dan Inderiati, 2017).
b. Suhu dan kebersihan air pada waterbath
Waterbath merupakan alat yang digunakan untuk meletakkan pita jaringan hasil pemotongan yang selanjutnya ditempelkan pada kaca objek dengan suhu air berkisar 10°C dibawah titik leleh parafin dan harus dijaga suhunya.
Kebersihan air waterbath juga harus dijaga dan bebas dari adanya gelembung, karena jika kotor akan menimbulkan artefak pada jaringan yang sudah diiris (Khristian dan Inderiati, 2017).
c. Suhu dan blocking
Keadaan blok jaringan yang dingin akan mempermudah dalam menghasilkan pita jaringan yang tipis karena blok jaringan dalam kondisi yang keras akibat suhu dingin serta menghindar dari rusaknya jaringan akibat sulit dipotong tipis (Khristin dan Inderiati, 2017).
d. Kerataan pada pewarnaan
Melakukan pewarnaan sesuai prosedur akan menghasilkan pewarnaan yang baik. Tujuan pewarnaan yaitu
29
untuk membedakan antara satu sel dengan sel lainnya dengan cara memberikan warna yang kontras terhadap komponen seluler (Khristian dan Inderiati, 2017; Bruce-gregorios, 2006;
Ariyadi dan Suryono, 2017).
e. Ketajaman pisau mikrotom
Mengatur sudut pemotongan pisau merupakan salah satu persiapan yang perlu diperhatikan sebelum menggunakan mikrotom agar dapat mengurangi kegagalan serta terbentuknya artefak pada pita jaringan, seperti menempatkan pisau pada sudut optimum yaitu berkisar 35° (Khristian dan Inderiati, 2017).
30
9. Kriteria Penilaian Kualitas Mikroskopis
Tabel 2.1 Kriteria Penilaian Kualitas
No Struktur Deskripsi Kualitas
Skala Ordinal
Skala Nominal 1. Inti sel Warna pada inti sel sangat
jelas
Baik 3
Warna pada inti sel kurang jelas
Kurang baik 2 Warna pada inti sel tidak jelas Tidak baik 1 2. Sitoplasma Warna pada sitoplasma sangat
jelas
Baik 3
Warna pada sitoplasma kurang jelas
Kurang baik 2 Warna pada sitoplasma tidak
jelas
Tidak baik 1 3. Keseragaman
warna
Warna pada preparat seragam Baik 3 Warna pada preparat kurang
seragam
Kurang baik 2 Warna pada preparat tidak
seragam
Tidak baik 1 Sumber : Ariyadi dan Suryono (2017)
Preparat jaringan diamati pada mikroskop dengan perbesaran 100x untuk melihat keseragaman warna dan 400x untuk melihat warna pada inti sel serta sitoplasma. Masing masing preparat diamati dengan 5 lapang pandang yang berbeda. Parameter yang diamati pada setiap lapang pandang meliputi warna pada inti sel, warna pada sitoplsma, dan keseragaman warna. Masing-masing parameter tersebut diberi skor 3 apabila warna pada inti sel, sitoplasma, dan keseragaman warna preparat baik. Skor 2 apabila warna pada inti sel, sitoplasma, dan keseragaman warna preparat kurang baik. Skor 1 apabila warna pada
31
inti sel, sitoplasma, dan keseragaman warna preparat tidak baik.
Selanjutnya nilai yang diperoleh dijumlahkan dengan kriteria sebagai berikut:
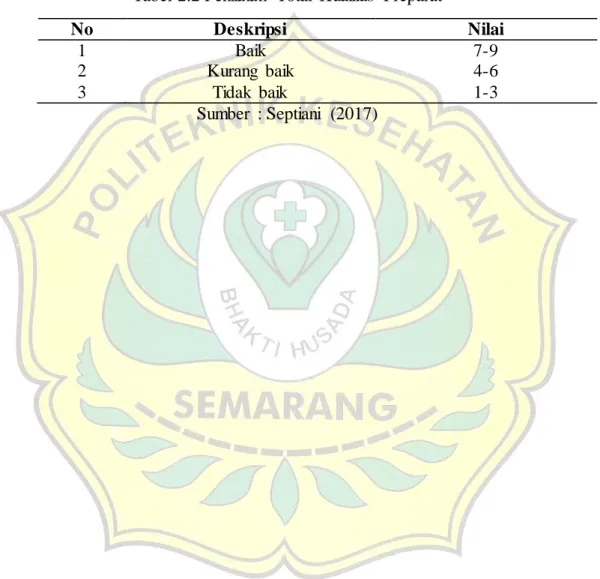
Tabel 2.2 Penilaian Total Kualitas Preparat
No Deskripsi Nilai
1 Baik 7-9
2 Kurang baik 4-6
3 Tidak baik 1-3
Sumber : Septiani (2017)
32 B. Kerangka Teori
C. Kerangka Konsep
Sampel Hepar Mencit
Teknik Histologi Jaringan
Tahap Pewarnaan (Staining)
Reagen Hematoxylin Eosin
Larutan Ekstrak Umbi Bit Merah
Kualitas Preparat Gambaran Mikroskopis : a. Inti sel b. Sitoplasma c. Kerataan warna
Kualitas Preparat Larutan Ekstrak
Umbi Bit