ii
KATA PENGANTAR
Puji dan syukur kita panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya yang telah memberikan kepada kita semua, sehingga Buku Penuntun Kimia Dasar ini dapat tersusun dan disajikan sebagaimana yang telah direncanakan. Buku ini berisi tentang peraturan dan tata tertib laboratorium, tata cara penulisan jurnal dan judul-judul praktikum semester genap.
Penyusunan buku ini bertujuan untuk meningkatkan kualitas laboratorium, memudahkan mahasiswa dalam melaksanakan praktikum serta meningkatkan layanan UPT.PP.LIDA USU.
Buku penuntun ini telah kami susun dengan maksimal, namun kami menyadari sepenuhnya bahwa masih ada kekurangan baik dalam penulisan maupun tata bahasa sehingga perlu ditingkatkan kualitasnya kembali pada masa yang akan datang.
Akhir kata kami mengucapkan banyak terima kasih kepada semua pihak yang telah berkontribusi, sehingga terwujudnya buku penuntun UPT. PP. LIDA USU. Smoga buku ini bermanfaat bagi kita semua.
Tim Penyusun,
ii TIM PENYUSUN
Penyusun : 1. Sabarmin Perangin-angin, S.Si, M.Si 2. Rikson Siburian, Ph.D
3. Dr. Darwin Yunus Nasution, MS 4. Saharman Gea, Ph.D
5. Dr. Helmina Br Sembiring, M.Si 6. Prof. Dr. Harry Agusnar, M.Sc. M.Phill 7. Prof. Dr. Zul Alfian, M.Sc
8. Dr. Yugia Muis, M.Si
9. Dra. Saur Lumban Raja, M.Si 10. Dr. Andriayani, S.Pd, M.Si 11. Dr. Sovia Leny, S.Si, M.Si 12. Dr. Mimpin Ginting, M.S 13. Dr. Adil Ginting, M.Sc 14. Dr. Juliati Tarigan, M.Si 15. Dr. Cut Fatimah Zuhra, M.Si 16. Dra. Herlince Sihotang, M.Si 17. Dede Ibrahim, S.Si, M.Si
18. Zulham Effendi Sinaga, S.Si, M.Si 19. Juli Novita Sari, S.Si
20. Hari Mahendra 21. Putri Faradilla 22. Nabilla Hannani 23. Ade Yolanda 24. Ulfa Ayu Ningrum 25. Taufik Hidayat 26. Muhammad Abduh
Editor : Prof. Dr. Timbangen Sembiring, M.Sc Desain Sampul : Sri Rahayu, S.Si
ii
DAFTAR ISI
KATA PENGANTAR ... i
TIM PENYUSUN ... ii
DAFTAR ISI ... iii
PERATURAN DAN TATA TERTIB LABORATORIUM KIMIA DASAR LIDA USU ... 1
TATA CARA PENULISAN JURNAL ... 4
JUDUL PRAKTIKUM PEMBUATAN ESTER ... 6
TITRASI ASAM BASA ... 10
TITRASI REDOKS ... 14
ADSORPSI LARUTAN ... 18
PEMISAHAN KOMPONEN DAN CAMPURAN ... 22
SAPONIFIKASI ESTER ... 25
UJI ZAT ADITIF PADA MAKANAN ... 29
ANALISA MELALUI PENGENDAPAN (GRAVIMETRI) ... 33
Laboratorium Kimia Dasar
LIDA USU 1
PERATURAN DAN TATA TERTIB LABORATORIUM KIMIA DASAR
UPT. PP. LIDA USU
I. WAKTU
1. Waktu yang berlaku adalah Waktu Indonesia Bagian Barat (WIB)
2. Praktikan harus sudah hadir didepan pintu masuk laboratorium paling lambat 15 menit sebelum praktikum dimulai
3. Bagi praktikan yang terlambat akan diberikan sanksi.
II. PERSYARATAN MASUK LABORATORIUM
1. Praktikan yang diizinkan mengikuti praktikum adalah praktikan yang sudah mendaftar dan mengikuti pengarahan di Laboratorium Kimia Dasar LIDA – FMIPA USU Medan 2. Praktikan harus berpakaian rapi, bersih, dan sopan
- Tidak boleh memakai T-shirt dalam bentuk apapun termasuk T-shirt berkerah - Memakai kemeja yang sopan
- Memakai celana atau rok panjang yang menutupi kaki - Memakai kaos kaki tebal
- Memakai sepatu tertutup
- Bagi wanita yang berambut panjang, rambut harus diikat rapi - Tidak diperkenankan memakai perhiasan
3. Memakai jas praktikum berwarna putih bersih
4. Membawa buku laporan sementar beserta format data, kertas responsi, peralatan laboratorium lengkap, flowsheet, sampel lengkap, tugas – tugas (jika ada)
5. Laporan Resmi Praktikum ( Jurnal ) diserahkan pada praktikum selanjutnya, apabila tidak lengkap maka praktikan akan diberikan sanksi.
Laboratorium Kimia Dasar
LIDA USU 2
III. TATA TERTIB DALAM LABORATORIUM
1. Tidak diperkenankan makan dan minum di dalam laboratorium 2. Tidak diperkenankan merokok
3. Tidak diperkenankan ribut dan berjalan – jalan
4. Segala bentuk peralatan komunikasi (Seperti : HandPhone, dll.) di-nonaktifkan 5. Keluar atau masuk laboratorium harus dengan izin asisten laboratorium
6. Harus sopan dan tidak melawan kepada Dosen dan Asisten 7. Praktikum dimulai setelah ada instruksi dari asisten
8. Peralatan yang dipinjam harus dengan bon alat yang telah disetujui oleh asisten
9. Periksa peralatan sebelum keluar dari loker. Jika sudah keluar dari loker, peralatan menjadi tanggung jawab praktikan.
10. Peralatan yang pecah atau rusak harus diganti
11. Ambilah bahan kimia yang diperlukan di rak bahan sesuai dengan judul percobaan yang akan dilakukan ( jangan mengambil bahan di rak judul percobaan lain ), jika bahan tidak tersedia, tanyakan kepada asisten
12. Lakukan praktikum sesuai dengan prosedur yang telah diterangkan oleh asisten 13. Setiap hasil percobaan yang diperoleh harus ditunjukkan kepada asisten
14. Selesai praktikum, simpan kembali bahan kimia pada tempatnya semula 15. Cuci dan keringkan peralatan sebelum dikembalikan
16. Kebersihan meja dan wastafel adalah tanggung jawab praktikan
17. Kembalikan peralatan ke loker dan mintalah kembali bon alat kepada asisten sebagai bukti praktikan tidak mempunyai hutang – piutang kepada laboratorium
18. Catatlah data percobaan pada buku laporan sementara dan mintalah ACC kepada asisten yang bersangkutan
19. Untuk praktikum hari pertama, mintalah format data yang sebenarnya kepada asisten yang bersangkutan. Untuk praktikum selanjutnya, praktikan harus mempersiapkan format data sebelum masuk
20. Selesai praktikum, praktikan tidak diperkenankan keluar dari laboratorium tanpa izin dari asisten
Laboratorium Kimia Dasar
LIDA USU 3
IV. PERATURAN TAMBAHAN
1. Praktikan harus mengenakan jas praktikum setiap memasuki laboratorium 2. Memakai dan membuka jas praktikum harus di luar laboratorium
3. Tas ditanggalkan ketika memasuki ruangan asisten atau ruangan lain dalam laboratorium 4. Ketuklah pintu terlebih dahulu ketika memasuki setiap ruangan dalam laboratorium dan
masuklah setelah diberi izin oleh asisten. ( Jangan sekali – kali masuk jika tidak ada asisten dalam ruangan )
5. Tidak boleh memasuki ruangan yang bertuliskan “ ASISTANT ONLY “ 6. Urusan Laboratorium harus diselesaikan didalam Laboratorium
7. Praktikan harus hafal prosedur percobaan
8. Praktikan yang tidak hadir dapat mengganti hari praktikum dijudul yang tidak hadir tersebut jika disertai dengan surat atau izin dari kepala laboratorium/asisten.
9. Praktikan yang gagal dapat mengulang praktikum pada tahun berikutnya V. KRITERIA PENILAIAN
1. Responsi ( lisan dan tulisan ) : 20 % 2. Jurnal ( bobot isi dan kerapian ) : 20 % 3. K – 3 ( keterampilan, kerapian, dan kesopanan ) : 25 %
4. Tugas : 5 %
5. Refreshing test ( Final Test ) : 30 %
Laboratorium Kimia Dasar
LIDA USU 4
TATA CARA PENULISAN JURNAL
JUDUL PERCOBAAN I. PENDAHULUAN
I.1 Tujuan Percobaan - Untuk mengetahui..
(minimal 3 buah ) II. TINJAUAN PUSTAKA
________________________________________________________________________
______________________________________________________________________________
_____________________________________________(Chang, 2005).
(sebanyak 2 lembar dan terdiri dari 2 tinjauan pustaka yaitu 1 Textbook dan 1 Bahasa Indonesia )
III. METODOLOGI PERCOBAAN III.1 Alat
Beaker Glass 250 ml Pyrex
Gelas Ukur 10 ml Pyrex
Tabung Reaksi Pyrex
dst..
III.2 Bahan HCl(aq) 0,01 M NaOH(aq) 0,01 M Aquadest(l)
dst..
III.3 Prosedur Percobaan - Disediakan 1 tabung reaksi - Diisi dengan 1 ml HCl 0,01 M
dst..
III.4 Flowsheet
0,5 g serbuk Cu
dimasukkan kedalam cawan
Hasil 2 cm
Laboratorium Kimia Dasar
LIDA USU 5
IV. HASIL DAN PEMBAHASAN IV.1 Data Percobaan
No Perlakuan Pengamatan
IV.2 Reaksi dan Perhitungan IV.2.1 Reaksi Percobaan
HCl(aq) + NaOH(aq) NaCl(s) + H2O(l)
IV.2.2 Perhitungan M1.V1 = M2 . V2
IV.3 Diskusi
________________________________________________________________________
__________________________________________________________________
V. KESIMPULAN DAN SARAN V.1 Kesimpulan
(Sesuai dengan tujuan percobaan dan minimal 3 buah) V.2 Saran
- Sebaiknya, praktikan selanjutnya….
(minimal 3 buah)
DAFTAR PUSTAKA
Chang,R., 2005. KIMIA DASAR. Jilid 1. Edisi Ketiga. Jakarta : Erlangga Halaman 60-62
Medan, Mei 2018
Asisten Praktikan
( ) ( )
Laboratorium Kimia Dasar
LIDA USU 6
PEMBUATAN ESTER
TUJUAN PERCOBAAN
- Untuk mengetahui cara mensintesis ester secara laboratorium
- Untuk mengetahui aroma serta cara identifikasi beberapa senyawa ester - Untuk mengetahui aplikasi percobaan
- Untuk mengetahui pembagian senyawa ester
LATAR BELAKANG
Sejumlah besar senyawa dialam raya terdiri dari bahan yang menyenangkan bagi kita.
Berbagai macam bunga dan buah mengandung zat-zat yang baunya enak. Berkat ilmu pengetahuan, zat ini telah dapat dipisahkan. Didefenisikan dan disintesis begitu banyak sehingga senyawa ini tersedia melimpah dengan harga yang layak untuk digunakan dalam kosmetik, produk-produk rumah tangga, alat pembersih dan bahkan berbagai macam makanan.
Hasil sintesis senyawa ini dapat diharapkan dengan pasti. Umumnya senyawa yang baunya wangi digolongkan kedalam kelas ester. Senyawa dari ester-ester ini mempunyai gugus fungsi.
Dengan R dan R’ adalah gugus alkil.
Salah satu metode untuk menghasilkan ester adalah dengan mereaksikan asam karboksilat dengan alkohol pada suasana asam.
Laboratorium Kimia Dasar
LIDA USU 7
ALAT DAN BAHAN ALAT
- Gelas ukur - Pipet tetes - Tabung reaksi - Rak tabung reaksi - Penangas air - Kapas - Korek api - Kaki tiga - Kawat kasa - Bunsen
- Penjepit tabung - Vortex
BAHAN
- C2H5OH absolut - C4H9OH
- CH3COOH glasial - C6H5COOH - H2SO4 6 M - Aquadest
PROSEDUR PERCOBAAN
1. Sintesis dan identifikasi senyawa ester - Disediakan dua buah tabung reaksi
- Dimasukkan 1 ml C2H5OH absolut kedalam tabung reaksi - Ditambahkan 1 ml CH3COOH glasial
- Ditambahkan 10 tetes H2SO4 6 M - Ditutup dengan kapas
- Dipanaskan dalam penangas air selama ± 15 menit
- Diangkat dari penangas air dan dicium aroma dari kapas (identifikasi senyawa ester) - Dilakukan percobaan yang sama untuk :
C4H9OH + CH3COOH C4H9OH + C6H5COOH
C2H5OH absolut + C6H5COOH
2. Sintesis dan identifikasi senyawa ester dengan variasi volume alkohol - Disediakan dua buah tabung reaksi
- Dimasukkan 4 ml C2H5OH absolut kedalam tabung reaksi
Laboratorium Kimia Dasar
LIDA USU 8
- Ditambahkan 3 ml CH3COOH glasial - Ditambahkan H2SO4 6 M
- Ditutup dengan kapas
- Dipanaskan dalam penangas air selama ± 15 menit
- Diangkat dari penangas air dan dicium aroma dari kapas (identifikasi senyawa ester) - Diulagi percobaan yang sama untuk variasi penambahan C2H5OH absolut sebanyak 5 ml,
dan 6 ml
3. Sintesis dan identifikasi senyawa ester dengan variasi volume asam karboksilat - Disediakan dua buah tabung reaksi
- Dimasukkan 3 ml C2H5OH absolut kedalam tabung reaksi - Ditambahkan 4 ml CH3COOH glasial
- Ditutup dengan kapas
- Dipanaskan dalam penangas air selama ± 15 menit
- Diangkat dari penangas air dan dicium aroma dari kapas (identifikasi senyawa ester) - Diulangi percobaan yang sama untuk variasi penambahan CH3COOH glasial
DATA PERCOBAAN
1. Sintesis dan identifikasi senyawa ester
No Perlakuan Pengamatan
1
2
3
4
1 ml C2H5OH absolut + 1 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
1 ml C2H5OH absolut + 1 ml C6H5COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
1 ml C4H9OH absolut + 1 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
1 ml C4H9OH absolut + 1 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
Laboratorium Kimia Dasar
LIDA USU 9
2. Sintesis dan identifikasi senyawa ester dengan variasi volume alkohol
No Perlakuan Pengamatan
1
2
3
4 ml C2H5OH absolut + 3 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
5 ml C2H5OH absolut + 3 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
6 ml C2H5OH absolut + 3 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
3. Sintesis dan identifikasi senyawa ester dengan variasi volume asam karboksilat
No Perlakuan Pengamatan
1
2
3
3 ml C2H5OH absolut + 4 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
3 ml C2H5OH absolut + 5 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
3 ml C2H5OH absolut + 6 ml CH3COOH glasial + 10 tetes H2SO4 6 M ditutup dengan kapas lalu dipanaskan
PERHITUNGAN -
TUGAS
1. Jelaskan pembagian gugus fungsi!
2. Jelaskan metode-metode pembentukan senyawa ester!
3. Jelaskan pembagian senyawa ester
Laboratorium Kimia Dasar
LIDA USU 10
TITRASI ASAM BASA
TUJUAN PERCOBAAN
- Untuk mengetahui cara menstandarisasi larutan penitrasi - Untuk mengetahui prinsip percobaan
- Untuk mengetahui konsentrasi sampel
LATAR BELAKANG
Suatu penerapan penting dari stokiometri di laboratorium adalah analisa unsure-unsur untuk menentukan komposisinya. Pengukuran yang didasarkan pada massa dinamakan gravimetric, dan pengukuran yang dilakukan berdasarkan volume larutan dinamakan volumetric atau titrimetri. Dalam percobaan ini teknik analisis volumetrik diterapkan pada analisa contoh yang mengandung asam.
Pada analisa volumetrik, contoh yang dianalisis ditempatkan dalam Erlenmeyer dan kemudian disiapkan untuk analisis. Contoh padat dilarutkan terlebih dahulu. Selanjutnya larutan direaksikan dengan suatu larutan penitrasi yang diketahui, maka konsentrasi dari zat yang dianalisis dapat ditentukan. Suatu larutan yang konsentrasinya diketahui secara tepat dinamakan larutan standart, dan proses pengukuran konsentrasi larutan ini dinamakan standarisasi.
Reaksi yang dapat dipakai untuk analisa volumetric ini harus mempunyai sifat-sifat penting anatara lain stoikiometri yang baik,tidak memberikan reaksi samping (artinya, hanya bahan yang dianalisa yang beraksi dengan titran), laju reaksi tinggi, tidak ada gangguan yang berarti, dan ada alat untuk mendeteksi titik ekivalen titrasi. Jika reaksi kekurangan satu atau dua sifat tadi, titrasi ,masih dapat dilangsungkan asalkan tepat dilakukan dengan hati-hati.
Beberapa jenis reaksi dapt digunakan untuk titrasi yaitu reaksi pengendapan, reduksi dan asam-basa, yang semuanya dapat berlangsung secara sempurna. Pada percobaan ini akan digunakan reaksi asam basa, untuk menstandarisasi contoh yang mengandung asam. Singkatnya, reaksi asam basa atau netralisasi disebabkan oleh perpindahan proton (ion H+) dari asam ke basa.
Laboratorium Kimia Dasar
LIDA USU 11
ALAT DAN BAHAN ALAT
- Erlenmeyer 100 ml - Pipet volume 10 ml
- Buret 50 ml
- Statif dan klem
- Gelas ukur 10 ml - Labu takar 100 ml - Botol aquadest
- Beaker glass 250 ml - Pipet tetes
- Bola karet - Buret digital BAHAN
- H2C2O4(aq) 0,1 M
- NaOH(aq) 0,1 M
- Indikator Phenolphtalein(aq)
- Sampel
PROSEDUR PERCOBAAN
A. Standarisasi Larutan NaOH 0,1 N - Dipipet 10 ml H2C2O4 0,1 N - Dimasukkan kedalam Erlenmeyer
- Ditambahkan 3 tetes indikator phenolphthalein
- Dititrasi dengan larutan standar NaOH 0,1 N sehingga terjadi perubahan warna menjadi merah lembayung (merah rose)
- Dicatat volume NaOH yang dipakai
- Diulangi perlakuan yang sama sebanyak tiga kali B. Standarisasi Larutan HCl 1 N
- Dipipet 10 ml NaOH 0,1 N - Dimasukkan kedalam Erlenmeyer - Ditambahkan 3 tetes indikator BTB
- Dititrasi dengan larutan standar HCl 1 N sehingga terjadi perubahan warna menjadi kuning kehijauan
- Dicatat volume HCl yang dipakai
- Diulangi perlakuan yang sama sebanyak tiga kali
Laboratorium Kimia Dasar
LIDA USU 12
C. Standarisasi Sampel Alkalimetri - Dipipet 10 ml sampel
- Dimasukkan kedalam labu takar 100ml
- Diencerkan dengan aquadest sampai garis batas - Dihomogenkan
- Dipipet 10 ml sampel yang diencerkan dari labu takar - Dimasukkan ke dalam erlenmeyer
- Ditambahkan 3 tetes indikator phenolphtalein
- Dititrasi dengan NaOH 0,1 N sehingga terjadi perubahan warna menjadi merah lembayung
- Dicatat volume NaOH yang terpakai
- Diulangi perlakuan yang sama sebanyak tiga kali D. Standarisasi Sampel Asidimetri
- Dipipet 10 ml sampel
- Dimasukkan kedalam labu takar 100ml
- Diencerkan dengan aquadest sampai garis batas - Dihomogenkan
- Dipipet 10 ml sampel yang diencerkan dari labu takar - Dimasukkan ke dalam erlenmeyer
- Ditambahkan 3 tetes indikator BTB
- Dititrasi dengan HCl 1 N sehingga terjadi perubahan warna menjadi kuning kehijauan - Dicatat volume HCl yang terpakai
- Diulangi perlakuan yang sama sebanyak tiga kali DATA PERCOBAAN
a. Standarisasi larutan NaOH 0,1 M
No Volume H2C2O4 0,1 N ( ml) Phenolphtalein (tetes) Volume NaOH 0,1 N (ml)
1. 10 3 V1 =
2. 10 3 V2 =
3. 10 3 V3 =
Vrata-rata = b. Standarisai Larutan HCl 1 N
No Volume NaOH 0,1 N ( ml) BTB (tetes) Volume HCl 1 N (ml)
1. 10 3 V1 =
2. 10 3 V2 =
3. 10 3 V3 =
Vrata-rata =
Laboratorium Kimia Dasar
LIDA USU 13
c. Standarisasi Sampel Alkalimetri
No Volume Sampel ( ml) Phenolphtalein (tetes) Volume NaOH 0,1 N (ml)
1. 10 3 V1 =
2. 10 3 V2 =
3. 10 3 V3 =
Vrata-rata =
d. Standarisasi Sampel Asidimetri
No Volume Sampel ( ml) BTB (tetes) Volume HCl 1 N (ml)
1. 10 3 V1 =
2. 10 3 V2 =
3. 10 3 V3 =
Vrata-rata =
TUGAS
1. Jelaskan prinsip percobaan!
2. Jelaskan syarat titrasi yang baik!
3. Jelaskan pengertian dari : a. Titrasi
b. Titran c. Titrat d. Indikator e. Titik Akhir f. Titik Ekivalen g. Larutan Standar
Laboratorium Kimia Dasar
LIDA USU 14
TITRASI REDOKS
TUJUAN PERCOBAAN
- untuk mengetahui beberapa reaksi redoks - untuk mengetahui kadar As2O3 dari racun tikus - untuk mengetahui prinsip titrasi redoks
LATAR BELAKANG
Oksidasi adalah suatu proses yang mengakibatkan hilangnya satu elektron atau lebih dari dalam zat (atom, ion atau molekul). Bila suatu unsur dioksidasi, keadaan oksidasinya berubah keharga yanng lebih positif. Suatu zat pengoksidasi adalah zat yang memperoleh elektron, dan dalam proses itu zat itu direduksi. Proses ini berlaku juga untuk proses dalam zat padat, lelehan atau gas.
Reduksi sebaliknya adalah suatu proses yanng mengakibatka diperolehnya satu elektron atau lebih oleh zat. Bila suatu unsur direduksi, keadaan oksidasi menjadi lebih negatif. Jadi suatu zat pereduksi adalah zat yang kehilangan elektron, dalam proses itu zat ini dioksidasi.
ALAT DAN BAHAN ALAT
- Buret
- Statif dan klem - Beaker glass - Erlenmeyer - Termometer - Bunsen - Kaki tiga - Kawat kasa - Pipet volume - Pipet tetes - Botol aquadest - Gelas ukur - Korek api - Spatula - Corong - Kertas saring
Laboratorium Kimia Dasar
LIDA USU 15
- Bola karet - Plastik - Karet BAHAN
- KmnO4 0,1N - H2C2O4 0,1N - H2SO4 2M - KOH 0,1M - Sampel - Aquadest
PROSEDUR PERCOBAAN A. Standarisasi KMnO4
- Dipipet 10 ml H2C2O4
- Dimasukkan kedalam erlenmeyer - Ditambahkan 5 ml H2SO4 2 M - Dipanaskan pada suhu 60-70oC
- Dititrasi dengan KmnO4 hingga berubah warna menjadi merah rose - Dicatat volume KMnO4 yang terpakai
- Diulangi percobaan sebanyak 3 kali
B. Penentuan kadar sampel - Ditimbang 5 gram sampel
- Dimasukkan kedalam erlenmeyer dan dilarutkan dengan 50 ml KOH 0,1M - Didiamkan, disaring
- Dipipet sebanyak 10 ml
- Dimasukkan kedalam erlenmeyer - Ditambahkan 10 ml H2SO4 2 M - Dipanaskan pada suhu 60-70oC
- Dititrasi dengan KMnO4 hingga berubah warna menjadi merah rose - Dicatat volume KMnO4 yang terpakai
- Diulangi percobaan sebanyak 3 kali
Laboratorium Kimia Dasar
LIDA USU 16
DATA PERCOBAAN A. Standarisai KMnO4
No Perlakuan Pengamatan
1 2 3 4 5 6 7
dipipet 10 ml H2C2O4
dimasukkan kedalam erlenmeyer ditambahkan 5 ml H2SO4 2 M dipanaskan pada suhu 60-70oC
dititrasi dengan KMnO4 hingga berubah warna menjadi merah rose
dicatat volume KMnO4 yang terpakai diulangi percobaan sebanyak 3 kali
B. Penentuan kadar sampel
No Perlakuan Pengamatan
1 2 3 4 5 6 7 8 9 10 11
ditimbang 5 gram sampel
dimasukkan kedalam erlenmeyer dan dilarutkan dengan 50 ml KOH 0,1M
didiamkan, disaring dipipet sebanyak 10 ml
dimasukkan kedalam erlenmeyer ditambahkan 10 ml H2SO4 2 M dipanaskan pada suhu 60-70oC
dititrasi dengan KMnO4 hingga berubah warna menjadi merah rose
dicatat volume KMnO4 yang terpakai diulangi percobaan sebanyak 3 kali
Perhitungan
A.menentukan konsentrasi KMnO4
V1 N1 = V2 N2
V1 = Volume H2C2O4
V2 = Volume KMnO4
N1 = Konsentrasi H2C2O4
N2 = Konsentrasi KMnO4
B. menentukan kadar sampel - konsentrasi sampel dalam KOH
V1 N1 = V2 N2
V1 = Volume KMnO4
V2 = Volume sampel dalam KOH N1 = Konsentrasi KMnO4
N2 = Konsentrasi sampel dalam KOH
Laboratorium Kimia Dasar
LIDA USU 17
- kadar sampel (berat sampel)
N = n
x V Mr
g 1000
N = Konsentrasi sampel dalam KOH g = Berat sampel
V = Volume KOH n = Valensi sampel
TUGAS
1. Jelaskan pengertian dari : a. Reaksi kimia
b. Titrasi c. Titran d. Titrat e. Reduksi f. Oksidasi g. Reduktor h. Oksidator
2. Jelaskan pembagian titrasi!
3. Tuliskan aturan bilangan oksidasi!
Laboratorium Kimia Dasar
LIDA USU 18
ADSORPSI LARUTAN
TUJUAN PERCOBAAN
- Untuk mengetahui cara kerja arang aktif
- Untuk mengetahui konsentrasi asam asetat sebelum dan sesudah penambahan arang aktif - Untuk mengetahui pengaruh penambahan arang aktif terhadap perubahan warna pada
sampel
LATAR BELAKANG
Kompetisi antara molekul-molekul zat tertentu dan pelarut untuk teradsorpsi menimbulkan suatu proses dinamik dimana molekul-molekul zat terlarut dan molekul-molekul pelarut secara kontinue mengadakan kontak dengan mata permukaan adsorben tertahan beberapa saat dan kemudian masuk kembali pada fase bergerak pada saat teradsorbsi, zat terlarut dipaksa untuk berpindah aliran maju fase bergerak, akibatnya hanya molekul-molekul dengan afinitas yang besar terhadap adsorben akan secara selektif tertahan.
Gaya-gaya intamolekul terjadi karena sifat alamiah permukaan suatu diskontinue ke dalam sistem pada setiap bidang antar muka terdapat efek energi permukaan pada gaya london yang relatif lemah terbentuk antara semua permukaan dengan setiap molekul teradsorbsi ataupun antara permukaan yang bersifat nonpolar dan molekul polar yang teradsorbsi.
ALAT DAN BAHAN ALAT
- Buret 50 ml - Gelas ukur 25 ml - Pipet volume 10 ml - Erlenmeyer 100 ml - Gelas beaker 100 ml - Corong
- Statif dan klem - Botol aquadest - Pipet tetes - Plastik dan karet - Kertas saring
Laboratorium Kimia Dasar
LIDA USU 19
- Neraca analitis - Autoklaf - Sieve shaker BAHAN
- CH3COOH(aq) 1,0087 N - CH3COOH(aq) 2,1749 N - CH3COOH(aq) 3,1855 N - Arang aktif(s)
- Indikator PP(aq)
- NaOH(aq) 1 N - Aquadest(l)
- Sampel
PROSEDUR PERCOBAAN a. CH3COOH
- Dimasukkan 30 ml asam asetat ke dalam erlenmeyer 100 ml - Ditambahkan 1 gr arang aktif
- Ditutup dengan plastik dan karet - Dikocok 15 menit
- Disaring
- Dimasukkan masing-masing 10 ml filtrat ke dalam erlenmeyer - Ditetesi 3 tetes indikator PP ke dalam masing-masing erlenmeyer - Dititrasi dengan NaOH
- Dicatat volume NaOH yang dipakai
- Diulangi prosedur yang sama untuk variasi konsentrasi CH3COOH yang lain b. Sampel
- Dimasukkan 20 ml sampel ke dalam masing-masing erlenmeyer - Erlenmeyer I ditambahkan 0,5 g arang aktif
- Erlenmeyer II ditambahkan 1 g arang aktif - Ditutup dengan plastik dan karet
- Dikocok selama 15 menit - Disaring
- Diamati perubahan warna yang terjadi - Dicatat hasilnya
Laboratorium Kimia Dasar
LIDA USU 20
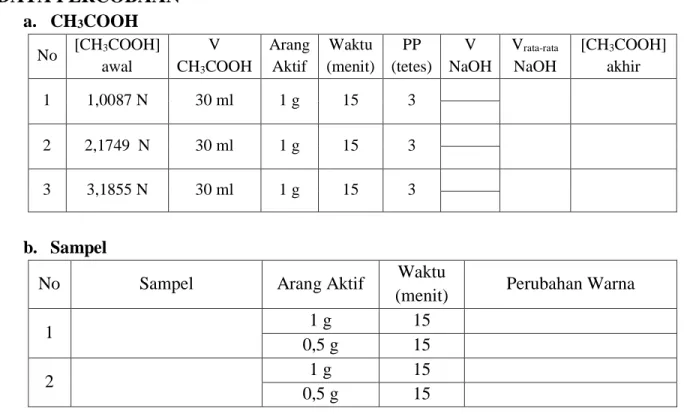
DATA PERCOBAAN a. CH3COOH
No [CH3COOH]
awal
V CH3COOH
Arang Aktif
Waktu (menit)
PP (tetes)
V NaOH
Vrata-rata
NaOH
[CH3COOH]
akhir
1 1,0087 N 30 ml 1 g 15 3
2 2,1749 N 30 ml 1 g 15 3
3 3,1855 N 30 ml 1 g 15 3
b. Sampel
No Sampel Arang Aktif Waktu
(menit) Perubahan Warna
1 1 g 15
0,5 g 15
2 1 g 15
0,5 g 15
PERHITUNGAN
1. Menentukan konsentrasi CH3COOH akhir (setelah adsorpsi) V1 N1 = V2 N2
V1 = Volume CH3COOH yng dititrasi V2 = Volume NaOH yang terpakai N1 = Konsentrasi CH3COOH akhir N2 = Konsentrasi CH3COOH 2. Menentukan nilai Y
Y = log x t/m
X = konsentrasi CH3COOH akhir t = waktu pengocokan (menit) m = massa arang aktif
Grafik Metode biasa X vs Y
X = konsentrasi CH3COOH akhir Y = log x t/m
No X Y
Laboratorium Kimia Dasar
LIDA USU 21
Penentuan garis regresi
No X Y XY X2
1 2 3 Σ
X = konsentrasi CH3COOH akhir Y = log x t/m
a =
X2 X
2
n
Y X XY
n
b =
2 2
2
X X
n
XY X
Y X n
Garis regresi (y baru) Y = ax + b
X = konsentrasi CH3COOH
No x Y
1 2 3
TUGAS
1. Jelaskan pengertian dari : a. Adsorpsi
b. Absorpsi c. Adsorben d. Adsorbat
2. Tuliskan syarat-syarat adsorben yang baik!
3. Jelaskan tahap pembuatan arang aktif!
Laboratorium Kimia Dasar
LIDA USU 22
PEMISAHAN KOMPONEN DARI CAMPURAN
TUJUAN PERCOBAAN
- Untuk mengetahui harga Rf dari masing-masing sampel
- Untuk mengetahui kandungan senyawa yang terdapat dalam suatu sampel berdasarkan harga Rf
- Untuk mengetahui faktor-faktor yang mempengaruhi harga Rf
LATAR BELAKANG
Campuran merupakan kumpulan berbagai molekul,zat, ion, elektron, dan partikel lainnya yang ukurannya berbeda satu sama lain. Untuk memperoleh zat atau unsur murni dari suatu campuran dapat dilakukan proses pemisahan. Proses pemisahan digunakan untuk mendapatkan dua atau lebih produk yang lebih murni dari suatu campuran kimia.
Untuk memisahkan campuran dapat dilakukan dengan beberapa cara antara lain:
- Ekstraksi yaitu proses pemisahan komponen zat dari suatu campuran berdasarkan perbedaan kelarutan
- Dekantasi yaitu proses pemisahan cairan dari padatanya dengan menuangkan supernatan secara perlahan
- Kristalisasi yaitu pemisahan zat padat dari campuranya berdasarkan kelarutanya dengan pembentukan molekul kristal
- Kromatografi adalah pemisahan komponen dalam suatu campuran yang didasarkan pada perbedaan migrasi suatu zat antara dua fase yang berbeda.
Pada percobaan ini menggunakan metode kromatografi salah satunya kromatografi kertas adalah kromatografi yang menggunakan kertas selulosa murni yang mempunyai afinitas besar terhadap air atau pelarut polar lainnya. Kromatografi kertas digunakan untuk memisahkan campuran menjadi komponennya- komponennya dengan prinsip “ Like Dissolve Like” bahwa senyawa yang bersifat polar akan larut dalam pelarut yang bersiafat polar sedangkan senyawa yang bersifat non polar akan larut dalam pelarut non polar.
Laboratorium Kimia Dasar
LIDA USU 23
ALAT DAN BAHAN ALAT
- Chamber - Tutup kaca
- Beaker glass 250 mL - Botol akuades - Pipa kapiler - Benang
- Kertas Saring Whatmann no.1 ukuran 15 x 10 cm - Gunting
- Penggaris - Stop Watch - Bunsen - Sentrifuge BAHAN
- BAW ( Butanol : Asetat : Water ) - Akuades
- Sampel
PROSEDUR PERCOBAAN
- Dibersihkan Chamber dengan akuades kemudian dikeringkan
- Kemudian diisi chamber dengan pelarut BAW sampai ketinggian ± 1 cm
- Dijenuhkan chamber dengan cara menutup chamber dan digoncang-goncang selama ± 10 menit
- Diambil kertas saring Whatmann dan digunting dengan ukuran 15 x 10 cm kemudian dilipat
- Dimasukkan benang ke dalam jarum jahit yang kemudian dijahit kedalam kertas saring - Diukur 1 cm dari ujung bagian atas dan diukur 2 cm dari bagian bawah kertas saring - Ditotolkan sampel pada bagian batas bawah kertas saring
- Dimasukkan ke dalam chamber yang sudah dijenuhkan lalu chamber ditutup rapat - Diamati pergerakan noda dan pelarutnya hingga 20 menit
- Diambil kertas saring dari camber lalu dikeringkan
- Diukur jarak noda yang ditempuh sampel dan jarak yang ditempuh pelarut - Dicatat hasil dan dihitung nilai Rf nya.
Laboratorium Kimia Dasar
LIDA USU 24
DATA PERCOBAAN
No Pengamatan
Jarak yang ditempuh noda Jarak yang ditempuh pelarut Rf
TUGAS
1. Jelaskan pengertian dari : a. Kroma
b. Kromatografi c. Kromatograf d. Fase diam e. Fase gerak f. Eluen
2. Jelaskan prinsip dari kromatografi kertas
3. Jelaskan faktor-faktor yang mempengaruhi harga Rf
4. Jelaskan metode penampakan bercak
Laboratorium Kimia Dasar
LIDA USU 25
SAPONIFIKASI ESTER
TUJUAN PERCOBAAN
- Untuk mengetahui sifat fisika dan kimia dari minyak dan lemak - Untuk mengetahui cara kerja sabun
- Untuk mengetahui perbedaan minyak dan lemak
LATAR BELAKANG
Asam karboksilat dapat bereaksi dengan basa menghasilkan garam karboksilat dan air.
Asam Karboksilat Garam Karboksilat
Pada umumnya garam larut dalam air tetapi di dalam asam sering tidak larut. Reaksi dengan natrium karbonat (Na2CO3) juga membentuk garam-garam karboksilat, karbondioksida dan air. Hidrolisis suatu ester dalam pelarut basa disebut juga saponifikasi. Hasil rekasi tersebut adalah garam dan alkohol.
Ester Garam Karboksilat Alkohol
Reaksi saponifikasi pada umumnya mudah diikuti, teristimewa pada ester yang tidak larut dalam air sebab garam dan alkohol mempunyai bobot molekul kecil umumnya tidak larut.
Lapisan ester secara bertahap berkurang, penambahan asam encer ke dalam larutan garam karboksilat mengubah garam menjadi asam karboksilat.
Garam Karboksilat Asam Karboksilat
R C
O OH
Na+ OH-
+ R C
O O-Na
H2O +
R C
O
OR’ + Na+ OH- R C O
O-Na + R’OH
R C
O ONa
+ HCl R C
O OH
Na+Cl- +
Laboratorium Kimia Dasar
LIDA USU 26
C O
C17H35
C O
C17H35
Pengertian saponifikasi asam lemak adalah reksi penyabunan asam lemak dengan basa yang menghasilkan sabun dan gliserol. Asam lemak dihasilkan oleh hidrolisa lemak atau minyak yang dalam percobaan ini dilakukan pemanasan. Reaksi penyabunan adalah sebagai berikut:
Lemak Basa Kuat Sabun Giserol
ALAT DAN BAHAN ALAT
- Beaker glass 250 ml - Gelas ukur 25 ml - Gelas ukur 10 ml - Tabung reaksi
- Rak tabung reaksi - Botol aquadest - Bunsen
- Kaki tiga - Kawat kasa - Spatula
- Kertas Saring Biasa - Pipet tetes
- Batang pengaduk - Corong Kaca - Hot Plate stirer
3Na+ OH-
+ 3C17H35 C
O ONa
+
C O
C17H35
CH2 O
CH O
CH2 O
CH2 OH
CH OH
CH2 OH
Laboratorium Kimia Dasar
LIDA USU 27
BAHAN
- Minyak (l)
- Aquadest (l)
- MgSO4(aq) 1M
- CaCl2(aq) 1M
- Pb(NO3)2 (aq) 1M
- NaOH(l) 3M
- NaCl(l) jenuh - Etanol Absolute (aq)
PROSEDUR PERCOBAAN A.Saponifikasi
- Dimasukkan 5 ml minyak kedalam beaker glass
- Dimasukkan 20 ml etanol absolute dan 15 ml NaOH 3M - Dipanaskan diatas bunsen hingga terbentuk endapan - Didinginkan
- Ditambahkan 25 ml larutan NaCl jenuh
- Dipisahkan antara sabun dan gliserol dengan kertas saring B.Test uji
- Dimasukkan padatan sabun ke dalam empat tabung reaksi
- Ditambahkan 3 ml aquadest kedalam masing-masing tabung reaksi
Tabung I : ditambahkan Pb(NO3)2 1M sebanyak 1 ml
Tabung II : ditambahkan MgSO4 1M sebanyak 1 ml
Tabung III : ditambahkan CaCl2 1M sebanyak 1 ml
Tabung IV : -
- Dikocok dan diamati buih yang terbentuk - Dicatat hasilnya
Laboratorium Kimia Dasar
LIDA USU 28
DATA PERCOBAAN
A.Pembuatan Sabun
No Perlakuan Pengamatan
1 5 ml minyak
2 Ditambahkan 20 ml etanol absolute + 15 ml NaOH 3M 3 Dipanaskan diatas bunsen
4 Ditambahkan 25 ml larutan NaCl jenuh
5 Dipisahkan sabun dan gliserol dengan kertas saring B.Test Uji Sabun
No Perlakuan Pengamatan
1 Sabun + air + 1ml Pb(NO3)2 1M + dikocok 2 Sabun + air + 1ml MgSO4 1M + dikocok 3 Sabun + air + 1ml CaCl2 1M + dikocok 4 Sabun + air + dikocok
Keterangan: (-) tidak ada buih (+) buih sedikit (++) buih banyak
(+++) buih sangat banyak PERHITUNGAN
- TUGAS
1. Jelaskan perbedaan Minyak dan Lemak
2. Jelaskan pembagian kesadahan air dan cara mengatasinya
3. Tuliskan dan Jelaskan Pembagian Asam Lemak beserta contohnya 4. Tuliskan dan jelaskan sifat fisika dan sifat kimia dari minyak dan lemak 5. Jelaskan cara kerja sabun dalam mengangkat kotoran
Laboratorium Kimia Dasar
LIDA USU 29
UJI ZAT ADITIF PADA MAKANAN
TUJUAN PERCOBAAN
- Untuk mengetahui jenis-jenis zat aditif
- Untuk mengetahui uji kualitatif zat aditif pada makanan - Untuk mengetahui kandungan zat aditif pada sampel LATAR BELAKANG
Menurut peraturan Menteri Kesehatan RI No. 329/MenKes/PER/XII/, yang dimaksud dengan aditif makanan adalah bahan yang ditambahkan dan dicampurkan sewaktu pengolahan makanan untuk meningkatkan mutu. Termasuk kedalamnya adalah pewarna, penyedap rasa dan aroma, pemantap, antioksidan, pengawet, pengemulsi, anti gumpal, pemucat, dan pengental.
Pada umumnya bahan tambahan dapat dibagi menjadi 2 bagian besar yaitu :
- Aditif sengaja, yaitu aditif yang diberikan dengan sengaja dengan maksud dan tujuan tertentu, misalnya untuk meningkatkan konsistensi, nilai gizi, cita rasa, mengendalikan keasaman atau kebasaan, memantapkan bentuk dan rupa dan lain sebagainya.
- Aditif tidak sengaja, yaitu aditif yang terdapat dalam makanan dalam jumlah sangat kecil sebagai akibat dari proses pengolahan.
Bila dilihat dari asalnya, aditif dapat berasal dari sumber alamiah seperti lesitin, asam sitrat, dan lain sebagainya; dapat juga disintesis dari bahan kimia yang mempunyai sifat serupa dengan bahan alamiah yang sejenis, baik susunan kimia maupun sifat metabolismenya seperti misalnya betakaroten, asam askorbat, dan lain-lain. Pada umumnya bahan sintetik mempunyai kelebihan yaitu lebih pekat, lebih stabil, dan lebih murah. Walaupun demikian, ada kelemahannya, yaitu sering terjadi ketidaksempurmaan proses sehingga mengandung zat-zat yang berbahaya bagi kesehatan dan kadang-kadang bersifat karsinogenik yang dapat merangsang terjadinynya kanker pada hewan dan manusia.
Laboratorium Kimia Dasar
LIDA USU 30
ALAT DAN BAHAN ALAT
- Tabung Reaksi - Rak Tabung Reaksi - Pipet Tetes
- Cawan Porselen - Alu dan Lumpang - Korek Api
- Hotplate
- Penjepit Tabung - Beaker Glass - Pisau Cutter - Botol Aquadest
BAHAN
- Aquadest (l)
- NH4OH (aq) 12%
- FeCl3(aq) 0,5%
- Etanol (aq) 96%
- H2SO4(aq) 80%
- KMnO4(aq) 1 M
- Na2B407.10H20 (s)
PROSEDUR PERCOBAAN A. Uji Kualitatif Asam Benzoat
- Dipotong-potong sampel
- Dimasukkan kedalam tabung reaksi - Ditambahkan aquadest secukupnya
- Ditambahkan NH4OH (aq) 12 % dan FeCl3 0,5 % - Dipanaskan
- Diamati perubahan yang terjadi hingga terbentuk endapan kuning kecoklatan atau menghasilkan warna kuning kecoklatan
- Dicatat hasilnya
B. Uji Kualitatif Asam Salisilat - Dipotong-potong sampel
- Dimasukkan kedalam tabung reaksi - Ditambahkan aquadest secukupnya - Ditambahkan FeCl3 0,5 %
Laboratorium Kimia Dasar
LIDA USU 31
- Dipanaskan
- Diamati perubahan yang terjadi hingga menghasilkan warna kuning kecoklatan - Dicatat hasilnya
C. Uji Kualitatif Formalin
- Dihaluskan sampel dengan alu dan lumpang - Dimasukkan kedalam beaker glass
- Ditambahkan aquadest secukupnya - Dihomogenkan
- Didekantasi filtrat sebanyak 2 ml kedalam tabung reaksi - Ditambahkan 1 tetes KMnO4 1 N
- Dipanaskan
- Diamati perubahan yang terjadi hingga menghasilkan warna bening - Dicatat hasilnya
D. Uji Kualitatif Boraks - Dipotong-potong sampel
- Dimasukkan kedalam cawan porselen - Diteteskan H2SO4(aq) 80% secukupnya - Ditambahkan etanol (aq) 96 % secukupnya - Dibakar dengan nyala api
- Diamati perubahan yang terjadi hingga terbentuk warna hijau nyala - Dicatat hasilnya
DATA PERCOBAAN
No Nama Sampel Pereaksi
Uji Benzoat Uji Salisilat Uji Formalin Uji Boraks
1. Sampel
Keterangan:
+ : terdapat bahan pengawet -: tidak terdapat bahan pengawet
PERHITUNGAN -
Laboratorium Kimia Dasar
LIDA USU 32
TUGAS
1. Gambarkan struktur dari asam benzoat, asam salisilat, formalin dan boraks!
2. Tuliskan sifat-sifat asam benzoat, asam salisilat, formalin dan boraks!
3. Tuliskan tujuan penambahan zat aditif pada makanan!
Laboratorium Kimia Dasar
LIDA USU 33
ANALISA MELALUI PENGENDAPAN (GRAVIMETRI)
TUJUAN PERCOBAAN
- Untuk mengetahui sifat-sifat dari kristal pada percobaan - Untuk mengetahui fungsi penambahan reagen
- Untuk mengetahui metode-mtode pembentukan kristal
LATAR BELAKANG
Analisa gravimetri adalah proses isolasi dan pengukuran berat suatu unsur atau senyawa tertentu. Bagian terbesar dari penetuan secara analisis gravimetri meliputi transformasi unsur atau radikal senyawa murni stabil yang dapat segera diubah menjadi bentuk senyawa yang dapat ditimbang dengan teliti. Berat unsur dihitung berdasarkan rumus senyawa dan berat atom unsur- unsur yang menyusunnya. Pemisahan senyawa atau unsur-unsur yang dikandung dilakukan dengan beberapa cara seperti metode pengendapan, metode penguapan, metode elektroanalisa atau berbagai macam metoda lainnya.
Metode gravimetric merupakan suatu cara analisa kimia kuantitatif yang didasarkan pada prinsip oembagian berat yang didapat dari proses pemisahan analit dari zat-zat lain dengan metode pengendapan. Zat yang telah diendapkan ini disaring dan dikeringkan serta ditimbang dan diusahakan endapan yang terbentuk harus murni.
Persyaratan berikut harus dipenuhi agar metode gravimetri itu berhasil
1. proses pemisahan hendaknya cukup sempurna sehingga kuantitas analit yang tak terendapkan secara analitis tak dapat dideteksi (biasanya 0,1 mg atau kurang dalam menentapkan penyusun utama dari suatu makro)
2. zat yang ditimbang hendaknya mempunyai susunan yang pasti dan hendaknya murni atau hampir murni. Bila tidak akan diperoleh hasil yang galat.
Laboratorium Kimia Dasar
LIDA USU 34
ALAT DAN BAHAN ALAT
- Bunsen - Kaki tiga - Kawat kasa - Corong
- Gelas ukur 25 ml - Beaker glass 250 ml - Cawan porselen - Spatula
- Korek api - Neraca analitik
- Kertas saring whattman no.42 - Pipet tetes
- Erlenmeyer
- Batang pengaduk kaca - Oven
- Sampel cup BAHAN
- BaCl2(aq) 1M - CH3COOH(aq)
- HCl(aq) 6M - H2SO4(aq) 6M - K2CrO4(aq) 0,2M - Aquadest(l)
PROSEDUR PERCOBAAN A. Pembuatan BaCrO4
- Dimasukkan 13 ml BaCl2 1 M ke dalam beaker glass
- Dimasukkan 16 ml K2CrO4 0,2M ke dalam beaker glass secara perlahan-lahan - Diendapkan hingga terbentuk 2 lapisan
- Dipanaskan larutan dinyala bunsen sambil diaduk hingga mendidih - Diangkat dan disaring
- Dikeringkan
- Dicuci endapan dengan aquadest dan CH3COOH - Dikeringkan
- Ditimbang endapan
Laboratorium Kimia Dasar
LIDA USU 35
B. Pembuatan BaSO4
- Dimasukkan 13 ml BaCl2 1 M ke dalam beaker glass
- Dimasukkan 16 ml H2SO4 0,2M ke dalam beaker glass secara perlahan-lahan - Diendapkan hingga terbentuk 2 lapisan
- Dipanaskan larutan dinyala bunsen sambil diaduk hingga mendidih - Diangkat dan disaring
- Dikeringkan
- Dicuci endapan dengan aquadest dan CH3COOH - Dikeringkan
- Ditimbang endapan C. Uji Kelarutan BaCrO4
- Dimasukkan endapan BaCrO4 ke dalam 3 tabung reaksi yaitu tabung I ditambahkan aquadest
tabung II ditambahkan HCl 6 N tabung III ditambahkan H2SO4 6 N - Dikocok
- Diamati perubahan yang terjadi - Dicatat hasilnya
D. Uji Kelarutan BaSO4
- Dimasukkan endapan BaSO4ke dalam 3 tabung reaksi yaitu tabung I ditambahkan aquadest
tabung II ditambahkan HCl 6 N tabung III ditambahkan H2SO4 6 N - Dikocok
- Diamati perubahan yang terjadi - Dicatat hasilnya
Laboratorium Kimia Dasar
LIDA USU 36
DATA PERCOBAAN A. Kristal BaCrO4
No Perlakuan Pengamatan
1. Ditimbang kertas saring 2. Dimasukkan 13 ml BaCl2 1 M 3. Dimasukkan 16 ml K2CrO4 0,2 M
4. Dipanaskan hingga mendidih sambil diaduk 5. Disaring
6. Dikeringkan
7. Dicuci endapan dengan aquadest dan CH3COOH 8. Dikeringkan
9. Ditimbang endapan 10. Uji kelarutan
Tabung I : kristal BaCrO4 + aquadest, diamati Tabung II : kristal BaCrO4 + HCl 6 M, diamati Tabung III : kristal BaCrO4 + H2SO4 6 M, diamati
B. Kristal BaSO4
No Perlakuan Pengamatan
1. Ditimbang kertas saring 2. Dimasukkan 13 ml BaCl2 1 M 3. Dimasukkan 16 ml H2SO4 0,2 M
4. Dipanaskan hingga mendidih sambil diaduk 5. Disaring
6. Dikeringkan
7. Dicuci endapan dengan aquadest dan CH3COOH 8. Dikeringkan
9. Ditimbang endapan 10. Uji kelarutan
Tabung I : kristal BaSO4 + aquadest, diamati Tabung II : kristal BaSO4 + HCl 6 M, diamati Tabung III : kristal BaSO4 + H2SO4 6 M, diamati TUGAS
1. Tuliskan sifat-sifat dari kristal yang terbentuk!
2. Jelaskan metode pembentukan kristal!
3. Tuliskan dan gambarkan bentuk-bentuk kristal!
4. Tuliskan fungsi penambahan reagen!