aku
x
Karakteristik yang berbeda dari cairan dibandingkan dengan padat dan gas:
F
z Kepadatan relatif tinggi (daripada gas) dan volume tetap z Memiliki mobilitas banyak urutan besarnya lebih besar dari
z Ketidakseimbangan gaya pada molekul permukaan yang menarik ke dalam cairan curah dan keluar ke fase uap yang berdampingan. Satuan: gaya/
panjang (dyne/cm, mN/m)
padatan .---- jadi, antarmuka yang melibatkan cairan umumnya berperilaku homogen.
Tegangan permukaan:
, erg/cm2 )
z Energi permukaan: jumlah kerja yang diperlukan untuk meningkatkan luas permukaan cairan dengan jumlah satuan. (satuan: J/m2
8.1 Sifat permukaan cairan: tegangan permukaan
Bab 8 Antarmuka Cair-Cair
sebagai oap f ilm Machine Translated by Google
Ringkasan ditemukan pada
Tabel 8.1 z Tegangan permukaan air (71-73 dyne/cm pada suhu kamar) lebih besar daripada pelarut organik. z Tegangan permukaan pelarut organik hanya berubah sedikit dengan panjang rantai (berat molekul). z Tegangan
antarmuka antara dua cairan: (a). dua cairan yang sangat tidak dapat bercampur ---- 12 12 - 12ÿ
Cair-gas > cair-cair, jadi
z Berbagai interaksi tarik-menarik dari dua fase melintasi
Tegangan antarmuka (kelebihan energi permukaan) dalam sistem cair-cair akan lebih rendah daripada antarmuka cair-gas.
antarmuka:
(b) sangat bercampur ----ÿ12 << 12 - 12ÿ
= (2ÿmkT)1/2 p0
z Dengan mobilitas molekul seperti itu, jelaslah bahwa permukaan cairan murni memberikan sedikit hambatan (dibandingkan dengan padatan) terhadap gaya-gaya yang mungkin bertindak untuk mengubah bentuknya.
(8.1) Permukaan atau antarmuka umumnya dianggap statis. Pada kenyataannya, pertukaran molekul yang cepat antara wilayah curah dan antarmuka, dan antara fase cair dan uap harus ada. Dalam keseimbangan, nilai tukar, adalah
p0 : kesetimbangan tekanan uap cairan.
z Peningkatan suhu peningkatan mobilitas permukaan 8.1.2 Efek Suhu pada Tegangan Permukaan
: koefisien lengket (0,03 – 1,0)
Air: < 3 ms
z Pada suhu mendekati suhu kritis, Tc, dari cairan, tegangan permukaan mendekati nol. (gaya kohesif yang bekerja antar molekul sangat kecil, uap tidak dapat mengembun)
= G/ÿA
Perkiraan waktu tinggal (25 C):
m : massa molekul
meningkatkan total entropi permukaan mengurangi energi bebas, G, dan mengurangi
8.1.1 Mobilitas permukaan
Tungsten: 1037 detik
ketegangan (Ramsey dan Shields):
z Persamaan empiris untuk memprediksi koefisien suhu permukaan Merkuri: 5 ms
Machine Translated by Google
r
r 0
0
r
Pr
(8.6) p = 2ÿ/r
Ketika r1 = r2 = r (bola)
Sebuah perbedaan tekanan akan dikembangkan di setiap permukaan melengkung.
Untuk setetes air dengan jari-jari 1 nm, pr = 3p0
(8.4)
Kondensasi molekul cair untuk membentuk tetesan yang sangat kecil z Perbedaan tekanan, p, di dalam gelembung (ÿp = pi – po) ----
z Untuk penurunan jari-jari r yang sangat kecil, tekanan uap (pr) lebih tinggi daripada di atas permukaan datar (p0).--- Persamaan Kelvin
akan terhambat oleh penghalang energi yang relatif tinggi karena kelengkungan.
Persamaan Young-Laplace:
8.1.3. Efek Kelengkungan Permukaan
RT ln (pr/p0) = 2ÿM/rÿ = 2ÿVm /r p = (1/r1 + 1/r2)
Po Machine Translated by Google
8.1.4 Tegangan Permukaan Dinamis
z Ketika permukaan baru dibuat, masuk akal untuk mengasumsikan bahwa jumlah waktu yang terbatas akan diperlukan untuk molekul baru untuk berdifusi ke permukaan dan untuk mengembalikan sistem ke kesetimbangan.
Tegangan permukaan permukaan baru tersebut disebut tegangan permukaan dinamis.
Machine Translated by Google
sulit untuk mengukur tegangan permukaan dalam waktu sesingkat itu.
z Solusi polimer mungkin membutuhkan waktu beberapa menit, jam, atau bahkan berhari-hari untuk dicapai Berat molekul rendah, konsentrasi curah tinggi laju difusi tinggi
keseimbangan terutama karena waktu yang lama yang dibutuhkan untuk rantai untuk berorientasi.
2
Waktu yang diperlukan untuk mencapai kesetimbangan setelah permukaan baru dibuat ---
Waktu untuk difusi molekul cair ke permukaan
(konstanta self-diffusion, 10-6 cm /s), sekitar urutan milidetik---
Orientasi molekul pada permukaan --- untuk molekul
asimetris (seperti alkohol atau surfaktan), tegangan permukaan akan menjadi fungsi dari orientasi molekul pada antarmuka.
Beberapa waktu terbatas diperlukan untuk terjadinya orientasi.
X: fraksi mol komponen 1 campuran = 1X + 2(1-X) ,
Biasanya, akan ada beberapa penyimpangan positif negatif dari linearitas. (Gbr. 8.5)
8.2 Tegangan Permukaan Solusi
Untuk campuran biner ideal, tegangan permukaan larutan mix :
Penambahan elektrolit anorganik selalu mengakibatkan peningkatan
z Untuk dua cairan yang dapat bercampur:
z Ketika komponen kedua adalah elektrolit anorganik
Kehadiran zat terlarut sering mengakibatkan pergantian tegangan permukaan. Paling umum, efeknya adalah menurunkan tegangan permukaan, namun efek sebaliknya juga ditemukan.
Machine Translated by Google
Efektivitas relatif ion dalam meningkatkan tegangan permukaan air umumnya mengikuti deret Hofmeister :
Li+ > Na+ > K+ dan F- > Cl- > Br- > I-
z Zat terlarut adalah bahan organik dalam larutan berair
dan tingkat penurunan tersebut tergantung pada: (1) kepala hidrofilik, (2). ekor hidrofobik, (3) kecenderungan bahan untuk menyerap pada antarmuka udara-air. ---- Gambar 8.7
Efek tersebut dihasilkan dari penataan molekul air di permukaan akibat fenomena penyelamatan.
Tegangan permukaan akan berkurang dengan penambahan zat terlarut organik
2 = -(1/RT)[dÿ/dlnc2]
kesetimbangan adsorpsi konstan)) Prinsip dasar --- persamaan adsorpsi Gibbs
(2) Aktivitas permukaan molekul surfaktan (KL:Langmuir 8.2.1. Surfaktan dan Pengurangan Tegangan Permukaan
(1) Konsentrasi berlebih permukaan,
Kurva konsentrasi tegangan permukaan yang khas ---- Gambar. 8.8
= o – nRTÿm ln (1 +KLC)
Tegangan permukaan cairan ditentukan oleh:
Persamaan Szyszkowski dari isoterm Langmuir:
Machine Translated by Google
Contoh: Oktan-air--- (gaya dispersi lemah): hingga 52 mN/m
surfaktan
z Dua aspek proses yang digunakan untuk membahas kinerja a Jika fase uap digantikan oleh fase terkondensasi yang memiliki
kerapatan molekul lebih tinggi dan lebih banyak kesempatan untuk interaksi menarik antar molekul di wilayah antarmuka, tegangan antarmuka akan
berkurang.z Setiap perubahan dalam sifat molekul yang menyusun permukaan akan diharapkan menghasilkan penurunan energi permukaan sistem.
--- aksi surfaktan dalam menurunkan tegangan permukaan.
Contoh: konsentrasi yang diperlukan untuk mengurangi tegangan permukaan sebesar 20 mN/m, C20.
Oktanol-air – (gugus kutub berinteraksi lebih spesifik dengan air): hingga 8,5 mN/m
(1) Konsentrasi surfaktan dalam fase curah yang diperlukan untuk menghasilkan efisiensi surfaktan reduksi tegangan permukaan
tertentu.
8.3 Adsorpsi Surfaktan dan Gibbs Monolayers
diperoleh efektivitas surfaktan.
cairan.
z Sebagian besar surfaktan tidak mempengaruhi tegangan permukaan bahan organik
(2) Pengurangan maksimum tegangan permukaan yang dapat
8.2.2 Pengaruh Kepadatan fase8.3.1. Efisiensi, Efektivitas, dan Struktur Surfaktan
--- konsep dasar yang mengatur adsorpsi molekul aktif permukaan
pada antarmuka. – Isoterm adsorpsi Gibbs.
molekul pelarut pada antarmuka.
Untuk kelompok kepala tertentu, efisiensi secara langsung tergantung pada panjang rantai hidrokarbon.
Efisiensi surfaktan: terkait langsung dengan termodinamika transfer rantai dari massal ke antarmuka.
(1). struktur surfaktan, (2). substitusi surfaktan untuk
CH3(CH2)nS, S: gugus kepala hidrofilik
karakter hidrofobik) Surfaktan dapat dinyatakan sebagai:
z Modifikasi rantai mengubah karakteristik surfaktan (perubahan -log (C)20 = pC20 = n(-A)/2.3RT +(-B)/2.3RT + K (8.9)
Atom karbon yang terletak di lokasi cabang berkontribusi kira-kira 2/3 lebih banyak ke karakter seperti yang terletak di rantai utama.
Sebuah cincin benzena biasanya memberikan kontribusi efek yang setara dengan ekspresi
z Efisiensi surfaktan dapat didefinisikan secara matematis dengan
Percabangan dalam kelompok hidrofobik menghasilkan pengurangan hidrofobisitas rantai surfaktan.
z Karakteristik surfaktan relatif terhadap:
terminal metil (CH3), dan kelompok kepala (S), masing-masing.
Gugus metilen yang terletak di antara dua gugus kutub memberikan kontribusi efek yang setara dengan 1/2 dari yang terletak di badan utama hidrofob.
A, B, K: istilah untuk energi bebas transfer metilen (CH2),
3,5 kelompok metilen.
Machine Translated by Google
pC20 = Atr + mBtr
(sebuah). batas kelarutan suhu Krafft (Tk) ---- surfaktan (ÿmin) akan ditentukan oleh salah satu dari dua faktor:
Nilai Ccmc / C20 yang besar menunjukkan bahwa surfaktan bebas yang tersedia digunakan lebih efektif.---Tabel 8.2
7-30 unit OE, menunjukkan efisiensi adsorpsi yang mengikuti hubungan kira- kira linier:
Btr: konstanta terkait dengan grup OE, m : jumlah unit OE dalam rantai POE
(b) konsentrasi misel kritis (CMC).
Atr: konstanta terkait dengan - CH2 –
harus digunakan di atas Tk nya.
8.3.2 Efektivitas Adsorpsi
-ÿÿcmc = (ÿo- 1) +2,3 nRTÿmlog(Ccmc/C1) (8.11) meningkat.
Efisiensi adsorpsi sedikit menurun seiring m
Hubungan khas vs. lnC linier, untuk konsentrasi di bawah CMC z Surfaktan nonionik polioksietilen (POE) dengan rata-rata
Mendekati jumlah maksimum surfaktan teradsorpsi, m, yang dicapai pada konsentrasi massal maksimum surfaktan bebas.
Ccmc/C20
Terkait dengan karakter penurunan tegangan permukaan maksimum, (ÿmin).
z Metode yang berguna untuk mengevaluasi efektivitas surfaktan adalah dengan:
Efisiensi dan efektivitas surfaktan mungkin tidak berjalan paralel.--- Secara umum diamati bahwa bahan yang menghasilkan penurunan tegangan permukaan yang signifikan pada konsentrasi rendah (yaitu, lebih efisien) kurang efektif (yaitu, memiliki m yang lebih kecil )
Machine Translated by Google
Untuk surfaktan ionik rantai lurusÆkelompok kepala selalu
mendominasi.---jadi, min hanya sedikit berbeda dengan panjang rantai hidrokarbon.(Tabel 8.2) min berhubungan dengan m, m meningkat min
menurun (efektifitas lebih tinggi)
Perubahan struktur lain yang memberikan efek yang jauh lebih dramatis:
(Gbr. 8.9)
Untuk surfaktan alkil normal, panjang rantai C8 – C20 memiliki efek kecil pada efektivitas.
ukuran molekul yang teradsorpsi.----baik bagian hidrofobik atau hidrofilik Jumlah maksimum molekul yang dapat dipasang ke area
tertentu (ÿm) tergantung pada luas penampang rantai hidrofobik atau kelompok kepala, mana yang lebih besar.
Dengan adanya elektrolit, tolakan elektrostatik antara molekul yang berdekatan berkurang area efektif menjadi lebih kecil sedikit peningkatan efektivitas surfaktan.
Tanda muatan pada surfaktan ionik hanya memiliki pengaruh kecil--- menunjukkan bahwa kebutuhan geometrik cukup konstan dari satu kelompok utama ke kelompok berikutnya.
Hidrofobik bercabang dan rantai ganda meningkat
bahan organik terfluorinasi memiliki sedikit interaksi dengan fase yang berdekatan, kekuatan pendorong tinggi untuk adsorpsi, efisiensi tinggi fluor memiliki energi permukaan yang sangat rendah, tegangan permukaan sangat rendah (efektivitas tinggi)
Contoh: R-N+ (CH3)3X- (surfaktan kationik)
kelompok hidrofobik peningkatan signifikan dalam efisiensi dan efektivitas
terkait dalam ukuran dan karakter muatan.
z Ketika atom fluor diganti dengan hidrogen dalam
Kelompok kepala mungkin tidak terlalu penting untuk hidrofil
Pengenalan kelompok kutub lain yang terletak jauh dari kelompok kepala (Gbr. 8.10) perubahan orientasi molekul teradsorpsi penurunan yang signifikan dari kedua efisiensi dan efektivitas.
Efek counterion: ikatan ion yang ketat mengurangi tolakan elektrostatik antara molekul yang teradsorpsi pengemasan surfaktan yang lebih ketat meningkatkan efisiensi dan efektivitas.
Machine Translated by Google
Perbandingan skema dari lapisan tunggal teradsorpsi (Gibbs monolayer) dan lapisan tunggal yang tidak larut (Langmuir monolayer)--- Gbr. 8.11
Untuk gambar yang tepat (monolayer tidak larut), penghalang akan menjauh dari sisi yang ditambahkan surfaktan (asam stearat).---- karena tekanan permukaan yang lebih tinggi.
fase cair pendukung dan pada dasarnya terisolasi di permukaan.
tidak bergerak
Monolayer tidak larut: untuk bahan yang memiliki kelarutan sangat rendah dalam
Untuk gambar kiri (Gibbs monolayer), L = R, penghalang B 8.4 Film Monomolekuler Tidak Larut
z Jika surfaktan disuntikkan ke satu sisi permukaan (seperti yang ditunjukkan pada Gambar 8.11) dan tunggu keseimbangan.
arti fisis: tekanan yang meluas yang diberikan oleh molekul tetangga
monolayer terhadap tegangan permukaan (berkontraksi) dari subfase cair murni. (Gbr. 8.12)
Momen-momen dipol dari gugus-gugus ini sebagian berorientasi pada antarmuka o : tegangan permukaan cairan pendukung murni
Hampir semua bahan aktif permukaan memiliki kelompok kepala kutub.
8.4.2 Potensi Permukaan 8.4.1 Tekanan permukaan (ÿ)
z Kurva area-tekanan (ÿ-A) dapat dibangun dengan kompresi area lapisan tunggal yang memungkinkan seseorang untuk menentukan tentang sifat film dan beberapa karakteristik molekuler dari bahan yang diadsorpsi
= o –
Machine Translated by Google
(8.13)
Dengan adanya film monolayer yang teradsorpsi (monolayer Gibbs atau monolayer Langmuir), sifat reologi (viskositas permukaan, elastisitas) dari permukaan dapat berubah.
8.4.3 Reologi Permukaan V = n cosÿ/ÿ
: momen dipol grup kepala (dikenal atau dapat diakses)
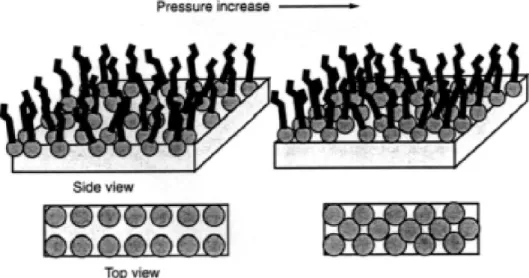
z Peningkatan viskositas permukaan yang dihasilkan oleh film teradsorpsi z Dengan meningkatnya kepadatan monolayer, mobilitas film berkurang. ----
Viskositas permukaan meningkat secara substansial dan film berperilaku seolah-olah dalam keadaan terkondensasi.
n: jumlah molekul dalam film (jumlah diketahui)
Persamaan (8.13) memungkinkan seseorang untuk memperkirakan sudut kemiringan (ÿ) dari dipol ke permukaan normal menyimpulkan orientasi seluruh molekul.
sebuah vakum)
: permitivitas film (konstanta dielektrik x permitivitas
bentuk persisten, menstabilkan emulsi, meredam gelombang permukaan.
z Potensi film permukaan yang diukur dapat digunakan untuk menyimpulkan informasi tentang orientasi molekul yang teradsorpsi. (tapi hanya kira-kira)
Dapat digunakan untuk mempelajari penetrasi lapisan tunggal yang tidak larut oleh bahan yang disuntikkan tepat di bawah permukaan. ( contoh:
lapisan tunggal: membran biologis, bahan penetrasi di bawah film: obat) Untuk monolayer campuran, potensi film permukaan dapat digunakan untuk memperkirakan homogenitas film, atau komposisi film (bila nilai film murni diketahui)
1. Film gas: molekul relatif berjauhan dan memiliki mobilitas permukaan yang signifikan, molekul pada dasarnya bertindak secara independen dengan orientasi acak, kompresibel.
3. Film terkondensasi (padat): molekul koheren, kaku, tidak dapat dimampatkan, padat, dengan viskositas permukaan tinggi dan sedikit mobilitas, berorientasi tegak lurus terhadap permukaan.
8.5 Keadaan Fisik Film Monolayer
Karakteristik film monolayer dapat dibedakan sebagai: keadaan gas, cair, dan padat:
2. Film cair (diperluas): setara dengan keadaan cair, molekul-molekulnya koheren dan padat, dengan kompresibilitas yang jauh lebih rendah dan orientasi yang lebih teratur daripada fase gas, kira-kira tegak lurus terhadap permukaan tetapi ekornya kurang padat.
Machine Translated by Google
A = xk T
8.5.1. Film Gas
(8.16) z Pertimbangkan interaksi molekuler:
2
Untuk rantai alkil hidrokarbon, area pembatasnya sekitar 0,5
menunjukkan tingkat kompresibilitas yang signifikan, mempertahankan fase seragam.
biasanya 10-20% lebih besar dari luas penampang rantai hidrokarbon molekul:
Ao: berhubungan langsung dengan luas penampang dari area yang teradsorpsi secara vertikal. Diubah oleh interaksi antar molekul
nm
(8.17)
memiliki kompresibilitas lebih rendah dari L1 (2). Cairan kental (L2):
8.5.2 Film Cair
z Kombinasi Persamaan. (8.16) dan (8.17)
. (nilai teoritis 0.2 nm2 )
z Modifikasi dengan menggunakan konstanta Ao (area yang ditempati oleh teradsorpsi
(1). Cairan diperluas (L1): kisaran antara gas dan cairan kental
kelompok kepala dikemas tertutup, tetapi selanjutnya dapat dikompresi untuk memberikan pengaturan pengemasan yang lebih ketat.--- (Gbr.
8.15--- dari struktur kubik ke heksagonal.) Fase cair dapat dibagi menjadi dua subkelas:
kurva -A mengalami transisi bertahap ke linearitas
(A-Ao) = xk T (A-Ao) = k T
Machine Translated by Google
cluster, interaksi antar cluster kecil 8.5.3. Film Kental
z Interaksi kohesif antar molekul cukup untuk pembentukan
Gambar BAM asam stearat pada fase gas (ÿ 0)
Hai
20 (Aÿ 21)
serta untuk palmitat dan miristis, dan anggota lain dari seri dengan lebih dari 12 karbon.
Area molekul kritis untuk asam stearat adalah sekitar 0,205 nm2 10 (Aÿ23.1)
z Ketika area berkurang ke titik di mana cluster dipaksa untuk berinteraksi melalui kontak fisik, tekanan meningkat dengan cepat. z Kurva -A khas untuk asam stearat pada air dan HCl pada 20
30 (Aÿ20.5)
Luas penampang SA yang diperkirakan dengan difraksi sinar-X adalah sekitar 0,185 nm2
8.16)
,
.
C (Gbr.
sebagai
5 (A=24,1)
Pada HCl (0,1N), transisi fase antara terjadi sebelum pembentukan fase kental.
Pada air, fase berpindah dari fase gas ke fase padat terkondensasi tanpa melewati keadaan cair yang diperluas.
Machine Translated by Google
Sifat ekor.
Jika gugus kepala memiliki solvasi yang lebih tinggi, (misalnya, -OH alkohol, C18OH), dapat dikompresi menjadi film L2 tetapi tidak menjadi film padat.
Untuk n <8 film gas karena kelarutan air yang signifikan.
Jenis film monolayer akan tergantung pada sejumlah faktor: sifat ekor dan kelompok kepala, tingkat keselamatan kelompok kepala, fase cair pendukung, suhu.
Panjang rantai panjang (misalnya, n 14) film padat
Panjang rantai lebih pendek (misalnya, 10 <n <14) film L2
--- Film padat atau L2 akan disukai
8.5.4 Beberapa Faktor Yang Mempengaruhi Jenis Film Yang Dibentuk
Tetapi gugus –COOH jauh lebih kuat terkait sendiri dan menghasilkan film yang kental.
z Untuk bahan rantai lurus, mis. Asam karboksilat (CH3(CH2)nCOOH)
Molekul gugus hidrofilik cenderung terletak lebih datar di permukaan air pada tekanan permukaan rendah.
Jika atom hidrogen diganti dengan fluor (atau halida lainnya): jenis film Jika ekornya bercabang atau memiliki dua atau lebih rantai hidrokarbon (misalnya ester): luas penampang menjadi lebih besar dan pembentukan film lebih meluas.
Untuk molekul yang mengandung dua gugus hidrofilik: interaksi antara molekul dan air meningkat karena adanya gugus kedua
Ketika tekanan meningkat, energi yang dibutuhkan untuk memaksa kelompok tersebut menjauh dari permukaan akan lebih besar. Proses berdirinya ekor dalam bahan seperti itu bertahap, sehingga akan menghasilkan karakteristik kurva dari film yang diperluas. (Gbr. 8.17) Machine Translated by Google
z Kelompok kepala yang besar cenderung membuat ekor lebih jauh terpisah dan mencegah efisiensi pengepakan. Bentuk diperluas daripada film padat .
(1). Trans ikatan rangkap --- rantai hidrokarbon akan lebih lurus interaksi lateral yang tinggi dan efisiensi pengepakan yang baik film padat atau L2 .
z Kelompok kepala bermuatan, tolakan elektrostatik antara molekul yang berdekatan memaksa mereka terpisah dan mengurangi interaksi. film yang diperluas.
(2). isomer cis : memiliki struktur tikungan paksa, mengurangi kemampuan untuk mengemas film yang diperluas (L1) dengan rapat . (Gbr. 8.18)
Pengaruh Kelompok Kepala.
Untuk asam karboksilat tak jenuh:
Hai
z Suhu transisi tergantung pada panjang rantai (untuk kelompok kepala yang sama). Ketika penambahan satu gugus –CH2-, suhu transisi
meningkat 5 C.
z Fase monolayer dan perubahan fase sensitif terhadap suhu.
z Gambar khas yang menunjukkan variasi isoterm sebagai fungsi dari z Saat suhu menurun: lapisan tunggal berubah dari diperluas
suhu. (Gambar ditunjukkan di bawah) menjadi kental atau padat. (suhu transisi) Pengaruh Suhu.
Machine Translated by Google
8.5.5 Formasi Film Campuran z Untuk asam karboksilat:
z Untuk spesies terionisasi: subfase yang mengandung elektrolit netral (NaCl) dapat mengurangi tolakan elektrostatik antara kelompok kepala dan dengan demikian meningkatkan efisiensi pengemasan.
z Sifat subfase: pH, konsentrasi dan valensi ion terlarut.
film kental
(1) larutan ideal: interaksi antara dua bahan sama dengan interaksi antara bahan murni. Artinya, tidak ada “interaksi khusus” antara berbagai bahan. ----
mantan. Dua rantai normal
Pada nilai pH rendah asam cenderung tidak terionisasi padat atau
Jenis lapisan tunggal campuran dapat bervariasi antara dua kasus ekstrim:
Untuk amina: efeknya berlawanan dengan asam karboksilat.
Jika bahan yang berbeda dicampur yang dapat mengalami interaksi tertentu (misalnya, alkohol ditambahkan ke asam karboksilat), monolayer asam menjadi lebih kental ---- karena alkohol dapat
kekuatan meningkat film yang diperluas Pada nilai pH tinggi kelompok kepala terionisasi ditingkatkan tolakan
asam karboksilat (Gbr. 8.19a), karakteristik lapisan tunggal campuran terletak di antara sifat-sifat bahan murni.
Pengaruh Perubahan Sifat Substrat (Subfase)
Setiap kation berasosiasi dengan dua molekul asam (bentuk garam logam) menghasilkan pengemasan yang lebih rapat dan pembentukan film padat atau padat.
z Dengan adanya ion polivalen (Ca2+ misalnya):
dua bahan dapat membentuk film heterogen, dengan pulau-pulau (misel 2 dimensi) dari satu film "mengambang" di lautan yang lain (Gbr. 8.19 d)
z Fenomena penting dari film campuran di bidang biologi dan medis: --- meniru fenomena dalam sistem biologis (dinding sel dan membran)
Meningkatkan tekanan permukaan dapat menyebabkan pengusiran satu komponen dari permukaan (Gbr. 8.19c).
(2) sistem yang tidak dapat bercampur: dua bahan cukup berbeda dan tidak ada interaksi khusus.
Penetrasi film: bahan aktif permukaan terlarut dalam subfase masuk Machine Translated by Google
8.5.6 Film Permukaan Polimer dan Protein
z Karena panjang molekul polimer dan interaksi kompleks yang terlibat dalam interaksi intra dan interchain, sifat-sifat film tersebut kurang jelas dan lebih sulit untuk
menentukan
Ketika dilakukan dengan hati-hati, banyak informasi menarik tentang makromolekul dapat
Eksperimen penetrasi tipikal --- pembentukan lapisan tunggal yang tidak larut pada tekanan permukaan , setelah itu bahan aktif permukaan yang larut disuntikkan di bawah lapisan tunggal dan perubahan tekanan permukaan (pada area konstan) karena penetrasi atau masuknya bahan baru ke dalam lapisan tunggal. Juga perubahan luas permukaan, potensial permukaan dan lain -lain dapat dipelajari.
Dibutuhkan waktu lama untuk film makro-molekul untuk mendapatkan keadaan setimbang yang sebenarnya.
Sistem yang telah dilakukan melibatkan: Hg, hidrokarbon rantai panjang,
Untuk merkuri, dengan tegangan permukaan tinggi, menyerap hampir semua hal sulit untuk mempertahankan permukaan Hg yang bersih.
8.5.7. Film Monolayer pada Antarmuka Cair-Cair dan Cairan Tidak Berair
z Substrat padat: kaca, logam, mika -- bahan apa pun yang memiliki afinitas relatif kuat untuk satu bagian bahan monolayer
z Studi lapisan tunggal pada cairan selain air telah dibatasi oleh kesulitan eksperimental dan kurangnya relevansi praktis yang jelas.
Transfer monolayer pada antarmuka gas-cair ke substrat padat----biasanya disebut sebagai "teknik Langmuir-Blodgett" dan film yang ditransfer disebut
"Langmuir-Blodgett Film"
---- Alasan: adanya cairan nonpolar mengurangi interaksi kohesif lateral antara ekor yang berdekatan (pembengkakan lapisan tunggal).
z Keterbasahan film LB asam karboksilat.
8.5.8. Film Monolayer dan Multilayer yang Disimpan minyak mineral, dll.
z Pada antarmuka air-cairan nonpolar: area per molekul alkohol dan asam karboksilat lebih besar daripada luas yang menyebar pada antarmuka air- udara.
z Jenis film LB (Gambar 8.21) Machine Translated by Google
(sebuah)
(b)
bÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿ
LB aÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿÿ
(b)
(c)
Machine Translated by Google