MODUL PANDUAN
PRAKTIKUM DASAR TEKNIK KIMIA
LABORATORIUM PRAKTIKUM DASAR TEKNIK KIMIA JURUSAN TEKNIK KIMIA
FAKULTAS TEKNIK INDUSTRI UPN “VETERAN” YOGYAKARTA
2018
Nama :………
NIM : ………..
Kelompok : ………..
KATA PENGANTAR KATA PENGANTAR
Segala puji dan syukur penyusun panjatkan kepada Tuhan Yang Mahakuasa, atas berkat dan rahmatnya sehingga modul ini dapat selesai disusun. Modul ini merupakan panduan untuk pelaksanaan praktikum dasar teknik kimia yang dilakukan oleh mahasiswa Program Studi S1 Teknik Kimia. Praktikum ini bertujuan agar mahasiswa dapat lebih memahami tentang proses-proses dasar yang dilakukan dalam suatu operasi di suatu pabrik kimia atau operasi proses lainnya secara umum.
Modul panduan praktikum ini terbagi ke dalam dua belas modul praktikum. Enam modul pertama berkaitan dengan proses yang bersifat difusional, sedangkan enam modul terakhir berkaitan dengan proses mekanis. Adapun sistematika tiap modul terdiri atas latar belakang, tujuan, dasar teori, alat-bahan, cara kerja, serta tabel kerja praktikum.
Tentu saja masih ada kekurangan dalam penyusunan modul praktikum ini. Oleh karena itu, penyusun sangat berharap adanya kritik, saran, serta masukan terhadap modul ini.
Besar harapan penyusun agar modul praktikum ini dapat memberikan manfaat yang sebesar- besarnya baik bagi penyusun sendiri maupun segenap mahasiswa dan asisten laboratorium yang menggunakan modul praktikum ini.
Tim Penyusun
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
DAFTAR ISI DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... ii
MODUL 1 PENGERINGAN ... 1
MODUL 2 HETP (HIGH EQUIVALENT OF THEORITICAL PLATE) ... 11
MODUL 3 DIFUSIVITAS INTEGRAL ... 18
MODUL 4 KOEFISIEN TRANSFER MASSA ... 29
MODUL 5 COOLING TOWER ... 38
MODUL 6 LEACHING ... 45
MODUL 7 ALIRAN FLUIDA... 53
MODUL 8 MIXING TIME ... 64
MODUL 9 FILTRASI ... 72
MODUL 10 SEDIMENTASI... 82
MODUL 11 DINAMIKA PROSES: PENGOSONGAN TANGKI & PENGUKURAN SUHU ... 93
MODUL 12 PEMANASAN TANGKI HORIZONTAL BERPENGADUK ... 100
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
MODUL 1 PENGERINGAN MODUL 1 PENGERINGAN A. Latar Belakang
Proses pengeringan zat padat merupakan operasi teknik kimia yang paling banyak dijumpai di industri, terutama pada industri bahan makanan. Pengeringan bertujuan untuk mengurangi kadar air bahan sampai batas perkembangan mikroorganisme terhambat sehingga bahan yang dikeringkan memiliki waktu simpan lebih lama. Dalam mempelajari proses pengeringan, perlu diperhatikan beberapa hal, antara lain variasi bentuk dan ukuran bahan, jenis bahan serta metode pemberian kalor yang dibutuhkan untuk penguapan, dari hal tersebut ditentukan kondisi fisik bahan dan operasi.
Proses pengeringan dilakukan dengan cara penguapan air. Cara tersebut dilakukan dengan mengalirkan udara panas ke sekeliling bahan sehingga tekanan uap air bahan lebih besar daripada tekanan uap air di udara. Perbedaan tekanan ini menyebabkan perpindahan massa uap air dari bahan ke udara. Kemampuan udara membawa uap air semakin besar apabila perbedaan kelembapan udara dan bahan semakin besar. Faktor lain yang mempercepat proses pengeringan adalah kecepatan udara yang mengalir.
B. Tujuan Percobaan
a. Menentukan hubungan antara kadar air dalam bahan dengan waktu pengeringan (x vs t) b. Menentukan hubungan antara kecepatan pengeringan dngan waktu pengeringan (R vs t) c. Menentukan hubungan antara kecepatan pengeringan dengan kandungan air dalam
bahan (R vs x)
d. Menentukan koefisien kecepatan pengeringan (KG) C. Dasar Teori
Transfer massa adalah gerakan molekul-molekul atau elemen fluida yang disebabkan karena adanya suatu gaya pendorong (Hardjono, 1989). Beda konsentrasi, beda tekanan dan beda suhu merupakan gaya pendorong dalam proses transfer massa. Bila suatu zat dikontakkan dengan udara yang kelembapannya lebih rendah dari kandungan kebasahan zat padat, zat padat akan melepaskan sebagian dari kebasahan dan mengering sampai seimbang dengan udara. Bila udara lebih lembab dari zat padat yang berada dalam
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
keseimbangan dengan udara, zat padat akan menyerap kebasahan dari udara sehingga tercapai keseimbangan.
Pengeringan (drying) zat padat berarti pemisahan sejumlah kecil air atau zat cair lain dari bahan padat sehingga mengurangi kandungan sisa zat cair di dalam bahan padat itu sampai suatu nilai terendah yang dapat diterima (Mc. Cabe, 1993). Pengeringan merupakan suatu cara mengurangi kandungan air suatu bahan dengan jalan memasukkannya ke dalam alat pengering atau oven sehingga terjadi penguapan dari zat cair yang ada dalam bahan tersebut. Tidak semua pengeringan dilakukan didalam oven.
Ada beberapa cara pengeringan atau menghilangkan air yang tidak termasuk dalam operasi pengeringan yaitu dengan cara penekanan (Treyball, 1985).
Secara umum, kecepatan pengeringan dipengaruhi oleh faktor-faktor di bawah ini : 1. Luas transfer massa ( A )
Air yang menguap melalui permukaan bahan. Adapun air di bagian tengah akan merembes ke bagian permukaan dan kemudian menguap. Salah satu cara mempercepat pengeringan adalah dengan memotong-motong bahan pangan yang akan dikeringkan. Pemotongan atau pengirisan akan memperluas permukaan bahan sehingga air lebih mudah keluar. Potongan-potongan kecil atau lapisan yang tipis akan mengurangi jarak gerakan panas ke pusat bahan pangan.
2. Kelembapan ( H )
Jika suhu lebih tinggi dan kelembapan lebih rendah maka kecepatan pengeringan akan lebih cepat. Udara lembab akan menurunkan kecepatan penguapan sehingga pengering akan berjalan lama.
3. Tekanan ( P )
Semakin kecil tekanan udara maka semakin besar kemampuan udara untuk mengangkut air selama pengeringan, dengan semakin kecilnya tekanan berarti kerapatan udara makin berkurang sehingga uap air dapat lebih banyak tertampung dan disingkirkan dari bahan pangan. Jika tekanan udara semakin besar maka udara disekitar pengeringan akan lembab, sehingga kemampuan menampung uap air terbatas dan menghambat proses atau laju pengeringan.
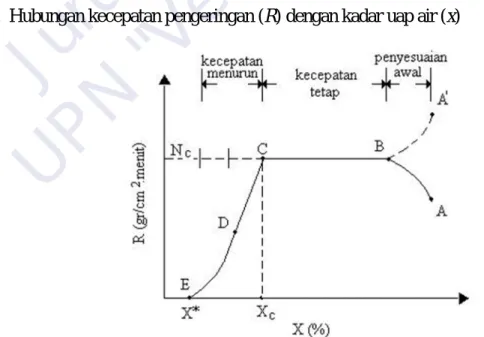
Dalam proses pengeringan dapat dibuat suatu kurva hubungan sebagai berikut : a. Hubungan antara kadar air (x) dan waktu pengeringan (t)
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
Gambar 5. Kurva hubungan antara kadar air (x) dengan waktu (t)
Keterangan :
A’ : Daerah permukaan bagian atas yang basah A – B : Periode yang terjadi setelah analisa pengeringan
B – C : Daerah bagian kecepatan yang konstan, setelah ditambah kelembapannya C – D : Periode pengeringan mendekati jenuh
D – E : Daerah pada saat kecepatan pengeringan mulai menurun lebih cepat dari sebelumnya E : Daerah dengan kadar air bahan padat sudah mendekati kandungan air pada
kesetimbangan, setelah pengeringan dapat dihentikan karena keadaan telah konstan.
Dari grafik dapat dapat diketahui bahwa semakin lama waktu pengeringan (t) yang dilakukan maka semakin berkurang kadar air ( X ) dalam suatu bahan
b. Hubungan kecepatan pengeringan (R) dengan kadar uap air (x)
Gambar 6. Kurva hubungan antara kecepatan pengeringan (R) dengan kadar uap air (x)
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan Keterangan :
A – B: Kecepatan pengeringan mungkin naik atau turun tergantung kandungan airnya B : Kecepatan pengeringan konstan
B – C: Proses pengeringan terjadi, yaitu cairan yang terdapat dalam bahan padat teruapkan C – D: Periode dengan kadar air semakin kecil
c. Hubungan antara kecepatan pengeringan (R) dengan waktu pengeringan (t)
Gambar 7. Kurva hubungan antara kecepatan pengeringan dengan waktu pengeringan Keterangan :
A – B : Daerah laju pengeringan naik jika laju ditingkatkan B –C : Daerah kecepatan pengeringan konstan
C : Titik saat kecepatan konstan berakhir dan kecepatan pengeringan mulai turun C – D : Kecepatan pengeringan turun drastis
D. Alat dan Bahan 1. Alat
a. Neraca digital b. Penjepit c. Oven
d. Termometer Toven
e. Termometer Twet
f. Termometer Tdry
g. Pompa vacuum
2. Bahan
a. Silinder berlubang kotak b. Silinder berlubang bulat c. Bola pejal
Keseluruhan material berbahan dasar kayu.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
(a) (b) (c)
Gambar 8. (a) Silinder Berlubang Kotak (b) Silinder pejal, dan (c) Bola pejal
3. Rangkaian Alat Keterangan :
Oven Tdry
Twet
Pompa Vakum Heater
Termostat Termometer
E. Cara Kerja Langkah Kerja
1. Rendam ketiga bahan ke dalam air selama 30 menit.
2. Timbang ketiga bahan tersebut dan catat sebagai berat awal bahan.
3. Atur oven pada pada suhu 800C dan jaga tekanan agar tetap konstan.
4. Masukkan bahan yang telah ditimbang ke dalam oven yang telah diatur. Secara bersamaan hidupkan pompa vakum dan stopwatch.
5. Setelah selang waktu tertentu, catat Twet, Tdry, dan Toven. Matikan pompa lalu keluarkan bahan dan timbang berat bahan.
6. Ulang percobaan terus menerus hingga diperoleh berat yang konstan.
Gambar 8. Rangkaian alat Drying
7 1
6
5 3 4
2
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
Analisis Perhitungan
1. Luas Permukaan Bahan
a. Luas permukaan silinder berlubang kotak
= ( ) + ( ) [( ) + 8 ]……….(1) b. Luas permukaan silinder pejal
= 2 + 2 ………(2)
c. Luas permukaan bola pejal
= 4 ………(3)
2. Kecepatan pengeringan (R)
= ………(4)
3. Kandungan air (X%)
= 100% ………(5)
4. Konstanta kecepatan pengeringan
= ………(6)
a. Mencari Pai
Twet diketahui (dari Wet bulk Termometer)
= ... (7)
dengan menggunakan steam table diktat OTK II Ir. Harjono apendik IV halaman 288 maka diperoleh Pai.
b. Mencari Pa
………(8)
Untuk mencari Ya digunakan gambar 5-6, halaman 158 diagram kelembaban system udara uap air pada tekanan 1 atm dari diktat OTK II Ir.
Harjono dengan mengetahui terlebih dahulu Tdry dan Twet. Daftar Simbol:
Wn = Berat bahan sebelum dikeringkan (gr) Wn+1 = Berat bahan setelah dikeringkan (gr) A = Luas permukaan aktif bahan (cm2) T = Selang waktu (menit)
Wd = Berat kering (gr)
R = Kecepatan pengeringan (gr/cm2menit)
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
Pai = Tekanan jenuh pada Twet (gr/cm2) Pa = Tekanan uap jenuh (gr/cm2) Ya = Molal humidity
Pt = Tekanan total (atm)
KG = Konstanta kecepatan pengeringan (menit)-1 D = Diameter (cm)
L = Tinggi silinder (cm)
F. Daftar Pustaka
Hardjono, Ir. 1989, Operasi Teknik Kimia II, edisi ke-1, hal. 192-240, Universitas Gadjah Mada, Yogyakarta
McCabe, W.L., Smith, J.C., and Harriot, P., 1993, Operasi Teknik Kimia, Jilid 2, edisi 4, hal 204, 249-267, Erlangga, Jakarta
Perry, R.H., 1984, Chemical Engineer’s Handbook, 6th ed. McGraw Hill Book Company, Inc., New York
Treybal, R.E. 1981, Mass Transfer Operation, 4th ed, p. 668, McGraw-Hill Book Company, Tokyo.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
TABEL KERJA PRAKTIKUM
HASIL PERCOBAAN:
1. SILINDER BERLUBANG PERSEGI
Berat bahan sebelum direndam : gram
Jari-jari luar (r) : cm
Jari-jari dalam (s) : cm
Panjang Silinder (L) : cm
Luas Permukaan : cm2
Twet mula-mula : oC
Tdry mula-mula : oC
Berat bahan setelah direndam air : gram
Suhu Oven : °C
No. Waktu (s) Berat Bahan (gram) Twet Tdry W 1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
2. SILINDER PEJAL
Berat bahan sebelum direndam : gram
Jari-jari (r) : cm
Panjang Silinder (L) : cm
Luas Permukaan : cm2
Twet mula-mula : oC
Tdry mula-mula : oC
Berat bahan setelah direndam air : gram
Suhu Oven : °C
No. Waktu (s) Berat Bahan (gram) Twet Tdry W 1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Pengeringan
3. BOLA PEJAL
Berat bahan sebelum direndam : gram
Diameter Bola : cm
Luas Permukaan : cm2
Twet mula-mula : oC
Tdry mula-mula : oC
Berat bahan setelah direndam air : gram
Suhu Oven : °C
No. Waktu (s) Berat Bahan (gram) Twet Tdry W 1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
HETP
MODUL 2
HETP (HIGH EQUIVALENT OF THEORITICAL PLATE) MODUL 2 HETP (HIGH EQUIVALENT OF THEORITICAL PLATE) A. Latar Belakang
Dalam industri sering dibutuhkan bahan-bahan yang relatif murni terhadap bahan- bahan lainnya, baik dalam proses industri maupun hasil industri. Metode yang digunakan untuk memisahkan suatu bahan dari campurannya dengan bahan lain, antara lain: filtrasi, ekstraksi, kristalisasi, distilasi, dan sebagainya. Metode distilasi lebih sering digunakan untuk bahan-bahan yang terdiri dari cairan-cairan, yaitu dengan menggunakan menara pemisah, baik jenis dengan bahan isian maupun dengan plate.
Distilasi atau penyulingan adalah suatu metode pemisahan campuran bahan kimia berdasarkan perbedaan kemudahan menguap (volatilitas) bahan dengan titik didih yang berbeda. Distilasi menggunakan panas sebagai agen pemisah campuran, campuran zat dididihkan hingga menguap dan uap ini kemudian didinginkan kembali ke dalam bentuk cairan. Zat yang memiliki titik didih lebih rendah akan menguap terlebih dahulu
Konsep HETP pada dasarnya merupakan distilasi yang dipakai untuk mencari tinggi kolom bahan isian yang ekuivalen dengan satu plate teoritis. Konsep HETP juga dipergunakan untuk membandingkan suatu efisiensi menara isian, kecepatan dan sifat fluida, keadaan operasi pada umumnya oleh variasi keadaan dispersi cairan dipermukaan bahan isian.
B. Tujuan percobaan
Percobaan ini bertujuan untuk menentukan perbandingan tinggi kolom bahan isian yang ekuivalen terhadap satu plate teoritis.
C. Dasar Teori
Untuk mengetahui tinggi bahan isian yang harus digunakan untuk menghasilkan produk dengan komposisi yang sama dengan satu plate teoritis pada menara bertingkat digunakan dengan istilah HETP (High Equivalent of Theoritical Plate). HETP adalah tinggi bahan isian yang akan memberikan perubahan komposisi yang sama dengan perubahan komposisi yang diberikan satu plate teritis. Variabel yang mempengaruhi HETP antara lain: tipe dan ukuran bahan isian, kecepatan aliran masing-masing fluida, konsentrasi fluida, diameter menara, sifat fisis bahan di fraksinasi. (Treybal, R.E., 1981)
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
HETP
HETP dalam penggunaannya sering digunakan dalam perhitungan menara distilasi dengan bahan isian.
Di dalam distilasi ada beberapa cara untuk menentukan jumlah plate teoritis sebagai plate minimum, yaitu dengan cara:
Metode McCabe-Thiele
Komposisi uap dan cairan di dalam kolom distilasi dianggap mencapai kesetimbangan dan memenuhi persamaan berikut:
a ab
a ab
a X
Y X
1 1
. Di mana :
Ya = fraksi mol uap Xa = fraksi mol air
Syarat syarat metode McCabe Thiele :
Apabila sistem campuran yang disuling menghasilkan diagram komposisi uap jenuh dan cair jenuh atau garis operasi mendekati garis lurus atau sejajar.
Jika persyaratan a) dapat dipenuhi, maka Ln/Vn+1 pada seksi rektifikasi dan Lm/Vm+1
pada seksi striping bernilai tetap. Keadaan semacam ini dikenal sebagai “Constant molal ever flow and vaporation”.
Tekanan di seluruh menara dianggap tetap.
Panas pencampuran ( Hs) dapat diabaikan.
Panas laten penguapan ( ) rata – rata tetap.
Persamaan garis operasi untuk seksi enriching / rektifikasi (Garis Operasi Atas):
1
1 1
R X X R
Yn R n d
Sedangkan persamaan garis operasi dari seksi striping (Garis Operasi Bawah)
b
m X
V X B V Y L
Penentuan jumlah plate minimum (Npmin) dilakukan dengan asumsi refluks total di mana seluruh uap yang terembunkan dalam kondensor dikembalikan ke dalam kolom sebagai refluks sehingga tidak ada hasil distilat (D = 0). Perbandingan refluks (Lo/D) adalah tak terhingga. Pada kondisi ini, slope dari garis operasi atas = 1.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
HETP
Metode Fenske Underwood
bd a
d P
P , pada suhu puncak (td)
bd a
w P
P , pada suhu bawah (tw)
Di mana : Paº = tekanan uap murni komponen a Pbº = tekanan uap murni komponen b
Untuk campuran ideal, metode ini didasarkan atas volatilitas relatif ab antar komponen, dengan terlebih dahulu menetapkan d dan w.
) 1 ( 1
a a
a a
ab X Y
X Y
Di mana:
Y = mol fraksi uap X = mol fraksi cairan
Untuk mendapatkan Nmin dengan logaritma menghasilkan:
log 1 1 log 1
min
ab d b
b d
X X
X X
N
Jika perubahan nilai ab dari dasar kolam tidak terlalu menyolok, maka untuk ab
digunakan rata-ratanya
aquades alkohol
d P
P , pada suhu puncak (td)
aquades alkohol
w P
P , pada suhu bawah (tw)
3. Metode Ponchon – Savorit
(Menggunakan diagram entalpi komposisi)
HETP sering digunakan untuk perhitungan menara distilasi dengan memakai bahan isian. Dengan metode di atas, jumlah plate minimum dapat diketahui, sehingga harga HETP dapat dihitung:
minimum plate
Jumlah
isian bahan kolom
packing Tinggi
HETP
Manfaat dari HETP adalah untuk menghitung tinggi kolom bahan isian dengan terlebih dahulu menentukan jumlah plate teoritis.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
HETP
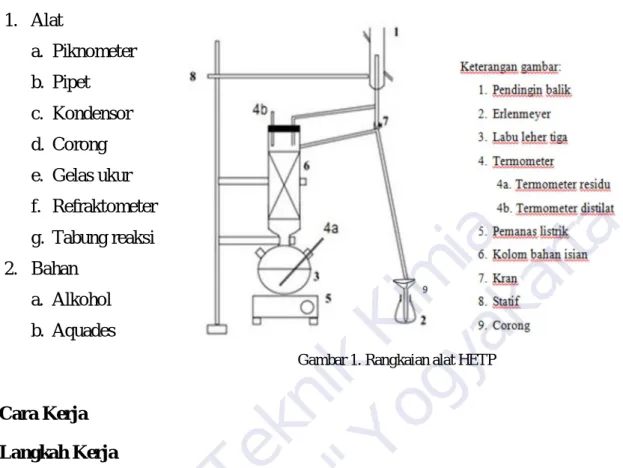
D. Alat dan Bahan 1. Alat
a. Piknometer b. Pipet
c. Kondensor d. Corong e. Gelas ukur f. Refraktometer g. Tabung reaksi 2. Bahan
a. Alkohol b. Aquades
Gambar 1. Rangkaian alat HETP
E. Cara Kerja Langkah Kerja
1. Periksa terlebih dahulu rangkaian alat percobaan.
2. Buat larutan umpan, yaitu campuran alkohol dan aquades dengan perbandingan volume 150 ml: 200 ml ; 175 ml:175 ml dan 200 ml:150 ml.
3. Masukkan umpan ke dalam labu leher tiga, usahakan jangan sampai tumpah.
Hidupkan pendingin balik dan pemanasnya. Atur kran pada posisi refluks total.
4. Catat secara periodik perubahan suhu residu dan destilat, sehingga dapat diketahui berapa lama dicapai suhu keduanya tetap. Setelah suhu destilat dan residu konstan, ambil distilat dengan memutar kran refluks, kemudian amati indeks biasnya. Setelah cukup, kran dikembalikan ke posisi refluks total.
5. Matikan pemanas, ambil residu dan tampung seperti pada pengambilan destilat. Amati indeks biasnya.
6. Hidupkan pemanas seperti semula.
7. Amati indeks bias distilat dan indeks bias residu dengan refraktomer.
8. Ulangi percobaan mulai dari langkah ke-3.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
HETP
Analisis Perhitungan
a. Penentuan densitas alkohol
Menera piknometer sebagai berikut:
Berat piknometer kosong = A gram Berat piknometer + aquadest = B gram Berat aquadest (B-A) = C gram
Dari tabel 2-28 pada buku Perry’s Chemical Engineering Handbook 7thedition, didapatkan densitas aquadest sebesar aquadest gram/mL sehingga:
= Menentukan densitas alkohol:
Berat piknometer + alkohol = D gram Berat alkohol (D-A) = E gram
=
b. Penentuan kadar alkohol
Dengan mengetahui densitas alkohol pada suhu T, maka dari tabel 2-110 pada buku Perry’s Chemical Engineering Handbook 7th edition akan didapatkan kadar alkohol sebesar K%.
c. Pembuatan grafik standar
Untuk membuat grafik standar antara fraksi mol dengan indeks bias diperlukan beberapa campuran dengan berbagai perbandingan untuk menghitung fraksi mol dengan data-data:
Kadar alkohol : K %
Alkohol : L ml
Aquadest : M ml
Densitas alkohol
Maka : Alkohol = alkohol x L x K % = S gmol.
BM alkohol
Aquadest = ( aquadest x M) + alkohol x L (100% - K%) BM aquadest
= R gmol Sehingga fraksi alkohol: X =
R S
S = Q mol
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
HETP
dari harga fraksi mol alkohol tersebut dan indeks bias dapat dibuat grafik standar.
d. Penentuan fraksi mol destilat dan residu sampel
Dengan mengetahui indeks bias sampel dan dengan menggunakan grafik standar, didapat fraksi mol destilat dan residu.
e. Penentuan sifat penguapan (volatilitas) rata – rata ( ab) Harga d dan w dicari dengan menggunakan rumus :
= °° ; P pada suhu td
= °° ; P pada suhu tw =
Pº alkohol dan aquadest dapat dilihat pada fig. 543, p. 583, G.G. Brown, “Unit Operation”.
f. Penentuan HETP
Terlebih dahulu hitung jumlah plate minimum (Npmin). Npmin pada percobaan ini diasumsikan sebagai kondisi kondensor dan reboiler total, dengan cara:
(1) Metode Mc Cabe Thiele
Metode ini menggunakan grafik antara fraksi mol uap (Y) vs fraksi mol cairan (X). dalam penggambaran kurvanya digunakan diagram kesetimbangan etanol – aquadest yang terdapat pada G.G. Brown, “Unit Operation”, p.582.
(2) Metode Fenske Underwood Dengan rumus :
log 1 1 log 1
min
ab d b
b d
X X
X X N
Maka harga HETP :
HETP = Tinggi kolom bahan isian/ Npmin
F. Daftar Pustaka
Brown, G.G., 1978 ,”Unit Operation”, 14th ,John Willey and Sons, New York
Perry, R.H.,1984,“Chemical Engineers Handbook”,7th edition,Mc Graw Hill Book Company Inc., New York
Treyball, R.E., 1981,”Mass Transfer Operation”, 4th edition, Mc Graw Hill Book Company Inc., Tokyo
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
HETP
TABEL KERJA PRAKTIKUM
Hasil Pengamatan
Suhu Aquades : °C
Berat piknometer kosong : gram
Berat piknometer + aquades : gram
Berat aquades : gram
Berat piknometer + alcohol : gram
Berat alkohol : gram
Densitas aquades : gr/ml
Volume piknometer : ml
Densitas alkohol : gr/ml
Tinggi bahan isian : cm
Tabel indeks bias larutan standar:
No Alkohol (ml)
Aquades (ml)
Mol Alkohol
Mol Aquades
Fraksi Mol Alkohol (X)
Indeks Bias (n) 1
2 3 4 5 6 7 8 9 10
Indeks Bias Umpan dan Residu
No Umpan (ml) Indeks Bias Suhu
Aquades Alkohol Distilat Residu Tw Td
1 2 3
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
MODUL 3
DIFUSIVITAS INTEGRAL MODUL 3 DIFUSIVITAS INTEGRAL
A. Latar Belakang
Fenomena transfer massa banyak dijumpai dalam kehidupan sehari-hari. Sebagai contoh, pergerakan asap dari cerobong mengepul ke udara sekeliling dengan jalan difusi.
Begitu pula dengan gula yang dimasukkan ke air, maka gula akan melarut dengan menyebar di dalam air teh dengan jalan difusi. Difusi adalah peristiwa mengalirnya atau berpindahnya suatu zat dalam pelarut dari bagian yang berkonsentrasi tinggi ke bagian yang berkonsentrasi rendah. Faktor yang mempengaruhi kecepatan difusi yaitu ukuran partikel, kecepatan partikel bergerak, luas suatu area, jarak antara dua konsentrasi, dan suhu. Dengan mengetahui difusivitas (koefisien difusi) suatu zat, dapat diketahui kemampuan penyebaran massa zat tersebut ke dalam fase zat lain. Semakin besar harga difusivitas suatu zat, maka zat tersebut dikatakan mempunyai kemampuan transfer massa yang besar pula. Dalam industri kimia, koefisien difusi berperan dalam perhitungan waktu proses yang selanjutnya digunakan dalam perancangan kapasitas alat.
B. Tujuan Percobaan
Menentukan koefisien difusivitas integral (DAB) yang merupakan perbandingan luas dengan waktu dalam satuan cm2/detik dari larutan asam oksalat yang berbeda.
C. Dasar Teori
Difusi adalah perpindahan molekul dari konsentrasi tinggi ke rendah. Oleh karena itu, perpindahan komponen atau molekul terjadi karena adanya perbedaan konsentrasi (Singh and Heldman, 2001). Difusi dapat diartikan sebagai salah satu bentuk transfer massa yang disebabkan oleh adanya gaya dorong (driving force) yang timbul karena gerakan-gerakan molekul atau elemen fluida. Difusivitas cairan tergantung pada sifat – sifat komponen, temperatur serta konsentrasi cairan tersebut. Namun, dalam pelaksanaan percobaan ini faktor temperatur diabaikan. Hal ini karena perbedaan temperatur yang kecil menyebabkan perbedaan densitas yang kecil, sehingga massa tidak berubah secara signifikan. Walaupun penyebab difusi umumnya adalah gradien konsentrasi, difusi dapat juga terjadi akibat gradien tekanan, gradien suhu, ataupun medan gaya yang diterapkan
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
tekanan (bukan tekanan parsial) disebut difusi tekanan (pressure diffusion). Adapun yang disebabkan oleh gradien suhu disebut difusi termal (thermal diffusion), sedangkan yang disebabkan oleh medan gaya dari luar disebut difusi paksa (forced diffusion).
Terdapat beberapa faktor yang memengaruhi kecepatan difusi, yaitu :
b. Ukuran partikel. Semakin kecil ukuran partikel, semakin cepat partikel tersebut bergerak, sehingga kecepatan difusi semakin tinggi.
c. Ketebalan membran. Semakin tebal membran, semakin lambat kecepatan difusi.
d. Luas suatu area. Semakin besar luas area, semakin cepat kecepatan difusinya.
e. Jarak. Semakin besar jarak antara dua konsentrasi, semakin lambat kecepatan difusi.
f. Suhu. Semakin tinggi suhu, partikel mendapatkan energi untuk bergerak lebih cepat.
Dalam teori kinetik yang disederhanakan, sebuah molekul bergerak secara garis lurus dengan kecepatan yang seragam. Pada saat molekul tersebut bertumbukan dengan molekul lain, maka terjadi perubahan kecepatan baik besarnya maupun arahnya.
Molekul bergerak secara zig–zag, tetapi tetap menuju arah tertentu sesuai dengan perbedaan konsentrasi yang menjadi gaya pendorongnya. Karena gerakan yang berliku – liku, waktu difusi menjadi lama. Adapun pengaruh dari tekanan dan temperature, dengan adanya penurunan tekanan, jumlah tumbukan akan berkurang sehingga kecepatannya akan bertambah. Sedangkan dengan kenaikan temperatur menyebabkan gerakan molekul semakin cepat. Mekanisme terjadinya difusi dari sistem biner (dua komponen) dengan perbedaan konsentrasi dapat diilustrasikan oleh gambar berikut:
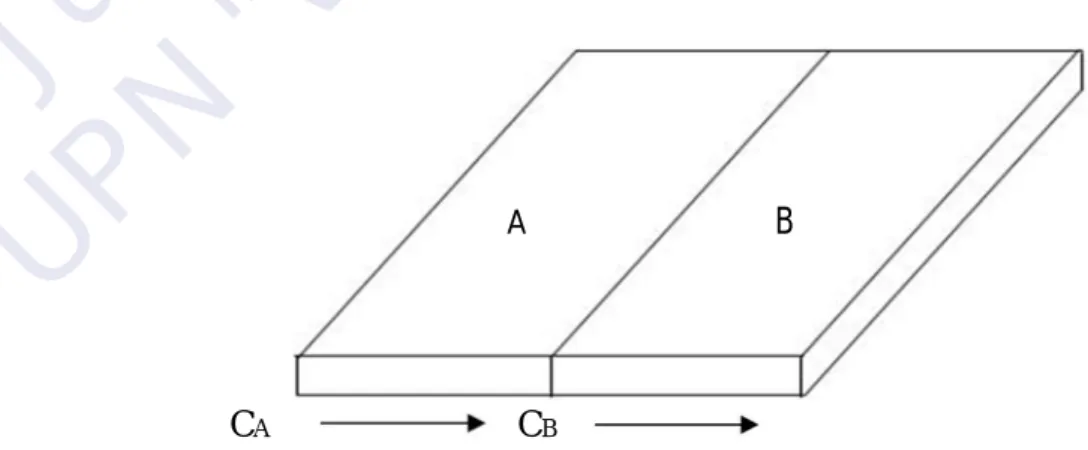
A B
CA CB
Gambar 1. Mekanisme terjadinya difusi dari sistem biner
Bagian A ke B pada awalnya mempunyai konsentrasi yang berbeda. Karena adanya transfer massa maka konsentrasi massa pada A akan berkurang dan konsentrasi
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
B akan bertambah. Apabila proses difusi berlangsung dalam waktu yang relatif lama, maka konsentrasi A dan B akan seimbang atau CA = CB.
Difusivitas/koefisien difusi adalah suatu faktor perbandingan antara fluks massa terhadap gradien konsentrasi zat yang mendifusi. Zat yang terlarut akan mendifusi dari daerah berkonsentrasi tinggi ke daerah berkonsentrasi rendah. Difusivitas/koefisien difusi merupakan sifat spesifik sistem yang tergantung pada suhu, tekanan dan komposisi sistem. DAB adalah koefisien difusi untuk komponen A yang mendifusi melalui komponen B. Hubungan dasar difusi molekuler di atas pertama kali ditemukan oleh Fick untuk sistem isotermal dan isobarik.
Koefisien difusi dapat dijumpai pada persamaan hukum Fick:
dx D dC
JAx AB A (1)
Tanda negatif menunjukkan bahwa difusi terjadi dengan arah yang sejalan dengan penurunan konsentrasi.
Neraca massa pada suatu proses difusi:
Massa Masuk – Masuk Keluar – Massa yang Bereaksi = Massa Akumulasi dx
x dC dx A
D dC dx A
D dC
A A
x x A AB x
A
AB . 0 . .
. (2)
Persamaan (2) dibagi dengan A x, maka:
dx dC dx
dC dx
DAB d A A (3)
dx dC dx
C
DAB d A A
2 2
(4)
dx dC D dx
C
d A
AB
A 1
2 2
(5)
Bila dalam percobaan digunakan asam oksalat
Konsentrasi asam oksalat mula – mula dalam pipa kapiler adalah CA0 pada : x = x
t = 0 CA = CA0
Konsentrasi asam oksalat dalam pipa kapiler pada waktu t = ~ : x = x
t = ~
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
Pada ujung pipa kapiler yang tertutup tidak ada transfer massa : x = 0
t = t
2 0
2
dx C d A
Konsentrasi asam oksalat pada ujung pipa kapiler pada setiap saat : x = L ; t = t ; CA = CA
Penyelesaian dari persamaan diferensial (5) adalah:
1
2 2 2
4 1 exp 2
2 . cos 2 1 . 2
1 4
n
AB n
A L
t D n
L L n
C n (6)
Menghitung asam oksalat setelah difusi : N = CA . V
dN = CA . dV + V . dCA ; CA = tetap dN = CA . A .dx
N = CA . A . dx
Jumlah asam oksalat mula – mula dalam pipa kapiler adalah : No = CAo .A. L
Persentase asam oksalat setelah difusi dalam pipa kapiler adalah :
% 100
0
N x
E N (7)
% 100
0
0 x
AL C
dx C A E
A L
A
(8)
% 100 . .
0 0
Ldx C E C
L
A
A (9)
Persamaan (6) disubstitusikan ke persamaan (9), sehingga diperoleh:
2
2 2 2
2 4
1 exp 2
1 . 2
1 800
n
AB
L
t D n
E n (10)
Untuk DAB yang tetap dan DAB .t/L2 kecil, maka persamaan (6) dapat didekati dengan:
2
200 .
100 L
t
E DAB (11)
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
2
200 .
100 L
t
E DAB (12)
log 2
2 200 1
log 100
log L
D t
E AB (13)
log 2
200 log 2 100
log
2 L
D t
E AB (14)
Sehingga persamaan dapat dibuat grafik hubungan antara log 2
L
t terhadap E
100 log
2 dan juga persamaan diatas dapat diselesaikan dengan metode least square, dengan persamaan pendekatan secara garis lurus sebagai berikut:
bx a
y (16)
Di mana:
E y 2log100
. 200 log
2 DAB
a
log 2
L x t
b = tan = gradient = 1 dengan:
E = perbandingan asam oksalat yang tertinggal t = waktu (menit)
L = panjang pipa kapiler (cm) DAB = koefisien difusi (g/cm2.detik) D. Alat dan Bahan
1 Alat
a. Alat suntik b. Termometer
c. Timbangan analitik d. Tangki penampung air e. Bak difusi
f. Pipa-pipa kapiler g. Buret
h. Statif dan klem
i. Erlenmeyer j. Corong k. Penggaris
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
2 Bahan a. Aquades b. Indikator PP c. Larutan NaOH
d. Larutan asam Standar
e. Larutan asam oksalat (H2C2O4)
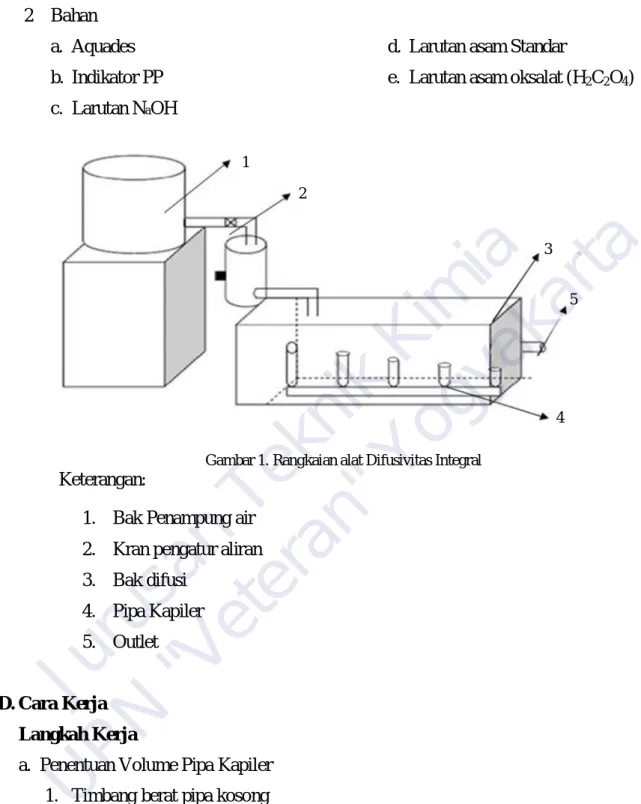
Gambar 1. Rangkaian alat Difusivitas Integral
Keterangan:
1. Bak Penampung air 2. Kran pengatur aliran 3. Bak difusi
4. Pipa Kapiler 5. Outlet D. Cara Kerja
Langkah Kerja
a. Penentuan Volume Pipa Kapiler 1. Timbang berat pipa kosong
2. Timbang pipa yang telah diisi aquades 3. Ukur panjang pipa dan suhu aquadest.
4. Cari densitas aquadest berdasarkan suhu aquadest yang telah diketahui kemudian hitung volume pipa.
5. Ukur tinggi masing-masing pipa kapiler dan ujung atas yang terbuka sampai dasar pipa kapiler yang tertutup dan masih dapat diisi dengan aquadest.
1
2
3
5
4
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
b. Standardisasi larutan NaOH
1. Ambil asam standar sebanyak volume tertentu dalam Erlenmeyer 2. Tambahkan indikator PP (2 tetes)
3. Lakukan titrasi serta catat volume NaOH yang dibutuhkan.
4. Ulangi langkah selama dua kali c. Standarisasi asam oksalat
1. Ambil sejumlah volume tertentu asam oksalat (X1) 2. Tambahkan indikator PP
3. Lakukan titrasi menggunakan larutan NaOH 4. Catat volume NaOH yang dibutuhkan.
5. Ulangi langkah di atas
6. Ulangi percobaan untuk asam oksalat (X2) d. Percobaan difusi,
1. Isi pipa kapiler dengan asam oksalat dan usahakan tidak ada gelembung udara.
2. Susun pipa kapiler ke dalam bak difusi dengan mengurutkan dari posisi tinggi ke rendah
3. Alirkan air dan atur kran agar terbentuk aliran laminer.
4. Pada saat air mencapai puncak pipa kapiler catat waktu sebagai t=0 (x).
5. Ambil asam oksalat yang terdapat pada pipa kapiler menggunakan jarum suntik 6. Masukkan asam oksalat tersebut ke dalam erlenmeyer dan ditambahkan
aquadest hingga volume tertentu.
7. Tambahkan indikator PP dan lakukan titrasi menggunakan larutan NaOH.
8. Ulangi langkah sebanyak 1 kali
9. Lakukan percobaan untuk asam oksalat X2 Analisis Perhitungan
Penentuan volume pipa
=
Keterangan: V = Volume pipa (ml) m = massa aquadest (g)
= densitas aquadest (gr/ml) Penentuan normalitas NaOH
1 1 = 2 2
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
Keterangan : V1 = Volume asam standar (ml) N1 = Normalitas asam standar (N) V2 = Volume NaOH (ml)
N2 = Normalitas NaOH (N)
Penentuan normalitas asam oksalat sebelum dan sesudah difusi
3 3 = 2 2
Keterangan : V3 = Volume asam oksalat (ml) N3 = Normalitas asam oksalat (N) Penentuan persentase asam oksalat
= 100%
Keterangan : E = persentase sisa asam oksalat (%)
No = Normalitas asam oksalat sebelum difusi (N) N = Normalitas asam oksalat setelah difusi (N) Penentuan difusivitas
Data n ditentukan dari rumus :
= 100 200 yang dijabarkan menjadi
2 log(100 ) = log + 2 log(200 )
Persamaan diatas diselesaikan dengan metode least square = + dengan : = 2 log (100 )
a = tan = gradient = 1
b = intercept = 2 log (200 ) = log ( / 2)
E = persentase sisa asam oksalat (%) t = waktu (detik)
L = panjang pipa kapiler (cm)
= koefisien difusivitas (cm2/detik) Penentuan % kesalahan
= 100%
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
F. Daftar Pustaka
Brown, G.G., 1950, Unit Operation, John Willey and Sons, Inc. New York
Hardjono. 1989. Diktat Kuliah Operasi Teknik Kimia II . Hal 1 – 4. Fakultas Teknik Jurusan Teknik Kimia. UGM Yogyakarta.
Perry .J.H. 1984.Chemical Engineering Hand Book,6th edition. Mc Graw Hill Book Company, New York.
Treyball. RE, 1995. Mass Transfer Operation. Mc. Graw Hill Book Company. New York
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
TABEL KERJA PRAKTIKUM A Menentukan volume pipa kapiler
Suhu aquadest : °C
Densitas aquadest : g/ml
No. Panjang pipa (cm)
Berat pipa kosong
(gr)
Berat pipa isi (gr)
Berat Aquadest
(gr)
Volume pipa
(ml) 1.
2.
3.
4.
B Standardisasi larutan NaOH
Normalitas asam standar : N No Volume NaOH
(ml)
Volume Asam Standar (ml)
Normalitas NaOH (ml)
1.
2.
3.
Volume NaOH rata-rata : N
Normalitas NaOH rata-rata : ml
C Standardisasi Asam Oksalat
Normalitas NaOH : N
Selang waktu : menit
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Difusivitas Integral
a. Volume NaOH sebelum dan setelah difusi Asam Oksalat (X1)
No
Waktu (menit)
Volume NaOH (ml)
Volume Asam Oksalat
(ml)
Normalitas Asam Oksalat
Normalitas Asam Oksalat
setelah difusi sebelum pengenceran Sebelum
difusi
Sesudah difusi
Sebelum difusi
Sesudah difusi 1.
2.
3.
4.
b. Volume NaOH sebelum dan setelah difusi Asam Oksalat (X1)
No
Waktu (menit)
Volume NaOH (ml)
Volume Asam Oksalat
(ml)
Normalitas Asam Oksalat
Normalitas Asam Oksalat
setelah difusi sebelum pengenceran Sebelum
difusi
Sesudah difusi
Sebelum difusi
Sesudah difusi 1.
2.
3.
4.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
MODUL 4
KOEFISIEN TRANSFER MASSA MODUL 4 KOEFISIEN TRANSFER MASSA
A. Latar Belakang
Dalam industri kimia, operasi transfer massa dari satu fase ke fase yang lain digunakan sebagai operasi dasar pemisahan komponen dari campurannya. Sebagai contoh, penerapan proses transfer massa dalam pemurnian belerang dengan menghembuskan udara untuk menghilangkan kotorannya.
Percobaan ini dilakukan menggunakan kapur barus atau naftalena (C10H8) yang dikontakkan dengan udara. Naftalena merupakan senyawa hidrokarbon aromatik yang memiliki rumus sebagai berikut:
Gambar 1. Gugus Naftalena
Dalam hal ini, terjadi transfer massa dari fase padat (naftalena) ke fase gas (udara) yang dikenal sebagai sublimasi.
B. Tujuan Percobaan
a. Mencari besarnya koefisien transfer masssa (kca) dengan menggunakan variabel tinggi tumpukan (L) naftalena (C10H8)
b. Menentukan hubungan antara koefisien transfer massa (kca) dengan tinggi tumpukan naftalena (L)
C. Dasar Teori
Transfer massa merupakan perpindahan suatu komponen dari campuran yang terjadi karena adanya perubahan dalam kesetimbangan sistemnya disebabkan karena adanya perbedaan konsentrasi. Adanya perbedaan konsentrasi zat kimia antara bahan dan lingkungan disebut sebagai driving force atau gaya penggerak dari proses transfer massa.
Perpindahan dapat terjadi dalam satu fase maupun antara satu fase dengan driving force. Proses transfer massa dipengaruhi oleh:
1. Luas permukaan kontak bahan dengan fluida
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
Luas permukaan kontak bahan dengan fluida berpengaruh terhadap proses transfer massa. Semakin besar luas permukaan kontak bahan dengan fluida maka transfer massa yang terjadi semakin cepat.
2. Konsentrasi
Perbedaan konsentrasi zat kimia antara bahan dan lingkungan merupakan driving force atau gaya penggerak dari proses transfer massa. Semakin besar perbedaan konsentrasi, maka transfer massa semakin cepat.
3. Jarak dari permukaan ke pusat naftalena
Semakin besar jarak dari permukaan ke pusat bahan maka transfer massa semakin lama karena untuk mencapai kesetimbangan yang merata dibutuhkan waktu yang lebih lama.
4. Waktu
Semakin lama waktu penyubliman, laju pergerakan transfer massa semakin lambat. Hal ini karena perbedaan konsentrasi yang semakin kecil dengan berjalannya waktu.
5. Porositas
Porositas adalah ukuran dari ruang kosong antara material, dan merupakan fraksi dari volume ruang kosong terhadap volume total, yang bernilai antara 0 dan 1, atau sebagai persentase antara 0-100%. Semakin besar atau semakin banyak pori pada bahan maka semakin cepat transfer massanya. Hal ini karena semakin banyak pori, luas permukaan kontak semakin besar.
Pada percobaan ini digunakan bahan naftalena. Naftalena adalah hidrokarbon kristalin aromatik berbentuk padatan berwarna putih dengan rumus molekul C10H8 dan berbentuk dua cincin benzena yang bersatu. Senyawa ini bersifat mudah menguap (volatile) meskipun dalam bentuk padatan. Uap yang dihasilkan bersifat mudah terbakar. Naftalena paling banyak dihasilkan dari distilasi tar batubara dan sedikit dari hasil fraksinasi minyak bumi.
Sifat-sifat fisik:
Massa molar : 128,17052 gr Kepadatan : 1,14 gr/cm3
Titik lebur : 80,26oC = 353 K = 424oF Titik didih : 218oC = 491 K = 424oF
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
Kelarutan dalam air : 30 mg/L (Chemisty of Unja, 2011)
Kegunaan dari naftalena antara lain, sebagai reaksi intermediet dari berbagai reaksi kimia industri, seperti reaksi sulfonasi, polimerisasi, dan lain-lain.
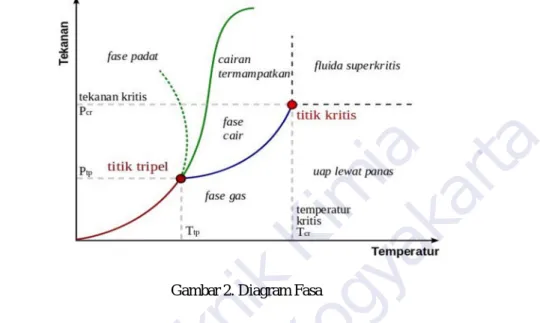
Gambar 2. Diagram Fasa
Penyubliman/sublimasi adalah peristiwa perubahan wujud zat dari padat menjadi gas. Pada proses penyubliman kapur barus/naftalena pada fixed bed, fase padat dilalui gas secara kontinu. Bila konsentrasi antarmuka kedua fase lebih besar daripada konsentrasi gas yang mengalir, maka terjadi transfer massa secara langsung dari fase padat ke fase gas (Brown,1978).
Reaktor fixed bed adalah reaktor yang menggunakan katalis padat yang diam dan zat pereaksi berfasa gas. Butiran-butiran katalis yang biasa dipakai dalam reaktor fixed bed adalah katalisator yang berlubang di bagian tengah, karena luas permukaan per satuan berat lebih besar dibandingkan butiran katalis berbentuk silinder, dan aliran gas lebih lancar (Nunulasa, 2011).
Pada keadaan steady state, kecepatan perpindahan massa dari padat ke fase gas:
A kca CAs CAg
dt
dN * (1)
Dengan kca adalah nilai transfer massa per satuan luas per satuan beda konsentrasi dan biasanya didasarkan kecepatan mulai yang seragam (McCabe,1983).
Dengan menganggap diameter zat padat konstan pada elemen volume tertentu pada kondisi steady state dapat ditulis :
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
Gambar 3. Mekanisme transfer massa
Neraca kecepatan
Kecepatan masuk kecepatan keluar = kecepatan akumulasi z A C C a k C
A G C
A
G c As Ag
z Ag z
Ag z * * * *
*
* (2)
Persamaan (2) dibagi dengan elemen volume (V = A* z), dan dengan mengambil lim z 0, sehingga diperoleh:
Ag As c
z Ag z Ag z
z k a C C
z C G C
G
*
*
* lim
0 (3)
Ag As c
Ag k a C C
dz
GdC * (4)
Persamaan di atas dapat diselesaikan dengan cara pemisahan variabel dan kemudian diintegralkan untuk tiap variabel.
L z
z c C
C As Ag
Ag dz
G a k C C
dC
Ag
Ag 0
2
1
(5) Dengan pengintegralan, maka diperoleh:
G a L C k
C C C
c Ag
As Ag As
2
ln 1 (6)
Pada suatu aliran masuk (gas) belum ada zat padat yang terikut sehingga CAg dianggap nol, sehingga:
G aL C k
C C
c Ag
As As
2
ln (7)
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
Kecepatan perpindahan massa zat padat dalam gas ekuivalen dengan perubahan berat zat per satuan waktu, sehingga dapat ditulis:
t C m
C A
G* * Ag2 Ag1 (8)
Dengan m adalah perubahan jumlah mol naftalena yang diukur pada selang waktu tertentu. Kemudian, karena CAg1 = 0, maka
t C m A
G* * Ag2 (9)
sehingga
t A G CAg m
*
2 * (10)
Persamaan (10) disubstitusikan ke persamaan (7) dan diperoleh:
t A G C m
C L
a G k
As As c
*
*
ln (11)
D. Alat dan Bahan 1. Alat
a. Timbangan b. Gelas c. Stopwatch 2. Bahan
Naftalena (C10H8) atau kapur barus
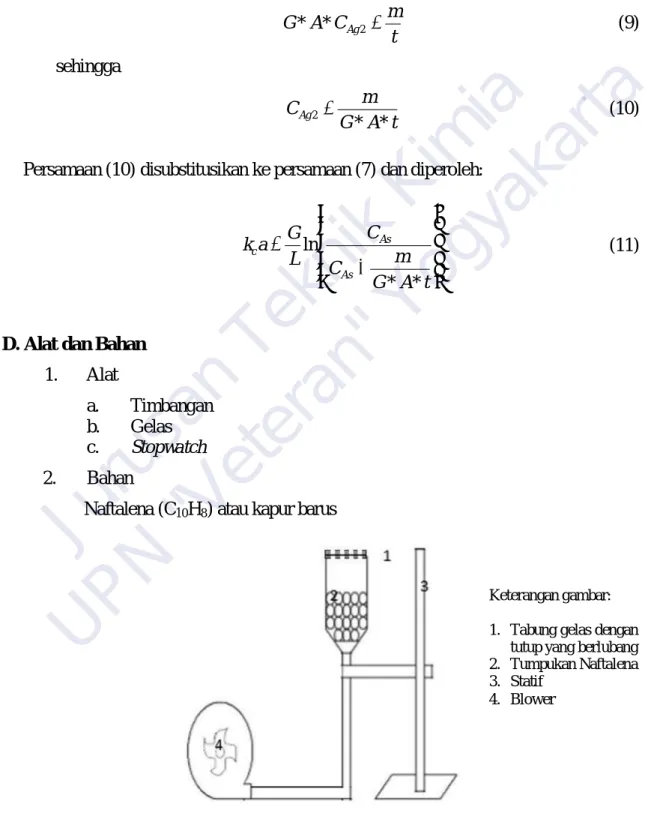
Gambar 4. Rangkaian Alat Transfer Massa
Keterangan gambar:
1. Tabung gelas dengan tutup yang berlubang 2. Tumpukan Naftalena 3. Statif
4. Blower
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
E. Cara Kerja Langkah Kerja
1. Masukkan dan susun naftalena ke dalam tabung gelas dengan tinggi 2 cm dengan posisi vertikal
2. Timbang naftalena dan catat sebagai berat awal
3. Susun kembali naftalena ke dalam tabung gelas sebagaimana langkah (a).
4. Hidupkan blower dan mematikan setelah selang waktu 100 detik.
5. Timbang kembali naftalena. Catat sebagai berat akhir dan berat awal untuk pengukuran berikutnya.
6. Lakukan percobaan sebanyak 5 kali dengan selang waktu yang sama.
7. Ulangi langkah di atas dengan tinggi tumpukan 4 cm dan 6 cm Analisis Perhitungan
a. Penentuan luas penampang
Luas penampang tabung gelas = Luas penampang tabung pipa = b. Penentuan kecepatan linear gas
Ap
G G
'
c. Penghitungan koefisien transfer massa
t A G C m
C L
a G k
As As c
*
* ln
d. Menghitung persen (%) kesalahan
% kesalahan= y data-y hitung
y data x 100%
Daftar simbol :
Ap = Luas penampang pipa (cm2)
A = Luas penampang tabung gelas (cm2)
CAg = Konsentrasi zat pada setiap saat (gmol/cm3) CAs = Konsentrasi jenuh zat pada interface (gmol/cm3) Dp = Diameter pipa (cm)
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
G = Kecepatan linier udara (cm/s) G’ = Kecepatan volumetrik udara (cm3/s) kca = Koefisien transfer massa volumetrik (s-1) L = Tinggi tumpukan (cm)
m = Mol naftalena yang tersublimasi (gmol) t = Waktu (detik)
F. Daftar Pustaka
Brown,G.G.,1978,”Unit Operation”, P.P.511-513,14th ed., Modern Asia Editional, Charles E.Tuttle Company, Tokyo.
Chemisty of Unja, 2011, “Naftalena”, http://kimia-master.blogspot.co.id/2011/11 /definisi-naftalena-adalah-hidrokarbon.html (diakses pada tanggal 2 Juni 2017, pukul 17.51 WIB).
Hardjono, 1989, “Operasi Teknik Kimia II”, Teknik Kimia UGM , Yogyakarta.
Mc.Cabe,W.L., 1983,”Operasi TeknikKimia”’hal.140., edisi keempat, jilid 2, Erlangga, Jakarta.
Nunulasa, 2011, “Reaktor Fixed Bed”, https://nunulasa.wordpress.com/2011/03/
10/reaktor-fixed-bed/ (diakses pada tanggal 2 Juni 2017, pukul 17.49 WIB).
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
TABEL KERJA PRAKTIKUM
HASIL PERCOBAAN
Kecepatan udara masuk = cm3/detik
Konsentrasi jenuh naftalena = gmol/cm3
Berat molekul naftalena = g/gmol
Diameter tabung = cm
Luas penampang tabung = cm2
Diameter pipa = cm
Luas penampang pipa = cm2
Selang waktu = menit = detik
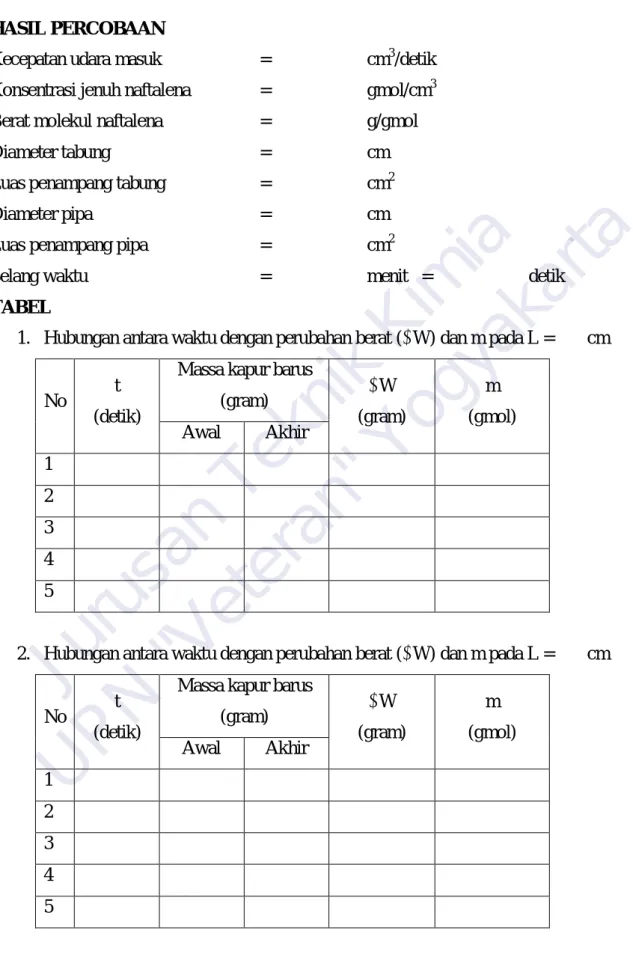
TABEL
1. Hubungan antara waktu dengan perubahan berat ( W) dan m pada L = cm
No t
(detik)
Massa kapur barus
(gram) W
(gram)
m (gmol) Awal Akhir
1 2 3 4 5
2. Hubungan antara waktu dengan perubahan berat ( W) dan m pada L = cm
No t
(detik)
Massa kapur barus
(gram) W
(gram)
m (gmol) Awal Akhir
1 2 3 4 5
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Koefisien Transfer Massa
3. Hubungan antara waktu dengan perubahan berat ( W) dan m pada L = cm
No t
(detik)
Massa kapur barus
(gram) W
(gram)
m (gmol) Awal Akhir
1 2 3 4 5
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Cooling Tower
MODUL 5 COOLING TOWER MODUL 5 COOLING TOWER
A. Latar Belakang
Dalam industri kimia, air pendingin sangat dibutuhkan sebagai media pengambil panas fluida yang terjadi di dalam suatu heat exchanger, atau lebih spesifik disebut sebagai cooler. Pertukaran panas tersebut menyebabkan air dingin mengalami perubahan temperatur. Temperatur air pendingin tersebut naik karena panas yang dibawa oleh suatu fluida diserap oleh air tersebut. Air yang mengalami perubahan temperatur tersebut tidak dapat langsung digunakan kembali sebagai pendingin. Selain itu, air ini tidak dapat dibuang ke sungai maupun ke lingkungan karena temperatur air masih sangat tinggi dan tidak memenuhi syarat Analisis Mengenai Dampak Lingkungan (AMDAL).
Proses pendinginan air tersebut dapat dilakukan dalam suatu menara pendingin yang disebut cooling tower. Proses pendinginan dapat terjadi dengan bantuan udara luar serta alat tertentu untuk mempercepat pendinginan tersebut. Alat yang biasa digunakan dalam industri kimia adalah kipas (fan). Penggunaan teknologi cooling tower di dalam dunia industri sangat penting dalam rangka efisiensi dan konservasi energi. Oleh karena itu, pemahaman tentang prinsip kerja atau operasi cooling tower sangat diperlukan.
B.Tujuan Percobaan
c. Mempelajari pelajari karakteristik menara atau kolom yaitu bilangan satuan transfer unit keseluruhan (NTU), faktor bahan isian (m) dan eksponensial (n).
d. Mempelajari pengaruh kenaikan temperatur air masuk menara terhadap bilangan transfer unit keseluruhan (NTU).
e. Mempelajari pengaruh L/Ga terhadap NTU.
C. Dasar Teori
Menara pendingin (cooling tower) adalah suatu menara yang digunakan untuk mendinginkan air pendingin yang telah mengalami kenaikan suhu pada proses pertukaran panas. Proses ini dilakukan sehingga air pendingin dapat digunakan kembali untuk proses selanjutnya.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Cooling Tower
Prinsip kerja dari cooling tower adalah kontak langsung antara permukaan air dengan udara kering. Apabila air panas berkontak dengan udara yang lebih dingin maka air akan mengalami penurunan temperatur. Penurunan temperatur ini disebabkan oleh penguapan sebagian cairan dan kehilangan panas terindera (sensible heat). Sebaliknya udara akan menjadi panas dan mengalami pelembaban (Hardjono, 1989).
Dalam menara pendingin, kontak antara aliran air panas dengan aliran udara kering berlangsung dengan arus yang berlawanan (countercurrent). Air panas dimasukkan dari atas menara dan dikeluarkan dari bagian dasar menara. Pada bagian atas menara, panas ditransfer dari air panas ke udara. Terjadi gradien temperatur, yaitu temperatur air lebih tinggi daripada lapisan film antarmuka gas-cair (interface) dan temperatur antarmuka lebih tinggi daripada temperatur udara. Panas terindera ini dipindahkan dari air ke udara. Pada bagian dasar menara, temperatur air dan antarmuka bisa jadi lebih rendah daripada udara dan panas terindera ditransfer dari cairan dan udara ke lapisan antarmuka. Panas ini kemudian diserap sebagai panas laten dalam proses penguapan air (Brown, 1978).
Muatan panas (air panas) pada bagian atas kolom dinyatakan sebagai L (lb/jam.ft2), sedangkan pasokan air make-up dinyatakan sebagai Lo (lb/jam.ft2). Jika Q adalah laju panas (BTU/jam) melewati kondensor, maka kita dapat mendefinisikan muatan panas per ft2 sebagai q/A, dengan A adalah luas penampang aliran dalam menara pendingin (Kern, D.Q., 1989).
Gambar 1. Prinsip kerja menara pendingin
Neraca energi untuk udara hasil pendinginan adalah:
Q + LoCp To = G (H2 – H1) (1)
L, T1
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Cooling Tower
Persamaan ini menggunakan temperatur referensi pada °F udara kering, dengan panas uap masuk dalam lb udara kering. (Kern, D.Q., 1989)
Neraca energi untuk komposisi air :
Q = LCp (T1 – T2) + LoCp (T2 – To) (2) Kombinasi dari kedua persamaan diatas adalah :
G (H2 H1) = L Cp ( T1 – T2 ) + Lo Cp T2 (3) Jumlah air make up yang digunakan untuk mengganti air yang menguap adalah :
Lo = G ( X2 – X1) (4)
Dalam menara pendingin, udara digunakan untuk mendinginkan air panas. Air yang telah melewati kolom memiliki temperatur yang lebih rendah dari temperatur kering (dry bulb temperature) udara masuk, tetapi tidak akan lebih rendah daripada temperatur bola basah (wet-bulb temperature) udara masuk.
Pada area teratas dari kolom, air panas mula-mula berkontak dengan udara kering yang lebih dingin dari air panas. Penurunan entalpi air total atau pertambahan entalpi campuran udara adalah setimbang.
dq = d ( LCpT ) = G dH (5) Aliran udara yang melewati menara pendingin adalah tetap karena dinyatakan dalam basis udara kering. Namun, aliran air tidak konstan karena ada yang hilang oleh penguapan. Dengan nilai penguapan yang lebih kecil dari sirkulasi (2%), dapat diasumsikan harga L adalah konstan (Kern, D.Q., 1989).
d (LCpT ) = LCp dT (6)
LCp dT = G dH (7)
Menurut Lewis, persamaan dalam sistem campuran udara dan air dapat dinyatakan sebagai berikut:
LCpdT = G dH = k ( H’ – H ) a dV (8) Di mana Cp air diasumsikan = 1 Btu/lboF
Data-data dalam menara pendingin sering digambarkan dalam bentuk ka. K/L Vs L/G untuk variasi temperatur cooling tower .
Hubungan antara NTU dengan L/Ga dapat didekati dengan persaman polinomial yaitu:
y = ax2 + bx + c; y = NTU ; x = L/Ga.
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Cooling Tower
D. Alat dan Bahan 1. Bahan
a. Air b. Udara 2. Rangkaian Alat
Gambar 2. Rangkaian alat cooling tower
E. Cara Kerja Langkah Kerja
1. Periksa rangkaian alat mengenai kesesuaiannya.
2. Periksa dan catat suhu yang terbaca pada termometer bola basah (Twm) dan termometer bola kering (Tdm) sebagai Twm dan Tdm awal.
3. Masukkan air ke dalam tangki pemanas air, panaskan sampai suhu tertentu kemudian suhu dijaga konstan.
4. Hidupkan kipas exhaust dan pompa secara bersamaan. Atur rotameter pada skala tertentu dan atur keran yang menuju menara pendingin.
5. Pada percobaan pertama, catat Twm, Tdm dan Tair keluar menara pada kecepatan aliran yang konstan.
6. Pada percobaan kedua, lakukan hal yang sama untuk laju alir yang bervariasi dengan suhu masuk yang konstan.
Keterangan gambar : 1. Tangki air panas 2. Pompa
3. Keran pengatur rotameter 4. Rotameter
5. Menara kolom isian 6. Tangki air dingin 7. Tdry
8. Twet
9. Tair keluar menara 10. Baskom air 11. Kompor 12 Kipas exhaust
Jurusan Teknik Kimia
UPN "Veteran" Yogyakarta
Cooling Tower
Analisis Perhitungan
a. Menghitung harga (L/Ga) 1. Menghitung harga L
Dengan diameter pipa (Dp) dihitung luas penampang pipa (Ap) untuk menghitung debit air.
Q = Lv . Ap
Kecepatan massa air dihitung dengan rumus : m = air .Q
1. Menghitung harga Ga
Dengan mengetahui Twm dari percobaan, maka dapat dicari Vs (ft2 udara/lb udara kering) dari tabel 12.4 Perry Chemical Engineer’s Handbook. K