SIMULASI PENDETEKSIAN SINYAL SENSOR GAS H2S MENGGUNAKAN Ag2O BERBASISKAN FUNGSI KERJA
(Skripsi)
Oleh Adi Sucipto 1817041043
JURUSAN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
2022
ii ABSTRAK
SIMULASI PENDETEKSIAN SINYAL SENSOR GAS H2S MENGGUNAKAN Ag2O BERBASISKAN FUNGSI KERJA
Oleh ADI SUCIPTO
Simulasi ini telah berhasil dilakukan dengan tujuan untuk membuat model dalam proses pendeteksian gas H2S pada bahan Ag2O. Hasil simulasi ini dibandingkan dengan hasil eksperimen terkait sensor gas H2S pada bahan Ag2O. Simulasi ini diawali dengan membuat Persamaan Diferensial Biasa (PDB) dari tiga reaksi yang mengandung empat hunian gas yaitu 𝜃H2S, 𝜃O, 𝜃SO2, dan 𝜃H2O. PDB ini diselesaikan dengan program MATLAB. Berdasarkan hasil eksperimen yang ada, dilakukan fitting grafik untuk sensor gas H2S pada bahan Ag2O. Fitting ini perlu dilakukan untuk mengetahui keakuratan dari penyelesaian PDB yang dilakukan oleh MATLAB. Rata- rata selisih antara hasil simulasi dan ekperimen pada setiap parameter yang memiliki nilai terkecil dijadikan sebagai nilai terbaik dari parameter tersebut. Proses pencarian nilai parameter dari selisih nilai simulasi dan eksperimen ini dinamakan optimasi parameter. Parameter yang terlibat antara lain dua Koefisien Lengket Awal, empat Koefisien Arrhenius, dan enam Koefisien Arrhenius. Setiap nilai parameter dioptimasi dengan diberikan nilai awal dan nilai parameter lainnya dibuat konstan.
Setelah semua nilai ditemukan, dilakukan optimasi kedua. Nilai-nilai optimasi parameter didapatkan yaitu 𝑆0−H2S sebesar 0,1528; 𝑆0−O sebesar 0,044; 𝜈𝑓3 sebesar 9,2 × 1012 s-1; 𝜈r1 sebesar 8,29 × 1012 s-1; 𝜈r2 sebesar 1,6 × 1012 s-1; 𝜈r3 sebesar 6,804
× 1012 s-1; 𝐸f1 sebesar 0,074 eV; 𝐸f2 sebesar 0,056 eV; 𝐸f3 sebesar 0,226 eV; 𝐸r1 sebesar 0,72 eV; 𝐸r2 sebesar 0,1264 eV; dan 𝐸r3 sebesar 0,028 eV. Hasil simulasi akhir menunjukkan rata-rata error pada suhu 25 0C, 95 0C, dan 135 0C berturut-turut adalah 35,7378%; 1,4266%; dan 1,3391% dengan hunian tersebesar adalah H2S pada suhu 135 0C dengan nilai 0,0474 ML.
Kata kunci: simulasi, sensor gas, Ag2O, H2S.
iii ABSTRACT
H2S GAS SENSOR SIGNAL DETECTION SIMULATION USING Ag2O BASED ON WORK FUNCTION
By
ADI SUCIPTO
This simulation has been successfully carried out to make a model for the process of detecting H2S gas on Ag2O materials. The results of this simulation are compared with experimental results related to H2S gas sensors on Ag2O materials. This simulation begins by making the Ordinary Differential Equation (ODE) from three reactions containing four gas occupancy, namely 𝜃𝐻2𝑆, 𝜃𝑂, 𝜃𝑆𝑂2, and 𝜃𝐻2𝑂. This ODE is solved by the MATLAB program. Based on the existing experimental results, a graph fitting was carried out for the H2S gas sensor on Ag2O material. This fitting needs to be done to determine the accuracy of the GDP settlement carried out by MATLAB. The average difference between the simulation and experimental results for each parameter that has the smallest value is used as the best value for that parameter. The process of searching for parameter values from the difference between simulation and experimental values is called parameter optimization. The parameters involved include two initial stickiness coefficients, four Arrhenius coefficients, and six Arrhenius coefficients. Each parameter value is optimized given the initial value and the other parameter values are kept constant. After all, values are found, a second optimization is performed. Parameter optimization values obtained are 𝑆0−𝐻2𝑆 is 0,1528; 𝑆0−𝑂 is 0,044; 𝜈𝑓3 is 9,2 × 1012 s-1; 𝜈𝑟1 is 8,29 × 1012 s-1; 𝜈𝑟2 is 1,6 × 1012 s-1; 𝜈𝑟3 is 6,804 × 1012 s-1; 𝐸𝑓1 is 0,074 eV; 𝐸𝑓2 is 0,056 eV; 𝐸𝑓3 is 0,226 eV; 𝐸𝑟1 is 0,72 eV; 𝐸𝑟2 is 0,1264 eV; and 𝐸𝑟3 is 0,028 eV. The final simulation results show the average error at temperatures of 25 0C, 95 0C, and 135
0C, respectively, is 35.7378%; 1.4266%; and 1.3391% with the largest occupancy is H2S at a temperature of 135 0C with a value of 0.0474 ML.
Keyword: simulation, gas sensor, Ag2O, H2S.
iv
SIMULASI PENDETEKSIAN SINYAL SENSOR GAS H2S MENGGUNAKAN Ag2O BERBASISKAN FUNGSI KERJA
Oleh ADI SUCIPTO
Skripsi
Sebagai Salah Satu syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Fisika
Fakultas Matematika dan Ilmu Pengetahuan Alam
JURUSAN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
2022
v
vi
vii
viii
RIWAYAT HIDUP
Penulis bernama lengkap Adi Sucipto. Penulis lahir pada tanggal 04 Mei 1998 di kota Bandar Lampung dan merupakan anak ke-3 dari pasangan Bapak Bastian dan Ibu Yuliana. Penulis menyelesaikan pendidikan dasar di SDIKT Robbi Rodhiya pada tahun 2011. Penulis melanjutkan pendidikan menengah pertama pada tahun 2014 di SMPN 8 Bandar Lampung dan pendidikan menengah atas di selesaikan di SMAN 13 Bandar Lampung pada tahun 2017. Penulis terdaftar sebagai mahasiswa Fisika FMIPA Universitas Lampung pada tahun 2018 melalui jalur Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN). Selama menjadi mahasiswa, penulis aktif menjadi anggota di Himpunan Mahasiswa Fisika pada tahun 2018 – 2019 pada bidang SAINTEK.
Pada tahun 2021, penulis melakukan Praktik Kerja Lapangan (PKL) di Laboratorium Material Universitas Lampung. Dalam bidang kepenulisan ilmiah, penulis memiliki pengalaman menulis laporan PKL dengan judul “Pembuatan Video Praktikum Percobaan Pemuaian Panas Menggunakan Dial Gauge dan Difraksi sebagai Pendukung Pembelajaran Selama Pandemi COVID-19”. Selain itu, penulis pernah terdaftar sebagai peserta pada Program Kreativitas Mahasiswa (PKM) pada tahun 2021. Penulis juga melakukan pengabdian masyarakat lewat program KKN pada tahun 2021 di Kecamatan Teluk Betung Barat, Kelurahan Negeri Olok Gading Kota Bandar Lampung.
ix
MOTTO
“ Hidup bukan tentang memilih, seringkali kitalah yang sedang dipilih ”
(Adi Sucipto)
“ Banyak hal-hal baik di dunia diawali dengan rasa takut ”
(Anonim)
“ Apabila sesuatu yang kau senangi tidak terjadi, maka senangilah apa yang terjadi ”
(Ali bin Abi Thalib)
x
PERSEMBAHAN
Dengan Penuh Rasa Syukur Kepada Allah Subhanahu wa ta’ala, karya ini dipersembahkan kepada :
Kedua Orang Tuaku Bapak Bastian & Ibu Yuliana
Terimakasih untuk segala do’a dan usaha yang selalu diberikan demi kesuksesan putranya hingga mampu meyelesaikan pendidikan di tingkat Universitas sebagai Sarjana Fisika
Keluarga Besar & Teman-teman
Terimakasih atas segala dukungan yang telah diberikan sehingga dapat tetap bertahan dalam keadaan suka maupun duka
Almamater Tercinta UNIVERSITAS LAMPUNG
xi
KATA PENGANTAR
Puji syukur penulis haturkan kepada Allah SWT. karena atas segala rahmat dan karunia yang diberikan, penulis dapat menyelesaikan skripsi yang berjudul “Simulasi Pendeteksian Sinyal Sensor Gas H2S Menggunakan Ag2O Berbasiskan Fungsi Kerja”. Skripsi ini ditulis sebagai syarat untuk meraih gelar Sarjana Sains (S.Si.) pada bidang Fisika Material Fakultas Matematika dan Ilmu Pengetahuan Alam.
Penulis menyadari dalam penulisan skripsi ini terdapat kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran sebagai bahan perbaikan di masa mendatang.
Akhir kata semoga skripsi ini dapat berguna dalam ilmu pengetahuan dan menjadi rujukan pada penelitian-penelitian selanjutnya.
Bandar Lampung, 31 Agustus 2022
Adi Sucipto
xii SANWACANA
Puji syukur kehadirat Allah SWT. yang telah memberikan nikmat sehat serta karunia- Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Simulasi Pendeteksian Sinyal Sensor Gas H2S Menggunakan Ag2O Berbasiskan Fungsi Kerja”. Penulisan skripsi ini dapat diselesaikan karena penulis menerima banyak bantuan baik secara langsung ataupun tidak langsung. Oleh kerana itu, pada kesempatan ini penulis akan menyampaikan terima kasih kepada pihak-pihak yang telah membantu penulis dalam menyelesaikan skripsi ini antara lain:
1. Ayah dan Umak yang selalu mendo’akan penulis dan terus memberikan kasih sayang sehingga penulis dapat menyelesaikan pendidikan di Universitas Lampung.
2. Bapak Dr. rer. nat. Roniyus Marjunus, M.Si. sebagai pembimbing utama yang telah membimbing penulis dengan sangat sabar serta telah memberi pemahaman terkait penulisan skripsi ini.
3. Bapak Iqbal Firdaus, M.Si. sebagai pembimbing kedua yang senantiasa membantu, membimbing, dan memberi pemahaman kepada penulis.
4. Ibu Dr. Yanti Yulianti, M.Si. sebagai dosen penguji yang telah memberi masukan dan koreksi dalam penyelesaian skripsi ini.
xiii
5. Bapak Gurum Ahmad Pauzi, S.Si., M.T. selaku Ketua Jurusan Fisika FMIPA Universitas Lampung.
6. Bapak Drs. Syafriadi, M.Si. sebagai Pembimbing Akademik yang senantiasa membantu dan memberikan nasihat kepada penulis.
7. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku Dekan FMIPA Universitas Lampung.
8. Kakak pertama penulis, Pipit Ashari yang sangat membantu penulis baik dari segi moral dan material, serta terus mendo’akan dan memberikan semangat kepada penulis dalam menyelesaikan skripsi ini.
9. Kakak kedua penulis, Ari Yatno yang telah membantu penulis.
10. Teman-teman seperjuangan Ahmad Saiful Munir, Eza Ariyani, Selvi Hidayanti, Faradilla Nabila, Tiara Widiastuti, Anisyah Anggraini, Sonya Gultom, Cahlia Kurnia, Nindya Aisha, dan Silvi Indah yang telah membantu penulis saat memulai penelitian hingga penelitian selesai.
11. Keluarga besar Lapet yang sudah memberikan dukungan, semangat, serta menjadi tempat berkeluh kesah selama penyelesaian skripsi ini.
12. Rekan-rekan Guru SDN 3 Kampung Baru yang terus memberi semangat kepada penulis untuk menyelesaikan skripsi ini.
13. Seluruh mahasiswa/i jurusan Fisika FMIPA Universitas Lampung angkatan 2018, dan teman- teman yang tidak bisa saya sebutkan satu per satu.
Akhir kata, penulis haturkan do’a dan panjatkan rasa syukur kepada Allah SWT, semoga Allah SWT memberikan imbalan yang berlipat atas bantuan semua pihak dan
xiv
semoga Allah SWT selalu memudahkan langkah kita yang telah membantu penulis dalam menyelesaikan skripsi ini.
Bandar Lampung, 31 Agustus 2022
Adi Sucipto
xv DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
ABSTRAK ... ii
ABSTRACT ... iii
HALAMAN JUDUL ... iv
LEMBAR PERSETUJUAN ... v
LEMBAR PENGESAHAN ... vi
HALAMAN PERNYATAAN ... vii
RIWAYAT HIDUP ... viii
MOTTO ... ix
PERSEMBAHAN ... x
KATA PENGANTAR ... xi
SANWACANA ... xii
DAFTAR ISI ... xv
DAFTAR GAMBAR ... xix
DAFTAR TABEL ... xxvii
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
xvi
1.2 Rumusan Masalah ... 4
1.3 Batasan Masalah ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA ... 6
2.1 Interaksi Gas dengan Permukaan Bahan ... 6
2.1.1 Fungsi Kerja (ɸ) ... 6
2.1.2 Adsorpsi ... 7
2.1.3 Reaksi ... 10
2.1.4 Disosiasi ... 10
2.1.5 Desorpsi ... 11
2.2 Reaksi Pendeteksian Gas H2S ... 11
2.3 Pendeteksian Gas H2S Berbasis Perubahan Fungsi Kerja () ... 14
III. METODE PENELITIAN ... 16
3.1 Tempat dan Waktu Penelitian ... 16
3.2 Alat dan Bahan ... 16
3.3 Prosedur Penelitian ... 16
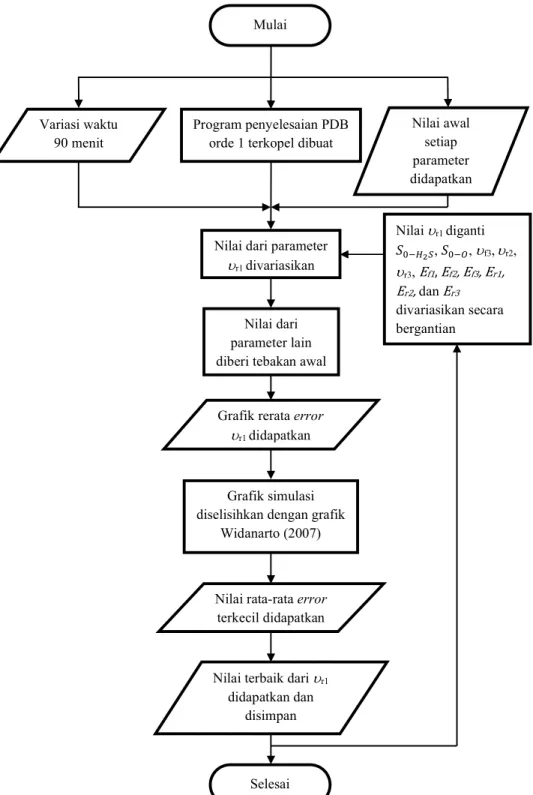
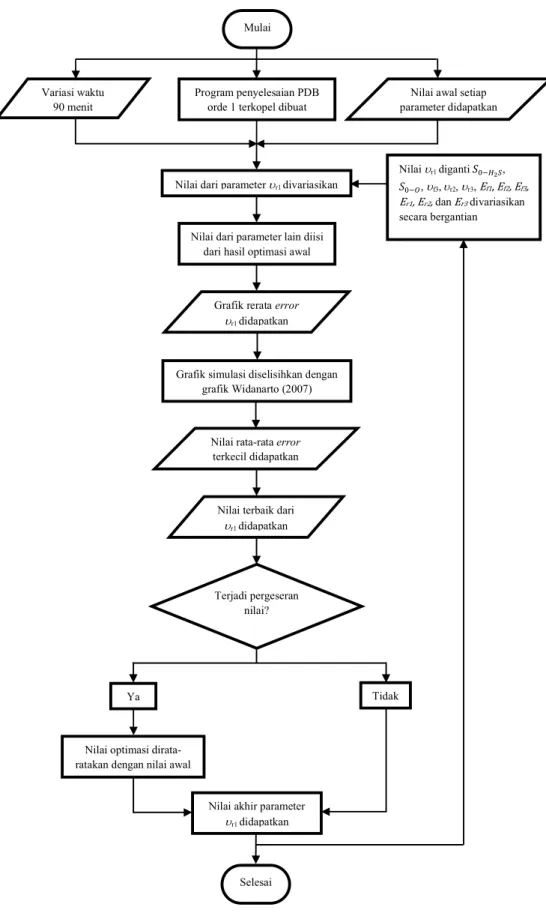
3.3.1 Menyusun Persamaan Diferensial Biasa (PDB) Orde Satu untuk Hunian Molekul/Atom... 16
3.3.2 Fitting Persamaan Garis pada Hasil Penelitian Widanarto dkk., (2011) ... 16
3.3.3 Optimasi Parameter ... 17
3.3.4 Optimasi Ulang Parameter ... 18
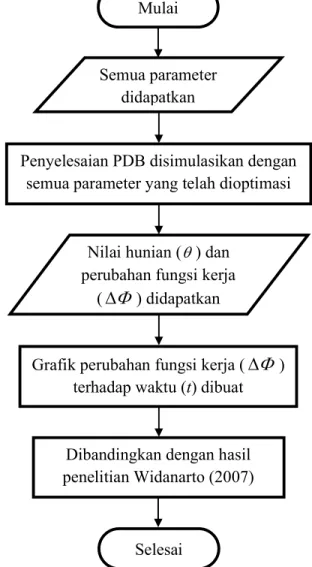
3.3.5 Simulasi Akhir Perubahan Fungsi Kerja Terhadap Waktu ... 19
3.4 Diagram Alir ... 20
IV. HASIL DAN PEMBAHASAN ... 23
4.1 Penyusunan Persamaan Diferensial ... 23
4.2 Persamaan Garis Penelitian Widanarto (2007) ... 24
4.3 Optimasi Parameter ... 28
xvii
4.3.1 Energi Adsorpsi H2S pada Bahan Ag2O (𝐸f1) ... 29
4.3.2 Energi Adsorpsi O pada Bahan Ag2O (𝐸f2) ... 31
4.3.3 Energi Reaksi Maju H2S dan O pada Bahan Ag2O (𝐸f3) ... 33
4.3.4 Energi Desorpsi H2S pada Bahan Ag2O (𝐸r1) ... 35
4.3.5 Energi Desorpsi O pada Bahan Ag2O (𝐸r2) ... 37
4.3.6 Energi Reaksi Balik SO2 dan H2O pada Bahan Ag2O (𝐸r3) ... 39
4.3.7 Koefisien Lengket Awal H2S pada Bahan Ag2O (𝑆0−H2S) ... 41
4.3.8 Koefisien Lengket Awal O pada Bahan Ag2O (𝑆0−O) ... 44
4.3.9 Koefisien Arrhenius Reaksi Maju H2S dan O pada Bahan Ag2O (𝜈f3) ... 46
4.3.10 Koefisien Arrhenius Desorpsi H2S pada Bahan Ag2O (𝜈r1) ... 48
4.3.11 Koefisien Arrhenius Desorpsi O pada Bahan Ag2O (𝜈r2) ... 50
4.3.12 Koefisien Arrhenius Reaksi Balik SO2 dan H2O pada Bahan Ag2O (𝜈r3) ... 52
4.4 Optimasi Ulang Parameter ... 54
4.4.1 Energi Adsorpsi H2S pada Bahan Ag2O (𝐸f1) ... 55
4.4.2 Energi Adsorpsi O pada Bahan Ag2O (𝐸f2) ... 57
4.4.3 Energi Reaksi Maju H2S dan O pada Bahan Ag2O (𝐸f3) ... 59
4.4.4 Energi Desorpsi H2S pada Bahan Ag2O (𝐸r1) ... 62
4.4.5 Energi Desorpsi O pada Bahan Ag2O (𝐸r2) ... 64
4.4.6 Energi Reaksi Balik SO2 dan H2O pada Bahan Ag2O (𝐸r3) ... 67
4.4.7 Koefisien Lengket Awal H2S pada Bahan Ag2O (𝑆0−H2S) ... 69
4.4.8 Koefisien Lengket Awal O pada Bahan Ag2O (𝑆0−O) ... 72
4.4.9 Koefisien Arrhenius Reaksi Maju H2S dan O pada Bahan Ag2O (𝜈f3) ... 74
4.4.10 Koefisien Arrhenius Desorpsi H2S pada Bahan Ag2O (𝜈r1) ... 77
4.4.11 Koefisien Arrhenius Desorpsi O pada Bahan Ag2O (𝜈r2) ... 79
4.4.12 Koefisien Arrhenius Reaksi Balik SO2 dan H2O pada Bahan Ag2O (𝜈r3) ... 81
4.5 Simulasi Akhir ... 84
xviii
4.6 Persamaan Garis Penelitian Widanarto (2007) untuk Suhu 25 oC
dan 135 oC ... 88 4.7 Optimasi Koefisien Lengket Awal untuk Suhu 25 oC ... 95
4.7.1 Optimasi Koefisien Lengket Awal H2S pada Bahan Ag2O (𝑆0−H2S) untuk Suhu 25 oC ... 95 4.7.2 Optimasi Koefisien Lengket Awal O pada Bahan Ag2O (𝑆0−O)
untuk Suhu 25 oC ... 97 4.8 Optimasi Ulang Koefisien Lengket Awal untuk Suhu 25 oC ... 100
4.8.1 Optimasi Ulang Koefisien Lengket Awal H2S pada Bahan Ag2O (𝑆0−H2S) untuk Suhu 25 oC ... 100 4.8.2 Optimasi Ulang Koefisien Lengket Awal O pada Bahan
Ag2O (𝑆0−O) untuk Suhu 25 oC ... 102 4.9 Optimasi Koefisien Lengket Awal untuk Suhu 135 oC ... 105
4.9.1 Optimasi Koefisien Lengket Awal H2S pada Bahan Ag2O (𝑆0−H2S) untuk Suhu 135 oC ... 105 4.9.2 Optimasi Koefisien Lengket Awal O pada Bahan Ag2O (𝑆0−O)
untuk Suhu 135 oC ... 107 4.10 Optimasi Ulang Koefisien Lengket Awal untuk Suhu 135 oC ... 109
4.10.1 Optimasi Ulang Koefisien Lengket Awal H2S pada Bahan Ag2O (𝑆0−H2S) untuk Suhu 135 oC ... 109 4.10.2 Optimasi Ulang Koefisien Lengket Awal O pada Bahan
Ag2O (𝑆0−O) untuk Suhu 135 oC ... 112 4.11 Simulasi Akhir untuk Suhu 25 oC, Suhu 95 oC, dan Suhu 135 oC ... 114 4.12 Hunian/Coverage untuk Suhu 25 oC, Suhu 95 oC, dan Suhu 135 oC .... 117 IV. KESIMPULAN DAN SARAN ... 121
DAFTAR PUSTAKA LAMPIRAN
xix
DAFTAR GAMBAR
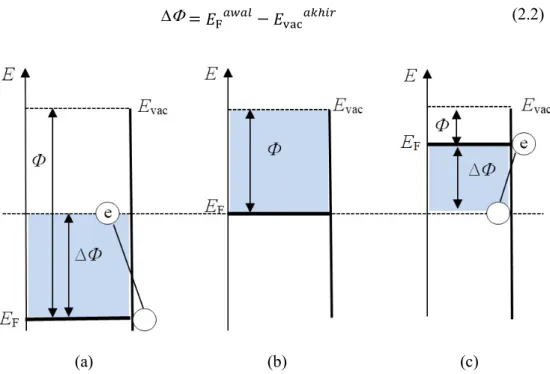
Halaman Gambar 2.1 Grafik energi perubahan fungsi kerja (∆Փ) akibat adsorpsi
gas pada permukaan bahan yang mana (a) terpapar gas pengoksidasi, (b) tidak terpapar gas dan (c) terpapar gas
pereduksi (Senft dkk., 2011) ... 7 Gambar 2.2 Proses (a) adsorpsi fisika dan (b) adsorpsi kimia ... 8 Gambar 2.3 Efek temperatur pada sensor selama pengukuran 20 ppm H2S
(Widanarto, 2007)... 14 Gambar 3.1 Diagram alir optimasi parameter ... 20 Gambar 3.2 Diagram alir optimasi ulang ... 21 Gambar 3.3 Diagram alir simulasi final perubahan fungsi kerja () terhadap
waktu (𝑡) ... 22 Gambar 4.1 Fitting kurva terhadap penelitian Widanarto (2007) ... 25 Gambar 4.2 Grafik optimasi parameter 𝐸f1 pada range energi 0-10 eV dengan
partisi 1 ... 29 Gambar 4.3 Grafik optimasi parameter 𝐸f1 pada range energi 0-10 eV dengan
partisi 0,1 ... 30 Gambar 4.4 Grafik optimasi parameter 𝐸f1 pada range energi 0-1 eV dengan
partisi 0,01 ... 31 Gambar 4.5 Grafik optimasi parameter 𝐸f2 pada range energi 0-10 eV dengan
partisi 1 ... 32
xx
Gambar 4.6 Grafik optimasi parameter 𝐸f2 pada range energi 0-10 eV dengan partisi 0,1 ... 32 Gambar 4.7 Grafik optimasi parameter 𝐸f2 pada range energi 0-1 eV dengan
partisi 0,01 ... 33 Gambar 4.8 Grafik optimasi parameter 𝐸f3 pada range energi 0-10 eV dengan
partisi 1 ... 34 Gambar 4.9 Grafik optimasi parameter 𝐸f3 pada range energi 0-10 eV dengan
partisi 0,1 ... 34 Gambar 4.10 Grafik optimasi parameter 𝐸f3 pada range energi 0-1 eV dengan
partisi 0,01 ... 35 Gambar 4.11 Grafik optimasi parameter 𝐸r1 pada range energi 0-10 eV dengan
partisi 1 ... 36 Gambar 4.12 Grafik optimasi parameter 𝐸r1 pada range energi 0-10 eV dengan
partisi 0,1 ... 36 Gambar 4.13 Grafik optimasi parameter 𝐸r1 pada range energi 0-1 eV dengan
partisi 0,01 ... 37 Gambar 4.14 Grafik optimasi parameter 𝐸r2 pada range energi 0-10 eV dengan
partisi 1 ... 38 Gambar 4.15 Grafik optimasi parameter 𝐸r2 pada range energi 0-10 eV dengan
partisi 0,1 ... 38 Gambar 4.16 Grafik optimasi parameter 𝐸r2 pada range energi 0-1 eV dengan
partisi 0,01 ... 39 Gambar 4.17 Grafik optimasi parameter 𝐸r3 pada range energi 0-10 eV dengan
partisi 1 ... 40 Gambar 4.18 Grafik optimasi parameter 𝐸r3 pada range energi 0-10 eV dengan
partisi 0,1 ... 40 Gambar 4.19 Grafik optimasi parameter 𝐸r3 pada range energi 0-1 eV dengan
partisi 0,01 ... 41 Gambar 4.20 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0-10 dengan
partisi 1 ... 42 Gambar 4.21 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0-10 dengan
partisi 0,1 ... 43
xxi
Gambar 4.22 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0-1 dengan partisi 0,01 ... 43 Gambar 4.23 Grafik optimasi parameter 𝑆0−𝑂 pada range nilai 0-10 dengan
partisi 1 ... 44 Gambar 4.24 Grafik optimasi parameter 𝑆0−𝑂 pada range nilai 0-10 dengan
partisi 0,1 ... 45 Gambar 4.25 Grafik optimasi parameter 𝑆0−𝑂 pada range nilai 0-1 dengan
partisi 0,01 ... 45 Gambar 4.26 Grafik optimasi parameter 𝜈f3 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1012 ... 46 Gambar 4.27 Grafik optimasi parameter 𝜈f3 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1011 ... 47 Gambar 4.28 Grafik optimasi parameter 𝜈f3 pada range nilai 7 × 1012−
1 × 1013 s-1 dengan partisi 1 × 1012 ... 47 Gambar 4.29 Grafik optimasi parameter 𝜈r1 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1012 ... 48 Gambar 4.30 Grafik optimasi parameter 𝜈r1 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1011 ... 49 Gambar 4.31 Grafik optimasi parameter 𝜈r1 pada range nilai 7 × 1012−
1 × 1013 s-1 dengan partisi 1 × 1010 ... 49 Gambar 4.32 Grafik optimasi parameter 𝜈r2 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1012 ... 50 Gambar 4.33 Grafik optimasi parameter 𝜈r2 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1011 ... 51 Gambar 4.34 Grafik optimasi parameter 𝜈r2 pada range nilai 0 − 2 × 1012 s-1
dengan partisi 2 × 1010 ... 51 Gambar 4.35 Grafik optimasi parameter 𝜈r3 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1012 ... 52 Gambar 4.36 Grafik optimasi parameter 𝜈r3 pada range nilai 0 − 1 × 1013 s-1
dengan partisi 1 × 1011 ... 53 Gambar 4.37 Grafik optimasi parameter 𝜈r3 pada range nilai 2 × 1012− 1 ×
1013 s-1 dengan partisi 2 × 1010 ... 53
xxii
Gambar 4.38 Grafik optimasi ulang parameter 𝐸f1 pada range nilai 0-10 eV dengan partisi 1 ... 55 Gambar 4.39 Grafik optimasi ulang parameter 𝐸f1 pada range nilai 0-10 eV
dengan partisi 0,02 ... 56 Gambar 4.40 Grafik optimasi ulang parameter 𝐸f1 pada range nilai 0-1 eV
dengan partisi 0,002 ... 56 Gambar 4.41 Grafik optimasi ulang parameter 𝐸f2 pada range nilai 0-10 eV
dengan partisi 1 ... 57 Gambar 4.42 Grafik optimasi ulang parameter 𝐸f2 pada range nilai 0-10 eV
dengan partisi 0,02 ... 58 Gambar 4.43 Grafik optimasi ulang parameter 𝐸f2 pada range nilai 0-2 eV
dengan partisi 0,004 ... 59 Gambar 4.44 Grafik optimasi ulang parameter 𝐸f3 pada range nilai 0-10 eV
dengan partisi 1 ... 60 Gambar 4.45 Grafik optimasi ulang parameter 𝐸f3 pada range nilai 0-10 eV
dengan partisi 0,02 ... 60 Gambar 4.46 Grafik optimasi ulang parameter 𝐸f3 pada range nilai 0-1 eV
dengan partisi 0,002 ... 61 Gambar 4.47 Grafik optimasi ulang parameter 𝐸r1 pada range nilai 0-10 eV
dengan partisi 1 ... 62 Gambar 4.48 Grafik optimasi ulang parameter 𝐸r1 pada range nilai 0-10 eV
dengan partisi 0,02 ... 63 Gambar 4.49 Grafik optimasi ulang parameter 𝐸r1 pada range nilai 0-1 eV
dengan partisi 0,002 ... 64 Gambar 4.50 Grafik optimasi ulang parameter 𝐸𝑟2 pada range nilai 0-10 eV
dengan partisi 1 ... 65 Gambar 4.51 Grafik optimasi ulang parameter 𝐸r2 pada range nilai 0-1 eV
dengan partisi 0,002 ... 66 Gambar 4.52 Grafik optimasi ulang parameter 𝐸r2 pada range nilai 0 − 0,4 eV
dengan partisi 0,0008 ... 66 Gambar 4.53 Grafik optimasi ulang parameter 𝐸r3 pada range nilai 0-10 eV
dengan partisi 1 ... 67
xxiii
Gambar 4.54 Grafik optimasi ulang parameter 𝐸r3 pada range nilai 0-10 eV dengan partisi 0,02 ... 68 Gambar 4.55 Grafik optimasi ulang parameter 𝐸r3 pada range nilai 0-1 eV
dengan partisi 0,002 ... 69 Gambar 4.56 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai 0-10
dengan partisi 1 ... 70 Gambar 4.57 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai 0-1
dengan partisi 0,002 ... 70 Gambar 4.58 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai 0 − 0,2
dengan partisi 0,0004 ... 71 Gambar 4.59 Grafik optimasi ulang parameter 𝑆0−𝑂 pada range nilai 0-10 eV
dengan partisi 1 ... 72 Gambar 4.60 Grafik optimasi ulang parameter 𝑆0−O pada range nilai 0-10 eV
dengan partisi 0,02 ... 73 Gambar 4.61 Grafik optimasi ulang parameter 𝑆0−𝑂 pada range nilai 0-1 eV
dengan partisi 0,002 ... 74 Gambar 4.62 Grafik optimasi ulang parameter 𝜈f3 pada range nilai 0 −
1 × 1013 s-1 dengan partisi 1 × 1012 ... 75 Gambar 4.63 Grafik optimasi ulang parameter 𝜈f3 pada range nilai 0 −
1 × 1013 s-1 dengan partisi 2 × 1010 ... 75 Gambar 4.64 Grafik optimasi ulang parameter 𝜈f3 pada range nilai
9 × 1012− 1 × 1013 s-1 dengan partisi 2 × 109 ... 76 Gambar 4.65 Grafik optimasi ulang parameter 𝜈r1 pada range nilai 0 −
1 × 1013 s-1 dengan partisi 1 × 1012 ... 77 Gambar 4.66 Grafik optimasi ulang parameter 𝜈r1 pada range nilai 0 −
1 × 1013 s-1 dengan partisi 2 × 1010 ... 78 Gambar 4.67 Grafik optimasi ulang parameter 𝜈r1 pada range nilai 8 × 1012−
1 × 1013 s-1 dengan partisi 2 × 109 ... 78 Gambar 4.68 Grafik optimasi ulang parameter 𝜈r2 pada range nilai 0 −
1 × 1013 s-1 dengan partisi 1 × 1011 ... 79 Gambar 4.69 Grafik optimasi ulang parameter 𝜈r2 pada range nilai 0 − 1 × 1013 s-1 dengan partisi 2 × 1010 ... 80
xxiv
Gambar 4.70 Grafik optimasi ulang parameter 𝜈r2 pada range nilai 1 × 1012− 3 × 1013 s-1 dengan partisi 2 × 109 ... 81 Gambar 4.71 Grafik optimasi ulang parameter 𝜈r3 pada range nilai 0 −
1 × 1013 s-1 dengan partisi 1 × 1012 ... 82 Gambar 4.72 Grafik optimasi ulang parameter 𝜈r3 pada range nilai 0 −
1 × 1013 s-1 dengan partisi 2 × 1010 ... 82 Gambar 4.73 Grafik optimasi ulang parameter 𝜈r3 pada range nilai 6 × 1012−
8 × 1012 s-1 dengan partisi 2 × 109 ... 83 Gambar 4.74 Grafik perbandingan CPD (V) antara eksperimen Widanarto
(2007) dan hasil simulasi pada bahan Ag2O untuk suhu 95 oC ... 85 Gambar 4.75 Grafik perbandingan CPD (V) antara eksperimen Widanarto
(2007) dan hasil simulasi pada bahan Ag2O pada suhu 25 oC ... 87 Gambar 4.76 Grafik perbandingan CPD (V) antara eksperimen Widanarto
(2007) dan hasil simulasi pada bahan Ag2O pada suhu 135 oC .... 87 Gambar 4.77 Fitting kurva terhadap penelitian Widanarto (2007) untuk
suhu 25 oC ... 89 Gambar 4.78 Fitting kurva terhadap penelitian Widanarto (2007) untuk
suhu 135 oC ... 92 Gambar 4.79 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0 − 0,01
dengan partisi 0,00002 untuk suhu 25 oC ... 95 Gambar 4.80 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0 − 1 × 10−3
dengan partisi 1 × 10−6 untuk suhu 25 oC ... 96 Gambar 4.81 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0 − 1 × 10−4
dengan partisi 2 × 10−7 untuk suhu 25 oC ... 97 Gambar 4.82 Grafik optimasi parameter 𝑆0−O pada range nilai 0 − 10 dengan
partisi 0,02 untuk suhu 25 oC ... 98 Gambar 4.83 Grafik optimasi parameter 𝑆0−O pada range nilai 0 − 1 dengan
partisi 0,002 untuk suhu 25 oC ... 99 Gambar 4.84 Grafik optimasi parameter 𝑆0−O pada range nilai 0 − 0,1 dengan
partisi 0,0002 untuk suhu 25 oC ... 99 Gambar 4.85 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai 0 − 0,1
dengan partisi 0,0002 untuk suhu 25 oC ... 100
xxv
Gambar 4.86 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai 0 − 0,01 dengan partisi 0,00002 untuk suhu 25 oC ... 101 Gambar 4.87 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai 0 −
1 × 10−3 dengan partisi 2 × 10−6 untuk suhu 25 oC ... 102 Gambar 4.88 Grafik optimasi ulang parameter 𝑆0−O pada range nilai 0 − 10
dengan partisi 0,02 untuk suhu 25 oC ... 103 Gambar 4.89 Grafik optimasi ulang parameter 𝑆0−O pada range nilai 0 − 2
dengan partisi 0,004 untuk suhu 25 oC ... 103 Gambar 4.90 Grafik optimasi ulang parameter 𝑆0−O pada range nilai 0 − 0,1
dengan partisi 0,0002 untuk suhu 25 oC ... 104 Gambar 4.91 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0 − 10
dengan partisi 1 untuk suhu 135 oC ... 105 Gambar 4.92 Grafik optimasi parameter 𝑆0−H2S pada range nilai 0 − 10
dengan partisi 0,02 untuk suhu 135 oC ... 106 Gambar 4.93 Grafik optimasi parameter 𝑆0−H2S pada range nilai 2 − 4
dengan partisi 0,004 untuk suhu 135 oC ... 106 Gambar 4.94 Grafik optimasi parameter 𝑆0−O pada range nilai 0 − 10
dengan partisi 1 untuk suhu 135 oC ... 107 Gambar 4.95 Grafik optimasi parameter 𝑆0−O pada range nilai 0 − 10
dengan partisi 0,02 untuk suhu 135 oC ... 108 Gambar 4.96 Grafik optimasi parameter 𝑆0−O pada range nilai 0 − 1
dengan partisi 0,002 untuk suhu 135 oC ... 108 Gambar 4.97 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai
0 − 10 dengan partisi 1 untuk suhu 135 oC ... 110 Gambar 4.98 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai
0 − 10 dengan partisi 0,02 untuk suhu 135 oC ... 110 Gambar 4.99 Grafik optimasi ulang parameter 𝑆0−H2S pada range nilai
2 − 4 dengan partisi 0,004 untuk suhu 135 oC ... 111 Gambar 4.100 Grafik optimasi ulang parameter 𝑆0−O pada range nilai
0 − 10 dengan partisi 1 untuk suhu 135 oC ... 112
xxvi
Gambar 4.101 Grafik optimasi ulang parameter 𝑆0−O pada range nilai
0 − 10 dengan partisi 0,02 untuk suhu 135 oC ... 113 Gambar 4.102 Grafik optimasi ulang parameter 𝑆0−O pada range nilai
0 − 1 dengan partisi 0,002 untuk suhu 135 oC ... 113 Gambar 4.103 Grafik perbandingan CPD (V) antara eksperimen
Widanarto (2007) dan hasil simulasi pada bahan Ag2O untuk suhu 25 oC setelah optimasi koefisien lengket H2S dan O (a) menggunakan nilai koefisien lengket
awal dan (b) menggunakan fungsi lengket awal ... 115 Gambar 4.104 Grafik perbandingan CPD (V) antara eksperimen
Widanarto (2007) dan hasil simulasi pada bahan Ag2O untuk suhu 95 oC (a) menggunakan nilai koefisien
lengket awal dan (b) menggunakan fungsi lengket awal ... 115 Gambar 4.105 Grafik perbandingan CPD (V) antara eksperimen
Widanarto (2007) dan hasil simulasi pada bahan Ag2O untuk suhu 135 oC setelah optimasi koefisien lengket H2S dan O (a) menggunakan nilai koefisien lengket
awal dan (b) menggunakan fungsi lengket awal ... 116 Gambar 4.106 Hunian Gas H2S pada permukaan Ag2O untuk suhu 25 oC,
95 oC, dan 135 oC ... 117 Gambar 4.107 Hunian atom O pada permukaan Ag2O untuk suhu 25 oC,
95 oC, dan 135 oC ... 118 Gambar 4.108 Hunian atom SO2 pada permukaan Ag2O untuk suhu 25 oC,
95 oC, dan 135 oC ... 119 Gambar 4.109 Hunian H2O pada permukaan Ag2O untuk suhu 25 oC, 95 oC,
dan 135 oC ... 120
xxvii
DAFTAR TABEL
Halaman
Tabel 2.1 Parameter proses adsorbs/desorpsi/reaksi ... 13 Tabel 3.1 Nilai tebakan awal untuk optimasi parameter ... 18 Tabel 4.1 Persamaan garis hasil fitting penelitian Widanarto (2007) ... 25 Tabel 4.2 Hasil optimasi awal parameter ... 54 Tabel 4.3 Rekapitulasi nilai optimasi parameter ... 84 Tabel 4.4 Nilai akhir parameter-parameter yang terlibat ... 85 Tabel 4.5 Perbandingan nilai perubahan CPD antara eksperimen dan
simulasi ... 86 Tabel 4.6 Nilai parameter-parameter untuk optimasi variasi suhu 25 oC
dan 135 oC ... 88 Tabel 4.7 Persamaan garis hasil fitting penelitian Widanarto (2007)
untuk suhu 25 oC ... 89 Tabel 4.8 Persamaan garis hasil fitting penelitian Widanarto (2007)
untuk suhu 135 oC ... 92 Tabel 4.9 Hasil optimasi koefisien lengket awal untuk suhu 135 oC ... 109 Tabel 4.10 Nilai koefisien lengket untuk suhu 25 0C dan 135 0C ... 114
1
I. PENDAHULUAN
1.1 Latar Belakang
Pencemaran udara saat ini sedang menjadi permasalahan di dunia. Banyak sekali upaya baik dari pemerintah maupun ilmuwan untuk mencegah dan mengatasi pencemaran udara. Pencemaran udara diakibatkan oleh bau terutama gas NH3
(Amonia), H2S (Hidrogen Sulfida), CH3S (Methanethiolate), (CH3)2S2 (Metil Disulfida), asam-asam alifatik, serta CO (Karbon Monoksida) (Rosenfeld dan Henry, 2000). Di antara gas yang telah disebutkan, gas H2S memiliki tingkat toksisitas yang tinggi dibandingkan dengan senyawa HCN (Hidrogen Sianida) (Cotton dan Wilkinson, 1989).
H2S merupakan gas alam yang memiliki bau menyengat seperti telur busuk. Bau telur busuk pada gas H2S dapat tercium bahkan pada konsentrasi 0,5 ppm (Soemirat, 2004). Karakteristik dari gas H2S yaitu tidak memiliki warna dan mudah terbakar. Gas H2S digolongkan sebagai gas asphyxiant yaitu gas yang dapat menggantikan oksigen dalam sistem pernapasan yang akan menyebabkan asfiksia dan berujung kematian (Soemirat, 2009). Gas H2S dapat ditemukan di peternakan karena dihasilkan dari dekomposisi limbah hasil peternakan yang menyebabkan asfiksia pada peternak karena gas H2S membuat gangguan pada proses respirasi sel dengan menghambat enzim Sitokrom C Oksigenase (Hayatilllah dan Suwandi, 2018). Menurut National Institute for Occupational Safety and Health, H2S dapat
2
dengan cepat melumpuhkan saraf penciuman pada konsentrasi 100 ppm dan juga menjadi penyebab utama kematian mendadak di tempat kerja.
Karena banyaknya bahaya dari gas H2S, maka diperlukan sebuah sensor gas pendeteksian kadar gas H2S agar pencemarannya dapat dikendalikan. Sensor gas merupakan alat yang memanfaatkan perubahan kondisi lingkungan menjadi sinyal listrik. Besarnya sinyal listrik yang dihasilkan akan tergantung dari konsentrasi dan jenis gas yang mengenai sensor tersebut. Bahan semikonduktor logam oksida biasanya digunakan sebagai sensor gas (Wang dkk., 1998). Prinsip kerja dari sensor gas adalah ketika gas mengenai permukaan sensor maka akan terjadi perubahan nilai resistansi (Korotcenkov, 2014) atau perubahan nilai fungsi kerja (Capone dkk., 2003).
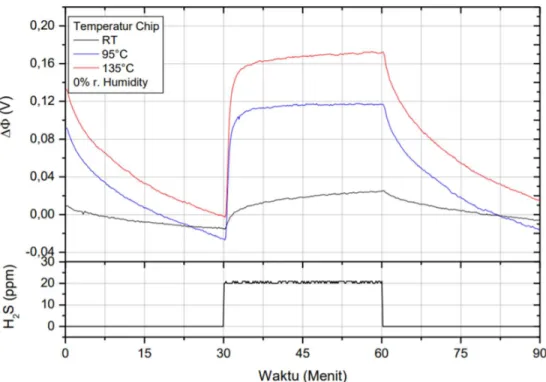
Penelitian terkait sensor gas H2S telah dilakukan oleh Widanarto (2007) menggunakan bahan Ag2O yang dilakukan dengan mengalirkan gas H2S selama 15 menit pada suhu 135 0C, 95 0C, dan suhu kamar. Widanarto (2007) mendapatkan perubahan fungsi kerja (ΔΦ) sebesar 0,12 V pada suhu 95 0C. Simulasi tentang sensor gas H2S perlu dilakukan untuk memberikan informasi yang berguna agar lebih memahami interaksi, reaksi, dan cara kerja dari sebuah sensor yang menggunakan bahan tertentu.
Susanto (2020) telah melakukan simulasi terkait gas NH3 (Amonia) pada bahan ZnO yang hasilnya dibandingkan dengan penelitian Widanarto (2007). Susanto (2020) menggunakan dua belas parameter yang terlibat dalam mekanisme reaksi agar diperoleh nilai terbaik berdasarkan rerata error terkecil. Hasil perubahan fungsi kerja (ΔΦ) yang didapatkan oleh Susanto (2020) pada simulasi sebesar 12,7 mV sedangkan pada hasil percobaan Widanarto (2007) sebesar 15,5 mV. Meskipun
3
terdapat perbedaan perubahan fungsi kerja hasil simulasi pada penelitian Susanto (2020) dengan hasil penelitian Widanarto (2007), namun trend grafik yang dihasilkan antara simulasi dan percobaan sama.
Zuandara (2020) juga telah melakukan simulasi terkait gas SO2 pada bahan ZnO yang hasilnya juga dibandingkan dengan penelitian yang dilakukan oleh Widanarto (2007). Hasil perubahan fungsi kerja (ΔΦ) yang didapatkan oleh Zuandara (2020) pada simulasi sebesar -9 mV sedangkan pada hasil percobaan Widanarto (2007) sebesar -35 mV. Menurut Zuandara (2020), hal ini disebabkan karena hanya melibatkan 12 parameter dengan reaksi dasar yang dilibatkan sebanyak tiga (3) reaksi dan molekul/atom yang dilibatkan hanya empat (molekul/atom) sehingga hasil yang didapatkan tidak terlalu optimal.
Simulasi sinyal sensor menggunakan ZnO juga telah dilakukan oleh Kakalenteu (2020) terhadap gas NO2. Seperti dua simulasi sebelumnya, simulasi ini dibandingkan dengan penelitian yang dilakukan oleh Widanarto (2007). Rata-rata selisih kesalahan perubahan fungsi kerja antara hasil simulasi yang diperoleh dengan hasil eksperimen adalah 0,447035 V. Simulasi ini memiliki trend yang sama dengan penelitian Widanarto (2007).
Fath (2020) telah melakukan simulasi sensor gas H2 pada material Pt80Au14Ti6 yang hasilnya dibandingkan dengan penelitian Marjunus (2018). Simulasi ini berhasil mendapatkan grafik dengan trend yang sama dengan penelitian Marjunus (2018).
Namun nilai perubahan fungsi kerja yang didapatkan pada simulasi yaitu sebesar - 240 mV tidak tepat sama dengan penelitian Marjunus (2018) yang memiliki nilai (- 297±9) mV.
4
Simulasi ini diawali dengan studi literatur terkait reaksi yang terjadi antara permukaan bahan, gas H2S, dan gas O2. Lalu dilanjutkan dengan mencari nilai parameter untuk koefisien lengket, koefisien Arrhenius, dan energi aktivasi untuk reaksi maju dan reaksi mundur. Selanjutnya dilakukan pencocokan data eksperimen yang dilakukan oleh Widanarto (2007). Optimasi nilai parameter perlu dilakukan karena nilai yang didapatkan dari hasil studi literatur tidak mencerminkan nilai asli pada sensor gas H2S berbahan Ag2O. Untuk memastikan bahwa data yang didapatkan dari hasil optimasi nilai di atas independen atau tidak, maka perlu dilakukan lagi optimasi nilai dari data awal. Langkah terakhir adalah melakukan simulasi untuk mendapatkan perubahan fungsi kerja yang akan dibandingkan dengan data hasil eksperimen. Selain itu akan didapatkan juga informasi terkait hunian/coverage dari masing-masing gas yang terlibat.
1.2 Rumusan Masalah
Rumusan masalah dalam penelitian ini adalah sebagai berikut:
1. Bagaimana simulasi pendeteksian gas H2S pada permukaan Ag2O berbasis perubahan fungsi kerja (ΔΦ)?
2. Bagaimana hasil simulasi jika dibandingkan dengan hasil eksperimen?
1.3 Batasan Masalah
Batasan masalah dari penelitian ini adalah sebagai berikut:
1. Reaksi yang terlibat berjumlah tiga (3) reaksi.
2. Parameter yang digunakan berjumlah 12 parameter untuk mengukur perubahan fungsi kerja (ΔΦ).
5
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Membuat simulasi atau pemodelan untuk deteksi gas H2S pada permukaan Ag2O berbasis perubahan fungsi kerja (ΔΦ).
2. Membandingkan hasil simulasi dengan hasil eksperimen dari sensor gas H2S berbahan Ag2O.
1.5 Manfaat Penelitian
Manfaat penelitian ini adalah sebagai berikut:
1. Memahami mekanisme deteksi H2S pada sensor gas melalui metode simulasi.
2. Berkontribusi dalam ilmu pengetahuan terkait teori pendeteksian gas H2S pada bahan Ag2O berbasis perubahan fungsi kerja (ΔΦ).
6
II. TINJAUAN PUSTAKA
2.1 Interaksi Gas dengan Permukaan Bahan 2.1.1 Fungsi Kerja
Permukaan suatu logam memiliki atom yang terdiri dari inti atom dan elektron.
Elektron ini dapat lepas dari permukaan sebuah logam atau semikonduktor.
Pelepasan elektron ini memerlukan energi minimum yang dinamakan Fungsi Kerja dan disimbolkan dengan (dalam eV). Dalam semikonduktor dan isolator, fungsi kerja dapat dianggap sebagai perbedaan energi antara elektron yang diam dalam ruang hampa di luar zat padat dan elektron yang terikat paling longgar dalam zat padat (Bare dan Somorjai, 1986).
Fungsi kerja juga didefinisikan sebagai selisih antara tingkat energi fermi dan energi vakum. Secara matematis, nilai fungsi kerja dapat dihitung menggunakan Persamaan (2.1) (Senft dkk., 2011).
= 𝐸 − 𝐸 (2.1)
dengan 𝐸 (dalam eV) merupakan tingkat energi fermi dan Evac merupakan tingkat energi vakum. Tingkat energi fermi ini dapat berubah nilainya jika terdapat molekul gas yang mengenai suatu material. Sesuai dengan Persamaan (2.1), perubahan tingkat Energi Fermi akan menyebabkan perubahan fungsi kerja. Pada Gambar 2.1(a) dijelaskan bahwa jika suatu material terpapar oleh gas pereduksi, maka akan menyebabkan tingkat energi fermi berkurang sehingga meningkatkan nilai fungsi kerja. Sebaliknya, jika suatu bahan terpapar oleh gas pengoksidasi seperti yang
7
ditunjukkan oleh Gambar 2.1(c), maka tingkat energi fermi akan bertambah sehingga menyebabkan berkurangnya nilai fungsi kerja dari material. Secara metematis, perubahan nilai fungsi kerja dapat dituliskan menurut Persamaan (2.2) (Senft dkk., 2011).
= 𝐸 − 𝐸 (2.2)
(a) (b) (c)
Gambar 2.1. Grafik energi perubahan fungsi kerja (∆Փ) akibat adsorpsi gas pada permukaan bahan yang mana (a) terpapar gas pengoksidasi, (b) tidak terpapar gas dan (c) terpapar gas pereduksi (Senft dkk., 2011).
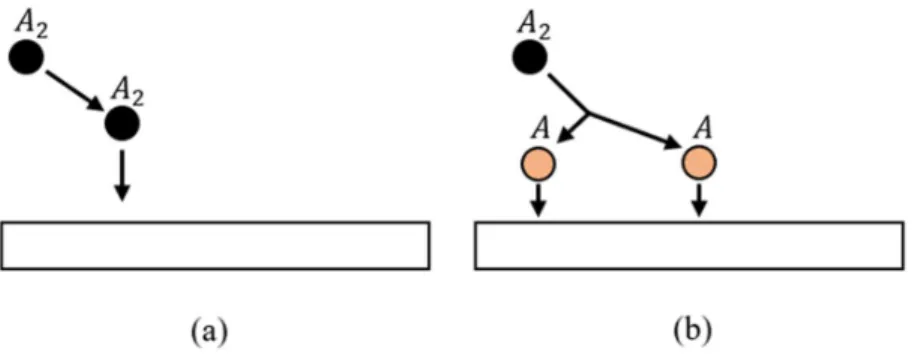
2.1.2 Adsorpsi
Salah satu proses yang terjadi ketika sebuah material padat terpapar oleh gas adalah penyerapan atau adsorpsi. Adsorpsi dapat dibagi menjadi dua, yaitu adsorpsi fisika dan adsorpsi kimia yang prosesnya ditunjukkan pada Gambar 2.2 (Senft dkk., 2011).
8
Gambar 2.2. Proses (a) adsorpsi fisika dan (b) adsorpsi kimia.
Gambar 2.2 (a) merupakan gambar yang menunjukkan terjadinya proses adsorpsi fisika. Adsorpsi fisika terjadi ketika gas yang datang pada permukaan tidak bereaksi dengan permukaan tersebut sehingga gas tetap sama seperti saat datang. Adsorpsi fisika ini terjadi pada suhu rendah. Energi ikat adsorpsi fisika (∆𝐸 dengan satuan eV) akan mengurung molekul yang terserap pada bahan. Nilai ∆𝐸 untuk adsorpsi fisika terletak antara 0,0021 eV sampai 0,301 eV (Roberts dan McKee, 1978).
Adsorpsi kimia terjadi pada suhu tinggi dan ditunjukkan pada Gambar 2.2 (b).
Energi ikat adsorpsi kimia yang disimbolkan dengan ∆𝐸, biasanya memiliki nilai yang lebih tinggi dari energi ikat adsorpsi fisika. Ketika suatu gas mengenai permukaan bahan, maka akan terjadi ikatan kimia yang memisahkan molekul tersebut. Sebagai contoh, jika terdapat molekul 𝐴 yang mengenai bahan, maka molekul itu akan terpisah menjadi dua molekul 𝐴. Perubahan molekul ini memerlukan energi yang disebut energi disosiasi (𝐸 dengan satuan eV). Pada adsorpsi kimia, nilai energi disosiasi ini lebih besar dari 0,311 eV (Gottfried, 2003).
Permukaan bahan yang terkena suatu gas akan memiliki suatu nilai yang disebut dengan nilai hunian/coverage. Nilai hunian ini disimbolkan dengan 𝜃 dan memiliki satuan Mono Layer atau ML. Perubahan dari nilai hunian ini dapat dihitung. Namun
9
sebelum menghitung perubahan nilai hunian, perlu dihitung terlebih dahulu laju adsorpsi seperti yang ditunjukkan pada Persamaan (2.3) (Nix, 2014).
𝑟 = , (2.3)
dengan 𝑁 merupakan jumlah atom/molekul yang terserap pada permukaan bahan yang secara matematis dapat ditulis seperti pada Persamaan (2.4)
𝑁 = 𝜎𝜃, (2.4)
dengan 𝜎 merupakan kerapatan atom pada permukaan dengan satuan atom/𝑚 . Selain bergantung pada jumlah atom/molekul yang terserap pada permukaan, laju adsorpsi juga bergantung pada fluks molekul yang datang ke permukaan. Secara matematis, fluks molekul dapat ditulis seperti pada Persamaan (2.5).
𝐹 =√
, (2.5)
dengan P (dalam Pa) merupakan tekanan parsial dari gas, m (dalam kg) merupakan massa dari molekul gas, k merupakan konstanta Boltzmann dengan nilai 1,38 × 10 𝐽𝐾 , dan T (dalam K) merupakan suhu.
Selain memiliki fluks molekul, permukaan bahan juga memiliki nilai koefisien lengket (S) yang secara matematis dapat ditulis seperti pada Persamaan (2.6).
𝑆 = 𝑆 (1 − 𝜃) exp − , (2.6) dengan 𝑆 merupakan koefisien lengket sebelum permukaan terkena gas, 𝑧 merupakan konstanta yang nilainya 1 untuk gas yang tidak terdisosiasi dan 2 untuk gas yang terdisosiasi. Laju perubahan hunian/coverage pada permukaan selama
10
proses adsorpsi didapatkan dengan menggabungkan Persamaan (2.3) hingga Persamaan (2.6), yang dapat dilihat pada Persamaan (2.7).
𝜃= ( 𝜃)
√ exp − . (2.7)
2.1.3 Reaksi
Ketika suatu bahan menyerap dua molekul atau lebih, maka molekul tersebut akan bereaksi di permukaan bahan tersebut. Sebagai contoh, ketika terdapat molekul A dan molekul B bertemu di permukaan, maka molekul itu akan membentuk molekul AB. Mekanisme Langmuir-Hinshelwood menjelaskan nilai perubahan hunian AB dapat dihitung dengan Persamaan (2.8) (Somorjai dan Li, 2010).
= 𝜈 exp − 𝜃 𝜃 , (2.8)
dengan 𝜈 merupakan koefisien Arrhenius yang merepresentasikan jumlah reaksi antara A dan B setiap detiknya, 𝐸 adalah energi aktivasi atau energi minimum agar terjadi reaksi antara molekul A dan B, 𝜃A dan 𝜃B merupakan nilai hunian dari gas A dan gas B.
2.1.4 Disosiasi
Disosiasi dalam kimia merupakan proses yang terjadi ketika suatu molekul terpisah menjadi bagian yang lebih kecil. Misalnya gas AB ketika mengalami proses disosiasi, maka gas AB akan terpisah menjadi gas A dan gas B. Nilai perubahan hunian dari proses disosiasi dapat dilihat pada Persamaan (2.9).
𝑑𝜃
𝑑𝑡 = 𝑣 exp −𝐸
𝑘𝑇 𝜃 , (2.9)
11
dengan 𝑣 merupakan koefisien Arrhenius yang merepresentasikan jumlah disosiasi AB setiap detik, 𝐸 adalah energi minimum yang dibutuhkan agar disosiasi gas AB dapat terjadi (dalam eV) dan 𝜃AB adalah hunian molekul gas AB.
2.1.5 Desorpsi
Penyerapan atau adsorpsi seperti yang sudah dibahas pada 2.1.2 memiliki sifat reversible yang artinya terdapat proses yang merupakan kebalikan dari adsorpsi.
Proses kebalikan dari adsorpsi ini disebut desorpsi. Desorpsi didefinisikan sebagai pelepasan suatu zat dari permukaan bahan. Pelepasan ini tidak dapat terjadi begitu saja, namun harus disertai dengan pengambilan sebuah energi yang disebut energi desorpsi (𝐸 dalam eV). Nilai perubahan hunian atom atau molekul di atas permukaan dapat dihitung dengan menggunakan Persamaan (2.10) (Senft, 2009).
𝑑𝜃
𝑑𝑡 = 𝑣 exp −𝐸
𝑘𝑇 𝜃, (2.10)
dengan 𝑣 merupakan koefisien Arrhenius yang merepresentasikan jumlah desorpsi setiap detik.
2.2 Reaksi Pendeteksian Gas H2S
Berdasarkan studi literatur yang telah dilakukan, didapatkan beberapa reaksi terkait pendeteksian gas H2S. Reaksi antara H2S dengan permukaan bahan yaitu
H2S(g) + * ⇄ H2S(ad), (2.11) di mana tanda bintang melambangkan permukaan bahan (Bashiri & Mohamadi, 2016). Namun, dalam penelitian ini reaksi tersebut diusulkan seperti Persamaan (2.12)
12
H2S(g) + (S) ⇄ H2S(ad), (2.11) Gas oksigen yang mengenai permukaan bahan juga dapat bereaksi dengan permukaan bahan seperti yang dilaporkan oleh Callaghan (2006) di mana reaksinya dapat dilihat pada Persamaan (2.13)
O2(g) + (2S) ⇄ 2O(ad), (2.13)
Seperti yang telah dijelaskan pada bagian 2.1.3 bahwa molekul di permukaan bahan dapat bereaksi di permukaan bahan tersebut. Berdasarkan hal itu, maka senyawa H2S dan atom O2 pada permukaan bahan dapat bereaksi. Berdasarkan studi literatur yang telah dilakukan, didapatkan persamaan reaksi antara H2S dengan O di permukaan bahan yaitu (Liu dkk., 2009)
H2S(ad) + 3O(ad) ⇄ SO2(ad) + H2O(ad), (2.14) Simbol (g) pada persamaan (2.11) – (2.14) melambangkan fase gas dan simbol (S) melambangkan permukaan bahan. Selain reaksi yang terjadi di permukaan bahan seperti yang dijelaskan pada persamaan (2.12), (2.13), dan (2.14), dibutuhkan pula beberapa parameter sebagai penunjang pada penelitian ini. Nilai-nilai parameter dapat dilihat pada Tabel 2.1. Baris 1, baris 2, dan baris 3 pada Tabel 2.1 berturut- turut merupakan nilai parameter untuk Persamaan (2.12), Persamaan (2.13), dan Persamaan (2.14).