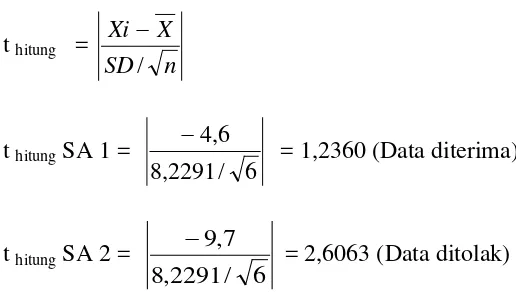PENETAPAN KADAR NIPAGIN PADA KECAP MI INSTAN
SECARA SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
OLEH:
ELFRIDAWATI SIALLAGAN
NIM 071501049
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENETAPAN KADAR NIPAGIN PADA KECAP MI INSTAN
SECARA SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ELFRIDAWATI SIALLAGAN
NIM 071501049
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
PENETAPAN KADAR NIPAGIN PADA KECAP MI INSTAN
SECARA SPEKTROFOTOMETRI SINAR TAMPAK
OLEH:
ELFRIDAWATI SIALLAGAN NIM 071501049
Dipertahankan di Hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: Juni 2011
Pembimbing I, Panitia Penguji,
Drs. Syafruddin, MS., Apt. Drs. Fathur Rahman Harun, M.Si., Apt. NIP 194811111976031003 NIP 195201041980031002
Pembimbing II, Drs. Immanuel S. Meliala, M.Si., Apt.
NIP 195001261983031002
Prof. Dr. Jansen Silalahi, M.App.Sc., Apt.
NIP 195006071979031001 Drs. Nahitma Ginting, M.Si., Apt. NIP 195406281983031002
Drs. Syafruddin, MS., Apt.
NIP 194811111976031003
Dekan,
KATA PENGANTAR
Puji dan syukur kepada Allah yang telah melimpahkan berkat-Nya,
sehingga penulis dapat menyelesaikan skripsi dengan judul “Penetapan Kadar Nipagin Pada Kecap Mi Instan secara Spektrofotometri Sinar Tampak”. Tujuan penelitian ini adalah untuk menetapkan kadar nipagin pada kecap mi instan secara
spektrofotometri sinar tampak mengunakan pereaksi deniges. Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana Farmasi dari Fakultas
Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih yang tiada terhingga kepada Papa St. J. Siallagan, Mama R. Butarbutar, Kakak Aferlita
Siallagan, S. Kep., Adik Tuppal Siallagan, Adik Afriani Siallagan, serta semua keluarga yang tidak dapat disebutkan satu per satu, yang telah banyak memberikan doa dan dorongan serta bantuan moril dan materil kepada penulis
selama menempuh pendidikan S-1 Farmasi.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Drs.
Syafruddin, MS., Apt. dan kepada Bapak Prof. Dr. Jansen Silalahi, M. App. Sc., Apt. selaku dosen pembimbing yang telah banyak memberikan bimbingan dan bantuan yang sangat berarti mulai dari penelitian hingga selesainya penyusunan skripsi ini.
Pada kesempatan ini penulis juga menyampaikan ucapan terima kasih kepada:
2. Bapak Drs. Suryadi Achmad, M.Sc., Apt., selaku Dosen Penasehat
Akademik yang telah memperhatikan dan membimbing penulis selama masa perkuliahan.
3. Bapak Drs. Fathur Rahman Harun, M.Si., Apt., Bapak Drs. Immanuel S. Meliala, M.Si., Apt., dan Bapak Drs. Nahitma Ginting, M.Si., Apt., selaku dosen penguji yang telah memberikan masukan dan saran kepada penulis
hingga selesainya penulisan skripsi ini.
4. Seluruh Staf Pengajar dan Pegawai Tata Usaha di Fakultas Farmasi, serta
seluruh Asisten di Laboratorium yang telah banyak membimbing penulis selama perkuliahan dan membantu penulis dalam menyelesaikan penelitian ini.
5. Kelompok KTB “Desciple” (Danny Philipe, Bane Doli, Jonni Aristo, Betty, Fraptin, Septien, Gustina, Firman Apul, Nova, dan Robecka).
6. Kelompok kecilku “Ofel Okuli” (Santa, Ira, Eviyani, Aprilla, Michael,
Claudian, Samuel, dan Desi).
7. Sahabat-sahabatku “Rejoicing in Love” ( Santa, Ira, Debi, Alex, Eva,
Novalina, Via, Triwati, Martianus, Vintha, Juwita, Sari, Jimmy, Sandro, Melati, Cory, Rachmad, Ernal, Hendry, Febri, Wandi, Fanny, Silvana, Melisa, dan Sylvia).
8. Teman-teman Farmasi 2007 khususnya konsentrasi Sains dan Teknologi Farmasi serta semua pihak yang tidak dapat disebutkan satu per satu.
hati penulis bersedia menerima kritik dan saran yang membangun pada skripsi ini.
Semoga skripsi ini bermanfaat bagi kita semua.
Medan, Juni 2011
Penulis,
Elfridawati Siallagan
PENETAPAN KADAR NIPAGIN PADA KECAP MIE INSTAN SECARA SPEKTROFOTOMETRI SINAR TAMPAK
Abstrak
Nipagin adalah bahan pengawet yang diizinkan penggunaannya dalam makanan, tetapi kadarnya tidak boleh melebihi batas maksimum yang ditetapkan oleh Permenkes. Tujuan dari penelitian ini adalah untuk menentukan kadar nipagin yang terdapat dalam kecap mie instan dengan metode spektrofotometri sinar tampak menggunakan pereaksi deniges dan natrium nitrit 2% b/v.
Sampel yang diperiksa dalam penelitian ini adalah kecap yang terdapat dalam mie instan merk A, B, dan C yang diambil dari supermarket. Sampel diekstraksi menggunakan dietil eter dalam suasana asam (pH 1). Hasil ekstraksi dipanaskan dengan pereaksi deniges lalu ditambahkan larutan natrium nitrit 2% b/v dan didiamkan selama 42 menit.warna pink yang terbentuk diukur absorbansinya pada panjang gelombang 504 nm.
Kurva kalibrasi dibuat dalam konsentrasi 0, 15, 20, 22, 25, dan 30 mcg/ml dan diperoleh persamaan regresi Y = 0,0195X – 0,0017. Dari persamaan regresi diperoleh adanya hubungan yang linier antara konsentrasi dan absorbansi dengan koefisien korelasi (r2) = 0,9995. Kadar nipagin dalam kecap mie instan masing-masing yaitu 146,5 ± 10,6 mg/kg, 183,4 ± 2,4 mg/kg, dan 191,5 ± 4,5 mg/kg. Validasi metode menunjukkan akurasi yang memuaskan dengan persen perolehan kembali 87,62%. Dari hasil yang diperoleh menunjukkan bahwa tidak satupun dari sampel yang diuji mengandung nipagin yang melebihi batas maksimum yang ditetapkan oleh Permenkes RI No. 722/Menkes/Per/IX/88 tentang bahan tambahan makanan yaitu 250 mg/kg.
ANALYSIS OF NIPAGIN IN SOY SAUCE INSTANT NOODLES WITH VISIBLE SPECTROPHOTOMETRY
Abstract
Nipagin is allowed to use as preservatives in foods, but the levels should not exceed the maximum limit set by Permenkes. The purpose of this research was to determinate the level of nipagin contained in soy sauce instant noodles with visible spectrophotometric method using deniges’ reagent and sodium nitrite 2% w/v.
Samples examined in this research were soy sauce of instant noodles A, B, and C were taken from the supermarket. The sample was extracted using diethyl ether in acidic condition (pH 1). The extract was heated with deniges’ reagent followed by addition of sodium nitrite solution 2% w/v and allowed to stand for 42 minutes. The absorbance of the pink colour produced was measured at 504 nm.
Calibration curve made by concentrations of 0, 15, 20, 22, 25, and 30 mcg/ml and obtained regression equation Y = 0,0195 X – 0,0017. From the regression equation showed a linear correlation between concentration and absorbance with correlation coefficient (r2) = 0,9995. The levels of nipagin in soy sauce instant noodles were 146,5 ± 10,6 mg/kg, 183,4 ± 2,4 mg/kg, and 191,5 ± 4,5 mg/kg, respectively. The Validation methods showed a satisfactory accuracy with the percent recovery of 87,62%. From the results obtained showed that none of the samples tested contained nipagin that exceeded the maximum limit set by Permenkes RI No. 722/Menkes/Per/IX/88 about food additives that is 250 mg/kg.
DAFTAR ISI
Halaman
JUDUL
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Mi Instan ... 5
2.2 Kecap ... 6
2.3 Bahan Pengawet ... 6
2.3.1 Jenis-jenis Bahan Pengawet ... 7
2.4 Nipagin ... 8
2.5 Teknik Pemisahan dalam Analisis ... 10
2.5.1 Ekstraksi Cair-cair ... 10
2.6 Spektrofotometri UV-Visibel ... 11
2.7 Parameter Validasi ... 13
2.8 Analisis Nipagin dalam Kecap ... 15
BAB III METODE PENELITIAN ... 17
3.1 Tempat dan Waktu Penelitian ... 17
3.2 Bahan-bahan ... 17
3.2.1 Sampel ... 17
3.2.2 Pereaksi ... 17
3.3 Alat-alat ... 17
3.4 Pembuatan Pereaksi ... 18
3.4.1 Larutan NaCl jenuh ... 18
3.4.2 Larutan H2SO4 10% v/v ... 18
3.4.3 Pereaksi Deniges ... 18
3.4.4 Larutan Natrium Nitrit 2% b/v ... 18
3.5 Prosedur Penelitian ... 18
3.5.1 Pengambilan Sampel ... 18
3.5.2 Penyiapan Bahan ... 19
3.5.3 Proses Ekstraksi ... 19
3.5.4 Analisis Kualitatif ... 19
3.5.5.2 Penentuan Waktu Kerja ... 20
3.5.5.3 Penentuan Panjang Gelombang Maksimum ... 20
3.5.5.4 Penentuan Kurva Kalibrasi Larutan Standar Nipagin ... 21
3.5.5.5 Penetapan Kadar Nipagin dalam Sampel . 21 3.5.6 Analisis Data Secara Statistik ... 22
3.5.7 Uji Perolehan Kembali ... 22
3.5.8 Simpangan Baku Relatif ... 23
3.5.9 Penentuan Batas Deteksi dan Batas Kuantitasi ... 23
BAB IV HASIL DAN PEMBAHASAN ... 25
4.1 Analisis Kualitatif ... 25
4.2 Analisis Kuantitatif ... 27
4.2.1 Penentuan Waktu Kerja ... 27
4.2.2 Penentuan Panjang Gelombang Maksimum ... 27
4.2.3 Kurva Kalibrasi Nipagin ... 27
4.2.4 Analisis Kadar Nipagin pada Kecap Mi Instan ... 28
4.2.5 Uji Perolehan Kembali ... 29
4.2.6 Simpangan Baku Relatif ... 30
4.2.7 Batas Deteksi dan Batas Kuantitasi ... 31
BAB V KESIMPULAN DAN SARAN ... 32
5.1 Kesimpulan ... 32
5.2 Saran ... 32
DAFTAR PUSTAKA ... 33
DAFTAR TABEL
Halaman Tabel 1 Hasil Analisis Kualitatif Nipagin dengan Pereaksi Deniges
dan Natrium Nitrit 2% b/v ... 25 Tabel 2 Kadar Pengawet Nipagin pada Kecap Mie Instan ... 29 Tabel 3 Persen Uji Perolehan Kembali (recovery) Nipagin dalam
Sampel ... 30
DAFTAR GAMBAR
Halaman Gambar 1 Spektrum dari Nipagin BPFI Konsentrasi 22 µg/ml dan
Nipagin dalam Larutan Sampel ... 26 Gambar 2 Kurva Kalibrasi Larutan Standar Nipagin dengan Pereaksi
Deniges pada Panjang Gelombang 504 nm ... 28 Gambar 3 Hasil Analisis kualitatif Sampel dan Larutan Standar ... 36 Gambar 4 Grafik Penentuan Waktu Kerja Nipagin dengan Pereaksi
Deniges pada λ = 504 nm ... 39
DAFTAR LAMPIRAN
Halaman Lampiran 1. Hasil Analisis Kualitatif dengan Pereaksi Deniges dan
Natrium Nitrit 2% b/v ... 36
Lampiran 2. Data Hasil Penentuan Waktu Kerja Nipagin pada λ = 504 nm ... 37
Lampiran 3. Grafik Penentuan Waktu Kerja Nipagin dengan Pereaksi Deniges pada λ = 504 nm ... 39
Lampiran 4. Data Hasil Pengukuran Absorbansi Larutan Standar Nipagin ... 40
Lampiran 5. Perhitungan Persamaan Garis Regresi Larutan Standar Nipagin ... 41
Lampiran 6. Data Hasil Pengukuran Absorbansi Nipagin pada Sampel ... 42
Lampiran 7. Hasil Analisis Kadar Nipagin dalam Sampel ... 43
Lampiran 8. Contoh Perhitungan Kadar Nipagin dalam Sampel Mie Instan Merk A ... 44
Lampiran 9. Perhitungan Statistik Kadar Nipagin dalam Sampel ... 45
Lampiran 10. Perhitungan Batas Deteksi dan Batas Kuantitasi Nipagin 54 Lampiran 11. Data Hasil Pengukuran Absorbansi Perolehan Kembali Nipagin ... 56
Lampiran 12. Hasil Uji Perolehan Kembali Nipagin Setelah Penambahan Larutan Standar ... 57
Lampiran 13. Persen Perolehan Kembali Nipagin dalam Sampel ... 58
Lampiran 14. Contoh Perhitungan Persen Perolehan Kembali Nipagin dalam Sampel ... 59
Lampiran 15. Perhitungan Statistik Uji Perolehan Kembali ... 60
Lampiran 16. Alat Spektrofotometer UV-Visibel ... 63
Lampiran 17. Tabel Distribusi t ... 64
PENETAPAN KADAR NIPAGIN PADA KECAP MIE INSTAN SECARA SPEKTROFOTOMETRI SINAR TAMPAK
Abstrak
Nipagin adalah bahan pengawet yang diizinkan penggunaannya dalam makanan, tetapi kadarnya tidak boleh melebihi batas maksimum yang ditetapkan oleh Permenkes. Tujuan dari penelitian ini adalah untuk menentukan kadar nipagin yang terdapat dalam kecap mie instan dengan metode spektrofotometri sinar tampak menggunakan pereaksi deniges dan natrium nitrit 2% b/v.
Sampel yang diperiksa dalam penelitian ini adalah kecap yang terdapat dalam mie instan merk A, B, dan C yang diambil dari supermarket. Sampel diekstraksi menggunakan dietil eter dalam suasana asam (pH 1). Hasil ekstraksi dipanaskan dengan pereaksi deniges lalu ditambahkan larutan natrium nitrit 2% b/v dan didiamkan selama 42 menit.warna pink yang terbentuk diukur absorbansinya pada panjang gelombang 504 nm.
Kurva kalibrasi dibuat dalam konsentrasi 0, 15, 20, 22, 25, dan 30 mcg/ml dan diperoleh persamaan regresi Y = 0,0195X – 0,0017. Dari persamaan regresi diperoleh adanya hubungan yang linier antara konsentrasi dan absorbansi dengan koefisien korelasi (r2) = 0,9995. Kadar nipagin dalam kecap mie instan masing-masing yaitu 146,5 ± 10,6 mg/kg, 183,4 ± 2,4 mg/kg, dan 191,5 ± 4,5 mg/kg. Validasi metode menunjukkan akurasi yang memuaskan dengan persen perolehan kembali 87,62%. Dari hasil yang diperoleh menunjukkan bahwa tidak satupun dari sampel yang diuji mengandung nipagin yang melebihi batas maksimum yang ditetapkan oleh Permenkes RI No. 722/Menkes/Per/IX/88 tentang bahan tambahan makanan yaitu 250 mg/kg.
ANALYSIS OF NIPAGIN IN SOY SAUCE INSTANT NOODLES WITH VISIBLE SPECTROPHOTOMETRY
Abstract
Nipagin is allowed to use as preservatives in foods, but the levels should not exceed the maximum limit set by Permenkes. The purpose of this research was to determinate the level of nipagin contained in soy sauce instant noodles with visible spectrophotometric method using deniges’ reagent and sodium nitrite 2% w/v.
Samples examined in this research were soy sauce of instant noodles A, B, and C were taken from the supermarket. The sample was extracted using diethyl ether in acidic condition (pH 1). The extract was heated with deniges’ reagent followed by addition of sodium nitrite solution 2% w/v and allowed to stand for 42 minutes. The absorbance of the pink colour produced was measured at 504 nm.
Calibration curve made by concentrations of 0, 15, 20, 22, 25, and 30 mcg/ml and obtained regression equation Y = 0,0195 X – 0,0017. From the regression equation showed a linear correlation between concentration and absorbance with correlation coefficient (r2) = 0,9995. The levels of nipagin in soy sauce instant noodles were 146,5 ± 10,6 mg/kg, 183,4 ± 2,4 mg/kg, and 191,5 ± 4,5 mg/kg, respectively. The Validation methods showed a satisfactory accuracy with the percent recovery of 87,62%. From the results obtained showed that none of the samples tested contained nipagin that exceeded the maximum limit set by Permenkes RI No. 722/Menkes/Per/IX/88 about food additives that is 250 mg/kg.
BAB I PENDAHULUAN
1.1Latar Belakang
Mi instan merupakan makanan yang sangat populer, digemari berbagai kalangan dan berpotensi sebagai salah satu makanan alternatif pengganti beras.
Hal ini disebabkan karena mi instan memiliki rasa yang enak, proses penyajian yang mudah dan cepat, jumlah kalori cukup tinggi, harga relatif murah dan dapat
diproduksi dalam berbagai bentuk yang menarik serta daya simpan yang baik. Karena memiliki daya simpan yang baik, mi instan sering dipertanyakan apakah menggunakan bahan kimia sebagai pengawet dalam proses pembuatannya.
Setiap bungkus mie instan terdapat satu sachet bumbu dan beberapa bahan-bahan lainnya, seperti flavouring, kecap, saos, dan solid ingredient seperti sosis, suwiran sayur, bawang goreng, cabe kering dan sebagainya (Anonima,
2011). Pada proses pembuatan mi, pengawetan dilakukan dengan deep frying
yaitu penggorengan dalam minyak goreng panas pada suhu 1200-1600 C selama ±
2 menit sampai kering dan diperoleh kadar air kurang dari 4 % sehingga mikroorganisme tidak dapat berkembang biak (Eep, 2006). Sedangkan pembuatan bumbu-bumbunya menggunakan bahan kimia sebagai pengawet. Pengawet yang
paling umum digunakan yaitu asam benzoat dan nipagin (Chu et al., 2003). Menurut Ponte dan Tsen (1985), kombinasi dari pengggunaan asam benzoat dan
Tidak semua negara mengizinkan penggunaan nipagin sebagai pengawet
dalam makanan, misalnya: Belgia, Prancis, Belanda dan Turki (Ponte dan Tsen, 1985). Beberapa negara mengizinkan penggunaan nipagin dalam batas maksimum
yang bervariasi, seperti Kanada, Amerika Serikat mengizinkan batas maksimum penggunaan nipagin sebesar 1000 mg/kg, Singapura, Brunei Darussalam dan Taiwan mengizinkan batas maksimum sebesar 250 mg/kg dan Hongkong sebesar
550 mg/kg (Anonimb
Namun belakangan pemerintah Taiwan melakukan penarikan mi instan dari pasaran. Salah satu penyebabnya adalah karena adanya kandungan pengawet nipagin yang berlebihan di dalam kecap mi instan produksi Indonesia tersebut
(Jayadireja, 2010). Menurut Yuliarti (2007), penggunaan nipagin dan garam natriumnya yang berlebihan akan menimbulkan reaksi alergi pada mulut dan kulit.
Oleh karena itu, diperlukan pengawasan dan analisis kuantitatif terhadap pengawet nipagin dalam makanan secara rutin.
, 2011). Menurut Badan Pengawas Obat dan Makanan (BPOM), penggunaan nipagin di Indonesia diatur dalam Permenkes RI Nomor
722/Menkes/Per/IX/88 tentang bahan tambahan makanan yang mengizinkan penggunaan nipagin dalam kecap dengan batas maksimum 250 mg/kg (SNI, 1999).
Dalam beberapa literatur, penetapan kadar nipagin dapat dilakukan antara
lain dengan metode spektrofotometri ultraviolet pada panjang gelombang 252 nm (SNI, 1999), Kromatografi Cair Kinerja Tinggi (KCKT) dengan menggunakan
1981). Kertadarma dkk. (2004) menganalisis kandungan nipagin dan nipasol
secara kombinasi kromatografi lapis tipis dan spektrofotometri ultraviolet dalam beberapa jenis makanan, salah satu jenis makanan yang dianalisis adalah kecap.
Penelitian ini dilakukan untuk menetapkan kadar nipagin pada kecap mi instan secara spektrofotometri sinar tampak menggunakan pereaksi deniges. Metode ini dipilih karena adanya bahan pengawet lain dalam kecap mi instan
yaitu natrium benzoat yang bisa mengganggu saat pengukuran nipagin. Parameter validasi yang dilakukan dalam penelitian ini antara lain: akurasi, presisi, batas
deteksi dan batas kuantitasi.
1.2Perumusan Masalah
Perumusan masalah dari penelitian ini adalah apakah kadar nipagin sesuai
dengan standar Permenkes RI Nomor 722/Menkes/Per/IX/88 tentang bahan tambahan makanan yaitu sebesar 250 mg/kg?
1.3Hipotesis
Hipotesis dari penelitian ini adalah kadar nipagin sesuai dengan standar Permenkes RI Nomor 722/Menkes/Per/IX/88 tentang bahan tambahan makanan
yaitu sebesar 250 mg/kg.
1.4Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk menentukan kadar nipagin pada
kecap mi instan apakah sesuai dengan standar Permenkes RI Nomor 722/Menkes/Per/IX/88 tentang bahan tambahan makanan yaitu sebesar 250
1.5Manfaat Penelitian
Penelitian ini bermanfaat untuk memberikan informasi apakah penggunaan nipagin pada kecap mi instan sesuai dengan standar yang ditetapkan oleh
BAB II
TINJAUAN PUSTAKA 2.1 Mi Instan
Mi telah lama dikenal dan dikembangkan oleh masyarakat Cina dan Jepang sejak 5000-an tahun yang lalu. Berdasarkan jenisnya, mi digolongkan menjadi tiga jenis, yaitu mi basah, mi kering dan mi instan (Eep, 2006). Menurut
SNI (2000), mi instan didefinisikan sebagai produk makanan kering yang dibuat dari adonan tepung terigu atau tepung beras atau tepung lainnya sebagai bahan
utama dengan atau tanpa penambahan bahan lainnya, siap dihidangkan setelah dimasak atau diseduh dengan air mendidih dengan adanya penambahan bumbu.
Setiap bungkus mie instan terdapat satu sachet bumbu dan beberapa
bahan-bahan lainnya, seperti flavouring, kecap, saos, dan solid ingredient.
Flavouring yang terdapat dalam sachet bumbu mengandung MSG (Mono Sodium
Glutamat), garam, gula, bahan-bahan penggurih sperti HVP (Hydrolized
Vegetable Protein) dan yeast extract dan lain-lain. Bahan penambah rasa atau
flavour yang digunakan pada bumbu akan memberi rasa mie seperti ayam
bawang, ayam panggang, kari ayam, soto ayam, baso, sate dan sebagainya. Kecap mengandung gula, garam, kedelai, bahan pengawet natrium benzoat dan nipagin.
Solid ingredient adalah bahan-bahan pelengkap berupa sosis, suwiran sayur,
bawang goreng, cabe kering dan sebagainya (Anonima, 2011).
Dalam proses pembuatannya, mi tidak menggunakan bahan tambahan
penggorengan terdiri dari mangkok-mangkok penggorengan yang memuat
potongan mi melewati fryer yang berisi minyak goreng panas. Suhu minyak dari awal hingga akhir dibuat naik secara bertahap yaitu dari suhu 1200 C dan berakhir
pada suhu 1600
2.2 Kecap
C dalam waktu ± 2 menit (Winarno, 2002). Melalui proses penggorengan tersebut, kadar air mi dalam mi instan hanya 2–4 % saja sehingga tidak memungkinkan mikroba pembusuk berkembang biak. Dengan alasan
tersebut pada mi tidak perlu ditambahkan bahan pengawet makanan (Eep, 2006).
Kecap digunakan sebagai bumbu pada berbagai makanan. Menurut SNI (1999), kecap didefinisikan sebagai produk cair yang diperoleh dari hasil fermentasi dan atau cara kimia (hidrolisis) kacang kedelai (Glycine max L.)
dengan atau tanpa penambahan bahan makanan lain dan bahan tambahan makanan yang diizinkan. Proses fermentasi pembuatan kecap menggunakan bakteri Aspergillus oryzae atau Aspergillus soyae (Ayres et al., 1980). Pada proses
pembuatannya kecap menggunakan bahan tambahan sebagai pengawet. Pengawet yang paling umum digunakan pada kecap adalah asam benzoat dan ester dari
p-hidroksi benzoat (Chu et al., 2003). 2.3 Bahan Pengawet
Menurut peraturan Menteri Kesehatan Republik Indonesia Nomor
722/Menkes/Per/IX/1988, pengawet merupakan bahan tambahan pangan yang mencegah atau menghambat fermentasi, pengasaman atau peruraian lain terhadap
memberikan perlindungan bahan makanan dari proses pembusukan (Cahyadi,
2008).
Secara umum penambahan bahan pengawet pada pangan bertujuan
menghambat pertumbuhan mikroba pembusuk pada pangan baik yang bersifat patogen maupun tidak patogen, memperpanjang umur simpan pangan, tidak menurunkan kualitas gizi, warna, cita rasa, dan bau bahan pangan yang diawetkan,
tidak untuk menyembunyikan keadaan pangan yang berkualitas rendah, tidak digunakan untuk menyembunyikan penggunaan bahan yang salah atau yang tidak
memenuhi persyaratan, dan tidak digunakan untuk menyembunyikan kerusakan bahan pangan (Cahyadi, 2008).
2.3.1 Jenis-Jenis Bahan Pengawet
Bahan pengawet dikelompokkan sebagai bahan pengawet organik dan anorganik. Bahan pengawet organik yang diizinkan penggunaannya pada bahan pangan adalah asam benzoat, asam propionat, asam sorbat, kalium benzoat,
kalium propionat, kalium sorbat, kalsium benzoat, metil-p-hidroksi benzoat, natrium benzoat, natrium propionat, nisin, dan propil-p-hidroksi benzoat. Bahan
pengawet anorganik yang diizinkan penggunaannya pada bahan pangan adalah belerang dioksida, kalium bisulfit, kalium metabisulfit, kalium nitrat, kalium nitrit, kalium sulfit, natrium bisulfit, natrium metabisulfit, natrium nitrat, natrium
nitrit dan natrium sulfit (Cahyadi, 2008). Sedangkan bahan pengawet yang dilarang penggunaanya dalam makanan adalah formalin, natrium tetraboraks,
2.3.2 Penggunaan Pengawet dalam Bahan Makanan
Bahan pengawet seperti benzoat digunakan untuk mengawetkan minuman ringan, kecap, acar ketimun, margarin, sari buah, saus, dan makanan lainnya.
Nitrit sering digunakan untuk bahan pengawet daging olahan seperti sosis dan kornet dalam kaleng (Cahyadi, 2008). Sedangkan nipagin digunakan sebagai bahan pengawet pada kecap, sereal, minyak dan lemak, selai, sirup, minuman
kaleng, dan bumbu-bumbu kemasan (Anonimb
Pada kecap, pengawet yang paling umum digunakan adalah asam benzoat
dan nipagin (Chu et al., 2003). Asam benzoat memiliki aktivitas antimikroba yang optimum pada pH 2,5-4,0. Sedangkan nipagin memiliki aktivitas antimikroba yang sama seperti benzoat tetapi efektif pada rentang pH yang lebih luas.
Kombinasi dari pengggunaan asam benzoat dan nipagin sebagai pengawet dalam makanan dapat meningkatkan daya tahan makanan karena peningkatan efek antimikrobanya (Ponte dan Tsen, 1985).
, 2011).
2.4 Nipagin
Nipagin adalah metil ester dari p-hidroksibenzoat dengan rumus empiris
CH3(C6H4(OH)COO) dan berat molekul sebesar 152,12. Rumus bangun nipagin dapat dilihat pada gambar berikut.
sukar larut dalam air, dalam benzena dan dalam karbon tetraklorida; mudah larut
dalam etanol dan dalam eter (Ditjen POM, 1995).
Senyawa ester-p-hidroksi benzoat diabsorpsi oleh saluran pencernaan dan
ikatan ester dihidrolisa di hati dan ginjal, yang menghasilkan asam-p-hidroksi benzoat yang diekskresikan bersama urin. Umumnya metabolit dari paraben ini diekskresikan dalam 6-24 jam yang diberikan dengan dosis intravenus dan dosis
oral (Cahyadi, 2008).
Nipagin yang disebut juga sebagai metil paraben termasuk dalam bahan
pengawet makanan khususnya anti jamur yang juga digunakan secara luas sebagai pengawet untuk obat-obatan dan kosmetika. Penggunaan nipagin diatur dalam
Codex Alimentarius commission (CAC) dengan jumlah asupan dalam tubuh per
hari (acceptable daily intake/ADI) adalah 10 miligram per kilogram berat badan (Anonimb, 2011). Namun tidak semua negara mengizinkan penggunaan nipagin sebagai pengawet dalam makanan, misalnya: Belgia, Prancis, Belanda dan Turki
(Ponte dan Tsen, 1985). Beberapa negara mengizinkan penggunaan nipagin dalam batas maksimum yang bervariasi, seperti Kanada, Amerika Serikat mengizinkan
batas maksimum penggunaan nipagin sebesar 1000 mg/kg, Singapura, Brunei Darussalam dan Taiwan mengizinkan batas maksimum sebesar 250 mg/kg dan Hongkong sebesar 550 mg/kg (Anonimb, 2011). Menurut Badan Pengawas Obat
dan Makanan (BPOM), penggunaan nipagin di Indonesia diatur dalam Permenkes RI Nomor 722/Menkes/Per/IX/88 tentang bahan tambahan makanan yang
Penggunaan nipagin dalam jumlah yang berlebihan dalam jangka panjang
dapat menimbulkan masalah kesehatan seperti reaksi alergi pada mulut dan kulit (Yuliarti, 2007). Dermatitis dan iritasi kulit terjadi ketika pemakaian pada kulit
individu yang sensitif terhadap nipagin (Soni et al., 2002). Sebuah studi menemukan adanya nipagin pada jaringan kanker payudara yang menunjukkan bahwa ester paraben tidak selalu dipecah dan dikeluarkan oleh tubuh (Darbre et
al., 2004). Ester paraben memiliki aktivitas estrogenik terutama efeknya menimbulkan gangguan pada sistem endokrin dan berpotensi meningkatkan
resiko kanker payudara (Lemini et al., 2003). 2.5 Teknik Pemisahan dalam Analisis
Apabila pada suatu analisis ada dugaan bahwa komponen matriks akan
mengganggu penentuan dengan prosedur analisis yang telah dipilih, diperlukan pemisahan analit dari matriksnya dengan salah satu teknik pemisahan yang paling sesuai. Hasil pemisahan dapat berupa senyawa analit yang sudah murni, tetapi
bisa juga masih bercampur dengan komponen-komponen pengotor akan tetapi dengan konsentrasi yang rendah dan dapat dianalisis langsung atau mungkin
masih memerlukan pemurnian lebih lanjut. Untuk memisahkan analit dari komponen matriks yang mengganggu dapat diterapkan ekstraksi padat-cair, ekstraksi cair-cair, teknik destilasi, dan kromatografi (Kokasih et al, 2004).
2.5.1 Ekstraksi Cair-Cair
Ekstraksi cair-cair melibatkan ekstraksi analit dari fase air ke dalam
dengan substituen yang bersifat nonpolar atau agak polar. Sementara itu,
senyawa-senyawa polar dan juga senyawa-senyawa yang mudah mengalami ionisasi akan tertahan dalam fase air (Rohman, 2007).
Kebanyakan ekstraksi dilakukan dengan menggunakan corong pisah dalam waktu beberapa menit. Pelarut organik yang dipilih untuk ekstraksi pelarut adalah mempunyai kelarutan yang rendah dalam air (<10%), dapat menguap sehingga
memudahkan penghilangan pelarut organik setelah dilakukan ekstraksi, dan mempunyai kemurnian yang tinggi untuk meminimalkan adanya kontaminasi
sampel (Rohman, 2007).
2.6 Spektrofotometri UV-Visibel
Spektrofotometri serapan merupakan pengukuran suatu interaksi antara
radiasi elektromagnetik dan molekul atau atom dari suatu zat kimia. Teknik yang sering digunakan dalam analisis farmasi meliputi spektroskopi serapan ultraviolet, sinar tampak, infra merah, dan serapan atom (Ditjen POM, 1995). Keuntungan
utama dari metode spektrofotometri yaitu dapat menetapkan kadar suatu zat yang sangat kecil (Bassett, 1991).
Spektrofotometer Ultraviolet-Visibel adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan cahaya tampak yang diabsorpsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup
untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektrofotometer Ultraviolet-Visible biasanya digunakan untuk molekul
gelombang tertentu dengan menggunakan hukum Lambert-Beer. Sinar ultraviolet
berada pada panjang gelombang 200-400 nm sedangkan sinar tampak berada pada panjang gelombang 400-800 nm (Dachriyanus, 2004).
Warna sinar tampak dapat dihubungkan dengan panjang gelombangnya. Sinar putih mengandung radiasi pada semua panjang gelombang di daerah sinar tampak. Sinar pada panjang gelombang tunggal (radiasi monokromatik) dapat
dipilih dari sinar putih. Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan sinar tampak terdiri atas suatu sistem optik dengan
kemampuan menghasilkan sinar monokromatis dalam jangkauan panjang gelombang 200-800 nm (Rohman, 2007).
Alat Spektrofotometri pada dasarnya terdiri atas sumber sinar,
monokromator, tempat sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat. Spektrofotometer dapat bekerja secara otomatik ataupun tidak, dan dapat mempunyai sistem sinar tunggal atau ganda (Ditjen POM, 1979).
Sebagai sumber cahaya biasanya digunakan lampu hidrogen atau deuterium untuk pengukuran UV dan lampu tungsten untuk pengukuran pada
cahaya tampak. Panjang gelombang dari sumber cahaya akan dibagi oleh pemisah atau monokromator (Dachriyanus, 2004).
Analisis kuantitatif secara spektrofotmetri dapat dilakukan dengan metode
regresi dan pendekatan. 1. Metode Regresi
konsentrasi yang meningkat yang dapat memberikan serapan linier, kemudian
diplot menghasilkan suatu kurva kalibrasi. Konsentrasi suatu sampel dapat dihitung berdasarkan kurva tersebut (Holme and Peck, 1983).
2. Metode Pendekatan
Analisis kuantitatif dengan cara ini dilakukan dengan membandingkan serapan baku yang konsentrasinya diketahui dengan serapan sampel. Konsentrasi
sampel dapat dihitung melalui rumus perbandingan C = As.Cb/Ab dimana As= serapan sampel, Ab=serapan baku, Cb=konsentrasi baku, dan C=konsentrasi
sampel (Holme and Peck, 1983). 2.7 Parameter Validasi
Pensahihan adalah kerja yang dicatat dalam dokumen untuk membuktikan
bahwa prosedur analisis yang diuji akan dapat memenuhi fungsi yang sesuai dengan tujuannya dengan konsisten dan betul-betul memberikan hasil seperti yang diharapkan. Tujuan pensahihan adalah agar prosedur analisis tersebut diketahui
akurasi dan variabilitasnya, gangguan yang mungkin ada teridentifikasi dan diketahui pula kespeksifikan, presisi, serta kepekaanya (limit deteksi)
(Satiadarma, dkk., 2004). Menurut Harmita (2004), parameter validasi terdiri dari kecermatan (akurasi), keseksamaan (presisi), selektivitas (spesifisitas), linearitas dan rentang, batas deteksi dan batas kuantitasi, ketangguhan metode (ruggedness)
dan kekuatan (robustness).
Akurasi dari suatu metode analisis adalah kedekatan nilai hasil uji yang
diterapkan berulang kali pada sejumlah cuplikan yang diambil dari satu sampel
homogen. Presisi dinyatakan sebagai deviasi standar atau deviasi standar relatif (koefisien variasi) (Satiadarma, dkk., 2004).
Kespeksifikan dari suatu metode analisis adalah kemampuannya untuk mengukur kadar analit secara khusus dengan akurat, di samping komponen lain yang terdapat dalam matriks sampel. Kespesifikan sering kali dinyatakan sebagai
derajat bias dari hasil analisis sampel yang mengandung pencemar, hasil degradasi, senyawa sejenis yang ditambahkan atau komponen matriks,
dibandingkan dengan hasil uji sampel analit tanpa zat tambahan (Satiadarma, dkk., 2004).
Linearitas adalah kemampuan metode analisis yang memberikan respon
yang secara langsung atau dengan bantuan transformasi matematik yang baik, proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat
ditetapkan dengan kecermatan, keseksamaan, dan linearitas yang dapat diterima (Harmita, 2004).
Limit deteksi dari suatu metode analisis adalah nilai parameter uji batas, yaitu konsentrasi analit terrendah yang dapat dideteksi, tetapi tidak dikuantitasi pada kondisi percobaan yang dilakukan. Limit deteksi dinyatakan dalam
konsentrasi analit (persen, bagian per milyar) dalam sampel. Limit kuantitasi dari suatu metode analisis adalah nilai parameter penentuan kuantitatif senyawa yang
kuantitasi dinyatakan dalam konsentrasi analit (persen, bagian per milyar) dalam
sampel (Satiadarma, dkk., 2004).
Ketangguhan metode adalah derajat ketertiruan hasil uji yang diperoleh
dari analisis sampel yang sama dalam berbagai kondisi uji normal, seperti laboratorium, analisis, instrumen, bahan pereaksi, suhu, hari yang berbeda, dan lain-lain. Ketangguhan biasanya dinyatakan sebagai tidak adanya pengaruh
perbedaan operasi atau lingkungan kerja pada hasil uji. Ketangguhan metode merupakan ukuran ketertiruan pada kondisi operasi normal antara laboratorium
dan antar analis (Harmita, 2004).
2.8 Analisis Nipagin dalam Kecap
Nipagin diekstraksi menggunakan eter dalam suasana asam untuk
menghidrolisis esternya. Uji kualitatif nipagin dapat dilakukan dengan menambahkan pereaksi Millon ke dalam larutan hasil ekstraksi dan menghasilkan warna merah rose. Namun reaksi ini tidak spesifik karena beberapa senyawa
aromatik dengan gugus hidroksil yang terikat pada inti benzen memberikan warna dengan pereaksi Millon, misalnya asam salisilat memberikan warna orange
dengan pereaksi Millon. Pereaksi Millon kurang reprodusibel dan kurang stabil untuk menganalisis nipagin secara kuantitatif, sehingga diusulkan untuk menggunakan metode Lemieszek-Chodorowska, yaitu suatu metode dengan
memanaskan larutan sampel menggunakan pereaksi Deniges diikuti penambahan larutan natrium nitrit 2% sehingga terbentuk larutan berwarna pink yang dapat
memberikan absorbansi pada daerah sinar tampak (Egan et al., 1981).
dilakukan dengan metode elektroforesis kapiler dengan deteksi amperometrik.
Kondisi optimum pemisahan diperoleh dalam waktu 16 menit dengan tegangan 16kV menggunakan larutan dapar borax konsentrasi 80 mmol/l pada pH 9,94.
Ekstraksi dilakukan dengan menggunakan pelarut etanol-air-asam asetat (70:30:0,5). Metode ini memberikan persen perolehan kembali sebesar 95-102% dengan presisi sebesar ≤ 2,4% dan waktu migrasi ≤ 0,5% dari empat analit.
Chen et al. (2004) melakukan penetapan kadar turunan benzoat (metil paraben, propil paraben, butil paraben dan parahidroksibenzoat) dalam kecap
menggunakan elektroforesis kapiler dan mikroekstraksi. Sampel diekstraksi menggunakan etil asetat dalam suasana asam. Larutan hasil ekstraksi dipisahkan menggunakan dapar borax konsentrasi 20 mM (pH 9,2) pada tegangan 10 kV.
Pemisahan diperoleh dalam waktu 10 menit dengan asam hipurat sebagai standar internal untuk meningkatkan reprodusibilitas.
Kertadarma dkk. (2004) melakukan analisis kandungan nipagin dan
nipasol dalam beberapa jenis makanan secara kombinasi kromatografi lapis tipis dan spektrofotometri ultraviolet. Sampel diekstraksi menggunakan eter dalam
suasana asam lalu dilakukan pemisahan secara kromatografi lapis tipis pada lempeng silika gel menggunakan pelarut heksan:n-butanol:asam asetat (72:18:10) sebagai pengembang. Bercak yang terbentuk dikerok dan diekstraksi dengan
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini termasuk jenis penelitian deskriptif dan penelitian ini dilakukan di Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi USU dan
di Laboratorium Penelitian Fakultas Farmasi USU Medan pada bulan Januari 2011 sampai dengan Maret 2011.
3.2 Bahan-Bahan 3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah kecap pada mi instan
dari berbagai merk.
3.2.2 Pereaksi
Bahan yang digunakan adalah pro analisis keluaran E. Merck kecuali
disebutkan lain yaitu Asam Sulfat, NaCl, dietil eter, Merkuri Oksida Red, Natrium Nitrit, Nipagin BPFI (sertifikat pengujian dapat dilihat pada Lampiran 18
Halaman 65), dan Akuades.
3.3 Alat-Alat
Peralatan yang digunakan adalah: Neraca Analitik, Spektrofotometer UV
Mini 1240 Shimadzu (dapat dilihat Gambar 5 pada Lampiran 16 Halaman 63), Rotary evaporator, Penangas air, hot plate, pH indikator universal (E.Merck), dan
3.4 Pembuatan Pereaksi 3.4.1. Larutan NaCl jenuh
Sebanyak 90 g NaCl p.a ditimbang dan dilarutkan dengan 300 ml akuades
di dalam beaker gelas kemudian diaduk hingga NaCl tersebut tidak larut lagi.
3.4.2. Larutan H2SO4 10% v/v
Alirkan secara perlahan-lahan dan sedikit demi sedikit lewat batang
pengaduk 18,3 ml H2SO4 95% ke dalam botol kaca yang sudah dikalibrasi 300 ml
berisi 281,7 ml akuades sambil sesekali disertai pengadukan, didinginkan
(Mulyono, 2009).
3.4.3. Pereaksi Deniges
Larutkan 25 g Merkuri Oksida Red dalam 200 ml akuades, dinginkan
dalam es dan garam dan pelan-pelan tambahkan 100 ml H2SO4 95% dan
diencerkan dengan akuadtges hingga 500 ml (Cahyadi, 2008).
3.4.4. Larutan Natrium Nitrit 2% b/v
Larutkan 2 g NaNO2 p.a dalam akuades dan diencerkan dengan akuades
hingga 100 ml, dibuat segar (Ditjen POM, 1995).
3.5 Prosedur Penelitian 3.5.1 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa
membandingkan antara satu tempat dengan tempat yang lain, karena sampel dianggap homogen dan berasal dari nomor batch yang sama. Sampel yang
3.5.2 Penyiapan Bahan
Kecap mi instan merk A, mi instan merk B, dan mi instan merk C masing-masing dari nomor batch yang sama ditimbang ± 80 gram dan masing-masing
dihomogenkan.
3.5.3 Proses Ekstraksi
Proses ekstraksi yang dilakukan adalah modifikasi dari Kartadarma dkk.
(2004) dan SNI (1999). Sejumlah 10 g cuplikan kecap mi instan dicampur air suling sebanyak 50 ml kemudian dimasukkan ke dalam corong pisah. Ke dalam
corong pisah kemudian ditambah 10 ml larutan natrium klorida jenuh. Campuran diasamkan dengan asam sulfat 10% sampai pH 1, dan diekstraksi berturut-turut dengan 75, 50, dan 25 ml eter. Ekstrak eter dikumpulkan, dicuci tiga kali setiap
kali dengan 30 ml akuades. Lapisan eter kemudian diuapkan dengan penguap rotasi vakum, dan dilarutkan dalam akuades sampai 25 ml.
3.5.4 Analisis Kualitatif
Analisis kualitatif dilakukan dengan dua cara yaitu membandingkan warna yang terbentuk dari larutan sampel terhadap larutan standar dengan menggunakan
pereaksi deniges dan natrium nitrit 2% b/v dan dengan cara membandingkan spektrum larutan sampel terhadap larutan nipagin BPFI. Ke dalam 5 ml larutan sampel ditambahkan 5 ml pereaksi deniges. Dipanaskan pada penangas air selama
5 menit kemudian didinginkan. Ditambahkan natrium nitrit 2 % b/v sebanyak 5 tetes terbentuk kompleks berwarna pink (Egan et al., 1981). Kemudian diukur
3.5.5 Analisis Kuantitatif
3.5.5.1 Pembuatan Larutan Induk Baku Nipagin
Ditimbang 0,0500 gram Nipagin BPFI yang telah dikeringkan diatas silika
gel selama 5 jam, kemudian dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dalam akuades dan dicukupkan volumenya dengan akuades hingga garis tanda. Diperoleh konsentrasi nipagin pada Larutan Induk Baku (LIB) I
adalah 500 µg/ml.
Dari LIB I tersebut dipipet 7,5; 10; 11; 12,5 dan 15 ml kemudian
dimasukkan ke dalam labu tentukur 50 ml dan dicukupkan volumenya dengan akuades hingga garis tanda. Diperoleh konsentrasi nipagin pada LIB II yaitu 75; 100; 110; 125 dan 150 µg/ml.
3.5.5.2 Penentuan Waktu Kerja
Dari LIB II konsentrasi 110 µg/ml dipipet 5 ml, dimasukkan ke dalam erlenmeyer bertutup dan ditambahkan 5 ml pereaksi deniges. Dipanaskan pada
penangas air selama 5 menit, didinginkan, kemudian ditambahkan 5 tetes natrium nitrit 2% b/v, dikocok dan dimasukkan ke dalam labu tentukur 25 ml. Dicukupkan
volumenya dengan akuades hingga garis tanda (konsentrasi 22 µg/ml). Diukur
serapan pada λ maksimum 504 nm mulai menit ke-5 hingga menit ke-60 dengan
interval waktu 1 menit.
3.5.5.3 Penentuan Panjang Gelombang Maksimum
Dari LIB II konsentrasi 110 µg/ml dipipet 5 ml, dimasukkan ke dalam
volumenya dengan akuades hingga garis tanda (konsentrasi 22 µg/ml). Didiamkan
selama 42 menit dan diukur serapan λ maksimum 400-800 nm pada menit ke-43.
3.5.5.4 Penentuan Kurva Kalibrasi Larutan Standar Nipagin
LIB II masing-masing dipipet 5 ml, dimasukkan ke dalam erlenmeyer bertutup dan ditambahkan masing-masing 5 ml pereaksi deniges. Dipanaskan pada penangas air selama 5 menit, didinginkan, kemudian ditambahkan 5 tetes
natrium nitrit 2% b/v, dikocok dan dimasukkan ke dalam labu tentukur 25 ml. Dicukupkan volumenya dengan akuades hingga garis tanda (konsentrasi 15; 20;
22; 25 dan 30 µg/ml). Didiamkan selama 42 menit dan diukur serapan pada λ maksimum 504 nm pada menit ke-43.
3.5.5.5 Penetapan Kadar Nipagin dalam Sampel
Larutan sampel hasil ekstraksi dipipet 5 ml, dimasukkan ke dalam erlenmeyer bertutup dan ditambahkan 5 ml pereaksi deniges. Dipanaskan pada penangas air selama 5 menit, didinginkan, kemudian ditambahkan 5 tetes natrium
nitrit 2% b/v, dikocok dan dimasukkan ke dalam labu tentukur 25 ml. Dicukupkan volumenya dengan akuades hingga garis tanda. Didiamkan selama 42 menit dan
diukur serapan pada λ maksimum 504 nm pada menit ke-43 (Egan et al., 1981).
Kadar ditentukan dengan rumus sebagai berikut:
(g) Sampel Berat
n Pengencera Faktor
x (ml) Volume x
(mcg/ml) i
Konsentras (mcg/g)
Nipagin
Kadar =
3.5.6 Analisis Data Secara Statistik
Kadar nipagin yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis dengan metode standar deviasi dengan rumus (Sudjana,
2005):
SD =
(
)
1 -n
X
-Xi 2
∑
Keterangan : Xi = Kadar sampel
−
X= Kadar rata-rata sampel
n = jumlah perlakuan Untuk mencari t hitung digunakan rumus:
t hitung =
n SD
X Xi
/
−
dan untuk menentukan kadar nipagin di dalam sampel dengan interval
kepercayaan 95%, α = 0.05, dk = n-1, dapat digunakan rumus:
Kadar Nipagin = µ = X ± (t(α/2, dk) x SD / √n )
Keterangan :
−
X = Kadar rata-rata sampel
SD = Standar Deviasi
dk = Derajat kebebasan (dk = n-1) α = interval kepercayaan
n = jumlah perlakuan
3.5.7 Uji Perolehan Kembali
penentuan kadar nipagin dalam sampel setelah penambahan larutan standar
dengan konsentrasi tertentu (Ermer, 2005). Larutan standar yang ditambahkan yaitu, 10 ml larutan standar nipagin (konsentrasi 75 µg/ml).
Sampel mi instan merk C ditimbang secara seksama sebanyak 10 gram, lalu ditambahkan 10 ml larutan standar nipagin (konsentrasi 75 µg/ml), kemudian dilanjutkan dengan prosedur ekstraksi seperti yang telah dilakukan sebelumnya.
Persen perolehan kembali dapat dihitung dengan rumus di bawah ini (Harmita, 2004):
% = 100%
n ditambahka yang
standar larutan
kadar
awal sampel dalam
nipagin kadar
sampel dalam
nipagin total
kadar − ×
3.5.8 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara
berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang
dilakukan.
Adapun rumus untuk menghitung simpangan baku relatif adalah (Harmita, 2004) :
RSD = ×100%
X SD
3.5.9 Penentuan Batas Deteksi dan Batas Kuantitasi
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama.
Batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai
berikut (Harmita, 2004):
Simpangan Baku =
(
)
2
2
− −
∑
n Yi Y
Batas deteksi =
slope SB x
3
Batas kuantitasi =
slope SB x
BAB IV
HASIL DAN PEMBAHASAN
4.1 Analisis Kualitatif
Analisis kualitatif dilakukan dengan dua cara yaitu membandingkan warna yang terbentuk dari larutan sampel terhadap larutan standar dengan menggunakan
pereaksi deniges dan natrium nitrit 2% b/v dan dengan cara membandingkan spektrum larutan sampel terhadap larutan nipagin BPFI. Hasil analisis kualitatif
nipagin dalam sampel dengan perbandingan warna menggunakan pereaksi deniges dan natrium nitrit 2% b/v dapat dilihat pada Tabel 1 dan Lampiran 1 Halaman 36. Tabel 1. Hasil Analisis Kualitatif Nipagin dengan Pereaksi Deniges dan Natrium
Nitrit 2% b/v
No. Sampel Reaksi dengan Pereaksi Deniges
dan Natrium Nitrit 2% b/v Hasil
1. SA Pink +
2. SB Pink +
3. SC Pink +
Keterangan : + = mengandung nipagin; SA = mi instan merk A; SB = mi instan merk B; SC = mi instan merk C.
Tabel di atas menunjukkan bahwa ketiga sampel, yaitu mi instan merk A, B dan C mengandung pengawet nipagin. Sampel dikatakan positif mengandung
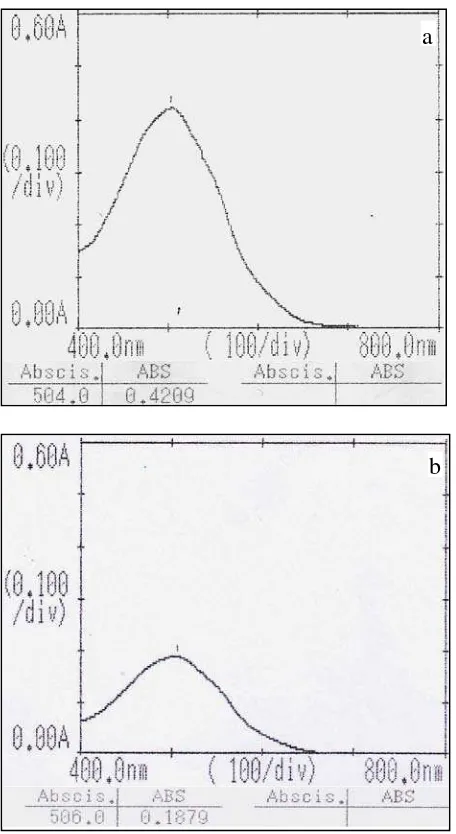
nipagin jika warna bening dari pereaksi berubah menjadi pink (Egan et al., 1981). Dari hasil uji kualitatif larutan nipagin BPFI (22 µg/ml) dengan pereaksi deniges dan natrium nitrit 2% b/v diperoleh spektrum dengan panjang gelombang
[image:41.595.114.507.400.500.2]pengujian nipagin BPFI dibandingkan terhadap spektrum sampel yang akan
[image:42.595.113.341.136.553.2]dianalisis.
Gambar 1. Spektrum dari (a) nipagin BPFI Konsentrasi 22 µg/ml dan (b) nipagin dalam Larutan Sampel
Hasil pengujian untuk larutan sampel pada Gambar 1(b) diperoleh spektrum dengan profil yang hampir sama dengan spektrum larutan nipagin BPFI pada Gambar 1(a) yang menyatakan adanya nipagin dalam sampel. Panjang
gelombang maksimum yang diperoleh dari larutan sampel yaitu 506 nm. a
4.2 Analisis Kuantitatif
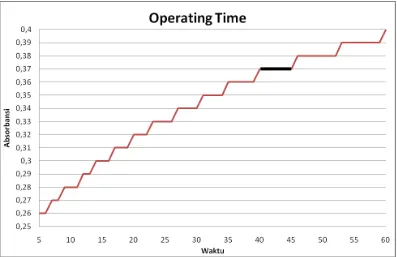
4.2.1 Penentuan Waktu Kerja
Untuk menentukan waktu kerja nipagin dengan pereaksi deniges,
digunakan larutan standar nipagin 22 µg/ml dan diukur absorbansinya pada λ 504
nm pada menit ke-5 sampai menit ke-60 (data dan grafik dapat dilihat pada Lampiran 2 dan 3 Halaman 37 dan Halaman 39). Dari hasil ditentukan waktu
kerja pada menit ke-43.
4.2.2 Penentuan Panjang Gelombang Maksimum
Kurva penentuan panjang gelombang maksimum nipagin dengan pereaksi deniges dapat dilihat pada Gambar 1(a). Dari penentuan diperoleh panjang gelombang maksimum larutan standar nipagin konsentrasi 22 µg/ml dengan
pereaksi deniges dan natrium nitrit % b/v adalah 504 nm.
4.2.3 Kurva kalibrasi Nipagin
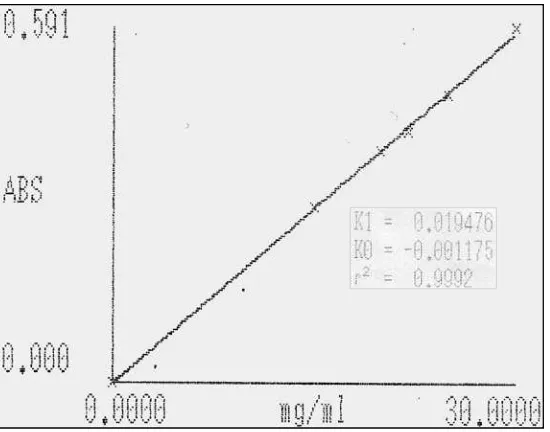
Kurva kalibrasi nipagin diperoleh dengan cara mengukur absorbansi dari
larutan standar nipagin dengan konsentrasi 0, 15, 20, 22, 25, dan 30 µg/ml pada panjang gelombang maksimum. Data hasil pengukuran absorbansi larutan standar
nipagin dapat dilihat pada Lampiran 4 Halaman 40. Perhitungan persamaan garis regresi dapat dilihat pada Lampiran 5 Halaman 41. Kurva kalibrasi larutan standar nipagin dapat dilihat pada Gambar 2. Dari pengukuran kurva kalibrasi
diperoleh persamaan garis regresi yaitu Y = 0,0195X – 0,0017.
Dari kurva kalibrasi diperoleh hubungan yang linear antara konsentrasi
Gambar 2. Kurva Kalibrasi Larutan Standar Nipagin dengan Pereaksi Deniges pada Panjang Gelombang 504 nm
4.2.4 Analisis Kadar nipagin pada kecap mi instan
Penentuan kadar nipagin dilakukan secara spektrofotometri sinar tampak
menggunakan pereaksi deniges. Konsentrasi nipagin dalam sampel ditentukan berdasarkan persamaan garis regresi kurva kalibrasi larutan standar nipagin. Data
absorbansi dan hasil analisis kadar nipagin dapat dilihat pada Lampiran 6 dan Lampiran 7 halaman 42 dan 43. Contoh perhitungan kadar nipagin dapat dilihat pada Lampiran 8 Halaman 44.
Analisis dilanjutkan dengan perhitungan statistik (perhitungan dapat dilihat pada Lampiran 9 Halaman 45 dan tabel distribusi t dapat dilihat pada
Tabel 2. Kadar Pengawet Nipagin pada Kecap Mi Instan
No Sampel Kadar Nipagin (mg/kg)
1. SA 146,5 ± 10,6
2. SB 183,4 ± 2,4
3. SC 191,5 ± 4,5
Keterangan : SA = mi instan merk A, SB = mi instan merk B, dan SC = mi instan merk C.
Dari Tabel 2 diketahui bahwa kadar nipagin pada kecap mi instan dari mi instan merk A, B dan C masing-masing adalah 146,5 ± 10,6 mg/kg ; 183,4 ± 2,4
mg/kg dan 191,5 ± 4,5 mg/kg. Menurut Permenkes RI Nomor 722/Menkes/Per/IX/88 tentang bahan tambahan makanan, batas maksimum
penggunaan pengawet nipagin pada kecap adalah 250 mg/kg. Dengan demikian, kadar pengawet nipagin pada kecap mi instan tidak melebihi ambang batas maksimum yang diizinkan sehingga aman untuk dikonsumsi.
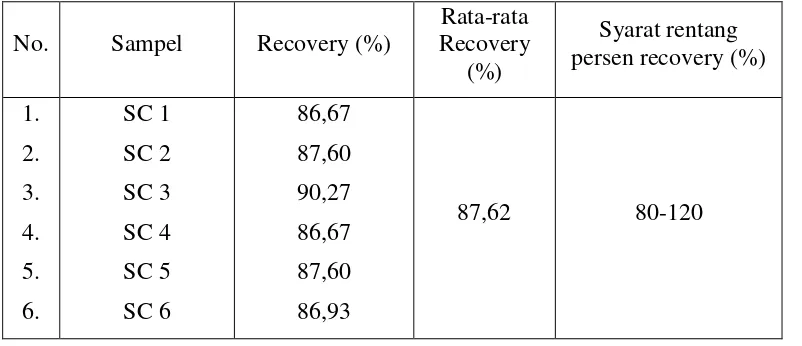
4.2.5 Uji Perolehan Kembali
Data absorbansi dan hasil uji perolehan kembali (recovery) pengawet nipagin setelah penambahan larutan standar nipagin dalam sampel dapat dilihat
pada Lampiran 11 Halaman 56 dan Lampiran 12 Halaman 57. Persen perolehan kembali nipagin dalam sampel dan contoh perhitungannya dapat dilihat pada
Lampiran 13 Halaman 58 dan Lampiran 14 Halaman 59. Persen uji perolehan kembali (recovery) nipagin dalam sampel dapat dilihat pada Tabel 3. Perhitungan statistik kadar perolehan kembali nipagin dapat dilihat pada Lampiran 15
Tabel 3. Persen Uji Perolehan Kembali (recovery) Nipagin dalam Sampel
No. Sampel Recovery (%)
Rata-rata Recovery
(%)
Syarat rentang persen recovery (%) 1.
2. 3. 4. 5. 6.
SC 1 SC 2 SC 3 SC 4 SC 5 SC 6
86,67 87,60 90,27 86,67 87,60 86,93
87,62 80-120
Berdasarkan Tabel 3, dapat dilihat bahwa rata-rata hasil uji perolehan kembali (recovery) nipagin adalah 87,62%. Persen recovery tersebut
menunjukkan kecermatan kerja yang memuaskan pada saat penentuan kadar nipagin dalam sampel. Hasil uji perolehan kembali (recovery) ini memenuhi syarat akurasi yang telah ditetapkan, yaitu rata-rata hasil perolehan kembali
(recovery) untuk sampel dalam matriks dengan nilai presisi yang dapat diterima adalah 80%-110% (Ermer, 2005).
4.2.6 Simpangan Baku Relatif
Berdasarkan perhitungan yang dilakukan terhadap data hasil pengukuran uji perolehan kembali kadar nipagin pada mi instan diperoleh nilai simpangan
baku dan nilai simpangan baku relatif. Perhitungan simpangan baku dan simpangan baku relatif dapat dilihat pada Lampiran 15 Halaman 60. Dari
perhitungan diperoleh nilai simpangan baku yaitu 0,3571 dan nilai simpangan baku relatif yaitu 0,1391%. Menurut Harmita (2004), nilai simpangan baku relatif untuk analit dengan kadar satu per seribu adalah 5%. Dari hasil yang diperoleh
4.2.7 Batas Deteksi dan Batas Kuantitasi
Berdasarkan data kurva kalibrasi nipagin, diperoleh batas deteksi dan batas kuantitasi. Perhitungan batas deteksi dan batas kuantitasi dapat dilihat pada
Lampiran 10 Halaman 54. Dari hasil perhitungan diperoleh batas deteksi sebesar 0,9876 µg/ml dan batas kuantitasinya sebesar 3,2921 µg/ml. Dari hasil perhitungan dapat dilihat bahwa semua hasil yang diperoleh pada pengukuran
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penentuan kadar nipagin yang dilakukan pada kecap mi instan
secara kuantitatif dengan menggunakan spektrofotometer sinar tampak diperoleh kadar nipagin yang terdapat pada kecap mi instan merk A, B dan C
masing-masing adalah 146,5 ± 10,6 mg/kg; 183,4 ± 2,4 mg/kg dan 191,5 ± 4,5 mg/kg. Hasil penelitian ini menunjukkan bahwa kadar pengawet nipagin pada kecap mi instan merk A, B dan C sesuai dengan standar Permenkes RI Nomor
722/Menkes/Per/IX/88 tentang bahan tambahan makanan yaitu sebesar 250 mg/kg.
Dari hasil uji perolehan kembali (recovery) nipagin dalam sampel diperoleh rata-rata persen perolehan kembali adalah 87,62%. Hasil uji perolehan kembali ini memenuhi syarat akurasi yang telah ditetapkan, yaitu rata-rata hasil
perolehan kembali adalah 80%-120% (Ermer, 2005). 5.2 Saran
Disarankan kepada peneliti selanjutnya untuk memeriksa kadar nipagin
pada bumbu dan saos menggunakan metode spektrofotometri sinar tampak dengan pereaksi deniges. Karena berdasarkan informasi yang diperoleh produk
tersebut menggunakan nipagin sebagai pengawet.
Disarankan kepada peneliti selanjutnya untuk memeriksa nipasol pada produk makanan, misalnya sari buah dan acar ketimun menggunakan metode
DAFTAR PUSTAKA Anonima
Anonimb. Risiko di Balik Zat Pengawet Methylparaben.
http:/www.ikatanapotekerindonesia.net. Diakses tanggal 17 maret 2011. . Mi Instan. http://www.republika.co.id/berita/fullnews. Diakses tanggal 17 Maret 2011.
Ayres, J.C., Mundt, J.O., dan Sandine, W.E. (1980). Microbiology of Foods. San Fransisco: W.H. Freeman and company. Hal. 238-239.
Bassett et al.1994. Buku ajar vogel: Kimia Analisis Kuantitatif Anorganik. edisi 4. Jakarta: EGC.
Cahyadi (2008). Analisis dan Aspek Kesehatan Bahan Tambahan Pangan. Edisi 2. Cetakan 1. Jakarta: Bumi Aksara. 9-15.
Chen, J.J., Lee, Y.C., Lin, H.C., dan Chen, R.L.C. (2004). Determination of Benzoate derivatives in Soy Sauce by Capillary Electrophoresis and In-Capillary Microextraction Prosedure. Journal of Food and Drug Analysis. Vol. 12, No. 4. Hal. 332-335.
Chu, T.Y., Chen, C.L., dan Wang, H.F. (2003). A Rapid Method for The Simultaneous Determination of Preservatives in Soy Sauce. Journal of Food and Drug Analysis. Vol. 11, No. 3. Hal. 246-250.
Chu, Q., Wang, J., Zhang, D., dan Ye, Z. (2010). Sensitive Determination of Parabens in Soy Sauces by capillary Zone Electrophoresis with Amperometric detection. Eur food Res Technol 231. Hal. 891-897.
Dachriyanus, (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. Hal. 1-3.
Darbre, P.D., Aljarrah, A., Miller, W.R., Coldham, N.G., Sauer, M.J., dan Pope, G.S. (2004). Concentration of parabens in human breast tumours. Journal of Applied Toxicology 24. Hal. 5-13.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Hal. 772.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 551,1061,1085.
Eep. (2006). Mi Instan Sehat, Aman Serta Layak Dikonsumsi?
Ermer, J. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Hal. 70-79.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. Vol.1. No.3. Hal. 117-135.
Jayadireja, A. (2010). Menelusuri Nipagin. http:/www.sendokgarpu.com. Diakses tanggal 28 Februari, 2011.
Kartadarma, E., Kisman, S. Dan Abdulah, N. (2004). Analisis Kandungan Nipagin dan Nipasol dalam Beberapa Jenis Makanan Secara Kombinasi Kromatografi Lapis Tipis dan Spektrofotometri Ultraviolet. Acta Pharmaceutica Indonesia. Vol. XXIX. No 3. Hal. 112-114.
Kokasih et al. 2004. Asas Pengembangan Prosedur Analisis. Edisi pertama. Surabaya: Airlangga University Press.
Lemini, C., Jaimes, R., Avila, M.E., Franco, Y., Larrea, F. Dan Lemus A.E. (2003). In vivo and in vitro estrogen bioactivities of alkyl parabens.
Toxicology and Industrial Health 19. Hal. 78.
Mulyono, (2009). Membuat Reagen Kimia di Laboratorium. Bandung: Bumi aksara. Hal. 35.
Ponte, J.G. dan Tsen, C.C. (1985). Food and Beverage Micology.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta. Penerbit: Pustaka belajar. Hal. 43-47,222.
Shargel, L., and Andrew, B. C. (1999). Applied Biopharmaceutics and Pharmacokinetics. USA: Prentice-hall international, INC. Hal. 15.
SNI 3543-1999. Kecap Kedelai. Departemen Perindustrian RI. Jakarta. Hal. 1-7.
SNI 3551-2000. Mi Instan. Departemen Perindustrian RI. Jakarta. Hal. 1-2.
Soni, M.G., Taylor, S.L.,Greenberg, N.A., dan Burdock, G.A. (2002). Evaluation of The health Aspects of Methyl Paraben: A Review of The Published Literature. Food Chemical Toxicology. Hal. 1335.
Sudjana. (2005). Metoda Statistika. Edisi Ke-6. Bandung: Tarsito. Hal. 93, 168-169, 193.
Syah, D. (2005). Manfaat dan Bahaya Bahan Tambahan Pangan. Himpunan Alumni Fakultas Teknologi Pertanian.
Lampiran 1. Hasil Analisis Kualitatif dengan Pereaksi Deniges dan Natrium Nitrit 2% b/v
[image:52.595.112.387.118.652.2]
Gambar 3. Hasil Analisis Kualitatif (a) Sampel dan (b) Larutan Standar
Keterangan : SA = mi instan merk A, SB = mi instan merk B, dan SC = mi instan merk C.
a
Lampiran 2. Data Hasil Penentuan Waktu Kerja Nipagin pada λ = 504 nm No. Menit ke- Absorbansi
1. 5 0,2576
2. 6 0,2614
3. 7 0,2665
4. 8 0,2708
5. 9 0,2759
6. 10 0,2800
7. 11 0,2848
8. 12 0,2893
9. 13 0,2932
10. 14 0,2971
11. 15 0,3007
12. 16 0,3043
13. 17 0,3076
14. 18 0,3108
15. 19 0,3143
16. 20 0,3176
17. 21 0,3207
18. 22 0,3239
19. 23 0,3265
20. 24 0,3293
21. 25 0,3326
22. 26 0,3344
23. 27 0,3369
24. 28 0,3398
25. 29 0,3424
26. 30 0,3446
27. 31 0,3469
28. 32 0,3494
29. 33 0,3519
30. 34 0,3541
31. 35 0,3563
32. 36 0,3585
33. 37 0,3601
34. 38 0,3619
35. 39 0,3639
36. 40 0,3655
37. 41 0,3677
38. 42 0,3693
39. 43 0,3713
40. 44 0,3729
41. 45 0,3746
42. 46 0,3761
43. 47 0,3777
45. 49 0,3807
46. 50 0,3820
47. 51 0,3835
48. 52 0,3846
49. 53 0,3860
50. 54 0,3873
51. 55 0,3890
52. 56 0,3904
53. 57 0,3915
54. 58 0,3927
55. 59 0,3940
Lampiran 3. Grafik Penentuan Waktu Kerja Nipagin dengan Pereaksi Deniges
[image:55.595.114.511.125.382.2]pada λ = 504 nm
Gambar 4. Grafik Penentuan Waktu Kerja Nipagin dengan Pereaksi Deniges
Lampiran 4. Data Hasil Pengukuran Absorbansi Larutan Standar Nipagin
No. Konsentrasi (µg/ml) Absorbansi
1. 0,000 0,000
2. 15,000 0,294
3. 20,000 0,389
4. 22,000 0,419
5. 25,000 0,481
Lampiran 5. Perhitungan Persamaan Garis Regresi Larutan Standar Nipagin
No. X Y XY X2 Y2
1. 0,000 0,000 0,0000 0,000 0,0000
2. 15,000 0,294 4,4100 225,000 0,0864
3. 20,000 0,389 7,7800 400,000 0,1513
4. 22,000 0,419 9,2180 484,000 0,1756
5. 25,000 0,481 12,0250 625,000 0,2314
6. 30,000 0,591 17,7300 900,000 0,3493
∑ 112,000 2,174 51,1630 2.634,000 0,9940
X = 18,6667 Y= 0,3623
a =
(
) (
) (
)
(
2)
(
)
2∑
∑
∑
∑
∑
− − X X n Y X XY n =(
) (
)
(
)
2000 , 112 ) 000 , 634 . 2 ( 6 174 , 2 000 , 112 ) 1630 , 51 ( 6 − − = 0,0195
Y= a X + b
b = Y − aX
= 0,3623 − (0,0195 x 18,6667)
= – 0,0017
Maka persamaan garis regresinya adalah : Y= 0,0195 X – 0,0017
r =
(
)(
)
(
) (
)
{
2}
{
(
) (
)
2}
1740 , 2 9940 , 0 6 000 , 112 000 , 634 . 2 6 1740 , 2 000 , 112 ) 1630 , 51 ( 6 − − −
r = 0,9995
(
) (
)( )
(
) (
)
{
2 2}
{
(
2) ( )
2}
Lampiran 6. Data Hasil Pengukuran Absorbansi Nipagin pada Sampel
No. Sampel Absorbansi A
A1 A2 A3
1. SA 1 0,2400 0,2289 0,2285 0,2325
2. SA 2 0,2399 0,2408 0,2408 0,2405
3. SA 3 0,2365 0,2427 0,2356 0,2383
4. SA 4 0,2202 0,2197 0,2238 0,2212
5. SA 5 0,2145 0,2190 0,2128 0,2154
6. SA 6 0,1960 0,2075 0,2084 0,2040
7. SB 1 0,2494 0,2532 0,2493 0,2506
8. SB 2 0,2502 0,2534 0,2528 0,2521
9. SB 3 0,2803 0,2811 0,2866 0,2827
10. SB 4 0,2893 0,2833 0,2814 0,2847
11. SB 5 0,2845 0,2775 0,2948 0,2856
12. SB 6 0,2971 0,3002 0,2977 0,2983
13. SC 1 0,2942 0,2953 0,2979 0,2958
14. SC 2 0,3027 0,3104 0,3052 0,3061
15. SC 3 0,2893 0,2952 0,2896 0,2914
16. SC 4 0,2853 0,2920 0,2946 0,2906
17. SC 5 0,3054 0,2955 0,3005 0,3005
18. SC 6 0,3079 0,2963 0,2979 0,3007
Lampiran 7. Hasil Analisis Kadar Nipagin dalam Sampel
No Sampel Berat
Sampel (g) Absorbansi (A) Konsentrasi (µg/ml) Kadar (mg/kg) 1. SA 1
SA 2 SA 3 SA 4 SA 5 SA 6 10,0007 10,0008 10,0009 10,0006 10,0004 10,0002 0,2325 0,2405 0,2383 0,2212 0,2154 0,2040 12,0103 12,4205 12,3077 11,4308 11,1333 10,5487 150,1 155,2 153,8 142,9 139,2 131,9 2. SB 1
SB 2 SB 3 SB 4 SB 5 SB 6 10,0002 10,0004 10,0007 10,0008 10,0007 10,0009 0,2506 0,2521 0,2827 0,2847 0,2856 0,2983 12,9385 13,0154 14,5846 14,6872 14,7333 15,3846 161,7 162,7 182,3 183,6 184,2 192,3 3. SC 1
SC 2 SC 3 SC 4 SC 5 SC 6 10,0005 10,0003 10,0012 10,0007 10,0010 10,0008 0,2958 0,3061 0,2914 0,2906 0,3005 0,3007 15,2564 15,7846 15,0308 14,9897 15,4974 15,5077 190,7 197,3 187,9 187,4 193,7 193,8
Lampiran 8. Contoh Perhitungan Kadar Nipagin dalam Sampel Mi Instan Merk A
Contoh Perhitungan Kadar Nipagin pada SA 1
Berat sampel yang ditimbang = 10,0007 gram Absorbansi (Y) = 0,2325
Persamaan Regresi:Y= 0,0195X – 0,0017
X = 0195 , 0 0017 , 0 2325 , 0 + = 12,0103
Konsentrasi nipagin = 12,0103 µg/ml
(g) Sampel Berat n Pengencera Faktor x (ml) Volume x (mcg/ml) i Konsentras (mcg/g) Nipagin
Kadar =
= g x ml x ml g 0007 , 10 5 25 / 0103 , 12 µ
= 150,1 µg/g = 150,1 mg/kg
Lampiran 9. Perhitungan Statistik Kadar Nipagin dalam Sampel 1. Perhitungan Statistik Kadar Nipagin pada Kecap Mi Instan Merk A
No. Sampel Xi
Kadar (mg/kg) (Xi – X) (Xi –X )
2 1. 2. 3. 4. 5. 6. SA 1 SA 2 SA 3 SA 4 SA 5 SA 6 150,1 155,2 153,8 142,9 139,2 131,9
− 4,6
− 9,7
− 8,3 2,6 6,3 13,6 21,16 94,09 68,89 6,76 39,69 184,96 ∑ 873,1
X = 145,5
415,55
SD =
(
)
1 -n X -Xi 2
∑
=
1 6 55 , 415− = 9,1165
[image:61.595.112.370.575.721.2]Pada interval kepercayaan 95% dengan nilai α = 0.05, dk = 5 diperoleh nilai t tabel = α /2,dk = 2,5706.
Data diterima jika t hitung < t tabel.
t hitung =
n SD X Xi / −
t hitung SA 1 =
6 / 2291 , 8 6 , 4 −
= 1,2360 (Data diterima)
t hitung SA 2 =
6 / 2291 , 8 7 , 9 −
t hitung SA 3 = 6 / 2291 , 8 3 , 8 −
= 2,2301 (Data diterima)
t hitung SA 4 =
6 / 2291 , 8 6 , 2
= 0,6986 (Data diterima)
t hitung SA 5 =
6 / 2291 , 8 3 , 6
= 1,6927 (Data diterima)
t hitung SA 6 =
6 / 2291 , 8 6 , 13
= 3,6542 (Data ditolak)
Untuk itu perhitungan diulangi dengan cara yang sama tanpa mengikutsertakan data ke-2 dan ke-6.
No. Sampel Xi
Kadar (mg/kg) (Xi – X ) (Xi – X)
2 1. 2. 3. 4. SA 1 SA 3 SA 4 SA 5 150,1 153,8 142,9 139,2 – 3,6 – 7,3 3,6 7,3 12,96 53,29 12,96 53,29 ∑ 586
X = 146,5
132,5
SD =
(
)
1 -n X -Xi 2
∑
=
1 4 5 , 132Pada interval kepercayaan 95% dengan nilai α = 0.05, dk = 3 diperoleh nilai t
tabel = α /2,dk = 3,1824.
Data diterima jika t hitung < t tabel.
t hitung =
n SD X Xi / −
t hitung SA 1 =
4 / 6458 , 6 6 , 3 −
= 1,0834 (Data diterima)
t hitung SA 3 =
4 / 6458 , 6 3 , 7 −
= 2,1969 (Data diterima)
t hitung SA 4 =
4 / 6458 , 6 6 , 3
= 1,0834 (Data diterima)
t hitung SA 5 =
4 / 6458 , 6 3 , 7
= 2,1969 (Data diterima)
Karena t hitung < t tabel, maka semua data tersebut diterima.
Kadar nipagin pada kecap mi instan merk A adalah :
µ = X ± (t (α/2, dk) x SD / √n ) = 146,5 ± (3,1824 x 6,6458 / √4)
[image:63.595.110.377.159.417.2]2. Perhitungan Statistik Kadar Nipagin pada Kecap Mi Instan Merk B
No. Sampel Xi
Kadar (mg/kg) (Xi – X ) (Xi – X)
2 1. 2. 3. 4. 5. 6. SB 1 SB 2 SB 3 SB 4 SB 5 SB 6 161,7 162,7 182,3 183,6 184,2 192,3 16,1 15,1
− 4,5
− 5,8
− 6,4
− 14,5
259,21 228,01 20,25 33,64 40,96 210,25 ∑ 1.066,8
X = 177,8
792,32
SD =
(
)
1 -n X -Xi 2
∑
=
1 6 32 , 792−
= 12,5882 [image:64.595.114.372.537.737.2]
Pada interval kepercayaan 95% dengan nilai α = 0.05, dk = 5 diperoleh nilai t tabel = α /2,dk = 2,5706.
Data diterima jika t hitung < t tabel.
t hitung =
n SD X Xi / −
t hitung SB 1 =
6 / 5882 , 12 1 , 16
= 3,1328 (Data ditolak)
t hitung SB 2 =
6 / 5882 , 12 1 , 15
= 2,9383 (Data ditolak)
t hitung SB 3 =
6 / 5882 , 12 5 , 4 −
t hitung SB 4 = 6 / 5882 , 12 8 , 5 −
= 1,1286 (Data diterima)
t hitung SB 5 =
6 / 5882 , 12 4 , 6 −
= 1,2454 (Data diterima)
t hitung SB 6 =
6 / 5882 , 12 5 , 14 −
= 2,8215 (Data ditolak)
Untuk itu perhitungan diulangi dengan cara yang sama tanpa mengikutsertakan data ke-1, ke-2 dan ke-6.
No. Sampel Xi
Kadar (mg/kg) (Xi −X ) (Xi −X )
2 1. 2. 3. SB 3 SB 4 SB 5 182,3 183,6 184,2 1,1
− 0,2
− 0,8
1,21 0,04 0,64
∑ 550,1
X = 183,4
1,89
SD =
(
)
1 -n X -Xi 2
∑
=
1 3 89 , 1−
= 0,9721
Pada interval kepercayaan 95% dengan nilai α = 0.05, dk = 2 diperoleh nilai t
tabel = α /2,dk = 4,3026.
Data diterima jika t hitung < t tabel.
t hitung =
[image:65.595.113.379.86.224.2]t hitung SB 3 =
3 / 9721 , 0
1 , 1
= 1,9599