SATSUMA (
C. unshiu
Marc.)
ALI HUSNI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa Fusi Protoplas Interspesies Antara Jeruk Siam Simadu (Citrus nobilis Lour.) Dengan Mandarin Satsuma (Citrus unshiu Marc.)
adalah karya saya dengan arahan komisi pembimbing dan belum pernah diajukan dalam
bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka disertasi ini.
Bogor, April 2010
Ali Husni
ALI HUSNI. Interspecies Protoplasts Fusion between Citrus Siam Simadu (Citrus nobilis Lour.) and Citrus Mandarin Satsuma (C. unshiu Marc.). Supervised by AGUS PURWITO, SUDARSONO, and IKA MARISKA.
Somatic hybridization is an important tool for supplying new varieties to be used directly as cultivar genetic improvement programs. In citrus, this technology has been extensively used and has many important implipications. The objectives to the research are produceed citrus somatic hybrids between citrus siam Simadu and Mandarin Satsuma with chemical fusion (PEG). Protoplasts of siam Simadu from calli with Mandarin Satsuma from mesophyll-derived protoplasts were regenerated by somatic embryogenesis. Concentration and duration of incubation in a solution of PEG strongly affected the fusion induction of siam Simadu with Mandarin Satsuma. High concentrations of PEG can increase the frequency of fusion, while the low concentration produces a low frequency of fusion. The result showed that protoplasts from embryogenic callus of Simadu tangerine and in vitro leaf of Mandarin Satsuma can be isolated in large numbers by using a combination of cellulase Onozuka R10, Yakult Yakult% 1% with R10 Maserozim in CPW solution. Protoplasts are purified with a mixture of 25% sucrose with 13% mannitol. Protoplast density produced from embryogenic callus is 15.7x105 protoplasts / g callus and 13x105 protoplasts/ g in vitro leaf. The concentration of PEG used to induce fusion between mesophyll protoplasts Mandarin Satsuma and siam Simadu callus affect the average number of protoplasts fusion. Average number of protoplasts were fused by using PEG 4% are 3.3 hetero fusion, 5.0 homo fusion and multi-fusion. Average number of protoplasts were fused by using PEG 30% are 4.7 hetero fusion, 6.7 homo fusion 6.7 and 7.7multi-fusion. The success of fusan regeneration on regeneration medium is influenced by PEG concentration used for induction of fusion. Protoplasts were fused with PEG only 4%, which can regenerate to form cell walls, making cell division, colony cells, micro-callus and somatic embryo. Protoplasts were fused with PEG 30% can only be regenerated to form the cell wall and cell division. Giving light to the culture after 2 weeks may accelerate cell division that can form colonies of cells. Dilutions of cell suspension with the same medium (without 2, 4-D) can accelerate the growth and development of the protoplasts formed colonies of cells, micro-callus and somatic embryos. MW medium is best used in the fusion because it can encourage of somatic embryos directly. Addition of ABA 0.5 mg / l in the media can produce somatic embryos and GA3 0.5 mg / l can germinate mature somatic embryos to plantlets with 76% germination efficiency. Somatic hybrids were germinated, then trasfered to a medium culture, and finally grafted in greenhouse. The hybrids were confirmed by growth of in vitro culture, morphology, cytology (chromosome number), molecular analysis (ISSR), and contain of chlorophyl
ALI HUSNI. Fusi Protoplas Intersepesies Antara Jeruk Siam Simadu (Citrus nobilis Lour.) dengan Mandarin Satsuma (C. unshiu Marc.). Dibimbing oleh: AGUS PURWITO, SUDARSONO, and IKA MARISKA.
beregenerasi membentuk dinding sel, melakukan pembelahan sel, koloni sel, mikro kalus dan embrio somatik, sedangkan protoplas yang difusikan dengan PEG 30% hanya dapat beregenerasi membentuk dinding sel dan pembelahan sel. Pemberian cahaya pada kultur setelah umur 2 minggu dapat mempercepat pembelahan sel sehingga dapat membentuk koloni-koloni sel. Pengenceran suspensi sel dengan media kultur yang sama (tanpa 2,4-D) dapat mempercepat pertumbuhan dan perkembangan protoplas membentuk koloni sel, mikro kalus dan embrio somatik. Media kultur MW merupakan media yang paling baik digunakan dalam kultur protoplas hasil fusi karena dapat menginduksi terjadinya embriogensis somatik secara langsung. Penambahan ABA 0.5 mg/l dalam media dapat mendewasakan embrio somatik dan GA3 0.5 mg/l dapat mengecambahkan embrio somatik dewasa sehingga diperoleh plantlet. Berdasarkan pertumbuhan hasil keragaan kultur in vitro pada media tumbuh yang selektif (MW+EM 500 mg/l) diperoleh 5 kandidat hibrida somatik dari 19 regeneran yang diuji. Evaluasi lebih lanjut dengan marka molekuler ISSR menggunakan primer ISSR8 diperoleh 4 hibrida somatik dari 5 kandidat yang diuji. Jumlah kromosom dari hibrida somatik yang diperoleh merupakan penjumlahan dari jumlah kromosom kedua tetuanya (36 pasang) kecuali R10 dengan jumlah kromosom 35 pasang. Warna, tulang, dan kandungan kloropil daun dari hibrida somatik merupakan intermediet dari kedua tetuanya.
© Hak cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
SATSUMA (
Marc.)
ALI HUSNI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Progran Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Lour.) dengan Mandarin Satsuma (C. unshiu Marc.)
Nama : Ali Husni
NIM : A161060121
Disetujui
Komisi Pembimbing
Ketua
Dr. Ir. Agus Purwito, M.Sc
Prof. Dr. Ir Sudarsono, M.Sc
Anggota Anggota
Dr. Ir. Ika Mariska, APU
Mengetahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil A Notodiputro, MS
dapat menyelesaikan penulisan disertasin ini yang merupakan salah satu syarat dalam rangka penyelesaian program Doktor (S3) di sekolah Pascasarjana Institut Pertanian Bogor (IPB) dengan judul “Fusi Protoplas Interspesies Antara Jeruk Siam Simadu (Citrus nobilis Lour.) dengan Mandarin Satsuma (C. unshiu Marc.)”.
Sebagian dari disertasi ini telah diterbitkan di Jurnal AGRITEK, Institut Pertanian Malang Vol 17 No.18 tahun 2008 dengan judul ‘Studi Isolasi Protoplas Tanaman Jeruk Siam dan Mandarin Satsuma, Jurnal Agro Biogen (dalam proses) dengan judul “Regenerasi Tanaman Jeruk Siam Melalui Jalur Embriogenesis Somatik”. Pada kesempatan ini penulis menyampaikan terima kasih dan penghargaan kepada Dr. Ir. Agus Purwito, M.Sc, selaku ketua komisi pembimbing dan Prof. Dr. Ir. Sudarsono, M.Sc serta Dr. Ir. Ika Mariska, APU sebagai anggota komisi pembimbing atas bimbingan, saran, dan motivasi mulai dari penulisan usulan penelitian (proposal), pelaksanaan penelitian, dan penulisan disertasi. Ucapan terimakasih dan penghargaan yang mendalam kepada ayah dan ibu tercinta H. Abdul Manan Harahap dan Ibu Hj. Mardiah Aritonang yang senantiasa sabar dalam mendo’akan, mendidik, dan mengarahkan anak-anaknya. Penulis ucapkan terimakasih juga kepada bapak dan ibu mertua H. Kosasih dan Hj Tejaningsih yang telah banyak memberikan semangat dan do’a dalam menyelesaikan disertasi ini. Secara khusus, penulis ucapkan terimakasih kepada istri tercinta dan anak-anakku yang tersayang atas dorongan dan bantuan yang begitu banyak, doa’ yang tulus serta pengertian dan perhatiannya yang begitu dalam yang dapat memberikan dorongan dan semangat dalam menyelesaikan studi dan disertasi ini.
Ucapan terimakasih juga kepada kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan sumberdaya Genetik Pertanian (BB-Biogen) di Bogor dan kepala Badan Penelitian dan Pengembangan Pertanian di Jakarta atas kesempatan yang diberikan kepada penulis untuk dapat melanjutkan pendidikan program Doktor. Terimakasih juga disampaikan kepada dekan sekolah Pascasarjana IPB, ketua program studi Agronomi, dan seluruh staf pengajar di departemen Agronomi IPB. Penulis tidak lupa mengucapkan terimakasih kepada Dr. Ir. Ika Mariska, APU sebagai ketua kelompok peneliti, rekan-rekan peneliti, dan teknisi kelompok peneliti Biologi sel dan Jaringan, BB- Biogen atas bantuan, dorongan dan kerjasamanya. Terimakasih juga disampaikan kepada saudari Chaerani Marta, S.Si, MP, Ir. Karsinah, MP dan saudara Yusuf yang telah banyak memberikan informasi, bantuan penyambungan (grafting) dan pemeliharaan tanaman hasil fusi protoplas di rumah kaca Balai Penelitian Jeruk dan Buah Subtropika di Batu, Malang. Terimakasih juga disampaikan kepada bapak Dr. Trijoko Santoso, M.Si atas bantuannya dalam mengidentifikasi hibrida somatik menggunakan marka molekular ISSR di laboratorium Biologi Molekuler BB-Biogen dan bapak Ujang Havid yang telah banyak membantu penulis dalam pembuatan preparat dan penghitungan jumlah kromosom di laboratorium sitologi Pusat Penelitian Biologi LIPI, Cibinong dan bapak Dr. Sutoro MS atas bantuan alat Chlorophyll Meter yang digunakan dalam penenentuan kandungan klorofil daun.
Penelitian ini didukung oleh dana dari penelitian Riset Insentif dari Kementerian Ristek dan dana penelitian beasiswa Badan Litbang Pertanian. Untuk itu, penulis menyampaikan terimakasih kepada bagian kerjasama Kementerian Riset dan Teknologi serta Kepala Badan Litbang Pertanian atas dana penelitian yang telah diberikan.
bernama H. Abdul Manan Harahap (Alm) dan ibu Hj. Mardiah Aritonang (Almh). Jenjang pendidikan penulis berturut-turut adalah lulusan sekolah dasar di SD Alwasliyah, Padangsidempuan pada tahun 1976, lulusan SMP Negeri V Padangsidempuan pada tahun 1980, lulusan SMA Negeri 32 Jakarta pada tahun 1983. Padatahun 1989 penulis mendapat gelar sarjana (S1) dari Fakultas Biologi Universitas Nasional, Jakarta. Gelar Magister Sains (M.Si) diperoleh pada tahun 2002 dari Program Studi Bioteknologi, Sekolah Pascasarjana, Institut Pertanian Bogor (IPB) dengan beasiswa dari PAATAP. Tahun 2006, penulis mendapat kesempatan untuk melanjutkan pendidikan Program doktor di Program Studi Agronomi di perguruan tinggi yang sama dengan beasiswa dari Badan Litbang Pertanian. Penulis menikah dengan Mia Kosmiatin, Ssi, Msi pada tahun 1995 dengan dikaruniai dua orang putri yang bernama Aphylla Planifolia Harp dan Aulia Floribunda Harp serta seorang putra yang bernama Muhammad Houzni Rafsanzani Harp.
1. Bahan tanaman dan media perlakuan yang digunakan pada setiap
tahapan percobaan dalam penelitian ……….. 29
2. Keberhasilan mendapatkan nuselus yang aseptik dari biji muda jeruk
siam Simadu dan Pontianak dalam media perlakuan ... 31
3. Respon nuselus jeruk siamSimadu dan Pontianak pada media
perlakuan terhadap persentase pembentukan kalus ……….... 32
4. Tipe kalus dan banyaknya jumlah pem yang dihasilkan dari setiap media perlakuan dari masing – masing jeruk siam setelah kultur
berumur 8 minggu ... 34
5. Persentase keberhasilan mendapatkan nuselus dan embrio yang
aseptik serta induksi kalus pada minggu ke- 4 dan ke- 8 ... 35
6. Tipe kalus dan banyaknya jumlah struktur pem dan globular yang
dihasilkan dari eksplan nuselus dan embrio, 8 minggu setelah kultur ... 36
7. Pengaruh penambahan ABA dalam proses pendewasaan struktur
globular embrio somatik, 4 minggu setelah kultur ... 39
8. Pengaruh penambahan GA dalam proses pengecambahan embrio
somatik menjadi plantlet benih somatik), 4 minggu setelah kultur ... 40
9. Kombinasi larutan enzim yang digunakan untuk isolasi protoplas
kalus embriogenik, daun in vitro dan suspensi sel ... 50
10. Keberhasilan biji berkecambah, tinggi tunas dan jumlah daun pada jeruk siam madu, Pontianak dan Mandarin Satsuma 4 minggu dalam
media MW+0.5 mg/l GA3 ... 53
11. Persentase keberhasilan induksi kalus dari nuselus dan embrio jeruk
siam simadu dan Pontianak, 2 bulan setelah kultur ………... 54
12. Produksi protoplas daun mesofil yang dihasilkan dari dua kombinasienzim yang berbeda setelah inkubasi 16 jam setelah
dimurnikan dengan campuran 25% sukrosa dalam larutan CPW.. ... 56
13. Produksi protoplas mesofil daun yang dihasilkan dari dua kombinasi enzim yang berbeda setelah inkubasi 16 jam setelah dimurnikan
dengan campuran 25% sukrosa + 13% manitol dalam larutan CPW ... 57
kombinasi enzim 1 setelah inkubasi 16 jam dan dimurnikan dengan
campuran 25% sukrosa + 13% manitol dalam larutan CPW …………. 61
16. Rata-rata jumlah protoplas yang dihasilkan dari mesofil daun dan kalus embriogenik yang diisolasi dengen enzim selulase 1% +
maserozim 1% yang diinkubasi selama 16 jam ……… 75
17. Produksi protoplas dari kalus dan mesofil daun menggunakan kombinasi enzim Selualse 1%+ Maserozim 1% yang diinkubasi selama 16 jam dan murnikan dengan campuran 25% sukrosa+13%
manitol dalam larutan CPW ………... 98
18. Pengaruh konsentrasi PEG (4 dan 30%) terhadap keberhasilan fusi (hetero fusi, homo fusi dan multi fusi) protoplas jeruk siam simadu
dengan Mandarin Satsuma, inkubasi 15 menit ………... 104
19. Pengaruh media kultur terhadap persentase kemampuan protoplas membentuk dinding dan pembelahan sel yang diinduksi fusi dengan
PEG 4 dan 30%, 2 minggu setelah kultur ... 107
20. Pengaruh media kultur terhadap persentase kemampuan protoplas melakukan pembelahan dan jumlah koloni sel setelah pemberian
cahaya, 2 minggu setelah kultur ………. 109
21. Pengaruh media kultur terhadap kemampuan koloni sel membentuk
mikrokalus , 1, 2, dan 3 minggu setelah pengenceran ……….. 111
22. Pengaruh media kultur terhadap kemampuan koloni sel membentuk
mikro kalus dan embrio somatik, 4 minggu setelah pengenceran ….... 113
23. Pendewasaan embrio somatik fase globular menjadi fase torpedo dan hati dalam media MW + 1.5 mg/l ABA + 500 mg/l EM umur 2 dan 4
minggu ……….... 129
24. Banyaknya jumlah kromosom dari f hibrida somatik yang dihasilkan
dan kedua tetuanya (Mandarin Satsuma dan siam Simadu) …………... 132 25. Morfologi batang hibrida somatik pada umur 5 bulan setelah
penyambungan .……….. 133
26. Morfologi daun hibrida somatik pada umur 5 bulan setelah
1. Diagram dan alur strategi penelitian serta keterkaitan antar percobaan
dari seluruh kegiatan penelitian ... 9
2. Kenampakan kalus embriogeneik yang dihasilkan (A= kalus dalam botol kultur , B= kalus yang diamati secara mikroskopik, pem= pre embrio dan
glob=globular) ……... 33
3. Penampakan gambar kalus yang berasal dari nuselus (A) dan embrio (B), penampakan mikroskopik kalus dari nuselus (C) dan kalus dari embrio
(D) ... 37
4. Tahapan proses pendewasaan embrio somatik dari jeruk siam (A=struktur globular, B=struktur hati, C=struktur torpedo dan D=
struktur kotiledon) ... 38
5. Tahapan pertumbuhan dan perkembangan dari embrio somatic dewasa menjadi plantlet pada jeruk siam (A=fase kotiledon, B=pembukan
kotiledon, C=Perkecambahan dan D=plantlet) ... 40
6. Penampakan kecambah biji jeruk siam dan mandarin dalam media MW+1mg/l GA3(A = siam simadu, B = siam pontianak dan C =
mandarin satsuma) ... 53
7. Penampakan kalus embriogenik dari eksplan nuselus (A dan C) dan
eksplan embrio (B dan D) ………... 54
8. Isolasi protoplas jeruk siam simadu, pontianak dan Mandarin Satsuma dari mesofil daun dengan pemurnian larutan sukrosa 25% + manitol 13% dalam larutan enzim 1(SM=siam simadu, SP=siam Pontianak, A=Protoplas siam simadu, B=protoplas siam Pontianak dan C=protoplas
Mandarin Satsuma) perbesaran 10x ...
58
9. Penampakan struktur kalus yang berasal dari nusellus (A) dan embrio (B)
serta pada saat inkubasi dalam larutan enzim (C dan D)... 60
10. Penampakan protoplas sebelum dan sesudah pemurnian dengan larutan sukrosa 25% + manitol 13% (A dan C=protoplas siam Simadu sebelum (10X) dan sesudah pemurnian (20X), B dan D=protoplas siam
Pontianak sebelum (10X) dan sesudah pemurnian (20X) ………... 62
11. Perbedaan warna protoplas yang diisolasi dari kalus dan mesofil daun (A dan C=isolasi protoplas dari kalus, B dan D=isolasi protoplas dari
mesofil daun) ………... 62
13. Tipe fusi (hetero, homo, dan multi fusi) dan rata-rata jumlah protoplas berfusi yang dihasilkan setelah perlakuan PEG 30% inkubasi 5, 10, dan
15 menit... 78 14. Penampakan miroskopik hasil fusi protoplas dengan perlakuan PEG 30%
perbesaran 20x.(A=hetero fusi, B=homo fusi dan C=multi fusi) ………. . 80
15. Perbandingan rata-rata jumlah protoplas berfusi sebelum dan sesudah penambahan larutan 200 µ l ke dalam suspensi protoplas yang telah difusi
dengan PEG 30% ... 81 16. Tipe fusi (hetero, homo, dan multi fusi) dan rata-rata jumlah protoplas
berfusi yang dihasilkan setelah perlakuan PEG 4% inkubasi 5, 10, dan 15
menit... 82
17. Induksi fusi antara protoplas yang diisolasi dari mesofil daun dan kalus untuk mendeteksi fusi hetero karion dengan PEG 4% (perbesaran 20x)
(A=heterofusi, B=homo fusi dan C=multi fusi) ... 83
18. Perbandingan rata-rata jumlah protoplas berfusi sebelum dan sesudah penambahan larutan 200 µ l ke dalam suspensi protoplas yang telah difusi
dengan PEG 4% ... 83
19. Penampakan kalus embriogenik daun in vitro yang digunakan sebagai sumber protoplas (A= kalus embriogenik dari jeruk siam Simadu dan, B=
daun in vitro dari jeruk Mandarin
Satsuma)...
92
20. Isolasi protoplas mesofil daun Mandarin Satsuma dan kalus jeruk siam Simadu dengan kombinasi enzim selulase 1%+maserozim 1% yang dimurnikan dengan larutan sukrosa 25% + manitol 13% (A dan C= mesofil daun dan protoplas yang dihasilkan, B dan D=kalus embriogenik dan protoplas yang dihasilkan) perbesaran 20x ...
99
21. Pengaruh konsentrasi PEG (4% dan 30%) terhadap keberhasilan fusi (hetro, homo, dan multi fusi) protoplas jeruk siam Simadu dengan
Mandarin Satsuma, inkubasi 15 menit... 100
22. Peningkatan jumlah protoplas berfusi setelah penambahan larutan pencuci ke dalam suspensi protoplas yang telah difusi selama 15 menit
dengan PEG 4% dan 30%... 101
23. Penampakan keadaan suspensi protoplas pada saat penambahan PEG (A) dan jenis fusi yang dihasilkan dari protoplas yang diinduksi dengan PEG selama 15 menit (B =hetero fusi, C=homo fusi, D=multi fusi, dan E=
pembelahan) ………... 106
25. Pertumbuhan dan perkembangan protoplas membentuk koloni sel setelah pemberian cahaya pada umur dua minggu setelah kultur
(A=penampakan kultur mata, B, C dan D = koloni sel) …………... 107
26. Penampakan kasat mata dan mikroskopik mikrokalus yang terbentuk pada media kultur KM8P, VKM, MT dan MW 4 minggu setelah pengenceran (A dan E=mikro kalus pada media KM8P, B dan F=mikro kalus pada media VMW, C dan G=mikro kalus pada media MT serta D
dan H=mikro kalus pada media MW) ... 110
27. Proses embriogenesis somatik langsung dari tahap sel tunggal embryoid hasil fusi antara jeruk siam Simadu dengan Mandarin Satsuma sampai menjadi plantlet pada media MW (. A dan B= Sel embryoid yang aktif membelah, C dan D= Pre-embrio (pem), E = Fase globuler, F = tahap
torpedo dan H= Fase hati) ………... 112
28. Proses pendewasaan dalam media MW+1.5 mg/l ABA dan
perkecambahan embrio somatik dalam media MW + 1.5 mg/l GA3menjadi plantlet (A= embrio somatik langsung dari hasil fusi, B dan C= pembentukan kalus embriogenik embrio somatik sekunder pada media pendewasaan, D dan E= perkecambahan embrio somatik pada media perkecambahan dan F= plantlet dalam
medsiaMW)……….. 114
29. Keragaan pertumbuhan in vitro regeneran hasil fusi protoplas dan kedua
tetuanya (Mandarin Satsuma dan siam Simadu) ... 130
30. Penggunaan primer ISSR8 (5’AGAGAGAGAGAGAGAGYC3’) dapat
membedakan hibrida somatik (R6, R7, R10 dan R19) dengan kedua tetuanya (Sm=siam Simadu dan St= Mandarin Satsuma) …...
131
31. Perbandingan jumlah kromosom antara putatif hibrida somatik yang dihasilkan dengan kedua tetuanya (A= siam Simadu, B= Mandarin
Satsuma, C= R6, D= R17, E= R10 dan F= R19) ... 132
22. Keragaan hibrida somatik di rumahkaca (A dan B= penyambungan dengan batang bawah JC, B= tanaman hasil penyambungan dan C=
1. Lampiran 1. Komposisi media dasar kultur, vitamin, dan komposisi
lainnya MS, MW, MT, KM, dan VKM... 152
2. Lampiran 2. Komposisi larutan CPW... 153
BAB I
PENDAHULUAN UMUM
Latar Belakang
Trend kebutuhan pasar dunia akan buah jeruk segar saat ini adalah mempunyai kategori buah yang tidak berbiji (seedless), mudah dikupas (easy peeling) dan mempunyai tipe Mandarin dengan warna yang menarik (pigmented), kandungan gula tinggi, dan ukurannya besar (Spiegel-Roy dan Goldschmidt 1996;
Khan 2008; Nicotra 2007). Menurut Sudarwo (2003), kualitas produk yang
dihasilkan mampu bersaing di pasaran global sangat tergantung kepada
kemampuan menumbuhkan keunggulan biaya (harga) dan keunggulan diferensiasi
yang sangat mempengaruhi seperti;1)kemampuan meningkatkan produksi,
2)kemampuan menghasilkan inovasi teknologi, dan 3)efisiensi rantai produksi.
Jeruk siam (Citrus nobilis) varietas Pontianak dan Simadu (Medan) adalah dua dari jenis jeruk lokal komersial (Scion) yang ada di Indonesia. Kedua jenis jeruk ini termasuk dalam true species dari genus Citrus dengan jumlah genom 2n=2x=18. Jeruk Siam sangat mendominasi pertanaman jeruk di
Indonesia, yaitu mencapai 80% dari total pertanaman jeruk di Indonesia (Penebar
Swadaya 2004 dan Kuntarsih 2007). Pada tahun 2006 areal pertanaman jeruk di
Indonesia mencapai 72.390 ha dengan rata-rata produktivitas sebesar 35.44
ton/ha. Produksi nasional jeruk pada tahun yang sama adalah sebesar 2.565.543
ton (Deptan 2007).
Jeruk Siam atau dalam perdagangan internasional disebut jeruk Tanggerin
mempunyai ciri khas kulit tipis, rasanya manis, warna buah kuning – orange dan
hampir mendekati kategori tipe jeruk yang sesuai dengan kebutuhan pasar dunia
untuk dikonsumsi dalam keadaan segar. Namun demikian, kedua jenis jeruk
tersebut masih mempunyai biji yang relatif banyak (15-21biji per buah) dan warna
belum begitu menarik sehingga kalah bersaing dengan jeruk produk negara lain.
Hal ini terbukti dengan maraknya buah impor jeruk di pasar lokal mulai dari kaki
lima, toko dan supermarket yang menekan produk jeruk lokal sehingga menjadi
terpuruk yang mengakibatkan kerugian bagi petani jeruk. Untuk menghindari
untuk meningkatkan kualitas buah sehingga dapat diterima dan bersaing di pasar
gelobal. Salah satu cara yang dapat dilakukan secara efisien dan efektif adalah
merakit tanaman jeruk siam baru dengan sifat seedless dan pigmented sehingga dihasilkan jeruk yang tidak berbiji dan mempunyai warna yang menarik dan tetap
disukai.
Untuk mendapatkan buah jeruk lokal yang dikonsumsi dalam keadaan
segar dan sesuai dengan tuntutan pasar global (sifat seedless, pigmented, easy peeleng, dan rasanya manis) dapat dilakukan dengan cara meningkatkan keragaman genetik tanaman jeruk, khususnya jeruk siam. Untuk mendapatkan
jenis jeruk yang diinginkan dapat diperoleh dengan cepat, maka diperlukan
keragaman genetik jeruk siam yang tinggi. Keragaman genetik yang tinggi dapat
dilakukan dengan cara persilangan, induksi mutasi, keragaman somaklonal, fusi
protoplas, dan rekayasa genetika (Spiegel-Roy dan Goldschmidt 1996).
Keragaman genetik yang tinggi dapat terjadi secara alami ataupun buatan.
Keragaman genetik yang muncul sudah terbukti mempunyai peranan penting di
dalam peningkatan kualitas genetik tanaman. Perubahan genetik pada tingkat
ploidi mempunyai potensi yang besar untuk mendapatkan perubahan fenotipe dan
genotipe tanaman (Raza et al. 2003). Perubahan jumlah kromosom pada satu sel dapat disebabkan oleh beberapa perlakuan seperti perlakuan suhu rendah atau
tinggi atau dapat disebabkan pemberian auksin (2,4-D, D-camba, dan IAA)
konsentrasi tinggi dengan periode kultur yang lama (Harman dan Kester 1959),
kultur endosperm (Gmitter et al. 1990), hibridisasi somatik (Oiyama et al. 1981), dan induksi mutasi dengan sinar gamma (Jaskhani 1998).
Untuk meningkatkan keragaman genetik yang tinggi pada jeruk siam dapat
dilakukan dengan cara mengintrogresikan sifat seedless dan pigmented dari spesies jeruk lain seperti mandarin Satsuma. Jeruk mandarin Satsuma (C. unshiu
Marc.) merupakan jenis jeruk introduksi yang secara alami mempunyai sifat
seedless dengan jumlah genom 2n=2x=18 (Kunitake et al. 1991; Spiegel-Roy dan Goldschmidt 1996). Yamamoto et al. (1997) telah membuktikan melalui persilangan seksual dan silang balik bahwa pollen jeruk mandarin Satsuma
adalah steril (MS) yang dikendalikan oleh gen yang ada di sitoplasmik yang
mandarin Satsuma ke kultivar jeruk lainnya seperti siam Simadu sangat sulit
dilakukan melalui pemuliaan konvensional yang disebabkan oleh adanya faktor
inkopatibilitas, nusellus ployembrioni, dan masa juvenil yang lama. Oleh karena
itu perlu dicari cara lain untuk menggabungkan sifat seedless dari jeruk mandarin Satsuma dengan kultivar jeruk lainnya sehingga diperoleh jenis jeruk baru yang
yang tidak berbiji.
Salah satu cara yang dapat digunakan secara efisien dan efektif adalah
melalui hibridisasi somatik dengan teknik fusi protoplas. Melalui fusi protoplas
dapat diperoleh kombinasi genetik dari dua tetua yang tidak kompatibel, bahkan
dapat diperoleh rekombinasi genetik yang ada disitoplasma sehingga sifat CMS
yang dikontrol oleh gen yang ada disitoplasma (mtDNA dan cpDNA) dapat
diperoleh. Cai et al. (2007) melaporkan hasil fusi protoplas antara C. unshiu
dengan kultivar jeruk tradisional China yang mempunyai biji yang banyak C. sinensis (orange) kultivar Bingtang menghasilkan buah yang laku di pasaran, rasanya enak,dan mempunyai biji yang sedikit antara 6-10 biji/buah.
Tujuan Penelitian
1. Mendapatkan komposisi media kultur dan jenis eksplan yang dapat
menghasilkan kalus embriogenik.
2. Mendapatkan metoda isolasi protoplas dari mesofil daun dan kalus
embriogenik.
3. Mendapatkan metode fusi protoplas dan konsentrasi PEG yang dapat
menginduksi terjadinya fusi.
4. Mendapatkan metoda regenerasi protoplas hasil fusi antara jeruk siam Simadu
dengan mandarin Satsuma.
5. Mendapatka hibrida somatik antara jeruk siam Simadu dengan mandarin
Satsuma.
Hipotesis
1. Komposisi media dan jenis eksplan berpengaruh terhadap kemampuan
membentuk kalus embriogenik yang dapat diregenerasi melalui jalur
2. Jenis dan konsentrasi enzim sangat berpengaruh terhadap kemampuan
mengisolasi protoplas.
3. Komposisi media, kondisi fisik dan cara kultur berpengaruh terhadap
kemampuan protoplas beregenerasi membentuk dinding sel, pembelahan
sel, pembentukan mikro kalus, embrio somatik, dan plantlet.
4. Hibrida somatik dapat diperoleh dari fusi protoplas antara jeruk siam
Simadu dengan mandarin Satsuma .
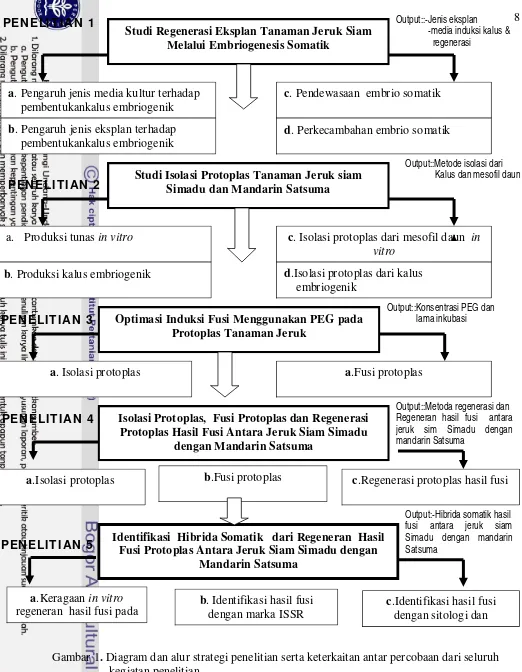
Strategi dan Alur Penelitian
Agar tujuan penelitian tersebut di atas dapat tercapai maka strategi
penelitian yang dilakukan harus mempunyai keterkaitan antara penelitian yang
satu dengan penelitian lainnya. Pada tahap awal penelitian dilakukan studi
regenerasi tanaman jeruk siam melalui jalur embriogenesis somatik untuk
mendapatkan komposisi media dan jenis eksplan yang baik digunakan untuk
regenerasi tanaman jeruk melalui jalur embrio genesis somatik (Penelitian 1). Pada penelitian ini dilakukan pencarian komposisi media dan jenis ekspklan yang
baik untuk menghasilkan kalus embriogenik serta regenerasinya melalui jalur
embriogenesis somatik. Diperolehnya metode regenerasi tanaman jeruk siam
melalui jalur embriogenesis somatik sangat penting karena akan menjadi acuan
pada penelitian regenerasi protoplas hasil fusi protoplas.
Sumber protoplas, komposisi enzim dan media pemurnian protoplas
merupakan faktor yang sangat berpengaruh terhadap keberhasilan mendapatkan
protoplas yang viabel dengan densitas yang tinggi. Berbagai hasil penelitian
melaporkan bahwa densitas protoplas yang dihasilkan pada saat isolasi protoplas
harus dapat mencapai kerapatan 105-106 protoplas/ml sehingga bisa dilanjutkan ke
tahap fusi protoplas. Pada tahap ini dilakukan penelitian studi isolasi protoplas
tanaman jeruk siam dan mandarin Satsuma untuk mendapatkan komposisi enzim
yang tepat untuk isolasi protoplas dari kalus embriogenik dan mesofil daun serta
larutan pemurnian protoplas sehingga diperoleh protoplas yang viabel dengan
densitas yang tinggi (Penelitian 2). Pada penelitian ini dilakukan pencarian komposisi enzim yang dapat mengisolasi protoplas dari kalus embriogenik dan
mengapungkan protoplas sehingga protoplas yang diperoleh terbebas dari debris
(protoplas murni). Perbedaan jaringan yang digunakan sebagai sumber protoplas
adalah untuk mempermudah pengamatan pada saat fusi protoplas. Protoplas yang
berasal dari mesofil daun akan mempunyai warna yang berbeda dengan protoplas
yang berasal dari kalus sehingga dapat diketahui jumlah hetero fusi.
Diperolehnya metode isolasi protoplas dari kalus embriogenik dan mesofil daun
merupakan syarat awal pada fusi protoplas karena densitas dan viabilitas protoplas
sangat menentukan dalam keberhasilan fusi protoplas.
Konsentrasi polyetilenlikol (PEG) dan lama inkubasi dalam larutan PEG
merupakan faktor yang sangat menentukan untuk mendapatkan protoplas yang
berfusi. Pada tahap ini dilakukan optimasi induksi fusi menggunakan larutan PEG
pada protoplas tanaman jeruk untuk mendapatkan konsentasi PEG dan lama
inkubasi yang optimal untuk menginduksi terjadinya fusi protoplas sehingga
diperoleh protoplas fusan (Penelitian 3). Pada penelitian ini dilakukan fusi protoplas menggunakan PEG konsentrasi rendah (4%) dan konsentrasi tinggi
(30%) dengan waktu inkubasi 5-15. Perbedaan konsentrasi PEG dan lama
inkubasi yang digunakan dalam induksi fusi dapat menentukan keberhasilan
regenerasi protoplas setelah perlakuan fusi.
Untuk mendapatkan regeneran hasil fusi protoplas antara jeruk siam
Simadu dengan mandarin Satsuma dilakukan isolasi protoplas dari kalus jeruk
siam Simadu dan mesofil daun in vitro mandarin Satsuma, fusi protoplas dengan PEG 4% dan 30% selama 15 menit dan regenerasi protoplas hasil fusi (Penelitian 4). Regenerasi protoplas hasil fusi sampai terbentuk tanaman dilakukan dengan beberapa tahap. Pada tahap awal regenerasi, kultur disimpan dalam keadaan gelap
selama dua minggu untuk regenerasi dinding sel. Setelah terbentuk dinding sel,
kultur diberi cahaya dengan intensitas cahaya 1000 lux selama 16 jam untuk
mendorong pembelahan sel sehingga terbentuk koloni sel dan embrio somatik
dengan struktur globuler. Untuk mendorong pertumbuhan dan perkembangan
koloni sel dan embrio somatik fase globuler dilakukan pengenceran dengan
media baru sehingga terbentuk mikro kalus dan embrio somatik fase torpedo dan
hati. Embrio somatik dipindahkan ke media padat (MW) untuk mendorong
asam absisik (ABA) dan menambahkan asam giberelin (GA3) untuk
berkecambahan sehingga diperoleh tanaman lengkap (plantlet).
Untuk mendapatkan hibrida somatik dari jeruk siam Simadu dengan
mandarin Satsuma secara dini dilakukan identifikasi secara in vitro pada media selektif (MW), secara molekuler dengan marka ISSR, sitologi dengan
menghitung jumlah kromosom dan kandungan klorofil, morfologi dan warna daun
serta tinggi tanaman (Penelitian 5). Untuk mempermudah pemahaman terhadap strategi penelitian yang dilakukan maka dibuat diagram alur penelitian yang
lengkap dan terperinci (Gambar 1).
Daftar Pustaka
Cai X, Fu J, Deng XX, and Guo WW. 2007. Production and molecular characterization of potential seedless cybrid plants between pollen steril Satsuma mandarin and two seedy Citrus cultivars. Plant Cell Tiss Organ Cult. 90:275-283.
Departemen Pertanian. 2007. Statistik Produksi HortiKultura Tahun 2006. Dirjen Hortikultura. Jakarta
Gmitter FG Jr, Deng XX, Hearn CJ. 1990. Induction of triploid Citrus plants from endosperm calli in vitro. Theor. Appl. Genet.80:785-790.
Hartman HT and Kester DE. 1959. Plant Propagation: Principles and Practices. P. 167. Princeton Hall Inc. NJ. USA.
Jaskani MJ.1998. Interploid hiybridization and regeneration of kinnow mandarin. A Thesis submitted in partial fulfiment of the requirements for the degree of Doctor of Philosophy in Horticulture Faculty of Agriculture University of Agriculture Faisal Abad, Pakistan.p.169.
Khan SRA. 2008. Citrus quality too meet global demand (Agri Overview). Website:http:www.Pakissan.Com. Diakses tanggal 7 Agustus 2008.
Kuntarsih S. 2007. Pengelolaan rantai pasok dengan bisnis jeruk (kasus jeruk siam Pontianak Kabupaten Sambas). Makalah dalam seminar Nasional jeruk. Yogyakarta, 13-14 Juni 2007.
Kunitake H, Kagami H, Mii M. 1991. Somatic embrtogenesis and plant regeneration from protoplasts of Stsuma?mandarin (Citrus unshiu Marc.) Scientia Horticilturae, 47:27-33.
Nicotra A. 2007.Mandarin-like hybrids of recent interest for fresh consumption. Problems and ways of control. Instituto Sperimentale per la Frutticoltura Rme-Italy. 13p.
Oiyama I, Kobayashi S, Yoshinaga K, Ohgawara T, and Ishii S, 1981. Use of pollen from a somatic hybrid between Citrus and Poncirus in the production of triploids. Hort.Sci., 26:1082-1087.
Spiegel-Roy P and Goldschmidt EE. 1996. Biology Of Citrus. Cambridge University Press. 221 p.
Sudarwo I. 2003. Peran teknologi dalam pengembangan buah tropika. Kerjasama Kementerian Ristek dengan PKBT-IPB. Bogor, 8-9 Mei.
Gambar 1. Diagram dan alur strategi penelitian serta keterkaitan antar percobaan dari seluruh Fusi Protoplas Antara Jeruk Siam Simadu dengan
Mandarin Satsuma
Output:-Hibrida somatik hasil fusi antara jeruk siam Simadu dengan mandarin Satsuma
PEN ELI T I AN 2 Studi Isolasi Protoplas Tanaman Jeruk siam Simadu dan Mandarin Satsuma
Optimasi Induksi Fusi Menggunakan PEG pada Protoplas Tanaman Jeruk
PEN ELI T I AN 3
PEN ELI T I AN 4 Isolasi Protoplas, Fusi Protoplas dan Regenerasi Protoplas Hasil Fusi Antara Jeruk Siam Simadu
dengan Mandarin Satsuma a. Pengaruh jenis media kultur terhadap
pembentukankalus embriogenik
c. Pendewasaan embrio somatik
b. Pengaruh jenis eksplan terhadap pembentukankalus embriogenik
d. Perkecambahan embrio somatik
a. Produksi tunas in vitro c. Isolasi protoplas dari mesofil daun in
vitro
b. Produksi kalus embriogenik d.Isolasi protoplas dari kalus
embriogenik
a.Isolasi protoplas c.Regenerasi protoplas hasil fusi
a.Fusi protoplas
b.Fusi protoplas
a.Keragaan in vitro
regeneran hasil fusi pada c.Identifikasi hasil fusi dengan sitologi dan
b. Identifikasi hasil fusi dengan marka ISSR
a. Isolasi protoplas
Output::Konsentrasi PEG dan lama inkubasi
BAB II
TINJAUAN PUSTAKA
Tanaman Jeruk
Jeruk (Citrus sp) adalah tanaman buah tahunan yang berasal dari Asia. Spiegel-Roy and Goldschmidt (1996) mengatakan bahwa China di percaya sebagai
tempat pertama kali jeruk tumbuh. Balai Pelitian Tanaman Jeruk dan Buah
Subtropika (Balitjestro), Badan litbang Pertanian di Malang telah mengumpulkan
lebih kurang 160 jenis jeruk yang dieksplorasi mulai dari Sabang sampai Merauke
serta beberapa jenis jeruk import. Beberapa jenis jeruk diantaranya adalah jeruk
keprok Tejakula, Sipirok, Kacang, Siam Banjar, Siompu, Simadu, Bali Merah, Crifta
01, Jemari Taji, Pamelo Ratu, Raja, Magetan, Sri Nyonya, Nambangan, jeruk manis
Pacitan dan lain-lainnya dan dapat tumbuh dan berproduksi di Indonesia mulai dari
dataran rendah sampai dataran tinggi, baik dilahan sawah maupun tegalan. Dari
semua jenis jeruk tersebut, jeruk siam, jeruk baby, jeruk keprok, jeruk Bali, jeruk
nipis dan jeruk purut merupakan jenis jeruk lokal paling banyak dibudidayakan di
Indonesia. Sedangkan jeruk yang diintroduksi paling banyak adalah jenis Lemon dan
Grapefruit. Sekitar 70-80% pertanaman jeruk di Indonesia adalah jeruk siam,
sedangkan jenis jeruk lainnya adalah jeruk keprok, dan pamelo (Badan Litbang
Pertanian 2005).
Jeruk, merupakan tanaman buah kedua terbesar produksinya di Indonesia,
yaitu sekitar 2.479.852 ton dengan sumbangan sebesar 15.34% terhadap produksi
buah nasional. Produksi dan luas panen jeruk Indonesia terus meningkat dari tahun
ketahun. Luas pertanaman jeruk di Indonesia pada tahun 2005 lebih dari 120.000 ha
dengan luas panen 67.883 ha dengan jumlah produksi mencapai 2.214.020 ton.
Pada tahun 2006 luas panen jeruk meningkat menjadi 72.390 ha dengan jumlah
produksi mencapai 2.565.543 ton (Deptan 2007). Saat ini Indonesia termasuk negara
pengimpor jeruk terbesar kedua di ASEAN setelah Malaysia, dengan volume impor
Malaysia, Brunei Darussalam, dan Timur Tengah. Ekspor jeruk nasional masih
sangat kecil dibanding dengan negara produsen jeruk lainnya seperti Spanyol, Afrika
Selatan, China, Yunani, Maroko, Pakistan, Belanda, Turki dan Mesir. Oleh karena
itu, pemacuan produksi jeruk nasional akan memiliki urgensi penting karena
disamping untuk meningkatkan pendapatan masyarakat, kesempatan kerja, konsumsi
buah dan juga meningkatkan devisa ekspor nasional (Badan Litbang Pertanian 2005).
Pertanaman jeruk di Indonesia didominasi oleh jeruk siam dan keporok
dengan produksi sebanyak 2.15 juta ton dan jeruk pamelo sebanyak 64 ribu ton. Luas
panen jeruk pada tahun yang sama adalah seluas 68 ribu ha yang terdiri dari 63 ribu
ha jeruk siam dan keprok serta 5.300 ha dari jeruk pamelo (Hutabarat dan Setyanto
2007). Jeruk ekspor Indonesia (termasuk mandarin) ditujukan pada pasar di wilayah
Asia, seperti Timor Leste, Malaysia, India, Hongkong, Iran, Singapura dan
Afganistan, sementara Indonesia mengimpor jeruk (termasuk Mandarin) dari 29
negara di dunia, terutama China, Pakistan dan Australia (Hutabarat dan Setyanto
2007).
Hambatan pengembangan jeruk di Indonesia antara lain: (1) Desakan
kebijakan perdagangan multilateral dan diberbagai negara, (2) Desakan terhadap
kebijakan perdagangan nasional, (3) Marjin keuntungan produsen rendah, (4) Ongkos
produksi rendah, keberlanjutan usaha tidak pasti, dan (5) Biaya transaksi dan
pemasaran tinggi.
Jeruk siam (Citrus nobilis Lour.)
Jeruk siam merupakan anggota jeruk keprok dengan nama ilmiah Citrus nobilis . Dinamakan jeruk siam karena berasal dari Siam (Thailand). Di negara asalnya, jeruk ini dikenal dengan nama som kin wan. Sampai saat ini sebenarnya belum ada data resmi tentang kapan dan dimana tepatnya jeruk siam pertama kali
didatangkan ke Indonesia. Meskipun demikian, ada daerah yang mempunyai catatan
yang cukup tentang kisah awal masuknya jeruk siam di wilayahnya, seperti
Jeruk siam hanya merupakan bagian kecil dari sekian banyak spesies dan
varietas jeruk yang sudah dikenal dan dibudidayakan. Para ahli Botani
mengelompokkan semua anggota famili Rutaceae ke dalam 7 subfamili dan 130
genus. Sedangkan yang menjadi induk tanaman jeruk adalah subfamili Aurantioidae
yang beranggotakan sekitar 33 genus. Subfamili ini masih dibagi lagi dalam beberapa
kelompok tribe dan subtribe. Jeruk tergolong dalam rumpun Citriae dan subtribe
Citrinae. Dari subtribe inilah berbagai jenis anggota tanaman jeruk berasal, termasuk
didalamnya jeruk siam.
Klasifikasi botani tanaman jeruk adalah sebagai berikut:
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Rutales
Famili : Rutaceae
Subfamili : Aurantioidae
Genus : Citrus
Spesies : Citrus nobilis Lour
Pada umumnya batang pohon jeruk siam yang dibudidayakan secara
komersial mempunyai tinggi antara 2.5-3.0 m. Pohon tersebut biasanya berasal dari
perbanyakan vegetatif (cangkokan atau okulasi). Untuk pohon yang berasal dari
okulasi, tingginya ditentukan oleh jenis batang bawah yang digunakan. Jeruk siam
yang menggunakan batang bawah JC (Japanese citroen) biasanya memiliki tinggi sekitar 272.5 cm, lingkaran batang 16.8 cm, dan lebar tajuk sekitar 197.5 cm.
Sedangkan tanaman jeruk siam yang menggunakan RL (Rough lemon) biasanya memiliki tinggi sekitar 267.5 cm, lingkar batang 31.9 cm, dan lebar tajuk 217.5 cm.
Kebanyakan varietas jeruk siam memiliki bentuk dan ukuran daun yang bisa
di bedakan dari jenis jeruk lainnya. Bentuk daunnya oval dan berukuran sedikit lebih
besar dari jeruk keprok Garut. Ukuran daunnya sekitar 7.5 cm x 3.9 cm dan memiliki
sayap daun kecil yang berukuran 0.8 x 0.2 cm. Ujung daunnya agak terbelah,
tepi daun. Antara batang dengan daun dihubungkan oleh tangkai daun dengan
panjang sekitar 1.3 cm. Tanaman jeruk siam biasanya berbunga sekitar bulan
September – Nopember. Bentuk dan warna bunganya cukup menarik. Ukuran bunga
kecil dan mungil dengan warna putih segar seperti bunga melati. Bentuk buahnya
bulat dengan ukuran idealnya sekitar 5.5 cm x 5.9 cm.
Jeruk siam memiliki ciri khas yang tidak dimiliki jeruk keprok lainnya karena
mempunyai kulit yang tipis sekitar 2 mm, permukaannya halus dan licin, mengkilap
serta kulit menempel lebih lekat dengan dagingnya. Dasar buahnya berleher pendek
dengan puncak berlekuk. Tangkai buahnya pendek, dengan panjang sekitar 3 cm dan
berdiameter 2.6 mm. Biji buahnya berbentuk ovoid, warnanya putih kekuningan
dengan ukuran sekitar 20 biji. Daging buahnya lunak dengan rasa manis dan harum.
Produksi buah cukup berat dengan bobot berat perbuah sekitar 75.6 g. Satu pohon
rata-rata menghasilkan sekitar 7.3 kg buah. Panen biasanya dapat dilakukan pada
bulan Mei – Agustus (Deptan 1994).
Pada dasarnya jeruk siam mepunyai satu nenek moyang yang berasal dari
Siam (Muangthai). Orang Siam menyebut jenis jeruk ini dengan nama som kin wan. Mungkin karena lidah orang Indonesia sulit untuk menyebutkan nama tersebut
sehingga terbiasa menyebutnya dengan nama Siam. Kelatahan ini terus berlanjut
sampai sekarang. Jeruk siam di Indonesia mempunyai banyak jenis tergantung dari
daerah asalnya seperti: jeruk siam Pontianak, siam Simadu, siam Garut, siam
Palembang, siam Jati Barang dan lain-lain. Dari berbagai nama tersebut, jeruk siam
Pontianak dan siam Simadu merupakan jenis jeruk siam yang paling dikenal.
Macam-macam jeruk siam tersebut tidak jauh berbeda satu dengan lainnya.
Perbedaannya biasanya dalam hal warna kulit, keharuman dan rasa yang sedikit
berbeda. Perbedaan ini biasanya timbul karena berbeda daerah penanamannya.
Tempat penanaman yang berbeda tentunya mempunyai karakteristik faktor alam yang
berbeda sehingga berpengaruh terhadap karakteristik buahnya.
Untuk pertumbuhan yang baik, jeruk siam memerlukan iklim dan kondisi
lingkungan yang sesuai untuk pertumbuhannya. Jeruk siam dapat tumbuh dengan
laut) sesuai dengan daerah asalnya di Muangthai. Ketinggian tempat penanaman
berpengaruh jelas terhadap rasa. Penanaman di atas 900 dpl menyebabkan rasa buah
jeruk siam menjadi sedikit asam (Deptan 1994).
Jeruk siam merupakan jenis jeruk yang paling banyak dibudidayakan di
indonesia. Dominasi pertanaman jeruk siam adalah sekitar 85% dari seluruh
pertanaman jeruk yang ada di indonesia. Kemudian diikuti oleh jeruk keprok sebesar
8%, jeruk pamelo 55% dan jenis jeruk lainnya sebesar 3% (Kuntarsih 2007).
Produksi jeruk siam Indonesia merupakan yang ke 3 terbesar di dunis setelah China
dan Spanyol, sedang jeruk pamelo adalah urutan nomor 9 di dunia.
Buah Jeruk Tanpa Biji (Seedless)
Seedless adalah merupakan sifat buah yang tidak memiliki biji. Sifat seedles
tersebut dapat diperoleh secara alami pada beberapa jenis tanaman yang mempunyai
kemampuan membentuk buah tanpa biji tanpa adanya penyerbukan dan pembuahan
yang disebut dengan buah partenokarpi (Frost and Soost 1968; Spiegel-Roy and
Goldschmidt 1996). Sifat tersebut merupakan sifat yang mempunyai nilai ekonomi
tinggi pada tanaman jeruk karena merupakan karakter yang harus dimiliki buah
jeruk konsumsi segar agar dapat bersaing di pasar global (Spiegel-Roy and
Goldschmidt 1996 dan Cai 2007). Sifat tersebut juga merupakan salah satu objek
penelitian yang banyak dilakukan pada program pemuliaan tanaman jeruk, baik
secara konvensional maupun non konvensional (Nicotra 2007).
Untuk mendapatkan tanaman jeruk yang mempunyai karakter buah seedless
pada tanaman jeruk sudah dimulai dilakukan beberapa dekade yang lalu melalui
pemuliaan konvensional. Satsuma mandarin (C. unshiu Marc.) adalah merupakan jenis jeruk berbuah seedless secara alami karena mempunyai sifat partenocarpy (Kunittake et al. 1991; Spiegel-Roy and Goldschmidt 1996). Yamamoto et al. (1997) telah berhasil membukt ikan bahwa sifat seedless yang terdapat pada jeruk Mandarin Satsuma disebabkan oleh pollennya yang steril (male sterility) dan bersifat apomiksis. Apomiksis adalah merupakan bentuk reproduksi aseksual dimana biji terbentuk dari
apomiksis pada tanaman jeruk Mandarin Satsuma menyebabkan keragaman
genetiknya rendah karena kondisi genetik embrio yang dihasilkan sama dengan tetua
betinanya. Untuk memindahkan sifat tersebut dari jeruk Mandarin Satsuma kepada
kultivar jeruk lainnya sangat sulit dilakukan melalui pemuliaan konvensional karena
adanya faktor genetik (inkompatible). Oleh karena itu perlu dicari cara lain untuk memindahkan sifat seedless dari jeruk Satsuma mandarin ke kultivar jeruk lainnya. Salah satu teknologi yang dapat digunakan adalah teknik fusi protoplas (Grosser et al. 1996; Moriguchi et al. 1996; Grosser and Gmitter 2005). Teknologi fusi protoplas pada tanaman jeruk telah banyak menghasilkan hibrida somatik baru (Kobayashi et al. 1988; Grosser and Gemitter 1991; Oiyama et al. 1991). Guo et al. (2004) berhasil memasukkan sifat seedless dari Satsuma melalui teknik fusi protoplas. Calixto et al.
(2004) mendapatkan hibrida somatik dari C. sinensis dengan C. grandis yang toleran terhadap virus Citrus tristeza, Phytophthora dan berpotensi digunakan sebagai batang bawah. Cai et al. (2007) juga berhasil menggunakan teknologi fusi protoplas untuk mendapatkan tanaman jeruk yang seedless hasil fusi protoplas antara C. unshiu Marc dengan C. grandis dan C. sinensis.
Untuk mendapatkan tanaman jeruk yang seedless juga dapat dilakukan dengan teknik mutasi. Mutasi secara alami dapat terjadi dengan frekuensi yang sangat
rendah. Untuk meningkatkan frekuensi terjadinya mutasi dapat diinduksi secara kimia
maupun fisik. Pemberian sinar X dan panas Neutron pada biji dan tunas dapat
menginduksi terjadinya mutasi (Broertjes and Van Harten 1988; Spingel-Roy et al. 1990). Induksi mutasi dengan radiasi dapat menghasilkan buah tanpa biji pada jeruk
lemon yang mempunyai biji lebih kurang 25 butir per buah (Spingel-Roy et al. 1990). Buah jeruk tanpa biji juga sudah diperoleh dari mutan kultivar jeruk tangelo
(Spingel-Roy and Vardi 1989). Pada tahun 1980 an sudah ditemukan mutan-mutan
jeruk yang menghasilkan buah seedless di Florida (Hearn 1984, 1986) dan di China (Zhou 1986). Selain mutan seedless, mutan yang mempunyai buah dengan kandungan asam yang rendah dan pematangan buah yang lebih cepat juga sudah diperoleh pada
mendapatkan jeruk lemon mutan yang seedless dan toleran terhadap penyakit mal secco yang disebabkan oleh jamur Phoma tracheiphila.
Isolasi Protoplas
Protoplas merupakan sebagai suatu hasil isolasi sel, yang sudah tidak mempunyai
dinding sel lagi, mengandung selulosa dan pektin. Isolasi protoplas pertama kali
dimulai oleh Klercker pada tahun 1892 secara mekanik menggunakan daun Stratiotes aloides yang terlebih dulu diplasmolisa, kemudian diiris tipis, dimasukkan dalam media cair, sehingga protoplas ada yang terlepas ke dalam medium (Bhojwani and
Razdan 1983). Isolasi protoplas dengan cara mekanik ini menghasilkan protoplas
yang rendah, banyak mengandung vakuola dan sel yang dihasilkan tidak bersifat
meristematik (Veilleux et al. 2005).
Metode isolasi protoplas dari tanaman mulai banyak digunakan pada tahun 1960
menggunakan larutan enzim untuk isolasi dan pemurnian dari sel tanaman. Pada
tahun 1960 Cocking berhasil mengisolasi protoplas yang hidup viable dari jaringan akar tomat melalui perlakuan dalam larutan enzim selulase yang diperoleh dari jamur
Myrothecium verrucaria. Pada tahun 1968, preparasi isolasi dan purifikasi protoplas dari jaringan tanaman mulai dilakukan secara komersial menggunakan larutan enzim
selluase dan maserozim (Veilleux et al. 2005).
Jenis dan konsentrasi enzim yang dapat dipergunakan untuk mengisolasi
protoplas sangat bervariasi. Ada 15 jenis enzim yang dapat dipergunakan seperti:
pektin glikosidase, pektinase, selulase R-10, silanase, maserozim, meiselase, rohamen
P, selulase onozuka RS, driselase, pektoliase Y-23, hemiselulase, selulisin, naserase,
dan rozim. Karena enzim bersifat termolabil sehingga sterilisasi tidak bisa dilakukan
dengan pemanasan. Sterilisai enzim hanya dilakukan dengan millipore filters yang
mempunyai lobang ”mesh” sebesar 0,22 – 0,24 mikron atau 0,24 – 0,45 mikron agar tidak rusak. Setiap jenis tanaman, bahkan setiap jenis jaringan yang digunakan
sebagai sumber protoplas mempunyai respon yang berbeda-beda terhadap enzim yang
digunakan sehingga untuk mencapai protoplas yang viabel dalam jumlah optimum
lama inkubasi yang digunakan untuk jaringan dan tanaman tertentu. Untuk dapat
menentukan banyaknya jumlah protoplas yang dihasilkan dari isolasi dapat dihitung
dengan cara tertentu. Menurut Power et al. (1970), densitas protoplas dapat dihitung dengan menggunakan alat haemocytometer dengan ruang dobel, protoplas yang
dihitung adalah protoplas yang berada dalam area one triplelined square.
Protoplas pada mulanya diisolasi dari bagian tanaman yang tumbuh di tanah.
Jaringan yang dapat diguanakan adalah akar, daun, nodul akar, coleoptil, jaringan
buah, tajuk bunga dan serbuk sari. Kemudian berkembang seiring dengan pesatnya
teknik biak in vitro. Saat ini, tanaman atau bagian tanaman yang baik digunakan sebagai sumber protoplas adalah tanaman yang berasal dari biakan in vitro karena sudah bebas dari patogen (steril) dan lebih mudah diisolasi karena dinding selnya
lebih tipis.
Karena protoplas merupakan sel tanpa dinding, maka bagaimana caranya
menghasilkan protoplas yang utuh, viabel dan dalam jumlah banyak sehingga
berfungsi normal dan dapat beregenerasi membentuk dinding sel, tumbuh dan
berkembang melakukan pembelahan.
Untuk menentukan protoplas yang dihasilkan bersifat viabel atau tidak dapat
dilakukan dengan teknik pewarnaan menggunakan FDA (Fluorescein Diacetat). Molekul FDA dapat masuk bebas melalui membran plasma ke dalam protoplas yang
masih hidup. Protoplas yang masih hidup melakukan metabolisme (viable) dapat dilihat dengan adanya eksitasi pada fluorescein yang ada dalam protoplas dengan
penyinaran memakai lampu ultra violet.
Untuk mencegah pecahnya protoplas biasanya digunakan zat anti pecah (anti
blastin) yang biasa disebut osmolyticum atau osmotic stabilizer. Zat anti pecah yang
biasa digunakan adalah gula alkohol, gula, sorbitol, mannitol, atau sakharosa.
Sihachakr (1998) dan Husni et al. (2004) menggunakan larutan sukrosa tunggal (21%) untuk mengapungkan protoplas tanaman terung yang diisolasi dari mesofil
daun. Grosser and Gmitter (1990) menggunakan kombinasi larutan manitol 13% dan
dengan sukrosa 25% sebagai larutan untuk memurnikan protoplas (furification solution) dari kalus dan mesopil daun tanaman jeruk.
Karena protoplas merupakan sel hidup yang telanjang, hanya dilindungi oleh
membran plasma, maka protoplas mulai dipergunakan untuk penelitian-pemelitian
biologi eksperimental, fisiologis dan biokimia, virologi, patologi, fusi protoplas,
manipulasi genetik dan rekayasa genetika.
Fusi Protoplas
Fusi protoplas adalah penggabungan dua genom dari dua tetua sel somatik
untuk menghasilkan hibrida. Usaha untuk memfusikan sel somatik dimulai pada awal
abad 20 oleh Winkler, Kuster dan Michel. Michel pada tahun 1937
mendemonstrasikan fusi protoplas dengan menggunakan NaNO3
Fusi protoplas dapat terjadi secara spontan atau dapat diinduksi dengan
beberapa cara antara lain dengan NaNO
. Kemudian
berkembang dengan berbagai percobaan untuk memperoleh senyawa kimia yang
dapat digunakan untuk menginduksi fusi.
3
Senyawa yang banyak digunakan untuk induksi fusi saat ini adalah dengan
penambahan polietilen glikol (PEG) dan arus listrik. Senyawa PEG dapat
menginduksi terjadinya fusi dengan frekuensi yang tinggi dan dapat tumbuh dan
berkembang menjadi tanaman hibrida baru. Terjadinya fusi telah dibuktikan
disebabkan oleh karena PEG dalam air bermuatan sedikit negatif dan mampu
membentuk ikatan hidrogen dengan membran plasma pada protoplas. Selain itu, PEG
juga dapat mengikat Ca
, asam lemak, ion kalsium dan pH tinggi,
dekstran sulfat, polifenil alkohol (PVP), polietilen glikol (PEG) dan arus listrik. Jika
dinding sel tanaman dihilangkan secara enzimatik, protoplas yang dihasilkan dapat
melakukan fusi secara spontan sehingga membentuk multinucleate fusion bodies. Kejadian ini biasa terjadi karena adanya plasmodesmata yang menghubungkan sel-sel
tanaman (Veilleux et al. 2005).
2+
atau kation lain. Kation Ca2+ membentuk jembatan antara
membran dan PEG sehingga meningkatkan agregasi (Grosser and Gemitter 1990;
Pada tahun 1974, induksi fusi menggunakan arus listrik juga mulai
diperkenalkan oleh Senda et al. secara manual pada tahun 1979. Kemudian diperbaharui oleh Zimmermann dan co-Workers pada tahun 1980 dengan dua sistem
menggunakan generator AC dan DC. Generator AC berfungsi untuk membuat
protopla sejajar seperti rantai, kemudian arus DC diberikan untuk membuat celah
yang dapat balik sehingga protoplas dapat berfusi (Zimmerman dan Scheurich 1981).
Semenjak hibrida somatik dapat diperoleh dari hasil fusi antara Nicotiana glauca dengan N. langsdorfii oleh Carlson et al. pada tahun 1972 maka teknik fusi protoplas mulai digunakan untuk menghasilkan hibrida baru baik inter maupun intra
specifik pada beberapa tanaman.yang secara genetik tidak bisa dilakukan karena
adanya faktor ketidak sesuaian gen (inkompatibilitas).
Fusi Protoplas pada Tanaman Jeruk
Pada tanaman jeruk, teknik fusi protoplas mulai berkembang setelah
Ohgawara et al. (1985) melaporkan keberhasilannya mendapatkan hibrida somatik antara C. sinensis dengan Poncirus tripoliata yang secara genetik inkompatibel. Semenjak itu, teknik tersebut banyak digunakan dalam program pemuliaan tanaman
jeruk di dunia seperti di Jepang oleh Kobayashi et al. (1988), Israel oleh Vardi et al.
(1987), Amerika Serikat oleh Grosser dan Gemitter (1990), di Prancis oleh Ollitrault
et al. (1996) dan di Brazil oleh Mendes da Gloria et al. (2000). Pada saat ini telah diperoleh lebih dari 250 kombinasi dari 40 tetua jenis jeruk melalui fusi protoplas
(Grosser et al. 2000; Cabasson et al. 2001; Guo et al. 2004).
Beberapa hasil penelitian yang telah menggunakan jeruk Mandarin Satsuma
(C. Unshui) sebagai salah satu tetua dalam teknologi fusi protoplas untuk perbaikan tanaman jeruk batang atas (C. sinensis) adalah Yamamoto and Kobayashi (1995), Yamamoto et al. (1997), Guo et al. (2004), Xu et al. (2006), dan Cai et al. (2007).
Teknologi fusi protoplas pada tanaman jeruk juga sudah banyak digunakan
untuk perbaikan genetik batang bawah. Grosser (1988) memfusikan C. sinensis
tripoliata untuk ketahanan terhadap garam dan dingin, Calixo et al. (2004) memfusikan C. sinensis dengan C. grandis untuk ketahanan terhadap virus dan Phytophthora, Fu et al. ( 2003) memfusikan C. sinensis dengan Clausena lansium.
Dengan teknologi fusi protoplas dapat dilakukan introgresi gen sifat baik
dari jeruk Mandarin Satsuma ke jeruk siam Simadu karena jeruk Mandarin
Satsuma merupakan jeruk tipe mandarin yang mempunyai sifat parthenocarpy yang
tinggi (seedless), mudah dikupas (easy peeling), pigmented dan telah adaptif di Indonesia. Untuk mendapatkan buah jeruk lokal yang mempunyai sifat sesuai
dengan tuntutan pasar (seedless, pigmented, low acid dan ukuran besar) secara efisien dan efektif dapat digunakan dengan cara mengintrogresikan sifat seedless dan
pigmented dari spesies jeruk lain seperti Mandarin Satsuma. Mandarin Satsuma (C. unshiu Marc.) adalah merupakan jeruk introduksi yang termasuk tipe Mandarin yang mempunyai sifat parthenocarpy yang tinggi (seedless), mudah dikupas (easy peeling) dan pigmented (Yamamoto et al. 1997; Spiegel-Roy dan Goldschmidt 1996). Hasil introgresi gen dari fusi protoplas tersebut dihasilkan hibrida dengan level ploidi
2n=4x=36 (Allotetraploid). Hibrida tersebut juga dapat digunakan sebagai tetua
yang akan disilangkan dengan jeruk Siam (2n) untuk mendapatkan hibrida yang
triploid (2n=3x) yang mempunyai sifat parthenocarpy yang tinggi. Strategi ini sudah
banyak dilakukan para pakar pemulia jeruk di dunia, seperti di Jepang pada tahun
1985 oleh Ohgawara et al dan Kobayashi and Ohgawara tahun 1988, di Amerika pada tahun 1988 oleh Grosser di Pakistan oleh Jaskani (1998) dan di Brazil oleh
Mendes-da-Gloria et al (1999 dan 2000). Dengan teknologi fusi protoplas tersebut telah banyak menghasilkan hibrida-hibrida baru yang mempunyai keunggulan, baik
karakter buah, morfologi dan ketahanan terhadap cekaman biotik dan abiotik.
Bila dibandingkan dengan produk hasil bioteknologi lainnya, khususnya
rekayasa genetika, fusi protoplas masih sangat diminati walaupun teknologi ini
tergolong sulit dan rumit. Produk hibrida somatik yang dihasilkan dapat diterima
Daftar Pustaka
Badan Litbang Pertanian. 2005. Prospek dan arah Pengembangan Agribisnis Jeruk. Badan Penelitian dan Pengembangan Pertanian, Departemen Pertanian. 39 h.
Bhojwani SS, Razdan MK. 1983. Plant Tissue culture. Theory and Practice. Elsevier Sciences Publishing Company Inc: 237-238.
Broertjes C, Van Harten AM. 1988. Applied Mutation Bbreeding for Vegetatively Propagated Crops. Development in Crops Science. V. 12, Oxford:Elsevier, 345 pp.
Cabasson CM, Luro F, Ollitrault O, Grosser JW. 2001. Non-random inheritance of mithocondrial genomes in Citrus hybrids froduced by protoplast fusion.
Plant Cell rep 20:604-609.
Cai XD, Fu J, Deng XX, Guo WW. 2007. Production and molecular characterization of potential seedless cybrid plants between pollen steril Satsuma Mandarin and two seedy Citrus cultivars. Plant Cell Tiss Organ Cult. 90:275-283.
Calixto MC, Filho FFAM, Mendes BMJ, Vieira MLC. 2004. Somatic hybridozation between Citrus sinensis (L.) Osbeck and C. grandis (L.) Osbeck. Pesq. Agropec. Bras. 39(7):1-6.
Departemen Pertanian . 1994. Penuntun Budiddaya Buah-buahan (Jeruk). Direktorat Jenderal Pertanian Tanaman Pangan. 269 h.
Departemen Pertanian. 2007. Statistik Produksi HortiKultura Tahun 2006. Dirjen Hortikultura. Jakarta.
Fu CH, Guo WW, Liu JH, Deng XX. 2003. Regeneration of Citrus sinensis + Clausena lansium intergeneric triploid ang tetraploid somatic hybrids and their molecular identification. In Vitro Cell Dev. Sci.20:251-255.
Frost HB, Soost RK. 1968. Seed reproduction development of gametes and embryos . In: Reuther W, Webber HJ, Batchelor (eds) The Citrus Industry. Vol. I. University of California Press, Barkley, Calif. Pp. 290-324.
Grosser JW, 1988. Application of protoplast fusion of citrus scion and rootstock improvement. Proc. Workshop. Scope for citrus breeding in Australia and the use of new breeding techniques, CSIRO, Merbein, Juli 1987, 146-151.
Grosser JW and Gmitter FG Jr. 1990. Protoplast fusion and citrus improvement. Plant Breeding Reviews. Portland, V.8, p.339-374.
Grosser JW and Gmitter FG Jr. 1991.Protoplast technology in tropical fruit, improvement, with focus on Citrus. Workshop on Agricultural Biotechnology Bogor, May 21-24.
Grosser JW, Gmitter FG, Tusa N, Reforgiato G, and Cucinotta. 1996. Further evidence of a cybridization requirement for plant regeneration from citrus leaf protoplast following somatic fusion. Plant Cell Rep. 15:672-676.
Grosser JW, Ollitrault P, Olivares-Fuster O. (2000). Somatic hybridization in Citrus: an effective tool to facilitate variety improvement. In Vitro Cell Dev Biol Plant 36:434-449.
Grosser JW and Gmitter FG Jr. 2005. Application of somatic hybridization and cybridization in crop improvement, with citrus as a model. In vitro Cell Dev. Biol Plant 39:360-364.
Gulsen O, Uzun A, Pala H, Canihos E, and Kafa G. 2007. Development of seedless and Mal secco tolerant mutant lemons through budwood irradiation. Science Horticultura.112 (2):184-190.
Guo WW, Prassad D, Cheng YJ, Serrano P, Deng XX, and Grosser. 2004. Targeted cybridization in citrus: transfer of Satsuma cytoplasm to seedy cultivars for potential seedlessness. Plant Cell rep 22:752-758.
Hearn CJ. 1984. Development of seedless orange and grapefruit cultivars through seed irradiation. J. Am. Soc. Hort. Sci., 109:270-273.
Hearn CJ. 1986. Development of seedless grapefruit cultivars through budwood irradiation. J. Am. Soc. Hort. Sci.,111:304-306.
Husni A, Mariska I, dan Hobir. 2004. Fusi Protoplas dan regenerasi protoplas hasil fusi antara Solanum melongena dengan S. torvum. Jurnal Bioteknologi Pertanian 9(1):1-8.
Jaskani MJ.1998. Interploid hiybridization and regeneration of kinnow mandarin. A Thesis submitted in partial fulfiment of the requirements for the degree of Doctor of Philosophy in Horticulture Faculty of Agriculture University of Agriculture Faisal Abad, Pakistan.p.169.
Kobayashi S, Ohgawara T, Ohgawara E, Oiyima I, and Ishii IS.1988. A somatic hybirid plant obtained by protoplast fusion between navel orange (Citrus sinensis) and Satsuma mandarin. Plant Cell Tissue and Organ Culture14:63-69.
Kobayashi S and Ohgawara T.1988. Production of somatic hybrid plants through protoplast fusion in Citrus. J. Agric. Rev. Quarterly. 22:181-188.
Kunitake H, Kagami H, and Mii M. 1991. Somatic embrtogenesis and plant regeneration from protoplasts of Stsuma?mandarin (Citrus unshiu Marc.) Scientia Horticilturae, 47:27-33.
Kuntarsih S. 2007. Pengelolaan rantai pasok dengan bisnis jeruk (kasus jeruk siam Pontianak Kabupaten Sambas). Makalah dalam seminar Nasional jeruk. Yogyakarta, 13-14 Juni 2007.
Mendes-da-Gloria FJ, Maurao Filho FA, Demetrio CGBM and Mendes BMJ. 1999. Embryogenic calli induction from nucellar tissu of Citrus cultivars. Sci. Agric. (56) 4: 1-11.
Mendes-da-Gloria FJ, Maurao Filho FA, Camargo LEA, and Mendes BMJ. 2000. Caipira sweet orange Rangpur lime: a swomatic hybrid with potential for use as rootstock in the Brazilian citrus industry. Genetic Molecular Biology, V.23, p. 661-665.
Moore GA. (2001). Oranges and lemons: clues to the taxonomy of Citrus from molecular markers. Trends Genet. 17(9):536-540.
Moriguchi T, Hidaka T, Omura M, Motomura T, and Akihama T. 1996. Genotypes and parental combination influence efficiency of cybrid induction in citrus by electrofusion. Hort Science 31:275-278.
Nicotra A. 2007.Mandarin-like hybrids of recent interest for fresh consumption. Problems and ways of control. Instituto Sperimentale per la Frutticoltura Rme-Italy. 13p.
Oiyama I, Kobayashi S, Yoshinaga K, Ohgawara T, and Ishii S, 1991. Use of pollen from a somatic hybrid between Citrus and Poncirus in the production of triploids. Hort.Sci., 26:1082-1087.
Ollitrault P, Dambier D, and Luro F. 1996. Somatic hybridization in Citrus; some new hybrids and alloplasmic plants. Proc. Int. Soc. Citricult.2:907-912. Power JB, Cummins SE, and Cocking EC. 1970. Fusion of isolated plant protoplasts.
Nature 255:1016-1018.
Sihachakr D. 1998. Culture Media and Protocols for Isolation and Fusion of Prtoplasts of Eggplant. Universite Paris sud, France (Tidak dipublikasi).
Spiege-Roy P and Vardi A. 1989. Induced mutations in citrus:In Proc.6th
International congres, pp 733-776, Tokyo: SABRAO.
Spiege-Roy P, Vardi A, and Elhanati A. 1990. Seedless induced mutan in highly seeded lemon (Citrus limon). Mutation Breed. Newsl. 36:11.
Spiegel-Roy P and Goldschmidt EE. 1996. Biology Of Citrus. Cambridge University Press. 221 p.
Vardi A, Breiman A, and Galun E. 1987. Citrus cybrids: production by donor-recipient protoplast fusion and verification by mitochondrial-DNA restriction profiles. Theor. Appl. Genet., 75:51-58.
Veilleux RE, Compton ME, and Saunders JA. 2005. Use of Protoplasts for Plant Improvement In R.N. Trigiano and D.J. Gray (Eds) Plant Development and Biotechnology.187-200pp. CRC Press LLC.
Xu XY, Liu JH, and Deng XX. 2006. Isolations of citoplats from Satsuma mandarin (Citrus unshiu Mrc.) and production of alloplasmic hybrid calluses via cytoplast-protoplsat fussion. Plant Cell rep. 25:533-539.
Yamamoto M, Matsumoto R, Okudai N, and Yamada Y. 1997. Aborted anthers of Citrus result from gene-cytoplasmic male sterility. Sci Hortic 70:9-14.
Zhou J. 1986. Induction of seedless mutation by irradiation citrus seeds with 60 gamma rays. China Citrus. 2:1-4.
Co
BAB IV
STUDI ISOLASI PROTOPLAS TANAMAN JERUK SIAM DAN MANDARIN SATSUMA)*
Ringkasan
Penelitian untuk mendapatkan metode isolasi protoplas dari tanaman jeruk siam (kultipar Simadu dan Pontianak) dan mandarin (kultivar Satsuma) telah dilakukan dari bulan Juli – Desember 2007. Dari hasil penelitian diperoleh bahwa jenis, konsentrasi, dan kombinasi enzim yang digunakan dalam isolasi protoplas sangat berpengaruh dalam keberhasilan isolasi protoplas. Kombinasi enzim selulase 1% (Onozuka RS-Yakult) dengan maserosim (Onozuka R-10 Yakult) (enzim 1) dapat mengisolasi protoplas dari jaringan daun maupun kalus embriogenik dengan densitas yang tinggi (105/ml) setelah dimurnikan dengan larutan sukrosa 25%+manitol 13%. Penambahan enzim pectoliyase Y-23 dalam komposisi enzim yang sama (enzim 2) juga dapat mengisolasi protoplas dari jaringan daun dan kalus embriogenik dengan densitas (105/ml). Rata-rata jumlah protoplas yang terisolasi dari jaringan daun adalah 1.3x105dari siam Simadu dan siam Pontianak, dan1.05x105dari Mandarin Satsuma pada enzim 1 serta 1.30x105, 1.20x105 dan 1.1x105 pada enzim 2. Rata-rata jumlah protoplas yang dihasilkan dari kalus yang berasal dari nuselus lebih banyak dari pada kalus embriogenik yang berasal dari embrio baik pada enzim 1 maupun enzim 2. Rata-rata jumlah protoplas yang dihasilkan adalah 1.5x105 siam Simadu maupun siam Pontianak.
*)Bagian disertasi ini telah dipublikasikan di Jurnal Agritek Vol. 17.2008.
PROTOPLAST ISOLATION STUDIES OF TANGERINE AND SATSUMA MANDARIN
Abstract
Research to find a method of protoplasts isolation from tangerine citrus (Simadu and Pontianak cultivars) and Satsuma Mandarin cultivar have been carried out from July to December 2007. Experiments have shown that the type, concentration, and the combination of enzymes used in protoplast isolation are very influential in the success of protoplast isolation. The combination of 1% cellulase (Onozuka RS, Yakult) with macerozim 1% (Onozuka R-10 Yakult) (enzyme 1) is able to isolate protoplasts from embryogenic callus or leaf tissue with high density (105/ml), after purified with a solution of sucrose 25% + 13% mannitol. Addition of Y-23 pectolyase enzyme in the composition of the same enzyme (enzyme 2) was also able to isolate protoplasts from embryogenic callus tissue and leafs with a density of 105/ml. Average number of protoplasts isolated from leaf tissue tangerine Simadu is 1.31x105, Tangerine Pontianak is 1.3x105, and Mandarin Satsuma 1.05x105, at enzyme 1 and 1.3x105, and 1.2x105 1.2x105 at enzyme 2. The average amount generated from callus protoplasts derived from embryogenic callus nuselus more than derived from embryos at both 1 and 2 enzymes. Average number of protoplasts produced was 1.5x105 from Simadu tangerine and 1.5 x105 from Pontianak tangerine. Average number of protoplasts produced was 1.5x105 from Simadu 1.5 x105 from Pontianak.