AKTIVITAS ANTIMIKROB DAN KARAKTERISASI
NANOSILVER EKSTRASELULER
Veronaea
sp. KT19
CHOLILA WIDYA HAPSARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi “Aktivitas Antimikrob dan
Karakterisasi Nanosilver Ekstraseluler Veronaea sp. KT19” adalah benar karya
saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
ABSTRAK
CHOLILA WIDYA HAPSARI. Aktivitas Antimikrob dan Karakterisasi
Nanosilver Ekstraseluler Veronaea sp. KT19. Dibimbing oleh KUSTIARIYAH
TARMAN dan POPI ASRI KURNIATIN.
Sintesis nanosilver secara biologis dapat menggunakan kapang. Tujuan penelitian ini adalah mengetahui karakteristik nanosilver dan menentukan
aktivitas antibakteri nanosilver ekstraseluler kapang Veronaea sp. KT19. Aktivitas
tertinggi ditunjukkan oleh ekstrak hari ke-6 dengan zona hambat pada bakteri Escherichia coli sebesar 15,5±0,7 mm dan Bacillus subtilis sebesar 13±2,8 mm. Pengujian karakteristik menggunakan spektrofotometri UV-Vis menunjukkan puncak penyerapan A6, A12, B6 (x), B6 (y), B12 (x) dan B12 (y) pada panjang gelombang 450 nm, 400 nm, 263,5 nm, 262 nm, 262,5 nm dan 256,5 nm. Rata-rata ukuran partikel terkecil didapatkan oleh A6 yaitu sebesar 32,25 nm. Aktivitas antimikrob terhadap 5 mikroorganisme uji menunjukkan aktivitas lemah pada Bacillus subtilis dan Staphylococcus aureus dan aktivitas sedang pada Escherichia coli, Pseudomonas aeruginosa dan Candida maltosa.
Kata kunci: antibakteri,biosintesis,nanosilver, Veronaea sp.
ABSTRACT
CHOLILA WIDYA HAPSARI. Antimicrobial activity and characterization of
extracellular nanosilver of Veronaea sp. KT19. Supervised by KUSTIARIYAH
TARMAN and POPI ASRI KURNIATIN
Synthesis of nanosilver biologically may use fungi. The purpose of this study was to characterize and to determine antimicrobial activity of extracellular
nanosilver of Veronaea sp. KT19. The highest activity was shown by extract of
day 6 with diameter of inhibition zones on the Escherichia coli was 15.5±0.7 mm
and Bacillus subtiliswas 13±2.8 mm. Spectrum of the nanoparticles of A6, A12, B6 (x), B6 (y), B12 (x), and B12 (y) was measured at a wavelength of 450 nm, 400 nm, 263.5 nm, 262 nm, 262.5 nm and 256.5 nm. The smallest particle size average obtained by A6 was 32.25 nm. Antimicrobial activity against 5
microorganisms showed weak activity againts Bacillus subtilis and
Staphylococcus aureus, showed moderate activity againts Escherichia coli, Pseudomonas aeruginosa and Candida maltosa.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
AKTIVITAS ANTIMIKROB DAN KARAKTERISASI
NANOSILVER EKSTRASELULER
Veronaea
sp. KT19
CHOLILA WIDYA HAPSARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi :Aktivitas Antimikrob dan Karakterisasi Nanosilver Ekstraseluler Veronaea sp. KT19
Nama : Cholila Widya Hapsari
NIM : C34090011
Program studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Kustiariyah Tarman, SPi, MSi Pembimbing I
Popi Asri Kurniatin, SSiApt, MSi Pembimbing II
Diketahui oleh
Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2013 ini adalah antibakteri nanosilver, dengan judul Aktivitas Antimikrob dan Karakterisasi
Nanosilver Ekstraseluler Veronaea sp. KT19.
Terima kasih penulis ucapkan kepada semua pihak, terutama kepada:
1 Ibu Dr Kustiariyah Tarman, SPi, MSi selaku dosen pembimbing 1
skripsi, atas bimbingan dan segala pembelajaran yang telah diberikan.
2 Ibu Popi Asri Kurniatin, SSiApt, MSi selaku pembimbing 2 skripsi, atas
pengarahan dan segala bimbingan.
3 Ibu Dr Ir Iriani Setyaningsih, MS selaku penguji, atas saran, kritik dan
arahan yang telah diberikan.
4 Ayah Sunan Hadi, ibu Cholifah, mbak Dessy Ika Wardani dan mbak
Masyitah Nur Ramdhani yang selalu mendukung, mendoakan dan melimpahkan segala kasih sayangnya.
5 Mas Amir Mahmud yang senantiasa mendukung, mendoakan dan
mengingatkan.
6 THP 46 yang telah mengukir banyak cerita dan kenangan selama kuliah
di departemen THP.
7 Teman seperjuangan laboratorium mikrobiologi (Dhani, Puspita, Rita,
Wenny, Arga dan Fitri) yang telah membantu selama penelitian berlangsung.
8 Keluarga besar THP (THP 45, THP 47 dan THP 48) yang telah
membantu dalam segala hal.
9 Tim basket FPIK yang telah memberikan pengalaman dan cerita.
10 Teman “Pondok Jaika” yang selalu membantu dalam segala hal.
11 Keluarga Ikatan Mahasiswa Jember di Bogor (IMJB) yang senantiasa
mendukung dan membantu dalam segala hal, baik suka maupun duka. Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2014
DAFTAR ISI
Ruang Lingkup Penelitian ... 2
METODE ... 2
Bahan ... 3
Alat ... 3
Prosedur Analisis Penelitian ... 3
Kultivasi Kapang Veronaea sp. KT19 ... 3
Biosintesis Nanosilver Ekstraseluler Veronaea sp. KT19 ... 4
Pengujian Karakteristik Nanosilver Ekstraseluler Veronaea sp. KT 19... 5
Pengujian Aktivitas Antimikrob ... 5
Peremajaan Mikroorganisme Uji ... 5
Kultivasi Mikrob Uji... 6
Pengujian Aktivitas Antimikrob ... 6
HASIL DAN PEMBAHASAN ... 7
Kurva Pertumbuhan dan Ekstraksi Komponen Bioaktif Veronaea sp. KT19 7 Aktivitas Antimikrob Veronaea sp. KT19 ... 8
Sintesis Nanosilver Ekstraseluler ... 9
Karakteristik Nanosilver ... 11
Ukuran Partikel ... 14
Aktivitas Antimikrob Nanosilver Ekstraseluler... 16
KESIMPULAN DAN SARAN ... 17
Kesimpulan ... 17
Saran ... 17
DAFTAR PUSTAKA ... 17
LAMPIRAN ... 20
DAFTAR TABEL
1 Aktivitas ekstrak Veronaea sp. KT 19 terhadap mikroorganisme uji ... 9
2 Ukuran partikel nanosilver ... 15
DAFTAR GAMBAR
1 Diagram alir penelitian ... 42 Diagram alir biosintesis nanosilver (metode A) ... 5
3 Diagram alir biosintesis nanosilver (metode B) ... 6
4 Kurva Pertumbuhan Veronaea sp. KT19 ... 7
5 Ekstrak komponen bioaktif kapang Veronaea sp. KT19 ... 8
6 Kultivasi sintesis ekstraseluler nanosilver. ... 9
7 Kultivasi sintesis nanosilver miselium ekstraseluler hari ke-6 ... 10
8 Kultivasi sintesis nanosilver miselium ekstraselulerhari ke-12. ... 10
9 Mekanisme reduksi biosintesis partikel perak ... 11
10 Spektrum UV-Vis filtrat nanosilver ekstraseluler ... 12
11 Spektrum UV-Vis nanosilver miselium hari ke-6 ... 13
12 Spektrum UV-Vis nanosilver miselium hari ke-12 ... 13
13 Sebaran partikel nanosilver ekstraseluler filtrat. ... 14
14 Sebaran partikel nanosilver ekstraseluler miselium hari ke-6 ... 14
15 Sebaran partikel nanosilver ekstraseluler miselium hari ke-12 ... 15
16 Aktivitas antimikrob nanosilver ekstraseluler ... 16
DAFTAR LAMPIRAN
1 Aktivitas antibakteri Veronaea sp. KT19 ... 212 Aktivitas antibakteri nanosilver ekstraseluler Veronaea sp. KT19 ... 21
3 Pengujian UV-Vis spektrofotometer B6 gelap ... 21
4 Pengujian UV-Vis spektrofotometer B6 terang ... 22
5 Pengujian UV-Vis spektrofotometer B12 gelap ... 22
PENDAHULUAN
Latar Belakang
Fungi merupakan kelompok mikroorganisme yang sangat besar dan dapat ditemukan di beberapa relung ekologi. Menurut Hawksworth (1991) ada sekitar 1.500.000 spesies fungi terdapat di dunia. Sekitar 200.000 spesies diperkirakan ada di Indonesia (Rifai 1995). Kapang merupakan sumber metabolit yang dapat digunakan sebagai zat antimikrob atau antibiotik. Antibiotik diperlukan sebagai upaya untuk melawan infeksi pada tubuh yang disebabkan oleh mikrob patogen (Sunatmo 2009). Penggunaan antibiotik sintetis atau buatan dapat menimbulkan efek samping yang tidak diharapkan apabila digunakan secara terus menerus.
Nanoteknologi merupakan suatu teknologi untuk memanipulasi ukuran material pada tingkat atom maupun molekul. Penerapan nanoteknologi sebagian besar menggunakan struktur ukuran kurang dari seratus nanometer (100 nm), sedangkan beberapa pakar mengusulkan bahwa ukuran partikel nano yaitu kurang dari 300 nm. Ukuran nano ini dapat menghasilkan sifat fisik dan kimia berbeda secara signifikan. Ukuran yang kecil ini akan meningkatkan rasio luas permukaan nanopartikel dengan volume partikel sehingga daya reaktivitasnya luar biasa tinggi (Winarno dan Fernandez 2010).
Penggunaan nanoteknologi untuk sintesis nanopartikel logam sudah banyak dikembangkan. Ada beberapa metode sintesis yang dapat digunakan, yaitu sintesis secara kimia, sintesis secara fisik dan secara biologi (Moghaddam 2010). Sintesis logam nanopartikel secara biologis adalah sintesis yang memanfaatkan komponen
biologi, seperti kapang (Rai et al. 2009). Sintesis nanopartikel secara biologi
merupakan metode yang paling baik dibandingkan dengan sintesis nanopartikel secara kimia maupun fisika. Sintesis secara biologi memiliki beberapa kelebihan yaitu memiliki nilai pemanfaatan yang lebih tinggi, prosesnya bersifat bersih, murah dan ramah lingkungan. Biosintesis nanopartikel logam diklasifikasikan menjadi dua, yaitu ekstraseluler dan intraseluler. Biosintesis intraseluler adalah proses sintesis yang berlangsung di dalam sel, sedangkan biosintesis ekstraseluler memerlukan pereaksi biologis untuk bioreduksi yang berupa enzim yang sudah
tersekresikan keluar sel (Moghaddam 2010). Duran et al. (2005) telah melakukan
biosintesis ekstraseluler menggunakan AgNO3 yang biasa disebut nanosilver pada
beberapa strain Fusarium oxysporum. Ukuran nanopartikel silver yang terbentuk
berkisar antara 20-50 nm. Vahabi et al. (2011) mensintesis secara ekstraseluler
nanopartikel silver yang berasal dari Trichoderma ressei dan diameter ukuran
nanopartikel silver yang dihasilkan berkisar antara 5-50 nm.
Menurut Prabakaran et al. (2012), sintesis nanosilver sudah diaplikasikan
dalam berbagai bidang, seperti sebagai katalis pada reaksi kimia, bio-labelling dan
pencegahan infeksi terhadap kuman pada luka. Nanoteknologi dapat diaplikasikan dalam zat antimikrob. Pemanfaatan nano-antimikrob ini dapat meningkatkan reaktivitas zat itu sendiri dan dapat diserap pada bagian yang dituju atau ditargetkan. Nano-antimikrob akan lebih cepat dan efektif dalam mematikan
bakteri yang dituju. Ray et al. (2011) menyatakan bahwa aktivitas nanosilver
2
Kapang Veronaea sp. KT19 berpotensi sebagai sumber zat antimikrob
alami. Kapang ini juga berpotensi sebagai media untuk sintesis nanopartikel silver. Tarman (2011) melakukan isolasi kapang ini dari permukaan habitat pasir pantai di daerah Malang, Jawa Timur.
Perumusan Masalah
Kapang Veronaea sp. KT19 menghasilkan metabolit sekunder yang dapat
digunakan sebagai antibiotik alami. Kapang ini juga dapat digunakan untuk
sintesis nanosilver. Penggunaan kapang Veronaea sp. KT19 dalam sintesis
nanosilver dan aktivitas antimikrobnya belum diketahui.
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan aktivitas antimikrob kapang Veronaea sp. KT19, karakteristik nanosilver ekstraseluler kapang Veronaea sp. KT19 dan aktivitas antimikrobnya.
Manfaat Penelitian
Penelitian ini diharapkan dapat menjadi sumber informasi untuk pemanfaatan bahan alami sebagai antibiotik dan mengembangkan teknologi nanopartikel berupa nanosilver.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah kultivasi kapang, biosintesis nanosilver ekstraseluler, pengujian karakteristik nanosilver dan pengujian aktivitas antimikrob.
METODE
Penelitian ini dilaksanakan pada bulan Januari sampai Desember 2013. Pembuatan kultur dan biosintesis nanosilver dilakukan di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Evaporasi ekstrak dilakukan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Pengujian karakteristik menggunakan spektrofotometer UV-Vis dilakukan di Laboratorium MIPA Bersama, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut
Pertanian Bogor. Pengujian karakteristik nanosilver dengan menggunakan particle
3
Bahan
Bahan yang digunakan adalah kapang Veronaea sp. KT19. Bahan yang
digunakan untuk kultivasi dan sintesis nanosilver adalah Potato Dextrose Agar
(PDA), Potato Dextrose Broth (PDB), akuades, etil asetat, kapas, kertas saring
dan AgNO3. Bahan yang digunakan untuk pengujian antimikrob meliputi media
Nutrient Agar (NA), Nutrient Broth (NB), Mueller Hinton Agar (MHA), Escherichia coli,Bacillus subtilis, Staphylococcus aureus, Pseudomonas aeruginosa dan Candida maltosa.
Alat
Alat yang digunakan dalam penelitian ini adalah cawan petri, pinset, gunting, pisau, pipet tetes, mikro pipet, gelas ukur, alumunium foil, sudip, labu
Erlenmeyer 500 mL dan 300 mL,corong, timbangan analitik (Sartorius TE212-L),
kertas saring, kapas, ose, lemari pendingin, rak tabung reaksi, tabung reaksi, shaker, vacuum rotary evaporator, vortex, inkubator (Thermolyne type 4200 Incubator), autoklaf (Yamato SM 52 Autoclave), spektrofotometer UV-VIS (UV-1700 PharmaSpec UV- Visible Spectrophotometer (SHIMADZU) dan UV Vis
(RS 2500) dan particle size analyzer (PSA,VASCO).
Prosedur Analisis Penelitian
Penelitian dibagi menjadi tiga tahap. Tahap pertama adalah kultivasi Veronaea sp. KT19, tahap kedua adalah biosintesis nanosilver dan tahap ketiga adalah karakterisasi dan pengujian aktivitas antimikrob. Karakterisasi dilakukan dengan menggunakan spektrofotometer UV-Vis, PSA dan pengujian aktivitas
antimikrob pada mikroorganisme uji, antara lain Escherichia coli, Bacillus
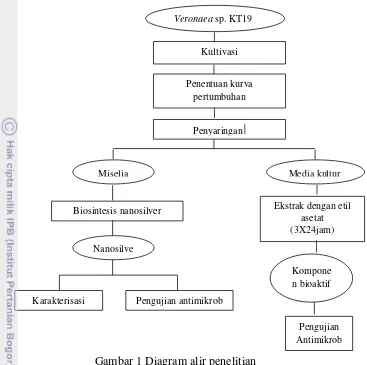
subtilis, Staphylococcus aureus, Pseudomonas aeruginosa dan Candida maltosa. Diagram alir prosedur penelitian dapat dilihat pada Gambar 1.
Kultivasi Kapang Veronaea sp. KT19
4
Gambar 1 Diagram alir penelitian
Biosintesis Nanosilver Ekstraseluler Veronaea sp. KT19
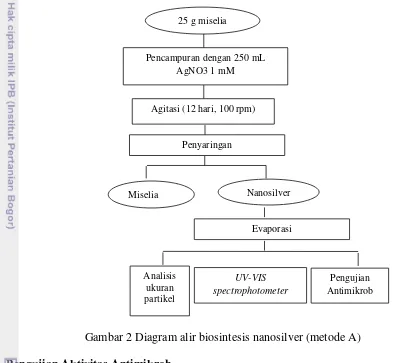
Biosintesis nanosilver menggunakan dua metode. Metode pertama,
biomassa kapang yang sudah dipanen dicuci dengan menggunakan air distilasi
yang steril untuk menghilangkan komponen media. Biomassa kapang Veronaea
sp. KT 19 basah sebanyak 25 g dicampur dengan 250 mL aquades steril dan
diagitasi pada shaker dengan kecepatan 100 rpm dengan suhu ruang selama 5
hari. Setelah itu, filtrat diambil dengan cara menyaring menggunakan kertas Whatman no. 1 dan filtrat yang dihasilkan sebanyak 50 mL dicampur dengan 50
mL larutan AgNO3 1mM. Larutan tersebut diagitasi pada kondisi gelap dengan
suhu ruang selama 72 jam (Ray et al. 2011). Metode ini dinamakan metode A6
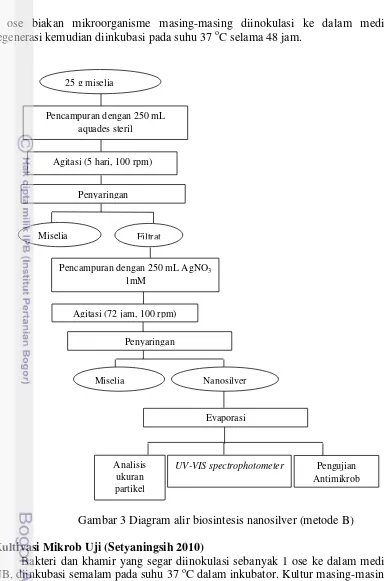
(sintesis menggunakan kapang kultivasi hari ke-6) dan A12 (sintesis menggunakan kapang kultivasi hari ke-12). Metode lainnya adalah biomassa
kapang Veronaea sp. KT 19 basah sebanyak 25 g dicampur dengan 250 mL
larutan silver nitrat (AgNO3) 1mM pada labu Erlenmeyer 500 mL. Campuran
biomassa dan AgNO3 diinkubasi pada shaker dengan kecepatan 100 rpm selama
12 hari pada suhu ruang (Vahabi et al. 2011). Biosintesis dilakukan pada kondisi
5
kondisi gelap menggunakan kapang kultivasi hari ke-12) (Minaeian 2008). Diagram alir biosintesis nanosilver dapat dilihat pada Gambar 2-3.
Pengujian Karakteristik Nanosilver Ekstraseluler Veronaea sp. KT 19
Selama proses biosintesis berlangsung dilakukan pengamatan terjadinya perubahan ion perak menjadi logam perak secara visual. Larutan nanosilver diukur menggunakan UV-1700 PharmaSpec UV- Visible Spectrophotometer
SHIMADZU setiap harinya (Vahabi et al. 2011)
Larutan nanosilver yang terbentuk diuji menggunakan PSA (VASCO). Pengujian ini dilakukan untuk mengetahui ukuran partikel yang terbentuk.
Pengujian Aktivitas Antimikrob
Pengujian aktivitas antimikrob melalui beberapa tahap, yaitu persiapan mikrob uji melalui peremajaan kultur bakteri dan kultur khamir. Kultur mikroorganisme yang telah disiapkan kemudian dilakukan pengujian aktivitas antimikrob menggunakan metode sumur agar.
Peremajaan Mikroorganisme Uji (Kusmiyati dan Agustini 2007)
Media yang digunakan adalah Nutrient Agar (NA) dengan komposisi, yaitu
ekstrak daging 1%, pepton 1% dan agar 1,5%. Media dilarutkan dalam akuades dan dipanaskan hingga larut sempurna, lalu dimasukkan ke dalam tabung reaksi
sebanyak 4 mL dan disterilkan dalam autoklaf pada suhu 121 oC, tekanan 1 atm
selama 15 menit. Tabung dimiringkan dan didiamkan hingga memadat. Sejumlah
25 g miselia
Agitasi (12 hari, 100 rpm)
Penyaringan
Miselia
Evaporasi
6
1 ose biakan mikroorganisme masing-masing diinokulasi ke dalam media
regenerasi kemudian diinkubasi pada suhu 37 oC selama 48 jam.
Kultivasi Mikrob Uji (Setyaningsih 2010)
Bakteri dan khamir yang segar diinokulasi sebanyak 1 ose ke dalam media
NB, diinkubasi semalam pada suhu 37 oC dalam inkubator. Kultur masing-masing
mikrob uji diukur kekeruhannya dengan menggunakan spektrometer UV-VIS
pada panjang gelombang 600 nm hingga mencapai OD 0,5 – 0,8.
Pengujian Aktivitas Antimikrob (Kusmiyati dan Agustini 2007)
Mikrob yang telah diinokulasi ke dalam media pertumbuhan (NB), masing-masing dimasukkan ke dalam media MHA. Media agar yang mengandung mikrob uji dituang dalam cawan petri yang telah memadat. Media didiamkan hingga
Filtrat 25 g miselia
Pencampuran dengan 250 mL aquades steril
Agitasi (5 hari, 100 rpm)
Penyaringan
Miselia
Pencampuran dengan 250 mL AgNO3
1mM
Agitasi (72 jam, 100 rpm)
Nanosilver
7
memadat, kemudian dibuat lubang. Lubang dimasukkan sintesis nanosilver
kapang Veronaea sp. KT 19 beserta kontrol positif dan negatif. Cawan diinkubasi
pada suhu 37 oC selama 24 jam dan dilakukan pengukuran zona hambat yang
terbentuk di sekeliling lubang dengan menggunakan penggaris. Jumlah ekstrak
yang digunakan untuk pengujian aktivitas antimikrob Veronaea sp. KT 19 adalah
0,5 mg, 1 mg dan 2 mg, sedangkan untuk pengujian aktivitas nanosilver
ekstraseluler menggunakan 2 mg. Pengujian aktivitas antibakteri Veronaea sp.
KT19 dilakukan terhadap 2 bakteri uji yaitu Bacillus subtilis dan Escherichia
coli, sedangkan untuk nanosilver ekstraseluler Veronaea sp. KT19 menggunakan
5 mikroorganisme uji yaitu Bacillus subtilis, Escherichia coli, Staphylococcus
aureus, Pseudomonas aeruginosa dan Candida maltosa.
HASIL DAN PEMBAHASAN
Kurva Pertumbuhan dan Ekstraksi Komponen Bioaktif Veronaea sp. KT19
Produksi komponen bioaktif pada suatu kapang berhubungan dengan fase
pertumbuhan. Fase pertumbuhan didapatkan dari kultur Veronaea sp. KT19 yang
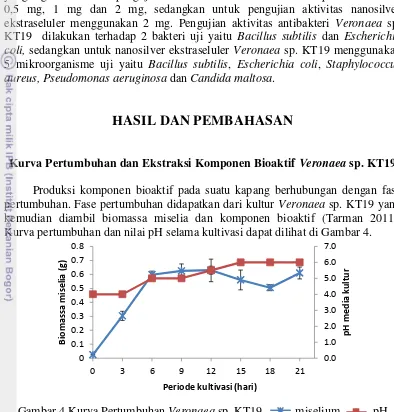
kemudian diambil biomassa miselia dan komponen bioaktif (Tarman 2011). Kurva pertumbuhan dan nilai pH selama kultivasi dapat dilihat di Gambar 4.
Gambar 4 Kurva Pertumbuhan Veronaea sp. KT19 miselium , pH
Kurva pertumbuhan yang terlihat pada Gambar 2 didapatkan dari biomassa
miselia kering. Kapang Veronaea sp. KT 19 mengalami fase eksponensial sampai
hari ke-6 kultivasi. Nilai pH kultur kapang Veronaea sp. KT19 cenderung stabil
setelah hari ke-12 hingga ke-21 kultivasi. Kurva pertumbuhan Veronaea sp. KT19
yang didapat dari penelitian Tarman (2011) menunjukkan bahwa Veronaea sp.
KT19 mengalami fase eksponensial sampai hari ke-6 kultivasi dan selama satu
minggu selanjutnya mengalami fase stasioner. Nilai pH kultur Veronaea sp. KT19
relatif stabil setelah hari ke-10 hingga hari ke-21 masa kultivasi. Perbedaan pertumbuhan pada kapang dipengaruhi oleh beberapa faktor, yaitu substrat, kelembapan, suhu, derajat keasaman substrat (pH) dan senyawa-senyawa kimia
yang ada di lingkungan (Gandjar et al. 2006).
8
Komponen bioaktif yang terdapat pada kapang Veronaea sp. KT19 diambil
melalui ekstraksi media kultur dengan menggunakan pelarut etil asetat. Hasil ekstraksi komponen bioaktif dapat dilihat pada Gambar 5.
(a) (b) (c) (d) (e)
Gambar 5 Ekstrak komponen bioaktif kapang Veronaea sp. KT19 (a) hari ke-3,
(b) hari ke-6, (c) hari ke-9, (d) hari ke-12 dan (e) hari ke-15
Gandjar et al. (2006) menyatakan bahwa proses metabolisme akan
menimbulkan adanya perubahan warna yang menandakan adanya komponen metabolit. Hasil yang didapatkan pada Gambar 5 menunjukkan bahwa hari ke-6 kultivasi menghasilkan ekstrak komponen bioaktif yang memiliki warna lebih pekat. Hal tersebut dikarenakan jumlah metabolit yang dihasilkan pada hari ke-6 lebih banyak dibandingkan dengan yang lainnya. Hasil ini sesuai dengan
penelitian Tarman (2011) bahwa isolat kapang Veronaea sp. KT19 memproduksi
metabolit tertinggi pada hari ke-6 kultivasi. Pada penelitian ini biomassa miselia terbanyak pada hari ke-12 kultivasi. Komponen bioaktif tertinggi didapatkan pada kultivasi hari ke-6. Hasil tersebut digunakan untuk pengujian aktivitas antibakteri dan sintesis nanosilver.
Aktivitas Antimikrob Veronaea sp. KT19
Media kultur cair kapang Veronaea sp. KT 19 yang diekstrak menggunakan
etil asetat selanjutnya digunakan untuk pengujian aktivitas antibakteri. Bakteri yang digunakan dalam pengujian termasuk dalam bakteri positif dan
Gram-negatif, yaitu Bacillus subtilis dan Escherichia coli. Pengujian aktivitas
antibakteri ekstrak kapang ini bertujuan untuk menentukan masa inkubasi kapang yang menghasilkan bioaktif paling banyak, selanjutnya digunakan untuk
biosintesis nanosilver. Roby et al. (2012) menyebutkan bahwa aktivitas
9
Tabel 1 Aktivitas ekstrak Veronaea sp. KT 19 terhadap mikroorganisme uji
Bakteri uji
Diameter zona hambat (mm)
Jumlah ekstrak hari ke-6 (mg) Jumlah ekstrak hari ke-12 (mg)
0,5 1 2 0,5 1 2
menunjukkan bahwa Veronaea sp. KT19 mampu menghambat bakteri
Gram-positif dan Gram-negatif yaitu Bacillus subtilis dan Escherichia coli. Hasil yang
sama ditunjukkan oleh ekstrak hari ke-12 bahwa Veronaea sp. KT19 mampu
menghambat kedua bakteri tersebut. Tabel 1 menunjukkan bahwa diameter zona
hambat yang terbentuk pada Escherichia coli lebih besar dibandingkan Bacillus
subtilis. Hal tersebut disebabkan karena Escherichia coli yang merupakan kelompok bakteri Gram-negatif memiliki dinding sel lebih tipis dibandingkan
dengan Bacillus subtilis yang tergolong bakteri Gram-positif. Pelczar dan Chan
(2010) menyatakan bahwa perbedaan struktur dinding sel tersebut yang menyebabkan kedua bakteri tersebut akan memberikan respon terhadap ekstrak antibakteri yang diberikan. Pengujian aktivitas antibakteri pada hari ke-6 menunjukkan zona hambat yang lebih besar dibandingkan hari ke-12. Hal tersebut menandakan bahwa komponen bioaktif berupa antibakteri saat hari ke-6 kultivasi
lebih banyak dibandingkan hari ke-12 masa kultivasi. Jawetz et al. (1996)
menyatakan bahwa adanya perbedaan zona hambat yang terbentuk dapat dipengaruhi oleh beberapa faktor, yaitu pH lingkungan, komposisi media, stabilitas senyawa antimikrob, jumlah (kepadatan) inokulum, lama inkubasi dan aktivitas metabolik mikroorganisme.
Sintesis Nanosilver Ekstraseluler
Kapang Veronaea sp. KT19 selanjutnya diambil miselianya untuk
dipergunakan dalam biosintesis nanosilver. Biosintesis nanosilver ekstraseluler dapat dilihat pada Gambar 6 - 8.
(a) (b) (c) (d)
10
(a) (b) (c) (d)
Gambar 7 Kultivasi sintesis nanosilver miselium ekstraseluler hari ke-6 (a) kondisi gelap sebelum sintesis, (b) kondisi gelap sesudah sintesis, (c) kondisi terang sebelum sintesis, (d) kondisi terang sesudah sintesis
(a) (b) (c) (d)
Gambar 8 Kultivasi sintesis nanosilver miselium ekstraselulerhari ke-12 (a) kondisi gelap sebelum sintesis, (b) kondisi gelap sesudah sintesis, (c) kondisi terang sebelum sintesis dan (d) kondisi terang setelah sintesis.
Sintesis nanosilver dengan menggunakan AgNO3menghasilkan ekstraseluler
berubah warna menjadi kecoklatan. Gambar 4 menunjukkan bahwa filtrat hari ke-6 berwarna lebih coklat dibandingkan dengan filtrat hari ke-12. Sintesis menggunakan miselia menunjukkan perubahan warna ekstraseluler nanosilver dari warna putih bening menjadi kekuningan (Gambar 7 - 8). Peningkatan intensitas warna larutan pada larutan nanosilver kemungkinan disebabkan karena agregasi dari sintesis nanosilver yang kemudian terbentuk dan bergabung secara
elektronis (Prakash dan Thiagarajan 2012). Ray et al. (2011) menyebutkan bahwa
perubahan warna ekstraseluler nanosilver menjadi kecoklatan dikarenakan adanya pengurangan ion silver yang mengindikasikan terbentuknya nanosilver.
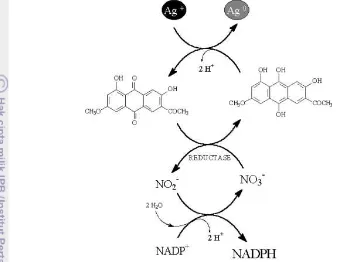
Mekanisme biosintesis nanosilver menggunakan mikroorganisme
dinamakan bioreduksi. Pembentukan nanosilver melalui dua proses. Proses yang pertama, nanopartikel dibentuk di permukaan dinding sel. Tahapan pertama dalam proses bioreduksi ini adalah terperangkapnya ion logam pada permukaan dinding sel. Hal ini menyebabkan adanya interaksi elektrostatis antara ion logam dengan enzim yang ada pada dinding sel. Setelah itu terjadi reduksi ion logam secara enzimatik, membentuk agregasi dan terbentuk nanopartikel. Sel mikroba mereduksi ion logam menggunakan enzim reduktase spesifik seperti
NADH-dependent reduktase atau nitrate NADH-dependent reduktase (Ramezania et al. 2010).
Proses yang kedua adalah biomassa kapang yang disimpan dalam air steril akan mengeluarkan komponen biologisnya ke air. Air ini akan berfungsi sebagai reduktan untuk mereduksi ion logam dan membentuk nanopartikel silver
(Moghaddam 2010). Duran et al. (2005) melakukan sintesis nanosilver
11
kapang ini terjadi karena adanya peranan senyawa nitrat reduktase bebas dan anthraquinon secara ekstraseluler. Mekanisme reduksi biosintesis nanosilver oleh Fusarium oxysporum dapat dilihat pada Gambar 9.
Gambar 9 Mekanisme reduksi biosintesis partikel perak (Duran et al. 2005)
Karakteristik Nanosilver
Spektrum UV-Vis
Penggunaan spektroskopi UV-Vis dalam pengujian karakteristik merupakan teknik yang sederhana untuk mengobservasi sintesis nanopartikel. Teknik ini memiliki kegunaan untuk memantau pembentukan dari nanosilver
(Kora et al. 2010). Nilai absorbansi yang didapatkan dari spektrofotometer
UV-Vis diantaranya memberikan informasi tentang komposisi dari nanopartikel (Narayanan dan Sakhtivel 2011). Penyerapan nanosilver pada spektroskopi UV-Vis dapat dilihat pada Gambar 10 - 12.
Perlakuan A6 dan A12 diamati karakteristik nanosilver yang terbentuk menggunakan spektroskopi UV-Vis selama 72 jam. Pengujian ini dapat mengindikasikan adanya penurunan ion silver yang terjadi terus menerus secara ekstraseluler yang kemudian bercampur dan terbentuk larutan nanosilver
(Minaeian et al. 2008). Gambar 10 (a) menunjukkan adanya puncak penyerapan
12
(a) (b)
Gambar 10 Spektrum UV-Vis filtrat nanosilver ekstraseluler (a) hari ke-6 dan (b) hari ke-12
Gambar 10 (a) dan 10 (b) menunjukkan bahwa nanosilver sudah terbentuk. Hal tersebut dikarenakan adanya pengurangan ion secara ekstraseluler dan
dilepaskan ke larutan (Duran et al. 2005). Prabakaran et al. (2012) menyatakan
bahwa puncak penyerapan yang kuat terbentuk pada panjang gelombang 200-400. Absorbansi pada panjang gelombang tersebut menunjukkan adanya nanosilver yang terbentuk. Puncak penyerapan yang terbentuk pada beberapa panjang
gelombang menandakan bahwa surface plasmone resonance yang kuat berada di
panjang gelombang tersebut. El-Rafie et al. (2010) mensintesis nanopartikel silver
menggunakan kapang Fusarium solani dan nanosilver yang terbentuk
menunjukkan puncak penyerapan pada panjang gelombang 420 nm. Ramteke et
al. (2013) membuat nanosilver yang terbentuk dari ekstrak daun tulsi (Ocimum
sanctum) dan menunjukkan puncak penyerapan pada panjang gelombang 450 nm.
Penelitian Ray et al. (2011) menunjukkan bahwa puncak penyerapan terbentuk
pada panjang gelombang 440 nm. Perbedaan puncak absorbansi yang terbentuk dapat dipengaruhi oleh komposisi media yang terdapat pada kedua larutan tersebut. Hal ini sesuai dengan pernyataan Moghaddam (2010) bahwa komposisi media kultur dapat mempengaruhi optimasi pembentukan nanopartikel silver sehingga mempengaruhi ukuran partikel yang disintesis.
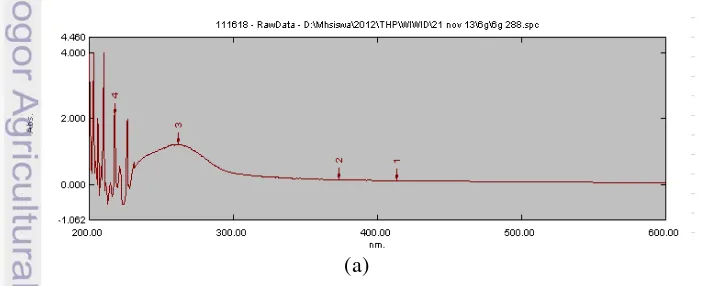
Perlakuan B6 terang dan B6 gelap diamati selama 12 hari (288 jam). Spektrum spektroskopi UV-Vis nanosilver dari perlakuan B6 terang dan B6 gelap dapat dilihat pada Gambar 11.
(a)
350 400 450 500 550 600
ab
350 400 450 500 550 600
13
(b)
Gambar 11 Spektrum UV-Vis nanosilver miselium (a) hari ke-6 kondisi gelap dan (b) hari ke-6 kondisi terang.
. Gambar 11 (a) dan 11 (b) menunjukkan puncak penyerapan pada panjang gelombang 262 nm dan 263,5 nm. Nilai absorbansi tertinggi B6 gelap adalah pada jam ke-288 (akhir pengamatan) dan B6 terang pada jam ke-120. Bhainsa dan D‟souza (2006) menyatakan bahwa adanya puncak penyerapan yang terbentuk pada panjang gelombang rendah menandakan adanya residu ikatan amida, triptofan dan tirosin pada protein. Hal tersebut menunjukkan komponen protein menjadi komponen utama dalam bioreduksi nanopartikel. Protein ini yang menentukan struktur enzim dan enzim tersebut digunakan untuk bioreduksi nanopartikel.
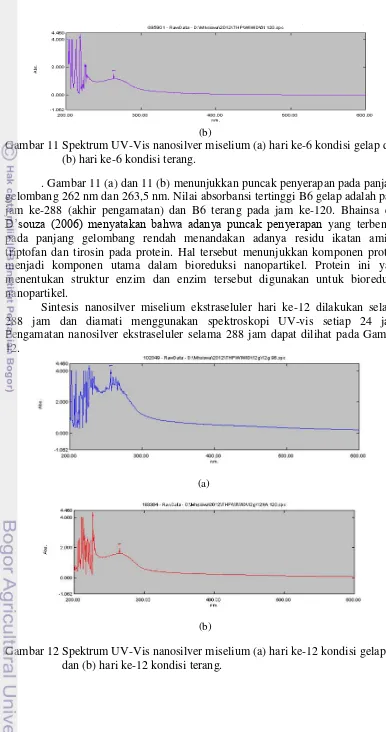
Sintesis nanosilver miselium ekstraseluler hari ke-12 dilakukan selama 288 jam dan diamati menggunakan spektroskopi UV-vis setiap 24 jam. Pengamatan nanosilver ekstraseluler selama 288 jam dapat dilihat pada Gambar 12.
(a)
(b)
14
Gambar 12 (a) dan 12 (b) menunjukkan puncak penyerapan pada panjang gelombang 256,5 nm dan 262,5 nm. Perlakuan B12 gelap dan B12 terang memiliki nilai absorbansi tertinggi pada jam ke-96 dan ke-120 masa inkubasi. Nilai absorbansi tertinggi B12 gelap adalah 3,718 sedangkan B12 terang adalah
1,612. Duran et al. (2005) menyatakan bahwa adanya penyerapan pada panjang
gelombang sekitar 265 nm menunjukkan adanya protein asam amino aromatik. Perbedaan puncak penyerapan yang terbentuk pada beberapa perlakuan di atas dapat dipengaruhi oleh beberapa faktor, diantaranya waktu inkubasi, adanya sumber cahaya dan komposisi media. Hal tersebut sesuai Moghaddam (2010) yang menyatakan bahwa perbedaan optimasi pembentukan nanosilver dipengaruhi oleh beberapa parameter, yaitu pH, waktu inkubasi, adanya sumber cahaya, suhu dan komposisi media kultur. Optimasi yang berbeda dapat merubah komposisi kimia, bentuk dan ukuran partikel yang disintesis (Moghaddam 2010).
Adanya panjang gelombang yang terbentuk dikarenakan surface plasmone
resonance (SPR) yang kuat berada di panjang gelombang tersebut. SPR merupakan fenomena resonansi yang antara gelombang cahaya dan elektron-elektron pada permukaan logam yang menghasilkan osilasi dan diukur kuantitasnya (Badia 2007). Perbedaan panjang gelombang yang terbentuk dapat dikarenakan kuantitas nanosilver yang berbeda.
Ukuran Partikel
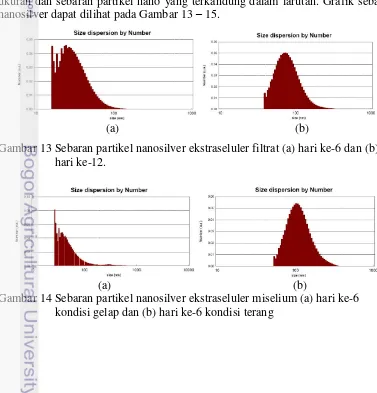
Karakteristik nanosilver dapat diketahui salah satunya dengan mengetahui ukuran partikel. Pengujian dengan menggunakan PSA adalah untuk mengetahui ukuran dan sebaran partikel nano yang terkandung dalam larutan. Grafik sebaran
nanosilver dapat dilihat pada Gambar 13 – 15.
(a) (b)
Gambar 13 Sebaran partikel nanosilver ekstraseluler filtrat (a) hari ke-6 dan (b) hari ke-12.
(a) (b)
15
(a) (b)
Gambar 15 Sebaran partikel nanosilver ekstraseluler miselium (a) hari ke-12 kondisi gelap dan (b) hari ke-12 kondisi terang
Gambar 13-15 menunjukkan sebaran ukuran partikel nanosilver yang terbentuk pada setiap perlakuan. Jumlah partikel yang terbentuk memiliki ukuran yang berbeda. Perbedaan jumlah partikel yang terbentuk pada setiap perlakuan dipengaruhi oleh perbedaan optimasi yang dilakukan. Moghaddam (2010) menyatakan bahwa perbedaan optimasi yang dilakukan dapat mempengaruhi komposisi kimia, bentuk dan ukuran nanopartikel silver yang disintesis.
Ukuran partikel nanosilver diketahui melalui uji PSA. Metode penghitungan sebaran partikel nanosilver yang digunakan pada PSA ini adalah
metode cumulants. Metode cumulants merupakan suatu metode analisa data yang
digunakan pada alat yang menggunakan Dynamic Light Scaterring (Frisken
2001). Ukuran partikel yang sudah dianalisa, akan tertera pada software yang
telah disambungkan pada alat PSA. Sebaran ukuran partikel nanosilver dapat dilihat pada Tabel 2.
Tabel 2 Ukuran partikel nanosilver
Sampel Rentang Ukuran Dmean number
A6 16,22 – 70,81 32,25
16
Aktivitas Antimikrob Nanosilver Ekstraseluler
Filtrat ekstraseluler yang telah disintesis selanjutnya digunakan untuk pengujian aktivitas antimikrob nanosilver ekstraseluler. Aktivitas antimikrob nanosilver ekstraseluler dapat dilihat pada Gambar 16.
Gambar 16 Aktivitas antimikrob nanosilver ekstraseluler, Bacillus subtilis,
Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa dan Candida maltosa
Pengujian aktivitas antimikrob dilakukan pada bakteri Bacillus subtilis,
Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus dan Candida maltosa. Gambar 16 menunjukkan bahwa aktivitas antimikrob pada beberapa mikroorganisme uji memiliki diameter zona hambat yang besarnya relatif sama, yaitu berkisar antara 4-7 mm. Davis dan Stout (1971) menyatakan bahwa apabila zona hambat yang terbentuk berukuran kurang dari 5 mm, maka aktivitasnya dikategorikan lemah, berukuran 5-10 mm dikategorikan sedang, 10-19 mm dikategorikan kuat dan 20 mm atau lebih dikategorikan sangat kuat. Aktivitas
lemah cenderung ditunjukkan pada Bacillus subtilis dan Staphylococcus aureus,
sedangkan terhadap Escherichia coli, Pseudomonas aeruginosa dan Candida
maltosa menunjukkan aktivitas yang sedang. Hasil ini menunjukkan bahwa ukuran nanosilver tidak berpengaruh pada aktivitas antimikrob terhadap mikroorganisme uji. Perbedaan aktivitas yang dihasilkan disebabkan oleh
kemampuan mikroorganisme uji melawan komponen antibakteri. Bacillus subtilis
dan Staphylococcus aureus yang merupakan bakteri Gram-positif memiliki
dinding sel yang tebal dibandingkan dengan Escherichia coli dan Pseudomonas
aeruginosa yang termasuk bakteri Gram-negatif. Aktivitas antimikrob ekstraseluler nanosilver yang ditunjukkan cenderung lemah dan sedang. Hal tersebut dapat disebabkan oleh kurangnya optimasi dalam pembentukan nanosilver ekstraseluler. Nanosilver ekstraseluler yang dihasilkan belum mencapai hasil yang optimal sehingga aktivitas antibakteri yang dihasilkan kurang optimal pula.
Logam silver sudah diketahui memiliki daya hambat yang kuat dan efek bakterisidal yang baik dalam aktivitas antibakteri. Nanosilver memiliki luas area permukaan yang lebih besar dan fraksi atom permukaan yang lebih tinggi
A6 A12 B6 gelap B6 terang B12 gelap B12 terang
17
dibandingkan dengan silver dalam ukuran lebih besar (Maneerung et al. 2008).
Winarno dan Fernandez (2010) menyatakan bahwa ukuran partikel yang kecil dapat meningkatkan reaktivitasnya. Ada beberapa mekanisme nanosilver sebagai antibakteri yaitu dengan mempengaruhi sintesis dinding sel, mengganggu fungsi membran sel, menghambat sintesis protein dan menghambat sintesis nukleat.
KESIMPULAN DAN SARAN
terdeteksi pada panjang gelombang 450 nm, 400 nm, 262 nm, 263,5 nm, 256,5 nm dan 262,5 nm. Rata-rata ukuran partikel terkecil didapatkan pada sintesis nanosilver menggunakan filtrat hari ke-6 yaitu sebesar 32,25 nm. Aktivitas antimikrob nanosilver ekstraseluler terhadap 5 mikroorganisme uji menunjukkan
aktivitas lemah terhadap B. subtilis dan S.aureus, aktivitas sedang terhadap E.
coli, P. aeruginosa dan C. maltosa.
Saran
Penelitian selanjutnya perlu dilakukan optimasi pembentukan nanosilver, misalnya optimasi masa inkubasi untuk memaksimalkan pembentukan
nanopartikel dari kapang Veronaea sp. KT19.
DAFTAR PUSTAKA
Bhainsa KC, D‟souza SF. 2006. Extracelluler biosynthesis of silver nanoparticles
using the fungus Aspergillus fumigatus. Colloids and Surfaces B:
Biointerfaces 47:160-164.
Davis WW, Stout TR. 1971. Disc plate method of microbiological antibiotic
assay. Journal of Microbiology 22(4):659-665.
Duran N, Marcato PD, Alves OL, Souza GIHD, Esposito. 2005. Mechanistic
aspect of biosynthesis of silver nanoparticles by several Fusarium
oxysporum strains. Journal of Nanobiotechnology 3:8.
18
Frisken BJ. 2001. Revisiting the method of cumulants for the analysis of dynamic
light scattering data. Applied Optics 40(24):4087-4091.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta
(ID): Yayasan Obor Indonesia.
Hawksworth DL. 1991. The fungal dimension biodiversity: magnitude,
significance, and conservation. Mycological Research 95(6):641-655.
Jawetz E, Melnick J, Adelberg E. 1996. Mikrobiologi Kedokteran. Ed ke-20.
Nugroho E, Maulany RF, penerjemah. Jakarta (ID): EGC. Terjemahan dari: Medical Microbiology.
Kora AJ, Sashidhar RB, Arunachalam. 2010. Gum kondagagu (Cochlospermum
gossypium): A template for the green synthesis and stabilization of silver
nanoparticles with antibacterial application. Carbohydrat Polymers
82:670-679.
Kusmiyati, Agustini NWS. 2007. Uji aktifitas senyawa antibakteri dari mikroalga Porphyridium cruentum. Biodiversitas 8(1):48-53.
Maneerung T, Tokura S, Rujiravanit R. Impregnation of silver nanoparticles into
bacterial cellulose for antimicrobial wound dressing. Carbohydrates
Polymers 72:43-51.
Minaeian S, Shahverdi AR, Nohi AS, Shahverdi HR. 2008. Extracellular
biosynthesis of silver nanoparticles by some bacteria. Journal Science
Islamic Azad University 17(66):1-4.
Moghaddam KM. 2010. An introduction to microbial metal nanoparticle
preparation method. The Journal of Young Investigators 19:19.
Mohanraj VJ, Chen Y. 2006. Nanoparticles – A review. Tropical Journal of
Pharmaceutical Research 5(1):561-573.
Narayanan KB, Sakhtivel. 2011. Heterogeneous catalytic reduction of anthropogenic pollutant, 4-nitrophenol by silver-bionanocomposite using Cylindrocladium floridanum. Bioresource Technology 102:10737-10740.
Pelczar MJ, Chan ECS. 2010. Dasar-Dasar Mikrobiologi 1. Hadioetomo RS,
Imas T, Tjitrosomo, Angka SL. penerjemah. Jakarta (ID): Penerbit
Universitas Indonesia. Terjemahan dari: Elements of Microbiology.
Prabakaran M, Subha K, Thennarasu V, Merinal S. 2012. Biosynthesis of silver
nanoparticles using Sphaerulina albispiculata and evaluation of
antibacterial activity. European Journal of Experimental Biology
2(1):297-303.
Prabhu S, Poulose EK. 2012. Silver nanoparticles: mechanism of antimicrobial
action, synthesis, medical applications, and toxicity effects. International
Nano Letters 2(32):1-10.
Prakash RT, Thiagarajan. 2012. Syntheses and characterization of silver
nanoparticles using Penicillium sp. isolated from soil. International Journal
of Advanced Scientific and Technical Research 1:137-149.
Pratama R. 2012. Pemanfaatan metabolit ekstraseluler Lactobacillus delbrueckii
subsp. bulgaricus dalam pembentukan nanopartikel perak [skripsi]. Bogor
(ID): Institut Pertanian Bogor.
Ramezania F, Ramezanib M, Talebiz S. Mechanistic aspects of biosynthesis of
19
Ramteke C, Chakrabarti T, Sarangi BK, Pandey RA. 2013. Synthesis of silver
nanoparticles from the aquaeos extract of leaves of Ocimum sanctum for
enhanced antibacterial activity. Journal of Chemistry 2013:1-8.
Rai M, Yadav A, Bridge P, Gade A. 2009. Myconanotechnology: a new and emerging science. Applied Mycology 14:258-267.
Ray S, Sarkar S, Kundu S. 2011. Extracelluler biosynthesis of silver annoparticles
using the micorrhizal mushroom Tricholoma crassum (Berk.) SACC.: Its
antimicrobial activity against pathogenic bacteria and fungus, including
multidrug resistant plant and human bacteria. Digest Journal of
Nanomaterials and Biostructures 6(3):1289-1299.
Rifai MA. 1995. The biodiversity of Indonesian microbial diversity. Regional
Workshop on Culture Collection of Microorganism in Southeast Asia. June 10-20, 1995. Yogyakarta (ID): Gadjah Mada University.
Roby MHH, Sarhan MA, Selim KAH, Khalel KI. Antioxidant and antimicrobial
activities of essential oil and extracts of fennel (Foeniculum vulgare L.) and
chamomile (Matricaria chamomilla L.). Industrial Crops and Products.
Setyaningsih I. 2010. Kultivasi dan karakterisasi komponen aktif dan nutrisi dari
mikroalga laut Chaetoceros gracilis [disertasi]. Bogor (ID): Sekolah Pasca
Sarjana, Institut Pertanian Bogor.
Sunatmo TI. 2009. Mikrobiologi Esensial. Jilid 1. Jakarta (ID): Ardy Agency.
Tarman K. 2011. Biological and chemical investigations of Indonesian marine-derived fungi and their secondary metabolites. [disertasi]. Greifswald (DE): Ernst-Moritz-Arndt-Universitat Greifswald.
Vahabi K, Mansoori GA, Karimi S. 2011. Biosynthesis of silver nanoparticles by
fungus Trichoderma reesei (a route for large scale production of AgNPs).
Insciences Journal 1(1):65-79.
Winarno FG, Fernandez IE. 2010. Nanoteknologi bagi Industri Pangan dan
20
21
Lampiran 1 Aktivitas antibakteri Veronaea sp. KT19
Bakteri uji
Diameter zona hambat (mm)
Jumlah ekstrak hari ke-6 Jumlah ekstrak hari ke-12
0,5 mg 1 mg 2 mg 0,5 mg 1 mg 2 mg
Escherichia coli 12 11 14 15,5 15 16 0 1 2 1 3 2
Bacillus subtilis 3 6 9 10 15 11 1 1 2 1 4 6
Lampiran 2 Aktivitas antibakteri nanosilver ekstraseluler Veronaea sp. KT19
Mikroorganisme uji
Diameter zona hambat (mm) Perlakuan
A6 A12 B6 gelap B6 terang B12 gelap B12 terang
Bacillus subtilis 5,5 4,5 5 6,5 4,5 5
Escherichia coli 6 5 5 6,5 4,5 5
Pseudomonas aeruginosa 6 5 5 5,5 5 4,5
Staphylococcus aureus 6 5 5 5 5,5 5
Candida maltosa 5,5 5 5,5 5 5,5 6
Lampiran 3 Spektrum UV-Vis spektrofotometer B6 gelap
Pengamatan jam ke-144
22
Lampiran 4 Spektrum UV-Vis spektrofotometer B6 terang Pengamatan jam ke-144
Panjang gelombang maksimal : 266 nm Absorbansi : 0,711
Lampiran 5 Spektrum UV-Vis spektrofotometer B12 gelap Pengamatan jam ke-72
23
Lampiran 6 Spektrum UV-Vis spektrofotometer B12 terang Pengamatan jam ke-72
24
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jember pada tanggal 25 Mei 1991 dari pasangan bapak Sunan Hadi dan ibu Cholifah, dan merupakan anak ketiga dari tiga bersaudara.Pendidikan formal yang ditempuh penulis dimulai dari SD Negeri 01 Patrang Jember dan lulus pada tahun 2003. Pada tahun yang sama melanjutkan pendidikan SLTP Negeri 2 Jember yang lulus pada tahun 2006,dan melanjutkan pendidikan di SMA Negeri 2 Jember dan lulus pada tahun 2009.Pada tahun 2009, penulis melanjutkan pendidikan ke jenjang yang lebih tinggi yaitu program Strata 1 (S1) Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur USMI.
Selama mengikuti perkuliahan, penulis aktif dalam kegiatan organisasi
sebagai anggota Himpunan Mahasiswa Teknologi Hasil Perikanan
(HIMASILKAN) IPB divisi pengembangan sumber daya manusia periode 2010-2011, anggota Ikatan Mahasiswa Jawa Timur (IMAJATIM) divisi budaya olahraga dan seni periode 2010-2012 dan bendahara Ikatan Mahasiswa Jember di Bogor (IMJB) periode 2010-2012. Penulis juga merupakan tim bola basket FPIK periode 2010-2013. Penulis telah melaksanakan Praktik Lapangan di PT Istana Cipta Sembada, Banyuwangi dengan judul Penerapan Sanitasi dan Higiene pada
Proses Pembekuan Udang (Penaeus vannamei) di PT. Istana Cipta Sembada,
Banyuwangi.
Penulis pernah menjadi asisten praktikum Teknologi Pengolahan Hasil Perairan I (2012), Teknologi Pengolahan Hasil Perairan II (2013), Teknologi Pengolahan Hasil Perairan (2013), Teknologi Produk Tradisional Hasil Perairan (2013) dan Penanganan Hasil Perairan (2013). Penulis juga aktif mengikuti lomba karya tulis tingkat nasional. Beberapa prestasi yang pernah diraih yaitu Pekan
Kreativitas Mahasiswa bidang kewirausahaaan (PKM-K) dengan judul „Steak