PERTUMBUHAN DAN KUALITAS DAGING IKAN PATIN
SIAM YANG DIBERI PAKAN DENGAN KADAR PROTEIN
BERBEDA DAN DIPERKAYA HORMON PERTUMBUHAN
REKOMBINAN
RENI AGUSTINA LUBIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Pertumbuhan dan Kualitas Daging Ikan Patin Siam yang Diberi Pakan dengan Kadar Protein Berbeda dan Diperkaya Hormon Pertumbuhan Rekombinan” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
Reni Agustina Lubis
RINGKASAN
RENI AGUSTINA LUBIS. Pertumbuhan dan Kualitas Daging Ikan Patin Siam yang Diberi Pakan dengan Kadar Protein Berbeda dan Diperkaya Hormon Pertumbuhan Rekombinan. Dibimbing oleh ALIMUDDIN dan NUR BAMBANG PRIYO UTOMO
Ikan patin siam Pangasianodon hypophthalmus adalah salah satu komoditas budidaya ikan air tawar yang memerlukan waktu relatif lama untuk mencapai ukuran konsumsi. Produksi induk dan benih unggul dapat dilakukan menggunakan metode hibridisasi, triploidisasi, seleksi ikan, dan transgenesis tetapi memerlukan waktu relatif lama karena regenerasi induk ikan patin yang cukup lama. Alternatif lain adalah pemberian hormon pertumbuhan rekombinan (recombinant growth hormone/rGH). Aplikasi rGH dapat dilakukan menggunakan metode injeksi, perendaman dan melalui pakan. Aplikasi rGH melalui pakan lebih praktis dengan jumlah ikan yang lebih banyak. Pemberian rGH pada pakan dengan kadar protein berbeda diharapkan mampu meningkatkan pertumbuhan melalui protein sparing effect. Oleh karena itu, penelitian ini bertujuan mengevaluasi penggunaan hormon pertumbuhan rekombinan pada pakan dengan kadar protein berbeda terhadap kinerja pertumbuhan dan kualitas daging ikan patin siam.
Protein rGH yang telah disalut (coating) dengan kuning telur ayam dicampur dengan pakan komersial berkadar protein berbeda (23%, 28%, dan 32%) dengan dosis kering 2 mg/kg pakan masing-masing perlakuan, dan kontrol tanpa penambahan rGH. Setiap perlakuan memiliki 3 ulangan. Ikan patin (bobot awal : 110.66 ±0.66 g) diberi pakan mengandung rGH 2 kali seminggu (bulan pertama dan bulan ketiga), dua kali sehari. Feeding rate yang digunakan adalah 3% dari biomassa ikan. Pemeliharaan ikan dilakukan selama 4 bulan pada kolam beton berukuran 200 m2 yang dipasang hapa berukuran 2x1x1.5 m3 dengan padat tebar 20 ekor per hapa. Parameter yang diuji meliputi pertambahan bobot, laju pertumbuhan spesifik (LPS), jumlah konsumsi pakan (JKP), rasio konversi pakan (RKP), tingkat kelangsungan hidup (TKH), retensi protein (RP) dan lemak (RL), indeks hepatosomatik (IHS), karkas, dan lemak perut. Analisis data dengan tabel sidik ragam dilakukan menggunakan software statistik Minitab 16. Ekspresi gen growth hormone (GH) dianalisis secara deskriptif.
pakan berprotein 32% tanpa suplementasi rGH menghasilkan nilai yang sama perlakuan pakan protein 32% dengan penambahan rGH (P>0,05).
Analisis semi-kuantitatif PCR menunjukkan bahwa ekspresi gen GH di otak ikan saat 24 jam pasca perlakuan rElGH lebih tinggi dibandingkan kontrol. Hal tersebut mengindikasikan bahwa pemberian rElGH menginduksi ekspresi GH endogen. Namun demikian, peningkatan ekspresi GH endogen tidak mempengaruhi pertumbuhan ikan patin (P>0,05). Pada penelitian ini penyebab ekspresi GH endogen lebih tinggi pada perlakuan pakan 23% daripada 28% belum diketahui. Namun demikian, kadar lemak ikan perlakuan pakan 23% dan 28% yang disuplementasi rElGH menurun dibandingkan kontrolnya. Sebagai kesimpulan, pemberian pakan berkadar protein 28% dan diperkaya rElGH memberikan kinerja pertumbuhan dan kualitas daging yang baik pada pembesaran ikan patin.
SUMMARY
RENI AGUSTINA LUBIS. Growth Performance and Flesh Quality of Striped Catfish Fed Diets with Different Protein Level and Enriched by Recombinant Fish Growth Hormone. Supervised by ALIMUDDIN and NUR BAMBANG PRIYO UTOMO
Striped catfish Pangasianodon hypophthalmus is one of the freshwater fish farming commodities that requires a relatively long time to reach consumption size. Broodstock and superior seed production can be performed using hybridization, triploidyzation, selection, and transgenesis but require a relatively long time for regeneration. Another alternative ways is administration of recombinant growth hormone (recombinant growth hormone/rGH). Application of rGH can be done by injection, immersion and feed supplementation. The application of rGH using feed supplementation is more practically in large quantities of fish. Supplementation of rGH on feed with different protein levels are expected to increase growth rate through protein sparing effect. Therefore, this study aimed to evaluate application of rGH on feed with different protein levels on growth performance and product quality striped catfish.
The rGH coated with chicken egg yolk at a dry-based dose of 2 mg/kg of feed was sprayed onto commercial feed with different protein levels (23%, 28%, and 32%). Each treatment has a control without rGH supplementation and three replications. Striped catfish (initial weight: 110.66 ± 0.66 g) was fed diets containing rGH 2 times a week (first month and third month) and two times a day. Feeding rate was 3% of fish biomass. Fish were reared in concrete pond 200 m2 insulated with nets measuring 2x1x1.5m3 with a density of 20 fish nets-1 for 4 months. Test parameters were observed including weight gain, specific growth rate, feed consumption, feed conversion ratio, survival rate, protein retention, lipid retention, hepatosomatic index, edible portion, belly fat and growth hormone gene expression. All data were further analyzed statistically using ANOVA with Minitab 16.0 statistical software. Growth hormone expression was analyzed descriptively.
The results showed that rGH supplementation on different protein level in feed have different effects (P <0.05) on wet body lipid levels. Exceptions, in the group of feed protein 23% with rGH supplementation showed a decrease in body fat levels, fat content of fish meat and fat retention than the control group 23% protein diet without rGH supplementation and not significantly different with the group 23% protein diet with rGH supplementation. Furthermore weight gain, SGR protein diet in the group of fish fed 28% protein diet enriched with rGH and the group of fish fed 32% protein diet without rGH supplementation was the same as in that of 32% protein diet with rGH supplementation (P>0.05).
This indicated that administration of rElGH induces the expression of endogenous GH. However, the increasing of endogenous GH does not affect the growth of catfish (P>0.05). In this study is not known yet the cause of increasing of endogenous GH gene expression in treatment 23% protein diet compared to treatment 28% protein diet. However, the fat content of fish fed treatment 23% and 28% protein diet supplemented rElGH decreased compared to controls. In conclusion, feeding 28% protein diet with rElGH supplementation provides good growth performance and flesh quality in grow-out of striped catfish.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PERTUMBUHAN DAN KUALITAS DAGING IKAN PATIN
SIAM YANG DIBERI PAKAN DENGAN KADAR PROTEIN
BERBEDA DAN DIPERKAYA HORMON PERTUMBUHAN
REKOMBINAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah Tesis ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak bulan November 2015 sampai Mei 2016 dengan tema tentang rekayasa budidaya ikan patin siam. Judul penelitian ini adalah “ Pertumbuhan dan kualitas daging ikan patin siam yang diberi pakan dengan kadar protein berbeda dan diperkaya hormon pertumbuhan rekombinan”.
Penulis menyadari bahwa keberhasilan dalam menyelesaikan penelitian ini tidak semata didapatkan sendiri, namun tidak terlepas dari segala bantuan dan dukungan berbagai pihak, baik ide, pemikiran, tenaga, moril dan material. Oleh
karena itu penulis menyampaikan rasa terima kasih mendalam kepada Dr. Alimuddin, S.Pi, M.Sc dan Dr. Ir. Nur Bambang Priyo Utomo, M.Si sebagai
komisi pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian sampai pada penulisan tesis. Penulis juga menyampaikan rasa terima kasih kepada Dr. Ir. Odang Carman, M.Sc sebagai dosen penguji luar komisi dan Dr. Mia Setiawati, M.Si sebagai komisi program studi yang telah memberikan saran dan masukan dalam ujian sidang tesis ini.
Terima kasih kepada Kepala Balai Perikanan Budidaya Air Tawar (BPBAT) Jambi ketika penulis memulai studi S2 yang telah memberikan nasehat, motivasi dan dukungan dalam penyelesaian studi S2 yang penulis lakukan. Terima kasih disampaikan kepada Badan Pengembangan Sumber Daya Manusia Kelautan dan Perikanan (BPSDM-KP) yang telah memberikan beasiswa kepada penulis untuk melanjutkan studi S2 di Sekolah Pascasarjana Institut Pertanian Bogor.
Terima kasih dan penghargaan yang tinggi penulis haturkan kepada ayahanda H. Pardamean Lubis (alm) dan Ibunda Hj. Rabiah Nasution atas doa, dukungan dan semangatnya. Kepada suamiku, Janu Dwi Kristianto, M.IL yang selalu memberikan dukungan, doa, kesabaran dan kasih sayang yang sangat berarti dan kepada anakku (Fakhrie Zhafran Khairy Husen) yang menjadi penyemangat dan harapan penulis. Terima kasih kepada Ayah mertua Edi Junaidy Husen (alm), Ibu mertua Pamiarsih atas segala semangat dan doa yang diberikan. Kepada adikku M. Riza Zulfi Lubis, SE dan H. M. Yahdinin Lubis, S.HI; kakak ipar Novie Karunia Sari, A.Md serta adik ipar Dede Tri Kurniawan, M.Pd; terima kasih untuk semua cinta, doa dan perhatiannya.
Terima kasih kepada rekan-rekan mahasiswa Program Studi Ilmu Akuakultur Angkatan 2014 atas kebersamaan, kekompakan, kerjasama serta
motivasinya dalam menempuh studi. Kepada Suardi Laheng, M.Si, Hasan Nasrullah, Sulasy Rohmy, Megawati W, Sucly Aldis, Sumitro, Ainun Putri
Saribanun K, Anny Hary Ayu, Ibu Lina Mulyani, Mba Retno, Bapak Wasjan serta Bapak Henda atas kebersamaan dan kerjasamanya selama penelitian.
Penulis telah berusaha semaksimal mungkin dalam penyelesaian karya ilmiah ini. Dengan harapan, karya ilmiah ini dapat bermanfaat bagi penulis dan para pembaca pada umumnya.
Bogor, Desember 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
1. PENDAHULUAN 1
Latar belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 3
Waktu dan Tempat 3
Produksi rGH 3
Pakan Uji 3
Pemeliharaan Ikan dan Pengambilan Data 4
Parameter Uji 4
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 11
4 SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Komposisi proksimat pakan uji (bobot kering) 3 2 Bobot akhir (Bt, g individu-1), penambahan bobot tubuh
(g individu1), laju pertumbuhan spesifik (LPS, % hari-1), jumlah konsumsi pakan, (JKP, g individu-1), dan rasio konversi pakan
(RKP, %) 8
3 Kadar air, protein dan lemak tubuh ikan patin siam (% bobot basah), serta retensi protein (%) dan retensi lemak (%) yang diberi pakan perlakuan hormon pertumbuhan rekombinan 8 4 Kualitas daging (filet, % ) dan lemak perut (belly fat, %) ikan patin
siam yang diberi pakan dengan penambahan hormon pertumbuhan
rekombinan 9
5 Indeks hepatosomatik (HIS), kadar air, lemak, dan glikogen hati
ikan patin siam 10
DAFTAR LAMPIRAN
1 Prosedur analisis proksimat 19
2 Prosedur analisis kadar glikogen hati 21
3 Prosedur analisis ekspresi gen GH 22
1
PENDAHULUAN
Latar Belakang
Ikan patin siam Pangasianodon hypophthalmus merupakan komoditas budidaya ikan air tawar yang berkembang cukup pesat di Indonesia. Kenaikan rata-rata produksi ikan patin Indonesia dari Tahun 2010-2014 mencapai 31,63% (SIDATIK 2015). Kendala umum yang dihadapi pembudidaya ikan antara lain harga pakan ikan yang meningkat dengan harga jual ikan yang tetap stabil. Ikan patin memiliki pertumbuhan yang lambat, dibutuhkan waktu 6-7 bulan untuk mencapai ukuran 400-600 gram dengan ukuran tebar awal 5-8 cm (SNI 2002). Masa pemeliharaan yang cukup lama dengan harga pakan yang terus meningkat berimbas pada biaya produksi yang cukup tinggi dan terbatasnya margin keuntungan yang diterima pembudidaya ikan. Tepung ikan merupakan salah satu sumber protein utama. Secara umum kualitas pakan dilihat dari kandungan proteinnya. Semakin tinggi kandungan protein, maka harga pakan tersebut semakin mahal terkait dengan harga tepung ikan yang relatif tinggi saat ini. Pakan merupakan komponen biaya yang paling besar dalam menunjang keberhasilan usaha budidaya ikan. Pada sistem budidaya semi-intensif, biaya pakan berkisar 30-60% dari total biaya produksi (Hasan 2010).
Protein merupakan bahan utama yang dibutuhkan dalam pertumbuhan (Halver & Hardy 2002). Protein dapat dimanfaatkan untuk pertumbuhan apabila kandungan lemak dan karbohidrat seimbang, jika tidak maka protein akan digunakan untuk energi dibandingkan untuk pertumbuhan (Craigh & Helfich 2002). Dengan kata lain, penambahan nutrien non-protein sebagai penghasil energi dapat menurunkan penggunaan protein sebagai sumber energi (protein sparing effect) sehingga dapat meningkatkan fungsi protein dalam menunjang pertumbuhan ikan (Hasan & Khan 2013).
Upaya lain untuk menghasilkan benih berkualitas tinggi adalah melalui aplikasi rekayasa genetik, diantaranya aplikasi protein rekombinan, hibridisasi, triploidisasi, seleksi dan teknologi transgenesis. Salah satu pendekatan yang terbukti mampu meningkatkan laju pertumbuhan adalah pendekatan bioteknologi molekuler antara lain melalui aplikasi hormon pertumbuhan rekombinan (recombinant growth hormone; rGH). Hormon pertumbuhan adalah hormon peptida yang berasal dari kelenjar pituitari bagian anterior berperan dalam pengaturan pertumbuhan dan metabolisme serta kesetimbangan energi (Bartke 2005).
Pemberian rGH dapat dilakukan melalui pakan, penyuntikan/injeksi dan melalui perendaman. Pemberian rGH secara oral melalui pakan lebih praktis dengan jumlah ikan yang lebih banyak. Penelitian mengenai penambahan rGH pada pakan terbukti mampu meningkatkan laju pertumbuhan ikan channel catfish
(Silverstein et al. 2000), ikan baronang Siganus sp. (Funkenstein et al. 2005), ikan sidat Anguilla sp. (Handoyo et al. 2012), ikan nila Oreochromis niloticus
(Muhammad et al. 2013), dan ikan gurami Osphronemus goramy (Budi et al.
2014).
2
(2014) menunjukkan pemberian pakan dengan kadar protein berbeda yang diperkaya rGH mampu meningkatkan pertumbuhan dan efisiensi pemanfaatan protein pada benih ikan gurami. Selanjutnya Rasmussen et al. (2001) menyatakan bahwa pemberian rGH dapat menurunkan kadar lemak dan meningkatkan sintesis protein dalam tubuh, kandungan lemak yang lebih rendah pada ikan dengan laju pertumbuhan yang lebih cepat menunjukkan protein sparing effect yang terjadi seiring dengan meningkatnya level GH. Kobayashi et al. (2007) juga menyebutkan bahwa hormon pertumbuhan dapat meningkatkan retensi dan penyerapan protein serta mereduksi ekskresi amonia. Hal ini memberikan informasi penting dalam rangka meningkatkan efisiensi penggunaan pakan. Tujuan penelitian ini adalah untuk mengevaluasi efek penggunaan hormon pertumbuhan rekombinan pada pakan dengan kadar protein berbeda terhadap pertumbuhan dan kualitas daging ikan patin siam.
Perumusan Masalah
Pembesaran ikan patin siam untuk mencapai ukuran ikan konsumsi membutuhkan waktu relatif lama. Hal ini berdampak pada kebutuhan pakan yang meningkat yang berimbas kepada biaya produksi yang tinggi. Permasalahan yang dihadapi oleh pembudidaya ikan patin, kenaikan harga pakan tidak diikuti dengan peningkatan harga jual ikan sehingga banyak dari pembudidaya menggunakan pakan murah yang umumnya dengan kadar protein rendah. Dampak yang ditimbulkan dari penggunaan pakan tersebut diduga menyebabkan pertumbuhan ikan yang lambat serta konversi pakan tinggi. Salah satu pendekatan molekuler yang dikembangkan dalam meningkatkan laju pertumbuhan adalah melalui aplikasi hormon pertumbuhan rekombinan. Pemberian rGH pada pakan dengan kadar protein berbeda pada pembesaran ikan patin diharapkan mampu memberikan hasil yang lebih baik pada pakan berkadar protein lebih rendah melalui protein sparing effect pada pakan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi efek penggunaan hormon pertumbuhan rekombinan pada pakan dengan kadar protein berbeda terhadap kinerja pertumbuhan dan kualitas daging ikan patin siam
Manfaat Penelitian
3
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2015 sampai Mei 2016. Penyiapan pakan mengandung rGH ikan kerapu kertang (rElGH) dan analisa ekspresi gen GH dilakukan di Laboratorium Reproduksi & Genetika Organisme Akuatik Departemen Budidaya Perairan, dan pemeliharaan ikan dilakukan di Kolam Percobaan Fakultas Perikanan dan Ilmu Kelautan. Analisis proksimat dilakukan di Laboratorium Nutrisi Ikan. Analisis kualitas air dilakukan di Laboratorium Lingkungan Departemen Budidaya Perairan FPIK IPB.
Produksi rGH
Produksi rElGH dalam bentuk protein total dilakukan dengan menggunakan bakteri Escherichia coli strain BL21 yang mengandung vektor ekspresi protein pCold/rElGH. Metode kultur bakteri dan metode koleksi rGH dilakukan seperti dijelaskan oleh Alimuddin et al. (2010).
Pakan Uji
Pakan uji yang digunakan dalam penelitian ini adalah pakan komersial dengan kadar protein berbeda, yaitu pakan A (protein 23%), pakan B (protein 28%), dan pakan C (protein 32%). Hasil analisis proksimat pakan uji disajikan pada Tabel 1. Sebanyak 2 mg rElGH (kering) dilarutkan dalam 15 ml PBS (phosphate buffer saline) dan dicampurkan dengan 20 mg kuning telur ayam yang berfungsi sebagai pengikat (binder). Setelah dihomogenisasi menggunakan vortex, campuran kuning telur dengan rElGH disemprotkan merata pada 1 kg pakan (Hardiantho et al. 2012). Penyalutan pakan dengan kuning telur dan PBS juga dilakukan pada pakan kontrol. Setiap perlakuan pakan memiliki kontrol tanpa penambahan rElGH. Setiap perlakuan dan kontrol diulang sebanyak tiga kali. Tabel 1. Komposisi proksimat pakan uji (bobot kering)
4
Pemeliharaan Ikan dan Pengambilan Data
Benih ikan patin siam (bobot awal: 110,66±1,32 g) dipelihara di kolam beton ukuran 200 m2 menggunakan hapa berukuran 2×1×1,5 m3 dengan padat tebar 20 ekor/hapa. Benih ikan patin siam yang digunakan berasal dari Balai Layanan Usaha Produksi Perikanan Budidaya (BLUPPB) Karawang. Pada awal pemeliharaan dilakukan proses aklimatisasi selama dua minggu. Pada akhir aklimatisasi, ikan dipuasakan selama 24 jam untuk menghilangkan pengaruh sisa pakan dalam tubuh ikan. Kemudian ikan ditimbang untuk mengetahui bobot awal. Tiga ekor ikan diambil untuk uji proksimat tubuh ikan awal.
Ikan dipelihara selama 4 bulan, dan diberi pakan dengan feeding rate 3% dari biomassa ikan, dua kali sehari (pagi dan sore). Pemberian pakan mengandung rElGH dilakukan dua kali seminggu dengan interval waktu 3 hari pada bulan pertama dan bulan ketiga, dan pakan tanpa rElGH pada hari lainnya. Sampling bobot ikan dilakukan setiap 20 hari sekali. Pada akhir pemeliharaan, ikan dipuasakan selama 24 jam, selanjutnya jumlah ikan dihitung dan bobot ditimbang. Setelah penimbangan bobot akhir, sampel ikan diambil secara acak 3 ekor tiap ulangan untuk analisis proksimat tubuh dan daging, karkas, lemak perut dan indeks hepatosomatik (IHS). Kualitas air kolam pemeliharaan selama penelitian, yaitu suhu air berkisar 29-34C, pH 7,05-7,51, DO (dissolved oxygen) berkisar 4,20-7,60 mg L-1 dan TAN (total ammonium nitrogen) 0,12-0,80 mg L-1.
.
Parameter Uji
Parameter yang dievaluasi pada penelitian ini adalah pertambahan bobot, laju pertumbuhan spesifik (LPS), jumlah konsumsi pakan (JKP), rasio konversi pakan (RKP), tingkat kelangsungan hidup (TKH), analisis proksimat pakan, tubuh dan daging ikan, indeks hepatosomatik (IHS), lemak hati, lemak perut, karkas, dan analisis ekspresi gen penyandi hormon pertumbuhan (GH, growth hormone). Pertambahan Biomassa, LPS, dan RKP
Bobot tubuh ikan diukur setiap 20 hari sampai akhir percobaan. Pertambahan biomassa dihitung berdasarkan persamaan:
Pertambahan biomassa = Bt−B0
Keterangan:
Bt = Biomassa pada akhir perlakuan (g) B0 = Biomassa pada awal perlakuan (g)
Laju pertumbuhan spesifik (LPS) ikan uji dihitung berdasarkan persamaan yang dikemukakan oleh Huisman (1987), yaitu:
LPS (%) =
Keterangan:
5 Wt = Rata-rata bobot individu pada waktu akhir pemeliharaan (g)
W0 = Rata-rata bobot individu pada waktu awal pemeliharaan (g) t = Lama waktu pemeliharaan (hari)
Rasio konversi pakan (RKP) dihitung dengan menggunakan persamaan yang dikemukakan oleh Guillaume et al. (1999), yaitu:
RKP =
Keterangan:
RKP = Rasio konversi pakan
P = Jumlah pakan yang diberikan selama pemeliharaan (g) Wt = Biomassa ikan pada waktu akhir pemeliharaan (g) W0 = Biomassa ikan pada awal pemeliharaan (g)
Wm = Bobot ikan yang mati selama pemeliharaan (g)
Tingkat Kelangsungan Hidup (TKH)
Tingkat kelangsungan hidup (TKH) dihitung menggunakan rumus (Asdari
et al. 2011), yaitu:
TKH (%) =
Keterangan :
TKH = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan pada akhir pengamatan (ekor) N0 = Jumlah ikan pada awal pengamatan (ekor) Retensi Protein dan Retensi Lemak
Nilai retensi protein dihitung berdasarkan persamaan (Takeuchi, 1988) RP (%) =
Keterangan :
RP = Retensi protein (%)
Fp = Kandungan protein tubuh pada pada akhir percobaan (g) I = Kandungan protein tubuh pada pada awal percobaan (g) P = Jumlah protein yang dikonsumsi (g)
Nilai retensi lemak dihitung berdasarkan persamaan (Takeuchi, 1988)
RL (%)
=
Keterangan :
6
Fl = Kandungan lemak tubuh pada pada akhir percobaan (g) I = Kandungan lemak tubuh pada pada awal percobaan (g) L = Jumlah lemak yang dikonsumsi (g)
Analisis Proksimat
Analisis proksimat (Lampiran 1 dan 2) dilakukan terhadap pakan dan daging ikan pada awal dan akhir masa pemeliharaan dengan cara mengambil sebanyak tiga ekor ikan secara acak setiap perlakuan. Analisis proksimat untuk kadar air menggunakan metode pemanasan dalam oven bersuhu 105-110ºC, serat kasar menggunakan metode pelarutan contoh dengan asam dan basa lemah, dan pemanasan; protein kasar menggunakan metode Kjeldahl; lemak kering menggunakan metode Soxchlet; lemak basah menggunakan metode Folch; kadar abu dengan pemanasan dalam tanur bersuhu 600 ºC (Takeuchi, 1988)
Bobot Karkas dan Lemak Perut
Untuk pengukuran karkas, dan lemak perut dilakukan dengan cara mengambil sebanyak tiga ekor ikan secara acak dari setiap perlakuan dan kontrol pada akhir pemeliharaan.
× 100
Bobot Karkas (%) =
Lemak perut atau lemak bagian perut dihitung pada akhir penelitian berdasakan bobot lemak perut (g) dibagi dengan bobot tubuh ikan (g) (Suryaningrum et al. 2010) dengan menggunakan rumus :
Lemak perut
(%) =
× 100
Analisis Organ Hati
Pada akhir masa penelitian, sebanyak tiga ekor ikan dari setiap perlakuan diambil secara acak untuk dilakukan analisis kadar air, lemak dan IHS (indeks hepatosomatik). IHS diukur dengan menimbang bobot hati ikan dibandingkan dengan bobot tubuh ikan patin hasil perlakuan. IHS dihitung dengan menggunakan rumus (Kiritnikom 2012), yaitu:
7 Analisis Ekspresi Gen Penyandi Pertumbuhan (GH )
Analisis ekspresi gen penyandi pertumbuhan (GH). dilakukan untuk mendapatkan informasi tentang ekspresi gen GH akibat pemberian rGH eksogen dengan cara mengambil sampel hipofisa dari tiga ekor ikan patin siam pada masing-masing perlakuan dan digabung (Lampiran 3). Pengambilan sampel dilakukan di akhir perlakuan, yaitu setelah pemberian pakan rGH diberhentikan selama 4 minggu. Pemberian pakan yang mengandung rGH dan pakan kontrol dilakukan setelah ikan dipuasakan sehari (untuk mengosongkan isi lambung sebelum pemberian GH). Hipofisa diambil pada jam ke-24 setelah perlakuan. Tahapan ekstraksi RNA dan sintesis cDNA GH dilakukan seperti yang dijelaskan Safir (2012)
Analisis Data
Penelitian ini menggunakan rancangan faktorial dengan dua faktor, yaitu pemberian hormon pertumbuhan rekombinan dan pakan dengan kadar protein berbeda. Setiap perlakuan memiliki 3 ulangan. Data yang diperoleh ditabulasi dengan Ms. Excel 2013 dan uji ANOVA dianalisis dengan menggunakan program MINITAB 16. Perlakuan yang berbeda nyata diuji lanjut dengan uji Tuckey. Data kualitas air dan ekspresi gen GH dianalisis secara deskriptif.
3
HASIL DAN PEMBAHASAN
Hasil Pertumbuhan dan kelangsungan hidup
8
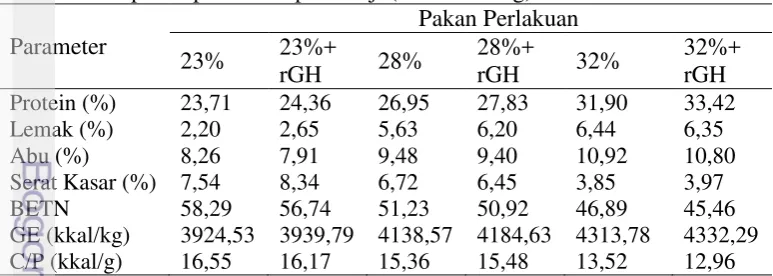
Tabel 2 Bobot akhir (Bt, g individu-1), penambahan bobot tubuh (g individu-1),
laju pertumbuhan spesifik (LPS, % hari-1), jumlah konsumsi pakan (JKP, g individu-1), dan rasio konversi pakan (RKP, %)
Perlakuan
1418,67±44,43b 308,00±44,48b 1,11±0.09c 537,33±20.06c 1,77±0.25a
rGH 436,60±29,87b 325,92±29,95b 1,15±0.06bc 553,67±72.63bc 1,69±0.07ab
28% tanpa rGH 547,71±20,52ab 437,06±20,52ab 1,34±0.03ab 604,07±37.31abc 1,38±0.06bc
rGH 646,81±57,22a 536,13±57,23a 1,48±0.07a 685,43±52.67ab 1,28±0.07c
32% tanpa rGH 608,45±74,75a 497,80±74,69a 1,43±0.11a 664,73±36.71abc 1,35±0.14c
rGH 690,94±65,36a 580,26±65,28a 1,54±0.08a 700,28±76.04a 1,21±0.00c
Two-way ANOVA
Protein Pakan (P) P<0,00 P<0,00 P<0,00 P<0,00 P<0,00
rGH (R) P<0,02 P<0,02 P<0,02 P<0,10 P<0,10
PxR (Interaksi) P<0,39 P<0,39 P<0,52 P<0,57 P<0,89
Standard Error 52,30 52,30 0,08 53,19 0,13
* tanpa rGH: pakan uji tanpa penambahan rElGH
*Huruf superskrip yang berbeda pada kolom yang sama menunjukkan secara statistik berbeda nyata antar perlakuan (P<0,05).
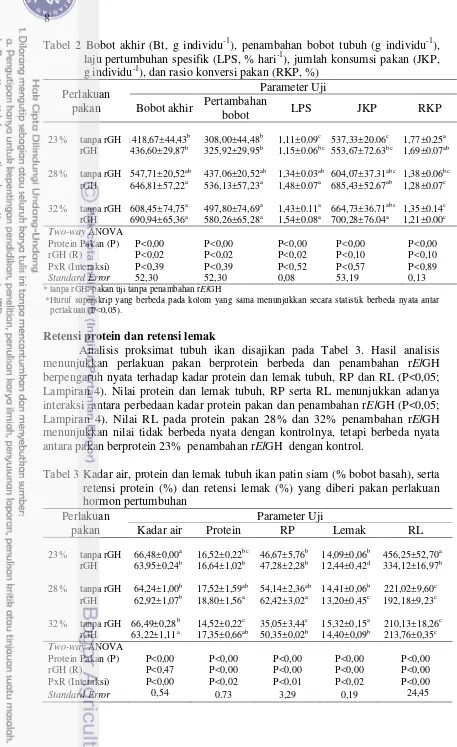
Retensi protein dan retensi lemak
Analisis proksimat tubuh ikan disajikan pada Tabel 3. Hasil analisis menunjukkan perlakuan pakan berprotein berbeda dan penambahan rElGH berpengaruh nyata terhadap kadar protein dan lemak tubuh, RP dan RL (P<0,05; Lampiran 4). Nilai protein dan lemak tubuh, RP serta RL menunjukkan adanya interaksi antara perbedaan kadar protein pakan dan penambahan rElGH (P<0,05; Lampiran 4). Nilai RL pada protein pakan 28% dan 32% penambahan rElGH menunjukkan nilai tidak berbeda nyata dengan kontrolnya, tetapi berbeda nyata antara pakan berprotein 23% penambahan rElGH dengan kontrol.
Tabel 3 Kadar air, protein dan lemak tubuh ikan patin siam (% bobot basah), serta retensi protein (%) dan retensi lemak (%) yang diberi pakan perlakuan
23% tanpa rGH 66,48±0,00a 16,52±0,22bc 46,67±5,76b 14,09±0,06b 456,25±52,70a
rGH 63,95±0,24b 16,64±1,02b 47,28±2,28b 12,44±0,42d 334,12±16,97b
28% tanpa rGH 64,24±1,00b 17,52±1,59ab 54,14±2,36ab 14,41±0,06b 221,02±9,60c
rGH 62,92±1,07b 18,80±1,56a 62,42±3,02a 13,20±0,45c 192,18±9,23c
32% tanpa rGH 66,49±0,28b 14,52±0,22c 35,05±3,44c 15,32±0,15a 210,13±18,26c
rGH 63,22±1,11a 17,35±0,66ab 50,35±0,02b 14,40±0,09b 213,76±0,35c
Two-way ANOVA
Protein Pakan (P) P<0,00 P<0,00 P<0,00 P<0,00 P<0,00
rGH (R) P<0,47 P<0,00 P<0,00 P<0,00 P<0,00
PxR (Interaksi) P<0,00 P<0,02 P<0,01 P<0,02 P<0,00
9
* tanpa rGH : pakan kontrol tanpa penambahan rElGH
* Huruf superskrip yang berbeda pada kolom yang sama menunjukkan secara statistik berbeda nyata antar perlakuan (P<0,05).
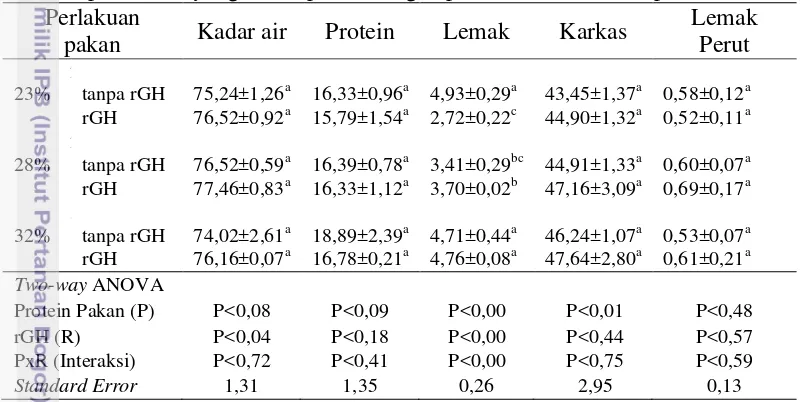
Kualitas daging ikan patin (filet) dan lemak perut (belly fat)
Pada Tabel 4 terlihat bahwa perlakuan pakan berprotein berbeda dengan penambahan rElGH berpengaruh nyata (P<0,05) pada kadar lemak daging ikan patin, tetapi tidak berbeda nyata pada kadar air, kadar protein, karkas dan lemak perut (P>0,05; Lampiran 4). Kadar lemak daging tertinggi terdapat pada ikan perlakuan pakan 23% tanpa suplementasi rGH, dan pakan 32% yang tidak dan diperkaya rGH. Pemberian rGH pada pakan 23% menurunkan kadar lemak daging ikan patin.
Tabel 4. Kualitas daging (filet, % ), karkas, dan lemak perut (belly fat, %) ikan patin siam yang diberi pakan dengan penambahan hormon pertumbuhan Perlakuan
pakan Kadar air Protein Lemak Karkas
Lemak Perut 2
23% tanpa rGH 75,24±1,26a 16,33±0,96a 4,93±0,29a 43,45±1,37a 0,58±0,12a
rGH 76,52±0,92a 15,79±1,54a 2,72±0,22c 44,90±1,32a 0,52±0,11a
2
28% tanpa rGH 76,52±0,59a 16,39±0,78a 3,41±0,29bc 44,91±1,33a 0,60±0,07a
rGH 77,46±0,83a 16,33±1,12a 3,70±0,02b 47,16±3,09a 0,69±0,17a
3
32% tanpa rGH 74,02±2,61a 18,89±2,39a 4,71±0,44a 46,24±1,07a 0,53±0,07a
rGH 76,16±0,07a 16,78±0,21a 4,76±0,08a 47,64±2,80a 0,61±0,21a
Two-way ANOVA
Protein Pakan (P) P<0,08 P<0,09 P<0,00 P<0,01 P<0,48
rGH (R) P<0,04 P<0,18 P<0,00 P<0,44 P<0,57
PxR (Interaksi) P<0,72 P<0,41 P<0,00 P<0,75 P<0,59
Standard Error 1,31 1,35 0,26 2,95 0,13
* tanpa rGH : pakan kontrol tanpa penambahan rElGH
* Huruf superskrip yang berbeda pada kolom yang sama menunjukkan secara statistik berbeda nyata antar perlakuan (P<0,05).
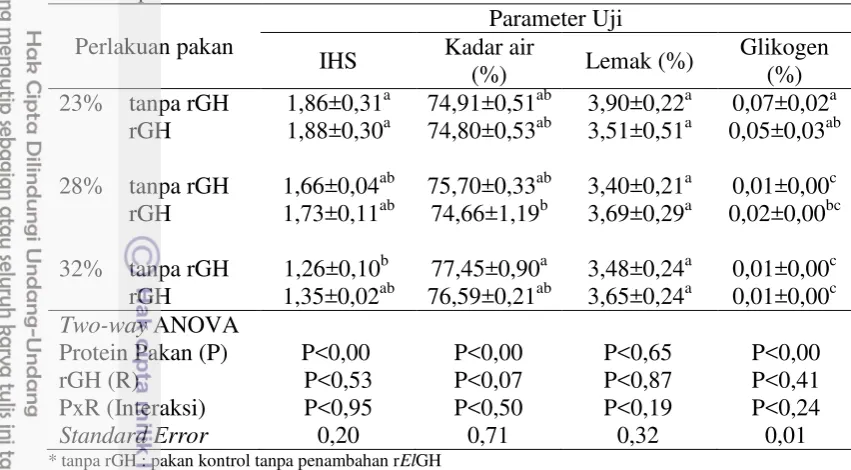
Indeks hepatosomatik (IHS), analisis kadar air, lemak dan glikogen hati
10
Tabel 5. Kadar air, lemak, glikogen dan indeks hepatosomatik (IHS) hati ikan patin siam
Perlakuan pakan
Parameter Uji IHS Kadar air
(%) Lemak (%)
Glikogen (%) 23% tanpa rGH 1,86±0,31a 74,91±0,51ab 3,90±0,22a 0,07±0,02a
rGH 1,88±0,30a 74,80±0,53ab 3,51±0,51a 0,05±0,03ab 28% tanpa rGH 1,66±0,04ab 75,70±0,33ab 3,40±0,21a 0,01±0,00c
rGH 1,73±0,11ab 74,66±1,19b 3,69±0,29a 0,02±0,00bc 32% tanpa rGH 1,26±0,10b 77,45±0,90a 3,48±0,24a 0,01±0,00c
rGH 1,35±0,02ab 76,59±0,21ab 3,65±0,24a 0,01±0,00c
Two-way ANOVA
Protein Pakan (P) P<0,00 P<0,00 P<0,65 P<0,00 rGH (R) P<0,53 P<0,07 P<0,87 P<0,41 PxR (Interaksi) P<0,95 P<0,50 P<0,19 P<0,24
Standard Error 0,20 0,71 0,32 0,01
* tanpa rGH : pakan kontrol tanpa penambahan rElGH
* Huruf superskrip yang berbeda pada kolom yang sama menunjukkan secara statistik berbeda nyata antar perlakuan (P<0,05).
Ekspresi Gen Penyandi Pertumbuhan (GH)
Pada penelitian ini, juga diukur level ekspresi GH. Sampel yang diukur ekspresinya berasal dari perlakuan pakan berprotein 23% dan pakan berprotein 28% dengan penambahan rGH dan kontrol masing-masing perlakuan. Pada pakan perlakuan 32% tidak dilakukan pengukuran ekspresi GH karena berdasarkan hasil yang diperoleh menunjukkan data pertumbuhan antara perlakuan pakan berprotein 32% tidak berbeda nyata dengan perlakuan pakan berprotein 28%. Hasil penelitian menunjukkan bahwa level ekspresi GH pada ikan perlakuan yang diberi pakan diperkaya dengan rElGH meningkat sebesar 39.33- 48.57% lebih tinggi dibandingkan kontrol.
11 hormon pertumbuhan rekombinan (rGH, bar putih), gambar kanan). Ekspresi mRNA gen β-aktin digunakan sebagai kontrol internal loading RNA total dalam sintesis cDNA. Kode A = pakan protein 23% + rGH; B = pakan protein 23%; C = pakan protein 28%+rGH; D = pakan protein 28%; K- = kontrol negatif
Pembahasan
Perlakuan pakan berprotein 23% dengan penambahan rElGH dan total energi yang lebih rendah (3924,53 kkal/kg) dan nilai rasio energi protein tinggi (16,17 kkal/g) menghasilkan penambahan bobot tubuh dan laju pertumbuhan spesifik yang rendah dibandingkan perlakuan pakan lainnya (P<0,05), dan tidak berbeda nyata dengan kontrol tanpa penambahan rGH (P>0,05; Lampiran 4). hormone transgenic carp) mencapai laju pertumbuhan yang lebih tinggi dibandingkan ikan mas kontrol (non transgenik) terutama dengan meningkatkan asupan pakan. Pada pakan dengan kadar protein tinggi, ikan mas transgenik mencapai tingkat pertumbuhan yang lebih tinggi melalui efisiensi konversi energi yang lebih tinggi. Perbedaan tersebut dapat disebabkan perbedaan spesies ikan. Menurut Hertz et al. (1991), efek rGH terhadap pertumbuhan, selain ditentukan oleh jenis rGH juga ditentukan oleh umur (age dependent) dan jenis ikan (species specific). Selain itu, hal tersebut diduga karena perbedaan total energi-protein 21% (4337,76 kkal/kg) dan rasio C/P (20,38) pakan uji yang digunakan pada penelitian Budi et al. (2014). Rasio energi protein (DE/P) pakan untuk ikan catfish
berkisar 7,4–12 kkal/g (Halver & Hardy 2002).
12
Nilai konversi pakan yang dihasilkan cenderung menurun sejalan dengan peningkatan kadar protein yang menunjukkan semakin rendah nilai konversi pakan, maka semakin efisien penggunaan pakan. Nilai konversi pakan pada perlakuan pakan berprotein 23% tanpa rGH tertinggi dibandingkan perlakuan lainnya. Nilai RKP pada perlakuan pakan berprotein 28 % dan 32% dengan penambahan rGH menunjukkan nilai yang tidak berbeda. Hasil yang diperoleh sejalan dengan pernyataan Liu et al. (2011), bahwa nilai konversi pakan menurun sejalan dengan peningkatan protein pakan.
Nilai retensi protein menunjukkan persentase bobot protein yang disimpan oleh tubuh. Nilai retensi protein tertinggi ditunjukkan pada perlakuan pakan protein 28% dengan penambahan rGH. Penurunan kadar lemak tubuh secara signifikan terjadi pada perlakuan pakan berprotein dengan penambahan rGH dibandingkan kontrol (P<0.05; Lampiran 4). Hasil ini sesuai dengan yang dilaporkan Safir (2012) bahwa perlakuan rGH pada pakan mampu menurunkan kadar lemak. Penelitian Kharisma (2009) mengenai pengaruh rasio karbohidrat dan kandungan lemak daging ikan patin dengan bobot awal 119,23 gram juga menunjukkan peningkatan rasio karbohidrat/lemak dalam pakan meningkatkan retensi lemak. Hal ini sesuai dengan hasil proksimat pakan uji yaitu pakan berprotein 23% memiliki rasio karbohidrat/lemak lebih tinggi dibandingkan perlakuan pakan yang lain (Tabel 1). Menurut Linder (1992), peningkatan kadar karbohidrat pakan diikuti penurunan kadar lemak akan menghasilkan retensi lemak yang semakin tinggi. Ikan akan menyintesis (biokonversi) lemak yang berasal dari nutrien non-lemak seperti karbohidrat menjadi asam-asam lemak dan trigliserida yang terjadi di hati dan jaringan lemak dikarenakan kekurangan asupan lemak. Sejalan dengan Kersten (2001) bahwa asam lemak dapat disintesis dari glukosa yang merupakan derivat dari karbohidrat jika asupan glukosa berlebih.
Kandungan protein daging pada semua perlakuan tidak berbeda nyata (15,79-18,89%). Hasil ini sedikit lebih tinggi dibandingkan dengan penelitian Poernomo et al. (2015) yaitu pemberian pakan berprotein 23-32% tanpa hormon menghasilkan kadar protein daging yang tidak berbeda (15,27-16,17%). Kandungan lemak daging ikan yang rendah terjadi pada pakan berprotein 23% diperkaya rGH (2,72%). Thammapat et al. (2010) menyatakan kandungan lemak ikan patin secara umum terdiri atas lemak rendah (2‒4%), lemak sedang (4‒8%) dan lemak tinggi (>8%). Berdasarkan Tabel 4, kandungan lemak daging ikan pada perlakuan pakan berprotein 23% diperkaya rGH dan perlakuan pakan berprotein 28% diperkaya rGH dan kontrol tergolong memiliki kandungan lemak rendah. Lebih lanjut, kandungan air daging pada penelitian ini berkisar 75,24-77,46%. Menurut Suryaningrum et al. (2010), kandungan air ikan patin berkisar 75,53-79,42%. Kadar air yang tinggi akan mempengaruhi tekstur daging ikan yang dihasilkan.
13 namun apabila kepala lebih besar dan daging tidak tebal maka semakin kecil proporsi karkas yang diperoleh (Suryaningrum et al. 2010).
Hati merupakan salah satu organ tubuh yang berfungsi untuk menyimpan lemak. Menurut NRC (2011), hati adalah pusat metabolisme nutrien dalam tubuh. Berdasarkan data hasil pengukuran IHS, nilai IHS berbanding terbalik dengan peningkatan kadar protein pakan. Menurut Arnason et al. (2010), penurunan IHS sejalan dengan peningkatan kadar protein pakan. Hal ini sejalan dengan Poernomo
et al. (2015), kadar lemak hati ikan patin menunjukkan nilai yang tidak berbeda antar perlakuan pakan dengan kadar protein berbeda (23%-32%). Glikogen merupakan bentuk penyimpanan karbohidrat pada hati dan daging ikan (Halver & Hardy 2002). Perlakuan pakan berprotein 23% diperkaya rGH dan kontrol menghasilkan glikogen hati yang lebih tinggi dibandingkan perlakuan pakan lainnya (Tabel 5). Moreira et al. (2008) menyatakan bahwa secara umum, peningkatan HSI yang disertai meningkatnya kadar karbohidrat pakan diduga berhubungan dengan deposisi glikogen yang meningkat dalam hati pada ikan diberi makan dengan pakan yang memiliki kadar karbohidrat tinggi. Selain itu, penelitian Ali & Jauncey (2005) pada ikan Clarias gariepinus menyatakan pakan berprotein rendah dan lemak tinggi menghasilkan deposisi lemak di seluruh tubuh dan hati ikan yang akan menyebabkan glikogen hati meningkat. Rasmussen
et al. (2001) menyatakan bahwa pemberian rGH dapat menurunkan kadar lemak dan meningkatkan sintesis protein dalam tubuh, kandungan lemak yang lebih rendah pada ikan dengan laju petumbuhan yang lebih cepat menunjukkan protein sparing effect yang terjadi seiring dengan meningkatnya level GH.
Hormon pertumbuhan (GH) adalah hormon pluripotent yang dihasilkan oleh kelenjar pituitari pada ikan teleostei sama halnya dengan vertebrata yang lain. GH berperan dalam pertumbuhan. Mekanisme GH dalam mempengaruhi pertumbuhan organ target dapat terjadi secara langsung (tanpa perantara IGF-1 dalam hati) dan tidak langsung (dimediasi oleh IGF-1 pada hati ikan).
Hasil elektroforesis semi-kuantitatif ekspresi gen GH saat 24 jam setelah pemberian pakan yang mengandung rElGH dari otak ikan patin siam dapat dilihat pada Gambar 4. Sebagai kontrol internal digunakan β-aktin. Berdasarkan hasil analisis ekspresi gen GH pada otak ikan perlakuan lebih tinggi dibandingkan kontrol. Hal tersebut mengindikasikan bahwa pemberian rElGH menginduksi ekspresi GH endogen. Namun demikian, peningkatan ekspresi GH endogen tidak mempengaruhi pertumbuhan ikan patin. Pada penelitian ini belum diketahui penyebab peningkatan ekspresi GH endogen pada perlakuan pakan 23% lebih tinggi daripada perlakuan pakan berprotein 28%. Namun demikian, kadar lemak ikan perlakuan pakan berprotein 23% dan 28% yang disuplementasi rElGH menurun dibandingkan kontrolnya. Oleh karena itu, diduga ada kaitan antara peningkatan ekspresi GH endogen dengan penurunan kadar lemak, dan hal ini perlu penelitian lanjut untuk membuktikannya. Selanjutnya Hertz et al. (1991) menyatakan bahwa efek rGH terhadap pertumbuhan, selain ditentukan oleh jenis rGH yang digunakan, juga ditentukan oleh umur (age dependent) dan jenis ikan (species specific).
Berdasarkan penelitian yang dilakukan Jenatoft et al. (2005) pada ikan
yellow perch, kurangnya pengaruh hormon pertumbuhan manusia (human growth hormone) dan hormon pertumbuhan rekombinan ikan yellow perch (rypGH,
14
rendah antara hormon dan reseptor (GHR) pada ikan yellow perch, (2) bahwa tingkat GH endogen sudah pada tingkat biologis maksimal, (3) faktor endokrin lain diperlukan dalam upaya GH meningkatkan pertumbuhan ikan yellow perch. Penurunan level IGF-1 24 jam setelah penanganan menunjukkan efek negatif dari penanganan stres pada axis GH-IGF-1 ikan yellow perch.
4
SIMPULAN DAN SARAN
Simpulan
Pemberian hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) pada pakan komersial menghasilkan pertumbuhan ikan yang lebih tinggi pada perlakuan pakan berkadar protein 28% dan 32 %. Pemberian rElGH pada pakan berprotein berbeda mampu menurunkan kadar lemak tubuh ikan patin siam.
Saran
15
DAFTAR PUSTAKA
Alimuddin, Lesmana I, Sudrajat AO, Carman O, and Faisal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal 5:11-17.
Ali MZ, Jauncey K. 2005. Approaches to optimizing dietary protein to energy ratio for African catfish Clarias gariepinus (Buchell, 1982). Aquaculture Nutrition. 11 : 95-101.
Arnason J, Rannveig B, Arnarsson I, Arnadottir GS, Thorarensen H. 2010. Protein requirements of Atlantic cod Gadus morhua L. Aquaculture Research
41:385–393.
Asdari R, Aliyu M, Hashim R, Ramachandran. 2011. Effect of different dietary protein and lipid source in the diet for Pangasius hypophthalmus (Sauvage, 1978) juvenile on growth performance, nutrient utilization, body indices and muscle and liver fatty acid composition. Agriculture Nutrition. 17:44-53 Bartke A 2005. Role of the growth hormone/insulin-like growth factor system in
mammalian aging. Minireview. Endocrinology. 146 : 3718-3723.
Budi DS, Alimuddin, Suprayudi MA. 2015. Growth response and feed utilization of giant gourami Osphronemus goramy juvenile feeding different protein level of the diets supplemented with recombinant growth hormone. HAYATI Journal Bioscience. 22:12-19.
Craigh S and Helfrich LA. 2002. Understanding fish nutrition, feed, and feeding. Virginia, USA: Department of Fisheries and Wildlife Science, Virginia Tech.
Dewi RRSP, Alimuddin, Sudrajat AO, Sumantadinata K. 2012. Efektivitas transfer dan ekspresi gen PhGH pada ikan patin siam Pangasianodon hypophthalmus. Jurnal Riset Akuakultur. 7 : 171-180.
Fu. C, Cui Y, Hung SSO, Zhu Z. 1998. Growth and feed utilization by F4 human growth hormone transgenic carp fed diet with different protein level.
Journal of Fish Biology 53 : 115-129.
Funkenstein B, Dyman A, Lapidot Z, de Jesus-Ayson EG, Gertler A, Ayson FG. 2005. Expression and purification of a biologically active recombinant rabbitfish Siganus guttatus growth hormone. Aquaculture. 250: 504-515. Halver JE, Hardy RW. 2002. Fish Nutrition (3rd edition). London, Inggris :
Academic Press. Inc.
Handoyo B. Alimuddin, Utomo NBP. 2012. Pertumbuhan, konversi dan retensi pakan, dan proksimat tubuh benih ikan sidat yang diberi hormon pertumbuhan rekombinan ikan kerapu kertang melalui perendaman. Jurnal Akuakultur Indonesia 11(2) : 132-140.
Hardiantho D, Alimuddin, Arief EP, Dwi HY dan Komar S. 2012. Performa benih ikan nila diberi pakan mengandung hormon pertumbuhan rekombinan ikan mas dengan dosis berbeda. Jurnal Akuakultur Indonesia. 11 : 17-22.
Hasan MR. 2010. On-farm feeding and feed management in aquaculture Manila, the Philippines. FAO Aquaculture Newsletter. 45(1): 48-49.
16
rohu Labeo rohita fingelings. World Journal Fish Marine Science 5 (3) : 244-250.
Hertz Y, Tchelet A, Madar Z, and Gertler A. 1991. Absorption of bioactive human growth hormone after oral administration in the common carp and its enhancement by deoxycholate. Journal Comp Physiology.161:159-163. Huisman EA. 1987. Principle of fish production.Department of Fish Culture and
Fisheries. Wageningen Agricultural University, The Netherland. 187p. Jentoft S, Topp N, Seeliger M, Malison JA, Barry TP, Held JA, Roberts S, Goetz
F. 2005. Lack on growth enhancement by exogenous growth hormone kinerja pertumbuhan dan kandungan lemak daging ikan patin Pangasius hypophythalmus untuk pembesaran [Tesis] Bogor (ID): Institut Pertanian Bogor.
Kiiratnikom S, Kiiratnikom A. 2012. Growth, fed utilization, survival and body composition of fingerlings of slender walking catfish Clarias nieuhofi fed diets containing different protein level. Journal Science Technology. 34:37-43.
Kim LE, Lee SM. 2005. Effects of the dietary protein and lipid levels on growth and body composition of bagrid catfish Pseudobagrus fulvidraco.
Aquaculture. 243: 323‒329.
Kobayashi S, Alimuddin, Moita T, Miwa M, Lu J, Endo M, Takeuchi T, and Yoshizaki G. 2007. Transgenic Nile tilapia Oreochromis niloticus over-expressing growth homone show reduced ammonia excretion. Aquaculture. 270 : 427-435.
Linder M.C 1992. Nutrisi dan metabolisme karbohidrat, 781 hal. Dalam: Linder M.C. Biokimia nutrisi & metabolisme (terjemahan). Jakarta. UI-Press. Liu XY, Wang Y, JI WX. 2011. Growth, feed utilization and body composition of
Asian catfish Pangasius hypophthalamus feed at different dietary protein and lipid level. Aquaculture Nutrition. 11 : 578-584
Mokoginta, I., Takeuchi, T., Hadadi, A. & Jusadi, D. 2004. Different capabilities in utilizing dietary carbohydrate by fingerling and subadult giant gouramy
Osphronemus goramy. Fisheries Science. 70:996-1002.
Moreira IS, Peres H, Couto A, Enes P, Oliva-Teles A. 2008. Temperature and dietary carbohydrate level effects on performance and metabolic utilization of diets in European sea bass (Dicentrarchus labrax) juveniles. Aquaculture. 274:153–160
Muhammad, M Zairin Jr, Alimuddin and O Carman. 2013. Growth response of four Nile tilapia strains fed on diet containing a recombinant teleostean growth hormone. International Journal of Science: Basic and Applied Research (ISJBAR). 16 :397-406
[NRC] Nutritional Research Council. 2011. Nutrient requirement of fish and shrimp. Washington DC (USA): National Academic Press.
17 komersial dengan kadar protein berbeda. Jurnal Akuakultur Indonesia
14(2): 104-111.
Rasmussen RS, Ronsholdt B, Ostenfeld TH, McLean E, Byatt JC. 2001. Growth feed utilization, carcass composition and sensory characteristics of rainbow trout treated with recombinant bovine placental lactogen and growth hormone. Aquaculture. 195 :367-384.
Safir M. 2012. Respon benih ikan gurami Osphronemus goramy yang diberi hormone pertumbuhan rekombinan melalui oral pada dosis berbeda. [Tesis]. Bogor (ID) : Institut Pertanian Bogor.
[SIDATIK] Pusat Data Statistik dan Informasi KKP 2015. Kelautan dan perikanan dalam angka tahun 2015. [internet]. [diunduh 20 September 2016].Tersedia dari www.kkp.go.id.
Silverstein JT, William RW, Munetaka S and Walon WD. 2000. Bovine growth hormone treatment of chanel catfish : strain and temperature effects on growth, plasma IGF-I level, feed intake and efficiency and body composition. Aquaculture. 190:77-78.
[SNI] Standar Nasional Indonesia. 2002. Ikan patin siam Pangasius hypophthalmus. SNI.01-6483.5-2002.
Suryaningrm DT, Muljanah I, Tahapai E, 2010. Profil sensori dan nilai gizi beberapa jenis ikan patin dan hibrid nasutus. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. 5 (2) : 153-164.
Takeuchi T. 1988. Laboratory work chemical evaluation of dietary nutrients. In : Watanabe T (ed). Fish Nutrition and Marinculture. Tokyo : Department of Aquatic Bioscience. Tokyo University of Fisheries. JICA. pp: 179-226. Thammapat P, Raviyan P, Siriamorpon S. 2010. Proximate and fatty acids
composition of muscles and viscera of Asian catfish Pangasius bocourti.
Food Chemistry. 122(1): 223–227.
Watanabe T. 1988. Fish nutrition and mariculture. Department of Aquatic Bioscience. Tokyo University of Fisheries. JICA. 233 p
18
19 Lampiran 1. Prosedur Analisis Proksimat
1. Prosedur Analisis Kadar Protein A. Prosedur Oksidasi
1. Sampel ditimbang sebanyak 0.5 gram dan dimasukkan ke dalam labu Kjeldahl.
2. Katalis (K2SO4+CuSo4.5H2O) dengan rasio 9:1 ditimbang sebanyak
3 gram dan dimasukkan ke dalam labu Kjeldahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian
labu tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400°C selama 3-4 jam sampai terjadi perubahan warna cairan dalam labu menjadi hijau bening.
4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didestilasi. B.Prosedur Destilasi
1. Beberapa tetes H2SO4 dimasukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan akuades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian dididihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0.05 N dan ditambahkan 2 tetes indikator
methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
4. Campuran alkaline dalam labu destilasi disuling menjadi uap air selama 10 menit terjadi pengembunan pada kondensor.
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, di atas permukaan larutan. Kondensor dibilas dengan akuades selama 1-2 menit.
C. Prosedur Titrasi
1. Larutan hasil destilasi dititrasi dengan larutan NaOH 0.05 N. 2. Volume hasil titrasi dicatat.
3 .Prosedur yang sama juga dilakukan pada blanko.
Kadar Protein (%) = 0.0007 * x (Vb – Vs) x 6.25 ** x 20 x 100 S
Keterangan :
Vb = Volume hasil titrasi blanko (ml) Vs = Volume hasil titrasi sampel (ml) S = Bobot sampel (gram)
20
2. Prosedur Analisis Kadar Lemak A. Metode ekstraksi Soxhlet
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110° dalam waktu
1 jam. Kemudian didiinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1)
2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan yang merendam sampel dalam soxhlet berwarna bening.
5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanaskan dalam oven selama 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2 ).
B. Metode Folch
1. Labu silinder dimasukkan dalam oven terlebih dahulu pada suhu 110°C
selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1).
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas homogenize dan ditambahkan larutan kloroform/methanol (20xA),
sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disaring dengan
vacuum pump.
4. Sampel yang telah disaring tersebut dimasukkan dalam labu pemisah yang telah diberi larutan MgCl2 0.03 N(0.2xC), kemudian dikocok dengan kuat
minimal selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
5. Lapisan bawah yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform / methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2).
Kadar Lemak (%) = X2 –X1 x 100
A 3. Prosedur Analisis Kadar Air
1. Cawan dipanaskan dalam oven pada suhu 100°C selama 1 jam dan
kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipanaskan dalam oven pada suhu 110°C selama 4 jam
21
Kadar Air (%) = (X1+A)-X2 x 100
A 4. Prosedur Analisis Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100°C selama 1 jam dan kemudian
dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipanaskan dalam tanur pada suhu 600°C sampai menjadi
abu kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2).
Kadar Abu (%) = X2 –X1 x 100
A
5. Prosedur Analisis Kadar Serat Kasar
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110°C setelah
itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1).
2. Sampel ditimbang sebanyak 0.5 gram (A) dimasukkan ke dalam Erlenmeyer 250 ml.
3. H2SO4 0.3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer kemudian
dipanaskan di atas pembakar Bunsen selama 30 menit. Setelah itu NaOH 1.5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanaskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air panas,
dan 25 ml aseton.
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105-110°C selama 1 jam kemudian didinginkan dalam desikator
5-15 menit dan ditimbang (X2).
7. Setelah itu dipanaskan dalam tanur 600°C hingga berwarna putih atau
menjadi abu (sekitar 4 jam). Kemudian dimasukkan dalam oven 105-110°C
selama 15 menit, didinginkan dalam desikator selama 5-15 menit dan ditimbang (X3).
Kadar Serat Kasar (%) = (X2 – X1 – X3) x 100
22
Lampiran 2. Prosedur Analisis Kadar Glikogen Hati Analisis Kadar Glikogen Hati
23 Lampiran 3. Prosedur Analisis Ekspresi Gen GH
RNA total diisolasi dari jaringan hipofisa ikan patin siam. Jaringan diambil secara aseptis dan disimpan dalam botol sampel yang telah berisi bahan isogen sebanyak 200 µl. Jaringan dihancurkan menggunakan penggerus yang sebelumnya telah disterilkan dengan dietylpyrocarbonate (DEPC) 1 %. Ke dalam tabung mikro ditambahkan larutan isogen hingga mencapai volume akhir 600 µl dan diinkubasi selama 5 menit pada suhu ruang sampai jaringan terlisis sempurna. Kloroform sebanyak 200 µl ditambahkan, kemudian disentrifugasi selama 5 menit dengan kecepatan 10.000 rpm pada suhu ruang. Supernatan yang terbentuk dipindahkan ke dalam tabung mikro baru yang telah berisi 400 µl isopropanol. Kemudian disentrifugasi selama 15 menit dengan kecepatan 10.000 rpm pada suhu 4ºC. Supernatan pada tabung mikro dibuang, dan pelet RNA pada dasar tabung mikro dilarutkan dengan cara menambahkan 1 ml etanol 70% dingin, disentrifugasi lagi selama 15 menit dengan kecepatan 10.000 rpm. RNA dikeringkan dengan cara membuang larutan yang terdapat dalam tabung mikro. Setelah kering sempurna, RNA dilarutkan dengan 30 µ l DEPC 0.1%. Konsentrasi hasil isolasi RNA total diukur menggunakan alat pengukur konsentrasi RNA/DNA (GeneQuant) pada panjang gelombang 260 dan 280 nm.
Sintesis cDNA GH dilakukan menggunakan kit Ready-to-Go You-Prime First Strand Beads, FSRMB (Amersham pharmacia biotech, USA). Konsentrasi RNA dibuat 3 µg dalam 30 µl DEPC. Larutan RNA diinkubasi pada suhu 65ºC selama 10 menit dan kemudian disimpan di atas es (on ice). Sampel RNA dipindahkan ke dalam tube FSRMB dan ditambahkan 3 µl primer „dT3‟RACE
-VECT” (5”-GTA ATA CGA CTC ACT ATA GGG CAC GCG TGG TCG ACG
GCC CGG GCT GGT TTT TTT TTT TTT TTT TTT-3‟) dengan konsentrasi 1 µg/3 µl. Larutan dihomogenkan dan diinkubasi pada suhu 37 ºC selama 1 jam. cDNA yang terbentuk ditambahkan 30 µl SDW steril dan disimpan dalam sebanyak 35 siklus; 72ºC selama 3 menit; dan mesin didinginkan hingga mencapai suhu 4ºC.
Sebagai kontrol internal digunakan β-aktin . Deteksi gen β-aktin dilakukan
dengan menggunakan primer forward (5‟-GAC CTC ACA GAC TAC CTC ATG -3‟) dan primer reverse (5‟- TCA TTG CCC ATG GTG ATG ACC -3‟). Panjang fragmen ß aktin yang diapit oleh kedua primer tersebut sekitar 300 bp. PCR dilakukan dengan progam : 94ºC selama 3 menit; ( 94ºC selama 30 detik; 58ºC selama 30 detik; 72ºC selama 30 detik) sebanyak 35 siklus 72ºC selama 3 menit; dan 4ºC (sampai suhu mesin mencapai 4°C). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1 %. Analisis ekspresi gen dilakukan secara semi-kuantitatif, yaitu dengan membandingkan rasio ekspresi gen GH dengan β-aktin. Kuantifikasi ketebalan pita pada gen GH dan
24
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap Bobot akhir pada selang kepercayaan 95%.
Protein N Mean Grouping 32 6 649.7 A
28 6 597.3 A 23 6 427.6 B
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap Bobot akhir pada selang kepercayaan 95%.
Hormon N Mean Grouping 1 9 591.4 A
2 9 524.9 B
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap Bobot akhir pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap pertambahan bobot pada selang kepercayaan 95%.
Protein N Mean Grouping 32 6 539.0 A
28 6 486.6 A 23 6 317.0 B
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap pertambahan bobot pada selang kepercayaan 95%.
Hormon N Mean Grouping 1 9 480.8 A
25 Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap pertambahan bobot pada selang kepercayaan 95%.
27 terhadap kadar air tubuh ikan pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping protein tubuh ikan pada selang kepercayaan 95%.
Protein N Mean Grouping 28 6 18.2 A
23 6 16.6 B 32 6 15.9 B
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap kadar protein tubuh ikan pada selang kepercayaan 95%.
Hormon N Mean Grouping 1 9 17.6 A
2 9 16.2 B
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap kadar protein tubuh ikan pada selang kepercayaan 95%.
28
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap kadar lemak tubuh pada selang kepercayaan 95%.
Protein N Mean Grouping 32 6 14.9 A
28 6 13.8 B 23 6 13.3 C
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap kadar lemak tubuh pada selang kepercayaan 95%.
Hormon N Mean Grouping 2 9 14.6 A
1 9 13.3 B
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhaap kadar lemak tubuh pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap retensi protein pada selang kepercayaan 95%.
Protein N Mean Grouping 28 6 58.3 A
23 6 47.0 B 32 6 42.7 B
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap retensi protein pada selang kepercayaan 95%.
Hormon N Mean Grouping 1 9 53.3 A
2 9 45.3 B
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap retensi protein pada selang kepercayaan 95%.
29
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap retensi lemak pada selang kepercayaan 95%. terhadap retensi lemak pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping daging ikan patin pada selang kepercayaan 95%.
Protein N Mean Grouping terhadap kadar air daging ikan patin pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping 28 1 3 77.5 A
30 Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap kadar protein daging ikan pada selang kepercayaan 95%.
Protein N Mean Grouping 32 6 17.8 A
28 6 16.4 A 23 6 16.1 A
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap kadar protein daging ikan patin pada selang kepercayaan 95%.
Hormon N Mean Grouping 2 9 17.2 A
1 9 16.3 A
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap kadar protein daging ikan patin pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap Kadar lemak daging ikan patin pada selang kepercayaan 95%.
Protein N Mean Grouping 32 6 4.7 A
23 6 3.8 B 28 6 3.6 B
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap Kadar lemak daging ikan patin pada selang kepercayaan 95%.
Hormon N Mean Grouping 2 9 4.4 A
31 Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap Kadar lemak daging ikan patin pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap karkas pada selang kepercayaan 95%.
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap lemak perut pada selang kepercayaan 95%.
Protein N Mean Grouping 28 6 0.6 A
32
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap lemak perut pada selang kepercayaan 95%.
Hormon N Mean Grouping 1 9 0.6 A
2 9 0.6 A
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap lemak perut pada selang kepercayaan 95%.
33 Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap kadar air hati pada selang kepercayaan 95%. terhadap kadar air hati pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap kadar lemak hati pada selang kepercayaan 95%. terhadap kadar lemak hati pada selang kepercayaan 95%.
34
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap kadar glikogen hati pada selang kepercayaan 95%.
Hormon N Mean Grouping 2 9 0.0 A
1 9 0.0 A
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap kadar glikogen hati pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping terhadap kadar air tubuh ikan pada selang kepercayaan 95%.
35 protein tubuh ikan pada selang kepercayaan 95%.
Protein N Mean Grouping 28 6 18.2 A
23 6 16.6 B 32 6 15.9 B
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap kadar protein tubuh ikan pada selang kepercayaan 95%.
Hormon N Mean Grouping 1 9 17.6 A
2 9 16.2 B
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap kadar protein tubuh ikan pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap kadar lemak tubuh pada selang kepercayaan 95%.
Protein N Mean Grouping 32 6 14.9 A
28 6 13.8 B 23 6 13.3 C
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap kadar lemak tubuh pada selang kepercayaan 95%.
Hormon N Mean Grouping 2 9 14.6 A
1 9 13.3 B
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhaap kadar lemak tubuh pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping 32 2 3 15.3 A
36
Uji lanjut Tukey pengaruh kadar protein berbeda yang berbeda terhadap retensi protein pada selang kepercayaan 95%.
Protein N Mean Grouping 28 6 58.3 A
23 6 47.0 B 32 6 42.7 B
Uji lanjut Tukey pengaruh pemberian hormon rGH terhadap retensi protein pada selang kepercayaan 95%.
Hormon N Mean Grouping 1 9 53.3 A
2 9 45.3 B
Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap retensi protein pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping
37 Uji lanjut Tukey pengaruh kadar protein berbeda dan pemberian hormon rGH terhadap retensi lemak pada selang kepercayaan 95%.
Protein Hormon N Mean Grouping 23 2 3 461.5 A