PERTUMBUHAN BENIH IKAN BOTIA YANG DIBERI
HORMON PERTUMBUHAN REKOMBINAN DENGAN
METODE BERBEDA
ASEP PERMANA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul : “Pertumbuhan Benih Ikan Botia Yang Diberi Hormon Pertumbuhan Rekombinan Dengan Metode Berbeda” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
RINGKASAN
ASEP PERMANA. Pertumbuhan benih ikan botia yang diberi hormon pertumbuhan rekombinan dengan metode berbeda. Dibimbing oleh ALIMUDDIN dan WARTONO HADIE.
Permasalahan utama dalam budidaya ikan botia adalah pertumbuhannya yang lambat, memerlukan waktu sekitar enam bulan untuk mencapai ukuran jual (panjang total 4-5 cm). Pertumbuhan yang lambat tentunya menyebabkan waktu produksi yang lama dan menambah biaya produksi. Peningkatan pertumbuhan dapat dipacu melalui penggunaan hormon pertumbuhan rekombinan (recombinant growth hormone/rGH).
Hormon rGH dapat diaplikasikan dengan tiga metode, yaitu: injeksi, oral melalui pakan, dan perendaman. Pemberian rGH melalui kombinasi dua metode (perendaman dan oral) mampu memberikan respons yang lebih baik dibandingkan satu metode, dikarenakan adanya pemberian yang berulang. Berdasarkan hal itu, penelitian ini bertujuan untuk mengevaluasi respons pemberian rGH yang berasal dari ikan kerapu kertang (rElGH) melalui metode berbeda terhadap pertumbuhan ikan botia.
Penelitian ini dilakukan dalam tiga tahap, yaitu: tahap 1 (penentuan dosis rElGH terbaik melalui metode perendaman). Pada tahap 1, ikan uji yang digunakan adalah larva ikan botia umur tujuh hari setelah menetas. Larva diberi kejut salinitas dengan NaCl 2,0% selama satu menit, kemudian direndam selama satu jam dalam air yang mengandung 0,3% NaCl, 0,01% bovine serum albumin (BSA) dan rElGH dosis berbeda (0,12; 1,2; 12 dan 120 mg/L bobot basah). Sebagai kontrol, larva direndam dalam air tanpa rElGH dan NaCl (kontrol-1), air mengandung 0,3% NaCl dan 0,01% BSA (kontrol-2), dan air mengandung 0,3% NaCl (kontrol-3). Selanjutnya larva ikan botia dipelihara sampai umur tiga bulan dengan padat tebar 5 ekor/L. Hasil penelitian menunjukkan bahwa dosis rElGH 1,2; 12 dan 120 mg/L memberikan peningkatan panjang total dan laju pertumbuhan panjang (P<0,05) dibandingkan kontrol-1 dengan nilai tertinggi pada dosis 1,2 mg/L sebesar 7,3% (panjang total) dan 4,7% (laju pertumbuhan harian panjang), sedangkan dosis 0,12 mg/L tidak berbeda nyata (P>0,05) dengan semua kontrol. Selain itu, persentase benih ukuran besar pada akhir penelitian meningkat sekitar 5% pada dosis 1,2 mg/L, persentase ukuran sedang hampir sama dan persentase ukuran kecil menurun dibandingkan kontrol-1. Dengan demikian dapat disimpulkan bahwa dosis perendaman terbaik rElGH adalah 1,2 mg/L.
ekor/L. Hasil penelitian menunjukkan bahwa pertumbuhan benih ikan botia dengan pemberian rElGH melalui bloodworm pada dosis 30 mg/kg pakan, lebih panjang (P<0,05) dibandingkan kontrol dan perlakuan rElGH dosis 0,3 mg/kg pakan, tetapi tidak berbeda nyata dengan perlakuan dosis rElGH 3 mg/kg pakan. Pada perlakuan dosis rElGH 0,3 dan 3 mg/kg pakan tidak berbeda nyata (P>0,05) dan keduanya juga tidak berbeda nyata dengan kontrol. Nilai pertumbuhan panjang benih ikan botia meningkat seiring peningkatan dosis rElGH, nilai paling tinggi terdapat pada perlakuan 30 mg/kg pakan sebesar 5,87% lebih cepat dibandingkan kontrol. Dengan demikian dapat disimpulkan bahwa dosis pemberian rElGH terbaik melalui pakan alami bloodworm adalah 30 mg/kg pakan.
Penelitian tahap 3 merupakan kegiatan lanjutan penelitian 1 dan penelitian 2. Pada penelitian tahap 3 ini, tiga metode pemberian rElGH yang diujikan yaitu melalui perendaman, oral dan kombinasi antara perendaman dan oral. Dosis rElGH melalui perendaman adalah 1,2 mg/L, dan dosis melalui oral yang diterapkan adalah 30 mg/kg pakan yang telah ditentukan sebagai hasil terbaik pada penelitian sebelumnya. Ikan uji dipelihara dalam akuarium dengan volume 50 L dengan sistem resirkulasi, selama 168 hari dengan kepadatan 50 ekor/akuarium. Hasil penelitian menunjukkan bahwa perlakuan kombinasi perendaman dan oral memberikan hasil pertumbuhan sebesar 12,04% lebih tinggi dibandingkan kontrol (P<0,05) untuk panjang total, dan 5,83% lebih tinggi dibandingkan kontrol (P<0,05) untuk laju pertumbuhan harian panjang. Selain itu, perlakuan kombinasi juga dapat meningkatkan ekspresi gen insulin-like growth factor-1/IGF-1 sebesar 29,37% dibandingkan dengan kontrol. Perlakuan kombinasi juga dapat mengurangi biaya produksi sebesar Rp. 224,78,- per ekor dengan waktu pemeliharaan 18 hari lebih cepat dibandingkan kontrol untuk mendapatkan ukuran tubuh yang sama.
Berdasarkan hasil penelitian disimpulkan bahwa pemberian rElGH dengan dosis yang tepat melalui perendaman, oral dan kombinasinya mampu meningkatkan pertumbuhan benih ikan botia. Metode pemberian yang menghasilkan respons pertumbuhan terbaik pada penelitian ini adalah dengan mengkombinasikan pemberian melalui perendaman (pada saat larva) dan dilanjutkan pemberian secara oral melalui pakan alami bloodworm (pada saat ikan sudah bisa mengkonsumsi bloodworm). Peningkatan pertumbuhan ini bermanfaat untuk mempersingkat waktu produksi sampai ukuran jual dan juga mengurangi biaya produksi.
SUMMARY
ASEP PERMANA. Growth of clown loach juvenile treated with recombinant growth hormone using different method. Supervised by ALIMUDDIN and WARTONO HADIE.
Main problems in clown loach culture is slow growth rate, which takes about six months to reach the market size (4-5 cm total body length). Moderate growth rate eventually cause a long production time and increase the production costs. Growth improvement can be accelerated through recombinant growth hormone (rGH) application.
rGH can be applied using three methods: injection, immersion and orally through feed. rGH implementation through two methods combinations (immersion and oral) may be able to provide a better response than one methods application, due to repeated administrations. Based on that constate, this study aimed to evaluate the growth response of clown loach on recombinant giant grouper growth hormone (rElGH) administrations through different methods.
This research was conducted in three stages: stage 1 (determination of an optimum dose of rElGH through immersion method). In stage 1, treated fish were clown loach larvae of seven days old after hatching. Larvae were hyperosmotic treated with NaCl 2.0% for one minute, then soaked for one hour in water containing 0.3% NaCl, 0.01% bovine serum albumin (BSA) and rElGH on different doses (0.12; 1.2; 12 and 120 mg/L wet weight). As control, larvae were immersed in water without rElGH and NaCl (control-1), water containing 0.3% NaCl and 0.01% BSA (control-2), and water containing 0.3% NaCl (control-3). Furthermore clown loach larvae were reared until age of three months at stocking density of 5 fish/L. Results showed that rElGH doses 1.2; 12 and 120 mg/L provided increment in total length and length growth rate than control-1 (P <0.05) with the highest value reached at dose of 1.2 mg/L were 7.3% (total length) and 4.7% (daily length growth rate) while at dose of 0.12 mg/L was not significantly different (P> 0.05) with all of the controls. In addition, percentage of large-sizes juveniles increased at the end of the research about 5% at dose of 1.2 mg/L, percentage of medium sizes was about the same, and small-sizes percentage decreases compared to control-1. Thus, it concluded that the best immersion rElGH doses was 1.2 mg/L.
and both were also the same as controls. Length growth value of clown loach was increased by increasing the rElGH dose, the highest values were obtained in treatment of 30 mg/kg feed which was 5,87% higher than control. It was concluded that the best dosage of rElGH administration through live feed bloodworm was 30 mg/kg feed.
Research 3 was an advanced stage of the first and second research. In this study, three methods of rElGH administration were tested namely through immersion, oral and combination of immersion and oral. rElGH dosage through immersion method was 1.2 mg/L, and by orally was 30 mg/kg of feed which has been determined as the best results in previous studies. Fish were kept in 50 L glass tank, equipped with recirculation system, for 168 days with stocking density of 50 fish/aquarium. Results showed that the combination of immersion and oral treatments allowed total length growth (12.04%) higher than control (P<0.05), and 5,83% higher than control (P<0.05) for daily length growth. In addition, combination treatment also increased gene expression level ofinsulin-like growth factor-1/IGF-1, about 29.37% compared to controls. Combination treatment could also reduce production cost by Rp. 224.78,-/fish with rearing times 18 days faster than control to get the same body size.
Based on the results, it can be concluded that administering an appropriate dosage of rElGH through immersion, oral and combinations of both methods, were able to promote clown loach growth rate. Administration method that produces the best growth response in this study wasby combining the administration via immersion (during larval phase) and continued through bloodworm oral administration (when fish able to consume bloodworm). This growth increment is beneficial to shorten production time until fish reach the market size and also have an impact to reduce cost of fish production.
viii
©Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ix
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
ASEP PERMANA
PERTUMBUHAN BENIH IKAN BOTIA YANG DIBERI
HORMON PERTUMBUHAN REKOMBINAN
DENGAN METODE BERBEDA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
x
Judul Tesis : Pertumbuhan benih ikan botia yang diberi hormon pertumbuhan rekombinan dengan metode berbeda
Nama : Asep Permana
NIM : C151120311
Disetujui oleh Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc
Ketua Dr. Ir. Wartono Hadie, M.S Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr. Ir. Widanarni, M.Si
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc, Agr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala nikmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam karya ilmiah ini adalah penggunaan hormon pertumbuhan rekombinan dengan berbagai metode, dengan judul “Pertumbuhan Benih Ikan Botia Yang Diberi Hormon Pertumbuhan Rekombinan Dengan Metode Berbeda”.
Penulis menyampaikan terima kasih kepada Bapak Dr. Alimuddin, S.Pi., M.Sc dan Dr. Ir. Wartono Hadie, M.S atas bimbingan dan motivasi yang telah diberikan. Ucapan terima kasih penulis sampaikan kepada Dr. Sri Nuryati, S.Pi., M.Si selaku penguji luar komisi, Ibu Dr. Ir. Widanarni, M.Si selaku Ketua Program Studi Ilmu Akuakultur dan Bapak Prof. Dr. Ir. D. Djokosetiyanto, DEA selaku wakil Program Studi Ilmu Akuakultur yang hadir pada saat ujian sidang atas kritik dan saran yang diberikan. Penghargaan dan terima kasih juga penulis sampaikan kepada Bapak Drs. I Wayan Subamia, Bapak Anjang Bangun Prasetyo dan Bapak Drs. Agus Priyadi dari Balai Penelitian dan Pengembangan Budidaya Ikan Hias, Depok dan staf teknisi : Rona, Rinal, Santi, Hasan, Angga dan Dinar atas segala bantuan kepada penulis selama penelitian. Ungkapan terima kasih juga disampaikan kepada keluarga: Bapak, Mimih, Ema dan istri tercinta, serta kedua anakku atas segala do’a dan kasih sayangnya.
Akhir kata, penyusun berharap semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis Penelitian 2
METODE 2
Waktu dan Tempat Penelitian 2
Prosedur Pemeliharaan Dan Rancangan Perlakuan 2
Penelitian Tahap 1: Pemberian rElGH Dengan Dosis Perendaman
Berbeda 2
Penelitian Tahap 2: Pemberian rElGH Dengan Dosis Berbeda Secara
Oral Melalui Pakan 3
Penelitian Tahap 3: Pemberian rElGH Melalui Perendaman dan
Secara Oral Melalui Pakan 4
Analisis Ekspresi Gen IGF-1 Pada Penelitian Tahap ke-3 6
Analisis Biaya 6
Analisis Data 6
HASIL DAN PEMBAHASAN 7
Hasil Penelitian Tahap Pertama 7
Hasil Penelitian Tahap Kedua 9
Hasil Penelitian Tahap Ketiga 9
Ekspresi gen IGF-1 10
Analisis Biaya Produksi 11
Pembahasan 12
KESIMPULAN 15
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
1. Rancangan percobaan penentuan dosis perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) pada larva
ikan botia. 3
2. Rancangan percobaan penentuan dosis pemberian hormon pertumbuhan ikan kerapu kertang (rElGH) secara oral melalui pakan
bloodworm pada benih ikan botia. 4
3. Metode pemberian rElGH pada perlakuan yang digunakan dalam
penelitian. 5
4. Panjang (PT) dan bobot tubuh (BT), laju pertumbuhan panjang (LPHp) dan bobot harian (LPHb), sintasan benih ikan botia pada kontrol dan perlakuan hormon pertumbuhan rekombinan ikan kerapu
kertang dengan dosis berbeda. 8
5. Distribusi variasi ukuran ikan botia (kecil/S, sedang/M dan besar/L) di akhir penelitian pada perlakuan kontrol dan perlakuan hormon
pertumbuhan rekombinan ikan kerapu kertang dengan dosis berbeda. 8 6. Panjang akhir, laju pertumbuhan harian panjang (LPHp),
kelangsungan hidup benih ikan botia pada kontrol dan perlakuan pemberian rElGH dengan dosis berbeda secara oral melalui pakan
alami bloodworm. 9
7. Panjang akhir, laju pertumbuhan harian panjang (LPHp) dan sintasan benih ikan botia pada kontrol dan perlakuan pemberian rElGH melalui kombinasi perendaman pada stadia larva dan oral pada stadia
benih. 10
8. Perbandingan biaya produksi antara perlakuan kontrol (tanpa rElGH) dengan perlakuan terbaik yaitu kombinasi perendaman pada stadia larva dan dilanjutkan dengan oral lewat pakan pada stadia benih. 11
DAFTAR GAMBAR
1. Panjang ikan botia (Chromobotia macracanthus) yang diberi perlakuan hormon pertumbuhan ikan kerapu kertang (Epinephelus
lanceolatus) dengan dosis berbeda melalui metode perendaman. 7 2. Ikan botia umur enam bulan hasil percobaan perlakuan pemberian
rElGH dengan metode berbeda: A) kontrol; B) perendaman saja; C)
oral lewat pakan saja; D) perendaman + oral lewat pakan. 10
3. Kuantifikasi tingkat ekspresi mRNA gen insulin-like growth factor I (IGF-1) pada perlakuan kontrol (bar hitam) dan perlakuan hormon pertumbuhan rekombinan (rGH, bar putih) dengan kombinasi perendaman dosis 1,2 mg/L dan oral melalui pakan dosis 30 mg/kg pakan (gambar kanan). Ekspresi mRNA gen β-aktin digunakan
sebagai kontrol internal loading RNA total dalam sintesis cDNA. 11 4. Waktu yang diperlukan ikan botia mencapai ukuran jual (4 cm) pada
DAFTAR LAMPIRAN
1. Proses perendaman larva ikan botia dalam hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dan pemeliharaannya 18 2. Proses pencampuran hormon pertumbuhan rekombinan ikan kerapu
kertang (rElGH) ke pakan uji (bloodworm) 18
3. Hasil analisis IGF-1 pada hati ikan botia yang diberi perlakuan rElGH
dengan perlakuan terbaik dan kontrol 19
4. Perhitungan jumlah kebutuhan artemia dan perhitungan biayanya 19 5. Perhitungan kebutuhan penggunaan bloodworm selama penelitian dan
perhitungan biayanya 22
6. Perhitungan kebutuhan penggunaan rGH selama penelitian dan
perhitungan biayanya 22
7. Perhitungan kebutuhan penggunaan BSA selama penelitian dan
PENDAHULUAN
Latar Belakang
Pemberian hormon pertumbuhan rekombinan telah dilaporkan efektif untuk meningkatkan pertumbuhan ikan, dan umumnya pada ikan konsumsi. Pada ikan hias, efektivitas pemberian rGH telah dilaporkan pada ikan koki (Promdonkoy et al., 2004; Acosta et al., 2009), dan ikan manvish (Pterophyllum scalare) (Acosta et al., 2009). Beberapa hormon pertumbuhan yang berasal dari ikan sudah berhasil diproduksi, diantaranya rGH dari giant catfish (Promdonkoy et al., 2004), rGH dari ikan salmon (Moriyama & Kawauchi, 1990), rGH dari tilapia (Acosta et al., 2007), rGH dari ikan gurami dan ikan kerapu kertang (Alimuddin et al., 2010).
Pada umumnya rGH dari tiga spesies ikan yang diproduksi di Indonesia, hormon pertumbuhan rekombinan dari ikan kerapu kertang paling banyak digunakan karena tingkat produksi protein lebih tinggi dibandingkan dengan hormon pertumbuhan dari ikan mas (rCcGH) dan ikan gurami (rOgGH) (Irmawati et al,, 2012). Selain itu, bioaktivitas rElGH dalam merangsang pertumbuhan pada tilapia lebih baik dari pada rCcGH dan rOgGH (Alimuddin et al., 2010).
Hormon pertumbuhan rekombinan dapat diaplikasikan dengan cara injeksi (Promdonkoy et al., 2004), secara oral melalui pakan (Hardiantho et al., 2012), melalui perendaman (Acosta et al., 2007), dan kombinasi antara perendaman dan oral (Handoyo, 2012). Aminah (2012) melaporkan bahwa aplikasi rElGH pada benih ikan sidat melalui perendaman selama dua jam dengan dosis 3 mg/L, dapat meningkatkan biomassa sebesar 28% dan sintasan sebesar 15,2% lebih tinggi dibandingkan kontrol. Lebih lanjut, perendaman benih ikan sidat dalam air yang mengandung rElGH selama dua jam dengan dosis 12 mg/L dapat meningkatkan pertumbuhan sebesar 37,4% lebih tinggi dibandingkan kontrol (Handoyo et al., 2012). Sementara itu, perendaman udang vaname stadia PL 2 dalam air yang mengandung rElGH dosis 15 mg/L selama tiga jam dapat meningkatkan bobot sebesar 109,9%; panjang sebesar 26,0%; dan biomassa sebesar 66,0% lebih tinggi dibandingkan kontrol (Subaidah et al., 2012).
Budidaya ikan botia di luar habitatnya telah sukses dilakukan di Balai Penelitian dan Pengembangan Budidaya Ikan Hias, Depok. Permasalahan utama dalam budidaya ikan botia yaitu pertumbuhan yang lambat, diperlukan waktu sekitar enam bulan untuk mencapai (panjang total 4-5 cm) atau ukuran pasar (Permana et al., 2011).
2
Wong et al., 2006; Debnanth, 2010). Hasil akhir yang diharapkan adalah ikan botia yang diberikan rGH melalui metode yang berbeda dapat tumbuh cepat sehingga biaya pakan untuk pemeliharaan ikan botia dapat diperkecil.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji respons pertumbuhan benih ikan botia yang diberi hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) melalui perendaman pada stadia larva, oral pada stadia benih dan kombinasi kedua metode tersebut.
Manfaat Penelitian
Sebagai pedoman awal untuk menyusun standar prosedur operasional pemberian pakan dan teknologi pendederan ikan botia menggunakan hormon pertumbuhan rekombinan supaya dapat diterapkan dalam skala massal bagi pelaku budidaya ikan botia.
Hipotesis Penelitian
Penggunaan rGH melalui perendaman pada stadia larva dan benih dapat meningkatkan pertumbuhan ikan botia.
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan di Balai Penelitian dan Pengembangan Budidaya Ikan Hias (BPPBIH), Depok pada bulan Desember 2013 sampai dengan Desember 2014.
Prosedur Pemeliharaan dan Rancangan Perlakuan
Ikan dipelihara dalam akuarium ukuran 804020 cm3 dengan sistem resirkulasi dan diberi pakan berupa naupli artemia, dan bloodworm. Penelitian ini terdiri atas 3 tahap penelitian uji bioaktivitas rE1GH, dan setiap tahap menggunakan rancangan acak lengkap.
Penelitian Tahap 1: Pemberian rElGH Dengan Dosis Perendaman Berbeda
3
Berdasarkan hasil SDS-PAGE tingkat produksi rOgGH ikan gurami lebih kecil dibandingkan rE1GH ikan kerapu kertang (Handoyo, 2012), maka dalam penelitian penentuan dosis ini dilakukan penurunan dosis seperti yang ditampilkan pada Tabel 1.
Larva ikan botia yang digunakan dalam penelitian ini adalah hasil budidaya dari BPPBIH Depok, berukuran panjang 0,57 cm dan bobot 0,0019 g yang berasal dari satu induk. Larva diberikan perlakuan kejut salinitas NaCl 2,0% selama satu menit, kemudian direndam selama satu jam (hasil penelitian pendahuluan) dalam air mengandung larutan rElGH (rElGH dosis berbeda+NaCl 0,3%+BSA 0,01%) di dalam baskom plastik yang berisi 1 L air, dengan kepadatan 250 ekor. Selesai perendaman, larva kemudian diaklimatisasikan di wadah pemeliharaan. Prosedur perendaman larva ikan botia dalam hormon pertumbuhan rekombinan ikan kerapu kertang seperti dalam Lampiran 1.
Pemeliharaan ikan dilakukan selama tiga bulan dalam akuarium ukuran 804020cm3 (volume 50 L) dengan sistem resirkulasi. Padat tebar larva ikan botia adalah 5 ekor/L; setiap unit akuarium ditebar larva botia sebanyak 250 ekor. Pemberian pakan berupa naupli artemia dilakukan selama satu bulan pertama, dilanjutkan dengan kombinasi artemia dan bloodworm selama dua minggu dan selanjutnya dengan bloodworm 100% sampai umur tiga bulan. Sampling pertumbuhan dilakukan setiap tiga minggu sekali, sedangkan sintasan dan variasi ukuran ikan dihitung pada akhir penelitian (bulan ke-3).
Tabel 1. Rancangan percobaan penentuan dosis perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) pada larva ikan botia
Dosis perendaman rElGH berdasarkan bobot basah (mg/L)
A
E = kontrol tanpa perlakuan rGH dan tanpa perlakuan salinitas F = kontrol, perlakuan salinitas, BSA 0,01%
G = kontrol, perlakuan salinitas
A-D = perlakuan rGH berturut-turut 0,12; 1,2; 12; dan 120 mg/L
Penelitian Tahap 2: Pemberian rElGH dengan dosis berbeda secara oral
melalui pakan.
4
al., (2012) pada benih ikan nila, yaitu 3 mg/100 gram pakan, dengan frekuensi pemberian dua kali perminggu.
Pencampuran rElGH ke pakan uji : bloodworm yang telah dicairkan dan ditiriskan, disemprot larutan rElGH berbeda sesuai dosis dan diberi binder berupa kuning telur 0,13 mg/mL Phosphate Buffer Saline (PBS) berdasarkan Hardiantho et al., (2012). Bloodworm yang telah disemprot rElGH dibiarkan selama 5-10 menit sebelum diberikan ke benih ikan botia sesuai perlakuan. Bloodworm yang mengandung rElGH diberikan dua kali seminggu (tiga kali sehari) dan disiapkan setiap akan diberikan ke ikan (Lampiran 2).
Selama penelitian, benih dipelihara pada akuarium volume 50 L dengan sistem resirkulasi, padat tebar 1 ekor/L atau 50 ekor/akuarium. Pakan yang digunakan adalah bloodworm yang telah diberi protein rElGH dengan dosis berbeda, dan pakan tanpa diberi rElGH. Sampling pertumbuhan ikan dilakukan setiap tiga minggu sekali, sedangkan sintasan dihitung pada akhir penelitian (bulan ke-3).
Tabel 2. Rancangan percobaan penentuan dosis pemberian hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) secara oral melalui pakan bloodworm pada benih ikan botia
Dosis rElGH dalam pakan berdasarkan bobot basah (mg/kg pakan) Kode Unit
Penelitian Tahap 3: Pemberian rElGH melalui perendaman dan secara oral
melalui pakan.
5
Tabel 3. Metode pemberian rElGH pada perlakuan yang digunakan dalam penelitian.
Perlakuan Metode Pemberian rElGH
Kontrol (P) Tidak diberi
perlakuan rElGH melalui
perendaman
Tidak diberi perlakuan rElGH melalui oral lewat pakan
Perendaman (Q) Kejut salinitas 20 g/L, rendam
Oral melalui pakan (R) Tidak diberi perlakuan rElGH
Perendaman dan oral (S) Kejut salinitas 20 g/L, rendam
Keterangan : Penelitian dilakukan selama enam bulan, perendaman dilakukan satu kali pada awal pemeliharaan, pemberian rElGH melalui oral diberikan setelah ikan berumur tiga bulan dan
diberikan dua kali setiap minggu sampai ikan berumur enam bulan. Setiap perlakuan diulang tiga kali ulangan.
6
Analisis Ekspresi Gen IGF-1 Pada Penelitian Tahap ke-3
Analisis ekspresi gen IGF-1 dilakukan untuk menjelaskan mekanisme yang melibatkan rGH dalam induksi pertumbuhan ikan. IGF-1 diekspresikan di hati. Hati ikan botia perlakuan terbaik (kombinasi pemberian rElGH secara perendaman dan oral) serta kontrol diambil secara acak pada akhir penelitian masing-masing sebanyak tiga ekor dari setiap perlakuan. RNA total diekstraksi dari hati menggunakan Tri-Reagent Kit (Molecular Research Center). Sintesis cDNA dilakukan menggunakan Transcriptor First Strand cDNA Synthesis Kit (Roche) dengan konsentrasi total RNA 1µg tiap sampel. Ekspresi IGF-1 ikan botia dianalisis menggunakan metode RT-PCR menggunakan primer forward IGF-1 ACC ATG CGC TGT CTC CCG AGT ACC-3’) dan reverse IGF-1 (5’-CAC ACA AAC TGC AGC GTG TCT ACA AGC TCC-3’) (Hardiantho et al., 2012). Panjang gen target IGF-1 sekitar 150 bp. PCR dilakukan menggunakan kit Dream Taq Green PCR Master Mix (2X) Thermo Scientific. Komposisi pereaksi terdiri atas: 12,5 µl master mix, primer forward 1 µl dan reverse 1 µl (20 mol), cDNA 2 µl, dan nuclease free water sampai total volume reaksi 25 µl. Proses PCR IGF-1 dilakukan dengan program: denaturasi awal pada suhu 95°C selama 15 menit, diikuti oleh 35 siklus amplifikasi pada denaturasi 94°C selama 20 detik, annealing pada suhu 65°C selama 30 detik, dan ekstensi pada suhu 72°C selama 30 detik, serta ekstensi akhir pada suhu 72°C selama 10 menit kemudian pengkondisian akhir pada suhu 4°C. Sebagai kontrol internal digunakan gen β-aktin universal 2 menggunakan primer forward (5’-TAT GAA GGT TAT GCT CTG CCC-3’) dan reverse (5’-CAT ACC CAG GAA AGA TGG CTG-3’). Primer tersebut disusun menggunakan program GENETIX versi 7 dengan panjang gen target β-aktin universal-2 sekitar 300 bp. Proses PCR β-aktin dilakukan dengan program: denaturasi awal pada suhu 94°C selama 3 menit, diikuti oleh 30 siklus amplifikasi pada denaturasi 94°C selama 30 detik, annealing pada suhu 58°C selama 30 detik, dan ekstensi pada suhu 72°C selama 30 detik, serta ekstensi akhir pada suhu 72°C selama 3 menit kemudian pengondisian akhir pada suhu 4°C. Analisis ekspresi gen dilakukan secara semi- kuantitatif, yaitu dengan membandingkan tingkat ekspresi gen IGF-1 dan β-aktin. Kuantifikasi ketebalan pita pada gen IGF-1 dan β-aktin dilakukan menggunakan program Alpha View SA untuk membandingkan antara perlakuan terbaik dengan kontrol.
Analisis Biaya
Analisis biaya dilakukan dengan membandingkan biaya produksi antara perlakuan kontrol tanpa rElGH dan perlakuan yang memberikan respons pertumbuhan terbaik.
Analisis Data
7
piranti lunak SPSS versi 17. Ekspresi gen IGF-1 dan analisis biaya dibahas secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil Penelitian Tahap Pertama
Hasil penelitian menunjukkan bahwa panjang total tubuh ikan botia pada perlakuan B (1,2 mg/L), C (12 mg/L) dan D (120 mg/L) lebih panjang (P<0,05) dibandingkan kontrol-1, sedangkan perlakuan A (0,12 mg/L) sama dengan semua kontrol (Gambar 1). Pertumbuhan panjang ikan botia kecenderungannya menurun dari perlakuan B, C dan D dengan pertumbuhan tertinggi terdapat pada perlakuan B dengan nilai sekitar 7,3% lebih tinggi dibandingkan kontrol-1.
Gambar 1. Panjang ikan botia (Chromobotia macracanthus) yang diberi perlakuan hormon pertumbuhan ikan kerapu kertang (Epinephelus lanceolatus) dengan dosis berbeda melalui perendaman.
Panjang dan bobot total, laju pertumbuhan harian dan sintasan benih ikan botia ditunjukkan pada Tabel 4. Panjang total dan laju pertumbuhan harian panjang untuk perlakuan B, C dan D lebih tinggi (P<0,05) dibandingkan kontrol-1. Panjang total ikan perlakuan A sama (P>0,05) dengan semua kontrol. Disisi lain, pemberian rElGH melalui perendaman pada ikan botia tidak berpengaruh terhadap pertumbuhan bobot dan sintasan. Hasil ini sejalan dengan tuntutan pada
8
ikan hias dimana parameter panjang biasanya lebih dijadikan dasar atau patokan ukuran pembudidaya pada saat penjualan.
Tabel 4. Panjang (PT) dan bobot tubuh (BT), laju pertumbuhan panjang (LPHp) dan bobot harian (LPHb), sintasan benih ikan botia pada kontrol dan perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang dengan dosis berbeda.
Parameter Dosis perendaman rElGH (berdasarkan bobot basah, mg/L)
A (0,12) B (1,2) C (12) D (120) (kontrol-1) E (kontrol-2) F (kontrol-3) G
PT (mm) 26,55±0,75ab 27,32±0,31b 26,92±0,61b 26,89±0,44b 25,46±0,17a 26,56±0,87ab 26,53±0,53ab BT (g) 2,763±0,294a 2,907±0,156a 2,841±0,208a 2,898±0,088a 2,704±0,490a 2,824±0,199a 2,725±0,130a LPHp (%) 1,832±0,033ab 1,866±0,015b 1,848±0,027b 1,847±0,019b 1,782±0,007a 1,832±0,039ab 1,831±0,020ab LPHb (%) 8,669±0,125a 8,730±0,063a 8,702±0,087a 8,726±0,036a 8,643±0,202a 8,695±0,082a 8,653±0,057a Sintasan (%) 82±7a 78±6a 90±5a 84±2a 76±4a 86±5a 82±2a
Ikan yang direndam dalam air tanpa rElGH dan NaCl (kontrol-1), air mengandung 0,3% NaCl dan
0,01% BSA (kontrol-2), dan air mengandung 0,3% NaCl (kontrol-3). Huruf superskrip berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0,05).
Ukuran tubuh ikan botia pada akhir penelitian tahap 1 dikelompokkan menjadi tiga ukuran, dinamakan ukuran kecil (S), sedang (M) dan besar (L), dan hasilnya ditampilkan pada Tabel 5. Seperti ditunjukkan pada Tabel 5, pemberian rElGH melalui perendaman pada larva ikan botia tidak berpengaruh nyata (P>0,05) terhadap distribusi variasi ukuran S dan M, tetapi berpengaruh nyata (P<0,05) terhadap distribusi ukuran L pada akhir penelitian. Pengelompokan ukuran ditentukan berdasarkan rata-rata panjang tubuh dan standar deviasi, walaupun metode ini sebenarnya belum standar pada ikan botia, tidak seperti pada ikan neon tetra, sumatera dan ikan hias lainnya. Pengelompokan ini hanya untuk menampilkan variasi ukuran setelah tiga bulan pemeliharaan ikan.
Tabel 5. Distribusi variasi ukuran ikan botia (kecil/S, sedang/M dan besar/L) di akhir penelitian pada perlakuan kontrol dan perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang dengan dosis berbeda.
Ukuran Dosis perendaman (bobot basah, mg/L)
A (0,12) B (1,2) C (12) D (120) (Kontrol-1)E (Kontrol-2)F (Kontrol-3)G
S (%) 30,7±2,9a 28,1±4,8a 27,6±3,1a 28,4±7,0a 34,4±10,7a 32,2±2,0a 29,9±2,0a
M (%) 36,4±4,4a 34,9±4,3a 36,9±4,1a 36,4±7,4a 33,3±12,0a 35,6±4,0a 37,9±3,5a
L (%) 33,0±1,8ab 37,1±0,7b 35,6±1,1ab 35,2±1,3ab 32,2±1,1a 32,2±2,0a 32,2±2,0a
Perendaman hormon pertumbuhan rekombinan dilakukan sekali pada awal pemeliharaan dengan dosis berbeda. Huruf superskrip berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P<0,05). Ukuran S (kecil, TL= 15,5±4,5 mm), M (sedang, TL= 25,5±4,5 mm) dan L (besar, TL= 35,5±4,5 mm).
9
persentase ukuran kecil menurun dibandingkan kontrol-1. Dengan demikian dapat disimpulkan bahwa dosis perendaman terbaik rElGH adalah 1,2 mg/L.
Hasil Penelitian Tahap Kedua
Parameter yang diamati pada tahap kedua lebih sedikit dibandingkan pada tahap pertama, dikarenakan parameter panjang lebih dijadikan patokan untuk ikan hias. Penelitian uji bioaktivitas pemberian rElGH dengan dosis berbeda secara oral melalui pakan alami bloodworm didapatkan hasil seperti terlihat pada Tabel 6. Pertumbuhan benih ikan botia dengan pemberian rElGH melalui bloodworm pada benih ikan botia untuk perlakuan N (30 mg/kg pakan), lebih panjang (P<0,05) dibandingkan kontrol (K) dan perlakuan rElGH dosis 0,3 mg/kg pakan (L), tetapi tidak berbeda nyata dengan perlakuan dosis rElGH 3 mg/kg pakan (M). Pada perlakuan dosis rElGH 0,3 dan 3 mg/kg pakan (perlakuan L dan M) tidak berbeda nyata (P>0,05) dan keduanya juga tidak berbeda nyata dengan kontrol (K). Nilai pertumbuhan panjang benih ikan botia meningkat seiring peningkatan dosis rElGH, nilai paling tinggi terdapat pada perlakuan N sebesar 5,87% lebih tinggi dibandingkan kontrol.
Tabel 6. Panjang akhir, laju pertumbuhan harian panjang (LPHp), kelangsungan hidup benih ikan botia pada kontrol dan perlakuan pemberian rElGH dengan dosis berbeda secara oral melalui pakan alami bloodworm
Parameter Dosis rElGH dalam pakan berdasarkan bobot basah (mg/kg pakan)
K (0) L (0,3) M (3) N (30)
Panjang akhir (mm) 40,37±1,35a 40,44±0,78a 41,62±0,06ab 42,74±0,62b
LPHp (%) 0,548±0,040a 0,551±0,023a 0,585±0,002ab 0,617±0,017b
Sintasan (%) 86,00±6a 85,33±1,5a 88,67±9,45a 89,33±6,11a
Keterangan :Pemberian protein rekombinan hormon pertumbuhan dilakukan dua kali seminggu selama pemeliharaan dengan dosis berbeda. Huruf superskrip yang berbeda pada baris yang sama adalah berbeda nyata (P<0,05).
Pemberian rElGH dosis 30 mg/kg pada benih ikan botia melalui pakan alami bloodworm dapat meningkatkan pertumbuhan panjang secara signifikan sebesar 5,87% dibandingkan kontrol. Dosis pemberian rElGH terbaik melalui pakan alami bloodworm adalah 30 mg/kg pakan.
Hasil Penelitian Tahap Ketiga
10
berulang dan dalam dosis yang tepat. Sementara itu, sintasan ikan pada semua perlakuan adalah sama (P>0,05).
Tabel 7. Panjang akhir, laju pertumbuhan harian panjang (LPHp) dan sintasan benih ikan botia pada kontrol dan perlakuan pemberian rElGH melalui kombinasi perendaman pada stadia larva dan oral pada stadia benih.
Parameter Kontrol (P) Perendaman Perlakuan
saja (Q) Pakan saja (R) dan pakan (S) Perendaman
Panjang akhir (mm) 40,37±1,35a 41,97±0,61ab 42,74±0,62b 45,23±0,76c
LPHp (%) 1,165±0,020a 1,188±0,009ab 1,199±0,009b 1,233±0,010c
Sintasan (%) 86,00±6,00a 90,00±3,00a 89,33±6,11a 88,67±2,52a
Keterangan : Huruf superskrip yang berbeda pada baris yang sama adalah berbeda nyata (P<0,05).
Ukuran ikan tiap perlakuan pada akhir penelitian (setelah umur enam bulan) dapat dilihat pada Gambar 2.
P Q R S
Gambar 2. Ikan botia umur enam bulan hasil percobaan perlakuan pemberian rElGH dengan metode berbeda: P) kontrol; Q) perendaman saja; R) oral lewat pakan saja; S) perendaman + oral lewat pakan.
Ekspresi gen IGF-1
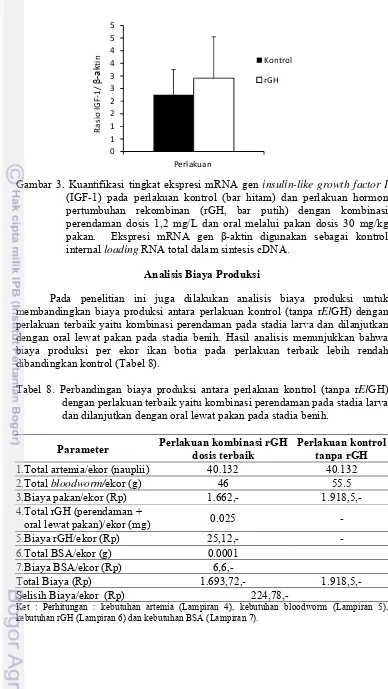
Pada penelitian ini juga diukur level ekspresi IGF-1. Hasil penelitian menunjukkan bahwa level ekspresi IGF-1 pada ikan perlakuan (2,91) meningkat sebesar 29,38% lebih tinggi dibandingkan kontrol (2,25) (Gambar 3). Tingginya tingkat ekspresi IGF-1 akibat pemberian rElGH menunjukkan bahwa aktivitas rElGH melibatkan IGF-1. Hasil analisis elektroforesis IGF-1 dapat dilihat pada Lampiran 3.
11
Gambar 3. Kuantifikasi tingkat ekspresi mRNA gen insulin-like growth factor I (IGF-1) pada perlakuan kontrol (bar hitam) dan perlakuan hormon pertumbuhan rekombinan (rGH, bar putih) dengan kombinasi perendaman dosis 1,2 mg/L dan oral melalui pakan dosis 30 mg/kg pakan. Ekspresi mRNA gen β-aktin digunakan sebagai kontrol internal loading RNA total dalam sintesis cDNA.
Analisis Biaya Produksi
Pada penelitian ini juga dilakukan analisis biaya produksi untuk membandingkan biaya produksi antara perlakuan kontrol (tanpa rElGH) dengan perlakuan terbaik yaitu kombinasi perendaman pada stadia larva dan dilanjutkan dengan oral lewat pakan pada stadia benih. Hasil analisis menunjukkan bahwa biaya produksi per ekor ikan botia pada perlakuan terbaik lebih rendah dibandingkan kontrol (Tabel 8).
Tabel 8. Perbandingan biaya produksi antara perlakuan kontrol (tanpa rElGH) dengan perlakuan terbaik yaitu kombinasi perendaman pada stadia larva dan dilanjutkan dengan oral lewat pakan pada stadia benih.
Parameter Perlakuan kombinasi rGH dosis terbaik Perlakuan kontroltanpa rGH
1.Total artemia/ekor (nauplii) 40.132 40.132
2.Total bloodworm/ekor (g) 46 55.5
3.Biaya pakan/ekor (Rp) 1.662,- 1.918,5,-
4.Total rGH (perendaman +
oral lewat pakan)/ekor (mg) 0.025 -
5.Biaya rGH/ekor (Rp) 25,12,- -
6.Total BSA/ekor (g) 0.0001
7.Biaya BSA/ekor (Rp) 6,6,-
Total Biaya (Rp) 1.693,72,- 1.918,5,-
Selisih Biaya/ekor (Rp) 224,78,-
Ket : Perhitungan : kebutuhan artemia (Lampiran 4), kebutuhan bloodworm (Lampiran 5), kebutuhan rGH (Lampiran 6) dan kebutuhan BSA (Lampiran 7).
12
Rendahnya biaya produksi dengan pemberian rElGH menunjukkan bahwa terdapat efisiensi biaya akibat waktu yang diperlukan benih ikan botia mencapai ukuran jual lebih cepat dibandingkan kontrol (Gambar 4).
Gambar 4. Waktu yang diperlukan ikan botia mencapai ukuran jual (4 cm) pada setiap perlakuan.
Dari Gambar 4terlihat bahwa terdapat perbedaan waktu yang diperlukan ikan botia mencapai ukuran jual (4 cm). Selisih waktu antara perlakuan terbaik yaitu kombinasi perendaman pada stadia larva dan dilanjutkan dengan oral lewat pakan pada stadia benih yaitu 18 hari lebih cepat dibandingkan kontrol.
Pembahasan Pertumbuhan
Peningkatan pertumbuhan melalui pemberian rGH pada ikan konsumsi sudah banyak dilaporkan. Metode pemberiannya juga beragam (injeksi, perendaman, dan oral). Pada ikan hias, efektivitas pemberian rGH telah dilaporkan pada ikan koki melalui injeksi dapat meningkatkan pertumbuhan bobot hingga 3,1 kali dibandingkan kontrol (Promdonkoy et al., 2004), pada ikan manvish melalui perendaman dapat meningkatkan pertumbuhan bobot hingga 1,6 kali dibandingkan kontrol (Acosta et al., 2009).
Pemberian rGH pada penelitian-penelitian sebelumnya biasanya hanya menggunakan satu metode saja. Pemberian melalui kombinasi antar metode sudah dilakukan pada ikan sidat, yaitu melalui kombinasi perendaman dan oral. Hasil penelitian menunjukkan bahwa kombinasi keduanya lebih baik dibandingkan
13
hanya melalui perendaman atau oral saja (Handoyo, 2012). Pada ikan hias, pemberian rGH melalui kombinasi antara satu metode dengan metode lainnya untuk memperbesar efek terhadap pertumbuhan belum pernah dilakukan. Pada penelitian ini, kombinasi pemberian rGH melalui perendaman pada stadia larva dan dilanjutkan secara oral melalui pakan alami bloodworm terbukti menghasilkan performa terbaik dibandingkan kedua metode yang lain (melalui perendaman saja atau oral saja). Hasil ini membuktikan bahwa pemberian rGH pada ikan perlu dilakukan secara berulang untuk mendapatkan hasil yang lebih maksimal seperti halnya pada ikan sidat (Handoyo, 2012). Hasil ini juga diperkuat dengan data bahwa level IGF-1 terdapat level tertinggi dan setelahnya akan kembali pada level normal. Pada ikan sidat, level IGF-1 meningkat pada jam ke 24 setelah pemberian dan tidak berbeda setelah hari ke-7 (Handoyo, 2012). Pada ikan rainbow, Haghighi et al., (2011) menyatakan bahwa hormon pertumbuhan rekombinan yang diberikan secara oral tidak terdeteksi lagi dalam darah, saluran pencernaan dan otot pada 90 menit setelah pemberian. Irmawati et al., (2012) melaporkan juga pada ikan gurami bahwa level IGF-1 larva ikan gurami mengalami peningkatan setelah direndam dalam larutan yang mengandung rGH, dan puncaknya pada jam ke-24 dan kemudian menurun sampai ke kondisi semula pada jam ke-48.
Penjelasan mengenai mekanisme masuknya rGH dalam tubuh ikan ketika diberikan melalui perendaman dan oral (melalui proses penyalutan) masih belum jelas. Pada penelitian sebelumnya dijelaskan bahwa gonadotropin releasing hormone mampu terserap oleh insang ikan mas koki, dan pada percobaan BSA yang diberi label radioaktif mampu melewati insang dan lapisan epidermis ikan rainbow trout setelah direndam dalam larutan yang berisi BSA tersebut. Ukuran partikel BSA (66,5 kDA) lebih besar dibandingkan dengan rGH (20-25 kDa) (Moriyama & Kawauchi, 1990); Carpio et al., 2007). Dengan demikian, diduga bahwa rGH diserap oleh tubuh ikan melalui insang dan lapisan epidermis. Selanjutnya, penyerapan rGH pada pemberian secara oral adalah melalui usus (Habibi et al., 2003).
14
Sintasan
Sintasan benih ikan botia yang diberi rElGH melalui perendaman, secara oral dan kombinasi perendaman dan oral sama dengan kontrol (P>0,05). Jika dilihat dari nilai sintasannya, semuanya tergolong tinggi yaitu >86%. Kondisi ini dikarenakan selama penelitian tidak ada serangan penyakit yang bisa menyebabkan rendahnya nilai sintasan. Terkait pengaruh rElGH terhadap sintasan, beberapa penelitian sebelumnya dilaporkan bahwa sintasan ikan yang diberi rElGH lebih tinggi daripada kontrol (Handoyo, 2012; Hardiantho et al., 2012). Pada faktanya, peningkatan daya tahan ikan yang telah diberi rGH terhadap infeksi penyakit karena GH mampu meningkatkan sel-sel yang berkompeten dalam sistem kekebalan tubuh (Kelley, 1989; Gala, 1991; Sakai et al., 1997; Harris & Bird, 2000).
Tingkat Ekspresi IGF-1
Peran GH dalam mempengaruhi pertumbuhan, penelitiannya sudah banyak dilakukan. Perkembangan terakhir diketahui adanya mekanisme secara langsung dan tidak langsung GH dalam memacu pertumbuhan. Mekanisme secara langsung adalah GH akan langsung mempengaruhi pertumbuhan organ target (tanpa perantara IGF-1 di dalam hati). Mekanisme tidak langsung adalah mekanisme GH dalam mempengaruhi pertumbuhan yang dimediasi oleh IGF-1 dalam hati ikan. Pada penelitian ini ekspresi IGF-1 lebih tinggi daripada kontrol. Hal tersebut mengindikasikan bahwa induksi pertumbuhan ikan botia akibat pemberian rElGH dimediasi oleh IGF-1. Hasil yang sama juga telah dilaporkan pada ikan yellow tail (Seriola quinqueradiata), perlakuan rGH dapat meningkatkan IGF-1 dalam hati (Pedroso et al., 2009). Pemberian GH secara oral pada ikan salmon juga meningkatkan plasma IGF-1 sampai puncaknya pada 24 jam setelah pemberian. Level plasma IGF masih tinggi sampai tiga hari, kemudian kembali pada level normal (Moriyama et al., 2000).
Analisis Ekonomi
15
KESIMPULAN
Dosis rElGH yang menghasilkan respons pertumbuhan ikan botia terbaik melalui metode perendaman pada stadia larva adalah 1,2 mg/L dan secara oral pada stadia benih adalah 30 mg/kg pakan. Pemberian rElGH secara kombinasi melalui metode perendaman pada stadia larva dan oral pada stadia benih lebih baik dibandingkan pemberian secara perendaman saja atau oral saja.
DAFTAR PUSTAKA
Acosta J, Morales R, Morales A, Alonso M, Estrasa MP. 2007. Pichia pastoris expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnol Lett. 29: 1671-1676.
Acosta J, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinez E, Valdes J, Borroto C, Besada V, Sanchez A, Herera F. 2009. Tilapia somatotropin polypeptides: potent enhancers of fish growth and innate immunity. Biotechnologia Aplicada. 26: 267-272.
Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faisal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal. 5: 11-16.
Aminah. 2012. Aplication of giant grouper recombinant hormone on glass eel by immersed at different doses (Skripsi). Bogor Agricultural University. Bogor.
Carpio Y, Leon K, Acosta J, Morales R, Estrada MP. 2007. Recombinant tilapia neuropeptide Y promotes growth and antioxidant defenses in African catfish Clarias gariepinus fry. Aquaculture. 272: 649-655.
Debnanth S. 2010. A review on the physiology of Insulin like Growth Factor-I (IGF-I) peptide in bony fishes and its phylogenetic correlation in 30 different taxa of 14 families of teleosts. Advances in Environmental Biology. 5: 31-52.
Gala R R. 1991. Prolactin and growth hormone in the regulation of the immune system. Proc Sot Exp Biol Med. 198: 513-527.
Habibi HR, Ewing R, Bajwa, Walker RI. 2003. Gastric uptake of recombinant growth hormone in rainbow trout. Fish Physiology and Biochemistry. 28: 463-467.
Haghighi M, Sharif RM, Sharifpour I, Sepahdari A, Lashtoo AGR. 2011. Oral recombinant bovine somatotropin improves growth performance in rainbow trout Oncorhynchus mykiss. Iranian Journal of Fisheries Sciences. 10: 415-424.
Handoyo, B. 2012. Respons benih ikan sidat terhadap hormon pertumbuhan rekombinan ikan kerapu kertang melalui perendaman dan oral (Tesis). Institut Pertanian Bogor. Bogor.
16
Hardiantho D, Alimuddin, Prasetyo AE, Yanti DH, Sumantadinata K. 2012. Performa benih ikan nila diberi pakan mengandung hormon pertumbuhan rekombinan ikan mas dengan dosis berbeda. Jurnal Akuakultur Indonesia. 11 (1): 17-22.
Harris J, Bird DJ. 2000. Modulation of the fish immune system by hormones: Mini review. Veterinary Immunology and Immunopathology. 77: 163-176. Irmawati, Alimuddin, Junior MZ, Suprayudi MA, Wahyudi AT. 2012. The
increase of growth rate giant gourami fry Osphronemus goramy Lac. that immersed with the water containing common carp growth hormone. Jurnal Iktiologi Indonesia.12: 13-23.
Kelley KW. 1989. Growth hormone, lymphocytes and macrophages. Biochemical Pharmacology. 38: 705-713.
Moriyama S, Kawauchi H. 1990. Growth stimulation of juvenile salmonids by immersion in recombinant salmon growth hormone. Nippon Suisan Gakkaishi. 56: 31-34.
Moriyama S, Felix GA, Hiroshi K. 2000. Growth regulation by insuline-like growth factor-1 in fish. Bioscience Biotechnology Biochemistry. 64: 1553-1562.
Pedroso FL, Fukada H, Masumoto T. 2009. In Vivo and in vitro effect of recombinant salmon growth hormone treatment on IGF-1 and IGFBPs in yellowtail Seriola quinqueradiata. Fisheries Science.75: 887-894.
Permana A, Kusumah VR, Priyadi A. 2011. Culture of Botia fish Chromobotia macracanthus Bleeker as ex-situ conservation model. Prosiding Forum Nasional Pemacuan Sumber Daya Ikan III. Hasil Penelitian Perikanan dan Kelautan, Bandung.
Promdonkoy B, Warit S, Panyim S. 2004. Production of a biologically active growth hormone from giant catfish Pangasianodon gigas in Escherichia coli. Biotechnol Lett. 26: 649-653.
Sakai M, Kajita Y, Kobayashi M, Kawauchi H. 1997. Immunostimulating effect of growth hormone: in-vivo administration of growth hormone in rainbow trout enhances resistance to Vibrio anguillarum infection. Veterinary Immunology and Immunopathology. 57: 147-152.
Sanchez JP, Piere YLB. 1999. Growth hormone axis as marker of nutritional status and growth performance in fish. Aquaculture, 177: 117-128.
Syazili A, Irmawati, Alimuddin, Sumantadinata K. 2011. Kinerja pertumbuhan dan kelangsungan hidup juvenil ikan gurami yang direndam hormon pertumbuhan rekombinan dengan frekuensi berbeda. Jurnal Akuakultur Indonesia. 11: 23-27.
Subaidah S, Carman O, Sumantadinata K, Sukenda, Alimuddin. 2012. Respons pertumbuhan dan ekspresi gen udang vaname Litopenaeus vannamei setelah direndam dalam larutan hormon pertumbuhan rekombinan ikan kerapu kertang. Jurnal Riset Akuakultur. 7: 359-369.b
17
LAMPIRAN
18
Lampiran 1. Proses perendaman larva ikan botia dalam hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dan pemeliharaannya
Kejut salinitas Pencampuran ikan dalam Direndam di baskom 20 g/L rElGH + BSA + 3 g/L plastik (1 jam)
Aklimatisasi Pemeliharaan Sampling di akuarium (5 ekor/L) (3 minggu sekali)
Lampiran 2. Proses pencampuran hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) ke pakan uji (bloodworm)
rElGH sesuai perlakuan Binder : kuning telur dilarutkan dalam ayam (Hardiantho, 2012)
10 ml PBS
Disemprotkan Diangin-anginkan Diberikan ke ikan secara merata (5-10 menit)
pada pakan
19
Lampiran 3. Hasil analisis IGF-1 pada hati ikan botia yang diberi perlakuan rElGH dengan perlakuan terbaik dan kontrol
Keterangan :
M = Marker
P1 = β-aktin kontrol ulangan 1 P2 = β-aktin kontrol ulangan 2 P3 = β-aktin kontrol ulangan 3
S1 = IGF-1 perlakuan terbaik ulangan 1 S2 = IGF-1 perlakuan terbaik ulangan 2 S3 = IGF-1 perlakuan terbaik ulangan 3
22
Lampiran 4. (lanjutan) Perhitungan biaya artemia selama penelitian
425 g artemia (cyste) 79.900.000
1 g artemia (cyste) 188.000
Jumlah kebutuhan artemia (cyste) 40.132
Jumlah kebutuhan artemia (g) 0.21
Harga 425 g artemia (Rp) 850.000
Harga 1 g artemia (Rp) 2.000
Harga 0,21 g artemia (Rp) 420
Lampiran 5. Perhitungan kebutuhan penggunaan bloodworm selama penelitian dan perhitungan biayanya
Jumlah kebutuhan bloodworm perlakuan kontrol (g) 55.5 Jumlah kebutuhan bloodworm perlakuan kombinasi (g) 46
Harga bloodworm/kg (Rp) 27.000
Harga bloodworm/g (Rp) 27
Biaya kebutuhan bloodworm perlakuan kontrol (Rp) 1.498,5 Biaya kebutuhan bloodworm perlakuan kombinasi (Rp) 1.242 Lampiran 6. Perhitungan kebutuhan penggunaan rGH selama penelitian dan
perhitungan biayanya
Dosis rGH melalui perendaman (mg/L) 0.12
Jumlah larva yang direndam (ekor) 1.000
Kebutuhan rGH total 0.00012
Harga rGH per mg (Rp) 1.000
Biaya rGH melalui perendaman (Rp) 0.12
Dosis rGH melalui oral per kg (mg) 3
Total bloodworm yang dikonsumsi 1 ekor ikan selama
perlakuan (g) 8.2
Kebutuhan rGH (mg) 0.025
Harga rGH/mg (Rp) 1.000
Biaya rGH melalui oral (Rp) 25
23
Lampiran 7. Perhitungan kebutuhan penggunaan BSA selama penelitian dan perhitungan biayanya
Dosis BSA melalui perendaman (g/L) 0.1
Jumlah larva yang direndam (ekor) 1.000
Kebutuhan BSA total (g) 0.0001
Harga BSA per g (Rp) 66.000
24
RIWAYAT HIDUP
Penulis dilahirkan di Cilacap pada tanggal 11 September 1981 sebagai anak kedua dari dua bersaudara oleh pasangan Rukman dan Tarmunah. Penulis menyelesaikan pendidikan sekolah menengah atas di SMU Negeri1 Dayeuhluhur tahun 1999. Pada tahun 2000 penulis diterima di Institut Pertanian Bogor pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, melalui jalur Penelusuran Minat Dan Bakat (PMDK). Pendidikan sarjana penulis selesaikan tahun 2006. Pada tahun 2012, penulis mendapatkan kesempatan untuk menempuh pendidikan magister ke Sekolah Pascasarjana IPB, program studi Ilmu Akuakultur.