THE STUDY OF ETHYLENE AND OXYGEN ADSORPTION FOR FRESH
FRUITS STORAGE
Adiesty Permata Kusumaning Ayu, Y. Aris Purwanto, and Sutrisno.
Departement of Machine and Biosistem Engineering, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Bogor Campus, PO Box 220, Bogor, West Java, Indonesia.
Phone 081931345087, e-mail: ichbindiest@yahoo.co.id
ABSTRACT
Most fruits are still doing respiration even after been harvested. Respiration causes ripening of the fruit and at the end will causes wilting and rotting them. There are several things that influences Respiration Quote including ethylene and oxygen gas. The ethylene and oxygen gas will increase Respiration Quote and causes the damaging of fruit and at the end will decrease its storage time. Postharvest treatments carried out in order to maintain the quality of fresh fruit. One of the treatments that can be used is potassium permanganate as ethylene scavenger and ascorbic acid as oxygen scavenger. The objectives of this study were to determine the effectiveness of ethylene and oxygen scavenger, the effect of airflow and to learn model of ethylene and oxygen adsorption.
Potassium permanganate (KMnO4) and ascorbic acid (C6H8O6) which used in this study
were KMnO4 75%, KMnO4 10%, C6H8O6 40%, and C6H8O6 60%. Each of the salute was adsorpted by
activated carbon as adsorption media. In addition, 700 rpm and 1800 rpm velocity of fan were applied in each KMnO4 and C6H8O6 combination. The using of velocity fan produced 0.159 m3/s and
0.408 m3/s volumetric airflow. Based on research, R1K1A2 (1800 rpm, KMnO4 75%, C6H8O6 60%)
showed best result because it was able to decrease ethylene up to 121.40233 ppm in second hour measurement and there was not any ethylene measured at the next hour measurements. In oxygen measurement, the best behavior wos R2K1A2 (700rpm, KMnO4 75%, C6H8O6 60%) because it was
able to decrease oxygen up to 20.5% while others were only reach 20.6%. Model of ethylene adsorption follows quadratic polynomial equation: E(t) = 0.0426 - 0.0127t+0.0009t2, E(t) is ethylene adsorption rate (ml/gram/hour) and t is time in hour. Model of oxygen adsorption follows linier equation, E(t) = 21.02 – 0.0158t, E(t) is oxygen concentration (%) and t is time in hour.
BAB I. PENDAHULUAN
1.1
LATAR BELAKANG
Sebagian besar buah-buahan yang telah dipanen masih melakukan proses respirasi. Respirasi menyebabkan terjadinya pematangan pada buah dan pada akhirnya buah tersebut akan mengalami perubahan seperti pelayuan dan pembusukan. Respirasi sendiri merupakan perombakan bahan organik yang lebih komplek seperti pati, asam organik dan lemak menjadi produk yang lebih sederhana (karbondioksida dan air) dan energi dengan bantuan oksigen. Aktivitas respirasi penting untuk mempertahankan sel hidup buah. Buah-buahan dengan laju respirasi tinggi cenderung cepat mengalami kerusakan. Percepatan respirasi ini juga dipengaruhi oleh keberadaan etilen. Etilen adalah senyawa organik sederhana yang berfungsi sebagai hormon pertumbuhan, perkembangan dan kelayuan. Oleh sebab itu keberadaan etilen perlu ditekan pada saat buah telah mengalami kematangan agar daya simpan buah-buahan lebih lama.
Pola respirasi produk hortikultura dibagi menjadi dua, yaitu klimaterik dan non-klimaterik. Produk holtikultura yang memiliki respirasi klimaterik ditandai dengan produksi karbohidrat meningkat bersamaan dengan buah menjadi masak dan meningkatnya produksi etilen. Saat buah-buahan mencapai masak fisiologi, respirasinya mencapai klimaterik yang paling tinggi. Respirasi klimaterik dan proses pemasakan dapat berlangsung pada saat buah masih di pohon atau telah dipanen.
Pemanenan dapat dilakukan ketika laju respirasi suatu buah-buahan sudah mencapai klimaterik. Hal ini karena ketepatan pemanenan sangat mempengaruhi kualitas buah-buahan tersebut. Buah yang dipanen terlalu muda akan menyebabkan kematangan yang tidak sempurna sehingga kadar asamnya meningkat dan rasa buah menjadi asam. Pemanenan yang terlalu tua menyebabkan kualitas buah turun pada saat disimpan dan rentan terjadi pembusukan. Buah-buahan yang tergolong klimaterik adalah pisang, tomat, pepaya, apel dan mangga. Pola respirasi buah-buahan yang tidak menunjukkan karakteristik seperti klimaterik disebut non-klimaterik. Contoh buah-buahannya adalah strawbery, jeruk, cabai, dan nanas.
Pengurangan laju respirasi sampai batas tertentu dapat memperpanjang daya simpan buah-buahan segar tetapi kebutuhan energi sel terpenuhi. Pengendalian respirasi tersebut dapat dilakukan dengan memberikan beberapa perlakuan pascapanen. Buah-buahan merupakan produk hortikultura yang mudah rusak oleh karena itu penanganan pascapanen ini menjadi salah satu bagian penting dalam suatu sistem pemasaran buah-buahan. Salah satu teknologi pascapanen tersebut adalah
Modified Atmosphere Packaging (MAP). MAP tergolong aktif, dikenal sebagai active packaging jika mutu udara di dalam kemasan diubah dengan memasukkan bahan tambahan (additives) ke dalam kemasan. Bahan tambahan di dalam kemasan ditunjukkan untuk memperpanjang masa simpan dan mempertahankan mutu buah (Widodo, 2004).
mikroba anaerob yang sensitif terhadap karbondioksida (Anonim, 1991). Hal ini menunjukan bahwa bahan penyerap etilen dan oksigen dapat diaplikasikan berdampingan secara langsung dengan produk hortikultura, termasuk buah-buahan. Dalam beberapa kasus, umum digunakan teknik simulasi untuk mengetahui efektifitas bahan penyerap sebelum diaplikasikan sebagai bagian dari sistem pengepakan buah segar. Simulasi ini dilakukan dalam ruang tertutup sehingga tidak ada pengaruh udara dari luar sistem. Pemakaian kipas di dalam sistem bertujuan untuk sirkulasi udara sehingga udara (etilen dan oksigen) di dalam ruang tertutup dapat tersalurkan kedalam bahan penyerap.
1.2 TUJUAN PENELITIAN
Tujuan dari penelitian ini adalah:
1. Mempelajari pengaruh kecepatan aliran udara kipas terhadap penyerapan etilen dan oksigen 2. Menentukan konsentrasi penyerap etilen dan oksigen yang paling baik
II. TINJAUAN PUSTAKA
2.1 PERANAN ETILEN DALAM PENYIMPANAN BUAH
Etilen adalah suatu gas tanpa warna dengan sedikit berbau manis. Etilen merupakan suatu hormon yang dihasilkan secara alami oleh tumbuhan dan merupakan campuran yang paling sederhana yang mempengaruhi proses fisiologi pada tumbuhan. Proses fisiologi pada tumbuhan antara lain perubahan warna kulit, susut bobot, penurunan kekerasan, perubahan kadar gula dan lain-lain (Winarno dan Aman, 1979).
Etilen merupakan jenis senyawa tidak jenuh atau memiliki ikatan rangkap yang dapat dihasilkan oleh jaringan tanaman pada waktu tertentu dan pada suhu kamar etilen berbentuk gas. Senyawa ini dapat menyebabkan terjadinya perubahan penting dalam proses pertumbuhan tanaman dan pematangan hasil-hasil pertanian. Etilen disebut hormon karena dapat memenuhi persyaratan sebagai hormon yang dihasilkan oleh tanaman, bersifat mobile dalam jaringan tanaman dan merupakan senyawa organik. Pada tahun 1959 diketahui bahwa etilen tidak hanya berperan dalam proses pematangan saja, tetapi juga berperan dalam mengatur pertumbuhan tanaman (Winarno, 2002). Trucker di dalam Saputro (2004) menyatakan bahwa gas etilen (C2H4) adalah suatu jenis bahan yang banyak digunakan sebagai pemicu (trigger) proses pematangan, dimana jumlah dan waktu yang tepat dalam pemberiannya juga sangat khas untuk tiap jenis buah. Menurut Winarno dan Aman (1979), konsentrasi etilen selama pematangan berubah-ubah. Buah pisang yang baru dipanen mengandung etilen 0.2 ppm dan sekitar 4 jam sebelum pematangan jumlah etilen secara cepat bertambah menjadi sekitar 0.5 ppm. Pisang pada saat memasuki proses pematangan, jumlah etilen sekitar 1.0-1.5 ppm dan segera setelah respirasi hingga mencapai puncak klimaterik jumlah etilen meningkat menjadi 25-40 ppm.
Usaha untuk mengurangi etilen akan mengakibatkan tertundanya kematangan dan mempertahankan kesegaran serta memperpanjang umur simpan (Pantastico et. al., 1989). Pada buah klimaterik respon etilen hanya berpengaruh pada saat fase pre-klimaterik sedangkan pada buah non-klimaterik, aktivitas respirasi dan pematangan dapat dipercepat pada semua fase tahap pematangan. Dengan adanya etilen, proses respirasi akan berlangsung cepat dan ikut dalam proses reaksi pemasakan. Semakin matang buah, produksi etilen semakin menurun. Adanya perlakuan tertentu yang dapat mengurangi kandungan etilen disekitar buah dapat memperpanjang umur simpan buah tersebut.
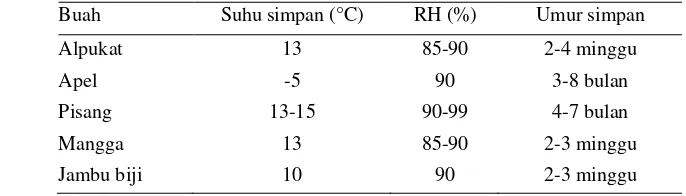
Tabel 1. Umur simpan beberapa jenis buah
Buah Suhu simpan (°C) RH (%) Umur simpan
Alpukat 13 85-90 2-4 minggu
Apel -5 90 3-8 bulan
Pisang 13-15 90-99 4-7 bulan
Mangga 13 85-90 2-3 minggu
Jambu biji 10 90 2-3 minggu
2.2 PENYERAP ETILEN
Terdapat beberapa macam senyawa penyerap etilen yang telah digunakan seperti karbon aktif yang diberi Brom dan Selit dengan KMnO4 kemudian berkembang menjadi KMnO4 Vermikulit. Apabila KMnO4 dimasukan kedalam kemasan pisang maka dapat menambah umur simpan pisang selama 2 minggu. Preparasi komersial zat penyerap etilen adalah “Purafil” (KMnO4 alkaslis dengan silikat) produksi Carbon Chemical Company ternyata mampu menyerap seluruh C2H4 yang dikeluarkan buah pisang yang disimpan dalam kantong polietilen tertutup rapat (Pantastico, 1989).
Penyerap etilen lain yang dapat digunakan adalah kalium permanganat (KMnO4), karbon aktif dan mineral-mineral lain yang dimasukkan ke dalam sachet. Bahan yang paling banyak digunakan adalah kalium permanganat yang dijerapkan pada silika gel. Permanganat akan mengoksidasi etilen membentuk etanol dan asetat. Bahan penyerap etilen ini mengandung 5% KMnO4 dan dimasukkan ke dalam sachet untuk mencegah keluarnya KMnO4 karena KMnO4 bersifat racun (Pantastico, 1989).
Tabel 2. Penyerap etilen komersil yang telah dikembangkan
Manufacturer Country Trademark Scavanger mechanism
Packaging form Air repair Products, Inc. USA N/A KMnO4 Sachet/blanket
Ethylene Control, Inc. USA N/A KMnO5 Sachets
Extenda Life System USA N/A KMnO6 Sachets
Kess Irrigations Systems USA BioKleen Titanium dioxide catalyst
not known
Sekisui Jushi Japan Neupalon Activated carbon Sachets
Honsu Paper Ltd Japan Hatofresh Activated carbon Paper/board
Mitsubishi Gas Chemical Co. Ltd
Japan SendoMate Activated carbon Sachet
Cho Yang Heung San Co. Ltd
Korea Orega Activated clays/zeolites
Plastic film
Evert-Fresh Coorporation USA Evert-Fresh Activated zeolites Plastic film
Odja Shoji Co. Ltd Japan BO Film Crysburite ceramic Plastic film
PEAK fresh Products Ltd Australia PEAK fresh Activated zeolites Plastic film
Food Science Australia Australia N/A Tetrazine derrivative
Plastic film
Sumber: Smart Packaging Technoligies for Fast Moving Consumer Goods. [http//books.google.co.id.]
Etilen dapat dioksidasi oleh kalium permanganat menjadi mangandioksida, kalium hidroksida, dan karbondioksida (Ahvenainen, 2003). Reaksi pemecahan etilen oleh kalium permanganat dapat dilihat dari persamaan berikut:
Kalium permanganat harus dibentuk menjadi larutan supaya penggunaanya bisa lebih efektif dan diserap oleh sebuah media penyerap kalium permanganat ke dalam bahan penyerap lebih optimal. Beberapa media penyerap yang banyak digunakan yaitu selit, vermikulit, pellet aluminia, karbon aktif, atau perlit. Biasanya bahan-bahan tersebut mengandung 4-6% KMnO4. Bahan penyerap yang mengandung KMnO4 berubah warna dari ungu menjadi coklat selama penggunaanya. Perubahan warna ini mengindikasikan kapasitas penyerapan yang tersisa, karena KMnO4 bereaksi menjadi MnO2 lalu menempel dan menutup permukaan bahan penyerap sehingga tidak bisa menyerap etilen lagi (ahvenainen, 2003).
Penggunaan KMnO4 dianggap mempunyai potensi besar karena sifatnya yang tidak mudah menguap sehingga dapat disimpan berdekatan dengan buah tanpa menimbulkan kerusakan (Roestamasyah, et, al., 1984, di dalam Pramudianti, 2004). Lebih lanjut, Abeles (1973) menjelaskan bahwa etilen perlu dihilangkan karena etilen sangat berpengaruh dalam menentukan umur simpan buah, sayuran, dan bunga secara nyata. Apeland (1961) di dalam Pramudianti (2004) menemukan bahwa permanganat dapat secara efektif menurunkan proses penguningan mentimun pada penyimpanan dan memperpanjang masa simpannya. Dostal dan Holf (1968) di dalam Pramudianti (2004) membuktikan bahwa larutan permanganat lebih efektif sebagai penyerap etilen daripada asam kromat yang ditambahkan dengan SnCl2, FeSO4, dan O2O5.
Penelitian yang dilakukan oleh Manan (1985) digunakan batu bata sebagai media penyerap kalium permanganat 75%. Percobaan yang dilakukan menggunakan buah pisang dalam bentuk sisir yang dimasukkan kedalam kantong plastik polietilen tebal 0.08 mm bersama bahan penyerap batu bata dengan ukuran 40 cm3 yang telah dicelup kedalam larutan KMnO4 75% selama 30 menit. Kantong plastik yang digunakan ada yang berlubang dan tanpa lubang. Perlakuan yang mampu memperpanjang umur simpan buah pisang ambon yang paling lama atau mencapai masa optimum umur 36 hari dan mulai lewat masak umur 39 hari adalah perlakuan kombinasi polietilen tanpa lubang dan batu bata ukuran 40 cm3 yang telah dicelupkan ke dalam KMnO4 75%.
Sholihati (2004) menyatakan bahwa secara umum perlakuan bahan penyerap etilen,KMnO4 10 gr, 20 gr, dan 30 gr memberikan pengaruh terhadap penghambatan pematangan, dengan dapat ditekannya produksi etilen dan dapat dipertahankannya warna hijau, tekstur serta aroma pisang buah raja selama 15 hari pada suhu 28 °C, dan 45 hari pada suhu 13 °C. Perlakuan penyerap terhadap penekanan produksi etilen dengan memecah ikatan rangkap etilen menjadi etilen glikol dan mangan dioksida, serta memperlambat proses perubahan fisik dan kimia pisang raja yang ditandai dengan warna tetap hijau sampai pada akhir penyimpanan dan kekerasan yang dapat dipertahankan serta tingginya kadar pati, rendahnya kadar gula, dan susut bobot yang cenderung rendah.
Dalam penelitian Darmawan (2007) digunakan larutan KMnO4 untuk mengemas bunga krisan tipe fiji yellow. Larutan KMnO4 yang digunakan terdiri dari dua macam, yaitu larutan dengan konsentrasi 5% dan 10%. Pada penelitian-penelitian terdahulu yang menggunakan KMnO4 sebagai penyerap etilen, konsentrasi yang lazim digunakan yaitu dalam satuan ppm. Pada awal konsep percobaan pada bunga krisan tipe fiji yellow akan digunakan dua macam konsentrasi larutan, yaitu konsentrasi larutan 50% dan 100%. Akan tetapi setelah dicoba dilakukan percobaan pembuatan larutan KMnO4 50% dan KMnO4 100%, butiran KMnO4 tidak dapat larut seluruhnya dalam air, sehingga menghasilkan endapan pada dasar bak air. Setelah dilakukan beberapa kali percobaan, akhirnya ditemukan bahwa butiran KMnO4 mulai larut pada konsentrasi 10% dan atau kurang dari 10%.
Faktor penyebab keragaman dari reaksi kimia senyawa ini adalah karena perbedaan valensi dari unsur Mn (mangan) mulai dari 1-7 yang hampir semuanya stabil kecuali 1 dan 5 (Siagian, 2009). Adapun sifat dan karakteristik dari KMnO4 adalah sebagai berikut:
1. Kristal berwarna ungu jelas atau hampir gelap
2. Larut 16 bagian dalam air pada suhu 20 °C dan membentuk larutan ungu 3. Berat jenis 2,703 g/cc
4. Berat molekul 158
5. KMnO4 merupakan bahan pengoksidasi dan bahan antiseptik
6. KMnO4 mudah rusak bila terkena cahaya matahari langsung, yakni akan terbentuk MnO2 yang mengendap. (Badan Penelitian dan Pengembangan Industri, 1998).
(a) KMnO4 serbuk (b) KMnO4 larutan
Gambar 1. KMnO4 dalam bentuk (a) serbuk dan (b) larutan
2.3 PERANAN OKSIGEN DALAM PENYIMPANAN BUAH
Oksigen merupakan unsur golonga
semua unsur lainnya (utamanya menjadi
unsur ini2 yang tidak berwarna, tidak berasa, dan tidak berbau. Oksigen merupakan unsur semesta berdasarkan massa dan unsur paling melimpah di 20,9% volume atmosfer bumi (http://id.wikipedia.org).
menembus plastik kemasan tidak mampu dihilangkan dengan teknologi tersebut. Untuk itu diperlukan penyerap oksigen yang mampu menyerap O2 pascakemas di dalam kemasan.
2.4 PENYERAP OKSIGEN
Menurut Nakamura dan Hosino (1983), yang dimaksud dengan penyerap oksigen adalah suatu bahan yang dapat menyerap oksigen secara kimiawi. Prinsip kerja dari penyerap oksigen ini adalah terjadinya reaksi antara suatu bahan dengan oksigen di udara, sehingga kalor di udara menjadi berkurang.
Banyak bahan atau senyawa yang dapat bereaksi dengan oksigen di udara, tetapi untuk dapat berfungsi sebagai penyerap oksigen yang baik, bahan tersebut harus memenuhi beberapa kriteria, yaitu tidak beracun, mempunyai kecepatan penyerapan yang baik, tidak menghasilkan gas beracun atau berbau, harus cukup stabil dalam penyimpanan, berukuran kecil tapi kapasitasnya besar, bahan baku mudah diperoleh dan murah (Nakamura dan Hosino, 1983).
Tabel 3. Penyerap oksigen komersil yang telah dikembangkan
Manufacturer Country Trade name Scavanger
mechanism Packaging form Mitsubishi Gas Chemical
Co. Ltd Japan Ageless Iron based
Sachets dan Labels
Taogosei Chem. Industry
Co. Ltd Japan Vitalon Iron based Sachets
Nippon soda Co. Ltd Japan Seagul Iron based Sachets
Finetec Co. Ltd Japan Sanso-Cut Iron based Sachets
Tokyo Seikan Kaisha Ltd. Japan Oxguard Iron based Plastic trays
Ueno Seiyaku Co. Ltd.
Japan Oxyeater Iron based Sachets dan Labels
M&G
Italy ActiTUF iron based Polyester bottles
Chevron Chemicals USA N/A Benzyl acrylate Plastic film
W.R. Grace Co, Ltd
USA PureSeal Ascorbate/
Metalic salts Bottle crowns
Grace Darex Packaging
Technologies USA DarExtend Ascorbate Bottle crowns Food Science Australia
Australia ZerO2
Photosensitive dye/organic
compund
Plastic film, bottles containers
CMB Technologies
Prancis Oxbar Cobalt catalysed
polymer oxidation Plastic bottles
Dalam penelitiannya, Sutrisno (2004) menjelaskan bahwa peranan penyerap oksigen dan bahan pelapis tehadap komoditi paprika sebagai upaya memperkecil susut bobot cukup efektif karena jumlah oksigen di udara yang sedikit dapat menghambat proses metabolisme atau respirasi sehingga kehilangan zat-zat relatif kecil. Sedangkan bahan pelapis berperan untuk memperkecil transpirasi sehingga kehilangan air dalam paprika dapat diperkecil dan penurunan susut bobot pun dapat diperkecil. Buah segar yang diberi edible coating dan penyerap oksigen dapat memperkecil kontak oksigen dengan zat-zat nutrisi dan enzim yang terdapat di dalam buah sehingga proses respirasi dapat dihambat dan laju perubahan buah dari segar ke senesen terkendali. Nampaknya terjadi interaksi antara penyerap oksigen dan bahan lapis terhadap kadar gas oksigen yang selanjutnya dipengaruhi oleh suhu penyimpanan (Permanasari, 1998: Vermeinen, 1999 di dalam Sutrisno, 2004). Penggunaan penyerap oksigen dari serbuk besi yang diaktifkan dengan NaCl terbukti dapat memperpanjanng umur simpan produk-produk pangan dengan baik (Kartikasari, 1992).
Pada umumnya teknologi pengemasan bahan pangan menggunakan satu atau lebih konsep berikut ini: oksidasi asam askorbat (C6H8O6), oksidasi serbuk besi, oksidasi pewarna peka cahaya, oksidasi enzimatis, asam lemak tak jenuh dan ragi. Diantara bahan makanan tersebut, asam askorbat dianggap yang paling luas penerimaannya oleh konsumen. Adapun reaksi yang akan terjadi dengan asam L-askorbat adalah:
Asam L-askorbat ↔ Asam dehidro L-askorbat + H2O
Reaksi asam L-askorbat diatas berlangsung dengan bantuan enzim oksidase atau peroksidase. Dari reaksi tersebut dapat dijelaskan bahwa dengan keberadaan asam L-askorbat aktif, oksigen didalam kemasan akan menurun karena digunakan untuk mengoksidasi asam L-askorbat yang akhirnya akan menyebabkan respirasi pada buah menurun dan memperpanjang masa simpan.
Dalam bukunya, Pantastico (1986) menyatakan bahwa asam askorbat, Cu-EDTA (kupri etilena diamin tetraasetat) dan BOH diketahui sebagai pembangkit pembentukan C2H4 (Cooper, dkk., 1986; Palmer dkk., 1967; Rasnussen dan Cooper 1968) bila disemprotkan sebelum pemanenan. Tetapi setelah dicoba sebagai pencelupan pascapanen, tidak ada dari zat-zat itu yang menghilangkan warna hijau dengan laju yang serupa dengan pengaruh pemberian C2H4 pada jeruk sitrun dan jeruk manis ”Satsuma” (Tsai dan Chiang, 1970), meskipun penghilangan warna hijaunya sedikit lebih baik daripada buah-buahan yanng tidak diberi perlakuan.
2.5 ADSORPSI
Adsorpsi adalah suatu proses pemisahan dimana komponen dari suatu fase fluida berpindah ke permukaan zat padat yang menyerap. Biasanya partikel-partikel kecil zat penyerap dilepaskan pada adsorpsi kimia yang merupakan ikatan kuat antara penyerap dan zat yang diserap sehingga tidak mungkin terjadi proses yang bolak-balik. Dalam adsorpsi digunakan istilah adsorbat dan adsorben. Adsorbat adalah substansi yang terjerap atau substansi yang akan dipisahkan dari pelarutnya, sedangkan adsorben merupakan suatu media penyerap. Adsorpsi yang terjadi pada permukaan adsorben dibagi dalam dua jenis, yaitu:
1. Adsorpsi Fisika
Adsorpsi fisika terjadi karena adanya gaya van der walls dan biasanya adsorpsi ini berlangsung secara bolak-balik. Ketika gaya tarik-menarik molekul antara zat terlarut dengan adsorben lebih besar dari gaya tarik-menarik zat terlarut dengan pelarut, maka zat terlarut akan cenderung teradsorpsi pada permukaan adsorben.
2. Adsorpsi Kimia
Adsorpsi kimia terjadi karena adanya reaksi kimia antara zat padat dengan adsorbat larut dan reaksi ini tidak berlangsung bolak-balik. Interaksi suatu senyawa organik dan permukaan adsorben dapat terjadi melalui tarikan elektrostatis atau pembentukan ikatan kimia yang spesifik misalnya ikatan kovalen. Sifat-sifat molekul organik seperti struktur, gugus fungsional dan sifat hidrofobik berpengaruh pada sifat-sifat adsorpsi.
Menurut Reynold (1982), adsorpsi adalah suatu proses dimana suatu partikel menempel pada suatu permukaan akibat dari adanya perbedaan muatan lemah diantara kedua benda, sehingga akhirnya membentuk suatu lapisan tipis partikel-partikel halus pada permukaan tersebut. Terdapat beberapa bahan yang umum digunakan sebagai bahan penyerap gas, diantaranya zeolit, silika gel, dan arang aktif. Ketiga bahan ini dianggap cukup aman jika diletakkan di sekitar buah selama tidak terjadi kontak langsung antara buah dengan bahan penyerap.
Zeolit umumnya didefinisikan sebagai kristal alumina silika yang berstruktur tiga dimensi, yang terbentuk dari tetrahedral alumina dan silika dengan rongga-rongga di dalam yang berisi ion-ion logam, biasanya alkali atau alkali tanah dan molekul air yang dapat bergerak bebas. Struktur zeolit sejauh ini diketahui bermacam-macam, tetapi secara garis besar strukturnya terbentuk dari unit bangun primer, berupa tetrahedral yang kemudian menjadi unit bangun sekunder polihedral dan membentuk polihendra dan akhirnya unit struktur zeolit. Karena sifat unik dari zeolit, maka zeolit banyak digunakan untuk berbagai aplikasi di industri, diantaranya zeolit digunakan di industri minyak bumi sebagai cracking, di industri deterjen sebagai penukar ion, pelunak air sadah dan di industri pemurnian air, serta berbagai aplikasi lain (Sunarya, 2009).
Zeolit juga ditemukan sebagai bantuan endapan pada bagian tanah jenis basalt dan komposisi kimianya tergantung pada kondisi hidrotermal lingkungan lokal, seperti suhu, tekanan uap air setempat dan komposisi air tanah lokasi kejadiannya.Zeolit sebagai katalis hanya mempengaruhi laju reaksi tanpa mempengaruhi kesetimbangan reaksi karena mampu menaikkan perbedaan lintasan molekuler dari reaksi yang terjadi. Katalis berpori dengan pori-pori yang sangat kecil akan memuat molekul-molekul kecil tetapi mencegah molekul besar masuk. Zeolit dapat menjadi katalis yang shape-selective dengan tingkat transisi selektitas atau dengan pengeluaran reaktan pada dasar diameter molekul. Zeolit mampu menjadi katalis asam dan dapat digunakan sebagai pendukung logam aktif atau sebagai reagen, serta dapat digunakan dalam katalis oksida.
mengoksidasi gas etilen. Walaupun demikian, silika gel dapat digunakan dengan KMnO4 untuk meningkatkan kapasitas penyerapan etilen. Selanjutnya dikatakan bahwa untuk mengikat etilen, bahan utama yang biasa digunakan adalah silika gel dengan KMnO4 sebagai pereaksi dengan etilen. Silika gel merupakan suatu bentuk dari silika yang dihasilkan melalui penggumpalan sol natrium silikat (NaSiO2). Sol mirip agar-agar ini dapat didehidrasi sehingga berubah menjadi padatan atau butiran mirip kaca yang bersifat tidak elastis. Sifat ini menjadikan silika gel dimanfaatkan sebagai zat penyerap, pengering dan penopang katalis (http://punkels.wordpress.com).
Arang aktif merupakan senyawa karbon amorph, yang dapat dihasilkan dari bahan-bahan yang mengandung karbon atau dari arang yang diperlakukan dengan cara khusus untuk mendapatkan permukaan yang lebih luas. Arang aktif dapat mengadsorpsi gas dan senyawa-senyawa kimia tertentu atau sifat adsorpsinya selektif, tergantung pada besar atau volume pori-pori dan luas permukaan. Daya serap arang aktif sangat besar, yaitu 25-1000% terhadap berat arang aktif (Djatmiko, et.al., 1983).
Setyaningsih (1995) mengungkapkan bahwa terdapat dua jenis arang aktif yang dapat dibedakan menurut fungsinya, yaitu arang penyerap gas (gas adsorben carbon) dan arang fasa cair (liquid-phase carbon). Arang penyerap gas digunakan untuk menyerap gas. Pori-pori yang terdapat pada arang jenis ini adalah mikropori yang menyebabkan molekul gas akan mampu melewatinya, tapi molekul dari cairan tidak akan melewatinya. Karbon jenis ini dapat ditemui pada karbon tempurung kelapa. Arang fasa cair digunakan untuk menyerap zat yang tidak diinginkan dari cairan atau larutan. Jenis pori-pori dari karbon ini adalah makropori yang memungkinkan molekul berukuran besar untuk masuk. Arang jenis ini biasanya berasal dari batu bara dan selulosa. Adapun mekanisme penyerapan menggunakan arang aktif adalah sebagai berikut :
a. Molekul adsorbat berpindah menuju lapisan terluar dari adsorben.
b. Karbon aktif dalam kesatuan kelompok mempunyai luas permukaan pori-pori yang besar sehingga dapat mengadakan penyerapan terhadap adsorbat.
c. Sebagian adsorbat ada yang teradsorpsi di permukaan luar, tetapi sebagian besar teradsorpsi di dalam pori-pori adsorben dengan cara difusi.
d. Bila kapasitas adsorpsi masih sangat besar, sebagian besar molekul adsorbat akan teradsorpsi dan terikat di permukaan. Tetapi bila permukaan pori adsorben sudah jenuh dengan adsorbat maka akan terjadi dua kemungkinan, yaitu, (1) terbentuk lapisan adsorpsi kedua, ketiga dan seterusnya, dan (2) tidak terbentuk lapisan adsorpsi kedua, ketiga dan seterusnya sehingga adsorbat yang belum teradsorpsi akan terus berdifusi keluar pori.
(a) (b) (c)
Gambar 3. Jenis bahan penyerap (a) arang aktif, (b) silika gel, dan (c) zeolit
Dalam penelitian ini, terdapat dua proses adsorpsi, pertama adsorpsi asam askorbat dan kalium permanganat pada arang atau karbon aktif dan yang kedua adalah adsorpsi gas oksigen atau etilen pada arang aktif. Sehingga dapat dikatakan bahwa etilen dan oksigen merupakan adsorbat sedangkan arang aktif berperan sebagai adsorben. Proses adsorpsi tergantung pada sifat zat padat yang mengadsorpsi, sifat atom/molekul yang diserap, konsentrasi, temperatur dan lain-lain.
2.6 POLA PENYERAPAN ETILEN DAN OKSIGEN
Pola Penyerapan Etilen dan Oksigen dapat ditentukan melalui pendekatan model matrmatika. Model matematika adalah pengabstraksian suatu masalah nyata berdasarkan asumsi tertentu ke dalam simbol-simbol matematika. Saat ini model matematika dipandang sebagai suatu alat yang ampuh dan murah untuk mengkaji dan menyelesaikan permasalahan dari berbagai bidang baik sains, teknik, industri, maupun ilmu-ilmu sosial. Kegunaannya sangat luas, mulai dari prediksi dan mitigasi bencana sampai dengan dukungan terhadap pengambilan keputusan
Chapra dalam Rizki (2004) mendefinisikan model matematika sebagai suatu formulasi atau persamaan yang mengungkapkan segi utama suatu sistem atau poses fisika dalam istilah matematika. Model matematika di bentuk dari dua tahapan. Tahapan pertama memerlukan penguasaan konsep dasar peristiwa yang ditinjau, pemahaman konsep matematika, kemampuan imajinasi dan kemampuan menyederhanakan (membuat asumsi). Sedangkan tahap kedua dilakukan secara analitis atau secara numerik dengan operasi matematika. Cara analitis memerlukan kemampuan matematika yang tinggi tetapi memerlukan jumlah hitungan yang lebih banyak dengan bantuan komputer dan hanya memberikan jawaban pendekatan.
.
Setiawan (1997) menjelaskan tahapan pokok pendekatan matematis ada dua tahapan yaitu (1) penyusunan persamaan matematis yang dapat mendekati peristiwa yang ditinjau (pemodelan) dan (2) penyelesaian persamaan-persamaan matematis yang telah disusun. Phillips (1976) dalam operation research, yang dimaksud dengan model adalah representasi sederhana dari sesuatu yang nyata. Dengan pengertian ini menunjukkan bahwa model tidak selalu sempurna. Tidak semua model matematika dapat diselesaikan dengan solusi analitis. Jika solusi analitis sulit didapatkan maka digunakan simulasi. Simulasi adalah suatu prosedur kuantitatif, yang menggambarkansebuah sistem, dengan mengembangkan sebuah model dari sistemtersebut dan melakukan sederetan uji coba untuk memperkirakanperilaku sistem pada kurun waktu tertentu.
mutu yang akan terjadi pada kondisi tertentu. Untuk menyusun model penyerapan etilen dan oksigen diperlukan beberapa parameter yang dapat diukur secara kuantitatif seperti konsentrasi etilen dan oksigen dalam selang waktu tertentu.
Berdasarkan penelitian Sholihati (2004) yang menggunakan kalium permanganat untuk memperpanjang umur simpan pisang raja yang disimpan pada dua kondisi, yaitu suhu ruang (28 °C) dan suhu 15 °C. Konsentrasi KMnO4 yang digunakan adalah 10 gr, 20 gr, dan 30 gr dan arang aktif yang digunakan sebagai bahan adsorber adalah 10 gr, 20 gr, 30 gr, dan 40 gr. Model penyerapan etilen pada suhu 28 °C mengikuti persamaan:
E = 0.0002t2 – 0.0009t + 0.0014 (1)
Sedangkan model penyerapan etilen pada suhu 15 °C mengikuti persamaan:
E = 0.0006t2 – 0.0004t + 0.0007 (2)
Gambar 4. Pola penyerapan etilen pada suhu ruang
Gambar 4 memperlihatkan pola penyerapan etilen mengacu kepada model penyerapan yang disusun oleh Sholihati (2004). Dari gambar terlihat bahwa pola penyerapan etilen mengikuti model kuadratik dan laju penyerapan etilen semakin besar seiring dengan bertambahnya waktu.
Pola penyerapan oksigen berdasarkan Sagala (2010) menunjukan berkurangnya konsentrasi etilen akibat penggunaan asam askorbat selama 12 hari pengukuran, meskipun pengurangan oksigennya tergolong kecil (Gambar 5). Dalam penelitiannya, Sagala (2010) menggunakan asam askorbat 200 ppm, 400 ppm dan 60 ppm dan arang aktif sebanyak 10 gr sebagai media penyerapnya.
(a) (b)
Gambar 5. Pola penyerapan oksigen pada (a) suhu ruang dan (b) suhu 15 °C 0
0,002 0,004 0,006 0,008
0 2 4 6 8
La
ju P
e
ny
e
ra
pa
n
E
ti
le
n
(ml
/g
ra
m/j
a
m)
III. METODOLOGI PENELITIAN
3.1
TEMPAT DAN WAKTU
Penelitian dilaksanakan di laboratorium Teknik Pengolahan Pangan dan Hasil Pertanian (TPPHP) dan Laboratorium Lingkungan dan Bangunan Pertanian Fakultas Teknologi Pertanian pada bulan Juni sampai dengan September 2009.
3.2
BAHAN DAN ALAT
Bahan yang digunakan pada penelitian ini adalah gas etilen, gas oksigen, kalium permanganat, asam askorbat, dan arang aktif. Sedangkan alat yang diperlukan adalah balok kaca ukuran 50x20x20 cm3 dan tebal 8 mm, paralon diameter 4 inci dan panjang 35 cm, selang plastik diamter 4 mm, kipas,
syringe, gas kromatografi, gas analyzer, potensiometer, transistor, dan tachometer.
3.3
METODE PENELITIAN
3.3.1
Prosedur
3.3.1.1
Persiapan Bahan Penyerap Etilen dan Oksigen
Konsentrasi larutan KMnO4 sebagai bahan penyerap etilen yang digunakan adalah KMnO4 75% dan KMnO4 10% sedangkan konsentrasi asam askorbat yang digunakan sebagai bahan penyerap oksigen adalah asam askorbat 40% dan asam askorbat 60%. Larutan KMnO4 10% dibuat dengan cara melarutkan 10 gr KMnO4 serbuk kedalam 100 ml larutan. KMnO4 75% diperoleh dari pelarutan 75 gr serbuk KMnO4 kedalam 100 ml larutan dan dipanaskan pada suhu ± 60 °C. Asam askorbat 40% atau 60% diperoleh dengan melarutkan serbuk asam askorbat sebanyak 40 gr atau 60 gr kedalam 100 ml larutan.
Gambar 6. Proses persiapan bahan dan media penyerap 75 gr KMnO4 10 gr KMnO4 40 gr C6H806 60 gr C6H806
100 ml larutan 100 ml larutan 100 ml larutan 100 ml larutan
KMnO4 75% KMnO4 10% C6H80640% C6H80660%
Bahan penyerap etilen atau oksigen
Dikeringkan menggunakan kipas selama
30-45 menit
10 gr arang aktif
Diberikan masing-masing 5 ml
larutan
Dimasukkan dalam kain kasa
3.3.1.2
Persiapan Rangkaian Pengatur Kecepatan Kipas
Rangkaian digunakan untuk mengatur kecepatan kipas dengan dua putaran yang berbeda, yaitu 700 rpm dan 1800 rpm. Pada rangkaian digunakan power supply untuk mengubah tegangan AC yang berasal dari PLN menjadi DC yang disesuaikan dengan tegangan kipas. Skema rangkaian disajikan pada Gambar 7.
Sumber: hhtp://www.belajar-elektronika.com
Gambar 7. Rangkaian pengatur kecepatan kipas
Rangkaian pengatur kecepatan kipas terdiri dari beberapa komponen elekronika seperti resistor, kapasitor, IC LM317, dan potensiometer. Resistor berfungsi untuk mengatur atau membatasi besarnya kuat arus yang melewati suatu rangkaian dan membagi tegangan pada suatu rangkaian sehingga diperoleh suatu tegangan yang besarnya sesuai dengan kebutuhan. Potensiometer merupakan salah satu jenis resistor variabel yang sering digunakan untuk aplikasi-aplikasi pengaturan volume suara pada perangkat-perangkat audio (Bishop, 2002). Potensiometer yang digunakan pada penelitian adalah potensiometer putar. Cara kerja potensiometer ini dalam mengasilkan kecepatan putar yang diinginkan adalah dengan memutar tangkai putar yang ada pada potensiometer. Arus dan tegangan yang dihasilkan dapat disesuaikan dengan penggunaan potensiometer. Berdasarkan Hukum Ohm, semakin besarnya tahanan komponen akan memperkecil arus dan tegangan yang dihasilkan. Penggunaan IC LM317 dipilih karena fungsinya sebagai regulator tegangan DC (tegangan outputnya tergantung dengan potensiometer yang dipasang). Kipas yang digunakan adalah kipas DC 12 volt ukuran (80 x 80 x 25) mmdengan jumlah sudu 7 buah dan kecepatan maksimal 1800 rpm seperti yang terlihat pada Gambar 8.
Kipas bertujuan untuk mengumpankan udara di sekitar ruang penyerapan kedalam paralon yang berisi bahan penyerap etilen dan penyerap oksigen. Selanjutnya, putaran kipas diukur dengan menggunakan tachometer. Hasil putaran kipas ini berupa putaran/menit (rpm) yang selanjuntnya dapat dikonversi menjadi kecepatan angular kipas. Tipler (1991) dalam bukunya Fisika untuk Sains dan Teknik menyatakan hubungan antara putaran kipas dengan kecepatan angular kipas seperti yang terlihat pada persamaan berikut:
ω (rad/s) = (3)
Sedangkan hubungan antara kecepatan linier, v (m/s) dengan kecepatan anguler, ω (rad/s) adalah
(4)
Henderson dan Perry (1997) menyatakan bahwa kecepatan udara yang dihembuskan kipas merupakan hasil bagi antara laju aliran udara kipas dan luas outlet kipas, seperti yang terlihat pada persamaan berikut:
⟶ (5)
Keterangan :
Q = laju aliran udara yang dihasilkan kipas (m3/s) v = kecepatan udara pada kipas (m/s)
A= luas outlet kipas, (total luasan 7 buah sudu kipas) (m2) n = putaran kipas (rpm)
r = jari- jari sudu kipas (m)
3.3.1.3
Persiapan Ruang Penyerapan Etilen dan Oksigen
Gambar 9. Ruang penyerapan etilen dan oksigen
Gambar 10. Skema ruang penyerapan etilen dan oksigen
Keterangan :
A = balok kaca sebagai ruang penyerapan B = kipas seperti pada Gambar 8
C = penyerap etilen dan oksigen
D, E, F, dan G = lubang injeksi etilen dan lubang pengambilan sample etilen dan oksigen
Etilen yang diinjeksikan berasal dari tabung etilen yang tersedia di laboratorium sedangkan oksigen berasal dari oksigen ruangan, sebesar 21 %. Etilen awal yang diinjeksikan adalah 500 ppm. Selanjutnya kipas pengatur kecepatan disimpan di dalam paralon dan mulai dioperasikan untuk mengumpankan udara di dalam balok kaca ke dalam paralon yang telah berisi penyerap etilen dan penyerap oksigen dengan cara mengubah resistensi pada potensiometer sehingga dihasilkan dua putaran kipas yang berbeda.
3.3.2
Rancangan Penelitian
Rancangan penelitian yang digunakan adalah rancangan penelitian eksperimental dimana dilakukan eksperimen terlebih dahulu yang berupa simulasi penyerapan etilen dan oksigen. Adapun prosedur yang perlu dilakukan untuk tahap simulasi ini adalah dengan melakukan persiapan kolom penyerap, bahan penyerap, rangkaian pengatur kecepatan dan ruang penyerapan.
D E F G
o10.2 cm B C
20 cm
Kalium permanganat sebagai penyerap etilen yang digunakan adalah KMnO4 10% dan KMnO4 75%. Konsentrasi asam askorbat sebagai penyerap oksigen yang digunakan adalah C6H8O6 40%, dan C6H8O6 60%.
Tabel 4. Perlakuan Bahan Penyerap (KMnO4 dan C6H8O6)
Kecepatan KMnO4 C6H8O6 Simbol 1800 rpm
75% 60% R1K1A2 10% 40% R1K2A1 10% 60% R1K2A2
700 rpm
75% 40% R2K1A1 75% 60% R2K1A2 10% 40% R2K2A1 10% 60% R2K2A2
Pengukuran sampel etilen dilakukan setiap 2 jam sekali selama 8 jam sedangkan oksigen diukur setiap 4 jam sekali selama 24 jam untuk setiap kombinasi penyerap etilen dan oksigen yang digunakan. Selanjutnya dilakukan penyusunan pola penyerapan etilen dan oksigen berdasarkan hasil eksperimen. Pola penyerapan etilen dan oksigen yang akan dirancang merupakan fungsi dari waktu, kecepatan kipas, dan konsentrasi penyerap etilen dan oksigen. Diagram alir penelitian secara umum disajikan pada Gambar 10.
3.3.3
Pengamatan dan Analisa Sampel Etilen dan Oksigen
Analisis oksigen dapat dilakukan dengan menggunakan Gas Analyzer (GA). GA dinyalakan dan dibiarkan selama kurang lebih 45 menit sampai lampu petunjuk ready berkedip-kedip, GA siap digunakan. Pada saat running selang penyaluran oksigen dari ruang penyerapan etilen dan oksigen ke GA dijepit oleh klip agar oksigen yang ada pada ruang penyerapan tidak bocor (tidak ada sirkulasi udara). Pada saat pengamatan oksigen, klip ini dilepas sehingga oksigen yang ada pada ruang penyerapan terhubung dengan GA untuk dilakukan pembacaan nilai oksigen.
Gambar 11. Skema gas kromatografi
Sebelum dilakukan pengukuran, gas kromatografi harus dikalibrasi dengan standar etilen murni misalnya 50 ppm, 100 ppm, dan 200 ppm. Sampel dimasukan ke dalam gas kromatografi dan nilai konsentrasi ditunjukan dengan gambar peak (puncak) yang menunjukan luasan area dengan melihat
recorder time sample berdasarkan standar gas etilen.
Konsentrasi etilen (y) =
xCs
As
Ac
(4) Keterangan: y = produksi etilen (ppm)
Ac = luasan area konsentrasi sampel As = luasan area konsntrasi standar
Vetilen (ml/gram/jam) )x i / (ρetilen)] / [mabsorber x Δt] (5) Keterangan:
Vetilen = laju penyerapan etilen (ml/gram/jam) C 0 = konsentrasi etilen awal (ppm)
Ct = konsentrasi etilen pada jam ke-t (ppm) i = volume ruang penyerapan (ml)
ρetilen = 1.178 kg/m3 = 1.178 x 10-3 gr/cm3
marang = massa arang aktif sebagai absorber (gram)
Δt = selang waktu pengukuran ke-n dengan pengukuran selanjutnya (jam)
Voksigen (ml/gram/jam) = (6)
Keterangan:
Voksigen = laju penyerapan etilen (ml/gram/jam) C 0 = konsentrasi etilen awal (ppm)
Ct = konsentrasi etilen pada jam ke-t (ppm) i = volume ruang penyerapan (ml)
marang = massa arang aktif sebagai absorber (gram)
Gambar 12. Diagram alir penelitian [75%] [10%]
C2H4 KMnO4 KMnO4
Analisis:
1. Pengaruh kecepatan kipas terhadap penyerapan etilen dan oksigen 2. Konsentrasi bahan penyerap etilen/oksigen yang memberikan hasil
penyerapan paling baik
3. Pola penyerapan etilen dan oksigen
[60%] [40%]
O2
Persiapan sistem penyerap etilen dan oksigen
Penginjeksian etilen 500 ppm dan oksigen
1800 rpm 700 rpm
C6H8O6
[60%] [40%]
O2 C6H8O6
[10%]
IV. HASIL DAN PEMBAHASAN
4.1
Pengaruh Aliran Udara Kipas terhadap Penyerapan Etilen dan Oksigen
Pada ruang penyerapan digunakan kipas yang dihubungkan dengan rangkaian sederhana seperti pada gambar 7. Kecepatan kipas dapat diatur dengan cara mengubah resistansi potensiometer yang ada pada rangkaian. Pengukuran kecepatan kipas dilakukan dengan menggunakan tachometer. Adapun kecepatan kipas yang digunakan adalah 700 rpm dan 1800 rpm yang menghasilkan laju aliran udara 0.159 m3/s dan 0.408 m3/s. Perhitungan performansi kipas dapat dilihat pada Lampiran 3.
Kipas mulai digunakan sekitar 15 menit sebelum pengambilan sampel. Hal ini dilakukan untuk menghomogenisasikan udara yang ada pada ruang penyerapan. Data hasil penyerapan etilen dan oksigen untuk masing-masing kecepatan kipas dapat dilihat pada Lampiran 1. Gambar 12 menyajikan perbandingan penyerapan etilen untuk penggunaan kalium permanganat dan asam askorbat yang sama dalam dua kecepatan kipas yang berbeda. Gambar 13 memperlihatkan hasil penyerapan oksigen untuk penggunaan kalium permanganat dan asam askorbat yang sama dalam dua kecepatan kipas yang berbeda. Dari Gambar 13 terlihat bahwa putaran kipas mempengaruhi kecepatan reaksi kimia antara kalium permanganat dan etilen di dalam ruang penyerapan. Berdasarkan cepatnya etilen terserap oleh kalium permanganat, penggunaan kipas 700 rpm memberikan hasil penyerapan yang lebih baik dibanding dengan kipas 1800 rpm. Pada dasarnya kecepatan putaran kipas tidak mempengaruhi langsung reaksi kalium permanganat dan etilen. Dari hasil pengamatan, jika kecepatan udara diperbesar maka suhu berkurang dan kelembaban udaranya pun berkurang. Dalam hal ini kipas 1800 rpm menghasilkan suhu dan kelembaban udara lebih rendah dibanding dengan penggunaan kipas 700 rpm walaupun perbedaannya tidak terlalu signifikan (Lampiran 2). Suhu merupakan salah satu faktor yang mempengaruhi laju reaksi kimia. Umumnya kenaikan suhu mempercepat laju reaksi dan sebaliknya penurunan suhu akan memperlambat reaksi. Pada kipas 700 rpm untuk kombinasi penyerapan etilen dan oksigen yang sama, suhu di ruang penyerapan lebih tinggi dibanding dengan kipas 1800 rpm. Tingginya suhu pada akhirnya akan mempercepat reaksi kalium permanganat dan etilen sehingga etilen mampu terserap dalam waktu yang relatif singkat.
(a) 0
200 400 600
0 2 4 6 8
K
o
n
sen
tr
a
si
E
ti
len
(ppm
)
Waktu (jam)
(b)
(c)
Gambar 13. Konsentrasi etilen pada kecepatan 1800 rpm dan 700 rpm untuk perlakuan, a) R1K1A2 dan R2K1A2, b) R1K2A1 dan R2K2A2, dan c) R1K2A2 dan R2K2A2.
Kecepatan kipas pun turut memberikan pengaruh secara tidak langsung terhadap penyerapan oksigen (Gambar 14). Penggunaan kipas 700 rpm memperlihatkan hasil yang lebih baik dalam menyerap oksigen. Dalam waktu pengukuran yang sama, konsentrasi oksigen dengan menggunakan kipas 700 rpm cenderung lebih rendah dibanding dengan kipas 1800 rpm. Namun, kelembaban di ruang penyerapan lebih tinggi. Hal ini disebabakn oleh reaksi asam askorbat dan oksigen menghasilkan H2O lebih cepat dari penggunaan kipas 1800 rpm sehingga menyebabkan ruangan menjadi lebih lembab.
Analisa sidik ragam menunjukkan adanya perbedaan rata-rata konsentrasi etilen atau oksigen yang terserap akibat dari perbedaan waktu, namun tidak ada perbedaan nyata rata-rata konsentrasi etilen atau oksigen akibat dari perbedaan penggunaan kecepatan kipas yang berbeda dan juga tidak ada perbedaan nyata rata-rata konsentrasi eilen atau oksigen akibat dari interaksi waktu dengan kecepatan kipas (Lampiran 5).
0 200 400 600
0 2 4 6 8
K
o
n
sen
tr
a
si
E
ti
len
(ppm
)
Waktu (jam)
KMnO4 10%, C6H8O6 40%, 1800 rpm (R1K2A1) KMnO4 10%, C6H8O6 40%, 700 rpm (R2K2A1)
0 200 400 600
0 2 4 6 8
K
o
n
sen
tr
a
si
E
ti
len
(ppm
)
Waktu (jam)
(a)
(b)
(c)
(d)
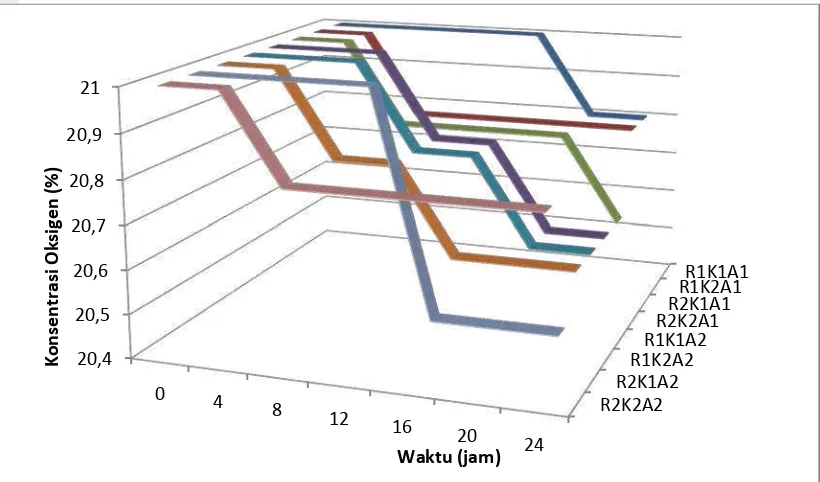
Gambar 14. Konsentrasi okisgen pada kecepatan 1800 rpm dan 700 rpm untuk perlakuan, a) R1K1A1 dan R2K1A1, b) R1K1A2 dan R2K1A2, c) R1K2A1 dan R2K2A1, dan d) R1K2A2 dan R2K2A2.
20 20,5 21 21,5
0 4 8 12 16 20 24
K o nse nt ra si O k si g e n (% ) Waktu (jam)
KMnO4 Jenuh, C6H8O6 40%, 1800 rpm (R1K1A1) KMnO4 Jenuh, C6H8O6 40%, 700 rpm (R2K1A1)
20 20,5 21 21,5
0 4 8 12 16 20 24
K o nse nt ra si O k si g e n (% ) Waktu (jam)
KMnO4 Jenuh, C6H8O6 60%, 1800 rpm (R1K1A2) KMnO4 Jenuh, C6H8O6 60%, 700 rpm (R2K1A2)
20 20,5 21 21,5
0 4 8 12 16 20 24
K o nse nt ra si O k si g e n (% ) Waktu (jam)
KMnO4 10%, C6H8O6 40%, 1800 rpm (R1K2A1) KMno4 10%, C6H8O6 40%, 700 rpm (R2K2A1)
20 20,5 21 21,5
0 4 8 12 16 20 24
K o nse nt ra si O k si g e n (% ) Waktu (jam)
Konsentrasi etilen dan oksigen dari setiap perlakuan mengikuti persamaan-persamaan seperti yang terdapat pada Tabel 5 dan Tabel 6. Dari kedua tabel tersebut terlihat bahwa perlakuan penyerap etilen yang paling mendekati model linier adalah R2K2A1 dengan nilai koefisien determinsai (R2) tertinggi yaitu 84.1%. Pada penyerapan oksigen, perlakuan yang paling mendekati persamaan linier adalah R1K1A2 dengan nilai koefisien determinsai (R2) tertinggi yaitu 89.9%.
Tabel 5. Persamaan regresi linier perlakuan penyerapan etilen
Perlakuan Persamaan R2
R1K1A2 y = -112.14x + 460.69 0.671 R1K2A1 y = -98.570x + 401.33 0.507 R1K2A2 y = -107.09x + 444.27 0.623 R2K1A1 y = -127.12x + 535.83 0.791 R2K1A2 y = -105.18x + 426.97 0.580 R2K2A1 y = -126.33x + 541.46 0.841 R2K2A2 y = -101.90x + 409.52 0.529
Tabel 6. Persamaan regresi linier perlakuan penyerapan oksigen
Perlakuan Persamaan R2
R1K1A1 y = -0.036x + 21.086 0.625
R1K1A2 y = -0.088x + 21.143 0.899
R1K2A1 y = -0.036x + 21.000 0.625
R1K2A2 y = -0.079x + 21.086 0.890
R2K1A1 y = -0.057x + 21.057 0.800
R2K1A2 y = -0.107x + 21.214 0.750
R2K2A1 y = -0.079x + 21.143 0.890
4.2
Pengaruh Konsentrasi Kalium Permanganat terhadap Penyerapan Etilen
Hasil penelitian menunjukan konsentrasi etilen cenderung menurun tiap jam pengukuran dan umumnya etilen mampu terserap habis oleh arang aktif yang telah dicelupkan ke dalam kalium permanganat dalam waktu kurang dari 8 jam (Gambar 15).
Gambar 15. Penyerapan etilen dengan KMnO4
Pada penggunaan kipas 1800 rpm, kalium permanganat 75%, asam askorbat 60% (R1K1A2), etilen mulai terserap di jam pengukuran ke-2 dan pada pengukuran jam selanjutnya tidak ada sisa etilen di ruang penyerapan. Perlakuan R1K2A2 (kipas 1800 rpm, kalium permanganat 10%, asam askorbat 60%) menunjukan konsentrasi etilen menurun di setiap jam pengukuran dan mulai habis pada pengukuran jam ke-8. Konsentrasi etilen yang terukur pada perlakuan kipas 700 rpm, KMnO4 75%, asam askorbat 60% (R2K1A2) dan kipas 700 rpm, KMnO4 10%, C6H8O6 40% (R2K2A1) menurun tiap jam pengamatandan mulai habis pada pengukuran di jam ke-6 untuk R2K2A1 di jam ke-8 untuk R2K1A2.Pada penggunaan kipas 700 rpm, KMnO4 75%, C6H8O6 40% (R2K1A1) etilen mulai terserap pada jam ke-2 menjadi 273.325 ppm dan sudah tidak terdeteksi lagi pada pengukuran selanjutnya. Hal yang sama terjadi pada KMnO4 10%, C6H8O6 60% (R2K2A2). Etilen yang terukur pada jam ke-2 adalah 19.190 ppm dan pada jam ke-4, ke-6, dan ke-8, tidak ada etilen yang terukur.
Dari semua perlakuan penggunaan KMnO4 rata-rata mampu menyerap habis etilen selama delapan jam kecuali R1K2A1. Pada perlakuan tersebut etilen masih ada di pengukuran jam ke-8. Dalam hal ini, KMnO4 yang sebelumnya telah dijerapkan kedalam arang aktif (terjadi proses adsorpsi) sudah tidak dapat menyerap etilen lagi karena partikel-partikel kosong yang terdapat pada arang aktif telah terisi oleh etilen di pengukuran jam sebelumnya. Seperti halnya dikemukakan oleh Pramudianti (2004), yang menyatakan bahwa mekanisme penyerap etilen sesuai dengan mekanisme adsorpsi dimana proses adsorpsi pada arang melalui tiga tahapan dasar yaitu: 1) zat terserap pada arang bagian luar 2) zat bergerak melalui pori-pori arang, 3) zat terserap ke dinding bagian dalam arang. Menurut Reynold (1982), adsorpsi adalah suatu proses dimana suatu partikel menempel pada suatu permukaan akibat dari adanya perbedaan muatan lemah diantara kedua benda, sehingga akhirnya akan membentuk suatu lapisan tipis partikel-partikel halus pada permukaan tersebut. Adapun mekanisme penyerapan adalah sebagai berikut :
0 50 100 150 200 250 300 350 400 450 500
0 2 4 6 8
K
o
nse
nt
ra
si
E
ti
le
n
(ppm
)
Waktu (jam)
R1K1A2 R2K1A1 R2K1A2 R1K2A1
1. Molekul adsorbat berpindah menuju lapisan terluar dari adsorben.
2. Karbon aktif dalam kesatuan kelompok mempunyai luas permukaan pori yang besar sehingga dapat mengadakan penyerapan terhadap adsorbat.
3. Sebagian adsorbat ada yang teradsorpsi di permukaan luar, tetapi sebagian besar teradsorpsi di dalam pori-pori adsorben dengan cara difusi.
4. Bila kapasitas adsorpsi masih sangat besar, sebagian besar molekul adsorbat akan teradsorpsi dan terikat di permukaan. Tetapi bila permukaan pori adsorben sudah jenuh dengan adsorbat maka akan terjadi dua kemungkinan, yaitu, (a) terbentuk lapisan adsorpsi kedua, ketiga dan seterusnya, dan (b) tidak terbentuk lapisan adsorpsi kedua, ketiga dan seterusnya sehingga adsorbat yang belum teradsorpsi akan terus berdifusi keluar pori.
Seperti diketahui pada bahasan sebelumnya bahwa hasil reaksi antara KMnO4 dan etilen akan menghasilkan mangan dioksida (MnO2). Adanya MnO2 diperkirakan menempel di permukaan arang aktif dan menutupi partikel kosong arang aktif sehingga arang aktif tidak mampu lagi menyerap etilen atau dapat dikatakan arang aktif telah jenuh.
Pada Gambar 16 diketahui bahwa daya serap KMnO4 10% cenderung lebih baik dalam menyerap etilen dibandingkan dengan KMnO4 75%. Pada umumnya semakin tinggi konsentrasi zat yang bereaksi semakin cepat reaksi yang berlangsung. KMnO4 75% memiliki konsentrasi yang lebih tinggi dibanding dengan KMnO4 10% sehingga bereaksi lebih cepat. Ratih et. Al (1996) menyatakan bahwa suatu zat akan bereaksi apabila zat-zat tersebut bercampur dan saling bersinggungan. Persinggungan tersebut terjadi pada bagian permukaan zat. Makin banyak bagian zat yang bersinggungan, makin banyak pula kemungkinan terbentuknya zat baru, sehingga dapat dikatakan makin luas sentuhan, makin cepat reaksinya.
(a) (b) 0 200 400 600
0 2 4 6 8
K o n sen tr a si E ti len (ppm ) Waktu (jam) R1K1A2 R1K2A2 0 200 400 600
0 2 4 6 8
(c)
Gambar 16. Penyerapan etilen dengan konsentrasi KMnO4 yang berbeda pada kecepatan dan konsentrasi asam askorbat yang sama.
KMnO4 75% mengoksidasi etilen dengan cepat dan hasil reaksi antara KMnO4 75% dengan etilen akan menghasilkan mangan dioksida yang berupa endapan. Endapan ini melekat pada permukaan arang aktif sebagai media penyerap. Semakin banyak tumbukan antara partikel KMnO4 75% dengan etilen maka reaksi yang terjadi semakin cepat dan endapan mangan dioksida pun semakin banyak menempel pada permukaan arang aktif. Hal inilah yang diduga mempengaruhi kemampuan media penyerap dalam menyerap etilen yang semakin lama semakin berkurang. Selain itu, KMnO4 10% yang konsentrasinya lebih rendah dibanding dengan KMnO4 75% sehingga menghasilkan endapan mangan dioksida lebih lambat, memiliki daya serap yang lebih baik karena endapan mangan dioksida tersebut tidak terlalu menutupi permukaan media penyerap akibat dari lambatnya reaksi yang terjadi antara KMnO4 dan etilen.
Hasil analisa sidik ragam menunjukkan adanya perbedaan rata-rata tingkat penyerapan etilen akibat dari perbedaan waktu namun tidak ada perbedaan rata-rata tingkat penyerapan etilen akibat dari perbedaan perlakuan penyerap etilen yang digunakan (Lampiran 6a).
Gambar 17 menyajikan laju penyerapan etilen yang dapat dihitung berdasarkan konsentrasi etilen. Gambar 17 menunjukkan bahwa laju penyerapan etilen yang paling optimal untuk setiap perlakuan terjadi pada pengukuran di jam ke-2. Pada jam pengukuran selanjutnya terlihat bahwa laju penyerapan etilen semakin kecil. Hal tersebut terjadi karena daya serap kalium permanganat semakin berkurang, seiring dengan bertambahnya waktu pengukuran. Laju penyerapan etilen yang paling besar terjadi pada perlakuan R1K2A1 di jam ke-2 yaitu sebesar 0.0283 ml/g/jam. Penambahan konsentrasi KMnO4 akan memperkecil laju penyerapan etilen. Hal ini diduga dengan semakin tinggi molaritas larutan KMnO4, daya serap penyerapan etilen semakin rendah, sehingga memperkecil laju penyerapannya. Analisa statistik untuk laju penyerapan etilen terdapat pada Lampiran 6b yang memperlihatkan bahwa waktu pengukuran memberikan pengaruh nyata terhadap laju penyerapan etilen.
0 200 400 600
0 2 4 6 8
K
o
n
sen
tr
a
si
E
ti
len
(ppm
)
Waktu (jam)
Gambar 17. Laju penyerapan etilen oleh KMnO4
4.3
Pengaruh Konsentrasi Asam Askorbat terhadap Penyerapan Oksigen
Konsentrasi oksigen yang terserap oleh asam askorbat yang dijerapkan pada arang aktif menurun sejalan bertambahnya waktu (Gambar 18). Pada kecepatan 1800 rpm, KMnO4 75%, asam askorbat 40% (R1K1A1), oksigen baru terserap di jam ke-20. Penggunaan kipas 1800 rpm, KMnO4 75%, asam askorbat 60% (R1K1A2) memberikan hasil yang lebih baik dari perlakuan R1K1A1 karena oksigen mulai terserap di jam ke-12 dan terus menurun sampai 20.6 % pada jam ke-24. Pada penggunaan KMnO4 10%, asam askorbat 40% (R1K2A1), konsentrasi oksigen mulai berkurang pada jam ke-8 menjadi 20.8% dan tidak ada pengurangan konsentrasi oksigen lagi sampai jam ke-24.
Penggunaan KMnO4 75%, asam askorbat 40%, kecepatan 700 rpm (R2K1A1) dan KMnO4 10%, asam askorbat 60%, kecepatan 700 rpm (R2K2A2) mulai mereduksi oksigen pada pengukuran jam ke-8 menjadi 20.8% dan turun menjadi 20.6% di jam ke-24 untuk R2K1A1. Perlakuan KMnO4 75%, asam askorbat 60% (R2K2A2) mulai mereduksi oksigen di jam ke-12 dan kemudian turun menjadi 20.65 di jam ke-24. Konsentrasi oksigen pada perlakuan KMnO4 10%, asam askorbat 40% (R2K1A2) mulai berkurang setelah 12 jam dan kemudian menurun lagi di jam 16 sampai jam ke-24 menjadi 20.5%. Dari kedelapan perlakuan ini dapat dikatakan bahwa R2K1A2 merupakan penyerap oksigen yang paling baik karena mampu mereduksi oksigen dari 21% menjadi 20.5%. Penggunaan asam askorbat sebagai penyerap oksigen hanya mampu mereduksi oksigen sampai 20.5% selama 24 jam. Hal ini mungkin saja disebabkan karena konsentrasi asam askorbat sebagai penyerap oksigen masih belum optimal dalam mereduksi atau mengoksidasi oksigen di dalam ruang penyerapan.
0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
La
ju pe
ny
e
ra
p
e
ti
le
n
(m
l/
g
ra
m
/ja
m
)
Waktu (jam)
R2K2A2 R2K2A1 R2K1A2 R2K1A1
Gambar 18. Penyerapan oksigen dengan asam Askorbat
Menurut Pratt (1969) di dalam Abeles (1973) konsentrasi yang rendah dari oksigen akan menghambat produksi etilen. Hal ini akan memberikan pengaruh pada respirasi sehingga akan menghambat aksi etilen dalam pematangan buah. Namun berdasarkan pengamatan, tidak terlihat adanya pengaruh yang signifikan dari penggunaan penyerap oksigen terhadap pengurangan konsentrasi etilen. Konsentrasi oksigen yang mampu diserap oleh asam askorbat rata-rata terjadi pada jam ke-8 sedangkan etilen pada jam tersebut mampu tereduksi habis oleh kalium permanganat. Dalam hal ini, penurunan konsentrasi etilen tersebut tidak dipengaruhi langsung oleh keberadaan oksigen melainkan dipengaruhi oleh efektifitas kalium permanganat dalam mereduksi etilen. Hal ini diperkuat juga oleh hasil analisa sidik ragam yang menunjukan bawha tidak ada pengaruh konsentrasi oksigen terhadap penyerapan konsentrasi etilen (Lampiran 7a). Demikian halnya pada rata-rata perlakuan penyerapan oksigen yang tidak memberikan pengaruh pada tingkat penyerapan oksigen, namun ada perbedaan rata-rata tingkat penyerapan oksigen akibat dari perbedaan waktu (Lampiran 7b). R1K1A1 R1K2A1 R2K1A1 R2K2A1 R1K1A2 R1K2A2 R2K1A2 R2K2A2 20,4 20,5 20,6 20,7 20,8 20,9 21 0 4 8 12 16 20 24 K o nse nt ra si O k si g e n (%) Waktu (jam)
R1K1A1 R1K2A1 R2K1A1 R2K2A1 R1K1A2 R1K2A2 R2K1A2 R2K2A2
20,4 20,5 20,6 20,7 20,8 20,9 21 21,1
0 4 8 12 16 20 24
(a) (b) (c) (d)
Gambar 19. Penyerapan oksigen dengan konsentrasi asam askorbat yang berbeda pada kecepatan dan konsentrasi KMnO4 yang sama.
20,4 20,5 20,6 20,7 20,8 20,9 21 21,1
0 4 8 12 16 20 24
K o nse nt ra si O k isg e n (%) R1K2A1 R1K2A2 20,2 20,3 20,4 20,5 20,6 20,7 20,8 20,9 21 21,1
0 4 8 12 16 20 24
K o nse nt ra si O k isg e n (%) Waktu (jam) R2K1A1 R2K1A2 20,4 20,5 20,6 20,7 20,8 20,9 21 21,1
0 4 8 12 16 20 24
Sama halnya dengan penggunaan KMnO4 pada penyerapan etilen, pada penyerapan oksigen pun konsentrasi yang lebih rendah, yaitu asam askorbat 40% yang memiliki daya serap yang lebih baik dibandingkan dengan asam askorbat 60% (Gambar 19). Hal ini bisa jadi karena oksigen yang ada pada ruang penyerapan mengoksidasi asam askorbat 60% lebih cepat dari asam askorbat 40% sehingga arang aktif yang telah dicelupkan pada asam askorbat 60% lebih cepat jenuh dibandingkan dengan arang aktif yang telah dicelupkan pada asam askorbat 40%.
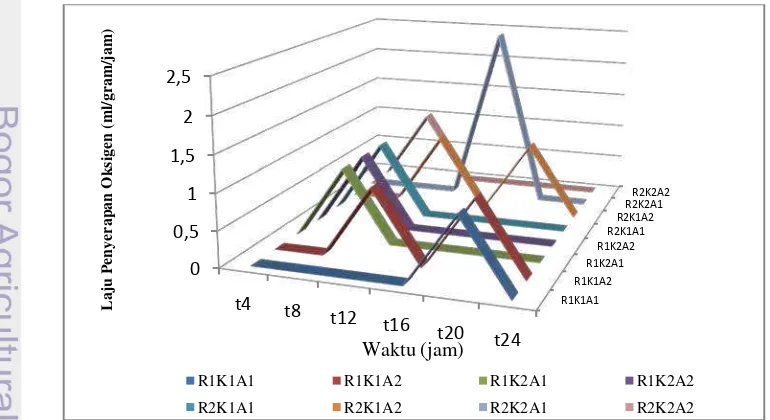
Berdasarkan data yang diperoleh dari penyerapan oksigen oleh asam askorbat, dapat ditentukan laju penyerapannya. Laju penyerapan oksigen yang paling optilmal terdapat pada perlakuan R2K2A1 yaitu sebesar 2.5 ml/gram/jam pada pengukuran di jam ke-16 (Gambar 19). Berbeda halnya dengan laju penyerapan etilen yang memperlihatkan nilai yang cukup besar diawal pengukuran, pada penyerapan oksigen, pengurangan konsentrasi oksigen mulai ada pada jam ke-8 sehingga lajunya pun baru dapat diketahui setelah jam ke-8 untuk beberapa perlakuan. Laju penyerapan oksigen cenderung menurun sejalan dengan bertambahnya waktu. Hal ini menandakan bahwa daya serap oksigen semakin berkurang akibat dari kejenuhan asam askorbat dalam menyerap oksigen (proses adsorpsi yang antara karbon aktif sebagai adsorben dan oksigen sebagai adsorbat). Reynold (1982) menyatakan bahwa adsorpsi gas oleh zat padat ditandai oleh (a) adsorpsi bersifat selektif, artinya suatu adsorben dapat menyerap suatu gas dalam jumlah besar, tetapi menyerap gas-gas lain dalam jumlah yang lebih kecil, (b) adsorpsi terjadi sangat cepat, dimana kecepatan adsorpsinya semakin berkurang dengan semakin banyaknya gas yang diserap, (c) adsorpsi tergantung dari luas permukaan adsorben, semakin porus adsorben maka semakin besar daya adsorpsinya, dan (d) jumlah gas yang diadsorpsi persatuan berat adsorben tergantung pada tekanan parsial (partial presure) gas, dimana semakin besar tekanan maka semakin banyak gas diserap.
[image:32.595.115.500.528.738.2]Selain itu, asam askorbat hanya mampu menyerap oksigen disekitar kolom penyerap (di dalam paralon) atau di sekitar sachet arang aktif saja dan tidak menyerap oksigen yang menyebar diseluruh ruang penyerapan. Sagala (2010) menyatakan bahwa kurang sensitifnya asam askorbat menunjukkan bahwa asam askorbat lebih dapat bereaksi dengan menyerap oksigen yang berada di dalam jaringan sel buah dibandingkan oksigen yang berada di sekitarnya (chamber) sehingga kurang efektif sebagai penyerap oksigen. Analisa sidik ragam untuk laju penyerapan oksigen terdapat pada Lampiran 7c yang memperlihatkan bahwa waktu pengukuran tidak memberikan pengaruh nyata terhadap laju penyerapan oksigen.
Gambar 20. Laju penyerapan oksigen oleh asam askorbat
R1K1A1 R1K1A2 R1K2A1 R1K2A2 R2K1A1 R2K1A2 R2K2A1 R2K2A2 0 0,5 1 1,5 2 2,5 t4 t8 t12 t16 t20 t24 L a ju P eny era pa n O k sig en (m l/g ra m /j a m ) Waktu (jam)
R1K1A1 R1K1A2 R1K2A1 R1K2A2
4.4
Pola Penyerapan Etilen dan Oksigen
Berdasarkan laju penyerapan etilen dan oksigen yang diperoleh dari penelitian dapat diketahui pola penyerapan etilen dan oksigen. Untuk penyerapan etilen, dilakukan pendekatan model penyerapan etilen berdasarkan penelitian Sholihati (2004) yang menggunakan kalium permanganat untuk memperpanjang umur simpan pisang raja pada suhu 28 °C yang mengikuti persamaan:
E = 0.0002t2 – 0.0009t + 0.0014
Keterangan:
[image:33.595.106.523.322.731.2]E : Laju penyerapan etilen (ml/gr/jam) t : Waktu (jam)
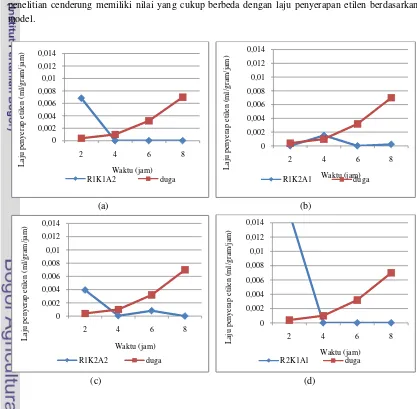
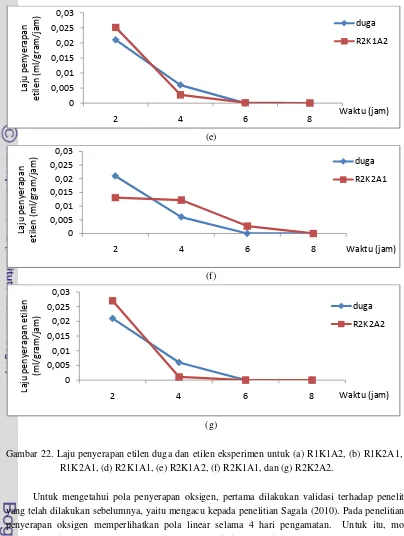
Gambar 20 menyajikan nilai laju penyerapan etilen berdasarkan model Sholihati (2004) dan laju penyerapan etilen hasil penelitian. Pada Gambar 20 terlihat bahwa laju penyerapan etilen hasil penelitian cenderung memiliki nilai yang cukup berbeda dengan laju penyerapan etilen berdasarkan model.
(a) (b)
(c) (d)
0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
2 4 6 8
L aju p en y er ap etilen ( m l/g ra m /ja m ) Waktu (jam) R1K1A2 duga 0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
2 4 6 8
L aju p en y er ap etilen ( m l/g ra m /ja m ) Waktu (jam) R1K2A1 duga 0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
2 4 6 8
L aju p en y er ap etilen ( m l/g ra m /ja m ) Waktu (jam) R1K2A2 duga 0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
2 4 6 8
(e) (f)
[image:34.595.106.526.77.452.2](g) Gambar 21. Perbandingan pola penyerapan etilen berdasarkan model dengan (a) laju R1K1A2, (b) laju R1K2A1, (c) laju R1K2A1, (d) laju R2K1A1, (e) laju R2K1A2, (f) laju R2K1A1, dan (g) laju R2K2A2.
Adanya perbedaan pola penyerapan diatas dapat disebabkan oleh perbedaan media yang digunakan dalam penelitian. Pada penelitian Sholihati (2004) digunakan pisang sebagai bahan observasi yang masih dapat melakukan aktivitas biologis setelah pemanenan seperti respirasi dan memproduksi etilen dalam jumlah tertentu. Bisa jadi tingginya laju penyerapan etilen dipengaruhi oleh tingginya produksi etilen yang dilakukan oleh pisang dan atau efektivitas media penyerap yang masih mampu menyerap etilen lebih banyak di jam akhir pengukuran dibandingkan dengan awal pengukuran. Sedangkan pada penelitian ini etilen yang diteliti berasal dari etilen yang sengaja diinjeksikan kedalam ruang penyerapan. Selain itu, pada penelitian ini, kemampuan bahan penyerap semakin menurun seiring dengan bertambahnya waktu pengukuran. Untuk itu, perlu disusun pola penyerapan etilen yang lebih mendekati kondisi nyata (hasil penelitian). Gambar 22 menunjukkan pola penyerapan etilen berdasarkan hasil penelitian. Pola penyerapan etilen ini membentuk persamaan polonomial kuadratik, yaitu:
E(t) = α + β1t + β2t2 (7)
E(t) = 0.0426 - 0.0127t+0.0009t2 (8)
0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
2 4 6 8
L aju p en y er ap etilen ( m l/g ra m /ja m ) Waktu (jam) R2K2A1 duga 0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
2 4 6 8
L aju p en y er ap etilen ( m l/g ra m /ja m ) Waktu (jam) R2K1A2 duga 0 0,002 0,004 0,006 0,008 0,01 0,012 0,014
2 4 6 8
t = variabel bebas = waktu pengukuran (jam)
E(t) = variabel tak bebas = laju penyerapan etilen (ml/gram/jam) α = dugaan parameter intersep model = 0.0426
β1 = koefisien regresi model = -0.0127 β2 = koefisien regresi model = 0.0009
(a) (b) (c) (d) 0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
L aj u p en y er ap an et il en (m l/ g ra m /j am ) Waktu (jam) duga R1K1A2 0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
La ju pe nye ra pa n e ti le n (m l/ g ra m /j a m ) Waktu (jam) duga R1K2A1 0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
La ju pe nye ra pa n e ti le n ( m l/ g ra m /j a m ) Waktu (jam) duga R1K2A2 0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
(e)
(f)
[image:36.595.108.512.79.615.2](g)
Gambar 22. Laju penyerapan etilen duga dan etilen eksperimen untuk (a) R1K1A2, (b) R1K2A1, (c) R1K2A1, (d) R2K1A1, (e) R2K1A2, (f) R2K1A1, dan (g) R2K2A2.
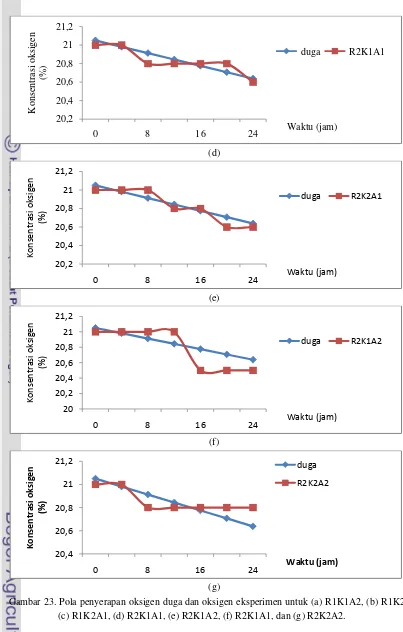
Untuk mengetahui pola penyerapan oksigen, pertama dilakukan validasi terhadap penelitian yang telah dilakukan sebelumnya, yaitu mengacu kepada penelitian Sagala (2010). Pada penelitianya, penyerapan oksigen memperlihatkan pola linear selama 4 hari pengamatan. Untuk itu, model penyerapan oksigen yang disusun adalah dengan melakukan pendekatan model linier, yaitu:
E(t) = α + β1t (9)
t = variabel bebas E(t) = variabel tak bebas
α = dugaan parameter intersep model β = koefisien regresi model
0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
La ju pe nye ra pa n e ti le n ( m l/ g ra m /j a m ) Waktu (jam) duga R2K1A2 0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
La ju pe nye ra pa n e ti le n ( m l/ g ra m /j a m ) Waktu (jam) duga R2K2A1 0 0,005 0,01 0,015 0,02 0,025 0,03
2 4 6 8
Pola penyerapan oksigen mengikuti persamaan:
E(t) = 21.02 – 0.0158 t (9)
t = waktu pengukuran (jam) E(t) = konsentrasi oksigen (%)
Pola penyerapan oksigen disusun berdasarkan konsentrasi oksigen setelah penyerapan. Dari persamaan (9) diketahui bahwa nilai intersep adalah 21.02 yang menggambarkan bahwa pada awal pengukuran (t=0), konsentrasi oksigen adalah 21.02% sedangkan koefisien regresi model bernilai negatif yang menyatakan bahwa setiap penambahan 1 jam pengukuran, maka konsentrasi oksigen akan berkurang sebesar 0.0158%. Validasi penyerap oksigen terdapat pada Gambar 22.
(a) (b) (c) 20,4 20,5 20,6 20,7 20,8 20,9 21 21,1
0 8 16 24
K ons ent ra si oks ige n (%) Waktu (jam) duga R1K2A1 20,2 20,4 20,6 20,8 21 21,2
0 8 16 24
K ons ent ra si oks ige n (%) Waktu (jam) duga R1K1A2 20,2 20,4 20,6 20,8 21 21,2
0 8 16 24
(d)
(e)
(f)
[image:38.595.105.508.69.701.2](g)
Gambar 23. Pola penyerapan oksigen duga dan oksigen eksperimen untuk (a) R1K1A2, (b) R1K2A1, (c) R1K2A1, (d) R2K1A1, (e) R2K1A2, (f) R2K1A1, dan (g) R2K2A2.
20,2 20,4 20,6 20,8 21 21,2
0 8 16 24
K ons ent ra si oks ige n (%) Waktu (jam) duga R2K1A1 20,2 20,4 20,6 20,8 21 21,2
0 8 16 24
K o n se n tra si o k sig e n (%) Waktu (jam) duga R2K2A1 20 20,2 20,4 20,6 20,8 21 21,2
0 8 16 24
K o n se n tra si o k sig e n (%) Waktu (jam) duga R2K1A2 20,4 20,6 20,8 21 21,2
0 8 16 24
V. PENUTUP
5.1.
KESIMPULAN
1. Perlakuan penyerapan etilen yang paling baik adalah R1K1A2 karena mampu mereduksi etilen pada jam ke-2 menjadi 121.40233 ppm dan etilen sudah habis di jam pengukuran selanjutnya. Penggunaan KMnO4 dengan konsentrasi lebih kecil memberikan hasil penyerapan etilen yang lebih baik. Perlakuan penyerapan oksigen yang paling baik adalah R2K1A2 yang mampu mereduksi oksigen menjadi 20.5%. Penggunaan konsentrasi asam askorbat dengan konsentrasi lebih kecil memberikan hasil penyerapan yang lebih baik. 2. Perlakuan penyerap etilen yang paling mendekati model linier adalah R2K2A1 dengan nilai
koefisien determinsai (R2) tertinggi yaitu 84.1%. Pada penyerapan oksigen, perlakuan yang paling mendekati persamaan linier adalah R1K1A2 dengan nilai koefisien determinsai (R2) tertinggi yaitu 89.9%.
3. Kipas 700 rpm mampu mempercepat reaksi etilen dan kalium permanganat dan reaksi asam askorbat oksigen di dalam ruang penyerapan dibandingkan dengan kipas 1800 rpm.
4. Debit aliran udara yang dihasilkan oleh kipas 700 rpm adalah 0.159 m3/s sedangkan kipas 1800 rpm adalah 0.408 m3/s.
5. Hasil analisis ragam menunjukkan adanya perbedaan rata-rata konsentrasi etilen atau oksigen yang terserap akibat dari perbedaan waktu, namun tidak ada perbedaan rata-rata konsentrasi etilen atau oksigen akibat dari perbedaan penggunaan kecepatan kipas yang berbeda dan juga tidak ada perbedaan rata-rata konsentrasi eilen atau oksigen akibat dari interaksi waktu dengan kecepatan kipas.
6. Pola laju penyerapan etilen mengikuti bentuk polinomial derajat dua dengan persamaan: E(t) = 0.0426 - 0.0127t+0.0009t2 dengan E(t) adalah laju penyerapan etilen (ppm/gram/jam) dan t sebagai waktu (jam).
7. Pola penyerapan konsentrasi oksigen dengan satu peubah (waktu) mengikuti persamaan linie, yaitu E(t) = 21.02 – 0.0158t dengan E(t) sebagai konsentrasi oksigen (%) dan t merupakan satuan waktu (jam).
5.2.
SARAN
Perlu adanya penelitian lebih lanjut mengenai:
KAJIAN POLA PENYERAPAN ETILEN DAN OKSIGEN UNTUK
PENYIMPANAN BUAH SEGAR
SKRIPSI
ADIESTY PERMATA K. A.
F14050656
DEPARTEMEN TEKNIK MESIN DAN BIOSISTEM
FAKULTAS TEKNOLOGI PERTANIAN
DAFTAR PUSTAKA
Abeles, FB. 1973. Ethylene in Plant Biology. New York: Academic Press.
Ahvenainen R. 2003.