ISOLASI, IDENTIFIKASI DAN KARAKTERISASI
MOLEKULAR VIRUS HEPATITIS B PADA
OWA JAWA (
Hylobates moloch
) DI INDONESIA
RACHMITASARI NOVIANA
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Isolasi, Identifikasi dan Karakterisasi Molekular Virus Hepatitis B pada Owa Jawa (Hylobates moloch) di Indonesia adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2012
ABSTRACT
RACHMITASARI NOVIANA. Isolation, Identification and Molecular Characterization of Hepatitis B Virus in Javan Gibbon in Indonesia. Under direction of JOKO PAMUNGKAS and DIAH ISKANDRIATI
Hepatitis B virus (HBV) was reported not only able to infect human being, but also non-human primates, especially the great apes group such as orangutans, gorillas, chimpanzees, as well as the lesser apes from the family of Hylobatidae. Among other species within the genus, Hylobates moloch (owa jawa or silvery/ javan gibbons), which is considered as one of Indonesia’s endemic endangered species, has been reported to harbor HBV of their own strain. Analyses of HBV isolated from infected gibbons were done in this study to reveal their relatedness to the published data. Plasma samples from nine javan gibbons were obtained as part of diagnostic purpose. Those animals were previously tested positive for the presence of hepatisis B-surface antigen (HBsAg) by enzyme-linked immunosorbent assay (ELISA). DNA samples were extracted from these nine plasma samples to be used as templates for amplification of the Pre-S1 region by polymerase chain reactions (PCR) technique using semi degenerate primers that could amplify several strains of HBVs. The PCR products of 457 - 459 base pairs were then subject to restriction fragment length polymorphism (RFLP) analyses using Bst2UI enzyme to evaluate the pattern of cleaved fragments. The PCR products were sequenced for further homology analyses and to create phylogenetic tree of the sequenced data obtained from the study in comparison with published data. Two plasma samples were used as templates for whole region amplification using sets of 4 primer. The PCR products of 3192 base pairs were sequenced for further homology analyses and to create phylogenetic tree. Phylogenetic tree analyses for Pre-S1 nucleotide region and whole region showed that the javan gibbon isolates formed their own clusters, separate from the other nonhuman primate isolates.
RINGKASAN
RACHMITASARI NOVIANA. Isolasi, Identifikasi dan Karakterisasi Molekular
Virus Hepatitis B pada Owa Jawa (Hylobates moloch) di Indonesia. Dibimbing oleh JOKO PAMUNGKAS dan DIAH ISKANDRIATI.
Hepatitis atau peradangan hati adalah suatu kondisi klinis akibat terjadinya peradangan atau inflamasi pada organ ataupun jaringan hati yang ditunjukkan dengan ditemukannya sel-sel inflamatori pada jaringan hati tersebut. Infeksi virus hepatitis merupakan salah satu penyebab terjadinya peradangan hati selain adanya penyebab non infeksius seperti penggunaan obat-obatan terlarang dan minuman beralkohol. Menurut data organisasi kesehatan dunia (WHO, 2011), satu dari tiga penduduk dunia telah terinfeksi virus ini sementara satu dari 20 penduduk dunia hidup dengan infeksi kronis. Infeksi virus hepatitis yang bersifat kronis dapat mengakibatkan kematian karena menyebabkan sirosis hati.
Virus hepatitis B, salah satu dari 5 virus penyebab penyakit hepatitis, dapat ditularkan melalui darah, hubungan kelamin (sexual intercourse) dan perinatal (mother to child) pada saat melahirkan atau menyusui. Transmisi perinatal dan infeksi carrier yang bersifat jangka panjang menyebabkan adanya endemisitas dan prevalensi tinggi di benua Asia terutama bagian selatan dan timur. Selain dapat menyerang manusia, virus hepatitis B juga diketahui dapat menyerang satwa primata terutama dari golongan kera. Infeksi virus hepatitis B pada satwa primata terdeteksi melalui uji serologis maupun uji viral. Deteksi viral virus hepatitis B dilakukan melalui polymerase chain reaction (PCR).Secara eksperimental telah dilakukan transmisi VHB manusia melalui inokulasi cairan saliva dari manusia yang menderita hepatitis B ke satwa primata keluarga Hylobatidae. Replikasi virus yang terjadi pada satwa tersebut mengindikasikan adanya hubungan kekerabatan yang dekat antara kedua inang (manusia dan Hylobatidae).
Penelitian mengenai infeksi virus hepatitis B pada owa jawa (Hylobates moloch), salah satu spesies dari keluarga Hylobatidae, belum banyak dilakukandi Indonesia meskipun spesies ini merupakan spesies endemik Indonesia. Penelitian ini bertujuan mengeksplorasi informasi mengenai infeksi virus hepatitis B (VHB) melalui penyidikan isolasi dan identifikasi VHB dari spesies owa jawa (Hylobates moloch) yang berasal dari pusat rehabilitasi dan lembaga konservasi eks-situ di Indonesia, dilanjutkan dengan melakukan pengkarakterisasian virus hepatitis B asal spesies tersebut.
Penelitian ini dilakukan dari bulan Januari 2011 sampai Juni 2011. Metode yang dilakukan untuk memperoleh isolat VHB yaitu melalui uji PCR yang dilakukan terhadap sembilan sampel owa jawa yang telah berstatus positif antigen hepatitis B permukaan (HbsAg). Menggunakan kit ekstraksi DNA (QIAmp DNA Mini Blood Kit,Qiagen) didapatkan ekstrak DNA dari sediaan plasma owa jawa.
tersebut memiliki target produk kurang lebih 455 pasang basa. Pasangan primer ini sebelumnya telah diketahui dapat mengamplifikasi VHB daerah Pre-S1 dari isolat orangutan. Hasil amplifikasi menunjukkan bahwa semua isolat hasil studi memperlihatkan pita DNA VHB pada elektroforesis horizontal menggunakan gel agarosa.
Penggunaan enzim restriksi BST2UI mampu menunjukkan bahwa VHB yang menginfeksi owa jawa berbeda dengan VHB yang menginfeksi orangutan maupun manusia. Hal ini terlihat dari visualisasi gel elektroforesis produk PCR yang terpotong dengan menggunakan enzim tersebut. Produk PCR dari owa jawa maupun dari kontrol positif VHB dari orangutan, dapat terfragmentasi menggunakan enzim restriksi BST2UI, namun produk PCR kontrol positif VHB manusia tidak dapat terpotong. Posisi pemotongan enzim restriksi yaitu pada urutan spesifik CC(A/T)GG, dari hasil sekuensing, terlihat bahwa tiap amplikon mempunyai posisi dan jumlah situs pemotongan yang berbeda. Dengan demikian enzim BST2UI dapat digunakan sebagai deteksi awal yang membedakan infeksi VHB berasal dari manusia atau bukan manusia.
Untuk mendapatkan sekuens lengkap dari genom VHBGi dilakukan amplifikasi menggunakan empat pasang primer yang didisain berasal dari daerah yang conserved sehingga masing-masing amplikon yang dihasilkan mempunyai fragmen kontagius yang saling overlapped. Pasangan primer pertama adalah PreS1F (5’-GGGTCACCATATTCTTGGGAAC-3’) dan R5(5’- AGCCCAAA AGACCCACAATTC-3’). Target produk PCR yang diharapkan sebesar 1840 pasang basa. Set primer kedua adalah F6 (5’-ATATGGATGATGTGGTA TTGGG-3’) dan X102 (5’-ACCTTTAACCTAATCTCC-3’). Target produk PCR yang diharapkan sebesar 1027 pasang basa. Primer forward X101 (5’ -TCTGTGCCTTCTCATCTG-3’) dengan primer reverse CORE2 (5’-CCCAC CTTATGAGTCCAAGG-3’). Target produk PCR yang diharapkan sebesar 924 pasang basa. Set primer keempat adalah CORE1 (5’-GAGTGTGGATTC GCACTCCTCC-3’) dan R1 (5’-TGTAACACGAGCAGGGGTCCTA-3’) dengan target produk PCR sebesar 2109 pasang basa. Dua dari 9 isolat VHB dapat teramplifikasi dengan baik menggunakan empat pasang primer tersebut. Hal ini ditunjukkan dengan terlihatnya pita DNA hasil amplifikasi dari masing-masing pasangan primer.
Produk PCR yang didapatkan baik menggunakan primer untuk daerah Pre-S1 maupun genom lengkap VHB kemudian dilakukan purifikasi menggunakan kit ekstraksi gel QiaQuick (QiaGen, USA), sebelum dilakukan sekuensing untuk mendapatkan data sekuens VHBGi dari isolat hasil studi, baik untuk regio Pre-S1 ataupun sekuens genom lengkap VHB Gi.
Hasil analisa filogenetik VHBGi daerah Pre-S1 (459 nukleotida) menggunakan program MEGA memperlihatkan bahwa terjadi keragaman di antara isolat owa jawa hasil studi, namun isolat owa jawa tersebut berada pada percabangan tersendiri terpisah dari kelompok satwa primata lainnya yang data sekuensya didapat dari GenBank.
@Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
ISOLASI, IDENTIFIKASI DAN KARAKTERISASI
MOLEKULAR VIRUS HEPATITIS B
DI OWA JAWA (
Hylobates moloch
) DI INDONESIA
RACHMITASARI NOVIANA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Primatologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Isolasi, Identifikasi dan Karakterisasi Molekular Virus Hepatitis B pada Owa Jawa (Hylobates moloch) di Indonesia
Nama : Rachmitasari Noviana
NIM : P053090031
Disetujui
Komisi Pembimbing
Dr. drh. Joko Pamungkas, M.Sc Dr. drh. Diah Iskandriati
Ketua Anggota
Diketahui
Ketua Mayor Primatologi Dekan Sekolah Pascasarjana
Prof. drh. Dondin Sajuthi, MST. PhD Dr. Ir. Dahrul Syah, MSc.Agr
Judul Tesis : Isolasi, Identifikasi dan Karakterisasi Molekular Virus Hepatitis B pada Owa Jawa (Hylobates moloch) di Indonesia
Nama : Rachmitasari Noviana
NIM : P053090031
Disetujui
Komisi Pembimbing
Dr. drh. Joko Pamungkas, M.Sc Dr. drh. Diah Iskandriati
Ketua Anggota
Diketahui
Ketua Mayor Primatologi Dekan Sekolah Pascasarjana
Prof. drh. Dondin Sajuthi, MST. PhD Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Segala puji dan syukur penulis haturkan ke hadirat Allah SWT atas segala
limpahan rahmatNya pada saat melakukan penelitian hingga dapat
diselesaikannya tesis yang bertema virus hepatitis B dengan judul tesis Isolasi, Identifikasi dan Karakterisasi Molekular Virus Hepatitis B pada Owa Jawa (Hylobates moloch) di Indonesia.
Penulis menyampaikan penghargaan setinggi-tingginya kepada Dr. drh.
Joko Pamungkas, M.Sc, selaku ketua komisi pembimbing sekaligus sebagai
kepala Pusat Studi Satwa Primata, LPPM-IPB dan Dr. drh. Diah Iskandriati selaku
anggota komisi pembimbing dan kepala Laboratorium Mikrobiologi dan
Imunologi PSSP, LPPM IPB atas segala bimbingan, arahan, pengertian dan
dukungan fasilitas serta dana penelitian sejak perencanaan penelitian sampai
penulisan tesis dapat diselesaikan. Ucapan terima kasih penulis sampaikan pula
kepada Dr. Ir. Dedi Duryadi Solihin, DEA sebagai penguji luar komisi yang tidak
hanya mengenalkan penulis dalam dunia analisa molekular namun juga
memberikan tambahan wawasan pengetahuan kepada penulis dan masukan dalam
penulisan tesis ini.
Rasa terima kasih dan penghargaan yang tulus penulis sampaikan kepada
Prof. drh. Dondin Sajuthi, MST, Ph.D; selaku Ketua Program Studi Primatologi
Sekolah Pascasarjana IPB yang telah membuka kesempatan kepada penulis untuk
melanjutkan pendidikan ke jenjang yang lebih tinggi. Kepada Direktur Taman
Safari Indonesia, atas kerjasamanya dalam penelitian ini, rasa terima kasih juga
penulis sampaikan.
Kepada teman sejawat di Laboratorium Mikrobiologi dan Imunologi, PSSP
LPPM-IPB, Uus Saepuloh, S.Si, M.BioMed; Silmi Mariya, S.Si, MS; dra. Maryati
Surya, MS; dra. Isti Kartika Sari; Sela Mariya, S.Si; Iin Indriawati, Tri Faujiani,
Dede Juarsa dan Budi Doyo serta teman-teman di Pusat Studi Satwa Primata
LPPM IPB atas kerjasamanya dan dukungan moril baik langsung maupun tidak
langsung.
Ucapan terima kasih tidak lupa penulis haturkan kepada seluruh staf
pengajar Program Studi Primatologi atas kesempatan untuk mendapatkan
mengikuti perkuliahan di Program Studi Primatologi, Sekolah Pascasarjana IPB.
Ucapan terima kasih juga disampaikan kepada staf administrasi Program Studi
Primatologi atas segala bantuannya selama ini.
Kepada ibunda tercinta, Siti Hidajati, yang tak pernah putus berdoa untuk
keberhasilan penulis, kepada suami dan anak-anakku terkasih, Dr. Ir. Entang
Iskandar, MS; Dienita Aulia dan Tiara Dwina Amany yang dengan penuh
kesabaran, pengertian dan kasih mendampingi penulis selama ini, penulis sangat
berterima kasih. Almarhum ayahanda Purnomo dan Mohamad Dawami serta
ibunda Siti Sadiah yang selama hidupnya selalu mengingatkan untuk selalu
belajar dan belajar. Kepada kakak-kakakku dan adik-adikku terima kasih atas doa
dan semangatnya selama ini.
Penghargaan dan ucapan terima kasih disampaikan kepada semua pihak
yang tidak dapat disebutkan satu persatu sehingga peneliti dapat menyelasaikan
studinya di program studi ini.
Semoga hasil penelitian penulis dapat menambah khasanah wawasan dan
berguna bagi dunia ilmu pengetahauan dan kesejahteraan manusia serta hewan.
Bogor, Februari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 14 November 1972 dari ayah Purnomo dan ibu Siti Hidayati. Penulis merupakan putri pertama dari tiga bersaudara.
Penulis menyelesaikan pendidikan dasarnya pada tahun 1985 di SD Hang Tuah VI, Jakarta. Tahun 1988 menyelesaikan Sekolah Menengah Pertama di SMPN 30 Jakarta, dan tahun 1991 menyelesaikan Sekolah Menengah Atas di SMAN 3 Jakarta. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB. Tahun 1996 penulis meyelesaikan pendidikan Strata 1 dari Fakultas Kedokteran Hewan IPB.
DAFTAR ISI
Amplifikasi DNA untuk Sekuens Daerah Pre-S1 VHB ……… 12
Restriction Fragment Length Polymorphism ………. 14
Amplifikasi DNA untuk Genom Lengkap VHB ………. 14
Pemurnian Produk PCR ………. 15
Analisa Hasil Sekuensing ……….. 15
Alur penelitian ……… 16
HASIL DAN PEMBAHASAN ………. 17
Virus hepatitis B Gibbon Regio Pre-S1……….. 17
Amplifikasi Virus Hepatitis B Regio Pre-S1 ……… 17
Restriction Fragment Length Polymorphism ……… 19
Pembuatan Pohon Filogenetik ……….. 22
Sekuens Genom Lengkap Virus Hepatitis B Gibbon ………. 25
Amplifikasi Virus Hepatitis B Gibbon ………. 25
SIMPULAN DAN SARAN ………... 31
DAFTAR PUSTAKA ……….. 32
LAMPIRAN ………. 35
DAFTAR GAMBAR
halaman
1 Organisasi genom virus hepatitis B manusia (sirkular) ……… 7 2 Siklus hidup virus hepatitis B ………....………. 8 3 Organisasi virus hepatitis B pada woolly monkey ……….. 10 4 Visualisasi PCR VHB regio Pre-S1 yang menginfeksi spesies owa jawa
di lokasi A ………. 18
5 Visualisasi PCR VHB regio Pre-S1 yang menginfeksi spesies owa jawa
di lokasi B ………. 18
6 Visualisasi pemotongan produk DNA menggunakan enzim restriksi
BSt2UI lokasi A……….. 20 7 Visualisasi pemotongan produk DNA menggunakan enzim restriksi
BSt2UI lokasi B ……….. 21 8 Pohon filogenetik VHB Hylobatidae berdasarkan (a) sekuens nukleotida
VHB regio Pre-S1 (459pb); (b) situs pemotongan sekuens nukleotida VHB region pre-S1 menggunakan ensim restriksi BsT2UI ……….. 22 9 Pohon filogenetik VHB Hylobatidae dan orangutan berdasarkan sekuens
nukleotida VHB regio Pre-S1 (459 nuklotida)……… 24 10 Pohon filogenetik VHB Hylobatidae dan orangutan berdasarkan sekuens
asam amino VHB regio Pre-S1 ……… 24
11 Visualisasi hasil amplifikasi genom lengkap VHBGi ………... 26 12 Rekonstruksi genom lengkap VHBGi linear berdasarkan posisi primer
yang digunakan ………. 26
13 Prediksi genom linear sekuens sampel C1 dibandingkan dengan sekuens
H. pileatus dari GenBank ……….….. 28 14 Pohon filogenetik VHB genom lengkap asal satwa primata dan
DAFTAR TABEL
halaman
1 Klasifikasi dan penyebaran genus Hylobates ………. 4
2 Pasangan primer untuk amplifikasi genom lengkap VHBGi ………. 14 3 Hasil pemeriksaan serologis HbSAg (data sekunder) dan hasil PCR atas
Regio Pre-S1 dari virus hepatitis B pada owa jawa ……….. 17 4 Data sekuens produk PCR VHBGi regio Pre-S1 dan situs pemotongan
DAFTAR LAMPIRAN
1 Pensejajaran berganda virus hepatitis B regio Pre-S1 isolat hasil
studi dan situs pemotongan enzim restriksi BSt2UI halaman ………….. 35
2 Data sekuens GeneBank virus hepatitis B ………. 37
PENDAHULUAN
Latar Belakang
Hepatitis merupakan manifestasi klinis dari perubahan jaringan atau organ
hati berupa peradangan atau inflamasi yang dikarakterisasikan dengan terdapatnya
sel-sel inflamatori pada jaringan hati. Peradangan tersebut dapat diakibatkan oleh
agen yang bersifat non-infeksius seperti minuman beralkohol dan penggunaan
obat-obatan, sedangkan agen yang bersifat infeksius dapat disebabkan oleh infeksi
virus hepatitis atau bakteria. Pada infeksi virus hepatitis penyakit dapat bersifat
akut maupun kronis serta dapat berakhir dengan kematian akibat terjadinya sirosis
pada hati. Saat ini menurut data WHO satu dari tiga penduduk dunia telah
terinfeksi virus ini sementara satu dari 20 penduduk dunia hidup dengan infeksi
kronis (WHO, 2011).
Sampai saat ini terdapat lima virus penting yang dilaporkan menjadikan hati
sebagai organ target utama infeksi, yaitu virus Hepatitis A (VHA), B (VHB), C
(VHC), D (VHD) dan virus Hepatitis E (VHE). Virus hepatitis B (VHB)
merupakan satu-satunya virus DNA dalam keluarga virus hepatitis. Tiga cara
utama transmisi virus hepatitis B yaitu melalui darah, hubungan kelamin (sexual intercourse) dan perinatal (mother to child) pada saat melahirkan atau menyusui. Transmisi perinatal dan infeksi carrier yang bersifat jangka panjang menyebabkan adanya endemisitas dan prevalensi tinggi di benua Asia terutama bagian selatan
dan timur.
Selain menginfeksi manusia, VHB dilaporkan dapat pula menginfeksi
beberapa spesies satwa primata di fasilitas konservasi eks-situ, terutama dari
golongan kera yaitu simpanse (Pan troglodytes), orangutan (Pongo sp), gorilla dan gibbon (Hylobates sp), serta dari golongan monyet yaitu woolly monkey
(Lagothrix lagotricha).
Adanya infeksi VHB dapat dideteksi melalui uji serologis untuk antigen
lagotricha (woolly monkey) asal kebun binatang di Amerika Serikat, yang mengalami peradangan hati (Lanford et al. 1998).
Analisis pohon filogenetik mengindikasikan bahwa virus yang menginfeksi
simpansedan Hylobates bersifat indigenus pada masing-masing inangnya (Norder
et al. 1996) dan berada pada cabang pohon filogenetik yang berbeda dengan infeksi VHB pada manusia (Mac Donnald et al. 2000). Secara eksperimental telah dilakukan pula transmisi VHB manusia melalui inokulasi cairan saliva dari
manusia yang menderita hepatitis B ke satwa primata keluarga Hylobatidae (Scott
et al. 1980). Replikasi virus yang terjadi pada satwa tersebut mengindikasikan adanya hubungan kekerabatan yang dekat antara manusia dan Hylobatidae dan kemungkinan adanya transmisi alami dari manusia ke keluarga Hylobatidae.
Penelitian mengenai infeksi virus hepatitis B pada owa jawa di Indonesia
belum banyak dilakukan. Informasi kejadian infeksi VHB pada satwa ini banyak
berasal dari luar Indonesia, meskipun spesies ini merupakan spesies endemik
Indonesia. Owa jawa juga merupakan spesies yang terancam punah menurut
International Union for Conservation of Nature (2008). Dengan status ini, telah
dilakukan upaya untuk mengatasi kepunahan spesies owa jawa ini melalui
beberapa usaha berupa penangkaran, taman satwa dan upaya pengembalian atau
pelepasliaran satwa ini ke habitat aslinya. Upaya tersebut sebaiknya diiringi pula
dengan pemeriksaan status kesehatan satwa dan orang-orang yang mengalami
kontak langsung dengan satwa tersebut. Salah satunya adalah virus hepatitis B
yang telah diketahui dapat menginfeksi manusia dan satwa primata.
Tujuan Penelitian
Mengeksplorasi informasi mengenai infeksi virus hepatitis B pada satwa
primata dari keluarga Hylobatidae, khususnya melalui penyidikan isolasi dan identifikasi VHB dari spesies owa jawa (Hylobates moloch) yang berasal dari pusat rehabilitasi dan beberapa lembaga konservasi eks-situ di Indonesia,
dilanjutkan dengan melakukan pengkarakterisasian virus hepatitis B asal spesies
Manfaat Penelitian
Dengan informasi yang diperoleh mengenai infeksi virus VHB dan
perbedaan karakter antara virus hepatitis B yang menginfeksi manusia (VHBHu)
dengan virus Hepatitis yang menginfeksi owa jawa (VHBGi), diharapkan dapat
membantu penapisan status mikrobiologik owa jawa di fasilitas lembaga
konservasi eks-situ, serta lebih lanjut dapat dimanfaatkan dalam pengelolaan
TINJAUAN PUSTAKA
Owa jawa
Taksonomi
Owa jawa (Hylobates moloch), dikenal pula dengan nama Javan gibbon
atau Silvery gibbon, menurut Napier dan Napier (1985), diklasifikasikan sebagai berikut:
Spesies : Hylobates moloch
Menurut Geissmann (1995), genus Hylobates dapat dikelompokkan dalam empat subgenus, yaitu Hylobates, Nomascus, Bunopithecus dan Sympalangus. Pola penyebaran dari masing-masing subgenus disajikan pada tabel di bawah ini.
Tabel 1 Klasifikasi dan Penyebaran genus Hylobates
Genus Subgenus Spesies Penyebaran
Morfologi owa jawa
Owa jawa adalah satwa primata arboreal, dengan tempat hidupnya adalah
kanopi pohon. Mereka tidak mempunyai ekor, mempunyai formulasi gigi yang
sama dengan Pongidae. Mempunyai tangan yang panjang, dengan panjang tangan dapat mencapai tanah disaat mereka berdiri dengan dua kaki (bipedal).
Pergelangan tangan dan bahu telah mengalami adaptasi sehingga memudahkan
pergerakan mereka dalam brakhiasi. Nowak (1999) mendefinisikan Hylobates
sebagai penghuni pohon, dan gibbon (owa) sangat sesuai dengan penamaan
tersebut. Ketangkasan genus ini dalam melakukan brakhiasi, bergerak dari satu
pohon ke pohon lainnya, melebihi satwa lainnya.
Supriatna dan Wahyono (2000) menyatakan bahwa tubuh owa Jawa
ditutupi rambut yang berwarna kecoklatan sampai keperakan atau kelabu. Bagian
dagu pada beberapa individu berwarna gelap. Rambut di atas kepala hitam dan
kulit muka hitam, alis berwarna putih, rambut pada bayi berwarna kelabu terang
dibanding dengan dewasa (Rowe 1996).
Adanya pembengkakan pada pada alat kelamin betina, terutama pada
Hylobates moloch, merupakan cirri menonjol pada genus Hylobates, namun pembengkakan ini tidak begitu nyata terlihat pada Hylobates pileatus (Mootnick 2006).
Status Konservasi
Owa jawa merupakan salah satu spesies endemik Indonesia. Keberadaan
spesies ini telah dilindungi sejak tahun 1931 untuk menghindari kepunahan
melalui Peraturan Perlindungan Binatang Liar No. 266 yang kemudian diperkuat
dengan Undang-undang No. 5 tahun 1990 dan SK Menteri Kehutanan 10
Juni1991 (Supriatna & Wahyono 2000). Pada tahun 1986 – 1990, International Union for Conservation Nation (IUCN) telah memasukkan owa jawa sebagai spesies yang terancam punah. Dikatakan sebagai terancam punah karena
populasinya di alam diperkirakan kurang dari 2500 individu, kemudian dengan
observasi yang berkesinambungan terjadi penurunan jumlah individu dewasa dan
Virus Hepatitis B Klasifikasi Virus
Virus Hepatitis adalah virus yang menjadikan hati sebagai target utama
infeksi. Infeksi virus dapat menyebabkan peradangan hati yang ditandai dengan
ditemukannnya sel-sel inflamatori pada hati. Terdapat lima virus yang dikenal
dapat mengakibatkan hepatitis dan berasal dari keluarga virus yang berbeda. Virus
hepatitis A merupakan anggota dari keluarga Picornaviridae. Virus hepatitis B adalah anggota keluarga Hepadnavidae. Virus hepatitis C merupakan anggota dari keluarga Flaviviridae, sedangkan virus hepatitis D dan E masing-masing merupakan anggota dari keluarga Deltaviridae dan Caliciviridae.
Menurut Komite Internasional Taksonomi Virus (International Committee on Taxonomy of Viruses, ICTV, 2009) keluarga Hepadnaviridae dibagi menjadi dua genus yaitu:
1. Genus Orthohepadnavirus, yaitu virus hepatitis yang menyerang mamalia, seperti hepatitis B virus (yang menginfeksi ordo primata), woodchuck hepatitis virus, ground squirrel hepatitis virus dan arctic squirrel hepatitis virus
2. Genus Avihepadnavirus, yaitu virus hepatitis yang menyerang bangsa unggas, seperti duck hepatitis virus, heron hepatitis virus dan goose hepatitis virus.
Genom Virus
Virus hepatitis B (VHB), sesuai dengan nama keluarga (Hepadnavirus)
adalah virus DNA dengan virion beramplop (envelope) berukuran 42-nm, dengan sebagian DNA virion adalah utas ganda (partially double stranded). Virus ini merupakan virus DNA hewan berukuran terkecil dan mempunyai ukuran genom
sebesar kurang lebih 3200 pasang basa, terdiri dari empat open reading frame
(ORF) untuk gen P, C, S dan X yang masing-masing mengkode DNA
polimerase/reverse transcriptase, protein inti (core), protein permukaan (surface)
dan protein X. Untuk gen S dibagi menjadi regio pre-S1, pre-S2 dan S. Gen C
Protein permukaan yang berada pada pembungkus virus (envelope) dikenal sebagai antigen permukaan (HbsAg) yang merupakan protein penting dalam
pendiagnosaan klinis infeksi dan imunisasi virus ini.
Selain HBsAg terdapat dua antigen penting lainnya yaitu antigen inti
hepatitis B (HBcAg) yang membentuk nukleokapsid virion, dan antigen e
(HBeAg) adalah antigen yang dikeluarkan ke dalam peredaran darah oleh sel-sel
yang terinfeksi virus (Levinson, 2008)
Gambar 1 Organisasi genom virus hepatitis B manusia (sirkular). Sumber: Wands, JR. 2004
Replikasi Virus
Virus hepatitis B merupakan virus DNA dengan utas ganda sebagian yang
menggunakan enzim transkripsi balik (reverse transcriptase) dalam replikasinya. Proses replikasi virus secara umum terdiri dari beberapa tahap, yaitu perlekatan
(attachment), penetrasi (penetration), uncoating, ekspresi gen, replikasi genom,
assembly dan pelepasan (release). Proses transkripsi terjadi di dalam nukleus, sementara replikasi genom berlangsung di sitoplasma, di dalam protein inti (White
dan Fenner, 1994).
Protein permukaan virion dapat menempel (attach) pada permukaan sel inang melalui reseptor spesifik. Situs penempelan virus hepatitis B adalah pada
protein L. Virion yang menempel pada permukaan sel inang mengalami
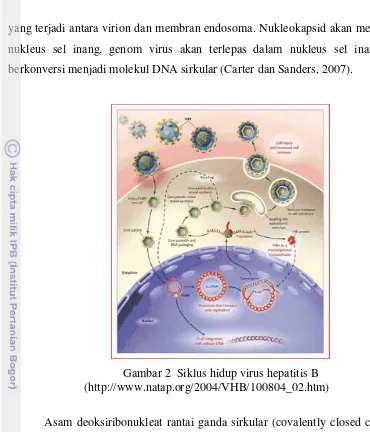
yang terjadi antara virion dan membran endosoma. Nukleokapsid akan memasuki
nukleus sel inang, genom virus akan terlepas dalam nukleus sel inang dan
berkonversi menjadi molekul DNA sirkular (Carter dan Sanders, 2007).
Gambar 2 Siklus hidup virus hepatitis B (http://www.natap.org/2004/VHB/100804_02.htm)
Asam deoksiribonukleat rantai ganda sirkular (covalently closed circular,
cccDNA) ini kemudian menjadi cetakan untuk sintesa asam ribonukleat
messanger (mRNA) menggunakan enzim polimerase RNA selular. Hepadnavirus merupakan keluarga DNA virus yang unik karena menggunakan mRNA sebagai
cetakan dalam menghasilkan genom DNA melalui transkripsi terbalik (reverse transcription) (White dan Fenner, 1994).
Transmisi Virus
Infeksi virus ini ditularkan melalui darah, hubungan kelamin dan perinatal
(dari ibu ke anak saat melahirkan dan menyusui). Transmisi melalui jarum suntik
yang terkontaminasi virus memperlihatkan bahwa transmisi sangat mudah terjadi.
Patogenesa
Setelah menginfeksi inangnya dan memasuki peredaran darah, VHB akan
menginfeksi hepatosit kemudian antigen viral akan berada pada permukaan sel
inang. Sel T sitotoksik akan memediasi sistem pertahanan tubuh untuk melawan
masuknya antigen viral berupa adanya inflamasi dan nekrosis. Virus ini tidak
menghasilkan efek sitopatik, sehingga diduga patogenesa virus ini merupakan
hasil dari pertahanan tubuh bermediasi sel (White dan Fenner, 1994). Penderita
dapat menjadi chronic carrier, bila antigen permukaan VHB (HBsAg) terdeteksi lebih dari 6 bulan. Pada penderita chronic carrier, terjadi kasus hepatocellular carcinoma dengan prevalensi tinggi (Levinson, 2008)
Virus Hepatis B Pada Satwa Primata
Warren et al. (1999) menemukan adanya infeksi VHB di lapangan secara alami pada orangutan yang berada di Pusat Rehabilitasi Orangutan Wanariset,
Kalimantan Timur. Sebanyak 195 sampel serum diujikan untuk mendeteksi
anti-hepatitis B inti (HBcAb), anti-HB permukaan (HBsAb) dan antigen permukaan
hepatitis B (HBsAg) serta uji PCR. Ditemukan bahwa 55 individu adalah HBsAg
positif, 28 HBsAb positif, uji PCR yang dilakukan pada individu HbsAg positif
diperoleh 32 sampel adalah positif VHB.
Vaudin et al. (1988) menemukan adanya infeksi VHB pada simpanse (Pan troglodytes), VHB juga terbukti dapat menginfeksi genus Hylobates dan
Nomascus (Noppornpanth et al. 2003), Gorilla gorilla (Grethe et al. 2000) dan
Lagothrix lagothricha (Lanford et al. 1998).
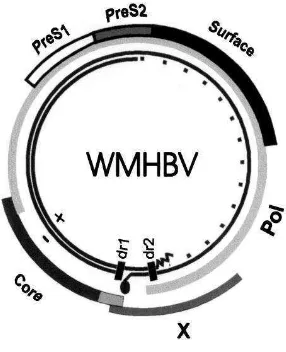
Infeksi VHB yang terjadi pada woolly monkey menjadi acuan awal penelitian hepatitis B pada satwa primata. Lanford et al. (1998) menemukan bahwa hepadnavirus yang diisolasi dari woolly monkey mempunyai perbedaan dari VHB yang berasal dari isolat manusia. Analisa filogenetik terhadap sekuens
nukleotida dilakukan pada bagian gen inti dan permukaan. Ditemukan bahwa
sekuens tersebut merupakan basal atau ancestral dari grup VHB pada manusia, sehingga diperkirakan bahwa virus hepatitis B yang menginfeksi woolly monkey
Gambar 3 Organisasi virus VHB pada woolly monkey (WMHBV)
(Lanford et al. 1998)
Transmisi VHB juga terjadi pada genus Hylobates. Analisa filogenetik dari isolat genus tersebut menyatakan bahwa sekuens nukleotida gen permukaan VHB
yang menginfeksi Hylobates yang berada dalam lembaga konservasi berada pada
cluster yang berbeda dengan VHB yang berasal dari inang lainnya (Noppornpanth
et al. 2003). Virus hepatitis B ditemukan tidak hanya pada sediaan darah namun juga dari cairan saliva Hylobates pileatus, H. lar, dan H. concolar. Dari analisa lanjutan menggunakan enzim restriksi (analisis RFLP) dari isolat gibbon dan
isolat manusia terlihat bahwa VHB yang menginfeksi keduanya merupakan VHB
yang mempunyai karakterisasi molekular yang berbeda (Noppornpanth et al. 2003).
Identifikasi Asam Nukleat Virus
Identifikasi agen virus dapat dilakukan melalui analisa genom virus.
Penggunaan reaksi enzim Taq DNA polimerase dalam tehnik PCR (Polymerase Chain Raction) memungkinkan identifikasi secara molekular yang memiliki sensitifitas tinggi dengan mengamplifikasi hanya dari satu molekul DNA tunggal
dan kopi gen tunggal dapat diekstraksi dari campuran genomik yang kompleks.
Dengan kata lain, PCR merupakan suatu reaksi in vitro untuk menggandakan
(mengamplifikasikan) jumlah molekul DNA pada target tersebut dengan bantuan
enzim Taq DNA polimerase dan oligonukleotida sebagai primer dalam sebuah
Tehnik amplifikasi DNA berbasis pada siklus termal berupa pemanasan dan
pendinginan secara berulang yang terdiri dari tiga tahap yaitu pemecahan
(denaturation), penempelan (annealing) dan pemanjangan (elongation). Primer yang digunakan berisi sekuens komplementari yang didisain untuk
mengamplifikasi region target tertentu . Primer yang berada sebelum daerah target
disebut primer forward dan yang berada setelah target disebut primer reverse
(Ubaidillah dan Sutrisno, 2009). Hasil amplifikasi DNA dengan tehnik PCR
kemudian dapat divisualisasikan sebagai pita-pita DNA pada gel agarosa. Teknik
ini sangat efisien untuk mengamplifikasi urutan DNA VHB.
Enzim endonuklease restriksi adalah enzim bakteri yang digunakan dalam
tehnik molekular untuk mengenali sekuens spesifik dalam DNA dan kemudian
melakukan pemotongan DNA tersebut untuk mendapatkan fragmen-fragmen
spesifik yang dikenal sebagai fragmen restriksi (Ubaidillah dan Sutrisno, 2009).
Ensim restriksi memainkan peranan penting dalam konstruksi molekul DNA
rekombinan dan mapping lokasi dari situs restriksi pada DNA. Selain itu, situs spesifik dari enzim restriksi ini pada fragmen gen tertentu dapat dijadikan sebagai
alat genotiping (karakteristik genotipe) dari individu pada spesies tersebut
(Ubaidillah dan Sutrisno, 2009).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan dari bulan Januari sampai dengan bulan Juni 2011,
bertempat di Laboratorium Mikrobiologi dan Imunologi, Pusat Studi Satwa
Primata, Lembaga Penelitian dan Pengabdian kepada Masyarakat, Institut
Pertanian Bogor (PSSP LPPM-IPB), Jalan Lodaya II/5, Bogor 16151.
Sampel Penelitian
Sampel yang dimanfaatkan dalam penelitian ini adalah plasma owa jawa
yang merupakan koleksi sampel Laboratorium Mikrobiologi dan Imunologi PSSP
LPPM-IPB, sebagai bagian dari pemeriksaan rutin kesehatan satwa dari beberapa
fasilitas konservasi eks-situ satwa primata. Semua sampel yang digunakan dalam
penelitian ini, berasal dari 9 ekor satwa owa jawa yang memiliki status positif
atas pemeriksaan terhadap antigen permukaan virus hepatitis B (HBsAg) melalui
uji ELISA (data sekunder).
Ekstraksi DNA
Pemurnian DNA virus dilakukan dari sampel plasma owa jawa
menggunakan kit QIAmp DNA Mini Blood Kit (Qiagen, USA) sesuai dengan petunjuk dari pedoman penggunaan dari perusahaan. Sebanyak 200µl sampel
plasma ditambahkan ke dalam tabung mikro yang telah berisi 20µl (20mg/ml)
proteinase K. Larutan penyangga pelisis (lisis buffer) ditambahkan sebanyak 200µl ke dalam masing-masing tabung mikro. Untuk menghomogenkan campuran
tersebut dilakukan homogenisasi menggunakan vortex dan dilanjutkan dengan
inkubasi selama 10 menit pada suhu 560 C. Prosedur selanjutnya dilakukan
sentrifugasi, pencucian dan elusi sesuai dengan prosedur baku dari kit ekstraksi
DNA QiAmp DNA Miniblood Kit.
Amplifikasi DNA untuk Sekuens Daerah Pre-S1 VHB
mengamplifikasi daerah Pre-S1 yang merupakan daerah variabel dan karakteristik
untuk VHB yang berasal dari spesies yang berbeda. Set primer forward dan
reverse disintesa dari sekuens bagian paling conserved di daerah yang variabel di antara berbagai strain VHB.
Sebanyak 50 µl reagen PCR yang terdiri dari, masing-masing 1µl primer
forward dan reverse (10 pmol/µl), 4 µl MgCl2 (25mM), 5 µl dNTPs (10 mM),
0,5µl Taq Gold Polymerase (5 U/µl), 5 µl PCR Buffer 10X (500mM KCl,
100mM Tris-HCl (pH 8,3), sampel DNA (10 ul) dan ddH2O (23,5 ul) dimasukkan
ke dalam tabung mikro 200µl dan dihomogenkan menggunakan vortex.
Merujuk kepada penelitian yang dilakukan oleh Warren et al. (1999) yang telah berhasil mengamplifikasi VHB daerah Pre-S1 dari isolat orangutan,
digunakan pasangan primer yang sama untuk mengamplifikasi VHB daerah
Pre-S1 dari isolat DNA owajawa yaitu hepB-SF1 dengan sekuens 5’ -TGYGGGTCACCWTATTCTTGGG-3’ dan hepB-SRout yang memiliki sekuens 5’-CACTGTTCCTGAACTGGAGC-3’. Pasangan primer tersebut memiliki target produk kurang lebih 455 pasang basa.
Amplifikasi DNA dilakukan menggunakan mesin PCR (Perkin Elmer,
Model 9700), melalui beberapa tahapan. Pada tahap awal dilakukan pre-PCR
untuk mengaktifkan enzim polymerase pada suhu 940C selama 10 menit. Tahapan selanjutnya adalah amplifikasi PCR yang terdiri atas denaturasi sampel pada suhu
940C selama 30 detik, annealing pada suhu 620C selama 30 detik, dan tahap elongasi pada suhu 720C selama 1 menit. Tahapan ini dilakukan selama 30 kali
dengan siklus yang berulang. Tahap akhir adalah post-PCR dengan suhu 720C
selama 10 menit.
Produk PCR yang telah diamplifikasi tersebut dijalankan pada gel agarosa
2% yang mengandung ethidium bromida 1 µg/ml dalam bufer TAE menggunakan
elektroforesis horizontal. Penanda DNA 1 kb (Invitrogen, USA) dan produk PCR
yang telah ditambahkan pewarna (loading dye) dimasukkan ke dalam sumur gel. Alat dokumentasi Gel Doc 2000 (BioRad, USA) digunakan untuk
memvisualisasikan hasil elektroforesis. Sebagai kontrol positif PCR digunakan
DNA positif VHB gibbon (VHBGi), VHB manusia (VHBHu) dan VHB
Restriction Fragment Length Polymorphism (RFLP)
Terhadap produk PCR yang memberikan hasil positif pada uji PCR
dilakukan digesti menggunakan enzim restriksi BSt2UI (1 U/µl) yang bekerja
pada sekuens spesifik yaitu CC(A/T)GG dari sekuens nukleotida sampel. Enzim
restriksi ini telah diketahui dapat memotong sekuens nukelotida dari VHBOu
namun tidak dapat memotong sekuens nukleotida dari VHBHu. Sebanyak 20µl
campuran reagensia yang terdiri dari 1µl enzim BSt2UI (1IU/ul), buffer pereaksi
10 x sebanyak 1,5µl, dan produk PCR sebanyak 3,5µl. Ditambahkan air destilasi
sampai volume mencapai 20µl. Kemudian dilakukan inkubasi pada suhu 600C
selama 1 jam.
Untuk memvisualisasikan hasil restriksi enzim, produk PCR yang telah
diinkubasi dengan enzim restriksi tersebut dijalankan melalui gel agarosa
menggunakan elektroforesis horizontal dengan berkonsentrasi 2% yang
ditambahkan ethidium bromida sebagai pewarna (staining), selama 1,5 jam, 100V. Pembacaan hasil eletroforesis dilakukan melalui alat GelDoc.
Amplifikasi DNA untuk Sekuens Genom Lengkap VHB
Amplifikasi DNA untuk mendapatkan sekuens genom lengkap VHBGi
merujuk kepada Sa-Nguanmoo et al. (2008) yang menggunakan empat set primer seperti tertera pada tabel 2 di bawah ini.
Tabel 2 Pasangan primer untuk amplifikasi genom lengkap VHBGi
Primer set
Primer Sekuens primer Posisi nukleotida Target produk (pb) 1 PreS1F 5’-GGGTCACCATATTCTTGGGAAC-3’ 2814 -2835
1840 R5 5’-AGCCCAAAAGACCCACAATTC-3’ 1015 - 995
2 F6 5’-ATATGGATGATGTGGTATTGGG-3’ 737-758
1027 X102 5’-ACCTTTAACCTAATCTCC-3’ 1764 - 1748
3 X101 5’-TCTGTGCCTTCTCATCTG-3’ 1552 - 1569
924 CORE2 5’-CCCACCTTATGAGTCCAAGG-3’ 2476 - 2457
4 CORE1 5’-GAGTGTGGATTCGCACTCCTCC-3’ 2268 - 2289
2109 R1 5’-TGTAACACGAGCAGGGGTCCTA-3’ 201 - 180
Sebanyak 50 µl reagensia PCR yang terdiri dari, masing-masing satu pasang
dNTPs (10 mM), 1µl Taq Gold Polymerase (5 U/µl), 5 µl PCR Buffer 10X
(500mM KCl, 100mM Tris-HCl (pH 8,3), sampel DNA (10 ul) dan ddH2O
(23ul) dimasukkan ke dalam tabung mikro 200µl dan dihomogenkan
menggunakan vortex.
Amplifikasi DNA dilakukan menggunakan mesin PCR (Perkin Elmer,
Model 9700), melalui beberapa tahapan. Pada tahap awal dilakukan pre-PCR
untuk mengaktifkan enzim polymerase pada suhu 940C selama 10 menit. Tahapan
selanjutnya adalah amplifikasi PCR yang terdiri atas denaturasi sampel pada suhu
940C selama 30 detik, annealing pada suhu 550C selama 30 detik, dan tahap elongasi pada suhu 720C selama 2 menit. Tahapan ini dilakukan selama 40 kali
dengan siklus yang berulang. Tahap akhir adalah post-PCR dengan suhu 720C
selama 10 menit.
Produk PCR yang telah diamplifikasi tersebut dijalankan pada gel agarosa
2% yang mengandung ethidium bromida 1 µg/ml dalam bufer TAE menggunakan
elektroforesis horizontal. Penanda DNA 1 kb dan produk PCR yang telah
ditambahkan pewarna (loading dye) dimasukkan ke dalam sumur gel. Alat dokumentasi Gel Doc 2000 (BioRad, USA) digunakan untuk memvisualisasikan
hasil elektroforesis. Sebagai kontrol positif digunakan DNA positif VHB gibbon
(VHBGi), VHB manusia (VHBHu) dan VHB orangutan (VHBOU).
Pemurnian Produk PCR
Pemotongan gel produk PCR dilakukan dengan memotong gel yaitu tepat
pada bagian gel yang memiliki pita yang berpendar saat diradiasi sinar UV.
Potongan gel hasil amplifikasi kemudian dilakukan pemurnian menggunakan
kit ekstraksi gel QiaQuick (Qiagen, USA). Untuk mendapatkan sekuens
nukleotida, hasil pemurnian produk PCR dilakukan di Macrogen Inc, Korea.
Sekuensing dilakukan baik terhadap produk PCR VHBGi regio Pre-S1 maupun
genom lengkap VHBGi.
Analisa Hasil Sekuensing
Pembacaan hasil sekuensing mengunakan perangkat lunak komputer
2.0 (BLAST, 2011) dan ClustalW2 (Kumar et al. 2011). Pembuatan pohon filogenetik menggunakan perangkat lunak komputer MEGA versi 5.0 (Kumar et al. 2011). Sebagai pembanding dimasukkan urutan nukleotida virus Hepatitis B asal spesies Gibbon lainnya di luar Indonesia, orangutan, manusia , woolly monkey, simpanse dan gorilla dari data GeneBank.
Alur Penelitian
Seleksi owa jawa yang terdeteksi positif dari hasil uji serologi HBsAg akan
dilanjutkan dengan uji karakteristik diagnostik cepat melalui PCR dengan primer
daerah Pre-S21 VHB.
Isolat yang memberikan karakteristik spesifik dengan sediaan material DNA
yang memadai maka akan dilakukan karakteristik nukleotida penyusun virus
hepatitis B pada owa jawa secara utuh.
Kemungkinan terjadinya transmisi VHB secara interspesies maupun
intraspesies pada owa jawa
Sampel darah owa jawa penangkaran eksitu
Karakteristik diagnostik cepat melalui PCR dengan primer
spesifik VHB daerah pre-S1dari sampel positif serologi owa jawa yang positif secara
uji serologi HBsAg
Rekonstruksi pohon filogenetik dengan satwa
primata lain
Karakteristik molekular secara utuh VHB pada owa jawa Rekonstruksi pohon
HASIL DAN PEMBAHASAN
Virus Hepatitis B Gibbon Regio Pre-S1
Amplifikasi Virus Hepatitis B Regio Pre-S1
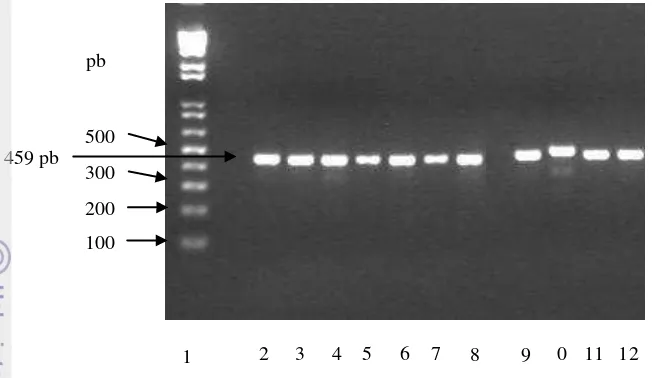
Hasil amplifikasi dari9 sampel DNA owa jawa yang telah berstatus serologis
positif terhadap antigen virus hepatitis B menggunakan pasangan primer hepSF-1
dan hepSR-out menghasilkan fragmen pita DNA sekitar 459 pasang basa (Tabel
3). Hal ini menunjukkan bahwa ke-9 individu owa jawa tersebut terinfeksi
dengan virus hepatitis B (VHB).
Tabel 3 Hasil pemeriksaan serologis HbsAg (data sekunder) dan hasil PCR atas regio Pre-S1 dari virus hepatitis B pada owa jawa
No. ID HBsAg Hasil PCR VHB
Sebagai pembanding dalam amplifikasi digunakan kontrol positif yang
berasal dari pasien manusia dan orangutan penderita hepatitis B. Gambar 4 dan 5
menunjukkan hasil amplifikasi virus hepatitis B gibbon yang dilalukan pada gel
agarosa menggunakan elektroforesis horizontal. Pada kontrol positif pasien
manusia, terlihat bahwa pita DNA isolat VHB manusia berada di atas pita DNA
dari isolat kontrol positif DNA VHB orangutan maupun sampel penelitian. Posisi
pita isolat kontrol positif VHB orangutan berada di antara pita isolat VHB sampel
dan kontrol positif VHB manusia. Hasil PCR memperlihatkan bahwa ketujuh
(Gambar 4) dan kedua (Gambar 5) sampel DNA owa jawa teramplifikasi dengan
baik menggunakan pasangan primer untuk regio pre-S1 VHB dengan ukuran
Gambar 4 Visualisasi PCR VHB Regio Pre-S1 yang menginfeksi spesies owa jawa pada lokasi A. (1)Penanda DNA 1kpb, (2) isolat A1, (3) A2, (4) A3, (5) A5, (6) A6, (7) A8, (8) A9, (9) kontrol positif VHBGi, (10) kontrol positif VHBHu, (11) kontrol positif VHBOu
100 pb 300 pb
200 pb 400 pb 500 pb
1 2 3 4 5 6
459 pb
Gambar 5 Visualisasi PCR VHB Regio Pre-S1 yang menginfeksi spesies owa jawa pada lokasi B.(1) marker DNA 1kbp, (2) isolat C1, (3) C2, (4) kontrol positif VHBHu, (5) kontrol positif VHBOu1 dan (6) kontrol positif VHBOu2.
Menurut Warren et.al (1999), dengan menggunakan pasangan primer hepSF-1 dan hepSR-out, akan menghasilkan amplikon VHB Regio Pre-S1 sebesar
455 pasang basa. Jika mengacu pada hasil sekuensing beberapa sampel yang
3 4 6
1 9 10
1 2 3 5 7 8 11 12
300
200
100 500 pb
dilakukan di Macrogen (Korea), didapatkan bahwa besar masing-masing
amplikon berbeda-beda (Tabel 4). Dengan melakukan pensejajaran sekuens
terhadap semua sekuens isolat sampel VHB menggunakan program ClustalW2
(Larkin MA, et al. 2007) terlihat adanya keragaman pada besar amplikon, hal ini mungkin disebabkan adanya insersi ataupun delesi nukleotida dari masing-masing
produk PCR. Data sekuen isolat VHB bervariasi antara 457pb, 458pb dan 459 pb,
berbeda dengan target produk yang diharapkan sebesar 455pb.
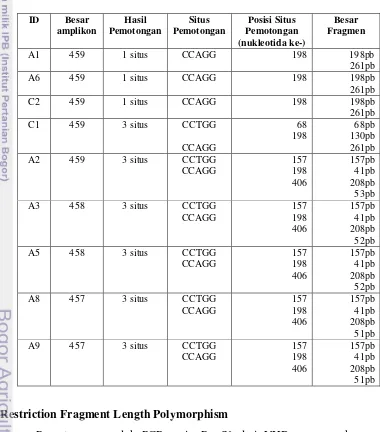
Tabel 4 Data sekuens produk PCR VHBGi regio Pre-S1 dan situs pemotongan dari enzim restriksi BSt2UI
ID Besar
restriksi Bst2UI menghasilkan fragmentasi produk PCR dengan situs pemotongan
spesies tertentu. Hasil potongan enzim restriksi (Gambar 6 dan 7) memperlihatkan
bahwa pada 9 isolat owa jawa terjadi fragmentasi DNA, demikian pula pada
kontrol positif VHB gibbon dan orangutan. Namun pada kontrol VHB manusia
tidak terjadi pemotongan regio Pre-S1.
10 11 500 pb
300 pb
200 pb
100 pb
1 2 3 4 5 6 7 8 9 12
261 pb 208 pb 198 pb 157 pb
8 6
(a) (b) (c)
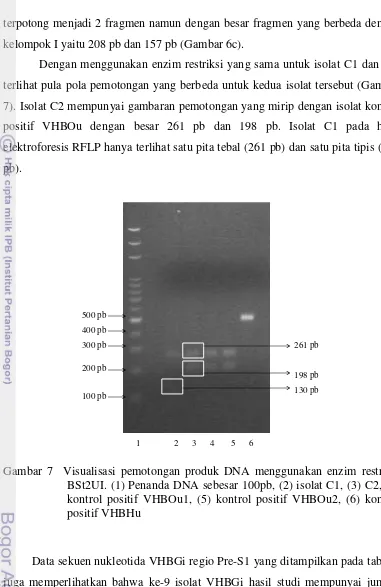
Gambar 6 Visualisasi produk DNA menggunakan enzim restriksi BSt2UI. (a). Baris 1(penanda DNA 1kpb Invitrogen, USA), Baris 2-8 (isolat hasil studi), Baris 9 kontrol positif VHBGi, Baris 10 kontrol positif VHBHu, Baris 11 kontrol positif VHBOu1, Baris 12 kontrol positif VHBOu2. (b). Isolat A6. (c). Isolat A9
Gambar 6a memperlihatkan adanya keragaman posisi pemotongan produk
PCR regio Pre-S1 VHB yang diisolasi. Sampel A1 dan A6, selanjutnya
dikelompokkan sebagai kelompok I, memperlihatkan posisi pemotongan yang
hampir sama dengan kontrol positif VHB regio Pre-S1orangutan. Sedangkan
sampel A2, A3, A5, A8 dan A9, selanjutnya dikelompokkan sebagai kelompok II,
mempunyai posisi pemotongan yang berbeda dengan kontrol positif VHB regio
pre-S1gibbon maupun orangutan. Kelompok I terlihat terpotong menjadi 2
terpotong menjadi 2 fragmen namun dengan besar fragmen yang berbeda dengan
kelompok I yaitu 208 pb dan 157 pb (Gambar 6c).
Dengan menggunakan enzim restriksi yang sama untuk isolat C1 dan C2,
terlihat pula pola pemotongan yang berbeda untuk kedua isolat tersebut (Gambar
7). Isolat C2 mempunyai gambaran pemotongan yang mirip dengan isolat kontrol
positif VHBOu dengan besar 261 pb dan 198 pb. Isolat C1 pada hasil
elektroforesis RFLP hanya terlihat satu pita tebal (261 pb) dan satu pita tipis (130
pb).
500 pb
200 pb 400 pb 300 pb
100 pb
261 pb
130 pb 198 pb
2
1 3 4 5 6
Gambar 7 Visualisasi pemotongan produk DNA menggunakan enzim restriksi BSt2UI. (1) Penanda DNA sebesar 100pb, (2) isolat C1, (3) C2, (4) kontrol positif VHBOu1, (5) kontrol positif VHBOu2, (6) kontrol positif VHBHu
Data sekuen nukleotida VHBGi regio Pre-S1 yang ditampilkan pada tabel 3
juga memperlihatkan bahwa ke-9 isolat VHBGi hasil studi mempunyai jumlah
dan posisi situs pemotongan yang berbeda, sehingga dapat dikelompokkan
menjadi dua kelompok. Isolat A1, A6 dan C2, hanya mempunyai satu situs
pemotongan yaitu pada nukleotida ke 198 sehingga produk PCR ketiga isolat
adalah 198 pb dan 261 pb. Isolat C1 mempunyai 2 situs pemotongan yaitu pada
nukleotida ke 68 dan 198, dengan besar fragmen 68 pb, 130 pb dan 261 pb.
Produk PCR isolat A2, A3, A5, A8 dan A9 mempunyai 3 situs pemotongan
dan terfragmentasi menjadi 4 fragmen. Hasil pemotongan pada kelima isolat
tersebut berada pada situs nukleotida ke 157, 198 dan 406. Besar fragmen yang
terbentuk adalah 157 pb, 41 pb, 208 pb dan 53 pb. Hasil elektroforesis RFLP
(Gambar 6a) tidak terlihat dua fragmen terkecil dari kelompok ini (41 pb dan 53
pb). Hal ini disebabkan karena dua fragmen tersebut mempunyai ukuran di bawah
100 pb, sehingga dengan menggunakan elektroforesis agarosa diduga mungkin
bermigrasi melewati batas bawah gel.
Pembuatan Pohon Filogenetik
Pensejajaran sekuens nukleotida VHBGi regio Pre-S1 untuk membangun
pohon filogenetik menggunakan perangkat lunak ClustalW dan Mega (versi 5)
dengan menyandingkan data sekuens nukleotida HBVGi Pre-S1 isolat hasil studi.
Menggunakan data sekuens nukleotida VHBGi Pre-S1 isolat hasil studi (459
nukleotida) dan hasil pemotongan sekuens menggunakan enzim restriksi BSt2UI
dapat dibentuk dua pohon filogenetik.
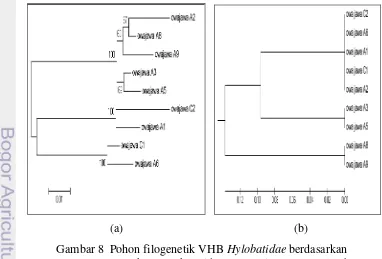
(a) (b)
Gambar 8 Pohon filogenetik VHB Hylobatidae berdasarkan (a) sekuens nukleotida VHB regio Pre-S1 (459 pb)
Hubungan kekerabatan virus hepatitis B regio Pre-S1 pada isolat owa jawa
hasil studi diperlihatkan pada Gambar 8a. Menggunakan metode rekonstruksi
filogeni neighbour-joining dengan model substitusi kimura 2-paramater (MEGA 5, 2011) terbentuk dua cluster besar yang memisahkan isolat-isolat VHBGi Pre-S1 hasil studi. Isolat VHBGi Pre-Pre-S1 owa jawa C2 dan A1 bersama-sama dengan
isolat VHBGi Pre-S1 owa jawa C1 serta A6 membentuk kelompok besar terpisah
dari isolat VHBGi Pre-S1 owa jawa A5, A3, A9, A8 dan A2. Dari 459 urutan basa
nukleotida didapatkan situs conserved sebanyak 375 (81,6%), situs variable 85 (18,4%), situs singleton 7,2 % dan situs parsim-info sebanyak 11,2%.
Menggunakan situs-situs restriksi yang dihasilkan oleh enzim restriksi
BsT2UI pada sekuens nukleotida isolat VHBGi hasil studi (lampiran 2) dapat
dibentuk pohon filogeni menggunakan konstruksi unweighted pair group method with arithmetic mean (UPGMA, metode tanpa pembobotan). Pada pohon filogenetik yang terbentuk (Gambar 8 b), isolat VHBGi Pre-S1 owa jawa A1, C2,
A6, C1 dan A2 membentuk cluster tersendiri, diikuti oleh percabangan yang dibentuk oleh isolat VHBGi Pre-S1 owa jawa A3 dan A5. Cabang terluar
dibentuk oleh isolat VHBGi Pre-S1 owa jawa A8 dan A9.
Terdapat perbedaan antara gambar 8a dan 8b yaitu pada gambar 8a isolat
VHBGi Pre-S1 owa jawa A2 berada pada cluster yang sama dengan A8 sementara
pada gambar 8b isolat VHBGi Pre-S1 owa jawa A2 berada pada percabangan
bersama isolat VHBGi Pre-S1 owa jawa C1, A6, C2 dan A1 terpisah dari isolat
VHBGi Pre-S1 owa jawa A8.
Gambar 9 memperlihatkan pohon filogenetik yang menunjukkan
hubungan kekerabatan berdasarkan sekuens nukleotida antara isolat VHBGi regio
Pre-S1 owa jawa di Indonesia dengan data isolat satwa primata lainnya dari
GeneBank. Isolat owa jawa hasil studi membentuk cluster besar tersendiri, terpisah dari cluster isolat Hylobates lar (no. akses HQ603076), orangutan (no. akses AF193864) dan H. pileatus (no. akses AY781187). Hal ini memperlihatkan bahwa virus hepatitis B yang menginfeksi owa jawa berbeda dengan orangutan
dan spesies Hylobates lainnya. Di dalam kelompok isolat hasil studi juga terbentuk pengelompokan, kelompok isolat C1, A6, C2 dan A1 berada pada
C1 dan A6 mempunyai kekerabatan sekitar 100% demikian pula antara isolat C2
dan A1. Isolat Hylobates agilis terpisah membentuk cluster terluar pada phon filogentik tersebut.
Gambar 9 Pohon filogenetik VHB Hylobatidae dan orangutan berdasarkan sekuens sekuens nukleotida VHB regio Pre-S1(459 nukleotida).
Data sekuens nukleotida VHB gibbon region Pre-S1 isolat hasil studi (459
bp) dan data isolat dari genBank di atas ditranlasikan ke dalam bentuk sekuens
asam amino menggunakan program MEGA (Kumar, et al. 2011).
Gambar 10 Pohon filogenetik VHB Hylobatidae dan orangutan berdasarkan sekuens asam amino VHB regio Pre-S1 (459 nukleotida).
Hubungan kekerabatan berdasarkan sekuens asam amino diperlihatkan
filogenetik yang dibentuk oleh sekuens nukleotida (Gambar 9). Isolat owa jawa
hasil studi tetap berada pada cluster tersendiri seperti pada gambar 9. Namun
cluster isolat A6 dan C1 berada pada percabangan yang berbeda dengan kelompok owa jawa hasil studi lainnya. Analisa asam amino menunjukkan bahwa isolat
VHBGi owa jawa C1 dan A6 mempunyai kemiripan komposisi asam amino
dengan isolat VHBGi dari orangutan, H. lar dan H. agilis. Perbedaan pohon filogenetik dapat terjadi karena perbedaan pembacaan basa nukleotida yang
ditranslasikan menjadi asam amino. Perbedaan urutan basa nukleotida akan
mempengaruhi komposisi asam amino yang terbentuk.
Dari kedua pohon filogenetik yang terbentuk dapat diperlihatkan bahwa
isolat virus hepatitis B yang menginfeksi owa jawa hasil studi berbeda dengan
virus hepatitis B yang menginfeksi orangutan dan dapat terdeteksi dini
menggunakan primer yang mengamplifikasi regio pre-S1 dari VHB.
Sekuens Genom Lengkap Virus Hepatitis B Gibbon
Amplifikasi Virus Hepatitis B Gibbon
Untuk mendapatkan sekuens genom lengkap dari virus hepatitis B Gibbon
(VHBGi), dilakukan amplifikasi DNA menggunakan empat pasangan primer.
Masing-masing pasangan primer mempunyai daerah overlapped pada ujung 5’
dengan ujung 3’ pada primer lainnya. Dari kesembilan isolat owa jawa hasil studi yang digunakan adalah isolat C1 dan C2.
Mengacu pada sekuens genom lengkap VHBGi (Sa-Nguanmoo et al., 2008), target produk PCR yang diharapkan pasangan primer pertama adalah
sebesar 1383 pasang basa, pasangan primer II sebesar 1027 pb, pasangan III
sebesar 927 pb dan pasangan primer IV sebesar 1115 pb.
Isolat C1 dan C2 diambil untuk mendapatkan data sekuens genom lengkap
VHBGi karena seluruh produk PCR dapat teramplifikasi dengan baik
menggunakan keempat pasangan primer tersebut (Gambar 11). Hasil sekuens
masing-masing produk PCR dari Macrogen Inc. (Korea) menggunakan primer
yang sama dengan yang digunakan dalam amplifikasi kemudian dianalisa
R1
Gambar 11 Visualisasi hasil amplifikasi genom lengkap VHBGi. Baris1 Ladder DNA1 kb, Baris 2-5 isolat C1 primer set 1, 2, 3, 4. Baris 6-9 isolat C2 primer set 1, 2, 3,4
Data sekuens dari masing-masing primer dipetakan untuk mendapatkan
rekonstruksi genom lengkap VHBGi dan dibuat secara linear (Gambar 12). Area
hijau menunjukkan posisi hasil amplifikasi set primer I (1397 pb), area tersebut
terlihat seperti terpotong dikarenakan rekonstruksi yang dibuat adalah secara
linear bukan melingkar yang merupakan bentuk asli genom VHB. Area merah
adalah posisi hasil amplifikasi pasangan primer kedua (1030 pb).
Gambar 12 Rekonstruksi genom lengkap VHBGi linear berdasarkan posisi primer yang digunakan.
Posisi pasangan primer ketiga ditunjukkan oleh area kuning (921 pb).
Sekuens nukleotida hasil amplifikasi pasangan primer keempat (1121 pb)
primer keempat, seperti halnya primer pertama, dimulai dari nukleotida ke 2273
dan melingkar kembali ke posisi ke 201. Hasil rekonstruksi dan pensejajaran
keempat pasang primer tersebut didapatkan ukuran VHB owa jawa sebesar 3192
pb (isolat C1) dan 3188 pb (isolat C2).
Data sekuens dari masing-masing pasangan primer VHBGi (3192 pb) hasil
studi disejarkan dengan data yang didapat dari GenBank yaitu isolat Ttblack
(3182 pb) dengan nomor akses GenBank AY330916 (Tabel 5). Pada Tabel 5
terlihat lokasi masing-masing gen VHBGi pada genom linearnya. Gen P dan S
mempunyai posisi tumpang tindih pada nukleotida ke-1 sampai 835.
Tabel 5 Data lokasi gen VHB pada isolat Ttblack (GenBank, AY330916)
Gen Posisi nukleotida Ukuran gen (bp)
Mengacu pada sekuens isolat Ttblack tersebut didapatkan posisi
masing-masing pasangan primer dari urutan nukleotidanya dalam mengkode gen-gen
VHBGi seperti yang tertera pada Tabel 6. Masing-masing pasangan primer
mempunyai daerah yang tumpang tindih (overlapped) dengan pasangan primer lainnya. Pada primer set pertama, dengan membandingkan posisi isolat hasil studi
(174-757) dengan isolat Ttblack (Tabel 5), dapat terlihat bahwa nukleotida pada
posisi tersebut berada pada daerah yang mengkode gen P dan sekaligus gen S.
Posisi primer set II mengkode sebagian daerah gen P dan S. Demikian pula primer
set 3 dan 4, mempunyai daerah yang tumpang tindih dengan gen lainnya.
Potongan-potongan sekuens primer kemudian dirangkaikan untuk
mendapatkan daerah-daerah yang mengalami overlapping pada ujung-ujung 5’ dan 3’. Dengan mengacu pada sekuens genom lengkap VHBGi pada Hylobates pilleatus data GenBank (nomor akses AY781186) dapat dilihat posisi overlapping
1374
2848 1835
Tabel 6 Daerah gen VHBGi berdasarkan pasangan primer yang digunakan
Primer
Gambar 13 memperlihatkan posisi masing-masing open reading frame (ORF)
dari genom lengkap VHBGi berdasarkan data sekuens nukleotida dari isolat C1.
Area hijau menunjukkan ORF S yang mengkode gen S (pre-S1, pre-S2 dan S),
terbagi menjadi dua bagian karena genom VHB yang sebenarnya berbentuk
sirkular dibuat menjadi linear, demikian pula area kuning yang menunjukkan ORF
P yang mengkode gen P. Warna merah menunjukkan ORF X yang mengkode gen
X. Sedangkan posisi pasangan primer ketiga yang mengkode gen C (Core dan
pre-Core) ditunjukkan oleh area biru.
S S
C X
P P
Gambar 13 Prediksi genom linier sekuens sampel C1 dibandingkan dengan sekuens H. pileatus dari GenBank (no akses AY781186)
berdasarkan posisi open reading frame.
Hasil penggabungan empat pasang primer menghasilkan genom lengkap
VHBGi isolate C1 yang terdiri dari 3192 nukleotida, sedangkan pada isolat C2
dihasilkan genom lengkap VHBGi yang terdiri dari 3188 nukleotida. Dengan
menggunakan sekuens genom lengkap VHBGi, isolat C1 dibandingkan dengan
C2 mempunyai perbedaan sebesar 1%. Hal ini disebabkan adanya insersi maupun
Pohon Filogenetik
Menggunakan data sekuens VHBGi genom lengkap yang didapatkan dari
GeneBank dan perangkat lunak komputer MEGA dapat dikonstruksi pohon
filogenetik yang memperlihatkan hubungan kekerabatan VHB antar spesies. Data
GeneBank yang digunakan adalah sekuens VHB genom lengkap dari isolat VHB
asal manusia (no. akses GQ 358158, HM 750156, GQ 358157, GQ 358156),
orangutan (no. akses AF 193864, AF 193863), Hylobates pileatus (no. akses AY 781187, AY 781187, AB 037928), H. agilis (no. akses FM209513), dan gorila (FJ798097) serta isolat HBV dari woolly monkey (AF 046996). Pohon filogenetik yang digunakan adalah neighbour-joining dengan model substitusi kimura-2 paramater menggunakan bootsrap 1000 kali (MEGA, 2011).
Gambar 14 Pohon filogenetik VHB genom lengkap asal satwa primata dan manusia (3129 nukleotida)
Gambar 14 memperlihatkan bahwa isolat VHBGi hasil studi (H. moloch C1 dan C2) berada pada satu percabangan dan mempunyai kedekatan genetik sebesar
99% di antara keduanya. Kedua isolat tersebut mempunyai kekerabatan yang lebih
dekat dengan isolat dari orangutan karena berada pada percabangan pohon yang
orangutan berada pada cluster tersendiri bersama dengan isolat H. agillis. Isolat VHB manusia membentuk cluster tersendiri, terpisah dari cluster VHB pada satwa primata. Hal ini menunjukkan bahwa kekerabatan VHB manusia jauh dari
VHB yang berasal dari satwa primata. Isolat Lagothrix lagothrica (woolly monkey) digunakan sebagai outgroup dalam pembentukan pohon filogenetik ini.
SIMPULAN DAN SARAN
Simpulan
Dalam penelitian ini dapat diisolasi virus hepatitis b yang berasal dari owa
jawa asal dan berada di Indonesia. Menggunakan isolat tersebut dapat
diidentifikasi secara molekular menggunakan tehnik PCR dan analisa
bioinformatika bahwa virus hepatitis b pada owa jawa (VHBGi) berbeda dengan
VHB pada satwa primata lainnya.
Analisa molekular untuk Pre-S1 region dapat ditentukan sekuens
nukleotidanya. Hasil pemotongan menggunakan enzim restriksi BSt2UI juga
memperlihatkan bahwa enzim tersebut dapat bekerja pada amplikon orangutan
dan owa jawa sehingga terbentuk fragmen-fragmen yang terpotong pada situs
tertentu, namun hal ini tidak terjadi pada isolat manusia.
Menggunakan empat pasangan primer , telah berhasil pula ditentukan sekuens
lengkap nukleotida dari genom VHBGi. Hasil analisa sekuens menggunakan
pohon filogenetik menyatakan bahwa isolat owa jawa berada pada cabang
tersendiri, terpisah dari manusia, kera maupun spesies Hylobates lainnya.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mendapatkan enzim restriksi
yang hanya bekerja spesifik pada amplikon owa jawa, sehingga enzim tersebut
dapat digunakan untuk pengujian diagnostik VHBGi.
Hasil sekuens lengkap VHBGi perlu dilakukan analisa lebih lanjut untuk
menetukan apakah VHBGi dapat menular ke manusia dan sebaliknya (aspek
zoonosis).
Penambahan sampel gibbon dari berbagai wilayah di Indonesia perlu
dilakukan untuk meneliti apakah ada perbedaan molekular VHB pada spesies
DAFTAR PUSTAKA
Andayani N, Brockelman W, Geissmann T, Nijman V, Supriatna J. 2008. Hylobates moloch. In: IUCN 2011. IUCN Red List of Threatened Species. Version 2011.1. http://www.iucnredlist.org/apps/redlist/10550
Basic Local Alignment Search Tools. 2011. http://blast.ncbi.nlm.nih.gov/ Blast. cgi
Carter JB, Saunders VA. 2007. Virology: Principles and Applications. John Willey & Sons, Ltd. England
Geissmann T. 1995. Gibbon Systematic and Species Identification. International Zoo news. 42:467-501.
Grethe S, Heckel JO, Rietschel W, Hufert FT. 2000. Molecular epidemiology of hepatitis B virus variants in nonhuman primates. Journal of General Virology
74:11.
International Committee on Taxonomy of Viruses (ICTV). 2009. Hepadnaviridae. ICTV MasterSpeciesListversion10. http://talk.ictvonline.org/files/ictv_docu ments /m/msl/1231.aspx
Kumar S, Tamura K, Nei M. 2011. MEGA: Molecular Evolutionary Genetics Analyses, version 5.0. Pennsylvania State University, University Park, PA
Lanford RE , Chavez D, Brasky KM, Burn III RB, Rico-Hesse R. 1998. Isolation of a hepadnavirus from the woolly monkey, a New World primate. Proc. Natl. Acad. Sci. USA 95 : 5757–5761.
Lanford RE, Chavez D, Rico-Hesse R ,Mootnick AR. 2000. Hepadnaviruses infection in captive Gibbon. Journal of Virology 74:6.
Larkin MA, et al. 2007. ClustalW and ClustalX version 2. Bioinformatics 2007 23(21): 2947-2948
Levinson W. 2008. Review of Medical Microbiology and Immunology, 10th edition. USA. MacGraw-Hill Companies, Inc.
Mac Donald DM, Holmes EC, Lewis JCM, Simmonds P. 2000. Detection of hepatitis B virus infection in Wild-Born Chimpanzees (Pan troglodytes): Phylogenetic relationships with human and other primate genotypes. Journal of Virology. 74:9.
Napier JR, Napier PH. 1985. The Natural History of The Primate. Cambridge. MIT Press
Norder H, et al. 1993. Genetic relatedness of hepatitis B viral strains of diverse geographical origin and natural variations in the primary structure of the surface antigen. Journal of General Virology 74:1341-1348.
Noppornpanth S et al. 2003. Molecular epidemiology of gibbon hepatitis B virus transmission. Journal of General Virology 84:147 – 155.
Norder H, Ebert JW, Fields HA, Mushahwar IK, Magnius LO. 1996. Complete sequencing of a gibbon hepatitis B virus genome reveals a unique genotype distantly related to the chimpanzee hepatitis B virus. Journal of Virology 218 (1):214-23. Experimental transmission of hepatitis B virus by semen and saliva. Journal of Infectious Disease. 142(1):67-7.
Supriatna J, Wahyono EH. 2000. Panduan Lapangan Primata Indonesia. Jakarta. Yayasan obor Indonesia
Ubaidillah R, Sutrisno H. 2009. Pengantar Biosistematik: Teori dan Praktek. LIPI. Bogor
Vaudin M, Wolstenholme AJ, Tsiquaye KN, Zuckerman AJ, Harrison TJ. 1988. The complete nucleotide sequence of the genome of a hepatitis b virus isolated from a naturally infected chimpanzee. Journal of General Virology 69:1383-1389.
Warren KS, Heeney JL, Swan RA, Heriyanto, Verschoor EJ. 1999. A new group of Hepadnaviruses naturally infecting orangutans (Pongo pygmaeus). Journal of Virology 73:9
World Health Organization (WHO). 2011. Hepatitis B: Factsheet no 204.