ANALISIS GENETIK DAN PEWARISAN SIFAT
KETAHANAN CABAI TERHADAP INFESTASI KUTUDAUN
MELON, Aphis gossypii Glover (HEMIPTERA: APHIDIDAE)
ADY DARYANTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Genetik dan Pewarisan Sifat Ketahanan Cabai terhadap Infestasi Kutudaun Melon, Aphis gossypii Glover (Hemiptera: Aphididae) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Ady Daryanto
RINGKASAN
ADY DARYANTO. Analisis Genetik dan Pewarisan Sifat Ketahanan Cabai terhadap Infestasi Kutudaun Melon, Aphis gossypii Glover (Hemiptera: Aphididae). Dibimbing oleh MUHAMAD SYUKUR, AWANG MAHARIJAYA dan PURNAMA HIDAYAT.
Faktor penyebab rendahnya produktivitas cabai di Indonesia diantaranya adalah serangan hama penyakit, kondisi tanah marginal, perubahan iklim hingga terbatasnya kemampuan petani dalam menyediakan benih bermutu dari varietas unggul. Kutudaun melon, Aphis gossypii, adalah salah satu hama dominan yang menyerang pertanaman cabai di wilayah Indonesia, khususnya wilayah dataran rendah yang hangat dan lembab. Kutudaun dapat menjadi vektor dari beberapa jenis virus. Pengendalian secara kimia menjadi pilihan utama para petani hingga saat ini dalam mengendalikan hama kutudaun. Faktanya kini, kutudaun melon telah resisten terhadap beberapa jenis insektisida kimiawi. Insektisida dilaporkan dapat pula membunuh serangga-serangga berguna lainnya seperti, polinator, parasitoid, dan predator. Studi mengenai pewarisan sifat ketahanan terhadap infestasi kutudaun melon perlu dilakukan guna menggali informasi genetik, sehingga mampu menyusun strategi yang efektif serta efisien dalam program pemuliaan tanaman cabai sehingga mampu merakit varietas cabai unggul dan tahan hama kutudaun melon. Varietas tahan yang dipadukan dengan sistem pengendalian hama terpadu (Integrated pest management) dapat menjadi strategi terbaik dalam hal pengendalian hama kutudaun.
Penelitian ini dilakukan dalam tiga bagian, yaitu (1) skrining ketahanan cabai terhadap infestasi kutudaun melon, (2) studi pewarisan sifat ketahanan cabai terhadap infestasi kutudaun melon, dan (3) analisis silang dialel dalam menentukan parameter genetik ketahanan cabai terhadap infestasi kutudaun melon. Penelitian bagian (1) menggunakan genotipe-genotipe cabai koleksi Departemen Agronomi dan Hortikultura IPB. Pertama, koloni kutudaun diambil dari pertanaman cabai kebun percobaan Leuwikopo IPB dan diperbanyak (rearing) dalam kotak serangga di lab Pemuliaan Tanaman Departemen Agronomi dan Hortikultura IPB. Identifikasi spesies kutudaun dilakukan di lab Taksonomi Departemen Proteksi Tanaman IPB. Pengujian ketahanan dilakukan pada bibit cabai berumur lima minggu atau bibit telah mencapai 4-6 daun. Metode yang digunakan adalah choice test untuk menduga ketahanan antixenosis dan non-choice test untuk menduga ketahanan antibiosis. Metode choice test digunakan kembali di percobaan bagian (2) dan (3).
Penelitian bagian (2) menggunakan satu set populasi enam generasi yang terdiri atas tetua tahan (P1), tetua rentan (P2), F1, BCP1, BCP2, dan F2. Genotipe IPB
C20 terditeksi sebagai tetua tahan baik pada ketahanan antixenosis dan antibiosis berdasarkan evaluasi percobaan 1 sedangkan tetua IPB C313 terditeksi sebagai tetua rentan. Penelitian bagian (3) menggunakan lima tetua cabai yang disaling-silangkan membentuk persilangan setengah dialel (half dialell). Lima genotipe tersebut antara lain IPB C20 sebagai tetua tahan dan IPB C3, IPB C4, IPB C5, serta IPB C313 sebagai tetua rentan.
tersebut berada dalam inti sel (tidak ada pengaruh maternal). Gen pengendali ketahanan adalah resesif. Derajat dominansi tetua rentan overdominan terhadap tetua tahan. Aksi gen pengendali sifat infestasi kutudaun melon di tanaman cabai adalah aditif dan dominan dengan dominansi ragam dominan jauh lebih besar dibandingkan ragam aditif. Nilai heritabilitas arti luas tergolong tinggi akan tetapi heritabilitas arti sempit tergolong sangat rendah. Gen-gen pengendali karakter infestasi kutudaun melon terhadap sifat kerentanan dominan lebih banyak dibandingkan gen pengendali ketahanannya. Gen-gen ketahanan masih tersebar di dalam beberapa genotipe selain IPB C20, sehingga metode pemuliaan yang baik digunakan untuk meningkatkan level ketahanan adalah metode convergent breeding melalui rekombinan transgresif dan recurrent selection.
SUMMARY
ADY DARYANTO. Genetic Analysis and Inheritance of Chili Pepper Resistance to Melon Aphid, Aphis gossypii Glover (Hemiptera: Aphididae). Supervised by MUHAMAD SYUKUR, AWANG MAHARIJAYA and PURNAMA HIDAYAT. Several factors which sharply decreased productivity of chili pepper are disease and pest attract, land marginal, climate change, and limited access to have good variety and seeds. The melon aphid or cotton aphid (Aphis gossypii Glover) is one of the major pests of chili pepper. Aphid colonies can cause significant yield loss by damaging leaves and stem tissues. They can also act as vector of many kind of viruses. Chemical based crop protection is the major way to control aphid until now. In fact, melon aphid has been resistant to many kind of insecticides. Insecticides can also damage beneficial insects such as, predators, parasitoids, and pollinators. Therefore the use of insecticides should be limited. The use of resistant varieties may help to reduce the use of insecticides, together with Integrated Pest Management.
Study on genetics analysis and inheritance of resistance to aphid infestation were conducted in three steps; (1) screening several genotypes for identify the antixenosis and antibiosis based resistance of melon aphids that may be explored as sources of resistance in aphid resistance breeding program of chili pepper, (2)
inheritance study of chili pepper resistance to melon aphid’s infestation, (3) diallel
analysis to estimate genetics parameter of chili pepper resistance to aphid.
The experiment on step (1) used germplasm collection of chili pepper genotypes from the Department of Agronomy and Horticulture, IPB. Melon aphids were collected from chili pepper cultivation at Univ. farm of Bogor Agricultural University, Indonesia following by the identification of the species to ensure that the aphid colonies were A. gossypii Glover. Screening germplasm genotypes was conducted during the seedling phase of chili pepper (4-6 leaves or 5 weeks after sowing), in an insect box. Antixenosis based resistance test were conducted in a choice test method while antibiosis based resistance test were conducted in no-choice test method. Choice test was used in experiment step (2) and (3).
The experiment on step (2) used one set populations derived from a cross between a resistant line (IPB C20) and susceptible line (IPB C313), that is population of P1, P2, F1, BCP1, BCP2, and F2 respectively. The experiment on step
(3) used five parent lines for half diallel crosses. They were IPB C20 as resistant line and IPB C3, IPB C4, IPB C5, IPB C313 as susceptible lines. Genotype IPB C20 consistently had the lowest aphids per plant compared to other genotypes, especially with IPB C313 by experiment (1) to (3). There were no maternal effect and resistance were controlled by polygenic genes. The dominance degree of susceptible lines were over dominance than resistance lines. Gene effects for
resistance to aphid’s infestation were additive and dominance. Dominance effect
larger than additive effects. Broad-sense heritability value were high but narrow-sense heritability value were low. Convergent breeding and recurrent selection would be effected to increase level of resistance to melon aphid in chili pepper
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
ANALISIS GENETIK DAN PEWARISAN SIFAT
KETAHANAN CABAI TERHADAP INFESTASI KUTUDAUN
MELON, Aphis gossypii Glover (HEMIPTERA: APHIDIDAE)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Analisis Genetik dan Pewarisan Sifat Ketahanan Cabai terhadap Infestasi Kutudaun Melon, Aphis gossypii Glover (Hemiptera: Aphididae)
Nama : Ady Daryanto NIM : A253130231
Disetujui oleh
Komisi Pembimbing
Prof Dr Muhamad Syukur, SP MSi Ketua
Dr Awang Maharijaya, SP MSi Anggota
Dr Ir Purnama Hidayat, MSc Anggota
Diketahui oleh
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti Wahyu EK, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: (18 November 2015)
Tanggal Lulus:
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala rahmat serta karunia-Nya sehingga karya ilmiah ini dapat penulis selesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2014 ini ialah Analisis Genetik dan Pewarisan Sifat Ketahanan Cabai terhadap Infestasi Kutudaun Melon, Aphis gossypii Glover (Hemiptera: Aphididae)
Penelitian dan penulisan tesis ini di bawah bimbingan Prof Dr Muhamad Syukur, SP MSi selaku Ketua Komisi Pembimbing, Dr Awang Maharijaya, SP MSi dan Dr Ir Purnama Hidayat, MSc selaku anggota Komisi Pembimbing. Di dalam kesempatan ini penulis sampaikan rasa terima kasih dan penghargaan yang tulus atas waktu serta kesempatan yang telah diluangkan oleh komisi pembimbing dalam membimbing, mengarahkan, serta menjadi teladan bagi penulis. Penelitian tesis ini didanai oleh Hibah Kompetensi DIKTI tahun 2014 dan 2015 dengan No. kontrak 51/IT3.II/LT/2014 dan 083/SP2.H/ PL/Ditlibamas/II/2015.
Penghargaan serta rasa terima kasih yang tulus penulis sampaikan pula kepada:
1. Dirjen DIKTI atas beasiswa BPPDN 2013-2015.
2. Rektor Institut Pertanian Bogor, Dekan Sekolah Pascasarjana, dan Ketua Program Studi Pemuliaan dan Bioteknologi Tanaman IPB yang telah memberikan kesempatan penulis untuk melanjutkan jenjang Pascasarjana IPB. 3. Prof Dr Ir Sobir, MS dan Dr Dewi Sukma, SP MSi selaku penguji luar komisi serta perwakilan program studi pada ujian tesis atas tambahan wawasan dan masukan sehingga tesis ini dapat disempurnakan.
4. Staf dan Pegawai Departemen Agronomi dan Hortikultura, Fakultas Pertanian IPB atas segala kerjasama dan bantuannya.
5. Ayahanda Edwan Narus, Ibunda Yusnidar, dan adik ku Popy Pitriyani yang telah memberikan kepercayaan penuh kepada penulis dalam kasih sayang serta doa-doa indahnya.
6. Teman-teman Labdik Pemuliaan Tanaman “Family Solanaceae”: Abdul Hakim
SP, Arya Widura SP MSi, Estriana Riti SP, Faradila Putri SP, M. Alfarabi SP MSi, Kak Marlina Mustofa SP MP, Nura SP MSi, Rudi Hermanto SP, Siti Hapsoh SP MSi, Tiara Yudilastari SP, Tustiah Tri SP Yunandra SP, dan Mbak Zahratul Mila SP MSi atas bantuan tenaga, sharing informasi, persahabatan, dan ikatan kekeluargaan yang erat.
7. Teman-teman Pemuliaan dan Bioteknologi Tanaman angkatan 2013, “Ahayy
2013”, atas kebersamaan dan perjuangan dalam persabahatan yang hangat.
8. Ibu Iis laboran lab Taksonomi dan Muhammad Kevin, SP atas bantuan bahan, alat, serta sharing informasi dalam identifikasi kutudaun.
9. Juanita Elina SP, Yuni Widyastuti SP, dan Nur Laela SP atas bantuan dan
support di dalam koreksi naskah hingga dukungan moril untuk penulis.
10.Forum Pascasarjana (FORSCA) AGH 2014/2015 atas kesempatan pengembangan diri di dalam organisasi kemahasiswaan tingkat Pascasarjana. 11.Dosen mentor serta teman-teman program Summer Course dan Winter Course
2014 atas kebersamaan, kekeluargaan, motivasi, dan pengalaman Internasional. 12.Dosen mentor serta teman-teman program UCGF 2015 atas kebersamaan, dan
13.Keluarga Pondok Angsa Balio tempat penulis tinggal semasa mengenyam pendidikan di IPB: Ibu Haji Syarif dan Abdullah bin Arif SP MSi.
14.Keluarga besar Bapak Asrin Aburdin atas dukungan doa serta semangat untuk penulis.
Akhir kata, mohon maaf atas segala kekurangan dan kesalahan di dalam penulisan karya ilmiah ini. Semoga karya ilmiah ini dapat bermanfaat dalam pengembangan ilmu pengetahuan khususnya di bidang Pemuliaan dan Bioteknologi Tanaman serta pertanian pada umumnya dan menjadi amal ibadah bagi penulis. Amin.
DAFTAR ISI
DAFTAR ISI xi
DAFTAR TABEL xii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN 1
2 TINJAUAN PUSTAKA 4
3 RESISTENSI TANAMAN CABAI TERHADAP KUTUDAUN MELON,
Aphis gossypii Glover (HEMIPTERA: APHIDIDAE) 8
Abstrak 8
Pendahuluan 8
Bahan dan Metode 10
Hasil dan Pembahasan 13
Simpulan 19
4 ANALISIS PEWARISAN SIFAT KETAHANAN CABAI TERHADAP INFESTASI KUTUDAUN MELON, Aphis gossypii Glover
(HEMIPTERA: APHIDIDAE) 20
Abstrak 20
Pendahuluan 20
Bahan dan Metode 21
Hasil dan Pembahasan 25
Simpulan 30
5 ANALISIS SILANG SETENGAH DIALEL POPULASI CABAI
TERHADAP INFESTASI KUTUDAUN MELON (Aphis gossypii Glover) 31
Abstrak 31
Pendahuluan 31
Bahan dan Metode 32
Hasil dan Pembahasan 38
Simpulan 45
6 PEMBAHASAN UMUM 46
Simpulan Umum 49
Saran Umum 49
DAFTAR PUSTAKA 50
LAMPIRAN 56
DAFTAR TABEL
1 Infestasi kutudaun melon per daun pada 21 genotipe cabai dengan
metode choice test 14
2 Rataan jumlah infestasi kutudaun melon pada enam genotipe cabai
dengan metode choice test 15
3 Rataan ukuran morfologi bibit cabai berdaun 4-6 pada enam
genotipe cabai 16
4 Korelasi infestasi kutudaun melon per daun dan per tanaman terhadap
beberapa karakter morfologi bibit cabai 16
5 Pengaruh enam genotipe cabai terhadap aspek biologi hidup
kutudaun melon 18
6 Nimfa survival, nimfa per hari, dan fekunditas kutudaun melon pada
enam genotipe cabai 18
7 Parameter genetik 24
8 Nilai potensi rasio dan jumlah faktor efektif sifat ketahanan cabai
terhadap infestasi kutudaun melon pada populasi IPB C20 x IPB C313 27 9 Nilai duga parameter genetik uji untuk skala individu karakter infestasi
kutudaun melon per tanaman, per daun, dan bersayap pada cabai 29 10 Komponen ragam dan nilai heritabilitas sifat ketahanan cabai populasi
persilangan IPB C20 x IPB C313 terhadap infestasi kutudaun melon 29 11 Skema persilangan half diallel lima galur murni cabai 33
12 Sidik ragam silang dialel 34
13 Setengah dialel ketahanan cabai terhadap infestasi kutudaun A. gossypii 34
14 Sidik ragam daya gabung metode Griffing II 37
15 Kuadrat tengah genotipe cabai terhadap infestasi kutudaun melon pada karakter infestasi kutudaun per tanaman, per daun, dan bersayap 38 16 Pendugaan parameter genetik infestasi kutudaun melon pada
tanaman cabai 38
17 Uji nilai tengah dan kehomogenan ragam karakter morfologi bibit cabai pada populasi F1 dan F1R persilangan cabai IPB C20 x IPB C313 41 18 Uji nilai tengah dan kehomogenan ragam karakter infestasi kutudaun
melon pada populasi F1 dan F1R persilangan cabai IPB C20 x IPB C313 41 19 Analisis ragam daya gabung umum (DGU) dan daya gabung khusus
(DGK) sifat ketahanan cabai terhadap infestasi kutudaun melon 42 20 Nilai daya gabung umum (DGU) dan daya gabung khusus (DGK)
sifat ketahanan cabai terhadap infestasi kutudaun melon 43 21 Nilai rata-rata infestasi kutudaun melon per tanaman cabai P1, P2,
dan F1 cabai serta nilai heterosis dan heterobeltiosis 44 22 Nilai rata-rata infestasi kutudaun melon per daun cabai P1, P2,
DAFTAR GAMBAR
1 Bagan alir penelitian 3
2 Kunci spesifik identifikasi untuk kutudaun melon (A. gossypii) 10
3 Metode choice test. 11
4 Metode no-choice test 12
5. Siklus hidup kutudaun melon pada tanaman cabai 17 6 Skema persilangan biparental, IPB C20 x IPB C313, dalam membuat
populasi enam generasi 22
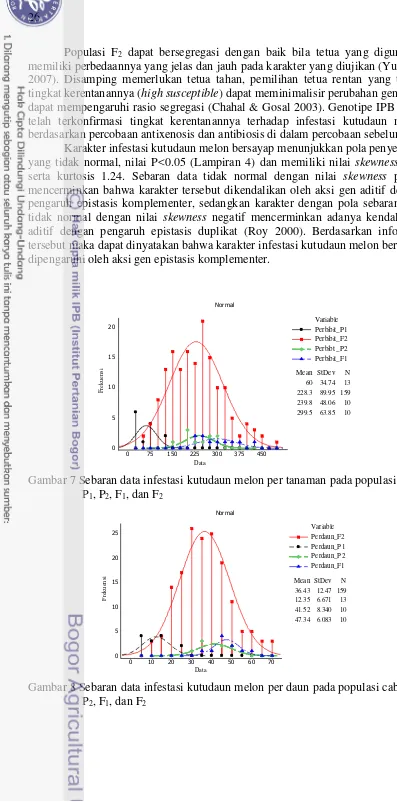
7 Sebaran data infestasi kutudaun melon per tanaman pada populasi cabai
P1, P2, F1, dan F2 26
8 Sebaran data infestasi kutudaun melon per daun pada populasi cabai
P1, P2, F1, dan F2 26
9 Sebaran data infestasi kutudaun melon bersayap pada populasi cabai
P1, P2, F1, dan F2 27
10 Skema posisi relatif nilai tengah F1 terhadap kedua tetua pada sifat ketahanan cabai terhadap infestasi kutudaun melon per tanaman pada
populasi persilangan IPB C20 x IPB C313 28
11 Skema posisi relatif nilai tengah F1 terhadap kedua tetua pada sifat ketahanan cabai terhadap infestasi kutudaun melon per daun pada
populasi persilangan IPB C20 x IPB C313 28
12 Skema posisi relatif nilai tengah F1 terhadap kedua tetua pada sifat ketahanan cabai terhadap infestasi kutudaun bersayap pada populasi
persilangan IPB C20 x IPB C31 28
DAFTAR LAMPIRAN
1 Genotipe plasma nutfah cabai (C. annuum) 56
3 Sebaran kenormalan infestasi kutudaun melon per tanaman pada
populasi F2 cabai 57
4 Sebaran kenormalan infestasi kutudaun melon per daun
populasi F2 cabai 57
5 Sebaran kenormalan infestasi kutudaun melon bersayap pada
1 PENDAHULUAN
Latar Belakang
Cabai merupakan salah satu tanaman hortikultura berekonomi tinggi yang menjadi inang bagi infestasi Aphis gossypii Glov, dikenal dengan nama kutudaun melon atau kutudaun kapas. Pemerintah menetapkan cabai sebagai sayuran unggulan nasional yang menempati areal penanaman terluas diantara tanaman sayuran lainnya. Berdasarkan data statistik yang dikeluarkan oleh Ditjen Hortikultura, produksi cabai nasional mencapai 1.7 juta ton dengan rata-rata produktivitas 7.2 ton ha-1 di tahun 2014 (BPS 2015) sedangkan potensi hasil yang
dapat dicapai adalah 17–21 ton ha-1 (Bahar & Nugrahaeni 2008). Faktor penyebab rendahnya produktivitas cabai di Indonesia diantaranya adalah serangan hama-penyakit, lahan marginal, perubahan iklim hingga terbatasnya kemampuan petani dalam menyediakan benih bermutu dari varietas unggul.
Kutudaun melon merupakan tipe hama polifag dengan kisaran inang yang luas. Hama ini adaptif pada tanaman cabai, melon, mentimun, kapas, jeruk, kopi, kakao, kentang, tembakau, dan beberapa tanaman-tanaman ornamental (Blackman & Eastop 2000). Kerusakan dari infestasi kutudaun dalam jumlah besar adalah terbentuknya embun jelaga (sooty mold). Embun jelaga merupakan hasil asosiasi kotoran kutudaun (honeydew) dengan cendawan yang menyebabkan permukaan daun tertutupi sehingga menghambat proses fotosintesis, daun mengguning, keriting, serta pertumbuhan mengerdil (Tilmon et al. 2011). Kutudaun melon dilaporkan vektor dari 50 jenis virus termasuk no-persisten virus seperti, CMV (cucumber mosaic virus), Potyvirus (ChiVMV), dan Polerovirus pada famili Solanaceae (Blackman & Eastop 2000; Escrius et al. 2000; Pinto et al. 2008; Gniffke et al. 2013).
Siklus hidup kutudaun melon berlangsung singkat dan reproduksi yang cepat. Perkembangbiakannya adalah aseksual-vivipar secara partenogenesis (Sudarto 1985; Blackman & Eastop 2000; Henneberry et al. 2000). Pola perkembangbiakan dan peningkatan level infestasi kutudaun sangat dipengaruhi oleh faktor-faktor ekologi seperti suhu, musuh alami, dan ketersediaan nutrisi pakan bagi kutudaun (Slosser et al. 1989; Tilmot et al. 2011). Satar et al. (2008) melaporkan bahwa kutudaun melon dapat berkembangbiak dengan baik pada suhu hangat. Kemampuan reproduksinya tergolong tinggi dengan rata-rata 2-3 ekor nimfa per hari (Sudarto 1985; Henneberry et al. 2000). Musuh alami bagi kutudaun melon antara lain imago dan larva dari Asian ladybeetle (Coccinellidae), Green lacewing (Chrysopidae), dan Orius sp. (Anthocoridae) (Tilmot et al. 2011). Nutrisi tanaman yang dimanfaatkan oleh kutudaun sebagai sumber pakan adalah unsur nitrogen, karbohidrat, dan asam amino (Slosser et al. 1989; Tilmot et al. 2011). Aplikasi pupuk berunsur nitrogen dan kalsium asetat dalam dosis tinggi akan menyebabkan peningkatan keberadaan kutudaun perluasan daun (Slosser et al. 1989).
merupakan kemampuan tanaman untuk membatasi dan mereduksi perkembangbiakan hama setelah terjadi kontak dengan tanaman. Antibiosis pada serangga tercermin dari tingginya mortalitas (kematian), rendahnya laju perkembangbiakan larva atau nimfa, dan menurunnya kemampuan reproduksi hama (fecundity) (Li et al. 2004; Hesler et al. 2007; Niks et al. 2011). Tanaman dengan resistensi antibiosis memiliki nilai negatif terhadap reproduksi kutu daun, dengan demikian pengendalian serangan kutudaun secara efektif dapat dilakukan (Mensah et al. 2008). Seperti halnya resistensi, toleransi ialah perbedaan kemampuan inang untuk merespon serangan hama dan membatasi kerusakan yang lebih luas per unit keberadaan hama tersebut (Hesler et al. 2007; Niks et al. 2011). Hingga saat ini, upaya pengendalian kutudaun bertumpu pada aplikasi zat kimia (insektisida). Resistensi kutudaun terhadap insektisida menjadi kendala yang komplek di dalam pengendalian kutudaun. Kutudaun telah mengalami resistensi terhadap insektisida dengan bahan aktif pyrethroid seperti, cypermethrin, alphacypermethrin, zetacypermethrin, cybuthrin, fen-propathrin, bifenthrin, dan lambdacyhalothrin (Ahmad et al. 2003). Informasi pewarisan sifat ketahanan kutudaun melon telah dilaporkan pada tanaman melon dan mentimun. Ketahanan melon terhadap A. gossypii dilaporkan dikendalikan oleh gen-gen minor atau poligenik (Boissot et al. 2010). Liang et al. (2015) menyatakan bahwa ketahanan mentimun terhadap infestasi A. gossypii dikendalikan oleh satu gen mayor aditif-dominan dan poligenik aditif-aditif-dominan sedangkan informasi pewarisan sifat ketahanan kutudaun pada cabai belum dilaporkan.
Salah satu solusi yang efektif dan efisien dalam mengendalikan hama kutudaun adalah menggunakan varietas tahan. Varietas tahan dapat menjadi solusi yang ramah lingkungan dan berkelanjutan dalam menggendalikan perkembangbiakan kutudaun, oleh karena itu penting mengetahui informasi genetik serta pola pewarisan sifat ketahanan cabai terhadap infestasi kutudaun sehingga mampu merakit varietas tahan. Informasi tersebut juga bermanfaat di dalam mendukung pertanian yang ramah lingkungan serta berkelanjutan.
Tujuan Penelitian
Penelitian ini bertujuan untuk: (1) Mendapatkan informasi ketahanan genotipe-genotipe cabai koleksi IPB untuk merakit cabai unggul tahan terhadap kutudaun melon. (2) Mendapatkan informasi kendali genetik pewarisan sifat ketahanan cabai terhadap kutudaun melon.
Hipotesis Penelitian
Hipotesis yang diajukan adalah (1) Terdapat setidaknya satu genotipe cabai yang tahan, medium tahan, dan rentan terhadap kutudaun melon untuk dijadikan tetua persilangan. (2) Terdapat minimal satu gen pengendali ketahanan cabai terhadap kutudaun dengan pola pewarisan aksi gen aditif atau dominan.
Manfaat Penelitian
Ruang Lingkup Penelitian
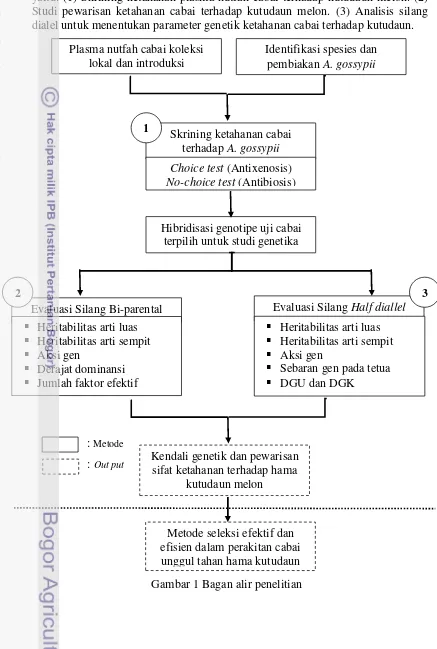
Tujuan penelitian dan hipotesis dijawab dengan melakukan serangkaian percobaan (Gambar 1). Kegiatan secara keseluruhan meliputi beberapa percobaan yaitu: (1) Skrining ketahanan plasma nutfah cabai terhadap kutudaun melon. (2) Studi pewarisan ketahanan cabai terhadap kutudaun melon. (3) Analisis silang dialel untuk menentukan parameter genetik ketahanan cabai terhadap kutudaun.
Gambar 1 Bagan alir penelitian Evaluasi Silang Bi-parental
Heritabilitas arti luas
Heritabilitas arti sempit
Aksi gen
Derajat dominansi
Jumlah faktor efektif
2
Plasma nutfah cabai koleksi lokal dan introduksi
Identifikasi spesies dan pembiakan A. gossypii
Skrining ketahanan cabai terhadap A. gossypii Choice test (Antixenosis)
No-choice test (Antibiosis)
Hibridisasi genotipe uji cabai terpilih untuk studi genetika
1
Evaluasi Silang Half diallel
Heritabilitas arti luas
Heritabilitas arti sempit
Aksi gen
Sebaran gen pada tetua
DGU dan DGK
3
Kendali genetik dan pewarisan sifat ketahanan terhadap hama
kutudaun melon
Metode seleksi efektif dan efisien dalam perakitan cabai unggul tahan hama kutudaun : Out put
2 TINJAUAN PUSTAKA
Biologi Kutudaun Aphis gossypii
Biologi hidup serangga secara umum meliputi siklus hidup, fekunditas (keperidian), reproduksi, dan ketahanan hidup pada inang. Kutudaun hidup secara berkoloni pada daun dan batang tanaman inang. Umumnya kutudaun memiliki siklus hidup yang kompleks. Kompleksitas tersebut terlihat dari kemampuan reproduksi secara seksual (telur) dan aseksual (partenogenesis), memiliki polimorfisme warna tubuh, kemampuan hibernasi dan aestivasi (dorman pada kondisi buruk di musim panas), kemampuan merubah tubuh dari tidak bersayap (apterous) menjadi bersayap (alatae), serta memiliki dua tipe inang yaitu, inang primer dan inang alternatif (Tilmon et al. 2011).
Terdapat dua tipe siklus hidup kutudaun yaitu, holocyclic dan anholocyclic.
Holocyclic merupakan siklus hidup kutudaun dengan kombinasi perkembangbiakan seksual dan aseksual sedangkan anholocyclic adalah siklus hidup kutudaun tanpa melalui perkembangbiakan seksual (mating) atau hanya berkembangbiak secara aseksual melalui vivipar-partenogenesis. Siklus hidup
holocyclic terjadi pada kutudaun di wilayah beriklim subtropis dan dingin sedangkan anholocyclic terjadi pada kutudaun di wilayah tropis (William & Dixon 2007). Siklus hidup anholocyclic menjadi siklus yang efektif bagi perkembangbiakan kutudaun untuk memperbanyak jumlah koloni selanjutnya menginfestasi inang, sehingga pengendaliannya menjadi lebih sulit dilakukan.
Perubahan tipe reproduksi aseksual menjadi seksual disebabkan oleh perubahan ekstrim pada suhu dan panjang hari. Suhu rendah dan panjang hari yang lebih panjang di musim gugur memacu terekspresinya nimfa kutudaun berkelamin jantan (William & Dixon 2007). Perubahan tubuh kutudaun menjadi bersayap (alatae) disebabkan oleh karena kontak fisik diantara individu kutudaun akibat padatnya populasi dan juga disebabkan oleh memburuk ketersediaan pakan (nutrisi) pada tanaman inang sehingga mendorong kutudaun untuk terbang berpindah inang (William & Dixon 2007). Nimfa kutudaun tumbuh dengan cepat menjadi imago (dewasa). Di dalam kurun waktu kurang dari satu minggu nimfa menjadi dewasa serta secara langsung mampu bereproduksi secara aseksual.
Siklus hidup (development time) kutudaun A. gossypii pada tanaman inang berlangsung singkat dan cepat dengan kemampuan reproduksi yang tinggi. Dilaporkan pada tanaman cabai hanya dalam kurun waktu 5-6 hari sedangkan di tanaman terong berlangsung lebih panjang yaitu, 5-10 hari (Parencia 1978; Sudarto 1985). Siklus hidup kutudaun A. gossypii pada tanaman mentimun adalah 4 hari (Van Steenis & E1-Khawass 1995). Periode reproduksi A. gossypii pada tanaman cabai berkisar 14-24 hari sedangkan di tanaman terong selama 7-12 hari. Rata-rata banyaknya nimfa yang dihasilkan setiap hari pada tanaman cabai dan terong adalah 3 ekor per hari (Sudarto 1985) dan di mentimun 6 ekor per hari (Van Steenis & E1-Khawass 1995). Fekunditas adalah kemampuan seekor kutudaun untuk menghasilkan progeni baru selama masa hidupnya. Fekunditas seekor kutudaun dilaporkan sebanyak 25 ekor pada terong, 54 ekor pada cabai (Sudarto 1985) dan 66 ekor pada mentimun (Van Steenis & E1-Khawass 1995).
Kemampuan hidup atau lama hidup (longevity time) imago kutudaun
terong sedangkan ketahanan hidup seekor kutudaun dari sejak instar 1 hingga mati pada tanaman cabai 23 hari dan 18 hari pada tanaman terong (Sudarto 1985).
Ekologi Kutudaun Aphis gossypii
Level infestasi kutudaun melon (A. gossypii) dipengaruhi oleh faktor-faktor ekologi antara lain, musuh alami, suhu, dan ketersediaan nutrisi. Musuh alami kutudaun antara lain larva dan imago dari Asian ladybeetle (Coccinellidae), Green lacewing (Chrysopidae), dan Orius sp. (Anthocoridae) (Tilmon et al. 2011). Kemampuan bertahan hidup dan pola perkembangbiakan kutudaun A. gossypii
sangat bergantung pada kondisi suhu. Suhu optimal bagi A. gossypii untuk dapat hidup dan berkembangbiak adalah 25- 30 oC (Kersting et al. 1999; Henneberry et
al. 2000; Satar et al. 2008). Satar et al. (2008) menyatakan bahwa rata-rata net produksi (Ro) seekor A. gossypii tertinggi pada suhu 22.5 oC (68.38 kutudaun) dan rata-rata net produksi terendah pada suhu 32.5 oC (0.22 kutudaun), sedangkan
Kersting et al. (1999) melaporkan bahwa rata-rata net produksi tertinggi pada suhu 25 oC (44.7 kutudaun). Mortalitas tertinggi pada A. gossypii dilaporkan terjadi pada suhu dingin, 15 oC dan 17.5 oC, dan panas ekstrim yaitu > 32.5 oC (Kersting et al. 1999; Satar et al. 2008). Suhu juga mempengaruhi produksi embun madu (honeydew) pada kutudaun. Henneberry et al. (2000) melaporkan bahwa produksi
honeydew pada suhu 26.7 oC lebih besar dibandingkan di suhu 15.6 oC dan 32.2 oC. Nutrisi tanaman yang banyak dilaporkan memiliki korelasi positif dengan kelimpahan kutudaun adalah unsur nitrogen. Sudarto (1985) menyatakan bahwa biologi kutudaun (fekunditas, lama hidup, ketahanan hidup, serta periode reproduksi) dipengarui oleh kandungan gizi yang terdapat pada tanaman inang seperti nitrogen. Tanaman inang dengan kandungan gizi tinggi menyebabkan adaptasi kutudaun lebih baik dibandingkan dengan tanaman bergizi rendah. Hal berbeda disampaikan oleh Blua dan Perring (1992) bahwa populasi A. gossypii pada tanaman labu (Cucurbita pepo) yang terjangkit virus Zucchiini yellow mosaic virus
(ZYMV) lebih tinggi dibandingkan pada tanaman sehatnya.
Metabolit sekunder diduga pula memiliki peran ketahanan tanaman terhadap serangga herbivora. Senyawa 6-methyl-5-hepten-2-one adalah salah satu senyawa volatil yang diduga kuat berhubungan dengan rendahnya preferensi
A. gossypii pada hasil skrining cabai paprika varietas Hibrida green belt di Brazil (da Costa et al. 2011). Chlorogenic acid dan Kaempferol dilaporkan sebagai metabolit sekunder yang berperan mereduksi serangan hama kutudaun, ulat daun, kumbang daun, dan leafhopper (Leiss et al. 2011).
Kerusakan oleh Kutudaun Aphis gossypii
masalah bagi per tanaman budidaya. Infestasi berat pada fase bibit (seedling) dilaporkan dapat menyebabkan daun tanaman kapas menjadi keriting atau belok serta menyebabkan bibit kerdil serta akhirnya mati. Sedangkan ketika infestasi berat yang terjadi selama masa generatif dapat menyebabkan daun-daun yang lebih tua menguning serta rontok dan dapat menyebabkan malformasi pada kapas (Parencia 1978). Berlandier et al. (2010) menyatakan bahwa ambang ekonomi bagi per tanaman canola adalah saat tanaman terinfestasi 20 persen oleh koloni kutudaun sehingga perlu dilakukan pengendalian kimiawi. Ambang batas ekonomi tanaman kapas adalah saat 30% populasi tanaman terinfestasi oleh kutudaun A. gossypii
(Stam et al. 1994). Infestasi A. gossypii pada tanaman okra dilaporkan dapat mereduksi hasil hingga 57% (Shannag et al. 2007).
Kerusakan tidak langsung yang disebabkan oleh kutudaun ialah terbentuknya embun jelaga (sooty mold). Embun jelaga merupakan hasil asosiasi kotoran kutudaun (honeydew) dengan cendawan. Embun jelaga menyebabkan permukaan daun tertutupi sehingga menghambat proses fotosintesis. Selanjutnya daun menguning dan keriting akibat cairan daun yang dihisap, dan pada akhirnya menyebabkan pertumbuhan tanaman mengerdil (Tilmon et al. 2011). Pada tanaman kapas, embun madu yang berasosiasi dengan embun jelaga menyebabkan sticky cotton sehingga menimbulkan masalah besar di pabrik tekstil pemintalan benang dan menurunkan kualitas dari produk yang dihasilkan (Reed 2000). Seekor kutudaun dapat menghasilkan eksresi gula sebesar 2.68 mikrogram per hari (Henneberry et al. 2000). Kerusakan tidak langsung lainnya yang utama dari infestasi kutudaun adalah kemampuannya menjadi vektor virus. Blackman dan Enstrop (2000) menyatakan terdapat 50 jenis virus yang dapat ditularkan oleh A. gossypii. Jumlah yang lebih besar dilaporkan oleh Satar et al. (1999) sebanyak 76 jenis virus.
A. gossypii menjadi vektor virus dari Cucumber mosaic virus (CMV),
Tobacco etch virus (TEV), Pepper mottle virus (PepMoV), Pepper veinal mottle virus (PVMV), Chilli veinal mottle virus (Chi VMV), Pepper yellow mosaic virus
(PepYMV) dan Potato virus Y (PVY) (da Costa et al. 2011).Virus mosaik kuning (BCMV: Bean common mosaic virus) dapat ditularkan secara non-persisten oleh
A. gossypii dan A. craccivora pada tanaman kacang panjang. Damayanti et al. (2010) menyatakan bahwa efektivitas A. gossypii untuk menularkan BCMV sebesar 70-100%, sedangkan A. crassivora mampu menularkan BCMV dari tanaman sakit ke tanaman sehat sebesar 90-100%.
Kutudaun telah banyak dilaporkan mengalami resistensi terhadap insektisida kimiawi. Hal ini yang menyebabkan pengendalian kutudaun menjadi sulit dilakukan. Insektisida berbahan aktif pyrethroid dalam mengendalikan ulat daun dilaporkan dapat memacu pertumbuhan populasi kutudaun (Reed 2000). Carletto et al. (2009) melaporkan bahwa A. gossypii resisten terhadap insektisida berbahan aktif dimethoate (Organophosphate) dan cypermethrin (Pyrethroid) yang disebabkan oleh adanya mutasi pada gen acetylcholinesterase (S431F).
Resistensi Tanaman terhadap Serangan Hama (Antixenosis, Antibiosis, Toleransi)
management (IPM). Terdapat tiga mekanisme ketahanan tanaman terhadap serangga herbivora yaitu, antixenosis (avoidance), antibiosis (resistensi), dan toleransi (Niks et al. 2011; Maharijaya 2013). Antixenosis atau avoidance
merupakan mekanisme pertahanan diri berupa morfologi, fenologi, dan bau tidak sedap dari bagian tanaman untuk menolak kehadiran hama penggangu (Niks et al. 2011; Mensah et al. 2008).
Antixenosis dapat dievaluasi melalui reduksi jumlah koloni hama (Hesler et al. 2007) dan preferensi kutudaun terhadap suatu genotipe (Kumar et al. 2011).
Mustard aphid (Lipaphis erysimi K.) memiliki preferensi lebih tinggi terhadap
Brassica rapa dibandingkan Brassica fruticulosa (Kumar et al. 2011). Preferensi kisaran inang dari kutudaun juga dipengaruhi oleh kemampuan daya adaptasi kutudaun itu sendiri. Sudarto (1985) melaporkan bahwa kutudaun asal tanaman cabai hanya dapat bertahan hidup 3 hari pada tanaman tomat dan 2 hari pada tanaman tembakau sedangkan pada tanaman cabai dan terong kutudaun dapat beradaptasi dan bertahan hidup masing-masing berurutan selama 23 hari dan 17 hari setelah diinfestasikan.
Antibiosis atau resistensi merupakan kemampuan tanaman untuk membatasi dan mereduksi perkembangbiakan patogen setelah terjadi kontak dengan tanaman. Antibiosis pada serangga tercermin dari tingginya mortalitas (kematian), rendahnya laju perkembangbiakan larva dan menurunnya kemampuan reproduksi hama (fecundity) (Li et al. 2004; Hesler et al. 2007; Mensah et al. 2008; Niks et al. 2011). Tanaman dengan resistensi antibiosis memiliki nilai negatif terhadap reproduksi kutudaun, dengan demikian pengendalian serangan kutudaun secara efektif dapat dilakukan (Mensah et al. 2008). Seperti halnya resistensi, toleransi merupakan perbedaan kemampuan tanaman untuk merespon serangan hama dan membatasi kerusakan yang lebih luas per unit keberadaan hama tersebut (Hesler et al. 2007; Niks et al. 2011).
Antixenosis dapat dievaluasi melalui metode choice test yaitu, melalui evaluasi preferensi kutudaun pada sejumlah genotipe tanaman di fase muda
(seedling) dan dalam kurun waktu tertentu (Diaz-Montano et al. 2006; Hesler et al.
3 RESISTENSI TANAMAN CABAI TERHADAP KUTUDAUN
MELON, Aphis gossypii Glover (HEMIPTERA: APHIDIDAE)
Abstrak
Kutudaun melon (Aphis gossypii Glover) adalah salah satu hama pengganggu utama tanaman cabai dan vektor dari 22 virus di Solanaceae. Hingga saat ini, pengendalian yang dilakukan berbasis bahan kimia berupa insektisida. Namun kini, kutudaun melon dilaporkan telah resisten terhadap insektisida. Insektisida juga membunuh serangga-serangga bermanfaat lainnya seperti, predator, parasitoid, dan polinator. Perakitan varietas inang resisten adalah salah satu cara terbaik dalam strategi pengendalian kutudaun. Terdapat tiga tipe ketahanan terhadap hama: antixenosis, antibiosis, dan toleransi. Belum dilaporkan mengenai varietas cabai tahan terhadap kutudaun di Indonesia. Tujuan dari penelitian ini adalah melakukan skrining dan identifikasi ketahanan antixenosis melalui metode choice test dan juga antibiosis melalui metode no-choicetest pada plasma nutfah cabai koleksi Lab Pemuliaan Tanaman IPB. Bibit cabai ditumbuhkan hingga berdaun 4-6 lalu diinfestasikan dengan dua ekor kutudaun tidak bersayap pada percobaan antixenosis dan dievaluasi setelah 12 hari infestasi. Daun terpisah (detached leaf) digunakan untuk pengujian in vitro ketahanan antibiosis. Daun cabai yang digunakan adalah daun ke-3 atau ke-4 yang telah membuka sempurna dari pucuk. Daun tersebut diletakkan pada sebuah kontainer tertutup (6.3 cm x 5 cm) berventilasi jaring serangga (50 mess). Percobaan antixenosis menunjukkan genotipe IPB C20 sebagai genotipe yang mampu menekan perkembangan koloni kutudaun per daun, total kutudaun per tanaman, dan kutudaun bersayap. Pengujian antibiosis menunjukkan adanya perbedaan respon diantara genotipe uji terhadap karakter-karakter biologi kutudaun. IPB C20 menyebabkan terganggunya biologi kutudaun yaitu, lama hidup, periode reproduksi, progeni kutudaun per hari, dan fekunditas kutudaun secara nyata dibandingkan IPB C313. Selain itu, terdapat korelasi positif antara karakter panjang daun dan posisi daun terhadap total kutudaun per tanaman. Ketahanan antixenosis dan antibiosis yang teridentifikasi memberikan peluang dilakukannya pemuliaan cabai unggul tahan terhadap hama kutudaun serta sebagai opsi tambahan di dalam strategi manajemen hama pada pertanaman cabai.
Kata kunci: antixenosis, antibiosis, Capsicum annuum, choice test, no-choice test
Pendahuluan
besar adalah terbentuknya embun jelaga (sooty mold) pada tanaman inang. Embun jelaga adalah hasil asosiasi kotoran kutudaun (honeydew) dengan cendawan. Embun jelaga menyebabkan permukaan daun tertutupi sehingga menghambat proses fotosintesis, daun menguning, keriting, dan pertumbuhan tanaman mengerdil akibat cairan daun yang dihisap oleh kutudaun (Tilmon et al. 2011). Siklus hidup A. gossypii berlangsung singkat, reproduksi secara vivipar (melahirkan), dan partenogenesis atau aseksual (Sudarto 1985; Blackman & Eastop 2000; Henneberry et al. 2000). Hal tersebut menyebabkan melimpahnya koloni kutudaun yang dapat merusak tanaman. Populasi kutudaun yang berlimpah tanpa adanya pengendalian pada tanaman cabai dilaporkan dapat menyebabkan penurunan hasil panen 56-65% (Fereres et al. 1996). Kutudaun juga mampu mentransmisi 22 jenis virus pada famili Solanaceae (Hook & Fereres, 2006), termasuk non-persisten virus seperti CMV (Cucumber mosaic virus), Potyvirus (ChiVMV), dan Polerovirus (Escrius et al. 2000; Pinto et al. 2008).
Manajemen dan pengendalian kutudaun telah dilakukan dengan cara kimiawi, musuh alami, dan budidaya. Hingga saat ini, pengendalian kimiawi menjadi pilihan utama para petani untuk pengendalian hama kutudaun. Akan tetapi, insektisida juga menyebabkan matinya serangga-serangga yang menguntungkan seperti predator, parasitoid, dan pollinator. Disamping itu, aplikasi bahan kimia juga menjadi isu serius bagi kesehatan dan lingkungan manusia. Carletto et al.
(2009) melaporkan A. gossypii resisten terhadap insektisida berbahan aktif dimethoate (organophosphate) dan cypermethrin (pyrethroid). Varietas resisten dapat menjadi solusi yang lebih ramah lingkungan dan berkelanjutan dalam mengendalikan perkembangbiakan kutudaun. Oleh karena itu, dinilai penting untuk melakukan identifikasi ketahanan tanaman cabai sehingga mampu mendukung pertanian yang berkelanjutan dan ramah lingkungan.
Bahan dan Metode
Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Genetika dan Pemuliaan Tanaman, Departemen Agronomi dan Hortikultura dan Lab. Taxonomi Departemen Proteksi Tanaman, sejak bulan April 2014 hingga bulan Juni 2015.
Bahan Tanaman
Materi genetik yang digunakan adalah dua puluh satu genotipe cabai (Capsicum annuum L.) yang terdiri dari delapan cabai besar, tujuh cabai rawit, dan enam cabai keriting (Lampiran 1) dari plasma nutfah cabai koleksi Laboratorium Genetika dan Pemuliaan Tanaman Departemen Agronomi dan Hortikultura, Faperta IPB dan AVRDC. Tanaman ditumbuhkan dari benih yang disemai di dalam tray plastik bersel 50. Pertama kali, dua benih disemai di dalam setiap sel tray plastik yang berisi media persemaian (campuran tanah, serabut kelapa, dan pupuk kandang; 1:1:1) dan dijadikan satu bibit perlubang setelah dua minggu semai. Selama percobaan tidak dilakukan penyemprotan insektisida guna menghindari pengaruh residu kimiawi terhadap bibit percobaan. Bibit berumur lima minggu atau berdaun 4-6 diletakan di dalam kotak serangga (insect proof box) untuk dilakukan infestasi kutudaun
Populasi Kutudaun
Kutudaun A. gossypii diambil dari lahan per tanaman cabai di lapangan percobaan Leuwikopo, IPB, Darmaga Bogor. Kutudaun melon dewasa (imago) dibiakkan pada tanaman cabai rentan. Identifikasi spesies dilakukan untuk memastikan bahwa spesies kutudaun yang diisolasi adalah A. gossypii
menggunakan panduan kunci identifikasi karya Blackman dan Eastop (2000). Kunci spesifik identifikasi untuk kutudaun melon adalah kornikel berwarna hitam, kauda berwarna gelap pucat (kauda lebih terang dibandingkan kornikel), dan lekukan diantara antena kepala (tubercles antennal tidak berkembang dengan baik (Gambar 2).
Gambar 2 Kunci spesifik identifikasi untuk kutudaun melon (A. gossypii). a. Tubercle antennal, b. Kornikel (siphunculi), & c. Kauda
c b
a
b a
Blackman dan Eastop (2007) menyatakan bahwa kauda atau ekor merupakan organ yang membantu pemercikan honeydew. Honeydew sendiri terekskresi dari rektum (anus). Kutudaun melon dewasa (imago) dibiakkan pada tanaman cabai rentan (susceptible) dan diperbanyak di kotak kedap serangga (insect proof box) pada kisaran suhu dan kelembaban ruang (suhu 28 ± 2 0C; RH 65 ± 10 %). Pemeliharaan rutin dilakukan dengan memindahkan kutudaun dewasa ke tanaman cabai rentan lainnya disaat populasi kutudaun sudah padat atau tanaman sudah terlihat sakit.
Skrining Ketahanan Plasma Nutfah Cabai Terhadap Kutudaun Melon
Dua puluh satu plasma nutfah cabai diskrining pada fase bibit, berdaun 4-6 atau lima minggu setelah semai (Gambar 3). Dua ekor kutudaun melon tidak bersayap (apterous) diinfestasikan menggunakan kuas halus ke daun dari bibit cabai. Kutudaun dibiarkan berpindah, makan, dan bereproduksi secara bebas (choice test). Pada hari ke-12 dilakukan identifikasi terhadap jumlah kutudaun yang ada di setiap genotipe dan kerusakan pada fase bibit (seedling) (Mensah et al. 2008).
Rancangan lingkungan yang digunakan adalah rancangan kelompok lengkap teracak (RKLT) dengan genotipe cabai sebagai perlakuan. Jumlah genotipe yang digunakan sebanyak 21 genotipe dengan dua ulangan, sehingga terdapat 42 satuan percobaan. Setiap genotipe terdiri atas lima tanaman uji. Total populasi tanaman adalah 210 tanaman.
Seleksi dilakukan terhadap enam genotipe uji dengan kriteria infestasi kutudaun melon per daun yaitu, (i) sangat rendah: 8-21 kutudaun, (ii) rendah: 22-35 kutudaun, (iii) medium rendah: 36-49 kutudaun, (iv) medium: 50-63 kutudaun, (v) medium tinggi: 64-77 kutudaun, (vi) tinggi: 78-91 kutudaun, dan (vii) sangat tinggi: 92-105. Genotipe-genotipe terseleksi diujikan kembali dan disiapkan menjadi tetua persilangan untuk percobaan selanjutnya.
Gambar 3 Metode choice test. a. bibit disiapkan pada tray sel 50, b. kotak kedap hama, c. evaluasi infestasi kutudaun
b c
Pengujian Ketahanan Antixenosis Genotipe Cabai terhadap Kutudaun Melon
Pengujian antixenosis menggunakan metode choice test, seperti halnya pada tahap skrining plasma nutfah. Kutudaun melon dibiarkan berpindah untuk makan dan bereproduksi secara bebas. Enam genotipe terpilih berdasarkan skrining adalah IPB C5, IPB C12, IPB C20, IPB C145, dan IPB C313. Observasi dilakukan pada hari ke-12 setelah infestasi dengan menghitung jumlah kutudaun melon per daun, per tanaman, dan bersayap. Rancangan lingkungan yang digunakan adalah RKLT dengan genotipe cabai sebagai perlakuan. Genotipe yang digunakan sebanyak enam genotipe yang diulang tiga kali, sehingga terdapat 18 satuan percobaan. Setiap genotipe terdiri atas lima tanaman sehingga akan terdapat 90 tanaman. Karakter lain yang akan diikutsertakan dalam penelitian ini adalah panjang daun, lebar daun, tinggi tanaman, dan preferensi kutudaun melon terhadap posisi daun (atas, tengah, dan bawah
Pengujian Ketahanan Antibiosis Genotipe Cabai terhadap Kutudaun Melon
Antibiosis dievaluasi mengunakan metode no-choice test, helai daun segar (detached leaf), dari bibit berusia sama dengan percobaan choice test (Gambar 4). Daun cabai yang digunakan adalah daun ke-3 atau ke-4 dari pucuk yang telah membuka sempurna. Daun tersebut diletakkan pada sebuah kontainer tertutup (6.3 cm x 5 cm) yang diberi ventilasi udara dengan jaring kedap serangga (50 mess) dan pelembab (kapas lembab) untuk menjaga turgositas daun. Kondisi lingkungan yang diperlukan ialah suhu 28 ± 2 °C, dan kelembaban udara (RH) 65 ± 10 % berdasarkan metode Satar et al. (2008). Observasi dilakukan setiap hari hingga semua kutudaun mati. Infestasi awal diletakkan 1-2 ekor imago dewasa selama 24 jam untuk mendapatkan 3-5 nimfa kutudaun yang pertama dilahirkan. Nimfa-nimfa tersebut dipertahankan untuk pengujian kemampuan bertahan hidup fase instar (nymphal survival) dan siklus hidup (development time). Selanjutnya diseleksi satu
a b
c d
imago dewasa dari pengujian nimfa sebelumnya untuk diuji fekunditas, lama hidup (longevity) dan periode reproduksi (reproduction time). Semua nimfa baru dihitung dan dimatikan setiap hari.
Nimfa survival adalah banyaknya nimfa yang hidup dari kelahiran pertama hingga menjadi imago dan melahirkan instar satu, sedangkan siklus hidup merupakan interval waktu dari nimfa instar satu hingga nimfa instar satu kembali. Lama hidup (longevity time) dihitung sejak nimfa pertama dilahirkan hingga imago terseleksi mati. Fekunditas adalah jumlah nimfa yang dihasilkan oleh seekor kutudaun selama hidupnya. Rancangan lingkungan yang digunakan adalah RKLT dengan genotipe cabai sebagai perlakuan. Genotipe yang digunakan sebanyak enam genotipe yang diulang tiga kali, sehingga terdapat delapan belas satuan percobaan. Setiap genotipe terdiri atas lima tanaman, total 90 tanaman.
Analisis Data
Analisis data yang dipergunakan adalah uji Normality test dan Bartlett’s test
pada taraf 5% untuk memenuhi asumsi εij~N(0,2); galat menyebar normal, nilai
tengah µ, dan ragam homogen. Selanjutnya data diuji dengan ANOVA (Uji F), bila perlakuan nyata di taraf 5% dilanjutkan dengan uji nilai tengah Beda Nyata Jujur (BNJ). Uji korelasi (pearson) dilakukan pada karaker-karakter daun terhadap infestasi kutudaun. Alat bantu software menggunakan Microsoft Excel 2013,
IRRI’s STAR, dan Minitab 15.
Hasil dan Pembahasan
Skrining Ketahanan Plasma Nutfah Cabai terhadap Kutudaun Melon
Skrining ketahanan terhadap kutudaun melon (A. gossypii) dilakukan pada dua puluh satu genotipe plasma nutfah cabai spesies C. annuum. Hasil skrining menunjukkan secara nyata (P <0.05) terdapat perbedaan respon genotipe terhadap infestasi kutudaun per daun (P< 0.05) (Tabel 1).
Kisaran infestasi kutudaun adalah 22.9 – 95.8 nimfa per daun. Genotipe IPB C5 memiliki jumlah nimfa kutudaun per daun terendah dengan rata-rata 22.9 nimfa, akan tetapi tidak berbeda nyata dengan genotipe IPB C145, IPB C325, IPB C324, IPB C120, IPB C313, IPB C140, IPB C4, dan IPB C20, sedangkan genotipe IPB C3 memiliki nilai infestasi kutudaun terbesar dengan rata-rata 95.8 nimfa per daun dan tidak berbeda nyata dengan genotipe IPB C19, IPB C10, IPB C142, IPB C51, IPB C15, dan IPB C12. Frantz et al. (2004) melaporkan terdapat perbedaan respon cabai terhadap infestasi kutudaun Myzus persicae dengan kisaran infestasi per daun 15.5 – 115.4 nimfa. Hal ini mengindikasikan terdapat perbedaan diantara genotipe cabai terhadap kesesuaian menjadi inang bagi kutudaun seperti halnya ditemukan pada spesies cabai di alam liarnya (wild type). C. annuum merupakan spesies yang umum ditanam oleh petani (Bosland et al. 2012) sehingga menjadi penting mengidentifikasi sumber ketahanan dari spesies tersebut serta memindahkan ketahanan ke dalam varietas komersial melalui persilangan konvensional dan dilanjutkan dengan seleksi.
Tabel 1 Infestasi kutudaun melon per daun pada 21 genotipe cabai dengan metode choice test
No Genotipe Kutudaun per daun 1) Klasifikasi infestasi
1 IPB C5 22.9 h Rendah 2 IPB C145 23.3 h Rendah 3 IPB C325 25.4 gh Rendah 4 IPB C324 28.4 fgh Rendah
5 IPB C120 28.4 fgh Rendah 6 IPB C313 29.4 fgh Rendah
7 IPB C140 36.8 efgh Medium rendah 8 IPB C4 36.9 efgh Medium rendah 9 IPB C20 45.7 efgh Medium rendah 10 IPB C9 51.5 defg Medium
11 IPB C159 54.4 def Medium
12 IPB C323 58.5 cde Medium 13 IPB C111 59.9 bcde Medium 14 IPB C322 59.9 bcde Medium
15 IPB C19 72.3 abcd Medium tinggi 16 IPB C10 76.5 abcd Medium tinggi 17 IPB C142 81.5 abc Tinggi
18 IPB C51 82.3 abc Tinggi
19 IPB C15 86.1 ab Tinggi 20 IPB C12 93.4 a Sangat tinggi 21 IPB C3 95.8 a Sangat tinggi
1) angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
nyata pada uji lanjut DMRT taraf 5%.
digunakan sebagai tetua persilangan. Genotipe terpilih tersebut antara lain IPB C5, IPB C145, dan IPB C313 yang masuk dalam kategori infestasi rendah, genotipe IPB C20 dalam kategori infestasi medium, dan genotipe IPB C15 serta IPB C12 dalam kategori infestasi tinggi.
Pengujian Ketahanan Antixenosis Genotipe Cabai terhadap Kutudaun Melon
Terdapat perbedaan yang signifikan (P<0.05) pada karakter infestasi pada hasil pengujian antixenosis menggunakan metode choice test. Infestasi nyata hanya ditunjukkan oleh genotipe IPBC20 dengan IPB C313, sedangkan terhadap empat genotipe lainnya tidak berbeda nyata (Tabel 2). Di dalam percobaan ini ditemukan perbedaan jumlah infestasi kutudaun per daun pada genotipe yang sama di percobaan skrining (Tabel 1) dengan percobaan choice test kedua (Tabel 2). Hal ini mengindikasikan terdapat mekanisme ketahanan antixenosis di tanaman cabai.
jumlah kutudaun per tanaman lebih dari 150 nimfa dikategorikan rentan. Berdasarkan kategori tersebut maka IPB C20 masuk ke dalam kategori tahan dan lima genotipe cabai lainnya masuk dalam kategori rentan. Implikasi dari adanya antixenosis pada per tanaman cabai adalah penggunaan pola tanam polikultur atau polivarietas serta menghindari pola tanam monokultur atau monovarietas. Niks et al. (2011) menyatakan bahwa pola tanam monokultur pada kultivar yang memiliki ketahanan antixenosis tetap akan berdampak buruk bagi kultivar tersebut bila tidak tersedia inang alternatif bagi hama.
Tabel 2 Rataan jumlah infestasi kutudaun melon pada enam genotipe cabai dengan metode choice test
1) angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
nyata pada uji lanjut BNJ (Tukey) taraf 5%.
Genotipe IPB C20 secara konsisten menunjukkan respon infestasi kutudaun melon yang rendah dibandingkan genotipe cabai lainnya (Tabel 2). Perbedaan respon terbentuknya kutudaun melon bersayap pada Tabel 2 adalah salah satu indikasi adanya antixenosis bekerja di genotipe cabai sehingga menekan terbentuknya kutudaun melon bersayap. Saat kondisi yang lain, no-preferensi terjadi, diinformasikan bahwa kutudaun dewasa dapat dilengkapi dengan sepasang sayap sebagai mekanisme pemencaran koloni akibat kepadatan populasi serta memburuknya nutrisi pada tanaman inang (William & Dixon 2007). Antixenosis disinyalir menjadi mekanisme ketahanan aktif pada spesies liar tomat terhadap infestasi kutu kebul(whiteflies) (Van de Elsen 2013). Ketahanan antixenosis dapat disebabkan oleh kerapatan atau jenis trikoma, adanya lapisan lilin, warna, dan ketebalan kutikula di daun (Firdaus et al. 2011). Bosland dan Ellington (1996) melaporkan adanya ketahanan antixenosis pada cabai bertrikoma rapat, C. pubescen, terhadap infestasi kutudaun M. persicae. Di dalam penelitian sejenis Maharijaya (2013) melaporkan bahwa ketahanan cabai terhadap thrips tidak disebabkan oleh kepadatan trikoma. Di dalam penelitian ini tidak dilakukan pengamatan terhadap kerapatan trikoma karena spesies cabai C. annuum bukan tipe cabai dengan trikoma yang rapat. Oleh karena itu, diduga ada mekanisme antixenosis lainnya yang menyebabkan ketahanan cabai C. annuum di dalam penelitian ini.
tersempit (1.44 cm) dibandingkan lima genotipe lainnya (Tabel 3). Berdasarkan data tersebut, diduga genotipe rentan dengan penampilan yang vigor pada fase bibit memiliki nilai preferensi lebih tinggi bagi kutudaun melon.
Hasil pengujian korelasi menunjukkan keeratan hubungan (korelasi) antara penampilan morfologi fase bibit dengan infestasi kutudaun melon (Tabel 4). Korelasi positif ditunjukkan oleh karakter kutudaun melon per daun terhadap kutudaun melon per tanaman (0.890). Hal tersebut memiliki arti kepadatan koloni kutudaun pada tanaman dipengaruhi kuat oleh kepadatan koloni kutudaun ditiap helai daun tanaman inang. Frantz et al. (2004) menerangkan bahwa korelasi positif terjadi pada jumlah infestasi kutudaun per tanaman dengan kutudaun per daun,
damage rating, produksi embun madu, dan lebar daun pada skrining cabai terhadap
M. persicae.
Tabel 3 Rataan ukuran morfologi bibit cabai berdaun 4-6 pada enam genotipe cabai Genotipe Tinggi bibit Panjang daun Lebar daun
1)
1)angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
nyata pada uji lanjut BNJ (Tukey) taraf 5%.
Karakter posisi daun juga menunjukkan hubungan positif terhadap perkembangan kutudaun di tanaman cabai. Posisi daun atas dan tengah menunjukkan korelasi positif dan kuat terhadap koloni kutudaun melon per daun dan kutudaun melon per tanaman. Idris dan Roff (2002) menyatakan bahwa koloni
A. gossypii ditemukan lebih banyak pada daun-daun lebih bawah dibandingkan daun atas pada semua tipe habitus tanaman cabai. Hal serupa terjadi pada preferensi
M. persicae terhadap daun bawah kentang dibandingkan daun muda atau apikal (Alvarez et al. 2014). Keeratan hubungan tersebut memberi peluang untuk menggunakan karakter kutudaun per daun dan daun tengah sebagai karakter penduga terhadap infestasi kutudaun di suatu genotipe cabai. Cara tersebut dapat memberikan kemudahan serta penghematan waktu observasi saat seleksi galur. Tabel 4 Korelasi infestasi kutudaun melon per daun dan per tanaman terhadap
beberapa karakter morfologi bibit cabai
Karakter Kutudaun per daun Kutudaun per tanaman 1)
Kutudaun per daun - 0.890 **
1) ** berbeda nyata pada uji korelasi person taraf 1%, * berbeda nyata pada uji korelasi person taraf
Tubuh kutudaun dewasa dapat dilengkapi dengan sepasang sayap bermanfaat sebagai mekanisme pemencaran koloni. William dan Dixon (2007) menyatakan terbentuknya sayap pada tubuh kutudaun disebabkan terjadinya kontak fisik diantara individu kutudaun sebagai akibat kepadatan populasi serta memburuknya nutrisi pada tanaman inang, sehingga mendorong kutudaun dewasa untuk terbang berpindah inang. Hasil korelasi menunjukkan bahwa jumlah kutudaun melon bersayap sangat dipengaruhi oleh kepadatan jumlah koloni kutudaun melon per daun (R=0.726) dan koloni kutudaun melon per tanaman (R=0.879). Karakter morfologi inang pada fase bibit juga memberikan nilai bagi preferensi kutudaun. Hal tersebut ditunjukan oleh nilai korelasi yang positif terhadap karakter tinggi bibit dan panjang daun cabai terhadap jumlah kutudaun melon per daun dan kutudaun melon per tanaman.
Pengujian Ketahanan Antibiosis Genotipe Cabai terhadap Kutudaun Melon
Hasil pengujian antibiosis menggunakan metode no-choice test atau
detached leaves (daun terpisah) menunjukkan seluruh karakter biologi hidup kutudaun melon dipengaruhi oleh genotipe kecuali siklus hidup. Siklus hidup kutudaun A. gossypii rata-rata berlangsung selama 4-5 hari dan tidak berbeda nyata diantara enam genotipe uji (Gambar 5).
Instar 1 (1 hari)
2 Hari
3 Hari 4 Hari
Instar 2 Instar 4
Instar 3 Imago (5 Hari)
Pergantian instar kutudaun melon ditandai dengan pergantian kulit (eksofia) yang berwarna putih, membesarnya ukuran tubuh, dan perubahan warna menjadi lebih gelap (hijau gelap) tapi kadang kala ditemukan pula imago kutudaun melon dengan warna kuning. Siklus hidup yang serupa berlangsung pada tanaman mentimun dan Colocasia esculenta var. esculenta (Van Steenis & E1-Khawass 1995; Agarwala & Choudhury 2013).
Periode reproduksi dan lama hidup enam genotipe cabai berada pada kisaran 7-12 hari dan 13-18 hari (Tabel 5). Genotipe IPB C20 memiliki lama hidup dan periode reproduksi paling singkat diantara genotipe uji lainnya, masing-masing 13 hari dan 7 hari, sedangkan genotipe IPB C313 menyebabkan lama hidup dan periode reproduksi yang lebih panjang bagi melon aphid diantara ke enam genotipe uji lainnya, yaitu secara berurutan 17.9 hari dan 11.8 hari. Lama hidup dan reproduksi yang singkat pada kondisi alami kutudaun akan menekan perkembangan koloni kutudaun. Terdapat perbedaan jumlah progeni per hari dan total nimfa (fekunditas) selama periode reproduksi diantara ke enam genotipe. Kisaran progeni dilahirkan per hari adalah 3-5 nimfa, sedangkan kisaran total nimfa yang dilahirkan selama masa hidupnya adalah 23 – 54 nimfa (Tabel 6). Genotipe IPB C20 menunjukkan kemampuan menekan progeni kutudaun per hari dan fekunditas dibandingkan IPB C313. Data tersebut mendukung data percobaan resistensi antixenosis sebelumnya dimana IPB C20 merupakan genotipe dengan preferensi kutudaun yang rendah. Pengaruh antibiosis ditemukan pula pada kedelai terhadap
A. glyciness dengan mereduksi fekunditas pada genotipe resisten atau toleran (Diaz-Montano et al. 2006; Hesler et al. 2007).
Tabel 5 Pengaruh enam genotipe cabai terhadap aspek biologi hidup kutudaun melon
Genotipe Siklus hidup Lama hidup
Periode
1) angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
nyata pada uji lanjut BNJ (Tukey) taraf 5%.
Tabel 6 Nimfa survival, nimfa per hari, dan fekunditas kutudaun melon pada enam genotipe cabai
Genotipe Nimfa Survival (%) Progeni nimfa per hari (nimfa hari-1)
1)angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda
Peningkatan kemampuan reproduksi dan kemampuan bertahan hidup
A. gossypii dipengaruhi pula oleh kandungan asam amino dan metabolit sekunder. Rostami et al. (2012) menerangkan bahwa fekunditas dan survival kutudaun A. gossypii pada tanaman Chrysanthemum iindicum berkorelasi positif dengan kadar asam amino atau nitrogen di daun. Walaupun dalam penelitian ini belum melakukan identifikasi hingga kandungan senyawa metabolit primer dan sekunder, akan tetapi informasi antibiosis melalui no-choice test dapat memberi peluang adanya resistensi yang disebabkan oleh proses biokimia di dalam genotipe itu sendiri.
IPB C20 adalah genotipe cabai dari spesies C. annuum. Antibiosis yang teridentifikasi pada spesies cabai C. annuum memperbesar peluang perakitan varietas cabai unggul tahan hama A. gossypii melalui persilangan konvensional. Oleh karena itu, tidak diperlukan persilangan antar spesies (intercrossing) yang sering kali menyebabkan inkompatibilitas hasil hibridisasi ataupun pendekatan rekayasa genetika dengan produk akhir GMO (genetic modified organism) yang masih kontroversi di masyarakat. Potensi antibiosis tanaman cabai terhadap hama thrips juga dilaporkan terdapat pada cabai spesies C. annuum (Maharijaya 2013).Varietas tahan maupun toleran terhadap A. gossypii menjadi modal penting di dalam sistem IPM (Integrated pest management). Efektivitas varietas tahan perlu dipadukan dengan kultur teknis serta aplikasi pestisida terkontrol guna mendapatkan hasil yang berkelanjutan (sustainable).
Simpulan
Kesimpulan penelitian ini antara lain: (1) Terdapat variasi preferensi kutudaun melon pada 21 genotipe plasma nutfah cabai. (2) Genotipe IPB C20 berpotensi sebagai genotipe tahan terhadap infestasi kutudaun A. gossypii
4 ANALISIS PEWARISAN SIFAT KETAHANAN CABAI
TERHADAP INFESTASI KUTUDAUN MELON, Aphis gossypii
Glover (HEMIPTERA: APHIDIDAE)
Abstrak
Kutudaun melon, Aphis gossypii Glover, adalah salah satu hama pengganggu yang penting dalam produksi cabai dan dapat menyebabkan kerusakan hingga 65% saat populasi tidak terkendali. Tujuan penelitian ini adalah mempelajari kendali genetik pewarisan sifat ketahanan cabai (Capsicum annuum
L.) terhadap infestasi kutudaun melon. Set populasi enam generasi (P1, P2, F1, F2,
BCP1, BCP2) dibentuk dari persilangan tetua P1 dengan nilai infestasi rendah (IPB
C20) dengan tetua P2 yang bernilai infestasi tinggi (IPB C313). Metode skrining
menggunakan choice test dengan menginfestasikan dua ekor kutudaun per daun kepada masing-masing bibit berumur lima minggu serta dievaluasi setelah 12 hari infestasi. Hasil penelitian menunjukkan bahwa ketahanan cabai terhadap infestasi kutudaun melon dikendalikan oleh banyak gen (poligen). Derajat dominansi tetua rentan dikategorikan overdominan terhadap tetua tahan. Tetua tahan dikendalikan oleh gen-gen resesif. Aksi gen pengendali ketahanan terhadap kutudaun melon adalah aditif dan dominan, ragam dominan lebih besar dibandingkan ragam aditif. Nilai heritabilitas arti luas tergolong tinggi sedangkan heritabilitas arti sempit tergolong sangat sempit. Metode seleksi dapat digunakan yaitu, metode rekombinasi transgresif atau recurrent selection.
Kata kunci: aksi gen, Capsicum annuum, enam generasi, heritabilitas, ragam dominan
Pendahuluan
Informasi pewarisan sifat ketahanan tanaman terhadap hama masih terbatas dilaporkan dibandingkan dengan pemuliaan tanaman terhadap penyakit. Ketahanan terhadap hama pertama kali dilaporkan pada tanaman anggur terhadap hama
Phylloxena vitifollae tahun 1861 selanjutnya pada padi terhadap hama wereng coklat, Nilaparvata lugens (Ghahal & Gosal 2003). Varietas cabai tahan terhadap infestasi hama kutudaun hingga saat ini belum banyak dikembangkan. Terdapat paling tidak tiga alasan kesulitan di dalam merakit tanaman tahan cekaman biotik seperti ketahanan terhadap hama kutudaun yaitu, (1) kendala dalam menentukan metode skrining, (2) tidak tersedianya sumber gen ketahanan, dan (3) informasi pewarisan sifat yang masih beragam (Yoon 2003). Pengembangan ketahanan terhadap hama juga memerlukan pengetahuan tidak hanya terhadap tanaman yang dimuliakan tetapi juga pengetahuan terhadap prilaku hama (pest behaviour) serta interaksi keduanya (Chahal & Gosal 2003)
(backcross). Asumsi yang perlu dipenuhi untuk melakukan analisis statistik dan analisis genetik dalam melacak gen-gen pengendali karakter tersebut adalah (1) tidak ada efek lingkungan, (2) tidak ada efek dominansi antar alel, (3) tidak ada efek epistasis, (4) gen memberikan efek yang sama dan bersifat aditif untuk semua lokus, (5) tidak ada pautan gen, dan (6) tetua dalam keadaan homozigositas lengkap serta tanaman F1 dalam keadaan heterozigositas lengkap (Allard 1960; Poehlman 1996).
Analisis pewarisan sifat ketahanan terhadap kutudaun melalui populasi enam generasi dengan metode choice test telah dilaporkan pada beberapa jenis tanaman seperti mentimum (Liang et al. 2015), melon (Boissot et al. 2010), kedelai (Mensah et al. 2008), kacang panjang (Kuswanto et al. 2007), dan tomat (Goffreda & Mutschler 1989). Beberapa hasil penelitian memberikan kesimpulan yang berbeda-beda dari monogenik hingga poligenik yang komplek. Liang et al. (2015) menyatakan bahwa ketahanan mentimun terhadap infestasi A. gossypii
dikendalikan oleh satu gen mayor aditif-dominan dan poligenik aditif-dominan. Di tanaman melon, ketahanan terhadap A. gossypii dikendalikan secara poligenik dengan empat aditif QTL dan dua epistasis QTL dari populasi RIls-nya,
recombinant inbreed lines (Boissot et al. 2010) sedangkan Klingler et al. (2001) pada tanaman yang sama, melon, melaporkan ketahanan tersebut dikendalikan oleh
single gen dan dominan.
Ketahanan terhadap kutudaun pada jenis tanaman serta kutudaun yang berbeda juga telah dilaporkan. Ketahanan tanaman kedelai terhadap A. glycines
dilaporkan dikendalikan oleh dua gen resesif yang berepistasis 15:1 (Mensha et al. 2008) sedangkan ketahanan kacang panjang terhadap A. craccivora dilaporkan dikendalikan oleh gen dominan rangkap dengan rasio 15 toleran : 1 peka, serta terdapat interaksi gen dominan x dominan pada evaluasi populasi F2-nya (Kuswanto et al. 2007). Informasi genetik yang dapat diperoleh dari analisis pewarisan sifat terdiri atas aksi gen, jumlah gen pengendali, keragaman genetik, heritabilitas serta informasi-informasi genetik lainnya (Sujiprihati et al. 2001). Informasi genetik tersebut sangat berguna dalam tahapan seleksi, sehingga seleksi diharapkan akan lebih efektif dan efisien. Penelitian ini bertujuan untuk memperoleh informasi pewarisan sifat ketahanan cabai (C. annuum L.) terhadap infestasi hama kutudaun A. gossypii.
Bahan dan Metode
Waktu dan Tempat Penelitian
Penelitian dilakukan dari bulan April 2014 hingga bulan September 2015. Pembentukan populasi dilakukan di Babakan Lio, Bogor. Kegiatan skrining ketahanan terhadap kutudaun dilakukan di Laboratorium Genetika dan Pemuliaan Tanaman, Departemen Agronomi dan Hortikultura IPB.
Bahan Tanaman
Material genetik yang digunakan adalah enam populasi yaitu, IPB C20 (P1)
sebagai tetua dengan nilai infestasi kutudaun melon rendah, IPB C313 (P2) dengan
nilai infestasi kutudaun melon tinggi, turunan pertama (F1), turunan kedua (F2),
silang balik P1 dan P2 (BCP1 dan BCP2) Masing-masing populasi memiliki jumlah