RINGKASAN
MARSHA YUNIKE PRADIPTA. Penggunaan Bakteri Pelarut Fosfat serta Kombinasinya pada Pertumbuhan Tanaman Sawi Sendok (Di bawah bimbingan RAHAYU WIDYASTUTI dan DWI ANDREAS SANTOSA).
Fosfor adalah salah satu unsur esensial yang penting bagi laju fotosintesis dan perkembangan akar. Sebagian besar bentuk fosfat terikat oleh koloid tanah sehingga tidak tersedia bagi tanaman. Mikrob pelarut fosfat dapat melarutkan fosfat terikat melalui sekresi asam organik sehingga dapat meningkatkan efisiensi pupuk fosfat. Secara alami, mikrob pelarut fosfat hidup di rizosfer.
Kegiatan dari penelitian ini meliputi isolasi bakteri, uji antagonis, uji pelarutan fosfat, dan aplikasi bakteri pelarut fosfat dengan pupuk SP-36 pada pertumbuhan tanaman sawi sendok. Sampel tanah untuk isolasi bakteri diambil di daerah Semplak. Penelitian dilakukan di laboratorium dan rumah kaca. Penelitian ini menggunakan rancangan acak lengkap yang disusun secara faktorial dengan tiga kali ulangan. Faktor pertama adalah empat isolat bakteri pelarut fosfat
Burkholderia sp. IS9, Pseudomonas aeruginosa P2, Bacillus subtilis J2, dan
Burkholderia sp. PS4. Faktor kedua adalah pupuk SP-36 dengan 50% dosis pupuk SP-36, 75% dosis pupuk SP-36, dan 100% dosis pupuk SP-36.
Hasil penelitian menunjukkan bahwa isolat bakteri tanah Burkholderia
sp. IS9 memberikan kemampuan melarutkan fosfat baik secara kualitatif dan kuantitatif yang paling tinggi dibandingkan dengan isolat bakteri yang lain. Keempat strain bakteri yang dikombinasikan dengan uji antagonistik secara in vitro tidak bersifat antagonis. Inokulasi perlakuan bakteri Burkholderia sp. PS4 dengan setengah dosis pupuk SP-36 meningkatkan tinggi tanaman, bobot basah dan bobot kering tanaman.
SUMMARY
MARSHA YUNIKE PRADIPTA. Utilization of Phosphate Solubilizing Bacteria and it’s Combination on The Growth of Sawi Sendok Plant (Under Supervision of RAHAYU WIDYASTUTI and DWI ANDREAS SANTOSA).
Phosphorus is one of the essential elements which plays a very important role in photosynthesis and root development. Most of the phosphate forms are bound in soil colloids, so that it is not available for plants. A group of the so called phosphate-solubilizing microorganisms (PSM) have ability to solubilize a bounding phosphate because they produce organic acid so that they can increase the efficiency of phosphate fertilization. Naturally phosphate-solubilizing microorganism live in the rhizosphere.
The research activities covered isolation of PSM, antagonistic test, phosphate solubilizing test, and the use of phosphate solubilizing bacteria (PSB) isolates combined with SP-36 fertilizer on the growth of sawi sendok plant. Soil samples for microbe isolation were taken from Semplak. The experiment was conducted at green house condition. The experiment was arranged according to completely randomized design (CRD) with two treatment factors provided and three replications. The first factor was phosphate solubilizing bacteria isolates namely Burkholderia sp. IS9, Pseudomonas aeruginosa P2, Bacillus subtilis J2, and Burkholderia sp. PS4. The second factor was phosphate fertilization, i.e 50%, 75% and 100% dosages of SP-36 fertilizer.
The result of the experiment showed that bacteria Burkholderia sp. IS9 isolate provided higher phosphate solubilizing capacity of the qualitative and quantitative ability test of phosphate solubilizing compared to other treatments. The inoculation of Burkholderia sp. PS4 with 50% dosage of SP-36 fertilizer increased plant height, biomass and plant dry weight.
Judul Penelitian : Penggunaan Bakteri Pelarut Fosfat serta Kombinasinya
a pada Pertumbuhan Tanaman Sawi Sendok Nama Mahasiswa : MARSHA YUNIKE PRADIPTA
Nomor Pokok : A14080049
Menyetujui,
Pembimbing I Pembimbing II
Dr. Rahayu Widyastuti, M.Sc Dr. Ir. Dwi Andreas Santosa, MS NIP. 19610607 199002 2 001 NIP. 19620927 198811 1 001
Mengetahui,
Ketua Departemen Ilmu Tanah dan Sumberdaya Lahan
Dr. Ir. Syaiful Anwar, M.Sc NIP. 19621113 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan di Purwokerto pada tanggal 1 Juni 1990 dan merupakan anak pertama dari pasangan Bapak Mahar Sukrisno dan Ibu Isa Yeniarti.
Penulis memasuki jenjang pendidikan dasar pada tahun 1996 di SD Negeri 1 Sokanegara Purwokerto dan lulus pada tahun 2002. Setelah itu penulis melanjutkan pendidikan di SMP Negeri 8 Purwokerto. Setelah lulus pada tahun 2005, penulis melanjutkan pendidikan di SMA Negeri 1 Purwokerto dan menyelesaikan pendidikan pada tahun 2008.
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi ini.
Skripsi ini merupakan hasil penelitian yang digunakan sebagai syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Ilmu Tanah dan Sumberdaya Lahan, Fakultas Pertanian, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan rasa hormat dan terimakasih kepada :
1. Ibu Dr. Rahayu Widyastuti, M.Sc selaku dosen pembimbing skripsi pertama dan pembimbing akademik atas bimbingan dan saran yang telah diberikan selama penelitian berlangsung hingga akhir penulisan skripsi ini.
2. Bapak Dr. Ir Dwi Andreas Santosa, M.S selaku dosen pembimbing skripsi kedua atas bimbingan dan saran yang telah diberikan selama penelitian berlangsung hingga akhir penulisan skripsi ini.
3. Ibu Dr. Lilik Tri Indriyati, M.Sc selaku dosen penguji pada pelaksanaan ujian sidang, atas bimbingan dan saran yang telah diberikan.
4. Kedua orang tua, Mahar Sukrisno dan Isa Yeniarti, adik-adikku atas kesabaran, doa dan semangat serta dukungan materi yang diberikan kepada penulis.
5. Yuwan P. Baki dan teman-teman MSL angkatan 45 atas doa dan motivasi kepada penulis.
6. Olivia Mersylia Tombe atas kerjasamanya dan membiayai penelitian ini. 7. Staff Laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumberdaya Lahan atas bantuan dan informasi yang diberikan selama penelitian.
Penulis berharap skripsi ini dapat bermanfaat bagi penulis secara pribadi dan bagi semua pihak yang membutuhkannya. Untuk itu, saran dan kritik yang membangun sangat penulis harapkan.
Bogor, September 2012
DAFTAR ISI
KATA PENGANTAR ... ii
DAFTAR ISI ... iii
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Fosfor ... 3
2.1.1 Bentuk-bentuk P di dalam Tanah ... 3
2.1.2 Ketersediaan P Tanah ... 4
2.1.3 Transformasi P-Anorganik ... 4
2.1.4 Faktor-faktor yang Mempengaruhi Retensi P di dalam Tanah ... 4
2.1.5 Kehilangan Fosfor dari Tanah ... 5
2.1.6 Pemupukan Fosfat dan Permasalahannya ... 5
2.1.7 Fungsi P bagi Tanaman ... 5
2.2 Mikrob Pelarut Fosfat ... 6
2.2.1 Penyebaran Mikrob Pelarut Fosfat ... 6
2.2.2 Mekanisme Pelarutan Fosfat ... 7
2.2.3 Isolasi Mikrob Pelarut Fosfat ... 8
2.3 Tanaman Sawi Sendok ... 9
2.4 Karakteristik Umum Latosol (Inceptisol) ... 9
III. BAHAN DAN METODE ... 11
3.1 Lokasi dan Waktu Penelitian ... 11
3.2 Alat dan Bahan Penelitian ... 11
3.4 Rancangan Penelitian ... 17
IV. HASIL DAN PEMBAHASAN ... 20
4.1 Analisis Tanah ... 20
4.2 Isolasi Bakteri Pelarut Fosfat dan Uji Kemampuan Pelarutan Fosfat ... 21
4.3 Uji Antagonistik Bakteri Pelarut Fosfat secara in vitro ... 25
4.4 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya pada Pertumbuhan Tanaman Sawi Sendok ... 25
4.4.1 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Tinggi Tanaman Sawi Sendok ... 25
4.4.2 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Lebar Daun Tanaman Sawi Sendok ... 27
4.4.3 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Jumlah Daun Tanaman Sawi Sendok ... 28
4.4.4 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Bobot Basah Tanaman Sawi Sendok ... 29
4.4.5 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Bobot Kering Tanaman Sawi Sendok ... 31
4.4.6 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Ketersediaan P dalam Tanah ... 32
4.4.7 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Kandungan P dalam Tanaman Sawi Sendok ... 34
V. KESIMPULAN DAN SARAN ... 37
Kesimpulan ... 37
Saran...37
DAFTAR TABEL
Nomer Halaman
1. Asal Isolat Bakteri Pelarut Fosfat Koleksi ... 11
2. Sifat Inceptisol yang digunakan sebagai media ... 20
3. Indeks Pelarutan P Bakteri Pelarut Fosfat Asal Tanah Inceptisol ... 21
4. Konsentrasi Pelarutan P Bakteri Pelarut Fosfat Asal Tanah Inceptisol pada Hari ke-5 ... 22
5. Indeks Pelarutan P Bakteri Pelarut Fosfat yang Terpilih ... 22
6. Konsentrasi Pelarutan P Bakteri Pelarut Fosfat yang Terpilih... 23
7. pH Media Kultur Pelarutan P secara Kuantitatif ... 24
8. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dengan Pupuk SP-36 terhadap Tinggi Tanaman Sawi Sendok pada 5 MST ... 26
9. Pengaruh Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Lebar Daun Tanaman Sawi Sendok pada 5 MST ... 27
10. Pengaruh Perlakuan Bakteri Pelarut Fosfat dengan Pupuk SP-36 terhadap Jumlah Daun Tanaman Sawi Sendok pada 1 MST-5 MST ... 28
11. Pengaruh Interaksi Perlakuan Bakteri dengan Pupuk SP-36 terhadap Bobot Basah Tanaman Sawi Sendok ... 29
12. Pengaruh Interaksi Perlakuan Bakteri dengan Pupuk SP-36 terhadap Bobot Kering Tanaman Sawi Sendok ... 31
13. Pengaruh Interaksi Perlakuan Bakteri dengan Pupuk SP-36 terhadap Ketersediaan P dalam Tanah ... 32
DAFTAR GAMBAR
Nomer Halaman
1. Indeks Pelarutan Fosfat ... 13
2. Metode Uji Antagonistik Dua Isolat Bakteri ... 15
3. Metode Uji Antagonistik Tiga Isolat Bakteri ... 15
4. Metode Uji Antagonistik Empat Isolat Bakteri ... 16
DAFTAR LAMPIRAN
Tabel Lampiran Halaman
1. Hasil Analisis Kimia Tanah Inceptisol Berdasarkan Kriteria Pusat Penelitian Tanah 1983 ... 41 2. Kriteria Berdasarkan Penilaian Sifat-Sifat Kimia Tanah Pusat Penelitian
Tanah 1983 ... 42 3. Hasil Analisis Kimia Pupuk Kompos ... 43 4. Hasil Analisis Pupuk SP-36 ... 43 5. Pengaruh Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadapTinggi Tanaman Sawi Sendok pada 1 MST-3 MST ... 44 6. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36
terhadap Tinggi Tanaman Sawi Sendok pada 4 MST ... 45 7. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36
terhadap Lebar Daun Tanaman Sawi Sendok pada 1 MST ... 46 8. Pengaruh Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Lebar Daun Tanaman Sawi Sendok pada 2 MST-3 MST ... 47 9. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36
terhadap Lebar Daun Tanaman Sawi Sendok pada 4 MST ... 48 10. Hasil Analisis Ragam Pengujian Kuantitatif Isolat Bakteri Pelarut Fosfat . 48 11. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan
Pupuk SP-36 terhadap Tinggi Tanaman Sawi Sendok ... 49 12. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut... 49 13. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan
Pupuk SP-36 terhadap Jumlah Daun Tanaman Sawi Sendok ... 50 14. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan
Pupuk SP-36 terhadap Bobot Basah Tanaman Sawi Sendok ... 51 15. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan
Pupuk SP-36 terhadap Bobot Kering Tanaman Sawi Sendok ... 51 16. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan
18. Komposisi Media SPA (1000 ml) ... 52
19. Komposisi Media Pikovskaya (1000 ml) ... 52
20. Komposisi Media Nutrient Broth (1000 ml) ... 52
21. Kombinasi Perlakuan Bakteri dengan Pupuk SP-36 di Rumah Kaca ... 53
Gambar Lampiran 1. Uji Antagonistik Bakteri Pelarut Fosfat secara in vitro...53
I. PENDAHULUAN
1.1 Latar Belakang
Fosfor (P) merupakan salah satu unsur utama yang diperlukan tanaman dan memegang peranan penting dalam proses metabolisme. Dalam tanah dijumpai fosfor organik dan anorganik, keduanya merupakan sumber penting bagi tanaman. Tanaman menyerap fosfor dalam bentuk H2PO4-, HPO42-dan PO43-. Pada umumnya bentuk H2PO4- lebih tersedia bagi tanaman daripada HPO42- dan PO43-. Ketersediaan fosfor anorganik sangat ditentukan oleh pH tanah, jumlah dan tingkat dekomposisi bahan organik serta kegiatan jasad mikro dalam tanah (Lal, 2002).
Ketersediaan P dalam tanah pada umumnya rendah. Hal ini disebabkan P terikat menjadi Fe-fosfat dan Al-fosfat pada tanah masam atau Ca3(PO4)2 pada tanah basa. Adanya pengikatan-pengikatan fosfat tersebut menyebabkan pupuk fosfat yang diberikan tidak efisien sehingga perlu diberikan dalam takaran tinggi. Pemberian pupuk fosfat ke dalam tanah hanya 15-20 % yang dapat diserap oleh tanaman sedangkan sisanya akan terjerap di antara koloid tanah dan tinggal sebagai residu dalam tanah (Buckman dan Brady, 1956; Jones, 1982). Hal ini menyebabkan defisiensi fosfat bagi pertumbuhan tanaman.
asam organik seperti asam asetat, asam format, asam laktat, asam oksalat, asam malat dan asam sitrat yang dihasilkan oleh mikrob tersebut. Mikrob tersebut juga memproduksi asam amino, vitamin dan zat pengatur tumbuh seperti asam indol asetat (IAA) dan asam giberelin (GA3) yang dapat meningkatkan pertumbuhan tanaman (Richardson, 2001; Arshad dan Frankenberger, 1993; Patten dan Glick, 1996; Cunningham and Kuiack, 1992).
Dalam penelitian ini peran bakteri pelarut fosfat dalam meningkatkan serapan hara P diuji pada pertumbuhan tanaman sawi sendok (pakcoy). Tanaman sawi sendok merupakan jenis sayuran daun kerabat sawi yang mulai dikenal pula dalam dunia boga Indonesia. Sawi sendok adalah tumbuhan yang dimanfaatkan
daun atau bunganya sebagai bahan pangan (sayuran), baik segar maupun diolah. Tanaman sawi sendok ini memiliki potensial untuk dibudidayakan dan memiliki harga yang tinggi. Selain itu manfaat sawi sendok sangat penting untuk kesehatan (Aji, 2009).
1.2 Tujuan Penelitian
Tujuan penelitian adalah untuk mengetahui (1) kemampuan pelarutan fosfat dari berbagai macam isolat bakteri pelarut fosfat, (2) sifat antagonistik bakteri pelarut fosfat yang dikombinasikan pada uji secara in vitro, (3) efek dari sifat kombinasi bakteri pelarut fosfat pada pertumbuhan tanaman sawi sendok.
1.3 Hipotesis
1. Bakteri pelarut fosfat dapat melarutkan fosfat.
2. Empat strain bakteri pelarut fosfat yang terpilih tidak mempunyai sifat antagonistik satu sama lain.
II. TINJAUAN PUSTAKA
2.1 Fosfor
Fosfor merupakan unsur hara kedua yang penting bagi tanaman setelah nitrogen. Fosfor umumnya diserap tanaman sebagai ortofosfat primer (H2PO4-) atau bentuk sekunder (HPO42-). Fosfor kadarnya di dalam tanaman lebih rendah dari N, K, dan Ca. Hal ini disebabkan retensi yang tinggi terhadap unsur P di dalam tanah menyebabkan konsentrasinya di dalam larutan tanah cepat sekali berkurang (Leiwakabessy et al., 2003). Tanaman memerlukan P pada semua tingkat pertumbuhan terutama pada awal pertumbuhan dan pembungaan (Rubatzky dan Yamaguchi, 1999). Apabila terjadi kekurangan P akibat retensi di dalam tanah, tanaman akan menunjukkan gejala di dalam jaringan yang tua terlebih dahulu baru diangkut ke bagian-bagian meristem atau jaringan yang lebih muda (Tisdale et al., 1999).
Peranan fosfor (P) menurut Rismunandar (1990) dalam tanaman digunakan dalam pembentukan protein terutama dalam transfer metabolik ATP, ADP, fotosintesis dan respirasi, serta termasuk komponen dari fosfolipida, selain itu, peranan fosfor lainnya dalam pembentukan akar, mempercepat matangnya buah, dan memperkuat tubuh tanaman.
2.1.1 Bentuk-bentuk P di dalam Tanah
Fosfor dalam tanah berasal dari mineral apatit, yaitu fluoroapatit Ca3(PO4)3CaF2 (Tisdale et al., 1999).
2.1.2 Ketersediaan P Tanah
Unsur P dalam tanah yang terikat dalam bentuk senyawa fosfat merupakan senyawa yang mudah tersedia bagi tanaman. Unsur P, N, dan K digolongkan sebagai unsur utama, tetapi unsur P diabsorpsi dalam jumlah kecil dibandingkan dengan unsur N dan K. Tanaman mengabsorpsi P dalam bentuk ion orthofosfat primer, H2PO4- dan sebagian kecil dalam bentuk sekunder, HPO42-. Tanaman dapat juga mengabsorpsi fosfat dalam bentuk P-organik. Bentuk-bentuk ini berasal dari dekomposisi bahan organik dan dapat langsung dipakai oleh tanaman (Tisdale et al., 1999).
2.1.3 Transformasi P-Anorganik
Ada dua macam reaksi transformasi dalam tanah, yaitu reaksi pengendapan, yaitu reaksi ion fosfat dengan kation-kation di dalam larutan tanah membentuk senyawa-senyawa, yaitu Ca-fosfat, Al-fosfat, dan Fe-fosfat. Reaksi-reaksi absorpsi, terjadi baik pada permukaan mineral-mineral kristalin (permukaan dengan muatan tetap) maupun pada permukaan dengan muatan variabel seperti oksida/hidrousoksida dari Fe (III) dan Al, bahan organik, alofan dan kalsit (Leiwakabessy et al., 2003).
2.1.4 Faktor-faktor yang Mempengaruhi Retensi P di dalam Tanah
2.1.5 Kehilangan Fosfor dari Tanah
Kehilangan fosfor dari tanah dapat terjadi melalui mekanisme panen, pencucian, erosi, dan penguapan. Kehilangan fosfor yang paling utama adalah melalui mekanisme panen dan erosi. Hilangnya fosfor dari tanah yang terjadi melalui mekanisme panen tergantung dari produksi tanaman dan jumlah sisa hasil panen yang dikembalikan ke lahan pertanian. Selain itu, kehilangan P melalui pencucian sangat kecil karena kadar fosfat di dalam larutan tanah sangat kecil walaupun terjadi drainase yang hebat sekali. Kehilangan P melalui penguapan sampai saat ini dapat diabaikan. Sedangkan kehilangan P melalui erosi dapat terjadi di dalam tanah terdapat dalam bentuk yang relatif sukar larut, karena fosfat yang diberikan dalam pupuk segera diikat oleh tanah menjadi bentuk yang sukar larut (Tisdale et al., 1999).
2.1.6 Pemupukan Fosfat dan Permasalahannya
Fosfat mudah terfiksasi oleh Al dan Fe yang menyebabkan fosfat tidak tersedia bagi tanaman. Semakin rendah pH tanah maka semakin tinggi jumlah konsentrasi ion Al, Fe, dan Mn yang dapat larut. Akibatnya makin tinggi jumlah P yang diikat.
Adanya pengikatan-pengikatan fosfat tersebut menyebabkan pupuk fosfat yang diberikan tidak efisien sehingga perlu diberikan dalam takaran tinggi. Pemberian pupuk fosfat ke dalam tanah hanya 15-20 % yang dapat diserap oleh tanaman sedangkan sisanya akan terjerap di antara koloid tanah dan tinggal sebagai residu dalam tanah (Buckman dan Brady, 1956; Jones, 1982). Hal ini akan menyebabkan defisiensi fosfat bagi pertumbuhan tanaman.
2.1.7 Fungsi P bagi Tanaman
terhadap penyakit, metabolisme karbohidrat, dan dalam penyimpanan serta pemindahan energi (transfer energy) (Leiwakabessy, 2003).
Apabila terjadi kekurangan fosfat maka fosfat di dalam jaringan yang tua akan berpindah ke bagian-bagian meristem yang sedang aktif. Gejala-gejala kekurangan P adalah pertumbuhan terhambat (kerdil) karena pembelahan sel terganggu, daun-daun menjadi ungu atau coklat mulai dari ujung daun, dan terlihat jelas pada tanaman yang masih muda (Hardjowigeno, 1987).
2.2 Mikrob Pelarut Fosfat
2.2.1 Penyebaran Mikrob Pelarut Fosfat
Salah satu alternatif untuk meningkatkan efisiensi pemupukan fosfat dalam mengatasi rendahnya fosfat tersedia dalam tanah adalah dengan memanfaatkan kelompok mikrob pelarut fosfat yaitu mikrob yang dapat melarutkan fosfat tidak tersedia menjadi tersedia dan dapat diserap oleh tanaman. Dalam tanah dijumpai fosfor organik dan anorganik, keduanya merupakan sumber penting bagi tanaman. Tanaman menyerap fosfor dalam bentuk H2PO4-, HPO4 2-dan PO43-. Pada umumnya bentuk H2PO4- lebih tersedia bagi tanaman daripada HPO42- dan PO43-. Ketersediaan fosfor anorganik sangat ditentukan oleh pH tanah, jumlah dan tingkat dekomposisi bahan organik serta kegiatan jasad mikro dalam tanah (Lal, 2002).
Efek pelarutan umumnya disebabkan oleh adanya produksi asam organik seperti asam asetat, asam format, asam laktat, asam oksalat, asam malat dan asam sitrat yang dihasilkan oleh mikrob pelarut fosfat. Mikrob tersebut juga memproduksi asam amino, vitamin dan zat pengatur tumbuh seperti asam indol asetat (IAA) dan asam giberelin (GA3) yang dapat meningkatkan pertumbuhan tanaman (Richardson, 2001; Arshad dan Frankenberger, 1993; Patten dan Glick, 1996).
hanya berkisar dua puluh ribu sampai dengan satu juta per gram tanah (Alexander, 1977). Mikrob pelarut fosfat hidup terutama di sekitar perakaran tanaman yaitu di daerah permukaan tanah sampai kedalaman 25 cm dari permukaan tanah. Keberadaan mikrob pelarut fosfat berkaitan dengan banyaknya jumlah bahan organik yang secara langsung mempengaruhi jumlah dan aktivitas hidupnya. Akar tanaman mempengaruhi kehidupan mikrob dan secara fisiologis mikrob yang berada dekat dengan daerah perakaran akan lebih aktif daripada yang hidup jauh dari daerah perakaran.
Keberadaan mikrob pelarut fosfat dari suatu tempat ke tempat yang lainnya sangat beragam. Salah satu faktor yang menyebabkan keragaman tersebut adalah sifat biologisnya. Mikrob pelarut fosfat ada yang hidup pada kondisi asam, netral dan basa, ada yang hipofilik, mesofilik, dan termofilik, serta ada yang hidup di kondisi aerob atau anaerob. Pertumbuhan mikrob pelarut fosfat sangat dipengaruhi oleh kemasaman tanah. Pada tanah masam, aktivitas mikrob didominasi oleh kelompok fungi sebab pertumbuhan fungi optimum pada pH 5-5,5. Pertumbuhan fungi menurun bila pH meningkat. Sebaliknya pertumbuhan kelompok bakteri optimum pada pH sekitar netral dan meningkat seiring dengan meningkatnya pH tanah.
2.2.2 Mekanisme Pelarutan Fosfat
Fosfat di dalam tanah dapat dalam bentuk organik dan anorganik yang merupakan sumber fosfat penting bagi tanaman. Fosfat organik berasal dari bahan organik, sedangkan fosfat anorganik berasal dari mineral-mineral yang mengandung fosfat. Pelarutan senyawa fosfat oleh mikrob pelarut fosfat berlangsung secara kimia dan biologi baik untuk bentuk fosfat organik maupun anorganik. Mikrob pelarut fosfat membutuhkan adanya fosfat dalam bentuk tersedia dalam tanah untuk pertumbuhannya.
tersebut diikuti dengan menurunnya pH. Penurunan pH juga dapat disebabkan karena terbebasnya asam sulfat dan nitrat pada oksidasi kemoautotrofik sulfur dan amonium, berturut-turut oleh bakteri Thiobacillus dan Nitrosomonas (Alexander, 1977). Perubahan pH berperan penting dalam peningkatan kelarutan fosfat (Thomas, 1985; Asea et al., 1988). Selanjutnya asam-asam organik ini akan bereaksi dengan bahan pengikat fosfat seperti Al3+, Fe3+, Ca2+ atau Mg2+ membentuk khelat organik yang stabil sehingga mampu membebaskan ion fosfat terikat sehingga dapat diserap oleh tanaman.
Pelarutan fosfat secara biologi terjadi karena mikrob tersebut menghasilkan enzim antara lain enzim fosfatase (Lynch, 1983) dan menghasilkan enzim fitase (Alexander, 1977). Fosfatase merupakan enzim yang akan dihasilkan apabila ketersediaan fosfat rendah. Fosfatase disekresikan baik oleh akar tanaman dan mikrob (Joner et al., 2000). Fosfatase yang dihasilkan oleh mikrob lebih dominan di dalam tanah. Pada proses mineralisasi bahan organik, senyawa fosfat organik diuraikan menjadi bentuk fosfat anorganik yang tersedia bagi tanaman dengan bantuan enzim fosfatase. Enzim fosfatase dapat memutuskan fosfat yang terikat oleh senyawa-senyawa organik menjadi bentuk yang tersedia.
Mikrob pelarut fosfat juga menghasilkan fosfat terlarut ke dalam tanah sehingga fosfat tersedia dalam tanah meningkat dan dapat diserap oleh akar tanaman. Unsur hara P diserap oleh akar tanaman melalui mekanisme difusi.
2.2.3 Isolasi Mikrob Pelarut Fosfat
bening mencirikan bahwa bakteri tersebut mampu membebaskan fosfat dari kalsium fosfat yang digunakan dalam media Pikovskaya tersebut.
Kemampuan tiap mikrob pelarut fosfat tumbuh dan melarutkan fosfat berbeda-beda yang diidentifikasi dari waktu terbentuk dan luas zona bening. Mikrob pelarut fosfat yang unggul akan menghasilkan diameter zona bening yang paling besar dibandingkan dengan koloni yang lainnya.
Pengukuran kemampuan kuantitatif pelarutan fosfat dari mikrob dilakukan dengan cara menumbuhkan biakan murni mikrob pelarut fosfat pada media cair Pikovskaya. Sumber fosfat Ca3(PO4)2 dapat diganti dengan fosfat alam atau senyawa fosfat tidak larut lainnya. Medium disterilisasi dalam autoklaf dan kemudian diinokulasi dengan mikrob pelarut fosfat. Selanjutnya biakan tersebut diinkubasi. Kandungan P terlarut dalam media pikovskaya cair diukur dengan menggunakan metode Bray-1.
2.3 Tanaman Sawi Sendok
Tanaman sawi sendok mampu tumbuh pada ketinggian 5-2000 mdpl sehingga dapat ditanam pada dataran tinggi maupun dataran rendah. Tanaman sawi sendok tahan terhadap air hujan oleh karena itu dapat ditanam sepanjang tahun. Meski demikian, jumlah air yang berlebihan dapat menyebabkan tanaman menjadi lebih cepat busuk terutama pada bagian akar. Tanaman sawi sendok ini memiliki potensial untuk dibudidayakan dan memiliki harga yang tinggi. Selain itu manfaat sawi sendok sangat baik untuk menghilangkan rasa gatal di tenggorokan pada penderita batuk, penyembuh penyakit kepala, bahan pembersih darah, memperbaiki fungsi ginjal, serta memperbaiki dan memperlancar pencernaan. Sedangkan kandungan yang terdapat pada sawi sendok adalah protein, lemak, karbohidrat, Ca, P, Fe, vitamin A, vitamin B, dan vitamin C (Aji, 2009).
2.4 Karakteristik Umum Latosol (Inceptisol)
dengan batas horison baur. Kejenuhan basa (NH4OAc) kurang dari 30% sekurang-kurangnya pada beberapa bagian dari horison B di penampang 125 cm dari permukaan. Tanah latosol tidak mempunyai horison diagnostik kecuali jika tertimbun oleh 50 cm atau lebih bahan baru. Selain horison A umbrik atau horison B kambik, tidak memperlihatkan gejala plintik di dalam penampang 125 cm dari permukaan dan tidak mempunyai sifat-sifat vertik.
III. BAHAN DAN METODE
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan mulai bulan Januari 2012 sampai Juni 2012 di Laboratorium Bioteknologi Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan serta lahan milik CV. Meori Agro Jl. Atang Sanjaya KM 4 Pasir Gauk, Bogor.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat
Alat-alat yang digunakan dalam penelitian ini antara lain laminar air flow,
autoclave, oven, mikroskop, spektrofotometer, refrigerator, inkubator, alat pengocok, timbangan, cawan petri, pipet, jarum ose, erlenmeyer, gelas ukur, tabung reaksi, kertas saring, aluminium foil, karet gelang, spidol, plastik, polibag, dan pot.
3.2.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini antara lain contoh tanah dari lahan milik CV. Meori Agro untuk mendapatkan isolat bakteri pelarut fosfat dari tanah, isolat bakteri koleksi CV. Meori Agro (Tabel 1), media SPA ( Sucrose Potatoes Agar ) sebagai media biakan isolat bakteri koleksi, media Pikovskaya, media Nutrient Broth, aquades, larutan fisiologis, larutan PB dan PC, larutan standar 50 ppm P, alkohol, bibit tanaman sawi sendok berumur 2 minggu, dan pupuk kandang.
Tabel 1. Asal Isolat Bakteri Pelarut Fosfat Koleksi
Kode Bakteri Asal Isolat
Burkholderia sp. PS4 Rizosfer Tanaman Nilam
Pseudomonas aeruginosa P2 Rizosfer Tanaman Kacang Tanah
3.3Metode Penelitian
3.3.1 Pengambilan Contoh Tanah
Pengambilan contoh tanah dilakukan di sekitar rizosfer tanaman jagung (± 2 kg) dengan metode komposit yang kemudian tanah tersebut dikeringudarakan.
3.3.2 Isolasi dan Pemurnian Bakteri Pelarut Fosfat dari Tanah
Tahapan isolasi dilakukan dengan memasukkan 10 gram tanah ke dalam tabung erlenmeyer yang berisi 90 ml larutan fisiologis, dikocok (120 rpm) selama 30 menit pada suhu ruang yang kemudian dibuat seri pengenceran sampai 10-5. Sebanyak 1 ml dari seri pengenceran 10-3 , 10-4 dan 10-5 dituang di atas permukaan media Pikovskaya padat, kemudian disebar secara merata menggunakan batang penyebar dan diinkubasi selama 2-3 hari. Selanjutnya tahap pemurnian dilakukan dengan memurnikan antara koloni bakteri dengan koloni fungi yang tumbuh dengan menggoreskan koloni bakteri pada media Pikovskaya padat yang baru pada cawan petri dengan menggunakan metode gores. Isolat bakteri yang telah dimurnikan kemudian diinkubasi selama 3-4 hari.
3.3.3 Peremajaan Isolat Bakteri Pelarut Fosfat Koleksi
Ketiga isolat bakteri koleksi CV. Meori Agro digoreskan pada media SPA menggunakan jarum ose. Perlakuan tersebut dilakukan di dalam laminar air flow
agar tidak terjadi kontaminasi.
3.3.4 Pengujian Kualitatif Isolat Bakteri Pelarut Fosfat dari Tanah dan Isolat Bakteri Pelarut Fosfat Koleksi
kemudian digoreskan pada media Pikovskaya. Pengamatan dilakukan sampai terbentuknya zona bening di sekitar bakteri yang menandakan terjadinya pelarutan fosfat. Isolat bakteri pelarut fosfat dari tanah yang telah diinkubasi 3-4 hari diamati pertumbuhannya. Uji kualitatif dilakukan dengan cara menghitung besarnya zona bening yang terbentuk dengan menggunakan Indeks Pelarutan (IP) (Gambar 1).
IP =
A BGambar 1. Indeks Pelarutan Fosfat Keterangan :
A = diameter zona bening B = diameter koloni bakteri
Koloni-koloni bakteri pelarut fosfat yang diinginkan selanjutnya dimurnikan dengan metode gores pada cawan petri dan disimpan di dalam medium agar miring Pikovskaya. Kemampuan mikrob melarutkan fosfat dijadikan dasar untuk pemilihan mikrob unggul. Mikrob pelarut fosfat yang paling unggul digunakan untuk pengujian selanjutnya.
3.3.5 Pengujian Kuantitatif Isolat Bakteri Pelarut Fosfat dari Tanah dan Isolat Bakteri Pelarut Fosfat Koleksi
diperoleh lalu ditambahkan 5 ml larutan PB dan 5 tetes larutan PC. Selain itu juga mempersiapkan larutan standar 50 ppm P (0 ppm – 10 ppm) dan ditambahkan pula 5 ml larutan PB dan 5 tetes larutan PC kemudian diukur dengan menggunakan spektrofotometer. Supernatan yang dihasilkan dari hasil sentrifus diukur pelarutan fosfatnya dengan menggunakan spektrofotometer dan dibandingkan dengan kontrol. Masing-masing perlakuan dilakukan dengan ulangan sebanyak tiga kali.
3.3.6 Metode Pengukuran P dalam Larutan
Supernatan yang dihasilkan diencerkan hingga 50 kali kemudian dianalisis P terlarut dengan menggunakan metode Bray-1. Analisis yang digunakan menggunakan larutan standar 50 ppm dengan seri pengenceran 0-10 ppm P. Larutan ini dibuat dari larutan baku yang mempunyai konsentrasi lebih tinggi kemudian diencerkan dengan larutan Bray-1. Sebanyak 5 ml larutan PB dan 5 tetes larutan PC ditambahkan ke dalam 5 ml supernatan. Jumlah P larut diidentifikasi melalui intensitas warna biru dari larutan dengan metode kolorimetri (fosfomolibdat). Intensitas warna biru dari larutan dibaca pada gelombang 660 nm dengan spektrofotometer (Sulaeman et al., 2005).
3.3.7 Uji Antagonis Isolat Bakteri Pelarut Fosfat dari Tanah dan Isolat Bakteri Pelarut Fosfat Koleksi jika dikombinasikan secara in vitro Bakteri-bakteri yang digunakan untuk uji antagonis yaitu isolat koleksi CV. Meori Agro (Burkholderia sp. PS4, Pseudomonas aeruginosa P2, Bacillus subtilis
Gambar 2. Metode Uji Antagonistik Dua Isolat Bakteri
Gambar 3. Metode Uji Antagonistik Tiga Isolat Bakteri
Isolat Bakteri 2
Petridisk Isolat Bakteri 1
Isolat Bakteri 2
Isolat Bakteri 1 Isolat Bakteri 3
Gambar 4. Metode Uji Antagonistik Empat Isolat Bakteri
3.3.8 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya pada Pertumbuhan Sawi Sendok
1. Persiapan Inokulan
Isolat koleksi maupun isolat asal tanah yang terpilih masing-masing dipindahkan ke dalam 100 ml media Nutrient Broth dengan menggunakan jarum ose untuk dibiakan di atas mesin pengocok selama 3 hari. Pada hari ketiga diukur nilai rapat optis suspensi tersebut dengan menggunakan spektrofotometer dengan panjang gelombang 660 nm untuk memperoleh jumlah sel per milimeter suspensi. Penentuan populasi sel ini dilakukan dengan memasukkan nilai rapat optis pada persamaan kurva baku masing-masing bakteri. Kurva baku ini digunakan untuk menghitung jumlah sel isolat yang akan diinokulasikan.
2. Penanaman dan Perlakuan Bibit Tanaman Sawi Sendok
Benih sawi sendok ditumbuhkan pada media tanah dan menggunakan pupuk kandang (5 g /polibag) hingga berumur dua minggu di persemaian. Kemudian bibit tanaman sawi sendok dipindahkan ke polibag dan diberi perlakuan bakteri dengan kepadatan bakteri 108 sel/ml dengan cara menuangkan suspensi pada permukaan tanah, lalu diletakkan di dalam rumah kaca dan diamati pertumbuhannya. Penyiraman dilakukan setiap hari dengan mempertahankan
Isolat Bakteri 3
Petridisk
Isolat Bakteri 1 Isolat Bakteri 2
kadar air tanah pada keadaan 80% kapasitas lapang. Pertumbuhan tanaman sawi sendok di rumah kaca diamati selama lima minggu. Kombinasi perlakuan bakteri dengan pupuk SP-36 dapat dilihat di Tabel Lampiran 21.
3. Pengamatan Pertumbuhan Tanaman Sawi Sendok di Rumah Kaca
Setelah tanaman sawi sendok mencapai masa akhir vegetatif (5 minggu setelah tanam), tanaman diambil untuk pengamatan tinggi tanaman, lebar daun, jumlah daun, biomassa segar dan kering serta kandungan P di dalam jaringan tanaman.
3.4 Rancangan Penelitian
Rancangan yang akan digunakan dalam penelitian ini adalah Rancangan Acak Lengkap dengan dua faktor perlakuan, yaitu :
1. Pemberian isolat bakteri pelarut fosfat, terdiri dari 16 taraf, yaitu isolat bakteri kode IS9, J2, P2, PS4, J2+IS9, J2+PS4, P2+IS9, P2+J2, P2+PS4, PS4+IS9, J2+PS4+IS9, P2+J2+IS9, P2+J2+PS4, P2+PS4+IS9, P2+J2+PS4+IS9, dan kontrol (tanpa isolat bakteri pelarut fosfat).
Keterangan : IS9 (Burkholderia sp.), P2 (Pseudomonas aeruginosa), J2 (Bacillussubtilis), dan PS4 (Burkholderia sp.).
2. Pemberian dosis pupuk SP-36, terdiri dari 3 taraf, 50% dosis pupuk SP-36 (0,059 g/polibag), 75% dosis pupuk SP-36 (0,089 g/polibag), dan 100% dosis pupuk SP-36 (0,118 g/polibag).
Percobaan diulang sebanyak 3 kali, sehingga diperoleh 16 x 3 x 3 = 144 satuan percobaan.
Menurut Gaspersz (1991) model statistika untuk percobaan dengan menggunakan rancangan acak lengkap (RAL) faktorial adalah sebagai berikut :
Yijk = µ + αi + βj + (αβ)ij + E(ij)k
Di mana : µ : Rata-rata (nilai tengah) respon
βj : Efek dari pengaruh faktor perlakuan pada taraf ke-j
(αβ)ij : Pengaruh interaksi antara faktor perlakuan ke-i dan faktor perlakuan ke-j
Eij : Pengaruh komponen galat atau error dari faktor perlakuan ke-i dan faktor perlakuan ke-j pada ulangan ke-k
Yijk : Respon terhadap perlakuan faktor ke-i dan faktor ke-j pada ulangan ke-k
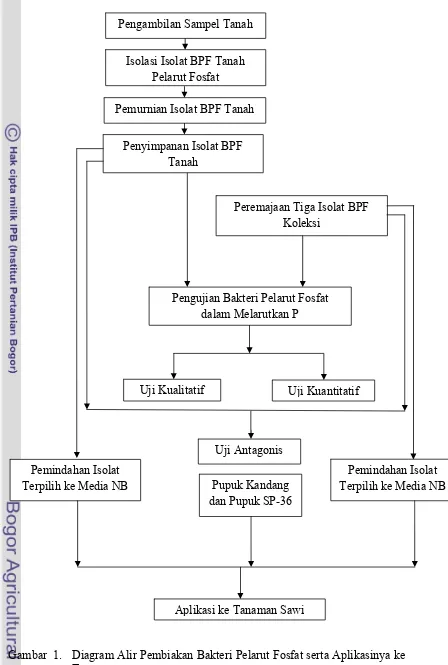
Gambar 1. Diagram Alir Pembiakan Bakteri Pelarut Fosfat serta Aplikasinya ke Isolasi Isolat BPF Tanah
Pelarut Fosfat
Pemurnian Isolat BPF Tanah
Pengujian Bakteri Pelarut Fosfat dalam Melarutkan P Penyimpanan Isolat BPF
Tanah
Uji Kualitatif Uji Kuantitatif Peremajaan Tiga Isolat BPF
Koleksi Pengambilan Sampel Tanah
Uji Antagonis
Pemindahan Isolat Terpilih ke Media NB Pemindahan Isolat
Terpilih ke Media NB Pupuk Kandang dan Pupuk SP-36
IV. HASIL DAN PEMBAHASAN
4.1 Analisis Tanah
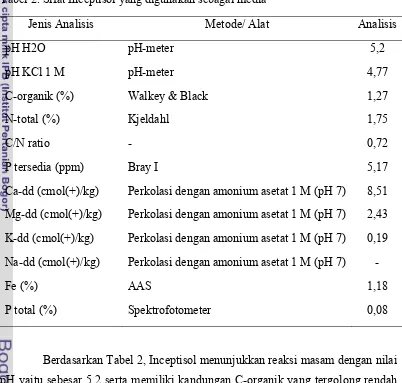
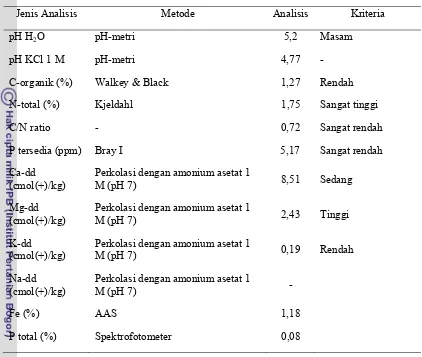
Hasil analisis sifat-sifat kimia dan fisik tanah awal (Inceptisol) disajikan pada Tabel 2 dan kriteria penilaian analisis sifat kimia tanah (PPT 1983) yang digunakan disajikan pada Tabel Lampiran 1.
Tabel 2. Sifat Inceptisol yang digunakan sebagai media
Jenis Analisis Metode/ Alat Analisis
pH H2O pH-meter 5,2
pH KCl 1 M pH-meter 4,77
C-organik (%) Walkey & Black 1,27
N-total (%) Kjeldahl 1,75
C/N ratio - 0,72
P tersedia (ppm) Bray I 5,17
Ca-dd (cmol(+)/kg) Perkolasi dengan amonium asetat 1 M (pH 7) 8,51 Mg-dd (cmol(+)/kg) Perkolasi dengan amonium asetat 1 M (pH 7) 2,43 K-dd (cmol(+)/kg) Perkolasi dengan amonium asetat 1 M (pH 7) 0,19 Na-dd (cmol(+)/kg) Perkolasi dengan amonium asetat 1 M (pH 7) -
Fe (%) AAS 1,18
P total (%) Spektrofotometer 0,08
berada pada daerah dengan curah hujan dan suhu yang relatif tinggi sehingga lapisan yang kaya bahan organik hilang tererosi.
Kandungan N-total pada tanah ini tergolong sangat tinggi, hal ini diduga karena terjadinya mineralisasi unsur N yang tinggi. Kandungan P-tersedia pada tanah ini sangat rendah diduga karena pH tanahnya rendah. Pada tanah masam, P difiksasi oleh Al dan Fe membentuk senyawa Al-P dan Fe-P yang tidak larut. Semakin rendah pH maka semakin tinggi jumlah konsentrasi ion Al, Fe, dan Mn yang dapat larut. Akibatnya semakin tinggi jumlah P yang diikat oleh Al dan Fe.
Nilai kandungan K dan Na pada tanah ini rendah karena adanya pencucian basa-basa yang relatif tinggi akibat adanya curah hujan yang tinggi. Nilai kandungan Ca tergolong sedang, sedangkan nilai kandungan Mg tergolong tinggi.
4.2 Isolasi Bakteri Pelarut Fosfat dan Uji Kemampuan Pelarutan Fosfat Hasil isolasi dan seleksi dari contoh tanah Inceptisol yang digunakan diperoleh sembilan isolat bakteri pelarut fosfat. Bakteri pelarut fosfat yang diisolasi dari tanah Inceptisol Semplak diukur kemampuannya dalam melarutkan P dengan menggunakan media Pikovskaya padat (uji kualitatif) dan cair (uji kuantitatif).
Tabel 3. Indeks Pelarutan P Bakteri Pelarut Fosfat Asal Tanah Inceptisol
Kode Bakteri
Tabel 4. Konsentrasi Pelarutan P Bakteri Pelarut Fosfat Asal Tanah Inceptisol pada Hari ke-5
Kode Bakteri ppm P
Kontrol (tanpa bakteri) 27,51
IS1 294,66
Berdasarkan uji kemampuan pelarutan fosfat secara kualitatif (Tabel 3) dan kuantitatif (Tabel 4), isolat bakteri IS9 memiliki kemampuan pelarutan fosfat yang paling unggul dibandingkan dengan isolat bakteri lainnya. Isolat bakteri IS9 selanjutnya dipilih untuk pengujian selanjutnya bersama dengan isolat bakteri koleksi CV. Meori Agro Burkholderia sp. PS4, Pseudomonas aeruginosa P2, dan
Bacillus subtilis J2. Berdasarkan hasil penelitian Tombe (2012), hasil analisis sekuen gen 16S rRNA menunjukkan bahwa isolat bakteri IS9 memiliki kemiripan sebesar 99% dengan Burkholderia sp. strain R-24196. Tabel 5 menunjukkan indeks pelarutan P isolat bakteri asal tanah yang terpilih dan isolat bakteri koleksi CV. Meori Agro.
Tabel 5. Indeks Pelarutan P Bakteri Pelarut Fosfat yang Terpilih
Kode Bakteri
Indeks Pelarutan (IP) P
Hari ke-
1 2 3 4 5 6 7
Burkholderia sp. IS9 1,55 1,93 2,05 2,16 2,24 2,28 2,47
Bacillus subtilis J2 0 0 0 0 1,00 1,12 1,12
Pseudomonas aeruginosa P2 1,15 1,30 1,32 1,33 1,35 1,39 1,41
Isolat yang menunjukkan zona bening terbesar selama pengamatan satu minggu adalah Burkholderia sp. IS9 dengan indeks pelarutan sebesar 2,47 dan indeks pelarutan terkecil adalah Bacillus subtilis J2 sebesar 1,12. Semakin besar indeks pelarutannya maka semakin besar jumlah P yang dilarutkan.
Berdasarkan Tabel 5 dapat dilihat bahwa semakin hari indeks pelarutan P semakin meningkat. Dilihat dari indeks pelarutan P yang dihasilkan dapat diketahui bahwa kemampuan bakteri dalam melarutkan fosfat bervariasi. Luas zona bening secara kualitatif menunjukkan besar kecilnya kemampuan bakteri melarutkan P dari fosfat tak larut (Rachmiati, 1995). Tatiek (1991) juga mengemukakan bahwa zona bening pada media padat tidak dapat menunjukkan banyak sedikitnya jumlah P terlarut yang dapat disumbangkan oleh setiap bakteri, meskipun luas sempitnya daerah bening dapat menunjukkan besar kecilnya kemampuan bakteri melarutkan P sukar larut. Pada uji kemampuan perlarutan P secara kuantitatif, Burkholderia sp. IS9 memiliki kemampuan melarutkan fosfat pada media Pikovskaya cair paling tinggi dibandingkan isolat bakteri lainnya (Tabel 6).
Tabel 6. Konsentrasi Pelarutan P Bakteri Pelarut Fosfat yang Terpilih
Bakteri
Keterangan : Angka-angka yang diikuti huruf yang sama pada kolom yang sama untuk bakteri menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5%.
adanya penurunan jumlah populasi sel bakteri yang akan mempengaruhi aktivitas bakteri dalam melarutkan P. Hawker (1950) menyatakan bahwa fosfat harus disuplai dengan jumlah yang cukup dalam media untuk proses fosforilasi karbohidrat dan pembentukan energi. Kemampuan bakteri pelarut fosfat dalam melarutkan fosfat berbeda-beda tergantung jenis strain (Tatiek, 1991). Hasil pengukuran fosfat terlarut pada kontrol (tanpa bakteri) menunjukkan adanya fosfat terlarut. Hal ini diduga disebabkan adanya pengaruh pemanasan pada proses sterilisasi autoklaf yang mengakibatkan terpecahnya ikatan Ca-fosfat pada media secara fisik menjadi bentuk fosfat terlarut.
Tabel 7. pH Media Kultur Pelarutan P secara Kuantitatif
Kode Bakteri
pH media kultur
Hari ke-
1 2 3 4 7
Kontrol (tanpa bakteri) 5,60 5,50 6,00 5,90 5,70
Burkholderia sp. IS9 4,00 3,80 4,60 4,05 4,55
Bacillus subtilis J2 5,00 4,95 5,10 4,95 4,75
Pseudomonas aeruginosa P2 4,60 4,50 5,10 4,80 5,10
Burkholderia sp. PS4 3,85 5,45 5,50 6,40 6,30
Pelarutan fosfat secara kuantitatif pada media Pikovskaya cair diikuti juga oleh penurunan pH media kultur. Hasil penelitian memperlihatkan pH pada kultur
Burkholderia sp. IS9, Pseudomonas aeruginosa P2, Bacillus subtilis J2 menurun saat 2 hari inokulasi. Nilai pH pada kultur Burkholderia sp. PS4 masih terjadi kenaikan kemudian cenderung menurun pada hari ke tujuh (Tabel 7). Adanya kenaikan pH pada kultur Burkholderia sp. PS4 pada hari ke- 1 sampai hari ke-4 diduga karena penurunan jumlah sel Burkholderia sp. PS4 sehingga aktivitas
4.3 Uji Antagonistik Bakteri Pelarut Fosfat secara in vitro
Pengujian antagonis Burkholderia sp. IS9, Pseudomonas aeruginosa P2,
Bacillus subtilis J2, dan Burkholderia sp. PS4 dilakukan dengan metode uji berpasangan pada media SPA baik secara tunggal maupun kombinasi. Uji antagonistik secara tunggal, kombinasi dua dan tiga strain bakteri tidak menunjukkan adanya sifat antagonis (Gambar Lampiran 1). Hasil dari uji antagonistik empat strain isolat bakteri pelarut fosfat menunjukkan bahwa empat strain isolat bakteri pelarut fosfat tidak bersifat antagonis satu dengan yang lainnya (Gambar 5). Hal ini menunjukkan bahwa keempat strain bakteri pelarut fosfat dapat hidup secara bersama-sama tanpa adanya isolat bakteri yang menekan pertumbuhan satu dengan yang lainnya.
Gambar 5. Uji Antagonistik Empat strain Bakteri Pelarut Fosfat
4.4 Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya pada Pertumbuhan Tanaman Sawi Sendok
4.4.1. Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Tinggi Tanaman Sawi Sendok
meningkatkan tinggi tanaman sebesar 15% dibandingkan dengan kontrol pada 5 MST.
Tabel 8. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dengan Pupuk SP-36 terhadap Tinggi Tanaman Sawi Sendok pada 5 MST
Kode Bakteri Dosis Pupuk SP 36 Rata-rata
50% 75% 100%
...Tinggi Tanaman (cm)...
Kontrol (tanpa bakteri) 29,03 bB 28,00 bB 26,27 bAB 27,77
Burkholderia sp. IS9 27,50 bAB 22,67 abAB 26,70 bAB 25,62
Bacillus subtilis J2 23,53 abAB 23,67 abAB 23,37 abAB 23,52
Pseudomonas aeruginosa P2 28,50 bB 22,00 abAB 19,67 aA 23,39
Burkholderia sp. PS4 30,63 cC 21,33 aAB 23,43 abAB 25,13
J2+IS9 15,83 aA 21,50 aAB 25,83 bAB 21,05
Keterangan : Angka-angka yang diikuti huruf besar yang sama (kolom) dan huruf kecil yang sama (baris) menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5 %.
Perlakuan Burkholderia sp. PS4 dengan 50% dosis pupuk SP-36 meningkatkan tinggi tanaman lebih besar dibandingkan dengan perlakuan kombinasi bakteri P2+J2 dengan 100% dosis pupuk SP-36. Hal ini menunjukkan bahwa Burkholderia sp. PS4 mampu mengurangi dosis pemakaian pupuk SP-36 dan meningkatkan tinggi tanaman paling besar dibandingkan dengan perlakuan lainnya.
kinetin tidak memberikan pengaruh yang nyata terhadap peningkatan tinggi tanaman padi gogo dari mulai 2 MST sampai 5 MST, tetapi ada beberapa perlakuan isolat bakteri pelarut fosfat yang dapat meningkatkan tinggi tanaman padi gogo.
4.4.2. Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Lebar Daun Tanaman Sawi Sendok
Berdasarkan Tabel 9 menunjukkan Perlakuan Burkholderia sp. PS4 meningkatkan lebar daun paling tinggi dibandingkan dengan perlakuan lainnya pada 5 MST.
Tabel 9. Pengaruh Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Lebar Daun Tanaman Sawi Sendok pada 5 MST
Perlakuan Lebar Daun (cm)
Kode Bakteri
Kontrol (tanpa bakteri) 6,30 abc
Burkholderia sp. IS9 5,98 abc
Bacillus subtilis J2 5,56 abc
Pseudomonas aeruginosa P2 5,69 abc
Burkholderia sp. PS4 7,94 d
J2+IS9 5,44 abc
P2+J2+PS4+IS9 6,30 abc
Dosis Pupuk SP-36
50% 5,49 a
75% 5,20 a
100% 6,15 b
Keterangan : Angka-angka yang diikuti huruf yang sama pada kolom yang sama untuk perlakuan bakteri atau pupuk SP-36 menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5%.
SP-36 memberikan pengaruh nyata terhadap lebar daun dibandingkan dengan kontrol pada 4 MST (Tabel Lampiran 9).
4.4.3. Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Jumlah Daun Tanaman Sawi Sendok
Perlakuan bakteri pelarut fosfat dan pupuk SP-36 masing-masing meningkatkan jumlah daun tanaman sawi sendok, namun tidak terdapat interaksi antara keduanya (Tabel 10).
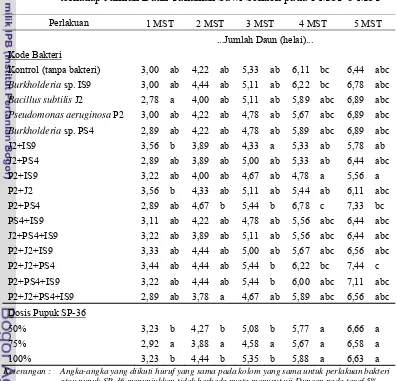
Tabel 10. Pengaruh Perlakuan Bakteri Pelarut Fosfat dengan Pupuk SP-36 terhadap Jumlah Daun Tanaman Sawi Sendok pada 1 MST-5 MST
Perlakuan 1 MST 2 MST 3 MST 4 MST 5 MST
Pseudomonas aeruginosa P2 3,00 ab 4,22 ab 4,78 ab 5,67 abc 6,89 abc
Burkholderia sp. PS4 2,89 ab 4,22 ab 4,78 ab 5,89 abc 6,89 abc
Keterangan : Angka-angka yang diikuti huruf yang sama pada kolom yang sama untuk perlakuan bakteri atau pupuk SP-36 menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5%.
menunjukkan bahwa adanya interaksi antara Pseudomonas aeruginosa P2,
Bacillus subtilis J2, dan Burkholderia sp. PS4 dalam meningkatkan pertumbuhan tanaman sawi sendok. Secara umum perlakuan bakteri dengan pupuk SP-36 tidak berpengaruh nyata terhadap jumlah daun. Hal ini juga terlihat di parameter tinggi tanaman dan lebar daun. Hal ini mungkin dikarenakan unsur P tersedia rendah sehingga tanaman tidak dapat menyerap P untuk pertumbuhan tanaman.
4.4.4. Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Bobot Basah Tanaman Sawi Sendok
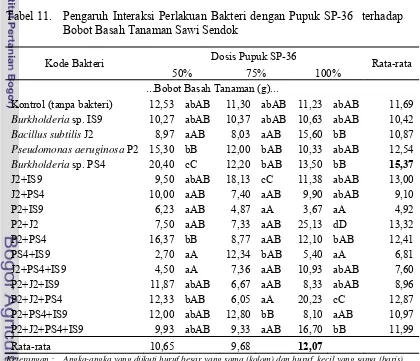
Berdasarkan Tabel 11, perlakuan kombinasi bakteri J2+IS9 dengan 75% dosis pupuk SP-36 meningkatkan bobot basah tanaman sebesar 60,4% dibandingkan kontrol. Perlakuan Burkholderia sp. PS4 dengan 50% dosis pupuk SP-36 meningkatkan bobot basah tanaman sebesar 63% dibandingkan kontrol.
Tabel 11. Pengaruh Interaksi Perlakuan Bakteri dengan Pupuk SP-36 terhadap Bobot Basah Tanaman Sawi Sendok
Kode Bakteri Dosis Pupuk SP-36 Rata-rata
50% 75% 100% ...Bobot Basah Tanaman (g)...
Kontrol (tanpa bakteri) 12,53 abAB 11,30 abAB 11,23 abAB 11,69
Burkholderia sp. IS9 10,27 abAB 10,37 abAB 10,63 abAB 10,42
Bacillus subtilis J2 8,97 aAB 8,03 aAB 15,60 bB 10,87
Pseudomonas aeruginosa P2 15,30 bB 12,00 bAB 10,33 abAB 12,54
Burkholderia sp. PS4 20,40 cC 12,20 bAB 13,50 bB 15,37
Perlakuan kombinasi bakteri P2+J2 dengan 100% dosis pupuk SP-36 meningkatkan bobot basah tanaman sebesar 123,8% dibandingkan dengan kontrol. Secara umum perlakuan Burkholderia sp. PS4 dan 100% dosis pupuk SP-36 memberikan bobot basah yang paling tinggi dibandingkan dengan perlakuan lainnya. Perlakuan kombinasi empat strain bakteri tidak memberikan pengaruh yang lebih baik dibandingkan dengan perlakuan yang tunggal ataupun kombinasi dua dan tiga strain bakteri. Hal ini diduga tidak adanya interaksi yang baik dari keempat strain bakteri dalam meningkatkan pertumbuhan tanaman.
4.4.5. Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Bobot Kering Tanaman Sawi Sendok
Tabel 12 menunjukkan bahwa perlakuan Burkholderia sp. PS4 dengan 50% dosis pupuk SP-36 berpengaruh nyata terhadap bobot kering dibandingkan dengan kontrol. Hal ini menunjukkan bahwa Burkholderia sp. PS4 mampu mengurangi 50% dosis pemakaian pupuk SP-36.
Tabel 12. Pengaruh Interaksi Perlakuan Bakteri dengan Pupuk SP-36 terhadap Bobot Kering Tanaman Sawi Sendok
Kode Bakteri Dosis Pupuk SP-36 Rata-rata
50% 75% 100% ...Bobot Kering Tanaman (g)
Kontrol (tanpa bakteri) 0,86 bB 0,88 bB 0,93 bB 0,89
Burkholderia sp. IS9 0,72 abAB 0,60 aAB 0,84 bB 0,72
Bacillus subtilis J2 0,55 aAB 0,57 aAB 0,88 bB 0,67
Pseudomonas aeruginosa P2 1,10 bB 0,86 bB 0,62 aAB 0,86
Burkholderia sp. PS4 1,17 cC 0,75 abAB 0,87 bB 0,93
Keterangan : Angka-angka yang diikuti huruf besar yang sama (kolom) dan huruf kecil yang sama (baris) menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5 %.
Perlakuan kombinasi bakteri P2+J2 dengan 100% dosis pupuk SP-36 berbeda nyata terhadap bobot kering dibandingkan kontrol. Secara umum perlakuan Burkholderia sp. PS4 dan 100% dosis pupuk SP-36 memberikan bobot kering yang paling tinggi dibandingkan dengan perlakuan lainnya.
4.4.6. Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Ketersediaan P dalam Tanah
Berdasarkan Tabel 13 menunjukkan bahwa adanya interaksi perlakuan bakteri dengan pupuk SP-36 terhadap ketersediaan P dalam tanah.
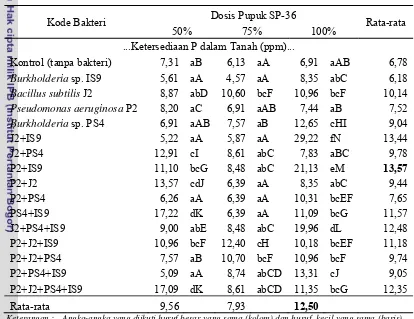
Tabel 13. Pengaruh Interaksi Perlakuan Bakteri dengan Pupuk SP-36 terhadap Ketersediaan P dalam Tanah
Kode Bakteri Dosis Pupuk SP-36 Rata-rata
50% 75% 100% ...Ketersediaan P dalam Tanah (ppm)...
Kontrol (tanpa bakteri) 7,31 aB 6,13 aA 6,91 aAB 6,78
Burkholderia sp. IS9 5,61 aA 4,57 aA 8,35 abC 6,18
Bacillus subtilis J2 8,87 abD 10,60 bcF 10,96 bcF 10,14
Pseudomonas aeruginosa P2 8,20 aC 6,91 aAB 7,44 aB 7,52
Burkholderia sp. PS4 6,91 aAB 7,57 aB 12,65 cHI 9,04
Keterangan : Angka-angka yang diikuti huruf besar yang sama (kolom) dan huruf kecil yang sama (baris) menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5 %.
P2+IS9 dan 100% dosis pupuk SP-36 memberikan ketersediaan P dalam tanah yang paling tinggi dibandingkan dengan perlakuan lainnya. Perlakuan kombinasi empat strain bakteri tidak memberikan pengaruh yang lebih baik terhadap ketersediaan P dibandingkan dengan perlakuan tunggal maupun kombinasi dua dan tiga strain bakteri.
4.4.7. Pengaruh Bakteri Pelarut Fosfat serta Kombinasinya terhadap Kandungan P dalam Tanaman Sawi Sendok
Pengaruh interaksi perlakuan bakteri pelarut fosfat dengan pupuk SP-36 terhadap kandungan P dalam tanaman ditunjukkan pada Tabel 14.
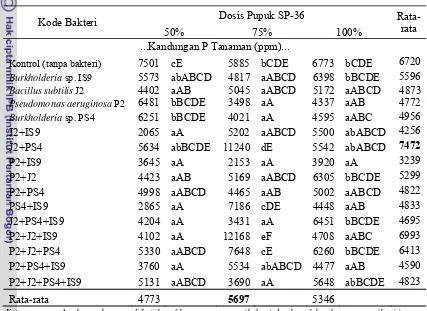
Tabel 14. Pengaruh Interaksi Perlakuan Bakteri dengan Pupuk SP-36 terhadap Kandungan P dalam Tanaman Sawi Sendok
Kode Bakteri Dosis Pupuk SP-36
Rata-rata 50% 75% 100% ...Kandungan P Tanaman (ppm)...
Kontrol (tanpa bakteri) 7501 cE 5885 bCDE 6773 bCDE 6720
Burkholderia sp. IS9 5573 abABCD 4817 aABCD 6398 bBCDE 5596
Bacillussubtilis J2 4402 aAB 5045 aABCD 5172 aABCD 4873
Pseudomonas aeruginosa P2 6481 bBCDE 3498 aA 4337 aAB 4772
Burkholderia sp. PS4 6251 bBCDE 4021 aA 4595 aABC 4956
J2+IS9 2065 aA 5202 aABCD 5500 abABCD 4256
J2+PS4 5634 abBCDE 11240 dE 5542 abABCD 7472
P2+IS9 3645 aA 2153 aA 3920 aA 3239
P2+PS4+IS9 3760 aA 5534 abABCD 4477 aAB 4590
P2+J2+PS4+IS9 5131 aABCD 3690 aA 5648 abBCDE 4823
Rata-rata 4773 5697 5346
Keterangan : Angka-angka yang diikuti huruf besar yang sama (kolom) dan huruf kecil yang sama (baris) menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5 %.
kemampuan bakteri pelarut fosfat dalam inokulan tersebut yang diinokulasikan pada tanaman (Widawati, 2005). Efektivitas bakteri pelarut fosfat dengan pemupukan dosis tertentu mampu meningkatkan kandungan P dalam tanaman.
Perlakuan kombinasi empat strain bakteri tidak memberikan pengaruh yang lebih baik terhadap kandungan P tanaman dibandingkan dengan perlakuan lainnya. Hal ini juga terjadi pada parameter tinggi tanaman, jumlah daun, bobot kering, bobot basah, dan ketersediaan P dalam tanah. Hal ini mungkin disebabkan oleh beberapa hal diantaranya terjadi persaingan yang lebih tinggi dalam mendapatkan unsur hara antara empat strain bakteri tersebut dibandingkan dengan perlakuan tunggal maupun kombinasi dua dan tiga strain bakteri. Selain itu, persaingan yang bersifat parasitik antara bakteri yang diinokulasikan dengan mikrob asli tanah tersebut (indigenous microbe) mungkin terjadi. Persaingan juga bisa terjadi antara mikrob tanah dengan perakaran dalam mendapatkan unsur hara. Tanah yang digunakan dalam percobaan ini berpotensi terjadi persaingan yang bersifat parasitik antara bakteri yang diinokulasikan dengan mikrob asli tanah karena tanah yang digunakan bersifat tidak steril. Pada saat aplikasi di tanah yang tidak steril, bakteri yang diinokulasikan harus mampu berkompetisi dengan mikrob indigenous tanah tersebut.
Pemberian bakteri juga sangat tergantung pada kondisi rizosfer serta kondisi ekologi setempat. Bakteri yang diinokulasikan harus mampu terlebih dahulu beradaptasi dengan kondisi setempat yang baru kemudian membantu meningkatkan pertumbuhan tanaman. Efektifitas bakteri pelarut fosfat dalam melarutkan unsur P yang terikat juga sangat berkaitan dengan cara beradaptasi bakteri pelarut fosfat dengan lingkungannya. Dikemukakan oleh Rao (1982), bahwa lingkungan yang baik dan cocok untuk jenis bakteri pelarut fosfat tertentu akan meningkatkan aktivitasnya dalam mengeluarkan asam-asam organik, enzim, dan hormon-hormon tumbuh untuk melarutkan unsur P tanah.
yang berbeda-beda. Ada beberapa bakteri yang mampu beradaptasi dan bertahan, ada juga bakteri yang tidak mampu beradaptasi dan akhirnya mati. Seperti dikemukakan oleh (Supriyo et al., 1992) aktivitas bakteri pelarut fosfat tetap tergantung pada lingkungannya, seperti jenis vegetasi, kelembaban, suhu, aerasi, dan reaksi tanah.
Secara umum pengaruh bakteri pelarut fosfat pada pertumbuhan tanaman sawi sendok, perlakuan Burkholderia sp. PS4 dengan 50% dosis pupuk SP-36 meningkatkan tinggi tanaman, bobot basah dan bobot kering tanaman. Hasil ini menunjukkan bahwa Burkholderia sp. PS4 mampu mengurangi penggunaan pupuk SP-36. Pada parameter pertumbuhan tanaman sawi sendok yang diamati ada beberapa data perlakuan yang tidak konsisten, hal ini dikarenakan adanya ketidakseragaman bibit tanaman sawi sendok yang digunakan. Oleh sebab itu terjadi keragaman pertumbuhan tanaman sawi sendok.
V. KESIMPULAN DAN SARAN
Kesimpulan
1. Bakteri Pelarut Fosfat Burkholderia sp. PS4, Pseudomonas aeruginosa P2,
Bacillussubtilis J2 dan Burkholderia sp. IS9 mampu melarutkan fosfat. 2. Bakteri Pelarut Fosfat Burkholderia sp. PS4, Pseudomonas aeruginosa P2,
Bacillus subtilis J2 dan Burkholderia sp. IS9 dikombinasikan secara in vitro tidak mempunyai sifat antagonistik.
3. Perlakuan Burkholderia sp. PS4 memberikan pengaruh yang paling baik terhadap tinggi tanaman, bobot basah, dan bobot kering tanaman serta dapat mengurangi 50% dosis pemakaian pupuk SP-36.
4. Perlakuan kombinasi bakteri P2+J2 lebih efektif dikombinasikan dengan 100% dosis pupuk SP-36 dalam meningkatkan pertumbuhan tanaman sawi sendok.
5. Perlakuan kombinasi empat strain bakteri tidak memberikan pengaruh yang lebih baik dibandingkan dengan perlakuan isolat tunggal maupun kombinasi dua dan tiga strain bakteri.
Saran
DAFTAR PUSTAKA
Aji, W. 2009. Fisiologi Tanaman Sawi Sendok. http: //unimed. academia.edu/Fisiologi_tanaman_sawi_sendok. (12 Januari 2012).
Alexander, M. 1997. Introduction to Soil Mycrobiology. 2nd Ed. John Wiley and Sons. New York. 467 p.
Arshad, M. and W.T. Frankenberger. 1993. Microbial production of plant growth regulators. p. 307-347. In F.B. Metting (Ed.). Soil Microbial Ecology. Marcel Dekker, Inc. New York, Bassel, Hongkong.
Asea, P.E.A., R.M.N. Kucey, and J.W.B. Stewart. 1988. Inorganic phosphate solubilization by two Penicillium species in solution culture and soil. Soil Biol. Biochem. 20: 459-464.
Buckman, H.O. and N.C. Brady. 1956. The Nature and Properties of Soils. 5th ed. Macmillan, New York.
Cunningham, JE. and C. Kuiack. 1992. Production of citric and oxalic acid and solubilization of calsium phosphate by Penicillium bilail. Appl. Environ. Microbial. 58:1451-1458
Fitriatin, B. N. 2004. Peranan Bakteri Pelarut Fosfat Penghasil Fitohormon dalam Meningkatkan Pertumbuhan dan Hasil Tanaman Padi Gogo. Fakultas Pertanian Universitas Padjadjaran. Bandung.
Hardjowigeno, S. 1987. Ilmu Tanah. Akademika Pressindo. Jakarta.
Havlin, J.L., J.D. Beaton, S.L. Tisdale, W.L. Nelson. 1999. Soil Fertility and Fertilizer. Sixth Ed. Prentice-Hall, Inc. New Jersey. 499 pp.
Joner, E. J., I. M. Aarle, and M. Vosatka. 2000. Phosphatase activity of extraradical arbuscular mycorrhiza hyphae: a review. Plant Soil 226: 199-210.
Jones, U. S. 1982. Fertilizers and Soil Fertility. 2nd ed. Reston Publ. Co. Reston, Virginia.
Kucey, R. M. N. 1983. Phosphate-solubilizing bacteria and fungi in various cultivated and virgin Alberta soils. Can. J. Soil Sci. 63:671-678.
Lal, L. 2002. Phosphate biofertilizers. Agrotech. Publ. Academy, Udaipur. India. 224p.
Leiwakabessy, F.M. 2003. Kesuburan Tanah. Institut Pertanian Bogor. Bogor. Lynch, J. M. 1983. Soil Biotechnology: Blackwell Sci. Pub. Co., London. 191p. Patten, C.L. and B. R. Glick. 1996. Bacterial biosynthesis of indole-3-acetic acid.
Can. J. Microbiol. 42; 207-220.
Rachmiati, Y. 1995. Bakteri pelarut fosfat dan rizosfer tanaman dan kemampuannya dalam melarutkan fosfat. Proseding Kongres Nasional VI HITI, Jakarta, 12-15 Desember 1995.
Rao, N.S. 1982. Mikrob Tanah dan Pertumbuhan Tanaman. Edisi ke-2 Penerbit UI.
Richardson. A. E. 2001. Prospect for using soil microorganism to improve the a quisition of phosphoprus by plants. Aust. J. Plant Physol. 58:797-906. Subba Rao, N.S. 1982. Biofertilizer Agriculture. Oxford and IBH Publishing Co.
New Delhi. 86 pp.
____________. 1994. Soil Microorganism and Plant Growth. Oxford and IBH Publishing Co. London. 353 pp.
Sulaeman, Suparta, Eviati. 2005. Analisis Kimia Tanah, Tanaman, Air, dan Pupuk. Balai Penelitian Tanah. Bogor.
Tatiek, H. 1991. Bakteri pelarut fosfat asal beberapa jenis tanah dan efeknya terhadap pertumbuhan dan hasil jagung (Zea mays L.) [Disertasi] Universitas Padjadjaran. Bandung.
Thomas, G. V. 1985. Occurence and availability of phosphate-solubilizing fungi from coconut plant soils. Plant Soil 87:57-364.
Tisdale, S. L., Nelson, W. L., Beaton, J. D., 1985. Soil Fertility and Fertilizer. New York : Macmillan Publising Company.
Widawati, S dan Sulasih. 2005. Augmentasi bakteri pelarut fosfat (BPF) potensial sebagai pemacu pertumbuhan caisin (Brassica caventis Oed.) di tanah marginal. Pusat Penelitian Biologi LIPI. Bogor.
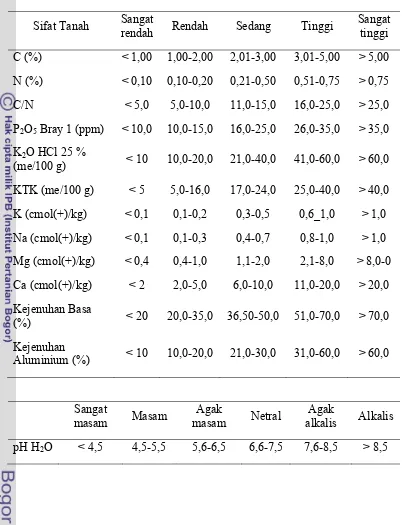
Tabel Lampiran 1. Hasil Analisis Kimia Tanah Inceptisol Berdasarkan Kriteria Pusat Penelitian Tanah 1983
Jenis Analisis Metode Analisis Kriteria
pH H2O pH-metri 5,2 Masam
Perkolasi dengan amonium asetat 1
M (pH 7) 8,51 Sedang
Mg-dd (cmol(+)/kg)
Perkolasi dengan amonium asetat 1
M (pH 7) 2,43 Tinggi
K-dd
(cmol(+)/kg)
Perkolasi dengan amonium asetat 1
M (pH 7) 0,19 Rendah
Na-dd (cmol(+)/kg)
Perkolasi dengan amonium asetat 1
Tabel Lampiran 2. Kriteria Berdasarkan Penilaian Sifat-Sifat Kimia Tanah Pusat Penelitian Tanah 1983
Sifat Tanah Sangat
Tabel Lampiran 3. Hasil Analisis Kimia Pupuk Kompos
Jenis Analisis Metode Hasil Analisis
N (%) Kjeldahl 2,14
C-organik (%) Spektrofotometri 33,56
P total (%) Spektrofotometri 0,36
P tersedia (%) Spektrofotometri 0,09
K (%) AAS 0,19
pH pH metri 7,27
C/N ratio - 15,68
Tabel Lampiran 4. Hasil Analisis Pupuk SP-36
Jenis Analisis Metode Hasil Analisis
P total (%) Spektrofotometri 23,02
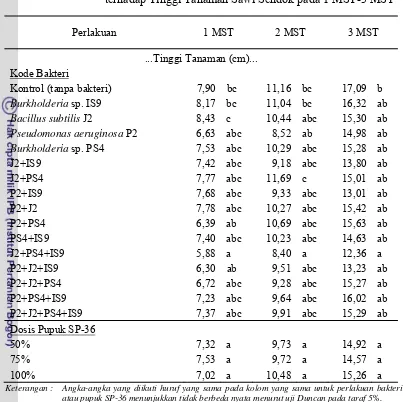
Tabel Lampiran 5. Pengaruh Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Tinggi Tanaman Sawi Sendok pada 1 MST-3 MST
Perlakuan 1 MST 2 MST 3 MST
...Tinggi Tanaman (cm)... Kode Bakteri
Kontrol (tanpa bakteri) 7,90 bc 11,16 bc 17,09 b
Burkholderia sp. IS9 8,17 bc 11,04 bc 16,32 ab
Bacillus subtilis J2 8,43 c 10,44 abc 15,30 ab
Pseudomonas aeruginosa P2 6,63 abc 8,52 ab 14,98 ab
Burkholderia sp. PS4 7,53 abc 10,29 abc 15,28 ab
J2+IS9 7,42 abc 9,18 abc 13,80 ab
J2+PS4 7,77 abc 11,69 c 15,01 ab
P2+IS9 7,68 abc 9,33 abc 13,01 ab
P2+J2 7,78 abc 10,27 abc 15,42 ab
P2+PS4 6,39 ab 10,69 abc 15,63 ab
PS4+IS9 7,40 abc 10,23 abc 14,63 ab
J2+PS4+IS9 5,88 a 8,40 a 12,36 a
P2+J2+IS9 6,30 ab 9,51 abc 13,23 ab
P2+J2+PS4 6,72 abc 9,28 abc 15,27 ab
P2+PS4+IS9 7,23 abc 9,64 abc 16,02 ab
P2+J2+PS4+IS9 7,37 abc 9,91 abc 15,29 ab
Dosis Pupuk SP-36
50% 7,32 a 9,73 a 14,92 a
75% 7,53 a 9,72 a 14,57 a
100% 7,02 a 10,48 a 15,26 a
Keterangan : Angka-angka yang diikuti huruf yang sama pada kolom yang sama untuk perlakuan bakteri atau pupuk SP-36 menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5%.
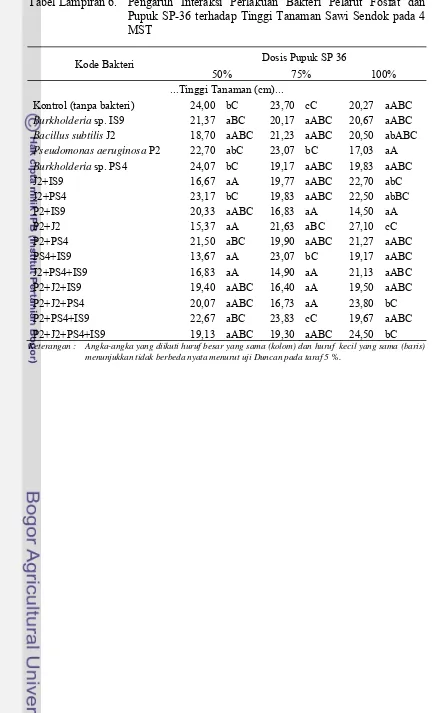
Tabel Lampiran 6. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Tinggi Tanaman Sawi Sendok pada 4 MST
Kode Bakteri Dosis Pupuk SP 36
50% 75% 100% ...Tinggi Tanaman (cm)...
Kontrol (tanpa bakteri) 24,00 bC 23,70 cC 20,27 aABC
Burkholderia sp. IS9 21,37 aBC 20,17 aABC 20,67 aABC
Bacillus subtilis J2 18,70 aABC 21,23 aABC 20,50 abABC
Pseudomonas aeruginosa P2 22,70 abC 23,07 bC 17,03 aA
Burkholderia sp. PS4 24,07 bC 19,17 aABC 19,83 aABC
J2+IS9 16,67 aA 19,77 aABC 22,70 abC
J2+PS4 23,17 bC 19,83 aABC 22,50 abBC
P2+IS9 20,33 aABC 16,83 aA 14,50 aA
P2+J2 15,37 aA 21,63 aBC 27,10 cC
P2+PS4 21,50 aBC 19,90 aABC 21,27 aABC
PS4+IS9 13,67 aA 23,07 bC 19,17 aABC
J2+PS4+IS9 16,83 aA 14,90 aA 21,13 aABC
P2+J2+IS9 19,40 aABC 16,40 aA 19,50 aABC
P2+J2+PS4 20,07 aABC 16,73 aA 23,80 bC
P2+PS4+IS9 22,67 aBC 23,83 cC 19,67 aABC
P2+J2+PS4+IS9 19,13 aABC 19,30 aABC 24,50 bC
Keterangan : Angka-angka yang diikuti huruf besar yang sama (kolom) dan huruf kecil yang sama (baris) menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5 %.
Tabel Lampiran 7. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Lebar Daun Tanaman Sawi Sendok pada 1 MST
Burkholderia sp. IS9 1,61 aABCD 2,21 dE 1,71 bBCD
Bacillus subtilis J2 1,94 dD 2,06 cD 1,79 bcBCD
Pseudomonas aeruginosa P2 1,42 aAB 1,79 bcBCD 1,72 bBCD
Burkholderia sp. PS4 1,73 bBCD 1,69 abBCD 1,76 bcBCD
J2+IS9 1,39 aAB 1,84 cCD 1,38 aAB
P2+J2+PS4+IS9 1,61 aABCD 1,53 aABC 1,79 bcBCD
Keterangan : Angka-angka yang diikuti huruf besar yang sama (kolom) dan huruf kecil yang sama (baris) menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5 %.
Tabel Lampiran 8. Pengaruh Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Lebar Daun Tanaman Sawi Sendok pada 2 MST-3 MST
Perlakuan 2 MST 3 MST
...Lebar Daun(cm)... Kode Bakteri
Kontrol (tanpa bakteri) 2,45 b 3,73 bc
Burkholderia sp. IS9 2,20 ab 3,48 bc
Bacillus subtilis J2 2,03 ab 3,14 abc
Pseudomonas aeruginosa P2 1,86 ab 3,42 abc
Burkholderia sp. PS4 2,31 ab 3,66 bc
J2+IS9 1,78 ab 2,87 ab
J2+PS4 2,25 ab 3,42 abc
P2+IS9 2,26 ab 2,77 ab
P2+J2 2,11 ab 3,56 bc
P2+PS4 2,42 b 3,38 abc
PS4+IS9 1,97 ab 2,94 abc
J2+PS4+IS9 1,62 a 2,51 a
P2+J2+IS9 1,92 ab 2,91 abc
P2+J2+PS4 1,90 ab 3,36 abc
P2+PS4+IS9 2,25 ab 3,85 c
P2+J2+PS4+IS9 2,14 ab 3,47 abc
Dosis Pupuk SP-36
50% 1,94 a 3,16 a
75% 1,92 a 3,02 a
100% 2,41 b 3,65 b
Tabel Lampiran 9. Pengaruh Interaksi Perlakuan Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Lebar Daun Tanaman Sawi Sendok pada 4 MST
Pseudomonas aeruginosa P2 5,27 bAB 5,17 abAB 4,66 abAB
Burkholderia sp. PS4 5,21 abAB 4,56 aAB 5,54 abBC
Keterangan : Angka-angka yang diikuti huruf besar yang sama (kolom) dan huruf kecil yang sama (baris) menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf 5 %.
Tabel Lampiran 10. Hasil Analisis Ragam Pengujian Kuantitatif Isolat Bakteri Pelarut Fosfat
Bakteri 4 287666,99 71916,75 15,54 0,005*
Total 10 629488,92
Hari ke-2
Bakteri 4 533819,68 133454,92 210,90 0,000*
Total 10 1339291,73
Hari ke-3
Bakteri 4 632417,60 158104,40 217,34 0,000*
Total 10 1597122,37
Hari ke-4
Bakteri 4 699498,55 174874,64 417,598 0,000*
Total 10 1371359,06
Hari ke-7
Total 10 976124,24 Keterangan : tanda * menunjukkan berbeda nyata (signifikan)
Tabel Lampiran 11. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Tinggi Tanaman Sawi Sendok
Total 144 15168,73
3 MST
Bakteri 15 212,29 14,15 1,13 0,344
Pupuk SP-36 2 11,42 5,71 0,45 0,636
Interaksi 30 502,74 16,76 1,33 0,148
Total 144 33967,48
4 MST
Bakteri 15 335,83 22,39 1,36 0,182
Pupuk SP-36 2 26,46 13,23 0,81 0,450
Interaksi 30 831,16 27,71 1,69 0,030*
Total 144 61977,17
5 MST
Bakteri 15 436,57 29,10 0,99 0,467
Pupuk SP-36 2 358,61 179,30 6,13 0,003*
Interaksi 30 1396,14 46,54 1,59 0,047*
Total 144 86167,78
Keterangan : tanda * menunjukkan berbeda nyata (signifikan)
Tabel Lampiran 12. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Lebar Daun Tanaman
Pupuk SP-36 2 7,42 3,71 8,82 0,000*
Keterangan : tanda * menunjukkan berbeda nyata (signifikan)
5 MST
Keterangan : tanda * menunjukkan berbeda nyata (signifikan)
Tabel Lampiran 14. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Bobot Basah Tanaman Sawi Sendok
Keterangan : tanda * menunjukkan berbeda nyata (signifikan)
Tabel Lampiran 15. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Bobot Kering Tanaman Sawi Sendok
Keterangan : tanda * menunjukkan berbeda nyata (signifikan)
Tabel Lampiran 16. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Ketersediaan P dalam Tanah
Tabel Lampiran 17. Hasil Analisis Ragam Pengaruh Pemberian Bakteri Pelarut Fosfat dan Pupuk SP-36 terhadap Kandungan P dalam Tanaman Sawi Sendok
Bakteri 15 165355723,11 11023714,87 2,77 0,001* Pupuk SP-36 2 20892990,88 10446495,44 2,62 0,078
Interaksi 30 290713154,68 9690438,49 2,43 0,001*
Total 144 4862003670,00
Keterangan : tanda * menunjukkan berbeda nyata (signifikan) Tabel Lampiran 18. Komposisi Media SPA (1000 ml)
Bahan Kimia Komposisi
Sucrose 20 g
Protopeptone 5 g
K2PO4 0,5 g
MgSO4 0,25 g
Agar bacto 22 g
Tabel Lampiran 19. Komposisi Media Pikovskaya (1000 ml)
Bahan Kimia Komposisi
Glukosa 10 g
Tabel Lampiran 20. Komposisi Media Nutrient Broth (1000 ml)
Bahan Kimia Komposisi
Beef extract 10 g
Peptone 10 g
NaCl 5 g