DAFTAR PUSTAKA
Adisarwanto, T. 2005. Kedelai. Penebar Swadaya, Jakarta. Hal 18-23.
Azriati, E., Asmeliza dan Yurmita, N., 2008. Respon Regenerasi Eksplan Kalus Kedelai (Glycine max (L.) Merrill) Terhadap Pemberian NAA Secara In Vitro. Universitas Negeri Padang, Padang.
Darmayanti, F. 2007. Pengaruh Pemberian ZPT Terhadap Pertumbuhan Kalus Kedelai. FMIPA Universitas Mulawarman. Samarinda.
Demiral, T dan Turkan, I., 2004. Comparative lipid peroxidation, antioxidant defense systems and proline content in roots of two rice cultivars differing in salt tolerance. Department of Biology Science Faculty Ege University. Turkey.
Dwidjoseputro, D. 1987. Pengantar Fisiologi Tanaman. Gramedia. Jakarta.
Fernando J.A., Carneiro M.L., Geraldi I.O., and Appezzato-da- Gloria B. 2002. Anatomical Study of Somatic Embryogenesis in Glycine max (L.) Merill. Brazilian Archives of Biology and Technology 45 (3) : 277 – 286.
George EF and PD Sherrington. 1994. Plant Propagation by Tissue Culture. Exegetics Limited. England.
Gullen, H dan Eris, A., 2003. Effect of heat stress on peroxidase activity and total protein content in strawberry plants. Department of Horticulture Faculty of Agriculture Uludag University. Turkey.
Gunawan, L.W. 1992. teknik Kultur jaringan tumbuhan. IPB-Press, Bogor.
Harahap, A., 2009. Pengaruh Umur Panen Terhadap Viabilitas dan Vigor Benih serta Pertumbuhan Kecambah Tiga Varietas Kedelai (Glycine max (L.) Merill). Universitas Sumatera Utara, Medan.
Henuhili, V., 2013. Kultur Jaringan Tanaman. Universitas Negeri Yogyakarta, Yogyakarta.
Irwan, A.W. 2006. Budidaya Tanaman Kedelai (Glycine max (L.) Merill). Fakultas Pertanian Universitas Padjadjaran, Jatinangor.
Kemeterian Pertanian. 2015. Pedoman teknis pengelolaan produksi kedelai tahun 2015. Direktorat Budidaya Aneka Kacang dan Umbi. Direktorat Jenderal Tanaman Pangan, Kementerian Pertanian.
Komariah, A. 2008. Identifikasi Varietas Kedelai Toleran Terhadap Genangan. Fakultas Pertanian Universitas Winajaya Mukti, Sumedang.
Laublin G, Saini HS and Cappadocia M. 1991. In Vitro Plant regeneration via Somatic Embryogenesis from Root Culture of Some Rhizomatous Irises. Plant Cell, Tissue and Organ Culture 27, 15-21.
Lestari, E.G. 2007. Kultur Jaringan: Menjawab Persoalan Pemenuhan Kebutuhan akan Peningkatan Kualitas Bibit Unggul dan Perbanyakannya secara Besar-Besaran. Bogor (ID). Ganang Dwi Kartika Pr.
Lestari, E.G., 2011. Peranan Zat Pengatur Tumbuh dalam Perbanyakan Tanaman melalui Kultur Jaringan. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
Nanang, D. A. 2009. Optimasi Pengembangan Media untuk Pertumbuhan Chlorella sp. pada Skala Laboratorium. Skripsi. Program studi Ilmu dan teknologi Kelautan. Fakultas Perikanan dan Kelautan, Institut Pertanian Bogor. Bogor.
Nopriani., I.Widiyawati, N. Gromokora., M.Engelbert. 2011. Pengamatan Stomata Tanaman C3, C4, dan CAM. Intitiut Pertanian Bogor. Bogor. Nursyamsi, 2010. Teknik Kultur Jaringan Sebagai Alternatif Perbanyakan
Tanaman untuk Mendukung Rehabilitasi Lahan. Balai Penelitian Kehutanan Makassar, Makassar.
Ohorella, Z., 2011. Respon Pertumbuhan dan Produksi Tanaman Kedelai pada Sistem Olah Tanah yang Berbeda. Universitas Al Amin Muhammadiyah Sorong, Papua Barat
Rubatzky, V. E. Dan M. Yamaguchi. 1998. Sayuran Dunia 2 : Prentice-Hall, Inc, New York.
Sari, W., 2009. Aktivitas Enzim Peroksidase dan Polifenol Oksidase pada Kalus Terung Belanda (Solanum betaceum Cav.) Setelah Diinduksi Kolkisin. Universitas Sumatera Utara, Medan.
Sastrosumarjo, S. 2006. Panduan laboratorium, hal. 38 - 63. Dalam S.Sastrosumarjo (Ed.) Sitogenetika Tanaman. IPB Press. Bogor.
Steenis, C. G. G. J. V. 2005. Flora. PT Pradnya Paramita, Jakarta. Suprapto, H.S. 2001. Bertanam Kedelai. Penebar Swadaya, Jakarta.
Sutrian, Y. 2004. Pengantar Anatomi Tumbuh-Tumbuhan. Rineka Cipta. Jakarta Suwignyo, R.A. 2007. Ketahanan Tanaman Padi terhadap Kondisi Terendam:
Pemahaman terhadap Karakter Fisiologis untuk Mendapatkan Kultivar Padi yang Toleran di Lahan Rawa Lebak. Fakultas Pertanian Universitas Sriwijaya, Palembang.
Tabin, A. 2010. Petunjuk Praktek Mikrobiologi Hasil Pertanian 2. Jakarta: Departemen Pendidikan Tinggi dan Kebudayaan.
Wawan, A., 2006. Budidaya Tanaman Kedelai (Glycine max (L.) Merill). Universitas Padjajaran, Bandung.
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Percobaan
Penelitian ini dilakukan di Laboratorium Kultur Jaringan Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan Maret 2016 sampai dengan selesai.
Bahan dan Alat
Bahan yang akan digunakan dalam penelitian ini meliputi bahan eksplan: biji kedelai yang diperoleh dari koleksi Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian (Balitkabi) Malang meliputi benih kedelai varietas Baluran, Gepak kuning dan Willis Media yang digunakan yaitu media Murashige and Skoog, zat pengatur tumbuh 2,4 D dan Kinetin, agar, aquades steril, bahan sterilisasi alat dan bahan yaitu detergen, alkohol 70%, klorox 10%, betadine, dithane, dan benlate. Bahan buffer pH yaitu NaOH 0,1 N dan HCL 0,1 N. Aluminium foil digunakan untuk menutup botol kultur. Bahan kimia untuk analisis histologi kalus embriogenik yaitu larutan FAA, butanol, lilin paraplast, safranin 1%. Bahan kimia untuk identifikasi kalus embriogenik toleran genangan yaitu larutan MS cair tanpa perlakuan, bahan larutan analisa klorofil yaitu aseton 85%, kertas saring; bahan analisa protein yaitu H2SO4 pekat katalis
Alat yang akan digunakan dalam penilitian ini meliputi alat-alat gelas: gelas piala, gelas ukur, erlenmeyer, cawan petri, batang pengaduk, botol kultur, alat-alat diseksi (scalpel, pinset, gunting, Laminar Air Flow Cabinet, timbangan analitik, pipet), alat sterilisasi (autoklaf, lampu spiritus, dan penyemprot alkolhol (hand sprayer) pH meter, lemari pendingin, rak kultur, alat pemotret, thermometer, lampu louresence, lux meter, kertas label, kertas payung, kertas lakmus, hot plate, kertas lakmus, hot plate, kertas tissue, korek, aluminium foil dan bekerglass. Alat-alat perkecambahan: botol kaca sebagai wadah perkecambahan, botol plastik sebagai wadah penuangan air genangan pada botol kaca kecambah.
Metode Penelitian
Penelitian ini meliputi dua kegiatan yang dilakukan secara bertahap, yaitu pembentukan kalus embriogenik dan identifikasi kalus embriogenik toleran genangan. Rancangan penelitian yang digunakan yaitu Rancangan Acak Lengkap (RAL) faktorial terdiri dari tiga faktor yaitu sebagai berikut :
Faktor I : Verietas yang diuji. D1 : Baluran
D2 : Gepak Kuning D3 : Willis
Faktor II : Media dengan Zat Pengatur Tumbuh yang diuji K1 : 5 mg/L 2,4 D + 0 mg/L kinetin
Faktor III : Proses Hipoksia P1 : Tanpa Penggenangan
P2 : Perlakuan penggenangan Ms 0 pada tiap botol Kultur dengan taraf dan konsentrasi yang sama
Kombinasi Perlakuan ada 12, yaitu D1K2P1 D1K2P2 D1K3P1 D1K3P2 D2K2P1 D2K2P2 D2K3P1 D2K3P2 D3K2P1 D3K2P2 D3K3P1 D3K3P2 Jumlah ulangan : 3 Ulangan
Jumlah perlakuan : 12 Kombinasi Jumlah Varietas : 3 Varietas
Jumlah eksplan tiap tabung uji : 1 Tanaman Jumlah seluruh eksplan : 36 Eksplan Jumlah seluruh Botol : 36 Botol Kultur Jumlah sampel/Botol : 1 Sampel
Data hasil penelitian dianalisis dengan sidik ragam model sebagai berikut :
Yijkl = µ + αi + βj + γk + (αβ)ij + (αγ)ik + (βγ)jk + (αβγ)ijk + εijkl
i = 1, 2, 3 j = 2, 3 k= 1, 2 l = 1, 2, 3 Dimana :
Yijkl = nilai pengamatan sampel ke-l yang memperoleh kombinasi perlakuan ke-i (taraf perlakuan faktor V), ke-j (taraf perlakuan faktor A) dan ke-k (taraf perlakuan faktor P);
μ = rataan umum
βj = pengaruh aditif taraf ke-j dari faktor A
γk = pengaruh aditif taraf ke-j dari faktor P
(αβ)ij = interaksi taraf ke-i faktor V dan taraf ke-j faktor A
(αγ)ik = interaksi taraf ke-i faktor V dan taraf ke-k faktor P
(βγ)jk = interaksi taraf ke-j faktor A dan taraf ke-jk faktor P
(αβγ)ijk = interaksi taraf ke-i faktor V; taraf ke-j faktor A dan taraf ke-k faktor P
εijkl = pengaruh galat percobaan pada sampel ke-l yang memperoleh kombinasi
perlakuan ke-ijk
Jika perlakuan ( Varietas yang diuji, jenis ZPT auksin dan interaksi) berbeda nyata dalam sidik ragam maka dilanjutkan dengan Uji Jarak Berganda Duncan (DMRT) dengan taraf 5 % (Gomez dan Gomez, 2007). Analisis dilakukan menggunakan software Costat for Window.
Pelaksanaan Penelitian
Tahap 1: Pembentukan Kalus Embriogenik Sterilisasi Alat
pada tekanan 17.5 psi, dengan suhu 121 0C selama 60 menit. Kemudian alat-alat tersebut dimasukkan ke dalam oven kecuali botol kultur.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media MS dengan menggunkan zat pengatur tumbuh yaitu 2,4D dan Kinetin dengan konsentrasi 5mg/l 2,4D; 10mg/l 2,4D+ 0,5 mg/l kinetin dan 15 mg/l 2,4D+ 1 mg/l kinetin. Perhitungan dilakukan seberapa banyak media yang akan dibuat sehingga stock yang akan diambil untuk dicampurkan dapat diketahui dan dituliskan volume masing-masing stock yang akan dipipet. Media dibuat dalam 1 L, semua stock media disiapkan diatas meja kerja dari porselin.
Untuk membuat media 1 liter, dituangkan aquadest 500 ml dalam gelas beker 1 liter, dengan batang magnetic di dalamnya. Ditimbang dan ditambahkan 30 g glukosa, 1 ml dari stok vitamin + 100 mg Myo-inositol. Dan ditambahkan 10 ml dari setiap maisng-masing larutan stok NH4NO3, KNO3, Na2 EDTA. & FeSO4.7H2O, CaCl2.2H2O, KH2PO4 dan 10 ml untuk larutan stok mikro. Setelah itu ditambahkan zat pengatur tumbuh pada masing-masing perlakuan yang digunakan sebanyak 10 ml. Dijadikan volume larutan hingga mendekati tanda 1 liter dengan menambahkan aquadest, diukur pH pada 5.6-5.8. Lalu dituang medium ke dalam erlenmeyer 2 liter dan ditambahkan agar 8-10 g. Dipanaskan hingga agar larut. Setelah itu ditunggu hingga larutan tampak bening maka larutan siap untuk dijadikan larutan media.
Didiamkan beberapa saat terlebih dahulu larutan media yang telah di hot plate. Sambil menunggu larutan media dingin botol kultur yang sudah
botol. Lalu larutan media yang sudah dingin dimasukkan kedalam botol kultur dan ditutup dengan aluminium foil. Media disterilisasi dengan autoclave pada 15 psi, 121 oC selama kurang lebih 30 menit. Setelah itu media didinginkan didalam laminar dan disimpan di kulkas.
Persiapan Ruang Kultur
Seluruh permukaan Laminar Air Flow Cabinet (LAFC) sebelumnya dibersihkan terlebih dahulu dan disemprot menggunakan alkohol 70% kumudian dilap. Lalu blower dihidupkan dan disterilkan dengan sinar ultra violet selama 1 jam sebelum proses penanaman dilakukan, semua alat yang akan dipakai harus disemprot dengan alkohol 70% sebelum dimasukkan ke dalam Laminar Air Flow Cabinet (LAFC).
Sterilisasi Eksplan
Bahan tanam yang digunakan dalam penelitian ini adalah benih kedelai varietas Baluran, Detam-1 dan Gepak kuning. Benih kedelai yang digunakan sebaiknya bermutu tinggi baik secara genetik, fisik dan fisiologi. Daya tumbuh tinggi yaitu lebih dari 90% dan toleransi terhadap genangan.
dibilas dengan aquadest steril minimal 3 kali. Eksplan direndam dengan larutan Betadine 55 selama 10 menit sambil digojok kemudian dibilas dengan aquadest minimal sebanyak 3 kali.
Penanaman
Penanaman eksplan dilakukan di LAF yang telah disterilkan dengan alkohol 70%. Eksplan yang akan di tanam adalah kotiledon kedelai, Eksplan yang akan dikulturkan kedalam media tanam diletakkan di petridish, dimana kotiledon dipisahkan dari bagian embrio. Kemudian eksplan ditanamkan ke dalam botol median sesuai dengan perlakuan. Setiap botol media sesuai dengan perlakuan. Setiap botol kultur terdiri dari 1 eksplan. Botol kultur diletakkan di Rak Kultur dibawah cahaya.
Pemeliharaan
Botol-botol kultur yang telah ditanami eksplan pada rak-rak kultur didalam ruangan kultur setiap hari disemprot dengan alkohol 70% agar bebas dari mikroorganisme (bakteri dan jamur) yang menyebabkan terjadinya kontaminasi. Suhu ruang kultur yang digunakan adalah 18-22 0C dan intensitas cahaya sebesar 2000 lux.
Tahap 2: Identifikasi Kalus Toleran Genangan Aplikasi Penggenangan terhadap Kalus
Identifikasi kalus dilakukan secara 2 tahap, yaitu tahap 1 sebelum dilakukan aplikasi penggenangan dan tahap 2 yaitu setelah dilakukan aplikasi penggenangan.
selama 48 jam. Proses penggenangan kalus dapat dilihat dari Gambar. 1 dibawah ini.
Gambar 1. Proses Penggenangan Kalus Pengukuran Kadar Klorofil (mg/l)
Pengukuran kandungan klorofil total menggunakan metode Arnon (1949) diukur dengan spektrofotometri. Kalus segar digerus dengan mortar kemudian serbuk kalus diukur beratnya sebanyak 1g. Sampel yang sudah digerus kemudian diekstraksi dengan 100 ml aseton 85%. Lalu didiamkan selama 1 malam didalam kulkas. Ekstrak tersebut disaring dengan kertas saring. Filtrat yang didapat ditempatkan didalam cuvet untuk selanjutnya diukur kandungan klorofil total dengan alat spektrofotometer UV-Vis pada panjang gelombang 645 nm dan 663 nm. Kadar klorofil total dihitung dengan rumus:
Klorofil Total = 8,02 (A.663) + 20,2 (A.645) mg/l Analisis Total Protein (mg/l)
Campuran dilarutkan kedalam 5 ml etanol 98% , lalu ditambahkan 10 ml asam fosfor 85%. Campuran dihomogenkan (dikocok kuat) lalu disaring dengan kertas saring dan disimpan dalam botol gelap dan suhu rendah. Stok pereaksi Bradford harus diencerkan 5 kali sebelum digunakan.
Larutan standar protein dibuat dengan menimbang 0,01 g BSA (bovine serum albumin) yang kemudian ditambahkan 10 ml buffer ektraks sehingga diperoleh larutan stok BSA dengan konsentrasi 1000 ppm. Kemudian larutan stok konsentrasi 1000 ppm diencerkan dengan melarutkan 0,5 ml larutan stok dilarutkan dengan ditambahkan 4,5 ml buffer ektraks sehingga diperoleh larutan stok BSA 100 ppm.
Larutan stok tersebut digunakan membuat kurva standar dengan konsentrasi 0, 10, 20, 30, 40, 50, 60, 70, 80, 90 dan 100 ppm. Pengukuran standar protein dengan menambahkan 0.05 ml seri larutan standar dengan 2.5 ml reagen Bradford. Kemudian larutan divortex dan di inkubasi pada suhu ruang selama 10‐60 menit. Larutan ini memberikan warna biru dan dibaca pada panjang gelombang 595 nm. Dengan menggunakan regresi linear, akan didapatkan persamaan matematik untuk larutan standar protein. Pengukuran sampel dilakukan dengan cara menambahkan 0.05 ml ekstrak enzim kasar dengan 2.5 ml reagen Bradford divortex dan diinkubasi pada suhu ruang selama 10‐60 menit. Absorbansi Larutan sampel protein dibaca pada panjang gelombang 595 nm (Anam, 2011).
Analisis Enzim Peroksidase (unit/mg/l protein)
10.000 rpm. Kemudian diambil gumpalan lateks tersebut menggunakan pinset dan akan menyisakan serum. Selanjutnya diambil serum menggunakan mikropipet sebanyak 0,1 ml dan ditambahkan kedalam tube yang berisi 1 ml CaCl2 (1:10).
lalu dihomogenkan menggunakan sentrifius dengan kecepatan 10000 rpm, dengan suhu 4°C selama 15 menit. Pembuatan Larutan A phenol-aminoantipirine (larutan fenol 810 mg dan amino antiphirine 25 mg dalam 50 ml air) dan larutan B dengan mencampurkan 30% H2O2 ditambahkan dengan larutan Buffer MES pH 6
perbandingan 1:100 dengan konsentrasi akhir 0.01M. Larutan A dan B tidak dapat dijadikan larutan stok. Pengukuran POD menggunakan spektrofotometer UV/Vis dengan menambahkan 1.4 ml larutan A dan 1.5 ml larutan B kedalam kuvet 3 ml yang lalu ditambahkan 200 µl ekstrak kedalam kuvet lalu aduk.Diukur pada absorban 510 nm Perhitungan aktifitas peroksidase dihitung dengan rumus :
A510 = Af – Ai
A510 = unit POD dengan panjang gelombang 510 nm Af = pembacaan peroksidase akhir (final)
Ai = pembacaan peroksidase awal (initial) Unit POD Aktivitas enzim peroksidase =
Protein terlarut
(Sumber : SOP. Plant Peroxidase Activity Determination, 1994). Analisis Enzim SOD (unit/mg/L protein)
unit SOD g protein Aktivitas SOD =
Peubah Amatan
Persentase Eksplan Membentuk Kalus Embriogenik (%)
Pengamatan dilakukan pada akhir penelitian pembentukan kalus embriogenik dengan menghitung jumlah eksplan membentuk kalus.
Persentase eksplan membentuk kalus = x 100 %
Warna Kalus
Pengamatan dilakukan secara visual terhadap penampakan kalus. Dimana warna kalus diamati pada tiap perlakuan dalam suatu botol kultur.
Tekstur Kalus
Pengamatan dilakukan secara visual terhadap penampakan kalus. Tekstur kalus yang diamati yaitu kalus yang remah/friable dan kalus kompak.
Berat Bobot Kalus Total (g)
Bobot segar kalus total ditimbang pada akhir pengamatan pertumbuhan yaitu pada umur 8 MST dengan cara menimbang kalus dengan timbangan analitik pada tiap perlakuan dalam satu botol kultur.
Pengukuran Kandungan Klorofil (mg/l)
Kandungan klorofil diukur pada akhir identifikasi kalus embriogenik toleran genangan. Pengukuran kadar klorofil secara spektrofotometrik didasarkan pada hukum Lamber – Beer. Metode yang dilakukan untuk menghitung kadar klorofil pada penelitian ini adalah Metode Arnon (1949), dalam Kumianjani (2015) yaitu dengan menggunakan palarut aceton 85 % dan mengukur nilai
Pengukuran Total Protein (mg/l)
Konsentrasi total protein (mg/l) diukur pada akhir identifikasi kalus embriogenik toleran genangan. Pengukuran konsentrasi total protein menggunakan metode Bradford (1976). Absorbansi Larutan sampel protein dibaca pada panjang gelombang 595 nm.
Pengukuran Enzim Peroksidase (unit/mg/l protein )
Pengukuran aktivitas enzim peroksidase diukur pada akhir identifikasi kalus embriogenik toleran genangan. Pengukuran ini menggunakan Standart Operating Procedures (1994) yang dimodifikasi dengan mengukur absorbansi larutan sampel kemudian dibaca oleh spektrofotometer pada panjang gelombang 510 nm menggunakan spektrofotometer UV-Vis, diukur pada 0 detik dan 60 detik setelah didiamkan. Aktivitas satu unit enzim peroksidase dapat dilihat peningkatan absorbansi 0,01/menit.
Aktivitas enzim superoksida dismutase (unit/mg/l protein)
HASIL DAN PEMBAHASAN Hasil
Tahap I. Pembentukan Kalus Embriogenik Persentase Pertumbuhan Kalus (%)
Hasil penelitian menunjukkan persentase pertumbuhan kalus untuk varietas Baluran (D1K1, D1K2, D1K3) adalah 0% dikarenakan semua eksplan tidak tumbuh. Sedangkan untuk varietas Gepak Kuning (D2K1, D2K2, D2K3) dan Varietas Willis (D3K1, D3K2, D3K3) memiliki tingkat persentase pertumbuhan kalus adalah 100%.
Keadaan Visual Kalus
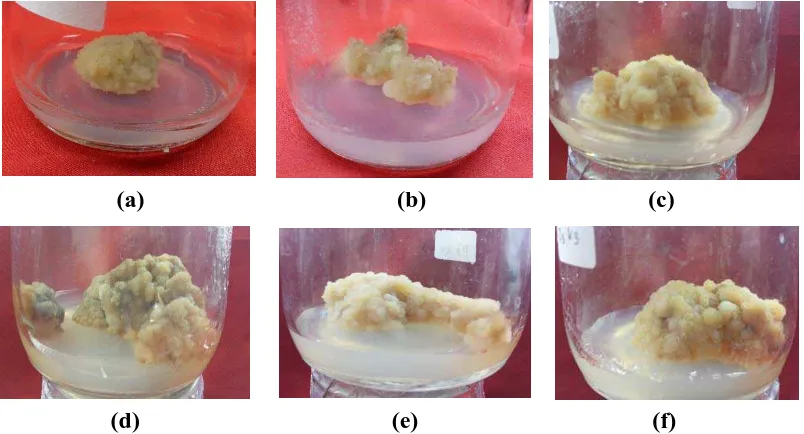
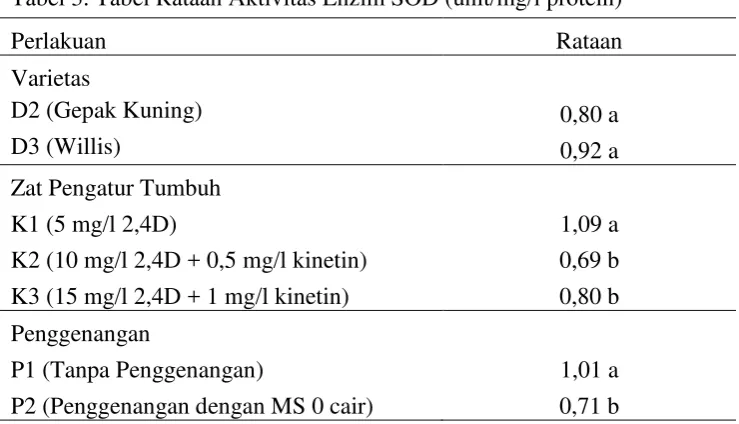
Data hasil pengamatan terhadap keadaan visual kalus pada setiap perlakuan dapat di lihat pada Gambar 2.
(a) (b) (c)
(d) (e) (f)
Gambar 2. (a) Perlakuan D2K1 menghasilkan kalus berwarna putih kekuningan dengan tekstur kompak dan tipe perkembangan globular.
(b) Perlakuan D2K2 menghasilkan kalus berwarna putih dengan tekstur kompak dan tipe perkembangan globular.
(d) Perlakuan D3K1 menghasilkan kalus berwarna coklat dengan tekstur kompak dan tipe perkembangan globular.
(e) Perlakuan D3K2 menghasilkan kalus berwarna putih dengan tekstur kompak dan tipe perkembangan globular.
(f) Perlakuan D3K3 menghasilkan kalus berwarna putih kekuningan dengan tekstur kompak dan tipe perkembangan globular.
Bobot Kalus (g)
Hasil uji beda rataan berat bobot kalus dapat dilihat pada Tabel 1. Berdasarkan hasil sidik ragam diketahui bahwa varietas, zat pengatur tumbuh dan penggenangan berpengaruh nyata terhadap pertambahan bobot kalus.
Tabel 1. Berat Bobot Kalus (gram)
Perlakuan Rataan
Varietas
D2 (Gepak Kuning) 4,75 a
D3 (Willis) 4,36 b
Zat Pengatur Tumbuh
K1 (5 mg/l 2,4D) 4,15 b
K2 (10 mg/l 2,4D + 0,5 mg/l kinetin) 4,36 b K3 (15 mg/l 2,4D + 1 mg/l kinetin) 5,16 a
Penggenangan
P1 (Tanpa Penggenangan) 4,27 b
P2 (Penggenangan dengan MS 0 cair) 4,84 a
Keterangan : - angka-angka yang diikuti oleh huruf yang sama pada baris dan kolom yang sama menunjukkan pengaruh nyata pada uji DMRT pada taraf kepercayaan 5% pada kolom atau baris yang sama
Tahap 2. Identifikasi Kalus Embriogenik Toleran Genangan Nilai Total Protein (mg/l)
Data pengamatan dan sidik ragam dari nilai total protein dapat dilihat pada Lampiran 8. sidik ragam menunjukkan bahwa interaksi antara varietas dan zat pengatur tumbuh berpengaruh nyata terhadap nilai total protein. Interaksi nilai total protein tertinggi terdapat pada perlakuan D3K3 yaitu 243,66 mg/l sedangkan interaksi nilai total protein terendah terdapat perlakuan D2K3 yaitu 174,50 mg/l.. Hasil uji beda rataan konsentrasi protein dapat dilihat pada Tabel 2.
Tabel 2. Interaksi rataan nilai total protein antara varietas dan zat pengatur tumbuh
Perlakuan K1 K2 K3 Rataan
D2 (Gepak Kuning) 197,35 ab 199,41 ab 174,50 b 190,42 D3 (Willis) 189,76 b 199,59 ab 243,66 a 211,00
Rataan 193,55 199,50 209,08 200,71
Keterangan : - angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
- Perlakuan K1= 5 mg/l 2,4D; K2= 10 mg/l 2,4D + 0,5 mg/l kinetin; K3= 15 mg/l 2,4D+ 1 mg/l kinetin.
Berdasarkan Tabel 2. dapat dilihat bahwa interaksi rataan nilai total protein pada perlakuan D3K3 berbeda nyata dengan interaksi perlakuan D3K1 dan D2K3. Sedangkan perlakuan D3K3 tidak berbeda nyata dengan perlakuan D2K1, D2K2 dan D3K2. Sidik ragam menunjukkan bahwa baik varietas, zat pengatur tumbuh dan penggenangan tidak memberikan pengaruh yang nyata terhadap nilai total protein (mg/l).
Aktivitas Enzim SOD (unit/mg/l protein)
yang nyata terhadap aktivitas enzim SOD namun tidak ada dari interaksi serta varietas yang menunjukkan pengaruh yang nyata terhadap aktivitas enzim SOD. Tabel rataan terhadap aktivitas enzim SOD dapat dilihat dari Tabel 3.
Tabel 3. Tabel Rataan Aktivitas Enzim SOD (unit/mg/l protein)
Keterangan : angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
Berdasarkan hasil pengamatan pada parameter uji aktivitas SOD menunjukkan rataan tertinggi pada varietas terdapat pada varietas Willis (0.92 unit/mg/l protein). Nilai rataan dari faktor zat pengatur tumbuh tertinggi yaitu dengan penggunaan konsentrasi K1= 5 mg/l 2,4 D (1,09 unit/mg/l protein) berbeda nyata dengan K2 dan K3. Faktor perlakuan penggenangan sendiri memiliki rataan tertinggi pada perlakuan tanpa penggenangan (1,01 unit/ppm) berbeda nyata dengan perlakuan dengan penggenangan MS 0 cair.
Aktivitas Enzim POD (unit/mg/l protein)
Berdasarkan pengamatan sidik ragam terhadap aktivitas enzim POD menunjukkan bahwa penggenangan menunjukkan pengaruh yang nyata terhadap aktivitas enzim SOD serta interaksi dari varietas dan zat pengatur tumbuh juga
Perlakuan Rataan
Varietas
D2 (Gepak Kuning) 0,80 a
D3 (Willis) 0,92 a
Zat Pengatur Tumbuh
K1 (5 mg/l 2,4D) 1,09 a
K2 (10 mg/l 2,4D + 0,5 mg/l kinetin) 0,69 b K3 (15 mg/l 2,4D + 1 mg/l kinetin) 0,80 b
Penggenangan
P1 (Tanpa Penggenangan) 1,01 a
menunjukkan pengaruh nyata terhadap aktivitas enzim POD. Tabel rataan terhadap aktivitas enzim SOD dapat dilihat dari Tabel 4.
Tabel 4. Tabel Rataan Aktivitas Enzim POD (unit/mg/l protein)
Keterangan : angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%.
Berdasarkan tabel diatas diketahui bahwa varietas Willis memiliki rataan tertinggi yaitu 0,56 unit/mg/l protein. Dari faktor zat pengatur tumbuh diketahui bahwa K2 merupakan perlakuan dengan rataan tertinggi yaitu 0,64 unit/mg/l protein. Pada perlakuan penggenangan diketahui bahwa P1 berbeda nyata dengan P2 dengan rataan tertinggi diperoleh pada perlakuan P1 yaitu 0,65 unit/mg/l protein.
Pengamatan sidik ragam terhadap interaksi antara varietas dan zat pengatur tumbuh menunjukkan pengaruh yang nyata terhadap aktivitas enzim POD. Interaksi antara varietas dan zat pengatur tumbuh dapat dilihat pada Tabel 4.
Perlakuan Rataan
Varietas
D1 (Gepak Kuning) 0,45 a
D2 (Willis) 0,56 a
Zat Pengatur Tumbuh
K1 (5 mg/l 2,4D) 0,41 a
K2 (10 mg/l 2,4D + 0,5 mg/l kinetin) 0,64 a K3 (15 mg/l 2,4D + 1 mg/l kinetin) 0,47 a
Penggenangan
P1 (Tanpa Penggenangan) 0,65 a
P2 (Penggenangan dengan MS 0
Tabel 5. Interaksi rataan aktivitas enzim POD antara varietas dan zat pengatur tumbuh
Keterangan : - angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
- Perlakuan K1= 5 mg/l 2,4D; K2= 10 mg/l 2,4D + 0,5 mg/l kinetin; K3= 15 mg/l 2,4D+ 1 mg/l kinetin.
Berdasarkan tabel diatas diketahui bahwa interaksi rataan aktivitas enzim POD tertinggi diperoleh pada perlakuan D3K2 yaitu 1,22 unit/mg/l protein dan rataan terendah yaitu pada perlakuan D3K3 0,82 unit/mg/l protein. Perlakuan D3K2 tidak berbeda nyata dengan D2K3 tetapi berbeda nyata dengan D3K1, D2K1, D2K2 dan D3K3.
Klorofil Total (mg/l)
Pengamatan sidik ragam terhadap klorofil total (mg/l) menunjukkan bahwa varietas dan penggenangan berpengaruh nyata terhadap nilai klorofil total. Interaksi antara varietas dan zat pengatur tumbuh juga menunjukkan pengaruh yang nyata terhadap nilai klorofil total. Hasil pengamatan dan sidik ragam dari aktivitas enzim SOD dapat dilihat pada Lampiran 11. Berdasarkan Tabel 6 dapat dilihat bahwa varietas Gepak Kuning memiliki rataan nilai klorofil total tertinggi yaitu 4,51 mg/l dan berbeda nyata dengan varietas Willis dengan nilai rataan klorofil total 4,00 mg/l. Berdasarkan faktor zat pengatur tumbuh, dapat dilihat bahwa K1 tidak berbeda nyata dengan K2 dan K3. Nilai rataan klorofil total tertinggi merupakan pada perlakuan K3 yaitu 4,46 mg/l. Pada faktor penggenangan menunjukkan bahwa P1 berbeda nyata dengan P2 dimana nilai
Perlakuan K1 K2 K3 Rataan
D2 (Gepak Kuning) 0,91 c 0,86 c 1,12 ab 0,89
D3 (Willis) 0,97 bc 1,22 a 0,82 c 1,09
rataan total klorofil tertinggi yaitu pada perlakuan tanpa penggenangan (P1) yaitu 4,63 mg/l.
Tabel 6. Tabel Rataan Klorofil Total (mg/l)
Keterangan : angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%.
Hasil pengamatan sidik ragam menunjukkan bahwa interaksi antara varietas dan zat pengatur tumbuh berpengaruh nyata terhadap nilai klorofil total (mg/l). Nilai interaksi rataan antara varietas dan zat pengatur tumbuh dapat dilihat pada Tabel 7.
Tabel 7. Interaksi rataan klorofil total antara varietas dan zat pengatur tumbuh
Perlakuan K1 K2 K3 Rataan
D2 (Gepak Kuning) 4,74 a 4,04 ab 4,75 a 4,51
D3 (Willis) 3,60 b 4,23 ab 4,17 ab 4,00
Rataan 4,17 4,14 4,46 4,26
Keterangan : - angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
- Perlakuan K1= 5 mg/l 2,4D; K2= 10 mg/l 2,4D + 0,5 mg/l kinetin; K3= 15 mg/l 2,4D+ 1 mg/l kinetin
Perlakuan Rataan
Varietas
D1 (Gepak Kuning) 4,51 a
D2 (Willis) 4,00 b
Zat Pengatur Tumbuh
K1 (5 mg/l 2,4D) 4,17 a
K2 (10 mg/l 2,4D + 0,5 mg/l kinetin) 4,14 a K3 (15 mg/l 2,4D + 1 mg/l kinetin) 4,46 a
Penggenangan
P1 (Tanpa Penggenangan) 4,63 a
Dari tabel diatas diketahui bahwa perlakuan D2K1 merupakan interaksi rataan klorofil total tertinggi yaitu 4,23 mg/l. Perlakuan D2K1 tidak berbeda nyata dengan D2K3, D2K2, D2K3 dan D3K3 tetapi berbeda nyata dengan D3K1.
Pembahasan
Berdasarkan persentase pertumbuhan, kalus Baluran memiliki nilai 0 %. Sedangkan Varietas Gepak Kuning dan Willis memiliki persentase pertumbuhan 100%. Menurut Liptan (2000) pada umumnya tanaman memiliki perbedaan fenotip dan genotip yang sama. Perbedaan varietas cukup besar mempengaruhi perbedaan sifat dalam tanaman. Keragaman penampilan tanaman terjadi akibat sifat dalam tanaman (genetik) atau perbedaan lingkungan kedua-duanya. Perbedaan susunan genetik merupakan salah satu faktor penyebab keragaman penampilan tanaman.
menandakan bahwa kalus mulai mengalami oksidasi dan gejala browning (pencoklatan) menyebabkan perkembangan kalus menjadi lambat, sehingga proses diferensiasi sel juga berjalan lambat.
Hasil penelitian menunjukkan bahwa tekstur kalus dari seluruh perlakuan menghasilkan tekstur yang kompak (Gambar. 3). Menurut George and Sherrington (1984) jenis auksin yang sama menyebabkan tipe kalus menjadi homogen serta jenis auksin akan mempengaruhi tipe kalus bila di subkultur. Berdasarkan tekstur dan komposisi selnya, kalus dapat dibedakan menjadi kalus yang kompak dan remah. Tekstur kalus yang kompak dianggap baik karena dapat mengakumulasi metabolit sekunder lebih banyak. Penelitian Sugiyarto dan Paramita (2014) menyatakan bahwa kalus yang baik untuk digunakan sebagai bahan penghasil metabolit sekunder yaitu memiliki tekstur kompak (non friable). Kalus kompak mempunyai tekstur padat dan keras, yang tersusun dari sel-sel kecil yang sangat rapat, sedangkan kalus remah mempunyai tekstur lunak dan tersusun dari sel-sel dengan ruang antar sel yang banyak.
Hasil penelitian menunjukkan bahwa setiap perlakuan mengahasilkan kalus yang mempunyai tipe perkembangan globular. Pada Gambar 3. dapat dilihat bahwa setiap kalus mengalami pembentukan embriogenik pada fase globular. Hal ini sesuai dengan pernyataan Dodeman (1997) yang menyatakan bahwa perkembangan sel-sel embriogenik ditandai ketika sebagian besar dari sel-sel mulai berdifrensiasi dan ukurannya bertambah besar menjadi sel bentuk globular.
kalus . Berdasarkan hasil pengamatan pada Tabel 1, diketahui bahwa varietas Gepak Kuning memiliki nilai rataaan tertinggi yaitu 4,75 g berbeda nyata dengan varietas Willis dengan nilai rataan lebih rendah yaitu 4,36 g. Pada faktor zat pengatur tumbuh dapat dilihat bahwa rataan bobot kalus tertinggi pada perlakuan K3 yaitu 5,16 g dan terendah pada perlakuan K1 yaitu 4,15 g. Hasil pengamatan sidik ragam pada faktor penggenangan menunjukkan bahwa P1 berbeda nyata dengan P2 yang memiliki nilai rataan tertinggi yaitu 4,84 g. Menurut Jimnez and Bangerth (2001) selain auksin, sitokinin juga berfungsi untuk menstimulasi pembelahan pada massa pro-embriogenik sel. Keduanya dibutuhkan untuk inisiasi kalus embriogenik. Penambahan auksin-sitokinin ke dalam medium tumbuh adalah untuk mengatur pembelahan, pemanjangan,diferensiasi sel, dan pembentukan organ. Dengan mengetahui pengaruh auksin dan sitokinin dalam menginduksi kalus embriogenik pada kultur meristem kedelai, akan membantu meningkatkan potensi regenerasi embrio somatik kedelai dan proses perbaikan varietas, baik dengan rekayasa genetik maupun seleksi in vitro.
penggenangan diperoleh pada perlakuan D3K3 yaitu 227,0 mg/l. Hal ini disebabkan karena terjadi proses denitrifikasi akibat perlakuan penggenangan sehingga nilai total protein menjadi rendah, pada kondisi tergenang ketersediaan nitrogen dalam bentuk nitrat sangat rendah. Menurut Dwidjoseputro (1987) nitrogen juga sangat berperan sebagai penyusun senyawa protein dalam sel. Nitrogen merupakan komponen utama protein sel yang merupakan bagian dasar kehidupan organisme dan berfungsi untuk menyokong unsur dari sel alga serta membentuk senyawa penting di dalam sel, termasuk protein dan merupakan bagian penting dari klorofil.
penting dari sistem pelindungan itu adalah pertahanan secara enzimatis, seperti SOD dan katalase yang dapat menghindari O2- dan H2O2 selain metabolit seperti
askorbat, glutation dan tokoperol yang berfungsi untuk mengatur tingkat keaktifan oksigen pada jaringan tanaman. Tanaman dapat bertahan apabila enzim SOD dan katalase dapat melindungi jaringan tanaman dalam kondisi cekaman oksidatif.
Hasil analisis data statistik menunjukkan bahwa faktor penggenangan berpengaruh nyata terhadap nilai klorofil total. Interaksi antara varietas dan zat pengatur tumbuh juga menunjukkan pengaruh yang nyata terhadap nilai klorofil total. Berdasarkan data penelitian menunjukkan bahwa klorofil total pada perlakuan kontrol tertinggi yaitu pada perlakuan D2K1 sedangkan pada perlakuan penggenangan yang tertinggi yaitu D2K2. Umumnya Gepak kuning memiliki klorofil total lebih tinggi dibandingkan varietas Willis. Nilai total klorofil pada kalus yang tidak diberi perlakuan penggenangan (P1) cenderung lebih tinggi dibandingkan nilai klorofil total pada perlakuan penggenangan. Hal ini dikarenakan kandungan klorofil berpengaruh pada proses metabolisme tumbuhan. Hal ini sesuai dengan pendapat Bidwell (1979) bahwa gangguan terhadap metabolisme akibat anaerobic akan menghambat produksi ATP, pengaruh CO2 juga didalam kultur jaringan berkaitan erat dengan kebutuhan bagi proses fotosintesis. Secara umum diduga bahwa CO2 merupakan syarat mutlak untuk kultur jaringan tanaman dibawah kondisi cahaya. Metabolisme pertumbuhan kalus juga berpengaruh terhadap pembentukan pigmen, pembelahan dan pembesaran sel.
KESIMPULAN DAN SARAN
Kesimpulan
1. Zat pengatur tumbuh 2,4 D dan Kinetin memberikan pengaruh yang nyata terhadap pertumbuhan kalus dan pertambahan bobot kalus kedelai.
2. Interaksi dari kombinasi ZPT 2,4 D dan Kinetin tidak berpengaruh nyata terhadap induksi kalus embriogenik pada beberapa varietas kedelai.
3. Hasil penelitian terhadap analisis nilai total protein menunjukkan bahwa nilai protein pada kalus yang diberi penggenangan mengalami penurunan, berdasarkan data aktivitas enzim SOD dan POD menunjukkan bahwa dari kedua varietas yang diuji tidak ada yang tahan terhadap penggenangan. Data klorofil total pada kalus yang diberi penggenangan mengalami penurunan nilai total klorofil.
Saran
TINJAUAN PUSTAKA Botani Tanaman
Klasifikasi tanaman kedelai Glycine max (L.)Merill adalah sebagai berikut : Kingdom : Plantae; Divisi : Spermatophyta; Subdivisio: Angiospermae; Kelas: Dicotyledonae; Ordo: Rosales; Famili: Papilionaceae; Genus: Glycine; Species : Glycine max (L.) Merill (Steenis, 2005).
Akar kedelai mulai muncul dari belahan kulit biji yang muncul di sekitar misofil. Pertumbuhan akar tunggang dapat mencapai panjang sekitar 2 m atau lebih pada kondisi yang optimal, namun demikian, umumnya akar tunggang hanya tumbuh pada kedalaman lapisan tanah olahan yang tidak terlalu dalam, sekitar 30-50 cm. Sementara akar serabut dapat tumbuh pada kedalaman tanah sekitar 20-30 cm. Akar serabut ini mula-mula tumbuh di dekat ujung akar tunggang, sekitar 3-4 hari setelah berkecambah dan akan semakin bertambah banyak dengan pembentukan akar-akar muda yang lain (Wawan, 2006).
Batang berbentuk pesergi dengan rambut coklat yang menjauhi batang atau mengarah ke bawah. Pertumbuhan batang terdiri dari dua tipe yaitu determinate dan interdeterminate yang didasarkan keberadaan bunga pada pucuk batang (Irwan, 2006).
Bentuk daun kedelai yaitu bulat (oval) dan lancip (lanceolate). Tanaman kedelai mempunyai dua bentuk daun yang dominan, yaitu stadia kotiledon yang tumbuh saat tanaman masih berbentuk kecambah dengan dua helai daun tunggal dan daun bertangkai tiga (trifoliate leaves) yang tumbuh selepas masa pertumbuhan. Daun mempunyai bulu dengan warna cerah dan jumlahnya bervariasi (Irwan, 2006).
Periode berbunga pada tanaman kedelai cukup lama yaitu 3-5 minggu untuk daerah subtropik dan 2-3 minggu di daerah tropik, seperti di Indonesia. Jumlah bunga pada tipe batang determinate umumnya lebih sedikit dibandingkan pada batang tipe indeterminate. Warna bunga yang umum pada berbagai varietas kedelai hanya dua, yaitu putih dan ungu. Setiap ketiak tangkai daun yang mempunyai kuncup bunga dan dapat berkembang menjadi polong disebut sebagai buku subur. Tidak setiap kuncup bunga dapat tumbuh menjadi polong, hanya berkisar 20-80% (Wawan, 2006).
Polong biasanya bewarna hijau. Polongnya yang berkembang dalam kelompok, biasanya mengandung 2-3 biji yang berbentuk bundar atau pipih, dan sangat kaya akan protein dan minyak (Rubatzky dan Yamaguchi, 1998).
Biji kedelai berkeping dua yang terbungkus oleh kulit biji. Embrio terletak diantara keping biji. Warna kulit biji bermacam-macam ada yang kuning, hitam, hijau dan coklat. Bentuk biji kedelai pada umumnya bulat lonjong, ada yang bundar atau bulat agak pipih. Besar biji bervariasi tergantung varietas. Di Indonesia besar biji bervariasi dari 6 gram – 30 gram (Suprapto, 2001).
diploid, sehingga kotiledon akan bersifat triploid. Hasil yang diperoleh dalam kultur in vitro ini hanya berupa sel-sel kalus. Jadi penelitian ini mengindikasi perbedaan genetik yang akan mengakibatkan perbedaan kemampuan kompetensi regenerasi atau kondisi fisiologis dari jaringan eksplant (Fernando et al., 2002). Kultur Kalus
Salah satu teknik perbanyakan tanaman adalah dengan teknik kultur jaringan. Kultur jaringan adalah suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, jaringan, organ serta menumbuhkannya dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali. Perbanyakan tanaman melalui kultur jaringan sangat berbeda dibandingkan dengan perbanyakan secara konvensional karena perbanyakan melalui kultur jaringan memungkinkan perbanyakan tanaman dalam skala besar dengan waktu yang relatif lebih cepat (Nursyamsi, 2010).
Kultur adalah budidaya, dan jaringan adalah sekelompok sel yang mempunyai bentuk dan fungsi yang sama. Kultur jaringan merupakan metode untuk mengisolasi bagian dari tanaman, seperti sel, sekelompok sel, jaringan, dan organ, serta menumbuhkan dalam kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman yang lengkap. Dasar orientasi kultur jaringan adalah teori totipotensi sel, yang ditulis oleh Schleiden dan Schwann, bahwa bagian tanaman yang hidup mempunyai totipotensi, kalau dibudidayakan di lingkungan yang sesuai, dapat tumbuh menjadi tanaman yang sempurna (Henuhili, 2013).
potongan jaringan yang diambil mampu mengadakan perbesaran, perpanjangan, dan pembelahan sel dan membentuk suatu massa sel yang belum terdiferensiasi yang disebut kalus serta membentuk shootlet (tunas), rootlet (akar), atau planlet (tanaman lengkap). Manfaat dari kultur in vitro ini antara lain menyediakan bibit tanaman yang sehat dalam jumlah banyak dalam waktu yang relatif singkat, dalam areal yang kecil, tidak tergantung pada musim dan memungkinkan manipulasi genetic (Azriati et al., 2008).
Keuntungan pengadaan bibit melalui kultur jaringan antara lain dapat diperoleh bahan tanaman yang unggul dalam jumlah banyak dan seragam, selain itu dapat diperoleh biakan steril (mother stock) sehingga dapat digunakan sebagai bahan untuk perbanyakan selanjutnya. Untuk mendapatkan hasil yang optimum maka penggunaan media dasar dan zat pengatur tumbuh yang tepat merupakan faktor yang penting. Kombinasi media dasar dan zat pengatur tumbuh yang tepat akan meningkatkan aktivitas pembelahan sel dalam proses morfogenesis dan organogenesis (Lestari, 2011).
Kultur kalus selain dapat digunakan untuk teknik perbanyakan tanaman juga merupakan salah satu cara untuk memproduksi senyawa metabolit sekunder (George dan Sherington, 1994). Pada kultur kalus, pemberian zat pengatur tumbuh (ZPT) baik auksin maupun sitokinin sangat diperlukan. Penggunaan ZPT tersebut secara tunggal atau kombinasi dengan konsentrasi yang tepat diharapkan dapat menginduksi dan meningkatkan pertumbuhan kalus sehingga didapatkan biomassa yang besar.
Terbentuknya kalus yang bertekstur kompak dipacu oleh adanya hormon auksin endogen yang diproduksi secara internal oleh eksplan yang telah tumbuh membentuk kalus tersebut. Pemberian zat pengatur tumbuh dapat mempengaruhi produksi metabolit sekunder, hal ini disebabkan ZPT yang ditambahkan dapat menyebabkan perubahan fisiologi dan biokimia tumbuhan melalui pengaturan kerja enzim. ZPT berperan dalam pengikatan membran protein yang berpotensi untuk aktivitas enzim. Hasil pengikatan ini mengaktifkan enzim tersebut dan mengubah substrat menjadi beberapa produk baru. Produk baru yang terbentuk ini menyebabkan serentetan reaksi-reaksi sekunder salah satunya adalah pembentukan metabolit sekunder (Nur dan Dini, 2013).
Zat Pengatur Tumbuh
yakni tidak mudah terurai oleh pemanasan pada proses sterilisasi dan harganya relatif murah (Nurfadilah, 2013).
Zat pengatur tumbuh (ZPT) didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil yang disintesiskan pada bagian tertentu tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis. ZPT dalam tanaman bekerja saling berinteraksi sehingga merupakan suatu sistem yang digunakan dalam perkembangan tanaman, namun pengaruhnya tidak dapat digeneralisasikan. ZPT yang umum digunakan untuk menumbuhkan organ-organ baru dalam kultur in-vitro adalah golongan auksin dan sitokinin (Wattimena et al., 1992).
Pada tahap induksi kalus perlu ada penambahan ZPT seperti auksin. Kalus dapat diinduksi dari eksplan potongan daun yang dikulturkan pada perlakuan 2,4 D. Induksi kalus diawali dengan penebalan eksplan pada bagian potongan dan di daerah yang mengalami pelukaan. Penebalan tersebut merupakan interaksi eksplan dengan media tumbuh, zat pengatur tumbuh dan lingkungan tumbuh sehingga ekspan bertambah besar (Yelnititis dan Komar, 2010).
secara alamiahnya bersifat autotrof dikondisikan menjadi heterotrof dengan cara memberikan nutrisi yang cukup kompleks di dalam medium kultur, sehingga sel-sel membelah secara tidak terkendali membentuk massa sel-sel yang tidak terorganisir (kalus) (Rusdianto dan Indrianto, 2012).
Menurut Jimnez and Bangerth (2001) selain auksin, sitokinin juga berfungsi untuk menstimulasi pembelahan pada massa pro-embriogenik sel. Keduanya dibutuhkan untuk inisiasi kalus embriogenik. Penambahan auksin-sitokinin ke dalam medium tumbuh adalah untuk mengatur pembelahan, pemanjangan, diferensiasi sel, dan pembentukan organ. Dengan mengetahui pengaruh auksin dan sitokinin dalam menginduksi kalus embriogenik pada kultur meristem.
Umumnya spesies tanaman membutuhkan konsentrasi auksin yang tinggi (biasanya 2,4-D) untuk induksi embriogenesis somatik, sedangkan sitokinin tidak dibutuhkan. Tetapi pada spesies tertentu dari tanaman monokotil dibutuhkan sitokinin (Laublin et al., 1991). Pada umumnya pemberian auksin ke dalam medium padat tanpa sitokinin dapat menginduksi kalus embriogenik, tetapi dengan ditambahkan sitokinin akan meningkatkan proliferasi kalus embriogenik. Kalus Embriogenik
sering ditambahkan pada media kultur in vitro adalah ZPT golongan auksin dan sitokinin. ZPT sintetik golongan auksin seperti NAA, dan 2,4-D, NAA lebih sering digunakan karena lebih stabil dari yang lain. ZPT sintetik golongan sitokinin yang sering digunakan seperti BAP dan 2-iP (Azriati et al., 2008).
Menurut Lestari (2007) zat pengatur tumbuh merupakan salah satu faktor penting dalam induksi kalus dan penentuan arah regenerasi kalus menjadi tanaman. Zat pengatur tumbuh paling penting yang terlibat dalam arah regenerasi kalus menjadi tanaman pada kultur in vitro adalah auksin, sitokonin dan giberelin eksogen yang terkandung dalam media.
Kalus adalah jaringan meristematik yang merupakan wujud dari dediferensiasi. Dalam kultur jaringan menginduksi terbentuknya kalus merupakan langkah yang penting. Setelah terbentuknya kalus baru diberikan perlakuan rangsangan untuk berdiferensiasi membentuk akar atau tunas. Secara histologi, kalus berasal dari pembelahan berkali – kali sel – sel parenkim di sekitar berkas pengangkut dan beberapa elemen penyusun berkas pengangkut kecuali xilem. Dalam teknik kultur jaringan (in vitro), kalus dapat diinduksi dengan menambahkan zat pengatur tumbuh yang sesuai pada media kultur. Selain zat pengatur tumbuh atau hormon pertumbuhan, penambahan vitamin dan protein juga diperlukan untuk pertumbuhan kalus. Induksi kalus dalam teknik kultur jaringan tanaman diperlukan untuk memunculkan keragaman sel somatik di dalam kultur in vitro dan meregenerasikan sel tersebut menjadi embrio somatik (Nanang, 2009).
pembelahan sel tertinggi, 3) fase linier, yaitu fase dari pembelahan sel mulai melambat tetapi laju dari perkembangan sel meningkat, 4) fase perlambatan, di mana laju pembelahan sel dan pemanjangan sel menurun, 5) fase stasioner, di mana jumlah dan ukuran sel konstan stabil (Purnamaningsih dan Misky, 2011).
Pertumbuhan adalah peningkatan permanen ukuran organisme atau bagian dari tumbuhan yang merupakan hasil dari peningkatan jumlah dan ukuran sel. Pertumbuhan dicirikan dengan bertambahnya berat yang irreversible, sehingga pengukuran berat segar kalus dapat mewakili variabel pertumbuhan kalus. Berat segar secara fisiologis terdiri dari dua kandungan yaitu air dan karbohidrat. Berat segar kalus yang besar ini disebabkan karena kandungan airnya yang tinggi. Berat basah yang dihasilkan sangat tergantung pada kecepatan sel-sel tersebut membelah diri, memperbanyak diri dan dilanjutkan dengan membesarnya kalus (Nur dan Dini, 2013).
yang keras dan kompak. Namun ada kalus yang tumbuh terpisah – pisah menjadi fragmen-fragmen yang kecil, kalus yang demikian dikenal dengan kalus remah (friable). Warna kalus dapat bermacam-macam tergantung dari jenis sumber eksplan itu diambil, seperti warna kekuning – kuningan, putih, hijau, atau kuning kejingga – jingaan (Sari, 2009).
Warna kalus yang masih menunjukkan warna kekuningan menunjukkan bahwa kalus tersebut masih aktif berdiferensiasi, kalus tersebut diduga juga mengandung klorofil dan menunjukkan adanya trikoma glandular yang merupakan tempat terakumulasinya artemisinin, sehingga pada fase akhir eksponensial masih dimungkinkan terjadinya aktivitas sintesis artemisinin. Jika sebaliknya terjadi perubahan wama kalus menjadi kecoklatan/browning, kemungkinan besar pertumbuhan dan perkembangan kalus tersebut telah memasuki fase stasioner (penuaan) sehingga menyebabkan produksi metabolit sekunder menurun (Purnamaningsih dan Misky, 2011).
tekstur kompak (non friable). Tekstur kalus yang kompak dianggap baik karena dapat mengakumulasi metabolit sekunder lebih banyak (Nur dan Dini, 2013). Varietas
Program pemuliaan tanaman di Indonesia didasarkan atas petimbangan untuk mendapatkan varietas unggul yang berdaya hasil tinggi, memiliki mutu yang baik serta mempunyai sifat-sifat unggul lainnya seperti toleran terhadap kekeringan, lahan masam, salinitas tinggi, tahan rebah, hama dan penyakit. Kombinasi teknik seleksi dengan iradiasi secara in vitro telah terbukti dapat lebih efektif dan efisien untuk mendapatkan keragaman genetik yang inginkan. Dalam hal ini, iradiasi akan meningkatkan keragaman genetik populasi sel somatik, melalui seleksi menggunakan metode tertentu akan menyingkirkan mutasi yang tidak diinginkan sehingga populasi somaklon yang dihasilkan sesuai dengan yang diinginkan (Lestari, 2007).
Varietas adalah kelompok tanaman dalam jenis atau spesies tertentu yang dapat dibedakan dari kelompok lain berdasarkan suatu sifat atau sifat-sifat tertentu. Pada umumnya tanaman memiliki perbedaan fenotip dan genotip yang sama. Perbedaan varietas cukup besar mempengaruhi perbedaan sifat dalam tanaman. Keragaman penampilan tanaman terjadi akibat sifat dalam tanaman (genetik) atau perbedaan lingkungan kedua-duanya. Perbedaan susunan genetik merupakan salah satu faktor penyebab keragaman penampilan tanaman (Liptan, 2000).
Pengaruh Penggenangan Terhadap Fisiologis Tanaman
dengan adanya metode melalui seleksi in vitro akan menghasilkan varietas baru yang tahan terhadap cekaman biotik dan abiotik dengan sifat yang diwariskan. Selain itu teknik ini lebih efisien karena kondisi seleksi dapat dibuat homogen, tempatnya relatif lebih sedikit, dan efektif selesi lebih tinggi. Penggunaan teknik in vitro akan menghasilkan populasi sel varian melalui seleksi pada media yang sesuai (Serres and Voesenek, 2008).
Cekaman oksigen rendah (hipoksia) juga memicu respons seluler tanaman seperti penurunan pH. Peristiwa ini diamati pada kebanyakan organisme dan merupakan faktor penting untuk ketahanan (survival) tanaman pada kondisi hipoksia. Penurunan pH sebagai salah satu tanggapan setelah terjadi hipoksia akar. Perubahan pH seluler mengawali kematian sel dan pembentukan aerenkim. Selain itu, perubahan pH juga berhubungan dengan ABA dalam mengatur stomata dan sebagai sinyal selama kekeringan dan cekaman genangan (Jackson and Ram, 2003).
Pada beberapa hasil penelitian dikatakan bahwa hormon tumbuhan dapat menginduksi perubahan peroksidase dan polifenol oksidase seiring dengan adanya regulasi dari pertumbuhan dan perkembangan tanaman. Dalam hal resistensi terhadap adanya patogen pada tanaman, aktivitas peroksidase akan meningkat pada tanaman yang terserang patogen dan enzim ini akan membentuk suatu ketahanan internal yang dapat meningkatkan resistensi dari tanaman (Arora dan Bajaj, 1981).
udara. Kondisi ini menyebabkan terjadinya hipoksia atau anoksia di sekitar perakaran. Oksigen sangat berperan dalam proses metabolisme yang menghasilkan energi di dalam sel, sehingga konsentrasi oksigen yang sangat rendah di perakaran menyebabkan terganggunya aktivitas metabolik dan produksi energi (Sutrian, 2004).
Oksigen berfungsi sebagai akseptor elektron dalam jalur fosforilasi oksidatif yang menghasilkan ATP yang merupakan sumber energi utama dalam metabolisme seluler. Dalam kondisi anoksia, jaringan padi mensintesis lebih banyak solubel protein. Sebagian besar anaerobik protein ini adalah enzim yang terlibat dalam metabolisme karbohidrat (alkohol dehidrogenase, aldolase, glukosa phosphat isomerase, sukrosa synthase, piruvat decarboksilase, gliserol phosphat dehidrogenase). Protein tersebut akan diproduksi beberapa jam setelah anoksia. Seperti telah disebutkan di atas bahwa oksigen berfungsi sebagai akseptor penghasil energi dalam proses respirasi. Pada tanaman yang tidak toleran genangan atau bila tanaman terendam semua, kontak antara tanaman dengan oksigen menjadi terhambat sehingga proses respirasi tersebut tidak dapat dilangsungkan (Tabin, 2010).
senyawa protein dalam sel. Nitrogen merupakan komponen utama protein sel yang merupakan bagian dasar kehidupan organisme dan berfungsi untuk menyokong unsur dari sel serta membentuk senyawa penting di dalam sel, termasuk protein dan merupakan bagian penting dari klorofil (Dwidjoseputro, 1987).
Sistem antioksidan di dalam sel tumbuhan menyediakan perlindungan melawan pengaruh racun dari oksigen spesies yang aktif. Komponen penting dari sistem pelindungan itu adalah pertahanan secara enzimatis, seperti SOD dan katalase yang dapat menghindari O2 - dan H2O2 selain metabolit seperti askorbat,
glutation dan tokoperol yang berfungsi untuk mengatur tingkat keaktifan oksigen pada jaringan tanaman. Tanaman dapat bertahan apabila enzim SOD dan katalase dapat melindungi jaringan tanaman dalam kondisi cekaman oksidatif (Bosch and Alegre, 2002)
Penggunaan mutagen dapat menyebabkan perubahan genetik pada tanaman. Perubahan genetik akan berpengaruh terhadap proses fisiologis terutama metabolisme sel. Metabolisme berkaitan erat dengan aktivitas dan distribusi dari beberapa enzim pada tanaman seperti peroksidase dan polifenol oksidase. Kedua enzim ini pada tumbuhan terdapat pada organ, jaringan, sel serta komponen terkecil dari sel seperti organel serta bagian interselulernya. Peranan dari peroksidase dan polifenol oksidase yaitu berperan dalam proses pertumbuhan dan perkembangan tumbuhan dan juga dapat meningkatkan resisten ketahanan dari tumbuhan tersebut (Widiyanto, 1992).
jaringan tanaman, sel serta komponen subselulernya termasuk organel sel Peroksidase merupakan anggota dari enzim reduktase yang dianggap memiliki hubungan nyata dengan penyebab perubahan pada rasa, warna, tekstur dan kandungan gizi buah-buahan dan sayur-sayuran yang belum diolah. Peroksidase pada tanaman merupakan isozim yang berperan dalam pertumbuhan, diferensiasi dan pertahanan. Aktivitas isozim peroksidase dapat dideteksi karena adanya aktivitas yang luar biasa pada jaringan. Peroksidase mengkatalisis H2O2 menjadi H2 dan O2 (Gaspar et al., 1980).
PENDAHULUAN Latar Belakang
Kedelai merupakan sumber protein nabati utama bagi sebagian besar penduduk Indonesia. Sampai saat ini kedelai masih menjadi salah satu komoditas pangan yang sangat penting di Indonesia. Dalam rangka meningkatkan ketahanan pangan di tingkat nasional khususnya ketersediaan bahan pangan kedelai, diperlukan upaya yang sungguh-sungguh untuk meningkatkan produksinya dan tentunya harus diprogramkan secara teliti, terencana, berjangka panjang dan tepat sasaran. Pemanfaatan utama kedelai adalah dari biji. Biji kedelai kaya protein dan lemak serta beberapa bahan gizi penting lain, misalnya vitamin (asam fitat) dan lesitin. Biji yang diolah menjadi tepung kedelai secara garis besar dapat dibagi menjadi 2 kelompok manfaat utama, yaitu olahan dalam bentuk protein kedelai dan minyak kedelai (Ohorella, 2011).
Kebutuhan kedelai meningkat setiap tahunnya sehingga menimbulkan tantangan yang berat bagi pembangunan pertanian kedelai, tantangan ini semakin berat karena di satu sisi laju permintaan terus meningkat, akan tetapi disisi lain muncul berberapa permasalahan diantaranya keterbatasan lahan yang sempit. Rata-rata kebutuhan kedelai setiap tahunnya sebesar ± 2,2juta ton biji kering, akan tetapi kemampuan produksi dalam negeri saat ini baru mampu memenuhi sebanyak 779.992 ton (BPS, 2013) atau 33,91 % dari kebutuhan sedangkan berdasarkan ARAMII tahun 2014 baru mencapai 921.336 ton atau 40,06% (Kementerian Pertanian, 2015).
Tersedianya varietas kedelai yang adiptif pada kondisi tersebut memberikan arti penting dalam rangka percepatan peningkatan produksi kedelai dalam negeri. Untuk mengatasi pengaruh genangan, pemilihan varietas toleran terhadap keadaan tersebut perlu dilakukan, metode seleksi untuk memilih varietas toleran terhadap genangan dapat dilakukan di lapang atau di laboratorium. Viabilitas benih pada kondisi suboptimum dapat dideteksi dan dilakukan di rumah kaca atau di laboratorium dengan mengecambahkan benih pada media yang dapat dikontrol dan praktis seperti metode kultur jaringan.
Dalam membantu proses uji coba varietas kedelai yang tahan terhadap fase penggenangan, kultur jaringan merupakan teknik yang dipromosikan, karena dengan adanya metode melalui seleksi in vitro akan menghasilkan varietas baru yang tahan terhadap cekaman biotik dan abiotik dengan sifat yang diwariskan. Selain itu teknik ini lebih efisien karena kondisi seleksi dapat dibuat homogen, tempatnya relatif lebih sedikit, dan efektif selesi lebih tinggi. Penggunaan teknik in vitro akan menghasilkan populasi sel varian melalui seleksi pada media yang sesuai (Suwignyo, 2007).
Pengembangan kedelai toleran genangan tidak hanya bermanfaat bagi pengembangan kedelai di lahan sawah, tetapi juga prospektif bagi wilayah yang sering mengalami cekaman genangan seperti lahan pasang surut. Luas lahan pasang surut di Indonesia mencapai 20,10 juta ha, sekitar 20-30% diantaranya berpotensi sebagai lahan pertanian. Untuk mendukung peningkatan produksi kedelai tersebut melalui penanaman varietas unggul toleran genangan diantaranya Baluran, Gepak Kuning dan Willis maka produksi kedelai pada lahan di Indonesia dapat dioptimalkan (Suriadikarta dan Satria, 2007).
Berdasarkan uraian diatas penulis tertarik untuk melakukan penelitian terhadap identifikasi kalus embriogenik pada beberapa varietas kedelai dengan pemberian kombinasi ZPT 2,4D dan kinetin pada kondisi hipoksia secara in vitro. Tujuan Penelitian
Untuk mengetahui kombinasi dari ZPT 2,4D dan kinetin yang efektif dalam menginduksi kalus embriogenik dari beberapa varietas kedelai pada kondisi hipoksia secara in vitro.
Hipotesis Penelitian
1. Zat pengatur tumbuh 2,4D dan Kinetin berpengaruh nyata terhadap pertumbuhan kalus embriogenik tanaman kedelai pada kondisi hipoksia secara in vitro.
2. Interaksi antara varietas kedelai dengan ZPT 2,4D dan kinetin berpengaruh nyata terhadap pertumbuhan kalus embriogenik tanaman kedelai pada kondisi hipoksia secara in vitro.
Kegunaan Penelitian
ABSTRAK
Dian Simbolon, Identifikasi Kalus Embriogenetik pada Beberapa Varietas Kedelai dengan Pemberian Kombinasi 2,4D dan Kinetin pada Kondisi Hipoksia Secara In Vitro. Dibimbing oleh Revandy I. M Damanik dan Rosmayati.
Kebutuhan kedelai terus meningkat namun produksi belum mampu memenuhi kebutuhan kedelai nasional. Salah satu upaya untuk meningkatkan produksi adalah dengan mengindentifikasi kedelai yang toleran terhadap genangan. Penelitian ini bertujuan untuk mengetahui kombinasi dari ZPT 2,4D dan kinetin yang efektif dalam menginduksi kalus embriogenik dari beberapa varietas kedelai pada kondisi hipoksia secara in vitro. Penelitian dilaksanakan di Laboratorium Kultur Jaringan Tanaman Universitas Sumatera Utara, Medan pada bulan Maret sampai Oktober 2016. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor perlakuan. Faktor pertama adalah beberapa varietas yang diuji terdiri dari Baluran, Gepak Kuning dan Willis. Faktor kedua adalah konsentrasi kombinasi ZPT. Parameter yang diamati adalah pertumbuhan kalus, bentuk dan warna kalus, berat bobot kalus, pengukuran kandungan klorofil, analisis total protein, analisis enzim POD dan SOD. Hasil analisis data menunjukkan bahwa perlakuan varietas, zat pengatur tumbuh dan penggenangan berpengaruh nyata dalam pertambahan bobot kalus kedelai.
ABSTRACT
Dian Simbolon, Identification embriogenic callus on several soybean varieties by giving several combination of 2,4 D and Kinetin at Hypoxic Condition. Supervisied by Revandy I. M Damanik and Rosmayati.
Soybean demand continues to increase as the number of people , but the production has not be enable to complete the needs of national soybean. One effort to increase production is to indentificat soybean acreage of inundation. The aims of this research was to determine the best combination of 2,4D and Kinetin in inducing embryogenic callus on some varieties of soybean in hypoxic condition. This research was carried out in The Tissue Culture Laboratory, Agriculture’s Faculty Of North Sumatera. This research conducted on March until October 2016. Thus research used factorial Completely Randomized Design with three factors were varieties, combination of ZPT and Inundation treatment. The parameters measured are visualization of callus, percentage of growth callus, percentage of weight callus, the amount of chlorophyll, concentration of protein, analysis to SOD enzyme activity and POD enzyme activity.The results showed that Varieties, Zat pengatur tumbuh and hypoxic factor give significant effect to percentage of weight callus
IDENTIFIKASI KALUS EMBRIOGENIK PADA BEBERAPA VARIETAS KEDELAI (Glycine max (L.) Merill) DENGAN PEMBERIAN 2,4D DAN
KINETIN PADA KONDISI HIPOKSIA SECARA IN VITRO
SKRIPSI
OLEH: DIAN SIMBOLON
120301274
AET- PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
IDENTIFIKASI KALUS EMBRIOGENIK PADA BEBERAPA VARIETAS KEDELAI (Glycine max (L.) Merill) DENGAN PEMBERIAN 2,4D DAN
KINETIN PADA KONDISI HIPOKSIA SECARA IN VITRO
SKRIPSI
OLEH: DIAN SIMBOLON
120301274
AET- PEMULIAAN TANAMAN
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul Penelitian : Identifikasi Kalus Embriogenik pada BeberapaVarietas Kedelai (Glycine max (L.) Merill) dengan Pemberian 2,4D dan Kinetin pada Kondisi Hipoksia Secara In Vitro
Nama : Dian Simbolon
NIM : 120301274
Program Studi : Agroekoteknologi Minat : Pemuliaan Tanaman
Disetujui Oleh: Komisi Pembimbing
(Ir. Revandy I. M Damanik Msi, M.Sc , Ph.D.)
Ketua Komisi Pembimbing Anggota Komisi Pembimbing (Prof.Dr. Ir. Rosmayati, MS.)
Diketahui Oleh:
(Prof. Dr. Ir. T. Sabrina, M. Sc Ketua Program Studi Agroekoteknologi
ABSTRAK
Dian Simbolon, Identifikasi Kalus Embriogenetik pada Beberapa Varietas Kedelai dengan Pemberian Kombinasi 2,4D dan Kinetin pada Kondisi Hipoksia Secara In Vitro. Dibimbing oleh Revandy I. M Damanik dan Rosmayati.
Kebutuhan kedelai terus meningkat namun produksi belum mampu memenuhi kebutuhan kedelai nasional. Salah satu upaya untuk meningkatkan produksi adalah dengan mengindentifikasi kedelai yang toleran terhadap genangan. Penelitian ini bertujuan untuk mengetahui kombinasi dari ZPT 2,4D dan kinetin yang efektif dalam menginduksi kalus embriogenik dari beberapa varietas kedelai pada kondisi hipoksia secara in vitro. Penelitian dilaksanakan di Laboratorium Kultur Jaringan Tanaman Universitas Sumatera Utara, Medan pada bulan Maret sampai Oktober 2016. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor perlakuan. Faktor pertama adalah beberapa varietas yang diuji terdiri dari Baluran, Gepak Kuning dan Willis. Faktor kedua adalah konsentrasi kombinasi ZPT. Parameter yang diamati adalah pertumbuhan kalus, bentuk dan warna kalus, berat bobot kalus, pengukuran kandungan klorofil, analisis total protein, analisis enzim POD dan SOD. Hasil analisis data menunjukkan bahwa perlakuan varietas, zat pengatur tumbuh dan penggenangan berpengaruh nyata dalam pertambahan bobot kalus kedelai.
ABSTRACT
Dian Simbolon, Identification embriogenic callus on several soybean varieties by giving several combination of 2,4 D and Kinetin at Hypoxic Condition. Supervisied by Revandy I. M Damanik and Rosmayati.
Soybean demand continues to increase as the number of people , but the production has not be enable to complete the needs of national soybean. One effort to increase production is to indentificat soybean acreage of inundation. The aims of this research was to determine the best combination of 2,4D and Kinetin in inducing embryogenic callus on some varieties of soybean in hypoxic condition. This research was carried out in The Tissue Culture Laboratory, Agriculture’s Faculty Of North Sumatera. This research conducted on March until October 2016. Thus research used factorial Completely Randomized Design with three factors were varieties, combination of ZPT and Inundation treatment. The parameters measured are visualization of callus, percentage of growth callus, percentage of weight callus, the amount of chlorophyll, concentration of protein, analysis to SOD enzyme activity and POD enzyme activity.The results showed that Varieties, Zat pengatur tumbuh and hypoxic factor give significant effect to percentage of weight callus
RIWAYAT HIDUP
Dian Simbolon, lahir di Pematangsiantar, 07 April 1994, anak dari S.A Simbolon dan T Samosir merupakan anak ketiga dari tiga bersaudara.
Tahun 2012 penulis lulus dari SMA Negeri 4 Pematangsiantar dan pada tahun yang sama diterima di Program Studi Agroekoteknologi Fakulas Pertanian USU melalui jalur Ujian Masuk Bersama (UMB) Reguler dan memilih minat Pemuliaan Tanaman.
Selama menjadi mahasiwa, penulis aktif dalam organisasi Himpunan Mahasiswa Agroekoteknologi (HIMAGROTEK) dan aktif dalam kegiatan organisasi IMK (Ikatan Mahasiswa Katolik).
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa, atas berkat dan rahmat-Nya lah sehingga penulis dapat menyelesaikan skripsi ini dengan baik dan tepat pada waktunya. Judul dari skripsi ini adalah “Identifikasi Kalus Embriogenetik pada Beberapa Varietas Kedelai dengan Pemberian Kombinasi 2,4D dan Kinetin pada Kondisi Hipoksia Secara In Vitro”.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada kedua orangtua dan kedua abang penulis yang telah merawat dan mendidik penulis selama ini. Penulis juga mengucapkan terima kasih kepada Bapak Ir. Revandy I. M Damanik Msi, M.Sc , Ph.D. selaku ketua komisi pembimbing dan Prof. Dr. Ir. Rosmayati, MS., selaku anggota komisi pembimbing yang telah membimbing dan memberikan kritik dan saran dalam penyelesaian skripsi ini.
Akhir kata penulis mengucapkan terima kasih. Semoga Skripsi ini dapat menjadi bahan informasi yang bermanfaat bagi pihak yang membutuhkan.
Medan, November 2016
DAFTAR ISI
ABSTRAK ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR GAMBAR ... vi
DAFTAR TABEL ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesis Penelitian ... 3
Kegunaan Penelitian ... 4
TINJAUAN PUSTAKA Botani Tanaman ... 5
Kultur Kalus ... 7
Zat Pengatur Tumbuh ... 9
Kalus Embriogenik ... 12
Verietas ... 14
Pengaruh Penggenangan Terhadap Tanaman ... 16
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian ... 20
Bahan dan Alat ... 20
Metode Penelitian ... 21
Pelaksanaan Penelitian ... 22
Tahap I: Pembentukan Kalus Embriogenik ... 22
Sterilisasi Alat ... 22
Pembuatan Media ... 23
Persiapan Ruang Kultur ... 24
Strilisasi Eksplan ... 24
Penanaman ... 25
Tahap II : Identifikasi Kalus Embriogenik Toleran Penggenangan ... 26
Aplikasi Penggenangan Terhadap Kalus ... 26
Pengukuran Kadar Klorofil (mg/L/L) ... 27
Analisis Total Protein (mg/L) ... 27
Analisis Enzim Peroksidase (unit/mg/L protein) ... 27
Analisis Enzim SOD (unit/mg/L protein) ... 27
Peubah Amatan ... 27
Persentase Eksplan Membentuk Kalus (%) ... 27
Bentuk dan Warna Kalus ... 27
Berat Bobot Kalus(g) ... 27
Pengukuran Kandungan Klorofil (mg/L/L) ... 28
Analisis Total Protein(mg/L) ... 28
Analisis Enzim Peroksidase (unit/mg/L protein) ... 29
Analisis Enzim SOD (unit/mg/L protein) ... 30
HASIL DAN PEMBAHASAN Hasil ... 31
Tahap I : Pembentukan Kalus Embriogenik ... 31
Persentase Pertumbuhan Kalus (%) ... 31
Keadaan Visual Kalus ... 31
Bobot Segar Kalus (g) ... 32
Tahap II : Identifikasi Kalus Embriogenik Toleran Genangan ... 33
Nilai Total Protein (mg/L) ... 33
Aktivitas Enzim SOD (unit/mg/L protein) ... 34
Aktivitas Enzim Peroksidase (unit/mg/L protein) ... 35
Klorofil Total (mg/L/L)... 36
Pembahasan ... 37
KESIMPULAN DAN SARAN Kesimpulan ... 41
Saran ... 41
DAFTAR PUSTAKA ... 42
DAFTAR GAMBAR
No. Hal.
DAFTAR TABEL
No. Hal.
1. Berat Bobot Kalus (gram) ... 32 2. Interaksi Rataan Nilai Total Protein Antara Varietas dan Zat Pengatur
Tumbuh (mg/l) ... 33 3. Rataan Aktivitas Enzim SOD (unit/mg/l protein) ... 34 4. Rataan Aktivitas Enzim POD (unit/mg/l protein) ... 35 5. Interaksi rataan nilai aktivitas enzim SOD anatara varietas dan zat
pengatur tumbuhantara varietas dan penggenangan (unit/mg/l protein) .... 36 6. Rataan Klorofil Total (mg/l) ... 37 7. Interaksi Rataan Klorofil Total Antara Varietas dan Zat Pengatur Tumbuh
DAFTAR LAMPIRAN
No. Hal.
1. Bagan Alur Penelitian ... 45
2. Kegiatan Penelitian ... 46
3. Deskripsi Kedelai Varietas Baluran ... 47
4. Deskripsi Kedelai Varietas Gepak Kuning ... 48
5. Deskripsi Kedelai Varietas Willis ... 49
6. Komposisi Medium Murashige dan skoog (MS) ... 50
7. Model Sidik Ragam Rancangan Acak Kelompok ... 51
8. Data Persentase Pertumbuhan... 52
9. Data Bobot Segar Kalus... 53
10. Data Persentase Kadar Protein... 54
11. Nilai Aktivitas Enzim SOD ... 55
12. Nilai Aktivitas Enzim POD ... 56