UJI AKTIVITAS EKSTRAK ETANOL 90% DAUN
KELOR (
Moringa oleifera
Lam) TERHADAP
KONSENTRASI SPERMATOZOA, MORFOLOGI
SPERMATOZOA, DAN DIAMETER TUBULUS
SEMINIFERUS PADA TIKUS JANTAN GALUR
SPRAGUE-DAWLEY
SKRIPSI
AFINA ALMAS GHASANI
1112102000050
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UJI AKTIVITAS EKSTRAK ETANOL 90% DAUN
KELOR (
Moringa oleifera
Lam) TERHADAP
KONSENTRASI SPERMATOZOA, MORFOLOGI
SPERMATOZOA, DAN DIAMETER TUBULUS
SEMINIFERUS PADA TIKUS JANTAN GALUR
SPRAGUE-DAWLEY
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
AFINA ALMAS GHASANI
1112102000050
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Nama : Afina Almas Ghasani Program Studi : Farmasi
Judul : Uji Aktivitas Ekstrak Etanol 90% Daun Kelor (Moringa oleifera Lam) terhadap Konsentrasi Spermatozoa, Morfologi Spermatozoa, dan Diameter Tubulus Seminiferus Pada Tikus Jantan Galur Sprague-Dawley
Tanaman kelor (Moringa oleifera Lam) dikenal sebagai miracle tree karena hampir tiap bagian tanaman ini dapat digunakan untuk berbagai pengobatan. Daun Moringa oleifera mengandung beberapa golongan metabolit sekunder utama seperti alkaloid, flavonoid, tanin, dan isotiosianat yang berpotensi sebagai agen antifertilitas. Penelitian ini dilakukan untuk menguji potensi efek antifertilitas ekstrak etanol 90% daun kelor (Moringa oleifera Lam) pada tikus jantan. Penelitian ini bersifat rancang acak lengkap. Dua puluh ekor tikus jantan galur Sprague dawley dibagi menjadi 4 kelompok yaitu kelompok kontrol (Na CMC 0,5%), kelompok perlakuan I (200mg/kgBB), II (400 mg/kgBB), dan III (600 mg/kgBB). Ekstrak diberikan secara oral setiap hari selama 15 hari. Pada hari ke-16 tikus dikorbankan dan dilakukan pembedahan. Parameter antifertilitas yang dievaluasi pada penelitian ini terdiri dari konsentrasi spermatozoa, morfologi spermatozoa, dan diameter tubulus seminiferus. Data yang diperoleh dianalisis secara statistik menggunakan menggunakan uji one way ANOVA, Kruskal Wallis, dan LSD. Hasil penelitian menunjukkan bahwa ekstrak etanol 90% daun Moringa oleifera pada dosis 200 mg/kgBB, 400 mg/kgBB, dan 600 mg/kgBB dapat menurunkan konsentrasi spermatozoa, meningkatkan abnormalitas morfologi spermatozoa, dan menurunkan diameter tubulus seminiferus secara bermakna terhadap kontrol (p<0,05). Berdasarkan hasil penelitian tersebut, ekstrak etanol 90% daun Moringa oleifera memiliki efek antifertilitas yang selanjutnya dapat dikembangkan.
Name : Afina Almas Ghasani Program Study : Pharmacy
Title : Determination of 90% Ethanolic Extract of Kelor Leaves (Moringa oleifera Lam) Activity Against Spermatozoa Concentration, Spermatozoa Morphology, and Seminiferous Tubular Diameter in Male Sprague-Dawley Rats.
Kelor (Moringa oleifera Lam) known as miracle tree because almost all the parts of this plant have been used for various medicine. Moringa oleifera leaves contain main secondary metabolites such as alkaloid, flavonoid, tannin, and isothyocianate that can potencially be antifertility agent. The aim of this study was to evaluate the antifertility effect potency of 90% ethanolic Moringa oleifera leaves extract on male rat. This study was an experimental completely randomized design. Twenty Sprague-Dawley male rats were divided into four groups; control group (Na CMC 0,5%), treatment I (200 mg/kgBB), II (400 mg/kgBB), and III (600 mg/kgBB). The extract was given orally once a day for 15 days. At day 16, rats were euthanized. Antifertility parameter which evaluated in this study were sperm concentration, spermatozoa morphology, and seminiferous tubular diameter. Data was analyzed statistically by using one way ANOVA, Kruskal Wallis, and LSD test. The result showed that 90% ethanolic extract of Moringa oleifera leaves in dosage 200 mg/kgBW, 400 mg/kgBW, and 600 mg/kgBW decrease sperm concentration, increase abnormality of spermatozoa
morphology, and decrease seminiferous tubular diameter significantly (p≤0,05)
compared to control. Based on the results, 90% ethanolic extract of Moringa oleifera leaves has antifertility effect which can be developed further.
Puji dan syukur senantiasa penulis panjatkan kehadirat Allah SWT, Pemilik ilmu pengetahuan yang telah melimpahkan rahmat dan hidayah-Nya sehingga dengan seizin-Nya lah penulis dapat menyelesaikan penelitian dan menyusun skripsi berjudul “Uji Aktivitas Ekstrak Etanol 90% Daun Kelor (Moringa oleifera Lam) terhadap Konsentrasi Spermatozoa, Morfologi Spermatozoa, dan Diameter Tubulus Seminiferus Pada Tikus Jantan Galur Sprague-Dawley”. Shalawat serta salam semoga selalu tercurah kepada junjungan kita Nabi Muhammad SAW yang telah menjadi suritauladan bagi umatnya.
Penulis menyadari bahwa dalam penelitian dan penyusunan skripsi ini penulis telah memperoleh bantuan, bimbingan, motivasi, dan saran dari berbagai pihak. Oleh karena itu pada kesempatan ini perkenankanlah penulis menyampaikan ucapan terimakasih yang tulus dan sebesar-besarnya kepada:
1. Dr. Nurmeilis, M.Si., Apt selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
2. Dr. Azrifitria, M.Si., Apt dan Puteri Amelia, M.Farm., Apt selaku dosen pembimbing yang dengan sabar memberikan ilmu, masukan, dukungan, dan semangat kepada penulis.
3. Ibunda tercinta Siti Resnawati dan ayahanda tercinta Y. Wahyu Kustiawan yang senantiasa memberikan kasih sayang, pengorbanan, dukungan, serta doa yang tulus dan tiada henti dalam setiap langkah penulis. Semoga Allah senantiasa memberikan kebahagiaan dan membalas segala kebaikan ibunda dan ayahanda dengan jannah-Nya.
4. Adikku tersayang Aqbil Mufid Khalidan dan Akmal Nudiya Albar yang selalu menjadi penghibur di saat penat dan senantiasa menjadi motivasi penulis untuk selalu melakukan usaha yang terbaik.
yang diberikan kelak dapat menjadi amal jariyah untuk Bapak dan Ibu.
7. Sahabat-sahabat yang selalu menjadi tempat berbagi di saat suka maupun duka, selalu menguatkan penulis selama perkuliahan, Fenny, Rakha, dan Denny yang juga sekaligus menjadi partner terbaik selama penelitian. Semoga Allah selalu menjaga persahabatan kita dan mempermudah urusan kalian semua.
8. Sahabat-sahabat yang selalu membantu dan menjadi tempat berbagi selama penelitian Ade Rachma, Azmi Indillah, Risha Natasya Andriani, Nurul Fitri Rukmana, Siti Windi Hariani, Nita Fitriani, Noni Tri Utami, Zakiyah Zahra, Moethia, Harry Abdul Rahman, dan Nisa Utami Dewi.
9. Sahabat-sahabat yang selalu memberikan semangat dan selalu ada mendengarkan keluh kesah penulis meskipun jarak memisahkan, Juwita Sugitriana, Rias Nurul Suci, Ajeng Purnamasari, dan Predeurike Laora. Semoga sukses selalu menyertai kita semua meskipun melalui jalan yang berbeda.
10.Seluruh kakak-kakak (kak Rian, ka Aci, ka Fiza, ka Fio, ka Rahmi, ka Astri, ka Monica) yang selalu membimbing dan memberi saran terbaik kepada penulis selama penilitian.
11.Keluarga besar HMPS Farmasi UIN Syarif Hidayatullah Jakarta periode 2013-2014 dan periode 2014-2015 yang selalu mendukung dan memberi semangat kepada penulis.
12.Laboran Farmasi UIN Syarif Hidayatullah Jakarta, kak Eris, kak Walid, kak Yaenap, kak Lisna, dan Mbak Rani yang sangat membantu penulis dalam mempersiapkan alat dan bahan selama penelitian.
penulis sebutkan satu persatu.
Penulis menyadari bahwa penyusunan skripsi ini belum sempurna dan banyak kekurangan. Oleh karena itu saran dan kritik yang membangun sangat diharapkan. Semoga skripsi ini dapat bermanfaat bagi penulis pada khususnya dan bagi pembaca pada umumnya. Aamiin Ya Rabbal’alamin.
Ciputat, Juni 2016
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACK ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... xi
DAFTAR ISI ... xii
2.1.3 Deskripsi Tanaman Kelor ... 7
2.1.4 Kandungan Kimia ... 7
2.1.5 Kegunaan ... 11
2.1.6 Telaah Jurnal Penelitian Mengenai Tanaman Kelor (Moringa oleifera Lam) ... 12
2.2 Simplisia ... 13
2.3 Ekstrak dan Metode Ekstraksi ... 13
2.3.1 Definisi Ekstrak ... 13
2.3.2 Definisi Ekstraksi... 14
2.3.3 Metode Ekstraksi ... 14
2.4 Tinjauan Hewan Uji ... 17
2.4.1 Taksonomi Tikus Putih ... 17
2.4.2 Biologi dan Fisiologi Umum Tikus Putih ... 17
2.4.3 Sistem Reproduksi Tikus Jantan ... 18
BAB III METODOLOGI PENELITIAN ... 27
3.1 Waktu dan Tempat Penelitian ... 27
3.1.1 Waktu Penelitian ... 27
3.3 Rancangan Penelitian ... 28
3.3.1 Besar Sampel ... 28
3.3.2 Dosis dan Waktu Perlakuan ... 29
3.4 Prosedur Kerja ... 30
3.4.1 Pemeriksaan Bahan Uji (Determinasi) ... 30
3.4.2 Penyiapan Simplisia dan Pembuatan Ekstrak ... 30
3.4.3 Penapisan Fitokima ... 30
3.4.4 Pengujian Parameter Spesifik dan Non Spesifik Ekstrak ... 32
3.4.5 Penyiapan Hewan Uji ... 33
3.4.6 Pemberian Perlakuan ... 33
3.4.7 Pengukuran Parameter Antifertilitas... 34
3.4.8 Analisis Data ... 36
BAB IV HASIL DAN PEMBAHASAN ... 37
4.1 Hasil Penelitian ... 37
4.1.1 Determinasi Tumbuhan ... 37
4.1.2 Ekstraksi ... 37
4.1.3 Penapisan Fitokimia... 37
4.1.4 Pengujian Parameter Ekstrak ... 38
4.1.5 Pengujian Parameter Antifertilitas ... 39
4.2 Pembahasan ... 45
BAB V KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
5.2 Saran ... 57
DAFTAR PUSTAKA ... 58
Tabel Halaman
Tabel 2.1 Kandungan Kimia Moringa oleifera Lam ... 8
Tabel 3.1 Rancangan Percobaan ... 29
Tabel 3.2 Pengenceran Spermatozoa dan Jumlah Kotak yang Dihitung ... 34
Tabel 3.3 Cara Pengenceran Spermatozoa ... 34
Tabel 3.4 Rumus Konsentrasi Spermatozoa ... 35
Tabel 4.1 Hasil Penapisan Fitokimia Ekstrak Etanol 90% Daun Kelor ... 38
Tabel 4.2 Hasil Pengujian Parameter Ekstrak Etanol 90% Daun Kelor ... 38
Tabel 4.3 Hasil Perhitungan Konsentrasi Spermatozoa Hewan Uji ... 39
Tabel 4.4 Hasil Perhitungan Abnormalitas Morfologi Spermatozoa pada Hewan Uji ... 41
Gambar Halaman
Gambar 2.1 Tanaman Kelor ... 7
Gambar 2.2 Struktur Kimia Senyawa Bioaktif pada Daun Moringa oleifera Lam ... 9
Gambar 2.3 Sistem Urogenital Tikus Jantan Tampak Ventral ... 20
Gambar 2.4 Morfologi Sperma Tikus ... 21
Gambar 2.5 Spermatozoa Tikus yang Teramati pada Pembesaran 400x ... 21
Gambar 2.6 Pengamatan Photomicrograph Spermatozoa Normal ... 22
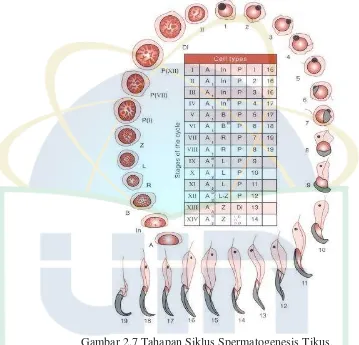
Gambar 2.7 Tahapan Siklus Spermatogenesis Tikus ... 24
Gambar 2.8 Pengaturan Hormon pada Sistem Reproduksi Hewan Jantan ... 26
Gambar 4.1 Grafik Hasil Perhitungan Konsentrasi Spermatozoa Hewan Uji ... 40
Gambar 4.2 Grafik Hasil Perhitungan Jumlah Spermatozoa dengan Morfologi Abnormal ... 42
Lampiran Halaman
1 Hasil Determinasi Tumbuhan ... 66
2 Alur Penelitian ... 67
3 Hasil Uji Etik Penggunaan Hewan Uji... 69
4 Surat Keterangan Kesehatan Hewan Uji ... 70
5 Hasil Penapisan Fitokimia Ekstrak Etanol 90% Daun Kelor (Moringa oleifera Lam) ... 71
6 Hasil Perhitungan Rendemen, Kadar Air, dan Kadar Abu ... 74
7 Perhitungan Dosis Ekstrak Etanol 90% Daun Kel8or (Moringa oleifera Lam) ... 75
8 Dokumentasi Kegiatan Penelitian ... 77
9 Hasil Pengukuran Bobot Badan Tikus ... 85
10 Hasil Perhitungan Konsentrasi Spermatozoa Hewan Uji... 88
11 Analisis Statistik Data Konsentrasi Spermatozoa Hewan Uji ... 89
12 Hasil Perhitungan Abnormalitas Morfologi Spermatozoa Hewan Uji ... 92
13 Analisis Statistik Data Abnormalitas Morfologi Spermatozoa Hewan Uji .... 93
14 Hasil Pengukuran Diameter Tubulus Seminiferus Hewan Uji ... 97
1 UIN Syarif Hidayatullah Jakarta PENDAHULUAN
1.1 Latar Belakang
Salah satu permasalahan utama di Indonesia saat ini adalah kepadatan penduduk. Menurut World Population Data Sheet 2015, Indonesia merupakan Negara ke-4 di dunia dengan estimasi jumlah penduduk terbanyak, yaitu 255,7 juta jiwa. Di antara Negara ASEAN, Indonesia dengan luas wiayah terbesar menjadi negara dengan penduduk terbanyak dengan angka fertilitas atau total fertility rate (TFR) 2,6 yang mana masih berada di atas rata-rata TFR Negara ASEAN yaitu 2,4 (Kementerian Kesehatan RI, 2014).
Perencanaan jumlah penduduk perlu dilakukan karena peningkatan jumlah penduduk dapat berpengaruh terhadap sektor lain seperti pembangunan, pendidikan, kesehatan, lapangan kerja, maupun kriminalitas (Tukiran, 2010). Perencanaan kehidupan berkeluarga yang baik juga akan meningkatkan derajat kesehatan ibu dan anak serta memperbesar peluang meningkatkan kesejahteraan keluarga (BKKBN, 2015). Upaya pemerintah dalam perencanaan jumlah penduduk dilakukan melalui program Keluarga Berencana (KB), yaitu suatu upaya mengatur kelahiran anak, jarak, dan usia ideal melahirkan, mengatur kehamilan, melalui promosi, perlindungan, dan bantuan sesuai hak reproduksi untuk mewujudkan keluarga berkualitas. Pengaturan kehamilan dalam program KB dilakukan dengan menggunakan kontrasepsi (Pusat dan Data Informasi Kementerian Kesehatan RI, 2014).
dipengaruhi oleh beberapa faktor. Menurut BKKBN (2013), faktor utama yang menyebabkan rendahnya partisipasi pria dalam menggunakan kontrasepsi adalah keterbatasan pilihan jenis kontrasepsi pria yang tersedia di pasaran. Metode kontrasepsi pria yang umum di Indonesia saat ini hanya kondom dan MOP (vasektomi), dan masih banyak keluhan masyarakat mengenai dua pilihan kontrasepsi tersebut (BKKBN, 2013). Keluhan yang dirasakan masyarakat mengenai kondom diantaranya adalah adanya perasaan kurang nyaman. Metode MOP (vasektomi) juga kurang disukai karena vasektomi bersifat irreversible sehingga ada keterbatasan untuk menghasilkan turunan kembali. Penelitian mengenai pengembangan kontrasepsi untuk pria perlu terus dikembangkan untuk menghasilkan metode kontrasepsi pria yang efektif, tidak berbahaya untuk kesehatan, reversible, dan nyaman untuk digunakan sehingga diharapkan partisipasi pria untuk menggunakan kontrasepsi dapat meningkat (Widodo, 2011).
Indonesia merupakan negara yang memiliki sumber daya alam yang melimpah. Kondisi Indonesia saat ini adalah sebagai mega-center keragaman hayati dunia, menduduki urutan terkaya kedua di dunia. Diketahui sekurang-kurangnya 9.600 spesies tumbuhan berkhasiat sebagai obat dari 30.000 spesies yang sudah teridentifikasi, (Direktorat Bina Produksi dan Distribusi Kefarmasian, 2014). Indonesia memiliki modal yang besar untuk mengembangkan kekayaan alam nya sebagai bahan baku obat. Oleh karena itu diperlukan perhatian khusus untuk mengembangkan kekayaan alam Indonesia sebagai bahan obat, termasuk untuk pengembangan produk kontrasepsi.
Mengenai aktivitas antifertilitas, secara empirik masyarakat Tripura, India biasa mengkonsumi campuran pasta daun dan akar kelor (Moringa oleifera Lam) setelah selesai masa menstruasi sebagai metode kontrasepsi (Das et al, 2014). Adapun pada pria, terdapat penelitian terdahulu yang dilakukan oleh Owalabi dan Ogunnaike (2014) yang menunjukkan potensi ekstrak etanol daun kelor (Moringa oleifera Lam) sebagai agen antifertilitas pada tikus jantan. Hasil penelitian Owalabi dan Ogunnaike (2014) menunjukkan adanya kerusakan pada jaringan testis dan epididimis pada pengamatan histologi setelah pemberian ekstrak etanol daun kelor. Disrupsi sel epitel epididimis mengindikasikan fungsi epididimis yang terganggu, sedangkan disrupsi yang terjadi pada jaringan testis memotong berbagai zona/lapisan sel germinal yang menunjukkan berbagai tahap perkembangan spermatozoa sehingga proses spermatogenesis juga terganggu.
Menurut Leone et al (2015) kandungan kimia ekstrak daun kelor (Moringa oleifera Lam) diantaranya adalah vitamin, karotenoid, asam fenolat, flavonoid, glukosinolat, isotiosianat, tanin, saponin, dan oksalat. Golongan metabolit sekunder yang memiliki aktivitas antifertilitas pada jantan menurut Winarno (1997) diantaranya adalah alkaloid, flavonoid, minyak atsiri, dan tanin. Beberapa golongan metabolit sekunder yang berpotensi sebagai antifertilitas tersebut terdapat dalam ekstrak etanol daun kelor, yaitu golongan alkaloid, flavonoid, dan tanin meskipun belum ada publikasi ilmiah mengenai senyawa kimia yang bertanggung jawab terhadap aktivitas antifertilitas dari daun kelor. Selain itu, kandungan benzil isotiosianat pada ekstrak daun kelor juga diduga memiliki aktivitas sebagai antifertilitas, yang mana menurut Adebiyi (2013) benzil isotiosianat merupakan senyawa bioaktif pada biji Carica papaya yang bertanggung jawab terhadap aktivitas antifertilitas.
Hal tersebut diatas melatarbelakangi perlunya dilakukan penelitian aktivitas antifertilitas pada ekstrak etanol 90% daun kelor (Moringa oleifera Lam) pada tikus jantan galur Sprague-Dawley. Parameter pengujian antifertilitas yang dilakukan meliputi konsentrasi spermatozoa, morfologi sperma dan diameter tubulus seminiferus secara in vivo.
1.2 Rumusan Masalah
Berdasarkan latar belakang yang telah dipaparkan di atas, maka dapat diambil rumusan masalah sebagai berikut:
Apakah ada pengaruh pemberian ekstrak etanol 90% daun kelor (Moringa oleifera Lam) terhadap konsentrasi spermatozoa, morfologi spermatozoa, dan diameter tubulus seminiferus pada tikus jantan galur Sprague-Dawley?
1.3 Tujuan Penelitian 1.3.1 Tujuan Umum
Untuk menguji aktivitas antifertilitas ekstrak etanol 90% daun kelor (Moringa oleifera Lam) pada tikus jantan galur Sprague-Dawley.
1.3.2 Tujuan Khusus
a. Untuk menguji apakah ekstrak etanol 90% daun kelor (Moringa oleifera Lam) dapat menurunkan konsentrasi spermatozoa pada tikus jantan galur Sprague-Dawley.
b. Untuk menguji apakah ekstrak etanol 90% daun kelor (Moringa oleifera Lam) dapat meningkatkan abnormalitas spermatozoa pada tikus jantan galur Sprague-Dawley.
1.4 Hipotesis
a. Ekstrak etanol 90% daun kelor (Moringa oleifera Lam) dapat menurunkan konsentrasi spermatozoa pada tikus jantan galur Sprague-Dawley.
b. Ekstrak etanol 90% daun kelor (Moringa oleifera Lam) dapat meningkatkan abnormalitas morfologi spermatozoa pada tikus jantan galur Sprague-Dawley.
c. Ekstrak etanol 90% daun kelor (Moringa oleifera Lam) dapat menurunkan diameter tubulus seminiferus pada tikus jantan galur Sprague-Dawley.
1.5 Manfaat Penelitian
Dari penelitian uji antifertilitas ekstrak etanol 90% daun kelor (Moringa oleifera Lam) pada tikus jantan galur Sprague-Dawley diharapkan dapat memberi manfaat sebagai berikut:
1. Memberi informasi kepada masyarakat mengenai manfaat daun kelor (Moringa oleifera Lam) sebagai agen antifiertilitas
2. Memberi kontribusi dalam pengembangan kontrasepsi alami .
TINJAUAN PUSTAKA 2.1Tanaman Kelor (Moringa oleifera Lam)
2.1.1 Klasifikasi
Klasifikasi tanaman kelor menurut USDA (2013) adalah sebagai berikut Kingdom : Plantae
Subkingdom : Tracheobionta (vascular plants) Superdivisi : Spermatophyta (seed plants) Divisi : Magnoliophyta (flowering plants) Kelas : Magnoliopsida (dicotyledons) Subkelas : Dilleniidae
Famili : Moringaceae Genus : Moringa
Spesies : Moringa oleifera Lam
2.1.2 Sinonim dan Nama Lokal
Sinonim dari Moringa oleifera Lam diantaranya adalah Anoma moringa (L.) Lour., Guilandina moringa L., Hyperanthera decandra Willd., Hyperanthera moringa (L.) Vahl, Hyperanthera pterygosperma Oken, Moringa edulis Medic., Moringa erecta Salisb., Moringa moringa (L.) Small, Moringa myrepsica Thell., Moringa nux-eben Desf., Moringa octogona Stokes, Moringa oleifera Lour., Moringa parviflora Noronha, Moringa polygona DC., Moringa pterygosperma Gaertn., Moringa zeylanica Pers., Copaiba langsdorfii (Desf.) Kuntze, Copaifera langsdorffii Desf., orth. var., Copaifera nitida Hayne, Copaifera sellowii Hayne (Navie dan Steve, 2010).
2.1.3 Deskripsi Tanaman
Kelor memiliki batang berkayu (lignosus), tegak, berwarna putih kotor, kulit tipis, permukaan kasar. Tinggi tanaman dapat mencapai 10 meter dengan percabangan simpodial, arah cabang tegak atau miring, cenderung tumbuh lurus dan memanjang. Daun kelor merupakan daun majemuk, bertangkai panjang, tersusun berseling, beranak daun gasal (imparipinnatus), helai daun saat muda berwarna hijau muda. Tanaman ini berbuah setelah berumur 12-18 bulan dengan bentuk buah panjang bersegi tiga, panjang 20-60 cm, buah muda berwarna hijau dan setelah tua menjadi berwarna coklat. Biji berbentuk bulat, berwarna coklat kehitaman. Akar tunggang, berwarna putih, membesar seperti lobak. (Kristina dan Syahid, 2014)
Gambar 2.1 Tanaman Kelor Sumber: Leone et al, 2015
2.1.4 Kandungan Kimia Tanaman Kelor
Tabel 2.1 Kandungan Kimia Moringa oleifera Lam
Bagian Tanaman Kandungan Kimia
Akar 4-(α-L-rhamnopiranoksiloxi)-benzilglukosinolat benzilglukosinolat, aurantiamid asetat, dan 1,3 dibenzil urea
Batang 4-hidroksimellein, vanillin, β-sitosteron, asam oktakosanik dan β-sitosterol
Kulit Kayu 4-(α-L-rhamnopiranosiloksi)-benzilglukosinolat Eksudat gum arabinosa, D-galaktosa, asam D-glukoronat,
L-rhamnosa, D-mannosa, D-xylosa dan
leukoantosianin
Daun Glikosida niazirin, niazirinin dan three mustard oil glycosides, 4-[4’-O-asetil-α-L-rhamnosiloksi) benzyl] isothiosianat, niaziminin A dan B. Growth promoters, asam fenolat, gallat, klorogenat, dan ferulat. Flavonoid-kaempferol, quercetin, dan rutin, asam askorbat, karotenoid (terutama lutein dan β -karoten)
Bunga Asam amino, sukrosa, d-glukosa, alkaloid, lilin, flavonoid-quersetin, kaempferol, isoquersetin, rhamnetin, kaempferitin,mineral-pottasium, kalsium
Biji Tua Crude protein, crude fat, karbohidrat, metionin, sistein, 4-(α -L-rhamnopiranosiloksi)-benzilglukosinolat, -L-rhamnopiranosiloksi)-benzilglukosinolat, moringin, mono-palmitat dan di-oleat trigliserida.
Minyak Biji Vitamin A, beta karoten, precursor Vitamin A Sumber: diolah kembali dari Singh et al., 2012 dan Pandey et.al, 2012
Gambar 2.2 Struktur Kimia Senyawa Bioaktif pada Daun Moringa oleifera Lam Sumber: Leone et al, 2015
2.1.5 Kegunaan
Tanaman kelor secara tradisional sudah banyak digunakan dalam
mengobati berbagai penyakit. Akar segar dari tanaman kelor sering digunakan
sebagai stimulant dan diuretik. Sedangkan jus akar tanaman kelor digunakan
sebagai cardiac tonic dan antiepilepsi. Rebusan biji kelor dipercaya berkhasiat
sebagai antiinflamasi, antispasmodik, dan diuretik. Kulit kayu nya digunakan
sebagai abortifacient, antifungal, dan antibakteri. Bunga nya digunakan sebagai
stimulant, tonik, diuretic, dan hipoglikemik (Mishra, 2011). Seluruh bagian dari
tanaman kelor (Moringa oleifera Lam) biasa digunakan untuk berbagai tujuan
pengobatan tradisional, tetapi yang paling sering digunakan oleh masyarakat
adalah bagian daunnya. Daun kelor kaya akan protein, mineral, beta-karoten, dan
antioksidan yang sering digunakan untuk mengobati malaria, demam typhoid,
arthritis, penyakit kulit, penyakit saluran kemih, hipertensi, dan diabetes.
Masyarakat Tripura, India biasa mengkonsumi campuran pasta daun dan akar kelor (Moringa oleifera Lam) setelah selesai masa menstruasi sebagai metode kontrasepsi (Das et al, 2014). Selain itu, secara tradisional daun kelor juga digunakan untuk meningkatkan sistem kekebalan tubuh (untuk mengobati gejala
terkait HIV/AIDS) serta stimulan jantung dan kontrasepsi (Leone et al, 2015).
Berbagai penelitian sudah banyak dilakukan terhadap aktivitas tanaman
kelor (Moringa oleifera Lam) secara farmakologi. Hasil penelitian menunjukkan
antimikroba, antianafilaktik, hepatoprotektif, radioprotektif, antiulcer,
antispasmodik, antihiperglikemik, antitumor, antiplasmodial, antifertilitas,
antioksidan, diureik, antihipertensi, dan antikanker (Pandey et al, 2012 dan Mishra
et al, 2011).
2.1.6 Telaah Jurnal Penelitian Mengenai Tanaman Kelor (Moringa oleifera
Lam)
Penelitian mengenai aktifitas antifertilitas akar Moringa oleifera pernah
dilakukan oleh Shukla (1988). Pada penelitian tersebut ekstak air akar Moringa
oleifera dilihat efeknya terhadap reproduksi tikus betina. Ekstrak akar Moringa
oleifera pada dosis 200-600 mg/kg yang diberikan secara bersamaan dengan
estradiol dipropionat (EDP) dapat mereduksi bobot basah uterin dan secara
histologi dapat menginhbisi epitelium luminal. Efek ini maksimum terjadi pada
dosis 600 mg/kg. Hal ini menunjukkan aktivitas antiestrogenik dari akar Moringa
oleifera, yang mana ekstrak tersebut mengantagonis secara progresif aktivitas
estrogenik dari EDP. Hasil penelitian tersebut juga menyebutkan bahwa ekstrak
air dari akar Moringa oleifera memilki aktivitas antiprogestasional. Hal ini dapat
terlihat dari pemberian eksrak dengan dosis 600 mg/kg yang diberikan secara
bersamaan dengan 3 mg progesteron dapat menghambat deciduoma pada 50%
tikus yang diujikan. Penelitian lain mengenai aktivitas akar Moringa oleifera
dilakukan oleh Paul CW dan Didia BC (2012) pada hewan uji hamster. Ekstrak
metanol dari akar Moringa oleifera diberikan kepada hewan uji dalam dosis 3,6
mg/kg, 4,6 mg/kg, dan 7 mg/kg secara intraperitonial. Hasil penelitian ini
menunjukkan bahwa ekstrak metanol dari akar Moringa oleifera dapat
menyebabkan perubahan histologi testis hamster yang aktifitasnya tergantung
pada besarnya dosis dan lama nya waktu perlakuan. Efek yang terlihat dimulai
dari pembentukan sedikit spermatid dan spermatozoa hingga tidak ada nya
pembentukan spermatozoa dan ketinggian sel sertoli yang memendek.
Penelitian mengenai aktivitas antifertilitas ekstrak tanaman kelor juga
dilakukan pada bagian daun. Nath D et al (1992) melakukan pengujian ekstrak
etanol 90% daun Moringa oleifera pada tikus betina hamil. Hasil penelitian ini
Owalabi J.O dan Ogunnaike P.O (2014) mengenai efek antifertilitas ekstrak etanol
daun kelor pada tikus jantan. Hasil penelitian Owalabi J.O dan Ogunnaike P.O (2014) menunjukkan bahwa ekstrak etanol daun kelor berpotensi sebagai agen antifertilitas yang terlihat dari adanya kerusakan pada jaringan terstis dan epididimis pada pengamatan histologi. Disrupsi sel epitel epididimis mengindikasikan fungsi epididimis yang terganggu. Selain itu, epitel pada tubulus seminiferus testis juga mengalami kerusakan. Terjadinya disrupsi pada jaringan testis memotong berbagai zona/lapisan sel germinal yang menunjukkan berbagai tahap perkembangan spermatozoa sehingga proses spermatogenesis terganggu. Struktur interstitial tubulus seminiferus juga mengalami kerusakan.
2.2Simplisia
Definisi simplisia dalam Materia Medika Indonesia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dikatakan lain, berupa bahan yang telah dikeringkan (Depkes RI, 2000). Farmakope Herbal Indonesia menyebutkan bahwa simplisia atau herbal adalah bahan alam yang telah dikeringkan yang digunakan untuk pengobatan dan belum mengalami pengolahan. Kecuali dinyatakan lain suhu pengeringan simplisia tidak lebih dari 600C. (Departemen Kesehatan RI, 2009)
2.3Ekstrak dan Metode Ekstraksi 2.3.1 Definisi Ekstrak
2.3.2 Definisi Ekstraksi
Ekstraksi adalah penyarian zat-zat berkhasiat atau zat-zat aktif dari bagian tanaman obat, hewan dan beberapa jenis ikan termasuk biota laut. Zat-zat aktif terdapat di dalam sel, namun sel tanaman dan hewan berbeda demikian pula ketebalannya, sehingga diperlukan metode ekstraksi dengan pelarut tertentu dalam mengekstraksinya. Tujuan ekstraksi bahan alam adalah untuk menarik komponen kimia yang terdapat pada bahan alam. Ekstraksi ini didasarkan pada prinsip perpindahan massa komponen zat ke dalam pelarut, dimana perpindahan mulai terjadi pada lapisan antar muka kemudian berdifusi masuk ke dalam pelarut (Harborne, 1987).
2.3.3 Metode Ekstraksi
Berbagai metode ekstraksi yang dapat dilakukan menurut Depkes RI (2000) adalah sebagai berikut:
A. Ekstraksi Cara Dingin a. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Secara teknologi, maserasi termasuk ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan. Remaserasi berarti dilakukan penyaringan maserat pertama, dan seterusnya.
b. Perkolasi
B. Ekstraksi Cara Panas a. Sokletasi
Sokletasi adalah ekstraksi mengunakan pelarut yang selalu baru, dengan menggunakan alat soklet sehingga terjadi ekstraksi kontinyu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. b. Refluks
Refluks adalah ekstraksi dengan menggunakan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
c. Infusa
Infusa adalah ekstraksi dengan pelarut air pada temperatur 900C selama 15 menit. Infusa adalah ekstraksi menggunakan pelarut air pada temperatur penangas air dimana bejana infus tercelup dalam penangas air mendidih, temperatur yang digunakan (96-980C) selama waktu tertentu (15-20 menit).
d. Dekok
Dekok adalah infus pada waktu yang lebih lama dan (≥30 menit) dan temperatur sampai titik didih air.
e. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40-500C.
C. Destilasi Uap
D. Cara Ekstraksi Lainnya
a. Ekstraksi Berkesinambungan
Proses ekstraksi yang dilakukan berulang kali dengan pelarut yang berbeda atau resirkulasi cairan pelarut dan prosesnya tersusun berurutan beberapa kali. Proses ini dilakukan untuk meningkatkan efisiensi (jumlah pelarut) dan dirancang untuk beberapa bahan dalam jumlah besar yang terbagi dalam beberapa bejana ekstraksi.
b. Superkritikal Karbondioksida
Penggunaan prinsip superkritik untuk ekstraksi serbuk simplisia, dan umumnya digunakan gas karbondioksida. Dengan variable tekanan dan temperatur akan diperoleh spesifikasi kondisi polaritas tertentu yang sesuai untuk melarutkan golongan senyawa kandungan tertentu. Penghilangan cairan pelarut dengan mudah dilakukan karena karbonioksida menguap dengan mudah, sehingga hampir langsung diperoleh ekstrak.
c. Ekstraksi Ultrasonik
Getaran ultrasonic (> 20.000 Hz) memberikan efek pada proses ekstrak dengan prinsip meningkatkan permiabilitas dinding sel, menimbulkan gelembung spontan (cavitation) sebagai stress dinamik serta menimbulkan fraksi interfase. Hasil ekstraksi tergantung pada frekuensi getaran, kapasitas alat dan lama proses ultrasonikasi.
d. Ekstraksi Energi Listrik
2.4Tinjauan Hewan Uji 2.4.1 Taksonomi Tikus Putih
Taksonomi tikus putih (Rattus norvegicus) menurut Krinke (2000) adalah sebagai berikut:
2.4.2 Biologi dan Fisiologi Umum Tikus Putih
Rattus norvegicus merupakan hewan percobaan yang ideal karena beberapa alasan, yaitu banyaknya ketersediaan literatur yang berhubungan dengan Rattus norvegicus, mudah dalam penanganannya, tingkat kesuburan tinggi, periode kehamilan pendek, pemeliharaan rendah dan dapat dijadikan model untuk berbgai gangguan dan penyakit manusia (University Animal Care Committee, 2009)
Adapun sifat biologi dan fisiologi dari Rattus norvegicus menurut University Animal Care Committe (2009) adalah sebagai berikut:
- Lebih aktif di malam hari (nokturnal) - Rasa ingin tahu tinggi
- Laju respirasi :75-115/menit
- Denyut jantung : 260-400/menit
- Konsumsi air harian : 10-12 ml/100 g BB - Konsumsi makanan harian: 10g/100g BB
- Siklus Estrus : 4-5 hari
- Durasi estrus : 12 jam
- Masa kehamilan : 20-22 hari
- Bobot lahir : 5 g
- Durasi breeding : 12-16 bulan
- Masa hidup : 2,5-3,5 tahun
Selain itu, terdapat pula data biologis lain mengenai tikus menurut Smith dan Mangkoewidjojo (1988) sebagai berikut:
- Lama masa kehamilan : 20-22 hari
- Umur dewasa : 40-60 hari
- Siklus kelamin : poliestrus
- Lama estrus : 9-20 jam
- Perkawinan : pada waktu estrus
- Ovulasi : 8-11 jam sesudah timbul estrus
- Fertilisasi : 7-10 jam sesudah kawin - Implantasi : 5-6 hari sesudah fertilisasi
- Berat dewasa : 300-400 g jantan; 250-300 gr betina - Suhu (rektal) : 36-390 C (rata-rata 37,50C)
- Tekanan darah : 90-180 sistol, 60-145 diastol - Sel darah merah : 7,2 – 9,6 x 106/mm3
- Sel darah putih : 5,0 – 13,0 x 103/mm3
- SGPT : 17,5 – 30,2 IU/liter
- SGOT : 45,7 – 80,8 IU/liter
2.4.3 Sistem Reproduksi Tikus Jantan
A. Organ Reproduksi Tikus Jantan
Sistem reproduksi pada tikus jantan terdiri atas sepasang testis yang terdapat dalam skrotum, sepasang kelenjar asesori, dan organ kopulasi. (Akbar, 2010). Skrotum berada pada bagian kaudoventral dan dapat memanjang melebihi abdomen, tergantung pada posisi tubuh tikus. Ukuran skrotum meningkat setelah testis turun (Suckow, 2006)
1. Testis
inguinal terbuka. Jarak antara dubur dan alat kelamin pada tikus jantan lebih jauh daripada betina (Suckow, 2006).
Testis dibungkus oleh kapsula fibrosa tebal, yaitu tunika albugenia. Bagian posterior jaringan ikat ini mengalami penebalan yang disebut mediastinum testis. Mediastenum ini membentuk sekat-sekat (septula testis) yang membagi lobus secara radier menjadi lobuli testis. Di dalam lobuli testis ini terdapat banyak saluran yang berliku-liku, yaitu tubulus seminiferus, tempat berlangsungnya spermatogenesis. Saluran ini kemudian bergabung di bagian mediastinum testis tempat terdapatnya rete testis. Rete testis ini berhubungan langsung dengan duktus eferen yang akan membentuk bagian kaput epididimis (Akbar, 2010).
Testis merupakan kelenjar eksokrin yang juga sekaligus sebagai kelenjar endokrin. Testis sebagai kelenjar eksokrin berfungsi menghasilkan sel sperma, yang dilakukan oleh bagian tubulus seminiferus. Testis sebagai kelenjar endokrin memiliki sel leydig yang mampu memproduksi testosteron, yaitu hormon yang bertanggung jawab pada proses spermiogenesis (Akbar, 2010).
2. Kelenjar Asesoris (Akbar, 2010)
Kelenjar asesoris pada hewan pengerat (termasuk tikus) pada umumnya terdiri dari epididimis, vas deferens, sepasang vesikula seminalis, prostat, dan sepasang glandula cowper (bulbourethralis).
Epididimis memiliki struktur memanjang yang bertaut rapat di bagian bawah testis sampai bagian atas testis dan di dalamnya terdapat duktus epididimis yang berliku-liku. Epididimis dapat dibagi menjadi bagian kepala badan, dan ekor. Saluran epididimis menghubungkan kelenjar testis dan vas deferens. Epididimis berfungsi untuk pematangan spermatozoa dan sekaligus tempat penyimpanan spermatozoa yang sudah matang (dewasa).
vas deferens dikelilingi oleh suatu pembesaran kelenjar-kelenjar yang disebut ampula. Sebelum masuk ke uretra, vas deferens bergabung terlebih dahulu dengan saluran pengeluaran vesikula seminalis dan membentuk duktus ejakulatoris. Duktus ejakulatoris kemudian berlanjut ke uretra yang merupakan saluran pengangkut sperma dari vas deferens ke penis.
Kelenjar asesoris lain diantaranya terdapat kelenjar bulbouretral (kelenjar Cowper), kelenjar prostat dan vesika seminalis. Kelenjar-kelenjar ini berfungsi membuat cairan semen yang dapat memungkinkan sperma ini berfungsi, membuat cairan semen yang dapat memungkinkan sperma bergerak aktif dan hidup untuk waktu tertentu.
3. Alat Kelamin Luar atau Organ Kopulatoris (Akbar, 2010)
B. Spermatozoa
Spermatozoa pada tikus lebih panjang dibanding dengan spesies mamalia lain, termasuk hewan yang lain maupun manusia (Setchell, 1984), dan panjangnya kurang lebih 150-200 mm. Kepala sperma tikus berbentuk seperti kail (Eddy dan O’Brien, 1994). Bagian kepala sperma berisi nukleus dan ujung kurang padat yang disebut sebagai akrosom. Bagian tengah sperma terdiri dari sentriol dan selubung spiral melingkar dari materi mitokondria. Ekor sperma mengandung filamen panjang aksial yang menjadi vibratil untuk jangka waktu singkat ketika spermatozoa ini matang. Pengamatan bagian tengah sperma tikus dengan pembesaran kadang sulit untuk dibedakan. Sehingga penilaian terhadap bagian tengah sperma dimasukkan sebagai bagian dari pengamatan ekor sperma. (Inveresk Research, 2000).
Gambar 2.4 Morfologi Sperma Tikus
Sumber: The rat as a small mammal. HGQ Rowett. Third edition, 1974.
Gambar 2.6 Pengamatan Photomicrograph Spermatozoa Normal Sumber: Inveresk Research, 2000
C. Spermatogenesis
Proses produksi spermatozoa dalam testis disebut spermatogenesis. Spermatogenesis dibagi menjadi 3 fase yaitu spermatositogenesis, meiosis dan spermiogenesis (Krinke, 2000 ; Akbar, 2010)
spermatosit sekunder dalam bagian adluminal pada sel sertoli pada tubulus seminiferus. Selama fase meiosis, masing-masing spermatosit sekunder selanjutnya akan melakukan pembelahan yang akan menghasilkan empat spermatid.
Tahap selanjutnya adalah memasuki fase spermiogenesis. Pada fase spermiogenesis ini akan terjadi perubahan morfologi spermatid menjadi spermatozoa. Spermiogenesis dibagi menjadi empat fase yaitu fase golgi, fase cap (fase tutup), fase akrosom dan fase pematangan (maturasi). Pada fase golgi, terbentuk butiran proakrosom dalam alat golgi spermatid. Butiran ini nantinya akan bersatu membentuk satu bentukan dengan akrosom disebut granula akrosom. Granula akrosom ini melekat ke salah satu sisi inti yang bakal jadi bagian depan spermatozoa. Pada fase cap, granula akrosom semakin membesar, bertambah pipih dan menuju bagian depan inti, sehingga akhirnya terbentuk semacam tutup (cap) sementara. Pada fase akrosom, terjadi redistribusi bahan akrosom. Nukeleuplasma berkondensasi dan sementara itu spermatid memanjang dengan batas kaudal menyempit dan membentuk sudut sehingga inti kelihatan lebih pipih dan tutup (cap) mengitari bagian ventral inti. Pemanjangan dan pemipihan ini berlangsung terus hingga bagian anterior spermatid menjadi sempit dan terjadi perubahan ujung kaudal spermatid dari bentuk bundar menjadi agak pipih. Pada fase pematangan, bentuk spermatid sudah hampir sama dengan spermatozoa dewasa. Terjadi perubahan bentuk spermatid sesuai dengan ciri spesies. Spermatid yang telah berubah menjadi spermatozoa berhubungan langsung dengan sel sertoli yang banyak mengandung glikogen, sehingga spermatozoa mendapat makanannya, akhirnya spermatozoa akan dilepaskan dari sel sertoli dan menuju lumen tubulus seminiferus. Proses pelepasan spermatozoa ini disebut spermeasi (Krinke, 2000 ; Akbar, 2010).
untuk melakukan satu siklus spermatogenesis yang terdiri dari 14 tahapan ini. Tiap spermatogonium pada tikus membuthkan empat siklus untuk menyelesaikan pembentukan spermatozoa, sehingga total waktu yang dibutuhkan untuk seluruh tahapan spermatogenesis pada tikus adalah 48 hari (Krinke, 2000).
Gambar 2.7 Tahapan Siklus Spermatogenesis Tikus,
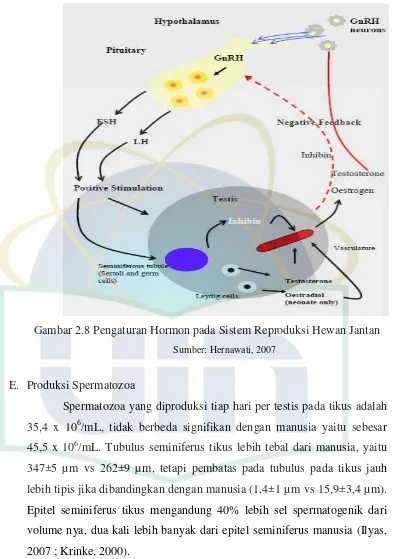
D. Pengendalian Hormon Terhadap Spermatogenesis
Proses spermatogenesis dikendalikan oleh sistem hormonal. Aksi hipotalamus-hipofisis berperan penting dalam sekersi gonadotropin yang mengatur aktivitas hormon dan sel spermatogenik di dalam testis (Akbar, 2010). Pada hewan jantan, gonadotrophin releasing hormone (GnRH) disekresikan dari hipotalamus untuk menstimulasi pelepasan lutenizing hormone (LH) dan foliccle stimulating hormone (FSH) dari pituitari anterior. LH dan FSH mengatur aktivitas testis. LH berperan dalam merangsang sel-sel leydig untuk memproduksi testosteron. Sedangkan peran FSH adalah menstimulasi sel-sel sertoli untuk proses pembentukan sel-sel germinal pada spermatogenesis. FSH dan testosteron dapat merangsang sel-sel spermatogenik untuk melakukan meiosis dan berdiferensiasi menjadi sperma (Surjono, 2001).
Aksi FSH pada spermatogenesis mungkin dimediasi oleh sel sertoli, karena hormon peptide tidak dapat secara langsung mencapai spermatosit dan spermatid melintasi sawar darah testis, yang terbentuk 16-19 hari setelah kelahiran. Sebaliknya, terstosteron dapat dengan mudah melewati sawar darah testis dengan difusi (dan mungkin juga oleh beberapa sistem trasnportasi). Telah dilaporkan bahwa tingkat testosteron di dalam cairan interstisial (lebih dari 50 ng/mL) pada tikus dewasa jauh lebih tinggi dibanding pada testis (sekitar 30 ng/mL) atau cairan vena perifer (< 10 ng/mL), menunjukkan aksi parakrin dan autokrin dari testosteron pada spermatogenesis di testis (Krinke, 2000)
Gambar 2.8 Pengaturan Hormon pada Sistem Reproduksi Hewan Jantan Sumber: Hernawati, 2007
E. Produksi Spermatozoa
METODOLOGI PENELITIAN 3.1 Waktu dan Tempat Penelitian
3.1.1 Waktu Penelitian
Penelitian akan dilaksanakan pada bulan November sampai dengan April 2016.
3.1.2 Tempat Penelitian
Pembuatan ekstrak dilakukan di Laboratorium Penelitian I, penapisan fitokimia di Laboratorium Kimia Obat, pengujian parameter ekstrak di Laboratorium Kimia Obat dan Laboratorium Penelitian II, dan pemeliharaan dan perlakuan hewan uji di Laboratorium Animal House Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta. Penggunaan freeze dryer dilakukan di PAIR BATAN Pasar Jumat, dan pembuatan preparat histologi testis dilakukan di laboratorium patologi klinik Universitas Indonesia.
3.2 Alat dan Bahan 3.2.1 Alat Penelitian
3.2.2 Bahan Penelitian
Bahan uji yang digunakan dalam penelitian ini berupa daun kelor muda maupun tua (Moringa oleifera Lam) yang dipeloreh dari Desa Parakan, Kecamatan Ciomas, Bogor dengan ketinggian 420 mdpl diatas permukaan laut. Bahan uji dikumpulkan pada bulan November 2016 pada waktu pagi hari. Sebelum dilakukan penelitian, dilakukan determinasi tanaman terlebih dahulu di Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong untuk mengetahui kebenaran bahan uji.
Bahan kimia yang digunakan dalam penelitian ini adalah etanol 90%, aquadest, pereaksi untuk penapisan fitokimia (etanol 70%, HCl 2N, reagen dragendorf, reagen mayer serbuk Mg, HCl pekat, eter, asam asetat anhidrat, asam sulfat, FeCl3 0,1%, reagen Liebermen-Buchard), natrium karbonil metil selulosa
untuk penyiapan suspensi zat aktif, bahan untuk penyiapan analisis sperma (larutan George, NaClfisiologis, formalin, eosin Y 1%)
3.2.3 Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah tikus putih jantan galur Sprague-Dawley yang sehat dan fertil berumur 3,5-4 bulan dengan berat badan 250-350 gram yang diperoleh dari Animal Facility and Modeling Provider Institut Pertanian Bogor (IPB).
3.3 Rancangan Penelitian 3.3.1 Besar Sampel
3.3.2 Dosis dan Waktu Perlakuan
Dosis yang digunakan pada penelitian ini terdiri dari dosis rendah (200 mg/kg), dosis sedang (400 mg/kg), dan dosis tinggi (600 mg/kg). Penggunaan dosis ini mengacu pada penelitian terdahulu yang dilakukan oleh Owalabi dan Ogunnaike (2014) yang menunjukkan bahwa ekstrak etanol daun kelor (Moringa oleifera Lam) pada dosis 200 mg/kg dapat menimbulkan kerusakan histologi testis dan epididimis tikus jantan sehingga berpotensi sebagai agen antifertilitas. Rujukan lain dalam penentuan dosis ini adalah penelitian terdahulu yang dilakukan oleh Shukla (1988) dalam penelitiannya mengenai aktifitas antifertilitas ekstrak air dari akar tanaman kelor (Moringa oleifera Lam) yang menunjukkan aktivitas antiestrogenik dan antiprogesteron setelah pemberian ekstrak air dari akar kelor (Moringa oleifera Lam) dengan dosis 200-600 mg/kg pada tikus betina. Perlakuan diberikan kepada hewan uji selama 15 hari merujuk pada guideline WHO protocol MB-50 dalam jurnal Deghan et al (2005).
Tabel 3.1 Rancangan Percobaan I (Kontrol) 6 Tikus diberikan suspensi
Natrium CMC 0,5% 90% daun kelor (Moringa oleifera Lam) yang disuspensikan ke dalam larutan Natrium CMC 0,5% dengan dosis 200 mg/kg
15 hari Testis dan 90% daun kelor (Moringa oleifera Lam) yang disuspensikan ke dalam larutan Natrium CMC 0,5% dengan dosis 400 mg/kg
15 hari Testis dan 90% daun kelor (Moringa oleifera Lam) yang disuspensikan ke dalam larutan Natrium CMC 0,5% dengan dosis 600 mg/kg
3.4 Prosedur Kerja
3.4.1 Pemeriksaan Bahan Uji (Determinasi)
Sebelum dilakukan penelitian, daun kelor (Moringa oleifera Lam) terlebih dahulu dideterminasi di di Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong untuk mengetahui kebenaran bahan uji.
3.4.2 Penyiapan Simplisia dan Pembuatan Ekstrak
Daun kelor (Moringa oleifera Lam) sebanyak 4,3 kg dikumpulkan, kemudian dicuci dengan air mengalir hingga bersih. Daun kelor yang telah dicuci selanjutya dikering anginkan. Daun kelor yang telah kering dihaluskan menggunakan blender hingga menjadi serbuk sebanyak 0,53 kg. Serbuk daun kelor selanjutnya ditimbang dan dilakukan ekstraksi cara dingin dengan metode maserasi. Pelarut yang digunakan untuk maserasi adalah etanol 90% (Nath, 1992). Maserasi dilakukan dengan memasukkan serbuk kering simplisia ke dalam maserator, lalu ditambahkan pelarut etanol 90% hingga seluruh bagian serbuk kering simplisia terendam dengan pelarut. Maserat selanjutnya dipisahkan dengan cara filtrasi. Proses penyarian diulang sekurang-kurangnya dua kali dengan jenis dan jumlah pelarut yang sama (Departemen Kesehatan RI, 2008). Filtrat yang diperoleh selanjutnya disaring menggunakan kapas dan kertas saring, lalu dipekatkan menggunakan vacuum rotary evaporator sampai diperoleh ekstrak kental. Jika belum didapatkan ekstrak kental, maka proses pemekatan ekstrak dilanjutkan dengan freeze dryer. Ekstrak kental yang diperoleh kemudian ditimbang.
3.4.3 Penapisan Fitokimia
Pada penapisan fitokimia dilakukan identifikasi kandungan golongan senyawa kimia pada ekstrak etanol 90% daun kelor (Moringa oleifera Lam) seperti alkaloid, flavonoid, terpenoid, tannin, saponin, steroid dan triterpenoid.
1. Identifikasi Golongan Alkaloid (Depkes RI, 1995)
selama 2 menit, dan didinginkan. Kemudian disaring dan filtratnya ditampung. Filtrat digunakan sebagai larutan percoban selanjutnya:
a. Larutan percobaan ditambahkan 2 tetes 2 tetes reagen dragendrof, terbentuknya endapan jingga coklat menandakan bahwa ekstrak mengandung alkaloid
b. Larutan percobaan ditambahkan 2 tetes reagen Mayer LP, terbentuknya endapan menggumpal putih atau kuning menandakan bahwa ekstrak mengandung alkaloid.
2. Identifikasi Golongan Flavonoid (Arifin Helmi, 2006)
Ekstrak sebanyak 100 mg dimasukkan ke dalam tabung reaksi lalu ditambahkan 1 mL etanol 70%. Ekstrak kemudian ditambahkan serbuk Mg dan asam klorida pekat. Terbentuknya warna orange, merah, atau kuning menandakan bahwa ekstrak mengandung flavonoid.
3. Identifikasi Golongan Terpenoid (Farnsworth,1966)
Ekstrak sebanyak 100 mg dalam cawan penguap ditambahkan 1 ml etanol 70% kemudian dilarutkan dalam 5 ml eter. Selanjutnya diuapkan hingga kering. Larutan pereaksi yang terdiri dari 10 tetes asam asetat anhidrat dan 5 tetes asam sulfat disiapkan, lalu ditambahkan ke dalam residu. Terbentuknya warna merah-hijau-violet-biru mendandakan bahwa ekstrak mengandung terpenoid
4. Identifikasi Golongan Tanin (Ramya, B. Shiney dan P. Ganesh, 2012)
Ekstrak sebanyak 500 mg dimasukkan ke dalam tabung reaksi lalu ditambahkan 2 ml etanol 70% dan 0,1% FeCl3.Terbentuknya warna hijau
kecoklatan menandakan bahwa ekstrak mengandung tannin.
5. Identifikasi Golongan Saponin (Departemen Kesehatan RI, 1995)
Ekstrak sebanyak 100 mg dimasukkan ke dalam tabung rekasi lalu ditambahkan 1 ml etanol 70%. Ekstrak kemudian ditambahkan 10 mg air panas, lalu didinginkan. Selanjutnya dilakukan pengocokan vertikal selama 10 detik dan didiamkan selama 10 menit. Terbentuknya buih setinggi 1 cm dan tidak hilangnya buih setelah penambahan 1 tetes asam klorida 2N menandakan bahwa ekstrak mengandung saponin.
Ekstrak sebanyak 100 mg dimasukkan ke dalam tabung reaksi lalu ditambahkan 1 ml etanol 70%. Ekstrak kemudian ditambahkan pereaksi Lieberman-Buchard. Terbentuknya warna biru-kehijauan menandakan bahwa ekstrak mengandung steroid, sedangkan terbentuknya warna merah, merah muda, atau ungu menunjukkan bahwa ekstrak mengandung triterpenoid.
7. Identifikasi Golongan Glikosida (Depkes RI, 1979 dalam jurnal Padmasari, 20013)
Larutan uji sebanyak 0,1 ml diuapkan diatas penangas air, larutkan sisa dalam 5 ml asam asetat anhidrat. Tambahkan 10 tetes asam sulfat P, terjadinya warna biru atau hijau menunjukkan adanya glikosida.
3.4.4 Pengujian Parameter Spesifik dan Non Spesifik
1. Pengujian Parameter Spesifik (Departemen Kesehatan RI, 2000) a. Identitas Ekstrak
Deskripsi tata nama: - Nama ekstrak
- Nama latin tumbuhan
- Bagian tumbuhan yang digunakan - Nama Indonesia tumbuhan
b. Organoleptik
Penggunaan panca indera untuk mendeskripsikan bentuk, warna, bau, dan rasa sebagai berikut:
- Bentuk: padat, serbuk-kering, kental, cair - Warna: kuning, coklat, dll
- Bau: aromatik, tidak berbau, dll - Rasa: pahit, manis, kelat, dll 2 Pengujian Parameter Non Spesifik
a. Kadar Abu (Departemen Kesehatan RI, 2000)
kertas dan kertas saring dalam kurs yang sama. Masukkan filtrat ke dalam kurs, uapkan. Kemudian pijarkan hingga bobot tetap, lalu ditimbang. Hitung kadar abu terhadap bahan yang telah dikeringkan di udara.
b. Kadar Air (Departemen Kesehatan RI, 2000)
Ekstrak ditimbang secara seksama sebanyak 1g sampai 2g dan dimasukkan ke dalam botol timbang dangkal bertutup yang sebelumnya telah dipanaskan pada suhu 1050C selama 30 menit dan telah ditara. Sebelum ditimbang, ekstrak diratakan dalam botol timbang dengan cara menggoyangkan botol hingga menjadi lapisan setebal kurang lebih 5mm-10mm. Jika ekstrak yang diuji berupa ekstrak kental, ratakan dengan bantuan pengaduk. Kemudian dimasukkan ke dalam ruang pengering, buka tutupnya, keringkan pada suhu 1050C hingga bobot tetap
3.4.5 Penyiapan Hewan Uji
Sebelum diberi perlakuan, tikus jantan galur Sprague-Dawley diaklimatisasi di animal house Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta selama minimal 7 hari pada kondisi laboratorium agar dapat menyesuaikan diri dengan lingkungan yang baru. Selama proses aklimatisasi, hewan uji diberi makan dan minum ad libitum dan dilakukan pengamatan kondisi umum hewan uji serta ditimbang berat badannya. Tikus yang digunakan untuk penelitian adalah tikus yang sehat, yaitu tikus yang berat badan selama proses aklimatisasi tidak mengalami perubahan lebih dari 10% dan secara visual memperlihatkan perilaku yang normal.
3.4.6 Pemberian Perlakuan
3.4.7 Pengukuran Parameter Antifertilitas
1. Perhitungan konsentrasi spermatozoa
Perhitungan konsentrasi spermatozoa tikus putih jantan dilakukan dengan cara mengambil spematozoa pada kauda epididimis. Spermatozoa yang didapat diletakan dalam cawan penguap yang berisi cairan NaCl sebanyak 500μl. Spermatozoa dimasukkan ke dalam kamar Neubauer (Hemasitometer) sampai kamar Neubauer terisi rata. Jumlah spermatozoa selanjutnya dihitung pada salah satu kamar hitung Neubauer. Kemudian ditentukan pengenceran yang akan dilakukan dan jumlah kotak yang akan dihitung, sesuai dengan jumlah spermatozoa yang telah diketahui (Tabel 3.2) (Ilyas, 2007).
Tabel 3.2. Pengenceran Spermatozoa dan Jumlah Kotak yang Dihitung No Jumlah spermatozoa dalam 1
kotak
Faktor Pengenceran Kotak kecil yang dihitung
1. > 40 50 kali 5
2. 15-40 20 kali 10
3. ≤15 10 kali 25
Adapun cara pengenceran spermatozoa dilakukan sesuai dengan cara yang tertera pada tabel 3.3 (Ilyas, 2007).
Tabel 3.3 Cara Pengenceran Spermatozoa
No. Pengenceran Pembuatan Pengenceran
1. 50 kali a. 980µl larutan George + 20 µl
spermatozoa
b. 2.450 µl larutan George + 50µl spermatozoa
2. 20 kali 90µl larutan George + 50µl spermatozoa
3. 10 kali a. 900µl larutan George + 100 µl
spermatozoa
Setelah pengenceran, dilakukan perhitungan spermatozoa kembali sesuai dengan jumlah kotak yang dihitung. Kemudian dilakukan perhitungan konsentrasi spermatozoa sesuai rumus dibawah ini (Ilyas, 2007).
Konsentrasi spermatozoa = n x 10.000x Fp x x vNaCl
Keterangan : n merupakan jumlah spermatozoa yang terhitung. Angka 10.000 merupakan volume kamar hitung Neubauer. Fp menunjukkan faktor pengenceran. Angka 25 adalah total kotak kecil yang terdapat dalam kamar hitung Neubauer. k adalah kotak kecil yang dihitung pada saat pengamatan. vNaCl merupakan volume NaCl fisiologis (ml) yang digunakan untuk membantu mengeluarkan spermatozoa dari kauda epididimis.
Perhitungan konsentrasi spermatozoa (juta/ml) dapat terlihat dari tabel 3.4 berikut.
Tabel 3.4. Rumus Konsentrasi Spermatozoa
No. Jumlah Kotak yang Dihitung Rumus Konsentrasi Spermatozoa
1. 5 n x 10.000 x 50 x 5 x 0,5
2. 10 n x10.000 x 20 x 2,5 x 0,5
3. 25 n x 10.000 x 10 x 1 x 0,5
2. Pengamatan Morfologi (Inversk Research et al, 2000)
Pemeriksaan morfologi sperma dilakukan dengan membedakan bentuk sperma normal dan abnormal dari sperma yang diamati. Jumlah sperma yang diamati minimal sejumlah 200. Pengamatan dilakukan di bawah mikroskop dengan perbesaran 400-1000 kali.
3. Diameter Tubulus Seminiferus
Pengukuran diameter tubulus seminiferus dilakukan dengan membuat preparat histologi testis tikus terlebih dahulu. Preparat histologi dilihat di bawah mikroskop dan diukur menggunakan mikrometer okuler. Pengukuran dilakukan dengan mengukur jarak terdekat antara 2 titik bersebrangan pada garis tengah nya yang terpendek dan mengukur jarak terjauh antara titik yang bersebrangan, kemudian dibagi dua. Tiap masing-masing preparat diukur minimal 10 tubulus. Hasil pengukuran dinyatakan dalam satuan mikro meter (µm) (Turk, 2007 dan Wahyuni, 2012).
3.4.8 Analisis Data
HASIL PENELITIAN DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Determinasi Tumbuhan
Determinasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi - Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. Hasil determinasi tumbuhan menunjukkan bahwa tumbuhan uji adalah benar daun kelor dengan spesies (Moringa oleifera Lam) yang merupakan famili Moringaceae. Surat pernyataan hasil identifikasi/determinasi tumbuhan dapat dilihat pada lampiran 1.
4.1.2 Ekstraksi
Daun kelor (Moringa oleifera Lam) segar sebanyak 4,3 kg yang diperoleh dari Desa Parakan, Kecamatan Ciomas, Bogor terlebih dahulu dicuci dan dikeringanginkan. Daun kelor yang sudah kering kemudian dihaluskan dengan blender sehingga diperoleh 521 g serbuk daun kelor (Moringa oleifera Lam). Serbuk daun kelor (Moringa oleifera Lam) selanjutnya dimaserasi berulang sebanyak 5 kali menggunakan pelarut etanol 90% sebanyak 13 L sehingga dihasilkan maserat yang berwarna lebih bening dibandingkan dengan maserat awal. Maserat selanjutnya dipekatkan dengan vacuum rotary evaporator. Hasil pemekatan dengan vacuum rotary evaporator belum dapat menghasilkan ekstrak kental, sehingga pemekatan dilanjutkan menggunakan freeze dryer di PAIR BATAN selama 2 minggu. Ekstrak kental yang diperoleh adalah sebanyak 104,20 gram dengan rendemen sebesar 20%. Perhitungan rendemen dapat dilihat pada lampiran 6.
4.1.3 Penapisan Fitokimia
Tabel 4.1 Hasil Penapisan Fitokimia Ekstrak Etanol 90% Daun Kelor
Golongan Senyawa Hasil Penapisan Fitokimia
Alkaloid (Depkes RI, 1995)
Terbentuk endapan jingga coklat setelah penambahan reagen dragendorf (positif)
Terbentuk keruh/berkabut setelah penambahan regen meyer (positif)
Flavonoid (Arifin Helmi, 2006) Terbentuk warna orange kemerahan (positif) Terpenoid (Farnsworth, 1966) Terbentuk warna hijau kebiruan (positif)
Tanin (Ramya et al, 2012) Terbentuk warna hijau kecoklatan (positif)
Saponin (Depkes RI, 1995)
Terbentuk buih setinggi kurang lebih 1,5 cm. Setelah penambahan HCl 2N buih tidak hilang (positif)
Steroid (Farnsworth, 1996) Terbentuk warna biru kehijauan (positif) Glikosida (Depkes RI, 1979) Terbentuk warna kehijauan (positif)
Triterpenoid (Farnsworth, 1996) Tidak terbentuk warna merah, merah muda, atau ungu (negatif)
Hasil penapisan fitokimia yang dilakukan menunjukkan bahwa ekstrak etanol 90% daun kelor (Moringa oleifera Lam) mengandung metabolit sekunder golongan alkaloid, flavonoid, terpenoid, saponin, steroid, dan glikosida.
4.1.4 Pengujian Parameter Ekstrak
Hasil pengujian parameter spesifik dan non spesifik ekstrak etanol 90% daun kelor (Moringa oleifera Lam) dapat dilihat pada table 4.2
Tabel 4.2 Hasil Pengujian Parameter Ekstrak Etanol 90% Daun Kelor Parameter
Parameter Spesifik Parameter Non Spesifik
a. Identitas Ekstrak
- Nama ekstrak: Ekstrak etanol 90% daun kelor (Moringa oleifera Lam)
- Nama latin tumbuhan: Moringa oleifera Lam
- Bagian tumbuhan yang digunakan: daun - Nama Indonesia tumbuhan: kelor
Pengujian parameter ekstrask etanol 90% daun kelor (Moringa oleifera Lam) yang dilakukan terdiri dari parameter spesifik dan non spesifik. Parameter spesifik ekstrak meliputi identitas ekstrak dan organoleptik. Parameter non spesifik ekstrak meliputi kadar air dan kadar abu. Hasil pengujian kadar air melebihi kadar yang dipersyaratkan oleh BPOM (2014), yaitu ≤10%. Adapun hasil pengujian kadar abu masih memenuhi persyaratan, yaitu ≤10,2% (Depkes RI, 2009).
4.1.5 Pengujian Parameter Antifertilitas
Hasil pengujian parameter antifertilitas terdiri dari hasil perhitungan konsentrasi spermatozoa, abnormalitas morfologi spermatozoa, dan diameter tubulus seminiferus. Data hasil pengujian parameter antifertilitas selanjutnya dianalisis secara statistik menggunakan software SPSS 21. Uji statistik dimulai dari uji normalitas dan homogenitas. Data yang memenuhi syarat normalitas dan homogenitas dilanjutkan dengan uji parametrik one way ANOVA, namun jika tidak memenuhi syarat normalitas dan homogenitas maka dilanjutkan dengan uji Kruskal Wallis untuk melihat ada atau tidak ada nya perbedaan data di seluruh kelompok perlakuan. Uji dilanjutkan dengan uji LSD (Least Significant Difference) untuk melihat kelompok mana yang memiliki perbedaan bermakna dengan kelompok perlakuan lainnya. a. Perhitungan Konsentrasi Spermatozoa
Perhitungan konsentrasi spermatozoa hewan uji dilakukan menggunakan bilik hitung neubauer. Hasil perhitungan konsentrasi spermatozoa pada hewan uji setelah 15 hari pemberian perlakuan dapat dilihat pada tabel 4.3
Tabel 4.3 Hasil Perhitungan Konsentrasi Spermatozoa Hewan Uji
No. Kelompok perlakuan Rerata Konsentrasi Spermatozoa
(juta/mL) ± SD
1. Kontrol 13,74 ±3,80
2. Dosis Rendah (200 mg/kgBB) 8,12±2,46
3. Dosis Sedang (400 mg/kgBB) 4,99±0,62
4. Dosis Tinggi (600 mg/kgBB) 2,74±0,95
Hasil perhitungan konsentrasi spermatozoa hewan uji setelah 15 hari pemberian perlakuan menunjukkan bahwa konsentrasi spermatozoa hewan uji mengalami penurunan seiring dengan peningkatan dosis ekstrak etanol 90% daun kelor (Moringa oleifera Lam). Grafik perhitungan konsentrasi spermatozoa pada hewan uji adalah sebagai berikut:
Gambar 4.1 Grafik Hasil Perhitungan Konsentrasi Spermatozoa Hewan Uji Hasil uji normalitas Shapiro-Wilk dan homogenitas Levene konsentrasi spermatozoa menunjukkan bahwa data konsentrasi spermatozoa hewan uji terdistribusi normal (p≥0,05), namun tidak bervariasi homogen (p≤0,05) sehingga uji statistik dilanjutkan dengan uji Kruskal-Wallis. Hasil uji Kruskal-Wallis yang dilakukan terhadap rata-rata konsentrasi spermatozoa tiap kelompok perlakuan menunjukkan nilai p≤0,05 yang berarti terdapat perbedaan konsentrasi spermatozoa yang bermakna antara semua kelompok perlakuan. Oleh karena itu, uji dilanjutkan dengan uji LSD.
Hasil uji LSD menunjukkan bahwa terdapat perbedaan bermakna antara konsentrasi spermatozoa kelompok kontrol dengan kelompok uji dosis 200mg/kg, 400mg/kg, dan 600 mg/kg. Lain hal nya dengan hasil uji LSD antar kelompok uji,
dosis 200 mg/kg dengan dosis 400 mg/kg dan dosis 600mg/kg (p≤0,05) namun tidak terdapat perbedaan bermakna antara pemberian dosis 400mg/kg dengan dosis 600mg/kg. Hal ini berarti bahwa pemberian ekstrak daun kelor pada dosis 200mg/kg, 400mg/kg, dan 600 mg/kg dapat menurunkan konsentrasi spermatozoa pada tikus jantan galur Sprague-Dawley jika dibandingkan dengan kelompok kontrol (p≤0,05). Tingkat penurunan konsentrasi spermatozoa pada dosis 600 mg/kg lebih tinggi dibandingkan dosis 200 mg/kg dan 400mg/kgBB, namun tingkat penurunan konsentrasi spermatozoa pada dosis 400mg/kg tidak berbeda bermakna secara statistik dengan dosis 600mg/kg.
b. Perhitungan Abnormalitas Morfologi Spermatozoa
Abnormalitas morfologi spermatozoal diamati pada 200 spermatozoa. Hasil perhitungan abnormalitas morfologi spermatozoa setelah 15 hari pemberian perlakuan dapat dilihat pada tabel 4.4
Tabel 4.4 Hasil Perhitungan Abnormalitas Morfologi Spermatozoa pada Hewan Uji
No. Kelompok perlakuan Rerata Abnormalitas Morfologi
Spermatozoa (%)
1. Kontrol 9,87 ± 1,02
2. Dosis Rendah (200 mg/kgBB) 16,40 ± 3,93
3. Dosis Sedang (400 mg/kgBB) 17,10 ± 2,84
4. Dosis Tinggi (600 mg/kgBB) 18,12 ± 3,21
Keterangan: Rerata abnormalitas morfologi spermatozoa tiap kelompok perlakuan dinyatakan dengan nilai n=5
Hasil perhitungan abnormalitas morfologi spermatozoa menunjukkan bahwa jumlah spermatozoa yang memiliki morfologi abnormal pada hewan uji setelah 15 hari pemberian perlakuan mengalami peningkatan seiring dengan peningkatan dosis ekstrak etanol 90% daun kelor (Moringa oleifera Lam).
Gambar 4.2 Grafik Hasil Perhitungan Abnormalitas Morfologi Spermatozoa Hasil uji normalitas Shapiro-Wilk dan homogenitas Levene pada data abnormalitas morfologi spermatozoa menunjukkan bahwa abnormalitas morfologi spermatozoa pada hewan uji terdistribusi normal dan bervariasi homogen (p≥0,05) sehingga uji statistik dilanjutkan dengan uji parameter one way ANOVA. Hasil uji parameter one way ANOVA yang dilakukan terhadap data rerata abnormalitas morfologi spermatozoa pada tiap kelompok perlakuan menunjukkan nilai p≤0,05 yang berarti terdapat perbedaan yang bermakna pada abnormalitas morfologi spermatozoa antara semua kelompok perlakuan. Oleh karena itu, uji dilanjutkan dengan uji LSD.
Hasil uji LSD menunjukkan bahwa terdapat perbedaan bermakna antara abnormalitas morfologi spermatozoa pada kelompok kontrol dengan kelompok uji dosis 200mg/kg, 400mg/kg, dan 600 mg/kg (p≤0,05). Lain hal nya dengan hasil uji LSD antar kelompok uji, yang mana tidak terdapat perbedaan abnormalitas morfologi spermatozoa yang bermakna antara kelompok uji dosis 200 mg/kg, 400mg/kg, maupun 600 mg/kg (p≥0,05). Hal ini berarti bahwa pemberian ekstrak daun kelor pada dosis 200mg/kg, 400mg/kg, dan 600 mg/kg dapat meningkatkan abnormalitas morfologi spermatozoa pada tikus jantan galur Sprague-Dawley jika dibandingkan dengan kelompok kontrol, namun tidak dipengaruhi peningkatan
0
Kontrol 200 mg/kgBB 400 mg/kgBB 600 mg/kgBB
c. Pengukuran Diameter Tubulus Seminiferus Hewan Uji
Hasil perhitungan diameter spermatozoa hewan uji setelah 15 hari pemberian perlakuan dapat dilihat pada tabel 4.4
Tabel 4.4 Hasil Perhitungan Diameter Tubulus Seminiferus Hewan Uji
No. Kelompok perlakuan Rerata Diameter Tubulus
Seminiferus (µm) ± SD
1. Kontrol 206,16 ± 10,24
2. Dosis Rendah (200 mg/kgBB) 188,77 ± 9,64
3. Dosis Sedang (400 mg/kgBB) 186,48 ± 9,78
4. Dosis Tinggi (600 mg/kgBB) 160,04 ± 8,39
Keterangan: Rerata diameter tubulus seminiferus tiap kelompok perlakuan dinyatakan dengan nilai n=5
Hasil pengukuran menunjukkan bahwa diameter tubulus seminiferus pada hewan uji setelah 15 hari pemberian perlakuan mengalami penurunan seiring dengan peningkatan dosis ekstrak etanol 90% daun kelor (Moringa oleifera Lam).
Grafik hasil pengukuran diameter tubulus seminiferus adalah sebagai berikut:
Gambar 4.3 Grafik Hasil Pengukuran Diameter Tubulus Seminiferus Hewan Uji
0
Kontrol 200 mg/kgBB 400 mg/kgBB 600 mg/kgBB
Hasil uji normalitas Shapiro-Wilk dan homogenitas Levene pada data diameter tubulus seminiferus menunjukkan bahwa data diameter tubulus seminiferus hewan uji terdistribusi normal dan bervariasi homogen (p≥0,05) sehingga uji statistik dilanjutkan dengan uji parameter one way ANOVA. Hasil uji parameter one way ANOVA yang dilakukan terhadap diameter tubulus seminiferus pada tiap kelompok perlakuan menunjukkan nilai p≤0,05 yang berarti terdapat perbedaan yang bermakna pada diameter tubulus seminiferus antara semua kelompok perlakuan. Oleh karena itu, uji dilanjutkan dengan uji LSD.