EFEK EKSTRAK KULIT BUAH RAMBUTAN
TERHADAP KADAR MDA DAN SOD
TIKUS YANG DIPAPAR ASAP ROKOK
Skripsi
disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Program Studi Biologi
oleh Erni Wulandari
4411412053
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS NEGERI SEMARANG
iv ABSTRAK
Wulandari, Erni. 2016. Efek Ekstrak Kulit Buah Rambutan terhadap Kadar MDA dan SOD Tikus yang Dipapar Asap Rokok. Skripsi. Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Semarang. Dr. drh. R. Susanti, M.P. Dr. Lisdiana, M.Si
Asap rokok merupakan polutan bagi manusia dan lingkungan. Asap rokok mengandung senyawa radikal bebas yang akan menyebabkan stres oksidatif. Pada kondisi stres oksidatif, radikal bebas menyebabkan peroksidasi lipid membran sel dan merusak organisasi membran sel. Penelitian ini bertujuan untuk menganalisis kadar MDA dan SOD pada tikus yang dipapar asap rokok dan diberi ekstrak kulit buah rambutan. Penelitian dilakukan pada 30 ekor tikus putih jantan galur Wistar yang dibagi menjadi 6 kelompok, yaitu kelompok A (normal), B (negatif), C (positif) dan D, E, F merupakan kelompok perlakuan ekstrak kulit buah rambutan dengan dosis secara berturut-turut 3, 6, 12 mg/200 gramBB dan paparan asap rokok selama 14 hari. Untuk mengetahui perbedaan kadar MDA dan SOD setiap kelompok dilakukan analisis data menggunakan uji one way anova dan uji lanjut LSD. Hasil analisis statistik menunjukkan kadar MDA pada kelompok A tidak berbeda nyata dengan kelompok C dan E. Kelompok D tidak berbeda nyata dengan kelompok F. Aktivitas SOD pada kelompok A berbeda nyata dengan kelompok lainnya. Aktivitas SOD kelompok C tidak berbeda nyata dengan kelompok E. Simpulan dari penelitian ini adalah ekstrak kulit buah rambutan dosis 6 mg/200 gramBB dapat menurunkan kadar MDA dan meningkatkan aktivitas SOD pada tikus yang dipapar asap rokok.
berjudul “Efek Ekstrak Kulit Buah Rambutan terhadap Kadar MDA dan SOD
Tikus yang Dipapar Asap Rokok”. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada Program Studi Biologi Universitas Negeri Semarang. Penulis menyadari dalam pembuatan skripsi ini tidak lepas dari bantuan berbagai pihak, maka pada kesempatan ini penulis menyampaikan penghargaan dan terimakasih kepada:
1. Rektor Universitas Negeri Semarang atas kesempatan yang diberikan untuk menempuh pendidikan di Unnes.
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Semarang yang telah memberikan izin penelitian.
3. Ketua Jurusan Biologi Universitas Negeri Semarang yang telah membantu kelancaran administrasi dalam penyelesaian skripsi.
4. Dr. drh. R. Susanti, M.P. dan Dr. Lisdiana, M.Si. selaku dosen pembimbing I dan II atas bimbingan, saran, bantuan dan berbagai kemudahan selama proses penyusunan skripsi.
5. Dr. Wiwi Isnaeni, M.S. selaku penguji skripsi yang telah memberikan kritik dan saran untuk kelayakan naskah skripsi saya.
6. Bapak, Ibu, Mas Heri, Dek Andry dan semua keluarga atas doa, perhatian dan dukungannya.
7. Melisa, Wawan, Alam, Nikmah, Mas Herdi dan Mba Fera atas bantuannya selama penelitian.
8. Nok Ely, Tante nCum, Uti Zamia serta teman-teman Biologi 2012 atas kebersamaan dan kenangan yang tak terlupakan.
9. Teman-teman seperjuangan di Kos Griya Ayu atas persaudaraan dan semangat.
vi
G.Mekanisme Kerja Kulit Buah Rambutan sebagai Antioksidan ... 26
H.Penentuan Aktivitas Penangkapan Radikal DPPH ... 27
I. Kerangka Berfikir ... 29
D.Rancangan Penelitian ... 31
E. Alat dan Bahan Penelitian ... 33
F. Prosedur Penelitian ... 36
G.Analisis Data ... 39
BAB IV HASIL DAN PEMBAHASAN A.Hasil Penelitian ... 40
B.Pembahasan ... 41
BAB V SIMPULAN DAN SARAN A.Simpulan ... 49
B.Saran ... 49
DAFTAR PUSTAKA ... 50
viii
DAFTAR GAMBAR
Gambar Halaman
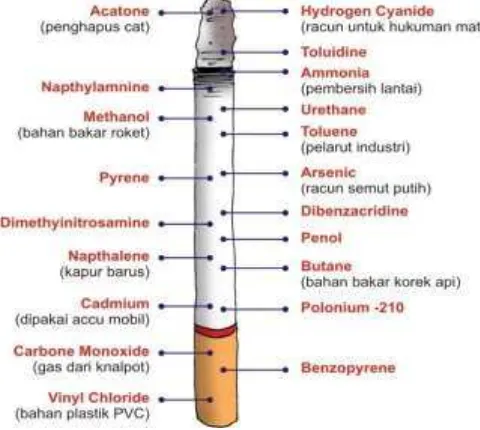
1. Kandungan senyawa kimia pada rokok ... 7
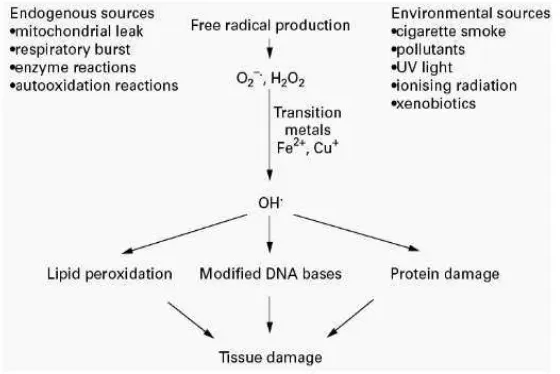
2. Sumber eksogen dan endogen radikal bebas ... 12
3. Kulit buah rambutan ... 15
4. Struktur kimia MDA ... 22
5. Reaksi antara radikal DPPH dengan antioksidan ... 28
6. Struktur molekul DPPH setelah menerima donor atom OH ... 28
7. Kerangka berfikir penelitian ... 29
1. Senyawa yang terkandung dalam asap rokok ... 8
2. Kandungan total phenolic content, total anthocyanin content dan tanin pada kulit buah rambutan ... 16
3. Kandungan geraniin, ellagic acid, corilagin dan asam askorbat pada kulit buah rambutan ... 17
4. Kandungan saponin, alkaloid, tanin dan flavonoid pada kulit buah rambutan (mg/100 g berat kering) ... 17
5. Alat penelitian ... 33
6. Bahan penelitian ... 34
7. Prosedur pengukuran kadar MDA ... 38
8. Prosedur pengukuran aktivitas SOD ... 38
x
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil pemeriksaan kadar MDA dan aktivitas SOD ... 58
2. Uji normalitas, homogenitas, anova dan post hoc kadar MDA .... 59
3. Uji normalitas, homogenitas, anova dan post hoc aktivitas SOD ... 64
4. Hasil identifikasi tumbuhan rambutan ... 70
5. Hasil uji DPPH ekstrak kulit buah rambutan ... 71
Rokok adalah produk dari daun tembakau yang kemunculannya menyebabkan kontroversial karena mampu menimbulkan pro dan kontra di masyarakat (Fitria et al. 2013). Merokok merupakan salah satu gaya hidup masyarakat di dunia, salah satunya Indonesia. Mengonsumsi rokok diketahui dapat menyebabkan gangguan kesehatan, baik secara langsung maupun tidak. Gangguan kesehatan yang ditimbulkan antara lain dapat berupa bronkitis kronis, emfisema, kanker paru-paru dan penyempitan pembuluh nadi (Church & Pryor 1985). Dampak rokok terhadap kesehatan sering disebut sebagai silent killer. Pengaruh tersebut timbul secara perlahan, dalam tempo yang relatif lama, tidak langsung dan tidak nampak secara nyata (Rupinder 2014).
Indonesia merupakan negara berkembang dengan penduduk perokok terbesar ketiga di dunia setelah Cina dan India (WHO 2013). Menurut survei WHO (2008), sepertiga dari penduduk dunia terutama orang dewasa adalah perokok. Jumlah perokok setiap tahun cenderung meningkat seiring dengan meningkatnya konsumsi rokok. Angka kematian di dunia akibat rokok mencapai 500 juta orang per tahun. Dalam setiap enam detik terdapat satu kematian akibat rokok
2
oksida dan formalin. Komponen partikel asap rokok diantaranya adalah tar, indol nikotin, karbarzol dan kresol (KPAI 2009).
Asap rokok merupakan campuran senyawa yang mengandung
≥4000 bahan kimia antara lain tar, nikotin, karbon monoksida dan zat-zat berbahaya lainnya. Senyawa yang terkandung pada asap rokok terdiri dari
≥200 zat bersifat racun (asam hidrosianat, akrolein, oksida nitrogen) dan
≥40 zat bersifat karsinogen (tar, nikotin, benzo(a)piren, senyawa
hidrokarbon) (Palanisamy et al. 2009). Dalam satu kali hisapan rokok terdapat 1014-16 molekul radikal bebas yang masuk ke dalam tubuh (Yanbaeva et al. 2007). Asap rokok adalah polutan bagi manusia dan lingkungan.
Asap rokok dapat menimbulkan respons stres, yaitu kondisi pada saat individu tidak mampu mengatasi beban fisik atau psikologis. Stres yang berat diketahui dapat menyebabkan stres oksidatif. Stres oksidatif adalah ketidakseimbangan antara jumlah radikal bebas dengan antioksidan tubuh. Pada kondisi stres oksidatif, terjadi peningkatan jumlah reactive oxygen species (ROS) di dalam tubuh (Haliwell & Gutteridge 1999). ROS adalah oksidan yang sangat reaktif. Dampak negatif senyawa tersebut timbul karena aktivitasnya, sehingga dapat merusak komponen sel yang sangat penting untuk mempertahankan integritas sel. Setiap ROS yang terbentuk dapat memulai suatu reaksi berantai yang terus berlanjut hingga ROS itu dihilangkan oleh ROS yang lain atau sistem antioksidan (Pillon & Soulage 2012).
peroksidasi lipid membran sel dan merusak organisasi membran sel. Salah satu biomarker terjadinya stres oksidatif adalah tingginya kadar
malondialdehyde (MDA) dan menurunnya aktivitas SOD akibat proses
peroksidasi lipid yang berlebihan di dalam sel (Hu et al. 2014).
Suatu cara untuk mengendalikan terjadinya stres oksidatif yang berlebihan yaitu dengan mengonsumsi antioksidan dari makanan (antioksidan eksogen). Salah satu sumber antioksidan eksogen adalah kulit buah dari tanaman rambutan (Nephelium lappaceum L). Tanaman rambutan banyak ditemui di Indonesia. Tanaman rambutan terdiri dari bagian akar, daun, biji, buah, kulit kayu dan kulit buah yang memiliki banyak manfaat sebagai sumber vitamin dan senyawa berkhasiat obat. Kulit buah rambutan merupakan salah satu bagian dari tanaman rambutan yang belum dimanfaatkan secara maksimal. Kulitnya yang berwarna merah ditemukan mengandung berbagai macam senyawa kimia.
Berdasarkan penelitian, kulit buah rambutan memiliki aktivitas antioksidan yang mengandung senyawa fenolik, alkaloid, steroid, terpenoid (Wardhani & Supartono 2015), asam askorbat (Wall 2006), flavonoid (Dirmawati 2008) serta antosianin (Hutapea et al. 2014) dengan kandungan tertinggi adalah senyawa fenolik (Fila et al. 2012). Penelitian Thitilerdecha et al. (2010) berhasil mengisolasi asam ellagat, korilagin dan geranin yang merupakan senyawa fenolik pada kulit buah rambutan. Senyawa fenolik bersifat antioksidan kuat dan terdapat paling banyak pada kulit buah rambutan. Senyawa tersebut mempunyai cincin aromatik dengan gugus hidroksil lebih dari satu dan berperan melindungi sel tubuh dari bahaya radikal bebas dengan cara mengikat radikal bebas.
4
B. Rumusan Masalah
Berdasarkan latar belakang di atas, maka rumusan masalah dalam penelitian ini adalah:
Bagaimana pengaruh pemberian ekstrak kulit buah rambutan terhadap kadar MDA dan aktivitas SOD pada tikus yang dipapar asap rokok?
C. Tujuan Penelitian
Tujuan penelitian ini adalah: Untuk menganalisis kadar MDA dan aktivitas SOD pada tikus yang dipapar asap rokok dan diberi ekstrak kulit buah rambutan.
D. Manfaat Penelitian
Dengan dilaksanakannya penelitian ini diharapkan dapat memberi manfaat sebagai berikut :
1. Memberikan informasi tentang hasil kajian efek pemberian ekstrak kulit buah rambutan sebagai sumber antioksidan
2. Meningkatkan kepercayaan masyarakat terhadap penggunaan obat yang berasal dari bahan-bahan alami.
3. Berguna sebagai bahan acuan untuk penelitian lebih lanjut mengenai ekstrak kulit buah rambutan sebagai antioksidan.
E. Penegasan Istilah
Untuk menghindari salah pengertian dalam memahami isi skripsi ini, perlu ada batasan-batasan terhadap beberapa istilah sebagai berikut : 1. Ekstrak Kulit Buah Rambutan
2. MDA
MDA merupakan senyawa dialdehida produk akhir dari peroksidasi lipid (Winarsi 2007). MDA dalam penelitian ini adalah hasil peroksidasi lipid oleh senyawa radikal bebas akibat dipapar asap rokok. MDA diukur menggunakan spektrofotometer pada panjang gelombang 545 nm.
3. SOD
SOD adalah antioksidan enzimatis yang melindungi jaringan dari kerusakan oksidatif akibat radikal bebas (Muchtadi 2013). SOD dalam penelitian ini diukur dengan metode kolorimetri dari BioVision
Incorporated menggunakan microplate reader pada panjang gelombang
450 nm. 4. Asap Rokok
BAB II
TINJAUAN PUSTAKA
A. Kandungan Senyawa Kimia Rokok
Rokok merupakan salah satu sumber utama paparan toksin yang secara kimiawi berpengaruh dalam menimbulkan berbagai jenis penyakit. Rokok adalah produk dari tembakau yang mengandung nikotin dan tar. Rokok berbentuk silinder terdiri dari kertas berwarna putih dan cokelat, berukuran panjang antara 70-120 mm (bervariasi tergantung negara) dengan diameter 10 mm, berisi cacahan daun tembakau dengan tambahan sedikit racikan cengkeh (Triswanto 2007). Rokok dibakar pada salah satu ujungnya dan dibiarkan membara agar asapnya dapat dihirup lewat mulut pada ujung lainnya. Rokok terdiri dari dua jenis, yaitu rokok yang berfilter dan rokok tidak berfilter. Filter pada rokok terbuat dari bahan busa serabut sintesis yang berfungsi untuk menyaring nikotin. Filter rokok mampu mengurangi jumlah tar dan nikotin dalam asap hingga 40-50% dibandingkan dengan rokok tidak berfilter (Shin et al. 2009).
Berdasarkan bahan bakunya rokok terbagi menjadi tiga kategori yaitu rokok putih, rokok kretek dan rokok klembak. Rokok putih adalah rokok yang terbuat dari daun tembakau dan diberi saus. Rokok kretek adalah rokok berbahan daun tembakau dan cengkeh yang diberi saus, sedangkan rokok klembak yaitu rokok yang terbuat dari daun tembakau, cengkeh, kemenyan dan saus. Fungsi penambahan bahan lain dalam pembuatan rokok adalah untuk mendapatkan efek rasa dan aroma tertentu (Sitepoe 2000).
Merokok adalah kegiatan menghisap asap dari pembakaran tembakau pada rokok. Mengonsumsi rokok sudah menjadi tren dan bahkan didalilkan sebagai tanda kedewasaan seseorang. Di Indonesia, jenis rokok yang banyak dikonsumsi adalah rokok kretek. Rokok kretek mengandung 60-70% tembakau, 30-40% cengkeh dan ramuan lainnya (Hutapea 2013). Rokok kretek mengandung 5 komposisi tambahan yaitu eugenol, acethyl
eugenol, β-caryophillene, α-humulene dan caryophillene epoxide. Berdasarkan penelitian, eugenol merupakan bahan anestetik yang digunakan oleh dokter gigi. Apabila eugenol dikonsumsi maka akan timbul efek anestesi pada pengguna rokok kretek. Eugenol juga memiliki efek antikonvulsan, penghambat transmisi neural dan peradangan (Guidotti et al. 1989).
Gambar 1. Kandungan senyawa kimia pada rokok (Kandar 2014)
8
Tabel 1. Senyawa-senyawa yang terkandung dalam asap rokok
Fase Asap Rokok Senyawa Efek c. Nikotin Kokarsinogen & iritan d. Fenol Kokarsinogen & iritan e. Kresol Kokarsinogen & iritan f. Β-Naftilamin Karsinogen
g. N-Nitrosonomikotin Karsinogen h. Benzo(a)piren Karsinogen
i. Logam renik Karsinogen
j. Indol Akselerator tumor
k. Karbazol Akselerator tumor
l. Katekol Kokarsinogen
Fase Gas a. Karbon monoksida Pengurangan transfer dan pemakaian O2
b. Asam hidrosianat Sitotoksik & iritan c. Asetaldehid Sitotoksik & iritan d. Akrolein Sitotoksik & iritan e. Amonia Sitotoksik & iritan f. Formaldehid Sitotoksik & iritan g. Oksida dari nitrogen Sitotoksik & iritan
h. Nitrosamin Karsinogen
i. Hidrozin Karsinogen
j. Vinil klorida Karsinogen (Palanisamy et al. 2009)
paru-paru juga dapat mengalami peningkatan stres oksidatif (Tostes et al. 2008).
Fase partikel asap rokok mengandung kompleks hidrokarbon yang akan bereaksi dengan nitrogen oksida (NO) dan membentuk senyawa radikal lain. NO yang terdapat pada asap rokok dapat menginisiasi PUFA dan mengakibatkan pembentukan peroksidasi lipid. Fase partikel asap rokok memiliki waktu paruh lebih lama daripada fase gas. Fase partikel mengandung ion logam yang dapat menghasilkan radikal hidroksil dari hidrogen peroksida. Radikal tersebut dapat menembus membran sel dan dapat menginduksi stres oksidatif (Pryor 1997). Radikal bebas akan mengikat molekul-molekul yang paling rentan pada membran sel seperti PUFA. Jembatan metilen pada PUFA merupakan sasaran utama radikal bebas yang akan membentuk radikal alkil, peroksil dan alkoksil (Allard et al. 1994).
Zat-zat yang terkandung dalam asap rokok sangat beracun karena mampu menimbulkan efek inflamasi dan radikal bebas yang dapat menurunkan efek antioksidan. Menurut Fitria et al. (2013) racun utama pada asap rokok yang mengganggu kesehatan sebagai berikut:
1. Tar
Tar adalah sejenis cairan kental berwarna coklat tua atau hitam, merupakan substansi hidrokarbon yang bersifat lengket dan menempel pada paru-paru. Tar merupakan suatu zat karsinogen yang dapat menimbulkan kanker pada saluran pernafasan dan paru-paru. Tar terdiri dari dua fase yaitu fase tar dan fase gas. Pada fase tar, merupakan pembentuk radikal bebas seperti quinon, semiquinon dan hidroquinon dalam bentuk matriks polimer. Pada fase gas, mengandung nitrit oksida dan nitrit peroksida yang dapat mengubah oksigen menjadi radikal bebas superoksida dan radikal bebas hidroksil yang sangat merusak (Lustbrader et al. 1983).
2. Nikotin
10
mengakibatkan ketergantungan. Nikotin berbentuk cair, tidak berwarna dan merupakan basa yang mudah menguap. Nikotin dapat meracuni saraf tubuh, meningkatkan tekanan darah, menimbulkan penyempitan pembuluh darah tepi dan menyebabkan ketagihan serta ketergantungan pada pemakainya (Benowitz 2008). Jumlah nikotin yang dihisap perokok dipengaruhi oleh berbagai faktor, yaitu kualitas rokok, jumlah tembakau setiap batang rokok, dalamnya isapan dan penggunaan filter.
Kandungan nikotin dalam rokok kretek lebih besar daripada rokok filter. Nikotin yang terdapat dalam asap rokok samping 4–6 kali lebih besar dari asap rokok utama. Rokok kretek mengandung lebih banyak nikotin dibandingkan dengan rokok putih. Kadar nikotin pada rokok kretek sebesar 46,8 mg sedangkan pada rokok putih yaitu 16,3 mg. Nikotin yang dikeluarkan oleh rokok kretek jumlahnya lebih banyak karena rokok kretek tidak dilengkapi dengan filter (Susanna et al. 2003).
3. Karbon monoksida
Karbon monoksida adalah sejenis gas beracun yang tidak berwarna dan tidak berbau. Gas CO yang dihasilkan sebatang rokok dapat mencapai 3-6%, sedangkan CO yang dihisap oleh perokok sejumlah 400 ppm (parts per million). Karbon monoksida terkandung dalam asap rokok mainstream maupun sidestream. Pada dosis rendah, paparan karbon monoksida dapat meningkatkan kadar karboksi hemoglobin (COHb) dalam darah sejumlah 2-16% yang dapat menyebabkan kekurangan oksigen pada jaringan (Sitepoe 2000).
4. Logam timbal (Pb)
negatif dalam tubuh serta menyebabkan penurunan kemampuan antioksidan sehingga menyebabkan stres oksidatif.
B. Asap Rokok sebagai Sumber Radikal Bebas
Radikal bebas adalah suatu senyawa yang memiliki satu atau lebih elektron tidak berpasangan di orbital luarnya (unpaired electron). Oleh karena elektronnya tidak berpasangan, maka senyawa tersebut labil dan sangat reaktif mencari pasangan. Radikal bebas akan menyerang dan mengikat elektron molekul di sekitarnya. Molekul yang terambil elektronnya akan mewarisi sifat reaktifnya sehingga timbul reaksi berantai yang tidak terputus (Muchtadi 2013). Reaksi rantai akan berhenti apabila reaktivitasnya diredam oleh senyawa yang bersifat antioksidan.
Radikal bebas dapat terbentuk melalui 3 tahapan reaksi yaitu inisiasi, propagasi dan terminasi.
1. Tahap inisiasi (permulaan), yaitu tahap pembentukan awal radikal-radikal bebas.
Misalnya:
Fe++ + H2O2 Fe+++ + OH- + ·OH
R1– H + ·OH R1· + H2O
2. Tahap propagasi (perambatan), yaitu tahap radikal bebas mengawali sederetan reaksi sampai terbentuk radikal bebas baru yang sering disebut sebagai reaksi rantai
R2– H + R1· R2· + R1– H
R3– H + R2· R3· + R2– H
3. Tahap terminasi (pengakhiran), yaitu tahap terputusnya daur propagasi oleh reaksi-reaksi terminasi. Reaksi ini mengubah radikal bebas menjadi radikal bebas yang stabil dan tidak reaktif.
R1· + R1· R1– R1
R2· + R1· R2– R1
12
sebagai sisa proses metabolisme protein, karbohidrat, lemak pada mitokondria, proses inflamasi, reaksi antara besi logam transisi dalam tubuh, fagosit, xantin oksidase, peroksisom maupun pada kondisi iskemia. Sumber dari luar tubuh adalah asap rokok, asap kendaraan bermotor, polusi lingkungan, radiasi ultraviolet, obat-obatan dan pestisida. Radikal bebas terpenting dalam tubuh adalah radikal derivat dari oksigen yang disebut kelompok oksigen reaktif (ROS) (Haliwell & Gutteridge 2007). ROS adalah senyawa pengoksidasi turunan oksigen yang bersifat sangat reaktif, terdiri atas kelompok radikal bebas dan kelompok nonradikal. Kelompok radikal bebas antara lain superoxide anion (O2·-), hydroxyl radicals (OH·) dan peroxyl radicals (RO2·). Kelompok nonradikal misalnya hydrogen peroxide
(H2O2) dan organic peroxides (ROOH) (Haliwell & Whiteman 2004).
Gambar 2. Sumber eksogen dan endogen radikal bebas (Young & Woodside 2001)
dapat mengikat radikal bebas lagi. Hal tersebut berbahaya karena radikal bebas berpotensi untuk berikatan dengan molekul lain sehingga molekul lain tidak stabil, menyebabkan peroksidasi lipid membran sel yang berlebihan, serta menyebabkan kerusakan pada protein dan DNA (Packer 1994).
Merokok telah diketahui dapat menyebabkan gangguan kesehatan yang diakibatkan oleh nikotin dari asap perokok aktif dan asap perokok pasif. Target utama asap rokok adalah paru-paru. Rusaknya paru-paru sebagai target utama yang langsung terkena asap rokok dapat dijelaskan dengan adanya paparan agen kimia di dalam asap rokok. Namun, efek yang menyebabkan penyakit kronik pada sistem organ lain kemungkinan adalah hasil pajanan secara tidak langsung (Yanbaeva et al. 2007). Merokok juga merupakan salah satu faktor resiko utama terhadap penyakit kardiovaskuler. Mekanisme potensial yang disebabkan merokok terhadap penyakit kardiovaskuler meliputi gangguan homeostasis, abnormalitas lipid dan disfungsi endotel (Papathanasiou et al. 2014).
Berdasarkan mekanisme kerjanya di dalam tubuh manusia, racun dibagi menjadi dua yaitu racun yang bekerja lokal dan sistemik (Wu & Wang 2005). Racun yang bekerja lokal dapat bersifat korosif, iritasi atau anestetik. Racun yang bekerja sistemik biasanya mempunyai afinitas terhadap salah satu sistem, contohnya alkohol dan karbon monoksida. Adapun racun yang bekerja lokal maupun sistemik misalnya asam karbol, arsen dan Pb. Efek lokal maupun sistemik dari paparan asap rokok dapat dijelaskan melalui mekanisme stres oksidatif dan inflamasi (Pearson et al. 2003).
14
Stres oksidatif dapat dilihat dari beberapa tanda yang berbeda, yaitu dengan pengukuran langsung agen oksidatif seperti produksi ROS oleh sel darah perifer, efek stres oksidatif pada target molekul (produk lipid peroksidasi dan protein teroksidasi), atau respon kapasitas antioksidan dalam plasma (Yanbaeva et al. 2007). Paparan bahan kimia oksidan dalam asap dikaitkan dengan penurunan tingkat antioksidan endogen dalam kompartemen sistemik. Sejumlah penelitian melaporkan bahwa merokok mengakibatkan rendahnya konsentrasi antioksidan dalam plasma.
Hasil penelitian Adyttia et al. (2014) menunjukkan bahwa pemberian asap rokok (3 batang/hari) pada tikus selama 14 hari mengakibatkan peningkatan kadar MDA. Penelitian Muhammad (2009), melaporkan bahwa pemberian asap rokok (4 batang/hari selama 30 hari) pada tikus menunjukkan adanya kenaikan kadar MDA dan penurunan aktivitas SOD. Hal ini dikarenakan keadaan stres akibat pemaparan asap rokok dapat meningkatkan jumlah radikal bebas yang menyebabkan penggunaan SOD semakin banyak sehingga jumlahnya semakin berkurang.
C. Kandungan Senyawa Kimia Kulit Buah Rambutan
Rambutan merupakan tumbuhan yang memiliki banyak manfaat dan sangat digemari masyarakat. Salah satu bagian yang belum dimanfaatkan secara maksimal adalah kulit buah rambutan. Banyak penelitian telah membuktikan berbagai macam senyawa kimia yang terkandung di dalamnya. Kulit buah rambutan ditemukan memiliki efek biologis seperti aktivitas antioksidan, antibakteri (Palanisamy et al. 2008; Thitilerdecha et al. 2008), antiproliferasi (Khonkarn et al. 2010), anti herpes simplex virus tipe 1 (Nawawi et al. 1999) dan antihiperglikemik (Palanisamy et al. 2011).
Gambar 3. Buah rambutan kultivar Sekaran (Dokumentasi penulis 2016)
16
Tabel 2. Kandungan total phenolic content, total anthocyanin content dan tanin pada kulit buah rambutan
Metode ekstraksi Pelarut Total phenolic
17
Tabel 3. Kandungan geraniin, ellagic acid, corilagin dan asam askorbat pada kulit buah rambutan Metode ekstraksi Pelarut Geraniin Ellagic acid
(mg/g ekstrak kering)
Corilagin (mg/g ekstrak kering)
Asam askorbat (mg/100 g berat segar)
Referensi
Maserasi Etanol
Air
37.9 ± 8.3d 15.2 ± 2.3d
- -
- -
- -
Palanisamy et al. (2011b)
Maserasi Etanol 3.79%c - - - Palanisamy et al. (2011a)
Maserasi Methanol 568d 53.5 71.9 - Thitilerdecha et al. (2010)
- - - 36.4 Wall 2006
Tabel 4. Kandungan saponin, alkaloid, tanin dan flavonoid pada kulit buah rambutan (mg/100 g berat kering)
Metode ekstraksi Pelarut Saponin Alkaloid Tanin Flavonoid Referensi
18
Alkaloid merupakan kelompok dari metabolit sekunder yang memiliki atom nitrogen, dan merupakan bagian dari cincin heterosiklik. Sebagian besar alkaloid mempunyai aktivitas biologis tertentu. Beberapa alkaloid dilaporkan memiliki sifat beracun, tetapi ada pula yang sangat berguna dalam pengobatan. Senyawa alkaloid dapat bertindak sebagai penangkap radikal bebas dan dapat mencegah terjadinya peroksidasi lipid pada hepatik mikrosomal (Moura et al. 2007).
Terpenoid merupakan senyawa yang mengandung atom karbon kelipatan lima. Terpenoid merupakan antioksidan alami, seperti halnya tokoferol dan asam askorbat. Terpenoid merupakan senyawa hidrokarbon isometrik terdapat pada lemak esensial, dapat membantu tubuh dalam proses sintesis organik dan pemulihan sel-sel tubuh. Terpenoid mampu menunda, memperlambat dan mencegah proses oksidasi lipid (Grassman 2005).
Tanin merupakan senyawa polifenol yang memiliki berat molekul cukup tinggi (lebih dari 1000) dan dapat membentuk kompleks dengan protein. Berdasarkan strukturnya, tanin dibedakan menjadi dua kelas yaitu tanin terkondensasi (condensed tannins) dan tanin terhidrolisiskan (hydrolysable tannins) (Harborne 1996). Tanin dilaporkan memiliki efek fisiologis seperti mempercepat pembekuan darah, menurunkan tekanan darah, menurunkan kadar lipid serum, menghasilkan nekrosis hati dan memodulasi respons imun (Chung et al. 1998). Tanin mempunyai kemampuan untuk mengikat protein dan juga menimbulkan astringent
sensation (rasa tidak enak) bagi hewan ternak atau manusia yang
mengkonsumsinya. Astringent sensation ini ditimbulkan karena adanya ikatan kompleks antara mukoprotein dengan tanin (Farida et al. 2000). Konsumsi senyawa tanin dalam jumlah banyak akan menimbulkan pengaruh negatif, misalnya menghambat penyerapan mineral. Selain itu, tanin juga berperan sebagai zat karsinogenik, hepatoksik dan memiliki aktivitas antinutritional (Chung et al. 1998).
senyawa golongan fenolik yang mempunyai struktur kimia C6-C3-C6
Flavonoid merupakan salah satu kelompok fenol yang terbesar di alam. Lebih dari 4000 jenis flavonoid telah diidentifikasi dan beberapa diantaranya memberikan warna pada bunga, buah dan daun. Flavonoid merupakan pigmen tumbuhan kuning, kuning jeruk, dan merah yang dapat ditemukan pada buah, sayuran, kacang, biji batang, bunga, herba, rempah-rempah, serta produk pangan dan obat dari tumbuhan seperti teh, minyak zaitun, cokelat, anggur merah dan obat herbal (de Groot & Rauen 1998). Flavonoid adalah senyawa polifenol yang mempunyai sifat kimia fenol, yaitu bersifat agak asam sehingga dapat larut dalam basa. Flavonoid mempunyai gugus hidroksil tak tersulih atau suatu gula, sehingga merupakan senyawa polar. Flavonoid larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, dan lain-lain (Markham 1988).
Flavonoid berperan sebagai antioksidan dengan cara mengkelat logam, berada dalam bentuk glukosida (memiliki rantai samping glukosa) atau dalam bentuk bebas yang disebut aglikon. Mekanisme flavonoid sebagai antioksidan yaitu mendonorkan ion hidrogen sehingga menetralisir efek toksik dari radikal bebas serta meningkatkan ekspresi gen antioksidan endogen melalui aktivasi nuclear factor erythroid 2 related factor 2 (Nrf2 ). Akibat dari proses tersebut akan terjadi peningkatan gen yang berperan dalam sintesis enzim antioksidan endogen, misalnya SOD (Sumardika & Jawi 2012).
20
berhasil mengisolasi senyawa fenolik bentuk polifenol dalam kulit buah rambutan. Senyawa tersebut yaitu asam ellagat, corilagin dan geraniin yang berpotensi sebagai antioksidan. Polifenol merupakan senyawa kimia yang mempunyai cincin aromatik dengan gugus hidroksil lebih dari satu.
Komponen fenolik merupakan terminator dari radikal bebas dan sebagai pengkelat ion logam redoks aktif. Ion logam tersebut memungkinkan peranannya untuk mengatalisasi reaksi peroksidasi lipid. Antioksidan fenolik menghalangi oksidasi lipid dan molekul lain dengan cara mendonasikan atom hidrogen ke senyawa radikal membentuk intermediet radikal fenoksil. Senyawa intermediet radikal fenoksil relatif
stabil sehingga tidak mampu lagi menginisiasi reaksi radikal selanjutnya.
Aktivitas biologis yang tinggi pada senyawa fenolik terletak pada posisi dan
jumlah gugus –OH (Nzaramba 2008).
Grup fenolik memiliki aktivitas sebagai antioksidan juga prooksidan. Banyaknya konsentrasi antioksidan yang ditambahkan dapat berpengaruh pada laju oksidasi. Pada konsentrasi rendah, grup fenolik dapat menghambat atau mencegah pembentukan radikal bebas. Namun, pada konsentrasi tinggi aktivitas antioksidan grup fenolik sering lenyap bahkan antioksidan tersebut menjadi prooksidan (Gordon 1990).
D. Malondialdehida (MDA)
Kerusakan oksidatif pada senyawa lipid terjadi ketika senyawa radikal bebas bereaksi dengan senyawa polyunsaturated fatty acid (PUFA). Lipid membran bilayer diketahui merupakan campuran fosfolipid dan glikolipid yang berikatan dengan asam lemak pada C1 dan C2 rantai gliserol.
Tingkat maupun jenis reaksi oksidasi pada berbagai asam lemak akan berlainan. Perbedaan ini sangat bergantung pada jumlah dan posisi ikatan rangkap pada rantai asam lemaknya (Muchtadi 2013).
lipid merupakan inisiasi reaksi berantai oleh radikal hidrogen atau oksigen yang menyebabkan teroksidasinya PUFA. PUFA lebih rentan terhadap reaksi radikal bebas dibandingkan asam lemak jenuh. Jembatan metilen yang dimiliki PUFA merupakan sasaran utama radikal bebas yang akan membentuk radikal alkil, peroksil, dan alkoksil. Bentuk produk oksidasi lipid yang banyak ditemukan dalam cairan biologis antara lain diena terkonjugasi dalam plasma, hidroperoksida dalam plasma, LDL teroksidasi dalam plasma, aldehid dalam plasma seperti TBARs, MDA dan 4-hidroksinoneal (Allard et al. 1994).
MDA terbentuk dari peroksidasi lipid pada membran sel yang merupakan reaksi radikal bebas. Apabila aktivitas radikal bebas melebihi mekanisme pertahanan normal, maka akan terjadi berbagai gangguan metabolis dan seluler. Radikal bebas dapat merusak sel dengan cara merusak membran sel tersebut. Kerusakan pada membran sel dapat terjadi dengan cara:
a. Radikal bebas berikatan secara kovalen dengan enzim dan/atau reseptor yang berada di membran sel sehingga mengubah aktivitas komponen-komponen yang terdapat pada membran sel tersebut b. Radikal bebas berikatan secara kovalen dengan komponen membran
sel sehingga mengubah struktur membran dan mengakibatkan perubahan fungsi membran dan/atau mengubah karakter membran menjadi seperti antigen
c. Radikal bebas mengganggu sistem transpor membran sel melalui ikatan kovalen, mengoksidasi kelompok thiol atau dengan mengubah PUFA
d. Radikal bebas menginisiasi peroksidasi lipid secara langsung terhadap PUFA dinding sel
22
mempengaruhi fluiditas membran, cross-linking membran, serta struktur dan fungsi membran (Powers & Jackson 2008).
Mekanisme kerusakan sel akibat serangan radikal bebas yang paling awal diketahui dan terbanyak diteliti adalah peroksidasi lipid. Peroksidasi lipid paling banyak terjadi di membran sel, terutama asam lemak tidak jenuh yang merupakan komponen penting penyusun membran sel. Pengukuran tingkat peroksidasi lipid diukur dengan mengukur produk akhirnya, yaitu malondialdehida (Lima et al. 2004). MDA merupakan produk peroksidasi lipid yang relatif konstan terhadap proporsi peroksidasi lipid, oleh karena itu merupakan indikator yang tepat untuk mengetahui kecepatan (rate) proses peroksidasi lipid in vivo. Malondialdehida memiliki tiga rantai karbon dengan rumus molekul C3H4O2 (Pryor et al. 1976).
MDA dapat bereaksi dengan komponen nukleofilik atau elektrofilik. Aktivitas non spesifiknya, MDA dapat berikatan dengan berbagai molekul biologis seperti protein, asam nukleat dan aminofosfolipid secara kovalen (Muchtadi 2013). Efek negatif senyawa radikal maupun metabolit elektrofilik dapat diredam oleh antioksidan, baik antioksidan zat gizi maupun antioksidan non gizi. Oleh karena itu, tinggi rendahnya kadar MDA sangat bergantung pada status antioksidan dalam tubuh seseorang.
Gambar 4. Struktur kimia MDA (Current Protocols 2010)
MDA plasma membuktikan kerentanan komponen membran sel terhadap reaksi oksidasi.
Pemeriksaan kadar MDA dapat dilakukan menggunakan beberapa cara, salah satunya dengan metode thiobarbituric acid reactive substance (TBARs) yang dapat dilakukan secara in vivo maupun in vitro (Josephy 1997). Tes ini didasarkan pada reaksi kondensasi antara satu molekul MDA dengan dua molekul TBA pada kondisi asam. Jumlah MDA yang terdeteksi menggambarkan banyaknya peroksidasi lipid yang terjadi.
E. Superoksida Dismutase (SOD)
Antioksidan adalah senyawa pemberi elektron yang mampu menangkal atau meredam dampak negatif oksidan dalam tubuh. Antioksidan bekerja dengan cara mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut bisa dihambat. Antioksidan terbagi menjadi tiga kelompok besar yaitu:
a. Antioksidan primer
Antioksidan primer disebut juga antioksidan enzimatis. Antioksidan meliputi enzim SOD, katalase dan glutation peroksidase (GSH-Px). Enzim-enzim tersebut mampu menekan atau menghambat pembentukan radikal bebas dengan cara memutus reaksi berantai dan mengubahnya menjadi produk lebih stabil, disebut sebagai reaksi chain breaking antioxidant. Suatu senyawa dikatakan sebagai antioksidan primer apabila dapat memberikan atom hidrogen secara cepat kepada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera berubah menjadi senyawa yang lebih stabil (Winarsi 2007).
b. Antioksidan sekunder
24
komponen non nutrisi dan komponen nutrisi dari sayuran dan buah-buahan meliputi vitamin E, vitamin C, β-karoten, flavonoid, asam urat, bilirubin dan albumin. Kerja antioksidan non enzimatis dengan cara memotong reaksi oksidasi berantai dari radikal bebas atau dengan cara menangkap radikal bebas (scavenger free radical). Akibatnya, radikal bebas tidak akan bereaksi dengan komponen seluler (Lampe 1999).
c. Antioksidan tersier
Kelompok antioksidan tersier meliputi sistem enzim DNA repair dan metionin sulfoksida reduktase. Enzim-enzim tersebut berfungsi dalam perbaikan biomolekuler yang rusak akibat reaktivitas radikal bebas.
Enzim SOD merupakan antioksidan penting yang berasal dari tubuh sendiri, berpengaruh sangat kuat dan merupakan pertahanan tubuh garis pertama dalam mengatasi stres oksidatif (Fridovich 1981). SOD merupakan antioksidan pencegah yang dapat menghambat kerusakan anion superoksida. Cara kerja SOD yaitu dengan mengkonversi anion superoksida menjadi komponen lain yang kurang berbahaya, yaitu hidrogen peroksida. Hidrogen peroksida di dalam mitokondria akan mengalami detoksifikasi oleh enzim katalase menjadi senyawa H2O dan O2, sedangkan H2O2 yang
berdifusi ke dalam sitosol akan didetoksifikasi oleh enzim glutation peroksidase (Lee et al. 2004). SOD bersifat tidak stabil terhadap panas, cukup stabil pada kondisi basa dan masih mempunyai aktivitas walaupun disimpan sampai lima tahun pada suhu 5 0C.
SOD
O2·- + O2·- + 2H+ H2O2 + O2
di hati, kelenjar adrenalin, ginjal, darah, limfa, pankreas, otak, paru-paru, lambung, usus, ovarium dan timus.
F. Senyawa Antioksidan Vitamin C
Vitamin C atau L-asam askorbat merupakan antioksidan yang larut dalam air (aqueous antioxidant). Senyawa tersebut merupakan bagian dari sistem pertahanan tubuh terhadap senyawa oksigen reaktif dalam plasma dan sel (Zakaria 1996). Vitamin C merupakan antioksidan yang bekerja sebagai donor elektron dengan cara memindahkan satu elektron ke senyawa logam Cu. Vitamin C juga dapat menyumbangkan elektron ke dalam reaksi biokimia intraseluler dan ekstraseluler. Vitamin C mampu menghilangkan senyawa oksigen reaktif di dalam sel netrofil, monosit, protein lensa dan retina. Vitamin tersebut juga dapat berinteraksi dengan Fe-ferritin. Di luar sel, vitamin C mampu menghilangkan senyawa oksigen reaktif, mencegah terjadinya LDL teroksidasi, mentransfer elektron ke dalam tokoferol teroksidasi dan mengabsorpsi logam dalam saluran pencernaan (Levine et al. 1995).
26
langsung juga meregenerasi ikatan antioksidan membran dengan cara menangkap radikal peroksil dan oksigen singlet (Zakaria 1996).
Penelitian Huang et al. (2002) pada perokok menunjukkan bahwa pemberian suplemen vitamin C 500 gram memberikan pengaruh dalam menurunkan peroksidasi lipid subjek yang diukur dengan kadar 8-iso-prostaglandin F2 urin. Mahfudz (2013), melaporkan bahwa pemberian vitamin C mampu menurunkan kadar MDA dan meningkatkan FMD (Flow
Mediated Dilatation) pada pasien PGK stadium V yang menjalani
hemodialisis. Ramatina (2014), melaporkan bahwa suplementasi vitamin C 500 mg mampu menurunkan kadar MDA plasma pada kelompok wanita muda sehat, mahasiswi alih jenis IPB. Berdasarkan hal tersebut, dapat disimpulkan bahwa vitamin C merupakan antioksidan sekunder yang mampu menangkap radikal bebas (scavenger free radical) sehingga radikal bebas tidak akan bereaksi dengan komponen seluler.
G. Mekanisme Kerja Kulit Buah Rambutan sebagai Antioksidan
Dalam pengertian kimia, senyawa antioksidan adalah senyawa pemberi elektron (electron donors). Secara biologis, pengertian antioksidan adalah senyawa yang mampu menangkal atau meredam dampak negatif oksidan dalam tubuh. Antioksidan mampu memerangi radikal bebas baik dengan cara mencegah, menghentikan ataupun memperlambat proses oksidasi. Antioksidan melindungi sel dan jaringan sasaran dengan cara memusnahkan ROS secara enzimatik atau dengan reaksi kimia langsung, mengurangi pembentukan ROS, mengikat ion logam yang terlibat dalam pembentukan ROS (tranferin, seruplasmin, albumin), memperbaiki kerusakan sasaran serta menghancurkan molekul yang rusak dan menggantinya dengan yang baru (Schuler 1990).
alkalosil (terminating chain reaction), pemutus rantai dari rangkaian reaksi yang diinisiasi oleh radikal bebas (inhibiing radical generating enzymes) dan peredam reaksi serta pembersih singlet oksigen (Kartikawati 1999).
Kulit buah rambutan mengandung senyawa polifenol yang berperan sebagai zat antioksidan. Polifenol memiliki struktur kimia yang sangat baik dalam aktivitas scavenging radikal dan menunjukkan aktivitas antioksidasi yang lebih efektif secara in vitro dibandingkan dengan asam askorbat dan α-tokoferol. Aktivitas antioksidasi dari polifenol ditandai dengan aktivitas yang relatif tinggi sebagai donor hidrogen (elektron), pemutus rantai dan pengkelat transisi logam (Rice-Evans et al. 1995). Aktivitas antioksidan senyawa polifenol dapat menghambat kerja radikal bebas melalui pengubahan senyawa radikal bebas reaktif menjadi stabil. Polifenol mampu menangkal oksigen dan radikal alkil dengan memberikan donor elektron (hidrogen) kepada radikal bebas sehingga terbentuk radikal fenoksil. Radikal fenoksil memiliki ikatan rangkap terkonjugasi sehingga tidak menimbulkan radikal bebas dan bersifat lebih stabil (Thitilertdecha et al. 2010).
H. Penentuan Aktivitas Penangkapan Radikal menggunakan DPPH
DPPH (1,1-diphenyl-2-picrylhydrazyl) merupakan suatu radikal bebas yang stabil pada suhu ruangan dan dapat bereaksi dengan atom hidrogen dari suatu antioksidan membentuk DPPH tereduksi. DPPH berperan sebagai sumber radikal bebas. Penangkapan radikal bebas menggunakan DPPH paling umum digunakan untuk menentukan aktivitas antioksidan suatu ekstrak tumbuhan. Radikal DPPH adalah suatu senyawa organik yang mengandung nitrogen tidak stabil dengan absorbansi kuat pada
λmaks 517 nm dan berwarna ungu gelap. DPPH akan bereaksi dengan
28
nilai absorbansi blanko dikurangi absorbansi sampel (Kedare & Singh 2011). Reaksi penangkapan radikal bebas menggunakan DPPH oleh suatu antioksidan dapat dilihat pada Gambar 6.
Gambar 5. Reaksi antara radikal DPPH dengan antioksidan (Windono 2001)
Gambar 6. Struktur molekul DPPH setelah menerima donor atom H (Cowie & Arrighi 2007)
I. Kerangka Berfikir
Gambar 7. Kerangka berfikir penelitian
J. Hipotesis Penelitian
Berdasarkan rumusan masalah yang telah dikemukakan, maka hipotesis yang akan diuji dalam penelitian ini adalah:
Pemberian ekstrak kulit buah rambutan menurunkan kadar MDA dan meningkatkan aktivitas SOD tikus yang dipapar asap rokok.
Peroksidasi lipid Ekstrak kulit buah
rambutan
Kandungan senyawa fenolik, alkaloid,
steroid, terpenoid, tanin, flavonoid, asam
askorbat, antosianin
MDA SOD ROS meningkat Karbon monoksida, tar, nikotin dan senyawa berbahaya lainnya
Paparan asap rokok
Antioksidan
MDA SOD Peroksidasi lipid
30 BAB III
METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian dilaksanakan selama 2 bulan. Penelitian ini terdiri dari beberapa tahap, yaitu pembuatan ekstrak kulit buah rambutan, pengukuran aktivitas antioksidan, pemeliharaan hewan coba, pemeriksaan kadar MDA dan aktivitas SOD. Pembuatan ekstrak kulit buah rambutan dilakukan di Laboratorium Farmasi FK Unissula. Pemeliharaan hewan coba dilakukan di Laboratorium Biologi FMIPA Unnes. Pengukuran aktivitas antioksidan dilakukan di Laboratorium Pangan Unika Soegijapranata. Pemeriksaan kadar MDA dilakukan di Laboratorium Biokimia Fakultas Kedokteran UNDIP dan pemeriksaan aktivitas SOD dilakukan di Laboratorium Gizi Pusat Studi Pangan dan Gizi UGM.
B. Populasi dan Sampel Populasi
Populasi yang digunakan dalam penelitian adalah tikus putih (Rattus novergicus) galur Wistar yang diperoleh dari Laboratorium Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Semarang.
Sampel
C. Variabel Penelitian
Ada 3 macam variabel dalam penelitian ini yaitu:
1. Variabel Bebas
Variabel bebas berupa ekstrak kulit buah rambutan.
2. Variabel terikat
Variabel terikat dalam penelitian ini adalah kadar MDA dan aktivitas SOD tikus.
3. Variabel kendali
Variabel kendali dalam penelitian ini adalah jenis rokok, jenis kelamin, umur, berat badan, jenis pakan tikus, ukuran dan kondisi lingkungan kandang tikus.
D. Rancangan Penelitian
Desain penelitian adalah Randomized Post Test Only With Control
Group Design dengan rancangan kelompok:
Kelompok A : Merupakan kelompok kontrol normal, tikus diberi akuades
Kelompok B : Merupakan kelompok kontrol negatif, tikus diberi paparan asap rokok selama 14 hari
32
Ekstrak kulit buah rambutan dalam penelitian ini adalah kulit buah rambutan kultivar Sekaran yang diperoleh dari Gunungpati, Semarang. Paparan asap rokok dalam penelitian ini merupakan hasil pembakaran 3 batang rokok kretek sebagai bahan penyebab peningkatan radikal bebas. Desain penelitian dapat dicermati pada Gambar 8.
Penentuan Dosis Ekstrak Kulit Buah Rambutan, Vitamin C dan Rokok
1. Dosis ekstrak kulit buah rambutan
Dosis ekstrak kulit buah rambutan mengacu pada penelitian Sandhiutami et al. (2015). Dosis ekstrak kulit buah rambutan yang digunakan yaitu: 21 mg/kgBB, 42 mg/kgBB dan 84 mg/kgBB. Sandhiutami et al. (2015) melaporkan bahwa dosis efektif untuk menurunkan kadar MDA mencit yang diberi aktivitas fisik berlebihan selama 7 hari adalah 42 mg/kgBB.
Dosis ekstrak kulit buah rambutan yang digunakan dalam penelitian ini yaitu 3 mg/ekor/hari, 6 mg/ekor/hari dan 12 mg/ekor/hari.
2. Dosis vitamin C
Dosis vitamin C mengacu pada penelitian Sandhiutami et al. (2015). Penelitian tersebut melaporkan bahwa pemberian vitamin C 6,5 mg/kgBB mampu meningkatkan aktivitas SOD pada mencit yang diberi aktivitas fisik berlebihan selama 7 hari. Dosis per 200 gram tikus adalah sebagai berikut:
Dosis Vit C : 0,13 x 7 = 1 mg
3. Dosis rokok
Penentuan jumlah rokok yang digunakan dalam penelitian ini mengacu pada penelitian Adyttia et al. (2014). Pada penelitian tersebut menunjukkan bahwa pemberian rokok 3 batang/hari selama 14 hari pada tikus mampu meningkatkan kadar MDA tikus. Oleh sebab itu, pada penelitian ini jumlah rokok yang digunakan adalah 3 batang/hari selama 14 hari.
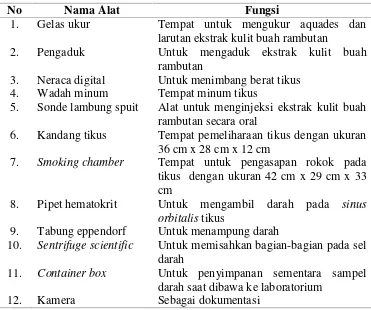
E. Alat dan Bahan Penelitian
Alat dan bahan yang digunakan dalam penelitian disajikan dalam Tabel 5 dan 6.
3. Neraca digital Untuk menimbang berat tikus
4. Wadah minum Tempat minum tikus
5. Sonde lambung spuit Alat untuk menginjeksi ekstrak kulit buah rambutan secara oral
6. Kandang tikus Tempat pemeliharaan tikus dengan ukuran 36 cm x 28 cm x 12 cm
7. Smoking chamber Tempat untuk pengasapan rokok pada
tikus dengan ukuran 42 cm x 29 cm x 33 cm
8. Pipet hematokrit Untuk mengambil darah pada sinus orbitalis tikus
9. Tabung eppendorf Untuk menampung darah
10. Sentrifuge scientific Untuk memisahkan bagian-bagian pada sel
darah
11. Container box Untuk penyimpanan sementara sampel
darah saat dibawa ke laboratorium
34
Tabel 6. Bahan penelitian
No Nama Bahan Fungsi
1. Ekstrak kulit buah rambutan
Bahan uji coba yang dilakukan
2. Asap rokok kretek Bahan uji coba sebagai radikal bebas 3. Akuades Pelarut ekstrak kulit buah rambutan
4. EDTA Untuk mencegah terjadinya koagulasi atau
penggumpalan darah 5. Tikus putih jantan Hewan uji coba
6. Asam pikrat Untuk menandai tikus
7. 8.
Kapas/tissue Etanol
Untuk membersihkan alat
Gambar 8. Alur penelitian Aklimatisasi selama 7 hari dengan pemberian pakan standar dan akuades
Perlakuan dilakukan selama 14 hari
Mengambil sampel darah pada hari ke 15
Mengukur kadar MDA dan SOD
Analisis data
36
F. Prosedur Penelitian
1. Pembuatan Ekstrak Kulit Buah Rambutan
Kulit buah rambutan yang digunakan dalam penelitian ini adalah kulit buah yang telah dipotong menjadi bagian kecil. Kulit buah kemudian dicuci menggunakan air mengalir dan dikeringkan di dalam ruangan selama 3-5 hari. Kulit yang sudah kering selanjutnya dihaluskan menggunakan blender hingga didapat serbuk kering. Metode ekstraksi yang digunakan dalam penelitian ini adalah metode maserasi. Serbuk kering diekstrasi menggunakan pelarut etanol 96% selama 24 jam pada suhu kamar dengan perbandingan 1:1. Suspensi yang diperoleh disaring menggunakan kertas Whatman No. 1. Filtrat yang terkumpul diuapkan menggunakan rotary evaporator hingga terbentuk pasta.
2. Pengukuran Aktivitas Antioksidan Menggunakan DPPH
Pengukuran diawali dengan pembuatan larutan DPPH. Sebanyak 1,97 mg DPPH dilarutkan dengan metanol dalam labu ukur sampai 100 ml, sehingga diperoleh larutan dengan konsentrasi 0,05 mM. Selanjutnya dilakukan pengukuran aktivitas antioksidan ekstrak kulit buah rambutan. Sebanyak 25 mg ekstrak kulit buah rambutan dilarutkan dengan metanol dalam labu ukur sampai 25 ml. Kemudian pada labu ukur sampel ditambahkan 5 ml larutan DPPH 0,5 mM. Larutan blanko dibuat dengan cara larutan DPPH 0,5 mM dipipet sebanyak 5 ml kemudian dimasukkan ke dalam labu ukur 25 ml lalu volumenya dicukupkan dengan metanol sampai garis tanda. Absorbansi DPPH diukur menggunakan spektrofotometer pada panjang gelombang 515 nm. Kemampuan antioksidan diukur sebagai penurunan serapan larutan DPPH akibat adanya penambahan sampel.
3. Perlakuan Hewan Percobaan
Penelitian ini diawali dengan mempersiapkan 30 ekor tikus putih galur Wistar yang diaklimatisasi selama 7 hari. Hewan percobaan dikelompokkan secara acak menjadi 6 kelompok masing-masing kelompok 5 ekor. Hewan ditempatkan pada kandang individual yang dibersihkan setiap hari. Tikus diberi pakan standar dan air minum secara ad libitum selama penelitian. Proses pemaparan dilakukan setiap pagi menggunakan 3 batang rokok dalam satu hari. Pemaparan dilakukan selama 14 hari. Pada saat akan diberi paparan asap rokok, hewan coba dipindahkan ke dalam kandang khusus yaitu smoking chamber sesuai kelompoknya. Kandang tersebut merupakan kotak pengasapan yang di dalamnya terdapat jeruji pembatas untuk memisahkan hewan coba dengan ujung rokok yang terbakar. Apabila hewan coba dimasukkan maka tikus dapat secara langsung terkena paparan asap rokok. Asap rokok dihembuskan berulang kali dengan bantuan tabung injeksi hingga rokok habis terbakar. Pemberian ekstrak kulit buah rambutan dilakukan satu jam setelah paparan asap rokok.
4. Pengambilan Darah
Pengambilan darah dilakukan pada hari ke 15 penelitian. Darah diambil dari sinus orbitalis dengan hematokrit sebanyak 3 ml dan ditampung dalam tabung eppendorf yang telah berisi EDTA. Sampel yang digunakan untuk pengukuran kadar MDA adalah plasma darah dan untuk pengukuran aktivitas SOD adalah whole blood. Darah yang terkumpul selanjutnya disentrifugasi dengan kecepatan 1000 rpm selama 10 menit pada suhu 4 0C. Plasma yang terbentuk dipindah ke dalam tabung baru dan disimpan pada suhu -80 0C sampai siap untuk dianalisis. Larutan penyangga yang terbentuk dihilangkan dari pelet eritrosit, kemudian eritrosit dilarutkan sebanyak 5X volumenya dengan menggunakan ddH2O. Eritrosit yang telah
38
5. Pengukuran Kadar MDA
Pemeriksaan kadar MDA menggunakan plasma darah. Prosedur pengukuran kadar MDA dapat dilihat pada Tabel 7.
Tabel 7. Prosedur pengukuran kadar MDA
Sampel Blanko
Sampel plasma 200 µl -
TCA 15% 2000 µl 2000 µl
TBA 0,37% dalam HCl 0,25 N 2000 µl 2000 µl
Campuran tersebut selanjutnya dipanaskan dalam waterbath pada suhu 950C selama 60 menit. Kemudian tabung diletakkan pada ice bath selama 15 menit. Sampel yang sudah dingin disentrifugasi dengan kecepatan 3000 rpm selama 15 menit. Supernatan yang terbentuk dipindahkan ke dalam kuvet kemudian dibaca absorbansinya menggunakan spektrofotometer pada panjang gelombang 545 nm.
Rumus penghitungan kadar MDA (nmol/ml) :
6. Pengukuran Aktivitas SOD
Pemeriksaan aktivitas SOD dilakukan menggunakan metode kalorimetri. Sampel yang digunakan dalam pengukuran ini adalah whole blood. Prosedur pengukuran aktivitas SOD dapat dilihat pada Tabel 8. Tabel 8. Prosedur pengukuran aktivitas SOD
Sampel Blanko 1 Blanko 2 Blanko 3
Semua larutan dihomogenkan dan diinkubasi pada suhu 370C selama 20 menit, selanjutnya dilakukan pengukuran absorbansi pada panjang gelombang 450 nm menggunakan microplate reader
Rumus penghitungan aktivitas SOD (%) :
( )
G. Analisis Data
40 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Penelitian
Hasil penelitian aktivitas antioksidan yang diuji menggunakan DPPH (1,1-difenil-2-pikrilhidrazil) dan dinyatakan sebagai % inhibisi, menunjukkan bahwa aktivitas antioksidan ekstrak kulit buah rambutan memiliki nilai sebesar 77,83% yang termasuk dalam kategori sedang. Hasil penelitian menunjukkan bahwa setiap kelompok memiliki variasi kadar MDA dan SOD. Berdasarkan uji normalitas diketahui bahwa data MDA dan SOD berdistribusi normal. Hasil uji one way anova menunjukkan ekstrak kulit buah rambutan berpengaruh terhadap kadar MDA dan SOD tikus yang dipapar asap rokok (Lampiran 2 & 3).
Hasil uji LSD (Tabel 9) menunjukkan bahwa pada kelompok A yaitu
kelompok normal memiliki kadar MDA terendah dan SOD tertinggi.
Kelompok normal digunakan sebagai kelompok kontrol untuk mengetahui
kadar MDA dan SOD pada keadaan normal tanpa pemberian ekstrak kulit
buah rambutan dan paparan asap rokok. Kadar MDA pada kelompok A
berbeda nyata dengan kelompok B, D, F dan tidak berbeda nyata dengan
kelompok C dan E. Aktivitas SOD kelompok A berbeda nyata dengan
kelompok lainnya (B, C, D, E dan F).
Tabel 9. Hasil rerata kadar MDA dan SOD
Kelompok Perlakuan Kadar MDA
(nmol/ml) menunjukkan perbedaan pada setiap kelompok perlakuan
Pada kelompok B yaitu kelompok kontrol negatif memiliki kadar
MDA sebesar 15,30 nmol/ml dan merupakan kelompok dengan kadar MDA
tertinggi. Kelompok B memiliki aktivitas SOD terendah, yaitu sebesar
29,45%. Kelompok B merupakan kelompok yang dipapar asap rokok 3
batang/hari. Kadar MDA dan aktivitas SOD pada kelompok B berbeda
nyata dengan semua kelompok lainnya (A, C, D, E dan F)
Pada kelompok E dan F merupakan kelompok yang diberi ekstrak
kulit buah rambutan dengan dosis 6 mg/200gBB dan 12 mg/200gBB .
Kadar MDA kelompok E berbeda nyata dengan kelompok B, D, F dan tidak
berbeda nyata dengan kelompok A dan C. Aktivitas SOD kelompok E
berbeda nyata dengan kelompok A, B, D, F dan tidak berbeda nyata dengan
kelompok C. Kadar MDA kelompok F berbeda nyata dengan kelompok A,
B, C, E dan tidak berbeda nyata dengan kelompok D. Aktivitas SOD
kelompok F berbeda nyata dengan kelompok lainnya.
B. Pembahasan
Hasil penelitian menunjukkan pemaparan asap rokok menyebabkan peningkatan kadar MDA. Pada kelompok kontrol negatif (kelompok B) memiliki kadar MDA tertinggi yang berbeda nyata dengan kelompok lainnya. Pada keadaan normal, radikal bebas terbentuk di dalam tubuh sangat lambat dan perlahan. Pada saat radikal bebas meningkat melebihi kemampuan pertahanan endogen, maka akan terjadi ketidakseimbangan antara jumlah radikal bebas dengan antioksidan endogen, sehingga terjadilah ketidakstabilan (stres) oksidatif. Stres oksidatif menyebabkan peroksidasi lipid yang berlebihan. Hasil dari peroksidasi lipid adalah MDA, sehingga meningkatnya peroksidasi lipid dapat menyebabkan kadar MDA dalam tubuh meningkat (Winarsi 2007).
42
organ lain kemungkinan adalah hasil pajanan secara tidak langsung (Yanbaeva et al. 2014).
Fase gas asap rokok terbukti menginisiasi autooksidasi in vitro dari PUFA sehingga terjadi peroksidasi lipid. Fase gas asap rokok dapat berisi hingga 1014 radikal bebas dan zat-zat reaktif per kepulan asap rokok. Radikal bebas dan oksidan yang terdapat pada fase gas asap rokok memiliki waktu paruh pendek, namun senyawa tersebut dapat memasuki aliran darah dan menyebabkan kerusakan oksidatif makromolekul (Swan & Lessov-Schlagger2007). Fase gas asap rokok juga mengandung aldehida jenuh dan tak jenuh yang lebih stabil daripada radikal bebas dan hidrogen peroksida. Senyawa tersebut dapat masuk ke dalam aliran darah menghasilkan ROS melalui interaksi dengan enzim NADPH. Akibatnya, jaringan yang jauh dari paru-paru juga dapat mengalami peningkatan stres oksidatif (Tostes et al. 2008).
Fase partikel asap rokok mengandung kompleks hidrokarbon yang akan bereaksi dengan nitrogen oksida (NO) dan membentuk senyawa radikal lain. NO yang terdapat pada asap rokok dapat menginisiasi PUFA dan mengakibatkan pembentukan peroksidasi lipid. Fase partikel asap rokok memiliki waktu paruh lebih lama daripada fase gas. Fase partikel mengandung ion logam yang dapat menghasilkan radikal hidroksil dari hidrogen peroksida. Radikal tersebut dapat menembus membran sel dan dapat menginduksi stres oksidatif (Pryor 1997). Radikal bebas akan mengikat molekul-molekul yang paling rentan pada membran sel seperti PUFA. Jembatan metilen pada PUFA merupakan sasaran utama radikal bebas yang akan membentuk radikal alkil, peroksil dan alkoksil (Allard et al. 1994).
turunan asam sinamat, kumarin, tokoferol dan asam-asam organik. Komponen senyawa fenolik bersifat polar dan memiliki kemampuan antioksidan melalui mekanisme sebagai pereduksi, penangkap radikal bebas, pengkelat logam, peredam terbentuknya singlet oksigen serta pendonor elektron (Winarsi 2007). Senyawa fenolik dapat larut dalam air. Penelitian Thitilerdecha et al. (2010) berhasil mengisolasi senyawa fenolik bentuk polifenol dalam kulit buah rambutan. Senyawa tersebut yaitu asam ellagat, corilagin dan geraniin yang berpotensi sebagai antioksidan.
Komponen fenolik merupakan terminator dari radikal bebas dan sebagai pengkelat ion logam redoks aktif. Ion logam tersebut memungkinkan peranannya untuk mengatalisasi reaksi peroksidasi lipid. Antioksidan fenolik menghalangi oksidasi lipid dan molekul lain dengan cara mendonasikan atom hidrogen ke senyawa radikal membentuk intermediet radikal fenoksil. Senyawa intermediet radikal fenoksil relatif stabil sehingga tidak mampu lagi menginisiasi reaksi radikal selanjutnya (Nzaramba 2008). Pada kelompok perlakuan ekstrak kulit buah rambutan didapatkan dosis efektif untuk menurunkan kadar MDA yaitu dosis 6 mg/200gBB (kelompok E).
Kadar MDA kelompok C 10,82±1,22 nmol/ml berbeda nyata dengan kelompok B (kontrol negatif) ), D dan F. Kelompok C merupakan kelompok kontrol positif. Penelitian tersebut menunjukkan bahwa vitamin C dapat mencegah proses peroksidasi lipid dengan mendonorkan elektron. Vitamin C memiliki sifat antioksidan yang dapat melindungi molekul yang dibutuhkan oleh tubuh (seperti protein, lipid, karbohidrat dan asam nukleat) dari kerusakan oleh radikal bebas (Winarsi 2007).
44
melaporkan bahwa kandungan senyawa tertinggi pada kulit buah rambutan adalah senyawa fenolik. Beberapa penelitian menunjukkan bahwa antioksidan fenolik juga memiliki aktivitas prooksidan dalam kondisi tertentu, seperti pada dosis tinggi, pH tinggi atau di hadapan ion logam (Decker 1997). Banyaknya konsentrasi antioksidan yang ditambahkan dapat berpengaruh pada laju oksidasi. Pada konsentrasi rendah, grup fenolik dapat menghambat atau mencegah pembentukan radikal bebas. Namun, pada konsentrasi tinggi aktivitas antioksidan grup fenolik sering lenyap bahkan antioksidan tersebut menjadi prooksidan (Bouayed & Bohn 2010). Oleh karena itu, diperlukan penelitian lebih lanjut mengenai dosis ekstrak kulit buah rambutan sehingga diketahui dosis yang efektif sebagai antioksidan dan prooksidan.
Enzim SOD adalah antioksidan enzimatis yang memegang peranan penting dalam melindungi sel dari stres oksidatif (Fridovich 1981). SOD mengatalisis reaksi dismutasi dari radikal anion superoksida menjadi hidrogen peroksida (H2O2). H2O2 akan diubah menjadi H2O oleh enzim
katalase dan glutation peroksidase (Lee et al. 2004). Kesempurnaan kerja sistem enzim antioksidan diperankan oleh tiga macam enzim tersebut (SOD, katalase, glutation peroksidase), namun antioksidan seluler tidak dapat bekerja secara individual tanpa dukungan asupan antioksidan sekunder dari bahan pangan. Oleh karena itu, diperlukan konsumsi bahan makanan yang kaya akan komponen antioksidan dengan jumlah memadai agar mampu memacu kerja enzim antioksidan dalam tubuh(Lampe 1999).
Pembentuk radikal bebas dari asap rokok terdapat dalam dua fase, yaitu fase gas yang berupa NO & nitrit peroksida (NO2) dan fase partikel
berupa quinine, semiquinone & hydroquinone (Trabel et al. 2000). Kedua fase pembentuk radikal bebas tersebut apabila bereaksi dengan logam transisi seperti Fe dan Cu akan menghasilkan radikal bebas O2· dan H2O2
Penurunan aktivitas SOD pada kelompok B menunjukkan bahwa pemaparan asap rokok mengakibatkan peningkatan radikal bebas pada tikus. Pada saat pemaparan asap rokok akan terbentuk radikal superoksida (O2·),
yaitu zat reaktif yang berbahaya bagi tubuh. Enzim SOD dapat menetralisir radikal tersebut dengan mengubah dua molekul O2· menjadi H2O2 dan O2.
Peningkatan O2· secara terus-menerus akan mengganggu aktivitas SOD
yang menyebabkan ketidakseimbangan antara oksidan dan antioksidan endogen (Fridovich 1981). Hal ini didukung oleh penelitian Muhammad (2009) yang menyatakan bahwa keadaan stres dapat meningkatkan jumlah radikal bebas. Kondisi tersebut akan menyebabkan penggunaan enzim SOD semakin banyak sehingga enzim SOD yang tersedia jumlahnya semakin berkurang.
Pada kondisi stres oksidatif, imbangan normal antara ROS dengan kemampuan antioksidan tubuh untuk mengeliminasinya mengalami gangguan sehingga menggoyahkan rantai reduksi-oksidasi normal. Akibatnya, terjadilah kerusakan jaringan (stres oksidatif). Kerusakan jaringan akibat radikal bebas tergantung pada beberapa faktor, antara lain target molekuler, tingkat stres yang terjadi, mekanisme yang terlibat serta waktu dan sifat alami dari sistem yang diserang (Winarsi 2007). Pada kelompok A (normal) mempunyai aktivitas SOD paling tinggi daripada kelompok lainnya. Hal ini disebabkan karena pada kelompok tersebut tidak mengalami perlakuan stres yang dapat memicu produksi radikal bebas, sehingga pemakaian enzim tersebut juga rendah (Muhammad 2009).
46
kulit buah rambutan mengandung komponen fenolik yang berfungsi sebagai antioksidan, sehingga pemakaian enzim SOD tidak terlalu tinggi.
Aktivitas antioksidan suatu bahan dipengaruhi oleh komponen di dalam bahan tersebut yang mampu menghambat terjadinya oksidasi. Fungsi antioksidan sebagai scavenger radikal bebas yaitu dengan memberikan atom hidrogen pada radikal (Winarsi 2007). Ekstrak kulit buah rambutan dilaporkan memiliki kandungan senyawa aktif yang terdiri atas senyawa alkaloid, flavonoid, steroid, terpenoid (Wardhani & Saptono 2015), saponin (Fila et al. 2012), antosianin (Hutapea et al. 2014), tanin (Thinkratok 2011) dan asam askorbat (Wall 2006). Kandungan senyawa kimia tertinggi pada ekstrak kulit buah rambutan adalah senyawa fenolik (Fila et al. 2012). Senyawa fenolik merupakan senyawa yang dicirikan oleh adanya cincin aromatik dengan satu atau dua gugus hidroksil (Harborne 1996). Senyawa fenolik yang terkandung pada ekstrak kulit buah rambutan terdiri atas senyawa alkaloid (Wardhani & Saptono 2015), flavonoid (Nurdin et al. 2013), antosianin dan tanin (Thitilerdecha et al. 2010).
SOD (Sumardika & Jawi 2012). Namun, dalam kondisi tertentu flavonoid dapat juga menampilkan aktivitas prooksidan dan hal tersebut berbanding lurus dengan jumlah total gugus hidroksil (Cao et al. 1997).
Tanin secara umum didefinisikan sebagai senyawa polifenol yang memiliki berat molekul cukup tinggi (lebih dari 1000) dan dapat membentuk kompleks dengan protein (Hernawan & Setyawan 2003). Tanin telah dianggap sebagai komponen "health-promoting" dalam makanan dan minuman yang berasal dari tanaman. Misalnya, tanin dilaporkan memiliki potensi antikanker, antimutagenik serta sifat antimikroba. Beberapa penelitian telah melaporkan tentang aktivitas antioksidan dan antiradikal tanin. Tanin tidak berfungsi hanya sebagai antioksidan primer (menyumbangkan atom hidrogen atau elektron), tanin juga berfungsi sebagai antioksidan sekunder. Tanin memiliki kemampuan untuk khelat ion logam seperti Fe (II) dan mengganggu salah satu langkah reaksi dalam reaksi Fenton. Disisi lain, tanin juga didefinisikan sebagai antinutrients yang berasal dari tumbuhan karena dapat memicu protein, menghambat enzim pencernaan, mengurangi pemanfaatan vitamin dan mineral (Karamac et al. 2006).
Metode penangkapan radikal menggunakan DPPH merupakan metode untuk pengujian antioksidan yang sederhana, cepat, mudah dan tidak membutuhkan banyak reagen. Metode ini terbukti akurat dan praktis. Pada metode ini, DPPH berperan sebagai radikal bebas yang akan diredam radikal bebasnya oleh antioksidan yang terdapat pada bahan uji. Bahan uji yang digunakan adalah ekstrak kulit buah rambutan kultivar Sekaran. Senyawa yang aktif sebagai antioksidan pada ekstrak kulit buah rambutan mereduksi radikal bebas DPPH (warna ungu) menjadi difenil pikril hidrazin, sehingga warna ungu semakin memudar (Molyneux 2004).
48
BAB V
SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil dan pembahasan yang telah dijabarkan, simpulan dari penelitian ini adalah:
Pemberian ekstrak kulit buah rambutan dosis 6 mg/200 gBB mampu menurunkan kadar MDA dan meningkatkan aktivitas SOD pada tikus yang dipapar asap rokok.
B. Saran