STRUKTUR POPULASI SEMUT INVASIF Anoplolepis gracilipes Smith
(HYMENOPTERA:FORMICIDAE) DI KEBUN RAYA BOGOR
RION APRIYADI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Struktur Populasi Semut Invasif Anoplolepis gracilipes Smith (Hymenoptera:Formicidae) di Kebun Raya Bogor adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
Rion Apriyadi
RINGKASAN
RION APRIYADI. Struktur Populasi Semut Invasif Anoplolepis gracilipes Smith (Hymenoptera:Formicidae) di Kebun Raya Bogor. Dibimbing oleh DAMAYANTI BUCHORI, IDHAM SAKTI HARAHAP dan AKHMAD RIZALI.
Invasi habitat oleh Anoplolepis gracilipes (yellow crazy ant) berdampak negatif pada keseluruhan ekosistem dan interaksi yang terjadi didalamnya. Keberadaan spesies semut ini menyebabkan terganggunya keseimbangan pada habitat yang dimasukinya dan seringkali menyebabkan tersingkirnya spesies lain penghuni habitat tersebut. Situasi ini menunjukkan pentingnya untuk mengetahui dan mempelajari struktur populasi dan perilaku A. gracilipes yang terdapat pada suatu ekosistem. Penelitian ini bertujuan untuk mempelajari struktur populasi semut invasif A. gracilipes di Kebun Raya Bogor. Agresi diamati dengan parameter indeks agresi, indeks mortalitas, dan aggression latency. Waktu penemuan makanan ditentukan dengan mengukur waktu yang diperlukan oleh A. gracilipes untuk menemukan makanan pada plat umpan madu pada jarak 20 meter dari sarang. Struktur populasi diamati dengan melakukan analisis DNA, yaitu dengan menggunakan 6 penanda mikrosatelit. Sampel dikumpulkan dari 5 koloni yang ditentukan berdasarkan data pola spasial A. gracilipes.
Hasil penelitian menunjukkan bahwa A. gracilipes menempati sekitar 25% dari area Kebun Raya Bogor dan populasi terpisah ke dalam 5 koloni potensial berdasarkan posisi keberadaan sarang. Agresi antara koloni menunjukkan ada perbedaan signifikan pada indeks agresi, indeks mortalitas dan aggression latency.
A. gracilipes membutuhkan waktu kurang dari 1 jam untuk menemukan makanan di sekitar sarang. Total 18 alel ditemukan pada seluruh populasi sampel A. gracilipes di Kebun Raya Bogor (200 individu dari 5 koloni potensial). AMOVA pada tiga level populasi menunjukkan adanya kelebihan heterozigot yang besar pada tingkat intrakoloni. Diferensiasi genetik yang rendah ditemukan pada level sarang dalam koloni dan koloni dalam total populasi. Hubungan antar koloni A. gracilipes di Kebun Raya Bogor menunjukkan adanya jarak genetik (FST) yang dekat.
Analisis struktur populasi menggunakan perangkat lunak STRUCTURE menunjukkan bahwa nilai logaritma kemiripan data genetik [LnP(D)] tertinggi pada K = 2 (K adalah asumsi jumlah subgrup). Pengelompokan individu ke dalam subgrup/koloni berdasarkan penanda mikrosatelit menunjukkan bahwa masing-masing koloni potensial tidak dapat dikelompokkan ke dalam kelompok genetik spesifik. Ada kemungkinan bahwa koloni potensial A. gracilipes yang ditemukan di Kebun Raya Bogor merupakan koloni baru yang berasal dari koloni induk yang sama dan mulai memisahkan diri menjadi koloni independen. Hal ini dapat terlihat pada hasil uji perilaku agresif yang menunjukkan adanya interaksi agresif pada beberapa koloni potensial yang ditemukan dengan skor yang cukup tinggi namun secara genetik hampir mirip satu sama lain.
SUMMARY
RION APRIYADI. Population Structure of Invasive Ant Anoplolepis gracilipes
Smith (Hymenoptera:Formicidae) in Bogor Botanical Garden. Supervised by DAMAYANTI BUCHORI, IDHAM SAKTI HARAHAP and AKHMAD RIZALI.
Anoplolepis gracilipes or commonly known as yellow crazy ant is widely distributed due to its invasiveness. The species easily becomes established and dominate even in a new habitat. The existence of this ant species can disrupt the balance of the communities in a particular habitat due to its ability to outcompete its competitors. Therefore, it is very important to know and study the population structure and behaviour of A. gracilipes in a given habitat. The aim of this research was to investigate the population structure of the invasive ant A. gracilipes in Bogor Botanical Garden. The aggression was observed using several parameters, i.e. aggression index, mortality index, and aggression latency. Food finding time was determined using honey bait plate in 20 m from the nest. The population structure was observed by DNA analysis using 6 microsatellite markers. Samples were collected from 5 colonies determined by spatial patterns of
A. gracilipes.
Result showed that A. gracilipes occupy around 25% of Bogor Botanical Garden area and the population was separated in 5 potential colonies based on the nest positions. Aggression between colonies showed there were significantly differences in aggression index, mortality index and aggression latency although in some potential colonies showed tolerance behavior. A. gracilipes needed less than 1 hour to find the food on surrounding nests. We found a total of 18 alleles in the entire population in Bogor Botanical Garden. Three level AMOVA showed there were high excess heterozygosity in intracolony level. Low genetic differentiation was found among nests within colony and among colonies within total population. We found close genetic distance (FST) among colonies of A.
gracilipes in Bogor Botanical Garden.
Population structure analysis using STRUCTURE showed the highest value in logarithm of the genetic data likelihood [LnP(D)] in K =2, (K is the assumed number of subgroup). Clustering the individuals into subgroup/colony based on microsatellite markers showed each potential colony can not be clustered into a specific cluster. There was a possibility that some of the potential colonies were found in Bogor Botanical Garden were newly formed colonies. Those colonies came from the same ancestor colony and began to separate themselves into independent colonies. This condition could be seen in some behavioral tests which showed that there were aggressive interactions between some potential colonies which had high score of aggression but genetically they were almost similar one each other.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
STRUKTUR POPULASI SEMUT INVASIF Anoplolepis gracilipes Smith
(HYMENOPTERA:FORMICIDAE) DI KEBUN RAYA BOGOR
RION APRIYADI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Struktur Populasi Semut Invasif Anoplolepis gracilipes Smith (Hymenoptera:Formicidae) di Kebun Raya Bogor
Nama : Rion Apriyadi NIM : A351120041
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Damayanti Buchori, MSc Ketua
Dr Ir Idham S Harahap, MSi Dr Akhmad Rizali, SP, MSi Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Entomologi
Dr Ir Pudjianto, MSi Dr Ir Dahrul Syah, MScAgr
10
PRAKATA
Alhamdulillahi robbil alamin, Puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan karunia dan hidayah-Nya sehingga penulis dapat menyelesaikan tesis yang berjudul “Struktur Populasi Semut Invasif
Anoplolepis gracilipes Smith (Hymenoptera:Formicidae) di Kebun Raya Bogor” sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Entomologi, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian ini telah dilaksanakan di Kebun Raya Bogor, Kampus IPB Dramaga dan Georg-August-Universität Göttingen pada bulan Juli 2013 hingga Juni 2014.
Penulis menghaturkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Prof. Dr. Ir. Damayanti Buchori, M.Sc, Bapak Dr. Ir. Idham Sakti Harahap, M.Si dan Bapak Dr. Akhmad Rizali, M.Si selaku komisi pembimbing yang telah memberikan banyak masukan, pelajaran, saran dan motivasi kepada penulis dalam menyusun tesis ini.
2. Dr. Jochen Drescher selaku field advisor atas segala masukan, pelatihan dan bimbingan teknis yang telah diberikan selama berlangsungnya penelitian dan penulisan tesis ini.
3. Ibunda Jumarni dan Ayahanda Ahmad Badaruddin atas segala nasihat, pelajaran hidup dan doa yang telah menghantarkan penulis untuk berada pada titik ini.
4. Istri Tercinta Tri Wenti, S.E atas segala dorongan semangat dan motivasi yang telah diberikan.
5. Adinda Ria Gusti Handayani atas segala dorongan semangat dan bantuan yang telah diberikan.
6. Prof. Stefan Scheu (CRC 990) yang telah memberikan ijin dan dukungan penelitian di Departement of Animal Zoology, Georg-August-Universität Göttingen, Jerman.
7. Pengelola Kebun Raya Bogor yang telah memberikan ijin dan bantuan teknis dalam menyelesaikan pengamatan lapangan.
8. Rekan – rekan mahasiswa Program Studi Entomologi angkatan 2012.
9. Rekan – rekan Laboratorium Pengendalian Hayati, Mbak Adha Sari, S.P dan Mbak Nita atas segala bantuan yang telah diberikan.
10.Partner lapangan Deni Pratama S.P atas kesediaannya mendampingi penulis selama pengamatan lapangan.
Semoga hasil penelitian ini bermanfaat dan menambah wawasan bagi kita semua.
Bogor, Oktober 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Hipotesis 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 4
Struktur Populasi 4
Spesies Invasif 5
Semut A.gracilipes 6
Taksonomi A. gracilipes 6
Reproduksi dan Dispersal 7
Makanan 8
Asal dan Persebarannya 8
Habitat 9
Ekosistem Kebun Raya Bogor 9
METODE PENELITIAN 11
Waktu dan Tempat 11
Bahan dan Alat 11
Prosedur Penelitian 11
Pemetaan dan Penentuan Posisi Koloni 11
Uji Perilaku/Aggression test 12
Uji Perilaku Penemuan Makanan 13
Analisis DNA 13
Analisis Data 15
HASIL 16
Koloni dan Sebaran Habitat A. gracilipes 16
Agresi Intraspesifik 19
Indeks Agresi 19
Indeks Mortalitas 20
Aggression Latency 21
Karakteristik Penemuan Makanan 23
Jarak Genetik (FST) pada Koloni Potensial A. gracilipes 27 Korelasi Antara Agresi dan Jarak Genetik (FST) 28 Struktur Populasi A. gracilipes di Kebun Raya Bogor 29
SIMPULAN 32
DAFTAR PUSTAKA 33
DAFTAR TABEL
1. Sekuens dan suhu annealing primer pada masing-masing lokus
mikrosatelit target (Felhaar et al. 2006) 14
2. Keragaman genetik A. gracilipes di Kebun Raya Bogor 25 3. Diferensiasi populasi yang diestimasi menggunakan 5 lokus
mikrosatelit dalam tiga level AMOVA 27
4. Nilai jarak genetik (FST) pada 5 koloni potensial menggunakan 1000
kali permutasi 28
5. Koefisien korelasi antara indeks agresi, indeks mortalitas, Tbite, Tdead
dan jarak genetik (FST) pada 5 koloni potensial A. gracilipes di Kebun
Raya Bogor 29
DAFTAR GAMBAR
1. Ciri-ciri morfologi umum A. gracilipes (Wilson & Taylor 1967) 7 2. Posisi peletakan umpan pada wilayah Kebun Raya Bogor 11 3. Sarang buatan dalam koleksi A. gracilipes sebagai spesimen uji agresi 12
4. Plat umpan madu 16
5. Posisi peletakan umpan pada wilayah Kebun Raya Bogor 16 6. Keberadaan semut A. gracilipes pada wilayah Kebun Raya Bogor 17 7. Persentase keberadaan A. gracilipes di Kebun Raya Bogor 17 8. Koloni potensial A. gracilipes yang ditemukan di Kebun Raya Bogor 18 9. Peralatan dan setup Uji Agresi (A), Interaksi yang terjadi antar semut
pekerja pada berbagai sarang yang berbeda (B) 19 10.Indeks spesimen uji pada berbagai kombinasi koloni potensial (nilai
tengah ± standar error; P <0.01) 20
11.Indeks Mortalitas spesimen uji pada berbagai kombinasi koloni
potensial (rata-rata ± standar error; P <0.01) 21 12.Aggression Latency (Rata-rata ± Standar Error; P<0.01) pada koloni
potensial A. gracilipes di Kebun Raya Bogor. (tbite: waktu yang
diperlukan untuk melakukan agresi/serangan pertama; tdead: waktu
yang diperlukan untuk membunuh semut kompetitor pada pengujian) 22 13.Waktu penemuan makanan pada koloni potensial A. gracilipes di
Kebun Raya Bogor 23
14.Pola tingkah laku A. gracilipes dalam menemukan makanan tanpa
14
16.Rata-rata logaritma kemiripan data (likelihood) [LnP(D)] dengan nilai K = 1 sampai 5. Garis vertikal menunjukkan nilai standar deviasi.
Analisis dilakukan dengan menggunakan 1000 kali pengulangan 29 17.Pengelompokan individu A. gracilipes di Kebun Raya Bogor ke
dalam kelompok genetik menggunakan nilai asumsi subgroup (K) 1 –
2
PENDAHULUAN
Latar Belakang
Tiap-tiap populasi suatu spesies memiliki interaksi yang kompleks dan karakteristik yang berbeda dengan spesies lain. Beberapa spesies organisme seperti serangga dapat membentuk kelompok kecil di dalam sebuah populasi yang dikenal sebagai subpopulasi. Berbeda dengan serangga soliter, serangga-serangga sosial seperti semut memiliki populasi dengan karakteristik unik yaitu adanya unit-unit koloni di dalam populasi. Pada beberapa spesies semut, koloni yang terbentuk terbagi ke dalam sarang-sarang yang terpisah satu sama lain sehingga terdapat tingkatan tertentu dalam suatu populasi (Steiner et al. 2007). Populasi yang terbagi ke dalam beberapa kelas tertentu dan terjadi interaksi didalamnya dikatakan sebagai populasi yang terstruktur (Briggs et al. 2010). Populasi yang terstruktur dapat mengalami perubahan tergantung pada kondisi subpopulasi atau koloni didalamnya. Perubahan dalam populasi yang terstruktur dapat diprediksi dari kondisi kolektif individu melalui model struktur populasi (Ellner & Guckenheimer 2006). Model struktur populasi diketahui telah secara luas digunakan dalam 30 tahun terakhir untuk menggambarkan dinamika suatu populasi (Ellner & Guckenheimer 2006). Struktur populasi dapat digambarkan ketika sebuah populasi mengalami penyimpangan dari proporsi keseimbangan Hardy-Weinberg yang disebabkan oleh berbagai faktor diantaranya adalah perkawinan tak acak, seleksi, dan mutasi (Ewens 2004). Struktur populasi sangat penting untuk melihat laju evolusi dan hubungan aliran gen antar populasi (Hartl 2007). Saat ini model struktur populasi telah banyak digunakan dalam berbagai fokus penelitian diantaranya adalah penelitian mengenai struktur populasi spesies invasif.
Keberadaan spesies invasif dalam suatu ekosistem memberikan dampak nyata terhadap perubahan kondisi lingkungan (Lockwood et al. 2007). Ketika spesies invasif masuk ke dalam habitat baru, daya rusaknya yang tinggi sering menyebabkan kehancuran habitat karena terjadinya monopolisasi lingkungan (Lockwood et al. 2007). Spesies invasif umumnya memiliki kemampuan distribusi dan migrasi yang cepat dan luas (Elton 2000). Spesies invasif pada golongan hewan sebagian besar berasal dari kelas insekta (serangga). Serangga memiliki kemampuan dispersal yang luas dan reproduksi yang cepat sehingga mendukung terjadinya invasi. Salah satu spesies serangga invasif yang memiliki persebaran yang cukup luas adalah semut (Lowe et al. 2000). Spesies semut invasif yang telah diketahui dan memiliki dampak invasi yang cukup luas yaitu
Anoplolepis gracilipes (Hymenoptera:Formicidae).
A. gracilipes dikenal dengan nama umum “Yellow Crazy Ant”. Spesies ini
2
terlibat dalam perkelahian mematikan (Drescher et al. 2011). Spesies ini memiliki
koloni dengan beberapa ratu dan membentuk struktur koloni besar yang dikenal dengan nama “Superkoloni” (Stewart et al. 2010). Kehadiran superkoloni ini secara tidak langsung telah memonopoli berbagai sumberdaya kehidupan pada sebuah lingkungan tertentu. Monopolisasi sumberdaya yang dilakukan oleh A. gracilipes mampu menekan populasi spesies lain pada suatu habitat. Selain itu, semut ini unggul dalam dominasi jumlah karena memiliki populasi yang berukuran cukup besar. Populasi yang berukuran besar dapat menekan pertumbuhan populasi lokal yang berukuran kecil sehingga menuju ke arah hilangnya spesies lokal pada suatu wilayah (Bahagiawati et al. 2010). A. gracilipes memiliki populasi terstruktur yang unik dimana individu membentuk kelompok pada masing-masing sarang, sarang-sarang secara kolektif yang dipimpin oleh beberapa ratu membentuk suatu koloni. Beberapa koloni membentuk sebuah superkoloni yang lebih besar melalui kerjasama antar sarang dan membentuk populasi unikolonial (Steiner et al. 2007). Adanya karateristik unik dalam populasi A. gracilipes menjadi sangat menarik untuk diteliti sebagai upaya mempelajari struktur populasi dan dinamika yang terjadi didalamnya. Karakter genetik pada A. gracilipes dapat dijadikan sebagai dasar dalam mempelajari struktur populasi semut ini. Karakter tersebut dapat diketahui melalui analisis genetik menggunakan marka molekuler.
Analisis struktur populasi menggunakan marka/penanda genetika molekuler merupakan teknik mutakhir untuk mengetahui dinamika populasi pada tingkat genetik. Salah satu penanda genetik yang sering digunakan adalah penanda mikrosatelit. Mikrosatelit telah banyak digunakan oleh para entomologis dalam mempelajari struktur dan dinamika populasi (Macdonald & Loxdale 2004). Penanda mikrosatelit lokus tunggal kodominan dapat mengungkapkan tingkat polimorfisme genetik yang terjadi pada suatu populasi (Goldstein and Schlӧtterer 1999). Mikrosatelit dapat divisualisasikan dengan menggunakan berbagai metode, salah satunya yaitu perunutan basa DNA (DNA sequencing). Urutan basa DNA dapat digunakan untuk melihat motif mikrosatelit pada lokus target dan mengukur indeks populasi struktural sehingga dapat dideteksi kemungkinan adanya aliran genetik pada suatu populasi (Hartl 2007).
Di Indonesia, informasi mengenai struktur populasi semut invasif A. gracilipes masih sangat terbatas. Kondisi ini menyebabkan perlunya penelitian mengenai struktur populasi A. gracilipes secara lebih mendalam. Penelitian ini merupakan salah satu upaya dalam mempelajari struktur populasi spesies invasif pada suatu habitat serta diharapkan dapat dijadikan sebagai referensi dalam menentukan langkah pengelolaan yang tepat di masa mendatang.
Tujuan
3
Hipotesis
1. Di Kebun Raya Bogor hanya terdapat satu koloni A. gracilipes.
2. Tidak ada perbedaan pada keragaman/variasi genetik antar koloni A. gracilipes yang terdapat di Kebun Raya Bogor.
Manfaat Penelitian
4
TINJAUAN PUSTAKA
Struktur populasi
Secara harfiah struktur populasi mengarah pada kepadatan suatu populasi, ukuran populasi, dinamika populasi, pertumbuhan populasi dan genetika populasi. Sebuah populasi dikatakan terstruktur jika didalamnya terdapat kelompok-kelompok individu yang saling berinteraksi satu sama lain didalamnya (Ellner &
Guckenheimer 2006). Struktur populasi secara genetik dapat diketahui dengan melihat distribusi dan perubahan frekuensi alel/gen dalam suatu populasi (Ewens 2004). Adanya perubahan frekuensi alel berhubungan erat dengan proporsi keseimbangan Hardy-Weinberg yang menyatakan bahwa frekuensi alel dan frekuensi genotip dalam suatu populasi akan tetap konstan, yakni berada dalam kesetimbangan dari satu generasi ke generasi lainnya kecuali apabila terdapat faktor-faktor tertentu yang mengganggu kesetimbangan tersebut (Guo & Thompson 1992). Faktor-faktor tersebut meliputi seleksi, perkawinan tak acak, mutasi, ukuran populasi terbatas/kecil, dan migrasi yang menyebabkan adanya perpindahan gen (Ewens 2004).
Seleksi. merupakan suatu keadaan dimana hanya sifat tertentu yang menjadikan suatu organisme menjadi lebih mampu dalam bertahan hidup dan bereproduksi. Genetika populasi menjelaskan istilah seleksi alam dengan mendefinisikan kebugaran sebagai kecenderungan atau probabilitas kelangsungan hidup dan reproduksi suatu populasi pada lingkungan tertentu. Seleksi alam diketahui bekerja pada tingkat fenotip atau karakteristik yang dapat diamati pada organisme, tetapi genetik merupakan dasar terbentuknya fenotip yang memberikan keuntungan pada reproduksi. Sehingga pada dasarnya genetik merupakan dasar awal yang menentukan karakteristik suatu populasi.
Perkawinan tak acak. Perkawinan pada umumnya terjadi tidak secara acak yaitu perkawinan yang terjadi antar individu dalam satu populasi yang sama. Hal ini dikarenakan adanya kemungkinan untuk bertemu dan berinteraksi yang lebih besar. Perkawinan yang terjadi secara tak acak menyebabkan pergeseran terhadap hukum keseimbangan Hardy-Weinberg dimana keturunan yang dihasilkan memiliki frekuensi genetik yang tidak konstan. Perkawinan sesama (inbreeding) merupakan salah satu bentuk perkawinan tidak acak yang terjadi pada suatu populasi. Inbreeding memberikan beberapa dampak negatif yang berpengaruh besar terhadap keseimbangan populasi. Dampak tersebut meliputi: Penurunan fertilitas reproduksi, meningkatkan resiko kelainan genetik, depresi pertumbuhan dan kehilangan kemampuan dispersal (Jiménez et al. 1994).
Mutasi. merupakan perubahan yang terjadi pada material genetik (DNA maupun RNA), baik pada taraf urutan gen (sekuens) yang disebut sebagai mutasi titik ataupun pada tingkat kromosom. Mutasi pada gen dapat mengarah pada munculnya alel baru dan menjadi dasar munculnya variasi-variasi baru pada spesies yang berujung kepada proses evolusi. Mutasi yang terjadi di alam biasanya memiliki frekuensi yang rendah, 1:10.000 individu. Mutasi di alam dapat terjadi akibat zat pembangkit mutasi (mutagen) dan radiasi.
5
populasi lainnya. Imigrasi atau emigrasi suatu populasi dapat bertanggung jawab terhadap perubahan frekuensi alel (proporsi anggota yang membawa varian gen tertentu). Terdapat sejumlah faktor-faktor yang memengaruhi aliran gen antara populasi-populasi yang berbeda. Salah satu faktor yang paling signifikan adalah mobilitas. Semakin besar mobilitas suatu individu, semakin besar potensi migrasi individu tersebut. Aliran gen antara dua populasi secara terus menerus dan konsisten juga dapat mengurangi variasi genetika antara dua kelompok.
Dalam perkembangannya, struktur populasi telah banyak digunakan dalam menggambarkan keadaan suatu populasi dan dinamikanya dalam suatu lingkungan (Ellner & Guckenheimer 2006). Struktur populasi dapat dijelaskan melalui analisis genetika populasi yang mempelajari perubahan susunan genetik di dalam suatu populasi. Salah satu indeks yang digunakan dalam mempelajari struktur populasi adalah indeks fiksasi (FST). Secara khusus, FST tidak mengukur identitas pada silsilah keturunan inbreeding (F), atau sistem inbreeding (f), atau dampak dari hanyut genetik pada rata-rata identitas keturunan hasil inbreeding.
Lebih tepatnya, FST mengukur rasio aliran gen yang hanyut dan bagaimana perbandingan ini berpengaruh terhadap struktur populasi dalam arti yang berorientasi pada proses (Templeton 2006). Nilai FST meningkat apabila ada variasi yang kecil di dalam subpopulasi dan terdapat diferensiasi genetik yang tinggi antar subpopulasi. Oleh karena itu, dalam hal definisi pola struktur populasi, FST mengukur proporsi variasi genetik di antara individu yang diambil dari semua populasi lokal yang disebabkan oleh perbedaan genetik. Hal ini merupakan salah satu langkah yang paling umum digunakan dalam mengukur struktur populasi dalam genetika evolusi.
Spesies Invasif
Spesies invasif dapat didefinisikan sebagai suatu spesies yang bukan spesies asli tempat tersebut (baik hewan ataupun tumbuhan), yang secara luas mempengaruhi habitat baru yang mereka invasi (Kolar & Lodge 2001). Menurut definisi USDA Forest Service (2003) spesies invasif merupakan spesies non-pribumi (introduksi) yang memiliki pengaruh terhadap suatu ekosistem dan menyebabkan kerugian secara ekonomi atau lingkungan atau berpotensi membahayakan kesehatan manusia. Beberapa ahli beranggapan bahwa spesies serangga tertentu yang dimasukkan ke dalam suatu wilayah oleh manusia secara sengaja disebut dengan spesies introduksi. Namun pendapat lain menyatakan bahwa spesies invasif lebih terdefinisi oleh sifat dan tingkah lakunya bukan oleh sumber introduksinya (Elton 2000) sehingga baik secara alami maupun oleh aktivitas manusia yang menyebabkan masuknya spesies baru yang bersifat invasif dikategorikan sebagai spesies invasif.
6
(Speight at al. 2006). Spesies baru yang masuk pada suatu wilayah tertentu akan mengoptimalkan setiap sumberdaya yang tersedia. Kemampuan spesies baru dalam memanfaatkan sumberdaya yang tidak mampu dijangkau atau dimanfaatkan oleh spesies asli akan menggeser populasi spesies asli menuju kepada pengurangan ukuran bahkan kepunahan (extinction) spesies asli tersebut (Lockwood et al. 2007). Sebagai contoh, spesies invasif Argentine ant (L. humile) secara nyata mampu menekan pertumbuhan populasi spesies semut lokal di California (Sanders et al. 2001).
Spesies invasif secara nyata telah mengubah komposisi populasi dalam suatu komunitas bahkan ekosistem tertentu. Keberadaan spesies baru yang lebih kompetitif dan lebih superior terhadap spesies lain semakin memberikan daya dukung yang besar bagi perkembangbiakan dan persebarannya (Mooney & Hobbs 2000). Daya dukung lingkungan yang tinggi dan disertai dengan kemampuan eksploitasi sumberdaya yang efisien menjadi dasar utama munculnya spesies asing yang bersifat invasif pada ekosistem di suatu wilayah tertentu.
Semut A. gracilipes
Taksonomi A. gracilipes
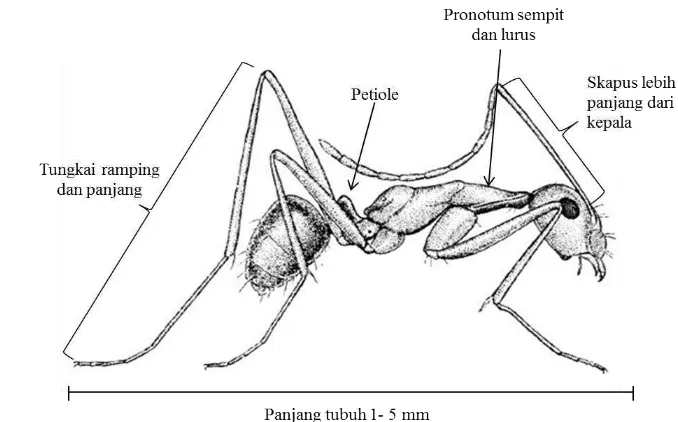
A. gracilipes Smith (Formica gracilipes Smith) atau dulunya dikenal dengan A. longipes Jerdon merupakan serangga yang berasal dari ordo Hymenoptera, famili Formicidae dan subfamili Formicinae (Harris & Berry 2010). Subfamili formicinae merupakan salah satu subfamili semut yang memiliki persebaran yang cukup luas. Subfamili ini memiliki ciri-ciri mempunyai satu buah
petiole dengan ruas antenna berjumlah 8 – 12. Subfamili formicinae memiliki ujung gaster dengan bentuk acidopore semisirkuler dan sirkuler yang terbentuk dari hypopygium, bentuk ini sering digambarkan sebagai nozzle (mulut pipa) (Bolton 1994). Karakter ini merupakan karakter mayor yang membedakan subfamili formicinae dengan subfamili lainnya. Terkadang diketahui pula
acidopore tersembunyi oleh tonjolan pygydium (Bolton 1994).
Smith (1857) mendeskripsikan karakter morfologi A. gracilipes kasta pekerja yaitu memiliki kepala berbentuk oval dan lebih lebar dari thoraks serta menyempit pada bagian belakang. Memiliki mata majemuk berwarna hitam dan menonjol. Protoraks menyempit membentuk leher yang ramping. Tungkai berukuran sangat panjang dengan tungkai pertama dan ketiga lebih panjang dari panjang tubuh total (kepala, thoraks, abdomen) (Gambar 1). A. gracilipes
memiliki panjang tubuh sekitar 1-5 mm (Holway et al. 2002). A. gracilipes
memiliki antenna yang panjang dengan panjang skapus 1.5 kali lebih panjang dari panjang kepala (Csurhes & Hankamer 2012). Pada umumnya jumlah segmen antenna mulai dari scapus, pedicel hingga flagellum berjumlah 11 ruas. Mesosoma memiliki bentuk ramping dan tidak memiliki seta/rambut-rambut pada bagian punggung. Pada bagian propodeum tidak memiliki seta-seta atau duri. Bagian mandibel masing-masing memiliki setidaknya delapan gerigi dan klipeus berbentuk cembung (Abbott et al. 2005).
7
mengungkapkan bahwa berdasarkan analisis genetik diketahui adanya dua haplotype A. gracilipes (Tipe A dan Tipe D). Haplotype D lebih agresif, invasif dan mampu menggantikan proporsi yang lebih tinggi daripada spesies semut lainnya. Hal ini diketahui bahwa 50 persen spesies semut lebih sedikit ditemukan di pulau-pulau yang diinvasi oleh A. gracilipes haplotype D.
Gambar 1 Ciri-ciri morfologi umum A. gracilipes (Wilson & Taylor 1967)
Reproduksi dan Dispersal
Banyak spesies semut membangun koloni dengan ratu tunggal. A. gracilipes memiliki karateristik unik yaitu membangun superkoloni dengan beberapa ratu, dan diketahui dapat membangun superkoloni hingga 300 ratu didalamnya. Pada beberapa sarang diantaranya memiliki ukuran terbesar dari setiap spesies semut di dunia, dan dapat meluas hingga lebih dari 150 hektar. Kepadatan A. gracilipes dapat mencapai hingga 20 juta semut per hektar yang telah tercatat di Christmas Island (Abbott et al. 2005: Lowe et al. 2000) dan sekitar 5 juta per hektar di Seychelles (Haines & Haines 1978). Superkoloni yang terbentuk bergantung pada tingkat agresi dan kerjasama antara sarang.
Semut pekerja memiliki siklus hidup 76-84 hari (Csurhes & Hankamer 2012) sedangkan ratu dapat bertahan hidup selama beberapa tahun (Walsh & Walters 2010). Semut pekerja diproduksi sepanjang tahun, tetapi dengan jumlah produksi yang berfluktuasi. A. gracilipes yang muncul mungkin mampu berkembang biak melalui perkawinan saudara (Intranidal mating) tanpa menderita depresi inbreeding sebagai heterozigositas tinggi yang dipertahankan pada pekerja (Drescher et al 2007; Thomas et al 2009). Keturunan seksual diproduksi setiap tahun tetapi pada umumnya 1-2 bulan sebelum musim hujan (Abbott et al. 2005). Koloni berkembang dengan menggunakan proses yang dikenal sebagai “budding”, yaitu satu atau beberapa ratu meninggalkan sarang secara bersama-sama dengan beberapa pekerja untuk membentuk koloni baru (Csurhes & Hankamer 2012).
8
gracilipes diketahui memiliki ketergantungan pada manusia sebagai mediator dalam penyebaran untuk membentuk koloni yang lebih jauh. Persebaran melalui aktivitas manusia seperti pertambangan, perdagangan antar wilayah bahkan melalui barang bawaan menjadi salah satu media persebaran A. gracilipes menuju wilayah lain (Csurhes & Hankamer 2012). Perkembangan koloni A. gracilipes
cukup luas di wilayah tropis (Wetterer 2005). Selain itu, Perkembangan koloni yang dilaporkan telah menyebar 37-402 m per tahun di Seychelles (Holway et al.
2002) dan 1100 m per tahun di Pulau Christmas atau jika dikalkulasikan setara dengan penyebaran rata-rata 3 m per hari (O'Dowd et al. 1999).
Makanan
A. gracilipes memiliki kisaran makanan yang luas, bersifat oportunistik yang merupakan sifat umum yang dimiliki oleh kebanyakan spesies semut invasif (GISD 2009). Spesies ini mampu memanfaatkan setiap sumberdaya yang berpotensi menjadi makanan yang tersedia di alam dan mampu menjelajah daerah yang luas untuk mendapatkan makanan. Makanan kaya protein yang diperlukan untuk reproduksi ratu (O'Dowd et al. 1999) sedangkan karbohidrat diperlukan untuk pertumbuhan larva dan pekerja. Selain itu, A. gracilipes juga sering ditemukan bersimbiosis dengan kutu-kutuan yang dapat memberikan embun madu sebagai sumber karbohidrat. Pasokan karbohidrat mungkin memainkan peran penting dalam keberhasilan invasi A. gracilipes (O'Dowd et al. 2003).
Vertebrata dan invertebrata lain merupakan mangsa yang berperan sebagai sumber makanan kaya protein. A. gracilipes dapat membunuh mangsa invertebrata, atau vertebrata kecil, dengan menyemprotkan asam format. Mekanisme penyemprotan asam format ini tidak membunuh target dengan sendirinya, tetapi dapat menyebabkan kebutaan dan menyebabkan kematian karena kelaparan (GISD 2009). Seperti banyak spesies semut lain, A. gracilipes
melemahkan hewan yang lebih besar seperti kepiting tanah, reptil kecil, mamalia kecil dan burung hanya jika jumlah semut yang menyerang sangat tinggi dan jika hewan yang diserang termasuk hewan yang rentan atau hewan-hewan yang berjalan di wilayah superkoloni (Csurhes & Hankamer 2012).
Asal dan Persebarannya
A. gracilipes diyakini berasal dari daerah afrika (Wetterer 2005). Drescher
9
Habitat
Iklim optimal bagi A. gracilipes adalah iklim tropis, namun beberapa populasi bertahan di iklim subtropis. Spesies ini melimpah di dataran rendah tropis di Asia, dan pulau-pulau di Samudera Hindia dan Samudera Pasifik. Perubahan iklim global diperkirakan akan meningkatkan berbagai kondisi lingkungan yang menguntungkan bagi A. gracilipes pada garis lintang yang lebih tinggi (Chen 2008). Habitat yang disukai meliputi daerah hutan di tepi sungai yang lembab dan hutan tropis dataran rendah (Abbott et al. 2005). Di Australia utara, A. gracilipes awalnya diyakini lebih memilih hutan hujan, tetapi penelitian baru-baru ini menegaskan mereka dapat berkembang pada daerah berkontur kasar, berbatu, dan daerah kering di Arnhem Land, Northern Territory (Csurhes & Hankamer 2012). Kehadiran akasia dan tanaman lainnya yang memasok karbohidrat yang berasal dari nektar bunga tampaknya menjadi pengaruh utama. Beberapa referensi menyatakan bahwa spesies ini dapat bertahan hidup di padang rumput (GISD 2009).
A. gracilipes biasanya menginvasi daerah yang lembab, ternaung, habitat terganggu seperti lahan pertanian, khususnya agroforestri. Curah hujan yang tinggi mungkin menjadi faktor penting yang menentukan distribusi, hal ini berkaitan dengan reproduksi induk yang bergantung pada awal musim hujan (Abbott et al. 2005). Sarang biasanya dibuat di dalam tanah, di celah dan retakan, di bawah serasah daun dan bagian bambu di lantai hutan (GISD 2009). Di Christmas Island, semut ini mudah mengambil alih liang kepiting merah dan juga bersarang di dasar rongga daun kelapa yang jatuh, A. gracilipes diketahui pula bersifat arboreal, bersarang di cekungan kanopi pohon dan tanaman epifit (O'Dowd et al. 1999).
Ekosistem Kebun Raya Bogor
Ekosistem sebagai unit ekologi yang merupakan ruang lingkup yang luas mengenai berbagai interaksi antara komponen biotik maupun abiotik didalamnya. Ekosistem dapat dikatakan juga sebagai suatu tatanan kesatuan secara utuh dan menyeluruh antara segenap unsur lingkungan hidup yang saling mempengaruhi. Ekosistem dalam ekologi tidak hanya melibatkan suatu sistem antara tingkah laku (behavior) dari faktor-faktor biotik dan non biotik, tetapi melibatkan berbagai sistem dalam aliran energi dan siklus materi (Begon et al. 2006). Dalam ekosistem, organisme dalam komunitas berkembang bersama-sama dengan lingkungan fisik sebagai suatu sistem. Organisme akan beradaptasi dengan lingkungan fisik baik secara langsung maupun tidak langsung (Campbell & Reece 2009).
10
11
METODE PENELITIAN
Waktu dan Tempat
Pengamatan lapangan dilakukan di Kebun Raya Bogor meliputi pemetaan posisi koloni menggunakan umpan madu dan eksplorasi sarang, koleksi spesimen uji, uji agresi dan uji penemuan sumberdaya serta koleksi sampel analisis genetik. Analisis DNA mikrosatelit meliputi kegiatan ekstraksi, Polymerase Chain Reaction (PCR), dan analisis fragmen mikrosatelit dilakukan di Departement of Animal Zoology, Georg-August-Universität Göttingen, Jerman. Penelitian ini dilaksanakan pada bulan Juli 2013 hingga bulan Juni 2014.
Bahan dan Alat
Bahan yang digunakan yaitu madu, alkohol 100%, botol koleksi, Fluon dan bahan analisis genetik seperti EDTA, primer spesifik, dan buffer. Alat yang digunakan meliputi GPS (global positioning system) Garmin 60CSx, kompas, plat umpan, pinset, arena bioassay, ember, handcounter, pipet dan molecular analysis tools.
Prosedur Penelitian Pemetaan dan Penentuan Posisi Koloni
Posisi koloni ditentukan dengan menandai setiap umpan madu yang digunakan menggunakan GPS. Umpan madu diletakkan pada setiap transek berukuran 50 x 50 m selama 2 jam pada pukul 09.00 hingga 11.00 WIB di seluruh wilayah Kebun Raya Bogor. Peletakan umpan madu dilakukan untuk mendeteksi ada atau tidaknya A. gracilipes (Gambar 2). Pengamatan dilanjutkan dengan observasi posisi sarang utama berdasarkan kepadatan aktivitas semut yang tercatat pada plat umpan. Sarang yang ditemukan dijadikan sebagai asumsi awal koloni A. gracilipes di Kebun Raya Bogor.
12
Uji perilaku (Aggression test)
Uji perilaku (uji agresi) dilakukan untuk mengidentifikasi batas-batas koloni. Uji agresi dilakukan dengan objek semut pekerja dari kelompok sarang yang terpisah untuk menentukan apakah mereka termasuk dalam koloni yang sama atau berbeda (Drescher et al. 2007; Drescher et al. 2010). Pengujian yang dilakukan berdasarkan rekomendasi Roulston et al. (2003), yaitu dengan mengamati interaksi yang terjadi antara pekerja dari superkoloni putatif pada arena pengujian yang terbuat dari plastik Polyethylene dengan tinggi 8 cm dan diameter 10 cm serta dilapisi dengan Fluon®TM untuk mencegah spesimen uji melarikan diri. Arena pengujian diberi alas kertas HVS dan diganti untuk setiap pengujian.
Semut dikumpulkan dengan terlebih dahulu meletakkan sarang buatan pada sarang alami yang telah diidentifikasi. Sarang buatan terbuat dari PVC dengan diameter 5 cm dan panjang 35cm (Gambar 3) dengan bagian dasar sarang diberi tutup untuk memudahkan pada saat pengumpulan semut. Setiap sarang alami yang ditemukan diletakkan 5 sarang buatan. Semut dikumpulkan dengan membuka tutup pada bagian dasar sarang buatan dan dimasukkan ke dalam ember yang telah dilapisi oleh Fluon®TM. Ember koleksi diberi kertas koran agar semut dapat bersarang selama proses pengujian. Semut hasil koleksi yang tidak digunakan dalam pengujian akan dikembalikan kembali ke sarang alaminya.
Gambar 3 Sarang buatan dalam koleksi A. gracilipes sebagai spesimen uji agresi
Agresivitas diamati dengan tiga indeks yaitu indeks agresi, indeks mortalitas dan aggression latency. indeks agresi (AI) diamati dengan meletakkan semut dari dua koloni yang berbeda ke dalam arena dengan rasio 5:5. Pengamatan dilakukan terhadap interaksi yang terjadi selama 5 menit peletakan spesimen uji. Pengujian menggunakan 10 ulangan untuk setiap kombinasi termasuk kontrol. Interaksi dinilai menggunakan skoring dengan menggunakan kriteria: (1) Tidak ada interaksi; (2) mengetukkan antenna; (3) menggigit satu sama lain; (4) menggigit dan menyemprotkan asam format.
13
menggunakan stopwatch. Pengamatan dilakukan terhadap jumlah semut yang mati setiap interval 5 menit selama 1 jam dan menggunakan 10 ulangan. Indeks mortalitas diperoleh dengan rumus MI = (y/2)/t50 (Drescher et al. 2007), dimana y adalah jumlah individu yang mati di akhir pengamatan (60 menit) dan t50 adalah waktu ketika setengah dari jumlah individu (y/2) telah dibunuh.
Aggression latency (AL) dilakukan dengan menggunakan rasio semut 5:1 untuk setiap kombinasi pengujian. Semut uji diletakkan secara bersamaan pada arena. Selanjutnya dilakukan penghitungan waktu yang diperlukan untuk melakukan serangan/agresi pertama (tbite) serta waktu yang diperlukan untuk
membunuh semut kompetitor (tdead) selama 10 menit. Masing-masing kombinasi
pengujian menggunakan 10 ulangan. Jumlah kombinasi pengujian ditentukan dari jumlah koloni potensial yang berhasil diidentifikasi melalui tahapan pemetaan dan penghitungan kepadatan semut pada tiap plat umpan.
Uji Perilaku Penemuan Makanan
Uji perilaku penemuan makanan meliputi waktu penemuan makanan dan pengamatan observatif terhadap perilaku semut pada plat umpan. Pengamatan waktu penemuan makanan dilakukan dengan meletakkan masing-masing 2 plat umpan madu pada jarak 20 meter dari lokasi sarang. Pengamatan dilakukan terhadap waktu yang diperlukan oleh A. gracilipes untuk menemukan umpan madu yang diletakkan dan dilakukan selama 60 menit untuk setiap umpan madu yang diberikan. Pengamatan observatif terhadap perilaku semut diamati dengan melihat perilaku semut pada saat menemukan makanan dan aktivitas yang terjadi pada plat umpan selama 20 menit.
Analisis DNA
Semut pekerja yang berasal 5 koloni awal dikoleksi sebagai sampel dengan menggunakan plat umpan. Masing-masing koloni diwakili oleh 5 titik sampel. Sebanyak 8 individu pada setiap titik sampel dikoleksi dan disimpan dalam Etanol 99,8%. Total individu yang digunakan berjumlah 200 individu sampel. Sampel kemudian ditransfer ke fasilitas laboratorium di Departement of Animal Zoology, Georg-August-Universität Göttingen - Jerman dan dilakukan analisis genetik DNA inti (mikrosatelit). Analisis mikrosatelit meliputi tahapan ekstraksi DNA,
Polymerase Chain Reaction (PCR), dan analisis produk PCR.
14
Setelah melalui inkubasi selanjutnya sampel didinginkan pada suhu ruangan dan ditambahkan larutan presipitasi protein yang berfungsi untuk memisahkan protein (termasuk DNA) dari sisa lisis sel. Sampel divorteks selama 20 detik agar larutan dan sampel tercampur dengan merata. Selanjutnya sampel didinginkan pada es selama 5 menit untuk mengoptimalkan proses presipitasi protein dan dilanjutkan dengan sentrifugasi selama 5 menit pada 16,000 rpm.
Presipitasi DNA dilakukan dengan mengambil supernatan yang terbentuk pada proses sebelumnya dan dipindahkan ke dalam tabung eppendorf baru yang telah berisi 100 μl Iso (2-) Propanol yang berfungsi sebagai presipitan DNA. Selanjutnya tabung eppendorf dibolak-balik sebanyak 50 kali dan disentrifugasi pada 16,000 rpm selama 20 menit. Supernatan yang terbentuk dibuang dengan hati-hati dan menyisakan lapisan pellet tipis pada dasar tabung reaksi. Pellet yang terbentuk dicuci dengan 100 μl ethanol 70% dan dibolak-balik sebanyak 30 kali serta dilanjutkan dengan sentrifugasi pada 16,000 rpm selama 3 menit. Supernatan dibuang dengan hati-hati untuk menjaga kuantitas DNA yang berhasil diekstraksi.
Pellet dikeringan pada suhu ruang selama 1 jam.
Tahapan selanjutnya yaitu rehidrasi DNA yang dilakukan dengan menambahkan larutan Hidrasi DNA pada pellet sebanyak 50 μl. Sampel DNA merupakan teknik perbanyakan DNA suatu organisme dengan menggunakan bantuan enzim polymerase dan parameter suhu bersiklus (Smith 2009). Tujuan dilakukannya PCR yaitu untuk meningkatkan kuantitas DNA hasil ekstraksi agar dapat digunakan pada rangkaian analisis DNA selanjutnya. PCR yang dilakukan pada penelitian ini menggunakan tujuh primer/lokus mikrosatelit polimorfik (Ano1, Ano3, Ano 5, Ano6, Ano8, Ano10) sesuai dengan metode Feldhaar et al.
(2006) (Tabel 1).
Tabel 1 Sekuens dan suhu annealing primer pada masing-masing lokus mikrosatelit target (Felhaar et al. 2006)
Lokus Sekuens Primer (5' - 3')
15
sebagai berikut: denaturasi awal selama 3 menit pada 94° C, diikuti dengan 30 siklus dengan tahapan denaturasi pada suhu 94° C selama 40 detik, annealing
pada suhu 45° C selama 40 detik, dan ekstensi pada suhu 72° C selama 40 detik, dan ekstensi akhir 3 menit pada 72° C (Feldhaar et al. 2006).
Analisis Produk PCR, Analisis produk PCR dilakukan dengan menggunakan teknik spektrometri massa yang diaplikasikan dalam ABI genetic Analyzer 3000. Spektrometri massa (MS) adalah teknik kimia analitik yang digunakan dalam mengidentifikasi jumlah dan jenis bahan kimia yang terdapat dalam sampel dengan mengukur rasio dan kelimpahan massa molekul terhadap muatan ion pada fase gas. Pada prinsipnya teknik yang digunakan yaitu matrix-assisted laser desorption/ionization (MALDI). Teknik ini memiliki 3 langkah utama yaitu (1) pencampuran sampel dengan bahan matriks yang sesuai dan diaplikasikan pada pelat logam; (2) Laser ditembakkan pada sampel yang memicu terjadi ablasi dan desorpsi sampel dan material matriks; (3) Molekul-molekul nukleotida yang terionisasi selanjutnya dideteksi berdasarkan massa molekul dan diakselerasikan dengan spektrometri massa yang digunakan. Penelitian ini menggunakan plat dengan jumlah 12 x 8 slot. Tiap slot berisi produk PCR yang dihasilkan dengan menggunakan masing-masing primer berlabel fluorescence dan bahan matriks. Plat selanjutnya ditransfer ke fasilitas laboratorium Genetika Georg-August-Universitat Gottingen untuk dianalisis. Hasil analisis berupa data fragmen mikrosatelit pada lokus yang ditargetkan. Setelah itu, ukuran masing-masing fragmen mikrosatelit akan digunakan untuk menghitung indeks struktur populasi seperti analysis of molecular variance (AMOVA) dan Indeks Fiksasi (FST)
Analisis Data
Data hasil pengujian agresi intraspesifik dianalisis menggunakan analysis of variance (ANOVA) Kruskal-Wallis pada tingkat kepercayaan 95% menggunakan perangkat lunak Statistica 6.0. Analisis diferensiasi genetik dan jarak genetik menggunakan 1000 kali permutasi dilakukan menggunakan perangkat lunak Arlequin 3.5. Analisis struktur populasi dilakukan dengan menggunakan analisis kemiripan genetik (likelihood) yang diaplikasikan dalam perangkat lunak Structure 2.3.4. Perhitungan proporsi keseimbangan Hardy-Weinberg dilakukan menggunakan perangkat lunak Genalex 6.0 dengan rumus umum:
Heterozigositas yang diamati (Ho)
Dimana n adalah jumlah individu dalam populasi, adalah alel individu pada lokus target.
Heterozigositas yang diharapkan (He)
16
HASIL DAN PEMBAHASAN
Koloni dan Sebaran Habitat A. gracilipes di Kebun Raya Bogor
Kebun Raya Bogor merupakan ekosistem dengan habitat campuran yang terdiri dari berbagai tipe habitat seperti hutan, rerumputan, sungai, dan habitat perkotaan disekitarnya. Kompleksitas ekosistem Kebun Raya Bogor dapat menjadi habitat bagi serangga seperti semut A. gracilipes. Hasil penelitian menunjukkan bahwa keberadaan semut A. gracilipes terpisah secara spasial pada wilayah Kebun Raya Bogor dan tersebar pada berbagai tipe habitat. Hal ini diketahui berdasarkan data semut A. gracilipes yang terperangkap oleh plat umpan madu yang diletakkan pada seluruh area penelitian (Gambar 4).
Gambar 4 Plat umpan madu
Sebanyak 298 plat umpan madu yang diletakkan pada seluruh area Kebun Raya Bogor (Gambar 5) untuk mendeteksi keberadaan A. gracilipes pada wilayah studi.
17
Keberadaan A. gracilipes tidak tersebar secara merata pada seluruh area, namun hanya berada pada beberapa spot atau wilayah tertentu (Gambar 6).
Gambar 6 Keberadaan semut A. gracilipes pada wilayah Kebun Raya Bogor.
Persentase keberadaan A. gracilipes pada ekosistem Kebun Raya Bogor berada pada kisaran 25% dari total area studi (Gambar 7). Hal ini menunjukkan bahwa hanya tempat-tempat dengan kriteria tertentu yang menjadi pilihan bagi A. gracilipes untuk membentuk sarang dan koloninya.
Gambar 7 Persentase keberadaan A. gracilipes di Kebun Raya Bogor
18
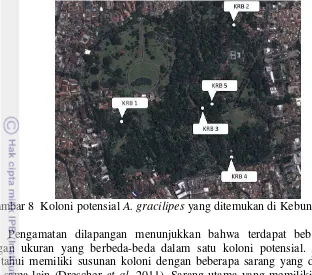
Gambar 8 Koloni potensial A. gracilipes yang ditemukan di Kebun Raya Bogor
Pengamatan dilapangan menunjukkan bahwa terdapat beberapa sarang dengan ukuran yang berbeda-beda dalam satu koloni potensial. A. gracilipes
diketahui memiliki susunan koloni dengan beberapa sarang yang dapat terpisah satu sama lain (Drescher et al. 2011). Sarang utama yang memiliki ukuran serta populasi yang lebih besar merupakan pusat koloni sedangkan sarang-sarang kecil di sekitarnya yaitu anak-anak koloni baru yang merupakan hasil penyebaran (budding) dari sarang utama (Csurhes & Hankamer 2012).
Observasi habitat di sekitar sarang utama dalam radius 50 meter menunjukkan bahwa A. gracilipes lebih sering dijumpai pada lingkungan yang lembab dan tidak terpapar oleh sinar matahari secara langsung seperti di bawah pohon, di bawah tumpukan daun kering, di dalam rongga akar dan batang tanaman bambu serta di bawah tumpukan sampah. Gruber et al. (2012) menemukan bahwa A. gracilipes tersebar secara meluas pada wilayah Arnhem Land, Australia dan menempati sarang yang bervariasi serta wilayah dengan kepadatan populasi yang beragam. Di Arnhem Land, A. gracilipes ditemukan pada daerah berkontur kasar, berbatu dan daerah kering (Csurhes & Hankamer 2012).
Keberadaan semut A. gracilipes pada area studi memiliki pola dan preferensi habitat yang hampir sama yaitu lebih banyak dijumpai pada habitat yang memiliki tanaman bambu. Tiga dari lima sarang yang ditentukan memiliki vegetasi utama tanaman bambu. Tanaman bambu digunakan oleh A. gracilipes
19
Agresi Intraspesifik
Agresi intraspesifik merupakan fenomena interaksi yang terjadi antara organisme dalam satu spesies yang sama. Hal serupa juga terjadi pada serangga-serangga sosial seperti semut A. gracilipes. Pengujian terhadap agresi intraspesifik ditujukan untuk mengetahui batas-batas antar koloni dari 5 sarang yang telah diidentifikasi sebelumnya. Uji agresi menjadi asumsi awal dalam menentukan jumlah koloni potensial A. gracilipes sesungguhnya yang terdapat dalam ekosistem Kebun Raya Bogor berdasarkan perilaku yang diamati.
Uji agresi dilakukan menggunakan pipa PVC berlapis Fluon sebagai “arena” pengujian dan dilengkapi dengan stopwatch pada masing-masing arena sebagai penunjuk waktu pada setiap ulangan yang di berlakukan (Gambar 9A). Interaksi yang terjadi pada masing-masing kombinasi sarang diamati berdasarkan jenis indeks yang telah ditetapkan. Gambar 9B menunjukkan interaksi yang terjadi pada semut pekerja yang berasal dari koloni potensial yang berbeda. Interaksi yang muncul dapat berupa serangan langsung pada semut lawan dengan cara menggigit dan menyemprotkan asam format. Selain itu interaksi lain yang terjadi yaitu berupa aktivitas mengetuk-ngetukkan antena antar satu sama lain sebagai cara mengenali anggota koloninya.
Gambar 9 Peralatan dan setup uji agresi (A), interaksi yang terjadi antar semut pekerja pada berbagai sarang yang berbeda (B)
Indeks Agresi
Indeks agresi merupakan tingkat agresi yang terjadi diantara spesimen uji yang dipaparkan dalam waktu dan rasio semut yang sama. Indeks ini diukur menggunakan skor yang merepresentasikan tingkat agresi atau tingkah laku yang terjadi pada spesimen uji. Hasil penelitian menunjukkan bahwa terdapat perbedaan pola tingkah laku/tingkat agresi yang terjadi pada berbagai kombinasi spesimen uji dari koloni potensial yang berbeda. Agresi dengan nilai 2.0 yang terjadi pada kombinasi koloni potensial yang sama menunjukkan bahwa tidak adanya aktivitas saling serang antara spesimen uji. Hal juga ini terjadi antara koloni potensial KRB 4 dengan KRB 5 serta KRB 3 dengan KRB 5. Kondisi ini mungkin mengindikasikan bahwa koloni potensial KRB 4 dan KRB 5 serta KRB 3 dan KRB 5 merupakan satu koloni yang sama. Namun agresi yang terjadi diantara koloni potensial KRB 3 dan KRB 4 dengan nilai 3.0 ± 0.14 terkategori ke dalam tipe agresif (Gambar 10).
20
Gambar 10 Indeks agresi spesimen uji pada berbagai kombinasi koloni potensial (nilai tengah ± standar error; P <0.01 [nilai pvalue Kruskal-Wallis pada keseluruhan hasil pengujian])
Hasil analisis menggunakan ANOVA Kruskal-Wallis menunjukkan bahwa terdapat beda nyata pada kombinasi koloni potensial yang diujikan. Agresi yang terjadi dengan nilai indeks diatas 3.0 dikategorikan termasuk ke dalam tipe agresif. Agresi koloni potensial KRB 1 terhadap KRB 2, KRB 4, dan KRB 5 menunjukkan bahwa KRB 1 memiliki tingkat agresi yang cukup tinggi terhadap hampir seluruh koloni potensial yang ditemukan di Kebun Raya Bogor. Agresi tertinggi terjadi antara KRB 2 dan KRB 5 dengan nilai indeks agresi 3.5 ± 0.16.
Indeks Mortalitas
21
Gambar 11 Indeks mortalitas spesimen uji pada berbagai kombinasi koloni potensial (rata-rata ± standar error; P <0.01 [nilai pvalue Kruskal-Wallis pada keseluruhan hasil pengujian])
Adanya fenomena ini mungkin disebabkan oleh KRB 3 dan KRB 4 merupakan koloni yang berasal dari penyebaran secara budding dari KRB 5. Koloni potensial KRB 3 dan KRB 4 mengenali koloni KRB 5 sebagai bagian dari koloni yang sama namun KRB 3 dan KRB 4 tidak mengenali satu sama lain sebagai anggota koloni yang sama.
Pola pengenalan antar anggota koloni semut didasari oleh susunan senyawa hidrokarbon pada kutikula yang dihasilkan oleh A. gracilipes (Suarez et al. 2002).
A. gracilipes mampu mengenali anggota koloninya melalui bau dan profil kutikula hidrokarbon yang dideteksi melalui organ basiconic sensilla yang terdapat pada antenna. Basiconic sensilla merupakan organ chemoreceptor yang digunakan oleh serangga dalam mendeteksi kondisi kimia pada lingkungan (Gullan & Cranston 2010). Tinggi rendahnya perilaku agresif sangat dipengaruhi oleh profil hidrokarbon pada kutikula (Vander Meer & Morel 1998). Selain itu, perilaku agresif juga dapat dipengaruhi oleh diet (Corin et al. 2007).
Aggression Latency
Aggression latency yang diamati bervariasi antar perlakuan kombinasi koloni potensial yang diujikan. Nilai tbite terkecil terdapat pada kombinasi uji
koloni potensial KRB 1 dan KRB 2 dengan nilai 51.45 ± 3.72 detik. Hal ini menunjukkan bahwa KRB 1 dan KRB 2 membutuhkan waktu yang sangat singkat untuk mengenali dan mulai menyerang antar satu sama lain. Sedangkan nilai tbite
22
Gambar 12 Aggression latency (Rata-rata ± Standar Error; P<0.01 [nilai pvalue Kruskal-Wallis pada keseluruhan hasil pengujian]) pada koloni potensial A. gracilipes di Kebun Raya Bogor (tbite: waktu yang
diperlukan untuk melakukan agresi/serangan pertama; tdead: waktu
yang diperlukan untuk membunuh semut kompetitor pada pengujian)
Nilai tdead 600 ± 0.0 menerangkan bahwa tidak ada semut uji yang mati
dalam interval waktu pengujian. Kombinasi uji antara koloni potensial KRB 1 dan KRB 2 menunjukkan bahwa agresi tersebut terjadi paling efektif yang diindikasikan melalui kemampuan membunuh spesimen uji (tdead) dalam waktu
yang paling singkat yaitu 570.25 ± 9.74. Hal ini menjelaskan bahwa agresi yang terjadi antara koloni KRB 1 dan KRB 2 tergolong ke dalam agresi yang cukup kuat.
23
Karakteristik Penemuan Makanan
Sumberdaya kehidupan terutama makanan merupakan faktor fundamental dalam siklus hidup suatu organisme, begitu pula pada semut invasif A. gracilipes.
A. gracilipes memiliki beberapa pola penemuan sumber makanan yaitu melalui eksplorasi dan simbiosis dengan organisme lain. Semut ini memiliki pola penemuan makanan yang unik dimana beberapa pekerja dalam jumlah sedikit mulai mengeksplorasi suatu wilayah untuk menemukan sumber makanan. Makanan yang ditemukan selanjutnya dieksploitasi dengan cara mengumpulkan pekerja dari koloni yang sama dan dalam jumlah yang lebih banyak. Hasil pengamatan menunjukkan bahwa aktivitas penemuan makanan ini dilakukan dengan waktu kurang dari 1 jam (Gambar 13). Kemampuan menemukan makanan yang cukup tinggi pada A. gracilipes menjadikan spesies ini dapat bertahan lebih lama pada suatu habitat. Dalam kondisi lingkungan yang mendukung, semut ini dapat memperluas daerah sebaran koloninya pada habitat baru. Persebaran koloni
A. gracilipes yang luas menyebabkan sumberdaya yang berada di dalam wilayah koloni dapat dengan mudah dimonopolisasi. Drescher et al. (2011) menemukan bahwa A. gracilipes sangat unggul dalam penemuan dan monopolisasi sumberdaya yang berada dalam wilayah superkoloninya.
Gambar 13 Waktu penemuan makanan pada koloni potensial A. gracilipes di Kebun Raya Bogor
Aktivitas penemuan makanan dalam satu jam memperlihatkan sejumlah semut A. gracilipes telah berada pada plat umpan dengan posisi mengelilingi cairan madu (Gambar 14A). Madu yang diletakkan pada plat umpan diambil dan disimpan pada bagian abdomen untuk selanjutnya dibawa menuju sarang. Apabila
24
Gambar 14 Pola tingkah laku A. gracilipes dalam menemukan makanan tanpa diberikan gangguan (A) dan setelah diberikan gangguan (B)
Selain itu diketahui bahwa setelah diberikan gangguan terhadap plat umpan, semut ini terlihat lebih agresif dalam mempertahankan wilayah sumber makanan yang mereka temukan. Hal ini diketahui terjadi pada spesies semut invasif lain seperti L. humile (Human & Gordon 1999) and S. invicta (Calcaterra et al. 2008). Keberadaan suatu koloni yang terdiri dari individu-individu dalam jumlah besar menuntut adanya kemampuan yang baik dalam mempertahankan sumberdaya yang ditemukan. Hal ini berkaitan erat dengan kelangsungan hidup koloninya sehingga perilaku agresif tampaknya menjadi sebuah faktor penting dalam bertahan hidup. Drescher et al. (2011) mengungkapkan bahwa perilaku agresif ini mungkin menjadi penyebab terjadinya persaingan terhadap spesies lokal pada habitat yang diinvasi oleh A. gracilipes.
Monopolisasi sumberdaya yang dilakukan oleh A. gracilipes pada wilayah penelitian dipertegas dengan tidak ditemukannya spesies semut lain pada plat umpan madu yang disebar disekitar sarang utama / pusat koloni. Drescher et al.
(2011) menemukan bahwa pada habitat terganggu A. gracilipes memiliki potensi untuk menggeser keberadaan kelompok spesies lokal. Parr (2008) menjelaskan bahwa dominasi salah satu spesies semut pada sumber makanan dapat mengontrol kekayaan spesies semut pada tingkat kelompok. Keunggulan dalam sisi jumlah dan agresivitas memberikan kesempatan yang lebih besar bagi A. gracilipes untuk mengeksploitasi dan memonopoli sumberdaya yang ada.
Selain menemukan sumberdaya secara eksplorasi, A. gracilipes
25
Gambar 15 Hubungan mutualisme antara kutu tanaman dan A. gracilipes
Dalam hubungan mutialistik ini, semut memberikan perlindungan kepada kutu tanaman dari serangan predator sedangkan kutu tanaman memberikan hasil ekskresi berupa embun madu yang menjadi salah satu sumber karbohidrat bagi semut (Buckley 1987; Borror et al. 1992). Namun diketahui bahwa simbiosis ini memiliki dampak ekologi yang luas (Speight et al. 2008), diantaranya yaitu kerusakan pada tanaman (Price 1997) dan secara dramatis merubah kelimpahan dan perilaku predasi semut pada tanaman (Sharma & Sundararaj 2011).
Proporsi Keseimbangan Hardy-Weinberg (HWE)
Hasil penelitian menunjukkan bahwa total terdapat 18 alel yang berasal dari populasi A. gracilipes (200 individu sampel) di Kebun Raya Bogor yang terpisah secara spasial ke dalam 5 koloni potensial yang berbeda. Keseluruhan jumlah alel total didapat pada 5 lokus dari total 6 lokus mikrosatelit yang digunakan. Lokus Ano8 tidak dapat didetaksi sebagai lokus monomorfik sehingga tidak dapat di analisis sebagai fragmen mikrosatelit polimorfik. Jumlah alel per lokus bervariasi antara 2 hingga 5 alel per lokus. Lokus Ano1 dan Ano3 memiliki alel terbanyak, masing-masing 5 alel per lokus (Tabel 2).
Tabel 2 Keragaman genetik A. gracilipes di Kebun Raya Bogor.
Lokus Na HO HE PHWE
Ano1 5 0.91014 0.55156 < 0.05
Ano3 5 0.99459 0.64492 < 0.05
Ano5 2 0.95216 0.49822 0.092
Ano6 2 1 0.5 < 0.05
Ano10 4 0.89973 0.54502 0.145
All 18 0.95100 0.54800 < 0.05
Ket: Na: jumlah alel pada seluruh populasi; HO: Heterozigositas yang diamati; HE:
Heterozigositas yang diharapkan; PHWE, nilai probabilitas terhadap Keseimbangan
26
Heterozigositas yang diamati (HO) berada pada rentang 0.89 hingga 1.00 dengan nilai keseluruhan HO= 0.95 sedangkan heterozigositas yang diharapkan (HE) berada pada rentang 0.49 hingga 0.64 (keseluruhan HE = 0.54). Tiga dari lima penanda mikrosatelit yang digunakan menunjukkan nilai yang signifikan (P<0.05) terhadap hukum keseimbangan Hardy-Weinberg. Nilai tersebut menjelaskan bahwa populasi A. gracilipes yang terdapat di Kebun Raya Bogor telah mengalami penyimpangan dari hukum keseimbangan Hardy-Weinberg. Sedangkan dua lokus lainnya (Ano5 dan Ano10) menunjukkan nilai yang tidak signifikan terhadap yang berarti frekuensi alel pada lokus tersebut masih berada dalam hukum keseimbangan Hardy-Weinberg. Hal ini menjelaskan bahwa terdapat pengaruh-pengaruh yang menyebabkan terjadinya pergeseran keseimbangan Hardy-Weinberg pada populasi A. gracilipes di Kebun Raya Bogor. Faktor-faktor tersebut dapat berupa ukuran populasi yang sangat besar, terjadinya mutasi, perkawinan tak acak, adanya seleksi dan aliran genetik pada suatu populasi (Stern 1943). Untuk kondisi di Kebun Raya Bogor, kemungkinan besar pengaruh yang mungkin terjadi adalah adanya perkawinan yang terjadi secara tidak acak (perkawinan antar sesama anggota koloni). Hal ini dipertegas dengan karakteristik koloni A. gracilipes yang bersifat polydomy. Polydomy
merupakan suatu bentuk koloni pada semut dimana secara sosial masih saling berhubungan namun memiliki sarang yang terpisah (Hölldobler & Wilson 1977). Fenomena ini mungkin berkaitan dengan fakta bahwa spesies semut pada tipe koloni ini tidak memiliki kemampuan untuk terbang sehingga hubungan antar sarang hanya terbentuk melalui jejak pekerja (Debout et al. 2007). Sifat ini mengindikasikan bahwa kemampuan untuk menemukan pasangan kawin yang berasal dari luar koloni lebih kecil sehingga potensi perkawinan tidak acak yang terjadi antar sesama lebih tinggi jika dibandingkan dengan spesies semut yang memiliki penyebaran bersayap. Hal ini memperkuat dugaan bahwa adanya perubahan genetik pada A. gracilipes sehingga tidak berada dalam keseimbangan Hardy-Weinberg mungkin disebabkan oleh adanya perkawinan yang terjadi secara tak acak. Sifat polydomy diketahui juga terdapat pada beberapa spesies semut invasif lain seperti L. humile (Jaquiery et al. 2005) dan Pheidole megacephala
(Fournier et al. 2009).
Diferensiasi Genetik pada A. gracilipes di Kebun Raya Bogor
27
menyebabkan terjadinya penurunan kebugaran dan kemampuan reproduksi dan dispersal yang dikenal sebagai depresi inbreeding (Jiménez et al. 1994). Namun pada A. gracilipes, mungkin terdapat mekanisme tertentu pada perkawinan sesama dimana keturunan yang dihasilkan tidak mengalami depresi inbreeding sehingga heterozigositas tetap dapat dipertahankan.
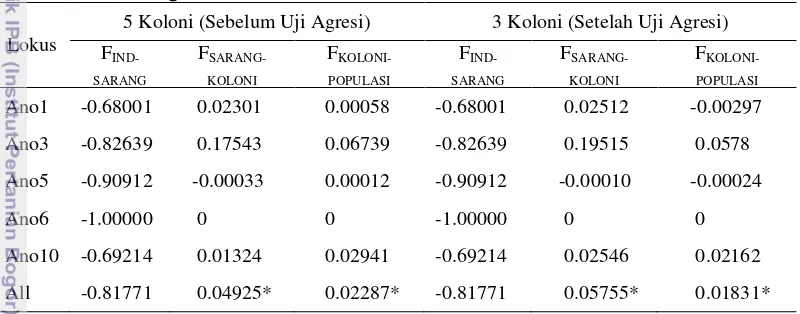
Diferensiasi genetik yang lebih tinggi terdapat pada antar sarang dalam koloni baik pada koloni awal (5 koloni sebelum uji agresi) dengan nilai 0.04925, Pvalue <0.05 dan koloni yang telah dipisahkan berdasarkan hasil uji agresi (3 koloni) dengan nilai 0.05575, P<0.05. Selain itu diferensiasi genetik pada level koloni dalam keseluruhan populasi juga menunjukkan nilai yang lebih tinggi (0.02287, P<0.05 dan 0.01831, P<0.05) jika dibandingkan dengan variasi genetik yang terdapat pada level individu di dalam sarang (Tabel 3).
Tabel 3 Diferensiasi populasi yang diestimasi menggunakan 5 lokus mikrosatelit dalam tiga level AMOVA.
Lokus
5 Koloni (Sebelum Uji Agresi) 3 Koloni (Setelah Uji Agresi)
F IND-seluruh tingkat populasi. Ketidakmerataan diferensiasi genetik antar level populasi juga ditemukan pada A. gracilipes yang terdapat di Sabah, Malaysia (Drescher et al. 2007).
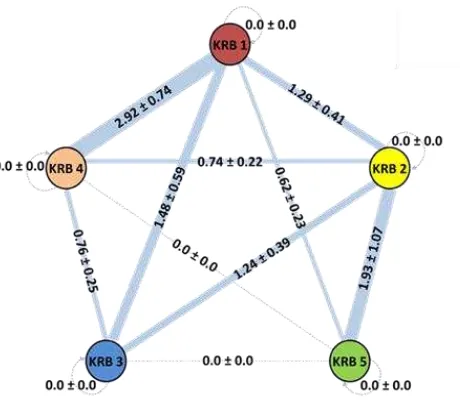
Jarak Genetik (FST) pada Koloni Potensial A. gracilipes
28
Tabel 4 Nilai jarak genetik (FST) pada 5 koloni potensial menggunakan 1000 kali permutasi
Secara keseluruhan nilai jarak genetik (FST) antar masing-masing koloni potensial berada pada kisaran 0.008 hingga 0.063. Nilai tersebut menunjukkan bahwa masing-masing koloni potensial A. gracilipes di Kebun Raya Bogor memiliki kemiripan genetik yang tinggi atau dengan kata lain memiliki keragaman genetik yang rendah. Keragaman genetik yang rendah (FST rendah) juga ditemukan pada spesies semut invasif L. humile (Jaqueiry et al. 2005). Kondisi ini umumnya terjadi pada koloni semut yang memiliki pola superkoloni
polygyny – polydomy dalam skala besar (Debout et al. 2007). Rendahnya diferensiasi genetik yang ada kembali merujuk kepada tingginya potensi perkawinan sesama yang terjadi pada suatu koloni. Tidak adanya transfer gen dari koloni/populasi lain mungkin menjadi penyebab adanya kemiripan genetik yang tinggi pada suatu koloni yang berujung pada terjadinya isolasi secara genetik.
Korelasi Antara Agresi dan Jarak Genetik (FST)
Hasil penelitian menunjukkan bahwa terdapat korelasi positif antara nilai indeks agresi (AI) dan indeks mortalitas (MI) walaupun secara statistik tidak berbeda secara signifikan (r2 = 0.62, P >0.05). Pada uji agresi ditemukan bahwa koloni potensial yang memiliki indeks agresi yang tinggi juga menunjukkan nilai indeks mortalitas yang tinggi pula walaupun tidak selalu konstan. Dalam penelitian ini, beberapa hasil pengamatan menunjukkan bahwa adanya bukti yang mengarah pada hubungan yang kuat antara indeks agresi dan indeks mortalitas walaupun diketahui tidak terjadi secara konsisten. Namun demikian, nilai indeks agresi berkorelasi negatif terhadap waktu yang diperlukan untuk melakukan serangan (Tbite) dan waktu yang diperlukan untuk membunuh semut lawan (Tdead)
(Tabel 5). Hal ini berarti secara keseluruhan menunjukkan bahwa semakin tinggi tingkat agresi maka waktu yang diperlukan untuk menyerang (Tbite) dan