SIFAT FISIKOKIMIA, TERMAL, DAN SPEKTROSKOPI
SELULOSA MIKROKRISTALIN SERABUT AMPAS SAGU
NONI CAHYANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sifat Fisikokimia, Termal, dan Spektroskopi Selulosa Mikrokristalin Serabut Ampas Sagu adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
iv
ABSTRAK
NONI CAHYANI. Sifat Fisikokimia, Termal, dan Spektroskopi Selulosa Mikrokristalin Serabut Ampas Sagu. Dibimbing oleh TUN TEDJA IRAWADI dan MOHAMMAD KHOTIB.
Selulosa mikrokristalin (MCC) adalah α-selulosa yang terdepolimerisasi sebagian. MCC lazim digunakan sebagai bahan sediaan obat. MCC hasil isolasi dari serabut ampas sagu dan MCC komersial (MCCK) dicirikan berdasarkan sifat fisikokimia, stabilitas termal, dan spektroskopinya. MCC1 diisolasi melalui tahap hidrolisis, pulping, dan bleaching, sedangkan MCC2 diisolasi dengan tahap pulping, bleaching, dan hidrolisis. Rendemen MCC1 dan MCC2 berturut-turut 13% dan 6.5% dengan kadar α-selulosa berturut-turut 78.61% dan 73.08%. Sifat fisikokimia ketiga MCC sesuai dengan MCC standar. MCC1 dan MCCK memiliki derajat polimerisasi yang sesuai dengan MCC standar (≤350), sedangkan derajat polimerisasi MCC2 >700. Spektrum inframerah MCC1 dan MCCK juga sesuai dengan MCC standar, sedangkan spektrum MCC2 masih menunjukkan keberadaan lignin. Berdasarkan analisis termal, MCC2 memiliki suhu degradasi dan kristalinitas tertinggi berturut-turut sebesar 396.26 °C dan 66.4%, karena kadar ligninnya tinggi. MCC1 memiliki luas permukaan terbesar, yang memungkinkannya mengikat zat aktif obat lebih banyak.
Kata kunci : mikrokristalin, sagu, selulosa
ABSTRACT
NONI CAHYANI. Physicochemical, Thermal, and Spectroscopic Properties of Microcrystalline Cellulose from Sago Waste Fibers. Supervised by TUN TEDJA IRAWADI and MOHAMMAD KHOTIB.
Microcrystalline cellulose (MCC) is a partially depolymerized from
α-cellulose. MCC is generally used as a medicinal preparation. MCC isolates from sago waste fiber and commercial MCC (MCCK) were characterized based on physicochemical, thermal, and spectroscopic properties. MCC1 was isolated through hydrolysis, pulping, and bleaching stages while MCC2 was isolated by pulping, bleaching, and hydrolysis steps, respectively MCC1 and MCC2 yields were 13% and 6.5% with α-cellulose levels of 78.61% and 73.08%. Physicochemical properties results of all three MCCs were in accordance with MCC’s standard. MCC1 and MCCK had degree of polymerizations fulfilling MCC’s standard ( 350) while for MCC2, the value was over 700. Infrared spectra of MCC1 and MCCK were also in accordance with MCC’s standard, whereas the MCC2 spectrum still showed the presence of lignin. Based on thermal analysis, MCC2 had the highest degradation temperature and degree of crystallinity, which were 396.26 °C and 66.4%, respectively, corresponding to the high lignin content. MCC1 had the largest surface area, enable to bind more active ingredient medicine.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
SIFAT FISIKOKIMIA, TERMAL, DAN SPEKTROSKOPIK
SELULOSA MIKROKRISTALIN SERABUT AMPAS SAGU
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Skripsi : Sifat Fisikokimia, Termal, dan Spektroskopi Selulosa Mikrokristalin Serabut Ampas Sagu
Nama : Noni Cahyani
NIM : G44090076
Disetujui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Pembimbing I
Mohammad Khotib, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Sifat Fisikokimia, Termal, dan Spektroskopi Selulosa Mikrokristalin Serabut Ampas Sagu”. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Februari hingga Juli 2013 di Laboratorium Terpadu, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Ibu Prof Dr Ir Tun Tedja Irawadi, MS selaku pembimbing I dan Bapak Mohammad Khotib, SSi, MSi selaku pembimbing II. Penulis juga mengucapkan terima kasih kepada Ayah, Ibu, serta keluarga atas segala doa dan kasih sayangnya.
Terima kasih juga kepada Bapak Drs Muhammad Farid dan Bapak Novriyandi Hanif, DSc atas segala diskusi dan saran berkaitan dengan penelitian. Selain itu, penulis juga mengucapkan terima kasih kepada Indah, Baim, Egi, Ivan, dan staf analis Laboratorium Terpadu atas bantuan dan masukan selama penelitian. Ucapan terima kasih juga penulis ucapkan kepada PT Indocement Tunggal Prakarsa, Batan Yogyakarta, Balai Kehutanan, Mia, Tati, Rahma, Rizky, Lestari, Pebry, Rahmi, Saima, Eka, Seffriwati, Ratna, Denar, Shinta, serta teman-teman Kimia 46 atas saran, semangat, dan pengalaman selama studi dan penelitian.
Semoga laporan ini dapat bermanfaat. Terima kasih
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR TABEL vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Pembuatan MCC1 ... 2
Pembuatan MCC2 ... 3
Pencirian MCC ... 3
HASIL DAN PEMBAHASAN 5 Hasil Pembuatan MCC ... 5
Sifat Fisikokimia MCC ... 8
Kelarutan MCC dalam Larutan NaOH/Urea ... 9
Stabilitas Termal dan Struktur MCC ... 9
SIMPULAN DAN SARAN 11 Simpulan ... 11
Saran ... 11
DAFTAR GAMBAR
1 Struktur selulosa I dan selulosa II 6
2 Spektrum FTIR selulosa 10
DAFTAR TABEL
1 Kandungan senyawa kimia MCC 72 Sifat fisikokimia MCC 8
3 Kelarutan selulosa dalam larutan NaOH/urea 9
4 Hasil analisis DTA/TGA dan XRD 10
5 Hasil spektrum FTIR MCC 11
DAFTAR LAMPIRAN
1 Bagan alir penelitian 142 Hasil analisis DTA/TGA 15
1
PENDAHULUAN
Indonesia merupakan penyumbang 55% sagu dunia, disusul Papua Nugini 20%, Malaysia 20%, dan negara lain sebesar 5%. Daerah penghasil sagu terbesar di Indonesia adalah Kepulauan Riau dan Papua. Areal tanaman sagu di Kepulauan Riau yang tersebar di daerah pesisir dan di pulau-pulau kecil di beberapa daerah kabupaten mencapai 69 916 ha. Sekitar 49 686 ha (71.06%) dari wilayah tersebut digunakan sebagai daerah perkebunan sagu rakyat yang menghasilkan sagu sebanyak 171 549 ton. Luas perkebunan sagu di Provinsi Papua sekitar 513 000 ha dengan produksi 139 ton (BPS 2007). Jumlah industri pengolahan sagu semakin meningkat berdasarkan data ekspor tepung sagu pada tahun 2011 dan 2012 berturut- turut, yaitu sebesar 1444.6 dan 2495.868 ton (BPS 2012).
Di kawasan Indo Pasifik terdapat 5 marga (genus) Palmae yang zat tepungnya telah dimanfaatkan, yaitu Metroxylon, Arenga, Corypha, Euqeissona, dan Caryota. Genus yang banyak dikenal adalah Metroxylon karena kandungan zat tepungnya cukup tinggi. Metroxylon sago mudah dijumpai di daerah Jawa Barat seperti Bogor, Sukabumi, dan Banten. Tanaman sagu yang berpotensi tinggi di Indonesia meningkatkan jumlah industri pengolahan sagu dan menghasilkan limbah sagu mencapai 60% dari setiap pohon sagu (Syakir et al. 2009). Limbah sagu yang dihasilkan berupa air sisa pencucian sagu, ampas sagu, serabut ampas sagu, dan kulit hasil pengupasan batang sagu. Limbah yang tidak diolah dapat mencemari lingkungan berupa peningkatan kemasaman tanah (pH <4) yang dapat menghambat pertumbuhan, bahkan menyebabkan kematian tanaman.
Ampas sagu telah digunakan sebagai bahan pakan ternak, sedangkan serabut ampas sagu belum banyak dimanfaatkan. Serabut ampas sagu mengandung selulosa sebesar 41.47% sebelum diisolasi dan setelah diisolasi menjadi 86.79% (Setyorini 2011). Kandungan selulosa yang tinggi ini dapat dimodifikasi sebagai fase diam untuk pemisahan senyawa aktif dan dibuat selulosa mikrokristalin (MCC). MCC adalah α-selulosa yang terdepolimerisasi sebagian dan dimurnikan sampai berwarna putih, tidak berbau, tidak berasa, memiliki derajat polimerisasi 350, dan berbentuk serbuk kristalin yang terdiri atas partikel berpori (Schuh et al. 2013). Tumbuhan berkayu dan kapas merupakan bahan baku yang lazim digunakan untuk membuat MCC. Penggunaan kayu tersebut dapat mengurangi ketersediaan kayu karena penebangan hutan secara besar-besaran sehingga Indonesia harus mengimpor MCC. Impor MCC cenderung meningkat dari bulan Januari hingga Desember dengan total impor sebesar 69 717 ton (BPS 2012).
Pembuatan MCC telah dilakukan dengan bahan baku gabah yang dibuat melalui tahap pulping dan bleaching, lalu dihidrolisis dengan asam mineral seperti HCl dan H2SO4 (Adel et al. 2011). Halim et al. (2002) juga telah membuat MCC dari jerami padi dengan memvariasikan lama hidrolisis, sedangkan Ejikeme (2008) menggunakan MCC dari kulit jeruk sebagai bahan sediaan tablet. Pemilihan serabut ampas sagu sebagai bahan baku MCC dapat meningkatkan nilai ekonomis limbah serabut ampas sagu, mengurangi biaya belanja turunan selulosa serbuk tiap tahun, dan mengatasi masalah lingkungan.
2
ditunjukkan dengan warna biru-ungu dalam larutan ZnCl2 teriodinasi (Azubuike et al. 2012). Sifat fisikokimia dan termal yang mendukung MCC untuk dijadikan bahan sediaan tablet meliputi bulk density, tap density, kadar air, luas permukaan, sudut diam, kadar abu, indeks Carr, nisbah Hausner, stabilitas termal (Azubuike dan Okhamafe 2012), dan derajat polimerisasi (Halim et al. 2002). Kemampuan MCC menahan tekanan saat pengemasan dapat ditentukan berdasarkan tap density yang tinggi (Ejikeme 2008), sedangkan luas permukaan MCC yang semakin besar akan memudahkan saat pengempaan dan semakin baik mengikat zat aktif. Indeks Carr digunakan untuk menentukan jumlah bubuk MCC yang dapat dipadatkan. Daya alir MCC yang baik dapat dilihat dari bulk density yang tinggi, kadar air dan nisbah Hausner yang rendah (Azubuike dan Okhamafe 2012), serta derajat polimerisasi (DP) 350 (Halim 1999), sedangkan analisis termal digunakan untuk menentukan suhu degradasi dan dekomposisi selulosa yang menunjukkan stabilitas termal MCC (Sundar et al. 2010). Kadar abu yang rendah mengindikasikan kandungan zat anorganik yang rendah (Azubuike et al. 2012).
Struktur MCC dicirikan menggunakan analisis difraksi sinar-X (XRD) dan spektroskopi inframerah transformasi Fourier (FTIR). Achmadi (1999) menyatakan bahwa selulosa memiliki 2 struktur, yaitu selulosa I dan II. Selulosa I merupakan struktur selulosa yang ada di alam, sedangkan selulosa II merupakan hasil perubahan selulosa I akibat larutan basa kuat dan pemanasan. Struktur selulosa II lebih mantap dibandingkan dengan selulosa I. Menurut Park et al. (2010), analisis XRD dapat menunjukkan keberadaan bentuk polimorf selulosa I dan II yang mengindikasikan struktur amorf dan kristalin selulosa. Spektroskopi FTIR digunakan untuk menentukan struktur kimia selulosa berdasarkan analisis gugus fungsi dalam sampel dan pembandingan dengan spektrum MCC standar (Adel et al. 2011).
Penelitian ini bertujuan mengkaji pengaruh metode isolasi pada sifat-sifat MCC dari serabut ampas sagu. MCC tersebut dan MCC komersial dicirikan berdasarkan sifat-sifat MCC standar untuk menentukan kelayakan selulosa tersebut sebagai MCC.
METODE
Penelitian ini terdiri atas 2 tahap, yaitu isolasi MCC dan pencirian MCC. Isolasi MCC dilakukan dengan 2 cara, yaitu MCC1 meliputi hidrolisis, pulping, lalu bleaching, serta MCC2 meliputi pulping dan bleaching dengan metode yang sama dengan MCC1, dan dilanjutkan dengan hidrolisis. Bahan yang digunakan adalah serabut ampas sagu Metroxylon dari Tanah Baru, Bogor dan MCC komersial (No. CAS: 9004-34-6 Sigma-Aldrich).
Pembuatan MCC1
Hidrolisis (modifikasi BSN 2008)
3
suhu 80 °C sambil diaduk menggunakan motor pengaduk selama 1 jam. Selanjutnya serabut ampas sagu dinetralkan dengan aliran air, lalu dikeringkan di bawah sinar matahari.
Pulping (modifikasi Sun et al. 2005)
Sebanyak 150 g hasil hidrolisis ditambahkan 3 L larutan NaOH 20% dan dipanaskan pada suhu 80 °C selama 2 jam. Setelah itu, hasil pulping dicuci dengan air mengalir hingga netral dan dikeringkan di bawah sinar matahari. Bleaching (modifikasi Sun et al. 2005)
Sebanyak 50 g contoh hasil pulping ditambahkan 1.25 L H2O2 5% pH 12 (dikondisikan dengan NaOH 40%) di dalam gelas piala 3 L. Campuran dipanaskan pada suhu 80 90 °C sambil diaduk menggunakan motor pengaduk dengan kecepatan pengadukan 200 rpm secara bertahap selama 2, 3, dan 3 jam. Setiap tahapan selesai, sampel dicuci dengan air mengalir hingga netral. Setelah 8 jam, hasil bleaching (selulosa) dikeringkan dalam oven dengan suhu 60 °C hingga bobot konstan. Setelah itu, selulosa dihaluskan.
Pembuatan MCC2
Pembuatan MCC2 diawali dengan proses pulping dan bleaching yang sesuai dengan pembuatan MCC1.
Hidrolisis (modifikasi Adel et al. 2010)
Sebanyak 50 g hasil delignifikasi dimasukkan ke dalam labu bulat 1 L dan ditambahkan 1 L HCl 3%, kemudian direfluks dengan suhu 80 °C selama 1 jam. Sampel dinetralkan dengan aliran air, lalu dikeringkan dalam oven pada suhu 60 °C hingga bobot konstan dan dihaluskan.
Pencirian MCC
Identifikasi MCC (British Pharmacopoeia 1993)
Sampel sebanyak 10 mg diletakkan dalam tabung reaksi dan didispersi dengan 2 mL larutan ZnCl2 teriodinasi. Perubahan warna larutan menjadi ungu-biru menunjukkan sampel tersebut hidroselulosa.
Identifikasi Pati (British Pharmacopoeia 1993)
Sampel sebanyak 0.2 g dimasukkan ke dalam tabung reaksi dan ditambahkan akuades sebanyak 10 mL. Setelah itu, diaduk selama 5 menit dan ditetesi larutan iodin 1%. Perubahan warna larutan menjadi ungu-biru menunjukkan sampel mengandung pati.
Kelarutan dalam Air (modifikasi British Pharmacopoeia 1993)
4
konstannya. Filtrat dipanaskan pada suhu 105 °C selama 1 jam dan dihitung persentase bobot sampel yang larut dalam air.
Bulk Density (modifikasi Azubuike dan Okhamafe 2012)
Bubuk MCC sebanyak 5 g (w) dituangkan ke dalam gelas ukur 100 mL dan ditentukan volume sampel (v0). Bulk density ditentukan dengan persamaan sebagai berikut:
Tap Density (modifikasi Azubuike dan Okhamafe 2012)
Bubuk MCC sebanyak 5 g (w) dituangkan ke dalam gelas ukur 100 mL, lalu dimampatkan dengan kayu silinder dari ketinggian 2.5 cm di atas permukaan yang kasar sekitar 100 ketukan sampai volume konstan. Volume konstan (v1) sampai volume dimampatkan dan massa setelah dimampatkan dicatat. Lalu ditentukan Tap density dengan persamaan sebagai berikut:
Indeks Carr dan Nisbah Hausner (modifikasi Azubuike dan Okhamafe 2012) Indeks Carr dan nisbah Hausner ditentukan dari nilai bulk density dan tap density dengan persamaan berikut:
Indeks Carr ‐ %
Nisbah Hausner
Luas Permukaan MCC
Sampel sebanyak 2 g dimasukkan ke dalam alat NOVA-1000 American Quantachrome dengan metode Brunauer, Emmet, dan Teller.
Sudut diam (modifikasi Azubuike dan Okhamafe 2012)
Sampel sebanyak 5 g dimasukkan ke dalam corong yang diletakkan di tempat yang statis dengan ketinggian ujung corong 2 cm. Sampel dibiarkan mengalir membentuk tumpukan kerucut, lalu ketinggian (h) dan jejari (r) diukur. Sudut diam (θ) dihitung dengan persamaan berikut:
tan
Kadar Air MCC (BSN 1992)
5
Kadar Abu MCC (BSN 1992)
Sampel sebanyak 3 g diletakkan dalam cawan porselen yang telah diketahui bobot konstannya, lalu dipanaskan di atas pembakaran bunsen sampai tidak berasap lagi. Sampel dimasukkan ke dalam tanur dengan suhu 500 °C selama 5 jam. Setelah bobot konstan, sampel ditimbang kembali dan kadar abu MCC dihitung.
Penentuan pH MCC (British Pharmacopoeia 1993)
Sampel sebanyak 0.2 g dimasukkan ke dalam tabung reaksi dan ditambahkan akuades sebanyak 10 mL. Campuran diaduk selama 5 menit dan diukur dengan pH-meter yang telah dikalibrasi.
Kelarutan MCC dalam Larutan NaOH/Urea (modifikasi Wang 2008)
Tabung reaksi sebanyak 3 buah dimasukkan sampel masing-masing sebanyak 0.2 g, kemudian ditambahkan larutan NaOH 9%, NaOH 6%/urea 4%, dan NaOH 7%/urea 12% pada setiap tabung. Setelah diaduk selama 5 menit, lalu tabung disimpan dalam lemari pendingin dengan suhu 20 °C selama 24 jam. Kemudian tabung diaduk selama 5 menit dan diamati kelarutannya.
Stabilitas Termal (modifikasi Azubuike dan Okhamafe 2012)
Sampel sebanyak 6 10 mg dipanaskan dari suhu ruang sampai suhu 400 °C pada laju alir nitrogen sekitar 5 °C/menit menggunakan alat DTG-60H FC-60A TA-60WS.
Difraksi Sinar-X MCC (modifikasi Azubuike dan Okhamafe 2012)
Serbuk selulosa dicetak dan ditekan dalam lubang wadah sampel dan dihaluskan dengan lembaran kaca. Pemayaran dilakukan pada 2θ 5° 65° menggunakan alat XRD D4 Commander Programme dan perangkat lunak Diffract.Eva v2.1.
Spektroskopi FTIR (modifikasi Azubuike dan Okhamafe 2012)
Sampel sebanyak 0.005 g dicampurkan dengan KBr sebanyak 0.1 g, lalu dihaluskan dan dioven selama 24 jam. Setelah itu, dimasukkan ke dalam wadah sampel FTIR. Pemayaran dilakukan pada kisaran bilangan gelombang 4000 400 cm-1.
HASIL DAN PEMBAHASAN
Hasil Pembuatan MCC
Selulosa mikrokristalin dapat dibuat dari bahan baku dengan kandungan
6
pulping, dan bleaching, sedangkan MCC2 dihasilkan dengan pulping, bleaching, dan hidrolisis (Lampiran 1).
Proses hidrolisis menggunakan larutan HCl 3% yang akan membentuk H+ dan Cl¯. Raharja et al. (2010) menyatakan bahwa gugus H+ dapat memecah ikatan glikosidik pada selulosa dan hemiselulosa sehingga membentuk monomer-monomer gula sederhana. Hidrolisis yang dilakukan pada suhu 80 °C dapat membantu melepaskan lignin dari selulosa dan hemiselulosa serta memecah lignin menjadi partikel kecil. Lepasnya lignin membuat selulosa dan hemiselulosa lebih mudah terhidrolisis. Berdasarkan penelitian Adel et al. (2011), hidrolisis dengan HCl menghasilkan rendemen yang lebih tinggi dibandingkan dengan H2SO4 karena larutan H2SO4 dapat menyerang gugus –OH pada selulosa.
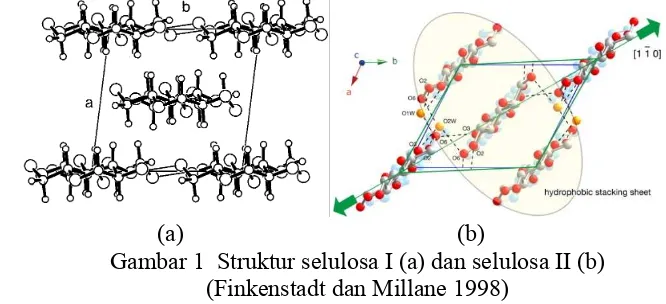
Selulosa I merupakan struktur asli selulosa yang tidak memiliki ikatan hidrogen di antara lapisan selulosa, hanya ada gaya van der Waals, sedangkan selulosa II lebih mantap karena memiliki ikatan hidrogen antarlapisan selulosa (Gambar 1). Selulosa II terbentuk jika kisi selulosa I hancur akibat pemekaran dalam larutan basa kuat.
((
(a) (b)
Gambar 1 Struktur selulosa I (a) dan selulosa II (b) (Finkenstadt dan Millane 1998)
Larutan NaOH merupakan larutan pemekar terbaik dalam proses pulping. Hal ini disebabkan kecocokan kation Na+ untuk menyusupi pori di antara bidang kisi selulosa. Penyusupan partikel saing menyebabkan pemekaran apabila diikuti dengan masuknya molekul air (Achmadi 1990). Proses bleaching menggunakan H2O2 efektif pada media basa. Spesi aktif H2O2 dihasilkan melalui reaksi disosiasi, yaitu anion peroksida (–OOH). Anion tersebut akan mengeliminasi gugus kromofor dari lignin. Spesi radikal aktif seperti radikal hidroksil (•OH) dan radikal anion superoksida (•O2–) yang terbentuk melalui dekomposisi H2O2 akan melarutkan hemiselulosa. Purwaningsih (2012) menyatakan bahwa radikal-radikal hasil dekomposisi awal H2O2 ini selanjutnya akan menghasilkan radikal aktif lainnya. Radikal aktif yang terbentuk akan bereaksi dengan radikal aktif lainnya menghasilkan oksigen dan anion hidroksil. Anion hidroksil dapat meningkatkan pH yang mengindikasikan hemiselulosa yang terlarut semakin banyak. Rendemen MCC1 sebesar 13% dan berwarna putih yang sesuai dengan MCC standar (Tabel 1).
7
Struktur selulosa II yang diduga terbentuk membuat asam encer tidak dapat menghidrolisis selulosa dan hemiselulosa sehingga monomer glukosa yang terbentuk sedikit. Hal ini ditunjukkan dengan rendemen MCC2 yang lebih rendah daripada MCC1, yaitu 6.5% dan berwarna cokelat muda (Tabel 1). Raharja et al. (2010) menyatakan bahwa kadar hemiselulosa meningkat karena terjadi ikatan dengan lignin yang menghambat hidrolisis. Hemiselulosa terbungkus dalam jaringan lignin sehingga saat pengukuran kadar hemiselulosa, lignin yang berikatan dengan hemiselulosa juga terukur. Hasil tersebut juga disebabkan metode MCC2 belum dioptimasi, sedangkan metode MCC1 sudah dioptimasi.
Kemurnian MCC dapat ditentukan berdasarkan identifikasi MCC, identifikasi pati, warna, pH, dan kelarutan dalam air. MCC diidentifikasi menggunakan larutan ZnCl2 teriodinasi yang akan menghasilkan warna biru atau ungu dengan hidroselulosa. Ketiga selulosa menunjukkan uji positif berwarna ungu. Kandungan pati dideteksi menggunakan larutan iodin yang berwarna biru-ungu apabila uji positif. Ketiga selulosa tersebut menunjukkan uji negatif pati yang menunjukkan bahwa sampel telah bebas dari ketidakmurnian MCC (Azubuike et al. 2012). Warna MCC1 dan MCC komersial (MCCK) yang putih sesuai dengan MCC standar yang menunjukkan kadar lignin yang rendah (Tabel 1).
Tabel 1 Kandungan senyawa kimia MCC
Parameter MCC1 MCC2 MCCK MCC Standar *)
Lignin (%) 0.03 12.67 3.17
Holoselulosa (%) 93.96 91.38 97.02
α-Selulosa (%) 78.61 73.08 65.87 Hemiselulosa (%) 15.35 18.30 31.15
Identifikasi MCC Ungu Ungu Ungu Biru-ungu
Identifikasi pati Kuning Kuning Kuning Tidak biru-ungu
pH MCC 7.48 5.67 6.83 5 7.50
Kelarutan dalam air (%) 0.0032 0.5920 0.2080 <0.24 Kadar abu (%) 0.55 1.20 0.34 <0.15 Kadar air (%) 7.31 3.82 4.85 <7.00
Warna Putih Cokelat muda Putih Putih
*)
British Pharmacopoeia (1993)
MCC1, MCC2, dan MCCK memiliki pH berturut-turut sebesar 7.48, 5.67, dan 6.83 yang sesuai dengan kisaran pH MCC sebesar 5 7.5. Menurut Ejikeme (2008), MCC dengan pH <5 dan >7.5 dapat menyebabkan overreaction apabila MCC dicampur dengan zat aktif obat. Kelarutan MCC dalam air juga digunakan untuk menentukan kemurnian MCC berdasarkan kelarutan gula sederhana hemiselulosa seperti xilosa dan manosa dalam air. Kelarutan gula sederhana lazimnya kurang dari 0.24% (British Pharmacopoeia 1993). MCC1 memiliki kelarutan yang lebih rendah dibandingkan dengan MCCK karena kadar hemiselulosa dan lignin MCCK yang lebih tinggi daripada MCC1. Lignin yang cukup tinggi dalam MCC2 diduga ikut terdispersi dalam air sehingga meningkatkan kelarutan dalam air (Lanz 2006).
8
kurang baik. Namun, MCC1 masih stabil digunakan sebagai bahan sediaan tablet karena kadar airnya kurang dari 7.5% (Lanz 2006). Kadar air 5% digunakan untuk tablet yang lembut, sedangkan MCC dengan kadar air 7% untuk tablet yang keras (Reirer 2000). Ketiga sampel memiliki kadar abu yang lebih tinggi daripada standar MCC, dengan MCCK memiliki kadar abu terendah. Hasil ini menunjukkan bahwa kadar unsur anorganik dalam MCCK lebih rendah dibandingkan dengan dalam MCC1 dan MCC2.
Sifat Fisikokimia MCC
Bulk density dan tap density MCC yang baik berturut-turut ialah 0.25 0.50 g/mL dan 0.33 0.70 g/mL (The Pharmaceutical Codex 1994). MCC1, MCC2, serta MCCK memiliki bulk density dan tap density yang baik. Semakin tinggi tap density, semakin baik kemampuan MCC menerima tekanan. Kemampuan mengalir MCC dalam alat pengempaan tablet ditentukan berdasarkan indeks Carr, nisbah Hausner, dan sudut diam. Semakin besar indeks Carr, semakin banyak jumlah bubuk MCC yang dapat dipadatkan. Indeks Carr juga digunakan sebagai acuan laju alir MCC. Kisaran indeks Carr berdasarkan Azubuike dan Okhamafe (2012), ialah 5 10, 12 16, 18 21, dan 23 28 yang berturut-turut menunjukkan sangat mudah mengalir, mudah mengalir, mengalir, dan laju alir rendah. Hasil yang didapat menunjukkan bahwa MCC1 dan MCCK mudah mengalir dengan nilai indeks Carr 13.16 dan 13.15, sedangkan MCC2 sangat mudah mengalir dengan nilai indeks Carr 9.7 (Tabel 2).
Tabel 2 Sifat fisikokimia MCC
Parameter MCC1 MCC2 MCCK
Bulk density (g/mL) 0.31 0.37 0.33
9
MCC1 memiliki luas permukaan terbesar yang menunjukkan ukuran partikel MCC1 paling kecil dibandingkan dengan MCC2 dan MCCK. Penurunan ukuran partikel meningkatkan luas permukaan efektif dalam kontak dengan zat aktif. Menurut Reirer (2000), peningkatan luas permukaan efektif MCC tidak selalu meningkatkan kelarutan dalam air apabila zat aktif tersebut bersifat hidrofobik. Agregasi mungkin dapat terjadi dan mengakibatkan penurunan kelarutan serta absorpsi. Analisis distribusi pori dapat secara lebih tepat menentukan kemampuan absorpsi MCC.
Kelarutan MCC dalam Larutan NaOH/Urea
Selulosa berantai molekul pendek dapat larut dalam NaOH. Larutan NaOH akan memasuki daerah amorf selulosa dan memutuskan ikatan hidrogen intra-selulosa dan antar-intra-selulosa. Selulosa membengkak diiringi dengan peningkatan mobilitas molekul. Mobilitas yang tinggi terjadi pada suhu di bawah 0 ºC yang dapat menurunkan kristalinitas selulosa sehingga dapat terlarut (Wang 2008). Penambahan urea ke dalam larutan NaOH dapat meningkatkan kelarutan MCC karena urea bertindak sebagai donor dan akseptor ikatan hidrogen dengan selulosa sehingga tidak terjadi penggabungan antar-selulosa. Kelarutan selulosa dalam larutan NaOH dan NaOH/urea 2% (b/v) ditunjukkan pada Tabel 3.
Tabel 3 Kelarutan selulosa dalam larutan NaOH/urea
Larutan Kelarutan
MCC1 MCC2 MCCK NaOH 9% Larut Tidak larut Larut NaOH 6% /urea 4% Larut Tidak larut Larut NaOH 7% /urea 12% Larut Tidak larut Larut
Derajat polimerisasi (DP) selulosa secara kualitatif dapat ditentukan berdasarkan kelarutan selulosa dalam NaOH dan urea. MCC1 dan MCCK larut dalam NaOH 9% yang menunjukkan DP 200, sedangkan MCC2 tidak larut dalam NaOH 7%/urea 12% yang menunjukkan DP >700 (Wang 2008). Larutan NaOH/urea digunakan untuk selulosa dengan DP tinggi, tetapi MCC2 tetap tidak larut. Hal ini disebabkan kadar lignin yang cukup tinggi membuat larutan NaOH tidak dapat memutus ikatan hidrogen selulosa.
Stabilitas Termal dan Struktur MCC
10
ketiga MCC tersebut menunjukkan difraksi tipe selulosa I dengan puncak difraksi pada sudut 2θ 15º dan 22.4º, sedangkan difraksi tipe selulosa II ditunjukkan oleh puncak difraksi pada sudut 2θ 20.4º (Azubuike dan Okhamafe 2012).
MCC2 memiliki suhu degradasi tertinggi (396.26 ºC) dan bobot terdegradasi terendah (76.98%) yang didukung dengan kadar abu sebesar 1.2% dan derajat kristalinitas sebesar 66.4%. Hal ini disebabkan kadar lignin yang tinggi meningkatkan kristalinitas dan ketahanan sampel pada suhu tinggi. Hasil tersebut sesuai dengan Wang (2008) yang menyatakan suhu degradasi hemiselulosa 200 260 ºC, selulosa 260 370 ºC, dan lignin 370 500 ºC. MCC 1 memiliki ciri-ciri yang paling mendekati MCC standar dengan kandungan α-selulosa yang tinggi, bobot terdegradasi dan suhu degradasi yang cukup tinggi, serta derajat kristalinitas yang tidak terlalu rendah.
Tabel 4 Hasil analisis DTA/TGA dan XRD Sampel
Spektrum FTIR MCC1 dan MCCK sesuai dengan MCC standar (Gambar 2), sedangkan spektrum MCC2 menunjukkan puncak pada 1592.20 cm-1 yang mengindikasikan adanya lignin (Tabel 5).
Gambar 2 Spektrum FTIR MCC1 (hitam), MCC2 (merah), dan MCCK (biru) Tabel 5 Hasil analisis spektrum FTIR MCC
Puncak (cm-1) Indikasi Literatur
800 900 Ikatan β-glikosida Haafiz et al.( 2013) 1163 Regang C O C asimetri
1425 1609 Regang C C aromatik
1600 Ikatan C OH
2900 Regang C H
11
SIMPULAN DAN SARAN
Simpulan
Isolat selulosa dari serabut ampas sagu yang diperoleh melalui proses hidrolisis, pulping, dan bleaching (MCC1) dan melalui pulping, bleaching, dan hidrolisis (MCC2), serta MCC komersial Sigma-Aldrich (MCCK) secara umum menunjukkan sifat yang sesuai dengan MCC standar British Pharmacopeia. Derajat polimerisasi MCC1 dan MCCK sesuai dengan MCC standar, tetapi MCC2 memiliki DP lebih dari 700 karena kandungan lignin yang masih cukup tinggi dan terlihat dari warnanya yang cokelat. Hal ini menunjukkan bahwa MCC2 belum terhidrolisis secara sempurna dan belum dapat dikatakan sebagai MCC. MCC1 memiliki ciri-ciri yang paling mendekati standar MCC dengan kandungan α-selulosa yang tinggi (78.61%), bobot terdegradasi dan suhu degradasi yang cukup tinggi (81.87% dan 396.26 °C), dan derajat kristalinitas yang cukup tinggi (56.7%). MCC1 dan MCCK memenuhi karakteristik MCC standar.
Saran
Metode pembuatan MCC1 perlu dioptimasi untuk meningkatkan rendemen MCC. Analisis distribusi pori pun perlu dilakukan untuk menentukan secara tepat kemampuan absorpsi MCC. Uji logam berat perlu dilakukan untuk memenuhi syarat pencirian MCC standar `menurut British Pharmacopeia dan aplikasi sebagai bahan sediaan tablet.
DAFTAR PUSTAKA
Achmadi SS. 1990. Kimia Kayu. Bogor (ID): IPB Pr.
Adel AM, Abd El-Wahab ZH, Ibrahim AA, Al-Shemy MT. 2011. Characterization of microcrystalline cellulose prepared from lignocellulosic materials. Part II: physicochemical properties. Carbohydr Polym. 83:676-687. doi:10.1016/j.carbpol.2010.08.039.
Adel AM, Abd El-Wahab ZH, Ibrahim AA, Al-Shemy MT. 2010. Characterization of microcrystalline cellulose prepared from lignocellulosic materials. Part I. Acid catalyzed hydrolysis. Biores Technol. 101:4446-4455. doi:10.1016/j.biortech.2010.01.047.
Azubuike CP, Okhamafe AO. 2012. Physicochemical, spectroscopic, and thermal properties of microcrystalline cellulose derivied from corn crobs. Int Recycling of Org Waste Agric. 1:1-9. doi:10.1186/2251-7715-1-9.
12
powders derived from cornstalks. Int Green Pharm. 6:193-198. doi: 10.4103/0973-8258.104930.
[BSN] Badan Standardisasi Nasional. Gravimetri. SNI 01-2891-1992. Jakarta (ID): BSN.
[BSN] Badan Standardisasi Nasional. Tepung Sagu. SNI 3729:2008. Jakarta (ID): BSN.
[BPS] Badan Pusat Statistik. 2012. Data Ekspor Impor [Internet]. [diunduh 2013 Apr 20]. Tersedia pada: www.bps.go.id.
[BPS] Badan Pusat Statistik. 2007. Produksi Sagu [Internet]. [diunduh 2013 Jul 6]. Tersedia pada: www.bps.go.id.
British Pharmacopoeia. 1993. Pharmaceutical Exipients. Ed ke-2. London (GB): HMSO Pr.
Ejikeme PM. 2008. Investigation of the physicochemical properties of microcrystalline cellulose from agricultural wastes I: orange mesocarp. Cellulose. 15:141-147. doi: 10.1007/MCC10570-007-9147-7.
[FAO] Food and Agriculture Organization of the United Nations. 1997. Compendium of Food Additive Specifications. Addendum 5. Roma (IT): Agriculture and Consumer Protection Department.
Finkenstadt VL, Millane RP. 1998. Crystal structure of Valonia cellulose 1β. Macromolecules. 31:7776-7783.
Haafiz MKM, Eichhorn SJ, Hassan A, Jawaid M. 2013. Isolation and characterization of microcrystalline cellulose from oil palm biomass residue. Carbohydr Polym. 93:628-634. doi: 10.1016/j.carbpol.2013.01.035.
Halim A, Ben ES, Sulastri E. 2002. Pembuatan mikrokristalin selulosa dari jerami padi (Oryza sativa Linn) dengan variasi waktu hidrolisa. J Sains Tek Farm. 7:86-87.
Halim A. 1999. Pembuatan dan uji sifat-sifat teknologi mikrokristalin selulosa dari jerami. J Sains Tek Farm. 4:1-8.
Lanz M. 2006. Pharmaceutical powder technology: toward a science based understanding of the behavior of powder systems [disertasi]. Basel (CH): Basel University.
Park S, Baker JO, Himmel ME, Parilla PA, Johnson DK. 2010. Cellulose crystallinity index: measurement techniques and their impact on interpreting cellulase performance. Biotechnol Biofuels. 3:1-10. doi: 10.1186/1754-6834-3-10.
Purwaningsih H. 2012. Rekayasa biopolimer dari limbah pertanian berbasis selulosa dan aplikasinya sebagai material separator [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Raharja S, Paryanto I, Yuliani F. 2010. Ekstraksi dan analisa dietary fiber dari buah mengkudu (Morinda citrifolia). J Tek Ind Pertan. 14(1): 30-39. Reirer GE. 2000. Avicel® PH Microcrystalline Cellulose. US: FMC Corporation. Rosa SML, Rehman N, Miranda MIG, Nachtigall SMB, Bica CID. 2012.
Chlorine-free extraction of cellulose from rice husk and whisker isolation. Carbohydr Polym. 87:1131-1138. doi:10.1016/j.carbpol.2011.08.084.
13
Schuh V, Allard K, Herrmann K, Gibis M, Kohlus T, Weiss J. 2013. Carboxymethyl cellulose (CMC) and microcrystalline cellulose (MCC) on functional characteristics of emulsified sausages. Meat Sci. 93:240-247. doi:10.1016/j.meatsci.2012.08.025.
Setyorini A. 2011. Sintesis dan aplikasi selulosa-g-poliakrilamida sebagai fase diam kromatografi kolom dari serabut ampas sagu [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sun JX, Xu F, Sun XF, Xiao B, Sun RC. 2005. Physico-chemical and thermal characterization of cellulose from barley straw. Polym Degrad Stab. 88:521-531.
Sundar ST, Sain MM, Oksman K. 2010. Characterization of microcrystalline cellulose and cellulose long fiber modified by iron salt. Carbohydr Polym. 80:35-43. doi:10.1016/j.carbpol.2009.10.072.
Syakir M, Bintoro MH, Agusta H. 2009. Pengaruh ampas sagu dan kompos terhadap produktivitas lada perdu. J Littri. 15(4):168-173.
14
Lampiran 1 Bagan alir penelitian
Pencirian MCC : Sifat fisikokimia Stabilitas termal Spektroskopi
Dibandingkan dengan MCC standar Isolasi MCC Serabut ampas sagu
15
16
17
Lampiran 3 Difraktogram XRD selulosa MCCK
MCC1
18