SINTESIS SELULOSA BENZOAT DARI
SERABUT AMPAS SAGU SEBAGAI FASE DIAM
KROMATOGRAFI KOLOM
AHMAD ROJALI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ii
ABSTRAK
AHMAD ROJALI. Sintesis Selulosa Benzoat dari Serabut Ampas Sagu Sebagai
Fase Diam Kromatografi Kolom. Dibimbing oleh TUN TEDJA IRAWADI dan
MOHAMMAD KHOTIB.
Ampas sagu merupakan limbah lignoselulosa (mengandung lignin,
selulosa, dan hemiselulosa) yang masih bisa dimanfaatkan menjadi bahan yang
lebih bernilai. Penelitian ini memodifikasi selulosa serabut ampas sagu menjadi
selulosa benzoat yang digunakan untuk fase diam kromatografi kolom. Serabut
ampas sagu dihidrolisis asam, lalu diubah menjadi pulp dalam NaOH 20% (b/v),
dan diputihkan dengan H
2O
2pH 12. Mikroselulosa diisolasi dari pulp dengan
larutan HCl 2.5 N. Mikroselulosa diesterifikasi dengan benzoil klorida dalam
pelarut piridina pada suhu 60 °C selama 4, 6, dan 8 jam. Inframerah transformasi
Fourier menunjukkan keberhasilan proses esterifikasi pada semua ragam waktu.
Derajat substitusi (DS) tertinggi (1.83) teramati pada produk esterifikasi selama 8
jam dengan hidrolisis awal menggunakan HCl. DS terendah (0.95) teramati pada
produk esterifikasi selama 4 jam dengan hidrolisis awal menggunakan H
2SO
4.
Selulosa benzoat dengan DS tertinggi memiliki ketahanan larut yang paling baik
terhadap pelarut metanol dan heksana, serta dapat diaplikasikan menjadi fase diam
kromatografi kolom untuk memisahkan zat ekstraktif temu-lawak.
ABSTRACT
AHMAD ROJALI. Synthesis of Cellulose Benzoate from Sago Waste Fiber for
Stationary Phase of Column Chromatography. Supervised by TUN TEDJA
IRAWADI and MOHAMMAD KHOTIB.
iii
SINTESIS SELULOSA BENZOAT DARI
SERABUT AMPAS SAGU SEBAGAI FASE DIAM
KROMATOGRAFI KOLOM
AHMAD ROJALI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
iv
Judul
: Sintesis Selulosa Benzoat dari Serabut Ampas Sagu Sebagai Fase
Diam Kromatografi Kolom.
Nama
: Ahmad Rojali
NIM
: G44070077
Disetujui
Diketahui
Ketua Departemen
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Tanggal lulus :
Pembimbing II
Mohammad Khotib, SSi, MSi
NIP 19781018 200701 1 002
Pembimbing I
v
PRAKATA
Alhamdulillahhirobbil’alamin..
Puji syukur ke hadirat Allah SWT atas nikmat dan karunia-Nya sehingga
karya ilmiah dengan judul “Sintesis Fase Diam
Kromatografi Kolom Berbasis
Selulosa Benzoat dari Serabut Ampas Sagu“ dapat diselesaikan. Shalawat serta
salam tak lupa selalu tercurah kepada junjungan Nabi besar Muhammad SAW,
keluarga, sahabat, dan pengikutnya yang setia. Karya ilmiah ini disusun
berdasarkan penelitian yang dilaksanakan pada bulan Maret 2011 hingga Oktober
2011, bertempat di Laboratorium Terpadu Institut Pertanian Bogor (IPB)
Baranangsiang.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. Tun Tedja Irawadi,
MS. dan Bapak Mohammad Khotib, S.Si, MSi. selaku pembimbing skripsi yang
telah memberikan bimbingan, arahan, dan dorongan moral dengan penuh dedikasi
kepada penulis. Penghargaan juga penulis sampaikan kepada seluruh staf pegawai
Laboratorium Terpadu IPB divisi penelitian khususnya Sujono, Ibrahim, dan
Indah.
Ucapan terima kasih yang tak terhingga juga penulis sampaikan kepada
Ayahanda Hidayat dan Ibunda Eta Dewita, serta Kakanda Nurhayati dan Chodijah
yang telah memberikan doa dan dorongan baik moral maupun material. Tak lupa
kepada teman-teman program pendidikan Sarjana (S1) Mayor Kimia Institut
Pertanian Bogor angkatan 2007, khususnya yang sering memberi masukan dan
semangat (Atri, Fijar, Indra, dan Amran) serta rekan satu penelitian (Bayu, Ujhe,
Ria, Icha, Siti, Ina, Riris, dan Mia).
Penulis menyadari bahwa karya ilmiah ini masih jauh dari kesempurnaan,
baik dalam penyajian maupun penulisannya. Semoga karya ilmiah ini dapat
berguna bagi penulis sendiri dan semua pihak yang membutuhkan di masa
mendatang demi kemajuan ilmu pengetahuan.
Wallahua’lam
.
Bogor, Oktober 2011
vi
RIWAYAT HIDUP
Penulis adalah putra ketiga dari pasangan Bapak Hidayat dan Ibu Eta
Dewita yang dilahirkan di Jakarta pada tanggal 8 Maret 1989. Penulis lulus dari
SMA Negeri 35 Jakarta pada tahun 2007. Penulis diterima di Institut Pertanian
Bogor (IPB) melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada
tahun yang sama dan diterima di Mayor Kimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
vii
DAFTAR ISI
Halaman
DAFTAR TABEL
... viii
DAFTAR GAMBAR
... viii
DAFTAR LAMPIRAN
... viii
PENDAHULUAN
... 1
METODE
Bahan dan Alat
... 2
Lingkup Kerja
... 2
Preparasi Ampas Sagu
... 2
Hidrolisis Fibril
... 2
Pulping
... 2
Delignifikasi
... 2
Isolasi Mikroselulosa
... 2
Esterifikasi Selulosa dengan Benzoil Klorida
... 2
Penentuan Derajat Esterifikasi
... 2
Preparasi Ekstrak Temu Lawak
... 3
Uji Ketahanan Terhadap Berbagai Pelarut
... 3
Kromatografi Kolom
... 3
Kromatografi Lapis Tipis (KLT)
... 3
Analisis FTIR
... 3
HASIL DAN PEMBAHASAN
Isolasi Selulosa
... 3
Mikroselulosa
... 5
Selulosa benzoat
... 5
Uji Daya Tahan Kelarutan
... 8
Kromatografi Kolom
... 8
Kromatografi Lapis Tipis
... 9
SIMPULAN ... 10
SARAN ... 10
DAFTAR PUSTAKA ... 10
viii
DAFTAR TABEL
Halaman
1 Hasil isolasi selulosa serabut ampas sagu ... 4
2 Hasil proses sintesis selulosa benzoat dengan berbagai variasi waktu ... 6
DAFTAR GAMBAR
Halaman
1
Foto (a) selulosa hidrolisis HCl, (b) selulosa hidrolisis H
2SO
4(c) SEM selulosa
hidrolisis HCl, (d) SEM selulosa hidrolisia H
2SO
4,perbesaran 50×
…………...
4
2
Spektrum FTIR selulosa murni, selulosa hasil isolasi (hidrolisis HCl), dan
selulosa hasil isolasi (hidrolisis H
2SO
4)
………..
5
3
Scanning Electronic Microscopy (SEM) mikroselulosa (a) hidrolisis awal HCl,
(b) hidrolisis awal H
2SO
4, perbesaran 500×
………
5
4
Mekanisme reaksi esterifikasi selulosa dengan benzoil klorida dalam pelarut
piridina (Jinming
et al. 2008
)
……….
6
5
Hasil foto SEM (a) selulosa benzoat, (b) selulosa (hidrolisis HCl), (c) selulosa
benzoat, (d) selulosa (hidrolisis H
2SO
4), perbesaran 500×
……….
6
6 Spektrum FTIR isolate selulosa (hidrolisis awal HCl dan H
2SO
4), dan selulosa
benzoat (hidrolisis awal HCl dan H
2SO
4……….
7
7 Grafik hubungan antara waktu (jam) dengan Derajat substitusi
(DS)
………..……
7
8
Foto ketahanan kelarutan selulosa benzoat dengan berbagai variasi waktu
terhadap terhadap pelarut metanol
………..
8
9
Kromatografi kolom (
flash
) selulosa benzoat
……….
8
10 Struktur kimia (a) xantorizol dan (b) kurkuminoid
………
...
…….
9
11 Hasil KLT fraksi kolom, standar xantorizol, dan ekstrak temu lawak dengan
eluen heksana:etil asetat (10:1) pada sinar Uv 254 nm
………...
9
12 Hasil KLT fraksi kolom, standar kurkuminoid, dan ekstrak temu lawak, eluen
kloroform:benzena:methanol (80:15:5) pada sinar uv 366 nm
………..
9
ix
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian………..
13
2 Hasil analisis proksimat awal, rendemen tiap tahap isolasi, dan rendemen isolasi
mikroselulosa……….
14
3 Selulosa benzoat tanpa proses isolasi mikroselulosa (a), selulosa benzoat hidrolisis
HCl/H
2SO
4(4, 6, dan 8) jam (b), dan selulosa benzoat kering hasil esterifikasi (c).
15
4
Hasil standardisasi HCl dan standardisasi NaOH………..
16
5
Derajat esterifikasi dan perhitungannya……….
17
6
Daya tahan kelarutan selulosa benzoat………...
18
7
R
fxantorizol pada eluen heksana:etil asetat (10:1)……….
19
8
R
fkurkuminoid pada eluen k
loroform:benzena:metanol (8:1.5:0.5)……….
20
PENDAHULUAN
Indonesia merupakan salah satu negara utama produsen sagu di dunia. Area penanaman sagu di Indonesia tersebar di berbagai daerah seperti Riau, Maluku, Sulawesi Utara, Sulawesi Selatan, dan Papua. Potensi pertanian sagu di Indonesia mencapai lebih dari 50% potensi pertanian sagu di dunia, yaitu sebesar 1.4 juta hektar (Susanto 2006). Pemanfaatan tanaman sagu sejauh ini cenderung terfokus pada patinya saja. Kandungan pati dalam empulur sagu yang dipanen secara komersial berkisar 18.8–38.8% berdasarkan bobot basah tanaman sagu (Singhal et al. 2008).
Industri ekstraksi pati sagu menghasilkan beberapa jenis limbah yang jumlahnya mencapai 6 kali jumlah tepung sagu yang dihasilkan. Limbah sagu tersebut meliputi ampas, kulit batang, dan air buangan yang dapat mencemari lingkungan berupa bau dan meningkatkan keasaman tanah (pH<4) (Syakir
et al. 2009). Sampai saat ini, ampas sagu hanya digunakan sebagai campuran pakan ternak (Matitaputty & Alfons 2006), sebagai arang briket, sumber bahan organik bagi tanah, dan pengisi adonan perekat dalam kayu lapis (Kumaran et al. 1997; Matitaputty & Alfons 2006).
Berdasarkan komponen kimianya, ampas sagu merupakan bahan lignoselulosa (lignin, selulosa, dan hemiselulosa) yang masih dapat dimanfaatkan menjadi bahan yang lebih
bernilai (Akmar & Kennedy 2001).
Kandungan selulosa dalam ampas sagu berpotensi meningkatkan nilai ekonominya. Selulosa merupakan makromolekul alamiah terbanyak dalam ampas sagu (Pusphamalar et al. 2006).
Selulosa merupakan polimer alami yang
dapat dimodifikasi menjadi produk
turunannya untuk memperoleh sifat-sifat yang
baru. Selulosa termodifikasi sering
diaplikasikan sebagai fase diam dalam pemisahan suatu zat. Beberapa kajian telah dilaporkan terkait dengan pemisahan secara kiral senyawa obat-obatan menggunakan kolom kiral berbasis-selulosa sebagai bahan pengemas kolom kromatografi cair kinerja tinggi (HPLC) (Chen et al. 2007).
Upaya penelitian dalam meningkatkan nilai ekonomi selulosa pada ampas sagu terus dikembangkan oleh para peneliti. Santi (2006) dan Irfana (2009) telah melakukan modifikasi sederhana asetilasi terhadap ampas sagu yang digunakan sebagai fase diam kromatografi kolom untuk pemisahan ekstrak temu lawak.
Kiat (2006) melaporkan telah membuat karboksimetil selulosa (CMC) dalam bentuk hidrogel. Pushpamalar et al. (2006) telah memodifikasi ampas sagu menjadi CMC dan
berhasil mengoptimasi kondisi reaksi
pembuatannya.
Salah satu produk turunan selulosa adalah selulosa benzoat, yang didapatkan dengan proses esterifikasi (Sjostrom 1998). Riswoko (2006) telah melakukan modifikasi terhadap selulosa jenis mikrokristalin menjadi ester dengan asil klorida turunan asam palmitat, asam 6-(p-metoksifeniloksi) heksanoat, dan asam 6-(p-sianobifenil-il-oksi) heksanoat dalam pelarut piridina. Derivatisasi selulosa sebagai ester hanya memodifikasi profil kelarutan dari produknya, sementara sifat-sifat polimeriknya tetap (Bobleter 1994). Analisis
permukaan dengan mikroskop elektron
pemayaran (SEM) menunjukkan bahwa
permukaan produk ester terlihat lebih berupa plastik film, tidak getas, dan bertekstur lebih kasar daripada selulosa murni (Riswoko 2006).
Penelitian ini bertujuan mengisolasi mikroselulosa ampas sagu dengan cara
pulping, dilanjutkan dengan proses esterifikasi
menggunakan benzoil klorida. Produk
selulosa benzoat diuji kemampuannya sebagai
fase diam kromatografi kolom untuk
memisahkan komponen-komponen bioaktif dari ekstrak temu lawak (kurkuminoid dan xantorizol). Pemisahan terhadap kelompok kurkuminoid telah banyak dilakukan, namun pada penelitian ini, dilakukan pemisahan xantorizol dari ekstrak etanol temu lawak.
Temu lawak (Curcuma xanthorriza
Roxb.) adalah tanaman obat-obatan yang tergolong keluarga Zingiberaceae. Temu lawak merupakan salah satu tanaman obat yang memiliki potensi sebagai antibakteri (Hwang 2000) dan antioksidan (Batubara et al. 2008). Xantorizol merupakan salah satu senyawa aktif dalam temu lawak yang memiliki kemampuan sebagai antibakteri
(Hwang 2000). Kandungan senyawa
xantorizol dalam temu lawak sebesar 21%
(Darusman et al. 2006). Kurkuminoid
2
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam
penelitian ini adalah serabut ampas sagu, (HCl, H2SO4, piridina, benzoil klorida,
metanol, etanol, aseton, toluena) p.a Merck, NaOH teknis, H2O2 5%, dan KBr.
Alat-alat analisis yang digunakan adalah alat-alat kaca, radas reaktor sintesis, blade stirrer, hot plate, refraktometer Abbé, penyaring vakum, kolom kromatografi (30×1) cm, pelat kromatografi lapis tipis (KLT), mikroskop elektron pemayaran (SEM), dan spektrofotometer inframerah transformasi Fourier (FTIR) Perkin-Elmer Spectrum One.
Lingkup Kerja
Penelitian ini dilakukan dalam beberapa tahapan (Lampiran 1), meliputi isolasi selulosa (hidrolisis fibril, pulping, dan delignifikasi), isolasi mikroselulosa, sintesis fase diam ester selulosa, pengukuran derajat esterifikasi, uji daya tahan terhadap berbagai pelarut pada fase diam hasil sintesis, pencirian fase diam dengan FTIR dan SEM, dan pemisahan xantorizol dari ekstrak temu lawak dengan kromatografi kolom berbasis selulosa benzoat.
Preparasi Ampas Sagu
Ampas sagu yang diambil dari pabrik tepung sagu di Cimahpar, Bogor dikeringkan di bawah sinar matahari selama 2 hari. Serabut ampas sagu yang telah dikeringkan kemudian diayak agar serabut kasarnya terpisah dari serbuk halus ampas sagu. Serabut kasar ampas sagu selanjutnya dianalisis proksimat awal yang meliputi kadar total
selulosa, kadar α-selulosa, dan kadar lignin.
Hidrolisis Fibril
Hidrolisis dengan HCl
Sebanyak 50 g serabut kasar ampas sagu yang telah digiling ditambahkan dengan 1000 mL larutan HCl 3% kemudian dipanaskan dalam penangas air hingga mencapai suhu 80
C. Suhu dijaga konstan selama 90 menit. Hasil hidrolisis dicuci dengan air mengalir hingga bebas asam (pH 7).
Hidrolisis dengan H2SO4
Sebanyak 200 g serabut kasar ampas sagu ditambahkan dengan 1000 mL larutan H2SO4
40%. Campuran diaduk selama 90 menit dengan pengaduk magnet pada suhu ruang (25
o
C). Hasil hidrolisis dicuci dengan air mengalir hingga bebas asam (pH 7).
Pulping (modifikasi Huang et al. 2007)
Sebanyak 50 g contoh hasil hidrolisis fibril ditambahkan 1000 mL larutan NaOH 20% kemudian dipanaskan dalam penangas air hingga mencapai suhu 80 C dan dijaga konstan selama 120 menit. Contoh ampas sagu hasil pulping dicuci hingga bebas basa dan dikeringkan dalam oven dengan suhu 60
C.
Delignifikasi (modifikasi Sun et al. 2005) Sebanyak 20 g contoh lignoselulosa hasil pulping ditambahkan 500 mL larutan H2O2
5% pH 12 dan dipanaskan dalam penangas air bersuhu 70 C yang dijaga konstan selama 2 jam. Setelah 2 jam, contoh dicuci hingga bebas basa. Proses ini diulangi sebanyak 2 kali lagi dengan larutan H2O2 baru,
masing-masing dipanaskan selama 3 jam. Kemudian contoh dikeringkan dalam oven bersuhu 60
C. Analisis proksimat kadar total selulosa,
kadar α-selulosa, dan kadar lignin juga dilakukan pada isolat selulosa ini.
Isolasi Mikroselulosa (modifikasi Ilindra & Dhake 2008) Sebanyak 50 g isolat selulosa ditambahkan 1000 mL larutan HCl 2.5 N panas (85 °C). Campuran dipanaskan kembali pada suhu 85 °C selama 30 menit dengan pengadukan konstan, lalu didinginkan dalam suhu kamar. Setelah dingin, mikroselulosa disaring dengan penyaring-vakum Büchner. Hasil penyaringan dicuci dengan air panas hingga bebas asam, kemudian dikeringkan.
Esterifikasi Selulosa dengan Benzoil Klorida (Riswoko 2006)
Sebanyak 10 g mikroselulosa dilarutkan dalam piridina selama 30 menit pada suhu 40 °C. Kemudian larutan dipanaskan pada suhu 60 °C selama 4, 6, dan 8 jam. Selama pemanasan, ditambahkan 70 mL benzoil klorida melalui corong penambah cairan. Produk kotor ester selulosa dicuci dengan HCl pH 3, lalu direndam dalam metanol dan dikeringkan hingga didapat selulosa benzoat kering.
Penentuan Derajat Esterifikasi (modifikasi Guimes 2008)
Sebanyak 1 g selulosa benzoat
3
Contoh kering selanjutnya ditambahkan 40 mL etanol 75% (v/v) dan dipanaskan dalam penangas air selama 30 menit pada suhu 60 ○
C. Sebanyak 40 mL NaOH 0.5 N yang telah distandardisasi ditambahkan setelah itu, dan dipanaskan lagi pada suhu yang sama selama 30 menit.
Contoh didiamkan selama 72 jam, kelebihan NaOH dititrasi dengan HCl 0.5 N
yang telah distandardisasi dengan
menggunakan indikator fenolftalein sampai warna merah muda lenyap. Contoh lalu didiamkan selama 24 jam untuk memberi kesempatan bagi NaOH berdifusi. Selanjutnya contoh dititrasi dengan NaOH 0.5 N sampai terbentuk warna merah muda kembali. Pengukuran blangko dilakukan sama dengan contoh, tetapi tanpa penambahan contoh selulosa benzoat. Kadar benzoil (KB) dihitung dengan rumus
dengan
A = volume NaOH untuk titrasi contoh (mL),
B = volume NaOH untuk titrasi blangko (mL),
C = volume HCl untuk titrasi contoh (mL),
D = volume HCl untuk titrasi blangko (mL),
F = 10.5 untuk kadar benzoil,
Na = normalitas HCl,
Nb = normalitas NaOH, dan
W = bobot kering contoh (g).
Sementara besarnya derajat substitusi (DS) dapat dihitung dari nilai KB menggunakan rumus
Preparasi Ekstrak Temu Lawak Sebanyak 25 g serbuk kering rimpang temu lawak dimasukkan ke dalam labu Erlenmeyer 250 mL, kemudian dimaserasi dengan 100 mL etanol p.a selama 24 jam. Maserat disaring dan dipisahkan ke dalam labu bulat. Residu dimaserasi ulang sebanyak 2 kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dalam labu bulat lalu dipekatkan dengan penguap putar pada suhu 40 °C hingga diperoleh ekstrak pekat. Ekstrak pekat rimpang temu lawak disimpan dalam botol berwarna gelap.
Uji Ketahanan Terhadap Berbagai Pelarut
Sebanyak 0.5 g produk selulosa benzoat dimasukkan ke dalam vial 15 mL, kemudian ditambahkan masing-masing 10 mL pelarut metanol p.a, etanol p.a, isopropanol p.a, asetonitril, n-heksana, dan air. Masing-masing larutan didiamkan selama 3×24 jam sambil sesekali diaduk, lalu diukur indeks biasnya
menggunakan alat refraktometer Abbe.
Pengukuran blangko dilakukan sama dengan contoh, tetapi tanpa penambahan contoh selulosa benzoat.
Kromatografi Kolom
Sebanyak 8 g selulosa benzoat dikemas dalam kolom kromatografi. Tinggi fase diam di dalam setiap kolom dibuat seragam (15 cm) dan laju alir diatur ±0.5 mL/menit. Ekstrak kasar temu lawak yang digunakan sebanyak 0.5 mL. Fase gerak yang digunakan adalah pelarut terbaik hasil uji ketahanan pelarut (metanol dan heksana). Ekstrak dielusi dengan mengalirkan fase gerak sampai semua fraksi keluar dari kolom. Setiap fraksi ditampung sebanyak 5 mL di dalam vial gelap.
Kromatografi Lapis Tipis (KLT) Fraksi-fraksi hasil pemisahan kromatografi kolom ditotolkan kurang lebih 20 kali di atas pelat KLT dengan jarak antarnoda sebesar 1 cm. Jarak batas atas dan batas bawah lintasan dari tepi pelat KLT sebesar 1 cm. Tiap noda dielusi dalam eluen heksana:etil asetat (10:1) untuk pemisahan xantorizol, dan eluen kloroform:benzena:metanol (80:15:5) untuk pemisahan kurkuminoid. Nilai retardation factor (Rf) yang diperoleh dibandingkan
dengan nilai Rf standar xantorizol dan standar
kurkuminoid.
Analisis FTIR
Sebanyak 0.01 g contoh selulosa benzoat dicampurkan dengan 0.1 g KBr. Campuran digerus sampai halus kemudian dipanaskan dalam oven 40 C selama 24 jam untuk menghilangkan uap air. Setelah 24 jam, campuran dianalisis dengan spektrometer FTIR Parkin Elmer Spectrum One dengan resolusi 4 cm-1.
HASIL DAN PEMBAHASAN
Isolasi Selulosa
4
serabut ampas sagu sebelum isolasi
menunjukkan kadar lignin 31.09%, dan holoselulosa 70.63% (Lampiran 2). Isolasi selulosa dilakukan dengan beberapa tahapan, yaitu hidrolisis fibril, pulping dengan NaOH, dan delignifikasi dengan peroksida. Proses hidrolisis dilakukan dengan 2 cara, yaitu hidrolisis dengan HCl 3% melalui proses pemanasan dan dengan H2SO4 40% tanpa
proses pemanasan. Pembandingan kedua metode ini dilakukan berdasarkan rendemen dan kemurnian hasil isolat selulosa.
Lignin dan hemiselulosa perlu dihilangkan dari serabut ampas sagu karena dalam penelitian ini target utama reaksi esterifikasi adalah α-selulosa. HCl encer (HCl 3%) digunakan untuk menghidrolisis sebagian besar hemiselulosa dan menghidrolisis pati (Achmadi 1990). Penggunaan H2SO4 selain
untuk hidrolisis, juga untuk memotong serat awal secara kimiawi sehingga menjadi lebih pendek tanpa harus melalui proses grinding. Hidrolisis fibril menghasilkan produk yang berwarna merah kecokelatan (untuk HCl) dan cokelat kehitaman (untuk H2SO4) dengan
rendemen masing masing sebesar 65% dan 55% (Lampiran 2).
Pemasakan dengan larutan NaOH
(pulping) bertujuan memutuskan ikatan
antara lignin dan selulosa (ikatan
lignoselulosa). Selain itu, larutan NaOH akan mengurangi ikatan hidrogen di dalam molekul selulosa sehingga terjadi pembengkakan yang mengubah struktur dinding sel. Perubahan struktur dinding sel mengakibatkan larutnya hemiselulosa dan melemahnya ikatan antara selulosa dan lignin sehingga mempermudah reaksi delignifikasi (Achmadi 1990). Proses
pulping menghasilkan rendemen sebesar 70– 75% (Lampiran 2).
Proses delignifikasi menggunakan larutan hidrogen peroksida (H2O2) lebih optimum
dalam kondisi pH tinggi (basa). Hidrogen peroksida bereaksi dengan gugus karbonil lignin melalui serangkaian reaksi yang kompleks dengan mekanisme radikal. Anion perhidroksil (–OOH) adalah bahan aktif yang bereaksi dengan struktur karbonil pada lignin sehingga lignin terpecah dan larut dalam
larutan NaOH (Ulia 2007). Proses
delignifikasi menghasilkan rendemen sebesar 65–70% (Lampiran 2).
Parameter keberhasilan isolasi selulosa
adalah kadar α-selulosa dan kadar lignin.
Semakin tinggi kadar α-selulosa dan semakin rendah kadar lignin, kemurnian isolat selulosa semakin baik. Kadar α-selulosa setelah tahap isolasi mengalami peningkatan dan kadar
lignin mengalami penurunan untuk kedua metode hidrolisis. Untuk hidrolisis awal HCl,
kadar α-selulosa meningkat menjadi 86.79% dengan kadar lignin yang tersisa sebesar 0.37% dan rendemen 20%. Sementara untuk hidrolisis awal H2SO4, kadar α-selulosa
meningkat menjadi 57.60% dengan kadar lignin yang tersisa sebesar 0.68%, dan rendemen 15% (Tabel 1).
Tabel 1 Hasil isolasi selulosa serabut ampas sagu
Sampel dengan hidrolisis
Parameter (%)
Lignin α-Selulosa
Hemi selulosa
% Isolasi
H2SO4 0.68 57.60 34.98 15%
HCl 0.37 86.79 6.78 20%
Berdasarkan kadar α-selulosa dan kadar lignin yang dihasilkan, metode isolasi melalui
hidrolisis dengan HCl 3% memiliki
kemurnian lebih tinggi daripada dengan H2SO4. Secara fisik (bentuk dan tekstur) juga
menunjukkan selulosa hasil isolasi dengan hidrolisis HCl 3% lebih mirip dengan selulosa murni (Gambar 1).
(a) (b)
(c)
(d)
Gambar 1 selulosa hasil hidrolisis dengan HCl (a) , dengan H2SO4 (b), foto
SEM selulosa (a) (c), foto SEM selulosa (b) (d), perbesaran 50×.
5
spektrum FTIR selulosa dicirikan dengan serapan pada bilangan gelombang sekitar 3200–3600 cm-1 (ulur –OH), 2800–3200 cm-1 (ulur C-H), dan daerah sidik jari dengan puncak ganda pada daerah 1000–1100 cm-1.
Spektrum FTIR selulosa hasil isolasi
memperlihatkan serapan ulur –OH pada bilangan gelombang 3282.84 cm-1, serapan ulur C-H pada 2900.94 cm-1, dan serapan dengan puncak ganda pada 1018.41 cm-1.
Gambar 2 Spektrum FTIR selulosa murni (— ), selulosa hasil isolasi (hidrolisis HCl) (—), dan selulosa hasil isolasi (hidrolisis H2SO4) (—).
Mikroselulosa
Isolasi mikroselulosa dibuat dengan menghidrolisis selulosa dalam larutan HCl 2.5 N. Perlakuan ini bertujuan mendapatkan selulosa berukuran mikron. Ukuran yang jauh lebih kecil akan memperbesar luas permukaan
selulosa dan meningkatkan kekuatan ikatan hidrogennya (Ilindra & Dhake 2008). Hasil mikroselulosa sangat berpengaruh terhadap keberhasilan reaksi esterifikasi. Proses esterifikasi selulosa tanpa proses mikro memberikan produk ester yang menggumpal dengan warna kecokelatan dan derajat substitusi (DS) yang rendah (Lampiran 3).
Pembuktian hasil mikroselulosa pada penelitian ini dilakukan dengan analisis SEM
pada perbesaran 500×. Hasil SEM
menunjukkan ukuran diameter serat
mikroselulosa mencapai sekitar 20 µm untuk kedua jenis selulosa isolasi (hidrolisis awal HCl dan hidrolisis awal H2SO4) (Gambar 3).
Selulosa Benzoat
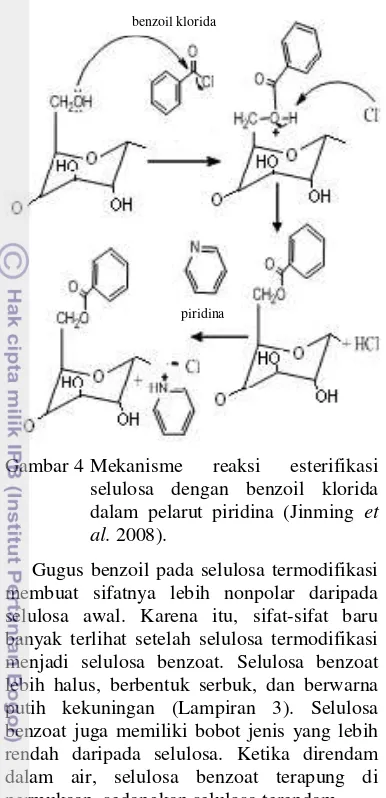
Selulosa benzoat disintesis melalui reaksi esterifikasi antara mikroselulosa hasil isolasi dan larutan benzoil klorida dalam pelarut piridina. Salah satu persyaratan reaksi esterifikasi selulosa adalah ionisasi gugus-gugus hidroksil pada selulosa. Setiap residu -D-glukopiranosa di dalam rantai selulosa mempunyai 3 gugus hidroksil reaktif, yaitu 2 hidroksil sekunder (HO-2 dan HO-3), dan 1 hidroksil primer (HO-6) (Sjostrom 1998) (Gambar 4).
Larutan piridina merupakan medium basa yang berfungsi sebagai katalis pengaktif gugus OH selulosa serta akan membentuk garam amonium dengan ion klorida yang
terbentuk selama proses esterifikasi
berlangsung. Pelarut piridina juga merupakan basa lemah tanpa gugus OH sehingga tidak reaktif terhadap gugus ester pada produk (Riswoko 2006).
Gambar 3 Foto SEM mikroselulosa: hidrolisis awal dengan HCl (a), hidrolisis awal dengan H2SO4
(b), perbesaran 500×.
6
Gambar 4 Mekanisme reaksi esterifikasi
selulosa dengan benzoil klorida dalam pelarut piridina (Jinming et al. 2008).
Gugus benzoil pada selulosa termodifikasi membuat sifatnya lebih nonpolar daripada selulosa awal. Karena itu, sifat-sifat baru banyak terlihat setelah selulosa termodifikasi menjadi selulosa benzoat. Selulosa benzoat lebih halus, berbentuk serbuk, dan berwarna putih kekuningan (Lampiran 3). Selulosa benzoat juga memiliki bobot jenis yang lebih rendah daripada selulosa. Ketika direndam dalam air, selulosa benzoat terapung di permukaan, sedangkan selulosa terendam.
Proses esterifikasi pada penelitian ini dilakukan dengan 3 variasi waktu, yaitu 4, 6, dan 8 jam dengan komposisi formula bahan dan suhu yang sama (65–70 ºC). Sebanyak 10
g selulosa akan menghasilkan produk
esterifikasi sekitar 20−25 g. Semakin lama
waktu esterifikasi, semakin banyak pula produk selulosa benzoat yang terbentuk (Tabel 2). Keberhasilan proses esterifikasi pada penelitian ini dilihat berdasarkan penampakan permukaan dengan SEM, analisis gugus fungsi dengan FTIR, dan pengukuran derajat substitusinya (DS).
Hasil foto SEM menunjukkan perbedaan yang sangat jelas antara permukaan selulosa dan permukaan selulosa benzoat. Perbesaran 500× memperlihatkan bahwa permukaan selulosa benzoat kasar seperti ada kumpulan serbuk yang menempel. Berbeda dengan permukaan selulosa hasil isolasi yang terlihat halus dan rata (Gambar 5).
(a) (b)
(c) (d)
Gambar 5 Hasil foto SEM: selulosa benzoat (a), selulosa (hidrolisis HCl) (b), selulosa benzoat (c), selulosa (hidrolisis H2SO4) (d), perbesaran
500×.
Tabel 2 Hasil proses sintesis selulosa benzoat dengan berbagai variasi waktu
Waktu (jam)
Proses hidrolisis awal
Bobot selulosa (g)
Volume benzoil klorida (mL)
Volume piridina (mL)
Bobot ester (g)
4
HCl
10.0122 70 100 20.5735
6 10.0215 70 100 23.0364
8 10.0017 70 100 25.6428
4
H2SO4
10.0021 70 100 21.9141
6 10.1003 70 100 22.5073
8 10.0118 70 100 23.0321
benzoil klorida
7
Gambar 6 Spektrum FTIR isolat selulosa (hidrolisis awal dengan HCl— dan H2SO4—), dan
selulosa benzoat (hidrolisis awal dengan HCl— dan H2SO4—).
Karakteristik serapan FTIR untuk
senyawaan ester meliputi serapan tunggal ulur karbonil C=O pada daerah 1690–1760 cm-1 dan serapan C–O pada daerah 1080–1300 cm
-1
(Jinming et al. 2008). Perubahan selulosa menjadi selulosa benzoat terlihat dari berkurang hingga tidak terlihatnya intensitas serapan ulur gugus hidroksil pada daerah 3000–3600 cm-1. Keberhasilan sintesis selulosa benzoat juga terlihat oleh adanya serapan C=O pada 1738 cm-1, serapan C–O pada 1157 cm-1, ulur C–H cincin benzena pada 3062 cm-1
,
1604 dan 1452 cm-1 untuk ulur aromatik C=C, serta serapan gugus C–H luar bidang benzena yang ramai di daerah kurang dari 1000 cm-1.Hasil spektrum FTIR memiliki kesesuaian
dengan DS selulosa benzoat. Derajat
substitusi (DS) menunjukkan banyaknya gugus OH yang tergantikan oleh gugus esternya (benzoil) selama proses esterifikasi berlangsung (Guimes 2008). Pengukuran DS dilakukan dengan menyabunkan contoh dalam larutan NaOH yang terstandardisasi. Jumlah NaOH yang terpakai diukur melalui titrasi asam-basa dengan HCl dan berbanding lurus dengan banyaknya gugus benzoil pada selulosa benzoat.
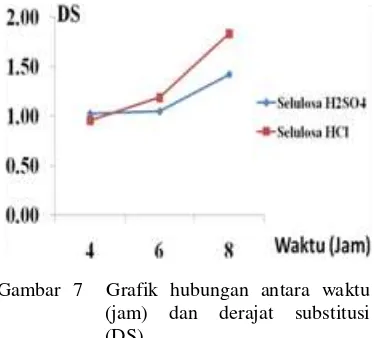
Hasil perhitungan menunjukkan, DS
tertinggi terdapat pada produk esterifikasi selulosa hasil hidrolisis awal dengan HCl pada waktu 8 jam. Sementara DS terendah terdapat pada produk esterifikasi selulosa hasil
hidrolisis awal dengan HCl pada waktu 4 jam. DS tertinggi bernilai 1.83 dan DS terendah 0.95 (Lampiran 5). Berdasarkan Gambar 7, dapat dikatakan bahwa semakin lama proses esterifikasi, semakin besar nilai DS-nya. Hal ini berlaku untuk kedua jenis selulosa benzoat (hidrolisis dengan HCl maupun dengan H2SO4). Selain itu, nilai DS selulosa benzoat
hasil hidrolisis awal dengan HCl lebih tinggi dibandingkan dengan hasil hidrolisis awal dengan H2SO4 untuk waktu esterifikasi yang
sama. Nilai DS yang dihasilkan belum mencapai nilai maksimum, yaitu 3.00. Oleh sebab itu, perlu dilakukan optimalisasi variasi waktu dan suhu untuk mencapai nilai DS mendekati 3.00.
8
Uji Daya Tahan Kelarutan
Produk selulosa benzoat dalam penelitian ini akan diaplikasikan sebagai fase diam. Syarat suatu zat dapat dijadikan sebagai fase diam di antaranya adalah tidak bereaksi (lembam) terhadap eluen/pelarut yang akan digunakan sebagai fase gerak. Oleh sebab itu, beberapa pelarut organik polar hingga nonpolar yang lazim dalam kromatografi diujikan untuk selulosa benzoat, yakni air, metanol, etanol, isopropanol, asetonitril, dan heksana. Larut atau tidaknya selulosa benzoat dalam suatu pelarut ditentukan berdasarkan selisih antara nilai indeks bias pelarut yang terkontaminasi dan pelarut murni, dengan refraktometer. Pelarut uji yang melarutkan selulosa benzoat adalah isopropanol. Pelarut terbaik yang paling sedikit dan bahkan tidak bereaksi sama sekali dengan fase diam adalah metanol (Gambar 8) dan heksana. Hal ini terlihat dari selisih indeks biasnya yang kecil (Lampiran 6). Pelarut terbaik digunakan sebagai eluen untuk aplikasi fase diam yang dikemas ke dalam kromatografi kolom.
Gambar 8 Foto ketahanan kelarutan selulosa benzoat dengan berbagai variasi waktu terhadap terhadap pelarut metanol.
Kromatografi Kolom
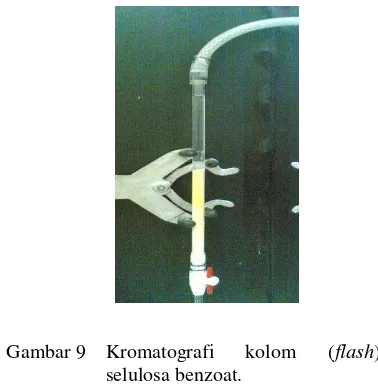
Kromatografi kolom dengan fase diam
selulosa benzoat diaplikasikan untuk
pemisahan xantorizol/kurkumin dari ekstrak temu lawak. Tinggi pengisi kolom yang digunakan ±15 cm dengan pemakaian sekitar 8.0 g selulosa benzoat, dikemas dengan cara
basah menggunakan eluen metanol.
Pengemasan cara basah dengan metanol dipilih karena pada saat dikemas secara basah dengan pelarut terbaik lainnya (heksana),
eluen tidak dapat turun meskipun
menggunakan pompa pendorong. Oleh karena itu, dalam kromatografi kolom ini digunakan
eluen tunggal metanol dengan proses
pengemasan dan elusi dibantu pompa
pendorong atau biasa dikenal dengan istilah kromatografi flash (Gambar 9). Selama proses elusi, tiap-tiap eluat ditampung dalam vial sebanyak 5 mL.
Gambar 9 Kromatografi kolom (flash)
selulosa benzoat.
Zat ekstraktif yang terkenal dalam ekstrak temu lawak adalah kurkumin dan xantorizol (Sidik et al. 1995). Xantorizol merupakan salah satu komponen aktif pada ekstrak temu lawak yang bersifat lebih nonpolar daripada kurkuminoid (Aguilar et al. 2001). Eluen metanol yang digunakan dalam kromatografi kolom ini sifatnya sangat polar dan mampu melarutkan seluruh zat ekstraktif dalam temu
lawak. Hasil uji ketahanan pelarut
menunjukkan bahwa fase diam (selulosa benzoat) yang dihasilkan memiliki sifat semipolar yang cenderung nonpolar. Hal ini juga dapat dijelaskan berdasarkan struktur kimia selulosa benzoat: gugus karbonil yang terstabilkan oleh gugus benzena dapat menurunkan sifat kepolaran.
Berdasarkan sifat kepolaran, seharusnya senyawaan kurkuminoid akan lebih dulu terelusi. Namun, selulosa benzoat merupakan fase diam kiral (CSP) yang interaksi
pemisahannya tidak berdasarkan sifat
kepolaran saja. Prinsip pemisahan fase diam ini berdasarkan interaksi retensi molekul yang berupa interaksi hidrofilik (ikatan hidrogen)
dan interaksi ikatan π–π antara selulosa benzoat, eluen, dan ekstrak temu lawak (Chen
et al. 2007). Selulosa benzoat memiliki ikatan
π–π pada gugus karbonil dan gugus benzena. Gugus benzoil dalam selulosa benzoat ini berperan penting dalam interaksi pemisahan.
9
interaksi gugus OH metanol dengan ekstrak lebih besar daripada ekstrak dengan selulosa benzoat. Secara garis besar, hasil KLT untuk fraksi 1–7 menunjukkan bahwa senyawa yang terelusi berturut-turut adalah senyawa xantorizol, bis-desmetoksikurkumin, dan desmetoksikurkumin.
Struktur senyawa xantorizol maupun senyawaan kurkuminoid sama-sama memiliki ikatan rangkap yang dapat berinteraksi π–π dengan selulosa benzoat. Ikatan π pada senyawa xantorizol lebih sedikit, maka terelusi lebih dahulu. Senyawa kurkuminoid juga memiliki ukuran sterik lebih besar sehingga lebih lambat terelusi (Gambar 10).
(a)
(b)
Gambar 10 Struktur kimia: xantorizol (a) dan kurkuminoid (b).
Kromatografi Lapis Tipis
Setiap fraksi yang diperoleh dari
kromatografi kolom diuji pemisahannya dengan KLT Silica Gel GF254. Eluen yang dipakai untuk KLT adalah eluen heksana:etil asetat (10:1) untuk melihat pemisahan
xantorizol dan eluen
kloroform:benzena:methanol (80:15:5) untuk melihat pemisahan kurkuminoid.
Hasil KLT menggunakan eluen
heksana:etil asetat (10:1), menunjukkan noda xantorizol berada pada fraksi 2 dan 3 di bawah penyinaran UV 254 nm. Rf untuk fraksi
2 dan 3 berturut-turut 0.519 dan 0.494 yang nilai Rf-nya berdekatan dengan nilai Rf standar
xantorizol dan ekstrak temu lawak, yaitu 0.519 dan 0.532 (Lampiran 7).
Dari hasil KLT menggunakan eluen
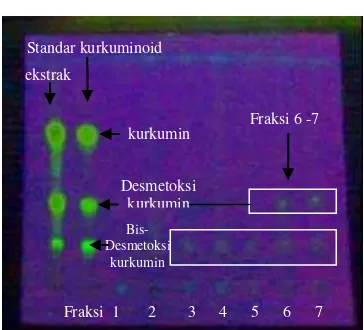
kloroform:benzena:metanol (80:15:5),
diketahui terdapat 3 noda pada standar kurkuminoid dan ekstrak kasar temu lawak.
Noda-noda tersebut merupakan noda
kurkumin, desmetoksikurkumin, dan bis-desmetoksikurkumin yang memiliki nilai Rf
secara berturut-turut 0.72, 0.45, dan 0.25. Hasil pemisahan fraksi-fraksi menunjukkan adanya noda bis-desmetoksikurkumin pada fraksi 2
–
7 dengan nilai Rf berturut-turut 0.27,0.3, 0.3, 0.31, dan 0.31, dan noda desmetoksikurkumin pada fraksi 6
–
7 dengan nilai Rf berturut-turut 0.45 dan 0.46 (Lampiran8). Berdasarkan hasil elusi KLT untuk
senyawa xantorizol dan kurkuminoid,
diketahui bahwa fase diam selulosa benzoat hasil sintesis dengan DS sebesar 1.83 dapat memisahkan zat aktif dari ekstrak kasar temu lawak.
Gambar 11 Hasil KLT fraksi kolom, standar xantorizol, dan ekstrak temu lawak dengan eluen heksana:etil asetat (10:1) pada sinar UV 254 nm.
Gambar 12 Hasil KLT ekstrak temu lawak, standar kurkuminoid, dan fraksi
tiap kolom dengan eluen
kloroform:benzena:metanol (80:15:5) pada sinar UV 366 nm.
Keterangan : R1 R2 Kurkumin -OCH3 -OCH3 Desmetoksikurkumi -OCH3 -H bis-desmetoksikurkumin -H -H
Fraksi 2 dan 3 Standar xantorizol dan ekstrak kurkumin
ekstrak
Standar kurkuminoid
Fraksi 1 2 3 4 5 6 7 Fraksi 6 -7 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
10
SIMPULAN
Isolasi selulosa serabut ampas sagu dengan hidrolisis awal HCl memiliki kemurnian dan rendemen yang tinggi. Proses esterifikasi tanpa proses pembuatan mikroselulosa sangat
berpengaruh terhadap warna menjadi
kecokelatan, produk menggumpal, dan derajat substitusi (DS) yang rendah terhadap selulosa benzoat.
Produk selulosa benzoat dengan DS tertinggi (1.83) memiliki ketahanan pelarut paling baik dalam metanol dan heksana. Produk esterifikasi yang berupa selulosa benzoat diaplikasikan ke dalam kromatografi
kolom bertekanan (flash) dan dapat
memisahkan komponen xantorizol pada fraksi 2, serta komponen bis-desmetoksikurkumin pada fraksi 3
–
5 dari komponen-komponen ekstrak temu lawak lainnya dengan eluen metanol.SARAN
Perlu penyalutan dengan 3-aminopropil trietoksisilana terhadap fase diam selulosa benzoat untuk imobilisasi. Perlu dilakukan optimalisasi reaksi esterifikasi serabut ampas sagu menggunakan benzoil klorida dalam pelarut piridina.
DAFTAR PUSTAKA
Achmadi SS. 1990. Kimia Kayu. Bogor: IPB Pr.
Aguilar MI, Guillermo D, Maria LV. 2001. New bioactive derivatives of xanthorrizol.
J Mex Chem Soc 45:56-59.
Akmar PF, Kennedy JF. 2001. The potential of oil and sago palm trunk wastes as carbohydrate resources. Wood Sci Technol
35:467-473.
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medicinal plants: Antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci 55: 230-235.
Bobleter O. 1994. Hydrothermal degradation of polymers derived from plants. Prog Polym Sci 19:797-841.
Chen X, Chio Y, Okamoto Y. 2007. Polysaccharide derivatives as useful chiral stationary phases in high-performance
liquid chromatography. Pure Appl Chem
79:1561-1573.
Darusman LK, Djauhari E, Nurcholis W. 2006. Kandungan xantorizol temu lawak (Curcuma xanthorrizha Roxb.) pada berbagai cara budi daya dan masa tanam.
Di dalam: Peranan Kimia Memacu
Kemajuan Industri. Prosiding Seminar Nasional Himpunan Kimia Indonesia. Bogor, 12 Sep 2006. Bogor: Auditorium Rektorat IPB Darmaga. hlm 279-287.
[FAO] Food and Agricultural Organization.
Compendium of Food Aditive
Specification. Adendum 5 [berkala
sambung jaring] http://www.fao.org/
docrep/w6355e/w6355e0l.htm.
Guimes RF et al. 2008. Synthesis and characterization of cellulose acetate
produced from recycled newspaper.
Carbohydr Polym 73:74-82.
Huang G, Jeffrey XS, Langrish TAG. 2007. NH4OH–KOH pulping mechanisms and
kinetics of rice straw. Biores Technol
98:1218-1223
Hwang JK, penemu; LG Household & Healthcare. 24 Feb 2004. Antibacterial composition having xanthorhizol. US patent 6 696 404.
Ilindra A, Dhake JD. 2008. Microcrystalline cellulose bagasse and rice straw. Indian Chem Technol 15:497-499.
Irfana L. 2010. Asetilasi selulosa ampas sagu dengan katalis I2 dan aplikasinya sebagai
fase diam kromatografi kolom [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Jinming Z et al. 2008. Synthesis of cellulose benzoates under homogenous conditions in an ionic liquid.Cellulose 16:299-308.
Kiat LJ. 2006. Preparation and
characterization of carboxymethyl sago
waste and it’s hydrogel [tesis]. Malaysia: Master of Science, Universiti Putra Malaysia.
Kumaran S, Sastry CA, Vikineswary S. 1997. Laccase, cellulase, and xylanase activities during growth of Pleurotus sajor-caju on
sago hampas. World J Microbiol
Biotechnol 13:43-49.
Matitaputty PR, Alfons JB. 2006. Inovasi
11
untuk ternak. Di dalam: Prosiding
Lokakarya Sagu dalam Revitalisasi Pertanian Maluku; Ambon, 29-31 Mei
2006. Ambon: Fakultas Pertanian
Universitas Pattimura. hlm 100-106.
Pushpamalar V, Langford SJ, Ahmad M, Lim YY. 2006. Optimization of reaction conditions for preparing carboxymethyl cellulose from sago waste. Carbohydr Polym 64:312-318.
Riswoko A. 2006. Pembuatan selulosa ester dan karakterisasi sifat polimer kristal cair.
Akta Kimia Indones 1:79-86.
Santi. 2006. Onggok sagu termodifikasi sebagai fase diam dalam kromatografi
kolom [skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sidik, Moelyono MW, Mutadi A. 1995. Temu lawak (Curcuma xanthorriza Roxb.). Jakarta: Phyto Medika.
Singhal RS et al. 2008. Industrial production, processing, and utilization of sago palm-derived products. Carbohydr Polym 72:1-20.
Sjostrom E. 1998. Kimia Kayu, Dasar-dasar dan Penggunaan Edisi 2. Sastrohamidjojo
H, penerjemah; Yogyakarta: UGM Pr.
Terjemahan dari: Wood Chemistry,
Fundamentals and Applications Second Edition.
Sun RC, Jones GL, Tomkinson J, Bolton J. 1999. Fractional isolation and partial
characterization of non-starch
polysaccharides and lignin from sago pith.
Industrial Crops and Products 19:211-220.
Susanto AN. 2006. Potensi dan perhitungan luas lahan sagu untuk perencanaan ketahanan pengan spesifik lokasi di Provinsi Maluku. Di dalam: Prosiding Lokakarya Sagu dalam Revitalisasi Pertanian Maluku; Ambon 29-31 Mei
2006. Ambon: Fakultas Pertanian
Universitas Pattimura. hlm 173-184.
Syakir M, Bintoro MH, Agusta H. 2009. Pengaruh ampas sagu dan kompos terhadap produktivitas lada perdu. J Litri
4:168-173.
Ulia H. 2007. Alternatif penggunaan hidrogen peroksida pada tahap akhir proses pemutihan pulp. [tesis]. Medan:
Fakultas Teknik Kimia, Universitas
12
13
Lampiran 1 Bagan alir penelitian
Pencirian ester
selulosa
- FTIR
-SEM
- ketahanan
terhadap pelarut
Hidrolisis awal (HCl
dan H
2SO
4)
Serabut ampas
sagu
Proses
pulping
selulosa
Fraksi-fraksi dari
berbagai kolom
Perhitungan
R
fIsolasi
mikroselulosa
Kromatografi kolom
Metanol, heksana
KLT
(pelat gel silika)
Esterifikasi selulosa
dengan benzoil klorida
Ester selulosa
Ekstrak temu
lawak
14
Lampiran 2 Hasil analisis proksimat awal, rendemen tiap tahap isolasi, dan
rendemen isolasi mikroselulosa.
Proksimat awal
Sampel
Parameter
Lignin (%) Holoselulosa
(%)
α-Selulosa (%) Serabut
ampas sagu 31.09 70.63 41.47
Non-serabut 12.02 32.39 14.23
Hidrolisis awal
Jenis Hidrolisis
Larutan asam Bobot
sampel (g)
Suhu (oC)
Waktu (menit) Bobot hasil (g) Rendemen (%) Konsentrasi (%) Volume (mL)
H2SO4 40 1000 200 27 90 110 55
HCl 3 1000 50 85 90 32–34 65
Pulping
Hidrolisis awal Bobot hasil hidrolisis Volume NaOH 20% (mL)Suhu (oC) Waktu (menit)
Rerata hasil (g)
Rendemen (%)
H2SO4 50 1000 80 120 34–36 70
HCl 50 1000 80 120 37–38 75
Delignifikasi
Hidrolisis awal Bobot hasil pulping (g) VolumeH2O2 (mL) Suhu ( o
C) Waktu
(menit)
Rerata hasil (g)
Rendemen (%)
H2SO4 20 500 70 I. 120
II. 180 III. 180
11–13 60
HCl 20 500 70 13–15 70
Isolasi mikroselulosa
Hidrolisis awal Bobot selulosa isolasi (g) Volume HCl 2.5 N (mL) Suhu (oC)Waktu (menit) Rerata hasil (g) Rendemen (%)
H2SO4 50 1000 85 35 28–33 60
15
Lampiran 3 Selulosa benzoat tanpa proses isolasi mikroselulosa (a), selulosa
benzoat hidrolisis HCl/H
2SO
4(4, 6, dan 8) jam (b), dan selulosa
benzoat kering hasil esterifikasi (c).
(a)
(b)
(c)
a b c
HCl
H2SO4
4 6 8
4 6 8
16
Lampiran 4
Hasil standardisasi HCl dan standardisasi NaOH.
Standardisasi HCl dengan Na
2BO
4•10H
2O (boraks)
Pembuatan larutan boraks
Bobot (g)
= 4.7820
Volume (mL)
= 50
BE (g/ek)
= 190.6825
[Boraks] (N)
= 0.5016
Penentuan [HCl] dengan boraks 0.5016 N
Ulangan
[Boraks]
(N)
Vol. Boraks
(mL)
Vol. HCl
(mL)
[HCl]
(N)
1
0.5016
10.00
9.75
0.5145
2
0.5016
10.00
9.70
0.5171
3
0.5016
10.00
9.70
0.5171
Rerata [HCl] (N)
0.5162
Standardisasi NaOH dengan H
2C
2O
4•2H
2O (asam oksalat)
Pembuatan larutan asam oksalat
Bobot (g)
= 1.6905
Volume (mL)
= 50
BE (g/ek)
= 63.035
[Oksalat] (N)
= 0.5364
Penentuan [Oksalat] dengan NaOH 0.5364 N
Ulangan
[Oksalat]
(N)
Vol.
Oksalat
(mL)
Vol.
NaOH
(mL)
[NaOH]
(N)
1
0.5364
10.00
10.60
0.5060
2
0.5364
10.00
10.60
0.5060
3
0.5364
10.00
10.70
0.5013
17
Lampiran 5
Derajat esterifikasi dan perhitungannya.
Sampel
Volume NaOH 0.5044 N (mL)
Volume HCl 0.5162 N
terpakai (mL)
Bobot sampel (g)
Kadar
Benzoil (%) DS Ditambahkan Titrasi
Sea-4 40 0.5 25.8 1.0008 40.02716 1.0232
Sea-6 40 0.5 25.7 1.0012 40.55253 1.0457
Sea-8 40 0.7 24.5 1.0006 48.13567 1.4194
Seb-4 40 0.4 26 1.0020 38.36880 0.9549
Seb-6 40 0.9 25.5 1.0031 43.66832 1.1873
Seb-8 40 0.8 23.4 1.0008 54.61259 1.8354
Blangko 40 0.1 32.8
Keterangan
Sea: selulosa benzoat dengan hidrolisis HCl Seb: selulosa benzoat dengan hidrolisis H2SO4
dengan
A
= volume NaOH untuk titrasi contoh (mL),
B
= volume NaOH untuk titrasi blangko (mL),
C
= volume HCl untuk titrasi contoh (mL),
F
= 10.5 untuk kadar benzoil,
D
= volume HCl untuk titrasi blangko (mL),
Na
= normalitas HCl,
Nb
= normalitas NaOH, dan
W
= bobot kering contoh (g).
Sementara besarnya DS dapat dihitung dari nilai KB menggunakan rumus
Contoh perhitungan Seb-3
�� % = 32.8−23.4 0.5162 + 0.8−0.1 0.5044 × 10.5
1.0008 = 54.61259
��= 162 × 54.61259
18
Lampiran 6 Daya tahan kelarutan selulosa benzoat
.Sampel
Indeks bias pelarut
Air selisih Metanol selisih Etanol selisish
Sea-1 1.3329 0.0004 1.3279 0.0002 1.3597 0.0008
Sea-2 1.3329 0.0004 1.3278 0.0001 1.3599 0.0010
Sea-3 1.3328 0.0003 1.3278 0.0001 1.3599 0.0010
Seb-1 1.3329 0.0004 1.3278 0.0001 1.3599 0.0010
Seb-2 1.3330 0.0005 1.3278 0.0001 1.3599 0.0010
Seb-3 1.3327 0.0002 1.3277 0 1.3601 0.0012
Blangko 1.3325 1.3277 1.3589
Asetonitril selisih Isopropanol selisih Heksana selisih
Sea-1 1.3425 0.0002 1.3875 0.012 1.378 0.0001
Sea-2 1.3427 0.0004 1.3877 0.0122 1.3785 0.0004
Sea-3 1.3426 0.0003 1.3870 0.0115 1.3783 0.0002
Seb-1 1.3428 0.0005 1.3873 0.0118 1.378 0.0001
Seb-2 1.3425 0.0002 1.3875 0.012 1.3782 0.0001
Seb-3 1.3425 0.0002 1.3871 0.0116 1.3782 0.0001
19
Lampiran 7
Rf
xantorizol pada eluen heksana:etil asetat (10:1)
Perhitungan
R
f=
Rf
xantorizol standar =
= 0.519
Rf
xantorizol ekstrak = 0.532
R
fxantorizol fraksi 2 = 0.519
R
fxantorizol fraksi 3 = 0.494
7,9 cm
4,1 cm
3,9 cm
4,1 cm
4,2 cm
Jarak noda ke titik awal elusi
Panjang elusi eluen
Fraksi 2 Fraksi 3
Panjang elusi
Standar Ekstra
k
20