SEBAGAI BIOMATERIAL SCAFFOLD
KULTUR SEL
I WAYAN DARYA KARTIKA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Karakterisasi dan Biokompatibilitas Kolagen Gelembung Renang Ikan Cunang (Muraenesox talabon) sebagai Biomaterial Scaffold Kultur Sel” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2017
I Wayan Darya Kartika
RINGKASAN
I WAYAN DARYA KARTIKA. Karakterisasi dan Biokompatibilitas Kolagen Gelembung Renang Ikan Cunang (Muraenesox talabon) sebagai Biomaterial
Scaffold Kultur Sel. Dibimbing oleh WINI TRILAKSANI dan I KETUT MUDITE ADNYANE
Produksi perikanan Indonesia terus meningkat setiap tahunnya dan menghasilkan limbah perikanan pasca pengolahan, salah satunya gelembung renang. Gelembung renang mempunyai sifat fungsional yang unik karena potensi kandungan kolagen yang cukup tinggi sehingga dapat menjadi alternatif untuk memenuhi kebutuhan pangan fungsional dan kosmetik sekaligus mengatasi kontroversi keamanan produk kolagen di kalangan keyakinan dan etnis tertentu, serta memiliki permintaan yang tinggi untuk bidang medis, terutama dalam bidang kultur sel. Proses isolasi dengan berbagai modifikasi dilakukan untuk memperoleh kolagen dengan rendemen dan kualitas yang tinggi, sekaligus memenuhi karakteristik biomaterial scaffold kultur sel. Tujuan penelitian ini adalah mendapatkan kolagen dengan karakteristik yang sesuai untuk kultur sel melalui identifikasi bioavailabilitas bahan baku, proses eliminasi protein nonkolagen dan modifikasi proses ekstraksi kolagen berbasis limbah gelembung renang ikan cunang (Muraenesox talabon).
Limbah gelembung renang ikan cunang (Muraenesox talabon) memiliki proporsi 0.26% dari seluruh bobot ikan (kurang dari 2% dari seluruh limbah non-daging) dengan kandungan protein 93.87% (basis kering). Bioavailabilitas kolagen terletak pada jaringan membran internal (tunica interna) dengan dominasi komposisi asam amino glisina, prolina, dan alanina sebagai penciri eksistensi kolagen. Perlakuan pretreatment dengan larutan NaOH 0.10 M selama 12 jam merupakan proses yang efektif dalam menghilangkan protein nonkolagen gelembung renang ikan cunang karena dapat melarutkan protein nonkolagen tanpa kehilangan protein kolagen secara signifikan.
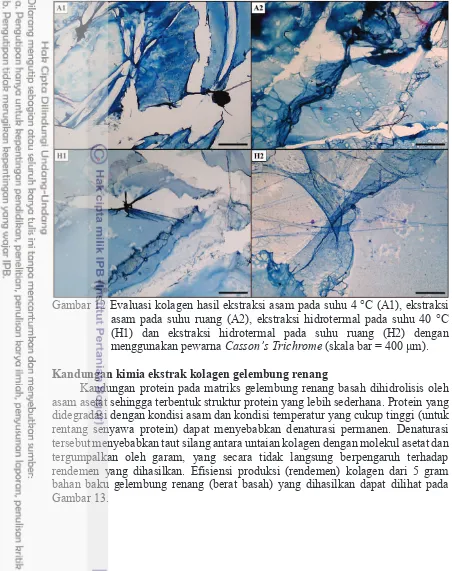
Proses ekstraksi asam maupun ekstraksi hidrotermal menghasilkan kolagen, yang teridentifikasi sebagai kolagen tipe I dengan rendemen masing-masing mencapai 2.73-6.40% untuk ekstraksi asam dan 26.20-43.33% untuk ekstraksi hidrotermal. Kandungan hidroksiprolin untuk seluruh perlakuan mencapai 71.99-85.49 mg/100 mg yang mengindikasikan kemurnian ekstrak kolagen diatas 70%. Sediaan kolagen gelembung renang dari seluruh proses ekstraksi menunjukkan eksistensi gugus amida A, amida B, amida I, II dan III dengan rasio serapan kolagen dan struktur heliks. Komposisi asam amino, asam imino, stabilitas termal, derajat kelarutan dan derajat pengembangan terbaik dihasilkan oleh kolagen hasil ekstraksi asam 4 °C (A1) dan ekstraksi hidrotermal pada suhu ruang (H2).
Biokompatibilitas kolagen gelembung renang terpilih (A1 dan H2) pada proses kultur sel sebagai substrat pelekatan sel menunjukkan tingkat inhibisi dibawah 40%. Efek sitoproliferatif tertinggi ditunjukkan oleh viabilitas sel tertinggi pada aplikasi kolagen A1 1200 ppm yaitu lebih dari 110%.
SUMMARY
I WAYAN DARYA KARTIKA. Characterization and Biocompatibility of Yellow-pike Conger (Muraenesox talabon) Swim Bladder Collagen as Cell Culture Scaffold Biomaterial. Supervised by WINI TRILAKSANI and I KETUT MUDITE ADNYANE
Indonesian fisheries production increase every year and produces fisheries waste, one of them is swim bladder. Swim bladder has unique functional properties due to the high potency of collagen content, therefore can be utilized as an alternative in fullfiling the needs as functional food and cosmetics demand for the biomedical fields, especially in application of cell culture technology as well as overcoming the product safety problem and controversy in certain etnic group. The collagen isolation within various modifications were conducted to produce collagen with high yield, good quality, and fullfiling the suitable biomaterial scaffold characteristics for cell culture. The purpose of this study was to get collagen with suitable characteristics for cell culture through the bioavailability identification of raw materials, non-collagenous substances elimination processing and modification of extraction processing based on the swim bladder waste of yellow-pike conger (Muraenesox talabon)
The swim bladder waste of yellow-pike conger (Muraenesox talabon) had a proportion of 0.26% of the total weight of fish (less than 2% of all non-meat waste) with 93.87% protein content (dry base). Bioavailability of collagen tissue located in the internal membrane (tunica interna) with a predominance of glycine, proline and alanine as a marker of the collagen existence. Pretreatment with 0.10 M NaOH solution for 12 hours was the effective process to remove non-collagenous proteins of yellow-pike conger swim bladder.
Both the acid extraction and hydrothermal extraction produced collagen, which was identified as type I collagen with a yield reached 2.73 to 6.40% for acid extraction and from 26.20 to 43.33% for hydrothermal extraction, respectively. The hydroxyproline content for all treatments reached 71.99 to 85.49 mg / 100 mg indicating that collagen purity was above 70%. Swim bladder collagen extract of the entire extraction process demonstrated the existence amide group A, B amide, amide I, II and III with the absorption ratio and the helical structure of collagen. The best composition of amino acids, imino acids, thermal stability, relative solubility and swelling degree produced by collagen with acid extraction at 4 °C (A1) and with hydrothermal extraction at room temperature (H2).
Biocompatibility of the swim bladder collagen candidate (A1 and H2) in cell culture processes as cell adhesion substrates showed inhibition rate below 40%. The highest cytoproliferative effects demonstrated by the highest cell viability on the application of collagen A1 1200 ppm of more than 110%.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KARAKTERISASI DAN BIOKOMPATIBILITAS KOLAGEN
GELEMBUNG RENANG IKAN CUNANG (Muraenesox talabon)
SEBAGAI BIOMATERIAL SCAFFOLD KULTUR SEL
I WAYAN DARYA KARTIKA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tesis: Dr. Tati Nurhayati, SPi, MSi
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, Ida Sang Hyang Widhi Waça atas segala asung kertha wara nugraha-Nya sehingga penulis dapat menyelesaikan tesis dengan judul “Karakterisasi dan Biokompatibilitas Kolagen Gelembung Renang Ikan Cunang (Muraenesox talabon) sebagai Biomaterial Scaffold Kultur Sel”. Penelitian ini didanai oleh Lembaga Pengelola Dana Pendidikan (LPDP) melalui Beasiswa Penelitian Indonesia Tesis/Disertasi. Tesis ini merupakan salah satu syarat untuk mendapatkan gelar Magister Sains di Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih yang setulusnya kepada:
1) Dr Wini Trilaksani, MSc selaku ketua komisi pembimbing dan sekaligus Ketua Program Studi Pascasarjana Teknologi Hasil Perairan yang memberikan banyak bantuan serta pengarahan selama proses penelitian dan penulis tesis ini.
2) Dr drh I Ketut Mudite Adnyane, MSi selaku komisi pembimbing yang telah membimbing dan memberikan pengarahan tentang dunia veteriner selama proses penelitian dan penulisan tesis ini.
3) Dr Eng Uju, SPi, MSi selaku Ketua Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB
4) Dr Asadatun Abdullah, MSM, MSi selaku perwakilan gugus kendali mutu atas kesediaan waktu dalam mengoreksi draft tesis sekaligus memberi masukan yang konstruktif kepada penulis.
5) Dr Tati Nurhayati, SPi, MSi selaku penguji luar komisi atas kesediaan waktu untuk mengkaji, mengoreksi dan memberi masukan terhadap tesis ini. 6) Lembaga Pengelola Dana Pendidikan (LPDP) yang telah memberi dukungan
finansial melalui Beasiswa Pendidikan Indonesia Tesis/Disertasi.
7) Keluarga besar penulis, ayah I Ketut Sudarwa dan ibu Made Aryawati, serta adik I Made Puja Raditya serta seluruh keluarga atas doa, kasih sayang, semangat dan dukungan selama penulis menempuh studi.
8) Teman-teman pascasarjana THP 2014, inspirator sekaligus motivator yang luar biasa Ayu Christien Rahaweman yang telah banyak memberikan semangat dan bantuan kepada penulis serta seluruh sahabat yang selalu mendoakan dan membantu penulis.
9) Pihak-pihak terkait yang telah membantu dalam penelitian, yang tidak dapat penulis sebutkan namanya satu per satu
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2017
I Wayan Darya Kartika
DAFTAR ISI
Rancangan Percobaan dan Analisis Data 16
3. HASIL DAN PEMBAHASAN 21
Karakteristik Gelembung Renang Ikan Cunang (Muraenesox talabon) dan
Ketersediaan Kolagen 21
Karakteristik proporsi dan proksimat gelembung renang 21 Karakteristik morfologis gelembung renang 24
Kandungan asam amino gelembung renang 29
Penghilangan Protein Nonkolagen dari Gelembung Renang 30 Pengaruh konsentrasi dan durasi pretreatment 31
Kombinasi pretreatment terbaik 32
Profil Kolagen Gelembung Renang Hasil Ekstraksi Asam dan Hidrotermal 32 Persebaran molekul kolagen gelembung renang 33 Kandungan kimia ekstrak kolagen gelembung renang 34 Rendemen dan kemurnian kolagen gelembung renang 35 Karakteristik Fisikokimia Kolagen Gelembung Renang 37 Spektrum gugus fungsi kolagen gelembung renang 38 Bobot molekul kolagen gelembung renang 41 Komposisi asam amino kolagen gelembung renang 43 Profil termodinamik kolagen gelembung renang 46 Karakteristik Sediaan Kolagen Gelembung Renang untuk Kultur Sel 48 Derajat kelarutan kolagen gelembung renang 49 Derajat pengembangan kolagen gelembung renang 50 Biokompatibilitas Kolagen Gelembung Renang pada Kultur Sel Epitel 51
Kondisi kultur sel epitel 51
Efek coating sediaan kolagen terhadap pertumbuhan sel Vero 52
02 Perlakuan kombinasi konsentrasi NaOH dan waktu perendaman 16
03 Analisis ragam (ANOVA) 20
04 Kandungan kimia (basis basah) gelembung renang ikan cunang (basah, kering), tuna (Thunnus albacares), dan patin (Pangasiussp.) 23 05 Kandungan kimia (basis kering) gelembung renang ikan cunang (basah,
kering), tuna (Thunnus albacares), dan patin (Pangasiussp.) 23 06 Rendemen dan kadar hidroksiprolina kolagen gelembung renang yang
diekstrak dengan metode berbeda* 36
07 Posisi puncak serapan spektrum FTIR kolagen gelembung renang yang
diekstrak dengan metode berbeda* 38
08 Rasio serapan gugus amida I dan amida III kolagen kolagen gelembung renang yang diekstrak dengan metode berbeda* terhadap serapan kolagen
dan gelatin 41
09 Komposisi kolagen (residu/1000 residu) kolagen gelembung renang yang
diekstrak dengan metode berbeda* 44
10 Hasil analisis sifat termal kolagen gelembung renang yang diekstrak dengan
metode berbeda* 47
DAFTAR GAMBAR
01 Jenis-jenis gelembung renang ikan (a) dan gelembung renang ikan cunang (b); lingkaran merah menunjukkan jenis gelembung renang
spesies ikan cunang. 5
02 Skema penelitian secara keseluruhan (tahap I, II, III, IV dan V). 6 03 Prosedur tissue processing (Kiernan 1999). 11 04 Diagram proses analisis data kuantitatif 19 05 Gelembung renang ikan cunang dipisahkan dari ikan (a), gelembung
renang (b), kumpulan limbah gelembung renang (c). 21 06 Proporsi gelembung renang terhadap (a) seluruh bagian dan (b) limbah
ikan cunang Muraenesox talabon( kepala, jeroan, gelembung
renang, kulit, tulang, daging). 22
07 Struktur morfologis gelembung renang ikan cunang
(Muraenesox talabon) keseluruhan (A) dan sebagian kecil (B). Jaringan otot (JO), jaringan kolagen (JK), dan serabut kolagen (SK); Pewarnaan
Casson’s Trichrome; Skala bar = 400 m. 25
08 Ilustrasi mekanisme reaksi histokimia pewarna Hematoxylin-Besi dan
Casson’s Trichrome(menggunakan model substrat-auxachrome
09 Reaksi histokimia kolagen dengan asam fosfotungtat dan chromogen (dye) pewarna Trichrome pada proses pewarnaan jaringan gelembung renang ikan cunang (Muraenesox talabon). 28 10 Komposisi asam amino per 1 gram (berat basah) limbah gelembung
renang ikan cunang (Muraenesox talabon). 29 11 Konsentrasi protein nonkolagen terlarut larutan NaOH. Konsentrasi
NaOH 0.05 M; 0.10 M; dan 0.15 M. Durasi perendaman
2 jam selama 24 jam (12 siklus). 31
12 Evaluasi kolagen hasil ekstraksi asam pada suhu 4 °C (A1), ekstraksi asam pada suhu ruang (A2), ekstraksi hidrotermal pada suhu 40 °C (H1) dan ekstraksi hidrotermal pada suhu ruang (H2) dengan menggunakan pewarna Casson’s Trichrome (skala bar = 400 m). 34
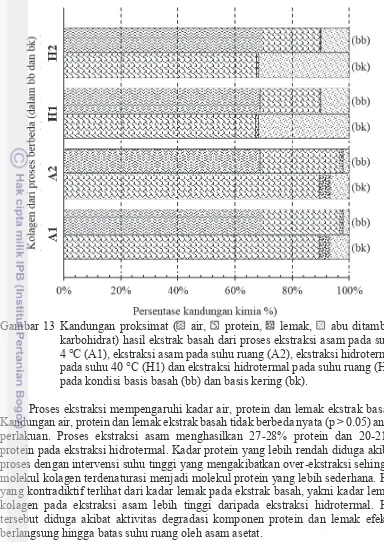
13 Kandungan proksimat ( air, protein, lemak, abu ditambah karbohidrat) hasil ekstrak basah dari proses ekstraksi asam pada suhu 4 °C (A1), ekstraksi asam pada suhu ruang (A2), ekstraksi hidrotermal pada suhu 40 °C (H1) dan ekstraksi hidrotermal pada suhu ruang (H2) pada kondisi basis basah (bb) dan basis kering (bk). 35 14 Spektrum serapan FTIR kolagen dengan proses ekstraksi asam pada
suhu 4 °C (A1 ―) dan ekstraksi asam pada suhu ruang (A2 ----). 39 15 Spektrum serapan FTIR kolagen dengan proses ekstraksi hidrotermal
pada suhu 40 °C (H1 ―) dan ekstraksi hidrotermal pada suhu ruang
(H2 ----). 39
16 Pola pita protein kolagen hasil ekstraksi asam pada suhu 4 °C (A1), ekstraksi asam pada suhu ruang (A2), ekstraksi hidrotermal pada suhu 40 °C (H1) dan ekstraksi hidrotermal pada suhu ruang (H2) dalam
SDS-PAGE 10% akrilamid. 42
17 Proporsi asam amino glisina, alanina, prolina, dan hidroksiprolina (%) pada kolagen hasil ekstraksi asam pada suhu 4 °C ( A1), ekstraksi asam pada suhu ruang ( A2), ekstraksi hidrotermal pada suhu 40 °C ( H1) dan ekstraksi hidrotermal pada suhu ruang ( H2). 45 18 Komposisi asam imino dan sekuens triplet glisina (G), prolina (P), dan
alanina (A)/hidroksiprolina (O) dari kolagen hasil ekstraksi asam pada suhu 4 °C ( A1), ekstraksi asam pada suhu ruang ( A2), ekstraksi hidrotermal pada suhu 40 °C ( H1) dan ekstraksi hidrotermal pada
suhu ruang ( H2). 46
19 Kelarutan relatif (%) kolagen hasil ekstraksi asam dan hidrotermal dari gelembung renang ikan cunang dalam 0.05 asam asetat pada
pH berbeda (n=3) 49
20 Derajat pengembangan kolagen dari seluruh proses ekstraksi (kandidat
vs non-kandidat) 51
21 Inhibisi (%) sel Vero setelah diberi perlakuan coating matriks kolagen hasil ekstraksi asam pada suhu 4 °C (A1), ekstraksi asam pada suhu ruang (A2), ekstraksi hidrotermal pada suhu 40 °C (H1) dan ekstraksi hidrotermal pada suhu ruang (H2) dengan beberapa konsentrasi
22 Viabilitas sel Vero setelah diberi perlakuan coating matriks kolagen hasil ekstraksi asam pada suhu 4 °C (A1), ekstraksi asam pada suhu ruang (A2), ekstraksi hidrotermal pada suhu 40 °C (H1) dan ekstraksi hidrotermal pada suhu ruang (H2) dengan beberapa konsentrasi
( 1200 ppm, 600 ppm, 300 ppm, 150 ppm dan 75 ppm). 54 23 Morfologi sel Vero tanpa coating kolagen (a) dan dengan coating
kolagen hasil ekstraksi asam pada suhu 4 °C (A1) (b), ekstraksi asam pada suhu ruang (A2) (c), ekstraksi hidrotermal pada suhu 40 °C (H1) (d) dan ekstraksi hidrotermal pada suhu ruang (H2) (e) pada konsentrasi
600 ppm. 54
DAFTAR LAMPIRAN 0
01 Analisis data (deskriptif, uji asumsi dan hipotesis) parameter dari
hasil percobaan 66
02 Data proporsi bagian tubuh ikan cunang (Muraenesox talabon) 67 03 Uji korelasi dan Uji T-sampel berpasangan data kandungan kimia
(basis basah) gelembung renang (b) dan kering (k) ikan cunang 68 04 Uji korelasi dan Uji T-sampel berpasangan data kandungan kimia
(basis kering) gelembung renang basah (b) dan kering (k) ikan cunang 69 05 Kandungan, persentase dan residu asam amino gelembung renang ikan
cunang (Muraenesox talabon) per 0,1 gram bahan baku (berat basah) 70 06 Penentuan absorbansi Bovine Serum Albumin (BSA) berbagai
konsentrasi sebagai kurva standar protein terlarut 71 07 Absorbansi protein terlarut (uji Bradford) NaOH 0.05 M; 0.10 M dan
0.15 M setiap 2 jam selama 24 jam 72
08 Konsentrasi protein terlarut larutan NaOH 0.05 M; 0.10 M dan
0.15 M setiap 2 jam selama 24 jam (mL) 72 09 Analisis sidik ragam (ANOVA) in Time kadar protein (nonkolagen)
terlarut 73 10 Penentuan nilai Rf dari jejak pita protein SDS-PAGE sebagai
kurva standar bobot molekul protein 75
11 Bobot molekul (BM) protein kolagen (SDS-PAGE) menurut
kurva standar 76
12 Analisis proksimat ekstrak kolagen basah (basis basah dan basis kering) 76 13 Penentuan emisi 4-L-hidroksiprolin berbagai konsentrasi sebagai kurva
standar hidroksiprolin 77
14 Komposisi asam amino kolagen hasil ekstraksi asam dan ekstraksi
hidrotermal per 1 gram sampel 78
15 Data absorbansi, persentase penghambatan dan tabel probit
coating kolagen 79
16 Kurva inhibisi coating kolagen terhadap sel Vero dan contoh
1.
PENDAHULUAN
Latar Belakang
Potensi sumber daya ikan Indonesia sangat melimpah, namun pemanfaatan selama ini hanya sebatas daging (fillet) untuk dikonsumsi. Proporsi fillet ikan mencapai 37-40% dari seluruh bobot total ikan (Kittiphattanabawon et al. 2010). Bagian selain daging mencapai 60-63% dan merupakan produk hasil samping dengan nilai komersial yang rendah. Produksi perikanan pada tahun 2014 mencapai 20.72 juta ton, terdiri dari produksi perikanan tangkap sebesar 6.72 juta ton dan produksi perikanan budidaya sebesar 14.52 juta ton (termasuk rumput laut) dengan nilai peningkatan 8-10 juta ton/tahun (KKP 2015). Produksi perikanan tangkap diprediksi mencapai kisaran 20 juta ton pada tahun 2016 (KKP 2015) dengan 60-63% potensi limbah mencapai sekitar 12 juta ton. Limbah perikanan tersebut berupa kepala, kulit, tulang, sirip, serpihan daging dan isi perut ikan, disamping itu terdapat pula limbah ikan berkualitas rendah (second grade) dari proses pengolahan industri (Muyoga et al. 2004a). Sisik dan perut ikan merupakan 2% dari seluruh limbah ikan yang belum termanfaatkan secara optimal.
Perut ikan, katak, atau lupe ikan adalah istilah komersial gelembung renang di Indonesia. Perut ikan dari beberapa spesies ekonomis penting misalnya kakap putih (Lates calcarifer), patin (Pangasius sp.), kurau/kuro (Eleutheronema tetradactylum) dikomersialkan dalam bentuk kering dengan harga mencapai Rp 1-2 juta/kg. Kebutuhan lupe ikan umumnya cukup tinggi di Indonesia karena dijadikan bahan tambahan dalam sup hipio dan resep obat-obatan Tiongkok (ANTARA 2015). Gelembung renang diproses menjadi isinglass untuk fining agent
pada industri bir di Eropa karena kandungan proteinnya dapat mengikat atau mengkelat substansi pencemar (Trilaksani et al. 2006; Niu et al. 2013).
Studi anatomi dan morfologi menunjukkan bahwa gelembung renang tidak hanya berfungsi sebagai sistem keseimbangan dan pengatur daya apung ikan, namun juga sebagai organ hidroakustik dan memperkuat impuls suara yang disalurkan organ osilasi Weber (Sarnowski 2004). Volume gelembung renang hanya menempati 5% dari volume ikan, namun mampu mengembalikan signal echo
lebih dari 50% pada pengujian Target Strength/TS dengan instrumen hidroakustik SIMRAD EY-60 (Yulandasari 2012). Pencitraan obyek dengan high-resolution microtomographic yang dipadukan dengan studi histologis tiga dimensi menunjukkan adanya hubungan unik antara gelembung renang-organ telinga primitif pada kelompok ikan Teleostei (Schulz-Mirbach et al. 2013). Fungsi dan peran yang unik dari gelembung renang diduga terkait dengan struktur jaringan ikat, khususnya matriks ekstraseluler atau extra cellular matrix (ECM).
tipe V terdapat pada jaringan ikat dalam kulit dan tendon (Nagai dan Suzuki 2000); serta kolagen tipe lain yang belum teridentifikasi pada gelembung renang.
Produk kolagen yang diekstrak dari ikan menjadi alternatif untuk mengatasi kebutuhan sekaligus kontroversi penggunaan kolagen di kalangan keyakinan dan etnis tertentu (Choi et al. 2013) terhadap bahan baku terestrial (babi, sapi dan ayam). Yamaguchi (2002) menyatakan sekitar 10% dari total konsumen kolagen di dunia terjangkit penyakit bovine spongiform encephalopathy (BSE) dan penyakit mulut dan kuku (PMK) karena infeksi protein prion yang tidak dapat dihilangkan dari sumber kolagen selama proses pengolahan. Hal tersebut menjadi pemicu bergesernya tren penggunaan sumber terestrial ke sumber akuatik, salah satunya ikan. Keunggulan kolagen dari limbah ikan yakni memiliki serat protein kolagen yang lebih pendek dari hewan terestrial, sehingga limbah gelembung renang diharapkan juga dapat ditransformasi menjadi kolagen dengan spesifikasi biomaterial medis(Liu et al. 2012; Muyonga et al. 2004a).
Pasar global kolagen dan biomaterial berbasis HA (hidroksiapatit) akan mencapai 4.6 miliar US Dolar pada 2020, seiring meningkatnya penggunaan biomaterial dalam pengobatan regeneratif (GIA 2015). Bidang pengobatan regeneratif selama ini masih terfokus pada zat pemicu regenerasi jaringan, namun belum fokus pada material organik sekaligus stimulator pertumbuhan sel (secara holistik). Oleh karena itu, kolagen dari bahan baku ikan berpeluang untuk dikembangkan sebagai perancah atau scaffold. Scaffold berbasis kolagen merupakan biomaterial yang berfungsi sebagai penyokong atau substrat untuk pertumbuhan sel dan menyatu dengan sel karena bersifat biodegradabel dan biokompatibel. Spesifikasi kolagen sebagai perancah dapat terpenuhi apabila terdapat kompatibilitas biologis antara produk kolagen dengan jaringan. Prinsip
resorbable collagen membranes (RCM) melalui pewarnaan Trichrome memastikan suatu produk mengandung kolagen dan mampu “meluruh” pada jaringan kolagen dalam tubuh (Almazrooa et al. 2014). Bioavailabilitas sekuen asam amino dasar –Gly-X-Y– pada setiap modifikasi proses ekstraksi harus tetap terjaga hingga produk akhir, sehingga menjadi nilai tambah untuk produk kolagen. Produksi fish collagen dan produk turunannya masih didominasi dari limbah sisik dan kulit ikan melalui ekstraksi asam. Ekstraksi asam dari kulit kakap merah
Lates calcarifer menghasilkan kolagen dengan rendemen 15.8% basis basah dan 58.1% basis kering; serta menghasilkan produk turunan gelatin dengan rendemen 14.33-16.80% (Trilaksani et al. 2012). Proses ekstraksi kolagen dari gelembung renang belum banyak dieksplorasi, namun beberapa penelitian menunjukkan bahwa kolagen yang diekstrak dari gelembung renang dapat menghasilkan rendemen yang lebih besar. Proses ekstraksi asam gelembung renang kakap merah L. calcarifer
menghasilkan kolagen larut asam (ASC) dengan rendemen 28.5% (basis basah) atau setara 85.3% basis kering (Sinthusamran et al. 2013). Gelembung renang
yellowfin tuna menghasilkan ASC dengan rendemen mencapai 1.07% (Kaewdang
et al. 2014). Gelembung renang ikan patin Pangasius hypopthalmus juga telah ditransformasi menjadi isinglass dengan rendemen 94.38-94.63% (Trilaksani et al. 2006).
al. 2013), ekstraksi hidrotermal (Niu et al. 2013), ekstruksi-hidroekstraksi (Huang
et al. 2016) serta ekstraksi dengan metode asam-hidro (Djailani et al. 2016). Proses-proses tersebut mengkombinasikan efek reagen kimia serta pengaturan suhu sehingga terdapat peluang untuk denaturasi kolagen menjadi derivat protein lain. Faktor struktur jaringan gelembung renang yang cukup “rapuh” memungkinkan proses ekstraksi dengan penggunaan bahan kimia yang rendah konsentrasi dan meminimalkan masukkan temperatur selama proses ekstraksi. Oleh karena itu, perlu dilakukan eksplorasi lebih jauh mengenai modifikasi proses isolasi dan karakterisasi kolagen gelembung renang ikan cunang melalui modifikasi dan validasi pada proses ekstraksi untuk memperoleh kualitas dan kuantitas kolagen sebagai bahan scaffold yang maksimal.
Rumusan Masalah
Gelembung renang merupakan potensi limbah organik yang belum banyak dimanfaatkan kandungan kolagennya yang diduga merupakan bagian yang kecil dari total proporsi limbah. Ikan cunang (Muraenesox talabon) adalah salah satu komoditas lokal perairan Indonesia yang memiliki ukuran besar. Ikan dewasa memiliki panjang ±1 meter dengan bobot tubuh ±1.5 kg. Pemanfaatan secara optimal 2% gelembung renang ikan cunang berarti memanfaatkan potensi sumber kolagen terbarukan dari limbah perikanan. Kolagen berbasis gelembung renang memiliki potensi yang besar untuk dikembangkan salah satunya dibidang medis, yakni sebagai scaffold atau substrat bagi pertumbuhan sel seperti sel Vero. Produktivitas kolagen dari gelembung renang sangat dipengaruhi oleh metode ekstraksi dan suhu ekstraksi yang digunakan. Metode ekstraksi kolagen telah banyak dikembangkan diantaranya ekstraksi menggunakan enzim pepsin, ekstraksi dengan pre-treatment asam, ekstraksi hidrotermal, ekstruksi-hidroekstraksi serta ekstraksi dengan metode asam-hidro. Proses-proses tersebut berpeluang untuk denaturasi kolagen menjadi derivat protein lain, oleh karena itu eksplorasi mengenai modifikasi proses isolasi dan karakterisasi kolagen gelembung renang ikan cunang melalui modifikasi dan validasi pada proses ekstraksi perlu dilakukan sehingga memperoleh kolagen yang baik sebagai bahan scaffold yang maksimal.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah mengembangkan sediaan kolagen untuk biomaterial scaffold dari gelembung renang ikan cunang. Tujuan khusus penelitian ini meliputi:
1. Memperoleh informasi bioavailabilitas kolagen pada limbah gelembung renang ikan cunang (Muraenesox talabon).
2. Menentukan pra-perlakuan terbaik untuk mengeliminasi substansi nonkolagen pada jaringan gelembung renang ikan cunang (Muraenesox talabon).
4. Menghasilkan sediaan kolagen dari gelembung renang dan menentukan sifat fisikokimia yang sesuai (mengacu kepada standar) keperluan kultur sel. 5. Menguji kompatibilitas kolagen gelembung renang secara biologis pada
proses kultur sel mamalia (sel Vero).
Hasil penelitian ini diharapkan dapat memberikan kontribusi terhadap proses pengembangan sediaan obat untuk keperluan klinis dan medis yang aman untuk digunakan oleh masyarakat.
2.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli 2015 hingga Juli 2016. Proses ekstraksi kolagen dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB. Karakterisasi histomorfologi dilakukan di Laboratorium Histologi, Departemen Anatomi, Fisiologi dan Farmakologi (AFF), Fakultas Kedokteran Hewan IPB dan Laboratorium Pusat Studi Satwa Primata (PSSP) Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan adalah gelembung renang ikan cunang (Muraenesox talabon) yang diperoleh dari hasil samping sentra UKM kerupuk di Desa Kenanga, Kecamatan Sindang, Kabupaten Indramayu-Jawa Barat. Larutan reagen NaOH, asam asetat (CH3COOH), HCl, etanol, NaCl pro analis (Merck, USA), akuades, deionized distilled water (DD-H2O) dan larutan Bradford digunakan selama proses ekstraksi kolagen. Larutan Bouin dan Paraformaldehyde, garam fisiologis, alkohol bertingkat (70%, 80%, 90%, 95%, absolut), xylol, parafin, metanol, akuades, larutan pewarna Casson’s Trichrome digunakan selama proses pembuatan preparat hingga pewarnaan jaringan kolagen.
Peralatan yang digunakan meliputi seperangkat alat bedah jaringan, Tissue
-Tek®TEC (Sakura Finetek, USA), inkubator EYELA® (Tokyo Rikakikai, Jepang),
tissue cassette, tabung Eppendorf, mikroskop Olympus CX-31 (Olympus Lifescience, USA), Dino-Eye®,neraca digital (Sartorius, Jerman), pH-meter, kertas pH, magneticstirrer dengan hotplate (Yamato Scientific, Jepang), waterbath (38 °C), sentrifuge HIMAC CR 21G (Hitachi Koki, Jepang), freeze dryer, pipet volumetrik, pipet tetes, mikropipet dan alat-alat gelas seperti gelas obyek, cover glass, tabung reaksi, gelas ukur, gelas piala, labu Erlenmeyer, corong, sudip.
Prosedur Penelitian
Penelitian dilakukan melalui tahapan: (1) penentuan ketersediaan kolagen pada limbah gelembung renang ikan cunang, (2) penghilangan protein nonkolagen dengan pretreatment, (3) isolasi kolagen dengan modifikasi proses ekstraksi, (4) karakterisasi fisikokimia sediaan kolagen dan (5) biokompatibilitas scaffold
Penentuan ketersediaan kolagen pada limbah gelembung renang ikan cunang (Kiernan 1999; AOAC 1995; Nollet dan Toldrá 2011)
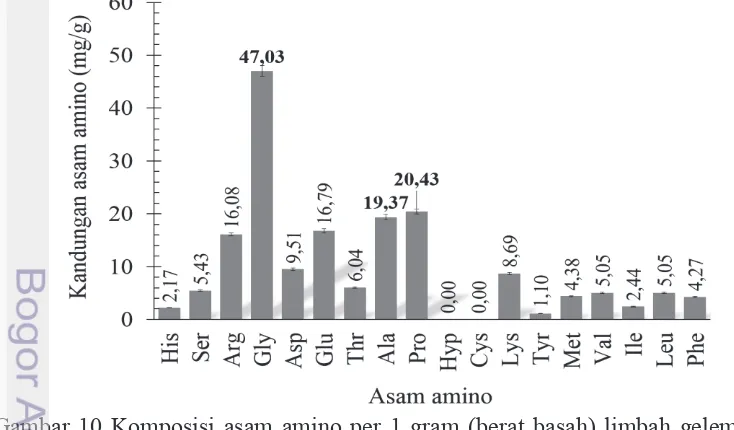
Gelembung renang ikan cunang (Gambar 1b) merupakan tipe gelembung renang ikan Teleostei (Gambar 1a) yang berbentuk kantung dengan ujung-ujung menyempit, disajikan pada Gambar 2. Gelembung renang dipisahkan dari organ ikan cunang lain secara hati-hati sehingga didapat gelembung renang yang utuh dan lengkap. Penentuan proporsi dilakukan dengan penimbangan gelembung renang (ketelitian 0.10 g) terhadap (a) keseluruhan bagian tubuh ikan dan (b) potensi limbah ikan (non-daging) cunang. Kandungan kimia gelembung renang ditentukan melalui uji proksimat (AOAC 1995), kemudian dibandingkan dengan kandungan kimia gelembung renang kering (komersial; diuji dengan metode yang sama). Morfologi gelembung renang diketahui dengan uji histologi (Kiernan 1999). Ketersediaan kolagen ditentukan dengan uji asam amino (Nollet dan Toldrá 2011) dan analisis lebih detail dilakukan pada asam amino penciri kolagen, yaitu glisina, prolina, alanina, dan hidroksiprolina (Ramachandran dan Reddi 2013).
Gambar 1 Jenis-jenis gelembung renang ikan (a) dan gelembung renang ikan cunang (b); lingkaran merah menunjukkan jenis gelembung renang spesies ikan cunang.
Separasi gelembung renang dari organ lain, pemotongan bahan baku dan preparasi lainnya dilakukan dalam keadaan dingin (4-10 °C) dan menggunakan gunting bedah. Gelembung renang utuh disimpan pada suhu rendah/dibekukan apabila tidak digunakan langsung (masa simpan maksimal 2 bulan) (Liu et al. 2015). Prosedur penentuan ketersediaan kolagen pada limbah gelembung renang ikan cunang disajikan pada Gambar 2 (Tahap I).
Penghilangan protein nonkolagen dengan pretreatment (Liu et al. 2015)
Protein nonkolagen, pigmen dan lemak dieliminasi dari gelembung renang melalui perendaman gelembung renang (berukuran 4.0 ± 0.5 cm2 ) dalam larutan alkali NaOH dengan rasio sampel : larutan adalah 1:10 (b/v), dalam 3 perlakuan konsentrasi NaOH yaitu 0.05 M; 0.1 M dan 0.15 M. Sampel direndam setiap 2 jam selama 24 jam pada suhu 4 °C dengan regulasi larutan NaOH setiap 2 jam. Analisis kandungan protein terlarut dilakukan pada air sisa rendaman NaOH untuk menentukan konsentrasi alkali dan waktu perendaman terbaik. Proses tersebut diulang kembali dengan konsentrasi larutan alkali dan waktu perendaman terbaik. Proses eliminasi substansi nonkolagen dapat dilihat pada Gambar 2 (Tahap II)
(b) Teleostei
(a)
Amla sp.
Cyprinus sp.
Protopterus sp.
Polypterus
Tidak
setiap 2 jam selama 24 jam
Na
Ekstraksi Asam Ekstraksi Hidrotermal
4 °C
Freeze drying(−40 °C; 1 atm) kolagen
Karakterisasi fisikokimia kolagen:
(1)Keragaan molekul kolagen, (2) Pola pita protein SDS-PAGE, (3) Spektrum gugus fungsi, (4) Komposisi asam amino, (5) Rendemen kolagen kering, (6) Kadar hidroksiprolin, (7) Sifat termal, (8) Derajat pengembangan
Pengujian biokompatibilitas kolagen pada sel Vero melalui aplikasi kolagen sebagai pelapis (coating) media kultur, pada konsentrasi 75 ppm, 150 ppm, 300
ppm, 600 ppm dan 1200 ppm dalam media DMEM
Tahap II
Isolasi kolagen dengan modifikasi proses ekstraksi (Liu et al. 2015; Huang et al. 2016)
Ekstraksi asam atau Acid SolubleCollagen (ASC) dilakukan sesuai prosedur Liu et al. (2015) dengan modifikasi suhu ekstraksi. Residu NaOH dicuci dengan akuades pH 7.0 ± 0.5 dingin hingga netral. Sampel kemudian diekstrak dengan CH3COOH 0.5 M (rasio 1:10; b/v) dengan perlakuan suhu ekstraksi selama 48 jam (2 hari) pada suhu 4 °C (A1) dan pada suhu ruang (A2). Suspensi hasil ekstraksi disaring menggunakan kain katun tipis. Filtrat suspensi dipresipitasi dengan NaCl hingga mencapai konsentrasi akhir 2.7 M dan diacampur hingga homogen. Campuran suspensi-NaCl kemudian didiamkan semalam pada suhu 4 °C, kemudian dipisahkan antara natan (pelet) dan supernatan dengan sentrifugasi (10.000×g, 30 menit, suhu 4 °C). Pelet kolagen terpresipitasi dikumpulkan dan selanjutnya didialisis menggunakan kantong dialisis (diameter pori-pori membran = 14 kDa) dalam asam asetat 0.1 M, asam asetat 0.05 M dan akuades berturut-turut selama 12 jam. Hasil dialisis merupakan larutan kolagen ASC.
Hidroekstraksi atau Water Soluble (WSC) dilakukan sesuai prosedur Huang
et al. (2016) dengan modifikasi suhu ekstraksi. Residu NaOH dicuci dengan akuades pH 7.0 ± 0.5 dingin hingga netral. Sampel kemudian direndam NaOH (1:3) (b/v) CH3COOH 0.05 M selama 15 menit pada suhu ruang. Sampel dicuci dengan akuades pH 7.0 ± 0.5 dingin hingga netral dan diekstrak dengan perbandingan 1:1 (b/v) selama 1 jam dengan perlakuan suhu ekstraksi. Suspensi yang telah diekstraksi, kemudian disaring menggunakan kain katun tipis. Konsentrasi air dikurangi dengan proses evaporasi vakum pada suhu 30 °C. Hasil evaporasi merupakan larutan kolagen WSC.
Pelakuan suhu pada proses ekstraksi dideskripsikan pada Tabel 1. Perlakuan diatur dalam Rancangan Acak Lengkap (RAL) dengan sub-pengamatan (a) empat perlakuan berbeda yang dianalisis ANOVA (A1 vs A2 vs H1 vs H2) dan (b) dua perlakuan berpasangan (sebelum vs sesudah) dari proses asam (A1 vs A2) serta hidrotermal (H1 vs H2) diuji T-berpasangan.
Tabel 1 Perlakuan suhu pada proses ekstraksi kolagen gelembung renang Metode ekstraksi Temperatur Agitasi Kode perlakuan
Acid Suhu rendah (4.0±1.0 °C) Ya A1
Acid Suhu ruang (27-30 °C) Ya A2
Hydrothermal Suhu tinggi (40.0±1.0 °C) Ya H1
Hydrothermal Suhu ruang (27-30 °C) Ya H2
Karakterisasi fisikokimia sediaan kolagen
Sediaan kolagen dikarakterisasi secara fisikokimia yang meliputi: (1) keragaman molekul kolagen dengan pewarnaan kolagen (Luna 1972; Khadijah 2014), (2) pola pita dan bobot molekul protein dengan SDS-PAGE (Laemlli 1970), (3) spektrum gugus fungsi amida dengn FT-IR (Muyonga et al. 2004b), (4) komposisi asam amino dengan UPLC (Nollet dan Toldrá 2011; Waters AccQ Inc. 1993), (5) rendemen kolagen (Huang et al. 2016), (6) kadar hidroksiprolina dengan spektrofluorometer (Gurung et al. 2009; Rismana et al. 2014), (7) sifat termal kolagen dengan DSC (Safandowska dan Pietrucha 2013), (8) derajat pengembangan (Tronci 2014). Parameter kualitatif dinilai secara kuantitatif dengan konversi berdasarkan skala Likert (McHall 2001; Gibbons dan Chakraborti 2011) melalui pembobotan skala sesuai justifikasi ilmiah. Penentuan karakteristik fisikokimia kolagen disajikan pada Gambar 2 (Tahap IV).
Pengujian biokompatibilitas sediaan kolagen sebagai scaffold pada kultur sel Vero (Sripriya dan Kumar 2016)
Ekstrak kolagen diaplikasikan sebagai scaffold atau media penunjang pada kultur sel. Kultur sel memungkinkan sel dapat tumbuh di luar jaringan organisme hidup dengan menyediakan, mengontrol dan memodifikasi faktor-faktor pertumbuhan pada media pertumbuhan. Biokompatibilitas atau kecocokan secara biologis dari kolagen ditentukan dengan mengevaluasi derajat proliferasi, pertumbuhan dan morfologi sel sebelum dan setelah aplikasi kolagen sebagai matriks ekstraseluler. Sel yang digunakan dalam penelitian ini adalah Sel Vero.
Sel Vero dibiakan dalam media Dulbecco’s Modified Eagle’s Medium
(DMEM) yang dilengkapi dengan 10% Fetal Bovine Serum (FBS), 100 unit/mL penisillin dan 100 g/mL streptomisin. Sel dibiakan dengan konsentrasi 5000 sel dalam 100 L media penumbuh selama 24 jam dalam inkubator pada suhu 37 °C dan atmosfer 5% CO2. Kolagen yang diaplikasikan ke sel dilarutkan dengan asam asetat, sehingga perlu dilakukan pengujian toksisitas pelarut terhadap sel Vero. Sel Vero yang telah dibiakan selama 24 jam selanjutnya ditambahkan dengan 0.5% dan 0.1% asam asetat glasial. Inkubasi dilakukan kembali dalam waktu 48 jam pada inkubator dengan suhu 37 °C dan atmosfer 5% CO2. Sel yang tidak mendapat perlakuan asam asetat glasial digunakan sebagai kontrol. Efek sitotoksisitas pelarut ditentukan melalui MTT assay. Konsentrasi asam asetat terendah dengan tingkat penghambatan terendah digunakan sebagai pelarut kolagen pada tahap evaluasi sitoproliferatif.
Aplikasi matriks kolagen dilakukan melalui metode coating (pelapisan) larutan kolagen gelembung renang ikan cunang (M. talabon) pada microplate 96
perlakuan coating kolagen pada well digunakan sebagai kontrol. Efek sitoproliferatif kolagen ditentukan melalui MTT assay.
Prosedur Analisis
Penentuan proporsi gelembung renang (Niu et al. 2013)
Bagian edibel dari ikan pada umumnya adalah daging dan sisanya adalah limbah perikanan. Niu et al (2013) menyatakan bahwa limbah industri perikanan berupa tulang, kulit, sisik, kepala, dan bagian dalam jeroan (ikan), termasuk gelembung renang. Penentuan proporsi gelembung renang terhadap ikan utuh (a) dan limbah ikan (b) dilakukan sesuai persamaan.
ሺaሻ=bobot gelembung renang (g)bobot ikan utuh (g)
ሺbሻ=bobot ikan utuh ሺgሻ-bobot daging (g)bobot gelembung renang (g)
Persamaan tersebut juga berlaku pada bagian tubuh selain gelembung renang, misalnya (a) daging, tulang, kulit, sisik, kepala, dan bagian dalam jeroan dan (b) tulang, kulit, sisik, kepala, dan bagian dalam jeroan. Perbandingan proporsi (a) dan (b) diilustrasikan dengan grafik batang.
Analisis kandungan kimia gelembung renang (AOAC 1995)
Analisis proksimat merupakan analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis kadar air, abu, lemak, protein dan serat kasar. Uji kadar air merupakan pengujian untuk menentukan jumlah air bebas ataupun air terikat yang terdapat pada suatu bahan. Tahap awal pengujian kadar air yakni cawan porselen dikeringkan dari sisa air dalam oven (105 °C, 1 jam). Cawan tersebut diletakkan ke dalam desikator (±15 menit) dan dibiarkan sampai dingin. Cawan tersebut ditimbang kembali hingga beratnya konstan. Sebanyak 5 g sampel dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105 °C selama 5 jam atau hingga beratnya konstan. Setelah selesai proses kemudian cawan tersebut dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang kembali. Kadar air ditentukan menurut persamaan:
Kadar airሺ%ሻ=BBെC
െA ×100%
Keterangan : A = Berat cawan kosong (g)
B = Berat cawan yang diisi dengan sampel (g)
C = Berat cawan dengan sampel yang sudah dikeringkan (g)
dalam tanur pengabuan dengan suhu 600 °C selama 1 jam, Cawan kembali ditimbang hingga didapatkan berat konstan. Kadar abu ditentukan menurut persamaan:
Kadar abuሺ%ሻ=BBെC
െA ×100%
Keterangan : A = Berat cawan porselen kosong (g) B = Berat cawan dengan sampel (g)
C = Berat cawan dengan sampel setelah dikeringkan (g)
Kadar protein (kasar) diketahui dengan menentukan jumlah total nitrogen (N) pada suatu bahan (asumsi: setiap asam amino mengandung N). Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi dan titrasi. Pengukuran kadar protein dilakukan dengan metode Kjeldahl. Sampel ditimbang sebanyak 0.25 g, kemudian dimasukkan ke dalam labu Kjeldahl 100 mL, lalu ditambahkan 0.25 g selenium dan 3 mL H2SO4 pekat. Sampel didestruksi pada suhu 410 °C selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu Kjeldahl ditambahkan 50 mL akuades dan 20 mL NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100 °C. Hasil destilasi ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes indikator bromcresol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 40 mL dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat dititrasi dengan HCl 0.1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti sampel. Kadar protein dihitung dengan rumus sebagai berikut:
Nitrogen (%) =ሺVol.ுsampel-Bobot sampelሺሻVol.ு blankoሻ×0.1NHCl×FP×14 ×100% Protein ሺ%ሻ = %N×FK
Keterangan: FP = faktor koreksi alat = 2.5 FK = faktor konversi = 6.25
Kadar lemak ሺ%ሻ=ሺW2-W1ሻ
W3 ×100%
Keterangan: W1 = Berat sampel (g)
W2 = Berat labu lemak kosong (g) W3 = Berat labu lemak dengan lemak (g)
Analisis karbohidrat (KH) dilakukan secara by difference, yaitu hasil pengurangan dari 100 % dengan kadar air, kadar abu, kadar protein dan kadar lemak, sehingga kadar karbohidrat tergantung pada faktor pengurangannya. Hal ini karena karbohidrat sangat berpengaruh terhadap zat gizi lainnya. Analisis kadar karbohidrat dapat dihitung dengan persamaan berikut:
KarbohidratሺΨሻ=100%-(kadar air+kabar abu +kadar lemak+kadar protein)
Uji histologis (Kiernan 1999; Luna 1992)
Uji histologi meliputi tahap (1) preparasi sampel menjadi bentuk preparat jaringan, (2) pembutan larutan pewarna, (3) pewarnaan jaringan. Gelembung renang (jaringan) utuh diproses menjadi preparat jaringan melalui serangkaian
tissue processing (fiksasi, dehidrasi, penjernihan, infiltrasi, penanaman dan pemotongan), seperti diilustrasikan pada Gambar 3 Jaringan difiksasi dalam larutan
Bouin hingga terfiksasi sempurna. Fiksasi dikatakan sempurna apabila larutan fiksasi telah masuk (terpenetrasi) hingga ke lapisan jaringan paling dalam. Fiksasi dihentikan dengan perendaman pada alkohol 70% (stopping point).
Gambar 3 Prosedur tissue processing (Kiernan 1999).
(sectioning) dengan ketebalan tertentu (4-5 m) dengan mikrotom, kemudian ditempatkan pada kaca obyek. Preparat disimpan dalam kotak preparat dalam inkubator (37 °C) agar jaringan tidak berjamur dan kotor. Tissue processing
diilustrasikan pada Gambar 2. Proses pewarnaan diawali dengan penghilangan parafin (perendaman preparat dalam xylol III, II, dan I masing-masing 2 menit) dan rehidrasi (perendaman dalam alkohol III, II, I dan dilanjutkan alkohol 96%, 90%, 80%, 70% masing-masing 3 menit). Preparat direndam dalam akuades dan air kran masing-masing selama 2 menit, kemudian preparat siap diwarnai.
Larutan pewarna jaringan kolagen terdiri atas Wiegert’s iron-hematoksilin sebagai pewarna inti sel dan Casson’s Trichrome sebagai pewarna jaringan kolagen. Larutan pewarna Casson’s Trichrome dibuat dengan mencampurkan secara secara berturut-turut phospotungstic acid (PTA), Orange G, Aniline Blue,
Acid Fuchsin dengan perbandingan masing-masing 1 g : 2 g : 1 g :3 g dalam 200 mL akuades Pewarnaan jaringan diawali dengan deparafinasi dan rehidrasi preparat, dicuci dengan akuades (3-5 menit), kemudian diwarnai pewarna
Wiegert's iron-Hematoxylin (campuran Wiegert's iron-Hematoxylin A dan
Wiegert's iron-Hematoxylin B rasio 1:1 (v/v)). Preparat pada kaca obyek dicuci akuades secukupnya, kemudian diwarnai dengan larutan pewarna Casson’s Trichrome. Kaca obyek direndam dalam asam asetat 1% selama 1 menit, kemudian dilakukan dehidrasi cepat dengan alkohol absolut (III, II, I) dan penjernihan dengan xylol (III, II, I). Sampel pada kaca obyek ditutup dengan cover glass yang direkatkan dengan Entelan®, kemudian preparat diamati menggunakan mikroskop. Kolagen ditunjukkan oleh jaringan ikat berwarna biru hingga kebiruan. Kenampakan gambar jaringan kolagen diambil secara fotomikroskopis digital menggunakan piranti lunak Dino-Eye® yang terpasang pada lensa okuler mikroskop.
Penentuan komposisi asam amino gelembung renang (Nollet dan Toldrá 2011; Waters AccQ Inc. 1993)
Komposisi asam amino ditentukan menggunakan alat Ultraperformance®
Liquid Chromatography (UPLC). Gelembung renang utuh dihaluskan hingga homogen, kemudian ditimbang 0.1 gram. Sampel ditambah 5 ml HCl 6N, dihomogenkan dengan vortex. Campuran dihidrolisis selama 22 jam pada suhu 110 °C. Hidrolisat dipindahkan ke labu ukur 50 ml, tambahkan akuabidest sampai tanda batas. Hidrolisat disaring dengan filter 0.45 m, sehingga menghasilkan filtrat. Filtrat diambil 500 L dengan pipet dan ditambah 40 m AABA (α
-aminobutyric acid; sebagai standar internal) serta ± 460 L akuabidest, dihomogenkan dengan vortex. Larutan campuran dipipet 10 L dan dicampur dengan 70 L l AccQ-Fluor Borate, dihomogenkan dengan vortex. Larutan dicampur 20 L reagen fluor A hingga homogen, kemudian didiamkan selama 1 menit. Larutan campuran diinkubasi selama 10 menit pada suhu 55 °C. Alikuot protein disuntikkan pada alat UPLC.
Alikuot protein disuntikkan pada alat UPLC. Analisis asam amino dilakukan dengan alat UPLC menggunakan kolom ACCQ-Tag Ultra C18 pada suhu 49 °C. Sistem komposisi gradien menjadi fase gerak dengan laju alir 0.7 mL per menit. Detektor analit berupa PDA dengan panjang gelombang 260 nm dan volume injeksi 1 L. Kadar asam amino dihitung dengan rumus:
RA = Luas area analit / Luas area AABA fp = Volume 1 ( ) / pemipetan ( ) × Volume 2 ( )
Kadar asam amino (mg/kg) = RAsampel× C. standar (pmol)RA1000000000 ×Bm×fp×1000 standar×Bobot sampel
Kadar asam amino (%) = Kadar asam amino (mg/kg) / 10000
Keterangan: RA = rasio analit sampel dan rasio analit standar Fp = faktor pengoreksi
Bm = bobot molekul (g/mol) C = konsentrasi
Penentuan kandungan hidroksiprolina (Neuman dan Logan 1950; Gurung et al. 2009; Rismana et al. 2014)
Asam amino hidroksiprolina dideteksi dengan metode spektroskopi massa melalui modifikasi tahap hidrolisis dan dye/chromogen. Ekstrak kolagen atau kolagen powder dikeringkan pada suhu 60 °C selama 12 jam dan dihidrolisis dengan HCl 6 N selama 6 jam pada suhu 110 °C. Hidrolisat kolagen dinetralkan hingga pH 7,0±1,0. Sampel cair diambil sebanyak 200 μL dicampur dengan 1 mL CuSO4 0.01 N, 1 mL NaOH 2.5 N, dan 1 mL H2O2 6%. Larutan kemudian diaduk dan diinkubasi pada suhu 80 °C selama 5 menit. Setelah proses inkubasi selesai, larutan didinginkan dan ditambahkan 4 mL H2SO4 3M dan 2 mL paradimetilaminobenzaldehid (sebagai larutan dye/chromogen/pemberi warna) 5%. Sampel diinkubasi kembali pada suhu 70 °C selama 16 menit kemudian didinginkan pada suhu 20 °C.
Sampel yang telah diinkubasi diukur serapan pendarannya dengan spektrofluorometer pada panjang gelombang EX/EM = 499/501 nm. Jumlah hidroksiprolina dalam sampel dihitung terhadap kurva standar 4-L-hidroksiprolina (Lampiran 13). Data diinterpretasi sebagai kandungan hidroksiprolin dalam 100 mg kolagen (mg/100 mg). Persentase dari perbandingan data kandungan hidroksiprolina hasil penelitian terhadap standar hidroksiprolina (12.8 g/100 g) pada molekul kolagen merupakan nilai kemurnian kolagen hasil ekstraski (Sripriya dan Kumar 2015).
Pengujian kadar protein terlarut (Bradford 1976)
Keragaman molekul kolagen (Hardyanti 2014)
Kolagen gelembung renang diambil masing-masing sebanyak 0.1 L, kemudian diletakkan di gelas obyek dan difiksasi kering udara. Setelah itu, sampel di rendam dalam larutan Casson’s Trichrome selama 5 menit, dicuci dengan air mengalir selama 3-5 detik dan dikeringkan dengan cara air diserap dengan kertas saring hingga kering. Dehidrasi cepat dilakukan dalam alkohol 100% sebanyak 3 kali, dijernihkan dalam xylol, kemudian dilekatkan dengan kaca penutup. Pengamatan jaringan kolagen dilakukan dengan mikroskop cahaya (Olympus CX-31) dengan perbesaran obyektif 40×.
Penentuan rendemen kolagen
Rendemen kolagen diperoleh dari perbandingan berat kering kolagen terhadap berat bahan baku awal:
Rendemen ሺ%ሻ=Berat bahan baku ሺgሻBerat kolagen ሺgሻ ×100%
Penentuan kandungan kimia ekstrak kolagen (AOAC 1995)
Analisis kandungan kimia pada ekstrak kolagen dilakukan untuk mengetahui kandungan air, kandungan protein dan kandungan lemak ekstrak kolagen. Prosedur pengujian kadar air, kadar protein, dan kadar lemak mengacu AOAC (1995) seperti yang telah dijelaskan pada prosedur analisis kandungan kimia gelembung renang. Data diinterpretasikan dalam bentuk grafik batang dan dilakukan analsis rasio kadar protein dan kadar lemak.
Penentuan komposisi asam amino kolagen (Nollet dan Toldrá 2011; Waters AccQ Inc. 1993)
Komposisi asam amino kolagen ditentukan mengacu pada prosedur Waters AccQ Inc. (1993) serta Nollet dan Toldrá (2011) seperti yang telah dijelaskan pada prosedur analisis komposisi asam amino gelembung renang sebelumnya. Sampel kolagen kering dari berbagai perlakuan (A1, A2, H1 dan H2) masing-masing ditimbang 0.1 gram kemudian diproses menjadi hidrolisat. Hidrolisat diinjeksikan ke alat Ultraperformance® LiquidChromatography (UPLC).
Penentuan sifat termal kolagen (Safandowska dan Pietrucha 2013)
Penentuan suhu transisi kolagen dilakukan menggunakan alat Differential Scanning Calorimetry (DSC). Sampel dimasukkan kedalam sebuah wadah krusibel kemudian krusibel dimasukkan ke dalam chamber DSC dan dipanaskan dari temperatur 0 °C hingga 140 °C dengan variasi laju pemanasan 10 °C/menit. Hasil pengukuran berupa termogram DSC yang ditampilkan pada perangkat lunak DSC menjadi sebuah grafik yang menunjukan parameter uji titik leleh, jumlah energi laten dan kisaran suhu saat berubah fase.
Pengujian solubilitas kolagen (Jongjareonrak et al. 2005; Minh et al. 2014) Kelarutan atau solubilitas kolagen ditentukan mengacu metode Jongjareonrak
tabung sentrifugasi dan pH diatur mulai dari 1 sampai 10 (dengan 6N NaOH/ 6N HCl). Volume larutan dibuat hingga 10 mL dengan air suling, sebelumnya disesuaikan dengan pH yang sama. Larutan disentrifugasi pada 20.000×g pada 4 °C selama 30 menit.
Reagen Biuret disiapkan dengan melarutkan 0.375 g tembaga (II) sulfat (CuSO4•5H2O) dan 1.51 g natrium tartrat (NaKC4H4O6) dalam 100 mL akuades. Campuran diaduk merata sambil ditambahkan 100 mL NaOH 7.5% (b/v; preparasi segar bebas CO2, air mendidih). Hasil campuran dipindahkan ke dalam labu takar 250 mL dan ditambah akuades hingga tepat tanda tera, kemudian dicampur hingga homogen. Reagen dapat langsung digunakan atau disimpan dalam botol gelap pada suhu 2-8 °C. Sampel protein dan akuades (sebagai kontrol) sebanyak 1 mL ditambah 4.5 mL reagen Biuret dalam tabung reaksi kemudian dicampur hingga homogen dengan vortex. Warna campuran diamati biru muda dan absorbansi protein sampel diukur dengan spektrofotometer UV-Vis pada panjang gelombang 545 nm.
Larutan stok protein standar (10 mg/mL) diencerkan menjadi 50 mL larutan protein standar dengan konsentrasi 0.0100; 0.0500; 0.100; 0.250; 0.500; 0.750; 1.00; 1.25; 1.50; 2.00; 2.50; dan 5.00 mg/mL. Absorbansi larutan protein standar diukur dengan spektrofotometer UV-Vis pada panjang gelombang 545 nm. Absorbansi diplotkan ke dalam kurva absorbansi standar. Kandungan protein pada supernatan ditentukan dengan uji Bradford dengan Bovine Serum Albumin (BSA) sebagai standar. Solubilitas dihitung melalui persamaan berikut:
Solubilitas = Kandungan protein supernatan (mg/mL)Total protein sampel (mg/mL)
Solubilitas relatif = Solubilitas pada pH tertentu (mg/mL)Solubilitas tertinggi (mg/mL)
Penentuan derajat pengembangan kolagen (Tronci 2014)
Pengujian terhadap kemampuan mengembang (swelling) sampel kolagen dilakukan sesuai prosedur Tronci (2014). Sampel kering dalam 5 mL akuades diinkubasi selama 10 menit, kemudian ditiriskan dan ditimbang beratnya. Swelling ratio (SR) atau derajat pengembangan berbasis berat sampel yang dihitung melalui persamaan berikut:
SR = mmb-mk
k ×100
dimana mb dan mk masing-masing adalah massa setelah mengembang dan massa sampel kering.
Pengujian 3-(4-,5 dimethylthiazol-2-yl)-2,5-difenil tetrazolium bromida (MTT) terhadap sel Vero
gelombang 595 nm menggunakan ELISA reader. Nilai absorbansi ditransformasi ke dalam rumus berikut untuk menghitung dinamika pertumbuhan sel.
I (%) = ൬AkontrolA െAsampel
kontrol ൰×100%
V (%) = ൬AAsampel
kontrol൰×100%
Keterangan: I = Inhibisi populasi sel yang mati akibat diberikan perlakuan
V = Viabilitas populasi tumbuh atau bertahan akibat diberikan perlakuan
Rancangan Percobaan dan Analisis Data
Rancangan percobaan adalah proses pengambilan data dari parameter-parameter yang dinilai selama proses produksi kolagen hingga ke tingkat pengujiannya secara eksperimental. Beberapa jenis rancangan digunakan untuk memperoleh data proses pengolahan gelembung renang menjadi kolagen.
Rancangan Acak Lengkap (RAL) in Time (Split Plot Time)
Rancangan percobaan ini digunakan pada tahap II (tahap pretreatment). Perlakuan yang diberikan adalah proses perendaman penghilangan protein nonkolagen dengan perendaman, digunakan 3 jenis (taraf) konsentrasi dan 12 fase durasi (taraf) perendaman yang disajikan pada Tabel 2. Hipotesis yang diajukan adalah hipotesis nol (H0) dan hipotesis alternatif (H1), yaitu:
Tabel 2 Perlakuan kombinasi konsentrasi NaOH dan waktu perendaman Konsentrasi Durasi perendaman NaOH (jam ke-x)
NaOH (M) 2 4 6 8 10 12 14 16 18 20 22 24 0.05 ... ... ... ... ... ... ... ... ... ... ... ... 0.10 ... ... ... ... ... ... ... ... ... ... ... ... 0.15 ... ... ... ... ... ... ... ... ... ... ... ...
H0 = Konsentrasi NaOH, durasi perendaman, serta interaksi konsentrasi NaOH-durasi perendaman tidak mempengaruhi kadar protein terlarut pada proses pretreatment.
H1 = Konsentrasi NaOH, durasi perendaman, serta interaksi konsentrasi NaOH-durasi perendaman mempengaruhi kadar protein terlarut pada proses pretreatment.
Model observasi Rancangan Acak Lengkap (RAL) in Time (Split Plot Time) yang digunakan sesuai persamaan (Gaspersz 1991):
Yijk = + τi + τj + τij + εijk
Keterangan
I = konsentrasi ke-1, 2, 3
K
ulangan ke-1, 2, 3
Yij = respon pengaruh perlakuan konsentrasi NaOH ke-i dan lama
perendaman ke-j pada ulangan ke-k
Μ = nilai tengah umum
τi = pengaruh konsentrasi NaOH ke-i
τj = pengaruh lama waktu perendaman ke-j
τij = pengaruh interaksi perlakuan konsentrasi NaOH ke-i dengan lama
waktu perendaman ke-j
εijk = faktor galat perlakuan konsentrasi NaOH ke-i dan lama perendaman ke-j
pada ulangan ke-k
Rancangan Acak Lengkap (RAL)
Rancangan percobaan ini digunakan pada tahap karakteristik ekstrak kolagen, karakteristik fisikokimia kolagen dan aplikasi kolagen pada kultur sel (Tahap III, IV dan V). Perlakuan yang diberikan adalah perlakuan proses asam pada suhu 4 °C (A1), asam pada suhu ruang (A2), hidrotermal pada suhu 40 °C (H1) dan hidroekstraksi pada suhu ruang (H2). Hipotesis yang diajukan adalah hipotesis nol (H0) dan hipotesis alternatif (H1), yaitu:
H0 = Proses ekstraksi (A1, A2, H1 dan H2) tidak mempengaruhi karakteristik ekstrak, karakteristik fisikokimia kolagen dan efek sitoproliferatif kolagen (beserta parameter kuantitatif yang berkenaan);
1 = 2 = 3 = 4
H1 = Proses ekstraksi (A1, A2, H1 dan H2) mempengaruhi karakteristik ekstrak, karakteristik fisikokimia kolagen dan efek sitoproliferatif kolagen (beserta parameter kuantitatif yang berkenaan);
1 ≠ 2 ≠ 3 ≠ 4
Parameter kuantitatif yang berkenaan:
Karakteristik ekstrakμ bobot molekul, kadar air, kadar protein, kadar lemak, rasio protein/lemak
Karakteristik fisikokimiaμ rasio gugus fungsi amida, komposisi asam amino penciri kolagen, komposisi sekuens asam amino, sifat termal kolagen
Efek sitoproliferatifμ inhibisi sel dan viabilitas sel
Model observasi Rancangan Acak Lengkap (RAL) yang digunakan sesuai persamaan (Gaspersz 1991):
Y
ij = + τi + εij
Keterangan
i = Perlakuan proses ke-1, 2, 3, 4 j = Ulangan ke-1, 2, 3,
Yij = respon pengaruh perlakuan ke-i ulangan ke-j
τi = pengaruh perlakuan ke-i
εij = pengaruh acak pada perlakuan ke-i ulangan ke j
Data dianalisis untuk mengetahui informasi dari hubungan-hubungan antar perlakuan maupun interaksi antar perlakuan. Setiap analisis data memiliki tujuan dan interpretasi data yang berbeda. Data yang diperoleh dianalisis dengan beberapa analisis, yakni:
Pengamatan Sampel Berpasangan
Rancangan percobaan ini digunakan untuk mengamati sampel sebelum dan sesudah diberikan perlakuan, yaitu pada pengujian proksimat (Tahap I). Selain itu, rancangan ini digunakan untuk mengamati perbedaan proses ekstraksi umum (A1 dan H1; sebelum) dan proses ekstraksi modifikasi (A2 dan H2; sesudah). Hipotesis yang diajukan adalah hipotesis nol (H0) dan hipotesis alternatif (H1), yaitu:
H0 = Tidak terdapat perbedaan antara dua pengamatan setelah maupun sebelum diberi perlakuan; D = 0
H1 = Terdapat perbedaan antara dua pengamatan setelah maupun sebelum diberi perlakuan; D ≠ 0
Model observasi Pengamatan Sampel Berpasangan yang digunakan sesuai persamaan (Gaspersz 1991):
t=ሺXഥ-Yഥሻඨ nሺn-1ሻ σ ൫n X1-Y1൯
f=1
Keterangan:
X = data sesudah Y = data sebelum
t = respon pengaruh perlakuan Σ = jumlah kelompok data n = jumlah data
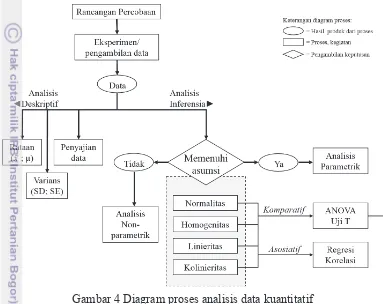
dan Sumertajaya 2000). Diagram proses analisis data kuantitatif disajikan pada Gambar 4.
Analisis Deskriptif
Interpretasi atau analisis data kuantitatif (interval atau rasio) dalam bentuk tabel, grafik maupun diagram. Tujuan analisis ini adalah untuk memudahkan pembaca memiliki pemahaman secara langsung. Keterangan data atau keadaan yang dalam analisis ini mencakup rataan ( ) dan standar deviasi (Δx).
Gambar 4 Diagram proses analisis data kuantitatif Uji T (independen & berpasangan)
Interpretasi atau analisis data kuantitatif (interval atau rasio) ini adalah satu metode pengujian hipotesis, data yang digunakan tidak bebas yang dicirikan dengan adanya hubungan nilai pada setiap sampel yang sama (berpasangan). Ciri-ciri yang paling sering ditemui pada kasus yang berpasangan adalah satu individu (objek penelitian) dikenai 2 buah perlakuan yang berbeda (Mattjik dan Sumertajaya 2000). Data yang dianalsis adalah rataan ( ), standar deviasi (Δx) dan hubungan korelasi. Analisis dilakukan dengan menggunakan piranti lunak Statistical Package for the Social Science (SPSS) versi 14 (IBM Corporation, US).
Uji F (Analisis Sidik Ragam/ANOVA)
dibandingkan menunjukkan adanya perbedaan (Mattjik dan Sumertajaya 2000). Data yang dianalsis adalah rataan ( ) dan varians (S) data, seperti ditunjukkan pada Tabel 3.
Tabel 3 Analisis ragam (ANOVA) Sumber
variasi
DB SS MS F-hitung
Antar perlakuan
(k-1) ܵܵ ܵܵ
݇ െ ͳ
ܯܵ ܯܵா Dalam
perlakuan (error)
(n-1)-(k-1) SSp= SSr − SSp ܵܵா
ሺ݊ െ ͳሻ െ ሺ݇ െ ͳሻ
Total (n-1) ࡿࡿ
Analisis dilakukan dengan menggunakan piranti lunak Statistical Analytical System
versi 9 (SAS Institute, US).
Apabila ada beda nyata secara statistik pada analisis sidik ragam maupun uji-T sampel berpasangan, dilanjutkan dengan uji Duncan Multiple Range Test
(DMRT) pada taraf kepercayaan λ5% (p ≤ 0.05). Pengujian parameter dapat dilihat pada Lampiran 1.
Analisis Korelasi-Regresi
Interpretasi atau analisis data kuantitatif (interval atau rasio) dalam bentuk hubungan data berpasangan independen, dependen (X,Y). Tujuan analisis ini adalah untuk mengetahui hubungan langsung maupun tidak langsung antara pasangan data dan memprediksi kecenderungan/pola/trend. Data yang dianalisis adalah data eksperimental untuk mendapatkan model persamaan. Analisis korelasi yang digunakan dalam penelitian ini antara lain adalah:
Regresi linear sederhana
ݕ ൌ ܣݔ ܤ ܥ Koefisien korelasi (Pearson Product Moment)
ݎ ൌ ݊ σ ݔݕ െ ሺσ ݔሻሺσ ݕሻ
ඥሼ݊ σ ݔଶെ ሺσ ݔሻଶሽሼ݊ σ ݕଶെ ሺσ ݕሻଶሽ
3.
HASIL DAN PEMBAHASAN
Karakteristik Gelembung Renang Ikan Cunang (Muraenesox talabon) dan Ketersediaan Kolagen
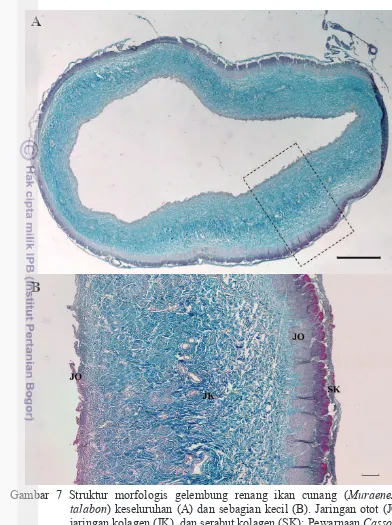
Gelembung renang merupakan salah satu bagian dari limbah hasil samping pengolahan produk perikanan dan dikelompokkan dalam jenis limbah jeroan. Gelembung renang telah dimanfaatkan salah satunya adalah obat-obatan tradisional dan jenis makanan tertentu. Jumlah produksi gelembung renang ikan cunang setiap bulannya mencapai 9 kwintal dengan harga jual Rp. 600.000/kg di kawasan Indramayu (Omat 2008). Data perikanan tangkap Indonesia menunjukkan total tangkapan ikan cunang mencapai 2554 ton pada tahun 2014 (KKP 2015). Gelembung renang ikan cunang (Muraenesox talabon) tergolong gelembung renang tipe tertutup dan berbentuk kantung memanjang dengan saluran buntu pada kedua ujungnya yang dapat dilihat pada Gambar 5a, 5b, dan 5c. Karakteristik dan ketersediaan kolagen pada gelembung renang M. talabon dapat dilihat dari proporsi gelembung renang, kandungan kimia, ketersediaan kolagen pada jaringan gelembung renang dan komposisi asam amino.
(a) (b) (c)
Gambar 5 Gelembung renang ikan cunang dipisahkan dari ikan (a), gelembung renang (b), kumpulan limbah gelembung renang (c).
Karakteristik proporsi dan proksimat gelembung renang
Proporsi gelembung renang pada ikan cunang merupakan salah satu cara untuk mengetahui ketersediaan gelembung renang sebagai bahan baku kolagen. Hasil pengukuran proporsi gelembung renang ikan cunang dapat dilihat pada Gambar 5. Gelembung renang memiliki proporsi yang lebih kecil daripada bagian lain, baik sebagai bagian tubuh maupun bagian dari limbah hasil perikanan, yakni masing-masing 0.57-0.67% dan 1.30-1.50%. Hasil pengukuran gelembung renang menunjukkan proporsi kurang dari 2% dengan bobot rata-rata 11.33 gram. Bobot yang rendah diduga akibat hilangnya sebagian besar konsorsium gas (O2, N2 dan H) dan air ketika dipreparasi. Penelitian Feuillade dan Nero (1998) menunjukkan bahwa proporsi gelembung renang Teleostei adalah ±5% (studi kasus tuna sirip kuning) dan 1-2% (studi kasus belut perak Jepang; Yamada et al. 2001). Proporsi (volume dan/atau bobot) pada Teleostei, khususnya kelompok Anguillidae
dipengaruhi fase pendewasaan, pola gerak, tekanan dan kedalaman (Skoglund 1961; Fänge 1983; Shrimpton et al. 1990).
dimanfaatkan sebagai campuran produk bakso dan kerupuk (Sarlan 2016) serta
nugget ikan (Murdinah dan Maharani 2009) di tingkat UKM atau unit usaha lebih besar. Limbah kulit dan tulang telah digunakan sebagai bahan baku kulit samak dan tepung ikan (Suryanti dan Peranginangin 2004). Oleh karena itu, bagian gelembung renang tersebut masih perlu diteliti lebih lanjut, salah satunya sebagai sumber kolagen. Keberlanjutan produksi gelembung renang menjadi kolagen tentunya tidak akan cukup jika hanya mengandalkan gelembung renang dari satu spesies saja. Ketersediaan gelembung renang hendaknya mencakup berbagai macam spesies dengan karakteristik proporsi yang lebih tinggi.
Gambar 6 Proporsi gelembung renang terhadap (a) seluruh bagian dan (b) limbah ikan cunang Muraenesox talabon ( kepala, jeroan, gelembung renang, kulit, tulang, daging).
Proporsi komponen air dari gelembung renang utuh beberapa jenis spesies ikan mencapai lebih dari 70%, seperti ditunjukkan pada Tabel 4. Kandungan tersebut berada di atas proksimat rata-rata masa otot/daging belut (Anguilla anguilla) dan belut conger (Conger conger) sebagai spesies kerabat dekat, yaitu 60-71% (air); 8-31% (lemak); 14.4% (protein) dan 80% (air); 0.2-11.9% (lemak); 19.4% (protein) (FAO 2015). Perbedaan hubungan terlihat antara kandungan proksimat gelembung renang utuh/segar (basah) dengan gelembung renang komersial (kering). Hasil uji korelasi menunjukkan bahwa hubungan antara kandungan serat sangat erat (R < 0.5) dengan komponen air, abu, protein dan lemak pada gelembung renang utuh/segar (basah). Setelah dikeringkan, keberadaan lemak tidak erat kaitannya dengan abu dan protein (R < 0.9), bahkan berkorelasi negatif dengan kadar air (Lampiran 3a, 3b). Lehninger (2000) menyatakan bahwa konsentrasi ion H+ dan OH− terkait dengan gugus fungsi protein dan lemak, sedangkan kandungan serat dan karbohidrat lebih dipengaruhi oleh afinitas mineral dan jumlah ion karbon bebas (Takatsuki et al. 1984; João-Ramalhosa et al. 2009).
selama proses, penyimpanan, pengolahan dan pengeringan jaringan gelembung renang yang akan mengubah komposisi biokimia yang lain. Hasil uji korelasi pada perhitungan kandungan kimia basis kering (Tabel 5) menunjukkan bahwa kandungan serat akan menurun seiring meningkatnya kandungan abu, protein dan lemak (Lampiran 4a) pada bahan baku basah. Bahan baku kering menunjukkan bahwa kandungan abu akan menurun dengan semakin meningkatnya kadar protein, lemak dan serat (Lampiran 4b). Hasil uji T-berpasangan (Lampiran 4c) menunjukkan bahwa terjadi perubahan kandungan abu dan lemak secara signifikan (p < 0.05). Kandungan protein basis kering dari gelembung renang kering (komersial) lebih tinggi dari gelembung renang basah (limbah), namun kadar protein kedua produk tidak berbeda nyata (p < 0.05) secara statistik. Kandungan protein pada limbah gelembung renang lebih tinggi daripada gelembung renang kering (komersial). Hal tersebut merupakan alasan utama untuk menggunakan gelembung renang basah sebagai bahan baku kolagen, selain itu manfaat lainnya adalah sebagai tindakan antisipasi terhadap degradasi protein pada produk kering (selama proses, distribusi dan penyimpanan). Alasan lainnya adalah kolagen akan diekstrak dari jaringan menggunakan pelarut, sehingga lebih efektif apabila dalam keadaan basah atau masih mengandung kadar air.
Tabel 4 Kandungan kimia (basis basah) gelembung renang ikan cunang (basah, kering), tuna (Thunnus albacares), dan patin (Pangasius sp.)
Komposisi Cunang Persentase (%) basis basah (basah)
Cunang (kering)
Tuna1 Patin2
Air 73.88±0.22a 13.94 ± 0.33b 83.33 74.03
Abu 0.26±0.02a 0.27 ± 0.08a 0.2λ 0.08
Protein 24.3λ±0.18b 80.70 ± 0.65a 12.0λ 25.67
Lemak 0.48±0.02b 3.53 ± 0.45a 1.44 0.03
Karbohidrat* 0.λλ±0.27b 1.56 ± 0.70a 2.85 0.1λ *dihitung secara by difference
1Pengujian proksimat gelembung renang utuh/segar (basah) dari Thunnus albacares (Kaewdang et al. 2014)
2Pengujian proksimat gelembung renang utuh/segar (basah) dari Pangasius sp. (Yanuardi 2006)
a-bAngka-angka pada kolom yang sama diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji
selang berganda Duncan)
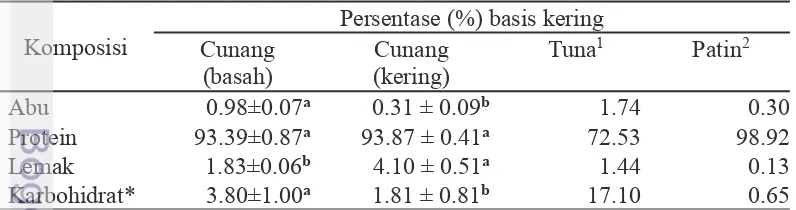
Tabel 5 Kandungan kimia (basis kering) gelembung renang ikan cunang (basah, kering), tuna (Thunnus albacares), dan patin (Pangasius sp.)
Komposisi Cunang Persentase (%) basis kering (basah)
Cunang (kering)
Tuna1 Patin2
Abu 0.λ8±0.07a 0.31 ± 0.09b 1.74 0.30
Protein λ3.3λ±0.87a 93.87 ± 0.41a 72.53 λ8.λ2
Lemak 1.83±0.06b 4.10 ± 0.51a 1.44 0.13
Karbohidrat* 3.80±1.00a 1.81 ± 0.81b 17.10 0.65 *dihitung secara by difference
1Pengujian proksimat gelembung renang utuh/segar (basah) dari Thunnus albacares (Kaewdang et al. 2014)
2Pengujian proksimat gelembung renang utuh/segar (basah) dari Pangasius sp. (Yanuardi 2006)
a-bAngka-angka pada kolom yang sama diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%