PATOGENISITAS MIKROORGANISME
ENTOMOPATOGEN DARI KEBUN MURBEI
TERHADAP ULAT SUTRA (Bombyx mori L.) DAN
PENGARUHNYA PADA KUALITAS KOKON
MIMI DERMAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
Patogenisitas Mikroorganisme Entomopatogen dari Kebun Murbei terhadap Ulat Sutra (Bombyx mori L.) dan Pengaruhnya pada Kualitas Kokon
Adalah benar merupakan hasil karya saya sendiri dan belum pernah dipublikasikan. Semua sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2006
ABSTRAK
MIMI DERMAWATI. Patogenisitas Mikroorganisme Entomopatogen dari Kebun
Murbei terhadap Ulat Sutra (Bombyx mori L.) dan Pengaruhnya pada Kualitas Kokon. Dibimbing oleh DEDY DURYADI, MIEN KAOMINI dan TEGUH
SANTOSO.
Rentannya serangga Bombyx mori L (Lepidoptera: Bombycidae) oleh infeksi mikroorganisme entomopatogen (MEP) merupakan permasala han utama dalam budidaya ulat sutra dan mengakibatkan terjadinya penurunan kualiatas kokon. Penelitian ini bertujuan untuk mengisolasi MEP dari kebun murbei (tanah dan daun), kemampuan MEP menginfeksi larva B. mori dan pengaruhnya terhadap kualitas kokon.
Hasil penelitian menunjukkan bahwa MEP yang berhasil diisolasi dari sampel tanah kebun dan daun murbei yaitu nematoda dari famili Steinernematidae, bakteri isolat PT, KP dan PB (tanah) serta isolat PT dan KC (daun). Cendawan yang diisolasi dari tanah yaitu yaitu Beauveria sp., Penicillium sp. dan Metarhizium sp., sedangkan dari daun diisolasi Cladosporium sp., Aspergillus sp.(warna kuning) (As1) dan Aspergillus sp.(warna ungu) (As2).
Potensi tanah dan daun sebagai sumber patogen yang mampu menimbulkan penyakit pada larva adalah sama, kelompok cendawan memiliki kemampuan yang lebih tinggi mematikan larva bila dibandingkan dengan kelompok bakteri dan nematoda.
ABSTRACT
MIMI DERMAWATI. The Pathogenicity of Entomopathogenic Microorganism from Mulberry Plantation to Silkworm (Bombyx mori L.) and their Effect to Cocoon Quality. Under the direction of DEDY DURYADI, MIEN KAOMINI, and TEGUH SANTOSO.
Silkworm diseases constitute a major constraint in sericulture productivity. The purposes of this research were to isolated entomopathogenic microorganism (MEP) from soil and mulberry leaves, to study the potency of MEP to infect larvae and their effect to cocoon quality.
Various patho genic microbes have been isolated from mulberry leaves and soil i.e. nematodes Steinernematidae, bacteria isolate PT, KP and PB from soil and bacteria isolate PT and KC from mulberry leaves. The entomopathogenic fungi isolated from soil were Beauveria sp., Penicillium sp. and Metarhizium sp., from mulberry leaves were Cladosporium sp., Aspergillus sp. (yellow) (As1) and Aspergillus sp. (violet) (As2). Soil was as potensial as mulberry leaves in provoking disease to larvae, fungi has potential better than bacteria and nematodes.
In the pathogenicity test of various isolates, entomopathogenic nematodes (Steinernematidae) isolated from soil caused larval mortality 46%, increased the percentage abnormal cocoon (29,85%), reduced single cocoon weight (1,73 gram) and decreased cocoon shell weight (19,78%). The dark yellow bacteria (KP) isolated from soil reduced the single cocoon weight (1,44 gram) and the light yellow bacteria (KC) isolated from mulberry leaves the decrease cocoon shell weight percentage (19,17%). Aspergillus sp. violet (As2) isolated from mulberry leaves caused larva mortality 60,00%, Aspergillus sp. yellow (As1) isolated from mulberry leaves caused high abnormal cocoon (32,28%).
©Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau keseluruhan dalam bentuk apapun, baik cetak, fotokopi,
PATOGENISITAS MIKROORGANISME
ENTOMOPATOGEN DARI KEBUN MURBEI
TERHADAP ULAT SUTRA (Bombyx mori L.) DAN
PENGARUHNYA PADA KUALITAS KOKON
MIMI DERMAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Megister Sains pada Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian
:
Patogenisitas Mikroorganisme Entomopatogen dari Kebun Murbei terhadap Ulat Sutra (Bombyx mori L.) danPengaruhnya pada Kualitas Kokon
Nama Mahasiswa : Mimi Dermawati
NRP : G 351020171
Program Studi : Biologi
Menyetujui :
1. Komisi Pembimbing
Dr. Ir. Dedy Duryadi S., DEA Ketua
Dr. Mien Kaomini Dr. Ir. Teguh Santoso, DEA Anggota Anggota
2. Ketua Program Studi Biologi 3. Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S., DEA Dr. Khairil A. Notodiputro, MS
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul “Patogenisitas Mikroorganisme Entomopatogen dari Kebun Murbei terhadap Ulat Sutra (Bombyx mori L.) dan Pengaruhnya pada Kualitas Kokon”
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan terima kasih kepada komisi pembimbing, Dr. Ir. Dedy Duryadi S., DEA sebagai Ketua Komisi Pembimbing, Dr. Mien Kaomini dan Dr. Ir. Teguh Santoso, DEA, masing- masing sebagai Anggota Komisi Pembimbing yang telah banyak memberikan pengarahan, bimbingan, saran, motivasi serta bantuan sarana dan prasarana kepada penulis, mulai dari penyusunan usulan penelitian, pelaksanaan penelitian dan penyusunan tesis. Ucapan terima kasih juga penulis ucapkan kepada Penguji Luar Bapak Dr. F.X. Koesharto yang telah banyak memberikan masukan kepada penulis untuk perbaikan dan kelengkapan tesis.
Penulis mengucapkan terima kasih yang setulus-tulusnya kepada keluarga tercinta, Ibunda Hj. Ratna Umar dan Papa Ali Umar (Alm), suami Amrios Amsyar, SE Akt, ananda putri yang tercinta Raisyya Luthfah Annisa, kakak (Dadi, Teta, Teti, Bang Rudi dan Sur ya), ipar (Kuniang Jufri, Uda Jasman dan Uda Samudra) serta para ponakan yang selalu mendoakan dan memberikan dukungan baik moril maupun materil kepada penulis dalam penyelesaian studi.
Terima kasih juga penulis sampaikan kepada teman-teman di Laboratorium Patologi Serangga: Bu Yanti, Bu Eli, Bu Zul, Lia, Duan, Dede, Ipung dan teman-teman angkatan 2002 Program Studi Biologi Pascasarjana IPB, serta semua pihak yang tidak bisa penulis sebut satu persatu juga diucapkan terima kasih atas kerjasama dan bantuannya.
Semoga Allah SWT memberikan balasan amal baik kepada mereka semua dengan balasan yang tak terhingga. Akhirnya semoga tulisan ini bermanfaat.
Bogor, September 2006
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 14 Juli 1977 di Padang, Sumatera Barat dari keluarga Bapak Ali Umar (Alm) dan Ibu Hj Ratna Umar.
Penulis menamatkan pendidikan SD pada tahun 1990 di SD Negeri I Kurai Taji, SMP tahun 1993 di SMP Negeri 3 Pariaman dan SMA Negeri I Pariaman tahun 1996. Pada tahun yang sama penulis melanjutkan studi ke Universitas Andalas Padang pada Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Jurusan Biologi dan lulus tahun 2001.
Pada tahun ajaran 2002/2003 penulis diterima sebagai Mahasiswa Sekolah Pascasarjana Institut Pertanian Bogor pada Program Studi Biologi Sub Program Zoologi dengan biaya sendiri.
Penulis menikah dengan Amrios Amsyar SE.Ak, pada tanggal 6 November 2005 dan penulis telah dikaruniai seorang putri yang diberi nama
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ...ix
PENDAHULUAN Latar Belakang... 1
Tujuan Penelitian... 2
Hipotesis ... 3
Manfaat Penelitian... 3
Ruang Lingkup Penelitian... 3
TINJAUAN PUSTAKA Bombyx mori L ... 4
Biologi dan fisiologi ... 4
Kokon dan serat sutra ... 5
Penyakit pada B. mori... 6
Mikroorganisme Entomopatogen ... 6
Nematoda entomopatogen ... 6
Bakteri entomopatogen... 8
Cendawan entomopatogen... 9
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 11
Koleksi Tanah dan Daun Murbei ... 11
Pemeliharaan Serangga ... 11
Isolasi Mikroorganisme Entomopatogen... 14
Uji Tapis dan Potensi MEP Sebagai Patogen... 17
PATOGENISITAS MIKROORGANISME
ENTOMOPATOGEN DARI KEBUN MURBEI
TERHADAP ULAT SUTRA (Bombyx mori L.) DAN
PENGARUHNYA PADA KUALITAS KOKON
MIMI DERMAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
Patogenisitas Mikroorganisme Entomopatogen dari Kebun Murbei terhadap Ulat Sutra (Bombyx mori L.) dan Pengaruhnya pada Kualitas Kokon
Adalah benar merupakan hasil karya saya sendiri dan belum pernah dipublikasikan. Semua sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2006
ABSTRAK
MIMI DERMAWATI. Patogenisitas Mikroorganisme Entomopatogen dari Kebun
Murbei terhadap Ulat Sutra (Bombyx mori L.) dan Pengaruhnya pada Kualitas Kokon. Dibimbing oleh DEDY DURYADI, MIEN KAOMINI dan TEGUH
SANTOSO.
Rentannya serangga Bombyx mori L (Lepidoptera: Bombycidae) oleh infeksi mikroorganisme entomopatogen (MEP) merupakan permasala han utama dalam budidaya ulat sutra dan mengakibatkan terjadinya penurunan kualiatas kokon. Penelitian ini bertujuan untuk mengisolasi MEP dari kebun murbei (tanah dan daun), kemampuan MEP menginfeksi larva B. mori dan pengaruhnya terhadap kualitas kokon.
Hasil penelitian menunjukkan bahwa MEP yang berhasil diisolasi dari sampel tanah kebun dan daun murbei yaitu nematoda dari famili Steinernematidae, bakteri isolat PT, KP dan PB (tanah) serta isolat PT dan KC (daun). Cendawan yang diisolasi dari tanah yaitu yaitu Beauveria sp., Penicillium sp. dan Metarhizium sp., sedangkan dari daun diisolasi Cladosporium sp., Aspergillus sp.(warna kuning) (As1) dan Aspergillus sp.(warna ungu) (As2).
Potensi tanah dan daun sebagai sumber patogen yang mampu menimbulkan penyakit pada larva adalah sama, kelompok cendawan memiliki kemampuan yang lebih tinggi mematikan larva bila dibandingkan dengan kelompok bakteri dan nematoda.
ABSTRACT
MIMI DERMAWATI. The Pathogenicity of Entomopathogenic Microorganism from Mulberry Plantation to Silkworm (Bombyx mori L.) and their Effect to Cocoon Quality. Under the direction of DEDY DURYADI, MIEN KAOMINI, and TEGUH SANTOSO.
Silkworm diseases constitute a major constraint in sericulture productivity. The purposes of this research were to isolated entomopathogenic microorganism (MEP) from soil and mulberry leaves, to study the potency of MEP to infect larvae and their effect to cocoon quality.
Various patho genic microbes have been isolated from mulberry leaves and soil i.e. nematodes Steinernematidae, bacteria isolate PT, KP and PB from soil and bacteria isolate PT and KC from mulberry leaves. The entomopathogenic fungi isolated from soil were Beauveria sp., Penicillium sp. and Metarhizium sp., from mulberry leaves were Cladosporium sp., Aspergillus sp. (yellow) (As1) and Aspergillus sp. (violet) (As2). Soil was as potensial as mulberry leaves in provoking disease to larvae, fungi has potential better than bacteria and nematodes.
In the pathogenicity test of various isolates, entomopathogenic nematodes (Steinernematidae) isolated from soil caused larval mortality 46%, increased the percentage abnormal cocoon (29,85%), reduced single cocoon weight (1,73 gram) and decreased cocoon shell weight (19,78%). The dark yellow bacteria (KP) isolated from soil reduced the single cocoon weight (1,44 gram) and the light yellow bacteria (KC) isolated from mulberry leaves the decrease cocoon shell weight percentage (19,17%). Aspergillus sp. violet (As2) isolated from mulberry leaves caused larva mortality 60,00%, Aspergillus sp. yellow (As1) isolated from mulberry leaves caused high abnormal cocoon (32,28%).
©Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau keseluruhan dalam bentuk apapun, baik cetak, fotokopi,
PATOGENISITAS MIKROORGANISME
ENTOMOPATOGEN DARI KEBUN MURBEI
TERHADAP ULAT SUTRA (Bombyx mori L.) DAN
PENGARUHNYA PADA KUALITAS KOKON
MIMI DERMAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Megister Sains pada Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian
:
Patogenisitas Mikroorganisme Entomopatogen dari Kebun Murbei terhadap Ulat Sutra (Bombyx mori L.) danPengaruhnya pada Kualitas Kokon
Nama Mahasiswa : Mimi Dermawati
NRP : G 351020171
Program Studi : Biologi
Menyetujui :
1. Komisi Pembimbing
Dr. Ir. Dedy Duryadi S., DEA Ketua
Dr. Mien Kaomini Dr. Ir. Teguh Santoso, DEA Anggota Anggota
2. Ketua Program Studi Biologi 3. Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S., DEA Dr. Khairil A. Notodiputro, MS
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul “Patogenisitas Mikroorganisme Entomopatogen dari Kebun Murbei terhadap Ulat Sutra (Bombyx mori L.) dan Pengaruhnya pada Kualitas Kokon”
Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan terima kasih kepada komisi pembimbing, Dr. Ir. Dedy Duryadi S., DEA sebagai Ketua Komisi Pembimbing, Dr. Mien Kaomini dan Dr. Ir. Teguh Santoso, DEA, masing- masing sebagai Anggota Komisi Pembimbing yang telah banyak memberikan pengarahan, bimbingan, saran, motivasi serta bantuan sarana dan prasarana kepada penulis, mulai dari penyusunan usulan penelitian, pelaksanaan penelitian dan penyusunan tesis. Ucapan terima kasih juga penulis ucapkan kepada Penguji Luar Bapak Dr. F.X. Koesharto yang telah banyak memberikan masukan kepada penulis untuk perbaikan dan kelengkapan tesis.
Penulis mengucapkan terima kasih yang setulus-tulusnya kepada keluarga tercinta, Ibunda Hj. Ratna Umar dan Papa Ali Umar (Alm), suami Amrios Amsyar, SE Akt, ananda putri yang tercinta Raisyya Luthfah Annisa, kakak (Dadi, Teta, Teti, Bang Rudi dan Sur ya), ipar (Kuniang Jufri, Uda Jasman dan Uda Samudra) serta para ponakan yang selalu mendoakan dan memberikan dukungan baik moril maupun materil kepada penulis dalam penyelesaian studi.
Terima kasih juga penulis sampaikan kepada teman-teman di Laboratorium Patologi Serangga: Bu Yanti, Bu Eli, Bu Zul, Lia, Duan, Dede, Ipung dan teman-teman angkatan 2002 Program Studi Biologi Pascasarjana IPB, serta semua pihak yang tidak bisa penulis sebut satu persatu juga diucapkan terima kasih atas kerjasama dan bantuannya.
Semoga Allah SWT memberikan balasan amal baik kepada mereka semua dengan balasan yang tak terhingga. Akhirnya semoga tulisan ini bermanfaat.
Bogor, September 2006
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 14 Juli 1977 di Padang, Sumatera Barat dari keluarga Bapak Ali Umar (Alm) dan Ibu Hj Ratna Umar.
Penulis menamatkan pendidikan SD pada tahun 1990 di SD Negeri I Kurai Taji, SMP tahun 1993 di SMP Negeri 3 Pariaman dan SMA Negeri I Pariaman tahun 1996. Pada tahun yang sama penulis melanjutkan studi ke Universitas Andalas Padang pada Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Jurusan Biologi dan lulus tahun 2001.
Pada tahun ajaran 2002/2003 penulis diterima sebagai Mahasiswa Sekolah Pascasarjana Institut Pertanian Bogor pada Program Studi Biologi Sub Program Zoologi dengan biaya sendiri.
Penulis menikah dengan Amrios Amsyar SE.Ak, pada tanggal 6 November 2005 dan penulis telah dikaruniai seorang putri yang diberi nama
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ...ix
PENDAHULUAN Latar Belakang... 1
Tujuan Penelitian... 2
Hipotesis ... 3
Manfaat Penelitian... 3
Ruang Lingkup Penelitian... 3
TINJAUAN PUSTAKA Bombyx mori L ... 4
Biologi dan fisiologi ... 4
Kokon dan serat sutra ... 5
Penyakit pada B. mori... 6
Mikroorganisme Entomopatogen ... 6
Nematoda entomopatogen ... 6
Bakteri entomopatogen... 8
Cendawan entomopatogen... 9
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 11
Koleksi Tanah dan Daun Murbei ... 11
Pemeliharaan Serangga ... 11
Isolasi Mikroorganisme Entomopatogen... 14
Uji Tapis dan Potensi MEP Sebagai Patogen... 17
Uji Patogenisitas ... 18
Analisis Kokon... 19
Pengamatan... 20
Analisis Data ... 21
HASIL DAN PEMBAHASAN Isolasi Mikroorganisme dari Tanah dan Daun Murbei ...22
Infeksi Virus dan Protozoa dalam Penelitian ... 24
Uji Tapis dan Potensi MEP dalam Menimbulkan Penyakit ... 26
Identifikasi MEP ... 30
Identifikasi nematoda entomopatogen ... 30
Identifikasi bakteri entomopatogen ... 31
Identifikasi cendawan entomopatogen ... 32
Uji Patogenisitas ... 35
Mortalitas ... 35
Kokon abnormal ... 40
Bobot kokon betina ... 43
Bobot kulit kokon... 44
SIMPULAN DAN SARAN ... 46
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
1. Hasil isolasi mikroorganisme dari tanah dan daun murbei ... 22
DAFTAR GAMBAR
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Kegiatan persutraan alam sudah cukup lama dikenal dan dibudidayakan oleh penduduk beberapa daerah di Indonesia. Karena sifatnya yang padat karya, budidaya ini mampu memperluas lapangan kerja, meningkatkan taraf hidup dan menambah penghasilan masyarakat, menanggulangi masalah tenaga kerja, menghasilkan devisa dan berperan dalam kegiatan produksi sandang (Samsijah & Andadari 1995).
Ulat sutra (Bombyx mori L.) merupakan serangga penghasil serat sutra yang telah mengalami domestifikasi sehingga rentan terhadap infeksi patogen. Kelompok mikroorganisme entomopatogen yang paling sering menginfeksi larva B. mori antara lain oleh bakteri, jamur, virus dan protozoa (mikrosporidia) (Atmosoedarjo et al. 2000). Singh & Saratchandra (2003) menyatakan bahwa penyakit pebrin yang disebabkan mikrosporidia, Nosema bombycis, merupakan penyakit yang paling berbahaya pada ulat sutra dan mampu menghancurkan kegiatan persutraan alam dalam waktu yang sangat singkat. Kelompok nematoda entomopatogen belum dilaporkan menginfeksi B. mori, namun diduga kelompok ini juga berpotensi menimbulkan penyakit karena sifat nematoda entomopatogen yang mempunyai kisaran inang cukup luas dan kurang spesifik (Tanada & Kaya 1993).
Keberadaan patogen dalam pemeliharaan ulat sutra berasal dari ruang dan peralatan pemeliharaan, sedangkan kondisi lingkungan (suhu dan kelembaban) serta kualitas daun murbei sebagai pakan merupakan faktor yang mempercepat penyebaran penyakit (Nataraju et al. 2002). Di Sulawesi Selatan lebih dari 60% ulat sut ra terserang oleh penyakit Aspergillus (Hee 1998), sedangkan di India kegagalan panen kokon akibat penyakit mencapai 30 - 40% (Baig et al. 1990).
meliputi para pekerja dan sterilisasi tubuh larva dengan menggunakan bahan disinfektan tubuh. Watanabe (2002) menganjurkan untuk mengembangkan pemeliharaan bibit ulat sutra yang resisten terhadap infeksi virus karena masuknya virus dalam pemeliharaan tidak dapat dikontrol. Singh et al. (2002) mendapatkan CSR hibrid sebagai bibit ulat sutra yang larva instar besarnya lebih resisten terhadap infeksi cendawan Aspergillus sp.. Namun sejauh ini serangan penyakit dalam pemeliharaan ulat sutra belum dapat ditanggulangi sepenuhnya
Daun murbei (Morus spp.) merupakan satu-satunya pakan bagi ulat sutra. Dengan sifat mono fagi ini menjadikan pakan sebagai faktor penentu keberhasilan dalam pemeliharaan. Hasil penelitian Sharma et al. (2003) menunjukkan terjadinya cross infectivity patogenantara hama penggulung daun murbei Diaphania pulverulentalis (Hampsom.) yang terinfeksi di lapangan dengan larva ulat sutra. Hal ini mengindikasikan bahwa serangan penyakit pada ulat sutra dapat terjadi melalui kontaminasi daun murbei oleh berbagai patogen yang penyebarannya dibantu oleh hama kebun murbei. Namun sampai sejauh ini belum ada data memadai yang menunjukkan keberadaan mikroorganisme entomopatogen pada daun murbei dan menimbulkan penyakit pada larva dan kokon sut ra. Dengan demikian perlu dilakukan kajian yang lebih komprehensif terhadap sumber infeksi, mikroorganisme penginfeksi serta akibat-akibat infeksi.
Hal ini penting dilakukan karena pada tingkat infeksi lanjut larva menjadi lemah dan mati kalaupun ada yang mampu bertahan hidup akan mengalami gangguan fisiologis seperti pembentukan kokon yang tidak normal, pupa mati dalam kokon bahkan gagal dalam pembentukan kokon yang secara langsung mempengaruhi produksi kokon dan kualitas serat.
Tujuan Penelitian
Hipotesis
1. Mikroorganisme entomopatogen (MEP) yang mengkontaminasi pakan daun murbei dapat menjadi salah satu sumber infeksi pada larva B. mori. 2. Infeksi MEP pada larva B. mori berpengaruh terhadap kualitas kokon.
Manfaat Penelitian
Diharapkan penelitian ini bermanfaat dalam menangani permasalahan persutraan alam Indonesia terutama kegagalan panen kokon akibat infeksi oleh mikroorganisme entomopatogen.
Ruang Lingkup Penelitian Ruang lingkup penelitian ini meliputi :
1. Isolasi mikroorganisme (nematoda, bakteri dan cendawan) dari sampel daun murbei dan tanah kebun murbei.
2. Uji tapis MEP terhadap B. mori dan potensinya dalam penurunan produktivitas persutraan alam.
TINJAUAN PUSTAKA
Bombyx mori L. Biologi dan fisiologi
Ulat sutra Bombyx mori L (Lepidoptera: Bombycidae) merupakan serangga yang biasa dipelihara dalam ruangan dan penghasil sut ra utama, meliputi 95% produksi sutra dunia. Sebutan lain adalah ulat sut ra murbei karena secara alami hanya makan daun murbei (Morus spp.) dan sutra yang dihasilkan dikenal sutra alam murbei (Sunanto 1997).
B. mori merupakan serangga dengan metamorfosis sempurna, endopterigota yaitu serangga dengan perkembangan sayap terjadi di dalam tubuh dan fase pradewasa berbeda denga n fase dewasa baik morfologi ataupun perilaku makan. Secara keseluruhan siklus hidup yang dilalui ulat sut ra meliputi telur, larva, pupa dan dewasa (imago). Pada masing- masing akhir instar ditandai dengan pergantian kulit (molting). Lamanya periode hidup mulai saat menetaskan telur sampai masa membuat kokon sekitar satu bulan dan sangat tergantung pada iklim serta keadaan lingkungan (Atmosoedarjo et al. 2000).
Sistem pencernaan makanan pada B. mori sangat sederhana, saluran makanan menyerupai tabung yang me ngecil pada bagian depan dan belakang. Bagian saluran makanan (alimentary canal) adalah: bagian depan (stomodeum) berfungsi menghancurkan makanan yang dicampur dengan air ludah. Bagian tengah (mesenteron) berfungsi dalam sekresi cairan pencernaan (enzim) dan penyerapan nutrisi. Bagian belakang (proktodeum) berfungsi menyerap air dan membentuk bahan makanan yang tidak dicerna menjadi padat, selanjutnya akan dikeluarkan melalui anus (Krishnaswami et al. 1973).
Korpus allatum menghasilkan hormon juvenil yang fungsi utamanya yaitu mengatur metamorfosis pada serangga pradewasa dan mengatur sintesis yolk dan deposisinya ke dalam oosit pada serangga dewasa (Chapman 1998).
Kokon dan serat sut ra
Kokon adalah rajutan filamen sut ra yang dihasilkan kelenjar sutra melalui proses insolubisasi yang disebabkan oleh aksi mekanik pengeluaran cairan sut ra (spinning), dan berfungsi sebagai pelindung saat berlangsungnya proses metamorfosis (Rukaesih et al. 1991). Bagian luar kokon berupa serat sutra yang membungkus kokon secara rapi dengan warna dan kehalusannya sangat ditentukan oleh jenis serangga penghasil sutra dan bahan pakannya (Lee 2000; Sunanto 1997).
Produk dari kokon yang sangat penting adalah serat atau filamen sutra. Serat sutra dihasilkan oleh sepasang kelenjar sutra (silk gland) dengan bagian-bagian seperti : a). Bagian depan merupakan saluran pengeluaran kelenjar yang terbuka pada ujungnya tepat di bawah mulut larva; b). Bagian tengah, bagian ini sebagai penghasil zat warna yang dibentuk bersama Serisin (C15H23N5O8) yang berfungsi sebagai perekat dua serat paralel dengan proporsi 25% dari bobot serat dan bersifat mudah larut dalam air panas; c). Bagian belakang kelenjar, sebagai penghasil serat sutra yang disebut Fibroin (C15H26N5O6) merupakan bagian utama serat filamen dengan proporsi 75% dari bobot total serat dan tidak larut dalam air panas (Tazima 1978).
Fibroin dan Serisin seluruhnya terbentuk dari protein murni yang mengandung berbagai asam amino. Fibroin tidak larut dalam air karena memiliki struktur molekul yang longgar dan kaya dengan asam amino hidrofobik seperti Glisin, Alanin, Serin dan Tirosin, sedangkan asam amino terbanyak pada Serisin adala h Serin, Asam Aspartat, Asam Glutamat, Glisin dan Treonin (Rukaesih et al. 1991).
kokon seperti kacang tanah (peanut), ras Cina berbentuk jorong (oval), dan Polivoltin berbentuk gelendong (spindle) (Lee 2000). Kokon tidak normal terdiri atas beberapa macam antara lain: kokon rangkap, berlubang, kotor bagian dalam, kotor bagian luar, ujung tipis, kulit tipis, bentuk menyimpang, berbulu, kulit berlapis dan kokon berlekuk (Atmosoedarjo et al. 2000).
Penyakit pada B. mori
Penyakit pada B. mori telah dipelajari sejak serikultur dikenal manusia, namun baru pada abad ke-19 diketahui bahwa patogen yang menyebabkan ketidaknormalan itu adalah sejenis mikrooganisme. Pada tahun 1835, Bassi de Lodi membuktikan bahwa cendawan dapat menyebabkan penyakit pada ulat sutra. Tahun 1870 Louis Pasteur juga mempublikasikan penyakit pada ulat sutra yang disebabkan oleh mikrosporidia dan bakteri (Steinhaus 1949).
Pada saat ini, penyakit serangga lebih intensif dipelajari dalam Patologi Serangga yang secara sempit diartikan sebagai salah satu cabang Entomologi yang mempelajari prinsip-prinsip patologi dengan menjadikan serangga sebagai model (Santoso 1993). Dalam arti luas patologi serangga berhubungan dengan pengamatan-pengamatan mengenai penyebab, simtomatologi dan epizootiologi penyakit serta perubahan-perubahan struktur kimia dan fungsi pada tubuh serangga akibat serangan penyakit. Adapun penyakit dapat dikatakan suatu penyimpangan dari kondisi normal (sehat) atau suatu kondisi yang tidak seimbang antara keadaan fisiologi serangga dengan lingkungannya (Tanada & Kaya 1993).
Mikroorganisme Entomopatogen
Nematoda entomopatogen • Morfologi dan anatomi
usus, rectum dan anus, umumnya nematoda entomopatogen tidak memiliki stilet (Tanada & Kaya, 1993).
Nematoda entomopatogen terdiri atas 2 famili penting yaitu famili Steinernematidae yang terdiri atas 2 genus yaitu Steinernema dan Neosteinernema dan famili Heterorhabditidae yang mempunyai 1 genus yaitu Heterorhabditis. Juvenil infektif (j.i.) dari genus Steinernema mempunyai panjang total tubuh berkisar 700 µm dan terdiri atas 22 spesies, genus Heterorhabditis mempunyai panjang tatal tubuh j.i. berkisar 0,6 – 0,7 mm dan terdiri atas 8 spesies, sedangkan genus Neosteirnernema hanya mempunyai satu spesies yaitu N. longicurvicauda (Wouts 1991).
• Patogenesis
Nematoda entomopatogen Steinernematidae dan Heterorhabditidae dicirikan oleh hubungan mutualistik dengan bakteri Xenorhabdus spp. dan Photorhabdus spp.. Genus Xenorhabdus untuk Steinernema spp. dan Photorhabdus dengan Heterorhabditis spp. (Boemare et al. 1996). Xenorhabdus terdiri atas 5 spesies penting yaitu X. nemathophillus, X. bovienii, X. poinarii, X. beddingii dan X. japonica serta Photorhabdus yang hanya memiliki satu spesies yaitu P. luminescens (Kaya & Gaugler 1993).
Pada proses infeksi serangga, j.i. memasuki lubang- lubang alami seperti spirakel, mulut, anus dan penetrasi langsung dengan cara merobek kutikula menggunakan gigi (Kaya & Gaugler 1993). J.i. masuk ke hemosel inang dengan membawa bakteri spesifik dalam ususnya kemudian melepaskan bakteri simbion yang berkembang biak dengan cepat serta menghasilkan toksin yang membunuh inang (Walsh & Webster 2003).
• Gejala Infeksi
Gejala dan tanda serangga yang terinfeksi nematoda dapat dikelompokkan menjadi tiga, yaitu efek internal, eksternal dan perilaku. Gejala umum yang terjadi adalah berkurangnya aktivitas makan larva, larva lemah dan kurangnya aktivitas bergerak dan akhirnya larva akan mati secara septicemia. Ciri spesifik yang ditemukan pada larva yang terinfeksi nematoda entomopatogen yaitu tubuh larva menjadi lembek dan bila dibedah, konstitusi jaringan dalam akan hancur dan cair (Kaya et al. 1993). Invasi nematoda terjadi 7 – 15 hari setelah infeksi (Kaya & Gaugler 1990) dan setelah 1 - 3 generasi beberapa ribu j.i. baru akan muncul dari bangkai inang dengan membawa bakteri simbion (Perez et al. 2003).
Bakteri entomopatogen
• Proses infeksi dan toksisitasBakteri entomopatogen yang mampu menimbulkan penyakit pada serangga apabila termakan disebut patogen sejati, sedangkan yang hanya mampu menimbulkan penyakit apabila serangga dalam kondisi yang lemah disebut dengan patogen potensial (Tanada & Kaya 1993).
Pada ulat sutra, mekanisme infeksi oleh bakteri umumnya melalui saluran pencernaan. Bakteri masuk melalui pakan yang terkontaminasi, masuk ke saluran pencernaan dan bakteri akan berkembang biak dengan membelah diri. Pada serangan sistemik, bakteri sampai di hemolim serangga melalui sistem peredaran darah, selanjutnya bakteri sampai ke jaringan tubuh lain dan merusak jaringan lainnya yang menyebabkan kematian pada serangga (Atmosoedarjo et al. 2000).
mesenteron dan toksin akan membentuk pori-pori kecil berukuran 0,5 – 1,0 nm. Akibatnya keseimbangan osmotik sel menjadi terganggu, ion-ion dan air mudah masuk ke dalam sel yang menyebabkan sel mengembang dan pecah sehingga akhirnya menyebabkan lisis (hancur) dan kematian pada serangga (Tanada & Kaya 1993).
• Gejala infeksi
Saluran makanan merup akan organ pertama yang diserang bakteri dengan tanda-tanda awal serangan secara umum yaitu menurunnya aktivitas makan dan pegerakan, daya keseimbangan tubuh berkurang, muntah, diare dan selanjutnya larva mati secara septicemia (Steinhaus 1949). Ciri spesifik baru dapat diamati pada bangkai larva terjadi paralisis di bagian mulut (saluran pencernaan) bahkan seluruh tubuh, bangkai serangga berwarna hitam dan mengeluarkan bau menyengat (Tanada & Kaya 1993). Infeksi bakteri pada ulat sutra menimbulkan penyakit “ Flacheri ” (Atmosoedarjo et al. 2000).
Menurut Steinhaus (1949) gejala infeksi larva Lepidoptera yang terserang B. thuringiensis ditandai dengan penurunan aktivitas makan dan berkurangnya mobilitas larva beberapa jam setelah infeksi, larva menjadi lemah dan larva kurang tanggap terhadap sentuhan. Setelah larva mati, larva kelihatan berwarna coklat tua atau hitam dan perubahan warna biasanya dimulai dari bagian anterior terus ke bagian posterior. Tubuh larva kemudian mengering dan mengkerut dengan integumen yang masih utuh, pupa dan imago mungkin terbentuk meskipun dalam kondisi terinfeksi, tetapi umumnya pupa atau imago berukuran kecil, cacat atau mandul (Tanada & Kaya 1993).
Cendawan entomopatogen • Mekanisme infeksi
Empat tahap proses infeksi cendawan pada serangga, antara lain: a). Kontak antara propagul cendawan dengan serangga inang, senyawa mukopolisakarida memegang peranan yang sangat penting; b). Penempelan dan perkecambahan propagul cendawan pada integumen serangga, kelembaban udara tinggi bahkan kadang-kadang air diperlukan untuk perkecambahan propagul cendawan; c). Tahap penetrasi dan invasi, untuk melakukan penetrasi menembus integumen cendawan membentuk tabung kecambah dan appresorium. Penembusan dilakukan secara mekanis atau kimia yaitu dengan mengeluarkan enzim atau toksin; d). Tahap destruksi dengan titik penetrasi terbentuk blastospora yang kemudian beredar dalam hemolim dan membentuk hifa sekunder untuk menyerang jaringan lain (Tanada & Kaya 1993).
Infeksi melalui saluran pencernaan makanan dapat terjadi apabila konidia cendawan tertelan sewaktu larva makan dan terbawa ke dalam saluran pencernaan 72 jam setelah infeksi (Broome et al. 1976). Ujung hifa akan mene mbus dinding saluran pencernaan dalam waktu 60 – 72 jam yang menyebabkan cairan saluran pencernaan masuk ke dalam hemosel, akibatnya terjadi perubahan pH dalam saluran pencernaan dan hemolim (Broome et al. 1976). Dengan bantuan sistem sirkulasi darah fragmen cendawan menyerang jaringan lain seperti jaringan adiposa, otot, sistem saraf, sistem kelenjar, tabung malpigi dan lain- lain. Pada infeksi lanjut sirkulasi darah lambat bahkan berhenti yang mengakibatkan kematian pada larva yang terinfeksi (Tanada & Kaya 1993). Setelah mati, cendawan berkembang pada berbagai jaringan dan tumbuh keluar menutupi seluruh tubuh dengan membentuk miselia sampai muncul konidia baru yang gampang lepas dan me njadi sumber infeksi berikutnya (Steinhaus 1949).
• Gejala infeksi
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Patologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini berlangsung dari Juli 2004 sampai dengan Juli 2005.
Koleksi Tanah dan Daun Murbei
Tanah dan daun murbei (Morus spp.) dikoleksi dari kebun penelitian kampus IPB Gunung Gede. Pengambilan sampel dilakukan dengan cara membagi kebun murbei (18 x 9) m2 menjadi 9 bagian yang sama (6 x 3) m2, pada masing-masing bagian ditentukan 5 titik secara acak untuk pengambilan sampel tanah dan daun (Lampiran 1).
Tanah diambil dengan menggunakan tabung yang berdiameter 12 cm dan tinggi 25 cm pada kedalaman 10 cm dan dihomogenkan, dimasukan ke dalam plastik dan dikemas sedemikian rupa sehingga tidak ada kontak dengan udara luar dan selanjutnya diproses di laboratorium. Sampel daun diambil pada tiga bagian tanaman murbei yaitu daun bagian atas (lembaran kedua dan ketiga dari pucuk), daun bagian tengah dan daun bagian bawah (Lampiran 2).
Pemeliharaan Serangga
Tenebrio molitor
Bombyx mori L.
Sterilisasi dan desinfeksi
Semua peralatan yang digunakan untuk pemeliharaan ulat sutra sebelum digunakan dilakukan sterilisasi panas untuk alat yang tahan panas dan perendaman dalam larutan disinfektan untuk yang tidak tahan panas. Pakan yang diberikan pada ulat sutra adalah pakan alami yaitu daun murbei (Morus spp.). Untuk menghindari terjadinya kontaminasi pada daun, dilakukan sterilisasi daun seperti pada Gambar 1.
Keterangan: A. Daun setelah direndam; B. Sterilisasi daun dalam Laminar Air Flow dengan sinar UV; C. Daun steril sebagai pakan
Daun direndam dalam larutan disinfektan selama ± 5 menit, dicuci di bawah air mengalir sebanyak 3 kali, ditiriskan, dikeringanginkan dan disterilisasi di bawah sinar UV dalam Laminar Air Flow. Untuk mempertahankan kondisi daun tetap segar, daun dibungkus dengan kantong plastik dan disimpan dalam lemari pendingin suhu 15°C.
Penetasan dan pemeliharaan
Telur B. mori yang digunakan pada penelitian ini adalah telur dari ras Cina dengan ciri utama telur berwarna hijau, larva polos dan kokon berbentuk bulat (oval). Telur-telur yang dihasilkan ngengat direndam dalam larutan formalin 2% selama 5 menit dan dikeringanginkan. Telur yang sudah kering direndam selama 5 menit dalam larutan HCl dengan berat jenis (BJ) 1.076 pada temperatur 46°C, kemudian dicuci di bawah air mengalir selama 1 jam untuk menghilangkan sisa asam yang menempel pada kulit telur, dikeringanginkan dan disimpan sampai telur menetas selama ± 10 hari.
Gambar 1. Sterilisasi daun murbei sebagai pakan larva B. mori
Telur yang siap menetas ditempatkan pada cawan petri, satu atau dua hari sebelum menetas bagian atas telur akan terlihat bintik hitam. Telur ditunggu sampai semua menetas, larva yang keluar lebih dulu disimpan pada suhu 5ºC (Gambar 2).
Gambar 2. Penetasan telur B. mori
Setelah larva keluar semuanya dilakukan hakitate yaitu pemberian pakan pertama daun murbei muda yang dirajang dengan ukuran (1 x 1) cm2. Pemeliharaan larva instar kecil dan instar besar dilakukan seperti pada Gambar 3.
Keterangan : A. Larva instar (instar III) kecil ; B. Larva instar besar (instar V)
Larva instar kecil (instar I – instar III) diberi pakan daun muda yang telah dirajang dengan frekuensi pemberian pakan 3 kali sehari yaitu pagi (08.00), siang (12.00) dan sore (16.00). Larva instar besar (instar IV dan instar V) diberi pakan daun yang lebih tua dan utuh dengan frekuensi pemberian pakan 4 kali sehari yaitu pagi (08.00), siang (12.00), sore (16.00) dan malam (20.00). Jumlah pakan yang diberikan tidak terbatas (ad libitum).
Gambar 3. Pemeliharaan larva B. mori
A B
Pada waktu larva mengalami pergantian kulit, dilakukan disinfeksi menggunakan campuran kapur tohor dan kaporit dengan perbandingan (95 : 5) untuk ulat kecil dan (90 : 10) untuk ulat besar. Disinfektan ditaburkan merata pada bagian tubuh larva menggunakan ayakan halus pada saat makan pertama pergantian instar, sedangkan pada saat larva melakukan pergantian kulit, tubuh larva ditaburi dengan kapur tohor.
Pengokonan dan panen kokon
Pada akhir instar V tubuh larva sudah terlihat transparan, larva dipindahkan ke dalam alat pengokonan, diberi label sesuai dengan perlakuan dan ditempatkan dalam rak pengokonan (Gambar 4). Panen kokon dilakukan satu minggu dari awal pengokonan.
Keterangan: A. Tempat pengokonan, B. Rak pengokonan.
Isolasi Mikroorganisme Entomopatogen
Nematoda entomopatogen
Isolasi nematoda dari tanah dilakukan dengan menempatkan 10 ekor serangga perangkap T. molitor dalam wadah gelas yang berisi 200 g tanah yang sudah dilembabkan; wadah gelas dibalik sehingga larva ditutupi tanah dan diinkubasi pada suhu kamar selama 3 hari. Terhadap T. molitor yang terinfeksi nematoda dilakukan White trap (Bedding & Akhurst 1975 dalam Kaya & Stock 1997) yaitu dengan cara meletakkan secara terbalik penutup petri ukuran kecil (Ø 5 cm) di dalam petri ukuran sedang (Ø 10 cm). Petri ukuran sedang diisi air steril
Gambar 4. Pengokonan larva B. mori
sebanyak 20 ml, kertas saring diletakkan di atas petri kecil dengan ujungnya mencapai permukaan air dan bangkai larva diletakkan di atas kertas saring lembab. Juvenil infektif (j.i.) yang terperangkap dalam air dipanen setiap 2 hari selama 2 minggu. Hasil panen ditampung pada labu erlemeyer dan disimpan dalam inkubator pada suhu 10º C (Gambar 5).
Keterangan : A. Ekstraksi nematoda tanah ; B. Infeksi kertas saring ; C. White trap ; D. Perbanyakan nematoda secara in vivo ; E. Penyimpanan nematoda.
Metode yang sama juga dilakukan terhadap sampel daun yaitu dengan cara memotong bagian daun yang rusak (robek dan berlubang kecil) dengan ukuran (1 x 1) cm2 sebanyak 10 potongan, dan dilakukan white trap. Panen j.i. juga dilakukan setiap 2 hari selama 2 minggu (Gambar 6).
Keterangan: A. Ekstraksi nematoda daun ; B. Infeksi kertas saring, C. White trap,
Perbanyakan dan pemurnian nematoda dilakukan secara in vivo pada larva T. molitor dengan menggunakan metode infeksi kertas saring (Wooding and Kaya 1998). Metode ini dilakukan dengan cara satu mililiter suspensi nematoda diencerkan dalam 9 ml aquades steril, ditularkan pada 20 larva T. molitor dan diinkubasi pada suhu kamar. Setelah 3 – 4 hari, terhadap larva yang terinfeksi dilakukan white trap. Nematoda yang terperangkap di dalam air dipanen setiap 2 hari selama 2 minggu.
Gambar 5. Teknik isolasi nematoda dari tanah C
A B D E
Gambar 6. Teknik isolasi nematoda dari daun murbei
Bakteri entomopatogen
Isolasi bakteri dari tanah dan daun dilakukan dengan membuat homogenat tanah (2 gram tanah dalam 20 ml aquades) dan homogenat daun (2 gram daun digerus dalam 20 ml aquades steril) dan disaring. Homogenat yang didapat dikocok dengan vorteks selama 5 menit. Selanjutnya masing- masing homogenat diencerkan dengan faktor pengenceran 106 dan 107, hasil pengenceran diinokulasikan sebanyak 0,1 ml pada cawan petri yang berisi media NA, dilabel dan diinkubasi pada suhu ruangan selama 48 jam dengan masing- masing 3 ulangan.
Koloni bakteri yang tumbuh setelah masa inkubasi dimurnikan dengan cara memindahkan masing- masing sel bakteri yang berbeda (berdasarkan perbedaan warna) pada tabung reaksi kecil dengan metode media miring. Biakan murni ini diinkubasi selama 48 jam pada suhu ruangan dan disimpan dalam lemari pendingin suhu 15ºC.
Cendawan entomopatogen
Untuk mendapatka cendawan entomopatogen (CEP) dari tanah dilakukan dengan metode Insect Baiting (Zimmermann 1986) (Gambar 7). Metode ini dilakukan dengan cara menempatkan 100 gram sampel tanah ke dalam cawan petri dan ditambahkan 10 ekor larva T. molitor. Cawan petri ditutup dan diinkubasi pada suhu kamar selama 14 hari dan secara periodik larva diamati. Larva yang terinfeksi CEP dicirikan dengan munculnya cendawan dari dalam tubuh larva yang dapat diamati dari ruas-ruas tubuh T. molitor.
Keterangan: A. Metode serangga perangkap; B. Larva terinfeksi bersporulasi; C. Suspensi cendawan dari larva terinfeksi, D. Pembiakan cendawan pada media agar PDA.
Untuk mengisolasi cendawan dari daun dilakukan dengan membuat homogenat daun (2 gram daun digerus dalam 20 ml aquades steril) dan disaring, masing- masing homogenat diencerkan dengan faktor pengenceran 105 dan 106 . Hasil pengenceran ditanamkan sebanyak 0,1 ml pada cawan petri yang berisi media PDA, diberi label dan diinkubasi pada suhu kamar selama 3 hari. Koloni cendawan yang tumbuh setelah masa inkubasi dipindahkan pada cawan petri yang berisi media baru dan disimpan dalam inkubator pada suhu 15ºC.
Uji Tapis dan Potensi MEP Sebagai Patogen
[image:42.596.169.404.87.331.2]Uji tapis MEP dilakukan dengan menginfeksikan MEP yaitu: 100 ekor nematoda dalam 2 ml aquades steril pada daun murbei untuk pakan 20 ekor larva uji B. mori instar II hari pertama. Hal yang sama juga dilakukan untuk bakteri dan cendawan dengan menginfeksikan ekstraks kasar bakteri dan cendawan. Uji tapis dilakukan untuk memilah mikrob yang benar-benar patogenik. Isolat nematoda yang mematikan larva uji disebut ne matoda entomopatogen (NEP), isolat bakteri yang mematikan larva uji disebut sebagai bakteri entomopatogen (BEP) dan isolat
Gambar 7. Isolasi cendawan entomopatogen dari tanah kebun murbei D
C
cendawan yang mematikan larva uji disebut cendawan entomopatogen (CEP). Pengamatan dilakukan terhadap tingkat mortalitas larva dan me nganalisis potensi MEP sebagai patogen. Mikrob patogenik diteliti lebih lanjut patogenisitasnya terhadap larva ulat sutra.
Identifikasi MEP
Identifikasi NEP dilakukan dengan membuat preparat nematoda pada gelas objek yang telah ditetesi larutan Ringer, kemudian ditutup dengan gelas penutup dan diamati di bawah mikroskop cahaya. Sebagai pedoman identifikasi digunakan buku Entomopathogenic Nematology (Adams & Nguyen 2002).
Identifikasi BEP dilakukan secara makroskopis yaitu dengan melihat perbedaan warna pada masing- masing koloni bakteri, bentuk koloni serta bentuk sel (Hadioetomo 1985) dan sebagai data tambahan juga dilakukan pengamatan secara mikroskopik sederhana yaitu dengan melihat bentuk dan sifat sel bakteri.
Identifikasi CEP dilakukan secara makroskopis dengan menga mati ciri-ciri fisik dari koloni cendawan pada media PDA. Untuk pengamatan secara mikroskopis, isolat CEP ditumbuhkan pada agar air yang tipis di gelas objek (Slide Culture), diinkubasi selama 2 minggu dan diamati morfologinya di bawah mikroskop cahaya. Identifikasi dilakukan dengan melihat ciri spesifik masing-masing isolat cendawan yang didasarkan pada kunci identifikasi dalam buku Illustrated Genera of Imperfect Fungi (Barnett & Hunter 1972).
Uji patogenisitas
Konsentrasi suspensi MEP
konsentrasi suspensi yang ditanam, jumlah koloni dikalikan dengan faktor pengenceran. Data jumlah bakteri yang diambil adalah petri dengan jumlah koloni bakteri 30–300.
Penentuan suspensi konidia CEP dengan konsentrasi 1 x 108 konidia/ml didapat dengan cara menambahkan 5 ml akuades steril ke dalam masing- masing cawan petri berisi biakan cendawan ya ng telah berumur 3 minggu dan diberi bahan perata Triton X100. Konidia dilepaskan dari media dengan kuas halus dan diaduk secara perlahan sampai rata. Suspensi yang diperoleh disaring dengan kain kasa, dilakukan pengenceran berseri, dan dihitung jumlah konidianya menggunakan haemocytometer, untuk mendapatkan konsentrasi aplikasi digunakan rumus pengenceran.
Aplikasi pada B. mori
Mikroorganisme yang bersifat entomopatogen, selanjutnya dilakukan uji patogenisitas dengan menginokulasikan isolat MEP pada daun murbei untuk pakan 20 ekor larva B. mori instar II hari pertama. MEP disuspensikan dalam aquades steril yang sudah mengandung perekatTriton X100.
Pengamatan dilakukan terhadap mortalitas larva dari awal perlakuan sampai pembentukan kokon. Pemberian pakan dilakukan setiap hari, untuk mendeteksi keberadaan patogen pada larva yang terinfeksi dilakukan pengamatan secara makroskopik dan mikroskopik. Pada nematoda, larva yang terinfeksi dilakukan white trap atau larva dibedah untuk melihat keberadaan nematoda pada bangkai larva. Pada bakteri dan cendawan dilakukan dengan mengisolasi patogen dari larva terinfeksi pada media agar.
Analisis kokon
reproduksi serangga. Variabel yang dianalisis antara lain persentase kokon abnormal, bobot kokon dan bobot kulit kokon.
Pengamatan
Mortalitas larva. Pengamatan dilakukan terhadap jumlah larva yang mati terinfeksi selama percobaan pada masing- masing perlakuan, dihitung untuk mengetahui efek letal serangga uji terhadap patogen, dengan rumus sebagai berikut :
M = (A/B) x 100 % Keterangan :
M = Mortalitas larva (%)
A = Jumlah larva yang mati terinfeksi B = Jumlah total larva
Kokon abnormal, dilakukan dengan menyeleksi kokon abnormal (tipis dan bernoda) yang dihasilkan pada perlakuan. Persentase kokon abnormal didapat dengan membandingkan jumlah kokon abnormal dengan jumlah total kokon pada masing- masing perlakuan, dengan rumus :
PKA = (JKA/JKT) x 100 % Keterangan :
PKA = Persentase kokon abnormal (%) JKA = Jumlah kokon abnormal
JKN = Jumlah kokon total pada perlakuan
Bobot kokon, didapat dengan menimbang berat kokon utuh yang dihasilkan pada masing- masing perlakuan (gram/ butir).
PKK = (BKK/BKU) x 100 %
Keterangan :
PKK = Persentase kulit kokon (%)
BKK = Bobot kulit kokon (kokon tanpa pupa) (g) BKU = Bobot kokon utuh ( kokon dengan pupa) (g)
Analisis Data
HASIL DAN PEMBAHASAN
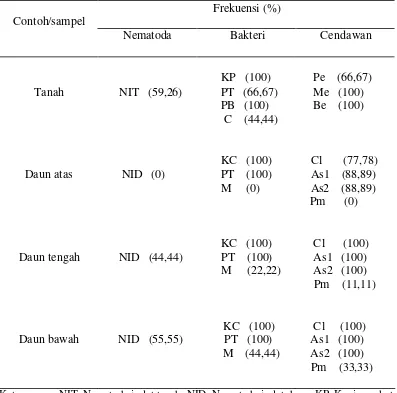
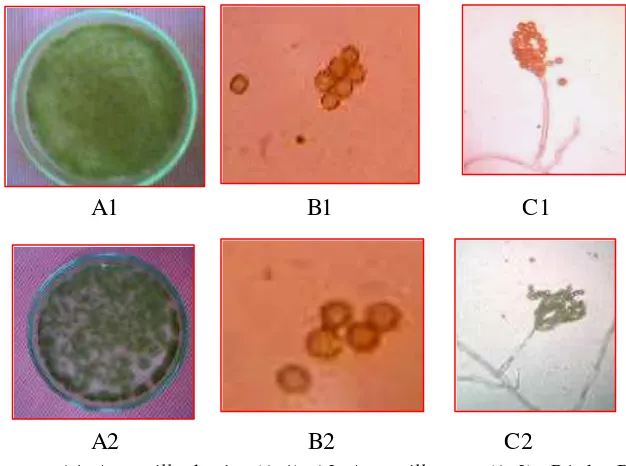
Isolasi Mikroorganisme dari Tanah da n Daun Murbei
[image:47.596.114.511.271.664.2]Dari tanah dapat diisolasi nematoda isolat tanah (NIT) dari famili Steinernematidae, 4 isolat bakteri yaitu : isolat PT (putih tebal), isolat KP (kuning pekat), isolat PB (putih bening) dan isolat C (coklat) serta 3 isolat cendawan entomopatogen dari genus Penicillium sp., Metarhizium sp. dan Beauveria sp. Tabel 1. Hasil isolasi mikroorganisme dari tanah dan daun murbei
Frekuensi (%) Contoh/sampel
Nematoda Bakteri Cendawan
Tanah NIT (59,26)
KP (100) PT (66,67) PB (100) C (44,44)
Pe (66,67) Me (100) Be (100)
Daun atas
NID (0)
KC (100) PT (100) M (0)
Cl (77,78) As1 (88,89) As2 (88,89) Pm (0)
Daun tengah NID (44,44)
KC (100) PT (100) M (22,22)
Cl (100) As1 (100) As2 (100) Pm (11,11)
Daun bawah NID (55,55)
KC (100) PT (100) M (44,44)
Cl (100) As1 (100) As2 (100) Pm (33,33)
Keterangan : NIT. Nematoda isolat tanah; NID. Nematoda isolat daun; KP. Kuning pekat; KC. Kuning cerah; PT. Putih tebal; PB. Putih bening; M. Merah.; Cl. Cladosporium sp.;
Dari daun dapat diisolasi nematoda isolat daun (NID), 3 isolat bakteri yaitu isolat PT (putih tebal), isolat KC (kuning cerah) dan isolat merah (M), dan 4 isolat cendawan yaitu dari genus Aspergillus sp. (warna kuning) (As1), Aspergillus sp. (warna ungu) (As2), Cladosporium sp. dan isolat putih melingkar (Pm) (Tabel 1).
Dominansi NIT dari famili Steinernematidae pada sampel tanah menunjukkan perilaku nematoda yang relatif menyebar di permukaan tanah sampai kedalaman 10 cm dan dapat ditemukan pada semua sampel tanah. Stock & Gress (2006) dalam penelitiannya tentang survey terhadap nematoda entomopatogen di Kepulaua n Sky, Arizona Selatan, menemukan dari 120 sampel tanah, 78,5% ditemukan nematoda entomopatogen dari kelompok Steinernematidae spp. dan 23,3% dari kelompok Heterorhabditidae.
Ditemukannya nematoda famili Steinernamatidae pada tanah kebun murbei sampai pada kedalaman 10 cm sesuai dengan perilaku Steinernematidae yang menyebar di permukaan tanah untuk menemukan serangga inang. Strategi ini sangat efektif untuk menemukan inang yang aktif dipermukaan tanah. Koppenhöfer & Fuzi (2003) dalam penelitiannya menemukan bahwa genus Steinernema dari jenis S. scarabidae lebih cepat menginfeksi inang yang hidup di permukaan tanah pada kedalaman 2 cm dengan persentase mortalitas serangga inang yang diinfeksi mencapai 76% – 96%. Campbell & Gaugler (1993) menyatakan bahwa famili Steinernematidae menggunakan strategi menunggu (ambushing) serta berdiri dengan ekor tanpa bergerak dalam periode waktu yang lama (nictation) untuk menyerang inang yang aktif di permukaan tanah.
Pada daun bagian tengah dan daun bagian bawah, banyak ditemukan mikrob dari berbagai kelompok seperti nematoda, bakteri dan cendawan dengan frekuensi keberadaannya juga mencapai 100%. Hal ini menunjukkan bahwa dengan posisi daun yang lebih dekat ke tanah memungkinkan mikrob dari tanah mengkontaminasi daun secara langsung melalui percikan air hujan dan secara tidak langsung yaitu penyebaran patogen pada tanaman murbei oleh hama yang terinfeksi patogen. Penelitian Sharma et al. (2003), menemukan hama penggulung daun yang terinfeksi berbagai patogen yang berasal dari kelompok virus, bakteri, cendawan dan protozoa pada kebun murbei.
Inveksi Virus dan Protozoa (mikrosporidia) dalam Penelitian
Selama pelaksanaan penelitian, juga ditemukan larva B. mori yang terinfeksi oleh mikroorganisme entomopatogen dari kelompok virus dan protozoa (mikrosporidia). Dua kelompok patogen ini tidak dipelajari lebih dalam selama penelitian berlangsung.
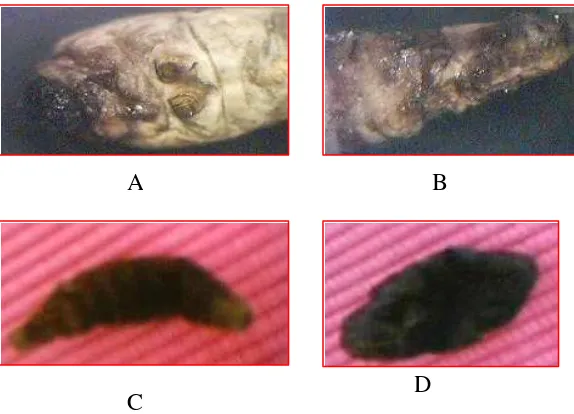
Infeksi virus entomopatogen
Infeksi larva B. mori oleh virus diketahui setelah larva memasuki instar besar (instar IV dan V). Ciri umum larva yang terinfeksi virus yaitu berkurangnya aktivitas makan dan bergerak yang ditandai dengan pergerakan larva yang menjauhi daun dan lebih menyukai berada di ujung tangkai daun, tubuh larva membesar dari ukuran normal dengan kutikula tubuh terlihat tipis.
Pada infeksi lanjut, ciri spesifik ditunjukkan oleh matinya larva secara mendadak (1 sampai 2 hari) dengan tubuh yang hancur dan mengeluarkan cairan putih. Setelah beberapa hari pasca kematian, bangkai larva yang hancur berubah warna menjadi hitam dengan bau yang menyengat (Gambar 8).
Keterangan: A. Awal kematian larva; B. 2 hari setelah kematian larva
Menurut Watanabe (2002), kelompok virus yang biasa menginfeksi B. mori antara lain Bombyx mori Nuclear Polyhedrosis Virus (BmNPV), Cytoplasmic Polyhedrosis Virus (CPV), Infeksi Flacherie Virus (IFV) dan Densonuc leosis Virus (DNV). Selanjutnya Watanabe (2002) mengatakan bahwa virus menginfeksi larva B. mori melalui mulut yaitu oleh pakan yang terkontaminasi. Virus yang telah mengandung virion-virion masuk ke dalam saluran pencernaan, partikel virus akan berikatan dengan sel-sel plasma membran pada epitelium mesenteron, selanjutnya virus memperbanyak diri dan melepas virion ke rongga tubuh serangga dan memyerang organ target lainnya (Tanada & Kaya 1993).
Watanabe (2002) juga mengatakan ada dua faktor yang mempenaruhi tingkat kerentanan B. mori terhadap virus yaitu: a). Faktor internal, sifat resistensi dan kerentanan virus yang sangat ditentukan oleh umur larva, pergantian kulit, metamorfosis dan proses diapause yang semunya dikontrol oleh sistem poligen; b). Faktor eksternal yang sangat ditentukan oleh proses infeksi, suhu, bahan kimia dan makanan baik pakan alami maupun pakan tambahan.
Infeksi protozoa (mikrosporidia) entomopatogen
Menurut Singh & Saratchandra (2003) infeksi mikrosporidia pada larva B. mori disebabkan oleh Nosema bombycis, dengan penyakit ya ng dikenal dengan pebrin. Penyakit ini paling menakutkan menyerang persutraan alam karena bersifat diturunkan dan penularannya sangat cepat. Infeksi terjadi akibat kontaminasi pakan oleh spora N. bombycis, spora ini akan membelah diri di saluran pencernaan dalam kondisi basa. Selanjutnya spora ini berkembang menghasilkan sporoplasma yang akan dilepaskan ke hemolim dengan bantuan filamen polar. Sporoplasma akan terus tumbuh dan memperbanyak diri, dengan bantuan sistem peredaran darah serangga, sporoplasma ini akan menginfeksi berbagai sistem tubuh lainnya seperti sistem otot dan jaringan lemak tubuh (Singh & Saratchandra 2003).
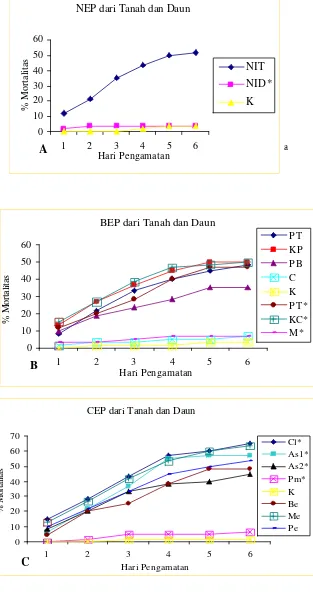
Uji Tapis dan Potensi MEP dalam Menimbulkan Penyakit
[image:51.596.249.400.62.185.2]Kelompok nematoda yang bersifat entomopatogen hanyalah NIT dari famili Steinernematidae (Gambar 10A), sedangkan kelompok bakteri yaitu isolat KP, isolat PB, dan isolat PT (dari tanah); isolat KC dan isolat PT (dari daun) (Gambar 10B), serta kelompok cendawan yaitu isolat Be, Me, dan Pe (dari tanah); isolat As1, As2, dan Cl (dari daun) (Gambar 10C). Isolat yang tidak bersifat entomopatogen adalah NID dan bakteri isolat coklat (C) (dari tanah); bakteri isolat merah (M) dan cendawan isolat Pm (dari daun) (Gambar 10A, 10B dan 10C).
NEP dari Tanah dan Daun 0 10 20 30 40 50 60
1 2 3 4 5 6
Hari Pengamatan
% Mortalitas
NIT NID* K
BEP dari Tanah dan Daun
0 10 20 30 40 50 60
1 2 3 4 5 6
Hari Pengamatan % Mortalitas P T KP P B C K P T * KC* M*
CEP dari Tanah dan Daun
0 10 20 30 40 50 60 70
1 2 3 4 5 6
Hari Pengamatan % Mortalitas Cl* As1* As2* Pm* K Be Me Pe a
[image:52.596.167.480.82.684.2]Keterangan : A. Nematoda ; B. Bakteri; C. Cendawan ; *. MEP dari daun.
Gambar 10. Uji tapis mikroorganisme entomopatogen dari tanah dan daun B
A
Mai dan Mulin (1996) mengelompokkan nematoda atas beberapa kelompok seperti kelompok parasit tumbuhan, predator pada nematoda lain, dekomposer dan entomopatogen. Diduga NID yang telah diuji hanya bersifat parasit pada tumbuhan karena nematoda ini diisolasi dari daun yang rusak. CTE (2004) menyatakan bahwa ada beberapa jenis mikrob tanah yang bersifat patogen pada bagian-bagian tanaman, ada yang bersifat patogen terhadap biota yang hidup di tanah dan ada juga yang bersifat patogen pada tanaman dan serangga.
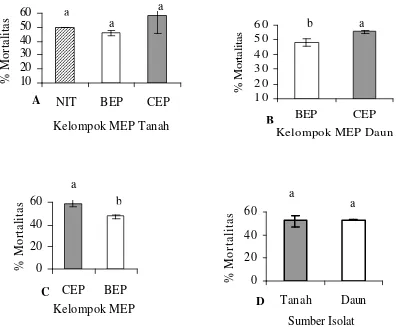
Berdasarkan kelompok MEP, rata-rata kemampuan mematikan larva uji antar MEP yang diisolasi dari tanah tidak berbeda nyata; sedangkan antar MEP yang diisolasi dari daun memperlihatkan nilai yang berbeda nyata (Gambar 11A dan 11B). Kemampuan MEP dari tanah mematikan larva uji mencapai 50% pada nematoda, 45,56% pada bakteri, dan 58,33% pada cendawan (Gambar 11A). Kemampuan MEP dari daun mematikan larva uji mencapai 48,33% pada bakteri dan 55,56% pada cendawan (Gambar 11B). Penggabungan hasil uji tapis tanpa melihat asal usul sampel didapatkan bahwa kemampuan mematikan larva uji oleh mikroorganisme kelompok cendawan lebih tinggi dari mikroorganisme kelompok bakteri yaitu 59,26% pada cendawan dan 47,31% pada bakteri (Gambar 11C).
Kemampuan cendawan dalam menginfeksi serangga sudah dikenal dalam berbagai penelitian, bahkan sifat entomopatogen cendawan ini dimanfaatkan untuk pengendalian serangga hama tanaman pertanian. Hal ini disebabkan karena cendawan mempunyai daya bunuh yang tinggi terhadap berbagai jenis serangga hama, mudah diperbanyak dan hanya memiliki sedikit efek samping terhadap organisme bukan sasaran (Ta nada & Kaya 1993). Menurut Ekesi et al. (2003) kemampuan cendawan Metarhizium anisopliae menginfeksi pupa lalat buah yang hidup di tanah meningkat dengan persentase mortalitas mencapai 80%, hal ini seiring dengan kenaikan suhu dan kelembaban tanah.
0
20
40
60
CEP
BEP
Kelompok MEP
% Mortalitas
0
20
40
60
Tanah
Daun
Sumber Isolat
% Mortalitas
10 20 30 40 50 60NIT BEP CEP
Kelompok MEP Tanah
% Mortalitas 1 0 2 0 3 0 4 0 5 0 6 0 BEP CEP Kelompok MEP Daun
% Mortalitas
[image:54.596.102.498.99.426.2]Keterangan : A dan B: Berdasarkan jenis MEP; C.Tanpa asal usul sampel; D. Berdasar sumber isolat Gambar 11. Kemampuan mematikan larva uji dari berbagai jenis MEP dan
asal sampel.
Berdasarkan sumber isolat, potensi isolat MEP tanah dan isolat MEP daun tidak berbeda nya ta dalam mematikan larva uji (Gambar 11D). Pada mikrob asal tanah selain bersifat merugikan tetapi ada beberapa jenis yang mungkin menguntungkan. Menurut Schloter et al. (2003) selain bersifat parasit pada tanaman, sebagian besar mikrob tanah memiliki peranan yang menguntungkan bagi pertanian, yaitu berperan dalam menghancurkan limbah organik, recycling hara tanaman, fiksasi biologis nitrogen, pelarutan fosfat, merangsang pertumbuhan, biokontrol patogen, dan membantu penyerapan unsur hara. Isroi (2006) juga mengatakan bahwa organisme patogen tanah akan merugikan tanaman ketika terjadi ketidakseimbangan populasi antara organisme patogen dengan mikrob pengendalinya, apabila jumlah organisme patogen lebih banyak
a
a b
a
b a a
dari jumlah mikrob pengendalinya maka akan merugikan bagi tanaman dan biota yang hidup pada tanah tersebut.
Identifikasi MEP
Identifikasi nematoda entomopatogen
Kelompok nematoda yang bersifat entomopatogen adalah NIT yang berasal dari famili Steinernematidae. Hasil pengamatan preparat menunjukkan morfologi luar dari Steinernematidae dengan ciri-ciri: kepalanya set-off, stoma berbentuk silinder, panjang dan melebar serta tidak mempunyai stilet. Nematoda jantan memiliki spikula yang relatif besar dan lebar, testis tunggal dan tidak memiliki bursa. Nematoda betina biasanya berukuran lebih besar dari nematoda jantan, memiliki vulva yang menonjol keluar, sepasang ovari dengan posisi yang berlawanan serta ekor pendek dengan ujung berbentuk kerucut (Gambar 12). Jika diamati dari suspensi cairan berisi nematoda maka, Steinernematidae bentuk tubuhnya relatif panjang dan ramping serta gerakannya sangat aktif.
Menurut Wouts (1991) kelompok Steinernematidae memiliki ukuran tubuh j.i. yang beraneka ragam. Steinernema glaseri memiliki panjang tubuh lebih dari 1000 µm, sedangkan S. felatie memiliki panjang tubuh kurang 700 µm. Wang & Ishibashi (1999) menyatakan bahwa dengan tubuh yang lebih panjang, S. glaseri mampu menemukan inang pada kedalaman 7 cm.
Keterangan: a.Juvenil infektif (j.i.) ; b. Bagian kepala; c. Bagian ekor; d. Kutikula Gambar 12. Identifikasi nematoda isolat tanah
a
b
c
Identifikasi bakteri entomopatogen
Dari tanah kebun murbei dapat diisolasi 3 jenis cendawan yang bersifat entomopatogen yaitu isolat KP (kuning pekat), isolat PT (putih tebal) dan isolat PB (putih bening). Isolat KP mempunyai ciri-ciri bentuk koloni bulat cembung, bewarna kuning pekat, bentuk sel kokus (bulat) dan motil. Isolat PT dengan bentuk koloni bulat cembung, berwarna putih tebal, bentuk sel kokus dan motil. Isolat PB koloni berbentuk bulat pipih, bewarna putih bening, bentuk sel kokus dan motil (Gambar 13).
Keterangan: A, A1. Isolat kuning pekat; B, B1. Isolat putih bening; C , C1. Isolat putih tebal
Dari daun murbei dapat diisolasi dua jenis bakteri entomopatogen yaitu isolat KC( kuning cerah) dan isolat PT (putih tebal). Isolat KC mempunyai ciri-ciri antara lain: bentuk koloni bulat cembung, warna koloni kuning cerah, bentuk sel kokus dan motil. Isolat PT dengan bentuk koloni bulat cembung, bewarna putih tebal, bentuk sel basil (batang) dan motil (Gambar 14).
Keterangan: A, A1. Isolat KP; B, B1. Isolat PB; C, C1. Isolat PT
A1 B1 C1
A
Gambar 13. Identifikasi isolat bakteri yang diisolasi dari tanah
A A1 B B1
[image:56.596.156.449.257.460.2]C B
Identifikasi cendawan entomopatogen
Dari tanah kebun murbei ditemukan tiga jenis cendawan entomopatoge n dari genus Penicillium sp. (Pe), Metarhizium sp. (Me) dan Beauveria sp. (Be) (Gambar 15).
Keterangan: Pe. Penicillium sp.; Me. Metarhizium sp.; Be. Beauveria sp.
Dari daun murbei dapat diisolas tiga jenis cendawan entomopatogen yaitu dari genus Aspergillus sp. (As1 dan As2) dan Cladosporium sp. (Cl) (Gambar 16).
Keterangan: As1. Aspergillus kuning (As2); Aspergillus ungu (As2); Cl. Cladosporium sp
Penicillium
Konidiopor muncul dari miselium tunggal, tegak lurus dan seringkali percabanganya muncul lebih ke ujung. Konidia berbentuk bulat terdiri dari satu sel dan tersusun dalam bentuk rantai basipetal (Gambar 17).
Keterangan: A. Biakan cendawan pada media PDA,; B. Konidia; C. Tubuh buah (konidiopor) Gambar 15. Cendawan entomopatogen isolat tanah kebun murbei
Gambar 16. Cendawan entomopatogen isolat daun murbei
As1 As2 Cl
Pe Be
Gambar 17. Identifikasi isolat Penicillium sp.
A B C
Metarhizium
Konidiopor tegak lurus dan memanjang, bercabang dan membentuk dinding sporulasi. Konidia berbentuk bulat panjang, tersusun membentuk rantai tunggal dan kadang berpasangan dengan konidia berwarna hijau (Gambar 18).
Keterangan: A. Biakan cendawan pada media PDA dan B. Konidia.
Beauveria
Miselium berwarna putih atau seperti benang halus yang tipis dan kadang seperti tepung. Konidia tunggal, hialin dan satu sel, susunannya tidak beraturan terkadang berbentuk zig- zag (Gambar 19).
Keterangan: A. Biakan cendawan pada media PDA; B. Konodia; C. Konidiopor
Cladosporium
Konidiopor berbentuk batang, tegak lurus, berwarna gelap, percabangannya bervariasi dan lebih ke ujung, berkelompok atau terkadang juga tunggal. Konidia bewarna gelap, 1 atau 2 sel bentuk dan ukuran bervariasi, ada yang bulat, agak bulat dan bulat tidak beraturan. Percabangan konidiopor membentuk rantai akropetalus (Gambar 20).
B
A A
B
Gamba r 18. Identifikasi isolat Metarhizium sp.
Keterangan: A. Biakan cendawan pada media PDA dan B. Konidia
Aspergillus
Konidiopor tegak lurus dan tidak begitu rumit, konidia berbentuk bulat, satu sel dan tersusun ke arah ujung. Konidia biasanya mempunyai warna yang bervariasi (Gambar 21).
Keterangan: A1. Aspergillus kuning (As1); A2. Aspergillus ungu(As2); B1 dan B2. Konidia, C1 dan C2. Konidiopor
A B
A2
C1 B1
A1
[image:59.596.146.459.388.621.2]C2 B2
Gambar 20. Identifikasi isolat Cladosporium sp.
Uji Patogenisitas
- Mortalitas
Kelompok nematoda Steinernematidae mampu menginfeksi larva B. mori dengan tingkat mortalitas berbeda nyata dengan kontrol. Persentase mortalitas larva B. mori yang diinfeksi dengan NIT mencapai 46%, dengan persentase mortalitas kontrol ha nya 3% (Tabel 2).
Tabel 2. Hasil uji patogenisitas MEP pada larva B. mori dengan konsentrasi 108sel/ml (BEP), 108konidia/ml (CEP) dan 50 (j.i)/ 5ml (NEP)
Parameter kokon yang diuji
MEP Isolat
M (%) KA (%) BK (g/butir) BKK (%)
NEP NIT K
46,00 ± 5,48 a 3,00 ± 4,47 b
29,85± 8,01a 3,16 ± 2,89 b
1,73 ± 0,13 b 2,13 ± 0,09 a
19,78± 1,49 b 24,30 ± 1,41a
BEP tanah BEP daun PT KP PB PT KC K
12,50 ± 2,88 b 26,25 ± 4,79 a 10,00 ± 0,00 b 8,75 ± 4,79 bc 21,25 ± 6,29 a 3,75 ± 2,50 c
11,44 ± 4,55 b 24,09 ± 9,99 a 6,94 ± 5,32 b 8,35 ± 3,58 b 25,71 ± 10,69 a
2,53 ± 3,04 b
1,73 ± 0,12 bc 1,44 ± 0,12 d 1,97 ± 0,22 ab
1,79 ± 0,1 b 1,52 ± 0,13 cd
2,16 ± 0,22 a
19,78 ± 1,49 a 19,22 ± 4,02 b 20,89 ± 1,56 a 20,04 ± 2,09 a 19,17 ± 1,94 b 22,00 ± 2,27 a
CEP tanah CEP daun Be Pe Me Cl As1 As2 K
51,67 ± 12,58 ab 55,00 ± 5 ab 58,33 ± 5,77 ab
51,67 ± 7,64 a 41,67 ± 16,07 b
60,00 ± 5 a 6,67 ± 2,89 c
19,43 ± 9,16 b 26,11 ± 6,73 ab
19,57 ± 4,58 b 24,09 ± 3,72 ab
32,28 ± 4,65 a 25,26 ± 33,18 ab
3,61 ± 3,13 c
1,76 ±0,13 a 1,88 ± 0,22 a 1,86 ± 0,05 a 1,86 ± 0,13 a 1,76 ± 0,21 a 1,74 ± 0,15 a 1,97 ± 0,09 a
20,59 ± 0,52 a 22,16 ± 2,10 a 22,23 ± 0,81 a 22,87 ± 2,14 a 21,27 ± 0,63 a 22,23 ± 3,38 a 21,90 ± 0,52 a
Keterangan : K. Kontrol; M. Mortalitas; KA. Kokon abnormal; BK. Bobot kokon; BKK. Bobot kulit kokon .Angka yang diikuti huruf yang sama pada kelompok yang sama tidak berbeda nyata menurut uji Duncan taraf 5%.
Ciri umum dari larva yang terinfeksi NIT antara lain terjadinya penurunan aktivitas makan dan pergerakan, larva cenderung diam, paralisis pada mulut dan pada infeksi lanjut larva akan mati. Ciri spesifik dari larva yang terinfeksi nematoda baru dapat diketahui beberapa hari setelah kematian larva yaitu terjadinya perubahan warna tubuh menjadi lebih transparan dan agak kecoklatan, tubuh lembek dan bila dibedah jaringan tubuh bagian dalam hancur namun tidak mengeluarkan bau busuk (Gambar 22).
Keterangan: A1. Infe ksi awal NIT; A2. infeksi akhir NIT
Perez et al. (2003) menyatakan bahwa infeksi nematoda oleh j.i. (stadia penginfeksi), masuk ke hemosel inang dengan membawa bakteri simbion yang berkembang biak dengan cepat dan menghasilkan toksin yang dapat memb unuh serangga inang. Beberapa keuntungan dari asosiasi tersebut adalah bakteri dapat membunuh inang dengan cepat secara septicemia, menyediakan nutrisi dan lingkungan yang cocok bagi perkembangan dan reproduksi nematoda (Tanada & Kaya 1993).
Gouge & Snyder (2006) menyatakan bahwa selain bersimbiosis dengan kelompok bakteri Xenorhabdus, famili Steinernematidae juga mampu bersimbiosis dengan beberapa kelompok bakteri lain, seperti: Enterobacter, Vibrio, Pseudomonas, Citrobacter dan Serratia. Berbagai laporan menyatakan bahwa larva B. mori juga sangat rentan terhadap kelompok bakteri tersebut terutama oleh kelompok bakteri Serratia dan Pseudomonas (Hee 1998).
[image:61.596.239.375.250.351.2]Bakteri isolat KP dari tanah memberikan mortalitas sebesar 26,25%, sedangkan isolat KC dari daun memiliki mortalitas sebesar 21,25 %. Kedua isolat ini berbeda nyata dengan isolat BEP lainnya termasuk kontrol dengan mortalitas kontrol mencapai 3,75% (Tabel 2). Larva yang terinfeksi BEP, setelah 1 x 24 jam