ISOLASI SENYAWA TRITERPENOIDA/STEROID DARI EKSTRAK n -HEKSANA DAUN
TUMBUHAN RUKU-RUKU (Ocimum sanctum L.)
SKRIPSI
DIAJUKAN OLEH:
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2008 AYU AFRIZA
LEMBAR PENGESAHAN
ISOLASI STEROID/TRITERPENOID DARI DAUN TUMBUHAN RUKU-RUKU (Ocimum sanctum L.)
DIAJUKAN OLEH : NIM : 030814002
Medan, Januari 2009
Diketahui oleh : Disahkan oleh :
Pembimbing I, Dekan Fakultas Farmasi
(Dra. Siti Aman, MS, Apt) (Prof. Dr. Sumadio Hadisahputra, Apt) NIP. 131 283 722 NIP. 131 283 716
Pembimbing II,
DAFTAR ISI
JUDUL ... i
HALAMAN PENGESAHAN ... ii
ABSTRAK ... iii
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
DAFTAR GAMBAR ... x
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang... 1
1.2. Perumusan Masalah ... 2
1.3. Hipotesis ... 2
1.4. Tujuan penelitian ... 3
1.5. Manfaat penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1. Uraian tumbuhan ... 4
2.1.1. Habitat dan daerah tumbuh ... 4
2.1.2. Morfologi tumbuhan ... 4
2.1.3. Sistematika tumbuhan ... 5
2.1.4 Sinonim ... 5
2.1.5. Kandungan kimia ... 5
2.1.6. Penggunaan tumbuhan ... 5
2.2. Uraian kimia ... 6
2.2.1. Triterpenoida/steroida ... 6
2.2.2. Steroid ... 8
2.3. Ekstraksi ... 9
2.4. Kromatografi ... 10
2.4.1. Kromatografi lapis tipis ... 11
2.4.2. Kromatografi kolom ... 13
2.5.2. Spektrofotometri sinar inframerah ... 16
BAB III METODOLOGI PENELITIAN ... 19
3.1. Alat-alat yang digunakan ... 19
3.2. Bahan-bahan yang digunakan ... 19
3.3. Pengumpulan sampel, identifikasi dan pengolahan sampel ... 20
3.3.1. Pengumpulan sampel ... 20
3.3.2. Identifikasi tumbuhan ... 20
3.3.3. Pengolahan sampel ... 20
3.3.4. Pengujian senyawa triterpenoida/steroida ... 21
3.3.5. Pembuatan ekstrak ... 22
3.4. Pembuatan larutan pereaksi ... 22
3.4.1. Pembuatan pereaksi Liebermann-Burchard ... 22
3.5. Pembuatan plat KLT ... 22
3.6. Analisis ekstrak n – heksana secara KLT ... 22
3.7. Isolasi ekstrak n – heksana dengan kromatografi kolom ... 23
3.8. Pemisahan senyawa triterpenoida/steroida dari fraksi F2 dengan KLT preparatiif sertas pemurnian kristal F2 ... 24
3.9. Uji kemurnian terhadap kristal hasil isolasi F2 dengan KLT dua arah 25 3.10. Karakterisasi isolat ... 25
3.10.1. Karakterisasi isolat secara spektrofotometri sinar ultraviolet ...` ... 25
3.10.1. Karakterisasi isolat secara spektrofotometri sinar inframerah ... ... 25
BAB IV HASIL DAN PEMBAHASAN... . 26
BAB IV KESIMPULAN DAN ... 28
5.1. Kesimpulan ... 28
5.2. Saran ... 28
DAFTAR TABEL Tabel
1. Harga Rf hasil KLT Ekstrak n-heksana daun tumbuhan ruku-ruku (Ocimum
DAFTAR LAMPIRAN
Lampiran
1. Hasil identifikasi tumbuhan ...
32
2. Gambar tumbuhan ruku-ruku (Ocimum sanctum L.)dan daun segar tumbuhan
ruku-ruku (Ocimum sanctum L.) ...
33
3. Bagan ekstraksi daun tumbuhan ruku-ruku (Ocimum sanctum L.)...
34
4. Kromatogram hasil KLT ekstrak n-heksana daun tumbuhan ruku-ruku
(Ocimum sanctum L.) ...
35
5. Bagan isolasi senyawa triterpenoida/steroida dari ekstrak n-heksana daun
tumbuhan ruku-ruku (Ocimum sanctum L.) ...
36
6. Kromatogram analisa KLT hasil kromatografi kolom ekstrak n-heksana daun
tumbuhan ruku-ruku (Ocimum sanctum L.) ...
37
7. Kromatogram analisa KLT hasil kromatografi kolom ekstrak n-heksana daun
tumbuhan ruku-ruku (Ocimum sanctum L.) ...
38
8. Kromatogram hasil penggabungan fraksi-fraksi dari kromatografi kolom
ekstrak n-heksana daun tumbuhan ruku-ruku (Ocimum sanctum L.) ...
39
9. Tabel Rf KLT kromatografi kolom ekstrak n-heksana daun tumbuhan
ruku-ruku (Ocimum sanctum L.) ...
40
10. Kromatogram KLT preparatif F2 ...
11.Kromatogram hasil uji kemurnian kristal F2 ...
42
12. Spektrum Ultraviolet kristal hasil isolasi...
43
11. Spektrum inframerah kristal hasil isolasi ...
44
DAFTAR GAMBAR
Gambar
1. Tumbuhan Ruku-ruku (Ocimum sanctum L.) ...
.... 33
2. Daun segar tumbuhan Ruku-ruku (Ocimum sanctum L.) ...
.... 33
3. Kromatogram hasil KLT ekstrak n-heksana daun tumbuhan Ruku-ruku
(Ocimum sanctum L.) ...
35
4. Kromatogram analisis KLT hasil kromatografi kolom dari ekstrak n-heksana
daun tumbuhan Ruku-ruku (Ocimum sanctum L.) ...
37
5. Kromatogram hasil penggabungan fraksi-fraksi dari kromatografi kolom ...
39
6. Kromatogram KLT preparatif F2 ...
7. Kromatogram hasil uji kemurnian isolat dengan KLT 2 arah ...
42
8. Spektrum Ultraviolet isolat F23 ...
43
9. Spektrum Inframerah isolat F23 ...
ABSTRAK
Telah dilakukan ekstraksi, isolasi dan karakterisasi senyawa
triterpneoida/steroida dari daun tumbuhan ruku-ruku (Ocimum sanctum L.) famili
Labiatae.
Ekstraksi dilakukan secara maserasi dengan pelarut n-heksana dan
ekstrak dianalisis KLT menggunakan fase gerak n-heksana - etil asetat dengan
perbandingan 90:10, 80:20, 70:30, 60:40 dan 50:50. Isolasi dengan kromatografi
kolom menggunakan pelarut landaian menggunakan fase gerak n-heksana – etil
asetat dengan perbandingan 100:0, 90:10, 80:20, 70:30, 60:40, dan 50:50 dan
diakhiri metanol. Isolat yang diperoleh dari kromatografi kolom berbentuk kristal,
kemudian dilakuakn pemisahan dengan KLT preparatif dan dimurnikan dengan
mencucinya dengan emtanol dingin. Uji kemurnian isolat dengan KLT dua arah.
Terhadap isolat yang diperoleh dilakukan karakterisasi secara spektrofotometri
sinar ultraviolet dan spektrofotometri inframerah.
Analisa KLT menunjukkan sedikitnya 12 senyawa triterpenoida/steroida
bebas pada ekstrak n – heksana dengan fase gerak n – heksana – etilasetat (70:30)
dan penampak bercak Liebermann-Burchard. Hasil KLT dua arahpada F23
menggunakan fase gerak n – heksana – etilasetat (70:30) dengan Rf 0,75 dan
toluena – etilasetat (70:30) dengan Rf 0,50. Hasil penafsiran isolat menunjukkan
absorbansi maksimum pada panjang gelombang 226 nm, dan menunjukkan
adanya gugus kromofor yang merupakan gugus fungsi berupa ikatan tak jenuh
yang menyerap radiasi di daerah uv. Penafsiran inframerah menunjukkan adanya
gugs −OH pada bilangan gelombang 3402,43, bilangan gelombang 2931,9 ; gugus
1404,18 ; gugus CH2, bilangan gelombang 1327,03 ; gugus CH3, , dan bilangan
gelombang 1103,99 dan 1056,99 menunjukkan gugus C−O.
ABSTRACT
The extraction, isolation and characterization of triterpenes/steroids of the
leaves of Ruku-ruku (Ocimum sanctum L.) family Labiatae has been carried out.
The extraction was carried out by maceration using n-hexane as solvent.
Crude extract of triterpenes/steroids was first analyzed by thin layer
chromatography using n – hexane – ethylacetate with ratio of (90:10, 80:20,
70:30, 60:40, 50:50) and was fractionated by column chromatography using n –
hexane - ethylacetate with ratio of (100:0, 90:10, 80:20, 70:30, 60:40, 50:50) and
ended with methanol. The isolate obataines from column chromatography and
purified by crystal, and separated by preparative thin layer chromatography and
purified by washing with cold methanol. The purity of isolates by two
dimensional thin layer chromatography using n - heksana – ethylacetate (70:30)
and Toluena - ethylacetat ( 70:30) and has Rf 0,75 and 0,50 (purple). The
characterization of isolates were carried out by ultraviolet and infrared
spectrophotometric method.
Analyzed by thin layer chromatography shows at least 12 free
triterpenoids/steroids compound. The result of two dimensional thin layer
chromatography from F23 using n – hexane - ethylacetate (70:30) and toluene –
ethylacetate (70:30) Rf 0,75 and 0,50 (purple). This isolates gave maximum
absorption at 226 nm, showed the chromofor which is a functional structure in the
form of unsaturated bond that absorb radiation in the UV region. The result of IR
shows that there −OH at wave number 3402,43, at wave number 2931,9 ; aliphatic
C−H, at wave number 1581,63 ; C=C, at wave number 1404,18 ; CH2, at wave
ABSTRAK
Telah dilakukan ekstraksi, isolasi dan karakterisasi senyawa
triterpneoida/steroida dari daun tumbuhan ruku-ruku (Ocimum sanctum L.) famili
Labiatae.
Ekstraksi dilakukan secara maserasi dengan pelarut n-heksana dan
ekstrak dianalisis KLT menggunakan fase gerak n-heksana - etil asetat dengan
perbandingan 90:10, 80:20, 70:30, 60:40 dan 50:50. Isolasi dengan kromatografi
kolom menggunakan pelarut landaian menggunakan fase gerak n-heksana – etil
asetat dengan perbandingan 100:0, 90:10, 80:20, 70:30, 60:40, dan 50:50 dan
diakhiri metanol. Isolat yang diperoleh dari kromatografi kolom berbentuk kristal,
kemudian dilakuakn pemisahan dengan KLT preparatif dan dimurnikan dengan
mencucinya dengan emtanol dingin. Uji kemurnian isolat dengan KLT dua arah.
Terhadap isolat yang diperoleh dilakukan karakterisasi secara spektrofotometri
sinar ultraviolet dan spektrofotometri inframerah.
Analisa KLT menunjukkan sedikitnya 12 senyawa triterpenoida/steroida
bebas pada ekstrak n – heksana dengan fase gerak n – heksana – etilasetat (70:30)
dan penampak bercak Liebermann-Burchard. Hasil KLT dua arahpada F23
menggunakan fase gerak n – heksana – etilasetat (70:30) dengan Rf 0,75 dan
toluena – etilasetat (70:30) dengan Rf 0,50. Hasil penafsiran isolat menunjukkan
absorbansi maksimum pada panjang gelombang 226 nm, dan menunjukkan
adanya gugus kromofor yang merupakan gugus fungsi berupa ikatan tak jenuh
yang menyerap radiasi di daerah uv. Penafsiran inframerah menunjukkan adanya
gugs −OH pada bilangan gelombang 3402,43, bilangan gelombang 2931,9 ; gugus
1404,18 ; gugus CH2, bilangan gelombang 1327,03 ; gugus CH3, , dan bilangan
gelombang 1103,99 dan 1056,99 menunjukkan gugus C−O.
ABSTRACT
The extraction, isolation and characterization of triterpenes/steroids of the
leaves of Ruku-ruku (Ocimum sanctum L.) family Labiatae has been carried out.
The extraction was carried out by maceration using n-hexane as solvent.
Crude extract of triterpenes/steroids was first analyzed by thin layer
chromatography using n – hexane – ethylacetate with ratio of (90:10, 80:20,
70:30, 60:40, 50:50) and was fractionated by column chromatography using n –
hexane - ethylacetate with ratio of (100:0, 90:10, 80:20, 70:30, 60:40, 50:50) and
ended with methanol. The isolate obataines from column chromatography and
purified by crystal, and separated by preparative thin layer chromatography and
purified by washing with cold methanol. The purity of isolates by two
dimensional thin layer chromatography using n - heksana – ethylacetate (70:30)
and Toluena - ethylacetat ( 70:30) and has Rf 0,75 and 0,50 (purple). The
characterization of isolates were carried out by ultraviolet and infrared
spectrophotometric method.
Analyzed by thin layer chromatography shows at least 12 free
triterpenoids/steroids compound. The result of two dimensional thin layer
chromatography from F23 using n – hexane - ethylacetate (70:30) and toluene –
ethylacetate (70:30) Rf 0,75 and 0,50 (purple). This isolates gave maximum
absorption at 226 nm, showed the chromofor which is a functional structure in the
form of unsaturated bond that absorb radiation in the UV region. The result of IR
shows that there −OH at wave number 3402,43, at wave number 2931,9 ; aliphatic
C−H, at wave number 1581,63 ; C=C, at wave number 1404,18 ; CH2, at wave
BAB I PENDAHULUAN
1.1Latar belakang
Indonesia memiliki lahan hutan tropis cukup luas dengan
keanekaragaman hayati yang tinggi, baik flora maupun fauna. Berbagai macam
tumbuhan berkhasiat obat yang ada di sekeliling kita dapat dimanfaatkan untuk
tujuan dalam upaya peningkatan kesehatan, pencegahan, maupun pengobatan
berbagai amcam penyakit. Pengobatan tradisional dengan memanfaatkan
tumbuhan berkhasiat obat telah diakui masyarakat dunia. Ini menandakan bahwa
kesadaran masyarakat telah timbul tentang pentingnya kembali ke alam (bact to
nature) untuk mencapai kesehatan yang optimal (Wijayakusuma, 2000).
Salah satu tumbuhan berkhasiat obat yang dikembangkan adalah dari daun
tumbuhan ruku-ruku (Ocimum sanctum L.), familia Labiatae, merupakan
tumbuhan terna, tumbuh tegak, banyak bercabang dan banyak dijumpai di hutan,
semak terbuka, kebun, ladang, terutama di daerah musim kemarau lama.
Tumbuhan ruku-ruku banyak digunakan sebagai antidiabetes,
antiinflamasi, antistress, antioksidan, karminatif, antipiretik (Ditjen POM, 1995;
Anonim, 2007). Peneliti sebelumnya menyebutkan bahwa ekstrak etanol dari
tumbuhan ruku-ruku (Ocimum sanctum L.) mempunyai efek antiinflamasi dan
dapat menurunkan udem buatan pada telapak kaki tikus putih yang diinduksi
karagenan, dan hasil skrining fitokimia dijumpai adanya senyawa golongan
alkaloid, flavonoid, glikosida, minyak atsiri, saponin, triterpenoid/steroid, tanin
Senyawa triterpenoid/steroid bebas merupakan salah satu kandungan
metabolit skunder yang banyak digunakan sebagai obat antara lain untuk
mengobati gangguan kulit, diabetes, gangguan menstruasi, malaria, kerusakan
hati, antifungi, antibakteri dan antivirus. Sedangkan senyawa
triterpenoida/steroida pada saponin banyak digunakan sebagai bahan baku untuk
pembuatan hormon steroid, (Fransworth, 1966; Robinson, 1995) sebagai
insektisida, antiinflamasi dan analgesik (Brunetton, 1995).
Berdasarkan hal diatas maka peneliti tertarik untuk mengisolasi steroid
yang terdapat pada tumbuhan ruku-ruku (Ocimum sanctum L.) dengan cara
maserasi terhadap daun. Selanjutnya dianalisis dengan kromatrografi lapis tipis
(KLT), kromatografi kolom dan kromatografi lapis tipis preparatif, senyawa hasil
isolasi dikarakterisasi dengan spektrofotometri ultraviolet (UV) dan
spektrofotometri inframerah.
1.2Perumusan Masalah
1. Apakah senyawa triterpenoida/steroida yang terdapat pada ekstrak n -
heksana daun tumbuhan ruku-ruku (Ocimum sanctum L.) dapat diisolasi
dengan secara kromatografi kolom, dan kromatografi lapis tipis preparatif.
2. Apakah senyawa steroid hasil isolasi dapat dikarakterisasi secara
spektrofotometri UV dan spektrofotometri IR.
1.3Hipotesis
1. Senyawa steroid yang terdapat pada ekstrak n-heksana daun tumbuhan
ruku-ruku (Ocimum sanctum L.) dapat diisolasi dengan kromatografi
2. Senyawa teriterpenoida/steroida hasil isolasi dapat dikarakterisasi secara
spektrofotometri UV dan IR.
1.4Tujuan Penelitian
Tujuan penelitian ini adalah mengisolasi senyawa golongan
triterpenoida/steroida dari ekstrak n – heksana daun tumbuhan ruku-ruku
(Ocimum sanctum L.) menggunakan kromatografi kolom, dan kromatografi lapis
tipis preparatif yang dilanjutkan dengan karakterisasi hasil isolasi menggunakan
spektrofotmetri UV dan spektrofotometri IR.
1.5. Manfaat Penelitian
Diperoleh informasi tentang senyawa triterpenoida/steroida hasil isolasi dari
BAB II TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi habitat dan daerah tumbuh, nama daerah,
sistematika tumbuhan, morfologi tumbuhan, kandungan senyawa kimia serta
pnggunaan tumbuhan.
2.1.1 Habitat dan Daerah Tumbuh
Tumbuhan ruku-ruku (Ocimum sanctum L.) tersebar diseluruh jawa dari
daratan rendah hingga kurang lebih 600 m diatas permukaan laut, terutama di
daerah-daerah dengan musim kemarau lama. Jenis ini terdapat, setempat sering
kali dalam jumlah besar, pada lapangan yang kering tersinar matahari, ladang dan
dalam hutan, semak-semak terbuka,tumbuh liar di kebun atau kuburan (Heyne,
1987; Naito, 1995)
2.1.2 Morfologi Tumbuhan
Tumbuhan terna, tinggi 30-150 cm. Batang berkayu, bentuk segi empat
beralur, biasanya bercabang banyak, berbulu,hijau. Daun tunggal bentuk bulat
telur, duduk berhadapan bersilang, ujung runcing, pangkal tumpul, tepi bergerigi,
pertulangan menyirip, daging daun tipis, permukaan berambut halus, hijau. Bunga
majemuk, bentuk berbibir, berbnulu, bertangkai pendek, hijau, mahkota bulat
telur. Buah coklat tua. Biji berbentuk kecil, hitam. Akar tunggang (Ditjen POM,
2.1.3 Sistematika Tumbuhan
Sistematika tumbuhan ruku-ruku menurut Tjitrosoepomo (1993);
Subrahmanyam (2003) sebagai berikut :
Divisi : Spermatophyta
Subdivisio : Angiospermae
Kelas : Dicotyledonae
Bangsa : Tubiflorae
Suku : Labiatae
Marga : Ocimum
Jenis : Ocimum sanctum L
2.1.4. Sinonim
Nama lain tumbuhan ruku-ruku adalah dikenal kemangi utan (Melayu);
balakana (Menado); Klampes, lampes (Sunda); Kemangen, Lampes (Jawa);
kemanghi, ko-roko (Madura); uku-uku (Bali); dan lufe-lufe (Ternate) (Heyne,
1987; Pitojo, 1999).
2.1.5. Kandungan Kimia
Kandungan kimia dari daun tumbuhan ruku-ruku (Ocimum sanctum L.)
mengandung senyawa alkaloid, flavonoid, minyak atsiri, saponin, tanin dan
triteropenoid/steroid (Anonim, 2007; Ditjen POM, 1995).
2.1.6. Penggunaan Tumbuhan
Tumbuhan ruku-ruku (Ocimum sanctum L.) digunakan sebagai antidiabetes,
antiinflamasi, antistress, antioksidan, laktagoga, emenagoga, karminatif,
2.2. Uraian Kimia
2.2.1. Triterpenoida/Steroida
Terpena merupakan senyawa organik bahan alam yang terdapat dalam
metabolit skunder tanaman, mencakup mono, seskui, di, tri dan senyawa
politerpena. Senyawa terpena dikaitkan terhadap bentuk strukturnya yang
merupakan kelipatan satuan lima atom karbon (isoprena) (Sastrohamidjojo, 1996).
Strutur isoprena dapat terlihat pada gambar 1.
CH3
CH2 C CH CH3
Gambar 1. Isoprena
Senyawa terpenoid bebas dalam jaringan tanaman, tidak terikat dengan
senyawa lain, tetapi banyak diantaranya terdapat sebagai glikosida dan ester dari
asam organik (Robinson, 1995).
Terpenoida adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30
Biosintesa terpenoida dimulai dari asetil CoA, kemudian membentuk
isopentil pirofosfat melalui asam mevalonat, lalu membentuk molekul yang lebih asiklik,
yaitu skulaena. senyawa ini tidak berwarna, berbentuk kristal, biasanya bertitik
leleh tinggi dan optis aktif. Berbagai macam aktivitas bilogis yang menarik dapat
ditunjukkan oleh beberapa triterpenoida, dan senyawa ini merupakan komponen
aktif dalam tumbuhan obat yang telah digunakan untk berbagai macam penyakit
termasuk diabetea, gangguan menstruasi, patukan ular, gangguan kulit, kerusakan
hati, malaria, antibakteri, antifungi dan antivirus (Robinson, 1995), insektisida,
besar melalui penggabungan ikatan kepala-ekor sehingga membentuk farnesil
pirofosfat selanjutnya terjadi ikatan kepala-ekor membentuk skualena kemudian
mengalami siklisasi dengan bantuan enzim skualena oksidosiklase yang
membentuk senyawa triterpenoida (Manitto, 1981).
Teriterpenoida dapat dibagi menjadi empat golongan senyawa yaitu :
triterpena sebenarnya, steroida, saponin dan glikosida jantung (Harborne, 1987).
Triterpena sebenarnya
Senyawa triterpena sebenarnya terdapat dalam bentuk asiklik maupun siklik,
yang diklasifikasikan sebagai berikut :
1. Triterpena asiklik, yaitu senyawa terpena yang tidak mempunyai cincin
tertutup pada struktur molekulnya, contohnya skualena.
2. Triterpena asiklik, yaitu senyawa triterpena yang mempunyai 3 cincin tertutup
pada struktur molekulnya, contohnya : ambrein.
3. Triterpena tetrasiklik, yaitu senyawa triterpena yang mempunyai 4 cincin
tertutup pada struktur molekulnya, contohnya : lanosterol.
4. Triterpena pentasiklik, yaitu senyawa triterpena yang mempunyai 5 cincin
tertutup pada struktur molekulnya, contohnya : α-amirin
Lanosterol α-amirin
2.2.2. Steroida
Steroida adalah senyawa triterpenoida yang kerangka dasarnya sistim
cincin siklopentanoperhidrofenantren. Senyawa ini tersebar luas di alam dan
mempunyai fungsi biologis yang sangat penting misalnya untuk kontrasepsi,
anabolik, dan antiinflamasi (Brunetton, 1995; Harborne, 1987).
Berdasarkan sumbernya, steroida dibagi atas (Manitto, 1981) :
1. Zoosterol, yaitu steroida yang berasal dari hewan, contohnya: kolesterol
2. Fitosterol, yaitu steroida yang berasal dari tumbuhan, contohnya: sitosterol
3. Mikosterol, yaitu steroida yang berasal dari fungi, contohnya: ergostal
4. Marinsterol, yaitu steroida yang berasal dari organisme laut, contohnya:
stelasterol.
Inti steroida dasar sama dengan inti lanosterol dan triterpenoida tetrasiklik
lain, tetapi hanya berbeda pada 2 gugus metil yang terikat pada sistem cincin,
pada posisi 10 dan 13 (Harborne, 1987; Robinson, 1995).
Menurut Robinson (1995) sistem penomoran steroida adalah sebagai
berikut :
2.3. Ekstraksi
Ekstraksi adalah suatu cara penyarian terhadap simplisia dengan
menggunakan suatu penyari tertentu. Cara pengekstraksian yang tepat tergantung
pada jenis senyawa yang diisolasi dan pelarut yang digunakan. Untuk
mengekstraksi senyawa yang ada terdapat pada tumbuhan terlebih dahulu
enzimnya diinaktifkan dengan etanol panas atau dengan mengeringkan bagian
tumbuhan yang diambil sebelum ekstraksi (Harborne, 1987).
Ekstraksi dapat dilakukan dengan beberapa cara (Ditjen POM, 2000), yaitu
:
a. Maserasi
Maserasi adalah proses ekstrakasi menggunakan pelarut dengan beberapa
kali pengocokan atau pengadukan pada temperatur ruangan. Remaserasi berarti
dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan
maserat.
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna, umumnya dilakukan pada temperatur ruangan. Prosesnya terdiri dari
tahapan pengembangan bahan, maserasi antara dan perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus-menerus sampai diperoleh ekstrak
(perkolat).
c. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur dengan titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
residu pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi
sempurna.
d. Sokletasi
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang selalu baru,
umumnya dilakukan dengan menggunakan alat khusus sehingga terjadi ekstraksi
kontinu dengan jumlah pelarut relatif konstan dan adanya pendingin balik.
e. Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada temperatur yang
lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40-500C.
f. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur pengangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980
Kromatografi pertama kali diperkenalkan oleh Tswett, seorang ahli botani
Rusia yang bekerja di Warsawa tahun 1906, ia mengumumkan pemerian
pemisahan klorofil dan pigmen lainnya dalam suatu sari tanaman. Karena adanya
pemisahan pita maka ia mengusulkan nama ”kromatografi” yang berasal dari
bahasa Yunani ”kromatos” yang berarti warna dan ”graphos” yang berarti menulis
(Sudjadi, 1988). Kromatografi didefinisikan sebagai pemisahan campuran dua C)
selama waktu tertentu biasanya 15-50 menit.
g. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur sampai
titik didih air.
atau lebih senyawa yang berbeda dengan distribusi antara dua fase, yaitu fase
diam dan fase gerak (Pavia, 1988).
Pada dasarnya semua cara kromatografi menggunakan dua fase yaitu fase
diam (stationary phase) dan fase gerak (mobile phase). Pemisahan sampel pada
komponen-komponennya tergantung pada gerakan relatif dari senyawa yang
dipisahkan pada kedua fase ini. Cara-cara kromatografi dapat digolongkan sesuai
dengan sifat-sifat dari fase diam, yang dapat berupa zat padat atau zat cair. Jka
fase diam berupa zat padat maka cara tersebut dikenal dengan kromatografi
serapan (absorbsi), jika zat cair dikenal sebagai kromatografi pembagian (partisi)
(Sastrohamidjojo, 1991).
2.4.1. Kromatografi Lapis Tipis
Kromatografi lapis tipis termasuk kromatografi adsobsi, sebagai fase diam
digunakan zat padat yang disebut adsorben (penyerap) dan fase gerak adalah zat
cair yang disebut larutan pengembang. Tebal
Plat lapis tipis untuk tujuan kualitatif adalah 0,1-0,3 mm, sedangkan untuk
pemisahan kuantitatif (KLT preparatif) mempunyai fase diam dengan ketebalan
0,5-2mm (Gritter, 1991; Hostettmann, 1995). Pendeteksian bercak hasil
pemisahan dapat dilakukan dengan bebera[a cara, yaitu dengan peraksi kimia
tanpa pemanasan dengan pemanasan, sinar lampu ultraviolet pada panjang
gelombang 254 nm dan 366 nm (Stahl, 1985).
a. Fase Diam
Pada kromatografi lapis tipis, fase diam berupa lapisan tipis yang terdiri
atas bahan padat yang dilapiskan pada permukaan penyangga datar. Lapisan
dari fase diam adalah ukuran partikel dan homogenitasnya, karena gaya adhesi
pada penyokong sangat tergantung pada kedua sifat trsebut. Partikel dengan
bituran yang kasar tidak akan memberikan hasil yang memuaskan. Salah satu cara
untuk memperbaiki hasil pemisahan adalah dengan menggunakan fase diam yang
biturannya halus. Penyerap yang banyak dipakai untuk kromatografi lapis tipis
adalah silika gel, alumunium oksida, kieselgur, selulosa dan poliamida
(Sastrohamidjojo, 1991; Stahl, 1985).
b. Fase Gerak
fase gerak ialah medium angkut dan terdiri atas satu atau beberapa pelarut.
Ia bergerak didalam fase diam yaitu suatu lapisan berpori, karena ada gaya
kapiler. Pemilihan sistem pelarut yang dipakai didarkan atas prinsip like dissolves
like yaitu untuk memisahkan sampel yang bersifa non polar digunakan sistem
pelarut yang bersifat non polar dan untuk memisahkan sampel yang bersifat polar
digunakan sistem pelarut yang bersifat polar (Stahl, 1985).
c. Harga Rf
Jarak pengembangan suatu senyawa pada kromatogram dinyatakan dengan
angka Rf atau hRf (Stahl, 1985).
Jarak perambatan bercak dari titi penotolan Rf =
Jarak perambatan pelarut dari titik penotolan
Faktor – faktor yang mempengaruhi harga Rf (Sastrohamidjojo, 1991) :
1. Struktur kimia dari senyawa yang dipisahkan
2. Sifat penyerap
3. Tebal dan kerataan dari lapisan penyerap
5. Derajat kejenuhan pengembang dalam bejana
6. Jumlah cuplikan
7. Suhu
2.4.2. Kromatografi Kolom
Kromatografi kolom terdiri dari kromatografi biasa atau kromatografi
kolom grafiti yaitu fase geraknya hanya dipengaruhi oleh daya tarik bumi
(gravitasi). Kromatografi lainnya adalah kromatografi cair vakum (KCV) yang
fase geraknya diberi tekanan. Kromatografi kolom termasuk dalam kromatografi
serapan, biasanya dipakai untuk memisahkan suatu campuran dari penjerap padat
dari suatu fase diam dan dialiri pelarut sebagai fase gerak (Sastrohamidjojo,
1991).
Kolom besar yang dipakai pada kromatografi kolom grafiti, merupakan
metode kromatografi terbaik untuk pemisahan campuran dalam jumlah besar
(lebih dari 1 gram). Campuran yang akan dipisahkan diletakkan berupa pita pada
bagian atas penjerap yang berada pada tabung kaca, tabung logam atau bahkan
tabung plastik. Pelarut (fase gerak) dibiarkan mengalir melalui kolom yang
disebabkan oleh gaya gravitasi. Pita senyawa zat terlarut bergerak melalui kolom
dengan laju yang berbeda, memisah, dan dikumpul berupa fraksi ketika keluar
dari dasar kolom.
Kolom kromatografi unuk pengaliran karena gaya gravitasi atau sistem
bertekanan rendah biasa terbuat dari kaca yang dilengkapi keran jenis tertentu
pada bagian bawahnya untuk mengatur aliran pelarut. Didalam tabung terdapat
penopang atau sejenis piringan plat, tepatnya diatas keran, untuk menahan Ketika pelarut pengelusi meninggalkan kolom sebagai eluat,
penyerap. Ukuran kolom beraneka ragam, tetapi biasannya panjangnya
sekurang-kurangnya 10 kali garis tengah dalamnya dan mungkin saja sampai 100 kali
(Gritter, 1991).
Kecepatan bergerak dari suatu komponen tergantung pada berapa besarnya
komponen terhambat atau tertahan oleh penyerap didalam kolom. Jadi suatu
senyawa yang diserap lemah akan bergerak lebih cepat daripada yang diserap
kuat. Akan terlihat bahwa jika perbedaan-perbedaan dalam serapan cukup besar
maka akan terjadi pemisahan yang sempurna (Hostetmann, 1986;
Sastrohamodjojo, 1991).
2.5. Spektroskopi
Spektroskopi adalah studi mengenai interaksi antara cahaya dengan atom
dan molekul. Umumnya spektroskopi dibagi menjadi 2 kelompok yaitu :
spektroskopi serapan dan spektroskopi emisi. Pengelompokkan ini berdasarkan
apa yang diukur setelah terjadi interaksi antara radiasi elektromagnetik dan sam
pel. Pembagian juga dapat didasarkan pada daerah-daerah panjang gelombang
dalam spektrum elektromagnetik. Sistem detektor menggunakan sel fotolistrik
maka metode pengukuran ini secara umum dinamakan spektrofotometri (Noerdin,
1985).
2.5.1. Spektrofotometri Sinar Ultraviolet
Spektrofotometri ultraviolet merupakan suatu metode analisa berdasarkan
atas pengukuran serapan suatu larutan yang dilalui radiasi monokromatis
ultraviolet. Apabila suatu molekul menyerap radiasi ultraviolet, didalam molekul
molekul paling luar, dari tingkat energi paling rendah ke tingkat energi yang lebih
tinggi. Panjang gelombang ultraviolet tergantung pada mudahnya promosi
elektron. Molekul-molekul yang memerlukan banyak energi untuk promosi
elektron akan menyerap radiasi ultraviolet pada panjang gelombang yang lebih
pendek. Molekul yang memerlukan energi yang lebih sedikit akan menyerap
panjang gelombnag yang lebih panjang (Fessenden dan Fessenden, 1995;
Noerdin, 1985).
Istilah-istilah yang sering digunakan dalam spektrofotometri ultraviolet
(Dachriyanus, 2004; Noerdin, 1985; Sastrohamodjojo, 1991) antara lain :
1. Kromofor adalah gugus tidak jenuh yang menyerap radiasi di daerah ultraviolet.
Hampir semua kromofor mempunyai ikatan tak jenuh. Contohnya : C=C, C=O
dan NO2.
2. Auksokrom adalah suatu substituen (biasanya gugus jenuh) yang bila terikat
pada kromofor akan mengubah panjang gelombang dan intensitas dari serapan
maksimum. Contohnya : -OH, -NH2
Daerah yang paling berguna dari spektrum ultraviolet adalah daerah
dengan panjang gelombang 200-400 nm. Spektrum ultraviolet adalah suatu , -Cl.
3. Pergeseran batokromik (pergeseran merah) adalah pergeseran serapan
maksimum ke arah panjang gelombang yang lebih panjang disebabkan substitusi
pada kromofor (oleh auksokrom) atau pengaruh pelarut.
4. Pergeseran hipsokromik (pergeseran biru) adalah pergeseran serapan ke
panjang gelombang yang lebih pendek. Efek hiperkromik yaitu suatu kenaikan
dalam intensitas serapan.
gambar antara panjang gelombang lawan intensitas serapan (absorbansi)
(Fessenden & Fessenden, 1995; Sastrohamodjojo, 1991).
2.5.2. Spektrofotometri Infra Merah
Bila sinar inframerah dilewatkan melalui cuplikan senyawa organik, maka
sejumlah frekuensi diserap sedang frekuensi yang lain diteruskan atau
ditransmisikan tanpa diserap. Pengukuran pada spketrum inframerah dilakukan
pada daerah bilangan gelombang 4000-200 cm -1. Penggunaan spektrofotometri
infra merah untuk maksud analisa lebih banyak ditujukan untuk identifikasi suatu
senyawa. Hal ini dimungkinkan, disebabkan spektrum infra merah senyawa
organik bersifat khas artinya senyawa yang berbeda akan mempunyai spektrum
yang berbeda pula (Sastrohamidjojo, 1991; Noerdin, 1985).
Cara menganalisa spektrum inframerah dari senyawa yang tidak diketahui.
adalah pertama harus ditentukan ada atau tidaknya beberapa gugus fungsional
utama, seperti C=O , O-H , C-O, C=C, C≡N, C≡C dan NO2. Menurut pavia
(1988), langkah-langkah umum untuk memeriksa pita-pita serapan yang penting
yang umum untuk memeriksa gugus yang penting pada spektrum inframerah
sebagai berikut :
1. Apakah terdapat gugus karbonil?. Gugus C=O memberikan puncak pada daerah
1820-1660 cm-1. puncak ini biasanya merupakan yang terkuat dengan lebar
medium pada spektrum.
2. Jika gugus C=O ada, periksalah gugus-gugus berikut. Jika C=O tidak ada
langsung ke nomor 3.
Asam : apakah ada gugus O-H?. Serapan melebar di daerah 300-2500 cm
-1
Amida : apakah ada N-H?. Serapan dekat 3500 cm-1, kadang-kadang dekat
puncak rangkap
Ester : apakah ada C-O. Serapan dengan intensitas medium di daerah
1300-1000 cm-1.
Anhidrida : mempunya dua serapan C=O di daerah 1810 dan 1760 cm-1.
Aldehida : apakah ada C-H aldehid?. Dua serapan lemah di dekat 2850-2750
cm-1 yaitu di sebelah kanan serapan C=H.
Keton : jika kelima kemungkinan di atas tidak ada
3. jika gugus C=O tidak ada
Alkohol/fenol : periksalah gugus O-H, merupakan serapan melebar di daerah
3600-3300 cm-1 yang diperkuat adanya serapan C-O di daerah
1300-1000 cm-1.
Amina : periksalah gugus N-H, yaitu serapan medium di daerah 3500 cm-1.
Eter : periksalah gugus C-O (serapan O-H tidak ada), yaitu serapan
medium di daerah 1300-1000 cm-1.
4. Ikatan rangkap dua dan/atau cincin aromatik
- C=C mempunyai serapan lemah di daerah 1650 cm-1
- Serapan medium sampai kuat pada daerah 1650-1450 cm-1 sering menunjukkan
adanya cincin aromatik.
- Buktikan kemungkinan di atas dengan memperhatikan serapan pada daerah C-H
aromatik disebelah kiri 3000 cm-1, sedangkan C-H alifatis terjadi di sebelah
kanan daerah tersebut.
5. Ikatan rangkap tiga
- C=C mempunyai serapan lemah tapi tajam di daerah 2150 cm-1. Periksa juga
CH asetilenik di dekat3300 cm-1.
6. Gugus nitro
Dua serapan kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1.
7. Hidrokarbon
- Apabila keenam kemungkinan di atas tidak ada
- Serapan utama di daerah CH dekat 3000 cm-1.
- Spektrum sangat sederhana, hanya terdapat serapan lain di daerah 1450-1375
BAB III
METODOLOGI PENELITIAN
Metode penelitian ini meliputi pengumpulan, pengolahan sampel,
pembuatan ekstrak n-heksana, analisis ekstrak dengan KLT dan dilanjutkan isolasi
dengan kromatografi kolom dan KLT preparatif, isolat yang diperoleh dimurnikan
dan diuji kemurniannya dengan KLT dua arah dengan fase gerak n-heksana -
etilasetat (70:30) dan toluena – etilasetat (70:30). Selanjutnya terhadap isolat yang
telah murni dikarakterisasi dengan menggunakan spektrofotometer ultraviolet
(UV) dan spektrofotometer inframerah (IR).
3.1. Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, blender (Philips), oven listrik (Gallenkamp), penguap vakum putar
(Heidolph), neraca kasar (Ohaus), neraca analitik (Sartorius), seperangkat alat
kromatografi lapis tipis (KLT), kromatografi kolom dan KLT preparatif,
spektrofotometer ultraviolet (QP 5000 Simadzu), dan spektrofotometer infra
merah (M-500 Buck).
3.2. Bahan-bahan yang digunakan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah daun segar
tumbuhan ruku-ruku (Ocimum sanctum L.) yang cukup dewasa. Bahan kimia
yang digunakan kecuali dinyatakan lain berkualitas pro analisis (E.Merck) yaitu :
plat pralapis tipis silika gel 254, sillika gel GF254. silika gel mesh 70-230 ASTM
dan air suling (laboratorium fitokimia).
3.3. Pengumpulan sampel, Identifikasi Sampel dan Pengolahan Sampel 3.3.1. Pengumpulan Sampel
Sampel yang digunakan dalam penelitian ini adalah daun segar tumbuhan
ruku-ruku (Ocimum sanctum L.) yang cukup tua dari daerah Kecamatan Marelan
tanah 600 lingkungan VIII Kota Medan. Pengumpulan sampel dilakukan secara
purposif, tanpa membandingkan dengan tumbuhan yang sama dari daerah lain.
3.3.2. Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan oleh Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Pusat Penelitian Biologi. Identifikasi tumbuhan dilakukan oleh
peneliti sebelumnya yaitu oleh Cut Azwanidar (2008). Hasil identifikasi
tumbuhan dapat dilihat pada lampiran 1 halaman 32. Gambar tumbuhan dapat
dilihat pada lampiran 2 halaman 33.
3.3.3 Pengolahan Sampel
Daun ruku-ruku yang segar dibersihkan dari pengotoran, dicuci dengan air
bersih, ditiriskan lalu ditimbang, diperoleh berat basah 5,8 kg. Selanjutnya daun
dikeringkan dengan cara diangin-anginkan di udara terbuka terhindar dari sinar
matahari langsung, setelah kering dan rapuh daun ditimbang, diperoleh berat
kering sebanyak 800 g. Selanjutnya daun diserbukkan dengan blender dan
3.3.4. Pengujian Senyawa Triterpenoida/Steroida
Terhadap serbuk daun tumbuhan ruku-ruku (Ocimum sanctum L.)
dilakukan pemeriksaan senyawa golongan triterpenoida/steroida dengan
penampak bercak Liebermann - Burchard.
Cara kerja :
Sebanyak 1 g serbuk daun dimaserasi dengan 20 ml eter selama 2 jam,
kemudian disaring, filtrat diuapkan dalam cawan porselen, sisa ditambahkan 2
tetes pereaksi Libermann-Burchard. Timbulnya warna ungu atau ungu kemerahan
yang kemudian menjadi biru hijau menunjukkan adanya senyawa
triterpenoida/steroida (Harborne, 1987).
3.3.5. Pembuatan Ekstrak
Pembuatan ekstrak dilakukan dengan cara maserasi menggunakan pelarut
n-heksan.
Cara kerja :
Sebanyak 800 g serbuk daun dimasukkan ke dalam wadah gelas yang
berwarna gelap bertutup, dimaserasi dengan pelarut n-heksana (6 liter), ditutup,
dibiarkan pada suhu kamar dan terlindung dari cahaya selama 2 x 24 jam sambil
sering diaduk, kemudian disaring, terhadap ampas dimaserasi kembali
menggunakan prosedur yang sama. Pengerjaan dilakukan tiga kali sampai maserat
tidak memberikan reaksi positif dengan penambahan pereaksi
Libermann-Burchard. Maserat yang diperoleh digabungkan kemudian diuapkan dengan
bantuan penguap vakum putar pada suhu ± 400C sampai diperoleh ekstrak
kental.ekstrak kental diperoleh sebanyak 26 g. Bagan ekstraksi dapat dilihat pada
3.4. Pembuatan Larutan Pereaksi
3.4.1. Pereaksi Libermann-Burchad (Harborne, 1987)
Sebanyak 20 ml asam asetat anhidrat dicampur dengan 1 ml asam sulfat
pekat dan 50 ml kloroform. Larutan ini harus dibuat baru.
3.5. Pembuatan Plat Kromatografi Lapis Tipis
Sebanyak 30 g silika gel GF254 dimasukkan ke dalam lumpang porselen
kering, ditambahkan 40 ml air suling, mula-mula diaduk perlahan-lahan dengan
alu sampai didapat suspensi yang seragam tanpa terjadi gelembung udara ataupun
gumpalan. Selanjtutnya ditambahkan air suling sebanyak 20 ml sambil diaduk.
Jangka waktu untuk memperoleh suspensi yang dapat disaputkan tidak boleh
melebihi sembilan puluh detik, kemudian suspensi segera dituanglan ke plat kaca.
Plat yang sudah dilapisi dibiarkan kering. Kemudian diaktifkan dalam oven pada
suhu 1100C selama 30 menit dengan posisi tegak dalam rak pengering. Plat
disimpan ditempat yang tidak lembab dan bebas uap laboratorium (Stahl, 1985).
3.6. Analisis Ekstrak n-Heksana secara Kromatografi Lapis Tipis (KLT)
Ekstrak n-heksana dianalisis secara KLT menggunakan plat pra lapis tipis
silika gel GF254
Ekstrak n-heksana ditotolkan pada plat pra lapis tipis silika gel GF , fase gerak campuran n-heksana :etil asetat dengan perbandingan
(90:10), (80:20), (70:30), (60:40), (50:50), penampak bercak adalah pereaksi
Libermann-Burchard.
Cara kerja :
254,ke
elusi selesai plat dikeluarkan dari bejana dan diamati secara visual, lalu disemprot
dengan pereaksi Libermann-Burchard, plat dipanaskan di oven pada suhu 85-950
Seperangkat alat kromatografi kolom dipasang, kemudian ke dalam dasar
kolom dimasukkan kapas yang telah dicuci dengan metanol dan dikeringkan
sebagai filter. Silika gel disuspensikan dengan fase gerak n-heksana, diaduk
sampai homogen dan dimasukkan ke dalam kolom yang telah diisi dengan fase
gerak yang sama sambil dinding kolom diketuk-ketuk untuk menghilangkan
gelembung udara dan dialiri dengan fase gerak sampai memadat. Kolom yang
sudah dikemas dibiarkan selama 24 jam, kemudian kolom dibuka sampai
genangan pelarut sama dengan tinggi silika gel. Ekstrak n-heksana dilarutkan
dengan sedikit fase gerak lalu dimasukkan ke dalam kolom secara perlahan-lahan.
Setelah sampel turun, lalu melalui dinding kolom secara perlahan-lahan dialirkan
fase gerak dengan menggunakan pipet tetes sambil kran kolom dibuka. Atur
tetesan yang keluar sama dengan tetesan pelarut dari reservoir. Hasil elusi
masing-msing ditampung 5 ml dalam vial yang telah diberi nomor dan elusi dihentikan C
selama 15 menit, diamati kembali warna bercak dan dihitung harga Rf. Hasil
kromatogram dapat dilihat pada lampiran 4 halaman 35.
3.7. Isolasi Ekstrak Dengan Kromatografi Kolom
Ekstrak n-heksana di kromatografi kolom menggunakan pelarut landaian
n-heksana – etilasetat dengan perbandingan 100:0, 90:10, 80:20, 70:30, 60:40,
50:50, dan fase diam silika gel 60 ukuran partikel 0,063-0,200 (mesh 70-230
ASTM)
setelah vial terakhir memberikan hasil negatif terhadap pereaksi
Libermann-Burchad. Selanjutnya di KLT dan pola kromatogram yang sama hasilnya
digabungkan menjadi satu fraksi. Kromatogram hasil kromatografi kolom dapat
dilihat pada lampiran 6 da 7 halaman 37 dan 38, kromatogram hasil
penggabungan fraksi dapat dilihat pada lampiran 8 halaman 39 dan harga Rf
penggabungan fraksi dapat dilihat pada lampiran 9 halaman 40.
3.8. Pemisahan Senyawa Triterpenoida/Steroida dari Fraksi F2 dengan KLT Preparatif serta Pemurnian Kristal F2
Kristal F2 hasil kromatografi kolom dikromatografi lapis tipis preparatif
menggunakan fase diam silika gel GF254, fase gerak n-heksana - etilasetat (70:30)
dan penampak bercak pereaksi Liebermann - Burchard.
Cara kerja :
Terhadap F2 ditotolkan berupa pita pada plat KLT berukuran 20 x 20 cm
lalu dimasukkan kedalam bejana yang telah jenuh dengan uap fase gerak. Setelah
elusi selesai plat dikeluarkan terhadap pereaksi dari bejana dan dikeringkan
kemudian bagian samping plat disemprot dengan pereaksi Liebermann - Burchard
lalu dipanaskan dengan bantuan hair dryer. Bagian plat silika gel yang
memberikan harga Rf sama dengan noda yang positif terhadap pereaksi
Liebermann - Burchard dikerok kemudian dilarutkan dengan pelarut metanol,
filtrat kemudian dimasukkan kedalam lemari pendingin sampai terbentuk kristal.
Larutan dipisahkan dari kristal yang terbentuk dan dicuci kembali berulang kali
dengan metanol dingin hingga diperoleh kristal murni. Kromatogram hasil KLT
3.9. Uji Kemurnian Terhadap Kristal Hasil Ioslasi F2 Dengan KLT 2 Arah
Terhadap isolat F2 dilakukan KLT 2 arah dengan prosedur yang sama
pada no. 2.9. menggunakan fase gerak I n-heksana : etil asetat (70:30) dan fase
gerak II kloroform : toluena (70:30), fase diam plat pralapis silika gel GF254,
sebagai penampak bercak pereaksi Liebermann-Burchard. Hasil kromatogram
dapat dilihat pada lampiran 11 halaman 42.
3.10. Karakterisasi Isolat
Karakterisasi isolat F2 menggunakan spektrofotometer sinar ultraviolet
dan spektrofotometer sinar inframerah.
3.10.1. Karakterisasi Isolat Secara Spektrofotometri Sinar Ultraviolet
Karakterisasi isolat secara spektrofotometri sinar ultraviolet dilakukan
dengan cara melarutkan isolat dengan metanol kemudian dimasukkan kedalam
kuvet yang telah dibilas dengan larutan sampel dan diukur panjang gelombang
maksimumnya pada panjang gelombang 200 – 400 nm. Hasil karakterisasi
spektrofotometer sinar ultraviolet dapat dilihat pada lampiran 12 halaman 43.
3.10.2. Karakterisasi Isolat Secara Spektrofotometri Sinar Inframerah
Karakterisasi isolat secara spektrofotometri sinar ultraviolet dilakukan
dengan cara melarutkan isolat dengan 1-2 ml pelarut yang cocok (metanol, etanol,
CHCl3, aseton, heksana atau freon-113). Tempatkan satu atau dua tetes larutan
pada plat NaCl, biarkan pelarut menguap hingga terbentuk bercak noda kemudian
dicetak pada sel plasma PCL-11M dan dimasukkan kedalam spektrofotometer
inframerah, diukur absorbansinya pada frekuensi 4000-400 cm-1. Hasil
karakterisasi spektrofotmeter sinar inframerah dapat dilihat pada lampiran 13
BAB IV
HASIL DAN PEMBAHASAN
Serbuk daun tumbuhan ruku-ruku (Ocimum sanctum L.) diekstraksi
dengan cara maserasi menggunakan pelarut n-heksana dengan tujuan agar
senyawa-senyawa triterpenoida/steroida bebas dapat tersari dengan sempurna.
Ekstrak dianalisi menggunakan fase diam plat pralapis tipis silika gel GF254, fase
gerak n-heksana : etil asetat dengan perbandingan 90:10, 80:20, 70:30, 60:40,
50:50, menggunakan penampak bercak Libermann-Burchad.
Isolasi senyawa triterpenoida/steroida dari ekstrak n-heksana dengan
kromatografi kolom menggunakan pelarut landaian n-heksana - etilasetat dengan
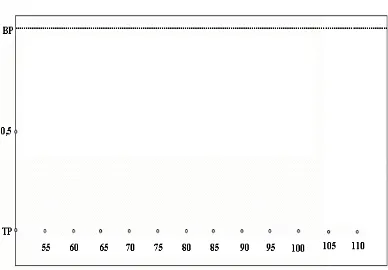
perbandingan 100:0, 90:10, 80:10, 70:30. 60:40, 50:50, diperoleh 8 fraksi yaitu F1
(vial 1-9), F2 (vial 10-29), F3 (vial 30-34), F4 (vial 35-54), F5 (vial 55-79), F6
(vial 80-94), F7 (vial 95-104), F8 (vial 105-110). Pada F2 telah terbentuk kristal
dan terbentuk 3 noda yaitu berturut-turut harga Rf 0,93 (merah ungu), Rf 0,83
(biru hijau), Rf 0,75 (ungu) terhadap pereaksi Libermann-Burchad. Selanjutnya
terhadap F2 dilakukan isolasi kembali dengan KLT preparatif menggunakan fase
gerak n-heksana : etil asetat (70:30), fase diam silika gel GF254. Isolat setelah
dicuci dengan metanol dingin diperoleh kristal bentuk amorf pada F23.
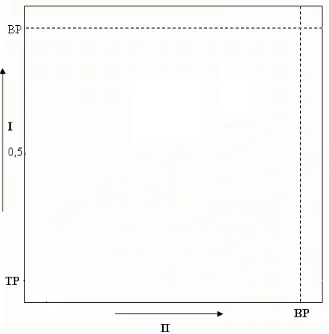
Hasil uji kemurnian dua arah dari F23
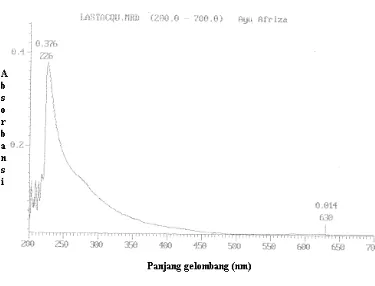
Hasil spektrofotometer sinar ultraviolet isolat F2
dengan fase gerak n-heksana-etil
asetat (70:30), toluena : etil asetat (70:30) memberikan satu bercak dan diperoleh
harga Rf berturut-turut 0,75 dan 0,50 (ungu).
3 memberikan panjang
Penafsiran spektrum inframerah pada bilangan gelombang 3402,43 cm-1
menunjukkan adanya gugus −OH, pita pada bilangan gelombang 2931,9
menunjukkan adanya gugus C−H alifatis, pita pada bilangan gelombang 1581,63
menunjukkan adanya ikatan C=C, pita pada bilangan gelombang 1404,18
menunjukkan adanya ikatan CH2, pita pada bilangan gelombang 1327,03
menunjukkan adanya ikatan CH3 serta bilangan gelombang 1103,99 dan 1056,99
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Isolasi senyawa triterpenoida/steroida dari ekstrak n-heksana yang telah
dilakukan diperoleh isolat murni kristal bentuk amorf dengan Rf 0,75 (ungu).
Karakterisasi isolat menggunakan spektrofotometer sinar ultraviolet
diperoleh panjang gelombang maksimum (λ) yaitu 226 nm dan karakterisasi
menggunakan spektrofotometer sinar inframerah menunjukkan adanya gugus
−OH, gugus C−H alifatis, gugus C=C, gugus CH2, gugus CH3, dan ikatan C−O.
5.2. Saran
Disarankan kepada peneliti selanjutnya untuk melanjutkan penelitian
terhadap senyawa triterpenoida/steroida lainnya yang terdapat pada tumbuhan
DAFTAR PUSTAKA
Anonim. Online (2007). http//www.botanicalpathways.com/issue%2011/
sacredbasel.html.
Brunetton, J. (1995). Pharmacognosy, Phytochemistry, Medical Plants. USA:
Lavoiser Publishing inch: P. 527, 528, 538.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik. Cetakan I. Padang. CV
Trianda Anugerah Pratama. Hal. 33.
Darmiati, I. (2007). Pemeriksaan Kandungan Kimia dan Uji Efek Antiinflamasi
dari Ekstrak Etanol Daun Ruku-Ruku (Ocimum sanctum L.). Skripsi
Fakultas Farmasi USU Medan hal. 4, 49.
Depkes RI. (1979). Farmakope Indonesia. Edisi III. Jakarta. Depkes RI. Hal. 748,
773.
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta. Depkes RI. Hal.
1003, 1004, 1061.
Ditjen POM. (1995). Materia Medika Indonesia. Edisi VI. Jakarta. Depkes RI.
Hal. 513, 518, 522, 553.
Ditjen POM. (2000). Parameter Pembuatan Ekstrak. Jakarta. Depkes RI. Hal.
6-7.
Farnsworth, N.P. (1996). Biological And Phytochemical Screening Of plants.
Journal Pf Pharmaceutical Sciences. Chicago. P. 257-259.
Gritter, R.J., Bobbit, J.M., dan Schwarting, A.E. (1991). Introduction to
Chromatography. 2nd ed. Terjemahan Padmawinta K. “(1991). Pengantar
Harborne, J.B. (1987). Metode Fitokimia. Terjemahan oleh Dr. Kosasih P. Dan
Dr. Iwang S. Cetakan II. Bandung. ”ITB. Hal. 147-152.
Heyne, K. (1987). Tumbuhan Berguna Indonesia. Badan Litbang Departemen
Kehutanan. Jilid III. Cetakan I. Jakarta : Yayasan Sarana Wijaya. Hal.
1979.
Hostetmann, K., Hostetmann., M., Marston, A. (1995). Cara Kromatografi
Preparatif : Penggunaan Pada Isolasi Senyawa Alam. Ierjemahan :
Padmawinata, K. Bandung, Penerbit ITB. Hal. 9-11.
Mangan, Y. (2003). Cara Bijak Menaklukkan Kanker : Sehat Dengan Ramuan
Tradusional. Jakarta : Agromedia Pustaka. Hal. 29.
Manitto, P. (1981). Biosintesis Produk Alami. Terjemahan : Koensoemardiyah,
Cetakan I Semarang : IKIP Semarang Pres. Hal. 231, 339, 379.
Naito, Y. (1995). Medical Herba, Index TumbuhanObat di Indonesia. Jakarta :
PT. Eisai Indonesia. Hal. 139, 281.
Robinson, T. (1995).. Kandungan Organik Tumbuhan Tinggi. Terjemahan :
Padmawinata, K. edisi VI. Bandung : ITB. Hal. 139, 281.
Sastrohamidjojo, H. (1966). Sintesis Bahan Alam. Yogyakarta. UGM Press. Hal.
78-79.
Sastrohamidjojo, H. (1986). Spektroskopi. Edisi Pertama. Cetakan Pertama
Yogyakarta. Liberty. Hal. 12.
Sastrohamidjojo, H. (1991).Kromatografi. Edisi I. Yogyakarta. UGM Press. Hal.
1-3.
Subrahmanyam, S. N. (2003). Modern Plant Taxonomy. New Delhi : Vikas
Publishing House PVT LTD. P. 55, 62.
Sudjadi. (1989). Metode Pemisahan. Kanasius. Hal. 73.
Tarigan, P. (1980). Sapogenin Steroid. Bandung. Penerbit Alumni. Hal. 15.
Tjitrosoepomoe, G. (2001). Morfologi Tumbuhan (Spermatophyta).
Lampiran 1. Hasil Identifikasi / Determinasi Tumbuhan
Lampiran 2
[image:47.595.149.473.124.352.2]Gambar 1. Tumbuhan Ruku-ruku (Ocimum sanctum L.)
Lampiran 3
dibersihkan
dikeringkan
dihaluskan
dimaserasi dengan n-heksana disaring
Diuapkan dengan
Penguap vakum putar
Bagan Ekstraksi Tumbuhan Ruku-ruku (Ocimum sanctum L.)
5,8 kg daun Ruku-ruku
800 g Daun kering
Filtrat Ampas
Lampiran 4
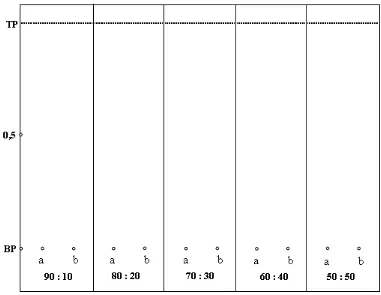
Gambar 3. Kromatogram hasil KLT ekstrak n-heksana daun ruku-ruku (Ocimum sanctum L.)
Keterangan : Fase diam silika gel GF254, fase gerak n-heksana – etilasetat 90:10,
80:30, 70:30, 60:40, 50:50, a:= dilihat secara visual, b = disemprot
pereaksi Liebermann-Burchard, BP = batas pengembangan, TP =
Lampiran 5
di kromatografi kolom
dengan pelarut landaian
n-heksana – etil asetat
(100:0,90:10,80:20,70:30,60
:40,50:50)
di KLT
eluat dengan senyawa kimia
yang sama digabung
Di KLT preparatif
diuji kemurnian dengan KLT
satu arah dan dua arah
dikarakterisasi dengan
spektrofotometri UV dan IR
Bagan Isolasi Senyawa Triterpenoida/steroida dari ekstrak n-heksana Daun Tumbuhan Ruku-ruku (Ocimum sanctum L.)
Lampiran 6
Gambar 4. Kromatogram analisa KLT hasil kromatografi kolom ekstrak n-heksana daun tumbuhan ruku-ruku (Ocimum sanctum L.)
Keterangan : fase diam silika gel GF GF254, fase gerak n-heksana – etilasetat
Lampiran 7
Gambar 5. Kromatogram analisa KLT hasil kromatografi kolom ekstrak n-heksana daun tumbuhan ruku-ruku (Ocimum sanctum L.)
Keterangan : fase diam silika gel GF254, fase gerak n-heksana – etilasetat
Lampiran 8
Gambar 6. Kromatogram penggabungan fraksi-fraksi dari kromatografi kolom ekstrak n-heksana daun tumbuhan ruku-ruku (Ocimum sanctum L.)
Keterangan : fase diam silika gel GF254, fase gerak n-heksana – etilasetat (70:30)
Lampiran 9
Tabel harga Rf hasil KLT kromatografi kolom ektrak n-heksana daun ruku-ruku
(Ocimum sanctum L.)
No. Fraksi (F) Rf Warna noda
1 F1 (vial 1-9) 0,87 Merah
2. F2 (vial 10-29) 0,93
0.83
0,75
Ungu merah
Biru hijau
Ungu
3. F3 (vial 30-34) 0,83
0,75
Biru hijau
Ungu
4. F4 (vial (35-54) 0,75
0,66
Ungu
biru hijau
5. F5 (vial55-79) 0,66
0,475
Biru hijau
Ungu
6. F6 (vial 80-94) 0,41
0,31
Ungu
Ungu lemah
7. F7 (vial 95-104) 0,31
0,23
Ungu lemah
Ungu lemah
8. F8 (vial 105-110) 0,23
0,15
Ungu lemah
Lampiran 10
Gambar 7. Kromatogram KLT preparatif F2
Keterangan : Fase diam silika gel GF254, fase gerak n-heksana : etil asetat (70:30),
penampak bercak Liebermann-Burchard, BP = batas pengembangan,
Lampiran 11
Gambar 8. Kromatogram hasil uji kemurnian F23dengan KLT dua arah
Keterangan : Fase diam silika gel GF254, fase gerak I n-heksana - etilasetat
(70:30), fase gerak II toluena - etilasetat (70:30), penampak bercak
Liebermann-Burchard, BP = batas pengembangan, TP = titik
Lampiran 12
Lampiran 13