PENGARUH SUHU HIDROLISIS PADA PEMBUATAN
DEKSTRIN DARI PATI KENTANG (
Solanum tuberosum
L.)
SECARA ENZIMATIS
SKRIPSI
OLEH:
ERNAWATI
NIM 121524118
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH SUHU HIDROLISIS PADA PEMBUATAN
DEKSTRIN DARI PATI KENTANG (
Solanum tuberosum
L.)
SECARA ENZIMATIS
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
ERNAWATI
NIM 121524118
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
PENGARUH SUHU HIDROLISIS PADA PEMBUATAN
DEKSTRIN DARI PATI KENTANG (
Solanum tuberosum
L.)
SECARA ENZIMATIS
OLEH:
ERNAWATI
NIM 121524118
Dipertahankan dihadapan panitia penguji Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal 03 Agustus 2015
Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Prof. Dr. Karsono, Apt. Prof. Dr. Hakim Bangun, Apt.
NIP 195409091982011001 NIP 195201171980031002
Pembimbing II, Prof. Dr. Karsono, Apt. NIP 195409091982011001
Popi Patilaya, S.Si, M.Sc., Apt Prof. Dr. Jansen Silalahi, M.App.Sc., Apt. NIP 197812052010121004. NIP 195006071979031001
Dra. Azizah Nasution, M.Sc, Ph.D., Apt. NIP 195503121983032001
Medan, Agustus 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
KATA PENGANTAR
Puji syukur kepada Allah SWT atas segala limpahan rahmat dan
karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
Tak lupa pula shalawat beriring salam kepada Rasulullah Muhammad SAW
sebagai suri tauladan dalam kehidupan.
Dekstrin dapat dibuat dari pati kentang dengan beberapa metode yaitu
metode basah, metode kering dan metode enzimatis. Salah faktor yang
mempegaruhi pembuatan dektrin adalah suhu hidrolisis. Skripsi dengan judul
“Pengaruh suhu hidrolisis pada pembuatan dekstrin dari pati kentang (Solanum
tuberosum L.) secara enzimatis” disusun untuk melengkapi salah satu syarat
mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera
Utara. Penelitian ini diharapkan dapat menjadi informasi untuk masyarakat,
termasuk akademisi tentang pengaruh suhu hidrolisis terhadap karakteristik
dekstrin dari pati kentang (Solanum tuberosumL.) secara enzimatis.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih kepada Bapak Prof. Dr. Karsono, Apt.,danPopi Patilaya, S.Si, M.Sc.,
Apt., selaku pembimbing yang telah memberikan waktu, bimbingan, dan nasehat
selama penelitian hingga selesainya penyusunan skripsi ini. Ucapan terima kasih
kepada Bapak Prof. Dr. Sumadio Hadisaputra, Apt., selaku Dekan Fakultas
Farmasi dan Ibu Prof. Dr. Julia Reveny, M.Si., Apt.,selaku Wakil Dekan I
Fakultas Farmasi USU yang telah memberikan bantuan dan fasilitas sehingga
penulis dapat menyelesaikan pendidikan, serta kepadaDra.,TutyRoidaPardede,
masa pendidikan di Fakultas Farmasi Universitas Sumatera Utara. Ucapan terima
kasih juga penulis sampaikan kepada Bapak Prof. Dr. Hakim Bangun, Apt.,
BapakProf. Dr. Jansen Silalahi, M.App.Sc., Apt., dan Ibu Dra. Azizah Nasution,
M.Sc, Ph.D., Apt., selaku dosen pengujiyang telah memberikan saran dan arahan
kepada penulis dalam menyelesaikan skripsi ini. Terima kasih juga kepada Ibu
Lia Laila, S.Farm., M.Sc., Apt., danBapakBayu Eko Prasetyo, S. Farm., M.Sc.,
Apt., selaku dosen yang telah memberi arahan dan bantuan kepada penulis
selama melakukan penelitian di Laboratorium Penelitian.
Ucapan terima kasih dan penghargaan yang tulus tiada terhingga kepada
Ayahanda Usman dan Ibunda Husna yang telah memberikan cinta dan kasih
sayang yang tidak ternilai dengan apapun dan motivasi serta doa yang tulus yang
tidak pernah berhenti. Kepala Dinas Kesehatan Aceh Utara Bapak dr. Effendi,
M.Kes yang telah memberi izin saya untuk melanjutkan pendidikan. Pemilik
Klinik Husada Lhoksukon Jamaluddin dan NS Erlina S.Kep, adik-adikku
tersayang, Irma Suryati SKM, Irza Lena Amd.FKG, IrwanSyah S.Pdi, Khairuddin
Amd.Kep dan lainnya yang telah memberikan dukungan dan doanya selama ini.
Penulis juga tidak lupa mengucapkan terima kasih kepada asisten lab
Penelitian, lab Sintesis Obat dan lab. Teknologi Sediaan Farmasi II atas
saran-saran yang diberikanDidiz, fera, Pia, Siti, Febi, Cut Raihanah, Amel, atas
dukungan, bantuan dan semangat yang luar biasa, serta teman-teman ekstensi
farmasi angkatan 2010, 2011, 2012 dan teman-teman Klinik Husada Lhoksukon.
Penulis menyadari bahwa tulisan ini masih memiliki banyak kekurangan,
dan saran yang membangun pada skripsi ini. Akhirnya, penulis berharap semoga
skripsi ini dapat memberi manfaat bagi kita semua.
Medan, Agustus 2015
Penulis
Ernawati
PENGARUH SUHU HIDROLISIS PADA PEMBUATAN
DEKSTRIN DARI PATI KENTANG (
Solanum tuberosum
L.)
SECARA ENZIMATIS
ABSTRAK
Latar belakang: Dekstrin dapat dibuat dari pati kentang dengan beberapa metode yaitu basah, kering dan enzimatis. Salah satu faktor yang mempegaruhi pembuatan dekstrin adalah suhu hidrolisis.
Tujuan: Tujuan penelitian ini adalah untuk membuat dan mengetahui pengaruh
suhu hidrolisis terhadap karakteristik dekstrin dari pati kentang (Solanum tuberosum L.) dengan metode enzimatis.
Metode: Umbi kentang dari Pasar Pagi Setia Budi dihaluskan dan didekantasi dengan air suling. Pati yang diperoleh disuspensi dalam air suling, lalu dipanaskan pada 95oC sambil diaduk hingga terbentuk gel. Setelah suhu massa gel 30oC ditambahkan enzim α-amilase 0,025g dan diaduk hingga homogen. Massa dipanaskan masing-masing pada suhu 35oC, 40oC dan 45oC selama 24 jam, kemudian dikeringkan pada suhu 80oC. Dekstrin yang dihasilkan diuji persyaratan mutunya sesuai dengan Standar Nasional Indonesia (SNI) 01-2593-1992. Karakterisasi meliputi rendemen, pemeriksaanwarna, pengujian kualitatif dengan larutan lugol, kehalusan mesh 80, kadar air, kadarabu, kelarutan dalam air dingin, dekstrosa ekuivalen dan derajat asam.
Hasil: Hasil penelitian menunjukkan bahwa metode enzimatis dengan suhu 35oC, 40oC dan 45oC rendemen dekstrin berturut-turut adalah 84,371%, 84,189% dan 81,448%. Pemeriksaaan warna dan pengujian kualitatif dengan larutan lugol pada ketiga suhu tersebut diperoleh hasil yang sama dekstrin berwarna putih dan ungu kecoklat-coklatan. Kehalusan mesh 80 dekstrin pada suhu 35oC, 40oC dan 45oC adalah 95,248% ± 0,2015, 95,293% ± 0,4833 dan 95,879% ± 0,5641. Kadar air adalah 8,860% ± 0,5301, 7,907% ± 0,0346 dan 4,540% ± 0,2069. Kadar abu dekstrin pada suhu 35oC, 40oC dan 45oC adalah 0,06% ± 0,0071, 0,07% ± 0,0123 dan 0,07% ± 0,0059. Bagian yang larut dalam air dingin dekstrin pada suhu35oC, 40oC dan 45oC adalah 68,972% ± 1,9995, 70,541% ± 1,9499 dan 70,915% ± 1,9980. Ekivalen dekstrosa dekstrin pada suhu 35oC, 40oC dan 45oC adalah 15,904 ± 0,4080, 16,963 ± 1,1825 dan 18,799 ± 0,5701. Derajat asam dekstrin pada suhu 35oC, 40oC dan 45oC adalah 4,393 ± 0,3975, 4,475 ± 0,5055 dan 4,661 ± 0,3190. Berdasarkan hasil analisis secara statistik diperoleh perbedaan pada pemeriksaan kadar air dan ekivalen dekstrosa (P < 0,05).
Kesimpulan: Suhu hidrolisis 35oC, 40oC dan 45oC mempengaruhi karakteristik dekstrin pada kadar air dan nilai ekivalen dekstrosa. Karakteristik dekstrin dari pati kentang (Solanum tuberosum L.) dengan metode enzimatis telah memenuhi persyaratan Standar Nasional Indonesia (SNI) 01-2593-1992.
EFFECT OF HYDROLYSIS TEMPERATURE IN DEXTRIN
PREPATION FROM POTATO (
Solanum tuberosum
L.)
STARCH ENZYMATICALLY
ABSTRACT
Background: Dextrin can be made from potato starch by wet, dry and enzymatic methods. One of the factors influences the preparation of dextrin is the hydrolysis temperature.
Objective: The purpose of this research was to produce and to determine the effect of hydrolysis temperature on the characteristics of dextrin made from potato starch (Solanum tuberosum L.) with enzymatic method.
Methods: Potato tubers were taken from Setia Budi’s Market, then the potato
tubers were mashed and decanted with distilled water. Starch was derivedfrom derived from potato tubers than was suspended in distilled water, and was then heated to 95oC while stirring to form a gel. Once the gel mass at temperature 30oCwas added α-amylase enzyme 0,025g and was stirred to homogeneous. Each mass are heated at temperature of 35oC, 40oC and 45oC for 24 hours, then are at temperature80oC. Dextrin was examined according to the Indonesian National Standard (SNI) 01-2593-1992. The characterization of the obtained dextrin included yield, color proofing, qualitative testing with Lugol's solution, 80 mesh fineness, moisture content, ash content, solubility in cold water, dextrose equivalent and the degree of acid.
Results: The results showed that enzymatic method with temperature 35oC, 40oC and 45oC were gained the yield of dextrin 84.371%, 84.189% and 81.448% respectively. The color examination and qualitative testing with Lugol's solution on all three temperatures obtained similar results of white dextrin and brownish purple color respectively. The mesh 80 fineness for temperature 35oC, 40oC and 45oC were 95.248% ± 0.2015, 95.293% ± 0.4833 and 95.879% ± 0.5641 respectively. The water contents for obtained dextrin for temperature35oC, 40oC and 45oC were 8.860 ± 0.5301%, 7.907%± 0.0346 and 4.540% ± 0.2069 respectively. The ash contents were 0.06% ± 0.0071, 0.07% ± 0.0123 and 0.07% ± 0.0059 for temperature of 35oC, 40oC and 45oC respectively. The cold water soluble contents were 68.972 ± 1.9995%, 70.541% ± 1.9499and 70.915% ± 1.9980 respectively. The dextrose equivalences were 15.904 ± 0.4080, 16.963 ± 1.1825 and 18.799 ± 0.5701 respectively. The degree of acid were 4.393 ± 0.3975, 4.475± 0.5055 and 4.661 ± 0.3190 respectively. Based on statistical analysis of the results it was obtained a significant difference on moisture content and dextrose equivalent examinations (P <0.05).
Conclusion: Hydrolysis temperature of 35oC, 40oC and 45oC affects the characteristics of dextrin in water content and dextrose equivalent value. Characteristics dextrin of potatoes starch (Solanum tuberosum L.) were obtained by enzymatic methods have met the requirements of the Indonesian National Standard (SNI) 01-2593-1992.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK... . vii
ABSTRACT ... . viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 5
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1 Uraian Tumbuhan... 7
2.1.1 Sistematika tumbuhan ... 8
2.1.2 Nama lain ... 8
2.1.3 Kandungan gizi ... 9
2.2.1 Pembuatan pati ... 11
2.2.2 Hidrolisis pati secara enzimatis ... 12
2.3 Pengaruh Suhu Reaksi Enzimatik ... 13
2.4 Dekstrin ... 14
2.5 Enzim α-amilase ... 15
2.6 Pembuatan Dekstrin ... 17
2.7 Penggunaan Dekstrin ... 19
BAB III METODE PENELITIAN ... 20
3.1 Jenis Penelitian ... 20
3.2 Alat dan Bahan ... 20
3.2.1 Alat-alat ... 20
3.2.2 Bahan ... 20
3.3 Pembuatan Pereaksi ... 21
3.3.1 Larutan NaOH 0,1 N ... 21
3.3.2 Larutan fenolftalein ... 21
3.3.3 Larutan iodium 0,1 N ... 21
3.3.4 Larutan lugol ... 21
3.4 Penyiapan Sampel ... 21
3.4.1 Pengambilan sampel ... 21
3.4.2 Identifikasi sampel ... 22
3.4.3 Pembuatan pati ... 22
3.4.4 Pembuatan dekstrin secara enzimatis ... 22
3.5 Pemeriksaan Rendemen ... 23
3.6.1 Pemeriksaan organoleptis ... 23
3.6.2 Pemeriksaan warna dengan larutan lugol ... 24
3.6.3 Penetapan derajat kehalusan ... 24
3.6.4 Penetapan kadar air ... 24
3.6.5 Penetapan kadar abu ... 24
3.6.6 Penetapan bagian yang larut dalam air dingin .. 25
3.6.7 Penetapan nilai ekuivalen dektrosa ... 25
3.6.8 Penetapan derajat asam ... 26
BAB IV HASIL DAN PEMBAHASAN ... 27
4.1 Identifikasi Tumbuhan ... 27
4.2 Karakteristik Pati ... 27
4.3 Rendemen ... 27
4.4 Karakteristik Dekstrin ... 28
4.4.1 Organoleptis ... 29
4.4.2 Reaksi warna ... 29
4.4.3 Derajat kehalusan ... 29
4.4.4 Kadar air ... 30
4.4.5 Kadar abu ... 31
4.4.6 Bagian yang larut dalam air dingin ... 31
4.4.7 Nilai ekivalen dekstrosa ... 32
4.4.8 Penetapan derajat asam ... 33
BAB V KESIMPULAN DAN SARAN ... 34
5.1 Kesimpulan ... 34
DAFTAR PUSTAKA ... 36
DAFTAR TABEL
Halaman
Tabel 2.1 Kandungan gizi kentang ... 9
DAFTAR GAMBAR
Halaman
Gambar 2.1 Amilosa dan amilopektin ... 10
Gambar 2.2 Mekanisme hidrolisis pati secara enzimatis ... 12
Gambar 2.3 Pengaruh suhu optimum terhadap laju reaksi enzimatik . 13
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil identifikasi tumbuhan ... 39
Lampiran 2. Gambar pati kentang ... 40
Lampiran 3. Hasil uji reaksiwarna + iodium 0,1 N ... 41
Lampiran 4. Dekstrin dari pati kentang ... 42
Lampiran 5. Hasil uji reaksi warna dekstrin + lugol... 43
Lampiran 6. Baganalirpembuatanpatikentang ... 44
Lampiran 7. Bagan alir pembuatan dekstrin ... 45
Lampiran 8. Bagan alir uji reaksi warna dengan lugol ... 46
Lampiran 9. Bagan alir pemeriksaan derajat kehalusan ... 47
Lampiran 10. Bagan alir penetapan kadar air ... 48
Lampiran 11. Bagan alir penetapan kadar abu ... 49
Lampiran 12. Bagan alir penetapan bagian yang larut dalam air dingin ... 50
Lampiran 13. Bagan alir penetapan nilai ekivalen dekstrosa ... 51
Lampiran 14. Bagan alir penetapan derajat asam ... 54
Lampiran 15. Perhitungan rendemen ... 55
Lampiran 16. Perhitungan derajat kehalusan ... 57
Lampiran17. Perhitungan kadar air ... 60
Lampiran 18. Perhitungan kadar abu ... 64
Lampiran 19. Perhitungan bagian yang larut dalam air dingin ... 67
Lampiran 20. Perhitungan nilai ekivalen dekstrosa ... 70
Lampiran21. Perhitungan derajat asam ... 73
Lampiran 23. Hasil analisis statistik kadar air ... 77
Lampiran 24. Hasil analisis statistik kadar abu ... 78
Lampiran 25. Hasil analisis statistik bagian yang larut dalam air dingin 79
Lampiran 26. Perhitungan statistik ekivalen dekstrosa ... 80
PENGARUH SUHU HIDROLISIS PADA PEMBUATAN
DEKSTRIN DARI PATI KENTANG (
Solanum tuberosum
L.)
SECARA ENZIMATIS
ABSTRAK
Latar belakang: Dekstrin dapat dibuat dari pati kentang dengan beberapa metode yaitu basah, kering dan enzimatis. Salah satu faktor yang mempegaruhi pembuatan dekstrin adalah suhu hidrolisis.
Tujuan: Tujuan penelitian ini adalah untuk membuat dan mengetahui pengaruh
suhu hidrolisis terhadap karakteristik dekstrin dari pati kentang (Solanum tuberosum L.) dengan metode enzimatis.
Metode: Umbi kentang dari Pasar Pagi Setia Budi dihaluskan dan didekantasi dengan air suling. Pati yang diperoleh disuspensi dalam air suling, lalu dipanaskan pada 95oC sambil diaduk hingga terbentuk gel. Setelah suhu massa gel 30oC ditambahkan enzim α-amilase 0,025g dan diaduk hingga homogen. Massa dipanaskan masing-masing pada suhu 35oC, 40oC dan 45oC selama 24 jam, kemudian dikeringkan pada suhu 80oC. Dekstrin yang dihasilkan diuji persyaratan mutunya sesuai dengan Standar Nasional Indonesia (SNI) 01-2593-1992. Karakterisasi meliputi rendemen, pemeriksaanwarna, pengujian kualitatif dengan larutan lugol, kehalusan mesh 80, kadar air, kadarabu, kelarutan dalam air dingin, dekstrosa ekuivalen dan derajat asam.
Hasil: Hasil penelitian menunjukkan bahwa metode enzimatis dengan suhu 35oC, 40oC dan 45oC rendemen dekstrin berturut-turut adalah 84,371%, 84,189% dan 81,448%. Pemeriksaaan warna dan pengujian kualitatif dengan larutan lugol pada ketiga suhu tersebut diperoleh hasil yang sama dekstrin berwarna putih dan ungu kecoklat-coklatan. Kehalusan mesh 80 dekstrin pada suhu 35oC, 40oC dan 45oC adalah 95,248% ± 0,2015, 95,293% ± 0,4833 dan 95,879% ± 0,5641. Kadar air adalah 8,860% ± 0,5301, 7,907% ± 0,0346 dan 4,540% ± 0,2069. Kadar abu dekstrin pada suhu 35oC, 40oC dan 45oC adalah 0,06% ± 0,0071, 0,07% ± 0,0123 dan 0,07% ± 0,0059. Bagian yang larut dalam air dingin dekstrin pada suhu35oC, 40oC dan 45oC adalah 68,972% ± 1,9995, 70,541% ± 1,9499 dan 70,915% ± 1,9980. Ekivalen dekstrosa dekstrin pada suhu 35oC, 40oC dan 45oC adalah 15,904 ± 0,4080, 16,963 ± 1,1825 dan 18,799 ± 0,5701. Derajat asam dekstrin pada suhu 35oC, 40oC dan 45oC adalah 4,393 ± 0,3975, 4,475 ± 0,5055 dan 4,661 ± 0,3190. Berdasarkan hasil analisis secara statistik diperoleh perbedaan pada pemeriksaan kadar air dan ekivalen dekstrosa (P < 0,05).
Kesimpulan: Suhu hidrolisis 35oC, 40oC dan 45oC mempengaruhi karakteristik dekstrin pada kadar air dan nilai ekivalen dekstrosa. Karakteristik dekstrin dari pati kentang (Solanum tuberosum L.) dengan metode enzimatis telah memenuhi persyaratan Standar Nasional Indonesia (SNI) 01-2593-1992.
EFFECT OF HYDROLYSIS TEMPERATURE IN DEXTRIN
PREPATION FROM POTATO (
Solanum tuberosum
L.)
STARCH ENZYMATICALLY
ABSTRACT
Background: Dextrin can be made from potato starch by wet, dry and enzymatic methods. One of the factors influences the preparation of dextrin is the hydrolysis temperature.
Objective: The purpose of this research was to produce and to determine the effect of hydrolysis temperature on the characteristics of dextrin made from potato starch (Solanum tuberosum L.) with enzymatic method.
Methods: Potato tubers were taken from Setia Budi’s Market, then the potato
tubers were mashed and decanted with distilled water. Starch was derivedfrom derived from potato tubers than was suspended in distilled water, and was then heated to 95oC while stirring to form a gel. Once the gel mass at temperature 30oCwas added α-amylase enzyme 0,025g and was stirred to homogeneous. Each mass are heated at temperature of 35oC, 40oC and 45oC for 24 hours, then are at temperature80oC. Dextrin was examined according to the Indonesian National Standard (SNI) 01-2593-1992. The characterization of the obtained dextrin included yield, color proofing, qualitative testing with Lugol's solution, 80 mesh fineness, moisture content, ash content, solubility in cold water, dextrose equivalent and the degree of acid.
Results: The results showed that enzymatic method with temperature 35oC, 40oC and 45oC were gained the yield of dextrin 84.371%, 84.189% and 81.448% respectively. The color examination and qualitative testing with Lugol's solution on all three temperatures obtained similar results of white dextrin and brownish purple color respectively. The mesh 80 fineness for temperature 35oC, 40oC and 45oC were 95.248% ± 0.2015, 95.293% ± 0.4833 and 95.879% ± 0.5641 respectively. The water contents for obtained dextrin for temperature35oC, 40oC and 45oC were 8.860 ± 0.5301%, 7.907%± 0.0346 and 4.540% ± 0.2069 respectively. The ash contents were 0.06% ± 0.0071, 0.07% ± 0.0123 and 0.07% ± 0.0059 for temperature of 35oC, 40oC and 45oC respectively. The cold water soluble contents were 68.972 ± 1.9995%, 70.541% ± 1.9499and 70.915% ± 1.9980 respectively. The dextrose equivalences were 15.904 ± 0.4080, 16.963 ± 1.1825 and 18.799 ± 0.5701 respectively. The degree of acid were 4.393 ± 0.3975, 4.475± 0.5055 and 4.661 ± 0.3190 respectively. Based on statistical analysis of the results it was obtained a significant difference on moisture content and dextrose equivalent examinations (P <0.05).
Conclusion: Hydrolysis temperature of 35oC, 40oC and 45oC affects the characteristics of dextrin in water content and dextrose equivalent value. Characteristics dextrin of potatoes starch (Solanum tuberosum L.) were obtained by enzymatic methods have met the requirements of the Indonesian National Standard (SNI) 01-2593-1992.
BAB I PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan salah satu negara penghasil kentang. Kentang
merupakan sumber karbohidrat yang dimanfaatkan sebagai bahan pangan, bahan
baku industri dan pakan ternak (Martunis, 2012).
Kentang (Solanum tuberosum L.) merupakan tanaman umbi-umbian yang
kaya akan karbohidrat dan menjadi prioritas untuk dikembangkan. Hal ini dapat
dilihat dari konsumsi kentang di dunia menempati urutan keempat setelah beras,
gandum, dan jagung Indonesia adalah negara penghasil kentang terbesar
dikawasan Asia Tenggara. Daerah produksi kentang di Indonesia tersebar di
daerah Sumatera Utara¸ Sumatera Barat, Jambi, Jawa Barat, Jawa Tengah, Jawa
Timur, dan Sulawesi Selatan (Niken dan Andepristia, 2013).
Kentang selain dikonsumsi dalam bentuk segar juga dimanfaatkan sebagai
sumber pati untuk keperluan industri farmasi (Martunis, 2012). Pati umumnya
tidak larut dalam air dingin, pemasakannya memerlukan waktu yang cukup lama
dan pasta yang terbentuk juga cukup keras. Modifikasi pati dilakukan agar
diperoleh sifat-sifat yang cocok untuk dimanfaatkan dalam industri farmasi. Pati
termodifikasi memiliki sifat fisikokimia yang lebih baik dibanding pati asal
(Ningsih, et al., 2010).
Pati termodifikasi dapat dihasilkan dari modifikasi pati kentang. Salah
satunya adalah dekstrin. Menurut Standar Nasional Indonesia (SNI 01-2593-1992)
dekstrin didefinisikan sebagai salah satu produk hidrolisis pati yang berbentuk
larut dalam air dingin, dapat membentuk lapisan film dan memiliki sifat adesif
(Ningsih, et al., 2010).
Penelitian-penelitian yang telah dilakukan tentang pembuatan dekstrin
diantaranya adalah Jati (2006) yang melakukan penelitian tentang pengaruh waktu
hidrolisis dan konsentrasi HCl terhadap nilai Dextrose Equivalen (DE) dan
karakterisasi mutu pati termodifikasi dari pati tapioka dengan metode hidrolisis
asam untuk mengetahui pengaruh faktor lama pemanasan, konsentrasi HCl dan
interaksi antara keduanya dalam pembuatan pati termodifikasi secara metode
basah (gelatinisasi) dan metode kering (penyangraian). Peneliti lainnya Triyono
(2007) telah melakukan pemanfaatan jenis umbi lain yaitu ubi jalar (Ipomea
batatas (L.) untuk meningkatkan fungsional pati dari ubi jalar dengan
menggunakan enzim α-amilase dari Bacillus subtilis sebagai bahan subsitusi
pengolahan pangan dengan memperhatikan pengaruh pH dan konsentrasi pati
yang dikarakterisasi sesuai persyaratan mutu Standar Nasioanal Indonesia (SNI).
Peneliti lainnya Ningsih, et al., (2010) melakukan penelitian tentang pembuatan
dekstrin dari pati ubi kayu (Manihot esculenta) menggunakan enzim amilase dari
Azospirillum sp. JG3 untuk meningkatkan kegunaan pati yang lebih luas dan
dikarakterisasi sesuai dengan syarat mutu dekstrin untuk industri pangan SNI
1992. Selain itu Santosa (2010) juga telah melakukan penelitian tentang hidrolisis
enzimatik pati tapioka (merk “Gunung Agung”) dengan kombinasi pemanasan
microwave-water bath pada pembuatan dekstrin sebagai salah satu usaha untuk
mengkonversi pati tapioka menjadi dekstrin dengan ketersediaan bahan baku pati
tapioka yang terpenuhi, sehingga dapat mengurangi volume impor dekstrin.
pembuatan dekstrin dari tepung tapioka (merk “Gunung Agung”) secara enzimatik
(α-amilase dari Bacillus licheneformis) dengan pemanasan microwave sebagai
pengganti pemanas konvensional dan mengkaji pengaruh konsentrasi pati dan
waktu likuifaksi terhadap Dextrose Equivalen (DE) dan viskositas.
Desktrin dapat diproduksi dengan tiga proses pembuatan yaitu proses
pembuatan secara enzimatis, proses pembuatan secara basah serta proses
pembuatan secara kering. Proses pembuatan secara enzimatis dilakukan karena
proses ini dapat berjalan pada suhu yang rendah, lebih spesifik, menghasilkan
sedikit produk samping (Pudiastuti dan Pratiwi 2013). Pembuatan secara kering
(penyangraian) menghasilkan perubahan warna pada pati selama proses
pembuatan sehingga dekstrin yang diperoleh berwarna lebih gelap. Pembuatan
dekstrin secara basah dengan menggunakan asam memiliki keunggulan karena
prosesnya mudah, bahan baku mudah didapatkan dan murah (Jati, 2006).
Kelemahan menggunakan asam yaitu dapat menghasilkan produk dengan rasa dan
warna yang buruk karena asam memiliki sifat sangat reaktif.
Dekstrin terbentuk melalui dua tahapan yaitu tahap gelatinisasi dan tahap
hidrolisis. Gelatinisasi adalah proses pemecahan pati dengan menggunakan air
dan panas. Hidrolisis adalah tahapan proses dimana pati yang telah tergelatinisasi
terhidrolisis menjadi dekstrin. Sejumlah asam, atau enzim ditambahkan pada
tahap hidrolisis untuk membentuk dekstrin (Santosa, 2010).
Produksi secara enzimatis umumnya dilakukan dengan menggunakan
enzim amilase. Enzim amilase di gunakan sebab ramah lingkungan, pemecahan
yang terjadi lebih spesifik dan tidak menimbulkan rasa yang menyimpang pada
dipengaruhi oleh suhu (Sadikin, 2002). Umumnya aktifitas enzim α-amilase
terjadi pada suhu 30-40 (Suarni dan Patong, 2007).
Dunia industri farmasi di Indonesia menggunakan dekstrin yang selama ini
diimport dari luar. Kebutuhan dekstrin dalam industri farmasi dari tahun ke tahun
semakin meningkat (Triyono, 2007). Volume import dekstrin Indonesia pada
tahun 2007 mencapai 39.309.703 kg senilai US$ 26.209.257. Itu meningkat dari
tahun sebelumnya yang hanya 36.747.033 kg senilai US$ 21.791.938 (Pudiastuti
dan Pratiwi, 2013).
Berdasarkan uraian diatas peneliti tertarik untuk melakukan penelitian
pembuatan dekstrin dari pati kentang karena belum sering diteliti sehingga
meningkatkan pemanfaatan pati kentang dan mengetahui pengaruh suhu hidrolisis
terhadap karakteristik dekstrin dari pati kentang secara enzimatis. Kemudian
dilakukan karakteristik dekstrin yang didapatkan menurut Standar Nasional
Indonesia (SNI 01-2593-1992).
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka permasalahan dalam penelitian
ini dirumuskan sebagai berikut:
a. Apakah dekstrin dapat dibuat dari pati kentang (Solanum tuberosum L.)
dengan menggunakan metode enzimatis?
b. Apakah suhu hidrolisis mempengaruhi karakteristik dekstrin yang dibuat
dari pati kentang (Solanum tuberosumL.) menggunakan enzim α-amilase?
c. Apakah dekstrin dari pati kentang (Solanum tuberosum L.) dengan metode
enzimatis menggunakan enzim α-amilase memenuhi persyaratan Standar
1.3 Hipotesis
Dari masalah yang dirumuskan diatas, hipotesis dalam penelitian ini
adalah sebagai berikut:
a. Dekstrin dapat dibuat dari pati kentang (Solanum tuberosum L.) menggunakan
metode enzimatis.
b. Suhu hidrolisis mempengaruhi karakteristik dekstrin yang dibuat dari pati
kentang (Solanum tuberosum L.) menggunakan enzim α-amilase.
c. Dekstrin dari pati kentang (Solanum tuberosum L.) dengan metode enzimatis
menggunakan enzim α-amilase memenuhi persyaratan Standar Nasional
Indonesia (SNI).
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk:
a. Membuat dekstrin dari pati kentang (Solanum tuberosum L.) menggunakan
metode enzimatis.
b. Mengetahui pengaruh suhu hidrolisis terhadap karakteristik dekstrin yang
dibuat dari pati kentang (Solanum tuberosum L.) menggunakan enzim
α-amilase.
c. Mengetahui dekstrin dari pati kentang (Solanum tuberosum L.) dengan metode
enzimatis menggunakan enzim α-amilase apakah memenuhi persyaratan
1.5Manfaat Penelitian
Penelitian ini diharapkan dapat menjadi informasi untuk masyarakat,
termasuk akademisi tentang pengaruh suhu hidrolisis terhadap karakteristik
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Tanaman kentang (Solanum tuberosum L.) berasal dari daerah tropika
yaitu dataran tinggi Andes Amerika. Daerah yang cocok untuk budidaya kentang
adalah dataran tinggi atau penggunungan dengan ketinggian 1000-1300 m di atas
permukaan laut, curah hujan 1500ml, suhu rata-rata harian 18-21 , serta
kelembaban udara 80-98% (Dinar, 2010).
Kentang merupakan tanaman bersifat menjalar. Batangnya berbentuk segi
empat, panjangnya biasa mencapai 50–120 cm. Batang dan daun berwarna hijau
kemerah–merahan. Bunga berwarna kuning keputihan atau ungu. Benang sarinya
berwarna kekuning-kuningan. Akarnya menjalar dan berukuran sangat kecil
bahkan sangat halus. Akar ini berwarna keputih-putihan.Varietas dapat
digolongkan dalam tiga golongan berdasarkan warna umbinya yaitu:
1. Kentang kuning, umbi kentang ini berkulit dan berdaging kuning
2. Kentang putih, kulit dan daging umbi kentang ini berwarna putih
3. Kentang merah, kulit dan umbinya kemerah-merahan
Beberapa faktor lingkungan yang dijadikan syarat tumbuh tanaman
kentang yaitu:
1. Iklim
Sesuai dengan pembawaan serta sifat aslinya, tempat yang disenangi
tanaman kentang kentang mula-mula yang berhawa dingin. Pada perkembangan
beradaptsi di daerah-daerah beriklim sedang (subtropis). Kemudian meluas lagi ke
daerah tropis yang memilki dua musim, seperti Indonesia.
2. Keadaan tanah
Tanah yang paling baik buat kentang adalah tanah yang gembur atau
sedikit mengandung pasir agar mudah diresapi air. Kelembapan tanah yang cocok
untuk umbi kentang adalah 70%. Kelembapan tanah yang lebih dari ini
menyebabkan kentang mudah diserang oleh penyakit busuk batang atau leher
akal.
2.1.1 Sistematika tumbuhan
Kingdom : Plantae
Divisi : Maqnoliophyta
Kelas : Maqnoliopsida
Ordo : Solanales
Famili : Solanaceae
Genus : Solanum
Spesies : Solanum tuberosum
2.1.2 Nama lain
Nama kentang bukan nama satu-satunya yang dimiliki tumbuhan berumbi
yang kaya karbohidrat tersebut. Selain nama itu masih banyak nama lagi yang
lain. Di Jawa Barat disebut luwi kumeli, di Aceh dan Minangkabau disebut
gantang, di Karo disebut gentang atau gadung leper, di Lampung disebut ketang
atau ubi mandira, di Palembang disebut ubi kumanden dan di Sumba disebut
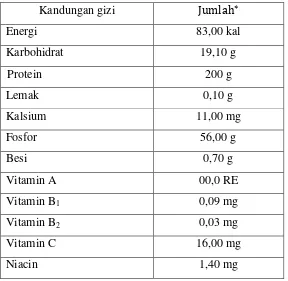
2.1.3 Kandungan gizi
Kentang selain sebagai sumber karbohidrat, kentang juga memiliki
kandungan nutrisi lain yang cukup tinggi, diantaranya protein dan beberapa
vitamin seperti vitamin A, vitamin B komplek serta vitamin C. Kandungan
vitamin C pada kentang dapat mencukupi setengah kebutuhan per hari bagi orang
dewasa dan lebih tinggi dibandingkan dengan padi dan gandum. Perbandingan
protein terhadap karbohidrat yang terdapat di dalam ubi kentang lebih tinggi
daripada biji serealia dan ubi lainnya.
Tabel 2.1. Kandungan gizi kentang
Kandungan gizi
Energi 83,00 kal
Karbohidrat 19,10 g
Protein 200 g
Lemak 0,10 g
Kalsium 11,00 mg
Fosfor 56,00 g
Besi 0,70 g
Vitamin A 00,0 RE
Vitamin B1 0,09 mg
Vitamin B2 0,03 mg
Vitamin C 16,00 mg
Niacin 1,40 mg
Ket * : Kandungan gizi dalam 100 g kentang Sumber : Dinar (2010).
2.2 Pati
Pati terdiri dari butiran-butiran kecil yang disebut granul. Granul pati
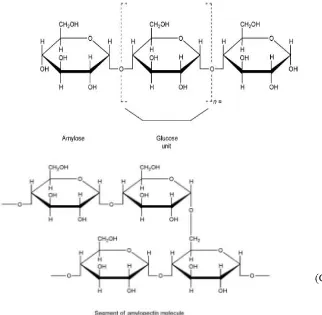
(Ridal, 2003). Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik.
Berbagai macam pati tidak sama sifatnya, tergantung dari panjang rantai C-nya,
serta apakah lurus atau bercabang rantai molekulnya. Amilosa mempunyai
struktur lurus dengan ikatan α-(1,4)-D-glukosidik, sedangkan amilopektin
mempunyai cabang dengan ikatan α-(1,6)-D-glukosidik sebanyak 4-5% dari berat
total (Winarno, 2004).
Pati digunakan sebagai pengental dan penstabil dalam makanan.
Komposisi pati pada umunya terdiri dari amilopektin sebagian besar dan sisanya
amilosa.Pati kentang mengandung amilosa sekitar 23% dan amilopektin 77%
(Niken dan Adepristian, 2013).Struktur kimia amilosa dan amilopektin
(Rowe, et al., 2009) ditunjukkan pada Gambar 2.1.
Amilosa dan amilopektin merupakan komponen penting pembentuk
struktur dasar pati, dan sangat mempengaruhi karakteristik fisiko kimia pati yang
dihasilkan. Amilosa memiliki karakteristik rantai relatif lurus, struktur gel kuat,
serta apabila diberi pewarna iodine akan menghasilkan warna biru. Sementara itu,
amilopektin memiliki karakteristik rantai bercabang, struktur gel lembek, dan
apabila diberi pewarna iodin akan menghasilkan warna coklat kemerahan
(Herawati, 2012).
2.2.1 Pembuatan pati
Pembuatan pati melalui tahapan proses pengupasan, pencucian,
pemotongan, penghalusan, peremasan, penyaringan, pengendapan, pencucian,
pengeringan, penghalusan dan pengayakan. Proses pengupasan dan pencucian
bertujuan untuk membersihkan umbi dari akar, kulit dan kotoran yang melekat
pada umbi tersebut. Pemotongan dimaksudkan untuk mempermudah proses
penghalusan umbi, penghalusan dilakukan bertujuan untuk merusak jaringan umbi
dan sel-sel umbi agar pati dapat keluar (Ridal, 2003).
Peremasan dimaksudkan untuk menyempurnakan kerusakan jaringan umbi
agar pati dapat keluar dari jaringannya dengan menambahkan akuades pada proses
penghalusan. Penyaringan bertujuan untuk memisahkan kotoran yang sukar
dihilangkan dengan pencucian dan memisahkan ampas dengan pati yang
diperoleh.Pati dibiarkan mengendap selama satu malam, kemudian dilakukan
pencucian dengan dengan akuades untuk mendapatkan pati yang bersih dan
berwarna putih.Pengeringan pati basah dilakukan dengan meletakkan pati basah
pada suhu ruangan hingga pati kering.Kemudian dilakukan penghalusan pati dan
2.2.2 Hidrolisis pati secara enzimatis
Proses hidrolisis pati merupakan pemutusan ikatan glikosidik pada rantai
polimernya oleh suatu reaktan yang dibantu oleh air. Proses hidrolisis merupakan
proses pemecahan rantai polimer menjadi penyusunnya yang lebih sederhana.
Hidrolisis pati dilakukan dengan dua cara yaitu dengan menggunakan asam atau
enzim misalnya dari golongan amilase. Amilase adalah enzim yang mempunyai
kemampuan memecah ikatan glukosida pada polimer pati. Penggunaan enzim
amilase lebih dimintai sebab ramah lingkungan, pemecahan yang terjadi lebih
spesifik dan tidak menimbulkan rasa yang menyimpang pada produk akhir
(Nangin dan Sutrisno, 2014).
Modifikasi pati dengan metode enzimatis terjadi melalui pemutusan ikatan
α-(1,4) glikosidik secara random atau pada tengah rantai polimer (Ridal, 2003).
Enzim α-amilase mempunyai bagian aktif anion karboksilat yang bertindak
sebagai nukleofil dan kation imidazolium sebagai elektrofil yang dapat memutus
[image:30.595.151.499.504.682.2]ikatan α-(1,4) glikosidik (Robyt, 1984).
Banyaknya jumlah monomer yang dihasilkan bergantung pada besarnya
konsentasi asam dan jumlah enzim yang digunakan.Semakin tinggi konsentasi
asam dan enzim yang digunakan maka semakin cepat reaksi hidrolisisnya dan
semakin banyak pula monomer yang dihasilkan (Jati, 2006).
2.3 Pengaruh Suhu Reaksi Enzimatik
Suhu reaksi berpengaruh terhadap laju reaksi enzimatik. Jika reaksi
tersebut dilangsungkan dalam berbagai suhu, kurva hubungan tersebut akan
menunjukan suhu tertentu, yang menghasilkan laju reaksi yang maksimum.
Dengan demikian, dalam hal ini juga ada kondisi optimum, yang disebut suhu
optimum (Sadikin, 2002).
Berdasarkan penelitian yang dilakukan Thippeswamy, et. al. (2006)
diperoleh pH optimum dan suhu optimum adalah 6,5 dan 60oC pada amilase dari
Bacillus sp.
Laju reaksi
A B
Suhu optimum
[image:31.595.181.410.453.674.2]Sumber : Sadikin (2002)
Pada gambar 2.3 tampak bahwa diluar suhu optimum, laju reaksi
enzimatik selalu lebih rendah.Makin besar perbedaan suhu reaksi dengan suhu
optimum, makin rendah laju reaksi. Akan tetapi, keadaan yang menyebabkan
rendahnya suhu optimum berbeda antara suhu yang lebih rendah dengan suhu
yang lebih tinggi. Pada suhu yang lebih rendah (sisi A pada gambar), penyebab
kurangnya laju reaksi enzimatik ialah kurangnya gerak termodinamik, yang
menyebabkan kurangnya tumbukan antara molekul enzim dengan substrat. Pada
daerah suhu yang lebih tinggi (sisi B pada ganbar), gerak termodinamik akan lebih
meningkat, sehingga benturan antar molekul niscaya akan lebih sering. Akan
tetapi, alih-alih meningkat, laju reaksi malahan menurun dengan cara sebanding
dengan selisih nilai dan suhu optimum. Dalam peningkatan suhu ini, selain gerak
termodinamika meningkat, molekul protein enzim juga mengalami denaturasi
(Sadikin, 2002).
2.4 Dekstrin
Dekstrin merupakan produk modifikasi atau turunan pati yang banyak
digunakan pada industri pangan dan farmasi. Dibandingkan pati asal dekstrin
memiliki berbagai kelebihan karakteristik, antara lain kelarutan dalam air dan
lebih stabil selama penyimpanan (Kalsum dan Surfiana, 2013).
Dekstrin adalah pati atau hidrolisis pati secara parsial dimodifikasi oleh
pemanasan dalam keadaan kering dengan atau tanpa asam, alkali atau agen
kontrol pH (USP, 2007).
Dekstrin merupakan produk degradasi pati yang dapat dihasilkan dengan
beberapa cara, yaitu memberikan perlakuan suspensi pati dalam air dengan asam
menggunakan perlakuan panas atau kombinasi antara panas dan asam atau katalis
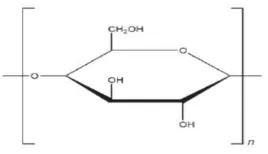
lain. Dekstrin mempunyai rumus kimia (C6H10O5)n dan memiliki struktur serta
karakteristik intermediate antara pati dan dekstrosa (Herawati, 2012).
Dekstrin praktis tidak larut dalam kloroform, etanol (95%), eter, dan
propan-2-ol, sedikit larut dalam air dingin dan sangat larut dalam air panas
membentuk larutan mucilaginous. Berat molekul dekstrin secara khas adalah
4.500-85.000 dan tergantung pada jumlah unit (C6H10O5)n didalam ikatan polimer
[image:33.595.241.375.338.415.2]dengan n = 28-525. Struktur kimia dekstrin (Rowe, etal., 2009) ditunjukkan pada
Gambar 2.4.
Gambar 2.4 Struktur dekstrin
2.5 Enzim α-amilase
Enzim adalah golongan protein yang paling banyak terdapat dalam sel
hidup, dan mempunyai fungsi penting sebagai katalisator reaksi biokimia yang
secara kolektif membentuk metabolisme perantara dari sel (Wirahadikusumah,
1989).
Enzim adalah golongan protein yang paling banyak terdapat dalam sel
hidup, dan mempunyai fungsi penting sebagai katalisator reaksi biokimiaα
-amilase merupakan endo-enzim yang memecah ikatan α-1,4 secara random atau
Pada tubuh manusia α-amilase terdapat pada saliva dan pankreas. Selain itu,
α-amilase juga dapat ditemukan pada gandum (barley), jamur (ascomycetes), dan
bakteri (bacillus).Enzim α-amilase umumnya diisolasi dari Bacillus
amyloquefaciens, Bacillus subtilis, Bacillus coagulans, Pseudomonas
saccharophila, Aspergillus orizae, dan Aspergillus candidus (Robyt, 1984).
Hidrolisis enzimatis memberikan beberapa keuntungan, yaitu prosesnya
lebih spesifik, kondisi prosesnya dapat dikontrol, biaya pemurnian lebih murah,
dihasilkan lebih sedikit abu dan kerusakan warna dapat diminimalkan
(Setyawan, 2015).
Beberapa faktor yang dapat mempengaruhi kerja enzim yaitu:
a. Suhu, semua reaksi kimia dipengaruhi oleh suhu. Kecepatan reaksi katalis
enzim Suhu dapat meningkat dengan meningkatnya suhu, tetapi karena enzim
merupakan protein yang akan terdenaturasi pada suhu tinggi maka enzim
memiliki suhu optimum dalam melakukan kerjanya. Setiap enzim memiliki
temperatur optimum yang berbeda-beda sehingga diperoleh efisiensi yang
maksimum (Mckee dan Mckee, 2004).
b. Nilai pH, konsentrasi ion hidrogen dapat mempengaruhi kerja enzim.
Perubahan pH yang tajam dapat menyebabkan enzim terdenaturasi. Beberapa
enzim aktif hanya pada nilai pH yang sempit. Nilai pH optimum pada setiap
enzim sangat bervariasi (Mckee dan Mckee, 2004).
c. Konsentrasi substrat, untuk dapat terjadi kompleks enzim substrat perlu adanya
kontak antara enzim dengan subtrat pada bagian aktif enzim. Menurut Robyt
(1984) α-amilase mempunyai bagian aktif anion karboksilat dan kation
menampung sedikit substrat. Bila konsentrasi substrat diperbesar, makin
banyak substrat yang dapat berhubungan dengan enzim pada bagian aktif
tersebut. Dengan demikian konsentrasi kompleks enzim substrat makin besar
dan hal ini menyebabkan makin besarnya kecepatan reaksi. Pada suatu batas
konsentrasi substrat tertentu, semua bagian aktif telah dipenuhi oleh substrat
atau telah jenuh dengan substrat. Dalam keadaan ini, bertambah besarnya
konsentrasi substrat tidak menyebabkan bertambah besarnya konsentrasi
kompleks enzim substrat, sehingga jumlah hasil reaksinya pun tidak bertambah
besar (Poedjiadi dan Supriyanti, 2009).
d. Konsentrasi enzim, kecepatan suatu reaksi yang menggunakan enzim
tergantung pada konsentrasi enzim tersebut. Pada suatu konsentrasi substrat
tertentu, kecepatan reaksi bertambah dengan bertambahnya konsentrasi enzim.
Dalam hal ini substrat yang digunakan dalam jumlah yang berlebih (Poedjiadi
dan Supriyanti, 2009).
2.6Pembuatan Dekstrin
Dari penelitian sebelumnya oleh Ningsih, et al., 2010 pembuatan dekstrin
dengan cara larutan pati yang telah dilarutkan kedalam beker gelas di atas hot
plate stirrer dipanaskan pada suhu 95 oC selama 3 jam. Enzim amilase
ditambahkan sambil diaduk dan campuran dimasukkan dalam oven. Campuran
dipanaskan pada suhu 40 oC selama 30 jam. Campuran diambil dan dilakukan uji
kualitatif dengan menggunakan larutan iodine setiap 3 jam sampai terbentuk
warna merah kecoklatan.
Menurut penelitian Zusfahair dan Ningsih (2012) pembuatan dekstrin dari
tersebut. Larutan pati yang diperoleh diinkubasi selama 3 jam pada suhu 95 oC
untuk proses gelatinisasi. Proses ini dimaksudkan untuk mempermudah proses
interaksi antara pati dan enzi. Langkah selajutnya adalah hidrolisis pati ubi kayu
menjadi dekstrin dengan katalis amylase FHD 45 % dari Azospirillum sp. JG3.
Proses hidrolisis dilakukan pada kondisi optimum amylase FHD 45 % tersebut
yaitu suhu 30 oC, pH 7 dan konsentrasi substrat 4%.
Pada tahun 2013 Pudiastuti dan Pratiwi melakukan penelitiann dengan
pembuatan dekstrin pada tahap awal sebelum membuat dekstrin adalah membuat
suspensi pati (10, 15, 20, 25, 30, 35 % ⁄ ), dengan melarutkan pati dalam
aquadest hingga volume 300 ml. Suspensi pati dimasukkan dalam botol reaksi dan
ditambahkan 40 ppm , O. pH suspense di cek dengan menggunakan pH
meter, pH diatur 6-6,5 dengan menggunakan larutan HCl 0,5N. Setelah pH sesuai
enzim α-amilase 0,5-0,6 kg/ton tepung kering ditambahkan dalam suspensi. Botol
reaksi ditutup rapat, dikocok agar larutan homogen kemudian dimasukkan dalam
microwave yang diseting power 10, defrost 2 untuk gelatinisasi. Setelah gelatin
terbentuk, botol reaksi dikeluarkan dari microwave dan di pindahkan ke
waterbath. Berpengaduk untuk diliquifikasi pada suhu 94oC selama waktu
liquifikasi yang ditentukan (30,60, 90, 120,150,180 menit). Larutan dekstrin yang
dihasilkan diinaktifkan enzimnya dengan menambahkan HCl 0,5N pH 4.
Pembuatan dekstrin pada penelitian Perwitasari dan Cahyo yaitu umbi
talas dikupas, kemudian dicuci lalu diparut dan tambahkan air lalu diperas
kemudian disarinng dan ampasnya dibuang. Suspensi pati talas diendapkan
kemudian dikeringkan atau dijemur dibawah sinar matahari (± 50 oC). Pati talas
dilakukan dalam autoclave dengan variasi suhu, waktu dan konsentrasi HCl. Hasil
diamnbil dan ditambahkan , didinginkan pada suhu kamar dan
di keringkan pada suhu 50 oC dihasilkan deksrin.
2.7 Penggunaan Dekstrin
Dekstrin dapat digunakan dalam bidang farmasi dan pangan. Dalam
bidang farmasi dekstrin digunakan sebagai diluents tablet dan kapsul, pengikat,
bahan selaput gula yang berfungsi sebagai plasticizer, perekat dan agen pengental
(thickening agent) untuk suspensi (Rowe, et al., 2009).
Beberapa sediaan farmasi yang menggunakan dekstrin sebagai bahan
tambahan :
a. OptiNateTM merupakan kapsul multivitamin/mineral yang diberikan
sebelum/sesudah melahirkan dan tablet kombinasi dengan asam lemak
esensial (Niazi, 2009a).
b. Krim hidrokortison 0,5 % dan krim hidrokortison 1 % (Niazi, 2009b).
Pada bidang pangan dekstrin dapat dimanfaatkan sebagai komponen utama
maupun bahan tambahan makanan dalam koridor food ingredient yang
merupakan komponen bahan makanan untuk memproduksi makanan siap saji.
Dekstrin dapat berfungsi sebagai bahan pengikat dan enkapsulasi yang
diaplikasikan dalam pengembang kue, perisa, rempah dan minyak (Herawati,
2012). Selain itu dekstrin dapat digunakan juga sebagai sumber karbohidrat
bagi orang yang menjalani program diet karena dekstrin memiliki kandungan
BAB III
METODE PENELITIAN
3.1 Jenis Penelitian
Jenis penelitian yang dilakukan adalah penelitian eksperimental yang
bertujuan untuk mengamati pengaruh suhu (variabel bebas atau sebab) terhadap
karakteristik (variabel terikat atau akibat) pada pembuatan dektrin.
3.2 Alat dan Bahan 3.2.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah plat penangas
berpengaduk (Thermo Scientific Cimarec), blender (Miyako), oven (Dynamica),
buret (Oberol), timbangan digital (Boeco), tanur (Stuart), alat-alat gelas (Pyrex,
Oberol),Orbital Shaker (Major Science), pH meter (Eco Testr),
termometer,pengaduk magnetik, tabungreaksi, cawan porselen, penangas air,
ayakanmesh 80, penjepit tabung, pipet tetes, kertas saring, klem, statif, spatula,
krus porselen, batang pengaduk, pipa kapiler dan alat-alat gelas lainnya.
3.2.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah kentang
(Solanum tuberosum L.), enzim α-amilase (Sigma Aldrich), Fehling A
(Sigma-Aldrich), Fehling B (Sigma-(Sigma-Aldrich), glukosa, natrium hidroksida, lugol, iodium,
3.3 Pembuatan Pereaksi 3.3.1 Larutan NaOH 0,1 N
Sebanyak 4 g natrium hidroksida dilarutkan dengan air suling hingga 1000
ml (Ditjen POM, 1979).
3.3.2 Larutan fenolftalein
Sebanyak 1 gfenolftalein P dilarutkan dalam 100 ml etanol P (Ditjen
POM,1995).
3.3.3 Larutan iodium 0,1 N
Sebanyak 1,269 g iodium P dilarutkan dalam larutan 1,8 g kalium iodida P
kemudian encerkan dengan air suling hingga 100 ml (Ditjen POM,1979).
3.3.4 Larutan lugol
Sebanyak 50 g iodium dan 100 g kalium iodida dilarutkan dalam 100 ml
air suling, setelah larut kemudian diencerkan menjadi 1000 ml (SNI, 1992).
3.4 Penyiapan Sampel
Penyiapan sampel meliputi pengambilan sampel, identifikasi sampel,
pembuatan pati dan pembuatan dekstrin.
3.4.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan yang sama dari daerah lain. Kentang yang
diambil adalah kentang yang berasal dari Berastagi dan diperoleh dari Pasar Pagi,
3.4.2 Identifikasi sampel
Sampel identifikasi oleh Herbarium Bidang Botani Pusat Penelitian dan
Pengembangan Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
Hasil identifikasi sampel dapat dilihat pada Lampiran 1 halaman 39.
3.4.3 Pembuatan pati
Sebanyak 6 kg umbi kentang dibersihkan dengan cara dicuci
menggunakan air yang mengalir. Setelah bagian kulit dipisahkan, dibilas kembali
diair yang bersih, kentang dipotong melintang dengan ukuran sedang ± 1 cm
kemudian dibagi beberapa bagian dan dimasukkan ke dalam blender, di
tambahkan air suling dengan perbandingan 5L/1kg. Massa diblender dan disaring
sambil diperas, dipisahkan ampas kentang dan suspensi pati. Air suling
ditambahkan kedalam, diaduk lalu disaring. Perlakuan ini diulang hingga
diperoleh filtrat jernih. Suspensi pati dikumpulkan dalam wadah dan didiamkan
selama ± 24 jam hingga pati mengendap. Setelah ± 24 jam, bagian atas larutan
yang keruh dibuang diganti dengan 2,5 L air suling dan dibiarkan kembali selama
± 24 jam. Perlakuan ini diulangi hingga bagian atas bening,cairan bening
kemudian dibuang dan endapan pati dikeringkan pada suhu ruangan (25-27oC).
Pati kering yang diperoleh kemudian dihaluskan dengan blender dan diayak
dengan ayakan mesh 80 (Ningsih,et al., 2010). Gambar pati kentang dapat dilihat
pada Lampiran 2 halaman 40 dan bagan alir pembuatan pati kentang dapat dilihat
pada Lampiran 6 halaman 44.
3.4.4 Pembuatan dekstrin secara enzimatis
Sebanyak 50 g pati kentang disupensikan dalam 250 ml air suling
penangas pada suhu 95oC dan diaduk dengan pengaduk magnetik selama ±15
menit hingga terbentuk gel. Suhu kemudian diturunkan hingga 30oC, ditambahkan
enzim α-amilase 0,025g kedalam gel. Campuran masing-masing dipanaskan pada
suhu 35oC, 40°C dan 45oC selama 24 jam sambil terus diaduk.Setiap 3 jam
dilakukan uji warna dengan menambahkan larutan lugol kedalam cuplikan
campuran tersebut. Dekstrin terbentuk jika cuplikan berwarna ungu kecoklatan
setelah ditambahkan larutan lugol.Untuk inaktif enzim dekstrin dipanaskan
hingga mendidih untuk dan dikeringkan dalam oven pada suhu dikeringkan dalam
oven pada suhu 80oC selama 7 jam. Setelah kering, dekstrin dihaluskan dengan
blender, lalu diayak dengan ayakan mesh 80 (Ningsih, et al., 2010). Gambar
dekstrin dari pati kentang dapat dilihat pada Lampiran 4 halaman 42 dan bagan
alir pembuatan dekstrin dapat dilihat pada Lampiran 7 halaman 45.
3.5 Pemeriksaan Rendemen
Pemeriksaan rendemen dekstrin dilakukan menurut prosedur Ningsih, et
al., 2010. Rendemen ditentukan dengan membandingkan berat dekstrin yang
diperoleh dengan berat pati yang digunakan.
Rendemen = x 100%
keterangan : a = berat pati yang digunakan (g) b = berat dekstrin yang diperoleh (g)
3.6 Karakteristik Dekstrin 3.6.1 Pemeriksaan organoleptis
Pemeriksaan organoleptis dilakukan dengan mengamati bentuk, bau, rasa,
3.6.2 Pemeriksaan warna dengan larutan lugol
Sebanyak 0,5 g serbuk dekstrin disuspensikan dalam 25 ml air suling lalu
ditetesi dengan larutan lugol. Warna yang terjadi diamati (SNI, 1992). Bagan alir
uji reaksi warna dengan lugol dapat dilihat pada Lampiran 8 halaman 46.
3.6.3 Penetapan derajat kehalusan
Kehalusan serbuk dekstrin ditentukan menurut prosedur SNI (1992).
Sebanyak 10 g dekstrin dihaluskan kemudian diayak dengan ayakan mesh 80,
bagian yang tertinggal dalam ayakan ditimbang.
Kehalusan = (100 – a)%
Keterangan: a = Persentase dari bagian yang tidak melewati saringan mesh 80.
Bagan alir peeriksaan derajat kehalusan dapat dilihat pada Lampiran 9
halaman 47.
3.6.4 Penetapan kadar air
Penetapan kadar air dekstrin dilakukan menurut prosedur Ningsih, et al.,
2010. Sebanyak 2 g dekstrin dimasukkan ke cawan porselen yang telah ditimbang
dan diketahui beratnya. Cawan dipanaskan ke dalam oven pada 105oC selama 2
jam. Setelah didinginkan dalam desikator, cawan kemudian ditimbang beratnya.
Kadar Air =( ) x 100%
Keterangan: a = berat dekstrin awal (g)
b = berat dekstrin setelah di keringkan (g).
Bagan alir kadar air dapat dilihat pada Lampiran 10 halaman 48.
3.6.5 Penetapan kadar abu
Penetapan kadar abu total dekstrin dilakukan menurut prosedur Ningsih,
pada 600°C selama 4 jam atau sampai semua dekstrin menjadi abu. Setelah
didinginkan dalam desikator, krus porselen kemudian ditimbang.
Kadar Abu = x100%
keterangan : a = berat abu (g)
b = berat dekstrin awal (g).
Bagan alir kadar abu dapat dilihat pada Lampiran 11 halaman 49.
3.6.6 Penetapan bagian yang larut dalam air dingin
Penetapan bagian yang larut dalam air dingin ditentukan menurut prosedur
SNI (1992). Sebanyak 0,5 g dekstrin dimasukkan kedalam erlenmayer dilarutkan
dengan 50 ml air suling kemudian disaring. Filtrat dipipet 10 ml dimasukkan ke
dalam cawan porselen yang telah diketahui beratnya, lalu di uapkan diatas
penanggas air. Setelah diuapkan, cawan tersebut di keringkan dalam oven pada
suhu100 selama 3 jam.
Bagian yang larut dalam air dingin =
x FP x 100%
Bagan alir bagian yang larut dalam air dingin dapat dilihat pada Lampiran 12
halaman 50.
3.6.7 Penetapan nilai ekivalen dekstrosa
Penetapan nilai ekivalen dekstrosa dilakukan menurut prosedur Ningsih, et
al., 2010. Sebanyak 2,5 g glukosa dilarutkan dengan air suling diencerkan sampai
1000 ml, lalu diambil 15 ml masukkan kedalam dan ditambah larutan Fehling A
dan B masing-masing 5 ml. Campuran didihkan kemudian dititrasi dengan larutan
glukosa sampai warna coklat kemerahan, kebutuhan titran dicatat lalu dihitung
FF=
Sebanyak 5 g dekstrin dilarutkan dalam 100 ml air suling kemudian
dimasukkan ke buret sebanyak 50 ml. Dimasukkan kedalam erlenmayer
masing-masing 5 ml larutan Fehling A dan B dan diambil 15 ml larutan glukosa. Larutan
didihkan dan dititrasi dengan larutan pati sampai warna coklat kemerahan, titran
yang dibutuhkan dicatat dan nilai ekivalen dekstrosa dihitung dengan cara:
DE= FFx
Bagan alir kadar abu dapat dilihat pada Lampiran 13 halaman 5I.
3.6.8 Penetapan derajat asam
Penetapan derajat asam dilakukan menurut prosedur SNI (1992). Sebanyak
5 g serbuk dekstrin dimasukkan ke dalam erlenmayer 250 ml dan ditambahkan
100 ml etanol yang terlebih dahulu dinetralkan dengan fenolftalein. Biarkan
tertutup selama 24 jam, sambil digoyangkan (Orbital Shaker). Setelah disaring
dengan kertas saring, 50 ml saringan dititrasi dengan NaOH 0,1 N, dicatat volume
NaOH 0,1 N yang diperlukan untuk mentitrasi 100 g serbuk dekstrin:
Derajat asam =
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tumbuhan
Identifikasi tumbuhan yang dilakukan oleh Herbarium Bidang Botani
Pusat Penelitian dan Pengembangan Biologi Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Bogor menunjukkan bahwa tumbuhan yang digunakan dalam
penelitian ini adalah kentang (Solanum tuberosum L.). Hasil identifikasi dapat
dilihat pada Lampiran 1 halaman 40. Melakukan identifikasi tumbuhan berarti
mengungkapkan atau menetapkan identitas (jati diri) suatu tumbuhan, untuk
menentukan nama yang benar dan yang tepat dalam sistem klasifikasi (Suraida,
2012).
4.2 Karakteristik Pati
Hasil pemeriksaan organoleptis pati kentang yaitu serbuk halus, tidak
berasa, tidak berbau dan putih. Hal ini sesuai dengan persyaratan Farmakope
Indonesia Edisi III (1979) dimana pemerian pati berbentuk serbuk halus, putih dan
tidak berbau (Ditjen POM, 1979). Hasil pemeriksaan pati dengan iodin terbentuk
warna biru. Hal ini disebabkan oleh pati yang berbentuk spiral, sehingga akan
mengikat iodin dan terbentuklah warna biru (Winarno, 2004). Hasil uji reaksi
warna pati dengan iodin dapat dilihat pada Lampiran 3 halaman 41.
4.3 Rendemen
Sebelum melakukan penelitian, saya melakukan orientasi pada suhu 50oC
itu saya melakukan penelitian pada suhu 35oC, 40oC dan 45oC. Hasil penelitian ini
didapat rendemen suhu 35oC, 40oC dan 45oC adalah 84,371%, 84,189% dan
81,448%. Rendemen merupakan perbandingan antara produk yang dihasilkan
(dekstrin) dengan banyaknya bahan yang digunakan dalam pembuatan pati
termodifikasi atau dekstrin. Beberapa faktor yang dapat mempengaruhi jumlah
rendemen yang dihasilkan, diantaranya adalah susut bobot saat proses
dekstrinisasi, pengeringan, pengayakan dan penggilingan (Triyono, 2007).
Perhitungan rendemen dapat dilihat pada Lampiran 15 halaman 55.
4.4 Karakteristik Dekstrin
Karateristik dekstrin dari pati kentang dapat dilihat pada Tabel 4.1 di
[image:46.595.121.512.441.710.2]bawah ini:
Tabel 4.1 Pengaruh suhu hidrolisis terhadap parameter dekstrin secara enzimatis
menggunakan α-amilase
Parameter dekstrin
Karakteristik dekstrin kentang pada suhu Karakteristik
dekstrin SNI- 1992
35 40 45
Warna bentuk rasa bau Putih amorf sedikit manis tidak berbau Putih amorf sedikit manis tidak berbau Putih amorf sedikit manis tidak berbau putih sampai kekuningan - - - Reaksi
warnalugol ungu kecoklatan ungu kecoklatan ungu kecoklatan
ungu kecoklatan
Derajat
kehalusan 95,248% ±0,2015 95,293% ±0,4833 95,879%± 0,5641 minimal 90
Kadar air 8,860%±0,5301 7,907% ± 0,0346 4,540% ±0,2069 maksimal 11
Kadar abu 0,06%±0,0071 0,07% ± 0,0123 0,07±0,0059 maksimal 0.5
Bagian larut dalam air dingin
68,972% ±1,9995 70,541% ±1,9499 70,915%±1.9980 minimal 97 %
Nilai DE 15,904 ±0,4080 16,963 ± 1,1825 18,799 ± 0,5701 -
4.4.1 Organoleptis
Hasil pemeriksaan warna pada Tabel 4.1 menunjukkan bahwa dekstrin
yang diperoleh dengan metode enzimatis menggunakan enzim α-amilase pada
pemanasan suhu 35oC, 40°C dan 45oC berwarna putih, berbentuk amorf, sedikit
manis, tidak berbau. Karakteristrik ini sesuai dengan karakteristrik dekstrin
menurut SNI 1992. Hasil penelitian warna tidak sama dengan yang diperoleh pada
hasil penelitian warna pada penelitian Zusfahair dan Ningsih (2012) yang
menggunakan pati ubi kayu yaitu berwarna kekuningan. Gambar dekstrin dapat
dilihat pada Lampiran 4 halaman 42.
4.4.2 Reaksi warna
Hasil uji reaksi warna dekstrin dengan larutan lugol terbentuk warna ungu
kecoklatan. Warna ungu kecoklatan menandakan terdapatnya gula pereduksi dari
hidolisa pati dengan metode enzimatis. Hal ini sama dengan penelitian yang
dilakukan Jati (2006), warna ungu kecoklatan yang dihasilkan menunjukkan telah
terjadi pemutusan rantai polisakarida pati menjadi monomer yang lebih sederhana,
seperti oligosakirida dan glukosa. Sehingga jumlah gula pereduksi meningkat
menimbulkan warna ungu kecoklatan. Karakteristik ini sesuai dengan
karakteristrik dekstrin menurut SNI 1992 (SNI, 1992). Hasil uji reaksi warna
dapat dilihat pada Lampiran 5 halaman 43.
4.4.3 Derajat kehalusan
Pada Tabel 4.1 dapat dilihat bahwa hasil derajat kehalusan dekstrin dengan
variasi suhu 35oC, 40oC, dan 45 oC masing-masing yaitu 95,248%± 0,2015,
95,293%±0,4833 dan 95,879%± 0,5641. Hasil analisis secara statistik diperoleh
kehalusan memenuhi persyaratan SNI tahun 1992 yaitu maksimal 90% (SNI,
1992). Hasil analisis statistik derajat kehlusan dapat dilihat pada Lampiran 22
halaman 76.
Ukuran partikel yang halus dan kecil diperlukan untuk mempermudah
penggunaan dekstrin. Ukuran yang seragam ini dibuat dengan cara memblender
dekstrin kering yang diperoleh, kemudian diayak denganayakan mesh 80.
Perhitungan derajat kehalusan dapat dilihat pada Lampiran 16 halaman 57.
4.4.4 Kadar air
Seperti yang ditunjukkan pada Tabel 4.1,kadar air dekstrin yang diperoleh
pada suhu35oC, 40oC dan 45oC masing-masing 8,860%± 0,5301, 7,907%± 0,0346
dan 4,540%± 0,2069. Hasil analisis secara statistik diperoleh nilai P = 0,027 (P
<0,05), menunjukkan bahwa perbedaan signifikan antara kadar air dekstrin yang
dibuat pada suhu 35oC, 40oC dan 45oC. Kadar air paling tinggi pada suhu 35oC,
dikarenakan semakin rendah suhu yang digunakan makin sedikit air yang teruap
(Martunis, 2012). Hasil analisis kadar air dapat dilihat pada Lampiran 23
halaman 77. Dekstrin yang bermutu baik akan memiliki kadar air yang rendah.
Kadar air yang tinggi dapat menyebabkan tumbuhnya mikroorganisme dan
menurunkan kualitas dekstrin. Dekstrin dengan kadar air yang rendah akan lebih
mudah dalam penyimpanan dan aplikasinya (Jati,2006).
Meskipun terdapat perbedaan signifikan, namun kadar air memenuhi
syarat mutu SNI tahun 1992 yaitu maksimal 11%,kadar air yang diperoleh pada
penelitian ini rendah di bandingkan kadar air yang diperoleh pada penelitian
Ningsih, et al.,2010 yang menggunakan pati ubi kayu metode enzimatis yaitu
4.4.5 Kadar abu
Hasil penelitian abu yang diperoleh pada penelitian ini seperti yang
terdapat pada Tabel 4.1 suhu 35oC, 40oC, 45oC adalah 0,06% ± 0,0071, 0,07% ±
0,0123 dan 0,07% ± 0,0059. Berdasarkan hasil analisis secara statistik diperoleh
nilai P = 0,612 (P > 0,05) tidak terdapat perbedaan yang signifikan antara suhu
terhadap kadar abu total pada dekstrin. Hasil analisis statistik kadar abu dapat
dilihat pada Lampiran 24 halaman 78.
Kadar abu berhubungan dengan mineral suatu bahan. Mineral yang
terdapat dalam suatu bahan merupakan dua campuran garam yaitu garam organik
dan garam anorganik. Abu adalah zat anorganik sisa hasil pembakaran suatu
bahan organik. Penentuan kadar abu dilakukan untuk mengetahui ada tidaknya
perubahan kandungan anorganik setelah proses pembentukan dekstrin
(Ningsih, et al.,2010). Nilai kadar abu yang diperoleh dalam penelitian ini dari
dekstrin kentang dengan variasi suhu masih memenuhi syarat mutu SNI tahun
1992 yaitu maksimal 0,5% (SNI,1992). Kadar abu yang diperoleh dari dekstrin
pati kentang lebih rendah dibandingkan kadar abu pati ubi kayu penelitian yang
dilakukan oleh Ningsih, et al., 2010 dengan enzim α-amilase yaitu 0,25%
(Ningsih, et al., 2010). Perhitungan kadar abu dapat dilihat pada Lampiran 18
halaman 64.
4.4.6 Bagian yang larut dalam air dingin
Hasil penelitian bagian yang larut dalam air dingin yang diperoleh pada
penelitian ini seperti yang terdapat pada Tabel 4.1 di atas, menunjukkan bahwa
bagian yang larut dalam dingindari dekstrin bertambah dengan meningkatnya
± 1,9995, 70,541% ± 1,9499 dan 70,915% ± 1,9980. Hasil analisis secara statistik
diperoleh nilai P = 0,501 (P>0,05), menunjukkan bahwa tidak terdapat
perbedaanyang siqnifikan. Hasil analisis statistik bagian yang larut dalam air
dingin dapat dilihat pada Lampiran 25 halaman 79. Menurut Corn Refiners
Association, Kelarutan dekstrin dalam air dingin yaitu 40-90% (Erickson, 2006).
Pati termodifikasi merupakan hasil penyederhanaan polimer dari pati, dengan
proses hidrolisis pati yang sifatnya tidak larut dalam air dingin diubah menjadi
dekstrin yang larut dalam dingin. Hidrolisis pati dengan enzim menyebabkan
ukuran molekul menurun sehingga kelarutan meningkat (Pentury, et al.,2013).
Perhitungan bagian yang larut dalam air dingin dapat dilihat pada Lampiran 19
halaman 67.
4.4.7 Nilai ekivalen dekstrosa
Pada penelitian ini diperoleh nilai ekivalen dekstrosa variasi suhu 35oC,
40oC dan 45oC sebesar 15,904 ± 0,4080, 16,963 ± 1,1825 dan 18,799 ± 0,5701.
Berdasarkan hasil analisis secara statistik diperoleh nilai P = 0,012 (P <0,05) ini
menunjukan perbedaan yang signifikan. Hasil analisis statistik ekivalen
dekstrosa dapat dilihat pada Lampiran 26 halaman 80. Nilai ekivalen dekstrosa
pada suhu45oC lebih tinggi dibandingkan pada suhu35oC dan 40oC. Hal ini
dikarenakan terdapat perbedaan pada suhu hidrolisis. Hidrolisis merupakan
tahapan proses dimana pati yang telah tergelatinisasi terhidrolisa menjadi dekstrin.
Semakin tinggi suhu maka hidrolisis pati semakin meningkat, sehingga pati
mengalami pemutusan rantai oleh enzim selama pemanasan menjadi molekul
dengan rantai yang lebih pendek yang disebut dengan ekivalen dekstrosa (Santosa,
dikonversikan menjadi monomer yang lebih sederhana, sehingga jumlah gula
pereduksi akan meningkat dan nilai ekivalen dektrosa meningkat. Nilai ekivalen
dektrosa merupakan indikator penting untuk mengontrol karakteristik dari produk
dekstrin. Ekivalen dektrosa material yang tinggi secara umum menunjukkan
pencoklatan, higroskopisitas, rasa manis dan kelarutan, sementara material yang
ekivalen dektrosanya rendah digunakan sebagai kontrol viskositas, perekat atau
bahan pembentuk lapisan film (Sun,et al.,2010). Nilai ekivalen dextrosa yang
diperoleh pada penelitian ini lebih tinggi dibandingkan nilai ekivalen dextrosa
yang diperoleh pada penelitian Zusfahair dan Ningsih (2012) yang menggunakan
pati ubi kayu yaitu sebesar 13,3%. Perhitung