BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Tanaman kentang (Solanum tuberosum L.) berasal dari daerah tropika yaitu dataran tinggi Andes Amerika. Daerah yang cocok untuk budidaya kentang adalah dataran tinggi atau penggunungan dengan ketinggian 1000-1300 m di atas permukaan laut, curah hujan 1500ml, suhu rata-rata harian 18-21 , serta kelembaban udara 80-98% (Dinar, 2010).
Kentang merupakan tanaman bersifat menjalar. Batangnya berbentuk segi empat, panjangnya biasa mencapai 50–120 cm. Batang dan daun berwarna hijau kemerah–merahan. Bunga berwarna kuning keputihan atau ungu. Benang sarinya berwarna kekuning-kuningan. Akarnya menjalar dan berukuran sangat kecil bahkan sangat halus. Akar ini berwarna keputih-putihan.Varietas dapat digolongkan dalam tiga golongan berdasarkan warna umbinya yaitu:
1. Kentang kuning, umbi kentang ini berkulit dan berdaging kuning 2. Kentang putih, kulit dan daging umbi kentang ini berwarna putih 3. Kentang merah, kulit dan umbinya kemerah-merahan
Beberapa faktor lingkungan yang dijadikan syarat tumbuh tanaman kentang yaitu:
1. Iklim
beradaptsi di daerah-daerah beriklim sedang (subtropis). Kemudian meluas lagi ke daerah tropis yang memilki dua musim, seperti Indonesia.
2. Keadaan tanah
Tanah yang paling baik buat kentang adalah tanah yang gembur atau sedikit mengandung pasir agar mudah diresapi air. Kelembapan tanah yang cocok untuk umbi kentang adalah 70%. Kelembapan tanah yang lebih dari ini menyebabkan kentang mudah diserang oleh penyakit busuk batang atau leher akal.
2.1.1 Sistematika tumbuhan Kingdom : Plantae
Divisi : Maqnoliophyta
Kelas : Maqnoliopsida
Ordo : Solanales
Famili : Solanaceae
Genus : Solanum
Spesies : Solanum tuberosum 2.1.2 Nama lain
2.1.3 Kandungan gizi
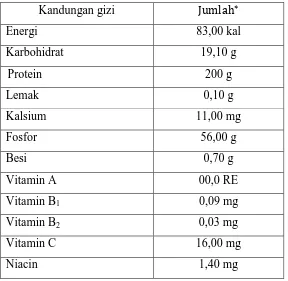
Kentang selain sebagai sumber karbohidrat, kentang juga memiliki kandungan nutrisi lain yang cukup tinggi, diantaranya protein dan beberapa vitamin seperti vitamin A, vitamin B komplek serta vitamin C. Kandungan vitamin C pada kentang dapat mencukupi setengah kebutuhan per hari bagi orang dewasa dan lebih tinggi dibandingkan dengan padi dan gandum. Perbandingan protein terhadap karbohidrat yang terdapat di dalam ubi kentang lebih tinggi daripada biji serealia dan ubi lainnya.
Tabel 2.1. Kandungan gizi kentang
Kandungan gizi
Energi 83,00 kal
Karbohidrat 19,10 g
Protein 200 g
Lemak 0,10 g
Kalsium 11,00 mg
Fosfor 56,00 g
Besi 0,70 g
Vitamin A 00,0 RE
Vitamin B1 0,09 mg
Vitamin B2 0,03 mg
Vitamin C 16,00 mg
Niacin 1,40 mg
Ket * : Kandungan gizi dalam 100 g kentang Sumber : Dinar (2010).
2.2 Pati
(Ridal, 2003). Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Berbagai macam pati tidak sama sifatnya, tergantung dari panjang rantai C-nya, serta apakah lurus atau bercabang rantai molekulnya. Amilosa mempunyai struktur lurus dengan ikatan α-(1,4)-D-glukosidik, sedangkan amilopektin
mempunyai cabang dengan ikatan α-(1,6)-D-glukosidik sebanyak 4-5% dari berat total (Winarno, 2004).
Pati digunakan sebagai pengental dan penstabil dalam makanan. Komposisi pati pada umunya terdiri dari amilopektin sebagian besar dan sisanya amilosa.Pati kentang mengandung amilosa sekitar 23% dan amilopektin 77% (Niken dan Adepristian, 2013).Struktur kimia amilosa dan amilopektin (Rowe, et al., 2009) ditunjukkan pada Gambar 2.1.
Amilosa dan amilopektin merupakan komponen penting pembentuk struktur dasar pati, dan sangat mempengaruhi karakteristik fisiko kimia pati yang dihasilkan. Amilosa memiliki karakteristik rantai relatif lurus, struktur gel kuat, serta apabila diberi pewarna iodine akan menghasilkan warna biru. Sementara itu, amilopektin memiliki karakteristik rantai bercabang, struktur gel lembek, dan apabila diberi pewarna iodin akan menghasilkan warna coklat kemerahan (Herawati, 2012).
2.2.1 Pembuatan pati
Pembuatan pati melalui tahapan proses pengupasan, pencucian, pemotongan, penghalusan, peremasan, penyaringan, pengendapan, pencucian, pengeringan, penghalusan dan pengayakan. Proses pengupasan dan pencucian bertujuan untuk membersihkan umbi dari akar, kulit dan kotoran yang melekat pada umbi tersebut. Pemotongan dimaksudkan untuk mempermudah proses penghalusan umbi, penghalusan dilakukan bertujuan untuk merusak jaringan umbi dan sel-sel umbi agar pati dapat keluar (Ridal, 2003).
2.2.2 Hidrolisis pati secara enzimatis
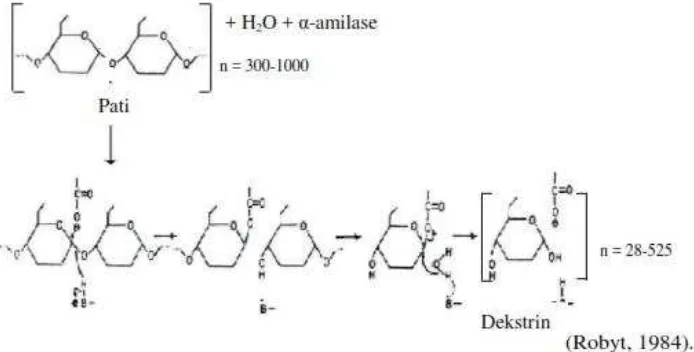
Proses hidrolisis pati merupakan pemutusan ikatan glikosidik pada rantai polimernya oleh suatu reaktan yang dibantu oleh air. Proses hidrolisis merupakan proses pemecahan rantai polimer menjadi penyusunnya yang lebih sederhana. Hidrolisis pati dilakukan dengan dua cara yaitu dengan menggunakan asam atau enzim misalnya dari golongan amilase. Amilase adalah enzim yang mempunyai kemampuan memecah ikatan glukosida pada polimer pati. Penggunaan enzim amilase lebih dimintai sebab ramah lingkungan, pemecahan yang terjadi lebih spesifik dan tidak menimbulkan rasa yang menyimpang pada produk akhir (Nangin dan Sutrisno, 2014).
Modifikasi pati dengan metode enzimatis terjadi melalui pemutusan ikatan α-(1,4) glikosidik secara random atau pada tengah rantai polimer (Ridal, 2003). Enzim α-amilase mempunyai bagian aktif anion karboksilat yang bertindak
sebagai nukleofil dan kation imidazolium sebagai elektrofil yang dapat memutus ikatan α-(1,4) glikosidik (Robyt, 1984).
Banyaknya jumlah monomer yang dihasilkan bergantung pada besarnya konsentasi asam dan jumlah enzim yang digunakan.Semakin tinggi konsentasi asam dan enzim yang digunakan maka semakin cepat reaksi hidrolisisnya dan semakin banyak pula monomer yang dihasilkan (Jati, 2006).
2.3 Pengaruh Suhu Reaksi Enzimatik
Suhu reaksi berpengaruh terhadap laju reaksi enzimatik. Jika reaksi tersebut dilangsungkan dalam berbagai suhu, kurva hubungan tersebut akan menunjukan suhu tertentu, yang menghasilkan laju reaksi yang maksimum. Dengan demikian, dalam hal ini juga ada kondisi optimum, yang disebut suhu optimum (Sadikin, 2002).
Berdasarkan penelitian yang dilakukan Thippeswamy, et. al. (2006) diperoleh pH optimum dan suhu optimum adalah 6,5 dan 60oC pada amilase dari
Bacillus sp.
Laju reaksi
A B
Suhu optimum Sumber : Sadikin (2002)
Pada gambar 2.3 tampak bahwa diluar suhu optimum, laju reaksi enzimatik selalu lebih rendah.Makin besar perbedaan suhu reaksi dengan suhu optimum, makin rendah laju reaksi. Akan tetapi, keadaan yang menyebabkan rendahnya suhu optimum berbeda antara suhu yang lebih rendah dengan suhu yang lebih tinggi. Pada suhu yang lebih rendah (sisi A pada gambar), penyebab kurangnya laju reaksi enzimatik ialah kurangnya gerak termodinamik, yang menyebabkan kurangnya tumbukan antara molekul enzim dengan substrat. Pada daerah suhu yang lebih tinggi (sisi B pada ganbar), gerak termodinamik akan lebih meningkat, sehingga benturan antar molekul niscaya akan lebih sering. Akan tetapi, alih-alih meningkat, laju reaksi malahan menurun dengan cara sebanding dengan selisih nilai dan suhu optimum. Dalam peningkatan suhu ini, selain gerak termodinamika meningkat, molekul protein enzim juga mengalami denaturasi (Sadikin, 2002).
2.4 Dekstrin
Dekstrin merupakan produk modifikasi atau turunan pati yang banyak digunakan pada industri pangan dan farmasi. Dibandingkan pati asal dekstrin memiliki berbagai kelebihan karakteristik, antara lain kelarutan dalam air dan lebih stabil selama penyimpanan (Kalsum dan Surfiana, 2013).
Dekstrin adalah pati atau hidrolisis pati secara parsial dimodifikasi oleh pemanasan dalam keadaan kering dengan atau tanpa asam, alkali atau agen kontrol pH (USP, 2007).
menggunakan perlakuan panas atau kombinasi antara panas dan asam atau katalis lain. Dekstrin mempunyai rumus kimia (C6H10O5)n dan memiliki struktur serta
karakteristik intermediate antara pati dan dekstrosa (Herawati, 2012).
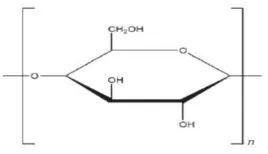
Dekstrin praktis tidak larut dalam kloroform, etanol (95%), eter, dan propan-2-ol, sedikit larut dalam air dingin dan sangat larut dalam air panas membentuk larutan mucilaginous. Berat molekul dekstrin secara khas adalah 4.500-85.000 dan tergantung pada jumlah unit (C6H10O5)n didalam ikatan polimer
dengan n = 28-525. Struktur kimia dekstrin (Rowe, etal., 2009) ditunjukkan pada Gambar 2.4.
Gambar 2.4 Struktur dekstrin
2.5 Enzim α-amilase
Enzim adalah golongan protein yang paling banyak terdapat dalam sel hidup, dan mempunyai fungsi penting sebagai katalisator reaksi biokimia yang secara kolektif membentuk metabolisme perantara dari sel (Wirahadikusumah, 1989).
Pada tubuh manusia α-amilase terdapat pada saliva dan pankreas. Selain itu, α-amilase juga dapat ditemukan pada gandum (barley), jamur (ascomycetes), dan
bakteri (bacillus).Enzim α-amilase umumnya diisolasi dari Bacillus amyloquefaciens, Bacillus subtilis, Bacillus coagulans, Pseudomonas
saccharophila, Aspergillus orizae, dan Aspergillus candidus (Robyt, 1984).
Hidrolisis enzimatis memberikan beberapa keuntungan, yaitu prosesnya lebih spesifik, kondisi prosesnya dapat dikontrol, biaya pemurnian lebih murah, dihasilkan lebih sedikit abu dan kerusakan warna dapat diminimalkan (Setyawan, 2015).
Beberapa faktor yang dapat mempengaruhi kerja enzim yaitu:
a. Suhu, semua reaksi kimia dipengaruhi oleh suhu. Kecepatan reaksi katalis enzim Suhu dapat meningkat dengan meningkatnya suhu, tetapi karena enzim merupakan protein yang akan terdenaturasi pada suhu tinggi maka enzim memiliki suhu optimum dalam melakukan kerjanya. Setiap enzim memiliki temperatur optimum yang berbeda-beda sehingga diperoleh efisiensi yang maksimum (Mckee dan Mckee, 2004).
b. Nilai pH, konsentrasi ion hidrogen dapat mempengaruhi kerja enzim. Perubahan pH yang tajam dapat menyebabkan enzim terdenaturasi. Beberapa enzim aktif hanya pada nilai pH yang sempit. Nilai pH optimum pada setiap enzim sangat bervariasi (Mckee dan Mckee, 2004).
menampung sedikit substrat. Bila konsentrasi substrat diperbesar, makin banyak substrat yang dapat berhubungan dengan enzim pada bagian aktif tersebut. Dengan demikian konsentrasi kompleks enzim substrat makin besar dan hal ini menyebabkan makin besarnya kecepatan reaksi. Pada suatu batas konsentrasi substrat tertentu, semua bagian aktif telah dipenuhi oleh substrat atau telah jenuh dengan substrat. Dalam keadaan ini, bertambah besarnya konsentrasi substrat tidak menyebabkan bertambah besarnya konsentrasi kompleks enzim substrat, sehingga jumlah hasil reaksinya pun tidak bertambah besar (Poedjiadi dan Supriyanti, 2009).
d. Konsentrasi enzim, kecepatan suatu reaksi yang menggunakan enzim tergantung pada konsentrasi enzim tersebut. Pada suatu konsentrasi substrat tertentu, kecepatan reaksi bertambah dengan bertambahnya konsentrasi enzim. Dalam hal ini substrat yang digunakan dalam jumlah yang berlebih (Poedjiadi dan Supriyanti, 2009).
2.6Pembuatan Dekstrin
Dari penelitian sebelumnya oleh Ningsih, et al., 2010 pembuatan dekstrin dengan cara larutan pati yang telah dilarutkan kedalam beker gelas di atas hot plate stirrer dipanaskan pada suhu 95 oC selama 3 jam. Enzim amilase ditambahkan sambil diaduk dan campuran dimasukkan dalam oven. Campuran dipanaskan pada suhu 40 oC selama 30 jam. Campuran diambil dan dilakukan uji kualitatif dengan menggunakan larutan iodine setiap 3 jam sampai terbentuk warna merah kecoklatan.
tersebut. Larutan pati yang diperoleh diinkubasi selama 3 jam pada suhu 95 oC untuk proses gelatinisasi. Proses ini dimaksudkan untuk mempermudah proses interaksi antara pati dan enzi. Langkah selajutnya adalah hidrolisis pati ubi kayu menjadi dekstrin dengan katalis amylase FHD 45 % dari Azospirillum sp. JG3. Proses hidrolisis dilakukan pada kondisi optimum amylase FHD 45 % tersebut yaitu suhu 30 oC, pH 7 dan konsentrasi substrat 4%.
Pada tahun 2013 Pudiastuti dan Pratiwi melakukan penelitiann dengan pembuatan dekstrin pada tahap awal sebelum membuat dekstrin adalah membuat suspensi pati (10, 15, 20, 25, 30, 35 % ⁄ ), dengan melarutkan pati dalam aquadest hingga volume 300 ml. Suspensi pati dimasukkan dalam botol reaksi dan ditambahkan 40 ppm , O. pH suspense di cek dengan menggunakan pH meter, pH diatur 6-6,5 dengan menggunakan larutan HCl 0,5N. Setelah pH sesuai enzim α-amilase 0,5-0,6 kg/ton tepung kering ditambahkan dalam suspensi. Botol reaksi ditutup rapat, dikocok agar larutan homogen kemudian dimasukkan dalam
microwave yang diseting power 10, defrost 2 untuk gelatinisasi. Setelah gelatin terbentuk, botol reaksi dikeluarkan dari microwave dan di pindahkan ke
waterbath. Berpengaduk untuk diliquifikasi pada suhu 94oC selama waktu
liquifikasi yang ditentukan (30,60, 90, 120,150,180 menit). Larutan dekstrin yang dihasilkan diinaktifkan enzimnya dengan menambahkan HCl 0,5N pH 4.
dilakukan dalam autoclave dengan variasi suhu, waktu dan konsentrasi HCl. Hasil
diamnbil dan ditambahkan , didinginkan pada suhu kamar dan di keringkan pada suhu 50 oC dihasilkan deksrin.
2.7 Penggunaan Dekstrin
Dekstrin dapat digunakan dalam bidang farmasi dan pangan. Dalam bidang farmasi dekstrin digunakan sebagai diluents tablet dan kapsul, pengikat,
bahan selaput gula yang berfungsi sebagai plasticizer, perekat dan agen pengental
(thickening agent) untuk suspensi (Rowe, et al., 2009).
Beberapa sediaan farmasi yang menggunakan dekstrin sebagai bahan
tambahan :
a. OptiNateTM merupakan kapsul multivitamin/mineral yang diberikan sebelum/sesudah melahirkan dan tablet kombinasi dengan asam lemak esensial (Niazi, 2009a).
b. Krim hidrokortison 0,5 % dan krim hidrokortison 1 % (Niazi, 2009b).