EVALUASI MUTU FISIK, MIKROBIOLOGI, DAN SIFAT
FUNGSIONAL GEL CINCAU HIJAU (
Premna oblongifolia
Merr.)
DALAM KEMASAN DENGAN PERLAKUAN PASTEURISASI
SKRIPSI
BANGUN MARLINA RATNA GINANJAR
F24080102
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
EVALUATION OF PHYSICAL, MICROBIOLOGICAL, AND
FUNCTIONAL PROPERTIES OF PASTEURIZED GREEN
GRASS (
Premna oblongifolia
Merr.) JELLY
Bangun Marlina Ratna Ginanjar, Antung Sima Firlieyanti, and Eko Hari Purnomo Department of Food Science and Technology, Faculty of Agricultural Engineering and Technology, Bogor Agricultural University, Darmaga Campus, PO. Box 220, 16680, Bogor, West Java, Indonesia.
Phone 62 856 92092915, email: [email protected]
ABSTRACT
Green grass (Premna oblongifolia Merr.) jelly is one of functional food, that has been widely studied for it’s beneficial effect. The purposes of this study are to design pasteurization condition of green grass jelly and to study the effect of pasteurization on the jelly properties. Thermal schedule based on 6D concept targetting S. aureus were applied on the product in three combinations of time and temperature. The combinations were 36 minutes in 75°C, 25 minutes in 85°C, and 22 minutes in 95°C. Pasteurization reduced pH value, L value, a value, b value, rate of syneresis, gel strenght, rupture point, and rigidity. Pasteurization also decreased the total of chloropyll, a chlorophyll, b chlorophyll, phenol, and capacity of antioxidant. But, pasteurization increased the total dietary fiber (TDF, SDF, dan IDF). The results showed that the best pasteurization condition was 22 minutes in 95°C based on the physical and functional properties. Physical characteristics of the selected product were 8.24 of pH value, 22.64 of L value, -0.60 of a value, 4.20 of b value, 2.84% of syneresis rate, 493.7105 g/cm2 of gel strength, 3.13 cm of rupture point, and 1.9955 g/cm of rigidity. Moreover, the functional characteristics were 1.2220 mg/L of total chloropyhll , 1.0385 mg/L of a chlorophyll, 0.1838 mg/L of b chlorophyll, 36.1220 mg GAE/L of total phenol, 19.1591 mg AEAC/L of antioxidant capacity, 3.0275% of TDF, 2.1743% of SDF, and 0.8532% of IDF. The product was organoleptically acceptable and microbiologically safe.
Bangun Marlina Ratna Ginanjar. F24080102. Evaluasi Mutu Fisik, Mikrobiologi, dan Sifat Fungsional Gel Cincau Hijau (Premna oblongifolia Merr.) dalam Kemasan dengan Perlakuan Pasteurisasi. Di bawah bimbingan Antung Sima Firlieyanti dan Eko Hari Purnomo. 2012.
RINGKASAN
Salah satu pangan fungsional yang sudah banyak diteliti adalah tanaman cincau hijau (Premna oblongifolia Merr.) terutama bagian daunnya. Produk cincau hijau yang banyak dikembangkan adalah gel cincau hijau, namun proses produksi yang masih tradisional meningkatkan potensi cemaran bakteri pembusuk dan bakteri indikator sanitasi sehingga berakibat terhadap singkatnya umur sinpan dan rendahnya keamanan produk. Hasil survei dari penelitian Pramitasari (2012) yang diambil dari 14 sampel penjual gel cincau hijau menyatakan bahwa penerapan sanitasi dan higiene sebagian besar penjual tidak menerapkan persyaratan sanitasi dan higiene. Hasil analisis memperlihatkan bahwa sampel gel cincau hijau mengandung total mikroba, koliform fekal, dan
Staphylococcus sp. berturut-turut sebesar 1.6 x 104 sampai dengan 2.4 x 106 CFU/g, 3.0 x 102 sampai dengan 4.4 x 103 CFU/g, dan 2.5 x 101 sampai dengan 2.0 x 103 CFU/g (Pramitasari 2012). Tujuan penelitian ini adalah untuk mendesain dan mengaplikasikan pasteurisasi untuk produk gel cincau hijau dalam kemasan, menetapkan kondisi (suhu dan waktu) pasteurisasi terpilih berdasarkan stabilitas sifat fisik dan sifat fungsional, dan menentukan karakterisasi produk terpilih secara fisik, mikrobiologi, fungsional, dan organoleptik.
Desain proses termal (pasteurisasi) yang dilakukan diharapkan untuk mereduksi 6 log S. aureus sebagai mikroorganisme target. Pasteurisasi yang terdiri dari uji distribusi panas dan penetrasi panas dilakukan dengan tiga kombinasi suhu dan waktu berupa suhu referensi pasteurisasi (85°C), 75°C, dan 95°C. Uji distribusi panas menggunakan 9 termokopel dan 41 dummy (produk tiruan). Dari hasil distribusi yang dilakukan menunjukkan bahwa titik-titik yang merupakan titik terdingin di dalam
blancher adalah titik pada termokopel nomor 7, 9, dan 10 dan titik-titik tersebut yang digunakan dalam penetrasi panas. Kombinasi suhu yang digunakan adalah 75°C, 85°C, dan 95°C dengan masing-masing perlakuan menggunakan tiga produk gel cincau hijau dan 38 dummy. Waktu pemanasan untuk mereduksi sebanyak 6 log mikroba (6D) pada suhu 85°C dengan nilai D609.5 adalah 0.0126 menit. Hasil uji penetrasi yang dihasilkan adalah 36 menit untuk suhu 75°C, 25 menit untuk 85°C, dan 22 menit untuk 95°C. Kombinasi-kombinasi waktu dan suhu tersebut sudah cukup memenuhi untuk mereduksi 6D mikroba target. Dari tiga kombinasi tersebut diaplikasikan terhadap produk untuk memilih perlakuan terbaik berdasarkan karakteristik fisik dan fungsional. Efektivitas reduksi juga dikonfirmasi melalui challenge test ayng menunjukkan penurunan sebesar 5.22 log CFU/g pada produk yang dipasteurisasi dengan suhu 85°C selama 25 menit.
Uji fisik terhadap gel cincau hijau yang dipasteurisasi meliputi pengukuran nilai pH, warna, tekstur, dan tingkat sineresis. Nilai pH berkisar antara 8.24-8.41. Semakin tinggi suhu pemanasan, nilai pH semakin turun, yaitu berkisar antara 8.24-8.41. Untuk warna dari segi L (kecerahan) berkisar antara 21.84-25.03. Nilai a berkisar antara -0.92 sampai dengan -0.55, sedangkan nilai b berkisar antara 5.50-3.77. Pasteurisasi membuat kecerahan gel cincau hijau berkurang. Semakin lama waktu pemanasan, maka kecerahan juga semakin berkurang (berkurangnya nilai L), begitu pula untuk nilai a dan b. Dari segi tekstur, nilai kekuatan gel yang diperoleh berkisar dari 265.9955 g/cm2-493.7105 g/cm2, titik pecah berkisar antara 2.6471 cm-3.1339 cm, dan nilai rigiditas memiliki rentang dari 1.1103 g/cm-1.9955 g/cm. Tingkat sineresis diukur pada hari ke-0 sampai ke-3 dan hasilnya berkisar antara 2.84%-3.45% yang menunjukkan bahwa pasteurisasi dapat mengurangi tingkat sineresis. Nilai pH, nilai L, dan tingkat sineresis memberikan hasil yang berbeda nyata pada taraf signifikansi 5% (p<0.05), sedangkan nilai a, nilai b, kekuatan pecah, titik pecah, dan rigiditas tidak memberikan hasil yang signifikan berbeda (p>0.05).
6.1716 mg/L-19.1591 mg/L, sedangkan kontrol berkadar 45.5795% yang artinya total antioksidan turun sebanyak 57.97%-86.45%. Perlakuan pasteurisasi mempengaruhi karakteristik fungsional secara signifikan. Semakin lama waktu pemanasan, maka degradasi sifat fungsional semakin besar. Setelah pasteurisasi, kadar serat pangan pada produk cenderung mengalami peningkatan. Kontrol memiliki nilai serat pangan secara berurutan untuk IDF, SDF, dan TDF adalah 0.8054 mg/L, 1.7630 mg/L, dan 2.5684 mg/L, sedangkan sampel dengan pasteurisasi berkisar antara 0.8045 mg/L-0.8532 mg/L, 1.7672 mg/L-2.1743 mg/L, dan 2.5717 mg/L-3.0275 mg/L. Peningkatan kadar serat pangan yang terjadi mencapai 5.93% untuk IDF, 23.33% untuk SDF, dan 17.88% untuk TDF dan peningkatan tertinggi dimiliki oleh perlakuan 95°C. Semakin tinggi suhu pasteurisasi, semakin tinggi kadar serat pangan yang dimiliki. Berdasarkan sifat fisik dan fungsional produk, terpilih produk dengan perlakuan 95°C selama 22 menit pemanasan.
EVALUASI MUTU FISIK, MIKROBIOLOGI, DAN SIFAT
FUNGSIONAL GEL CINCAU HIJAU (
Premna oblongifolia
Merr.)
DALAM KEMASAN DENGAN PERLAKUAN PASTEURISASI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
BANGUN MARLINA RATNA GINANJAR
F24080102
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Evaluasi Mutu Fisik, Mikrobiologi, dan Sifat Fungsional Gel Cincau Hijau
(Premna Oblongifolia Merr.) dalam Kemasan dengan Perlakuan
Pasteurisasi
Nama : Bangun Marlina Ratna Ginanjar
NIM : F24080102
Menyetujui: Dosen Pembimbing I,
(Antung Sima Firlieyanti, STP, M.Sc) NIP. 19791205.200501.2.002
Dosen Pembimbing II,
(Dr. Eko Hari Purnomo, STP, M.Sc) NIP. 19760412.199903.1.004
Mengetahui Ketua Departemen,
(Dr. Ir. Feri Kusnandar, M.Sc) NIP. 19680526.199303.1.004
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Evaluasi Mutu Fisik, Mikrobiologi, dan Sifat Fungsional Gel Cincau Hijau (Premna Oblongifolia Merr.) dalam Kemasan dengan Perlakuan Pasteurisasi adalah hasil karya saya sendiri dengan arahan dosen pembimbing akademis dan belum diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Februari 2013 Yang membuat pernyataan.
© Hak cipta milik Bangun Marlina Ratna Ginanjar, tahun 2013. Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa ijin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotokopi,
BIODATA PENULIS
Bangun Marlina Ratna Ginanjar, lahir di Jakarta, pada tanggal 27 Mei 1990 dari pasangan Ayah Sumarmo dan Ibu Inah Maemunah sebagai anak ketiga dari empat bersaudara. Penulis menamatkan pendidikan jenjang TK di TK Melati Mekar (1996), Madrasah An Nur (2000), SD di SDN 010 Pagi Cibubur (2002), jenjang SMP di SLTPN 258 Jakarta Timur (2005), jenjang SMA di SMA N 39 Jakarta (2008), dan jenjang S1 di Institut Pertanian Bogor (IPB) (2012) dengan Mayor Ilmu dan Teknologi Pangan (ITP) (Approved by IFT) melalui jalur SNMPTN dan mengambil beberapa mata kuliah Supporting Courses (SC). Selama mengikuti perkuliahan di IPB, penulis aktif menjadi anggota Himpunan Mahasiswa Ilmu dan Teknologi Pangan (HIMITEPA)
sebagai bendahara divisi HIMITEPA’s Corporation (periode tahun 2011). Penulis pernah menjabat
sebagai ketua divisi Dana Usaha pada acara Pelatihan Manajemen Pangan Halal (PLASMA 2010), anggota divisi Konsumsi pada acara Masa Perkenalan Fakultas dan Masa Perkenalan Departemen
“BAUR” (2010), serta divisi Acara sebagai koordinator lomba Speech Contest FALCON (2010). Penulis juga pernah mengikuti lomba Program Kreatifitas Mahasiswa (PKM) dan didanai tentang yoghurt dari susu jagung tahun 2010, membuat proposal IFT yang bertemakan mangga Kenya. Penuis juga pernah mengikuti training PLASMA tahun 2011. Dan sebagai tugas akhir, penulis melakukan
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan
Maret 2012 ini adalah gel cincau hijau dan aplikasi proses termal, dengan judul “Evaluasi Mutu Fisik,
Mikrobiologi, dan Sifat Fungsional Gel Cincau Hijau (Premna Oblongifolia Merr.) dalam Kemasan dengan Perlakuan Pasteurisasi”. Ucapan terima kasih, penulis sampaikan kepada semua pihak yang telah membantu dalam penyelesaian tugas akhir ini, yaitu:
1. Keluarga tercintaku, Ayah Sumarmo dan Ibu Inah Maimunah, kakakku Mba Tuti dan Mas Yogo, adikku Neno, dan seluruh keluarga besar atas segala doa, kasih sayang, motivasi, pengorbanan, dan yang telah diberikan.
2. Antung Sima Firlieyanti, STP, M.Sc sebagai pembimbing skripsi I yang senantiasa memberi saran, motivasi, semangat, bimbingannya, kesabaran, dan perhatian kepada Penulis.
3. Dr. Pak Eko Hari Purnomo, STP, M.Sc sebagai pembimbing skripsi II atas segala saran, bimbingan, dan motivasi yang telah diberikan kepada Penulis.
4. Dr. Endang Prangdimurti, STP, M.Si sebagai pemberi proyek penelitian dan penguji sidang akhir penulis, atas kesediaan waktu dan saran yang telah diberikan.
5. Para guru dan dosen yang telah memberikan ilmu dan pelajaran hidup yang berharga dari Taman Kanak-kanak (TK) hingga bisa menempuh jenjang Perguruan Tinggi (PT).
6. Pak Gatot, Bu Rub, Pak Nur, Teh Nurul, Mba Siti, Mba Ari, Mas Yeris, Mas Edi, Mba Vera, seluruh laboran dan teknisi Departemen ITP dan SEAFAST IPB yang selalu membantu.
7. Pak Parman sebagai pemasok daun cincau hijau.
8. Mba Yana, Atikah, Arum PP, Eka, Yufi, Nurul, Gita sebagai teman yang senantiasa memberikan semangat dan hiburan.
9. Andika sebagai teman penelitian satu proyek yang banyak mengingatkan dan memberikan bantuan dan saran. Priska, Raudha, Dio, Iin, Lathifah, Mba Nisa, Efratia, Rista, Ical, Ardy, Tiur, Mba Kiki sebagai teman-teman yang berada dalam satu laboratorium yang memberikan warna selama penelitian. Fathin dan Ahmadun sebagai teman seperjuangan yang memberikan bantuan serta saran dalam penelitian aplikasi proses termal ini.
10. Teman-teman satu kosan Kamila dan Edelweis (Irma, Ica, Ulan, Ube, Anik, Yesi, Nurul, Euis, Mega, Nisa, Ana, Mba Upa, dan Mba Mei), badminton (Mba Harum, Opi, Muti, Wahyu dkk.), dan TARATUTA (RP, Topan, Vitor, Mustain dkk.), semoga kita tetap bisa menjalin silaturahim. 11. Teman-teman ITP 2008 (TACOZ 45) dan B15 yang tidak bisa disebutkan satu per satu, yang
memberikan warna berbeda-beda serta staf UPT Dept. ITP Mba Anie, Mba Darsih, dan Bu Novie, Ibu serta Bapak UPT lainnya yang memberikan informasi dan ramah pelayanannya. 12. Orang-orang yang mengenal, membantu, dan mendoakanku.
Penulis menyadari karya tulis ini masih jauh dari kata sempurna. Semoga kedepannya, penulis mampu terus memperbaiki diri terutama dalam bidang kepenulisan. Penulis berharap semoga karya ilmiah ini dapat bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan terutama di bidang teknologi pangan dan gizi. Terima kasih.
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ...iv
DAFTAR GAMBAR ... v
DAFTAR TABEL ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 2
II. TINJAUAN PUSTAKA ... 3
A. Tanaman Cincau Hijau Perdu (Premna oblongifolia Merr.) ... 3
1. Botani dan klasifikasi ... 3
2. Pemanfaatan dan khasiat biologis ... 3
B. GEL CINCAU HIJAU ... 5
1. Karakteristik dan cara pembuatan gel cincau hijau ... 5
2. Mutu dan keamanan mikrobiologis gel cincau hijau ... 6
C. PASTEURISASI ... 7
D. Staphylococcus aureus ... 9
III. METODOLOGI PENELITIAN ... 11
A. Waktu dan Tempat ... 11
B. Bahan dan Alat ... 11
C. METODE PENELITIAN ... 12
1. Desain sampel ... 12
2. Desain proses termal (pasteurisasi) ... 13
3. Pembuatan gel cincau hijau (Premna oblongifolia Merr.) ... 14
4. Analisis sampel gel cincau hijau ... 15
IV. HASIL DAN PEMBAHASAN ... 24
A. Desain Gel Cincau Hijau dalam Kemasan ... 24
B. Desain Proses Termal (Pasteurisasi) ... 25
1. Uji distribusi panas ... 25
2. Uji penetrasi panas ... 27
C. Aplikasi Proses Termal ... 31
1. Efektivitas panas dalam mereduksi S. aureus ... 31
2. Sifat fisik ... 33
3. Sifat fungsional ... 38
4. Pemilihan dan karakteristik perlakuan terpilih ... 44
5. Uji organoleptik produk dengan perlakuan terpilih ... 46
6. Uji mutu dan keamanan produk dengan perlakuan terpilih... 47
V. SIMPULAN DAN SARAN ... 48
A. Simpulan ... 48
B. Saran ... 48
DAFTAR PUSTAKA ... 48
DAFTAR TABEL
Halaman
Tabel 1. Komposisi gizi daun Premna oblongifolia Merr ... 4
Tabel 2. Ketahanan panas bakteri non-spora (Walstra et al. 1999) ... 10
Tabel 3. Nilai suhu, D, dan F ... 14
Tabel 4. Perbandingan jenis lid cup ... 25
Tabel 5. Kombinasi suhu dan waktu pasteurisasi untuk mencapai F85 ... 28
Tabel 6. Hasil analisis sifat fisik ... 33
Tabel 7. Hasil pengukuran sifat fungsional gel cincau hijau ... 39
Tabel 8. Hasil analisis sifat fisik dan fungsional gel cincau hijau berbagai perlakuan ... 44
DAFTAR GAMBAR
Halaman
Gambar 1. Daun cincau hijau Premna oblongifolia Merr. ... 3
Gambar 2. Gel cincau hijau ... 5
Gambar 3. Struktur pektin ... 6
Gambar 4. Bentuk morfologi Staphylococcus aureus ... 9
Gambar 5. Diagram alir penelitian ... 12
Gambar 6. Posisi termokopel dalam blancher selama uji distribusi panas ... 13
Gambar 7. Dummy selama distribusi panas ... 13
Gambar 8. Diagram alir pembuatan gel cincau hijau ... 14
Gambar 9. Bentuk umum kurva standar dari Stevens LFRA Texture Analyser (Setyaningtyas 2000) 16 Gambar 10. Tipe gumpalan pada uji koagulase ... 18
Gambar 11. Air mineral, daun cincau hijau, NaHCO3, dan karagenan ... 24
Gambar 12. Jenis lid cup yang diuji sebagai tutup kemasan ... 25
Gambar 13. Grafik hasil distribusi panas ... 26
Gambar 14. Grafik hasil penetrasi tiga suhu pasteurisasi ... 27
Gambar 15. Hubungan lama pemanasan 75°C dan F859.5 kumulatif ... 28
Gambar 16. Perbesaran gambar 15 ... 29
Gambar 17. Kurva hubungan lama pemanasan 85°C dan nilai F859.5 ... 29
Gambar 18. Perbesaran gambar 17 ... 29
Gambar 19. Kurva hubungan lama pemanasan 95°C dan nilai F859.5 ... 30
Gambar 20. Perbesaran gambar 19 ... 30
Gambar 21. Hasil inkubasi kultur ... 31
Gambar 22. Hasil pewarnaan gram kultur perbesaran 100x10 dari media a) BHIB dan b) TSA... 31
Gambar 23. Koloni S. aureus pada media BPA+EYT ... 32
Gambar 24. Kurva hubungan waktu inkubasi dan total mikroba log CFU/mL media BHIB ... 32
Gambar 25. Total log CFU/mL S. aureus tanpa dan dengan pasteurisasi 85°C ... 33
Gambar 26. Kenaikan % sineresis selama hari ke-0 sampai dengan hari ke-3 ... 37
Gambar 27. Degradasi klorofil a menjadi feofitin a ... 41
Gambar 28. Nilai pengukuran dari setiap parameter dan perlakuan ... 45
Gambar 29. Nilai kekuatan pecah dari setiap perlakuan ... 45
Gambar 30. Hasil uji deskriptif dengan skala terstruktur ... 46
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Sertifikat ATCC 25923 ... 55
Lampiran 2. Pertumbuhan S. aureus dalam media BHBI selama inkubasi ... 57
Lampiran 3. Hasil uji distribusi panas ... 58
Lampiran 4. Hasil perhitungan uji penetrasi suhu 75°C ... 59
Lampiran 5. Hasil perhitungan uji penetrasi suhu 85°C ... 66
Lampiran 6. Hasil perhitungan uji penetrasi suhu 95°C ... 72
Lampiran 7. Hasil uji challenge test ... 77
Lampiran 8. Pengukuran nilai pH ... 78
Lampiran 9. Hasil uji statistik perlakuan pasteurisasi terhadap nilai pH ... 79
Lampiran 10. Pengukuran nilai L, a, dan b ... 80
Lampiran 11. Hasil uji statistik perlakuan pasteurisasi terhadap nilai L, a, dan b ... 81
Lampiran 12. Hasil pengukuran kekuatan pecah, titik pecah, dan rigiditas ... 83
Lampiran 13. Hasil uji statistik perlakuan pasteurisasi terhadap nilai kekuatan pecah, titik pecah, dan rigiditas ... 84
Lampiran 14. Hasil pengukuran tingkat sineresis ... 85
Lampiran 15. Hasil uji statistik perlakuan pasteurisasi terhadap tingkat sineresis (%) ... 87
Lampiran 16. Gambar sampel gel cincau hijau dan air sineresisnya ... 88
Lampiran 17. Hasil pengukuran kadar klorofil ... 89
Lampiran 18. Hasil uji statistik perlakuan pasteurisasi terhadap kadar klorofil ... 90
Lampiran 19. Kurva standar asam galat ... 93
Lampiran 20. Hasil pengukuran total fenol ... 94
Lampiran 21. Hasil uji statistik perlakuan pasteurisasi terhadap total fenol ... 95
Lampiran 22. Kurva standar asam askorbat ... 96
Lampiran 23. Hasil pengukuran kapasitas antioksidan ... 97
Lampiran 24. Hasil uji statistik perlakuan pasteurisasi terhadap total antioksidan ... 98
Lampiran 25. Hasil pengukuran kadar serat pangan ... 99
Lampiran 26. Hasil uji statistik perlakuan pasteurisasi terhadap kadar IDF, SDF, dan total serat pangan ... 100
Lampiran 27. Kuesioner uji deskripsi skala terstruktur... 103
Lampiran 28. Kuesioner uji rating hedonik ... 104
Lampiran 29. Hasil uji deksripsi skala terstruktur ... 105
Lampiran 30. Hasil uji rating hedonik ... 107
Lampiran 31. Hasil uji keamanan mikrobiologi ... 109
I.
PENDAHULUAN
A.
LATAR BELAKANG
Kesadaran masyarakat akan pentingnya kesehatan semakin meningkat yang mendorong masyarakat untuk mengkonsumsi pangan yang diketahui memiliki khasiat kesehatan atau dikenal sebagai pangan fungional. Pangan fungsional menurut Badan Pengawas Obat dan Makanan (2005) adalah pangan yang secara alamiah maupun telah melalui proses, mengandung satu atau lebih senyawa yang berdasarkan kajian-kajian ilmiah dianggap mempunyai fungsi-fungsi fisiologis tertentu yang bermanfaat bagi kesehatan. Pangan fungsional dapat dikonsumsi sebagaimana layaknya makanan atau minuman yang mempunyai karakteristik sensori berupa penampakan, warna, tekstur dan cita rasa yang dapat diterima oleh konsumen, tidak memberikan kontraindikasi dan tidak memberikan efek samping pada jumlah penggunaan yang dianjurkan terhadap metabolisme zat gizi lainnya.
Salah satu pangan fungsional yang sudah banyak diteliti adalah tanaman cincau hijau, terutama bagian daunnya. Daun cincau hijau banyak mengandung karbohidrat, polifenol, saponin, flavonoid, lemak, kalsium, fosfor, serta vitamin A dan B (Heyne 1987). Daun cincau hijau juga banyak mengandung klorofil dan mungkin juga mengandung karotenoid. Secara tradisional, tanaman ini telah banyak digunakan sebagai obat penurun panas (antipyrectic), obat radang lambung, rasa mual, dan penurun tekanan darah tinggi (Sunanto 1995). Menurut beberapa penelitian juga menyebutkan beberapa khasiat lain dari cincau hijau, yaitu anti kanker (Ananta 2000), meningkatkan jumlah limfosit (Pandoyo 2000), menurunkan jumlah radikal bebas (Handayani 2000), meningkatkan kapasitas antioksidan limfosit (Koessitoresmi 2002), dan tidak bersifat toksik bagi tubuh (Arisudana 2003; Nugrahenny 2003).
Produk cincau hijau yang banyak dikembangkan adalah gel cincau hijau. Namun, dalam pengembangannya masih memiliki kelemahan, terutama pada proses pembuatannya yang dapat menyebabkan kemungkinan tingginya cemaran mikrobiologis sehingga umur simpan gel cincau hijau menjadi singkat dan daerah penjualan produk sangat terbatas. Beberapa kendala utama dalam proses pembuatan gel cincau hijau antara lain persiapan dan proses pembuatan cincau hijau yang masih tergolong sederhana dan tradisional tanpa adanya proses pemanasan, kemungkinan penggunaan air yang tidak memenuhi syarat mutu sebagai air minum, sanitasi yang tidak terjamin, mulai dari bahan baku, peralatan yang digunakan, maupun kebersihan dan tingkat higiene dari pembuatnya.
Kemungkinan tingginya cemaran mikrobiologis yang mengakibatkan singkatnya umur simpan produk gel tersebut adalah potensi cemaran bakteri pembusuk, bakteri indikator sanitasi, dan bakteri patogen. Hasil survei dari penelitian Pramitasari (2012) yang diambil dari 14 sampel penjual gel cincau hijau menyatakan bahwa sebagian besar penjual tidak menerapkan beberapa persyaratan sanitasi dan higiene, baik dari segi penjamah makanan, peralatan, air, bahan makanan, bahan tambahan dan penyajian, sarana penjaja, serta sentra pedagang. Hasil analisis mikrobiologi terhadap 14 sampel gel cincau hijau memperlihatkan bahwa sampel gel cincau hijau mengandung total mikroba, E. coli, dan Staphylococcus sp. berturut-turut sebesar 1.6 x 104 sampai dengan 2.4 x 106 CFU/g, 3.0 x 102 sampai dengan 4.4 x 103 CFU/g, dan 2.5 x 101 sampai dengan 2.0 x 103 CFU/g (Pramitasari 2012).
untuk dilakukan usaha yang bertujuan untuk meningkatkan mutu dan keamanan mikrobiologis gel cincau. Salah satu faktor penting yang harus diperhatikan adalah penerapan sanitasi dan higiene pada praktek pembuatan dan penjualan gel cincau hijau. Selain itu, upaya untuk meningkatkan mutu dan keamanan gel cincau hijau dapat dilakukan dengan mengaplikasikan proses termal terhadap produk gel cincau hijau dalam kemasan. Perlakuan pemanasan berupa pengukusan diketahui dapat menurunkan kandungan mikrobiologi gel cincau hijau, tetapi berpengaruh negatif terhadap sifat fisiknya (Pramitasari 2012). Selain itu, penggunaan panas juga diduga akan berpengaruh terhadap sifat fungsional gel cincau hijau, yaitu kapasitas antioksidan, total fenol, total klorofil, dan serat pangan. Untuk itu perlu dilakukan optimasi proses termal yang akan diaplikasikan terhadap produk gel cincau hijau. Pada penelitian ini akan dilakukan desain dan aplikasi pasteurisasi yang dapat memperbaiki mutu dan keamanan produk secara mikrobiologis, serta memberi pengaruh yang minimal terhadap sifat fisik dan fungsional produk, serta diterima oleh panelis secara organoleptik.
B.
TUJUAN PENELITIAN
Tujuan penelitian ini adalah sebagai berikut:
1.
Mendesain dan mengaplikasikan pasteurisasi untuk produk gel cincau hijau dalam kemasan.2.
Menetapkan kondisi (suhu dan waktu) pasteurisasi terpilih berdasarkan stabilitas sifat fisikdan sifat fungsional.
II.
TINJAUAN PUSTAKA
A.
TANAMAN CINCAU HIJAU PERDU (
Premna oblongifolia
Merr.)
1.
Botani dan Klasifikasi
Cincau hijau spesies Premna oblingifolia Merr. dapat hidup dari dataran rendah sampai pada ketinggian 800 m di atas permukaan laut (Kusharto et al. 2008). Berikut ini adalah klasifikasi cincau hijau P. oblongifolia Merr. (Ben dan Syu 2008):
Kingdom : Plantae (tumbuhan)
Subkingdom : Tracheobionta (tumbuhan berpembuluh) Super divisi : Spermatophyta (menghasilkan biji) Divisi : Magnoliophyta (tumbuhan berbunga) Kelas : Magnoliopsida (berkeping dua/dikotil) Subkelas : Asteridae
Ordo : Lamiales Famili : Verbenaceae Genus : Premna
Spesies : Premna oblongifolia Merr.
Bentuk tanamannya berupa semak-semak, belukar, atau pohon tegak. P. oblongifolia
Merr. merupakan tanaman yang umumnya tumbuh secara liar, memiliki kelopak bunga yang tipis, berwarna putih, pendek dan berbulu, dengan ukuran 1.25-1.75 mm. Ukuran benang sarinya 2.5-3 mm. Pada batang yang masih muda, tertutup penuh oleh bulu pendek coklat. Daunnya berbentuk lonjong dengan tulang daun membujur, permukaannya cukup kasar dan tajam, keseluruhannya tipis, tepi daun bergerigi atau berlekuk, serta hanya sedikit berbulu di sebaliknya. Panjang daun antara 8.5-23.0 cm dengan lebar antara 3.5-10.0 cm dan panjang tangkai daun antara 1.5-4.0 cm (Syamsuhidayat dan Hutapea 1991). Daun cincau hijau perdu dapat dilihat pada Gambar 1.
Gambar 1.Daun cincau hijau Premna oblongifolia Merr.
2.
Pemanfaatan dan Khasiat Biologis
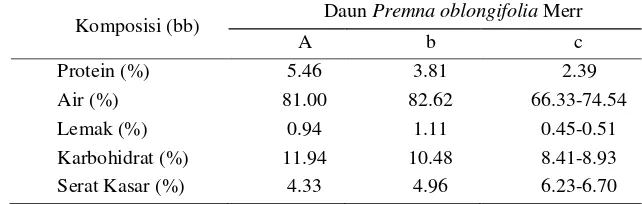
satu sumber makanan rendah kalori, karena kandungan lemaknya yang sedikit dan kandungan serat pangan yang tinggi (Arisudana 2003, Muslimah 2004) dan mengandung β-carotene yang dapat berfungsi sebagai prekursor vitamin A dan antioksidan (Jacobus 2003). Komposisi gizi daun cincau hijau dapat dilihat pada Tabel 1.
Tabel 1. Komposisi gizi daun Premna oblongifolia Merr
Komposisi(bb) Daun Premna oblongifolia Merr
A b c
Protein (%) 5.46 3.81 2.39
Air (%) 81.00 82.62 66.33-74.54
Lemak (%) 0.94 1.11 0.45-0.51
Karbohidrat (%) 11.94 10.48 8.41-8.93 Serat Kasar (%) 4.33 4.96 6.23-6.70
Sumber: aUntoro (1985), bMinawati (1985), cSunanto (1995) diacu dalam Kusharto et al. (2008).
Khasiat daun cincau hijau P. oblongifolia Merr. pada mencit yang telah diteliti antara lain meningkatkan jumlah limfosit (Pandoyo 2000), menurunkan jumlah radikal bebas (Handayani 2000), tidak bersifat toksik bagi tubuh (Arisudana 2003), dan bersifat antikanker (Chalid 2003). Ekstrak methanol batang cincau hijau mengandung komponen alkaloid quenine
(C20H24N2O2) yang berfungsi sebagai antipiretik dan penurun demam. Quenine juga dapat menekan pertumbuhan Plasmodium falsifarum yang menyebabkan penyakit malaria (Pandoyo 2000). Khasiat lain cincau hijau yang telah diteliti antara lain kemampuan penghambatan proliferasi sel kanker K562 dan Hela (Ananta 2000), kemampuan imunostimulan (pada konsentrasi rendah) maupun imunosupresan (pada konsentrasi tinggi) baik pada sel makrofag mencit maupun limfosit manusia (Handayani 2000), anti alergi pada mencit (Rachmini 2000), serta meningkatkan kapasitas antioksidan limfosit (Koessitoresmi 2002).
Pemberian bubuk gel daun cincau hijau Premna oblongifolia Merr. terhadap peningkatan
kadar β-carotene pada hati tikus (Jacobus 2003). Selanjutnya, Chalid (2003) menyatakan bahwa pengujian aktivitas antikanker ekstrak cincau hijau P. oblongifolia Merr. dilakukan terhadap mencit C3H. Penelitian tersebut menunjukkan bahwa penambahan volume tumor mencit yang diberi pakan ekstrak daun cincau hijau P. oblongifolia Merr. relatif lebih rendah dibandingkan dengan pembanding yang tidak diberi pakan ekstrak daun cincau hijau P. oblongifolia Merr.. Ekstrak daun mampu meningkatkan kadar glutation, menurunkan aktivitas enzim sitokrom P-420, dan menurunkan kadar MDA hati tikus serta tidak mempengaruhi enzim glutathion S-tranferase
B.
GEL CINCAU HIJAU
1.
Karakteristik dan Cara Pembuatan Gel Cincau Hijau
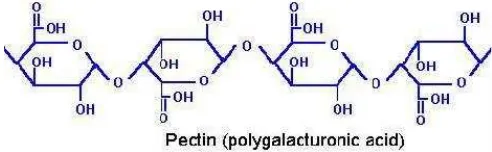
Menurut Fardiaz (1989), pembentukan gel adalah suatu fenomena penggabungan atau pengikatan silang rantai-rantai polimer sehingga terbentuk suatu jala tiga dimensi bersambungan. Selanjutnya jala ini menangkap atau mengimobilisasikan air didalamnya dan membentuk struktur yang kuat dan kaku. Sifat pembentukan gel ini beragam dari satu jenis hidrokoloid ke jenis lain, tergantung pada jenisnya.
Gel cincau hijau merupakan hasil peremasan daun cincau hijau yang dicampur dengan sejumlah air sebagai pelarutnya dan cairan yang didapatkan akan mengental dengan sendirinya. Gel cincau hijau dapat terbentuk pada suhu kamar, yaitu antara 25-30oC dan berwarna hijau karena mengandung klorofil dan bersifat tidak tembus cahaya (opaque) (Sunanto 1995). Fenomena pembentukan gel dari hidrokoloid cincau hijau terjadi dengan mekanisme gelasi. Gelasi merupakan fenomena penggabungan atau pembentukan ikatan silang rantai polisakarida sehingga membentuk jejaring tiga dimensi yang kontinu yang mampu memobilisasi dan memerangkap cairan sehingga menghasilkan formasi semi padat (Glicksman 1989). Gambar gel cincau hijau dapat dilihat pada Gambar 2.
Gambar 2. Gel cincau hijau
Gambar 3. Struktur pektin
Beberapa hal mempengaruhi daya tahan pecah gel adalah kadar daun cincau hijau, temperatur air pengekstrak, pH air pengekstrak, dan perendaman gel dalam air kapur (Ananta 2000). Semakin tinggi kadar daun cincau hijau, daya tahan gel meningkat. Tingginya suhu air (medium) membuat pembentukan gel menjadi lambat dan daya tahan pecah menurun. Gel tidak akan terbentuk pada temperatur 80ºC atau lebih. Rendahnya pH medium, waktu pembentukan gel menjadi lambat dengan daya tahan gel yang tinggi. Perendaman gel dalam air kapur membuat gel menjadi keras, tetapi rapuh, mudah pecah, dan murunkan daya tahan pecah gel.
Cara pembuatan gel cincau hijau yang diperoleh berdasarkan hasil wawancara Pramitasari (2012) terhadap 14 penjual gel cincau hijau adalah sebagai berikut: daun cincau hijau yang masih segar dicuci sampai bersih, kemudian diberi air dingin (suhu kamar) secukupnya. Setelah itu, daun cincau diremas terus-menerus sampai diperoleh air perasan yang kental. Selanjutnya larutan yang diperoleh disaring dan hasil penyaringan ini didiamkan selama ± 1 jam sampai terbentuk gel. Gel cincau hijau kemudian disimpan pada suhu kamar, yaitu antara suhu 25–30 °C di dalam wadah yang akan digunakan pada saat penjualan.
Setiap tahapan cara pembuatan gel cincau hijau yang dilakukan memiliki tujuan masing-masing. Pencucian daun cincau hijau segar bertujuan untuk menghilangkan kotoran-kotoran yang menempel pada daun, sehingga tidak mengontaminasi produk yang dihasilkan. Peremasan daun cincau dalam air dingin (suhu kamar) bertujuan untuk memudahkan peremasan daun cincau hijau. Peremasan daun cincau hijau tersebut dapat dilakukan dengan menggunakan tangan atau blender. Penyaringan bertujuan untuk memisahkan larutan kental dengan ampas daun, karena yang diperlukan untuk membuat gel cincau hijau hanya larutannya saja (Pramitasari 2012).
Pembuatan gel cincau hijau yang didapatkan dari studi literatur juga hampir sama dengan yang didapatkan pada saat wawancara yang dilakukan Pramitasari (2012). Perbedaan cara pembuatan gel cincau hijau yang didapatkan dari hasil wawancara dengan studi literatur terletak pada waktu yang dibutuhkan larutan kental daun cincau sampai dengan terbentuknya gel. Berdasarkan hasil wawancara, waktu yang dibutuhkan sampai dengan terbentuk gel adalah ± 1 jam, sedangkan berdasarkan studi literatur dibutuhkan waktu ± 5 jam sampai terbentuk gel. Perbedaan waktu yang dibutuhkan sampai dengan terbentuk gel mungkin disebabkan penggunaan bahan tambahan pada saat pembuatan, seperti larutan abu kayu.
2.
Mutu dan Keamanan Mikrobiologis Gel Cincau Hijau
diketahui bersih atau tidak, peralatan disimpan ditempat terbuka dan tidak terlindung, sarana penjaja tidak memiliki tempat untuk air bersih, penyimpanan peralatan, tempat cuci, tempat sampah dan tidak terlindung dari debu dan pencemaran, serta lokasi penjualan yang dekat dari sumber pencemaran.
Hal ini tentu dapat berpengaruh buruk terhadap mutu mikrobiologis dari produk gel cincau hijau yang dijualnya. Hasil analisis mikrobiologi gel cincau hijau memperlihatkan bahwa sampel mengandung total mikroba, E. coli, dan Staphylococcus sp. berturut-turut sebesar 1.6 x 104 sampai dengan 2.4 x 106 CFU/g, 3.0 x 102 sampai dengan 4.4 x 103 CFU/g, dan 2.5 x 101 sampai dengan 2.0 x 103 CFU/g. Perlakuan pengukusan dapat menurunkan jumlah mikroba total rata-rata 1.07 – 1.10 log CFU/g, jumlah E. coli rata-rata 1.00 – 1.18 log CFU/g, dan jumlah
Staphylococcus sp rata-rata 0.29 – 0.71 log CFU/g.
C.
PASTEURISASI
Proses termal adalah pengolahan pangan dengan menggunakan temperatur tinggi yang dapat membunuh sel vegetatif mikroorganisme pembusuk dan patogen sehingga produk menjadi aman dan umur simpan menjadi lebih lama. Pasteurisasi merupakan salah satu perlakuan dari proses termal. Pasteurisasi adalah suatu proses pemanasan yang relatif cukup rendah (umumnya dilakukan pada temperatur di bawah 100ºC) dengan tujuan untuk mengurangi populasi mikroorganisme patogen, sehingga bahan pangan yang dipasteurisasi tersebut mempunyai daya awet beberapa hari sampai beberapa bulan (Hariyadi 2000). Pasteurisasi umumnya dikombinasikan dengan proses pengawetan lainnya seperti fermentasi atau penyimpanan pada suhu rendah. Pada bahan pangan yang tergolong asam (pH<4.5), pasteurisasi bertujuan untuk memperpanjang umur simpan dan untuk membunuh mikroorganisme serta untuk mengaktivasi enzim yang terdapat dalam bahan pangan tersebut (Fellow 2000).
Pasteurisasi dapat dilakukan pada suhu yang relatif rendah dalam waktu yang relatif lama, yaitu 65°C selama 30 menit atau pada suhu tinggi dalam waktu singkat yaitu 72°C selama 15 detik. Semakin tinggi suhu pasteurisasi, semakin singkat proses pemanasannya. Dalam pasteurisasi, konsep yang umum digunakan adalah konsep 6D atau mereduksi jumlah mikroorganisme sebesar 6 log. Menurut Fellow (2000), konsep ini cukup memadai dari segi kualitas dan keamanan pangan. Hal ini dikarenakan proses pasteurisasi umumnya dikombinasikan dengan teknik pengawetan lainnya, yaitu menggunakan konsep hurdle (Kusnandar et al. 2006).
Dua jenis data utama pada pasteurisasi adalah (1) data kinetika inaktivasi termal, yaitu TDT (thermal death time) untuk mikroorganisme yang menjadi target dalam produk pangan yang akan diawetkan dan (2) distribusi dan penetrasi termal pada produk pangan yang berada di dalam kemasan dengan kenis dan ukuran tertentu (Muchtadi 2008). Kurva thermal death time (TDT), yaitu waktu yang diperlukan untuk membunuh sejumlah mikroorganisme pada suhu tertentu. Distribusi panas adalah penyebaran panas di dalam bak pasteurizer atau retort yang terjadi selama pemanasan untuk menentukan sebaran panas, termasuk titik terdingin dalam bak pasteurizer atau retort dan menentukan waktu minimum pemanasan sebelum alat digunakan. Penetrasi panas adalah perambatan panas dalam kemasan dan produk selama pemanasan untuk mengetahui perubahan temperatur produk selama pemanasan dan pendinginan dan proses termal dapat ditentukan dengan aman. Acuan penentuan distribusi dan penetrasi adalah titik terdingin dari
secara umum, penetrasi panas ke dalam produk pangan yang dikemas secara hermetis terjadi dalam tiga tahap, yaitu (1) transfer panas dari medium pemanas ke permukaan kemasan, (2) transfer panas melalui kemasan, dan (3) transfer panas dari permukaan dalam kemasan hingga mencapai titik terdingin (coldest point) dari produk.
Analisis data penetrasi panas untuk menghitung kecukupan proses termal dapat dilakukan dengan dua metode, yaitu metode umum dan metode formula. Metode umum adalah metode yang paling teliti dalam mengkalkulasi proses termal karena langsung menggunakan data penetrasi panas yang diperoleh dari hasil pengukuran tanpa mengasumsikan hubungan suhu-waktu dari produk tersebut (Muchtadi 2008). Nilai letalitas proses ditentukan dengan integral nilai letalitas (L) menggunakan data suhu terhadap waktu proses, yang dirumuskan sebagai berikut:
∫
Efek letalitas pada suhu tertentu yang dibandingkan suhu standar disebut nilai LR (Lethal Rate) atau LV (Lethal Value). Nilai LR suatu proses termal dapat dihitung dengan mengonversi waktu proses pada suhu tertentu ke waktu ekivalen pada suhu standar. Secara matematis, nilai LR dapat dihitung dengan persamaan berikut:
Nilai LR tidak memiliki satuan, yaitu bernilai 1 pada suhu standar (85°C). Pada suhu yang lebih tinggi dari suhu standar, nilai LR lebih besar dari satu. Sebaliknya, pada suhu di bawah suhu standar, niali LR lebih kecil dari satu. Nilai LR dapat digunakan untuk menghitung nilai F pada suhu tersebut (Hariyadi et al. 2006), yaitu dengan persamaan berikut:
∑
dengan FT = nilai pasteurisasi
Δt = selang waktu unutk mengamati suhu T = suhu pengamatan
LR = lethal rate = 10(T-TR)/Z
D.
Staphylococcus aureus
Staphylococcus aureus tergolong dalam famili Staphylococcaceae, gram positif, dan bersifat katalase positif. Bentuk morfologi bakteri ini adalah bulat dengan ukuran diameter 0.5– 1.5 µm, serta tidak membentuk spora selama pertumbuhannya. Biasanya sel S. aureus
berkelompok seperti buah anggur, tunggal, berpasangan atau dalam jumlah empat (Alcamo 1984). Morfologinya dapat dilhat pada Gambar 4.
Gambar 4. Bentuk morfologi Staphylococcus aureus
Minor dan Marth (1976) mengemukakan bahwa dinding sel S. aureus memiliki ketebalan kurang lebih 20 nm. Komponen penyusun utama dinding selnya adalah peptidoglikan sekitar 40-60% berat dinding sel. Peptidoglikan merupakan suatu makromolekul yang mempengaruhi kekakuan dinding sel selain asam teikhoat (Pelczar dan Reid 1972). Kerangka peptidoglikan terdiri dari N-asetil glukosamin dan N-asetil muramat yang berikatan silang (cross linkage) dengan ikatan α-1,4. Selain kerangka polisakarida terdapat juga suatu rantai tetrapeptida yang terdiri dari asam amino D dan L yang berikatan secara silang. Hampir setiap rantai tetrapeptida dihubungkan oleh jembatan pentaglisin ke rantai tetrapeptida yang berdekatan (Minor dan Marth 1976).
S. aureus membutuhkan aw minimum 0.86 untuk pertumbuhannya, dengan aw
optimumnya 0.990–0.995 (Frazier 1967). Suhu optimum pertumbuhannya adalah 35oC–37oC. Akan tetapi bakteri ini dapat tumbuh pada kisaran suhu 6.7oC–45.5oC, dengan pH optimum pertumbuhan 7.0-7.5 (Fardiaz 1983). S. aureus biasanya hidup sebagai saprofit dalam saluran pengeluaran lendir tubuh manusia dan hewan (Matz 1965). Bakteri ini sering terdapat pada pori-pori dan permukaan kulit, sehingga menyebabkan terjadinya infeksi (Alcamo 1984). Menurut Fardiaz (1983), selain menyebabkan intoksikasi, S. aureus juga menyebabkan berbagai macam infeksi seperti bisul, jerawat, meningitis, osteomielitis, pneumonia, dan mastitis pada hewan dan manusia. Ada enam macam enterotoksin yang diproduksi S. aureus di dalam makanan dan merupakan penyebab keracunan (intoksikasi), yaitu enterotoksin A, B, C1, C2, D, dan E. Enterotoksin A paling banyak ditemukan sebagai penyebab keracunan makanan dengan akibat terjadinya inflamasi pada kelenjar usus atau gastroenteritis (Fardiaz 1983).
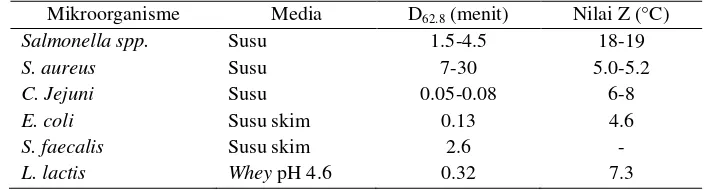
Staphylococcus aureus adalah bakteri mesofilik nonspora dan beberapa galurnya bersifat tahan panas. Ketahanan panas lebih tinggi terutama pada pangan dengan aktivitas air tinggi (Stewart 2003). Jika dibandingkan dengan bakteri lainnya Staphylococcus aureus memiliki ketahanan panas yang cukup tinggi pada suhu 62.8 °C. Staphylococcus aureus lebih tahan terhadap pemanasan pada heating menstruum susu dengan suhu 62.8 °C jika dibandingkan dengan bakteri nonspora lainnya seperti, E. coli, Campylobacter jejuni, S. faecalis, dan
dengan spora bakteri seperti spora Bacillus cereus, dan Clostridium botulinum. Perbandingan ketahanan bakteri dapat dilihat pada Tabel 2.
Tabel 2. Ketahanan panas bakteri non-spora (Walstra et al. 1999)
Mikroorganisme Media D62.8 (menit) Nilai Z (°C)
Salmonella spp. Susu 1.5-4.5 18-19
S. aureus Susu 7-30 5.0-5.2
C. Jejuni Susu 0.05-0.08 6-8
E. coli Susu skim 0.13 4.6
S. faecalis Susu skim 2.6 -
III.
METODOLOGI PENELITIAN
A.
WAKTU DAN TEMPAT
Penelitian ini dilaksanakan pada bulan Maret 2012 sampai dengan Januari 2013. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi Pangan Departemen Ilmu dan Teknologi Pangan (ITP) untuk evaluasi mikrobiologi gel cincau hijau, Laboratorium Rekayasa Pangan Departemen ITP untuk pembuatan gel cincau hijau dan analisis fisiknya, Pilot Plan PAU untuk uji distribusi dan penetrasi panas, dan Laboratorium Evaluasi Sensori ITP untuk uji organoleptik gel cincau hijau, serta Laboratorium Mikrobiologi SEAFAST Center, LPPM IPB untuk uji keamanan produk terpilih.
B.
BAHAN DAN ALAT
Bahan yang digunakan dalam penelitian ini antara lain sebagai berikut :
a. Bahan baku yang digunakan adalah daun cincau hijau (Premna oblongifolia Merr.) yang dibeli dari penjual cincau hijau. Sampel gel cincau hijau akan dikemas dengan kemasan cup plastik yang bervolume 200 mL dan ditutup dengan lid cup.
b. Bahan-bahan kimia yang digunakan, yaitu KH2PO4 (buffer fosfat) sebagai larutan pengencer, alkohol 70%, akuades, spiritus, ungu kristal, safranin, iodium, minyak imersi, egg yolk tellurite, buffer 4.00, buffer 7.00, metanol 85%, reagen DPPH, Folin-Ciocalteau, aseton 99.8%, sodium fosfat, enzim termamil, HCl 4N, pepsin, NaOH 4N, pankreatin, air destilata, etanol 78%, dan etanol 95%.
c. Media-media yang digunakan untuk analisis adalah Baird Parker Agar (BPA) yang ditambah dengan Egg YolkTellurite Emulsion (EYT), Plate Count Agar (PCA), Acidified Potato Dextrose Agar (APDA), Eosin Methylen Blue Agar (EMBA),Brilliant Green Lactose Lactose Bile Broth
(BGLBB), Lactose Broth (LB), Tetrathionate Broth (TTB), Rappaport Vassiliadis (RV), Hectoen Enteric Agar (HEA), Bismuth Sulfite Agar (BSA), Xylose Lysine Desoxycholate Agar (XLDA),
Triple Sugar Iron Agar (TSIA), Lysine Iron Agar (LIA), Nutrient Agar (NA), dan Brain Heart Infussion Broth (BHIB), serta Lauryl Tryptose Broth (LTSB).
d. Kultur yang digunakan sebagai inokulum adalah S. aureus yang terdiri dari satu strain.
Alat-alat yang digunakan adalah kompor, panci, tutup panci, blancher, kawat,
C.
METODE PENELITIAN
Penelitian ini akan dilaksanakan dengan tahapan-tahapan sebagai berikut:
Gambar 5. Diagram alir penelitian
1.
Desain Sampel
Formulasi berdasarkan Andika (2013), yaitu air:daun cincau hijau sebesar 15:1, karagenan sebanyak 2%, dan NaHCO3 sebanyak 0.125%. Ekstrak gel cincau hijau sebanyak 200 mL akan dikemas dalam kemasan cup gelas dan diberi lid cup dengan tebal 0.02 mm sebagai tutup kemasan. Lid cup dikelim menggunakan alat cupsealer dengan suhu 120°C selama ±7 detik. Penetapan jenis kemasan dan lid cup berdasarkan uji coba yang dilakukan terhadap kekuatan kemasannya dan tidak bocornya keliman bibir cup dengan tutup cup selama pemanasan 30 menit. Uji efektivitas proses
termal terhadap bakteri target (challenge test)
Analisis sifat fisik (warna, pH, kekuatan
pecah, dan sineresis)
Analisis sifat fungsional (antioksidan, fenol, klorofil,
dan serat pangan) Desain proses termal (pasteurisasi)
Pembuatan gel cincau hijau (Premna oblongifolia Merr.)
Aplikasi proses termal (3T, 3t) Desain gel cincau hijau dalam kemasan
Produk gel dengan T dan t terpilih
Analisis mutu dan keamanan mikrobiologis (kapang, khamir,
TPC, E. coli, S. aureus, Salmonella sp., dan Bacillus sp)
2.
Desain Proses Termal (Pasteurisasi)
Alat yang digunakan dalam penelitian ini adalah blancher yang berada di laboratorium Pilot Plan. Sampel yang diuji distribusi panas adalah dummy (sampel tiruan) yaitu air panas sebanyak 200 mL di dalam cup poliester dan ditutup dengan lid setebal 0.02 mm menggunakan
cup sealer. Jumlah dummy yang digunakan adalah 41 cup. Tanda panah merupakan asal dari uap panas yang dialirkan ke dalam blancher. Cara pengoperasian blancher serta boiler dapat dilihat pada Lampiran 32. Posisi termokopel dalam blancher pada uji distribusi panas dapat dilihat pada Gambar 6 dan Gambar 7.
Desain proses termal menggunakan kombinasi tiga suhu dan suhu terhadap bakteri target. Kombinasi suhu yang digunakan pada penelitian ini adalah 75˚C, 85˚C, dan 95˚C, sedangkan kombinasi waktu ditetapkan berdasarkan hasil uji penetrasi panas. Sebelum aplikasi proses termal dilakukan kalibrasi termokopel yang bertujuan untuk menguji termokopel sehingga termokopel yang digunakan benar-benar dalam kondisi baik. Uji distribusi panas juga diperlukan untuk mengetahui sebaran panas dan mendapatkan titik terdingin dari alat yang digunakan. Uji penetrasi panas dilakukan untuk mengukur waktu yang diperlukan sehingga produk dalam kemasan benar-benar telah mencapai suhu yang diinginkan pada saat perlakuan pasteurisai. Pengukuran penetrasi panas dihentikan bila suhu target telah tercapai.
Gambar 6. Posisi termokopel dalam blancher selama uji distribusi panas
Gambar 7. Dummy selama distribusi panas
Daun cincau hijau
Pembersihan dan blansir
Peremasan sampai lumat (daun:air 1:15)
0.125% Na2CO3 2% karagenan (Prakoso 2013)
1% inokulan bakteri target (109-1010 CFU/mL) untuk challenge test
Penyaringan
Filtrat
Sealing Cupping (200 mL)
Gel cincau hijau dalam kemasan
Gelling (2.5 jam, suhu refrigerator)
Tabel 3.Nilai suhu, D, dan F
Suhu (°C) Nilai D (menit) Nilai F = SD = 6D (menit)
75 0.0237 0.1424
85 0.0021 0.0126
95 0.0002 0.0011
3.
Pembuatan Gel Cincau Hijau (
Premna oblongifolia
Merr.)
Pembuatan gel cincau hijau dalam penelitian dapat dilihat pada Gambar 8. Bahan baku daun yang digunakan berumur 1-2 hari dan dipilih yang masih dalam keadaan baik, tidak terdapat bercak hitam atau coklat. Ciri daun yang digunakan masih berwarna hijau dan tidak layu. Untuk NaHCO3 dan karagenan disimpan dalam refrigerator, sedangkan untuk air dan daun disimpan pada suhu ruang. Dalam pembuatannya digunakan alat-alat yang bersih (dicuci air bersih dan sabun). Pembuat mencuci tangan dengan air bersih dan sabun setiap bersentuhan dengan produk.
4.
Aplikasi Proses Termal
Aplikasi proses termal yaitu pasteurisasi produk gel cincau dalam kemasan dilakukan dengan tiga kombinasi waktu dan suhu yang diperoleh dari tahap desain proses termal. Produk yang diberi perlakuan pasteurisasi dianalisis secara fisik (pH, warna, tekstur, dan sineresis) dan fungsional (serat kasar, kadar antioksidan, total fenol, dan total klorofil) pada hari ke-0 sebanyak dua ulangan dan duplo. Selain itu, dilakukan juga uji efektivitas panas dalam mereduksi bakteri target S. aureus dengan cara challenge test (artificial inoculation) pada produk yang dipasteurisasi pada suhu referensi (85°C). Sampel produk yang akan dianalisis berjumlah 3 yaitu 3 gel cincau terpasteurisasi. Berdasarkan dari proses termal yang dilakukan akan dipilih kombinasi suhu dan waktu terbaik pasteurisasi yang memberikan efek menurunkan jumlah mikrobiologi bakteri target maksimal dengan meminimalisasi kerusakan fisik dan sifat fungsional dari gel cincau hijau.
a. Analisis Fisik
Nilai pH
Alat pH meter dikalibrasi menggunakan larutan buffer pH 4.00 dan pH 7.00. Produk gel cincau hijau merupakan produk semi solid sehingga perlu dilakukan persiapan bahan sebelum pengukuran pH dilakukan. Gel cincau hijau dihomogenkan dengan cara memotong-motong menjadi bagian-bagian yang kecil, lalu dicincang atau digerus hingga halus. Kemudian, 25 gram gel cincau hijau ditempatkan pada gelas beker. pH gel cincau hijau diukur menggunakan pH meter yang telah terkalibrasi.
Sineresis (AOAC 1995)
Sineresis gel diamati dengan menyimpan gel yang terbentuk pada suhu refrigerator (10oC) selama hari ke-0, -1, -2, dan -3. Penyimpanan yang dilakukan dalam penelitian selama 3 hari di suhu refrigerator. Masing-masing gel diwadahi dengan cawan untuk menampung air yang dibebaskan dari dalam gel selama penyimpanan. Sineresis gel dihitung dengan mengukur kehilangan berat selama penyimpanan lalu dibandingkan dengan berat awal gel.
Sineresis Gel =
Keterangan: A = Berat sampel sebelum penyimpanan (gram) B = Berat sampel setelah penyimpanan (gram)
Warna
sampai +100 untuk warna merah dan nilai -a (negatif) dari 0 sampai -80 untuk warna hijau. Nilai b menyatakan warna kromatik campuran biru-kuning, dengan nilai +b (positif) dari 0 sampai +70 untuk warna biru dan nilai –b (negatif) dari 0 sampai -70 untuk warna kuning.
Tekstur Gel
Tekstur gel diukur dengan menggunakan alat Stevens LFRA Texture Analyser. Kondisi pengukuran yang digunakan sesuai dengan penelitian yang telah dilakukan Camus (2000). Jarak antara probe dengan gel sebesar 65 mm, diamater probe sebesar 0.5 inci (1.27 cm), dan sensitivitas 100 mV, dan strength 60%. Bentuk umum kurva yang diperoleh dari Stevens LFRA Texture Analyser dapat dilihat pada Gambar 9. Parameter yang diamati pada pengukuran ini adalah kekuatan pecah gel, titik pecah gel, dan rigiditas gel. Perhitungan kekuatan pecah, titik pecah, dan rigiditas gel menggunakan rumus Angalet (1986) serta Fry dan Hudson (1983) sebagai berikut:
Kekuatan pecah (g/ cm2) =
=
Titik pecah = Penetrasi pecah = AC
Rigiditas (g/ cm) =
[image:30.595.103.492.293.556.2]
Gambar 9. Bentuk umum kurva standar dari Stevens LFRA Texture Analyser (Setyaningtyas 2000)
b. Challenge test
Penyegaran dan Pengawetan Kultur (Dewi 2008)
Persiapan Inokulum (Dewi 2008 yang dimodifikasi)
Bakteri uji yang akan ditambahkan ke dalam produk dalam kondisi segar dimana bakteri belum memasuki fase kematian (berumur ± 24 jam). Kultur segar dalam agar miring TSA sebanyak 1 ose untuk digoreskan ke atas media selektif dalam cawan, yaitu BPA + EYT.
Kemudian diinkubasi selama 24 jam dengan suhu 35°C. Setelah proses inkubasi dilakukan, dilakukan transfer koloni ke media cair BHIB. Kemudian diinkubasi selama 18-20 jam dengan suhu 35°C dan diperoleh kultur segar. Yang mengandung 109-1010 sel S. aureus.
Inokulasi kultur S. aureus pada produk gel cincau hijau
Challenge test yang dilakukan produk gel cincau hijau dalam kemasan sebanyak 200 mL dengan proses termal konsep 6D. Penambahan 1% kultur S. aureus pada akhir fase log (109-1010 CFU/mL) ke dalam filtrat cincau hijau yang diharapkan pada produk terdapat 107-108 CFU/mL dan memudahkan perhitungan setelah dilakukan plating.
c. Analisis Mikrobiologi
Sebelum dilakukan uji mikrobiologi, dilakukan challenge test bakteri target yang akan diinokulasikan ke dalam produk sebanyak 109-1010 CFU/mL. Bakteri target tersebut harus diinkubasi dahulu dan agar diketahui berapa inkubasi untuk menghasilkan total mikroorganisme yang diharapkan dilakukan penetapan kurva S. aureus. Tahapan-tahapan dalam challenge test bakteri target (S. aureus) adalah penyegaran dan pengawetan kultur, persiapan inokulum, dan inokulasi S. aureus pada produk gel cincau hijau.
1. S. aureus (BAM 2001)
Isolasi S.aureus
Sampel uji yang berupa padatan ditimbang 10 gram kemudian ditempatkan dalam plastik steril dan ditambahkan larutan fisiologis NaCl 0,85 % sebanyak 90 mL. Larutan ini kemudian dihomogenisasi di dalam alat stomacher selama satu menit. Larutan ini merupakan larutan konsentrasi 10-1. Pemupukan dilakukan sampai 10-5. Metode yang digunakan adalah cawan sebar, yaitu agar steril dituang dan dibiarkan beku dahulu lalu sampel baru dituang dan diratakan dengan
hockey stick.
Dari masing-masing tingkat pengenceran tersebut, diambil 1 mL dan diinokulasikan pada tiga cawan yang berisi media BPA yang ditambah dengan EYT masing-masing 0.4 mL, 0.3 mL, dan 0.3 mL. Suspensi kemudian diratakan dengan menggunakan hockey stick steril yang terbuat dari kaca. Setelah sudah tidak terlihat suspensi mikroba di permukaan media, cawan diinkubasi dengan posisi terbalik pada suhu 35oC selama 45-48 jam. Setelah inkubasi, amati dan hitung jumlah koloni S. aureus yang mempunyai ciri khas berbentuk bundar, licin dan halus, cembung, diameter 2-3 mm, berwarna abu-abu sampai hitam pekat, dan dikelilingi zona opaque
dengan zona luar yang bening (clear zone). Cawan yang dipilih mengandung koloni 20-200 koloni.
Uji Koagulase
koagulase plasma kemudian diaduk dan inkubasi pada suhu 35°C. Tabung tersebut diamati setiap 6 jam sekali hingga 48 jam untuk melihat terbentuknya koagulan. Reaksi positif bila tabung dibalik koagulan tidak jatuh karena terbentuk secara padat (tipe 3+ atau 4+) yang dapat dilihat pada Gambar 10.
Gambar 10. Tipe gumpalan pada uji koagulase
2. Total Plate Count (TPC) (BAM 2001
)
Analisis yang dilakukan meliputi analisis total mikroba (TPC) dengan menggunakan
Plate Count Agar (PCA). Sampel uji ditimbang 10 gram kemudian ditempatkan dalam plastik steril dan ditambahkan pengencer sebanyak 90 mL. Larutan ini kemudian dihomogenisasi di dalam alat stomacher selama dua menit. Larutan ini merupakan larutan konsentrasi 10-1. Pemupukan dilakukan sampai 10-3. Metode yang digunakan adalah cawan tuang, yaitu agar steril dituangkan ke dalam cawan yang telah berisi sampel pada tingkat pengenceran tertentu. Cawan yang telah diinokulasi kemudian diinkubasi selama dua hari di dalam inkubator suhu 37 ⁰C untuk total mikroba. Cawan diinkubasi dalam posisi terbalik dan dipilih cawan yang menunjukkan jumlah koloni antara 25-250.
3. Kapang dan Khamir (BAM 2001
)
Analisis total kapang-khamir dengan menggunakan Acidified Potato Dextrose Agar
(APDA). APDA merupakan PDA yang diasamkan dengan penambahan asam tartarat 10 %. Sampel uji yang berupa padatan ditimbang 10 gram kemudian ditempatkan dalam plastik steril dan ditambahkan larutan fisiologis pengencer sebanyak 90 mL. Larutan ini kemudian dihomogenisasi di dalam alat stomacher selama dua menit. Larutan ini merupakan larutan konsentrasi 10-1. Pemupukan dilakukan sampai 10-3. Metode yang digunakan adalah cawan tuang, yaitu agar steril dituangkan ke dalam cawan yang telah berisi sampel pada tingkat pengenceran tertentu. Cawan yang telah diinokulasi kemudian diinkubasi selama lima hari di dalam inkubator 25⁰C. Cawan diinkubasi dalam posisi terbalik dan dipilih cawan dengan jumlah koloni 10-150.
4. Bakteri Koliform dan E. coli (BAM 2002)
Analisis E. coli menggunakan metode Most Probable Number (MPN) dan hitungan langsung. Uji koliform dengan MPN menggunakan 3 seri tabung pada 4 pengenceran pada media BGLBB. Sebanyak 10 gr contoh gel cincau hijau dimasukkan ke dalam plastik steril dan ditambahkan buffer fosfat sebanyak 90 mL kemudian dihomogenisasi menggunakan stomacher
dengan kekeruhan dan adanya gelembung gas pada tabung durham kemudian cocokkan hasil pengamatan dengan tabel MPN 3 seri tabung serta nyatakan dalam MPN koliform penduga/mL contoh.
Analisis E. coli dilakukan secara kuantitaf dengan hitungan langsung. Sampel yang telah disiapkan sebelumnya diencerkan kembali dengan cara dipipet sebanyak 1 mL, kemudian dibuat seri pengenceran sesuai dengan pengenceran yang dikehendaki. Dari masing-masing tingkat pengenceran tersebut, diambil 1 mL dan dimasukkan ke dalam cawan petri steril (duplo), lalu ditambahkan media Eosin methylen blue agar (EMBA) sebanyak 12-15 mL. Kemudian cawan tersebut digoyangkan di atas permukaan yang datar secara hati-hati untuk menyebarkan sampel secara merata dengan gerakkan seperti angka delapan. Setelah agar memadat, cawan diinkubasi dengan posisi terbalik pada suhu 35oC selama 18-24 jam. Setelah inkubasi, amati dan hitung jumlah koloni E. coli yang tumbuh pada media EMBA. Koloni khas E. coli pada media EMBA adalah berwarna gelap terpusat dan datar, dengan atau tanpa sinar hijau metalik dan berdiameter sekitar 0.5-1.5 mm.
5. Salmonella (BAM 2007)
Pra-pengkayaan
Sampel sebanyak 10 gram dimasukkan ke dalam plastik steril dan ditambahkan sebanyak 90 mL LB kemudian dihancurkan dengan stomacher selama dua menit. Kemudian sampel dipindahkan ke dalam erlenmeyer steril dan dibiarkan selama 60 ± 5 menit pada suhu ruang dalam keadaan tertutup kemudian diinkubasi selama 24 ± 2 jam pada suhu 35 ± 2°C.
Pengkayaan selektif
Sebanyak 1 mL sampel dari Lactose Broth yang telah diinkubasi diinokulasikan ke dalam 10 mL TTB dan divorteks, kemudian diinkubasi pada suhu 35 ± 2°C selama 24 ± 2 jam. Sebanyak 0.1 mL dari sampel yang sama diinokulasikan ke dalam 10 mL Rappaport Vassiliadis
(RV) Broth dan divorteks, kemudian diinkubasi pada suhu 42 ± 2°C selama 24 ± 2 jam.
Penduga
Sampel yang telah diinkubasi pada masing-masing media pengkayaanselektif diambil satu ose dan digoreskan secara kuadran pada media XLDA, HEA, dan BSA. Sebelum digores, media pengkayaan selektif divorteks terlebih dahulu. Ketiga agar selektif tersebut kemudian diinkubasi pada suhu 35 ± 2°C selama 24 ± 2 jam. Setelah inkubasi, dilihat apakah ada koloni tipikal yang tumbuh pada masing-masing agar.
abu-abu atau hitam, kadang tampak berwarna kilau metalik. Sekeliling koloni biasanya akan berwarna coklat pada awalnya dan akan menjadi hitam dengan bertambahnya waktu inkubasi,yang disebut
halo effect.
Penguat
Apabila terdapat koloni tipikal yang tumbuh maka analisa dilanjutkan dengan uji biokimia awal dengan menggunakan TSIA dan LIA. Koloni tipikal XLDA, HEA, dan BSA, diinokulasikan menggunakan jarum ose steril pada agar miring TSI dengan menggores dan menusukkannya. Tanpa pembakaran lagi, jarum ose tersebut diinokulasikan pada LIA miring dengan cara ditusuk dua kali dan digoreskan. Karena reaksi lysine decarboxylation harus benar-benar anaerob, maka tusukan pada media LIA harus mempunyai kedalaman sedikitnya 4 cm. Inkubasi media TSIA dan LIA miring dilakukan pada suhu 35 ± 2°C selama 24 ± 2 jam. Tabung ditutup secara longgar untuk memelihara kondisi aerobik pada waktu inkubasi dan mencegah produksi H2S berlebih. Reaksi spesifik Salmonella pada agar miring TSIA adalah bagian permukaan berwarna merah (reaksi basa), bagian dasar agar atau agar tusuk berwarna kuning (reaksi asam), dan memproduksi H2S (kehitaman pada agar kadang hingga menutupi warna dasar agar) dengan atau tanpa memproduksi gas. Reaksi spesifik Salmonella pada LIA miring adalah bagian permukaan dan dasar agar (agar tusuk) berwarna ungu (reaksi basa). Sebagian besar kultur
Salmonella memproduksi H2S pada LIA miring sedangkan beberapa yang bukan kultur
Salmonella menghasilkan reaksi warna merah bata pada media tersebut.
6. Bacillus sp.
Sampel sebanyak 10 g sampel yang sudah di dalam plastik steril diberi pengencer sebanyak 90 mL kemudian dihomogenkan selam dua menit dengan stomacher. Pemupukan hanya dilakukan pada pengenceran 101. Agar yang digunakan seharusnya adalah Mannitol egg Yolk Polymyxin (MYP), namun karena harga medianya mahal maka digunakan Nutrient Agar (NA). Pemupukan menggunakan metode cawan tuang. Inkubasi dilakukan pada suhu 30°C selama 1 hari. Jika reaksi belum jelas, inkubasi diperpanjang selama 1 hari.
Rumus penghitungan CFU/mL menggunakan rumus yang sama untuk semua mikroorganisme, yaitu:
dengan keterangan N = total koloni per mL atau gram sampel C = jumlah koloni yang dapat dihitung
n1 = jumlah cawan pada pengenceran pertama n2 = jumlah cawan pada pengenceran kedua
d = tingkat pengenceran pertama saat mulai penghitungan
d. Analisis Fungsional
Total fenol (Sakanaka et al. 2005)
Supernatan disaring dan diperoleh filtrat. Filtrat ditera sampai volume 10 mL dalam labu takar. Filtrat dipipet 0.125 mL ditempatkan pada tabung reaksi, ditambahkan 0.5 mL air deionisasi dan 0.125 mL reagen Folin – Ciocalteau, divorteks hingga homogen dan didiamkan 6 menit sebelum ditambahkan 1.2 mL larutan natrium karbonat 7%. Sampel kemudian ditambahkan 1 mL air deionisasi. Sampel didiamkan 90 menit pada suhu ruang dan ruang gelap sebelum diukur absorbansinya pada panjang gelombang 760 nm. Kurva standar dibuat dengan melarutkan asam galat dalam metanol 85% dengan berbagai konsentrasi 10-100 mgL-1. Perhitungan kadar total fenol menggunakan rumus persamaan regresi kurva standar asam galat y = ax + b. Data hasil perhitungan dinyatakan dalam satuan gallic acid equivalent (GAE)/ 100 g.
Kapasitas antioksidan (Sharma dan Bhat 2009 dengan modifikasi)
Sebanyak + 1 gram sampel gel diekstrak dengan 7 mL larutan metanol, dihomogenkan dan disentrifuse 3000 rpm selama 15 menit, hingga diperoleh supernatan. Supernatan disaring dan diperoleh filtrat. Filtrat ditera sampai volume 5 mL dalam labu takar. Filtrat dipipet 1 mL ke dalam tabung reaksi dan ditambahkan 7 mL metanol. Kemudian, 2 mL larutan DPPH 0.25 mM ditambahkan, dihomogenkan, dan diinkubasi pada suhu ruang dan ruang gelap selama 30 menit. Sampel kemudian diukur absorbansinya pada panjang gelombang 517 nm. Kurva standar asam askorbat dibuat dengan persiapan seperti sampel dengan konsentrasi 10-100 µM. Kapasitas antioksidan dihitung dengan menggunakan persamaan regresi linier y = ax + b dari kurva standar asam askorbat. Kapasitas antioksidan dinyatakan dalam satuan AEAC.
Pengukuran Total Klorofil (Nollet 2000)
Sebanyak + 2.5 g sampel bubuk daun dan bubuk gel diekstrak dengan aseton 99.80 % dan ditepatkan sampai volume 10 mL pada labu takar, kemudian divorteks dan dibiarkan selama semalam dalam refrigerator. Sampel selanjutnya disentrifugasi dengan kecepatan 3000 rpm selama 15 menit, kemudian disaring sampai diperoleh filtrat. Filtrat dibaca serapan warnanya pada panjang gelombang 645 dan 663 nm, untuk mengukur kadar total klorofil, klorofil a dan klorofil b. Perhitungan kadar klorofil dilakukan dengan rumus :
Total klorofil (mg/L) = 20.2 A645 nm + 8.02 A663 nm Klorofil a (mg/L) = 12.7 A663 nm – 2.69 A645 nm Klorofil b (mg/L) = 22.9 A645 nm – 4.68 A663 nm
Analisis Kadar Serat Pangan (Asp et al. 1983)
Persiapan Sampel
Sampel diberi perlakuan freeze-dried. Sebanyak 1.0 gram sampel dimasukkan ke dalam erlenmeyer, ditambahkan 25 mL buffer natrium fosfat pH 6,00 dan dibuat menjadi suspensi.
Kemudian ditambah 100 μl enzim termamyl, ditutup dan diinkubasi pada suhu 80oC selama 15 menit dengan inkubator bergoyang, selanjutnya diangkat dan didinginkan serta dilakukan pengaturan pH menjadi 1.5 dengan menambahkan HCl 4 N. Sampel selanjutnya ditambahkan enzim pepsin (0.1 g/mL), diinkubasi pada suhu 37oC, sambil diagitasi selama 120 menit.
diperoleh berat konstan (B). Penyaringan dilakukan dengan pompa vakum dan pembilasan menggunakan air destilata sebanyak 2 x 10 mL, sehingga diperoleh residu dan filtrat.
Penentuan serat pangan tidak larut (Insoluble Dietary Fibre)
Residu yang diperoleh dicuci dengan 2 x 10 mL etanol 78% dan 2 x 10 mL aseton pro analisis. Campuran larutan residu dikeringkan pada suhu 105oC, sampai diperoleh berat konstan + 12 jam (C=berat konstan setelah analisis dan dikeringkan). Cawan porselin dipanaskan dalam oven 105oC (1 jam), didinginkan dan ditimbang (D=berat cawan porselin). Kertas saring dan residu diabukan dalam tanur 500oC selama selama 5 jam, didinginkan, dan ditimbang (E=bobot setelah diabukan).
Penentuan serat pangan larut (Soluble Dietary Fibre)
Filtrat ditambahkan 50 mL etanol 95% hangat (60 °C) dan diendapkan selama 1 malam (24 jam). Endapan disaring dengan kertas saring yang diketahui beratnya (B2=berat kertas saring), dicuci dengan 2 x 10 mL etanol 78% dan 2 x 10 mL aseton. Endapan dikeringkan pada suhu 105 °C semalam (sampai konstan), didinginkan dalam desikator dan ditimbang (C=berat setelah dianalisis dan dikeringkan). Cawan porselin dipanaskan dalam oven 105oC selama 1-3 jam, didinginkan dalam desikator dan ditimbang (D=berat cawan porselin), selanjutnya kertas saring dan residu diabukan pada suhu 500 °C selama selama 5 jam, didinginkan dalam desikator, dan ditimbang (E= bobot setelah diabukan).
Penentuan kadar serat pangan total (Total Dietary Fibre)
Kadar serat pangan total diperoleh dengan cara menjumlahkan nilai serat pangan yang tidak larut dengan serat pangan larut. Blanko dikerjakan tanpa sampel, dengan perhitungan:
1. % Insoluble dietary fibre (IDF) dalam % basis kering
IDF =
2. % Soluble dietary fibre (SDF) dalam % basis kering
SDF =
3. % Total dietary fibre = % IDF + % SDF
Keterangan : A : berat sampel yang sudah dikeringkan (g) B, F : berat kertas saring (g)
D, H : berat cawan porselin (g)
C, G : berat setelah dianalisis dan dikeringkan (g)
e. Uji Organoleptik
IV.
HASIL DAN PEMBAHASAN
A.
DESAIN GEL CINCAU HIJAU DALAM KEMASAN
[image:38.595.140.487.255.368.2]Formulasi yang digunakan berdasarkan hasil penelitian Prakoso (2013), yaitu air:daun cincau 15:1, NaHCO3 dan karagenan sebanyak 0.125 % dan 2.00 % dari basis air yang digunakan (Prakoso 2013). NaHCO3 berguna untuk mempertahankan warna hijau dari cincau hijau selama proses pemanasan yang dilakukan, sedangkan karagenan sebagai hidrokoloid yang dapat membantu dalam proses gelling. Bahan-bahan tersebut dalat dilihat pada Gambar 11.
Gambar 11. Air mineral, daun cincau hijau, NaHCO3, dan karagenan
Penentuan jenis kemasan yang digunakan berdasarkan kekuatan keliman antara bibir cup
dengan tutup cup pada suhu pasteurisasi perlakuan yang tertinggi, yaitu 95°C. Penentuan kemasan cup plastik bertujuan untuk kepraktisan dalam mengkonsumsi dan menarik untuk dipandang. Gel cincau hijau pada umumnya yang dijual hanya menggunakan plastik dan diperlukan wadah berupa gelas untuk memakannya, maka dari itu kemasan cup plastik ini cukup praktis dan menarik.
Gambar 12. Jenis lid cup yang diuji sebagai tutup kemasan
Tabel 4. Perbandingan jenis lid cup
Jenis Lid Cup Kelebihan Kekurangan Pengujian seal pada suhu 95oC
Alumunium Foil Keliman sangat kuat Mahal, produk tidak tampak jelas, kurang praktis karena
seal sulit dibuka