PEMBUNGAAN
Hoya diversifolia
Blume
IPB (Bogor Agricultural University)
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul
Pengaruh Intensitas Cahaya dan Pemupukan terhadap Pertumbuhan dan
Pembungaan Hoya diversifolia Blume merupakan gagasan saya dan karya saya berserta komisi pembimbing belum pernah dipublikasikan dalam bentuk apapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2006
SINTHO WAHYUNING ARDIE
.
Pengaruh Intensitas Cahaya dan Pemupukan terhadap Pertumbuhan dan Pembungaan Hoya diversifolia Blume. Dibimbing oleh ANAS D. SUSILA, DIDY SOPANDIE dan SRI RAHAYU.Penelitian ini terdiri atas dua percobaan yang dilakukan di rumah naungan
University Farm, IPB, Darmaga, Bogor, mulai bulan Februari hingga Mei 2006. Tujuan percobaan I adalah untuk menentukan stadia perkembangan tunas generatif H. diversifolia Bl. secara morfologis dan anatomis dan mempelajari
hubungan antara kandungan gula endogen dengan induksi pembungaan
H. diversifolia Bl. Pengamatan morfologis menunjukkan bahwa perkembangan tunas generatif H. diversifolia Bl. meliputi fase induksi, inisiasi awal, insiasi lanjut, diferensiasi, pendewasaan bagian bunga, dan antesis. Kandungan gula total dan sukrosa tidak berbeda nyata antara pucuk yang terinduksi dan pucuk yang tidak terinduksi, tetapi kandungan gula tereduksi lebih tinggi pada pucuk
yang terinduksi (7.39 mg.g-1) dibanding pucuk yang tidak terinduksi
(4.14 mg.g-1).
Tujuan percobaan II adalah untuk mengetahui pengaruh intensitas cahaya dan pemupukan terhadap pertumbuhan dan pembungaan tanaman H. diversifolia
Bl. Intensitas cahaya tidak berpengaruh nyata terhadap parameter tinggi tanaman, jumlah daun, luas daun, dan jumlah tunas generatif H. diversifolia Bl. Tebal daun
©
Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungiPEMUPUKAN TERHADAP PERTUMBUHAN DAN
PEMBUNGAAN
Hoya diversifolia
Blume
SINTHO WAHYUNING ARDIE
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Nama : Sintho Wahyuning Ardie
NIM : A351040101
Program Studi : Agronomi
Disetujui
Komisi Pembimbing
Dr. Ir. Anas Dinurrohman Susila, MSi
Ketua
Prof. Dr. Ir. Didy Sopandie, MAgr
Anggota
Ir. Sri Rahayu, MSi
Anggota
Diketahui
Ketua Departemen Agronomi
Dr. Ir. Satriyas Ilyas, MS
Dekan Sekolah Pascasarjana
Dr. Ir. Khairil Anwar Notodiputro, MS
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan judul Pengaruh Intensitas Cahaya dan Pemupukan terhadap Pertumbuhan dan Pembungaan Hoya diversifolia Blume.
Pada kesempatan berbahagia ini penulis mengucapkan terima kasih kepada Dr. Ir. Anas Dinurrohman Susila, MSi selaku ketua komisi pembimbing atas bimbingan, arahan, kritikan, dan masukan selama penulisan proposal hingga penulisan tesis. Prof. Dr. Ir. Didy Sopandie, MAgr, dan Ir. Sri Rahayu, MSi, selaku anggota komisi pembimbing atas dorongan moril, motivasi, bimbingan yang sangat intensif, masukan dan diskusi selama penyusunan, pelaksanaan penelitian, dan penulisan tesis. Dr. Ir. Nurul Khumaida, MS selaku penguji luar komisi pembimbing atas kesediaan dalam meluangkan waktu untuk memberi saran dan masukan dalam ujian tesis. Terima kasih penulis ucapkan pada Dr. Ir. Satriyas Ilyas, MS (ketua PS pascasarjana Agronomi) yang telah memberikan saran-saran dan arahan sejak penulis diterima sebagai mahasiswa program pascasarjana IPB Program Studi Agronomi hingga selesai. Penulis ucapkan terima kasih yang sebesar-besarnya kepada Prof. Dr. Ir. Bambang S. Purwoko (Ketua Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB) yang telah memberikan banyak kemudahan bagi penulis untuk menyelesaikan pendidikan dan tesis selama 4 semester.
Terima kasih penulis ucapkan kepada Ir. Dorly, MSi dan Bapak Yadi atas bantuannya dalam membuat dan manganalisis preparat anatomi jaringan . Di samping itu penulis mengucapkan terima kasih banyak kepada Yudiansyah SSi, Bambang Hermawan, A.Ma., dan Joko Mulyono yang telah banyak berdiskusi dan memberi masukan selama bekerja di laboratorium Research Group for Crop Improvement dan laboratorium Ekofisiologi Tanaman , Departemen Agronomi dan Hortikultura. Terima kasih penulis ucapkan kepada Beginer Subhan SPi atas dukungan dan pengertiannya selama pelaksanaan penelitian in i. Kepada semua teman program studi Agronomi angkatan 2004 dan teman -teman terdekat, Neni
Penghargaan dan ungkapan terima kasih yang sedalam-dalamnya disampaikan kepada Mami, Papi, dan mas Inu serta seluruh keluarga, atas segala pengorbanan, semangat, doa dan kasih sayangnya.
Semoga Allah SWT mencatat kebaikan dari semua pihak dan memberikan balasan serta hidayah kepada kita sekalian. Akhirnya penulis berhadap semoga karya kecil ini dapat memberikan manfaat dalam memperkaya khasanah ilmu pengetahuan.
Bogor, Agustus 2006
Penulis dilahirkan pada tanggal 6 Juli 1982 di Samarinda, Kalimantan Timur dari ayah yang bernama Ir. Bambang Winarto, MM dan ibu Siti Aminah. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 2000 penulis lulus dari SMUN 1 Manado dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor melalui jalur USMI. Penulis memilih Program Studi Hortikultura, Jurusan Budidaya Pertanian, Fakultas Pertanian. Selama kuliah penulis bergabung dalam organisasi kemahasiswaan HIMAGRON dan aktif membantu berbagai mata kuliah dengan menjadi asisten praktikum.
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA Botani Tanaman H. diversifolia Bl ... 4
Pembungaan Tanaman ... 5
Pengaruh Intensitas Cahaya terhadap Pertumbuhan dan Pembungaan ... 6
Pengaruh Pemupukan terhadap Pertumbuhan dan Pembungaan ... 9
BAHAN DAN METODE Percobaan 1. Pengamatan Fase Perkembangan Organ Bunga H. diversifolia Bl. dan Perbedaan Kandungan Endogen ... 12 Percobaan 2. Pengaruh Intensitas Cahaya dan Pemupukan terhadap pertumbuhan dan Pembungaan H. diversifolia Bl. ... 13
HASIL DAN PEMBAHASAN Kondisi Umum Percobaan ... 16
Fase Perkembangan Organ Bunga... 17
Fase induksi dan perbedaan kandungan gula endogen... 17
Fase inisiasi awal... 20
Fase inisiasi lanjut... 20
Fase diferensiasi... 21
Fase pendewasaan bagian bunga dan anthesis... 22
Pengaruh Intensitas Cahaya dan Pemupukan terhadap pertumbuhan dan Pembungaan H. diversifolia Bl. ... 22
Pengaruh Intensitas Cahaya ... 24
Pengaruh Pemupukan tersarang dalam Intensitas Cahaya ... 35
PEMBUNGAAN
Hoya diversifolia
Blume
SINTHO WAHYUNING ARDIE
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan dengan sebenarnya bahwa tesis yang berjudul
Pengaruh Intensitas Cahaya dan Pemupukan terhadap Pertumbuhan dan
Pembungaan Hoya diversifolia Blume merupakan gagasan saya dan karya saya berserta komisi pembimbing belum pernah dipublikasikan dalam bentuk apapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2006
SINTHO WAHYUNING ARDIE
.
Pengaruh Intensitas Cahaya dan Pemupukan terhadap Pertumbuhan dan Pembungaan Hoya diversifolia Blume. Dibimbing oleh ANAS D. SUSILA, DIDY SOPANDIE dan SRI RAHAYU.Penelitian ini terdiri atas dua percobaan yang dilakukan di rumah naungan
University Farm, IPB, Darmaga, Bogor, mulai bulan Februari hingga Mei 2006. Tujuan percobaan I adalah untuk menentukan stadia perkembangan tunas generatif H. diversifolia Bl. secara morfologis dan anatomis dan mempelajari
hubungan antara kandungan gula endogen dengan induksi pembungaan
H. diversifolia Bl. Pengamatan morfologis menunjukkan bahwa perkembangan tunas generatif H. diversifolia Bl. meliputi fase induksi, inisiasi awal, insiasi lanjut, diferensiasi, pendewasaan bagian bunga, dan antesis. Kandungan gula total dan sukrosa tidak berbeda nyata antara pucuk yang terinduksi dan pucuk yang tidak terinduksi, tetapi kandungan gula tereduksi lebih tinggi pada pucuk
yang terinduksi (7.39 mg.g-1) dibanding pucuk yang tidak terinduksi
(4.14 mg.g-1).
Tujuan percobaan II adalah untuk mengetahui pengaruh intensitas cahaya dan pemupukan terhadap pertumbuhan dan pembungaan tanaman H. diversifolia
Bl. Intensitas cahaya tidak berpengaruh nyata terhadap parameter tinggi tanaman, jumlah daun, luas daun, dan jumlah tunas generatif H. diversifolia Bl. Tebal daun
©
Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungiPEMUPUKAN TERHADAP PERTUMBUHAN DAN
PEMBUNGAAN
Hoya diversifolia
Blume
SINTHO WAHYUNING ARDIE
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Nama : Sintho Wahyuning Ardie
NIM : A351040101
Program Studi : Agronomi
Disetujui
Komisi Pembimbing
Dr. Ir. Anas Dinurrohman Susila, MSi
Ketua
Prof. Dr. Ir. Didy Sopandie, MAgr
Anggota
Ir. Sri Rahayu, MSi
Anggota
Diketahui
Ketua Departemen Agronomi
Dr. Ir. Satriyas Ilyas, MS
Dekan Sekolah Pascasarjana
Dr. Ir. Khairil Anwar Notodiputro, MS
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan judul Pengaruh Intensitas Cahaya dan Pemupukan terhadap Pertumbuhan dan Pembungaan Hoya diversifolia Blume.
Pada kesempatan berbahagia ini penulis mengucapkan terima kasih kepada Dr. Ir. Anas Dinurrohman Susila, MSi selaku ketua komisi pembimbing atas bimbingan, arahan, kritikan, dan masukan selama penulisan proposal hingga penulisan tesis. Prof. Dr. Ir. Didy Sopandie, MAgr, dan Ir. Sri Rahayu, MSi, selaku anggota komisi pembimbing atas dorongan moril, motivasi, bimbingan yang sangat intensif, masukan dan diskusi selama penyusunan, pelaksanaan penelitian, dan penulisan tesis. Dr. Ir. Nurul Khumaida, MS selaku penguji luar komisi pembimbing atas kesediaan dalam meluangkan waktu untuk memberi saran dan masukan dalam ujian tesis. Terima kasih penulis ucapkan pada Dr. Ir. Satriyas Ilyas, MS (ketua PS pascasarjana Agronomi) yang telah memberikan saran-saran dan arahan sejak penulis diterima sebagai mahasiswa program pascasarjana IPB Program Studi Agronomi hingga selesai. Penulis ucapkan terima kasih yang sebesar-besarnya kepada Prof. Dr. Ir. Bambang S. Purwoko (Ketua Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB) yang telah memberikan banyak kemudahan bagi penulis untuk menyelesaikan pendidikan dan tesis selama 4 semester.
Terima kasih penulis ucapkan kepada Ir. Dorly, MSi dan Bapak Yadi atas bantuannya dalam membuat dan manganalisis preparat anatomi jaringan . Di samping itu penulis mengucapkan terima kasih banyak kepada Yudiansyah SSi, Bambang Hermawan, A.Ma., dan Joko Mulyono yang telah banyak berdiskusi dan memberi masukan selama bekerja di laboratorium Research Group for Crop Improvement dan laboratorium Ekofisiologi Tanaman , Departemen Agronomi dan Hortikultura. Terima kasih penulis ucapkan kepada Beginer Subhan SPi atas dukungan dan pengertiannya selama pelaksanaan penelitian in i. Kepada semua teman program studi Agronomi angkatan 2004 dan teman -teman terdekat, Neni
Penghargaan dan ungkapan terima kasih yang sedalam-dalamnya disampaikan kepada Mami, Papi, dan mas Inu serta seluruh keluarga, atas segala pengorbanan, semangat, doa dan kasih sayangnya.
Semoga Allah SWT mencatat kebaikan dari semua pihak dan memberikan balasan serta hidayah kepada kita sekalian. Akhirnya penulis berhadap semoga karya kecil ini dapat memberikan manfaat dalam memperkaya khasanah ilmu pengetahuan.
Bogor, Agustus 2006
Penulis dilahirkan pada tanggal 6 Juli 1982 di Samarinda, Kalimantan Timur dari ayah yang bernama Ir. Bambang Winarto, MM dan ibu Siti Aminah. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 2000 penulis lulus dari SMUN 1 Manado dan pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor melalui jalur USMI. Penulis memilih Program Studi Hortikultura, Jurusan Budidaya Pertanian, Fakultas Pertanian. Selama kuliah penulis bergabung dalam organisasi kemahasiswaan HIMAGRON dan aktif membantu berbagai mata kuliah dengan menjadi asisten praktikum.
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA Botani Tanaman H. diversifolia Bl ... 4
Pembungaan Tanaman ... 5
Pengaruh Intensitas Cahaya terhadap Pertumbuhan dan Pembungaan ... 6
Pengaruh Pemupukan terhadap Pertumbuhan dan Pembungaan ... 9
BAHAN DAN METODE Percobaan 1. Pengamatan Fase Perkembangan Organ Bunga H. diversifolia Bl. dan Perbedaan Kandungan Endogen ... 12 Percobaan 2. Pengaruh Intensitas Cahaya dan Pemupukan terhadap pertumbuhan dan Pembungaan H. diversifolia Bl. ... 13
HASIL DAN PEMBAHASAN Kondisi Umum Percobaan ... 16
Fase Perkembangan Organ Bunga... 17
Fase induksi dan perbedaan kandungan gula endogen... 17
Fase inisiasi awal... 20
Fase inisiasi lanjut... 20
Fase diferensiasi... 21
Fase pendewasaan bagian bunga dan anthesis... 22
Pengaruh Intensitas Cahaya dan Pemupukan terhadap pertumbuhan dan Pembungaan H. diversifolia Bl. ... 22
Pengaruh Intensitas Cahaya ... 24
Pengaruh Pemupukan tersarang dalam Intensitas Cahaya ... 35
ii
Saran ... 49 DAFTAR PUSTAKA ... 50
iii
1 Rata-rata intensitas cahaya dan persen naungan aktual pada bulan
Februari – Mei 2006 ... 16
2 Kandungan gula pada buku Hoya diversifolia Bl. ... 19
3 Rekapitulasi sidik ragam pengaruh intensitas cahaya dan pemupukan
terhadap karakter agronomi dan fisiologi tanaman H. diversifolia Bl. 23
4 Pengaruh intensitas cahaya terhadap tinggi tanaman H. diversifolia Bl. 24
5 Pengaruh intensitas cahaya terhadap jumlah buku H. diversifolia Bl. 25
6 Pengaruh intensitas cahaya terhadap jumlah daun H. diversifolia Bl. 25
7 Pengaruh intensitas cahaya terhadap warna dan kandungan klorofil
daun H. diversifolia Bl. pada 14 MSP ... 26
8 Pengaruh intensitas cahaya terhadap luas dan tebal daun H. diversifolia
Bl. pada 14 MSP ... 28
9 Pengaruh intensitas cahaya terhadap stomata daun H. diversifolia Bl.
pada 14 MSP ... 32
10 Pengaruh intensitas cahaya terhadap jumlah tunas generatif H.
diversifolia Bl. pada 14 MSP ... 33
11 Pengaruh intensitas cahaya terhadap kandungan NPK jaringan tanaman
H. diversifolia Bl. pada 14 MSP ... 34
12 Pengaruh pemupukan terhadap tinggi tanaman H. diversifolia Bl. ... 35
13 Pengaruh pemupukan terhadap jumlah buku H. diversifolia Bl. ... 36
14 Pengaruh pemupukan terhadap jumlah daun H. diversifolia Bl. ... 37
15 Pengaruh pemupukan terhadap luas dan tebal daun H. diversifolia Bl.
pada 14 MSP ………. 37
16 Pengaruh pemupukan terhadap warna dan kandungan klorofil daun H.
diversifolia Bl. pada 14 MSP ... 39
17 Pengaruh pemupukan terhadap jumlah tunas generatif H. diversifolia
iv
19 Pengaruh pemupukan terhadap kandungan NPK jaringan tanaman H.
v
1 H. diversifolia Bl.; A. Individu bunga; B. Bunga majemuk berbentuk
umbell; C. Daun ... 4
2 Spektrum cahaya yang dapat diserap oleh pigmen tanaman
(photosynthetically active radiation/ PAR) ... 7
3 Morfologi dan anatomi buku H. diversifolia Bl. sebelum dan pada fase induksi bunga ... 18
4 Morfologi dan anatomi buku H. diversifolia Bl. pada fase inisiasi awal 20
5 Morfologi dan anatomi buku H. diversifolia Bl. pada fase inisiasi lanjut 21
6 Morfologi dan anatomi buku H. diversifolia Bl. pada fase diferensiasi... 21
7 Morfologi bunga H. diversifolia Bl. pada fase pendewasaan bagian
bunga... 22
8 Standar warna hijau FHK Chlorophyl tester, CT-102 (Fujihira Industry Co.Ltd)... 27
9 Penampakan anatomi daun H. diversifolia Bl. secara melintang pada
perbesaran 400X ... 29
10 Penampakan anatomi daun H. diversifolia Bl. secara melintang pada
itensitas cahaya yang berbeda ... 30
11 Perbandingan pola distribusi stomata pada permukaan epidermis bawah daun H. diversifolia Bl. pada perbesaran 1000X... 31
12 Penampakan anatomi daun H. diversifolia Bl. secara melintang pada
perlakuan pemupukan ... 38
vi
Halaman
1. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap tinggi tanaman Hoya diversifolia Bl. ... 57 2. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap jumlah daun Hoya diversifolia Bl. ... 59 3. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap jumlah buku Hoya diversifolia Bl. ... 61 4. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap warna daun Hoya diversifolia Bl. ... 63 5. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap kandungan klorofil daun Hoya diversifolia Bl. ... 63 6. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap tebal dan luas daun Hoya diversifolia Bl. ... 63 7. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap jumlah tunas generatif Hoya diversifolia Bl. ... 64 8. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap stomata daun Hoya diversifolia Bl. ... 65 9. Sidik ragam pengaruh intensitas cahaya (I) dan pemupukan (P)
terhadap kandungan NPK jaringan tanaman Hoya diversifolia Bl... 66 10. Metode pembuatan preparat anatomi jaringan ... 67
11. Komposisi pupuk yang digunakan dalam penelitian... 68 12. Metode Anthrone untuk penetapan gula total (Apriyantono et al. 1989) 69 13. Metode Nelson-Somogyi untuk penetapan gula pereduksi (Sudarmadji
et al. 1984) ... 70 14. Metode analisis klorofil a dan b (Arnon 1949) ... 71 15. Metode penetapan n itrogen total (Metode Kjeldahl) ... 72 16. Metode penetapan P dan K pada tanaman. ... 73 17. Matriks korelasi antara parameter agronomi dan fisiologi pada
perlakuan intensitas cahaya dan pemupukan ... 74
Industri tanaman hias berkembang pesat dewasa ini. Nilai impor bunga potong dan tanaman hias meningkat 98.64% pada tahun 2005 dibanding nilai impor pada tahun 2001, yaitu dari US$ 604 921 menjadi US$ 1 201 599 (BPS 2006). Kebanyakan tanaman hias yang dikembangkan adalah spesies introduksi dari daerah sub tropis. Spesies-spesies introduksi tersebut memerlukan perlakuan khusus agar dapat beradaptasi dengan lingkungan tropis. Krisan misalnya, memerlukan panjang hari tertentu agar dapat berbunga, dan mawar potong hanya dapat diusahakan pada daerah dengan ketinggian tertentu. Di lain pihak, pasar tanaman hias mancanegara mulai marak dengan jenis tanaman hias eksotik. Indonesia merupakan pusat keragaman banyak spesies tanaman, dan diantaranya memiliki potensi untuk dikembangkan sebagai tanaman hias.
Marga Hoya dari famili Asclep iadaceae merupakan salah satu tanaman asli Indonesia yang memiliki potensi untuk dikembangkan sebagai tanaman hias. Sekitar 32 jenis Hoya Indonesia telah dikoleksi dan dikonservasikan di Kebun Raya Bogor (Rahayu 1999). Di pasar internasional Hoya dapat dijual dengan harga berkisar US$ 3.75 – 30.00 untuk satu setek tanpa akar sepanjang dua ruas (8-10 cm) (Winn 2005), sedangkan di dalam negeri Hoya belum banyak dikenal. Potensi Hoya terletak pada bentuk bunganya yang indah dan beraroma harum (Griffiths 1994). Sebagai tanaman asli Indonesia , Hoya mudah tumbuh dan diperbanyak, relatif bebas serangan hama dan penyakit serta tidak memerlukan budidaya yang intensif.
Hoya diversifolia Bl. adalah jenis Hoya yang memiliki bunga menarik dengan korola berwarna merah muda yang lembut (warna dadu) dan korona berwarna senada namun lebih tua (Rahayu 1998). Tanaman tersebut memiliki potensi untuk dikembangkan menjadi bunga potong karena memiliki tandan bunga berurutan di ujung percabangan dan memiliki bunga dalam jumlah banyak (20-30 per tandan; 5-20 tandan per tangkai) (Rahayu 2001 ).
terbentuk pada akhir musim hujan (Februari-Maret) dan memiliki jumlah bunga mekar terbanyak pada bulan April dan Mei.
Pembungaan pada tanaman dapat dipengaruhi oleh faktor endogen , seperti umur dan ukuran tanaman. Tanaman yang pembungaannya sangat ditentukan oleh faktor endogen dan tidak membutuhkan kondis i lingkungan tertentu untuk berbunga disebut sebagai autonomous flowering plants. Berlawanan dengan kelompok autonomous flowering plants, beberapa spesies membutuhkan kondisi lingkungan spesifik untuk dapat berbunga. Pada beberapa spesies tanaman lainnya, selain ditentukan oleh faktor endogen, pembungaan tanaman juga diregulasi oleh kondisi lingkungan (Taiz dan Zeiger 2002). Hoya adalah tanaman yang pembungaannya diduga ditentukan baik oleh faktor endogen maupun faktor lingkungan karena menurut Baudendis tel (1979) Hoya tidak akan berbunga hingga mencapai ukuran dan umur tertentu, dan menurut Rahayu (1998) pembungaan H. diversifolia sangat dipengaruhi oleh musim.
Salah satu faktor endogen yang dapat meregulasi pembungaan tanaman adalah gula. Gula berperan penting sebagai molekul penerima sinyal yang meregulasi berbagai macam gen dan dapat mempengaruhi berbagai aspek perkembangan dalam tanaman tingkat tinggi termasuk pembungaan. Pada tanaman Sinapis alba, konsentrasi sukrosa dalam floem yang menuju apeks pucuk meningkat secara cepat setelah terjadi induksi pembungaan (Bernier et al. 1993). Dengan demikian, peran gula sebagai salah satu faktor endogen yang dapat mempengaruhi pembungaan H. diversifolia Bl. perlu dipelajari lebih lanjut. Selain perubahan metabolisme pada pucuk yang dicerminkan oleh konsentrasi kandungan gula atau hormon (Bernier et al. 1993; Taiz dan Zeiger 2002), peralihan pucuk vegetatif ke generatif umumnya disertai laju pembelahan sel yang lebih tinggi (Kinet et al. 1985b) dan berakibat pada perubahan struktur yang sangat kecil pada pucuk. Menurut Lang (1987), perubahan biokimia pada saat terjadi induksi bunga tidak menyebabkan terjadinya manifestasi secara morfologis, sehingga perlu diamati melalui pengamatan anatominya.
Periode berbunga H. diversifolia Bl. yang secara alami hanya terjadi pada peralihan musim menunjukkan bahwa faktor lingkungan pada saat peralihan musim tersebut memiliki kemungkinan mempengaruhi induksi pembungaan
saat peralihan musim. Pengaruh intensitas cahaya terhadap pembungaan beberapa spesies tanaman disampaikan oleh Kinet et al. (1985a), yaitu terjadinya penghambatan antesis pada bunga mawar Baccara dan tomat akibat intensitas cahaya rendah, serta meningkatnya pembentukan bunga azalea pada intensitas cahaya tinggi. Menurut Taiz dan Zeiger (2002), tanaman yang tumbuh pada kondisi intensitas cahaya rendah mengalami fase juvenil yang lebih lama atau kembali menjadi juvenil. Ketersediaan hara merupakan faktor lingkungan lain yang dapat mempengaruhi pertumbuhan dan memiliki peluang menginduksi pembungaan tanaman. H. diversifolia Bl merupakan tanaman epifit yang pada habitat aslinya tidak memperoleh cukup hara. Kinet et al. (1985a) menyatakan bahwa pada beberapa spesies nitrogen meningkatkan laju perkembangan bunga dan jumlah bunga yang terbentuk, kekurangan kalium mengakibatkan ukuran bunga mawar yang lebih kecil bahkan gagal mekar, dan kekurangan fosfor menunda anthesis pada tomat. Oleh karena itu, peran intensitas cahaya dan pemupukan sebagai faktor lingkungan dalam pertumbuhan dan pembungaan
H. diversifolia Bl. perlu dipelajari lebih lanjut.
Setelah terinduksi, tahap perkembangan organ bunga selanjutnya merupakan proses yang tidak kalah pentingnya. Pucuk yang telah terinduksi untuk berbunga dapat mengalami kegagalan membentuk bunga yang normal bahkan gugur akibat berbagai faktor. Tahap-tahap perkembangan organ bunga
H. diversifolia Bl. belum terdokumentasikan dengan baik, sehingga belum tersedia informasi yang dapat menjadi acuan tahapan perkembangan bunga pada spesies ini. Dengan demikian penentuan stadia perkembangan organ bunga pada
H. diversifolia Bl. perlu dilakukan, baik secara morfologi maupun anatomi.
Tujuan Pene litian
Tujuan penelitian ini adalah (1) menentukan stadia perkembangan tunas generatif H. diversifolia Bl. secara morfologis dan anatomis , (2) mempelajari hubungan antara kandungan gula endogen dengan pembungaan H. diversifolia
Marga Hoya (Asclepiadaceae) merupakan tanaman tropis dengan pusat keragaman tertinggi di Semenanjung Malaysia, Indonesia, Filipina, dan Papua Nugini (Goyder 1990). Terdapat sekitar 200 spesies Hoya yang batas-batas penyebarannya meliputi Bagian Selatan Himalaya, Bagian Selatan Cina dan Jepang, Kepulauan Fiji, Kepuluan Samoa, Bagian Tropis dari Austr alia, hingga Madagaskar. H. diversifolia Bl. merupakan Hoya yang terdapat di hampir semua habitat Hoya, terutama di Indonesia, Filipina dan Malaysia (Burton 1992).
Gambar 1. H. diversifolia Bl.; A. Individu bunga ; B. Bunga majemuk berbentuk umbell; C. Daun. Sumber: Koleksi Sri Rahayu.
Tumbuhan ini merupakan tumbuhan epifit merambat dengan daun tebal (sukulen). Seluruh permukaan tumbuhan dilapisi lilin dan menghasilkan getah putih seperti susu. Daunnya terletak berhadapan, berbentuk bulat telur terbalik seperti ditunjukkan oleh Gambar 1C. Bunganya merupakan bunga majemuk yang tersusun dalam tandan berbentuk payung (umbell) (Gambar 1B). Gambar 1A menunjukkan masing-masing kuntum yang berbentuk bintang dan mempunyai ornamen tambahan (korona) yang juga berbentuk bintang. Korola pada bunga H. diversifolia Bl. memiliki warna merah muda yang lembut (warna dadu) dan permukaannya seperti beludru, sedangkan koronanya mempunyai warna senada yang lebih tua, terkesan padat seperti lilin (Rahayu 1998).
Organ reproduktif bunga Hoya terdiri atas putik dan benang sari yang tersusun dalam satu badan bunga yang disebut gynostemium. Stigma melebar berbentuk persegi lima dan terletak di tengah korona. Benang sari memadat membentuk struktur yang disebut pollinia. Setiap kuntum individu bunga
memiliki lima pasang pollinia. Struktur pollinia terdiri atas korpuskulum, yaitu alat melekatnya badan sari pada masing-masing sudut kepala gynostemium dan
translator aparatus yaitu tangkai sari yang menghubungkan setiap pasang pollinia
(Rahayu 2001).
Pembungaan Tanaman
Pembungaan pada tanaman dapat dipengaruhi oleh faktor endogen, seperti umur dan ukuran tanaman. Tanaman yang pembungaannya sangat ditentukan oleh faktor endogen dan tidak membutuhkan kondisi lingkungan tertentu untuk berbunga disebut sebagai autonomous flowering plants. Berlawanan dengan kelompok autonomou s flowering plants, beberapa spesies membutuhkan kondisi lingkungan spesifik untuk dapat berbunga, misalnya panjang hari, kualitas cahaya, intensitas cahaya, vernalisasi, serta ketersediaan hara dan air (Taiz dan Zeiger 2002). Studi fisiologi telah menghasilkan tiga model utama untuk menjelaskan pembungaan tanaman, yaitu konsep florigen/ anti-florigen, hipotesis penyebaran nutrisi (nutrient diversion hypothesis), dan model kendali oleh multi-faktor (multifactorial control model) (Bernier et al. 1993; Levy dan Dean 1998).
stimulus tersebut ke apeks pucuk melalui floem. Stimulus tersebut kemudian diberi nama florigen.
Bukti bahwa florigen diproduksi di daun ditunjukkan oleh penelitian defoliasi pada tanaman SDP Xanthium (Salisbury 1963). Bila daun dipotong segera setelah perlakuan SD, tanaman tetap vegetatif karena florigen belum dikirim dari daun. Florigen akan ditranslokasi dalam beberapa jam setelah perlakuan SD, yang ditunjukkan dengan berbunganya tanaman bila defoliasi dilakukan beberapa jam setelah perlakuan SD.
Sampai saat ini florigen belum berhasil diisolasi dan diindetifikasi. Kegagalan dalam mengisolasi dan mengidentifikasi florigen menyebabkan ban yak peneliti beralih pada model ke dua, yaitu. nutrient diversion hypothesis. Dalam konsep nutrient diversion dinyatakan bahwa pada induksi pembungaan, faktor lingkungan menyebabkan peningkatan jumlah asimilat yang bergerak ke meristem apikal. Peningkatan asimilat pada meristem apikal akan menyebabkan induksi pembungaan.
Pendapat bahwa asimilat merupakan satu-satunya hal penting dalam induksi pembungaan dalam nutrient diversion hypothesis disanggah oleh
multifactorial control model. Dalam model terakhir, terdapat sejumlah senyawa kimia, termasuk asimilat (sukrosa dan Ca2+) dan fitohormon (gib erelin, auksin, dan sitokinin), terlibat dalam induksi pembungaan.
Pengaruh Intensitas Cahaya Terhadap Pertumbuhan dan Pembungaan
Cahaya matahari merupakan unsur iklim yang sangat berperan bagi pertumbuhan tanaman melalui proses fotosintesis. Tiga fak tor utama radiasi yang penting bagi tanaman yaitu kuantitas (intensitas), kualitas, dan periode lama penyinaran. Intensitas adalah jumlah energi yang diterima tanaman pada luasan dan jangka waktu tertentu. Radiasi berpengaruh terhadap laju pertumbuhan, laju transpirasi dan periode kritis dalam pertumbuhan (Squire 1993).
oleh daun) memiliki terlalu banyak energi sehin gga akan menyebabkan ionisasi dan kerusakan pigmen. Hanya foton dengan panjang gelombang antara 390 – 760 nm (photosynthetically active radiation/ PAR) yang memiliki energi yang cocok untuk fotosintesis (Gardner et al. 1991).
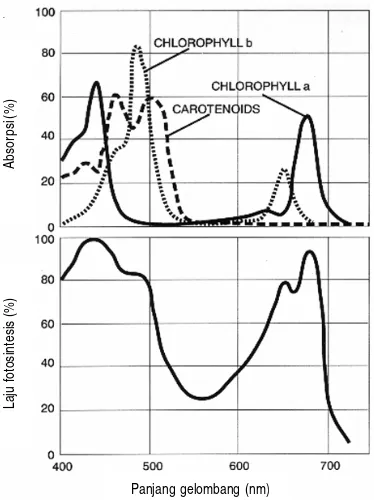
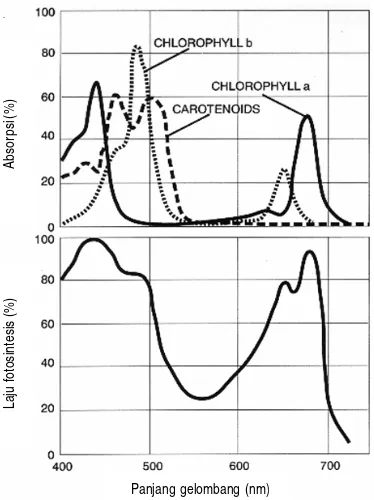
[image:32.612.225.412.339.589.2]Dalam proses fotosintesis, energi cahaya dikonversi ke molekul lebih tinggi (ATP) dan NADPH, terjadi di dalam pigmen atau kompleks protein yang menempel pada membran tilakoid yang terletak pada kloroplas. Pigmen tanaman yang meliputi klorofil a, klorofil b, dan karotenoid termasuk xantofil menyerap PAR terbaik pada panjang gelombang tertentu (Gambar 2). Klorofil a menyerap cahaya tertinggi pada kisaran panjang gelombang 420 nm dan 660 nm. Klorofil b menyerap cahaya paling efektif pada panjang gelombang 440 dan 640 nm, sedangkan karotenoid termasuk xanthofil mengabsorpsi cahaya pada pada panjang gelombang 425 dan 470 nm (Salisbury dan Ross 1992).
Gambar 2. Spektrum cahaya yang dapat diserap oleh pigmen tanaman, biasa disebut photosynthetically active radiation (PAR) (Salisbury dan Ross 1992).
PAR dikelompokan menjadi dua bagian berdasarkan kisaran panjang gelombang yang diserap pigmen tanaman yaitu panjang gelombang aktivitas tinggi (400-500 nm) kelompok cahaya biru, dan panjang gelombang aktif rendah
Panjang gelombang (nm)
Laju fotosintesis (%)
Absorpsi
(600-700 nm) kelompok cahaya merah (respon fitokrom). Cahaya merah (respon fitokrom) aktif untuk induksi fotoperiodisitas pembungaan, perkembangan kloroplas (tidak termasuk sintesis klorofil), penuaan (senescence) daun dan abisisi daun. Sedangkan PAR dari 500 -600 nm, kelompok cahaya hijau, tergolong tidak aktif untuk fotosintesis. Cahaya merah jauh (far-red) dengan panjang gelombang 700-800 nm juga tidak aktif untuk fotosintesis tetapi banyak mempengaruhi fotomorfogenesis (Grant 1997). Menurut Salisbury dan Ross (1992); Grant (1997), cahaya dengan panjang gelombang lebih pendek akan menghasilkan energi foton yang lebih besar dari pada cahaya dengan panjang gelombang lebih panjang. Adanya naungan dapat menyebabkan rendahnya foton yang dapat diserap (Neff, Frankhauser dan Chory 2000).
Pengaruh Intensitas Cahaya terhadap Tanaman
Intensitas cahaya dapat mempengaruhi proses metabolisme dalam tanaman. Intensitas cahaya rendah pada umumnya disebabkan oleh naungan. Spesies tanaman yang memiliki habitat ternaung (shade plant) memiliki laju fotosintesis yang lebih rendah, titik kompensasi cahaya yang rendah, serta respon fotosintesisnya mencapai jenuh pada tingkat radiasi yang lebih rendah dibanding spesies yang memiliki habitat di daerah terbuka (sun plant). Nilai kejenuhan cahaya tanaman shade plant lebih rendah karena laju respirasi pada shade plant
sangat rendah, sehingga dengan sedikit saja fotosintesis netto yang dihasilkan sudah cukup membuat laju pertukaran netto CO2 menjadi nol. Laju respirasi yang
rendah menunjukkan bentuk adaptasi dasar yang memungkinkan tanaman shade plant mampu bertahan pada lingkungan cahaya terbatas (Salisbury dan Ross 1992).
berubah sesuai dengan kondisi cahaya, yang menyebabkan tanaman menjadi efisien dalam menyimpan energi cahaya untuk perkembangannya. Peran yang kontras antara sel palisade dan sel bunga karang, yaitu sel palisade dapat menyebabkan cahaya lewat dan sel bunga karang menangkap cahaya sebanyak mungkin, menyebabkan absorbsi cahaya yang lebih seragam di dalam daun (Taiz and Zeiger 1991). Daun yang ternaungi memiliki total klorofil tiap pusat reaksi yang lebih banyak, memiliki rasio klorofil b/a lebih besar dan biasanya lebih tipis. Sel palisade daun yang ternaungi lebih pendek daripada daun yang terkena cahaya penuh dan konsentrasi rubisco lebih sedikit (Taiz and Zeiger 2002).
Pengaruh Intensitas Cahaya terhadap Pembungaan
Salah satu proses perkembangan tanaman yang dipengaruhi oleh intensitas cahaya adalah pembungaan. Tumbuhan tingkat tinggi mengalami beberapa fase perkembangan, yang terjadi pada suatu area dinamis yang disebut tunas meristem apikal. Selama perkembangan post-embryonic, tunas meristem apikal mengalami beberapa fase perkembangan dengan urutan: 1. fase juvenil, 2. fase vegetatif dewasa, dan 3. fase reproduktif dewasa. Transisi dari suatu fase ke fase lainnya disebut dengan perubahan fase. Transisi dari fase vegetatif dewasa ke fase reproduktif disebut sebagai pembungaan. Tanaman yang tumbuh pada kondisi intensitas cahaya rendah mengalami fase juvenil yang lebih lama atau kembali menjadi juvenil (Taiz dan Zeiger 2002). Pengaruh intensitas cahaya terhadap pembungaan beberapa spesies tanaman disampaikan oleh Kinet et al. (1985a), yaitu terjadinya penghambatan antesis pada bunga mawar Baccara dan tomat akibat intensitas cahaya rendah, serta meningkatnya pembentukan bunga azalea pada intensitas cahaya tinggi. Penyebab utama yang mungkin adalah bahwa intensitas cahaya yang rendah mengurangi suplai karbohidrat ke apeks, padahal karbohidrat, terutama sukrosa, memegang peranan penting dalam transisi juvenil ke dewasa (Taiz dan Zeiger 2002).
.
Pengaruh Pemupukan Terhadap Pertumbuhan dan Pembungaan
cukup dan seimbang merupakan faktor penting dalam menjamin pertumbuhan tanaman yang baik. Pemupukan diperlukan untuk menambah unsur hara dalam tanah atau media tanam agar diperoleh pertumbuhan dan produksi tanaman yang baik (Murni dan Faodji 1990). Studi mengenai hara tanaman telah menunjukkan bahwa mineral tertentu bersifat esensial bagi pertumbuhan dan perkembangan tanaman, dan diklasifikasikan sebagai unsur hara makro dan mikro tergantung pada jumlahnya dalam jaringan tanaman. Nitrogen (N), fosfor (P), kalium (K), kalsium (Ca), magnesium (Mg), dan sulfur (S) diperlukan tanaman dalam jumlah banyak sehingga disebut unsur hara makro. Unsur besi (Fe), mangan (Mn), tembaga (Cu), seng (Zn), boron (B), molibdenum (Mo), dan khlor (Cl) digunakan dalam jumlah sedikit sehingga disebut unsur hara mikro (Marschner 1995).
Tiap unsur hara memegang peranan penting dalam tanaman, yaitu menjadi bagian dari senyawa karbon (N dan S), berperan dalam menyimpan energi dan mempertahankan kesatuan struktur tanaman (P, Si, dan B), tetap dalam bentuk ion sebagai penyeimbang turgor, bagian dari enzim dan koenzim (K, Ca, Mg, Cl, Mn, dan Na), serta terlibat dalam reaksi redoks (Fe, Zn, C u, Ni, dan Mo). Hara dalam jumlah yang cukup dapat mendukung pertumbuhan dan perkembangan tanaman, sebaliknya kekurangan dan kelebihan hara dapat menyebabkan pertumbuhan dan perkembangan tanaman yang tidak normal (Taiz dan Zeiger 2002).
Ketersediaan hara bagi tanaman sangat dipengaruhi pH media tanam. Menurut Diatloff (1998), pH merupakan singkatan dari Pandus hydrogenii
(potential hydrogen) yaitu nilai (dari 1 sampai 14) yang menunjukkan sifat asam atau basa dari suatu larutan. Pertama kali diperkenalkan oleh ilmuwan asal Belanda, S. P. L. Sorensen pada tahun 1909 untuk menjelaskan konsentrasi ion-ion hidrogen yang berukuran sangat kecil. Nelson (1998) menyatakan bahwa ketersediaan semua nutrisi penting dalam media tanpa tanah berada pada kisaran nilai pH 5.4 – 6.0. Rendahnya pH menyebabkan peningkatan kandungan Fe, Mg, dan Al terlarut, dan menurunkan ketersediaan Ca, Mg, S, dan Mo. Pada pH tinggi, sebaliknya terjadi penurunan ketersediaan P, Fe, Mg, Zn, Cu, dan B.
Hantar Listrik (DHL) adalah nilai yang menunjukkan kadar garam dalam suatu larutan (Morgan 2000). Perubahan EC dalam suatu larutan berbanding lurus dengan banyaknya unsur hara yang terkandung dalam larutan nutrisi. Semakin banyak unsur hara yang terkandung dalam larutan nutrisi, maka nilai EC akan semakin tinggi (Permatasari 2001). Nilai EC akan semakin menurun dengan bertambahnya ukuran tanaman karena terjadinya penyerapan unsur hara oleh tanaman (Roan 1998).
Nitrogen (N), fosfor (P), dan kalium (K), merupakan unsur yang dibutuhkan dalam jumlah tinggi oleh tanaman. Nitrogen merupakan komponen penyusun asam amino, protein, nukleotida, klorofil, dan koenzim. Fosfor berperan dalam pembentukan senyawa berenergi tinggi (ATP dan ADP), asam nukleat, dan fosforilasi gula. Kalium memegang peranan penting sebagai kofaktor enzim dan pembukaan stomata. Bila unsur-unsur tersebut tidak tersedia dalam jumlah cukup dalam tanah atau media tanam, maka perlu dilakukan pemupukan. Pemupukan adalah upaya menambahkan unsur hara ke dalam tanah atau media tanam dalam rangka mendukung pertumbuhan dan perkembangan tanaman (Briggs dan Calvin 1987).
Bahan tanaman yang digunakan adalah 400 stek satu ruas (10 – 15 cm) batang H. diversifolia Bl. dari klon yang sama dan d iperoleh dari Kebun Raya Bogor. Stek ditanam dalam pot plastik hitam berdiameter 20 cm dengan media tanam campuran arang dan kompos yang sudah disterilisasi dengan perbandingan 1:2 pada bulan Juni 2005 dan dipelihara di bawah naungan 75%, di University Farm, IPB. Jumlah tanaman per pot adalah satu tanaman. Penyiraman dilakukan setiap dua hari sekali dengan volume siram 100 ml per pot untuk menjaga kelembaban media tanam. Pengendalian hama dan gulma dilakukan secara manual dan secara kimiawi.
Percobaan I. Pengamatan fase perkembangan organ bunga dan perbedaan kandungan gula endogen
Tujuan percobaan ini adalah untuk menentukan stadia perkembangan tunas generatif H. diversifolia Bl. secara morfologis dan anatomis dan mempelajari hubungan antara kandungan gula endogen dengan induksi pembungaan H. diversifolia Bl.
Bahan tanaman yang digunakan dalam percobaan I adalah 20 tanaman
Percobaan II. Pengaruh intensitas cahaya dan pemupukan terhadap pertumbuhan dan pembungaan H. diversifolia Bl.
Tujuan percobaan ini adalah untuk mengetahui pengaruh intensitas cahaya
dan pemupukan terhadap pertumbuhan dan pembungaan tanaman
H. diversifolia Bl.
Percobaan II disusun dengan menggunakan rancangan acak lengkap dengan rancangan perlakuan Rancangan Tersarang (Nested Design). Faktor pemupukan (dipupuk dan tidak dipupuk) tersarang dalam tiga taraf intensitas cahaya (28.2, 17.8, dan 10.2 Klux, setara dengan naungan 0%, 37%, dan 64%) sehingga terdapat 6 kombinasi perlakuan. Intensitas cahaya 17.8 dan 10.2 Klux diperoleh dengan menggunakan paranet 25% dan 55%. Tiap perlakuan terdiri atas 3 ulangan dan tiap unit percobaan terdiri atas satu pot tanaman berumur 8 bulan dan memiliki 2 buku serta 6 – 8 daun. Pemupukan dilakukan menggunakan pupuk N-P2O5-K2O (20-20-20) setiap dua hari sekali sesuai dengan jadwal
penyiraman, dengan konsentrasi 6 g.l-1 dan dosis 100 ml per pot. Setelah 2 bulan perlakuan pemupukan dilakukan menggunakan pupuk N-P2O5-K2O (6-30-30).
Pengamatan pertumbuhan dilakukan terhadap parameter agronomi dan parameter fisiologi, sedangkan pengamatan kondisi lingkungan dilakukan pada parameter suhu dan kelembaban relatif lingkungan dan intensitas cahaya.
A. Parameter agronomi. Pengamatan dilakukan seminggu sekali setelah perlakuan naungan dan pemupukan, sampai akhir pengamatan (1 4 minggu setelah perlakuan/ MSP), kecuali parameter luas daun dan warna daun yang hanya dilakukan pada akhir pengamatan.
1. Tinggi tanaman. Diukur dari batas kemunculan tunas pertama sampai titik tumbuh paling tinggi.
2. Jumlah daun. Pengamatan jumlah daun dilakukan dengan menghitung jumlah daun yang telah membuka sempurna dengan panjang minimal 2 cm.
3. Jumlah buku.
5. Warna daun. Pengamatan warna daun dilakukan pada daun yang terletak pada buku ke-2 menggunakan FHK Chlorophyll tester CT-102 (Fujihira industry Co.Ltd).
6. Jumlah tunas generatif per tanaman. Pengamatan jumlah tunas generatif dilakukan dengan menghitung jumlah tunas generatif yang telah mencapai stadium I (fase induksi).
B. Parameter fisiologi. Pengamatan dilakukan pada akhir pengamatan (14 MSP).
1. Ketebalan daun. Diukur dari preparat yang dibuat dengan metode Sass (1951). Pengamatan dan pengukuran dilakukan dengan menggunakan skala mikrometer pada daun paling muda yang telah membuka sempurna.
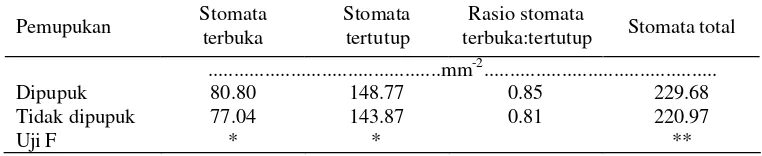
2. Kerapatan stomata dan rasio stomata yang membuka dan menutup. Dihitung dari preparat yang telah dibuat dari permukaan epidermis bawah. Preparat dibuat dengan cara melapisi permukaan bawah daun H. diversifolia Bl. pada pukul 10.00 dengan cat kuku bening, dan menempelkan lapisan cat kuku tersebut pada gelas ob jek menggunakan solatip. Jumlah stomata total, stomata terbuka, dan stomata tertutup diamati di bawah mikroskop dengan perbesaran 1000 kali.
3. Kandungan klorofil. Analisis kandungan klorofil a, b, dan klorofil total dilakukan dengan metode Arnon (1949) di Laboratorium RGCI (Research Group for Crop Improvement). Metode selengkapnya disajikan pada Lampiran 14.
C. Pengukuran data pendukung
1. Suhu dan kelembaban. Pengamatan ini dilakukan dengan mengukur suhu dan kelembaban setiap hari pada pukul 07.30, 12.30 dan 17.30. Pengukuran dilakukan dengan menggunakan thermo-hygrometer. Pengukuran suhu rata-rata harian dihitung dengan menggunakan rumus sebagai berikut (Handoko, 1993) :
2. Intensitas cahaya. Data intensitas cahaya dilakukan dengan mengukur intensitas cahaya di bawah naungan setiap satu minggu sekali dengan menggunakan light meter. Penetapan persen naungan dilakukan dengan mengukur intensitas cahaya di dalam naungan dan di luar naungan pada enam titik berbeda setiap satu bulan sekali pada pukul 10.00, 11.00, 12.00.
keterangan :
I : intensitas di dalam naungan D : intensitas di luar naungan
Analisis Data
Pengolahan data dilakukan dengan uji F pada sistem SAS (Statistical Analysis System) pada taraf 5%, jika terdapat pengaruh yang nyata maka uji dilanjutkan dengan Uji Jarak Berganda Duncan (Duncan’s Multiple Range Test).
% naungan = 100 % x ( 1 – I / D) Trata-rata harian = (( 2 T07.30 ) + T12.30 + T17.30 ) / 4
T07.30 = suhu pada pengamatan pukul 07.30
T12.30 = suhu pada pengamatan pukul 12.30
Penelitian ini menggunakan tiga taraf intensitas cahaya yaitu tanpa naungan, menggunakan naungan 25% dan 55%. Intensitas cahaya dan persentase naungan aktual selama perlakuan (Februari-Mei 2006) disajikan dalam Tabel 1.
Tabel 1. Rata-rata Intensitas Cahaya dan Persen tase Naungan Aktual pada Bulan Februari – Mei 2006
Naungan paranet (%)
Rata-rata intensitas cahaya (Klux)
Naungan aktual (%)
0 28.2 0
25 17.8 37
55 10.1 64
Suhu lingkungan selama penelitia n berfluktuasi tiap bulannya dan tidak terdapat selisih suhu yang berarti antar intensitas cahaya yang berbeda. Secara umum, rata-rata suhu udara tertinggi terjadi pada bulan April, yaitu 29.760C pada intensitas cahaya penuh, 29.220C pada intensitas cahaya 17.8 Klux dan 28.750C pada intensitas cahaya 10.1 Klux. Rata-rata suhu udara terendah terjadi pada bulan Mei, yaitu 28.900C pada intensitas cahaya penuh, 28.570C pada intensitas cahaya 17.8 Klux, dan 28.030C pada intensitas cahaya 10.1 Klux. Rata-rata selisih suhu udara antar intensitas cahaya penuh dengan intensitas cahaya 17.8 Klux adalah 0.350C, sedangkan dengan intensitas cahaya 10.1 Klux adalah 0.580C. Rata-rata selisih suhu udara antara intensitas cahaya 17.8 Klux dengan intensitas cahaya 10.1 Klux adalah 0.220C. Grafik rata-rata suhu dan kelembaban udara harian disajikan pada Lampiran 19 dan 20. Menurut Susatio (2003), konstruksi bangunan tanam tanpa penyekat mengakibatkan udara dapat mengalir dengan baik sehingga tidak terjadi perbedaan suhu lingkungan pada intensitas cahaya yang berbeda. Pada penelitian ini tidak terdapat penyekat antar perlakuan intensitas cahaya yang berbeda.
16%. Penelitian Ginting, Prasetio dan Sutater (2001) menunjukkan bahwa selisih rata-rata kelembaban udara relatif sebesar 11.5% akibat cara pemberian air yang berbeda pada intensitas cahaya yang sama, menyebabkan perbedaan pada tebal daun dan diameter bulb anggrek Dendrobium ’Jayakarta’. Tebal daun dan diameter bulb lebih tinggi pada kelembaban 76.5% dibanding pada kelembaban 65%.
Percobaan I. Fase perkembangan organ bunga
Pengamatan morfologis perkembangan tunas generatif H. diversifolia Bl. meliputi fase induksi, inisiasi awal, insiasi lanjut, diferensiasi, pendewasaan
bagian bunga, dan antesis. Pengamatan anatomis stadia pembungaan
H. diversifolia Bl. hanya dilakukan sampai tahap diferensiasi.
Fase induksi dan perbedaan kandungan gula endogen
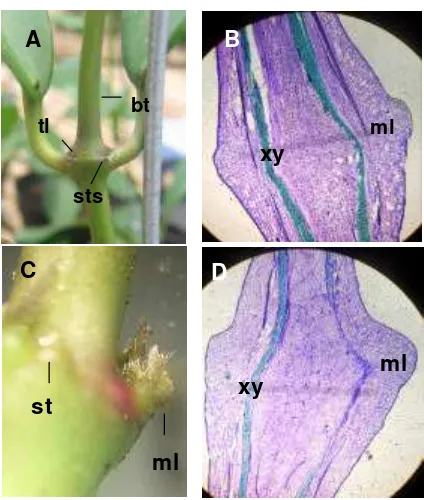
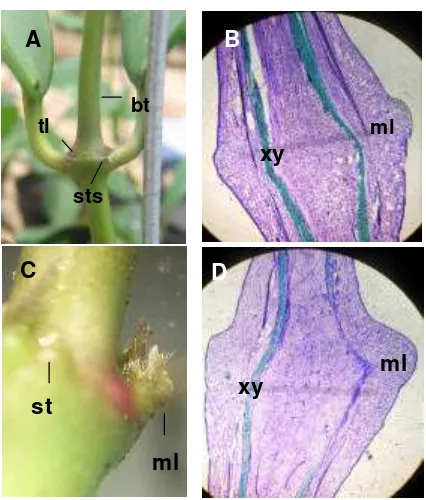
Tunas generatif H. diversifolia Bl. munc ul pada buku batang, dimana hanya terdapat satu tunas generatif pada tiap buku. Secara visual, tunas generatif tidak berasal dari perkembangan tunas apikal pada bagian ujung batang maupun dari tunas lateral pada ketiak daun. Tunas generatif muncul berdekatan dengan salah satu titik dari empat titik pada buku Hoya. Titik-titik tersebut merupakan bekas melekatnya stipule dan biasa disebut sebagai stipule scars. Stipule
merupakan organ yang berkembang pada dasar tangkai daun, dan pada
H. div ersfolia Bl. berjumlah sepasang dan tersusun melekat pada tiap tangkai daun (adnate) pada saat daun masih muda. Ketika daun telah berkembang, stipule akan gugur dan meninggalkan 4 buah (2 pasang) stipule scars pada sisi batang yang berlawanan (Gambar 3A). Irisan membujur buku H. diversifolia Bl. menunjukkan bahwa pada tonjolan stipule terdapat jaringan meristem (Gambar 3B). Menurut Fahn (1991), jaringan meristem terdiri atas kumpulan sel yang belum terdiferensiasi dan memiliki kemampuan untuk membelah diri namun dapat juga
ditemukan dalam keadaan dorman. Meristem pada tonjolan stipule
Gambar 3. Morfologi buku H. diversifolia Bl. (A) sebelum terjadi induksi bunga:
stipule scars (sts), tunas lateral (tl), batang yang merupakan perkembangan dari meristem apikal (bt), dan (C) pada fase induksi:
meristem lateral (ml), stipule (st). Irisan membujur buku
H. diversifolia Bl. (B) sebelum terjadi induksi bunga (Perbesaran 40X), dan (D) pada fase induksi bunga (Perbesaran 40X): xylem (xy), meristem lateral (ml).
Secara morfologi, fase induksi secara visual ditandai dengan adanya tonjolan pada stipule scars sepanjang kurang dari 1 mm (Gambar 3C). Sayatan membujur tunas gen eratif pada fase induksi secara mikroskopis menunjukkan belum terjadi perubahan struktur sel, baik dalam ukuran maupun bentuk, namun demikian terjadi pertambahan massa sel pada meristem lateral (Gambar 3D) dibanding sebelum terjadi induksi (Gambar 3B). Menurut Fahn (1991), perubahan pertama yang terjadi dalam transisi dari meristem vegetatif ke meristem reproduktif adalah bertambahanya aktivitas mitosis yang berakibat pada pertambahan dalam volume sel.
Saat dimulainya pembungaan, terjadi perubahan metabolisme pada ujung
pucuk (Kinet et al. 1985b). Perubahan metabolisme yang teramati pada
H. diversifolia Bl. adalah terjadinya perbedaan yang nyata pada kandungan gula pereduksi endogen (monosakarida) antara pucuk yang terinduksi berbunga den gan pucuk yang tidak terinduksi (Tabel 2). Kandungan gula total terlarut dan sukrosa
ml B
tl
sts bt
A
ml
D
st
ml C
tidak berbeda antara pucuk yang terinduksi dengan pucuk yang tidak terinduksi, akan tetapi kandungan gula pereduksi pada pucuk terinduksi lebih tinggi dibanding pucuk yang tidak terinduksi.
Tabel 2. Kandungan Gula pada Buku Hoya diversifolia Bl.
Kandungan gula (mg.g-1 bobot basah) Buku H. diversifolia Bl.
Total Pereduksi Sukrosa Pucuk terinduksi 42.845 7.394 33.678 Pucuk tidak terinduksi 36.582 4.139 30.821
Uji F tn * tn
Keterangan: tn: tidak berbeda nyata; *: berbeda nyata pada taraf a=5% pada uji F
Gula berperan penting sebagai molekul penerima sinyal (signaling molecule) yang meregulasi berbagai macam gen dan dapat mempengaruhi berbagai aspek perkembangan dala m tanaman tingkat tinggi termasuk pembungaan. Setelah induksi pembungaan Sinapis alba, konsentrasi sukrosa dalam floem yang menuju apeks pucuk meningkat secara cepat (Bernier et al. 1993).
Fase Inisiasi Awal
Fase inisiasi merupakan perkembangan setelah fase induksi. Bunga
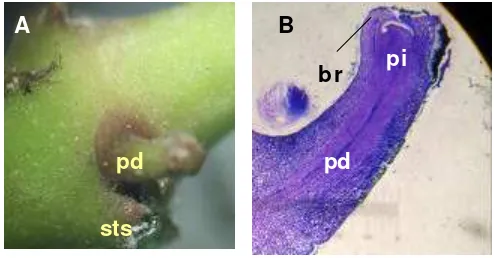
H. diversifolia Bl. termasuk bunga majemuk berbentuk payung (umbell), sehingga terjadi dua tahap inisiasi. Fase inisiasi awal secara visual ditandai dengan pemanjangan ibu tangkai bunga (peduncle). Sayatan membujur tunas generatif pada fase inisiasi awal secara mikroskopis menunjukkan terbentuknya primordia infloresens dan daun pelindung bunga (bract) (Gambar 4).
Gambar 4. A. Morfologi buku H. diversifolia Bl. pada fase inisiasi: peduncle (pd),
stipule scars (sts). B. Irisan membujur buku H. diversifolia Bl. pada fase inisiasi awal (Perbesaran 40X): primordia infloresens (pi),
peduncle (pd), bract (br).
Fase Inisiasi Lanjut
Fase inisiasi lanjut secara visual ditandai dengan pemanjangan peduncle (lebih dari 3 cm) dan melebarnya diameter ujung peduncle yang merupakan kumpulan primordia bunga dengan warna kemerahan (Gambar 5A). Sayatan membujur tunas generatif pada fase inisiasi lanjut secara mikroskopis menunjukkan terbentuknya primordia bunga, pemanjangan tangkai bunga (pedicel), terbentuknya primordia kelopak dan primordia mahkota (Gambar 5B).
pd
sts A
pi
pd
B
Gambar 5. A. Morfologi bunga H. diversifolia Bl. pada fase inisiasi lanjut:
peduncle (pd), stipule (st). B. Irisan membujur bunga H. diversifolia
Bl. pada fase inisiasi lanjut (Perbesaran 400X): primordia bunga (pbu), pedicel (pc), primordia kelopak (pk), primordia mahkota (pm).
Fase Diferensiasi
Fase diferensiasi secara visual memperlihatkan pembentukan bagian-bagian bunga, berupa kelopak dan mahkota yang berbentuk kuncup bulat berwarna hijau kekuningan (Gambar 6A). Gambar 6A menunjukkan bahwa dalam satu peduncle terdapat 15 kuncup individu bunga. Menurut Rahayu (1998) jumlah kuncup individu bunga dalam satu bunga majemuk dapat mencapai 15-20 buah. Sayatan membujur tunas generatif pada fase diferensiasi secara mikroskopis menunjukkan pemanjangan tangkai bunga (pedicel), terbentuknya kelopak, mahkota, dan gynostemium (Gambar 6B). Gynostemium merupakan organ reproduksi yang terdiri atas putik dan benang sari.
Gambar 6. A. Morfologi bunga H. diversifolia Bl. pada fase diferensiasi: peduncle
(pd). B. Irisan membujur bunga H. diversifolia Bl. pada fase diferensiasi (Perbesaran 400X): ped icel (pc), kelopak (k), mahkota (m), gynostemium (gyn).
pc
k
m
gyn
B
pd
A
pc pk
pm pbu B
st
pd
Fase Pendewasaan Bagian Bunga dan Anthesis
Pengamatan visual pada fase pendewasaan bagian bunga menunjukkan perubahan kuncup bulat menjadi pipih bersegi lima dan berwarna abu-abu muda dengan diameter individu bunga 6 mm (Gambar 7A). Setelah 7 hari bunga akan mekar (anthesis) secara serempak (Gambar 7B).
Masing-masing individu bunga memiliki garis tengah 10-12 mm, dengan bentuk bintang. Mahkota bunga berjumlah 5 helai dengan permukaan berambut halus dan mengkilap seperti beludru berwarna dadu. Pada bagian tengah individu bunga terdapat mahkota tambahan (korona) yang berukuran lebih kecil dari mahkota, berbentuk bintang, terkesan padat berlilin dengan warna lebih tua dibanding mahkota. Pada tiap mahkota dan korona terdapat kelopak yang tidak terlihat pada Gambar 7B dan 7C karena berukuran kecil dan tertutup oleh mahkota dan korona.
Gambar 7. Morfologi bunga H. diversifolia Bl. pada fase pendewasaan bagian bunga (A) dan pada fase anthesis (B) bunga majemuk dan (C) individu bunga: mahkota (m) dan korona (k).
Percoba an II. Pengaruh intensitas cahaya dan pemupukan terhadap pertumbuhan dan pembungaan H. diversifolia Bl.
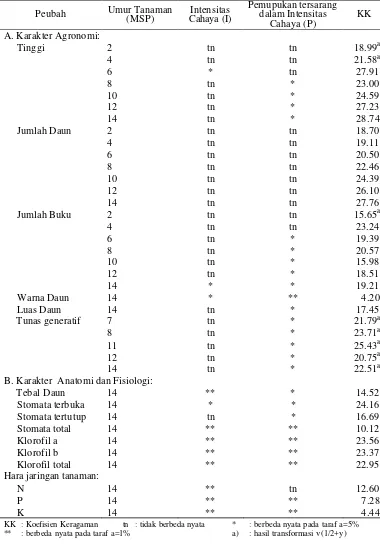
Rekapitulasi sidik ragam karakter morfologi dan fisiologi
H. diversifolia Bl. pada perlakuan intensitas cahaya dan pemupukan dapat dilihat pada Tabel 3. Karakter morfologi terdiri atas tinggi tanaman, jumlah daun, jumlah buku, warna daun, luas daun dan jumlah tunas generatif. Karakter fisiologi dan anatomi terdiri atas tebal daun, jumlah stomata daun (stomata terbuka, stomata tertutup, dan stomata total), kandungan klorofil daun (klorofil a, b, dan klorofil total), serta konsentrasi NPK jaringan tanaman.
B
A C m
Tabel 3. Rekapitulasi sidik ragam pengaruh intensitas cahaya dan pemupukan terhadap karakter agronomi dan fisiologi tanaman H. diversifolia Bl. Peubah Umur Tanaman (MSP) Cahaya (I) Intensitas Pemupukan tersarang dalam Intensitas
Cahaya (P)
KK
A. Karakter Agronomi:
Tinggi 2 tn tn 18.99a
4 tn tn 21.58a
6 * tn 27.91
8 tn * 23.00
10 tn * 24.59
12 tn * 27.23
14 tn * 28.74
Jumlah Daun 2 tn tn 18.70
4 tn tn 19.11
6 tn tn 20.50
8 tn tn 22.46
10 tn tn 24.39
12 tn tn 26.10
14 tn tn 27.76
Jumlah Buku 2 tn tn 15.65a
4 tn tn 23.24
6 tn * 19.39
8 tn * 20.57
10 tn * 15.98
12 tn * 18.51
14 * * 19.21
Warna Daun 14 * ** 4.20
Luas Daun 14 tn * 17.45
Tunas generatif 7 tn * 21.79a
8 tn * 23.71a
11 tn * 25.43a
12 tn * 20.75a
14 tn * 22.51a
B. Karakter Anatomi dan Fisiologi:
Tebal Daun 14 ** * 14.52
Stomata terbuka 14 * * 24.16
Stomata tertutup 14 tn * 16.69
Stomata total 14 ** ** 10.12
Klorofil a 14 ** ** 23.56
Klorofil b 14 ** ** 23.37
Klorofil total 14 ** ** 22.95
Hara jaringan tanaman:
N 14 ** tn 12.60
P 14 ** ** 7.28
K 14 ** ** 4.44
[image:48.612.130.510.107.657.2]Pengaruh Intensitas Cahaya
Tinggi Tanaman
Tinggi tanaman H. diversifolia Bl. tidak berbeda nyata pada perlakuan intensitas cahaya, kecuali pada 6 Minggu Setelah Perlakuan (MSP) (Tabel 3). Rata-rata tinggi tanaman pada beberapa intensitas cahaya dapat dilihat pada Tabel 4. Hasil sidik ragam selengkapnya pada Lampiran 1.
Tabel 4. Pengaruh intensitas cahaya terhadap tinggi tanaman (cm) H. diversifolia
pada 2-14 MSP
Waktu (MSP) Intensitas
cahaya (Klux) 21) 41) 6 8 10 12 14
28.2 2.34(25.50) 7.37(56.70) 77.58b 96.85 115.42 125.42 126.85 17.8 2.03(20.98) 6.77(50.47) 75.95b 107.07 124.58 148.10 155.68 10.1 2.50(33.18) 9.10(82.52) 112.78a 133.88 142.50 161.05 176.52
Uji F tn tn * tn tn tn tn
Keterangan: tn: tidak berbeda nyata; *: berbeda nyata pada uji F dengan taraf a=5%. A ngka-angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT. 1) hasil transformasi v(1/2+y). Angka dalam kurung menunjukkan nilai sebelum transformasi
Tabel 4 menunjukkan bahwa pada 6 MSP, tinggi tanaman H. diversifolia Bl. yang ditanam di bawah intensitas cahaya 10.1 Klux lebih tinggi dibandingkan tanaman yang ditanam tanpa naungan dan di bawah intensitas cahaya 17.8 Klux. Pada akhir pengamatan tinggi tanaman meningkat sebesar 27% dan 39% pada intensitas cahaya 17.8 dan 10.1 Klux dibanding pada intensitas cahaya 28.2 Klux, namun tidak signifikan. Menurut Goldsworthy dan Fisher (1992) tan aman ternaungi akan meningkatkan tinggi tanaman untuk meningkatkan efisiensi penangkapan cahaya. Auksin yang tertimbun di sisi cahaya rendah dapat mengakibatkan pemanjangan lebih cepat sehingga tanaman tumbuh lebih tinggi. Pada penelitian ini, batang tan aman di bawah intensitas 10.1 Klux (naungan 64%) tampak lebih kurus dan kecil dibandingkan pada intensitas cahaya penuh.
Jumlah Buku
Tabel 5. Pengaruh intensitas cahaya terhadap jumlah buku H. diversifolia pada 2-14 MSP
Waktu (MSP) Intensitas cahaya
(Klux) 21) 4 6 8 10 12 14
28.2 2.07 (3.83) 5.50 8.17 10.17 11.67 12.67 13.00 b
17.8 1.87 (3.16) 5.17 7.33 9.83 12.83 14.17 16.00 ab 10.1 2.16 (4.17) 6.00 9.50 11.50 12.50 14.67 17.83 a
Uji F tn tn tn tn tn tn *
Keterangan: tn: tidak berbeda nyata; *: berbeda nyata pada uji F dengan taraf a=5%. Angka-angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT. 1) hasil transformasi v(1/2+y). Angka dalam kurung menunjukkan nilai sebelum transformasi.
Jumlah buku H. diversifolia Bl. berkorelasi positif dengan tinggi tanaman (Lampiran 17). Meningkatnya jumlah buku seiring dengan meningkatnya tinggi tanaman menunjukkan bahwa panjang ruas batang H. diversifolia Bl. pada intensitas cahaya yang berbeda relatif tetap, yaitu 9.8 – 9.9 cm, dan oleh karena itu peningkatan tinggi tanaman pada kondisi intensitas cahaya rendah bukan merupakan etiolasi. Briggs dan Calvin (1987) menyatakan bahwa etiolasi merupakan pemanjangan ruas batang tanaman pada intensitas cahaya rendah. Panjang ruas batang H. diversifolia Bl. yang relatif tetap pada berbagai intensitas cahaya menunjukkan bahwa tanaman tersebut merupakan tanaman yang dapat beradaptasi pada kondisi naungan maupun cahaya penuh.
Jumlah Daun
Jumlah daun H. diversifolia Bl. tidak berbeda nyata selama perlakuan intensitas cahaya (2-14 MSP) (Tabel 3). Rata-rata jumlah daun pada beberapa intensitas cahaya dapat dilihat pada Tabel 6. Hasil sidik ragam selengkapnya pada Lampiran 2.
Tabel 6. Pengaruh intensitas cahaya terhadap jumlah daun H. diversifolia Bl. pada 2-14 MSP
Waktu (MSP) Intensitas cahaya
(Klux) 2 4 6 8 10 12 14
28.2 14.17 16.83 21.33 26.00 28.00 29.50 33.50 17.8 10.67 13.33 17.67 19.67 20.83 23.17 26.33 10.1 11.83 15.00 20.33 22.50 23.33 26.00 28.50
Uji F tn tn tn tn tn tn tn
Jumlah daun yang tidak berbeda pada intensitas cahaya yang berbeda menunjukkan bawah H. diversifolia Bl. merupakan spesies yang adaptif pada berbagai intensitas cahaya yang digunakan. Beberapa penelitian menunjukkan bahwa tanaman yang tidak dapat beradaptasi pada intensitas cahaya rendah akan memiliki jumlah daun yang lebih sedikit, misalnya pada kedelai (Anggarani 2005), sedangkan daun tanaman yang tidak dapat beradaptasi pada intensitas cahaya tinggi akan mengalami klorosis, memiliki ukuran daun yang lebih kecil serta jumlah daun yang lebih sedikit (Müller-Moule, Golan dan Niyogi 2004). Pada kedelai penurunan jumlah daun pada intensitas cahaya rendah disebabkan terjadinya penurunan jumlah buku tempat melekatnya daun pada intensitas cahaya tersebut (Anggarani 2005), namun pada H. diversifolia Bl. tidak terdapat korelasi nyata antara jumlah buku dengan jumlah daun (Lampiran 17).
Warna dan Kandungan Klorofil Daun
Warna, kandungan klorofil total, klorofil a, dan klorofil b daun H. diversifolia Bl. berbeda nyata pada perlakuan intensitas cahaya di akhir pengamatan (14 MSP) (Tabel 3). Rata-rata warna daun, kandungan klorofil total, klorofil a, klorofil b, dan nisbah klorofil a/b daun H. diversifolia Bl. pada beberapa intensitas cahaya dapat dilihat pada Tabel 7. Hasil sidik ragam selengkapnya pada Lampiran 4-5.
Tabel 7. Pengaruh intensitas cahaya terhadap warna dan kandungan klorofil daun
H. diversifolia pada 14 MSP Klorofil
Total Klorofil a Klorofil b
Nisbah klorofil a/b Intensitas cahaya
(Klux) Warna daun
……….mg/g daun segar…………..
28.2 165.53 b 0.21 c 0.14 c 0.07 c 1.88
17.8 169.75ab 0.30 b 0.20 b 0.10 b 1.80
10.1 177.27 a 0.43 a 0.28 a 0.15 a 1.78
Uji F * ** ** **
Keterangan: *: berbeda nyata pada uji F dengan taraf a=5%. **: berbeda nyata pada uji F dengan taraf a=1%. Angka-angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT
Gambar 8. Standar warna hijau FHK Chlorophyl tester, CT-102 (Fujihira Industry Co.Ltd)
Nilai yang semakin tinggi menunjukkan warna hijau yang lebih gelap diband ingkan standar. Daun H. diversifolia Bl. pada intensitas cahaya yang lebih rendah memiliki warna daun yang lebih hijau dibanding pada intensitas cahaya yang lebih tinggi. Daun pada intensitas cahaya 10.1 Klux nyata lebih hijau dibanding daun pada intensitas cahaya 28.2 Klux (Tabel 7). Warna daun yang lebih hijau seiring dengan menurunnya intensitas cahaya disebabkan kandungan klorofil yang lebih tinggi pada daun yang berada pada intensitas cahaya yang lebih rendah.
Tabel 7 menunjukkan bahwa kandungan klorofil a, b, dan total pada daun
H. diversifolia Bl. meningkat seiring menurunnya intensitas cahaya, sedangkan nisbah klorofil a/b menurun. Hasil serupa disampaikan oleh Yusnaeni (2002), bahwa daun H. diversifolia Bl. yang ditanam pada naungan 75% memiliki kandungan klorofil a, b, dan total yang nyata lebih tinggi serta nisbah klorofil a/b yang nyata lebih rendah dibanding daun H. diversifolia Bl. yang ditanam tanpa naungan.
Penurunan nisbah klorofil a/b seiring dengan menurunnya intensitas cahaya disebabkan karena terjadinya peningkatan kandungan klorofil b. Menurut Watanabe et al. (1991) dan Yeo et al. (1994), daun ternaungi umumnya mempunyai klorofil lebih banyak, khususnya klorofil b, terutama karena tiap klorofil mempunyai lebih banyak grana dibanding daun yang tidak ternaungi. Peningkatan klorofil b merupakan upaya tanaman untuk memperluas ukuran antena pada LHC II agar tercapai efisiensi tinggi dalam menangkap radiasi cahaya (Hidema et al. 1992).
Luas dan Tebal Daun
Luas daun H. diversifolia Bl. tidak berbeda nyata pada perlakuan intensitas cahaya, sedangkan tebal daun berbeda sangat nyata di akhir pengamatan (14 MSP) (Tabel 3). Rata-rata luas dan tebal daun H. diversifolia Bl. pada beberapa intensitas cahaya dapat dilihat pada Tabel 8. Hasil sidik ragam selengkapnya pada Lampiran 6.
Tabel 8. Pengaruh intensitas cahaya terhadap luas dan tebal daun H. diversifolia
pada 14 MSP
Intensitas cahaya (Klux) Luas Daun (cm2) Tebal daun (µm)
28.2 131.24 31.11 a
17.8 159.47 28.68 a
10.1 159.62 17.23 b
Uji F tn **
Keterangan: tn: tidak berbeda nyata; **: berbeda nyata pada uji F dengan taraf a=1%. Angka-angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada uji DMRT
Luas daun tanaman meningkat sebesar 22% pada intensitas cahaya 17.8 dan 10.1 Klux dibanding pada intensitas cahaya 28.2 Klux, akan tetapi tidak signifikan. Penelitian pada Lantana camara L. subsp. camara (Matsoukis, Tsiros, dan Kamoutsis 2004) dan Vitis vinifera ’Chardonnay’ (Heuvel et al. 2004) menunjukkan terjadinya peningkatan luas daun pada intensitas cahaya yang lebih rendah. Levitt (1980) menyatakan bahwa peningkatan luas daun pada kondisi intensitas cahaya rendah merupakan salah satu mekanisme adaptasi untuk mendapatkan cahaya secara optimal. Penghindaran terhadap defisit cahaya dapat dicapai dengan meningkatkan intersepsi efisiensi penangkapan cahaya, yaitu dengan meningkatkan area penangkapan cahaya yang dilakukan dengan meningkatkan luas daun per unit jaringan tanaman.
Gambar 9. Penampakan anatomi daun H. diversifolia Bl. secara melintang pada 14 MSP pada perbesaran 400 X: kutikula (kt), lapisan epidermis pertama (ep1), lapisan epidermis kedua (ep2), dan jaringan mesofil bagian atas (msa).
Gambar 9 menunjukkan bahwa sisi adaksial daun H. diversifolia Bl. mempunyai lapisan kutikula dan jaringan epidermis yang lebih dari satu lapisan (multiple). Di bawah jaringan epidermis terdapat jaringan mesofil yang belum terdiferensiasi dan mesofil bunga karang. Mesofil di bawah jaringan ep idermis
terdiri atas sel-sel berbentuk bulat dan tidak memanjang, sehingga daun
H. diversifolia Bl. tidak memiliki mesofil palisade. Sel-sel penyusun mesofil bunga karang memiliki bentuk menyerupai jaringan mesofil di atasnya namun memiliki ruang antar sel yang lebih besar. Menurut Esau (1977), beberapa tanaman dikotil memiliki jaringan mesofil yang tidak atau kurang terdiferensiasi, dan bila mesofil palisade dan mesofil bunga karang tidak terdiferensiasi dengan jelas pada sisi adaksial dan abaksial daun, daun tersebut disebut daun isobilateral. Karena daun H. diversifolia Bl. tidak memiliki mesofil palisade namun memiliki mesofil bunga karang, untuk selanjutnya mesofil di bawah lapisan epidermis akan disebut sebagai mesofil bagian atas.
Perlakuan intensitas cahaya mempengaruhi tebal daun H. diversifolia Bl. melalui perubahan jumlah lapisan mesofil, baik mesofil bagian atas maupun mesofil bunga karang (Gambar 10). Pada perlakuan intensitas cahaya 28.2 Klux, terdapat 8 – 10 lapisan mesofil bagian atas, sedangkan pada intensitas cahaya 17.8 Klux jumlah lapisan mesofil bagian atas menurun menjadi 6 – 8 lapisan, dan pada intensitas cahaya 10.1 Klux hanya terdapat 4 -5 lapis mesofil bagian atas. Taiz
kt
ep1 ep2
dan Zeiger (1991) menyatakan bahwa daun tanaman ternaungi lebih tipis dibanding daun tanaman yang ditanam di daerah terbuka, disebabkan oleh pengurangan sel mesofil. Peningkatan ketebalan daun kedelai pada intensitas cahaya tinggi disebabkan oleh meningkatnya jumlah lapisan dan ukuran sel mesofil, baik mesofil bunga karang maupun mesofil palisade (Sim ms, Seeman, dan Luo 1998).
Gambar 10. Penampakan anatomi daun H. diversifolia Bl. secara melintang pada 14 MSP pada perbesaran 100 X. (A) Pada intensitas cahaya 28.2 Klux, (B) pada intensitas cahaya 10.1 Klux: epidermis atas (epa), mesofil bagian atas (msa), mesofil bunga karang (msb), ruang antar sel (rs), dan epidermis bawah (epb).
Menurunnya ketebalan daun pada intensitas cahaya yang lebih rendah merupakan bentuk adaptasi tanaman terhadap intensitas cahaya. Menurut Sopandie et al. (2003), pada intensitas cahaya yang lebih rendah, daun yang lebih tipis memungkinkan diteruskannya cahaya ke daun yang terletak di bawahnya.
Selain meningkatkan transmisi cahaya, daun yang lebih tipis pada intensitas cahaya yang lebih rendah memungkinkan fotosintesis yang lebih efisien. Menurut Terashima, Miyazawa dan Hanba (2001) dan Terashima et al. (2006), daun yang lebih tebal memiliki hambatan difusi CO2 dalam ruang antar sel (Rias) yang lebih
tinggi dan membutuhkan energi yang lebih banyak untuk membentuk dan memelihara sel-sel daun, namun daun yang lebih tebal memiliki luas permukaan kloroplas yang menghadap ke ruang antar sel per luasan daun (Sc) yang lebih
tinggi. Peningkatan Sc menunjukkan peningkatan luasan difusi CO2, sehingga
A B
epa
msa
msb
epb rs
msa epa
msb
dapat meningkatkan asimilasi CO2.