KOMPONEN BIOAKTIF TANAMAN TORBANGUN
(
Plectranthus amboinicus
(Lour.) Spreng) MENGHAMBAT
VIABILITAS DAN MENDORONG APOPTOSIS SEL
KANKER PAYUDARA MCF-7 (ATCC
®HTB-
22™)
WAHID YULIANTO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Komponen Bioaktif Tanaman Torbangun (Plectranthus amboinicus (Lour.) Spreng) Menghambat Viabilitas dan Mendorong Apoptosis Sel Kanker Payudara MCF-7 (ATCC® HTB-22™)adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
RINGKASAN
WAHID YULIANTO. Komponen Bioaktif Tanaman Torbangun (Plectranthus amboinicus (Lour.) Spreng) Menghambat Viabilitas dan Mendorong Apoptosis Sel Kanker Payudara MCF-7 (ATCC® HTB-22™). Dibimbing oleh NURI ANDARWULAN, PUSPO EDI GIRIWONO dan JOKO PAMUNGKAS.
Kanker merupakan salah satu penyakit yang menjadi penyebab utama kematian di dunia. Kanker payudara merupakan jenis kanker terbanyak yang diderita oleh kaum wanita yakni 25% dari seluruh kasus kanker. Komponen bioaktif yang berasal dari alam mulai mendapatkan sorotan untuk dikembangkan sebagai terapi alternatif dalam menangani kanker karena dianggap memiliki efek samping yang lebih kecil dibandingkan dengan penggunaan kemoterapi. Tanaman merupakan sumber yang sangat kaya akan komponen metabolit sekunder alami yang saat ini banyak diteliti akan bioaktifitasnya untuk dikembangkan menjadi obat penyakit kanker. Salah satu tanaman yang secara farmakologis telah digunakan untuk menangani berbagai penyakit termasuk kanker karena memiliki kemampuan sitotoksik adalah Plectranthus amboinicus (Lour.) Spreng yang dalam Bahasa Indonesia dikenal sebagai tanaman torbangun. Meskipun telah banyak studi yang melaporkan bioaktifitas tanaman ini namun belum membahas komponen yang bertanggung jawab terhadap bioaktifitasnya berikut mekanisme yang terjadi. Oleh karena itu penelitian ini bertujuan untuk mengidentifikasi komponen bioaktif tanaman torbangun yang berperan dalam kemampuan penghambatan viabilitas sel kanker MCF-7 serta mengetahui mekanisme intra seluler yang terjadi di balik bioaktifitas tersebut.
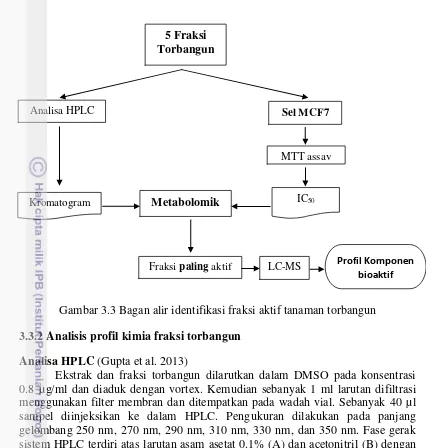
Percobaan bagian pertama bertujuan untuk mengetahui komponen fitokimia pada tanaman torbangun dan bioaktifitasnya sebagai antioksidan maupun penghambat viabilitas sel kanker MCF-7. Lima fraksi yang diuji adalah etanol, heksana, kloroform, etil asetat dan air. Hasil penelitian menunjukkan bahwa komponen fitokimia dari ekstrak dan fraksi daun torbangun sebagian besar berupa golongan fenolik yang terdiri atas flavonoid, tannin dan saponin. Secara kuantitatif, kandungan total fenol tertinggi terdapat pada fraksi etil asetat yakni 42.15 mg GAE/g sedangkan terendah pada fraksi heksana yakni 7.15 mg GAE/g. Aktifitas antioksidan berupa penangkapan radikal bebas DPPH tertinggi diperlihatkan oleh fraksi etil asetat dengan nilai IC50 4.22 ppm sedangkan
terendah pada fraksi heksana dengan nilai IC50 64.9 ppm. Terdapat korelasi positif
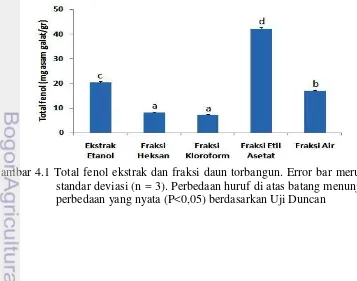
meskipun tidak tinggi antara kandungan total fenol dan aktifitas antioksidan. Adapun aktifitas penghambatan viabilitas sel kanker MCF-7 tertinggi dimiliki oleh fraksi heksana dengan nilai IC50 1.77 µg/ml dan terendah dimiliki oleh fraksi
air dengan nilai IC50 136.74 µg/ml. Tidak terdapat korelasi antara kandungan total
fenol dan kemampuan penghambatan viabilitas sel kanker MCF-7.
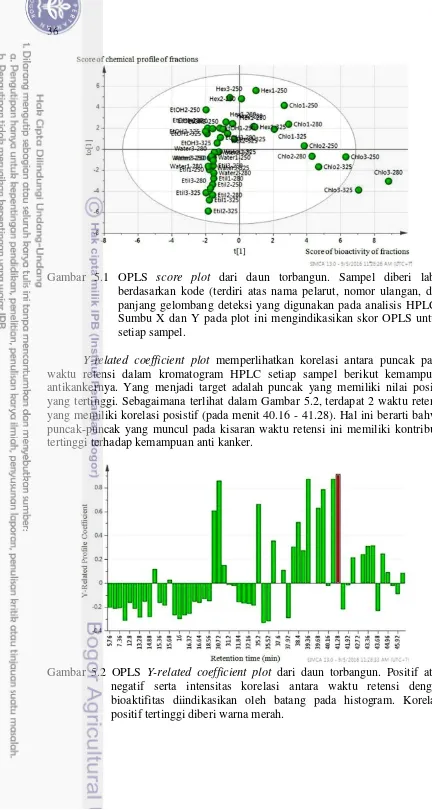
OPLS menunjukkan bahwa komponen dalam fraksi kloroform yang terelusi pada waktu retensi 40.16 - 41.28 menit memiliki kontribusi dalam menghambat viabilitas sel kanker MCF-7. Data spektra massa dari fraksi yang diisolasi mengindikasikan komponen yang merupakan sebuah abietane diterpene dengan nama 7-acetoxy-6-hydroxyroyleanone dimana komponen ini merupakan komponen utama yang berkontribusi terhadap kemampuan penghambatan viabilitas terhadap sel kanker MCF-7. Namun analisis LC-MS juga memperlihatkan bahwa terdapat 4 komponen lain dari fraksi yang diisolasi yang juga memiliki kontribusi dalam bioaktifitas fraksi torbangun. Hal ini berarti bahwa mungkin saja terdapat beberapa komponen di dalam sebuah puncak kromatogram HPLC. Sehingga aplikasi metabolomik ini berperan sebagai panduan cepat untuk mencari komponen yang berkontribusi dominan dalam bioaktifitasnya.
Percobaan bagian ketiga bertujuan untuk mengidentifikasi mekanisme komponen bioaktif dari fraksi terpilih yakni fraksi kloroform dan fraksi air dalam menginduksi apoptosis yang terjadi pada sel kanker MCF-7. Apoptosis diamati dengan melihat morfologi sel di bawah mikroskop fluorescence. Hasil penelitian menunjukkan bahwa kedua fraksi dapat menginduksi terjadinya apoptosis yang dibuktikan dengan morfologi sel khas apoptosis yakni pengkerutan sel dan kondensasi kromatin. Fraksi kloroform dapat menghambat 50% viabilitas sel kanker MCF-7 hanya dengan konsentrasi 1,6 ppm sementara fraksi air membutuhkan lebih dari 60 ppm untuk memberikan level penghambatan yang setara. Ekspresi mRNA gen-gen apoptosis seperti p53 dan p21 mengalami peningkatan akibat perlakuan fraksi kloroform. Adapun fraksi air hanya meningkatkan ekspresi mRNA gen p21 tanpa mempengaruhi ekspresi mRNA gen p53 yang mengindikasikan adanya perbedaan jalur induksi apoptosis antara kedua fraksi. Ekspresi mRNA gen-gen caspase mengalami peningkatan yang intensitas peningkatannya dipengaruhi oleh konsentrasi yang diberikan. Hasil penelitian ini menunjukkan bahwa apoptosis yang diinduksi oleh komponen dalam tanaman torbangun melibatkan jalur ekstrinsik dan intrinsik. Terdapat perbedaan komponen yang terkandung antara kedua fraksi yang perbedaan ini kemungkinan menjadi penyebab adanya perbedaan bioaktifitas dan perbedaan jalur dalam mekanisme aksinya.
Sebagai kesimpulan, penelitian ini berhasil mengungkap bahwa beberapa komponen bioaktif dalam tanaman torbangun memperlihatkan penghambatan viabilitas sel kanker MCF-7 yang kuat melalui suatu mekanisme apoptosis. Ini menunjukkan potensi komponen bioaktif tersebut sebagai obat anti kanker. Berdasarkan hasil penelitian ini maka disarankan untuk melakukan penelitian lanjutan menggunakan beberapa metode yang berbeda untuk memperkuat hasil yang diperoleh saat ini.
SUMMARY
WAHID YULIANTO. Torbangun Bioactive Compounds (Plectranthus amboinicus (Lour.) Spreng) Inhibit Viability and Induce Apoptosis in Breast Cancer MCF-7 (ATCC® HTB-22™) Cell. Supervised by NURI ANDARWULAN, PUSPO EDI GIRIWONO and JOKO PAMUNGKAS.
Cancer disease becomes the major cause of death globally. Breast cancer is the most frequently diagnosed cancer and the leading cause of cancer death among females around the world. Research interest nowadays drawing more attention on naturally-derived compounds for new therapy of cancer. since they are considered to have less harmful side effects compared to conventional treatments such as chemotherapy. The Plant Kingdom acts as abundance resource of naturally occurring secondary metabolites which are being investigated for their anticancer activities towards the development of new clinical medicines.
Plectranthus amboinicus (Lour) Spreng has been traditionally used to cure various illnesses. Despite many studies have already explored wide range of bioactivity of the plant, there is still however lack of study reporting which compounds of the plant that responsible for the bioactivity. The objective of this study was to identify the active compound in the plant which play a role to inhibit viability of breast cancer cell MCF-7.
The first experiment aimed at examining the phytochemical compounds of Plectranthus amboinicus (Lour) Spreng and to observe their bioactivity as antioxidant as well as inhibition of viability of breast cancer cell MCF-7. Five fractions of the plant extract were observed including ethanol, hexane, chloroform, ethyl acetate and water fraction. Result showed that phytochemical compounds of the plant extract and fraction are mainly phenolic group which consist of flavonoid, tannin and saponin. Quantitative analysis revealed that ethyl acetate fraction has the highest total phenolic content (42.15 mg GAE/g) whereas hexane has the lowest (7.15 mg GAE/g). The highest antioxidant activity measured by DPPH radical scavenging activity test was achieved by ethyl acetate fraction with IC50 value of 4.22 ppm, while the lowest was showed by hexane
fraction with IC50 value of 64.9 ppm. There was moderate correlation between
total phenolic content and antioxidant capacity. Inhibition of breast cancer cell MCF-7 viability on the other hand, achieved by hexane fraction with IC50 value of
1.77 µg/ml and the lowest was showed by water fraction with IC50 value of 136.74
µg/ml. There is no correlation between total phenolic content and viability inhibition of breast cancer MCF-7 cell.
The second experiment was aimed at identifying the active compounds in Plectranthus amboinicus (Lour) Spreng which play a role to inhibit viability of breast cancer cell MCF-7 using HPLC-based metabolomics approach. Five fractions of the plant extract were observed including ethanol, hexane, chloroform, ethyl acetate and water fraction. There were 45 HPLC chromatograms resulted from 5 fractions with 3 replications and 3 wavelength detection. The chromatograms compared to the data of IC50 from each fractions
spectra indicated that an abietane diterpene namely 7-acetoxy-6-hydroxyroyleanone was the main compound that contributed to the activity of cell viability inhibition. This metabolomics application method is presented as a quick preliminary guideline to uncover the most dominant compound in the bioactivity.
The third experiment was aimed at identifying the active compounds in the selected fractions of the plant extract which have effect on the apoptosis-related genes expression of breast cancer MCF-7. Apoptosis was observed morphologically using Hoechst nuclear staining. Expression of the genes was analyzed using Real-Time PCR. Chemical compounds of the plant fractions were determined using LC-MS. Cell morphology observation clearly indicated apoptosis which characterized by cell shrinkage and chromatin condensation after the treatment of both chloroform and water fraction. Increased mRNA expression of anti-apoptotic gene Bcl-2 could not prevent the cell from apoptosis. Messenger RNA Expression of p53 and p21 genes were increased significantly after treated with chloroform fraction. Conversely in the treatment of water fraction the plant extract did not affect the mRNA expression of p53 gene but did affect the mRNA expression of p21 gene suggesting p53-independent pathway of apoptosis when induced by water fraction. The mRNA expression of caspase 9, caspase 7 and caspase 1 were increased at concentration-dependent manner. P amboinicus fractions induce apoptosis primarily via intrinsic signaling pathway. There are differences of chemical constituent between the two fractions which may the cause of differences in the strength of cell viability inhibition as well as the pathway of its mechanism of action.
As conclusion, this study revealed that some of the bioactive compounds present in torbangun plant exhibited strong activity of cell viability inhibition against breast cancer cell MCF-7 through a pathway in the apoptosis mechanism. It can be suggested therefore to conduct further experiments using different methods to sthrengthen the present results.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
(
Plectranthus amboinicus
(Lour.) Spreng) MENGHAMBAT
VIABILITAS DAN MENDORONG APOPTOSIS SEL
KANKER PAYUDARA MCF-7 (ATCC
®HTB-
22™)
WAHID YULIANTO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi
Ujian Tertutup1. Dr. Nancy Dewi Yuliana, STP., M.Sc
Dosen Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian Institut Pertanian Bogor
2. Drh. Fitriya Nur Annisa Dewi, Ph.D Peneliti Pusat Studi Satwa Primata, Institut Pertanian Bogor
Sidang Promosi
1. Dr. Nancy Dewi Yuliana, STP., M.Sc
Dosen Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian Institut Pertanian Bogor
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah Subhanahu Wata’ala atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Sholawat serta Salam semoga selalu tercurah kepada manusia terbaik di alam semesta ini yakni Rasulullah Muhammad Shallalaahu alaihi wasallam. Adapun tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 sampai April 2016 ini ialah anti proliferasi sel kanker dengan judul Komponen Bioaktif Tanaman Torbangun (Plectranthus amboinicus (Lour.) Spreng) Menghambat Viabilitas dan Mendorong Apoptosis Sel Kanker Payudara MCF-7 (ATCC® HTB-22™).
Melalui kesempatan ini, penulis ingin menyampaikan ucapan terima kasih kepada semua pihak yang telah medukung dalam seluruh rangkaian studi termasuk penelitian dan penulisan disertasi.
Pertama, terima kasih yang setinggi-tingginya penulis ucapkan kepada Ibu Prof Dr Ir Nuri Andarwulan, Bapak Dr Puspo Edi Giriwono dan Bapak Dr drh Joko Pamungkas selaku pembimbing yang telah banyak memberikan arahan, dukungan, dan bimbingan sehingga disertasi ini dapat terselesaikan. Ucapan terima kasih penulis sampaikan pula kepada Ketua Program Studi Ilmu Pangan Ibu Dr Harsi D Kusumaningrum serta Sekretaris Program Studi Ilmu Pangan Ibu Dr Endang Prangdimurti beserta segenap jajaran di Program Studi atas pelayanan akademik selama ini. Terima kasih kami ucapkan atas kesediaan Ibu Dr. Nancy Dewi Yuliana, STP, MSc dan Ibu Drh. Fitriya Nur Annisa Dewi, PhD menjadi penguji luar komisi sehingga banyak memberi masukan demi kesempurnaan tulisan ini. Kami secara khusus juga ingin menyampaikan terima kasih yang tak terhingga kepada seluruh Ibu dan Bapak dosen di Program Studi Ilmu Pangan atas ilmu dan pelajaran yang telah dicurahkan. Semoga Allah memberikan balasan yang terbaik kepada beliau semua.
Kepada Pemerintah Republik Indonesia melalui Kementrian Riset dan Teknologi dan Pendidikan Dikti, penulis menyampaikan terima kasih atas bantuan beasiswa yang diberikan selama mengikuti program doktor ini. Terima kasih penulis sampaikan pula kepada Dekan Sekolah Pascasarjana IPB beserta seluruh jajarannya atas pelayanan akademik yang prima. Kepada Dekan Fakultas Peternakan Universitas Mataram Bapak Dr Maskur dan Bapak Dekan Periode sebelumnya Bapak Prof Yusuf Akhyar Sutaryono, penulis menyampaikan terima kasih atas kesempatan yang diberikan untuk melanjutkan studi. Kepada rekan kerja sekaligus sahabat Bapak Muh Prasetyo Nugroho, penulis menyampaikan terima kasih atas dukungan baik materi maupun non materi.
Mbak Mitha, Pak Dr Uus, Mbak Iin, Pak Budi dan Pak Dede serta Mbak Tita atas pelayanan yang sangat baik. Kepada teman-teman IPN terutama angkatan 2011 yakni Pak Sabariman, Pak Faleh, Pak Dwi, Pak Subaryono, Pak Rinto, Pak Tahrir, Bu Asnani, Bu Retnani, Bu Heny, Bu Eni, dan Bu Sherly terima kasih atas pertemanan selama ini dan mohon maaf apabila ada hal-hal yang kurang berkenan. Kepada Ibu Fitry secara khusus penulis menyampaikan terima kasih karena telah banyak memberikan bantuan selama proses penelitian dan penulisan disertasi.
Akhirnya ungkapan terima kasih penulis haturkan setulus-tulusnya kepada Ibunda Sri Marfu’atin dan Ayahanda Drs Kusnan atas kasih sayang yang tak berbatas serta dukungan baik moril maupun materiil yang tak terhitung banyaknya. Semoga Allah selalu mencurahkan kasih sayangNya kepada keduanya. Kepada istri tercinta ummi Indah Rani Kamelia yang telah bersabar menunggu dan terus memberikan dukungan selama penulis melaksanakan studi, maka penulis menyampaikan terima kasih dan ungkapan cinta yang mendalam. Kepada anak-anak tersayang Aisyah, Balqis, Ali, Utsman, Kamila dan Umar mohon maaf atas kurangnya perhatian dan kebersamaan selama Abi pergi sekolah. Semoga Allah menjadikan kalian sebagai anak-anak yang shaleh dan shalehah dan penyejuk pandangan mata Abi kelak. Kepada seluruh keluarga, terutama Adik-adik tercinta terima kasih atas doa dan kepercayaannya.
Sebagai penutup penulis memohon maaf apabila dalam tulisan ini terdapat kesalahan dan kekeliruan. Kritik dan saran sangat penulis harapkan demi kebaikan di masa yang akan datang. Demikian, semoga karya tulis ilmiah ini bermanfaat.
Bogor, September 2016
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
Hipotesis 4
Kebaruan Penelitian 4
2 TINJAUAN PUSTAKA
Potensi Anti Kanker Tanaman Torbangun 5
Metode Uji Viabilitas Sel Kanker 6
Komposisi dan Komponen Bioaktif Tanaman Torbangun 7
Metabolomik 8
Galur Sel Kanker Payudara 11
Mekanisme Apoptosis 11
3 METODOLOGI
Waktu dan Tempat Penelitian 15
Bahan dan Alat Penelitian 15
Prosedur Penelitian 16
Budidaya tanaman torbangun 16
Ekstraksi dan fraksinasi tanaman torbangun 17 Analisis profil kimia fraksi torbangun 19
Kultur sel dan uji bioaktifitas 20
4 EKSTRAKSI DAN FRAKSINASI KOMPONEN BIOAKTIF DAUN TORBANGUN (Plectranthus amboinicus (Lour) Spreng) SERTA POTENSINYA SEBAGAI ANTIOKSIDAN DAN PENGHAMBAT VIABILITAS SEL KANKER MCF-7
Pendahuluan 21
Bahan dan Metode Penelitian 22
Hasil dan Pembahasan 24
Simpulan 29
5 IDENTIFIKASI KOMPONEN BIOAKTIF DAUN TORBANGUN (Plectranthus amboinicus (Lour) Spreng) YANG BERSIFAT SITOTOKSIK TERHADAP SEL KANKER MCF-7 MENGGUNAKAN APLIKASI METABOLOMIK BERBASIS HPLC
Pendahuluan 30
Bahan dan Metode 31
Pembahasan 33
Simpulan 40
6 PENGARUH KOMPONEN BIOAKTIF TANAMAN TORBANGUN (Plectranthus amboinicus (Lour) Spreng) TERHADAP EKSPRESI GEN APOPTOSIS PADA SEL KANKER MCF-7
Pendahuluan 41
Bahan dan Metode 42
Hasil 44
Pembahasan 44
Simpulan 52
7 PEMBAHASAN UMUM 53
8 SIMPULAN DAN SARAN 61
DAFTAR PUSTAKA 62
DAFTAR TABEL
2.1 Uji aktifitas sitotoksik ekstrak daun torbangun terhadap sel kanker 5 2.2 Perbandingan metode analisis yang digunakan dalam metabolomik 9 2.3 Klasifikasi molekuler sel kanker payudara 11 4.1 Hasil pengujian fotokimia secara kualitatif 25 5.1 Nilai konsentrasi penghambatan IC50 dari ekstrak etanol tanaman
torbangun terhadap sel MCF-7
34
5.2 Prediksi komponen dari isolat sampel Chlo3250 39 6.2 Prediksi komponen hasil analisis LC-MS fraksi kloroform 51 6.3 Prediksi komponen hasil analisis LC-MS fraksi air 51
DAFTAR GAMBAR
1.1 Tanaman Torbangun Plectranthus amboinicus (Lour.) Spreng 2 2.1 Struktur kimia komponen fenolik sederhana (kiri). Struktur kimia
flavonoid (kanan)
8
2.2 Mekanisme apoptosis melalui berbagai jalur (Elmore 2007) 12 2.3 Mekanisme induksi cell cycle arrest dan apoptosis oleh suatu
komponen anthraquinone DHAQC (Yeap et al. 2015)
14
3.1 Tanaman torbangun yang ditanam di kebun Percobaan Leuwikopo, IPB
16
3.2 Bagan alir proses ekstraksi dan fraksinasi bertingkat 18 3.3 Bagan alir identifikasi fraksi aktif tanaman torbangun 19 4.1 Total fenol ekstrak dan fraksi daun torbangun. 25 4.2 Kemampuan antioksidan ekstrak dan fraksi daun torbangun dalam
menangkap radikal bebas DPPH ditampilkan sebagai IC50
dibandingkan dengan Vit C.
26
4.3 Korelasi antara total fenolik dan kemampuan antioksidan ekstrak dan fraksi daun torbangun.
27
4.4 Kemampuan ekstrak dan fraksi daun torbangun dalam menghambat viabilitas sel kanker MCF-7.
28
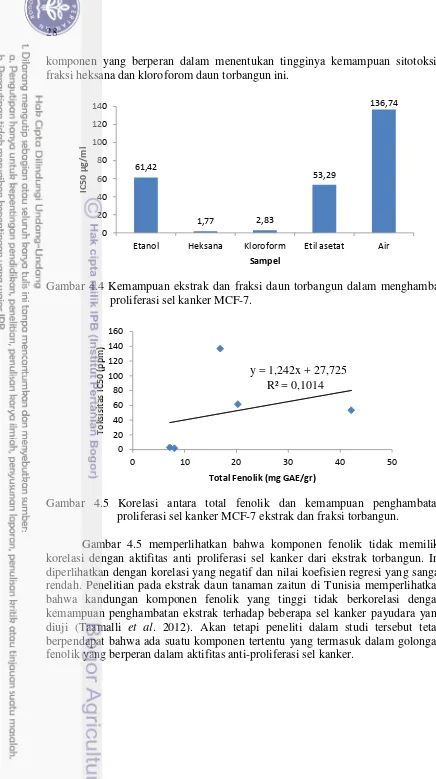
4.5 Korelasi antara total fenolik dan kemampuan penghambatan viabilitas sel kanker MCF-7 ekstrak dan fraksi torbangun.
28
5.1 OPLS score plot dari daun torbangun 36 5.2 OPLS Y-related coefficient plot dari daun torbangun 36 5.3 OPLS X-varian plot dari setiap fraksi daun torbangun pada waktu
retensi 41.28 menit
37
5.4 Kromatogram LC-MS isolat fraksi kloroform yang memperlihatkan adanya 5 puncak utama yang cenderung terelusi pada waktu retensi di bagian akhir durasi analisis
37
5.5 Spektrum massa senyawa pada waktu retensi 5.33 menit. 38 6.1 Morfologi Sel. Tanda Panah Menunjukkan Sel yang mengalami
Apoptosis
6.2 Ekspresi mRNA gen Bax dan Bcl-2 dengan perlakuan FK: fraksi koloroform dan FA: fraksi air
45
6.3 Ekspresi mRNA gen-gen penanda apoptosis akibat perlakuan fraksi koloroform
46
6.4 Ekspresi mRNA gen-gen penanda apoptosis akibat perlakuan fraksi air
47
6.5 Prediksi jalur apoptosis yang diinduksi oleh komponen dari fraksi kloroform dan fraksi air ekstrak torbangun.
49
6.6 Kromatogram LC-MS Fraksi Kloroform (A) dan Fraksi Air (B) daun torbangun
50
7.1 Komponen yang terdapat pada isolat fraksi kloroform yang ditunjuk berdasarkan hasil analisis metabolomik
55
7.2 Komponen yang teridentifikasi terdapat pada fraksi kloroform 56 7.3 Komponen yang teridentifikasi terdapat pada fraksi air 57
DAFTAR LAMPIRAN
1 Surat keterangan identifikasi tanaman 69
2 Metode uji fitokimia 70
3 Contoh perhitungan IC50 hasil uji MTT terhadap MCF-7 dari ekstrak
etanol daun torbangun
72
4 Nilai IC50 ekstrak etanol tanaman torbangun serta nilai 1/IC50 untuk
diinput dan dianalisa menggunakan OPLS (SIMCA Ver. 14)
73
5 Daftar primer yang digunakan dalam uji Real Time PCR 73 6 Contoh perhitungan ekspresi gen p21 dari data Real Time PCR 74 7 Hasil analisis statistik ANOVA dan uji beda nyata Duncan gen Bax
dan Bcl-2 dengan SPSS 21
75
8 Hasil analisis statistik ANOVA dan uji beda nyata Duncan gen p53, caspase 1, p21, caspase 9 dan caspase 7 pada perlakuan fraksi kloroform dengan SPSS 21
76
9 Hasil analisis statistik ANOVA dan uji beda nyata Duncan gen p53, caspase 1, p21, caspase 9 dan caspase 7 pada perlakuan fraksi air dengan SPSS 21
78
DAFTAR SINGKATAN
ACTB Actin-beta
APCI Atmospheric pressure chemical ionization ATCC American type culture collection
ATP Adenosine triphosphate CDK Cyclin dependent kinase DMSO Dimethyl sulfoxide DNA Deoxyribo nucleic acid DPPH 1,1-diphenyl-2-picrylhydrazyl EGFR Estrogen growth factor receptor ER Estrogen receptor
ESI Electrospray ionization FasL Fas Ligand
FBS Fetal bovine serum GAE Gallic acid equivalent
GC-MS Gas chromatography-mass spectrometry HER-2 Human epidermal growth factor receptor-2 HPLC High performance liquid chromatography IC50 Half maximal inhibitory concentration
ICE Interleukin-1β converting enzyme
LC-MS Liquid chromatography-mass spectrometry LDH Lactate dehydrogenase
LJA Laboratorium Jasa Analisis m/z Mass to charge ratio
MALDI Matrix assisted laser desorption MCF-7 Michigan Cancer Foundation-7 mRNA Messenger RNA
MTT 3(4,5-dimethylthiazol-2-yl)-2,2-diphenyltetrazolium bromide MW Molecular weight
MWD Multi wavelength detector MVDA Multi variate data analysis NMR Nuclear magnetic ressonance
OPLS Orthogonal Projection to Latent Structure PBS Phosphate buffer saline
PCA Principle component analysis PCNA Proliferating cell nuclear antigen PLS Partial least square
PSSP Pusat Studi Satwa Primata
qRT-PCR Quantitative Real Time-Polimerase Chain Reaction RNA Ribonucleic acid
SEAFAST South East Asian Food and Agricultural Science and Technology SRB Sulphorodhamine B
DAFTAR PUBLIKASI
1. Yulianto W, Andarwulan N, Giriwono PE, Pamungkas J. HPLC-based Metabolomics to Identify Cytotoxic Compounds from Plectranthus amboinicus (Lour.) Spreng Against Human Breast Cancer MCF-7 Cells. Journal of Chromatography B. Elsevier. Status Review 2nd(6 Oktober 2016). 2. Yulianto W, Andarwulan N, Giriwono PE, Pamungkas J. Bioactive
1 PENDAHULUAN
1.1Latar Belakang
Kanker merupakan salah satu penyakit yang menjadi penyebab utama kematian di dunia. Diperkirakan 14.1 juta kasus baru kanker terdeteksi pada tahun 2012 dan telah merenggut 8.2 juta jiwa. Kanker payudara merupakan jenis kanker terbanyak yang diderita oleh kaum wanita yakni 25% dari seluruh kasus kanker (Torre et al. 2015). Di Indonesia sendiri dari 1.5 juta kematian pada tahun 2014 berdasarkan data WHO 2014, sebanyak 8 persennya disebabkan oleh kanker. Dari sejumlah 92.200 kasus kanker pada wanita, sebanyak 48.998 kasus (21.4%) merupakan kanker payudara (WHO 2014). Masalah akibat kanker ini diperkirakan akan terus meningkat seiring peningkatan jumlah penduduk dan perubahan gaya hidup yang menjadi faktor pemicu terjadinya kanker (Torre et al. 2015).
Penanganan kanker saat ini masih sebagian besar didominasi oleh penggunaan metode kemoterapi karena efektif dalam membunuh sel kanker. Akan tetapi metode ini memiliki efek samping yakni kurang selektif dalam menyerang sel target sehingga aksinya tidak hanya menyerang sel kanker namun sel normal yang memiliki kecepatan pertumbuhan tinggi seperti sel-sel sumsum tulang, sel folikel rambut, dan sel-sel mukosa organ pencernaan juga menjadi sasaran kemoterapi tersebut (Chaveli-López 2014).
Komponen bioaktif yang berasal dari alam mulai mendapatkan sorotan untuk dikembangkan sebagai terapi alternatif dalam menangani kanker karena dianggap memiliki efek samping yang lebih kecil dibandingkan dengan penggunaan kemoterapi (Greenwell dan Rahman 2015). Tanaman merupakan sumber yang sangat kaya akan komponen metabolit sekunder alami yang saat ini banyak diteliti bioaktifitasnya untuk dikembangkan menjadi obat kanker (Shah et al. 2013). Salah satu tanaman yang secara farmakologis telah digunakan untuk menangani berbagai penyakit termasuk kanker karena memiliki kemampuan sitotoksik adalah Plectranthus amboinicus (Lour.) Spreng (Khare et al. 2011), yang dalam Bahasa Indonesia dikenal sebagai tanaman torbangun (Khattak et al. 2013). Masyarakat Batak menyebut tanaman ini dengan daun bangun-bangun karena dalam bahasa lokal Simalungun ”bangun” berarti bangkit yang menunjukkan kepercayaan masyarakat bahwa daun bangun-bangun dapat membangkitkan dan memulihkan kondisi ibu yang lemah setelah melahirkan (Damanik 2005).
Dalam bahasa Latin tanaman ini disebut Plectranthus amboinicus (Lour.) Spreng yang memiliki beberapa synonim yaitu Plectranthus aromaticus Roxb, Coleus amboinicus Lour dan Coleus aromaticus Benth (Lukhoba et al. 2006). Dalam bahasa Inggris tanaman ini memiliki beberapa nama antara lain Country-borage atau Indian-borage, Indian-mint, French-thyme, Mexican-mint, Soup-mint, Spanish-thyme. Di beberapa wilayah tanaman ini dikenal dengan berbagai istilah yaitu; Karpuravalli (Tamil), Pattharachuur (Bengal), Oreille, Hung Chanh, Maxian-thyme yang menunjukkan luasnya penyebaran tanaman ini terutama di daerah tropis (Khare et al. 2011).
mencapai ketinggian satu meter. Daunnya berwarna hijau muda, berbentuk lonjong bergerigi kasar dan tebal (Arumugam et al. 2016; Bhattacharjee 2010).
Sistematika taksonomi tanaman ini adalah sebagai berikut (Bhattacharjee 2010):
Kingdom : Plantae
Sub kingdom : Viridaeplantae Phylum : Tracheophyta Division : Magnolophyta Class : Magnoliopsida Subclass : Asteridae Order : Lamiales Family : Lamiaceae Genus : Coleus Species : Amboinicus
Nama latin : Coleus aromaticus Benth, Plectranthus amboinicus (Lour.) Spreng
Gambar 1.1. Tanaman torbangun (Plectranthus amboinicus (Lour.) Spreng)
Tanaman Plectranthus amboinicus (Lour.) Spreng telah dimanfaatkan di berbagai negara di dunia sebagai terapi untuk mengatasi berbagai masalah kesehatan. Di India, tanaman ini biasa ditanam di halaman rumah dan digunakan untuk mengobati demam malaria, batuk, asma kronis, menghancurkan batu ginjal, gangguan fungsi hati, bronchitis, sakit perut, diare dan epilepsy (Kaliappan dan Viswanathan 2008; Khare et al. 2011). Di Filipina tanaman ini digunakan untuk mengobati sakit kepala, sakit perut dan perut kembung, rematik dan sakit telinga. Di Kuba tanaman ini dimanfaatkan sebagai campuran untuk mengobati infeksi katarak (Khare et al. 2011). Di Brazil tanaman ini terkenal untuk mengobati inflamasi dan tumor (Brandao et al. 2013; Gurgel et al. 2009). Di Indonesia tanaman ini secara turun temurun digunakan sebagai stimulan untuk meningkatkan produksi ASI pasca melahirkan (Damanik 2009).
sistem imun pada ikan (Sunitha et al., 2010), anti rheumatoid arthritis (Chang et al. 2010), anti-convulsant atau anti kejang (Bhattacharjee 2010), penghilang rasa nyeri (Chen et al. 2014; Chiu et al. 2012; Seham S El-hawary et al. 2012), anti hyperglycemic dan anti hyperlipidemic (Viswanathaswamy et al. 2011), serta anti inflamasi (Chang et al. 2010; Chen et al. 2014; Chiu et al. 2012; Seham S El-hawary et al. 2012; Gurgel et al. 2009; Ravikumar et al. 2009).
Plectranthus amboinicus (Lour.) Spreng dalam bentuk minyak essensial memperlihatkan aktifitas antimikroba terhadap berbagai jenis mikroba seperti bakteri dan fungi penyebab infeksi saluran reproduksi wanita (Pritima dan Pandian 2005), terhadap methicillin resistantStaphylococcus aureus (De Oliveira et al. 2013), dan terhadap bakteri pathogen lainnya (Bhatt dan Negi 2012; Seham S. El-hawary et al. 2012). Minyak essensial tanaman torbangun juga dilaporkan memiliki kemampuan anti ketombe yang disebabkan oleh fungi Malassezia furfur (Selvakumar et al. 2012), dan studi oleh (Murthy et al. 2009) membuktikan bahwa minyak essensial torbangun mampu menghambat produksi toxin oleh Aspergillus ochraceus sehingga dapat diaplikasikan sebagai fungitoksikan pada komoditi pangan yang disimpan.
Adapun yang berkaitan dengan kemampuan anti kanker dari ekstrak tanaman torbangun, telah dilaporkan berdasarkan studi yang dilakukan menggunakan mencit yang diinduksi tumor ehrlich ascites carcinoma (Brandao et al. 2013; Gurgel et al. 2009). Sementara kemampuan anti-proliferasi terhadap sel kanker dilaporkan oleh (Seham S. El-hawary et al. 2012; Minker et al. 2007) dan (Hasibuan 2013). Namun studi-studi tersebut belum membahas komponen bioaktif apa yang berperan dalam aktifitas anti kanker atau sitotoksik tersebut berikut mekanisme yang terjadi pada tingkat seluler. Oleh karena itu, perlu dilakukan penelitian yang membahas lebih mendalam komponen bioaktif pada tanaman torbangun yang berperan dalam penghambatan viabilitas sel kanker khususnya sel kanker payudara MCF-7 yang digunakan sebagai model dalam penelitian ini.
1.2Perumusan Masalah
Tanaman torbangun secara empiris memiliki kemampuan bioaktif untuk mengobati berbagai jenis penyakit pada manusia dan telah terbukti berlaku pula pada berbagai hewan mamalia. Akan tetapi fakta empiris tersebut belum menjelaskan komponen apa yang terdapat dalam tanaman Torbangun yang bersifat bioaktif, serta bagaimana mekanisme aktifitas komponen tersebut. Untuk mengetahui identitas komponen yang terkandung dalam suatu bahan alami diperlukan serangkaian tahapan proses yakni ekstraksi, fraksinasi, isolasi dan identifikasi. Dalam setiap tahapan terdapat variasi alternatif metode yang beragam dimana setiap metode menentukan hasil yang akan diperoleh. Keberagaman ini merupakan hambatan tersendiri dalam upaya menentukan komponen yang bersifat aktif dari suatu bahan alami.
diperoleh melalui hasil eksperimen baik secara in vivo maupun in vitro. Pemilihan penggunaan uji in vitro selain karena pertimbangan keunggulan kemudahan teknis dan ekonomis, tetapi juga lebih mampu menjelaskan korelasi antara aktifitas biologis dan perlakuan tanpa adanya intervensi berbagai faktor yang kompleks sebagaimana terdapat dalam uji in vivo. Sel MCF-7 digunakan dalam penelitian ini dengan pertimbangan bahwa sel tersebut merupakan galur sel kanker payudara yang paling banyak digunakan di dunia yang memiliki karakteristik responsif terhadap pengaruh hormon dan kemoterapi (Holliday and Speirs 2011). Dengan karakteristik tersebut maka MCF-7 sangat ideal untuk dijadikan model dalam melihat respon sel akibat pengaruh paparan komponen kimia bioaktif dari ekstrak tanaman yang diujikan.
1.3Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk membuktikan peran komponen bioaktif tanaman torbangun sebagai penghambat viabilitas sel kanker secara in vitro.
Tujuan khusus penelitian ini adalah sebagai berikut:
1. Mengetahui profil komponen bioaktif dan kapasitas antioksidan ekstrak dan fraksi torbangun serta melihat korelasinya dengan kemampuan sitotoksik yang dimiliki oleh ekstrak dan fraksi tersebut terhadap sel kanker MCF-7.
2. Mengidentifikasi komponen bioaktif dalam ekstrak/fraksi daun torbangun yang berperan aktif dalam menghambat viabilitas sel kanker MCF-7 menggunakan metode matabolomik.
3. Mengidentifikasi mekanisme komponen bioaktif dalam ekstrak dan fraksi daun torbangun yang mempengaruhi ekspresi gen yang berkaitan dengan apoptosis pada sel kanker MCF-7.
1.4 Hipotesis
1. Komponen bioaktif dalam ekstrak dan fraksi daun torbangun memiliki korelasi dengan kapasitas antioksidan dan kemampuan penghambatan viabilitas sel kanker MCF-7.
2. Komponen golongan fenolik kemungkinan merupakan komponen yang berperan aktif dalam penghambatan viabilitas sel kanker MCF-7.
3. Komponen bioaktif dalam fraksi daun torbangun mampu menginduksi terjadinya apoptosis melalui jalur transduksi sinyal baik intrinsik maupun ekstrinsik.
1.5Kebaruan Penelitian
1. Penelitian ini mengidentifikasi komponen bioaktif dalam tanaman torbangun yang berperan dalam menghambat viabilitas sel kanker MCF-7 yakni berupa komponen diterpenoid yang diisolasi dari fraksi kloroform.
2 TINJAUAN PUSTAKA
2.1Potensi Anti Kanker Tanaman Torbangun
Tanaman torbangun Plectranthus amboinicus (Lour.) Spreng secara empiris telah digunakan di Brazil sebagai obat inflamasi dan tumor. Sebuah studi in vivo dilakukan oleh (Brandao et al. 2013) untuk membuktikan secara ilmiah kemampuan bioaktifitas tanaman tersebut dengan menggunakan mencit Swiss albino yang diinduksi Ehrlich ascites carcinoma pada jaringan di bawah kulit. Ekstrak hidroalkohol tanaman torbangun disuntikkan secara intraperitonial dengan dosis 200 mg/kg BB per hari selama 7 hari berturut. Hasil penelitian menunjukkan bahwa pemberian ekstrak mampu menurunkan volume cairan dalam perut (ascites) dan menurunkan secara signifikan jumlah sel Ehrlich carcinoma kelompok mencit perlakuan dibandingkan kontrol.
Sebelumnya penelitian serupa dilakukan oleh (Gurgel et al. 2009) menggunakan 2 jenis kanker yakni Sarcoma-180 selain Ehrlich ascites carcinoma. Perlakuan berupa injeksi intraperitonial ekstrak hidroalkohol torbangun dengan dosis 100, 150, 250 dan 350 mg/kg BB serta kontrol positif berupa Metrotexat 10 mg/kg. Diperoleh hasil bahwa perlakuan dengan dosis 350 mg/kg memberikan penghambatan tertinggi (66%) terhadap tumor Sarcoma-180, sedangkan dosis 100 mg/kg memberikan penghambatan tertinggi (74%) untuk tumor Ehrlich ascites carcinoma, sementara Metrotexat memberikan penghambatan hampir 100%. Namun kedua studi tersebut tidak melakukan analisa komponen yang ada di dalam ekstrak hidroalkohol yang dijadikan sebagai perlakuan. Sejauh ini hanya dua studi tersebut yang melaporkan hasil penelitian yang menggunaan ekstak tanaman torbangun untuk aktifitas anti kanker secara in vivo.
Tabel 2.1. Uji aktifitas sitotoksik ekstrak daun torbangun terhadap sel kanker
No Jenis sampel
Nilai IC50 (µg/ml)
Metode Ref.
HEPG2 MCF-7
1 Ekstrak etanol 70% dievaporasi vakum
24.5 22.5 SRB assay [1]
2 Ekstrak rebusan air yang diliofilisasi
25.8 18.2 SRB assay [1]
3 Jus segar yang diliofilisasi
10.1 6.8 SRB assay [1]
4 Ekstrak n-heksana - 63.6 MTT assay [2] 5 Ekstrak etil asetat - 7.6 MTT assay [2] 6 Ekstrak etanol - 1382.8 MTT assay [2]
7 Minyak esensial - 53 MTT assay [3]
Ket: SRB (Sulphorodhamine B)
MTT (3-(4,5-dimethyltiazol-2-yl)2,2-diphenyltetrazolium bromide)
Penelitian yang mengamati aktifitas anti-proliferasi sel kanker dari ekstrak tanaman torbangun secara in vitro khususnya terhadap sel MCF-7 dan HEPG2 telah dilaporkan oleh beberapa studi (Seham S. El-hawary et al. 2012; Hasibuan 2013; Minker et al. 2007; Thirugnanasampandan et al. 2015) sebagaimana terlihat pada Tabel 2.1. Studi in vitro tersebut juga belum mengupas secara detil komponen bioaktif yang berperan dalam aktifitas penghambatan proliferasi sel kanker. El-hawary et al. (2012) sempat mengarakterisasi komponen bioaktif pada ekstrak hidroalkohol yang digunakan namun belum membahas bagaimana mekanisme komponen yang diidentifikasi tersebut dalam penghambatan viabilitas sel.
2.2Metode Uji Viabilitas Sel Kanker
Beberapa jenis metode uji telah dikembangkan dan digunakan untuk mengukur viabilitas dan sitotoksisitas secara in vitro termasuk pewarnaan dye (inclusion atau exclusion) dan uji pembentukan koloni. Akan tetapi banyak dari metode-metode bersifat rumit dan kompleks dalam pengerjaan, membutuhkan waktu lama dan kurang sensitif sehingga tidak cocok untuk metode high-throughput screening. Secara umum terdapat tiga metode utama dalam pengamatan viabilitas sel atau sitotoksisitas dalam rangka seleksi komponen untuk dikembangkan menjadi kandidat obat baru (Niles et al. 2008):
Berdasarkan metabolisme aktifitas reduktase
Beberapa metode telah dikembangkan untuk memperkirakan viabilitas sel berdasarkan parameter metabolisme seluler termasuk yang menggunakan prinsip reduksi tetrazolium atau resazurin. Komponen tetrazolium dapat dikonversi menjadi formazan yang dapat merubah warna media. Konversi ini dilakukan oleh enzim lactate dehydrogenase yang banyak dihasilkan oleh sel yang mengalami proliferasi (DeBerardinis et al. 2008). Satu dari beberapa jenis tetrazolium yang pertama digunakan adalah MTT ( 3(4,5-dimethylthiazol-2-yl)-2,2-diphenyltetrazolium bromide). Hasil pengamatan dapat dibaca menggunakan multi-well microplate reader dan mampu memperlihatkan tingkat akurasi yang tinggi. Beberapa kelebihan penggunaaan MTT ini antara lain: praktis yakni tanpa ada tahapan pencucian, dapat dilakukan dengan cepat dengan akurasi yang tinggi, dan tidak membutuhkan penggunaan radioisotop yang beresiko (Mosmann 1983). Salah satu kekurangan MTT adalah formazan yang terbentuk tidak dapat larut pada media sehingga diperlukan satu tahapan lagi sebelum pembacaan absorbansi yakni pelarutan kristal formazan dengan DMSO atau isopropanol (Niles et al. 2008). Meskipun demikian MTT merupakan metode yang telah luas digunakan untuk mengamati proliferasi sel dan sitotoksisitas (Berridge et al. 1996).
Berdasarkan pengukuran ATP
dari luciferase pada kunang-kunang yang dapat menghasilkan signal yang berpendar. Salah satu kelebihan metode ini adalah sensitifitas yakni mampu mendeteksi ATP hingga jumlah <10 sel per sumur. Selain ini metode ini mampu mendeteksi kondisi persis saat dilakukan analisa, yang berbeda halnya dengan reduksi tetrazolium yang memerlukan waktu beberapa jam inkubasi untuk konversi tetrazolium menjadi formazan (Niles et al. 2008).
Berdasarkan enzim yang dirilis
Cara ketiga untuk mendeteksi sel yang mati adalah dengan mengukur aktifitas enzim yang merupakan marka atau penanda sel yang mati. Salah satunya adalah enzim lactate dehydrogenase (LDH). Aktifitas LDH dapat diukur secara tidak langsung melalui perlakuan sampel menggunakan reagen kimia yang mengandung laktate, NAD+, diaphorase dan pewarna redoks yang sesuai seperti resazurin yang dapat menghasilkan perubahan absorbansi atau perubahan profil fluorescence (Niles et al. 2008)
2.3Komposisi dan Komponen Bioaktif Tanaman Torbangun
Secara umum khasiat yang dimiliki oleh bahan pangan bergantung pada komposisi bahan pangan tersebut. Plectranthus amboinicus (Lour.) Spreng merupakan tanaman yang kaya akan nutrisi, yakni serat pangan tak terlarut (1,56%), protein (0,6%), serat pangan terlarut (0,31%), mineral-mineral (kalsium, fosfor, kalium, natrium, magnesium), trace mineral (zat besi, seng, tembaga, chromium), oksalat terlarut (0.02%). vitamin-vitamin (asam askorbat, tiamin), dan asam fitat (Gupta et al. 2005).
Santosa dan Hertiani (2005) menganalisa secara kualitatif komponen dalam ekstrak air daun torbangun yang dapat meningkatkan kemampuan fagositosis sel neutrofil. Hasil analisa menggunakan TLC (thin layer chromatography) menunjukan keberadaan senyawa polifenol, saponin, glikosida flavonol dan minyak atsiri (Santosa and Hertiani 2005). Rout et al. (2010) melakukan uji kualitatif komponen torbangun yang berasal dari ekstraksi menggunakan berbagai pelarut yaitu air, metanol, kloroform, dan petroleum eter. Analisa TLC memperlihatkan bahwa pada ekstrak air terdapat senyawa flavonoid, protein, asam amino, tannin, fenolik, terpenoid, karbohidrat, glikosida dan alkaloid. Demikian pula pada ekstrak metanol yang memberikan hasil yang sama dengan ekstrak air. Sementara pada ekstrak kloroform terdapat senyawa saponin, terpenoid dan steroid. Sedangkan pada ekstrak petroleum eter hanya terdapat senyawa saponin dan steroid.
Uji kualitatif juga dilakukan oleh Prameela dan Saj (2011) pada ekstrak metanol, kloroform dan petroleum eter. Hasil uji menunjukkan bahwa pada ekstrak metanol terdapat steroid, terpenoid, tannin dan saponin. Pada ekstrak kloroform terdapat gula reduksi, flavonoid, terpenoid, tannin, coumarin dan antraquinone. Sementara pada ekstrak petroleum eter mengandung steroid, coumarin dan saponin. Berdasarkan uji kuantitatif pada studi yang sama menunjukkan bahwa torbangun mengandung total karbohidrat (2.8), total selulosa (1.7), total protein (9.36), total fenol (0.03) dan total tannin (0.68) mg/g berat.
dengan ekstrak hidroalkohol dan bentuk kering beku. Hasil menunjukkan bahwa total fenol tertinggi berasal dari ekstrak etil asetat (±59) kemudian ekstrak aseton (±52), ekstrak hidroalkohol (±33), bentuk kering beku (±25), ekstrak metanol (±23) dan ekstrak heksana (±11) mg GAE/g ekstrak. Kandungan total fenol tersebut sejalan dengan kemampuan bioaktifitasnya dimana kemampuan antioksidan tertinggi ditunjukkan oleh ekstrak etil asetat dan kemampuan antibakteri tertinggi oleh ekstrak aseton (Bhatt and Negi 2012).
Hasil uji aktifitas antioksidan oleh Bhattacharjee (2010) menunjukkan bahwa ekstrak etanol yang berasal dari bagian daun tanaman torbangun memiliki aktifitas antioksidan tertinggi dibandingkan bagian tanaman lainnya yakni batang dan akar. Hal ini disebabkan karena kandungan total fenolik, flavonoid, alkaloid dan saponin juga lebih tinggi pada bagian daun dibandingkan batang dan akarnya. Dilaporkan bahwa pada ekstrak daun torbangun terdapat total fenolik (19,62 ± 0.83), flavonoid (4,21 ± 0.39), alkaloid (4,3 ± 0,74) dan saponin (2,09 ± 0,33) dalam persen berat/berat. Namun seluruh bagian tanaman ini memperlihatkan keberadaan komponen alkaloid, flavonoid, saponin, tannin, triterpenoid, sedangkan karotenoid hanya terdapat pada daun dan batangnya.
Gambar 2.1 Struktur kimia komponen fenolik sederhana (kiri). Struktur kimia flavonoid (kanan) (Garcia-Salas et al. 2010)
Studi review menyebutkan bahwa komponen volatile utama pada daun torbangun yang berkontribusi terhadap bioaktifitasnya antara lain carvacrol, thymol dan -caryophyllene (Khare et al. 2011). Pada penelitian oleh Murthy et al. (2009) diperoleh komponen volatile utama yang bersifat fungitoxic adalah carvacrol (70%), -caryophyllene (6.2%), p-cymene (5.6%), -terpinene (5.3%), 4-terpinenol (1.2%), α-cubebene (0.8%), α-bergamotene (γ.9%), α-caryophyllene (1.9%) dan eudesma-4,11-diene (1.8%). Penelitian lain oleh Selvakumar et al, (2011) melaporkan komponen volatile pada minyak esensial tanaman torbangun yang memiliki kemampuan bioaktif didominasi oleh komponen thymol (41.3%), 1,8-cineol (21.45%) dan carvacrol (13.25%).
2.3 Metabolomik
kemudian dapat dihubungkan dengan pengamatan yang diperoleh melalui sistem uji biologis tanpa harus mengisolasi komponen-komponen aktifnya (Yuliana et al. 2010).
[image:31.595.105.518.374.533.2]Tujuan utama metabolomik adalah untuk mengukur semua metabolit dalam suatu organisme secara kualitas dan kuantitas, sehingga dapat memberikan gambaran yang jelas mengenai organisme tersebut dalam kondisi tertentu (Kim et al. 2010). Untuk menganalisa metabolome, terdapat lima pendekatan utama yang saat ini digunakan yakni HPLC atauTLC-UV, GC-MS, LC-MS, MSn, dan NMR spektrofotometri. Masing-masing memiliki kelebihan dan kekurangan (Tabel 2.2). MS (mass spectrometry) dan NMR (nuclear magnetic ressonance) spektroskopi merupakan metode yang paling umum digunakan (Verpoorte et al. 2008). MS biasanya digabungkan dengan pemisahan kromatografi seperti gas chromatography (GC) dan high performance liquid chromatography (HPLC). GC-MS memperlihatkan sensitifitas dan resolusi yang tinggi dan pola fragmentasi yang bersifat reproducible. Database komersial sangat membantu dalam mengidentifikasi metabolit. Akan tetapi keterbatasan yang dimiliki GC-MS adalah rendahnya kisaran polaritas dan berat molekul yang dapat dideteksi. Komponen-komponen dengan struktur yang kompleks seperti metabolit sekunder tanaman yang berbentuk glikosida tidak dapat dianalisa menggunakan GC-MS.
Tabel 2.2 Perbandingan metode analisis yang digunakan dalam metabolomik HPLC /
TLC-UV GC-MS LC-MS MS
n
NMR
Preparasi sampel ++ - - + +++
Reproducibility - + - + +++
Absolute quantitation - - - - +++
Relative quantitation + ++ + ++ +++
Identitas + ++ ++ ++ ++
Jumlah komponen (±) 30 1000 200 1000 200
Kepekaan + ++ ++ +++ -
Skala dari – hingga +++ untuk sangat kurang hingga sangat baik Sumber: Verpoorte et al. (2008)
Untuk menganalisa metabolit yang polar digunakan metode soft ionisation MS seperti electrospray ionization (ESI), atmospheric pressure chemical ionization (APCI) atau matrix assisted laser desorption (MALDI). Kelebihan yang dimiliki oleh metabolomik berbasis MS ini adalah tingginya kisaran berat molekul dan polaritas serta akurasi berat molekul yang mampu dianalisa. Akan tetapi kondisi ionisasi dan matriks mempengaruhi perbedaan sensitifitas molekul sehingga mengurangi reproducibility. Selain itu masih minimnya database pada LC-MS mengharuskan untuk dilakukan identifikasi secara manual (Verpoorte et al. 2008).
berupa komposisi biomolekul suatu ekstrak kasar. NMR merupakan detektor universal dimana setiap signal memberikan informasi langsung mengenai struktur kimia suatu molekul. Spektrum NMR merupakan karakteristik fisik dari suatu komponen sehingga bersifat sangat reproducible. Ini menjadi kelebihan utama NMR sehingga metabolomik berbasis data NMR dapat digunakan terus menerus selama metode ekstraksi dan pelarut NMR yang digunakan tetap sama (Verpoorte et al. 2008). Salah satu kendala dalam aplikasi NMR adalah biaya yang cukup signifikan sehingga dalam hal ini HPLC menjadi alternatif dan Maser et al. (2014) telah melaporkan keberhasilan penggunakan HPLC dalam metabolomik untuk mengidentifikasi komponen antibakteri buah takokak (Solanum torvum Swart). Penggunaan teknologi LC-MS berdasarkan review (Wishart 2008) memiliki beberapa keunggulan antara lain sensitifitas yang tinggi, sampel dapat langsung diinjeksi tanpa pemisahan terlebih dahulu, membutuhkan jumlah sampel yang minimum, mendeteksi hampir semua komponen organik dan sebagian anorganik. Namun LC-MS ini memiliki beberapa kelemahan antara lain: tidak bersifat kuantitatif, membutuhkan waktu running yang cukup lama (beberapa puluh menit per sampel), resolusi pemisahan komponen kurang baik dan kurang reproducible, serta sulit mengidentifikasi komponen yang novel karena terbatasnya database.
Terdapat dua metode pendekatan dalam hal pemrosesan dan interpretasi data metabolomik yang berkembang saat ini. Pertama adalah pendekatan chemometric di mana komponen-komponen kimia secara umum tidak diidentifikasi, melainkan pola spektra dan intensitasnya dicatat untuk kemudian secara statistik dibandingkan untuk menentukan spektra tertentu yang menjadi pembeda antar kelompok (Wishart 2008). Adapun pendekatan kedua adalah metabolomik kuantitatif atau targeted profiling yang menitikberatkan pada usaha untuk mengidentifikasi dan atau mengkuantifikasi sebanyak mungkin komponen di dalam sampel. Ini biasanya dilakukan dengan membandingkan data spektra NMR atau MS dari sampel dengan spektra komponen murni pada referensi atau database. Begitu komponen teridentifikasi dan terkuantifikasi maka data kemudian diproses secara statistik untuk menentukan biomarker atau pathway metabolik yang penting.
2.4 Galur Sel Kanker Payudara
Galur sel kanker payudara yang pertama ditemukan adalah BT-20 pada tahun 1958. Salah satu keuntungan menggunakan galur sel dalam penelitian adalah memungkinkan untuk menyediakan populasi sel yang relatif homogen yang memiliki kemampuan bereplikasi sendiri dalam medium kultur sel standar. Baru sekitar 25 tahun kemudian ditemukan MCF-7 oleh Michigan Cancer Foundation yang menjadi paling populer digunakan di dunia saat ini. Hal ini disebabkan karena MCF-7 memiliki sensitifitas hormon yang tinggi dengan adanya estrogen receptor (ER) yang menjadikannya ideal sebagai model untuk mempelajari pengaruh hormon. Saat ini telah banyak galur sel kanker yang telah dikembangkan yang berasal baik dari sel tumor primer, pleural effusions atau jaringan metastasis yang terdapat pada pasien. Sel-sel tersebut telah tersedia secara komersial di berbagai bank sel (Holliday dan Speirs 2011).
Pada mulanya sel-sel kanker dapat dikelompokkan berdasarkan morfologinya seperti tipe histologi, tingkatan tumor, status lymph node dan keberadaan marka seperti ER dan yang mutakhir human epidermal growth factor receptor 2 (HER2). Namun dengan berkembangnya molecular profiling menggunakan DNA microarray maka heterogenitas tersebut dapat dibuktikan melalui profiling ekspresi gen. Sehingga sel kanker dapat dikelompokkan menjadi 5 sub-tipe sebagaimana tercantum dalam tabel 2.3.
Tabel 2.3. Klasifikasi molekuler sel kanker payudara
Sub tipe Profil
immunologi Karakteristik lain
Contoh galur sel
Luminal A ER+, PR+/-, HER2
-Ki67 rendah, responsif thd endokrin, umumnya responsif thd kemoterapi
MCF7, T47D, SUM185
Luminal B ER+, PR+/-, HER2
+
Ki67 tinggi, biasanya responsif thd endokrin, variatif kepekaan thd kemoterapi, HER2
+
adalah responsif terhadap trastusumab (antibodi)
BT474, ZR75
Basal ER-, PR-, HER2
-EGFR+ dan atau sitokeratin 5/6+, Ki67 tinggi, tidak responsif thd endokrin, umumnya responsif thd kemoterapi
MDA-MB468, SUM190
Claudin-low
ER-, PR-, HER2
-Ki67, E-cadherin, claudin-3, claudinin-4 dan claudinin-7 rendah, kepekaan sedang thd kemoterapi
BT549, MDA-MB231, SUM1315
HER2 ER-, PR-, HER2
+
Ki67 tinggi, responsif terhadap
trastusurmab, responsif thd kemoterapi
SKBR3, MDA-MB453 Ket: EGFR: epidermal growth factor receptor, ER: estrogen receptor, HER2: human epidermal growth factor receptor 2, PR: progesterone receptor.
Sumber: Holliday and Speirs (2011)
2.5Mekanisme Apoptosis
normal selama perkembangan dan pertumbuhan sel dan merupakan suatu mekanisme homeostasis untuk mempertahankan kestabilan populasi sel dalam suatu jaringan. Selain itu apoptosis merupakan suatu mekanisme pertahanan seperti saat terjadi reaksi imun atau saat sel mengalami kerusakan oleh penyakit atau substansi beracun (Elmore 2007).
Secara morfologi sel yang mengalami apoptosis memiliki karakteristik khusus yang dapat dibedakan dengan jenis kematian sel yang lain seperti nekrosis. Pada tahap awal apoptosis sel mengalami pengkerutan dan pyknosis yang dapat diamati melalui mikroskop cahaya. Sel mengkerut dengan ukuran yang mengecil, sitoplasma semakin pekat serta organel-organel semakin padat terbungkus di dalam sel. Pyknosis adalah hasil dari kondensasi kromatin dan ini merupakan ciri utama apoptosis. Kemudian terjadi blebbing pada membran plasma yang diikuti dengan karyorrhexis dan pemisahan bagian-bagian sel membentuk apoptotic bodies. Apoptotic bodies terdiri atas sitoplasma dengan organel yang padat terbungkus dengan atau tanpa pecahan inti sel. Integritas organel masih dapat dipertahankan karena masih berada di dalam membran plasma yang masih utuh. Apoptotic bodies ini kemudian difagositasi oleh makrofag, sel-sel parenkim atau sel-sel neoplastik dan kemudian didegradasi selama proses fagolisosom (Elmore 2007).
Mekanisme apoptosis sangat rumit dan kompleks yang melibatkan tahapan molekuler reaksi berantai yang bergantung pada energi. Hingga saat ini terdapat dua jalur utama apoptosis yakni ekstrinsik dan intrinsik . Terdapat satu jalur tambahan yakni yang melibatkan sitotoksisitas yang dimediasi oleh selT dan kematian sel yang bergantung pada perforin-granzyme. Ketiga jalur tersebut bertemu pada satu titik yakni tahap eksekusi yang diawali dengan pembelahan oleh caspase-3 mengakibatkan fragmentasi DNA, degradasi protein penyusun sel dan inti sel, protein crosslinking, pembentukan apoptotic bodies, ekspresi ligan untuk reseptor sel-sel fagosit dan akhirnya proses fagositosis.
[image:34.595.64.484.153.813.2]
Meskipun melalui jalur yang berbeda namun molekul pada satu jalur dapat mempengaruhi molekul-molekul pada jalur yang lain (Elmore 2007). Pada jalur intrinsik, apoptosis diinduksi oleh rangsangan tanpa mediasi reseptor yang kemudian menghasilkan signal dan secara langsung bereaksi pada target di dalam sel yakni diawali di mitokondria. Sesaat setelah terstimulasi, permeabilitas membran mitokondria akan mengalami perubahan dan mengakibatkan terlepasnya protein-protein pro-apoptosis seperti sitokrom c ke sitosol. Regulasi dari reaksi-reaksi tersebut diatur oleh anggota dari jenis protein Bcl-2 (Simstein et al. 2003). Molekul p53 merupakan protein penekan tumor yang pada kondisi normal levelnya rendah. p53 akan teraktivasi apabila sel terpapar oleh stimulus seperti agen yang dapat merusak DNA, hypoxia, kurangnya nukleotida atau aktivasi sel tumor. Molekul p53 merupakan upstream baik pada jalur regulator siklus sel maupun jalur apoptosis intrinsik yang dimediasi oleh kelompok protein Bcl-2 (El Deiry 1998; Elmore 2007 dan Verma et al. 2009). Protein p21 dikenal karena fungsi penghambatan pertumbuhan dengan menginduksi siklus sel melalui interaksi dengan dua domain yang berbeda. Pertama melalui interaksi dengan cyclin-dependent kinase (CDK) yang mengakibatkan terhambatnya pertumbuhan yakni tertahan pada salah satu fase siklus sel. Kedua melalui interaksi dengan molekul proliferating cell nuclear antigen (PCNA) yang mengakibatkan penghambatan sintesis DNA (Abbas dan Dutta 2009).
Baik jalur intrinsik maupun ekstrinsik keduanya bertemu pada satu titik yakni tahap eksekusi yang dianggap sebagai bagian akhir dari jalur apoptosis. Tahap ini melibatkan aktivasi caspase yang pada gilirannya mengaktivasi endonuklease sitoplasma dan protease yang akan mendegradasi materi-materi nukleus dan protein-protein penyusun sel. Begitu caspase teraktivasi sangat kecil kemungkinan untuk menghentikan terjadinya proses menuju kematian sel. Sampai saat ini ada 10 caspase utama yang telah teridentifikasi dan dikelompokkan menjadi inisiator caspase (caspase-2,-8,-9,-10), efektor atau eksekutor (caspase-3,-6,-7) dan caspase inflamasi (caspase-1,-4,-5) (Elmore 2007).
Gambar 2.3 Mekanisme induksi cell cycle arrest dan apoptosis oleh suatu komponen anthraquinone DHAQC (Yeap et al. 2015)
Apoptosis dapat dideteksi menggunakan beberapa metode antara lain: pengamatan morfologi sel, pengamatan fragmentasi DNA, deteksi caspase berikut substrat, regulator dan inhibitornya, pengamatan pada membran sel, deteksi apoptosis secara utuh pada jaringan atau embryo, serta pengamatan mitokondria (Elmore 2007).
3
METODOLOGI
3.1 Waktu dan Tempat PenelitianPenelitian dilaksanakan pada bulan September 2014 hingga Mei 2016 di beberapa Laboratorium sebagai berikut:
SEAFAST Center (South East Asian Food and Agricultural Science and Technology) IPB,
Laboratorium Mikrobiologi dan Immunologi PSSP (Pusat Studi Satwa Primata) IPB,
Kebun Percobaan Leuwikopo IPB, Laboratarium Kimia Pangan ITP IPB, Laboratorium Jasa Analisis (LJA) IPB,
Laboratorium Pelayanan Kimia Analitik Balai Penelitian Ternak Ciawi, Laboratorium BPPT Biotek Serpong,
dan Laboratorium Pusat Studi Biofarmaka IPB.
3.2 Bahan dan Alat Penelitian
Bahan
Bibit tanaman torbangun Plectranthus amboinicus (Lour.) Spreng diperoleh dari Pusat Studi Biofarmaka IPB Cikabayan. Spesimen tanaman telah diautentikasi oleh Pusat Penelitian Biologi, LIPI (Lembaga Ilmu Pengetahuan Indonesia) Cibinong Bogor (Surat Keterangan Identifikasi Tumbuhan terdapat pada Lampiran 1). Pelarut yang digunakan untuk proses ekstraksi antara lain: etanol absolut, n-heksana, kloforom, dan etil asetat diperoleh dari Merck-Germany. Kertas saring Whatman No. 42 untuk menyaring ekstrak. Berbagai pelarut standar HPLC untuk analisa HPLC dan LC-MS terdiri atas metanol, air HPLC, asam asetat, asetonitril, dan asam format. Filter membran ukuran pori 0.45 µm berbahan nylon (Minisart Sartorius) digunakan untuk preparasi sampel. Sel yang digunakan adalah sel adenokarsinoma payudara galur MCF-7 yang disediakan oleh PSSP IPB berasal dari ATCC® (American Type Culture Collection). Reagen dan bahan untuk kultur sel dan uji biologis antara lain: medium Roswell Park Memorial Institute (RPMI) 1640 (Sigma-Aldrich USA), fetal bovine serum FBS (Gibco), penicillin/streptomycin, dimethyl sulfoxide (DMSO, Merck-Germany), larutan penyangga Dulbecco’s Phosphate Buffer Saline (DPBS, Gibco), trypsin, trypane blue, ( 3-(4,5-dimethylthiazol-2-yl)-2,2-diphenyltetrazolium bromide) MTT, Rneasy Mini Kit (Qiagen) untuk ekstraksi RNA, dan iCycler One-Step qRealTime-PCR Kit (KAPA BIOSYSTEMS).
Peralatan penelitan
tabung sampel. Peralatan HPLC yang digunakan adalah (Agilent Technologies, USA) dengan Multi Wavelength Detector (MWD). Kolom C18 (150 mm x 4.6 mm i.d., ukuran partikel 5 µm). Sistem LC-MS yang digunakan yaitu UPLC-QToF-MS/MS (Waters) dan kolom Acquity UPLC BEH C18 (50 mm x 2.1 mm i.d., ukuran partikel 1.7 µm) dengan XEVO-G2QTOF (Waters, USA), model resolusi ESI positif dan MassLynk versi 4.1. Peralatan untuk kultur sel dan analisa bioteknologi yaitu: incubator CO2, Biosafety cabinet Class 2 (NuAire, USA),
microscope fluorescence (Nikon Optivat-2, Japan), hemocytometer, high speed centrifuge, microplate reader Rad, USA), dan Real Time-PCR system (Bio-Rad, USA).
3.3 Prosedur Penelitian
3.3.1 Budidaya tanaman torbangun
Tanaman torbangun ditanam di Kebun Percobaan Leuwikopo IPB yang lokasinya terletak pada posisi Lintang: -6.563682, dan Bujur: 106.725537 (NASA 2016). Lahan terlebih dahulu dipersiapkan dengan membuat bedengan dan mengaplikasikan pupuk kandang pada titik titik di mana bibit akan diletakkan. Jarak antar tanaman diperkirakan sekitar 40 cm. Tanaman dibiarkan dalam kondisi tidak ternaungi untuk memberikan peluang produksi metabolit sekunder yang optimal karena induksi panas, cahaya dan sinar UV (Akula dan Ravishankar 2011). Berdasarkan data yang diperoleh dari Badan Meteorologi, Klimatologi dan Geofisika (BMKG), curah hujan rata-rata per hari selama periode penanaman dan pemanenan (21 November 2014 – 9 Maret 2015) adalah 8.57 ± 14.64 mm. Curah hujan dalam bulan Desember 2014 adalah 200 mm yang tergolong menengah (BMKG 2016). Sedangkan rata-rata lama penyinaran sinar matahari adalah 3.94 ± 2.53 jam/hari. Tanaman dirawat dari hama dan gulma secara manual tanpa penggunaan pestisida. Penyiraman tanaman dilakukan setiap dua hari apabila diperlukan.
Ekstraksi dan fraksinasi tanaman torbangun
Pengambilan sampel
Prosedur pengambilan sampel dilaksanakan berdasarkan metode Andarwulan et al. (2014) dengan sedikit modifikasi. Secara ringkas tanaman torbangun dipanen dengan memotong daun yang tumbuh sekitar 15 cm dari ujung tiap cabang. Daun yang bersih dan bebas dari kerusakan dipilih dan langsung dikemas dalam plastik bersegel untuk kemudian langsung disimpan dalam freezer -20oC selama menunggu proses pengeringan beku. Sampel daun torbangun kemudian diliofilisasi dengan freeze dryer selama 2 x 24 jam. Daun torbangun kering kemudian dihaluskan menggunakan blender dan disaring dengan penyaring ukuran 30 mesh. Bubuk halus dimasukkan dalam kemasan plastik bersegel masing-masing 25g/kemasan, kemudian disimpan dalam freezer hingga proses selanjutnya (Andarwulan et al. 2014).
Ekstraksi dan fraksinasi komponen bioaktif
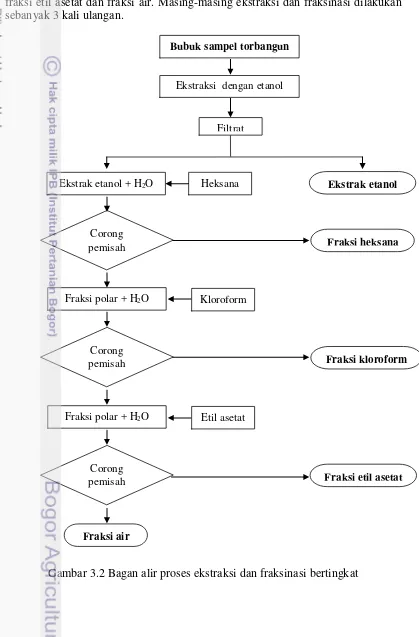
Proses ekstraksi secara umum diadaptasi dari metode Maser et al. (2015). Sejumlah bubuk sampel daun torbangun (25 g) dicampur dengan 500 ml etanol 80% dalam wadah erlenmeyer 500 ml sehingga diperoleh perbandingan sampel:pelarut (1:20, m/v). Untuk mengoptimumkan proses pengadukan maka 3 butir kelereng dimasukkan ke dalam campuran kemudian erlenmeyer dinaikkan ke atas platform shaker untuk diaduk selama 20 menit dengan kecepatan 125 rpm. Setelah itu campuran disonikasi dalam penangas ultrasound selama 50 menit. Kemudian dilakukan sentrifugasi selama 5 menit pada putaran 2000 rpm sehingga ekstrak yang menjadi supernatan dengan mudah dipisahkan dengan dekantasi. Ekstrak disaring dengan kertas Whatman no 42 dalam kondisi vakum. Filtrat kemudian ditempatkan pada botol kaca berwarna gelap, sedangkan retentate dan bubuk yang tersisa ditambahkan etanol 80% sebanyak 375 ml (1:15, m/v) untuk kemudian dilakukan ekstraksi kembali dengan metode yang sama seperti ekstraksi tahap pertama. Dari 100 gr bubuk sampel diperoleh total ekstrak sebanyak ± 3 liter. Filtrat kemudian dipekatkan menggunakan rotary evaporator pada temperatur 50oC sehingga diperoleh ekstrak etanol tanaman torbangun. Proses ekstraksi dilakukan dengan 3 kali ulangan (3 x 100 g bubuk). Ekstrak etanol pekat dibagi menjadi dua bagian yang salah satu bagian disimpan sebagai ekstrak etanol sedangkan bagian yang lain dilakukan fraksinasi.
botol kaca berwarna gelap. Sementara fraksi polar ditambahkan kembali dengan 225 ml heksana untuk dilakukan ekstraksi kembali seperti tahap sebelumnya.
[image:40.595.80.499.173.810.2]Fraksi polar hasil fraksinasi dengan heksana kemudian ditambahkan dengan kloroform untuk dilakukan fraksinasi sehingga diperoleh fraksi kloroform dan fraksi polarnya. Fraksi polar yang tersisa kemudian ditambahkan dengan etil asetat untuk dilakukan fraksinasi kembali sehingga diperoleh hasil akhir berupa fraksi etil asetat dan fraksi air. Masing-masing ekstraksi dan fraksinasi dilakukan sebanyak 3 kali ulangan.
Gambar 3.2 Bagan alir proses ekstraksi dan fraksinasi bertingkat
Bubuk sampel torbangun
Ekstrak etanol + H2O
Ekstraksi dengan etanol
Filtrat
Ekstrak etanol
Corong pemisah
Heksana
Kloroform Fraksi polar + H2O
Corong pemisah
Etil asetat Fraksi polar + H2O
Corong pemisah
Fraksi heksana
Fraksi kloroform
Fraksi etil asetat
Gambar 3.3 Bagan alir identifikasi fraksi aktif tanaman torbangun
3.3.2 Analisis profil kimia fraksi torbangun
Analisa HPLC (Gupta et al. 2013)
Ekstrak dan fraksi torbangun dilarutkan dalam DMSO pada konsentrasi 0.8 µg/ml dan diaduk dengan vortex. Kemudian sebanyak 1 ml larutan difiltrasi menggunakan filter membran dan ditempatkan pada wadah vial. Sebanyak 40 µ l sampel diinjeksikan ke dalam HPLC. Pengukuran dilakukan pada panjang gelombang 250 nm, 270 nm, 290 nm, 310 nm, 330 nm, dan 350 nm. Fase gerak sistem HPLC terdiri atas larutan asam asetat 0.1% (A) dan acetonitril (B) dengan gradien elusi 2-5% B (3 menit), 5-15% B (7 menit), 15-30% B (6 menit), dan 30-2% B (4 menit). dengan laju aliran 1 mL/menit. Kromatogram yang dihasilkan dari 5 fraksi dengan 3 ulangan dan 3 serapan panjang gelombang UV akan diperoleh 45 kromatogram. Data kromatogram akan dikorelasikan dengan data aktifitas anti kanker terhadap sel MCF-7 menggunakan analisis multivariat OPLS.
Penentuan fraksi aktif dengan metabolomik
Fraksi yang mengandung komponen aktif ditentukan melalui analisa menggunakan OPLS. Analisa ini menghasilkan 3 jenis keluaran yaitu score plot, Y related coefficient plot, dan X varian plot. Score plot menunjukkan klasifikasi fraksi berdasarkan level nilai IC50. Y related coefficient plot memperlihatkan
korelasi antara dua matriks yakni data selang waktu retensi dan data nilai IC50.
Adanya korelasi yang signifikan ditunjukkan dengan Y related coefficient yang bernilai positif. Sedangkan X varian plot memperlihatkan penyebaran peak area dari berbagai fraksi pada selang waktu retensi yang signifikan aktifitasnya. Berdasarkan plot-plot tersebut maka dapat diketahui fraksi yang memiliki peak
5 Fraksi Torbangun
Analisa HPLC Sel MCF7
MTT assay
Metabolomik
Fraksi paling aktif LC-MS Profil Komponen
bioaktif
IC50
area terbesar yang diduga mengandung komponen bioaktif (Maser et al. 2015). Fraksi yang terpilih kemudian akan digunakan untuk pengujian tahap berikutnya.
Identifikasi komponen bioaktif dengan LC-MS (Maser et al. 2015)
Sampel dilarutkan dengan 100 µL DMSO sebelum diinjeksi untuk analisis LC-MS sebanyak 5 µL dari larutan tersebut. Sistem LC-MS yang digunakan adalah (UPLC-QTOF-MS/MS: Waters) yang dilengkapi kolom UPLC BEH C18
(ukuran partikel 1,7 µm, 2,1 mm x 50 mm) dan MS dengan XEVO-G2QTOF (Waters) pada mode resolusi ESI positive dan MassLynk software (v. 4.1). fase gerak terdiri atas 0,1% asam formiat dalam air (A) dan 0,1% asam formiat dalam asetonitril (B). Elusi dilakukan dengan gradient sebagai berikut:: 5% B (1 menit), 5-100% B (5 menit), 100% B (1 menit), 100-5% B (0,5 menit), dan 5% B (1,5 menit). Total running time adalah 9 menit dengan laju aliran 0,3 ml/menit pada suhu 40oC. Identitas komponen ditentukan berdasarkan pol