PENGARUH PEMBERIAN VITAMIN E TERHADAP GAMBARAN
HISTOLOGIS TESTIS DAN JUMLAH SEL SPERMA MENCIT
(Mus musculus, L.) YANG DIPAPARI TUAK
TESIS
Oleh
MERIANI HERLINA NIM. 087008013/BM
PROGRAM MAGISTER ILMU BIOMEDIK
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH PEMBERIAN VITAMIN E TERHADAP GAMBARAN
HISTOLOGIS TESTIS DAN JUMLAH SEL SPERMA MENCIT
(Mus musculus, L.) YANG DIPAPARI TUAK
TESIS
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Magister Biomedik dalam Program Studi Magister Ilmu Biomedik
Fakultas Kedokteran Universitas Sumatera Utara
Oleh
MERIANI HERLINA NIM. 087008013/BM
PROGRAM MAGISTER ILMU BIOMEDIK
FAKULTAS KEDOKTERAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Telah diuji pada
Tanggal : 08 - 02 - 2011
PANITIA PENGUJI TESIS
Ketua : Prof.Dr.Drs. Dwi Suryanto, M.Sc
Anggota : 1. TM Fauzi, S.Si, M.Kes
ABSTRAK
Vitamin E berperan sebagai antioksidan dan dapat melindungi aksi kerusakan membran biologis akibat radikal bebas. Radikal bebas adalah suatu atom dan molekul yang tidak mempunyai pasangan elektron dan dapat merusak molekul-molekul penting bagi fungsi seluler. Pemberian asupan antioksidan berupa vitamin E diusulkan dapat menurunkan efek radikal bebas dalam tubuh.
Penelitian ini bertujuan untuk mengetahui tentang pengaruh pemberian vitamin E terhadap gambaran histologis testis, jumlah sel Leydig dan jumlah sperma pada testis mencit yang di papari tuak. Pada penelitian ini menggunakan mencit jantan (Mus musculus, L) strain DD Webster dewasa sehat dan fertil yang berumur 8-11 minggu dengan berat 20-35 g sebanyak 30 ekor dibagi dengan 6 kelompok perlakuan. Kelompok (K0) = kelompok kontrol pertama terdiri dari 5 ekor mencit dewasa jantan tanpa perlakuan selama 30 hari. Kelompok 2 (P1) = Kelompok perlakuan pertama terdiri dari 5 ekor mencit dewasa jantan yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor secara oral setiap hari selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dihentikan dan diganti dengan pemberian aquadest 0,5 ml. Kelompok 3 (P2) = Kelompok perlakuan kedua terdiri 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor secara oral selama 30 hari. Kelompok 4 (P3) = Kelompok perlakuan ketiga terdiri 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml /hari/ekor selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dihentikan diganti dengan pemberian vitamin E 0,25 mg/hari/ekor/mencit secara oral. Kelompok 5 (P4) = Kelompok perlakuan keempat terdiri 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dengan pemberian vitamin E 0,25 mg/ekor/hari secara oral. Kelompok 6 (P5) = Kelompok perlakuan kelima terdiri dari 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor dan pemberian vitamin E 0,25 mg/ekor/hari selama 30 hari secara oral. Mencit ditempatkan ke dalam kelompok secara random. Penelitian ini telah mendapat persetujuan dari komite etik penelitian USU. Hasil yang didapat pemberian vitamin E 0,25 mg/hari/mencit sejalan dengan pemaparan tuak selama 30 hari cenderung mempengaruhi peningkatan jumlah sel Leydig mencit, peningkatan diameter tubulus seminiferus mencit dan peningkatan jumlah spermatozoa mencit.
ABSTRACT
Vitamin E is one of the fat-soluble vitamins. Vitamin E acts as an antioxidant and can protect the biological action of membrane damage by free radicals. A free radicals is an atom or a molecule without a pair of electrons that can damage the molecules essential
for cellular function. Giving antioxidants in the form of vitamin E is proposed to reduce the effects of free radicals in the body.
This study aims to determine the effect of vitamin E on testicular histological features, the number of Leydig cells and testicular sperm count in mice given palm wine. In this study 30 healty and fertile adult male mice (Mus musculus, L.) strain DD Webster. The 8-11 week old mice (20-35 g) were divided in to 6 treatment groups. The first group (K0) = consisted of 5 mice without treatment for 30 days. The first treatment group (P1) consisted of 5 mice that were each given palm wine (20% alcohol) orally at 0.5 ml/day for 15 days. After 15 the palm wine was repleaced with water 0,5 ml. The second treatment group (P2) consisted of 5 mice that were each given palm wine (20% alcohol) orally 0.5 ml/day for 30 days. The third treatment group (P3) consisted of 5 mice that were each given palm wine (20% alcohol) orally 0.5 ml/day for 15 days. After 15 days the palm wine was replaced with 0.25 mg of vitamin E/day administered orally. The fourth treatment group (P4) consisted of 5 mice that were each given palm wine (20% alcohol) orally 0.5 ml/day for 30 days. After 15 days in addition to the palm wine with 0.25 mg of vitamin E/day was administered orally. The fifth treatment group (P5) consisted of 5 mice that were each given palm wine (20% alcohol) 0.5 ml/day and
vitamin E 0.25 mg/day orally. The mice were placed into groups randomly. This study was approved by the USU research ethics committee. The results of this study suggest concurrent administration of vitamin E (0.25 mg/day)
reduces the negative affect of palm wine. An increased number of Leydig cells, an increased diameter of seminiferous tubules and an increased number spermatozoa were observed in treatment group P5 as compared to the other treatment groups.
KATA PENGANTAR
Pertama-tama marilah kita ucapkan Puji dan Syukur Kehadirat Allah Yang Maha
Kuasa, karena berkat dan rahmatNya, maka saya dapat menyusun tesis ini. Penulisan
tesis ini merupakan salah satu persyaratan dalam memperoleh Gelar Magister pada
Program Magister Studi Ilmu Biomedik Fakultas Kedokteran Universitas Sumatera Utara
Medan. Adapun judul dari penelitian ini adalah Pengaruh Pemberian Vitamin E Terhadap
Gambaran Histologis Testis dan Jumlah Sel Sperma Mencit (mus musculus, L.) yang dipapari Tuak.
Terima kasih yang tak terhingga dan penghargaan yang setinggi-tingginya penulis
ucapkan kepada: Prof. Dr. Drs. Dwi Suryanto, M.Sc yang telah bersedia menjadi Ketua
Komisi Pembimbing yang telah banyak memberikan masukan-masukan dan penuh
perhatian dalam penulisan tesis ini. Bapak TM Fauzi, S.Si, M.Kes yang telah bersedia
menjadi Anggota Komisi Pembimbing yang selalu tabah dan sabar dalam membimbing
dan memberikan masukan-masukan demi kesempurnaan dalam penulisan tesis ini. Prof.
Dr. Drs. Syafruddin Ilyas, M.Biomed yang telah bersedia menjadi Komisi Pembanding
untuk memberikan masukan-masukan pada seminar tesis demi kesempurnaan penulisan
tesis ini. dr. Datten Bangun, SpFK, M.Sc, yang telah bersedia menjadi Komisi
Pembanding pada seminar tesis demi kesempurnaan penulisan tesis ini. Prof. dr. Gontar
A. Siregar, SpPD, KGEH selaku Dekan Fakultas Kedokteran Universitas Sumatera Utara
yang telah memberi izin penelitian pada penulis. Ibu dr. Yahwardiah Siregar, Ph.D selaku
Ketua Program Studi Magister Ilmu Biomedik Fakultas Kedokteran Universitas Sumatera
staf laboratorium Biokimia/Kimia Bahan Makanan (KBM) Universitas Sumatera Utara
Medan yang menyediakan tempat untuk penggunaan laboratorium dan bantuan tenaga
laboran dalam membantu saya pada penelitian ini. Pimpinan dan staf Laboratorium
Biologi FMIPA Universitas Sumatera Utara Medan yang menyediakan tempat dalam
penelitian tesis ini. Terima kasih penulis kepada Ketua Yayasan Imelda Medan dan
seluruh jajarannya yang telah memberikan kesempatan kepada penulis untuk mengikuti
pendidikan Program Studi Magister Ilmu Biomedik Fakultas Kedokteran USU Medan.
Direktris Akper Imelda Medan dan seluruh rekan-rekan kerja di Akper Imelda Medan
yang dengan penuh perhatian dan kasih memberikan dukungan dan semangat pada
penulis selama mengikuti pendidikan. Terima kasih yang tulus penulis ucapkan kepada
Suami tercinta Jupentus Tamba, SH, yang selalu memberikan dukungan moril dan
materil sehingga penulis dapat menyelesaikan pendidikan pada Program Studi Magister
Ilmu Biomedik Fakultas Kedokteran Universitas Sumatera Utara Medan. Rasa sayang
penulis kepada seluruh anak-anak yang tercinta; Jessica Christin Meriayuni, Jonathan
Christian Dinata, Jasmine Christin Meriayuni yang sering ditinggal-tinggal selama masa
pendidikan. Orang tua tercinta, abang, kakak dan adik-adik yang selalu mendoakan
penulis agar sukses dalam segala rencana terutama selama masa pendidikan ini. Terima
kasih juga buat seluruh teman-teman seperjuangan mahasiswa/i Biomedik Angkatan
2008 yang selalu bersedia berdiskusi demi kesempurnaan penulisan tesis ini. Semoga
tesis ini dapat bermanfaat bagi para pembaca dan mendapat penambahan ilmu serta
memunculkan ide-ide untuk penelitian baru.
Medan, Januari 2011
RIWAYAT HIDUP
Nama : Meriani Herlina
Tempat/tanggal lahir : Idi Aceh Timur, 29 Mei 1968
Agama : Katholik
Status : Menikah
Alamat : Jl Matahari 6 no: 167 Blok 6 Perumnas Helvetia Medan
Telp/Hp : 08126334750
Pendidikan :
SD Negeri No. 163087 Tebing Tinggi : 1975-1980
SMP Negeri 4 Tebing Tinggi : 1980-1983
SMA Swasta TagoreTebing Tinggi : 1983-1986
Akademi Keperawatan Herna Medan : 1986-1989
Akta Mengajar FKIP IKIP Medan : 1995-1996
S-1 Kesehatan Masyarakat USU Medan : 1996-1998
Program Magister Studi Ilmu Biomedik FK-USU Medan : 2008-2010
Riwayat Pekerjaan :
Perawat RSU Deli Medan : 1992
Staf Pengajar di Akademi Keperawatan Imelda Medan : 1992-sekarang
Perawat Ruangan RSU Imelda Medan : 1992-1996
Perawat Ruang Bedah RSU Imelda Medan : 1992-1998
Pembantu Direktur I di Akademi Keperawatan ImeldaMedan : 2003-2006
DAFTAR ISI
BAB III METODE PENELITIAN ... 23
DAFTAR TABEL
Nomor Judul Halaman
1 Komposisi nira dari berbagai tanaman palmae ... 12
2 Desain perlakuan ... 27
3 Jadwal penelitian ... 31
4 Rata-rata hasil analisis jumlah sel Leydig mencit ... 32
5 Diameter tubulus seminiferus testis mencit ... 34
DAFTAR GAMBAR
Nomor Judul Halaman
1 Kerangka konsep ... 5
2 Histologis testis ... 16
3 Kamar hitung Improved Neubauer ... 30
4 Grafik histogram jumlah sel Leydig mencit ... 33
5 Gambaran Jumlah sel Leydig mencit ... 34
6 Grafik histogram diameter tubulus seminiferus testis mencit .. 35
7 Gambaran diameter tubulus seminiferus mencit ... 36
x
DAFTAR LAMPIRAN
Nomor Judul Halaman
1 Penentuan kadar alkohol nira aren ... 47
2 Output analisis data jumlah sel Leydig mencit menggunakan software SPSS 13 ... 51
3 Output analisis data diameter tubulus seminiferus
menggunakan software SPSS 13 ... 53
4 Output analisis data jumlah sel spermatozoa mencit
menggunakan software SPSS 13 ... 54
5 Rekomendasi persetujuan etik penelitian kesehatan .... 55
ABSTRAK
Vitamin E berperan sebagai antioksidan dan dapat melindungi aksi kerusakan membran biologis akibat radikal bebas. Radikal bebas adalah suatu atom dan molekul yang tidak mempunyai pasangan elektron dan dapat merusak molekul-molekul penting bagi fungsi seluler. Pemberian asupan antioksidan berupa vitamin E diusulkan dapat menurunkan efek radikal bebas dalam tubuh.
Penelitian ini bertujuan untuk mengetahui tentang pengaruh pemberian vitamin E terhadap gambaran histologis testis, jumlah sel Leydig dan jumlah sperma pada testis mencit yang di papari tuak. Pada penelitian ini menggunakan mencit jantan (Mus musculus, L) strain DD Webster dewasa sehat dan fertil yang berumur 8-11 minggu dengan berat 20-35 g sebanyak 30 ekor dibagi dengan 6 kelompok perlakuan. Kelompok (K0) = kelompok kontrol pertama terdiri dari 5 ekor mencit dewasa jantan tanpa perlakuan selama 30 hari. Kelompok 2 (P1) = Kelompok perlakuan pertama terdiri dari 5 ekor mencit dewasa jantan yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor secara oral setiap hari selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dihentikan dan diganti dengan pemberian aquadest 0,5 ml. Kelompok 3 (P2) = Kelompok perlakuan kedua terdiri 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor secara oral selama 30 hari. Kelompok 4 (P3) = Kelompok perlakuan ketiga terdiri 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml /hari/ekor selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dihentikan diganti dengan pemberian vitamin E 0,25 mg/hari/ekor/mencit secara oral. Kelompok 5 (P4) = Kelompok perlakuan keempat terdiri 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dengan pemberian vitamin E 0,25 mg/ekor/hari secara oral. Kelompok 6 (P5) = Kelompok perlakuan kelima terdiri dari 5 ekor mencit dewasa yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor dan pemberian vitamin E 0,25 mg/ekor/hari selama 30 hari secara oral. Mencit ditempatkan ke dalam kelompok secara random. Penelitian ini telah mendapat persetujuan dari komite etik penelitian USU. Hasil yang didapat pemberian vitamin E 0,25 mg/hari/mencit sejalan dengan pemaparan tuak selama 30 hari cenderung mempengaruhi peningkatan jumlah sel Leydig mencit, peningkatan diameter tubulus seminiferus mencit dan peningkatan jumlah spermatozoa mencit.
ABSTRACT
Vitamin E is one of the fat-soluble vitamins. Vitamin E acts as an antioxidant and can protect the biological action of membrane damage by free radicals. A free radicals is an atom or a molecule without a pair of electrons that can damage the molecules essential
for cellular function. Giving antioxidants in the form of vitamin E is proposed to reduce the effects of free radicals in the body.
This study aims to determine the effect of vitamin E on testicular histological features, the number of Leydig cells and testicular sperm count in mice given palm wine. In this study 30 healty and fertile adult male mice (Mus musculus, L.) strain DD Webster. The 8-11 week old mice (20-35 g) were divided in to 6 treatment groups. The first group (K0) = consisted of 5 mice without treatment for 30 days. The first treatment group (P1) consisted of 5 mice that were each given palm wine (20% alcohol) orally at 0.5 ml/day for 15 days. After 15 the palm wine was repleaced with water 0,5 ml. The second treatment group (P2) consisted of 5 mice that were each given palm wine (20% alcohol) orally 0.5 ml/day for 30 days. The third treatment group (P3) consisted of 5 mice that were each given palm wine (20% alcohol) orally 0.5 ml/day for 15 days. After 15 days the palm wine was replaced with 0.25 mg of vitamin E/day administered orally. The fourth treatment group (P4) consisted of 5 mice that were each given palm wine (20% alcohol) orally 0.5 ml/day for 30 days. After 15 days in addition to the palm wine with 0.25 mg of vitamin E/day was administered orally. The fifth treatment group (P5) consisted of 5 mice that were each given palm wine (20% alcohol) 0.5 ml/day and
vitamin E 0.25 mg/day orally. The mice were placed into groups randomly. This study was approved by the USU research ethics committee. The results of this study suggest concurrent administration of vitamin E (0.25 mg/day)
reduces the negative affect of palm wine. An increased number of Leydig cells, an increased diameter of seminiferous tubules and an increased number spermatozoa were observed in treatment group P5 as compared to the other treatment groups.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Alkohol jika dikonsumsi mempunyai efek toksik pada tubuh baik secara langsung
maupun tidak langsung (Panjaitan, 2003). Penelitian yang dilakukan (Foa et al., 2006) menyebutkan bahwa etanol berpengaruh pada beberapa metabolisme organ dan jaringan
tubuh, termasuk organ reproduksi pria berupa keterlambatan pubertas, atrofi testis,
disfungsi ereksi, ginekomastia, gangguan proses spermatogenesis hingga infertilitas.
Selanjutnya konsumsi alkohol pada pria dapat menyebabkan disfungsi ereksi, infertilitas,
dan yang tak kalah pentingnya bersifat mengurangi ciri-ciri seksual sekunder pria.
Alkohol dapat merusak sel Leydig di dalam testis, dan produksi sekresi hormon
testosteron dan terjadinya feminisasi (Emanuele, 1998; Panjaitan, 2003).
Konsumsi alkohol adalah faktor yang sangat berperan penyebab kesehatan
masyarakat pemakainya tersebar luas dan meningkat di banyak negara. Pemberian
alkohol pada hewan percobaan diketahui dapat menurunkan konsentrasi hormon steroid,
menghambat ovulasi dan mengganggu transportasi sel sperma sampai ke tuba falopi.
Pemberian alkohol pada tikus dan monyet menurunkan berat ovarium dan menyebabkan
amenorhoe (Jensen et al., 1998). Rees (1993) melaporkan bahwa pemberian etanol dengan dosis 5 - 6% pada tikus menyebabkan penekanan pada kadar testosteron dalam
darah dan penyusutan testis (atrofi testis) (Emanuelle, 1998). Konsumsi alkohol dalam
waktu lama mempengaruhi disfungsi ereksi, menurunkan libido, dan ginekomastia.
merugikan fertilitas pria dan menyebabkan berkurangnya konsentrasi serum testosteron.
(Fabio et al., 2004).
Penelitian pada tikus jantan yang diberi alkohol 10% secara oral sebanyak 1 ml/hari
selama 60 hari menyebabkan penurunan proses pembentukan spermatozoa sekitar 24%
dari yang normal (Ilyas, 2004). Penelitian Nugroho (2007) menyatakan pemberian
minuman beralkohol dengan kadar 40% selama 30 hari dengan dosis 0,1 ml/hari/ekor, 0,2
ml/hari/ekor, 0,3 ml/hari/ekor dapat menyebabkan penurunan jumlah lapisan sel
spermatogenik dan penurunan berat vesikula seminalis pada mencit. Hal ini diperkuat
oleh (Foa et al., 2006) yang melaporkan bahwa penelitiannya pada tikus putih jantan dengan umur 40-60 hari (umur dewasa) sebanyak 35 ekor yang diberikan etanol peroral
dengan dosis 10%, 1g/kgBB/hr, 10%, 3g/kg/BB/hr, 30%, 1g/kgBB/hr, 30%, 3g/kgBB/hr
selama 45 hari menunjukkan bahwa etanol dapat menurunkan jumlah sel spermatosit
primer, sel spermatogonium dan sel Leydig.
Secara umum tuak dikenal oleh masyarakat di Indonesia adalah jenis minuman yang
disebut arak. Bagi masyarakat Batak Toba tuak merupakan minuman sehari-hari
(Ikegami, 1997). Tuak merupakan minuman beralkohol yang bahan dasarnya nira aren
(Arenga pinnata) mengandung alkohol dengan kadar 4% (Sunanto, 1993). Menurut Keputusan Menteri Kesehatan No.151/A/SK/V/81 bahwa minuman atau obat tradisional
yang tergolong dalam minuman keras mengandung alkohol >1%. Pengolahan nira aren
menjadi etanol sudah umum dilakukan petani aren, antara lain di daerah Minahasa
Sulawesi Utara, dengan cara menampung nira hasil sadapan dalam tangki selama 2-3 hari
tanpa menggunakan stater atau ragi, nira hasil fermentasi kemudian disuling dengan alat
2004). Pemberian tuak dengan dosis 0,21 ml/ekor/hari/mencit jantan dengan lama
pemberian 60 hari cenderung lebih menekan jumlah anak mencit dibandingkan dengan
dosis air tuak 0,05 ml/ekor/hari/mencit jantan, 0,09 ml/ekor/hari/mencit jantan, 0,13
ml//ekor/hari/mencit jantan, 0,17 ml/ekor/hari/ mencit jantan (Ilyas, 2004).
Vitamin E merupakan antioksidan pemecah rantai utama dan terdapat pada cairan
ekstrasel. Vitamin E dapat menetralisir hidroksil, superoksida, dan radikal hidrogen
peroksida dan mencegah aglutinasi sperma (Agarwal et al., 2005). Pemberian vitamin E dosis 4,4 IU/kg tidak menimbulkan efek pada sel Sertoli dan jumlah sperma, tetapi jika
pemberian vitamin E ditingkatkan menjadi 220 IU/kg dapat menurunkan konsentrasi
prostaglandin pada prostat dan kematangan vesikel seminal gland pada babi hutan
(Guzman, 2000). Pemberian vitamin E dengan dosis 100 mg/kg/hari tidak hanya
kompensasi efek toksik pada para-nonylphenol (p-NP) dalam berat testis, jumlah sperma,
motilitas sperma, dan produksi estrogen, tetapi juga meningkatkan kelangsungan hidup
dan perkembangan sperma tikus (Momeni et al.,2009)
Berdasarkan yang sudah dipaparkan di atas terlihat akan pengaruh pemberian alkohol
terhadap penurunan jumlah sel Leydig, testis dan produksi sekresi hormon testosteron,
sedangkan vitamin E dapat menetralisir hidroksil, superoksida, dan radikal hidrogen
peroksida dan mencegah aglutinasi sperma. Penelitian ini bertujuan untuk mengetahui
pengaruh pemberian vitamin E terhadap gambaran histologis testis, jumlah sel Leydig
1.2 Perumusan Masalah
Bagaimana pengaruh pemberian vitamin E terhadap gambaran histologis testis,
jumlah sel Leydig dan jumlah sperma pada mencit yang dipapari tuak.
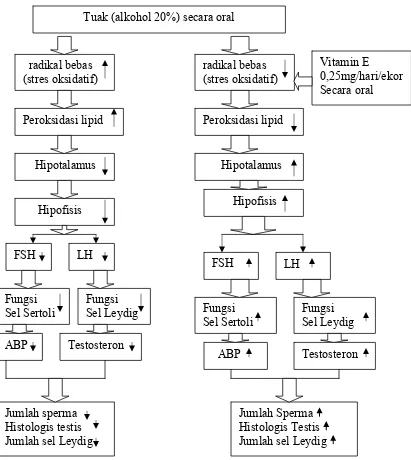
1.3 Kerangka Teori
Alkohol dapat merusak sel Leydig sehingga menurunkan kadar testosteron
intratestikular. Testosteron berfungsi dalam proses pematangan sperma pada
spermatogenesis, selain itu alkohol dapat juga menurunkan Luteinizing Hormon (LH) dan
Follicle Stimulating Hormon (FSH) (Emanuele dan Nicholas, 1998). LH berfungsi menstimulasi sel Leydig untuk menghasilkan testosteron sedangkan FSH dapat
mempengaruhi sel Sertoli untuk membentuk androgen binding protein (ABP) yang
Tuak (alkohol 20%) secara oral
Gambar 1: Kerangka Konsep Pengaruh Pemberian Vitamin E Terhadap
6
1.4 Tujuan Penelitian
1.4.1 Tujuan umum
Mengetahui pengaruh pemberian vitamin E terhadap gambaran histologis testis,
jumlah sel Leydig dan jumlah sperma pada testis mencit yang dipapari tuak.
1.4.2 Tujuan khusus
a. Untuk mengetahui pengaruh pemberian vitamin E terhadap gambaran histologis
testis mencit yang dipapari tuak.
b. Untuk mengetahui pengaruh pemberian vitamin E terhadap jumlah sel Leydig pada
testis mencit yang dipapari tuak.
c. Untuk mengetahui pengaruh pemberian vitamin E terhadap jumlah sel sperma pada
testis mencit yang dipapari tuak.
1.5 Hipotesis
Ha:a.Pemberian vitamin E mempunyai pengaruh terhadap jumlah sperma pada testis
mencit yang dipapari tuak.
b.Pemberian vitamin E mempunyai pengaruh terhadap gambaran histologis testis
mencit yang di papari tuak.
c.Pemberian vitamin E mempunyai pengaruh terhadap jumlah sel Leydig pada testis
mencit yang di papari tuak.
1.6 Manfaat Penelitian
Hasil penelitian ini diharapkan memberikan informasi ilmiah kepada masyarakat
khususnya bidang kesehatan dan dapat dijadikan referensi untuk penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Alkohol (Etanol)
2.1.1 Definisi
Alkohol terutama dalam bentuk ethyl alcohol (etanol), telah mengambil tempat penting dalam sejarah umat manusia paling sedikit selama 8000 tahun. Saat ini, alkohol
dikonsumsi secara luas. Sama seperti obat-obat sedatif-hipnotik lainnya, alkohol dalam
jumlah rendah sampai sedang bisa menghilangkan kecemasan dan membantu
menimbulkan rasa tenang atau bahkan euporia. Akan tetapi, alkohol juga dikenal sebagai
obat yang paling banyak disalahgunakan di dunia, suatu alasan yang tepat atas kerugian
besar yang mesti ditanggung masyarakat dan dunia medis (Masters, 2002). Kandungan
alkohol minuman berkisar dari 4 - 6% untuk bir, 10 - 15% untuk anggur, dan 40% dan
lebih tinggi untuk spirit hasil distilasi. Proof (kekuatan alkohol) minuman mengandung alkohol dua kali persen alkoholnya (sebagai contoh, alkohol 40% adalah 80 proof)
(Fleming et al., 2007).
Di Amerika Serikat, kira-kira 75% dari populasi dewasa mengkonsumsi minuman
beralkohol secara teratur. Mayoritas dari populasi peminum ini bisa menikmati efek
memuaskan yang diberikan alkohol tanpa menjadikannya sebagai risiko terhadap
kesehatan. Bahkan fakta terbaru menunjukkan bahwa konsumsi etanol secukupnya bisa
melindungi beberapa orang terhadap penyakit kardiovaskular. Akan tetapi, sekitar 10%
dari populasi umum di Amerika Serikat tidak mampu membatasi konsumsi etanol
yang terus meminum alkohol tanpa mempedulikan adanya konsekuensi yang merugikan
secara medis dan sosial yang berkaitan langsung dengan konsumsi alkohol mereka
tersebut akan menderita alkoholisme, suatu gangguan kompleks yang nampaknya
ditentukan oleh faktor lingkungan (Masters, 2002).
2.1.2 Farmakokinetika Etanol
Setelah pemberian oral, etanol diabsorpsi dengan cepat dari lambung dan usus halus
ke dalam aliran darah dan terdistribusi ke dalam cairan tubuh total (Fleming et al. 2007). Tingkat absorpsi paling tinggi pada saat lambung kosong. Adanya lemak di dalam
lambung menurunkan tingkat absorpsi alkohol (Chandrasoma dan Taylor, 2005). Setelah
minum alkohol dalam keadaan puasa, kadar puncak alkohol di dalam darah dicapai dalam
waktu 30 menit. Distribusinya berjalan cepat, dengan kadar obat dalam jaringan
mendekati kadar di dalam darah. Volume distribusi dari etanol mendekati volume cairan
tubuh total (0,5-0,7 L/kg) (Masters, 2002). Alkohol didistribusikan di dalam tubuh
(terutama dalam jaringan adiposa), menyebabkan efek dilusi (Chandrasoma dan Taylor,
2005).
Pada dosis oral ekuivalen dari alkohol, kaum wanita mempunyai konsentrasi
puncak lebih tinggi dibandingkan kaum pria, sebagian disebabkan karena wanita
mempunyai kandungan cairan tubuh total lebih rendah. Di dalam sistem saraf pusat,
konsentrasi etanol meningkat dengan cepat karena otak menampung sebagian besar aliran
darah dan etanol melewati membran biologi dengan cepat (Masters, 2002).
Lebih dari 90% alkohol yang digunakan dioksidasi di dalam hati, sebagian besar
urine dan udara yang dihembuskan biasanya sedikit, tetapi berjumlah konstan yang
berkorelasi dengan blood alcohol concentration (BAC). Hal ini merupakan prinsip yang mendasari penggunaan pemeriksaan urin dan nafas pada forensik di samping uji darah
(Chandrasoma dan Taylor, 2005). Orang dewasa tipikal dapat memetabolisme 7-10 g
(150-220 mmol) alkohol per jam, yang ekuivalen dengan kira-kira 10 oz bir, 3,5 oz
anggur, atau 1 oz minuman keras yang disuling dengan kadar murni 80 (Masters, 2002).
2.1.3 Pengaruh Alkohol Terhadap Sistem Endokrin dan Fungsi Seksual
Walaupun banyak orang percaya bahwa alkohol dapat meningkatkan aktivitas
seksual, tetapi efek yang sebaliknya lebih sering teramati. Banyak obat yang
disalahgunakan termasuk alkohol mempunyai efek disinhibisi yang pada awalnya dapat
meningkatkan libido. Namun, penggunaan alkohol jangka panjang dan berlebihan sering
menyebabkan penurunan fungsi seksual. Alkohol dapat menyebabkan disfungsi ereksi
pada pria setelah penggunaan akut maupun kronis. Insidensi disfungsi ereksi dapat terjadi
sampai pada 50% pasien alkoholisme kronis (Fleming et al., 2007). Van Thiel et al., (1978) mencatat bahwa disfungsi ereksi sangat sering terjadi di antara pasien dengan
kerusakan hati yang lebih parah (Emanuele, 1998).
Selain itu, banyak pecandu kronis akan mengalami atrofi testikular dan penurunan
fertilitas (Fleming et al., 2007) serta pengurangan ciri seksual sekunder pria (misalnya, pengurangan rambut wajah dan dada, pembesaran payudara, dan pergeseran posisi lemak
dari perut ke daerah pinggul) (Emanuele, 1998). Laporan klinis berupa ginekomastia dan
dalam keseimbangan hormon steroid (Masters, 2002). Hal ini terjadi pada 75% pria
dengan sirosis alkoholik lanjut (Lloyd dan Williams 1948).
Sejumlah penelitian lain juga telah menunjukkan bahwa penyalahgunaan alkohol
pada pria dapat menyebabkan gangguan produksi testosteron dan penyusutan testis
(atrofi testis) (Adler 1992). Atrofi testis terutama disebabkan hilangnya sel-sel sperma
dan penurunan diameter tubulus seminiferus (Van Thiel et al., 1974). Mekanisme yang terlibat dalam hal ini kompleks dan kemungkinan melibatkan perubahan fungsi
hipotalamus dan efek toksik alkohol langsung pada sel Leydig (Fleming et al., 2007). Produk metabolisme alkohol yaitu asetaldehida memiliki sifat toksik ke sel Leydig
daripada alkohol itu sendiri (Van Thiel et al., 1983; Santucci et al., 1983).
Penelitian yang dilakukan untuk mengetahui apakah ada hubungan efek alkohol
terhadap hipotalamus dan hipofisis dilakukan dengan mengeluarkan hipofisis anterior
tikus. Peneliti menumbuhkannya secara invitro dengan ada atau tidaknya alkohol.
Hasilnya menunjukkan alkohol menurunkan kadar LH bahkan dengan hipofisis yang
sudah terisolasi tersebut, setidaknya sebagian bertindak langsung ke hipofisis (Van Thiel
et al., 1983; Santucci et al., 1983). Hal ini selaras dengan penelitian Emanuelle (1998) yang menyebutkan bahwa atrofi testis mungkin disebabkan oleh beberapa faktor, yaitu
salah satunya adalah efek alkohol pada LH dan FSH yang merangsang pertumbuhan
testis. Faktor lain yaitu karena efek alkohol yang merusak testis, serta faktor lain, seperti
malnutrisi, akibat pengobatan dengan berbagai obat, dan penyalahgunaan obat-obatan
Konsumsi alkohol juga menyebabkan penurunan aktivitas enzim yang berperan
dalam sintesis hormon kelamin jantan. Alkohol dehidrogenase yang berada pada testis,
dalam keadaan normal mampu mengubah retinol menjadi retinal. Menurut Wright
(1991), alkohol menyebabkan kegagalan sintesis retinal di dalam testis. Kegagalan
sintesis retinal ini akan menyebabkan gangguan spermatogenesis, karena retinal
merupakan senyawa yang esensial untuk berlangsungnya spermatogenesis. Pada akhirnya
hal tersebut akan menyebabkan penurunan jumlah lapisan sel spermatogenik (Nugroho,
2007). Alkohol menyebabkan kegagalan hipotalamus dan hipofisis untuk mensekresikan
Gonadotrophine Releasing Hormon (GnRH), FSH, dan LH (Wright, 1991; Rees, 1993), selanjutnya akan diikuti oleh kegagalan sel Leydig untuk mensintesis testosteron dan sel
Sertoli tidak mampu melakukan fungsinya sebagai nurse cell (Nugroho, 2007).
Selain menimbulkan gangguan pada hipotalamus dan hipofisis, alkohol juga
bertindak sebagai inhibitor bagi enzim 5 α-reduktase. Enzim ini digunakan untuk
mengubah prohormon (testosteron) menjadi bentuk aktifnya yaitu 5 α-dihidrotestosteron.
Tidak adanya testosteron dalam bentuk aktif menyebabkan proses spermatogenesis tidak
terjadi, yang pada akhirnya menyebabkan gangguan pada proses spermatogenesis. Hal ini
akan menyebabkan penurunan jumlah lapisan sel spermatogenik (Nugroho, 2007).
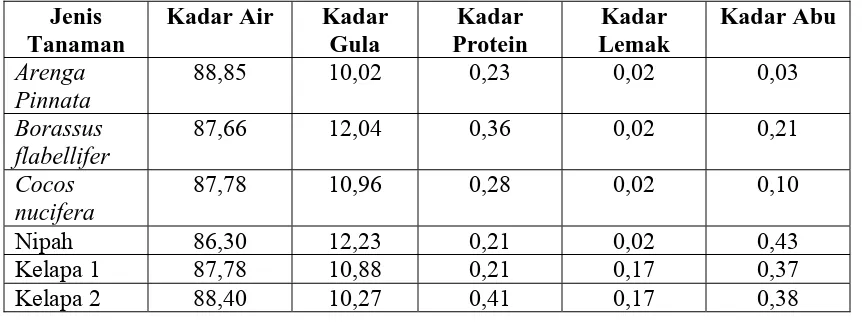
2.1.4 Nira Aren (Arenga pinnata)
Nira aren (Arenga pinnata (Wurmb.) Merr.) Sinonim : Arenga sacchrifera Labill
(nama lama). Familia : Arecaceae (Palmae). Boleh dikatakan semua bagian tanaman dipakai. Dari tongkol bunga jantan disadap cairan yang mengandung gula, di mana
cuka; bijinya dibuat manisan dan dimakan (kolang-kaling). Bagian yang digunakan
Tuak/legen (hasil peragian dari air bunga) dan akar.
Nama Lokal (nama daerah): Bak juk, Bak jok (Aceh); Pola, Paula, Bagot, Agaton,
Bargot (Batak); Anau, Biluluk (Minangkabau); Kawung, Taren (Sunda); Aren, Lirang,
Nanggung (Jawa); Jaka, Hano (BaIi); Meka (Sawu); Moke, Huwat (FIores); Akel, Akere,
Koito, Akol, Ketan (Sawu); Inru (Bugis); Bole (Roti); Seho (Ternate).
Komponen utama nira adalah air, karbohidrat dalam bentuk sukrosa, protein, lemak,
vitamin, dan mineral. Kerusakan nira disebabkan akibat aktivitas bakteri (Acetobacter sp) dan khamir (Saccharomyces sp) yang dapat menfermentasi sukrosa menjadi alkohol dan lebih lanjut menjadi asetat. Nira aren (Arenga pinnata Merr) diperoleh dengan cara menyadap tandan bunga. Tanaman dapat disadap setelah berumur 5-12 tahun. Dari tiap
pohon dapat disadap selama 3 tahun dan tiap tahun dapat disadap 3-4 tangkai bunga.
Dalam sehari aren menghasilkan 3-10 liter nira (Halim, 2008).
Tabel 1. Komposisi Nira dari Berbagai Tanaman Palmae (%).
2.2 Sistem Reproduksi Mencit Jantan
Sistem reproduksi mencit jantan terdiri atas testis dan kantong skrotum, epididimis
dan vas deferens, kelenjar asesoris pada masa embrio yang berfungsi untuk transport
sperma, kelenjar asesoris, uretra dan penis, selain uretra dan penis, semua struktur ini
berpasangan (Rugh, 1967).
2.2.1 Testis
Setiap testis ditutupi dengan jaringan ikat fibrosa, tunika albuginea, bagian tipisnya
atau septa akan memasuki organ untuk membelah menjadi lobus yang mengandung
beberapa tubulus disebut tubulus seminiferus karena di dalamnya berlangsung produksi
semua sel germinal fungsional jantan. Bagian tunika memasuki testis dan bagian arteri
testikular yang masuk disebut sebagai hilus. Arteri memberi nutrisi setiap bagian testis,
dan akan berhubungan dengan vena testikular ketika meninggalkan hilus (Rugh, 1967)
2.2.2 Fungsi Testis dan Testosteron
Secara embriogenis, testis berkembang dari gonadal ridge yang terletak di dalam rongga abdomen. Pada bulan-bulan terakhir kehidupan janin, testis perlahan mulai turun
keluar dari rongga abdomen melalui kanalis semi inguinalis masuk ke dalam skrotum.
Meskipun waktunya bervariasi proses penurunan testis biasanya selesai pada bulan ke
tujuh masa gestasi (Sherwood, 2004).
Testis melaksanakan dua fungsinya yaitu menghasilkan sperma dan mengeluarkan
testosteron. Sekitar 80% massa testis terdiri dari tubulus seminiferosa yang di dalamnya
jaringan ikat antara tubulus-tubulus seminiferosa inilah yang mengeluarkan testosteron.
(Sherwood, 2004)
Setelah disekresikan oleh testis, kurang lebih 97% dari testosteron berikatan lemah
dengan plasma albumin atau berikatan kuat dengan beta globulin yang disebut hormon
seks binding globulin dan akan bersirkulasi di dalam darah selama 30 menit sampai satu
jam. Pada saat itu testosteron ditransfer ke jaringan atau didegradasikan menjadi produk
yang tidak aktif yang kemudian dieksresikan (Sherwood, 2004)
2.2.3 Histologi
a. Tubulus seminiferus
Epitel tubulus seminiferus berada tepat di bawah membran basalis yang dikelililngi
oleh jaringan ikat fibrosa yang disebut jaringan peritubular yang mengandung serat-serat
jaringan ikat, sel-sel fibroblast dan sel otot polos yang disebut dengan sel mioid. Diduga
kontraksi sel mioid ini dapat mengubah diameter tubulus seminiferus dan membantu
pergerakan spermatozoa. Setiap tubulus ini dilapisi oleh epitel berlapis majemuk. Garis
tengahnya lebih kurang 150-250 µm dan panjangnya 30-70 cm. Panjang seluruh tubulus
satu testis mencapai 250 m. Tubulus kontortus ini membentuk jalinan yang tempat
masing-masing tubulus berakhir buntu atau dapat bercabang. Pada ujung setiap lobulus,
lumennya menyempit dan berlanjut ke dalam ruas pendek yang dikenal sebagai tubulus
rektus, atau tubulus lurus, yang menghubungkan tubulus seminiferus dengan labirin
saluran-saluran berlapis epitel yang berkesinambungan yaitu rete testis. Rete ini, terdapat
dalam jaringan ikat mediastinum yang dihubungkan dengan bagian kepala epididimis
Tubulus seminiferus terdiri sel spermatogenik dan sel Sertoli yang mengatur dan
menyokong nutrisi spermatozoa yang berkembang, hal ini tidak dijumpai pada sel tubuh
lain. Sel-sel spermatogenik membentuk sebagian terbesar dari lapisan epitel dan melalui
proliferasi yang kompleks akan menghasilkan spermatozoa (Junqueira, 2007).
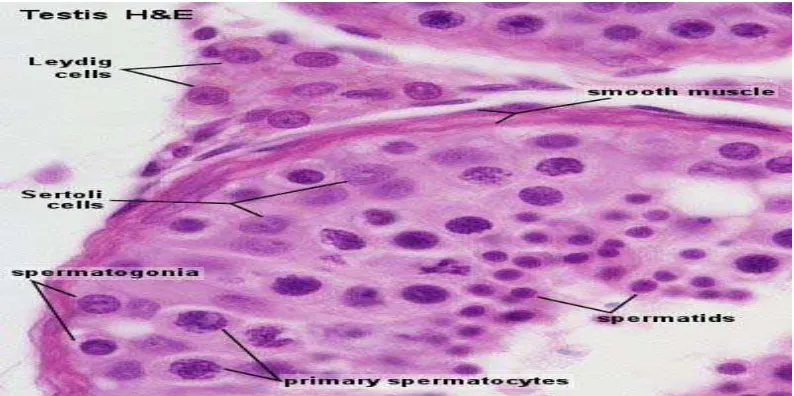
b. Sel-sel germinal
Spermatogonium adalah sel spermatif (Gambar 2), yang terletak di samping lamina
basalis. Sel spermatogonium relatif kecil, bergaris tengah sekitar 12 µm dan intinya
mengandung kromatin pucat. Pada keadaan kematangan kelamin, sel ini mengalami
sederetan mitosis lalu terbentuklah sel induk atau spermatogonium tipe A, dan mereka
berdiferensiasi selama siklus mitotik yang progresif menjadi spermatogonium tipe B.
Spermatogonium tipe A adalah sel induk untuk garis keturunan spermatogenik,
sementara spermatogonium tipe B merupakan sel progenitor yang berdiferensiasi menjadi
spermatosit primer (Junqueira, 2007). Spermatosit primer adalah sel terbesar dalam garis
turunan spermatogenik ini (Gambar 2) dan ditandai adanya kromosom dalam tahap
proses penggelungan yang berbeda di dalam intinya. Spermatosit primer memiliki 46
(44+XY) kromosom dan 4N DNA (Junqueira, 2007). Spermatosit sekunder sulit diamati
dalam sediaan testis karena merupakan sel berumur pendek yang berada dalam fase
Gambar 2 : Histologis Testis
Spermatosit sekunder memilki 23 kromosom (22+X atau 22+Y) dengan
pengurangan DNA per sel (dari 4N menjadi 2N). Pembelahan spermatosit sekunder
menghasilkan spermatid. Spermatid memiliki ukuran yang kecil garis tengahnya 7-8 µm
(Gambar 2), inti dengan daerah-daerah kromatin padat dan lokasi jukstaluminal di dalam
tubulus seminiferus. Spermatid mengandung 23 kromosom. Karena tidak ada fase S
(sintesis DNA) yang terjadi antara pembelahan meiosis pertama dan kedua dari
spermatosit, maka jumlah DNA per sel dikurangi setengahnya selama pembelahan kedua
ini menghasilkan sel-sel haploid (1N) (Junqueira, 2007).
c. Sel Sertoli
Sel Sertoli adalah sel pyramid memanjang yang sebagian memeluk sel-sel dari garis
keturunan spermatogenik (Gambar 2). Dasar sel sertoli melekat pada lamina basalis,
sedangkan ujung apeksnya sering meluas ke dalam lumen tubulus seminiferus. Dengan
yang mengelilingi sel spermatogenik. Kajian dengan mikroskop elektron mengungkapkan
bahwa sel ini mengandung banyak retikulum endoplasma licin, sedikit retikulum
endoplasma kasar, sebuah kompleks Golgi yang berkembang baik, dan banyak
mitokondria dan lisosom. Inti yang memanjang yang sering berbentuk segitiga, memiliki
banyak lipatan dan sebuah anak inti yang mencolok, memiliki sedikit heterokromatin.
Fungsi utama sel Sertoli adalah untuk menunjang, melindungi dan mengatur nutrisi
spermatozoa. Selain itu, sel Sertoli juga berfungsi untuk fagositosis kelebihan sitoplasma
selama spermatogenesis, sekresi sebuah protein pengikat androgen dan inhibin, dan
produksi hormon anti-Mullerian (Junqueira, 2007).
d. Sel Leydig
Sel insterstisial Leydig merupakan sel yang memberikan gambaran mencolok untuk
jaringan tersebut. Sel-sel Leydig letaknya berkelompok memadat pada daerah segitiga
yang terbentuk oleh susunan-susunan tubulus seminiferus. Sel-sel tersebut besar dengan
sitoplasma sering bervakuol pada sajian mikroskop cahaya. Inti selnya mengandung
butir-butir kromatin kasar dan anak inti yang jelas. Umumnya pula dijumpai sel yang
memiliki dua inti. Sitoplasma sel kaya dengan benda-benda inklusi seperti titik lipid, dan
pada manusia juga mengandung kristaloid berbentuk batang. Celah di antara tubulus
seminiferus dalam testis diisi kumpulan jaringan ikat, saraf, pembuluh darah dan limfe
(Junqueira, 2007).
2.2.4 Sel Spermatogenik
Spermatogenesis terjadi di dalam semua tubulus seminiferus selama kehidupan
rata-rata pada usia 13 tahun dan berlanjut sepanjang hidup (Ganong, 2008). Adapun
tahap-tahap spermatogenesis yaitu :
a. Spermatogonia primitif berkumpul tepat di tepi membran basal dari epitel
germinativum, disebut spermatogonia tipe A, membelah empat kali untuk
membentuk 16 sel yang sedikit lebih berdiferensiasi, yaitu spermatogonia tipe B.
Spermatogenia bersandar pada bagian dalam lamina basalis tubulus seminiferus,
berukuran daimeter sekitar 12 µm.
b. Spermatosid primer merupakan sel benih yang terbesar di dalam tubulus
seminiferus dengan diameter 17-19 µm, menempati daerah bagian tengah dari
epitelium (Fiore, 1986)
c. Spermatosit sekunder terletak lebih ke arah lumen, besarnya lebih kurang setengah
dari spermatosit primer.
d. Spermatid merupakan sel-sel yang ukurannya jauh lebih kecil, dengan nukleus yang
mengandung granula kromatin halus dan besar, umumnya terletak dalam
kelompok-kelompok dekat lumen dan sel sertoli (Fiore, 1986)
e. Spermatozoa mempunyai bentuk yang ramping, ukuran panjang sekitar 55-65 µm,
kepala spermatozoa yang kecil tertanam dalam sitoplasma sel-sel Sertoli, ekornya
menjulur ke dalam lumen tubulus seminiferus (Fiore, 1986).
2.2.5 Hormon yang Merangsang Spermatogenesis
a. Testosteron, disekresi oleh sel-sel Leydig yang terletak di interstisium testis.
Hormon ini penting untuk pertumbuhan dan pembagian sel-sel germinativum dalam
membentuk sperma.
b. Hormon Lutein (LH), disekresi oleh kelenjar hipofisis anterior, merangsang sel-sel
Leydig untuk menyekresi testosteron.
c. Hormon Perangsang Folikel (FSH), juga disekresi oleh sel-sel kelenjar hipofisis
anterior, merangsang sel-sel Sertoli; tanpa rangsangan ini, pengubahan spermatid
menjadi sperma (proses spermiogenesis) tidak akan terjadi.
d. Estrogen, dibentuk dari testosteron oleh sel-sel Sertoli ketika sel Sertoli sedang
dirangsang oleh hormon perangsang folikel, yang mungkin juga penting untuk
spermiogenesis. Sel-sel Sertoli juga menyekresi suatu protein pengikat androgen
yang mengikat testosteron dan estrogen serta membawa keduanya ke dalam cairan
dalam lumen tubulus seminiferus, membuat kedua hormon ini tersedia untuk
pematangan sperma.
e. Hormon Pertumbuhan (seperti juga pada sebagian besar hormon yang lain)
diperlukan untuk mengatur latar belakang fungsi metabolisme testis. Secara khusus
hormon tersebut meningkatkan pembelahan awal spermatogonia sendiri. Bila tidak
terdapat hormon pertumbuhan, seperti pada dwarfisme hipofisis, spermatogenesis
2.3 Vitamin E
2.3.1 Sifat Kimia Vitamin E
Vitamin E merupakan salah satu vitamin yang larut dalam lemak. Nama lain dari
vitamin E tokoferol, keaktifan vitamin E dalam beberapa senyawa tokoferol berbeda.
Dikenal ά-; -; dan δ- tokoferol menunjukkan keaktifan vitamin E yang paling tinggi.
Struktur kimia tokoferol adalah sebagai berikut. Alfa –tokoferol alam memutar bidang
polarisasi ke kanan, sedangkan alfa-tokoferol buatan adalah resemik (DL). Tokoferol
lainnya (beta, gama, dan delta) kurang penting karena potensi hayatinya rendah (Sudjadi
dan Rohman, 2008)
2.3.2 Fungsi Fisiologik dan Farmakodinamik
Vitamin E berperan sebagai antioksidan dan dapat melindungi aksi kerusakan
membran biologis akibat radikal bebas. Vitamin E melindungi asam lemak tidak jenuh
pada membran fosfolipid. Radikal peroksil bereaksi 1000 kali lebih cepat dengan vitamin
E daripada asam lemak tidak jenuh, dan membentuk radikal tokoferoksil (Gunawan,
2007). Selanjutnya radikal tokoferoksil berinteraksi dengan lain antioksidan seperti
vitamin C, yang akan membentuk kembali tokoferol. Vitamin E misalnya paling penting
untuk melindungi membran sel darah merah yang kaya akan asam lemak tidak jenuh
ganda dari kerusakan akibat oksidasi.
Vitamin E juga melindungi -kroten dari oksidasi (Gunawan, 2007), fungsi utama
vitamin E adalah sebagai antioksidan yang larut dalam lemak dan mudah memberikan
adalah molekul-molekul reaktif dan dapat merusak, yang mempunyai elektron tidak
berpasangan (Almaster, 2004).
Kebutuhan sehari pada orang Indonesia diperkirakan asupan 10-30 mg vitamin E
cukup untuk mempertahankan kadar normal di dalam darah. Beberapa zat yang terdapat
pada makanan misalnya selenium, asam amino yang mengandung sulfur, koenzim Q
dapat mengantikan vitamin E, (Gunawan, 2007).
2.3.3 Efek Kimia Vitamin E
Vitamin E berfungsi sebagai antioksidan yang larut dalam lemak dan mudah
memberikan hidrogen dari gugus hidroksil (OH) pada struktur cincin ke radikal bebas.
Radikal bebas adalah molekul-molekul reaktif dan dapat merusak, yang mempunyai
elektron tidak berpasangan (Gunawan, 2007).
Pada penelitian yang dilakukan terhadap manusia yang merokok dengan tujuan
untuk menentukan efek vitamin E baik secara sendiri-sendiri maupun kombinasi terhadap
kadar lipid peroksidasi secara in vivo ditemukan bahwa pemberian vitamin E secara
sendiri-sendiri dapat mereduksi lipid peroksidasi dengan kadar yang sama. Sedangkan
pemberian vitamin C dan vitamin E dengan cara kombinasi juga memberikan efek yang
sama tidak lebih besar dari pada pemberian secara sendiri-sendiri (Huang et al. 2002).
2.3.4 Efek Vitamin E Terhadap Fungsi Reproduksi
Vitamin E merupakan antioksidan pemecah rantai utama dan terdapat pada cairan
ekstrasel. Vitamin E dapat menetralisir hidroksil, superoksid, dan radikal hidrogen
22
kualitas semen dan parameter biokimia pada kelinci jantan yang diberikan vitamin E dan
minuman suplemen atau kombinasinya dapat mengurangi produksi radikal bebas dan
dapat memperbaiki kualitas cairan semen kelinci (Yousef et al., 2003)
Vitamin E sedikit ditemui jumlahnya pada cairan semen laki-laki infertil. Vitamin
E meningkatkan jumlah sperma secara invivo pada laki-laki infertil dengan dosis antara
200-1000 mg/hari (Agarwal et al., 2005). Penelitian (Acharya et al., 2006), terhadap testis tikus yang diberi cadmium (Cd) dengan memberikan suplemen vitamin E dengan
dosis 100 mg/kg berat badan menurunkan kadar peroksidasi lipid, meningkatkan jumlah
sperma, menurunkan persentase sperma abnormal, meningkatkan aktifitas enzim
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu
Penelitian akan dilakukan di Laboratorium Biokimia/Kimia Bahan Makanan
(KBM) Universitas Sumatera Utara dan Laboratorium Biologi FMIPA Universitas
Sumatera Utara Medan. Penelitian dilakukan selama 2 (dua) bulan Juni-Agustus 2010.
3.2 Rancangan Penelitian
Penelitian ini dilakukan dengan rancanga experimental dengan desain Rancangan
Acak Lengkap (RAL). Mencit jantan (Mus musculus L.) strain DD Webster dewasa, sebanyak 30 ekor, dengan menggunakan rumus perhitungan yaitu: (t-1)(n-1) ≥ 15
(Federer, 1963). Di mana t adalah jumlah perlakuan (dalam penelitian ini ada 6 kelompok
perlakuan) dan n adalah jumlah ulangan perkelompok, maka jumlah n yang diharapkan
secara teoritis adalah 5, maka jumlah keseluruhan hewan coba yang diperlukan dalam
penelitian ini adalah 30 ekor mencit jantan yang dipilih dari hasil perbanyakan untuk
keperluan penelitian. Mencit ditempatkan ke dalam kelompok secara random.
3.3 Bahan dan Alat Penelitian
3.3.1 Bahan Penelitian
diperoleh dari FMIPA Biologi Universitas Sumatera Utara Medan, sebanyak 30 ekor
mencit jantan dipilih dari hasil perbanyakan untuk keperluan penelitian.
Bahan Kimia
Larutan fiksatif, bouin, parafin, vitamin E murni (merck), hematoxylin Erlich –
Eosin (H-E).
3.3.2 Alat-alat
Alat utama yang digunakan dalam penelitian antara lain : jarum oval (gavage), spuit
1 ml, bak bedah dan dissecting set, gelas arloji, cawan petri, batang pengaduk, kamar
hitung Neubauer, mikroskop cahaya, objek glass, mikrotom, oven.
3.3.3 Air tuak atau nira aren
Air tuak didapat dari daerah Pancurbatu dengan cara mengambil air nira dari pohon
aren. Ada 4 sampel air tuak yang diambil untuk menentukan kadar alkoholnya yaitu: nira
aren asli, nira ditambah raru (Rapistrum rugosum L.), tuak asli, tuak yang siap dipasarkan, masing–masing 2 liter dan air tuak belum bermalam. Kemudian dibawa ke
laboratorium Biokimia/KBM FMIPA USU untuk ditentukan kadar alkohol yang
dikandungnya. Pada penelitian ini yang digunakan adalah air tuak yang siap di pasarkan
dengan kadar alkohol 20%.
3.4 Variabel Penelitian
3.4.3 Variabel Independen
1. Tuak (alkohol 20%)
3.4.4 Variabel Dependen
1. Jumlah Sel Leydig
2. Jumlah sel sperma
3. Histologis testis
3.5 Pelaksanaan Penelitian dan Pengamatan
3.5.1 Pemeliharaan Hewan Percobaan
Mencit ditempatkan di dalam kandang yang terbuat dari bahan plastik
(ukuran 30x20x10 cm) yang ditutup dengan kawat kasa. Dasar kandang dilapisi dengan
sekam padi setebal 0,5-1 cm dan diganti setiap tiga hari. Cahaya ruangan dikontrol persis
12 jam terang (pukul 06.00 sampai dengan pukul 18.00) dan 12 jam gelap (pukul 18.00
sampai dengan pukul 06.00). Pakan (pelet komersial) dan minuman air leiding /aquadest
disuplai setiap hari.
3.5.2 Etika Penggunaan
Pengunaan dan penanganan hewan di laboratorium penelitian dilakukan dengan
aturan etika penelitian hewan. Penelitian hewan yang diatur dalam Deklarasi Helsinki
untuk memperoleh ”ethical clearance” dari komite etika dan komite ilmiah penelitian FMIPA Biologi Universitas Sumatera Utara Medan.
3.5.3 Pemberian Perlakuan
Penelitian ini terdiri atas 6 kelompok perlakuan yaitu:
1 Kelompok 1 (K0) = kelompok kontrol pertama terdiri dari 5 ekor mencit dewasa
2. Kelompok 2 (P1) = Kelompok perlakuan pertama terdiri dari 5 ekor mencit dewasa
jantan yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor secara oral setiap hari
selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dihentikan dan
diganti dengan pemberian aquadest 0,5 ml.
3. Kelompok 3 (P2) = Kelompok perlakuan kedua terdiri 5 ekor mencit dewasa yang
diberi tuak (alkohol 20%) 0,5 ml/hari/ekor secara oral selama 30 hari.
4. Kelompok 4 (P3) = Kelompok perlakuan ketiga terdiri 5 ekor mencit dewasa yang
diberi tuak (alkohol 20%) 0,5 ml /hari/ekor selama 15 hari pertama dan 15 hari
berikutnya pemberian tuak dihentikan diganti dengan pemberian vitamin E 0,25
mg/hari/ekor/mencit secara oral.
5. Kelompok 5 (P4) = Kelompok perlakuan keempat terdiri 5 ekor mencit dewasa
yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor selama 15 hari pertama dan 15 hari
berikutnya pemberian tuak dengan pemberian vitamin E 0,25 mg/ekor/hari secara
oral.
6. Kelompok 6 (P5) = Kelompok perlakuan kelima terdiri dari 5 ekor mencit dewasa
yang diberi tuak (alkohol 20%) 0,5 ml/hari/ekor dan pemberian vitamin E 0,25 mg/
ekor/hari selama 30 hari secara oral. Mencit ditempatkan ke dalam kelompok
Tabel 2: Desain Perlakuan
3.5.4 Prosedur Pemeriksaan dan Pengamatan
Setelah perlakuan selama 30 hari, masing-masing hewan percobaan dikorbankan
dengan cara dislokasi leher, selanjutnya dibedah dan isolasi testis. Kemudian dilakukan
pengamatan sebagai berikut:
3.5.4.1 Pengamatan Pada Jumlah Sel Leydig
Jumlah sel Leydig dihitung pada semua lapangan pandang adanya bentuk tubulus
seminiferus bulat, kecuali pada sediaan yang tubulus seminiferusnya terpotong lebih dari
setengah. Tiap mencit dihitung jumlah sel Leydignya pada tiga (3) preparat yang
3.5.4.2 Pembuatan sediaan histologis testis
Pembuatan sediaan histologis menurut Suntoro, (1983) dengan metode parafin
adalah: fiksasi, dehidrasi, penjernihan, infiltrasi parafin, penanaman, penempelan,
pemotongan, penempelan, deparafinasi, pewarnaan, penutupan serta pemberian label.
Organ testis yangtelah dicuci dengan larutan NaCl 0,95% kemudian di masukkan
ke dalam larutan fiksatif Bouin selama 2 jam. Setelah proses fiksasi dilakukan proses
dehidrasi secara bertahap dengan alkohol 30%, 50%, 60%, 70%, 80%, 90%, 96%, hingga
alkohol absolut 100%, masing-masing selama 60 menit. Dilanjutkan dengan penjernihan
segera setelah proses dehidrasi dengan menggunakan xylol murni dengan perbandingan
1:3, 1:1, 3:1, masing-masing 60 menit lamanya, kemudian dimasukkan ke dalam xylol
murni kurang lebih selama 4 jam. Proses infiltarsi parafin dilakukan di dalam oven
dengan suhu 580C. Organ testis dimasukkan kedalam campuran xylol- parafin dengan perbandingan 1:3, 1:1, 3:1, selama 60 menit, kemudian dimasukkan ke dalam parafin
murni selama kurang lebih 10 jam. Kemudian dimasukkan ke dalam kotak kertas kecil
sebagai cetakan yang telah berisi parafin cair, dan dibiarkan sampai parafin mengeras
dan memadat. Blok parafin testis yang telah mengeras ditempelkan pada holder kayu
sampai melekat erat, kemudian dipasangkan pada mikrotom. Pengirisan dilakukan
dengan ketebalan 6 µm. Pada gelas benda diolesi dengan larutan albumin mayer dan
ditetesi dengan aquadest. Kemudian beberapa pita parafin diletakkan di permukaan
aquadest pada gelas benda dan dibiarkan beberapa saat, kemudian gelas benda
Pewarnaan dengan Hematoxylin Erlich - Eosin (H-E) dengan cara preparat
dideparafinasi dalam xylol sampai bebas parafin, kemudian dimasukkan kedalam alkohol
absolut, 96%, 80%, 70%, Hematoxylin, air mengalir masing-masing selama 2 menit
kemudian dimasukkan ke dalam alkohol 30%, 50%, Kemudian ke dalam larutan Eosin
selama 1 menit, lalu ke dalam alkohol 70%, 80%, 96%, alkohol absolut, selanjutnya
dimasukkan ke dalam xylol. Preparat ditutup dengan gelas penutup setelah ditetesi
dengan canada balsem terlebih dahulu, lalu diberi label.
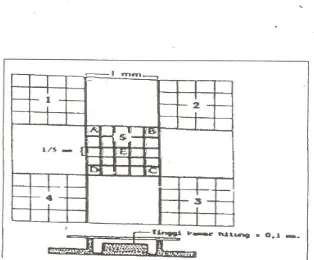
3.5.4.3 Pengamatan Jumlah Sperma
Pengamatan jumlah sperma dilakukan menurut Soehadi dan Arsad (1983). Setelah
30 hari perlakuan, masing-masing hewan percobaan dikorbankan dengan cara dislokasi
leher dan selanjutnya dibedah. Kemudian organ testis beserta epididimis sebelah kanan
dan kiri diambil dan diletakkan ke dalam cawan petri yang berisi NaCl 0,9%. Suspensi
sperma yang telah diperoleh terlebih dahulu dihomogenkan . Selanjutnya diambil
sebanyak 10µl, sampel dimasukkan ke dalam kotak-kotak hemositometer Improved
Neubauer serta ditutup dengan kaca penutup. Dilihat di bawah mikroskop cahaya dengan
pembesaran 400 kali, hemositometer diletakkan dan dihitung jumlah sperma pada
kotak/bidang A, B, C, D dan E. Hasil perhitungan jumlah sperma kemudian dimasukkan
ke dalam rumus penentuan jumlah sperma/mL suspensi sekresi cauda epididimis sebagai
Jumlah sperma = N/2 x 105 spermatozoa/ml suspensi
N : jumlah sperma yang dihitung dalam kotak
Gambar 3 : Kamar Hitung Improved Neubauer (Zanevald et al., 1986)
3.6 Analisis Data dan Pengujian Hipotesis
Semua data dipresentasikan dalam bentuk rata-rata ± simpangan baku ( ± SD).
Dilakukan uji normalitas dan homogenitas, dari hasil penelitian didapatkan data dengan
distribusi normal dan variansi datanya tidak homogen, sehingga dilakukan uji Kruskal
Wallis. Bila terdapat perbedaan maka dilakukan uji lanjut Mann Witney untuk melihat
perbedaan masing–masing kelompok perlakuan yang ada.
31
3.7 Jadwal Penelitian
Keseluruhan kegiatan penelitian dari persiapan sampai pada penulisan hasil
adalah lebih kurang 7 minggu. Urutan kegiatan jadwal pelaksanaan secara lengkap dapat
dilihat pada tabel berikut ini:
Tabel 3: Jadwal Penelitian
MINGGU KE
NO KEGIATAN 1 2 3 4 5 6 7
1 Persiapan V
2 Pelaksanaan V V V V
3 Analisa Data V
4 Penulisan Hasil V
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Berdasarkan hasil penelitian dan kumpulan data yang telah dilakukan selama
penelitian, maka dapat dibuat beberapa gambar grafik histogram dengan parameter hasil
pengukuran sebagai berikut:
4.1.1 Jumlah sel Leydig
Hasil pengukuran data jumlah sel Leydig tiap-tiap mencit jantan (Mus musculus
L.) strain DD Webster ditunjukkan pada Tabel 4 di bawah ini.
Tabel 4. Rata-rata Hasil Analisis Jumlah Sel Leydig Mencit (Mus musculus L.)
Kelompok N Jumlah sel Leydig ( ± SD)
Hasil analisis distribusi data dan homogenitas data didapatkan semua data jumlah sel
Leydig distribusinya normal dan variansi datanya tidak homogen. Hasil ini tidak
memenuhi asumsi untuk dapat dilakukan uji Anova satu arah. Setelah dilakukan
transformasi, distribusi data dan homogenitas data diuji lagi, tetapi masih tetap variansi
data tidak homogen. Maka dilakukan uji Kruskal Wallis dengan hasilnya bahwa ada
perbedaan masing-masing perlakuan dalam penelitian. (p<0,05). Oleh sebab itu
diperlukan uji lanjut Mann Whitney untuk melihat perbedaan masing-masing kelompok
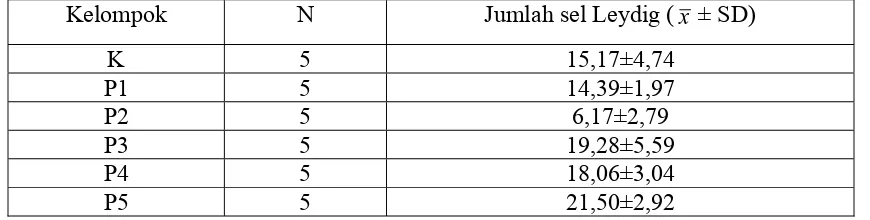
Rata-rata hasil analisis data jumlah sel Leydig mencit jantan ditampilkan pada Gambar 4
ab
b
a
c
c
d
Gambar 4. Grafik Histogram Jumlah Sel Leydig Mencit (Mus musculus L.) setelah diberikan perlakuan tuak dan vitamin E. Keterangan; Grafik histogram pada perlakuan berbeda yang diikuti oleh huruf kecil yang sama, berbeda tidak nyata pada taraf uji 5%. K= Kontrol, P1= 15 hari Tuak & 15 hari Aquades,P2= 30 hari Tuak, P3= 15 hari Tuak & 15-30 hari Vit.E, P4= 30 hari Tuak & 15-30- hari Vit.E, dan P5= 30 hari Tuak & 30 hari Vit.E. ┬ = standar deviasi (SD).
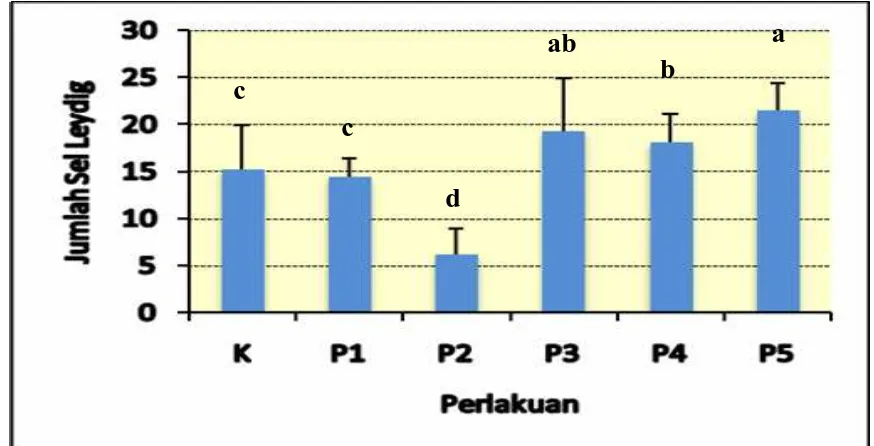
4.1.2 Gambaran Sel Leydig dalam testis
Jumlah sel Leydig pada masing-masing kelompok perlakuan menunjukkan
berbeda nyata pada taraf uji 5% yaitu terdapat pada kelompok perlakuan (P2), sedangkan
pada kelompok perlakuan yang lain yaitu K, P1, P3, P4 dan P5 menunjukkan berbeda
tidak nyata pada taraf uji 5%. Gambaran sel Leydig hasil potongan jaringan testis mencit
Gambar 5. Gambaran Jumlah Sel Leydig Mencit (Mus musculus L.) setelah diberikan perlakuan tuak dan vitamin E. Keterangan; K= Kontrol, P1= 15 hari Tuak & 15 hari Aquades,P2= 30 hari Tuak, P3= 15 hari Tuak & 15-30 hari Vit.E, P4= 30 hari Tuak & 15-30- hari Vit.E, dan P5= 30 hari Tuak & 30 hari Vit.E. ▬ = 40 μm.
4.1.3 Diameter tubulus seminiferus
Berdasarkan hasil pengukuran data diameter tubulus seminiferus tiap-tiap mencit
jantan (Mus musculus L.) strain DD Webster ditunjukkan pada Tabel 5. Tabel 5. Diameter Tubulus Seminiferus Testis Mencit (Mus musculus L.)
Kelompok N Diameter tubulus seminiferus ( ± SD) (µm)
K 5 234,44±38,65
P1 5 129,40±5,43
P2 5 112,48±17,40
P3 5 134,02±7,98
P4 5 162,36±46,66
P5 5 171,18±11,32
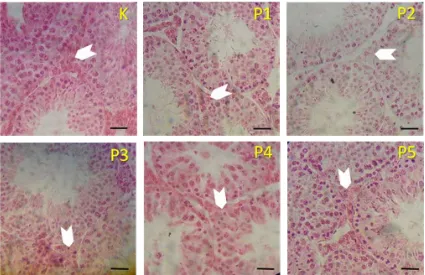
Rata-rata hasil analisis data diameter tubulus seminiferus mencit ditampilkan pada
Gambar 6. Hasil analisis distribusi data dan homogenitas data didapatkan semua data
diameter tubulus seminiferus distribusinya normal dan variansi datanya tidak homogen.
Hasil ini tidak memenuhi asumsi untuk dapat dilakukan uji Anova satu arah. Setelah
dilakukan transformasi, distribusi data dan homogenitas data diuji lagi, tetapi masih tetap
variansi data tidak homogen. Maka dilakukan uji Kruskal Wallis dengan hasilnya bahwa
ada perbedaan masing-masing perlakuan dalam penelitian. (p<0,05). Oleh sebab itu
diperlukan uji lanjut Mann Whitney untuk melihat perbedaan masing-masing kelompok
perlakuan yang ada. Hasilnya dapat dilihat pada Gambar 6 di bawah bawah ini.
bc
c
b
b
b
a
Gambar 6. Grafik Histogram Diameter Tubulus Seminiferus Testis Mencit (Mus musculus L.) setelah diberikan perlakuan tuak dan vitamin E. Keterangan; Grafik histogram pada perlakuan berbeda yang diikuti oleh huruf kecil yang sama, berbeda tidak nyata pada taraf uji 5%. K= Kontrol, P1= 15 hari Tuak & 15 hari Aquades, P2= 30 hari Tuak, P3= 15 hari Tuak & 15-30 hari Vit.E, P4= 30 hari Tuak & 15-30- hari Vit.E, dan P5= 30 hari Tuak & 30 hari Vit.E. ┬ = standar deviasi (SD).
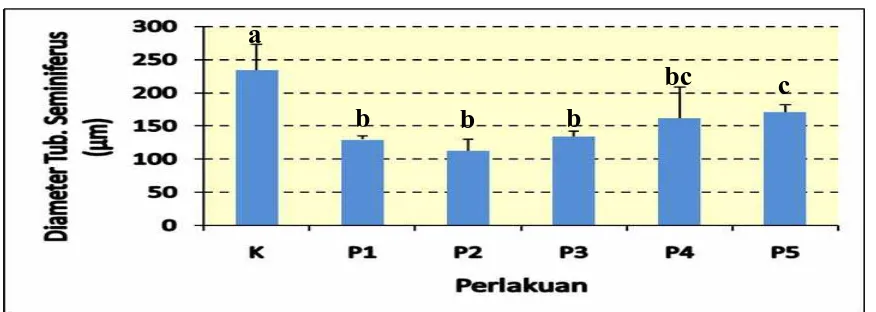
4.1.4 Gambaran Diameter tubulus seminiferus
Pada Gambar 7 dapat dilihat gambaran diameter tubulus seminiferus berbeda
nyata pada kelompok K dengan kelompok perlakuan P1-P3 tidak berbeda nyata pada
kelompok perlakuan P4-P5 pada taraf uji 5% masing-masing perlakuan setelah
Gambar 7. Berbagai Ukuran Diameter Tubulus Seminiferus Testis Mencit (Mus musculus
L.) (μm). setelah diberikan perlakuan tuak dan vitamin E. Keterangan; K= Kontrol, P1= 15 hari Tuak & 15 hari Aquades,P2= 30 hari Tuak, P3= 15 hari Tuak & 15-30 hari Vit.E, P4= 30 hari Tuak & 15-30- hari Vit.E, dan P5= 30 hari Tuak & 30 hari Vit.E. ▬ = 40
μm.
4.1.5 Jumlah spermatozoa mencit (Mus musculus L.)
Hasil pengukuran data jumlah spermatozoa setiap mencit ditampilkan pada
lampiran 3. Hasil perhitungan analisis dari rata-rata jumlah spermatozoa mencit untuk
semua kelompok perlakuan dan kontrol disajikan pada Tabel 6.
Tabel 6. Jumlah Spermatozoa (x106) Mencit (Mus musculus L.)
Kelompok N Jumlah spermatozoa ( ± SD) (juta/mL)
K 5 69,27±24,40
P1 5 2,87±3,90
P2 5 2,97±6,63
P3 5 4,20±5,35
P4 5 3,00±5,69
P5 5 19,30±17,20
Dari hasil tersebut dapat dibuat grafik histogram seperti yang tertera pada Gambar 8.
Pada pengujian distribusi dan homogenitas data, ternyata data tidak normal dan/atau
homogen, sehingga harus dilakukan transformasi data. Data hasil uji transformasi diuji
kembali distribusi dan homogenitas datanya, tetapi tetap saja datanya tidak normal
dan/atau tidak homogen. Maka data tersebut dianalisis dengan analisis non-parametrik
Kruskal-Wallis. Hasilnya, perbedaan jumlah spermatozoa mencit pada kelompok yang
berbeda adalah berbeda nyata (p<0,05) sehingga dilakukan uji lanjut Mann-Whitney.
a
b
b
b
b
b
Gambar 8. Grafik Histogram Jumlah Spermatozoa (jt/mL) Mencit (Mus musculus L.) setelah diberikan perlakuan tuak dan vitamin E. Keterangan; Grafik histogram pada perlakuan berbeda yang diikuti oleh huruf kecil yang sama, berbeda tidak nyata pada taraf uji 5%. K= Kontrol, P1= 15 hari Tuak & 15 hari Aquades, P2= 30 hari Tuak, P3= 15 hari Tuak & 15-30 hari Vit.E, P4= 30 hari Tuak & 15-30- hari Vit.E, dan P5= 30 hari Tuak & 30 hari Vit.E. ┬ = standar deviasi (SD).
Rerata jumlah spermatozoa paling tinggi pada kelompok kontrol (K) dan kemudian menurun pada kelompok perlakuan (P1- P4) berbeda tidak nyata dengan P5.
4.2. Pembahasan
4.2.1 Jumlah sel Leydig
Pada Gambar 4 di atas, menunjukkan adanya pengaruh (p<0,05) pemberian tuak
pada mencit selama 15 dan 30 hari, baik yang diberikan secara tunggal atau diikuti
sel Leydig yang paling tinggi didapatkan pada P5 (21,50±2,92), tidak berbeda nyata
dengan P3 (19,28±5,59), tetapi berbeda nyata dengan K (15,17±4,74), P1 (14,39±1,97),
P2 (6,17±2,79), dan P4 (18,06±3,04). Hal ini kemungkinan karena adanya pengaruh
vitamin E yang menghambat efek oksidan (radikal bebas) dari tuak sekaligus
mempertahankan kelangsungan hidup sel Leydig pada testis mencit penelitian. Seperti
yang dinyatakan Mather et al., (1983) bahwa, vitamin E dapat memperpanjang kelangsungan hidup dan fungsi sel Leydig dalam kultur sel Leydig. Kemudian Chen et al., (2005) menambahkan, bahwa secara keseluruhan, hasil in vitro dan in vivo yang dilaporkan konsisten dengan kesimpulan bahwa vitamin E memberikan suatu efek
perlindungan pada steroidogenesis (proses pembentukan steroid) sel Leydig.
Jumlah sel Leydig terendah didapatkan pada P2 (6,17±2,79), yang berbeda nyata
dengan K (15,17±4,74), P1 (14,39±1,97), P3 (19,28±5,59), P4 (18,06±3,04), dan P5
(21,50±2,92). Kemungkinan hal ini disebabkan oleh efek radikal bebas alkohol yang
merupakan kandungan dari tuak yang diberikan ke mencit. Radikal bebas dapat merusak
membran sel melalui peroksidasi lipid yang ada di membran sel. Telah diketahui bahwa
membran sel terdiri dari lipid bilayer yang merupakan struktur pembangun sel. Peningkatan peroksidasi lipid di membran dapat mengakibatkan terjadinya gangguan
transport ion-ion esensial dari dan dalam sel, sehingga pada akhirnya dapat menimbulkan
kematian pada sel. Van et al., (1983) menyatakan bahwa, etanol atau alkohol merupakan faktor lingkungan yang dapat menjadi toksin terhadap sel Leydig.
4.2.2 Diameter Tubulus Seminiferus
Pada Gambar 6 di atas, menunjukkan adanya pengaruh (p<0,05) pemberian tuak
dengan pemberian vitamin E terhadap diameter tubulus seminiferus mencit jantan
dewasa. Diameter tubulus seminiferus yang paling besar didapatkan pada K
(234,44±38,65 μm), berbeda nyata dengan P1 (129,40±5,43 μm), P2 (112,48±17,40 μm),
P3 (134,02±7,98 μm), dan P4 (162,36±46,66 μm), K (234,44±38,65 μm) dan P5
(171,18±11,32 μm). Hal ini kemungkinan karena tidak adanya pengaruh tuak yang
diberikan. Sehingga spermatogenesis di dalam tubulus seminiferus berjalan secara normal
tanpa pengaruh negatif dari tuak. Jumlah spermatozoa yang terbentuk di dalam tubulus
seminiferus menimbulkan dorongan akan bertambahnya diameter tubulus seminiferus
testis mencit.
Diameter tubulus seminiferus yang paling kecil didapatkan pada P2
(112,48±17,40 μm), tidak berbeda nyata dengan P1 (129,40±5,43), P3 (134,02±7,98), dan
P4 (162,36±46,66), tetapi berbeda nyata dengan K (234,44±38,65) dan P5
(171,18±11,32). Kemungkinan hal ini disebabkan oleh pengaruh negatif dari radikal
bebas alkohol yang ada dalam tuak. Radikal bebas menyebabkan banyaknya spermatozoa
yang mati. Sehingga terbentuk lumen yang membesar sehingga mendorong pengecilan
diameter tubulus seminiferus. Hasil penelitian Sakr et al., (2009) mendapatkan adanya degenerasi sel spermatogenik yang menyebabkan hilangnya kumpulan sperma sehingga
terjadi penurunan yang nyata pada diameter tubulus seminiferus dan tebal epitel
germinal.
4.2.3 Jumlah spermatozoa mencit (Mus musculus L.)
Adanya pengaruh (p<0,05) pemberian tuak baik sendiri atau bersama dengan
vitamin E pada mencit selama 15 dan 30 hari dapat terlihat pada Gambar 8 di atas.
berbeda nyata dengan P1, (2,87±3,9 juta/mL), P2 (2,97±6,63 juta/mL), P3 (4,20±5,35
juta/mL), P4 (3,00±5,69 juta/mL), dan P5 (19,30±17,2 juta/mL). Hal ini kemungkinan
karena tidak adanya pengaruh tuak atau alkohol pada mencit jantan, sehingga
spermatogenesis berkembang secara normal melalui regulasi poros hipotalamus, hipofisis
dan testis. Hipotalamus melepas Gonadotropin Hormone Releasing Hormone (GnHRH) dan menstimulasi hipofisis untuk melepaskan hormon gonadotropin Luteinizing Hormone
(LH) dan Follicle Stimulating Hormone (FSH). LH menginduksi sel Leydig untuk menghasilkan testosteron, sedangkan FSH menginduksi sel Sertoli untuk menghasilkan
Androgen Binding Protein (ABP) yang berguna untuk mengikat testosteron intratestikular yang diperlukan untuk spermatogenesis (proses pembentukan
spermatozoa). Bremner et al., (1981) telah didemonstrasikan bahwa LH terikat secara khusus pada sel Leydig, dimana dia menstimulasi akumulasi siklik Adenosin Mono Phospat (AMP) dan mengkonversi kolesterol menjadi pregnenolon, kemudian akhirnya meningkatkan kandungan testosteron yang merupakan produk steroid mayor di testis.
Kemudian Dym et al., (1979) menyatakan bahwa, FSH mengikat sel Sertoli dan spermatogonia dalam tubulus seminiferus. Pengikatan FSH terhadap sel Sertoli diikuti
oleh akumulasi siklik AMP, aktivasi protein kinase, dan produksi Androgen Binding Protein (ABP). Bowen (1998), hormon hipotalamus disebut sebagai hormon pelepas (releasing hormone) dan hormon penghambat (inhibiting hormone), yang refleksinya terlihat pada pengaruhnya terhadap hormon hipofisis anterior. Selain itu kemungkinan
karena adanya pengaruh vitamin E sebagai antioksidan bekerja dengan cara mencegah