KEANEKARAGAMAN BAKTERI SERASAH DAUN
Rhizophora apiculata YANG MENGALAMI DEKOMPOSISI
PADA BERBAGAI TINGKAT SALINITAS DI KOTA PARI
PANTAI CERMIN SUMATERA UTARA
TESIS
OLEH
DWI RAMADANI RITONGA
097030034/BIO
PROGRAM PASCASARJANA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM UNIVERSITAS SUMATERA UTARA
KEANEKARAGAMAN BAKTERI SERASAH DAUN
Rhizophora apiculata YANG MENGALAMI DEKOMPOSISI
PADA BERBAGAI TINGKAT SALINITAS DI KOTA PARI
PANTAI CERMIN SUMATERA UTARA
TESIS
Diajukan untuk melengkapi dan memenuhi syarat mencapai gelar
Magister Sains di Program Studi Biologi Program Pascasarjana
Universitas Sumatera Utara
OLEH
DWI RAMADANI RITONGA
097030034/BIO
PROGRAM MAGISTER BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
Judul Tesis : KEANEKARAGAMAN BAKTERI
SERASAH DAUN Rhizophora apiculata YANG MENGALAMI DEKOMPOSISI PADA BERBAGAI TINGKAT SALINITAS DI KOTA PARI PANTAI CERMIN
SUMATERA UTARA
Nama Mahasiswa : Dwi Ramadani Ritonga
Nomor Induk Mahasiswa : 097030034
Program Studi : Biologi
Menyetujui Komisi Pembimbing
(Dr. Ir. Yunasfi, MS) (Prof. Dr. Dwi Suryanto, M.Sc)
Ketua Anggota
Ketua Program Studi Dekan
Telah diuji pada
Tanggal : 06 Januari 2012
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Yunasfi, MS
Anggota : 1. Prof. Dr. Dwi Suryanto, M.Sc
2. Prof. Dr. Syafruddin Ilyas, M.Biomed
PERNYATAAN ORISINALITAS
KEANEKARAGAMAN BAKTERI SERASAH DAUN Rhizophora apiculata
YANG MENGALAMI DEKOMPOSISI PADA BERBAGAI TINGKAT SALINITAS DI KOTA PARI PANTAI CERMIN SUMATERA UTARA
TESIS
Dengan ini saya nyatakan bahwa saya mengakui semua karya Tesis ini adalah hasil kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah
dijelaskan sumbernya dengan benar.
Medan, Januari 2012
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH
UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademika Universitas Sumatera Utara, saya yang bertanda tangan
di bawah ini:
Nama : Dwi Ramadani Ritonga
NIM : 097030034
Program Studi : Magister Biologi Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada
Universitas Sumatera Utara hak Bebas Royalti Non-Eksklusif (Non-Exclusive
Royalti Free Right) atas Tesis saya yang berjudul:
KEANEKARAGAMAN BAKTERI SERASAH DAUN Rhizophora apiculata
YANG MENGALAMI DEKOMPOSISI PADA BERBAGAI TINGKAT SALINITAS DI KOTA PARI PANTAI CERMIN SUMATERA UTARA
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti ini,
Universitas Sumatera Utara berhak menyimpan, mengalih media, memformat,
mengelola dalam bentuk database, merawat dan mempublikasikan Tesis saya
tanpa meminta izin dari saya selama mencantumkan nama saya sebagai penulis
dan sebagai pemegang dan atau sebagai pemilik hak cipta.
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh tingkat salinitas terhadap keanekaragaman bakteri, laju dekomposisi serasah dan kandungan unsur hara C, N dan P pada serasah daun R. apiculata yang mengalami proses dekomposisi. Penelitian dilakukan di kawasan hutan mangrove Kota Pari Pantai Cermin Sumatera Utara. Serasah dikumpulkan menggunakan kantong serasah yang terbuat dari jaring nilon dengan mesh 2 mm. Serasah daun dikumpulkan selama 2 minggu. Kantong serasah diisi 50 gram daun kering dan diletakkan di lantai hutan mangrove pada 4 lokasi yang memiliki tingkat salinitas yang berbeda, pengamatan dilakukan tiap 15 hari. Hasil penelitian menunjukkan bahwa ada 18 jenis bakteri yang berhasil diisolasi dari serasah daun R. apiculata yang mengalami proses dekomposisi yaitu Bacillus (5 jenis), Flavobacterium (1 jenis),
Alcaligenes (1 jenis), Sporosarcina (2 jenis), Staphylococcus (1 jenis),
Micrococcus (2 jenis), Kurthia (1 jenis), Escherichia coli (1 jenis), Pseudomonas
(1 jenis), Planococcus (2 jenis), Mycobacterium (1 jenis). Jumlah bakteri yang paling banyak ditemukan pada tingkat salinitas 10-20 ppt yaitu 82,69 X 107 CFU/ml, sementara jumlah bakteri paling sedikit ditemukan pada tingkat salinitas >30 ppt yaitu 57,03 X 107 CFU/ml. Bakteri yang paling sering ditemukan selama proses dekomposisi adalah Bacillus sp. 1. Indeks keanekaragaman jenis bakteri pada serasah daun R. apiculata yang mengalami proses dekomposisi pada tingkat salinitas 0-10 ppt adalah 2,41, 10-20 ppt adalah 2,58, 20-30 ppt adalah 2,20, >30 ppt adalah 2,06. Frekuensi kolonisasi spesies bakteri antara 12,5 % sampai 100%. Tingkat salinitas berpengaruh terhadap laju dekomposisi pada serasah daun R. apiculata mulai dari 15 sampai 120 hari. Laju dekomposisi pada tingkat salinitas 0-10 ppt adalah, 0,60, 10-20 ppt adalah 0,50, 20-30 ppt adalah 0,44, >30 ppt adalah 0,45. Tingkat salinitas berpengaruh terhadap kandungan unsur hara C, N dan P pada serasah daun yang mengalami proses dekomposisi. Kandungan unsur hara C tertinggi terdapat pada serasah daun yang mengalami proses dekomposisi pada tingkat salinitas 0-10 ppt, sedangkan kandungan unsur hara C terendah terdapat pada tingkat salinitas >30 ppt. Kandungan unsur hara N tertinggi pada serasah daun R. apiculata yang mengalami proses dekomposisi terdapat pada tingkat salinitas >30 ppt, sedangkan kandungan unsur hara N terendah terdapat pada tingkat salinitas 10-20 ppt. Kandungan unsur hara P tertinggi terdapat pada tingkat salinitas >30 ppt sedangkan kandungan unsur hara P terendah terdapat pada tingkat salinitas 0-10 ppt.
ABSTRACT
The aims of this study were investigated the effect of salinity level on the diversity of bacteria and remaining in the C, N and P during the process of composition of the R. apiculata leaf litter. The research has been conducted at the mangrove forest of Kota Pari Cermin Beach North Sumatera. The leaf litter were collected using litter traps made of nylon mesh 2 mm pore. The leaf was collected for two weeks period. Litter bag was filled with 50 g leaf litter and put on the forest’s floor in four different salinity level, the litter bag was observed each 15 days of decomposition. The results of our investigation indicated that tottaly 18 species of bacteria were isolated from R. apiculata leaf litter undergoing the decomposition, including Bacillus (5 species), Flavobacterium (1 species),
Alcaligenes (1 species), Sporosarcina (2 species), Staphylococcus (1 species),
Micrococcus (2 species), Kurthia (1 species), Escherichia coli (1 species),
Pseudomonas (1 species), Planococcus (2 species), Mycobacterium (1 species). The highest amounts of bacteria at 10-20 ppt were 82,69 X 107 CFU/ml, whereas the lowest of bacteria at >30 ppt were 57,03 X 107 CFU/ml. Bacillus sp. 1 was dominant species during decomposition period. The species diversity indices in the leaf litter decomposition at 0-10 ppt were 2,41, at 10-20 ppt were 2,58, at 20-30 ppt were 2,20, at >20-30 ppt were 2,06. The frequency of the bacteria species colonization during the decomposition process ranged from 12,5 to 100%. The salinity level were influenced rate of decomposition R. apiculata in the leaf litter. The Salinity level on rate of decomposition leaf litter R. apiculata at 0-10 ppt were 0,60, at 10-20 ppt 0,50 ppt, at 20-30 ppt were 0,44, at >30 ppt were 0,45. The salinity level were influenced to C, N and P remaining in the leaf litter a long decomposition period. Sampel were analyzed for change in total C, N and P during decomposition period. The highest content of C was found in the leaf litter decomposed at 0-10 ppt, while the lowest content of C was found in the leaf litter decomposed at >30 ppt. The highest content of N was found in the leaf litter decomposed at >30 ppt, whereas the lowest content of N was found in the leaf litter decomposed at 10-20 ppt. The highest content of P was found in the leaf litter decomposed at >30 ppt, whereas the lowest content of P was found in the leaf litter at 0-10 ppt.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat
dan ridho-Nya sehingga penulis dapat menyelesaikan penulisan dan penyusunan tesis yang berjudul: “Keanekaragaman Bakteri Serasah Daun Rhizophora apiculata Yang Mengalami Dekomposisi Pada Berbagai Tingkat Salinitas Di Kota Pari Pantai Cermin Sumatera Utara”. Dengan selesainya penelitian dan penyusunan tesis ini, penulis mengucapkan terima kasih kepada:
1. Dr. Ir. Yunasfi, MS, dan Prof. Dr. Dwi Suryanto, M.Sc, atas segala
bimbingan dan arahannya dalam penelitian dan penulisan tesis ini.
2. Prof. Dr. Syafruddin Ilyas, M.Biomed dan Dr. Suci Rahayu, M.Si, sebagai
Dosen Penguji yang telah banyak memberikan saran-saran kepada penulis
dalam penyusunan tesis ini.
3. Pemerintah Provinsi Sumatera Utara melalui Badan Perencanaan
Pembangunan Daerah yang telah memberikan Beasiswa Pendidikan selama
mengikuti perkuliahan di Sekolah Pascasarjana Universitas Sumatera Utara.
4. Drs. Bahrum Harahap, MM selaku Bupati Kabupaten Padang Lawas Utara
yang telah memberikan rekomendasi perizinan.
5. Kepala Dinas Pendidikan Kabupaten Padang Lawas Utara yang telah
memberikan rekomendasi perizinan.
6. Kepala Sekolah dan guru-guru SMA Negeri 1 Padang Bolak Julu Kabupaten
Padang Lawas Utara yang telah memberikan dorongan, motivasi dan
rekomendasi perizinan untuk studi.
7. Kepala Laboratorium Mikrobiologi Fakultas Matematika dan ilmu
pengetahuan Alam Universitas Sumatera Utara, Staff dan Asisten yang telah
membantu selama penelitian.
8. Kepala Balai Penelitian Tanah Badan Penelitian dan Pengembangan
Pertanian Departemen Pertanian Bogor yang membantu dalam menganalisis
9. Bapak Drs. Hailullah Harahap, MM dan keluarga yang telah memberikan
kesempatan dan dukungan selama studi.
10. Ayahanda Drs. Syamsunur Ritonga dan Ibunda Tukmaida Harahap, S.Ag
yang telah tulus memberikan kasih sayang, motivasi, doa, nasehat kepada
penulis.
11. Kakanda Eka Frisdayanti Ritonga, S.Pd dan Feriliwan, SP, M.Si, adinda
Ahmad Yusuf Ritonga, ST dan Yunita Salmah Ritonga, S.Si yang telah
memberikan motivasi dan doa kepada penulis.
12. Ibu Dra. Awaltian Ramadhanita, M.Si yang telah bekerja sama selama kuliah
dan penelitian serta kepada semua teman-teman biologi 2009 penulis ucapkan
terimakasih atas kebersamaan yang telah terjalin.
13. Akhirnya kepada semua yang terlibat yang namanya tidak tersebutkan,
penulis ucapkan terimakasih.
Penulis berharap semoga pihak yang telah memberikan bantuan kepada
penulis mendapatkan balasan dari Allah SWT. Akhirnya penulis berharap semoga
tesis ini dapat bermanfaat bagi pengembangan ilmu pengetahuan.
Medan, Januari 2012 Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Padangsidimpuan, Sumatera Utara pada tanggal 04
Juni 1984 dari Pasangan Bapak Drs. Syamsunur Ritonga dan Ibu Tukmaida
Harahap S. Ag. Penulis merupakan anak kedua dari empat bersaudara.
Pada tahun 1996, penulis menyelesaikan pendidikan di SD Negeri 200117
Padangsidimpuan. Pada tahun 1999 menyelesaikan pendidikan di MTSs
Perguruan Rakyat Padangsidimpuan. Pada tahun 2002 menyelesaikan pendidikan
di SMA YPI Nurul Ilmi Padangsidimpuan. Pada Tahun 2008 menyelesaikan
pendidikan FKIP Universitas Riau, Jurusan Pendidikan Biologi dan memperoleh
gelar Sarjana Pendidikan Biologi. Pada tahun 2008 penulis mengajar di SMPN 3
Satu Atap Kecamatan Halongonan Kabupaten Padang Lawas Utara. Pada tahun
2009 sampai sekarang mengajar di SMA Negeri 1 Padang Bolak Julu Kabupaten
Padang Lawas Utara.
Pada tahun 2009 penulis mendapat kesempatan untuk melanjutkan studi
pada Sekolah Pascasarjana Universitas Sumatera Utara, Program Studi Biologi.
Sebagai satu diantara beberapa syarat untuk memperoleh gelar Magister Sains, penulis menyusun tesis dengan Judul “Keanekaragaman Bakteri Serasah Daun
DAFTAR ISI
1.2. Pembatasan dan Perumusan Masalah………. 3
1.3. Kerangka Pemikiran……… 4
1.4. Tujuan Penelitian………. 5
1.5. Hipotesis Penelitian………. 5
1.6. Manfaat Penelitian………... 6
BAB II. TINJAUAN PUSTAKA………... 7
2.1. Pengertian dan Peran Ekosistem Mangrove………….. 7
2.2. Peran Bakteri dalam Ekosistem Mangrove………. 9
2.3. Proses Dekomposisi Serasah Mangrove……….. 11
2.4. Kandungan Unsur Hara C, N dan P Serasah Daun Mangrove………. 12
2.5. Salinitas……….. 13
BAB III. METODE PENELITIAN……… 15
3.1. Tempat dan Waktu Penelitian……….. 15
3.2. Bahan dan Alat……… 15
3.3. Variabel yang akan Diamati……… 16
3.4. Pengumpulan Data Bakteri……….. 16
3.5. Pengumpulan Serasah Daun R. apiculata………. 16
3.6. Penempatan Serasah Daun R. apiculata di Lokasi Penelitian………. 17
3.7. Isolasi Bakteri Serasah Daun R. apiculata………. 20
3.8. Identifikasi Bakteri……….. 21
3.9. Penentuan Indeks Keanekaragaman Jenis Bakteri…… 21
3.12 Penentuan Laju Dekomposisi Daun Serasah R.
apiculata……….. 22
3.13 Penentuan Kandungan Unsur Hara C, N dan P yang Terdapat pada Serasah Daun R. apiculata……….. 23
BAB IV. HASIL DAN PEMBAHASAN……… 25
4.1. Jenis-jenis bakteri yang Terdapat pada serasah Daun R. apiculata yang Belum Mengalami Proses Dekomposisi 25 4.2. Jenis-jenis Bakteri yang Terdapat pada Serasah Daun R. apiculata yang Mengalami Proses Dekomposisi pada Berbagai Tingkat Salinitas……….. 25
4.3. Perbandingan Indeks Keanekaragaman Jenis Bakteri pada Berbagai Tingkat Salinitas……….. 36
4.4. Frekuensi Kolonisasi Tiap Jenis Bakteri………. 37
4.5. Penentuan Laju Dekomposisi Serasah Daun R. apiculatapada Berbagai Tingkat Salinitas………. 38
4.6 Kandungan Unsur C, N dan P Daun R. apiculata yang Mengalami Proses Dekomposisi pada Berbagai Tingkat Salinitas………... 42
BAB V. KESIMPULAN DAN SARAN……… 50
5.1. Kesimpulan……….. 50
5.2. Saran……… 40
DAFTAR KEPUSTAKAAN 51
DAFTAR TABEL
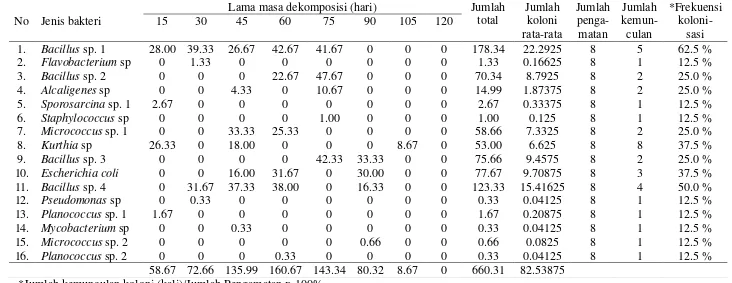
4.2 Jumlah Koloni Bakteri Rata-rata x 107(CFU/ml) Tiap Jenis Bakteri Tiap 15 Hari dan Frekuensi Kolonisasi pada mengalami proses dekomposisi selama 15 sampai 120 hari di lingkungan dengan salinitas 10-20 ppt.
29
4.4 Jumlah koloni x 107(CFU/ml) berbagai jenis bakteri tiap ulangan pada serasah daun R. apiculata yang telah mengalami proses dekomposisi selama 15 sampai 120 hari di lingkungan dengan salinitas 20-30 ppt.
30
4.5 Jumlah koloni x 107(CFU/ml) berbagai jenis bakteri tiap ulangan pada serasah daun R. apiculata yang telah mengalami proses dekomposisi selama 15 sampai 120 hari di lingkungan dengan salinitas >30 ppt.
31
4.6 Indeks Keanekaragaman Jenis Bakteri yang Terdapat pada Serasah Daun R. apiculata yang Belum Mengalami Proses Dekomposisi dan yang Mengalami Proses Dekomposisi.
36
4.7 Kandungan Rata-rata Unsur Hara C, N dan P yang Terdapat pada Serasah Daun R. apiculata yang Mengalami Proses Dekomposisi pada Berbagai Tingkat Salinitas.
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
1.1 Kerangka Pemikiran Penelitian 4
3.1 Bentuk dan Ukuran Kantong Serasah yang Terbuat dari Kain Kasa Nilon
17
3.2 Lokasi Plot untuk Penempatan Kantong Serasah 18
3.3 Peta Lokasi Penelitian 18
3.4 Plot Penempatan Kantong Serasah di Lapangan 19
3.5 Cara Pengenceran Serasah Daun R. apiculata untuk
Isolasi Bakteri pada Media Biakan dalam Cawan Petri 20
4.1. Perbandingan antara Jumlah Jenis Bakteri pada
Berbagai Tingkat Salinitas 33
4.2 Perbandingan antara Jumlah Populasi Jenis Bakteri pada
Berbagai Tingkat Salinitas 35
4.3 Perbandingan Bobot Kering Serasah Daun R. apiculata
pada Berbagai Tingkat Salinitas 39
4.4 Rata-rata Laju Dekomposisi Serasah Daun R. apiculata
selama 120 hari pada berbagai tingkat salinitas 40
4.5 Bentuk Serasah Daun R. apiculata yang Mengalami apiculata yang telah Mengalami Proses Dekomposisi
Pada Berbagai Tingkat Salinitas 45
4.7 Kandungan Unsur Hara C, N dan P Rata-rata serasah daun R. apiculata dengan Berbagai Lama Masa
5.0 Bentuk-bentuk Koloni Bakteri yang Terdapat pada Serasah Daun R. apiculata yang Belum Mengalami Proses Dekomposisi: A. Bacillus sp. 1, B. Micrococcus
sp.1, dan C. Bacillus sp. 4 L-2
6.0 Bentuk-bentuk Koloni Bakteri pada Serasah Daun R. apiculata yang Mengalami Proses Dekomposisi pada Berbagai Tingkat Salinitas: A. Flavobacterium sp, B.
Bacillus sp. 2, C. Sporosarcina sp. 1, D. Staphylococcus sp, E. Kurthia sp, F. Escherichia coli, G. Bacillus sp. 3, mengalami dekomposisi di lingkungan dengan berbagai
tingkat salinitas: A. Uji SA, B. Uji SCA, C. Uji TSIA. L-8
8.0 Hasil uji fisiologi berbagai jenis bakteri yang terdapat pada serasah daun R. apiculata yang belum dan sudah mengalami dekomposisi di lingkungan dengan berbagai tingkat salinitas: A. Uji Katalase, B. Uji Motilitas, C.
Bakteri Gram Positif, D, E dan F. Bakteri Gram negatif. L-9
9.0 Isolat bakteri serasah daun R. apiculata yang belum dan sudah mengalami proses dekomposisi pada berbagai
tingkat salinitas dalam Tabung Reaksi L-28
10.0 Isolat bakteri serasah daun R. apiculata yang belum dan sudah mengalami proses dekomposisi pada berbagai
tingkat salinitas dalam Cawan Petri. L-30
11.0 Petak-petak penempatan kantong berisi serasah daun R. apiculata: dengan tingkat salinitas 0-10 ppt (A), 10-20
DAFTAR LAMPIRAN
belum mengalami proses dekomposisi (kontrol) L-1
B. Bentuk-bentuk Koloni Bakteri yang Terdapat pada Serasah Daun R. apiculata yang Belum Mengalami
Proses Dekomposisi L-2
C. Bentuk-bentuk Koloni Bakteri pada Serasah Daun R. apiculata yang Mengalami Proses Dekomposisi pada
Berbagai Tingkat Salinitas L-3
D. Ciri-ciri Morfologi dan fisiologi bakteri yang terdapat pada serasah daun R. apiculata yang mengalami proses
dekomposisi pada berbagai tingkat salinitas L-4
E. Hasil uji fisiologi L-8
F. Jumlah koloni x 107(CFU/ml) berbagai jenis bakteri tiap ulangan pada serasah daun R. apiculata yang telah mengalami proses dekomposisi selama 15 sampai 120
hari di lingkungan dengan salinitas 0-10 ppt. L-10
G. Jumlah koloni x 107(CFU/ml) berbagai jenis bakteri tiap ulangan pada serasah daun R. apiculata yang telah mengalami proses dekomposisi selama 15 sampai 120
hari di lingkungan dengan salinitas 10-20 ppt. L-11
H. Jumlah koloni x 107(CFU/ml) berbagai jenis bakteri tiap ulangan pada serasah daun R. apiculata yang telah mengalami proses dekomposisi selama 15 sampai 120
hari di lingkungan dengan salinitas 20-30 ppt. L-12
I. Jumlah koloni x 107(CFU/ml) berbagai jenis bakteri tiap ulangan pada serasah daun R. apiculata yang telah mengalami proses dekomposisi selama 15 sampai 120
J. Nilai Absolut unsur hara C (%) serasah daun R. apiculata yang mengalami proses dekomposisi selama 15 hari sampai 120 hari di lingkungan dengan
berbagai tingkat salinitas. L-14
K. Nilai Absolut unsur hara N (%) serasah daun R. apiculata yang mengalami proses dekomposisi selama 15 hari sampai 120 hari di lingkungan dengan
berbagai tingkat salinitas. L-15
L. Nilai Absolut unsur hara P (%) serasah daun R. apiculata yang mengalami proses dekomposisi selama 15 hari sampai 120 hari di lingkungan dengan
berbagai tingkat salinitas. L-16
M. Analisis Statistik L-17
N. Matriks hubungan pengaruh berbagai tingkat salinitas terhadap jumlah koloni rata-rata (CFU/ml) berbagai jenis bakteripada serasah daun R. apiculata yang belum dan telah mengalami proses dekomposisi
selama 120 hari L-24
O. Rangkuman ciri-ciri morfologi berbagai jenis bakteri pada media NA yang terdapat pada serasah daun R. apiculata yang belum dan telah mengalami dekomposisi di lingkungan dengan berbagai tingkat
salinitas. L-25
P. Rangkuman ciri-ciri fisiologi berbagai jenis bakteri pada media NA yang terdapat pada serasah daun R. apiculata yang belum dan telah mengalami dekomposisi di lingkungan dengan berbagai tingkat
salinitas. L-26
Q Persentase bobot kering serasah daun R. apiculata tiap ulangan pada berbagai tingkat salinitas dan lama masa
dekomposisi L-27
R. Isolat bakteri serasah daun R. apiculata yang belum dan sudah mengalami proses dekomposisi pada
berbagai tingkat salinitas. L-28
S. Perhitungan Laju Dekomposisi Metode Olson (Olson,
1963) L-31
T. Petak-petak penempatan kantong berisi serasah daun
U. Prosedur Uji Fisiologi Bakteri L-35
V. Data Indeks Keanekaragaman jenis Bakteri pada
ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh tingkat salinitas terhadap keanekaragaman bakteri, laju dekomposisi serasah dan kandungan unsur hara C, N dan P pada serasah daun R. apiculata yang mengalami proses dekomposisi. Penelitian dilakukan di kawasan hutan mangrove Kota Pari Pantai Cermin Sumatera Utara. Serasah dikumpulkan menggunakan kantong serasah yang terbuat dari jaring nilon dengan mesh 2 mm. Serasah daun dikumpulkan selama 2 minggu. Kantong serasah diisi 50 gram daun kering dan diletakkan di lantai hutan mangrove pada 4 lokasi yang memiliki tingkat salinitas yang berbeda, pengamatan dilakukan tiap 15 hari. Hasil penelitian menunjukkan bahwa ada 18 jenis bakteri yang berhasil diisolasi dari serasah daun R. apiculata yang mengalami proses dekomposisi yaitu Bacillus (5 jenis), Flavobacterium (1 jenis),
Alcaligenes (1 jenis), Sporosarcina (2 jenis), Staphylococcus (1 jenis),
Micrococcus (2 jenis), Kurthia (1 jenis), Escherichia coli (1 jenis), Pseudomonas
(1 jenis), Planococcus (2 jenis), Mycobacterium (1 jenis). Jumlah bakteri yang paling banyak ditemukan pada tingkat salinitas 10-20 ppt yaitu 82,69 X 107 CFU/ml, sementara jumlah bakteri paling sedikit ditemukan pada tingkat salinitas >30 ppt yaitu 57,03 X 107 CFU/ml. Bakteri yang paling sering ditemukan selama proses dekomposisi adalah Bacillus sp. 1. Indeks keanekaragaman jenis bakteri pada serasah daun R. apiculata yang mengalami proses dekomposisi pada tingkat salinitas 0-10 ppt adalah 2,41, 10-20 ppt adalah 2,58, 20-30 ppt adalah 2,20, >30 ppt adalah 2,06. Frekuensi kolonisasi spesies bakteri antara 12,5 % sampai 100%. Tingkat salinitas berpengaruh terhadap laju dekomposisi pada serasah daun R. apiculata mulai dari 15 sampai 120 hari. Laju dekomposisi pada tingkat salinitas 0-10 ppt adalah, 0,60, 10-20 ppt adalah 0,50, 20-30 ppt adalah 0,44, >30 ppt adalah 0,45. Tingkat salinitas berpengaruh terhadap kandungan unsur hara C, N dan P pada serasah daun yang mengalami proses dekomposisi. Kandungan unsur hara C tertinggi terdapat pada serasah daun yang mengalami proses dekomposisi pada tingkat salinitas 0-10 ppt, sedangkan kandungan unsur hara C terendah terdapat pada tingkat salinitas >30 ppt. Kandungan unsur hara N tertinggi pada serasah daun R. apiculata yang mengalami proses dekomposisi terdapat pada tingkat salinitas >30 ppt, sedangkan kandungan unsur hara N terendah terdapat pada tingkat salinitas 10-20 ppt. Kandungan unsur hara P tertinggi terdapat pada tingkat salinitas >30 ppt sedangkan kandungan unsur hara P terendah terdapat pada tingkat salinitas 0-10 ppt.
ABSTRACT
The aims of this study were investigated the effect of salinity level on the diversity of bacteria and remaining in the C, N and P during the process of composition of the R. apiculata leaf litter. The research has been conducted at the mangrove forest of Kota Pari Cermin Beach North Sumatera. The leaf litter were collected using litter traps made of nylon mesh 2 mm pore. The leaf was collected for two weeks period. Litter bag was filled with 50 g leaf litter and put on the forest’s floor in four different salinity level, the litter bag was observed each 15 days of decomposition. The results of our investigation indicated that tottaly 18 species of bacteria were isolated from R. apiculata leaf litter undergoing the decomposition, including Bacillus (5 species), Flavobacterium (1 species),
Alcaligenes (1 species), Sporosarcina (2 species), Staphylococcus (1 species),
Micrococcus (2 species), Kurthia (1 species), Escherichia coli (1 species),
Pseudomonas (1 species), Planococcus (2 species), Mycobacterium (1 species). The highest amounts of bacteria at 10-20 ppt were 82,69 X 107 CFU/ml, whereas the lowest of bacteria at >30 ppt were 57,03 X 107 CFU/ml. Bacillus sp. 1 was dominant species during decomposition period. The species diversity indices in the leaf litter decomposition at 0-10 ppt were 2,41, at 10-20 ppt were 2,58, at 20-30 ppt were 2,20, at >20-30 ppt were 2,06. The frequency of the bacteria species colonization during the decomposition process ranged from 12,5 to 100%. The salinity level were influenced rate of decomposition R. apiculata in the leaf litter. The Salinity level on rate of decomposition leaf litter R. apiculata at 0-10 ppt were 0,60, at 10-20 ppt 0,50 ppt, at 20-30 ppt were 0,44, at >30 ppt were 0,45. The salinity level were influenced to C, N and P remaining in the leaf litter a long decomposition period. Sampel were analyzed for change in total C, N and P during decomposition period. The highest content of C was found in the leaf litter decomposed at 0-10 ppt, while the lowest content of C was found in the leaf litter decomposed at >30 ppt. The highest content of N was found in the leaf litter decomposed at >30 ppt, whereas the lowest content of N was found in the leaf litter decomposed at 10-20 ppt. The highest content of P was found in the leaf litter decomposed at >30 ppt, whereas the lowest content of P was found in the leaf litter at 0-10 ppt.
BAB I
PENDAHULUAN
1.1. Latar Belakang
Hutan mangrove dan perairan di sekitarnya merupakan suatu ekosistem
yang spesifik. Hal ini disebabkan oleh proses kehidupan biota (flora dan fauna)
yang saling berkaitan baik yang terdapat di darat maupun di laut (Odum, 1996).
Arief (2003) menyatakan bahwa hutan mangrove disebut juga sebagai interface
ecosystem karena menghubungkan daratan dengan daerah pesisir. Hutan
mangrove sebagai sumber daya alam, mempunyai fungsi strategis bagi ekosistem
pantai, yaitu sebagai penyambung dan penyeimbang ekosistem darat dan laut.
Secara ekologis mangrove berperan sebagai daerah pemijahan (spawning
grounds) dan daerah pembesaran (nursery grounds) berbagai jenis ikan, kerang
dan spesies lainnya. Selain itu serasah mangrove berupa daun, ranting dan
biomassa lainnya yang jatuh menjadi sumber pakan biota perairan dan unsur hara
yang sangat menentukan produktivitas perikanan laut.
Secara umum diketahui bahwa hutan mangrove memiliki produktivitas
yang tinggi dan banyak mendukung ekosistem di luarnya. Dua hal penting yang
saling berkaitan adalah siklus unsur hara di dalam hutan dan produktivitas hutan.
Siklus unsur hara mencakup impor dan ekspor bahan-bahan organik yang masih
ada atau keluar dari ekosistem yang dipacu oleh kondisi fisik dan biologi (Indiarto
et al., 1990). Sumbangan terpenting hutan mangrove terhadap ekosistem pesisir
berasal dari serasah daun yang gugur dan berjatuhan ke dalam air. Serasah daun
mangrove merupakan sumber bahan organik yang penting dalam rantai makanan
di kawasan pesisir yang dapat mencapai 7 sampai 8 ton/ha (Nontji, 1993).
Ekosistem mangrove memiliki fenomena yang khas, yakni terdapatnya
serasah daun yang dapat mengalami dekomposisi dengan bantuan bakteri dan
fungi. Daun–daun mangrove berperan sebagai produsen, sedangkan kelompok hewan sebagai konsumen dan bakteri sebagai dekomposer (Collier et al., 1973).
Bahan organik hasil dekomposisi merupakan zat penting bagi kelangsungan
Yunasfi (2006) untuk dapat dimanfaatkan oleh organisme yang terdapat pada
hutan mangrove, serasah tersebut perlu diuraikan terlebih dahulu menjadi
sederhana yang menjadi sumber makanan bagi organisme tersebut. Faktor-faktor
yang berperan dalam pelapukan serasah adalah iklim, lingkungan tempat tumbuh,
dan organisme. Faktor iklim adalah curah hujan, kelembaban, angin, cahaya
matahari, suhu udara dan lain-lain. Faktor lingkungan yang berperan adalah suhu
air, pH tanah, dan salinitas. Adapun organisme yang terdapat pada ekosistem
mangrove terdiri atas organisme yang cukup besar seperti kepiting, dan
mikroorganisme seperti bakteri, fungi dan lain-lain. Dalam proses kerjanya semua
faktor tersebut saling berinteraksi sehingga proses dekomposisi serasah dapat
berlangsung.
Pada hutan mangrove terdapat asosiasi jenis hewan dan jasad renik baik
yang terdapat di lantai hutan maupun yang menempel pada tanaman. Hutan
mangrove merupakan tempat berkembang komunitas bakteri. Bakteri memainkan
peran penting dalam ekosistem mangrove. Keberadaan dan keanekaragaman
bakteri dalam ekosistem mangrove dipengaruhi oleh faktor salinitas, pH, fisik,
iklim, vegetasi, nutrisi dan lokasi (Hrenovic et al., 2003). Beberapa bakteri
fotosintesis memainkan peranan dalam ekosistem mangrove melalui proses
fotosintesis, fiksasi nitrogen, metanogenesis, produksi enzim dan penghasil
antibiotik (Lyla dan Ajmal, 2006). Bakteri juga diketahui berperan penting dalam
penguraian serasah mangrove. Sebagian besar peran bakteri dalam proses
dekomposisi serasah secara langsung sebagai pengurai bahan-bahan organik yang
terakumulasi sebagai hasil dekomposisi serasah. Dalam peran tidak langsung ini
bakteri dikenal sebagai agens mikolitik (mycolytic agent) (Gyllenberg dan Eklund,
1974).
Aktivitas bakteri pada bahan organik adalah memineralisasi dan juga
memisahkan karbon organik menjadi bentuk biomassa bakteri (Boulton dan Boon,
1991). Aktivitas bakteri dalam siklus unsur hara pada sedimen adalah suatu hal
yang tidak bisa dipisahkan. Aktivitas bakteri tersebut tergantung pada
ketersediaan karbon-karbon yang dioksidasi (Pollard dan Kogure, 1993). Daur
bahan organik di laut sama dengan daur organik di lingkungan air tawar dan di
(N) melalui proses fotosintesis menghasilkan jaringan tumbuh-tumbuhan yang
menjadi makanan hewan. Keduanya menghasilkan zat organik, jika mati dan
membusuk dihasilkan bahan mentah untuk memulai daur bahan organik
(Romimohtarto dan Juwana, 2001)
Bakteri pengurai serasah daun mangrove sebagai agen utama dalam
dekomposisi (Sunarto, 2003) keberadaannya belum begitu banyak diteliti.
Pemahaman yang baik dari keberadaan bakteri pengurai merupakan suatu hal
yang bersifat eksplorasi untuk menemukan fungsi dan manfaatnya, sehingga dapat
dijadikan informasi yang penting dalam pengelolaan perairan pantai yang terdapat
di sekitar kawasan hutan mangrove. Hutan mangrove Kota Pari Pantai Cermin
merupakan kawasan yang banyak didominasi jenis vegetasi Rhizophora apiculata
dan belum banyak dilakukan penelitian pada daerah tersebut. Berdasarkan uraian
di atas akan dilakukan penelitian untuk mengetahui keanekaragaman bakteri yang
terdapat pada serasah daun R. apiculata yang mengalami dekomposisi berbagai
tingkat salinitas.
1.1. Pembatasan dan Perumusan Masalah
Penelitian tentang keanekaragaman bakteri serasah daun dibatasi pada R.
apiculata didasarkan pertimbangan bahwa serasah daun R. apiculata merupakan
serasah yang paling banyak ditemukan di Kota Pari Pantai Cermin bila dibanding
dengan serasah lainnya. Serasah yang digunakan dalam penelitian adalah daun R.
apiculata yang jatuh pada permukaan tanah dan tidak terikat lagi pada tumbuhan
hidup.
Keberadaan bakteri dalam ekosistem mangrove sangat penting. Populasi
bakteri dapat menjadi ukuran yang menentukan dalam mengetahui proses
dekomposisi pada suatu ekosistem (Tarumingkeng, 1994). Keberadaan bakteri
serasah daun mangrove sangat dipengaruhi oleh faktor lingkungan terutama
salinitas (Langenheders, 2005). Berdasarkan penelitian Hunter et al, (1986)
jumlah dan jenis keanekaragaman bakteri berkurang dengan peningkatan kadar
garam. Berdasarkan uraian di atas dapat dirumuskan beberapa permasalahan,
1. Apakah keanekaragaman bakteri pada serasah daun R. apiculata yang
mengalami proses dekomposisi dipengaruhi oleh tingkat salinitas?
2. Apakah laju dekomposisi serasah daun R. apiculata yang mengalami
proses dekomposisi dipengaruhi oleh tingkat salinitas?
3. Apakah kandungan unsur hara C, N dan P pada serasah daun R. apiculata
yang mengalami proses dekomposisi dipengaruhi oleh tingkat salinitas?
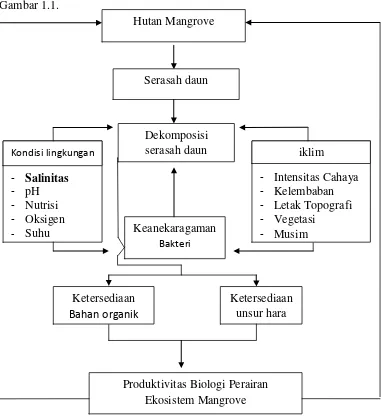
1.3. Kerangka Pemikiran
Pada ekosistem mangrove terdapat jenis-jenis pohon mangrove, seperti R.
apiculata. Secara skematis kerangka pemikiran penelitian dapat dilihat pada
Gambar 1.1.
Gambar 1.1 Kerangka Pemikiran Penelitian
Jenis pohon ini banyak menghasilkan serasah terutama yang berasal dari daun.
Serasah merupakan sumber utama detritus yang terdapat pada ekosistem
mangrove yang mempunyai peran penting memelihara kelangsungan siklus
ekosistem tersebut. Keanekaragaman bakteri di hutan mangrove memiliki peran
penting dalam proses dekomposisi. Hasil dekomposisi serasah adalah bahan
organik dan unsur hara yang penting bagi kehidupan organisme dan produktivitas
perairan terutama peristiwa rantai makanan.
1.4. Tujuan Penelitian
1. Untuk mengetahui keanekaragaman bakteri pada serasah daun R. apiculata
yang mengalami proses dekomposisi pada berbagai tingkat salinitas.
2. Untuk mengetahui laju dekomposisi serasah daun R. apiculata pada
berbagai tingkat salinitas.
3. Untuk mengetahui kandungan unsur hara C, N dan P pada serasah daun R.
apiculata yang mengalami proses dekomposisi pada berbagai tingkat
salinitas.
1.5. Hipotesis Penelitian
1. Serasah daun R. apiculata yang mengalami proses dekomposisi pada
tingkat salinitas >30 ppt memiliki keanekaragaman bakteri paling rendah
bila dibandingkan dengan tingkat salinitas 0-10 ppt, 10-20 ppt dan 20-30
ppt.
2. Serasah daun R. apiculata yang di tempatkan pada tingkat salinitas 0-10
ppt lebih cepat terdekomposisi bila dibandingkan dengan tingkat salinitas
10-20 ppt, 20-30 ppt dan >30 ppt.
3. Serasah daun R. apiculata yang mengalami proses dekomposisi pada
tingkat salinitas >30 ppt memiliki kandungan unsur hara C, N dan P paling
rendah bila dibandingkan dengan tingkat salinitas 0-10 ppt, 10-20 ppt dan
1.6. Manfaat penelitian
1. Mengetahui keanekaragaman jenis bakteri yang dapat mempercepat
terjadinya proses dekomposisi serasah daun mangrove sesuai dengan
kawasan mangrove dan tingkat salinitas yang ada.
2. Dapat digunakan sebagai informasi dasar untuk mempelajari siklus unsur
BAB II
TINJAUAN PUSTAKA
2.1. Pengertian dan Peran Ekosistem Mangrove
Kata mangrove merupakan kombinasi antara mangue (bahasa Portugis)
yang berarti tumbuhan dan grove (bahasa Inggris) yang berarti belukar atau hutan
kecil. Menurut Mac Nae (1978), kata mangrove digunakan untuk menyebut jenis
pohon-pohon atau semak-semak yang tumbuh di antara batas air tertinggi saat
pasang dan batas air terendah sampai di atas rata-rata permukaan air laut.
Berdasarkan SK Dirjen Kehutanan No. 60/Kpts/Dj./I/1978, hutan mangrove
dikatakan sebagai hutan yang terdapat di sepanjang pantai atau muara sungai dan
dipengaruhi oleh pasang surut air laut, yakni tergenang pada pasang dan bebas
genangan pada waktu surut. Snedaker (1978) menyatakan bahwa hutan mangrove
merupakan sekelompok jenis tumbuhan yang tumbuh di sepanjang garis pantai
tropika dan subtropika yang terlindung dan memiliki bentuk lahan pantai dengan
tipe tanah anaerob. Hutan mangrove merupakan vegetasi yang hidup di muara
sungai, daerah pasang surut, dan tepi laut (Baehaqie dan Indrawan, 1993).
Menurut Kusmana et al., (2005) hutan mangrove adalah tipe hutan yang
tumbuh di daerah pasang-surut (terutama di pantai yang terlindung, laguna, muara
sungai) yang tergenang pasang dan bebas dari genangan pada saat surut yang
komunitas tumbuhannya toleran terhadap garam. Adapun ekosistem mangrove
merupakan suatu sistem yang terdiri atas organisme (tumbuhan dan hewan) yang
berinteraksi dengan faktor lingkungan di dalam suatu habitat mangrove. Hutan
mangrove juga dikenal dengan istilah tidal forest, coastal woodland,
vloedbosschendan hutan payau.
Ekosistem mangrove adalah suatu lingkungan yang mempunyai ciri
khusus karena lantai hutannya secara teratur digenangi oleh air yang dipengaruhi
oleh salinitas serta fluktuasi ketinggian permukaan air karena adanya pasang surut
air. Hutan mangrove merupakan komunitas vegetasi pantai tropis dan subtropis,
yang didominasi oleh beberapa jenis pohon mangrove yang mampu tumbuh dan
Menurut Hutching dan Saenger (1987), faktor-faktor yang mempengaruhi
keberadaan mangrove adalah (1) suhu udara; (2) media lumpur; (3) air garam; (4)
kisaran pasang surut; (6) arus laut dan (7) pantai yang dangkal. Tumbuhan
mangrove memiliki kemampuan khusus untuk beradaptasi dengan kondisi yang
ekstrim, seperti kondisi tanah yang tergenang, kadar garam yang tinggi serta
kondisi tanah yang kurang stabil (Noor et al., 1999).
Flora mangrove dapat dikelompokkan ke dalam dua kategori (Chapman,
1976) yaitu (1) Flora mangrove inti, merupakan flora mangrove yang mempunyai
peran ekologi utama dalam formasi mangrove, yakni Rhizophora, Bruguiera,
Ceriops, kandelia, Sonneratia, Avicennia, Nypa, Xylocarpus, Deris, Acanthus,
Lumnitzera, Scyphiphora, Smythea dan Dolichandrone; (2) Flora mangrove
peripheral (pinggiran), merupakan flora mangrove yang secara ekologi berperan
dalam formasi hutan, yakni Excoecaria agallocha, Acrostichum aureum, Cerbera
manghas, Heritiera littoralis, Hibiscus tiliaceus, dan lain-lain.
Secara ekologis susunan sebaran jenis pohon di hutan mangrove mulai dari
laut ke arah daratan berturut-turut adalah jenis-jenis Avicennia, Sonneratia,
Rhizophora, Bruguiera, Ceriops, Lumnitzera dan Xylocarpus dengan batas sebar
yang tidak jelas. Pada umumnya hutan mangrove didominasi oleh jenis-jenis
Rhizophora, Bruguiera dan Ceriops yang kayunya mempunyai nilai ekonomi
tinggi. Frekuensi genangan air laut sangat menentukan ragam jenis vegetasi yang
dapat tumbuh dan pada umumnya jenis-jenis bakau (Rhizophora spp) tumbuh
terbanyak (Perum Perhutani, 1994).
Ekosistem mangrove mempunyai peran yang penting dalam mendukung
kehidupan organisme yang terdapat pada ekosistem tersebut. Adapun fungsi hutan
mangrove menurut Arief (2003) dapat dibedakan menjadi lima, yaitu fungsi fisik,
fungsi kimia, fungsi biologi, fungsi ekonomi, dan fungsi lain (wanawisata) seperti
dibawah ini. Fungsi fisik: (a) Menjaga garis pantai agar tetap stabil; (b)
melindungi pantai dan tebing sungai dari proses erosi atau abrasi, serta menahan
atau menyerap tiupan angin kencang dari laut ke darat; (c) Menahan sedimen
secara periodik sampai terbentuk lahan baru; (d) Sebagai kawasan penyangga
proses intrusi atau rembesan air laut ke darat, atau sebagai filter air asin menjadi
Fungsi kimia: (a) Sebagai tempat terjadinya proses daur ulang yang
menghasilkan oksigen; (b) Sebagai penyerap karbondioksida; (c) Sebagai
pengolah bahan-bahan limbah hasil pencemaran industri dan kapal-kapal di
lautan. Fungsi biologi: (a) Sebagai penghasil bahan pelapukan yang merupakan
sumber makanan penting bagi invertebrata kecil pemakan detritus, yang kemudian
berperan sebagai sumber makanan bagi hewan yang lebih besar; (b) Sebagai
kawasan pemijah bagi udang, ikan, kepiting, dan kerang yang setelah dewasa akan
kembali ke lepas pantai; (c) Sebagai kawasan untuk berlindung, bersarang, serta
berkembang biak bagi burung dan satwa lain; (d) Sebagai sumber plasma nutfah
dan sumber genetik. Fungsi ekonomi: (a) Penghasil kayu; (b) Penghasil bahan
baku industri; (c) Penghasil bibit ikan, udang, kerang, kepiting, telur burung.
Fungsi lain (Wanawisata): (a) Sebagai kawasan wisata alam pantai; (b) Sebagai
tempat pendidikan, konservasi, dan penelitian.
Naamin dan Hardjamulia (1991), menyatakan bahwa besarnya peran
ekosistem mangrove terhadap kehidupan dapat diamati dari keanekaragaman jenis
organisme, baik yang hidup di perairan, di atas lahan, maupun ditajuk-tajuk
tumbuhan mangrove serta ketergantungan manusia secara langsung terhadap
ekosistem ini. Bagian tanaman mangrove, termasuk batang, akar dan daun yang
berjatuhan memberikan habitat bagi spesies akuatik yang berasosiasi dengan
ekosistem mangrove. Ekosistem ini berfungsi sebagai tempat untuk memelihara
larva, tempat bertelur dan sumber pakan bagi berbagai spesies akuatik, khususnya
udang dan ikan bandeng (Sikong, 1978).
2.2. Peran Bakteri dalam Ekosistem Mangrove
Bakteri berperan penting dalam proses dekomposisi bahan organik.
Aktivitas bakteri mampu meningkatkan ketersediaan unsur hara melalui proses
mineralisasi karbon dan asimilasi nitrogen (Blum et al., 1988). Mikroorganisme
membutuhkan molekul-molekul organik dari organisme lain sebagai nutrisi agar
mampu bertahan hidup dan berkembang biak. Adanya aktivitas bakteri
menyebabkan tingginya produktivitas ekosistem mangrove (Lyla dan Ajmal,
Bakteri merupakan salah satu komponen penting yang berperan dalam
penguraian serasah daun di ekosistem mangrove. Hampir semua bakteri laut
bersifat Gram negatif dan ukurannya lebih kecil dibanding dengan bakteri non
laut. Bakteri Gram positif hanya 10% dari total populasi bakteri laut dan proporsi
terbesar terdiri atas bakteri Gram negatif berbentuk batang, yang umumnya
aktivitas gerakan dilakukan dengan bantuan flagel. Bakteri bentuk kokus
umumnya lebih sedikit dibanding bentuk batang. Keberadaan bakteri laut Gram
positif terbanyak ditemukan pada sedimen (Kathiresan dan Bingham, 2001).
Dalam proses dekomposisi di perairan mangrove, peran aktif bakteri mutlak
diperlukan. Bakteri akan menguraikan serasah secara enzimatik melalui peran
aktif dari enzim proteolitik, selulolitik dan kitinolitik. Bakteri kelompok
proteolitik berperan dalam proses dekomposisi protein adalah Pseudomonas,
sedangkan kelompok bakteri yang berperan dalam proses dekomposisi selulosa
adalah bakteri Cytophaga, Sporacytophaga, kelompok bakteri yang
mendekomposisi kitin meliputi Bacillus, Pseudomonas dan Vibrio (Lyla dan
Ajmal, 2006).
Bakteri memainkan peran penting dalam penguraian mangrove, juga
diketahui bahwa sedimen mangrove merupakan bahan penting dalam proses aliran
karbon pada hutan mangrove. Pada bagian atas sedimen mangrove dengan
ketebalan 2 cm ditemukan 3,6 x 1011 sel bakteri/gram bobot kering sedimen (Hogarth, 1999). Menurut Adel (2001) jumlah bakteri aminolitik yang ditemukan
pada serasah mangrove sebanyak 1,46 x 106 CFU/g. Komunitas bakteri mangrove di ekosistem mangrove India, menunjukkan bahwa jumlah bakteri yang hidup
bebas berkisar antara 8,1 x 106 sampai 10,9 x 106 dan yang berpigmen berkisar antara 0,18 x 106 sampai 1,95 x 106 CFU/g. Penelitian yang dilakukan oleh D’Costa et al, (2004) pada komunitas mangrove di India ditemukan 10 genus bakteri yaitu Bacillus, Micrococcus, Pseudomonas, Beijerinckia, Erwinia,
Microbacterium, Rhodococcus, Serratia, Staphylococcus dan Xanthomonas.
Menurut Kolm et al, (2002) Escherichia coli ditemukan di perairan estuaria teluk
Paranagua dan Antonina Brazil pada tingkat salinitas 1 ppt sampai 33 ppt
sedangkan menurut Terrones et al, (2005) Escherichia coli ditemukan di estuaria
bakteri yang terdapat pada serasah daun yang mengalami dekomposisi pada umur
enam hari dapat mencapai 6 x 108 sel/cm2/jam (Benner et al., 1988). Bakteri laut umumnya lebih kecil dibanding bakteri non-laut, dan proporsi terbesar terdiri atas
bakteri gram negatif bentuk batang, serta pada umumnya aktivitas pergerakan
dilakukan dengan bantuan flagella. Bakteri berbentuk bola (cocci) umumnya lebih
sedikit dibanding bakteri yang berbentuk batang. Kebanyakan bakteri laut terikat,
atau bergabung sesamanya untuk membentuk permukaan yang kuat (solid) karena
adanya bahan berlendir sehingga sel-sel saling terikat. Dengan cara ini bakteri
bisa membentuk lapisan permukaan yang mengakibatkan bakteri bisa hidup pada
alga, rumput laut dan tumbuhan mangrove (Hutching dan Saenger, 1987). Daya
tahan hidup dan perkembangan bakteri dipengaruhi oleh kelembaban, suhu dan
cahaya matahari dan jumlah bakteri berubah dari satu musim ke musim berikutnya
(Bell, 1974).
2.3. Proses Dekomposisi Serasah Mangrove
Dekomposisi merupakan kegiatan atau proses penguraian dan pemisahan
bahan-bahan organik menjadi bagian yang hancur (Satchell, 1974). Menurut
Nybakken (1993) Dekomposisi merupakan proses penting dalam fungsi ekologis.
Organisme yang telah mati mengalami penghancuran menjadi pecahan-pecahan
yang lebih kecil, dan akhirnya menjadi partikel-partikel yang lebih kecil.
Dekomposisi adalah proses penghancuran bahan organik dengan berat molekul
yang lebih besar menjadi komponen dengan berat molekul yang lebih besar
menjadi komponen dengan berat molekul yang lebih kecil melalui mekanisme
enzimatik (Saunder, 1980). Sejalan dengan itu Smith (1980) menyatakan bahwa
proses dekomposisi adalah gabungan dari proses fragmentasi, perubahan struktur
fisik dan kegiatan enzim yang dilakukan oleh dekomposer yang merubah bahan
organik menjadi senyawa anorganik. Serasah adalah bagian vegetatif dan
generatif yang terlepas dari tanaman yang bisa disebabkan oleh senescense atau
stress, oleh faktor mekanisme seperti angin, kombinasi kedua faktor ini atau mati
(Brown, 1984). Menurut Arief (2003), Serasah merupakan bahan organik yang
mengalami beberapa tahap proses dekomposisi dapat menghasilkan zat yang
rantai makanan. Serasah dalam ekologi digunakan untuk dua pengertian yaitu (1)
lapisan bahan tumbuhan mati yang terdapat pada permukaan tanah; (2) bahan
-bahan tumbuhan mati yang tidak terikat lagi pada tumbuhan (Yunasfi, 2006).
Menurut Mason (1977) terdapat 3 tahap proses dekomposisi serasah yaitu:
1. Proses pelindian (leaching), yaitu mekanisme hilangnya bahan-bahan yang
terdapat pada serasah atau detritus akibat curah hujan atau aliran air.
2. Penghawaan (wathering), merupakan mekanisme pelapukan oleh
faktor-faktor fisik seperti pengikisan oleh angin atau pergerakan molekul air.
3. Aktivitas biologi yang menghasilkan pecahan-pecahan organik oleh
makhluk hidup yang melakukan dekomposisi.
Bakteri adalah komponen biotik yang berperan penting dalam proses
dekomposisi (Mason, 1977). Menurut Saraswati dan Sumarno (2008), Proses
dekomposisi dimulai dengan kolonisasi bahan organik mati oleh bakteri yang
mampu mendekomposisi jaringan mati melalui mekanisme enzimatik. Bakteri
mengeluarkan enzim yang menghancurkan molekul-molekul organik kompleks
seperti protein dan karbohidrat dari tumbuhan yang telah mati. Beberapa enzim
yang terlibat dalam perombakan bahan organik antara lain Betta-glukosidase,
lignin peroksidase (LiP), manganese peroksidase (MnP), lakase dan reduktase.
Enzim reduktase merupakan penggabungan dari LiP dan MnP yaitu enzim
versatile peroksidase. Proses dekomposisi bakteri sangat dipengaruhi oleh kondisi
lingkungan terutama ketersediaan oksigen terlarut khususnya bakteri aerobik
(Saunder, 1980).
2.4. Kandungan Unsur Hara C, N dan P Serasah Daun Mangrove
Dekomposisi bahan organik yang tersedia di kawasan hutan mangrove
berasal dari bagian-bagian pohon, terutama yang berupa daun. Hasil analisis
laboratorium menunjukkan bahwa daun R. apiculata mengandung unsur hara
karbon 50,83%, nitrogen 0,83%, fosfor 0,025%, kalium 0,35%, kalsium 0,75%
dan 0,80% (Arief, 2003). Tanah hutan mangrove di daerah tropis dan subtropis
bersifat semi aerobik, rendahnya kandungan unsur hara, memiliki konsentrasi
logam berat yang tinggi dan salinitasnya lebih tinggi dibanding dengan tanah
pelapukan dengan cepat tanpa penambahan unsur hara, terutama pada keadaan
aerobik (Ito dan Nakagiri, 1997). Faktor yang mempengaruhi aktivitas bakteri
dalam penguraian bahan organik tumbuhan adalah jenis tumbuhan dan iklim.
Faktor tumbuhan biasanya terbentuk sifat fisik dan kimia daun yang tercermin
dalam perbandingan antara unsur karbon dan unsur nitrogen yang dinyatakan
sebagai nisbah C/N (Thaiutsa dan Granger, 1979). Meningkatnya
keanekaragaman bakteri mempengaruhi laju proses dekomposisi dan pola
pelepasan unsur hara. Selama proses dekomposisi, kehilangan masa ditentukan
oleh kandungan nitrogen dan rasio C/N pada substrat (Handayani et al., 1999).
Rasio C/N yang tinggi menunjukkan tingkat kesulitan substrat terdekomposisi.
Menurut Bross et al, (1995) rasio lignin/N merupakan indikator yang baik untuk
mendeteksi laju kehilangan masa. Selain itu, lignin juga turut berpengaruh
terhadap proses degradasi secara enzimatis pada karbohidrat dan protein (Mellilo
et al., 1982).
2.5. Salinitas
Salinitas merupakan kandungan garam dalam air laut yang dinyatakan
dalam satuan ppt atau gram dalam satu kilogram air laut. Tingkat salinitas
merupakan salah satu faktor yang mempengaruhi kehidupan serta pertumbuhan
mikroorganisme pada ekosistem mangrove. Menurut Polunin (1986), Ada
beberapa macam respons mikroorganisme terhadap salinitas, yaitu:
1. Mikroorganisme tidak mampu bertoleransi dan akan mati pada kondisi
salinitas tinggi, umumnya mikroorganisme yang berasal dari air tawar.
2. Mikroorganisme mungkin toleran pada salinitas tertentu tetapi akan
tumbuh lebih baik pada salinitas rendah.
3. Mikroorganisme hanya dapat tumbuh pada kondisi dengan salinitas
dengan adanya ion natrium.
Sebaran salinitas di laut dipengaruhi oleh beberapa faktor seperti pola
sirkulasi air, penguapan, curah hujan, dan aliran air sungai. Lapisan dengan
salinitas homogen, maka suhu juga biasanya homogen, selanjutnya pada lapisan
bawah terdapat lapisan pekat dengan degradasi densitas yang besar yang
permukaan air laut sangat erat kaitannya dengan proses penguapan dimana
garam-garam akan mengendap atau terkonsentrasi (Nontji, 2007). Aksornkoae (1993)
menyatakan bahwa salinitas merupakan lingkungan yang sangat menentukan
perkembangan organisme. Menurut Chester (1989) kandungan air laut terbanyak
adalah NaCl dengan ion Cl- terlarut rata-rata sebanyak 55% dari jumlah garam. Komposisi ion-ion garam dalam air laut yang salinitasnya 35 ppt adalah Cl -(19,354 ppt), SO42- (2,71 ppt), Br- (0,067 ppt), F- (0,001 ppt), B- (0,005 ppt) Na+
(10,770 ppt), Mg2+ (1,290 ppt, Ca2+ (0,412), K+ (0,399 ppt) dan Sr2+ (0,08 ppt). Beberapa garam sangat efektif mempengaruhi suhu pertumbuhan bakteri yaitu
NaCl > LiCl > MgCl2 > KCl2 > RbCl (Ljunger, 1962). Tekanan osmotik sel
berhubungan dengan salinitas yang selanjutnya mempengaruhi terhadap suhu
pertumbuhan bakteri (Stanley dan Morita, 1986). Aktivitas enzim maksimum
bakteri Halobacterium cutirubrum setelah penambahan 2M NaCl (Lanyi, 1969).
BAB III
BAHAN DAN METODE
3.1. Waktu dan Tempat Penelitian
Penelitian lapangan dilakukan di kawasan hutan mangrove Kota Pari
Pantai Cermin Sumatera Utara (luas 30 hektar dan secara geografis terletak pada
03039’42”LU dan 98057’40”BT). Isolasi dan identifikasi bakteri dilakukan di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara dan analisis kandungan unsur hara C, N dan P di
Balai Penelitian Tanah - Badan Penelitian dan Pengembangan Pertanian
Departemen Pertanian Bogor. Waktu penelitian akan dilakukan pada bulan Mei
2011 sampai Oktober 2011.
3.2. Alat dan Bahan
Bahan yang digunakan: serasah daun Rhizophora apiculata, media agar
Triple Sugar Iron Agar (TSIA), gelatin untuk menguji hidrolisis gelatin, Sulfat
Indol Motility (SIM), Simmons Citrate Agar (SCA), Nutrien Agar (NA),
Trypticase Soy Agar (TSA), bahan uji pewarnaan gram (crystal violet, lugol
iodine, safranin, etil alcohol 95%, aquades, hidrogen peroksida (H2O2), bahan uji
oksidasi dengan bactident oksidase.
Alat-alat yang digunakan: inkubator, otoklaf, labu Erlenmeyer, pemanas,
aluminium foil, lampu bunzen, cawan petri, neraca Ohauss dengan ketelitian 0,1
gram, gelas ukur, tabung reaksi, kapas, pipet serologi (1,0, 2,0 dan 10 ml),
mikroskop binokuler, objek glass, glass speader, hockey stick, jarum ose, coloni
caunter, hand refractometer, mortar steril, termos, tali plastik, kantong serasah
3.3. Variabel yang Diamati
Variabel yang diamati dalam penelitian ini adalah:
1. Variabel bakteri: jumlah koloni tiap-tiap jenis bakteri, jumlah jenis bakteri,
jumlah populasi jenis bakteri dan frekuensi kolonisasi berbagai jenis
bakteri.
2. Variabel serasah daun: laju dekomposisi serasah, bobot serasah sisa selama
mengalami proses dekomposisi, kandungan unsur hara C, N, dan P setelah
mengalami proses dekomposisi.
3.4. Pengumpulan Data Bakteri
Serasah daun R. apiculata ditempatkan pada lokasi dengan tingkat
salinitas sebagai berikut:
A. Tingkat salinitas 0 - 10 ppt
B. Tingkat salinitas 10 - 20 ppt
C. Tingkat salinitas 20 - 30 ppt
D. Tingkat salinitas >30 ppt
Pengumpulan data dilakukan setelah serasah ditempatkan di lapangan
dengan berbagai tingkat salinitas, selama waktu sebagai berikut:
A. Hari ke - 0 (Kontrol) F. Hari ke - 75
B. Hari ke - 15 G. Hari ke - 90
C. Hari ke - 30 H. Hari ke - 105
D. Hari ke - 45 I. Hari ke - 120
E. Hari ke - 60
Adapun Data yang dikumpulkan berupa data tentang identitas, jumlah jenis,
populasi, frekuensi kolonisasi dan keanekaragaman jenis bakteri dikumpulkan
untuk mengetahui pengaruh tingkat salinitas air, serta lama dekomposisi terhadap
parameter-parameter tersebut.
3.5. Pengumpulan Serasah Daun R. apiculata
Serasah daun dikumpulkan dengan menggunakan penampung serasah
yang terbuat dari jaring kasa nilon dengan ukuran 2 x 2 meter sebanyak 10 kain
permukaan air, hal ini dimaksudkan untuk menghindari saat air pasang. Serasah
daun R. apiculata yang dikumpul 4800 gram (50 g serasah x 8 perlakuan x 3
ulangan x 4 kelompok) dan kontrol 150 gram (50 g serasah x 3 ulangan).
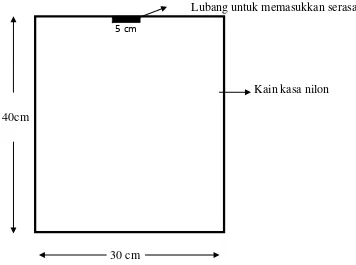
3.6. Penempatan Serasah Daun R. apiculata di Lokasi Penelitian
Serasah daun 50 gram dimasukkan ke dalam kantong serasah ukuran
40x30 cm yang terbuat dari nilon (Gambar 3.1). Jumlah kantong serasah yang
diperlukan sebanyak 96 buah (8 pengambilan x 3 ulangan x 4 kelompok).
Kemudian kantong berisi serasah ditempatkan pada lokasi penelitian dengan
berbagai tingkat salinitas yang telah diukur dengan hand refractometer.
Lubang untuk memasukkan serasah
5 cm 5 cm
Kain kasa nilon
40cm
30 cm
Gambar 3.1. Bentuk dan Ukuran Kantong Serasah yang Terbuat dari Kain Kasa Nilon
Pada lokasi dengan tingkat salinitas yang telah ditentukan, dibuat empat
plot (Gambar 3.2). Peta lokasi untuk penelitian disajikan pada Gambar 3.3.
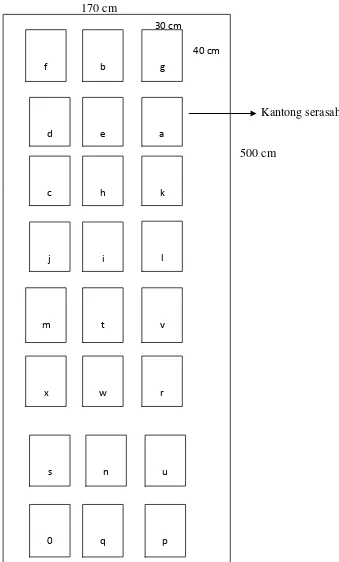
Kantong yang telah berisi serasah daun ditempatkan secara acak pada setiap plot
yang berukuran 500 x 170 cm (Gambar 3.4). Agar tidak dihanyutkan oleh pasang
air laut keempat ujung kantong serasah ini diikatkan pada kayu pancang yang
sudah diikatkan dengan kantong serasah diambil dari tiap tingkat salinitas sekali
15 hari dan pengambilan dilakukan sampai hari ke 120 hari.
Gambar 3.2. Lokasi Plot untuk Penempatan Kantong Serasah
170 cm
Kantong serasah
500 cm
Gambar 3.4. Plot Penempatan Kantong Serasah di Lapangan
30 cm
40 cm
c h k
j i l
m t v
x w r
s n u
d e a
f b g
3.7. Isolasi Bakteri Serasah Daun R. apiculata
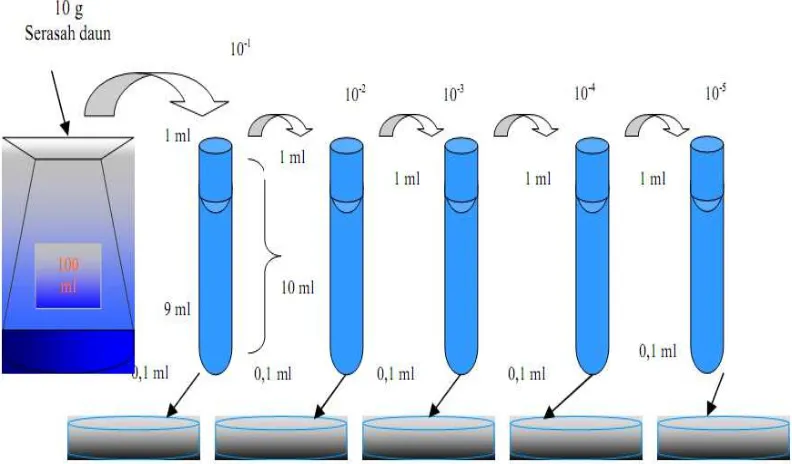
Isolasi bakteri dari serasah daun R. apiculata dilakukan dengan menumbuk
secara perlahan 10 gram serasah daun dalam mortar. Serasah daun R. apiculata
yang telah dihancurkan dimasukkan ke dalam labu Erlemenyer 250 ml (Gambar
3.5) selanjutnya dibuat suspensi dengan cara menambahkan air yang berasal dari
lingkungan serasah yang mengalami dekomposisi yang telah disterilkan, sampai
mencapai volume 100 ml. Setelah pengenceran serasah daun R. apiculata ini
mencapai volume 100 ml. Setelah pengenceran serasah daun R. apiculata ini
mencapai tingkat 10-7 sampel sebanyak 0,1 ml diambil untuk dibiakkan pada media agar nutrisi dalam cawan Petri. Untuk tiap pengenceran pekerjaan diulang 3
kali (Hadioetomo, 1993; Cappuccino dan Sherman, 1996).
Gambar 3.5. Cara Pengenceran Serasah Daun R. apiculata untuk Isolasi Bakteri pada Media Biakan dalam Cawan Petri
Suspensi bakteri sebanyak 0,1 ml diambil dengan pipet serologi dan
ditempatkan pada media biakan. Selanjutnya dengan hockey stick suspensi bakteri
disebar merata pada media. Suspensi bakteri diinkubasikan selama 48-72 jam.
Koloni bakteri yang berkembang, selanjutnya dimurnikan dengan membuat sub
biakan ke media NA dan TSA miring dalam tabung reaksi, kemudian
identifikasi bakteri pengamatan koloni dilakukan 1 sampai 12 hari setelah masa
inkubasi. Penghitungan koloni bakteri dilakukan terhadap cawan yang mempunyai
30 sampai 300 koloni bakteri. Jumlah koloni per ml dihitung dengan cara
mengalikan jumlah koloni yang terhitung dengan faktor pengenceran
(Hadioetomo, 1993; Cappuccino dan Sherman, 1996). Penentuan populasi bakteri
dari serasah daun R. apiculata yang telah mengalami proses dekomposisi sampai
120 hari dari berbagai perlakuan, dilakukan dengan pengenceran seperti pada
pengenceran seperti pada pengenceran daun yang belum mengalami dekomposisi.
3.8. Identifikasi Bakteri
Biakan murni ditumbuhkan pada media TSA dalam 2 cawan petri untuk
tiap isolat, selanjutnya diinkubasi pada suhu 370C selama 24 jam. Pengamatan untuk mengetahui ciri-ciri morfologi koloni bakteri yang meliputi sifat-sifat
umum koloni yaitu bentuk koloni, permukaan, tepi koloni, elevasi, warna koloni
(Hadioetomo, 1993; Cappucino dan Sherman, 1996).
Sifat fisiologi isolat bakteri yang diuji meliputi sifat-sifat sebagai berikut:
reaksi gram dengan pewarnaan atau dilakukan dengan uji kalium hidroksida
(KOH 3%). Isolat bakteri bersifat gram (-) jika berwarna merah atau terbentuk
benang lendir bakteri (kira-kira 5-20 mm panjangnya). Gram positif (+) jika
berwarna ungu atau tidak terbentuk benang lendir, kemampuan isolat
memproduksi katalase, kemampuan isolat melakukan hidrolisis gelatin,
kemampuan isolat menghidrolisis pati, kemampuan isolat dalam penggunaan gula,
kemampuan isolat dalam penggunaan sitrat, kemampuan isolat dalam melakukan
oksidasi, kemampuan motilitas isolat (Hadioetomo, 1993; Cappuccino dan
Sherman, 1996). Data hasil pengamatan diidentifikasi menggunakan Bergey’s
Manual of Determinative Bacteriology (Holt et al., 1994).
3.9. Penentuan Indeks Keanekaragaman Jenis Bakteri
Analisis keanekaragaman jenis bakteri dilakukan dengan menggunakan
H’ =
H’ = Indeks Keanekaragaman jenis Pi = ni/N
Ni = Nilai penting jenis ke i
N = Jumlah nilai penting semua jenis
S = Jumlah total spesies
Penelitian ini dilakukan dalam Rancangan Petak Terbagi dengan RAL
yang terdiri atas tingkat salinitas (0-10 ppt, 10-20 ppt, 20-30 ppt dan >30 ppt)
sebagai petak utama dan lama dekomposisi (kontrol, 15 hari, 30 hari, 45 hari, 60
hari, 75 hari, 90 hari, 105 hari dan 120 hari ) sebagai anak petak.
3.11. Analisis Data
Analisis data menggunakan Program SPSS
3.12. Penentuan Laju Dekomposisi Daun Serasah R. apiculata
Serasah daun R. apiculata dikeluarkan dari kantong serasah kemudian
dikeringanginkan dan ditimbang bobot basahnya. Selanjutnya dimasukkan ke
dalam amplop sampel. Amplop sampel yang berisi daun R. apiculata kemudian
serasah tersebut ditimbang untuk mengetahui bobot keringnya. Laju dekomposisi
serasah daun dihitung dari penyusutan bobot serasah yang terdekomposisi. Laju
dekomposisi serasah diperoleh dengan menggunakan persamaan (Olson,1963)
Xt / X0 = e – kt Xt = X0. e – kt 1n Xt = 1n X0– kt dengan:
Xt = Berat serasah setelah waktu pengamatan ke-t
X0 = Berat serasah awal
e = Bilangan logaritma natural (2,72)
k = Laju dekomposisi serasah
t = Waktu pengamatan
3.13. Penentuan Kandungan Unsur Hara C, N dan P yang Terdapat pada Serasah Daun R. apiculata
Untuk mengetahui kandungan unsur karbon dilakukan dengan metode
penetapan kandungan bahan organik berdasarkan kehilangan bobot karena
pemanasan. penetapan kadar karbon dilakukan dengan rumus:
Kadar C dalam daun = 100%
BKM = Bobot kering serasah daun setelah pemanasan 1050C BKP = Bobot kering serasah daun setelah pemanasan 3750C
Penentuan kadar nitrogen total dilakukan dengan menggunakan metode
Kjelldahl. Nitrogen (organik dan an organik) didekstrusi dengan H2SO4 pekat.
Dalam dekstrusi nitrogen diubah menjadi garam ammonium sulfat, kemudian
didestilasi dengan penambahan 50% NaOH untuk melepas NH4+ yang ditangkap
dengan HCL yang telah dibakukan sampai terjadi perubahan warna hijau menjadi
merah muda. Penetapan kadar nitrogen dilakukan rumus:
Kadar N dalam daun = 0,02 14 x100%
Dengan pengertian:
a. : Selisih volume
b. : Bobot kering dalam 0,1 gram tepung daun
0,02 : Normalitas HCL (sebelum distandarisasi terlebih dahulu untuk
mengetahui nilai normalitas yang tepat).
14 : Bobot atom Nitrogen
Untuk penentuan fosfor dilakukan dengan cara memasukkan 5 gram
contoh serasah daun kering udara, berukuran lebih kecil dari dua millimeter ke
dalam botol kocok. Selanjutnya ditambahkan 12,5 ml 25% HCL, dengan
menggunakan mesin pengocok dikocok selama 30 menit. Suspensi disaring
dengan kertas saring berlipat dan filtrat ditampung dalam labu ukur 100 ml,
kemudian dihimpitkan hingga tanda tera. Sebanyak 5 ml filtrat dimasukkan ke
dalam labu ukur 50 ml dan dihimpitkan hingga tanda tera. Alikuot sudah
mengalami pengenceran diambil dengan pipet sebanyak 5 ml dan dimasukkan ke
dalam tabung reaksi. Larutan PB dan PC ditambahkan secara berturut-turut,
dikocok dan dibiarkan selama 15 menit. Fosfor ditetapkan dengan
spektrofotometer pada panjang gelombang 660 nm. Selanjutnya dibuat larutan
blanko dan larutan baku untuk fosfor.
Kadar fosfor dihitung dengan rumus :