PENGGUNAAN HEPES DAN BUTIRAN EFERVESEN
DALAM SISTEM INKUBASI PADA PRODUKSI EMBRIO
DOMBA SECARA
IN
VlTRO
Oleh
JASWANDI
PROGRAM PASCASARJANA
INSTITUT PERTANIAN
BOGOR
&- SWX akan meninggikan orang-orang yang beriman di antaramu dan orang-orang yang diberi ilmu pengetahuan beberapa derajat (QS. Al-Mujibdalah : 11).
dan
.
.
.... . .
barang siapa menempuh jalan untuk menuntut ilmu maka Allah SWT. akan memudahkan baginya jalan ke surga (Muslim dari Abu Hurairah).Xeharibaan kedua orang tuaku yang senantiasa berdo'a untuk keberhasilan dan keselamatan anak-anaknya.
ABSTRAK
JASWANDI, 2002. Penggunaan Hepes dan Butiran Efervesen dalam Sistem Inkubasi pada Produksi Embrio Domba Secara In Vitro. Dibawah bimbingan YUHARA SIJKRA, MOZES R. TOELLHERE, ARIEF BOEDIONO DAN M. AGUS SETIADI.
Penelitian ini bertujuan mempelajari penggunaan Hepes dan butiran efervesen dalam sistem inkubasi pada produksi embrio domba secara m vitro. Oosit yang mempunyai beberapa lapis sel kurnulus (COC) dimatangkan dengan medium tzssue
culture ~nedtum-199 (TCM- 199) yang disuplementasi dengan beberapa level (kon- sentrasi) Hepes (0, 10,20 dan 30
mM)
dalam cawan petri dan straw. Oosit diinkubasi pada tiga kondisi yang berbeda yaitu inkubasi C02 5%, tanpa C 0 2 5% dan butiran efervesen. Untuk mendapatkan waktu optimum pada ketiga sistem inkubasi dilaku- kan percobaan pematangan oosit selama 16,20,24,28 dan 32 jam. Oosit yang telah matang difertilisasi dengan sperma segar selama 6 , 12, 18 dan 24 jam dalam masing- masing sistem inkubasi (C02 5%, tanpa C 0 2 5% dan butiran efervesen). Oosit yang telah difertilisasi dikultur untuk menentukan pengaruh inkubasi selama pematangan dan fertilisasi in vztra terhadap perkembangan embrio.Tingkat kematangan oosit dalam straw tidak menunjukkan perbedaan (P>0,05) dengan tingkat kematangan oosit dalam cawan petri, sementara penggunaan Hepes, tempat pernatangan dan sistem inkubasi menunjukkan interaksi yang nyata (P<0,05). Pada sistem inkubasi C 0 2 5%, tingkat kematangan tertinggi diperoleh pada medium TCM-199 tanpa Hepes (0 mM Hepes) pada cawan petri, dan tingkat kematangan oosit menurun dengan meningkatnya konsentrasi Hepes. Pada sistem inkubasi tanpa C02 5%, penambahan Hepes meningkatkan tingkat kematangan oosit. Tingkat kematangan tertinggi diperoleh pada medium TCM- 199 yang disuplementasi dengan 20 mM baik pada straw maupun cawan petri, tetapi ti& berbeda dengan konsentrasi Hepes 10 dan 30 mM. Pada sistem inkubasi butiran ef'ervesen tingkat kematangan tertinggi diperoleh pada medium TCM- 199 yang disuplernentasi dengan Hepes 10 mM pada straw. Periode pematangan yang optimum adalah 24-28 jam. Fertilisasi oosit m vrtro tidak dipengaruhi oleh sistem inkubasi maupun periode fertilisasi (P>O,O5). Perkembangan embrio tahap morula tidak menunjukkan perbe- daan pada ke tiga sistem inkubasi.
Dapat disimpulkan bahwa pematangan dan fertilisasi oosit m vitro dapat dilakukan tanpa C 0 2 5% dengan menambahkan Hepes 20 mM dan butiran efervesen dengan menambahkan Hepes 10 rnM.
ABSTRACT
JASWANDI, 2002. The Use of Hepes and Effervescent Granules in Incubation System of In Vitro Ovine Embryo Production. Advisory committee : YUHARA SUKRA, MOZES R. TOELIHERE, ARIEF BOEDIONO and M. AGUS SETIADI
The objective of this research was to study the use of Hepes and effervescent granules in incubation system of m vrtro ovine embryo production. The cumulus oocyte complexes (COCs) were matured in tissue culture medium-199 (TCM-199) supplemented with different levels of Hepes (0, 10, 20 and 30 mM) in petridish and straw. They were incubated in three different conditions : a) with 5% C02, b) without 5% C02, and c) effervescent granules. Five different periods of incubation (16, 20, 24,28 and 32 hours) in those system was designed to obtain the optimum maturation rate. Matured oocytes were fertilized by using ejaculated sperm for 6, 12, 18 and 24 hours in different incubation systems (5% CO2, without 5% C02, and effervescent granules). The fertilized oocytes were cultured to determine the effect of incubation system on in vitro maturation and fertilization on embryo development.
There was no difference (P>0.05) in maturation rate between petridish and straw treatments, whereas there was interaction (Pc0.05) among the Hepes, straw and incubation system treatments. In 5% C02 incubation system, the highest maturation rate was observed at TCM-199 + 0 rnM Hepes (without Hepes supplementation) in petridish, and the maturation rate were decreased by increasing Hepes level. In the absence of 5% C02, the use of Hepes increased the maturation rate. The highest maturation rate was observed at TCM-199 + 20 mM Hepes in petridish or straw, but there were not significant difference compared with 10 mM and 30 mM Hepes level in the medium. In effervescent granules incubation system, the highest maturation was observed at TCM-199
+
10 mM Hepes in straw. The optimum period of maturation was attained in COCs matured for 24-28 hours. Fertilization rate of matured oocytes was not affected by the incubation system or period of fertilization (P>0.05). There were no significant difference (P>0.05) in developmental rate to morula stage among the incubation system treatments in in vitro maturation and fertilization.It is concluded that the in vitro maturation and fertilization of ovine oocytes could be carried out in the absence of 5% C 0 2 incubation system by addition 20 inM Hepes buffered TCM- I99 or 10 mM Hepes in effervescent granules incubation system.
SURAT PERNYATMN
Saya menyatakan dengan sebenarnya bahwa disertasi yang berjudul "Penggu-
naan Hepes dan Butiran Efervesen dalam Sistem Inkubasi pada Praduksi
Embrio Damba Secara
In
vitro", merupakan gagasan atau penelitian saya sendiri, dengan bimbingan Komisi Pembimbing, kecuali yang dengan jelas ditunjukkanrujukannya. Disertasi belum pemah diajukan untuk memperoleh gelar pada program
sejenis di perguruan tinggi lain. Sernua data dan informasi yang digunakan secara
jelas dan dapat diperiksa kebenarannya
B gor, Desember 2002
PENGGUNAAN HEPES DAN BUTIRAN EFERVESEN
DALAM SISTEM INKUBASI PADA PRODUKSI EMBRIO
DOMBA SECARA
IN
VITRO
Oleh
JASWANDI
Disertasi sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi Reproduksi Pascasarjana Iustitut Pertanian Bogor
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : PENGGUNAAN HEPES DAN BUTIRAN EFERVESEN DALAM SISTEM INKUBASI PADA PRODUKSI
EMBRIO DOMBA SECARA IN ffTRO
Nama Mahasiswa : JASWANDI
Nomor Pokok : 975059
Program Studi : Biologi Reproduksi
Menyetujui : isi Pembimbing
'k
P~B.
Dr. drh. Yuhara Sukra, MSc.Y
Ketua
Prof. Dr. drh. Mozes R. Toelihere, MSc.
dr.
drh. Arief BoedionoAnggota Anggota
2. Ketua Program Studi Biologi Reproduksi
ogram Pasacasarjana
Prof. Dr. drh. Mozes R Toeli
Tanggal Iulus : 17 Desember
RIWAYAT HTDUP
Penulis dilahirkan tanggal 4 Oktober 1963 di Anding Kab. 50 Kota, Suma-
tera Barat, sebagai anak pertama dari Ayah Jasmi dan Ibu Raminas.
Pada tahun 1982 penulis inenamatkan pendidikan sekolah menengah atas di
SMA I1 Payakumbuh. Pada tahun yang sama mendapatkan kesempatan untuk
melanjutkan pendidikan di Fakultas Peternakan Universitas Andalas dan mendapat
gelar sarjana pada tahun 1986. Sejak tahun 1988 sampai sekarang penulis diangkat
sebagai staf pengajar pada Jurusan Produksi Ternak Fakultas Peternakan Universitas
Andalas. Pada tahun 1989 penulis mernperoleh beasiswa dari Tim Manajemen
Program Doktor (TMPD) Direktorat Jenderal Pendidikan Tinggi Departemen Pendi-
dikan dan Kebudayaan untuk memperdalam ilmu pada Program Studi Biologi
Reproduksi Pascasarjana IPB, dan memperoleh gelar Magister Science (MS) pada
tahun 1992. Pada tahun 1997 mendapat kesempatan untuk melanjutkan pendidikan
S3 pada Program Studi Biologi Reproduksi Pascasarjana IPB.
Penulis menikah dengan Dra. Fitrani Dwina, M.Ed tahun 1996 dan sekarang
telah dikarunia 2 orang anak, Randy Wahyu Hinanda (6 tahun) dan Annisa Dezura
PRAKATA
Puji syukur diucapkan kehadirat Allah S.W.T., atas berkat rahinat dan kurnia-
Nya penulis telah dapat menyelesaikan penyusunan dan penulisan disertasi ini. Judul
disertasi ini adalah : Penggunaan Hepes dan Butiran Efervesen Dalam Sistem
Inkubasi Pada Produksi Embrio Domba Secara In Etro, lsusun dan diajukan
sebagai syarat untuk memperoleh gelar Doktor pada Program Pascasarjana Institut
Pertanian Bogor.
Produksi embrio m vitro dapat menggunakan oosit yang berasal dari hewan
yang dipotong di Rumah Potong Hewan atau hewan mati, dan oosit yang diperoleh
dari hewan hidup dengan bantuan teknik ovum-pick-up. Dalam pemanfaatan oosit
hewan yang mati belum semua potensi yang ada dapat dimanfaatkan karena terbatas-
nya daya hidup oosit, sementara teknologi penyimpanan ovarium yang dapat mem-
pertahankan viabilitas oosit dalam waktu yang cukup lama atau selama transportasi
belum terseha. Untuk itu diperlukan teknologi yang memungkinkan proses produksi
embrio dapat dilakukan selama transportasi atau di luar laboratorium.
Kendala utama dalam produksi embrio di luar laboratorium atau selama
transportasi adalah keberadaan COz dan tempat pematangan. Prosedur standar
produksi embrio in vitro dilakukan dalam kondisi lingkungan ~nkubator yang
terkontrol, yaitu pada suhu 39 OC dan udara yang mengandung COZ 2,5-5% dan 0 2
20% dengan menggunakan cawan Petri. Keberadaan COz dalam inkubator sangat
penting dalam mempertahankan pH medium yang optimal bagi perhunbuhan embrio
yaitu sekitar 7,2-7,6. Selama proses produksi embrio in vitro C02 disuplai dari
tabung gas secara terus rnenerus.
Untuk meningkatkan fleksibilitas produksi embrio in vrtro, beberapa peneliti mencoba mengganti sumber atau peranan C02 dalam mempertahankan pH medium.
Penelitian pada sapi menunjukkan bahwa butiran efervesen dapat digunakan sebagai
sumber C02. Disamping itu peranan C02 dalam mempertahankan pH diduga juga
dapat digantikan dengan penambahan Hepes dalam medium pematangan. Selain
melalui manipulasi sistem inkubasi fleksibilitas produksi embrio zn vltro dapat
ditingkatkan dengan manipulasi tempat pematangan seperti penggunaan straw.
Sehubungan dengan ha1 tersebut dilakukan suatu penelitian untuk mengetahui aspek-
aspek tersebut dalam produksi embrio m vttro, sehingga teknologi ini lebih berdaya
guna dalam membantu pengembangan peternakan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Rektor
Universitas Andalas dan Dekan Fakultas Peternakan Universitas Andalas atas
bantuan, izin dan dorongan moral yang telah diberikan untuk melanjutkan dan me-
nyelesaikan pendidikan S3 di Pascasarjana IPB.
Ucapan terima kasih dan penghargaan yang tinggi disampaikan kepada Bapak
Prof. Dr. drh. Yuhara Sukra, MSc., sebagai ketua komisi pembimbing. Seorang Guru
Besar terkemuka dalam bidang Embriologi yang telah memberikan perhatian, arahan
dan bimbingan yang begitu besar dalam penyelesaian penelitian ini.
Selanjutnya penulis mengucapkan terima kasih dan menyampaikan penghar-
gaan yang tingg kepada Bapak Prof. Dr. drh. Mozes R. Toelihere, MSc., Bapak
komisi pembimbing Bapak-Bapak telah banyak memberikan waktu dan bimbingan
baik dalam penelitian maupun penulisan disertasi.
Kepada yang terhonnat Bapak Rektor Institut Pertanian Bogor, Ibu Direktur
Program Pascasarjana IPB dan Bapak Ketua Program Studi Biologi Reproduksi serta
Bapak-bapak dan Ibu-Ibu staf pengajar dan karyawan Jurusan Reproduksi dan
Kebidanan Fakultas Kedokteran Hewan IPB, singkatnya seluruh keluarga besar IPB,
penulis mengucapkan terima kasih dan sangat menghargai kesempatan dan fasilitas
serta kerjasama yang baik yang telah diberikan kepada penulis.
Ucapan terima kasih juga Qsampaikan kepada Ketua Beasiswa Pendidikan
Pascasarjana (BPPS) Ditjen Pendidikan Tinggi Departemen Pendidikan Nasional
(Depdiknas) yang telah memberikan bantuan biaya pendidikan Q Program Pasca-
sarjana IPB. Selanjutnya kepada Direktur Direktorat Penelitian dan Pengabdian
Kepada Masyarakat Ditjen Pendidikan Tinggi Depdiknas, yang telah memberikan
bantuan melalui proyek Hibah Tim periode tahun 1999-200 1, penulis ucapkan terima
kasih. Ucapan terima kasih yang sama juga disampaikan kepada Pemerintahan
Daerah TK. I Sumatera Barat atas bantuan dana yang telah diberikan meIalui
Universitas Andalas.
Kepada Bapak H. Oyip dan karyawan pemotongan hewan Ciampea, penulis
mengucapkan terima kasih atas izin yang telah diberikan dalam penyediaan materi
(ovariurn) untuk penelitian ini. Ucapan terima kasih disampaikan pula kepada Bapak
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada Ketua
Laboratorium Embriologi Jurusan Anatomi Fakultas Kedokteran Hewan IPB yang
telah memberikan bantuan fasilitas dan material penelitian untuk melaksanakan
penelitian.
Kepada yang terhorrnat Ibu Dr. drh. Ita Djuwita, M.Phi1. dan rekan sejawat
Ibu Dr. drh.Gunanti, MS., Bapak Dr.Ir. Yohan Rusiyantono, MS., Bapak Drs. Agung
Pramana, MS., Bapak drh. Kusdiantoro Mohammad, Bapak Ir. Bayu Rosa&, MS dan
drh. I Ketut Suathe, MS., penulis mengucapkan terima kasih atas bantuan moril dan
kerjasamanya. Demikian pula kepada seluruh mahasiswa yang sedang melaksanakan
penelitian di Laboratorium Embriologi dan Wahyudin, penulis mengucapkan terima
kasih atas bantuannya.
Terima kasih juga disampaikan kepada kedua orang tua clan mertuaku yang
selalu mendoakan dan kepada istriku serta anak-anakku atas pengertian, pengorbanan
dan dorongan moril yang telah diberikan selama mengikuti pendidikan ini.
Akhirnya, penulis mendoakan semoga Tuhan memberikan rakhrnat dan
kurnia-Nya kepada semua pihak yang telah memberikan bantuan kepada penulis.
Semoga apa yang telah dituangkan dalam disertasi ini akan berguna bagi kesejah-
teraan urnat.
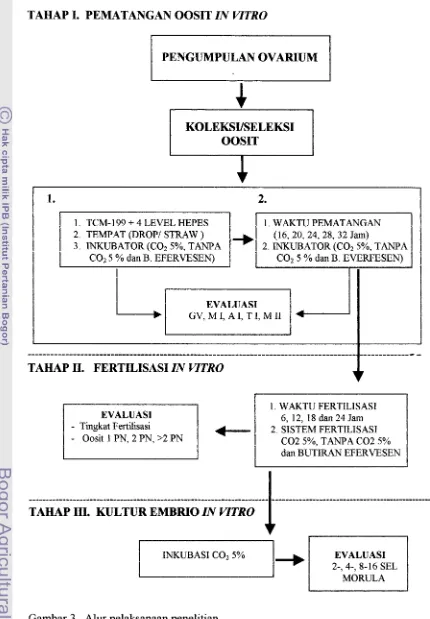
DAFTAR GAMBAR
1. Struktur kimia penyangga Hepes (C4Hl4N204S) . . . .
.
. . .2. Posisi oosit dan medium dalam straw .. . . ..
3. Alur pelaksanaan penelitian . . .
.
. . 4. Ovarium domba yang dikoleksi dari RPH (a, folikel dan b, corpusluteum) . . .
5. Perkembangan status inti oosit domba selama pematangan in vitro. . . .
6. Pengaruh faktor inkubator, konsentrasi Hepes dalarn medium TCM-199 dan penggunaan straw terhadap tingkat kematangan oosit (M-11) . . .
7. Tingkat kematangan oosit (M-11) in vitro pada berbagai periode dan sistem inkubasi ... .. . .. . ... . .. .. . . .. . . . .. . . .. . . ... . . .. ... , .. . . . 8. Tingkat perkembangan pronukleus dan fertilisasi in vitro pada ber- bagai sistem inkubasi . . . .. 9. Perubahan yang dialami sperma dan sel telur selama fertilisasi.
10. Tingkat perkembangan pronukleus dan fertilisasi in vitro pada ber- bagai periode inkubasi ... . .
.
. . ..
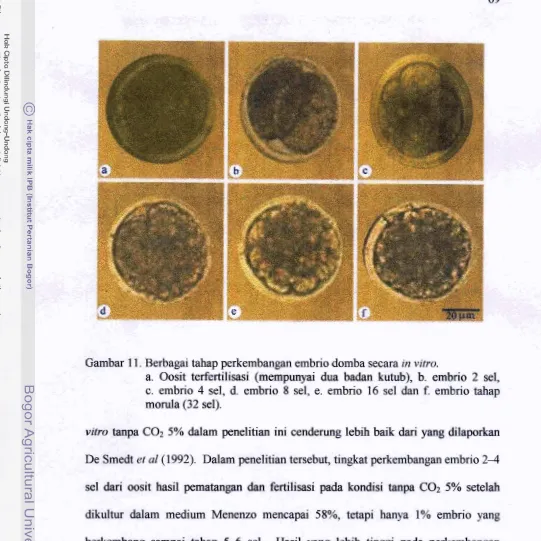
. . . .. . .1 1. Berbagai tahap perkembangan embrio domba in vitro . . .
.
. . .. .Halaman
26
3 1
4 1
DAFTAR LAMPIRAN
Komposisi medium koleksi oosit (Phosphat Buffer Saline, PBS).
Komposisi meQum pematangan in vitro.
Medium fertilisasi in viiro.
Sebaran normal data tingkat kematangan oosit domba in vitro pada berbagai konsentrasi Hepes, tempat pematangan dan sistem inkubasi.
Analisis sichk ragam tingkat kematangan oosit domba in vitro pada berbagai konsentrasi Hepes, tempat pematangan dan sistem inkubasi.
Analisis sidik ragam tingkat kematangan oosit in vitro pada berbagai periode pematangan dan sistem inkubasi .
Sebaran normal data 1 PN (1 pronukleus) pada berbagai periode pematangan dan sistem inkubasi.
Analisis sidik ragarn 1 PN (1 pronukleus) pada berbagai periode pematangan dan sistem inkubasi.
9. Sebaran normal data 2 PN (2 pronuklei) pada berbagai periode pematangan dan sistem inkubasi.
10. Analisis sidik ragam 2 PN (2 pronuklei) pada berbagai periode pematangan dan sistem inkubasi.
11. Sebaran normal data >2 PN (>2 pronuklei) pada berbagai periode pema- tangan dan sistem inkubasi.
12. Analisis sidik ragam >2 PN (>2 pronuklei) pada berbagai periode pematangan dan sistem inkubasi.
13. Sebaran normal data tingkat fertilisasi in vitro pada berbagai periode pema- tangan dan sistem inkubasi.
14. Analisis sichk ragam tingkat fertilisasi oosit in vitro pada berbagai periode pematangan dan sistem inkubasi.
DAFTAR IS1
Halaman
PRAKATA
... DAFTAR IS1
DAFTAR TABEL ...
... Vlll ... xii ... Xlll ... DAFTAR GAMBAR
DAFTAR LAMPIRAN ...
PENDAHULUAN ... Tujuan Penelitian ...
... Manfaat Penelitian
Hipotesis ...
TINJAUAN PUSTAKA ... Potensi dan Perkembangan Oosit ... Produksi Embrio In Vitro ... Sistem Inkubasi ...
MATERI DAN METODE PENELITIAN
Materi Penelitian ... ... Metode Penelitian
Rancangan Penelitian ...
Analisis Statistik ...
HASIL DAN PEMBAHASAN
Potensi Ovarium Domba Sebagai Sumber Oosit ...
...
Pematangan Oosit In Vitro
... Fertilisasi In Vitro
... Kultur Embrio In Vitro
KESIMPULAN DAN SARAN
... Kesimpulan
... Saran-saran
DAFTAR PUSTAKA ...
LAMPIRAN .
DAFTARTABEL
Halaman
1. Rata-rata jumlah foli'kel dan kualitas oosit yang diperoleh per 43 ...
ovarium
2. Tingkat kematangan oosit in vitro pada berbagai konsentrasi 47 Hepes, tempat pematangan dan sistem inkubasi (%) ...
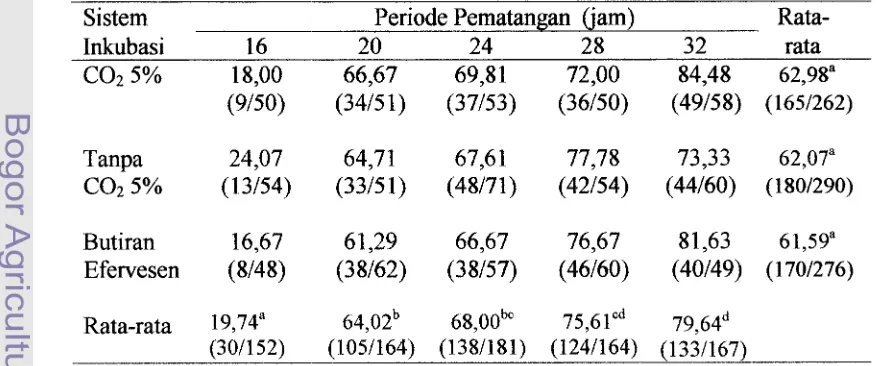
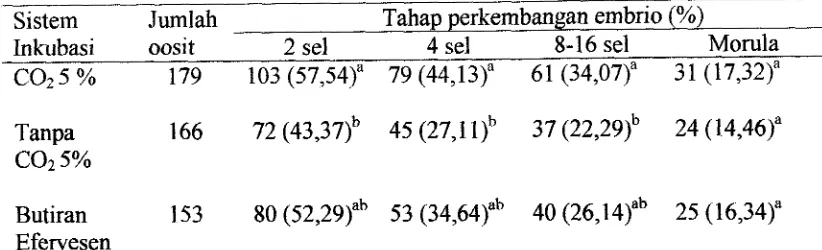
3. Tingkat kematangan oosit pada berbagai periode pematangan 54 dan sistem inkubasi (%). ...
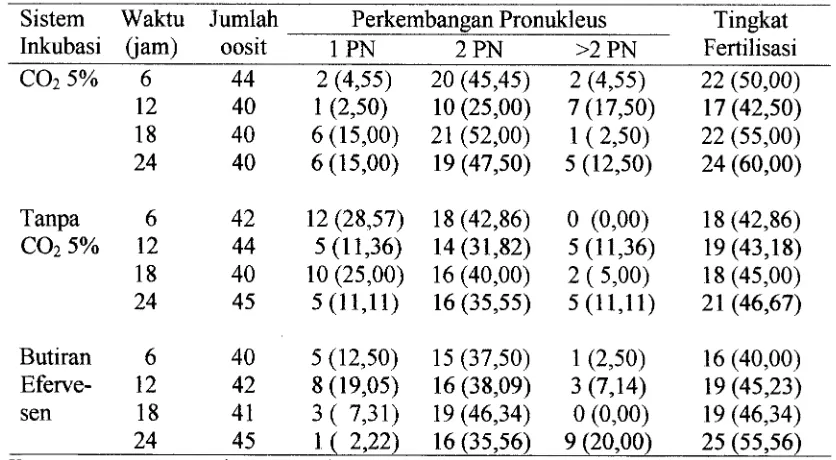
4. Perkembangan pronukleus IPN, 2 PN dan >2 PN dan tingkat 59 fertilisasi in vitro pada berbagai periode fertilisasi dan sistem
inkubasi ...
PENDAHULUAN
Kebutuhan terhadap produksi peternakan seperti daging, telur dan susu terus
meningkat sejalan dengan meningkatnya kesadaran masyarakat terhadap gizi.
Namun demikian peningkatan tersebut belum diimbangi oleh penyediaannya. Hal
ini terlihat dari konsumsi daging tahun 2000 yang mencapai 1.523.000 ton,
sementara produksi daging dalam negeri hanya 1.450.700 ton (Anonimus, 2001a).
Kekurangan produksi tersebut dipenuhi dengan mengimpor baik dalam bentuk
daging beku maupun sapi bakalan.
Dalarn upaya mencukupi kebutuhan pangan hewani masyarakat, pemerintah
telah menetapkan visi pembangunan subsektor peternakan tahun 2000 - 2005 yaitu :
"terwujudnya rnasyarakat yang sehat dan produktif serta kreatif melalui pem- bangunan peternakan yang tangguh berbasis sumber daya lokal" (Anonimus, 200 1 b). Salah satu surnber daya lokal yang dijadikan sebagai komoditi ternak utarna
dalam mewujudkan sasaran tersebut adalah ternak domba. Keunggulan temak
domba antara Iain mudah dipelihara, tidak membutuhkan lahan yang luas, mempu-
nyai produktifitas yang tinggi karena masa bunting yang pendek dan dapat melahir-
kan anak lebih dar~ satu qkor dalarn satu kelahiran. Populasi ternak domba di
Indonesia pada tahun 2000 adalah 8.621.237 ekor, dengan kenaikan populasi rata-
rata 3,41 % per tahun. Hampir 90% dari populasi tersebut tersebar di pulau Jawa
dan terbanyak di daerah Jawa Barat yaitu sekitar 3,8 juta. Kontribusi ternak domba
Untuk ineningkatkan peran yang lebih besar sebagai sumber pangan hewani
di masa depan diperlukan perbaikan manajemen pemeliharaanya. Selain dengan
cara-cara konvensional, peningkatan produktifitas ternak ini akan lebih efektif bila
perbaikan tersebut juga disertai dengan penerapan temuan-temuan baru khususnya
dalam bidang bioteknologi. Dalam aspek reproduksi, penerapan bioteknologi seperti
Inseminasi Buatan (IB) pada sistem perkawinan ternak telah memberikan
sumbangan yang cukup signifikan bagi peningkatan populasi dan produksi ternak,
khususnya pada ternak sapi dan sudah dirintis pada ternak domba. Disamping IB,
dalam beberapa dekade belakangan ini mulai dikembangkan teknologi TransJer
Embrro (TE) dan Fertilisasi In Vitro (FIV).
Teknologi fertilisasi zn vltro merupakan teknologi untuk produksi embrio
pada lingkungan buatan (di luar tubuh). Teknologi ini terdiri atas serangkaian
kegiatan yang meliputi pematangan oosit, fertilisasi oosit dengan sperma dan kultur
embrio. Produksi embrio melalui fertilisasi in vitro dapat menggunakan oosit yang
berasal dari Rumah Potong Hewan (RPH) maupun dari hewan hidup yang diperoleh
melalui teknik Ovum Plck-Up (OPU) dengan bantuan ultrasonografr (Ptak et al.,
1999 dan Kochhar el al., 2002). Dengan demikian teknologi fertilisasi in vitro dapat
menjadi alternatif produksi embrio dalam pelaksanaan TE, selain melalui superovu-
lasi yang memiliki keterbatasan berupa keragaman respons individu terhadap pem-
berian hormon gonadotropin (Gordon, 1994, dan Brackett dan Zuelke, 1993).
Manfaat lain dari teknologi fertilisasi m vitro adalah membuka peluang yang lebih besar untuk mengembangkan teknik manipulasi gamet dan embrio seperti produksi
dengan menyediakan embrio dalam jumlah banyak dan murah. Produksi embrio
secara in vitro telah banyak dilakukan pada berbagai spesies ternak seperti sapi
(Trounson et al., 1994 dan Boediono et al., 1994), kerbau (Totey et al., 1993),
domba (Brown et al., 1998, Ptak et ul., 1999, Ledda et al., 1999 dan Jaswandi et al.,
200 I), kambing (Pawshe et al., 1994 dan Boediono et al., 200 1) dan pada kucing,
anjing dan cheetah (Beveridge dan Jabtour, 1998).
Dalam pemanfaatan oosit hewan yang dipotong atau mati untuk produksi
embrio in vrtro belum semua potensi oosit yang ada termanfaatkan karena terbatas-
nya daya hidup oosit, sementara teknologi koleksi ovarium yang dapat meinperta-
hankan viabilitas oosit dalam waktu yang cukup lama atau selama transportasi ke
laboratorium belum optimal. Keadaan tersebut merupakan kendala dalam pemanfa-
atan ovarium yang terdapat pada tempat yang jauh dari laboratorium FIV termasuk
ternak domba dan kambing yang pada umumnya tempat pemotongannya tersebar di
berbagai lokasi dalam skala kecil. Hal tersebut juga merupakan faktor penghambat
penerapan teknologi fertilisasi In vitro dalam upaya penyelamatan plasma nutfah
satwa liar, khususnya satwa langka yang dilindungi (endangered specres) yang mati
di habitatnya. Untuk ini diperlukan teknologi yang memungkinkan proses produksi
embrio in vitro dilakukan selama transportasi atau di luar laboratorium.
Kendala utama dalam produksi embrio di luar laboratorium atau selama
transportasi adalah keberadaan C02 dan tempat pematangan. Menurut
Pinyopummintr dan Bavister (1995) produksi einbrio secara in vitro dilakukan
dalam kondisi lingkungan inkubator yang terkontrol, yaitu pada suhu 3 9 ' ~ dan
Upaya lain untuk meningkatkan fleksibilitas produksi embrio in vltro dapat dilakukan dengan memodifikasi tempat pematangan dengan yang mudah dikemas
seperti tabung Epppenctorf dan straw. Selama ini straw telah digunakan untuk
kemasan oosit beku dan semen beku (Chen et al., 2000 dan Chen et al., 2001); oleh
karena itu diharapkan j uga dapat digunakan untuk pematangan dan fertilisasi oosit.
Penggunaan straw untuk tujuan tersebut akan memudahkan proses transportasi.
Dalam penggunaan wadah tertutup seperti straw untuk menyimpan sel-sel
yang aktif melakukan metabolisme diperlukan beberapa pertimbangan seperti faktor
waktu, karena produk metabolisme berupa C02 dan asam laktat dapat menurunkan
pH medium (Freshney, 1987). Disamping itu kondisi inkubasi seperti dalam straw
diduga juga mempengaruhi laju pematangan. Penelitian Shamsuddin et al., (1993)
menunjukkan bahwa pada kondisi tanpa C02 5% proses pematangan yang ditandai
dengan pengeluaran polar body I (badan kutub I) cenderung lebih lambat dari pada
kondisi dengan COz 5%. Dengan demikian penggunaan straw perlu dikaitkan
dengan penambahan penyangga Hepes dalam medium serta waktu inkubasi sehing-
ga efek sinergi penggunaannya dapat dicapai secara optimal.
Untuk mencapai tuiuan di atas dilakukan penelitian yang terdiri atas tiga
rangkaian percobaan dengan judul : Penggunaan Hepes dan Butiran Efervesen
Tujuan Penelitian
Tujuan penelitian ini adalah untuk :
1. Membandingkan dan menentukan efektifitas penambahan berbagai level
penyangga Hepes dalam medium TCM-199 untuk pematangan oosit yang
dilakukan pada cawan Petri atau straw yang dikultur pada sistem inkubasi
C02 5%, tanpa C02 5% maupun menggunakan butiran efervesen.
2. Mendapatkan waktu atau periode terbaik pematangan dan fertilisasi zn vitro
pada sistem inkubasi tanpa C02 5% dan menggunakan butiran efervesen.
3. Mengetahui pengaruh sistein inkubasi pada pematangan dan fertilisasi oosit
terhadap perkembangan embrio in vitro.
Kegunaan Penelitian
1. Meningkatkan pemberdayaan potensi oosit ternak yang dipotong atau mati
terutama yang berasal dari tempat pemotongan yang jauh dari laboratorium
FIV untuk produksi embrio in vitro.
2. Mengatasi keterbatasan fasilitas C02 dalam produksi embrio zn vztro, se-
hingga dengan didapatkannya metode tanpa C02, produksi embrio in vitro
Hipotesis
I . Penambahan berbagai level penyangga Hepes dalam medium pematangan
TCM- 199 yang dikombinasikan dengan penggunaan straw sebagai tempat
pematangan akan meningkatkan efektifitas pematangan oosit pada sistem
inkubasi dengan atau tanpa COz 5% maupun menggunakan butiran
efervesen.
2. Perpanjangan periode pematangan akan meningkatkan persentase oosit yang
mencapai tahap Metafase-IT, baik pada sistem inkubasi C 0 2 5%, tanpa C02
5% maupun menggunakan butiran efervesen.
3. Perpanjangn periode fertilisasi akan memberi peluang oosit terfertilisasi yang
lebih banyak, baik pada sistem inkubasi C 0 2 5%, tanpa C02 5% maupun
menggunakan butiran efervesen.
4. Kemampuan berkembang embrio dari oosit hasil pematangan dan fertilisasi
in vltro dengan sistem inkubasi tanpa C 0 2 5% atau menggunakan butiran efervesen sarna atau Iebih baik dibandingkan dengan oosit hasil pematangan
TINJAUAN PUSTAKA
Potensi dan Perkembangan Oosit
Potensi oosit yang terdapat pada ovarium mamalia pada saat dilahirkan
diperkirakan mencapai 200.000 buah. Namun demikian tidak semua oosit tersebut
tumbuh menjadi matang, hanya sekitar 300 buah yang dapat mencapai tahap pema-
tangan dan dapat diovulasikan, sedangkan yang lainnya mengalami pertumbuhan
sesaat dan kemudian mati (Gordon, 1994).
Pada sebagian besar mamalia, pematangan meiosis dimulai menjelang
waktu lahir ketika oogonia mengalami proliferasi dan masuk profase meiosis I. Sel
germinal yang sekarang dikenal sebagai oosit terhenti pada tahap drctiate yang
ditandai oleh sebuah inti yang besar yang disebut germznal vesrcle (GV). Pada saat ini kromatin mengalami kondensasi dan oosit dikelilingi oleh sel-sel epitel yang
membentuk folikel primordial. Folikel ini berperan sebagai pool oosit yang siap
direkrut selama usia produktif hewan betina. Beberapa signal akan mendorong per-
kembangan folikel primordial, folikel yang sedang berkembang (growzng follrcles)
dan folikel vesikuler. Hulshof et al. (1 993) menjelaskan bahwa folikel primordial
dibedakan dari folikel yang sedang berkembang berdasarkan sel-sel yang menge-
lilingi oosit. Pada folikel-folikel yang sedang berkembang sel yang mengelilingi
lebih banyak dari pada folikel primordial. Selanjutnya Monioux et al. (1993) menyatakan bahwa folikel vesikuler terdiri atas sebuah oosit primer, komponen
kompleks sel somatik sel granulosa dan sel kolumnar dan sebuah ruang berisi cairan
Oosit yang telah selesai berkembang dikelilingi oleh suatu lapisan sel folikel
yang kompak untuk membentuk kompleks kurnulus oosit (cumulus-oocyte complex,
COC). Selama pra ovulasi, sel kumulus mensintesis dan menimbun suatu matrik
intraseluler yang diperkaya dengan asam hialuronat. Fenomena ini ditujukan
sebagai ekspansi kumulus, yang memfasilitasi pelepasan COC dari dinding folikel
dan pengeluarannya saat ovulasi serta penangkapan oosit oleh fimbriae oviduk.
Selanjutnya, perluasan kumulus dapat juga mempengaruhi keragaman perkembang-
an baik oosit maupun spenna yang diperlukan untuk keberhasilan pembentukan dan
perkembangan zigot (Chen et al., 1993).
Pematangan oosit baik secara m vivo maupun in vrtro meliputi pematangan
inti dan sitoplasma. Secara in vzvo pematangan oosit terjadi dalam folikel pra
ovulasi setelah LH surge bersamaan dengan selesainya perkembangan folikel pra
ovulasi. Pematangan inti merupakan mulainya meiosis dari tahap GV sampai tahap
Metafase-I1 (M-11). Pematangan sitoplasma meliputi perubahan struktural dan
molekuler yang menyiapkan kemampuan (competency) oosit yang telah matang
untuk terjadinya fertilisasi dan perkembangan embrio tahap awal (Bevers et al.,
1997). Sitoplasma memainkan peranan penting daIam penyusunan perlengkapan
metabolik untuk produksi energi yang mencukupi fungsi seluler selama pema-
tangan, cleavage dan pembentukan blastosis (Krisher dan Bavister, 1998). Hasil
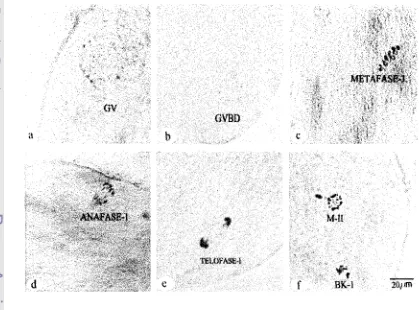
pengamatan terhadap perkembangan inti oosit kambing pada berbagai waktu
pematangan tn vltro menunjukkan bahwa 89% oosit yang dikoIeksi dari ovarium
berada pada tahap GV. Pada permulaan kultur, 16,4% oosit mulai mengalami
Veslcle Breakdown, GVBD) inencapai puncak setelah einpat jam. Metafase I
tercapai antara 12 dan 14 jam setelah inkubasi. Tahap anafase dan telofase relatif
singkat yaitu antara 14 dan 18 jam setelah inkubasi. Metafase 11 yang ditandai
dengan dikeluarkannya Badan Kutub-I (BK-I) terjadi setelah 16 jam clan mencapai
87% setelah 24 jam (Pawshe et al., 1994a)
Dalam proses in vivo, oosit yang dilepaskan folikel akan masuk ke dalam
tuba fallopii, yaitu tempat terjadinya proses pembuahan atau fertilisasi. Hanya
sperma yang telah mengalami kapasitasi yang dapat memasuki oosit, sedangkan
sperma yang tidak mengalami kapasitasi akan tetap menempel pada permukaan oosit
(Yanagimachi, 1994). Kapasitasi sperrna dan reaksi akrosom merupakan kejadian
fisiologis yang penting sehingga memungkinkan sperma melakukan penetrasi zona
pelusida dari oosit untuk memulai proses fertilisasi. Kapasitasi sperma melibatkan
perubahan biokimia pada bagian luar inembran sperma. Sedangkan reaksi akrosom
meliputi fusi dan pecahnya plasma sperma serta membran bagian luar akrosom
berlanjut dengan eksositosis yang memungkinkan pelepasan enzim. Kejadian ini
bersamaan dengan hiperaktifitas motilitas sperma, dan secara normal terjadi dekat
atau di dalam zona pelusida (Brackett dan ZueIke, 1993).
Pada peristiwa kapasitasi terjadi pelepasan enzim hyaluronrdase yang
berperan dalam penetrasi sel-sel kumulus. Penetrasi pada lapisan ini melibatkan
proses enzimatik (trypsin llke substances dun zona lysine) yang membentuk celah
tempat sperma melewati lapisan ini (White et al., 1992). Menurut Yanagiinachi
rasio ~ a ' : K+ yang makin meningkat di daerah ampula tuba Fallopii, proses
kapasitasi berakhir menjelang sperma menembus korona radiata.
Reaksi akrosom dapat terjadi sebelum atau setelah penempelan kepala
sperma pada reseptor glikoprotein yang terdapat pada zona. Penempelan kepala
sperma pada zona pelluctda 3 (ZP3) memungkinkan interaksi dengan komponen-
komponen zona lainnya yang menstimulasi reaksi akrosom. Penetrasi zona oleh
sperma terjadi tiga sampai 15 menit setelah penempelan kepala sperma. Pada saat
sperma yang telah mengalami reaksi akrosom mulai penetrasi ke dalam zona
pelusida glikoprotein zona pelluctda-2 (ZP 2) berperan sebagai reseptor sperma
yang kedua yang mempertahankan penempelan sperma selama melewati seluruh
lapisan zona (Hafez dan Hafez, 2000).
Dalam sitoplasma oosit, membran sperma pecah dan sperma masuk ke
dalam ooplasma oosit tanpa membran. Di dalam ooplasma, pada inti sperma akan
terbentuk beberapa nukleoli yang langsung bersatu dan selapis membran yang
mengelilingi. Struktur ini disebut dengan pronukleus (PN) jantan. Penetrasi spenna
menyebabkan oosit mengalami aktivasi. Setelah sperma masuk ke dalam ooplasma,
badan kutub I1 dikeluarkan dan secara bersamaan diikuti oleh pembentukan PN
betina. Kedua pronuklei akan bergabung sebelum meiosis pertama dari tahap cleu-
v q e dimulai. Proses ini disebut dengan szngamr dan terjadi 14 sampai 16 jam setelah penetrasi sperma (Toelihere, 1985 dan Gordon, 1994). Proses fertilisasi sele-
sai setelah PN menghilang dan digantikan oleh kromosoin yang bersatu pada profase
dari pembelahan pertama (Yanagimachi, 1994 ). Menurut Bazer et al. (1993) zigot
mzszasz pronukIeus ketika terjadi proses singami. Sei-sel hasil pembelahan itu
disebut blastomer. Pembelahan sel berlanjut sampai terbentuk blastomer yang lebih
banyak tetapi bentuk yang lebih kecil. Proses pembelahan sel tanpa penambahan
massa sel ini disebut cleavage.
Produksi Embrio In Vitro
Produksi embrio menggunakan teknik in vitro memerlukan oosit untuk
melewati tiga proses biologis yaitu pematangan, fertilisasi dan perkembangan zigot
sampai tahap blastosis.
Pematangan Oosit
In
VitroUntuk dapat dibuahi oleh sperma, oosit hams mengalami pematangan inti
maupun sitoplasma. Tujuan pematangan oosit adalah untuk menghasilkan sebuah
oosit sekunder haploid yang diperlengkapi dengan berbagai kebutuhan biologis yang
diperlukan untuk keberhasilan perkembangan embrio berikutnya (Hyttell et ul,
1997). Pada saat ini oosit mamalia yang dikeluarkan dari folikel dan dikultur secara
zn vitro dapat mengalami pematangan meiosis (M-11), baik pada medium yang
diperkaya dengan atau tanpa hormon (Downs ,1993).
Pada seluruh spesies mamalia, kompetensi meiosis yang sempurna dicapai
setelah folikel berukuran f 3 mm atau satelah oosit mencapai diameter
+
110 pmyang kurang dari 2 inm menghasilkan angka cleavage yang lebih rendah dari ukuran
2-6 mm (De Smedt et al., 1992). Viabilitas oosit dipengaruhi oleh metode koleksi
ovarium, sumber oosit dan kualitas oosit. Koleksi dan transportasi ovarium dari
tempat pemotongan ke Iaboratorium dilakukan pada suhu 30-35'~ (Gordon, 1994).
Pengumpulan ovarium pada suhu jauh di bawah 3 0 ' ~ menyebabkan oosit meng-
alami pematangan inti yang tidak sempuma (First clan Parish, 1987). Koleksi oosit
dari ovarium dengan teknik penyayatan (slzczng) merupakan cara yang sederhana
dan efisien. Meskipun teknik aspirasi menghasilkan jurnlah oosit yang lebih banyak
per ovarium, tetapi persentase oosit dengan sel kumulus kompak lebih tinggi diper-
oleh dengan teknik penyayatan (Paswhe et al., 1994b).
Kondisi morfologi sel-sel kumulus berhubungan dengan potensi perkem-
bangan oosit (Boni et al., 2002). Sel-sel kumulus mendukung perkembangan oosit
antara lain melalui sekresi faktor-faktor terlarut yang mendorong kompetensi
perkembangan oosit atau dengan menghilangkan komponen yang menekan perkem-
bangan embrio dari medium (Hashimoto et al., 1998). Sel-sel kumulus mensintesis
tiga macam protein. Protein dengan berat molekul 25,5; 79 dan 104 kDA disintesis
dalam jumlah banyak selama 12 jam pertama pematangan dan secara gradual inenu-
run sampai 24 jam. Satu macam protein (41 H A ) disintesis oleh sel-sel kumulus
empat jam setelah pematangan dimulai (Wu et al., 1996).
Berdasarkan keadaan sel-sel kurnulus dan sitoplasma oosit, Loos et al, (1988) mengelompokkan oosit atas empat kategori kualitas yaitu (A) oosit yang
dikelilingi oleh multi lapisan sel-sel kurnulus dan mempunyai sitoplasma homogen,
dan mempunyai sitoplasma koinpak, kasar dan bagian tepi agak hitam, (C) oosit
yang dikelilingi oleh lapisan sel-sel kumulus yang kurang kompak dan mempunyai
sitoplasma tidak beraturan dengan bercak-bercak hitam dan lebih gelap dari kuaiitas
A dan B, dan (D) lapisan sel-sel kumulus berpencar membentuk gumpalan gelap
dan sitoplasma tidak beraturan serta oosit secara keseluruhan menghitam. Djati
(1999) mengemukakan bahwa tingkat pematangan oosit A dan B tidak dipengaruhi
oleh musim maupun bangsa ternak, sehingga dapat digunakan untuk mengurangi
ketidakseragaman individu dari sampel dan kondisi lingkungan atau musim
Medium yang digunakan dalam pematangan oosit in vztro tidak hanya dapat
mempengaruhi proporsi oosit yang mencapai M-I1 atau fertilisasi, tetapi juga akan
mempengaruhi perkembangan embrio berikutnya (Bavister, 1992). Salah satu
medium yang banyak digunakan untuk pematangan dan kultur embrio in vitro
adalah tissue culture medium1 99 (TCM- 1 99). TCM- 1 99 terdiri atas garam-garam
Earle 's yang mengandung N-(2-hidroxylethio-piperuzine-N-(2-ethane sulfonic acid) (HEPES) atau natrium bikarbonat sebagai penyangga dan disuplementasi dengan
piruvat, laktat, asarn amino, vitamin, purin serta substansi lainnya yang terdapat
dalam serum (Gordon, 1994). Medium TCM-199 telah menjadi media standar yang
digunakan dalam pematangan in vitro pada ternak sapi dan domba. Medium lain yang digunakan dalam pematangan oosit in vztro antara lain adalah CR-laa
(Rosenkrans dan First, 1994 dan Rusiyantono, 2001) dan medium Ham's F-I0
(Hawk dan Wall, 1993).
Penambahan serum ke dalam medium pematangan dapat meningkatkan
1994) dan swnber nutrisi seperti asam-asam amino dan garam-garam organik
(Walker et al., 1992). Serum mungkin mempengaruhi perkembangan oosit secara
langsung atau secara tak langsung melalui sel-sel kumulus (Trounson et al., 1994).
Penelitian pada domba menunjukkan bahwa 98% oosit domba yang berasal
dari folikel 2-6 mm inengalami pematangan sempurna dalam medium TCM-199
yang Isuplementasi Fetal CaZfSerum (FCS) lo%, FSH dan LH (masing-masing 10
pg/ml) dan estradiol 1 pg/ml (Szolozi et al., 1988). Slavik et al. (1 992) menambah-
kan Calf Serum (CS) 15% dalam medium yang sama untuk pematangan oosit
domba. Berdasarkan evaluasi sitologi setelah fertilisasi diperoleh 81% zigot
mempunyai dua buah pronukleus (2 PN). Pada babi pematangan oosit mengguna-
kan medium TCM- 199 yang disuplementasi dengan FCS 10% menghasilkan angka
pematangan 9 1 , 1 %, dan 86,6% mempunyai PN setelah diaktivasi (Setiadi et al.,
1998). Beberapa jenis serum lain yang digunakan dalam pematangan dan fertilisasi
in vitro adalah Fetal Bovine Serum (FBS) dan Bovine Serum Albumin (BSA)
(Gordon, 1994), Superovulated Cows Serum (Boediono et al, 1994).
Suplementasi gonadotropin seperti FSH, estradiol dan LH ke dalam medium
pematangan mernpertihatkan hasil yang bervariasi. Guler et al. (2000) rnenyatakan
bahwa penambahan estradiol (E2) sebesar 100 qg' mL ke dalam medium TCM-199
yang juga disuplementasi dengan FSH mempunyai pengaruh positif terhadap
pematangan inti dan sitoplasma oosit. Penambahan hormon secara bersama-sama
dengan set-sel folikel dilaporkan dapat mendorong ekspansi sel-sel kumulus
penambahan berbagai dosis kombinasi FSH (0-15 qg) dan LH (0-49 pg)
meningkatkan ekspansi sel-sel kumulus tetapi berpengaruh tidak nyata terhadap
angka blastosis. Ekspansi sei kumulus yang maksimal terjadi pada penambahan
FSH 1 qglml dan LH 1 pg /ml dalam medium (Choi et al., 2001). Dalarn penelitian
lain dilaporkan bahwa medium tanpa hormon menghasilkan angka pematangan
(Wahid et al., 1991) dan viabilitas oosit (Galli dan Moor, 1991) yang cukup tinggi.
Shamsuddin et al. (1993) mengemukakan bahwa baik pada inkubasi dengan
C02 5% maupun tanpa C 0 2 5%, Badan Kutub (BK) mulai Qkeluarkan 18 jam
setelah oosit diinkubasi. Munculnya BK akan meningkat secara signifikan selama
periode kultur 20 jam pada sistem inkubasi CO;! 5% dan 24 jam pada sistem
inkubasi tanpa C 0 2 5%. Beberapa laporan lain mengenai lama pematangan rn vrtro
menunjukkan bahwa waktu pematangan yang terbaik adalah 24 jam sampai 27 jam
(Pawshe, et al., 1994 dan De Smedt, et al., 1992). Pematangan oosit selama 18 dan
24 jam menghasilkan angka cleavage yang sarna, tetapi blastosis yang Qhasilkan
dari oosit yang dimatangkan selama 24 jam lebih tinggi dari pematangan 18 jam
(Monaghan et al., 1993).
Fertilisasi In Vitro
Fertilisasi merupakan suatu proses yang kompleks yang menghasilkan
penggabungan dua gamet, restorasi jumlah kromosom somatik dan mulainya
perkembangan suatu individu baru (Gordon. 1994). Keberhasilan fertilisasi in vrtro
memerlukan kesiapan yang xnemadai dari oosit dan sperrna secara biologis dan
(Bracket dan Zuelke, 1993). Berbagai aspek kondisi kultur seperti medium, waktu
inseminasi dan kapasitasi, sistem kultur terus diidentifikasi untuk meningkatkan
keberhasilan fertilisasi in vztro.
Fertilisasi In vltro dapat dilakukan dalam beberapa media diantaranya
medium Tyrode-Athumtn/Lactate/fl~yruvlc actd (TALP, Parrish et a/., 1986),
Brackett-Oliphant (B-0; Brackett dan Oliphant, 1975) dan Defined Medium-Hepes
(DM-H). DM-H merupakan modifikasi medium B-0 yang digunakan Crozet et ~ d . ,
(1987) untuk fertilisasi in vitro pada domba. Medium ini juga memperlihatkan
tingkat keberhasilan yang tinggi pada kambing (De Smedt et a/., 1992, Le Gal,
1995 dan Martino et ul., 1996). Medium DM-H mengandung NaCl 129,5 mM,
NaHC03 4,16 mM dan Hepes 10 mM. Untuk kapasitasi medium DM-H di
suplementasi dengan serum domba yang diinaktivasi (heat inactivated sheep serum)
20%, dan medium fertilisasi juga ditambah dengan Hemicalcium 7,75 mM.
Untuk dapat membuahi oosit, sperma hams mengalami proses kapasitasi dan
reaksi akrosorn. Dalarn pelaksanaan FIV proses kapasitasi rneliputi kegiatan pemi-
sahan (pencucian) sperma dari bagian plasma semen dan inkubasi sperma. Lu et ul.
(1987) melakukan pemisahan sperma dari plasma dengan metode swim-up dalam
medium yang mengandung heparin 100 pg /ml selama 15 menit. Penggunaan
konsentrasi heparin yang lebih rendah juga efektif dengan memperpanjang waktu
inkubasi. De Smedt et ul. (1992) melakukan pencucian sperma menggunakan
teknik sentrifugasi pada kecepatan 200 G selama 10 menit dalam medium DM-H.
jam dalam 2 ml medium DM-H yang ditainbah dengan serum doinba estrus 20%.
Bagian atas yang kaya dengan sperma motil diencerkan sampai 1 x lo7 spermalml
lalu diinkubasi selama lima sampai enam jam pada suhu 3 8 , 5 ' ~ dalam tabung tertu-
tup (tanpa COz 5%). Dengan prosedur yang sama Martino et al. (1996) melakukan
inkubasi spenna selama empat jam.
Suplementasi substrat seperti kafein dan heparin ke dalam medium dapat
meningkatkan proses kapasitasi sperma dan memperbaiki keberhasilan fertilisasi m
vrtro. Pengujian menggunakan pewarnaan chlortetracyclrne (CTC) memperlihatkan frekuensi sperma terkapasitasi yang lebih tinggi dalain medium yang inengandung
kafein dibandingkan dengan medium tanpa kafein. Keberhasilan kapasitasi tertinggi
diperoleh pada penambahan kafein 7,5 mM (Coscioni et ul., 2001). Penambahan
kombinasi kafein dan heparin dalam medium akan memberikan kemampuan pene-
trasi spenna pada sel telur yang lebih baik jika dibandingkan dengan penambahan
heparin atau kafein saja. Pengaruh sinergis diperoleh dari penggunaan heparin 20
pg/inl dan kafein 10 mM dalarn medium kapasitasi sperma beku yang dicuci meng-
gunakan teknik sentrifugasi selama 20 menit sebelum inseminasi (Niwa dan
Ohgoda, 1988). Dalam penelitian yang lain Niwa et al. (1992) menggunakan
medium B-0 ditambah dengan kafein-culcc.ium luctute 10 mM untuk pencucian
, erum sperma, dan medium B-0 ditambah dengan heparin 20 pglml dan Hovrne C
Albumzn (BSA) 2% untuk pencucian oosit. Dalam penelitian tersebut medium
Kecepatan reaksi akrosom juga dipengaruhi oleh suhu inkubasi. Juinlah
sperma yang mengalami reaksi akrosom meningkat dengan meningkatnya suhu
inkubasi. Iqbal &an Hunter (1992) menggunakan media fertilisasi yang diperkaya
dengan heparin mendapatkan angka fertilisasi yang lebih tinggi dari oosit yang
diinkubasi dengan sperma pada suhu 3 9 ' ~ dibandingkan inkubasi suhu 37".
Ferti lisasi oosit m vltro dilakukan dengan mencampurkan 1 x 1 ~ \ ~ e r m a / m l
yang telah dikapasitasi dengan oosit rang telah matang dalam 50-100 p1 medium.
Medium fertilisasi ditutup dengan minyak mineral kemudian diinkubasi selama 48
jam (Sirard el a/., 1985). De Srnedt et a1 (1992) dan Le Gal, (1995) melakukan
fertilisasi oosit kambing dengan 1 x lo6 sperma/ml dalam tabung tertutup 1 ml
selama 17 jam. Penempatan oosit 50 per drop dapat terfertilisasi oleh sperma, tetapi
produksi blastosis akan menurun bila konsentrasi sperma melebihi 1,6 x 10"
spemdml (Ling dan Lu, 1990)
Menurut Gordon (1994) inkubasi oosit dan sperma yang terlalu lama dapat
mengurangi kemampuan oosit berkembang karena sperma mempunyai potensi untuk
melepaskan enzlm hzdrolltzk ke dalam medium fertilisasi. Tingkat fertilisasi m vztro
tertinggi diperoleh pada oosit yang dimatangkan 22-24 jam dan difertilisasi dengan
sperma delapan jam (Chian el at., 1992). Menurut Dode et al. (2002) selama tiga
jain pertama hanya 26,5% oosit yang terbuahi dengan tingkat cleuvuge 13,1%.
Tingkat fertilisasi dan cleavage secara progresif meningkat dari 6-12 jam inkubasi.
Beberapa peneliti lain mendapatkan waktu optimal fertilisasi 18-20 jam (Long et
Kultur Embrio In Vilro
Transfer embrio pada umumnya dilakukan setelah etnbrio berumur enam
sampai tujuh hari yaitu setelah berada pada tahap morula atau tahap blastosis.
Transfer embrio tahap 2-4 sel menghasilkan tingkat kebuntingan dan kelahiran yang
relatif rendah (Slavik et ul., 1992). Untuk itu zigot hasil fertilisasi perlu dikultur
untuk perkembangan berikutnya sebelum di transfer atau dibekukan. Kultur embrio
mamalia secara m vztro membutuhkan lingkungan yang cocok sehingga memung-
kinkan zigot mengalami pembelahan (cleavage) dan berkembang sampai tahap
blastosis (Peters, 1992). Beberapa komponen lingkungan kultur yang sangat inem-
pengaruhi adalah medium, serum, subtrat energi, sistem inkubasi (seperti fase gas,
pH dan suhu), penggunaan ko-kultur dan kualitas air (Gordon, 1994). Perbedaan
hasil yang diperoleh para peneliti dapat disebabkan karena perbedaan satu atau lebih
dari kom ponen-koinponen tersebut (Shamsuddin et ul., 1993).
Slavik et ul. (1992) melakukan kultur embrio domba dalam drop (0,l ml)
medium TCM-199 yang ditambah dengan Calf Serum 15%, dan diinkubasi pada
suhu 3 8 , 5 ' ~ dalam inkubator dengan komposisi udara C 0 2 5%, 0 2 10% dan N2 85%
Setelah 24 sampai 26 jam di kultur, 60% einbrio inengalami peinbelahan tahap 2 sel
dan meningkat 68% setelah dikultur 50 jam. Trounson et u1. (1994) melakukan
kultur embrio dengan menempatkan empat embrio per tetes medium dan menginku-
basi selama 24 jam dalam inkubator COz 5%. Mereka mendapatkan 39% zigot
berkeinbang mencapai tahap blastosis. Gardner et at. (1994) mengeinukakan bahwa
karena embrio mensekresikan faktor-fak?or yang mempertahankan perkembangan
mereka.
Pada embrio sapi, domba dan babi, masalah yang dihadapi dalam mencapai
perkembangan zigot sampai blastosis adalah adanya hambatan perkembangan (zn
vitro development block). Hambatan ini terjadi pada tahap yang berbeda diantara
spesies. Pada babi terjadi pada tahap 4 sel dan pada sapi dan domba tahap 8-16 sel.
Cara-cara yang telah digunakan untuk mengatasi hambatan perkembangan embrio
antara lain adalah kokultur menggunakan sel-sel somatik seperti sel oviduk, sel
granulosa dan sel kumulus, atau dengan modifikasi medium kultur seperti penggu-
naan serum dan konsentrasi glukosa (Peters, 1992). Kondisi yang menguntungkan
dari sistem kokultur diduga melibatkan growth factor atau beberapa faktor yang
secara normal dihasilkan sel tersebut (Bavister, 1992). KO-kultur dengan sel-sel
kumulus atau trofoblas mendorong perkembangan embrio dini melewati sel-blok
tahap 8-sel (Nakao dan Nakatsuji, 1990). Suatu keuntungan menggunakan sel
kumulus dalam kultur embrio adalah lebih mudah diperoleh dari mikrodrop setelah
digunakan untuk pematangan oosit m vitro.
Pada domba terdapat indikasi bahwa growth factors termasuk insulin lzke
growth .factor-I (IGF-I) memainkan peranan pada perkembangan embrio di oviduk
(William dan Butler, 1990). Penambahan insulin atau insulin-like growth.factor-1
(IGF-1) dapat meningkatkan perkembangan embrio yang dikultur (Herrler et ul.,
1992). Insulin meningkatkan pertumbuhan embrio 4-6% sebagaimana terlihat dari
peneliti menambahkan insulin 5 pg/ml pada medium kultur embrio kambing
(Rusiyantono, 2001) dan sapi ( Suzuki et al., 1999).
Penggantian medium yang digunakan setiap 48 jam diperlukan untuk
mencegah akurnulasi toksik amoniurn yang dihasilkan dari degradasi asam amino
(Gordon, 1994). Penggantian medium dengan interval tersebut pada medium yang
disuplementasi dengan asam amino dan glutamin dapat mengurangi embrio yang
terhenti berkembang pada tahap 8-16 sel (Gardner et al., 1994).
Sistem Inkubasi
Peranan C 0 2 Dalam Kultur In Vitro
Pada umumnya oosit dimatangkan secara in vitro menggunakan sistem
kultur non-statzc, dimana 10 sampai 20 oosit dimatangkan dalam 50-100 p1 me-
dium (drop). Penggunaan tetes (drop) yang ditutupi dengan minyak mineral mem-
berikan beberapa keuntungan seperti mencegah dan inengurangi penguapan, men-
cegah kontaminasi mikroba, mengurangi fluktuasi suhu dan memudahkan peng-
amatan selama inkubasi (Gordon, 1994).
Komposisi gas udara dimana oosit dan embrio diinkubasi merupakan salah
satu faktor penting yang mempengaruhi perkembangannya. Tingkat pematangan
dan fertilisasi oosit serta pertumbuhan embrio terbaik diperoleh pada fase gas C 0 2
2,5-5% dan Oz 5% di udara (Pinyopummintr dan Bavister, 1995). Menurut
Freshney (1987) peranan C02 dalam mempertahankan medium agak kompleks dan
dengan konsentrasi COz dan HCOq- yang dilarutkan serta pH. Tekanan C 0 2 di udara
mempengaruhi jumlah C02 yang dilarutkan secara langsung. Oleh karena itu setiap
medium mempunyai rekomendasi tekanan C02 dan konsentrasi bikarbonat untuk
mendapatkan pH dan osmolalitas yang diinginkan. Perubahan minor pH (+ 0,15)
dalam medium kultur yang disebabkan oleh C 0 2 dan bikarbonat dengan nyata mem-
pengaruhi perkembangan embrio (Vaj ta et ul., 1997).
Selain mempengaruhi pH medium, C 0 2 juga berperanan sebagai substrat
pada metabolisme embrio. Penelitian menggunakan embrio hamster memperlihat-
kan perkembangan embrio yang sama antara embrio yang dikultur pada kondisi C02
5% menggunakan medium yang diperkaya asam lemah dengan embrio yang dikultur
pada kondisi C 0 2 10% menggunakan medium tanpa diperkaya asam lemah. Dari
hasil tersebut disimpulkan bahwa gas C02 selama kultur m vztro dapat berperanan
sebagai asam lernah. Aktifitas C 0 2 sebagai asam lemah yaitu dengan mempenga-
ruhi pH intraseluler (Carney dan Bavister, 1987). Pada tahap oosit pH intraseluler
berkisar 7,13-7,25 (House, 1994, Depypere dan Leybaert 1 994). Pada sel somatik
pH intraseluler berperanan dalam mengontrol metabolisme melalui enzim kunci
phosphrflrruktosa ktnase (PFK). PFK adalah regulator utama glikolisis yang aktifi-
tasnya sangat tergantung pada pH (Wuttke dan Walz, 1990).
Thompson (1996) mengemukakan bahwa ketergantungan terhadap COz tidak
mutlak untuk perkembangan embrio sebagaimana terlihat pada embrio sapi yang
inampu berkembang sainpai tahap blastosis bila medium ditambah dengan
ini kemungkinan disebabkan embrio sapi, mencit dan domba menghasilkan 2-5
pmol C 0 2 per embrio per jam dari glukosa sebagai substrat sisa metabolisme (Wang
dan Wales, 1993). Keadaan ini dapat dimanfaatkan sebagai dasar dalam manipulasi
C 0 2 5% yang diperlukan dalam inkubator. Margawati et a/. (1997a) melakukan
pematangan oosit domba dengan tiga metode yaitu 1) pematangan dala~n eppendorf
menggunakan medium TCM-199 bikarbonat yang disuplementasi dengan FCS
lo%, HCG 10 yglml, estradiol I yglml pada kondisi tanpa C02 5%, 2) oosit
dimatangkan dengan metode dan medium yang sama pada cawan Petri, dan 3) oosit
dimatangkan dalam cawan Peteri menggunakan medium yang sama dengan ling-
kungan C 0 2 5%. Pematangan ketiga metode dilakukan dalam inkubator selama 24
jam pada temperatur 3 8 ' ~ . Oosit yang matang difertilisasi dalam medium B-0
dengan 12 x 1
o6
sperma/ml selama enam jam dan dikultur dalam SOF yang disuple-mentasi dengan BSA pada suhu 3 8 ' ~ pada kondisi C02 5% selama tujuh hari. Hasil yang diperoleh menunjukkan perbedaan sistem inkubasi tersebut tidak berpengaruh
nyata terhadap angka morula dan blastosis. Oleh karena itu disimpulkan bahwa
oosit domba yang dimatangkan secara In vitro tanpa C 0 2 5% dapat berkembang
Penggunaan Hepes dalam Medium untuk Menggantikan Peranan COz 5% pada Kultur
In
VitroMedium kultur membutuhkan penyangga atau buffer pada dua konQsi yaitu
(1) kultur dilakukan menggunakan tempat terbuka sehingga perubahan konsentrasi
C02 akan meningkatkan pH medium dan (2) C 0 2 dan asam laktat diproduksi secara
berlebihan sehingga menyebabkan pH menjadi turun.
Suatu penyangga dapat ditambahkan pada meQum untuk menstabilkan pH,
tetapi CO2 eksogen masih dibutuhkan oleh beberapa sel, terutama pada konsentrasi
sel rendah untuk mencegah kehilangan C 0 2 yang tidak dilarutkan dan bikarbonat
dari medium (Freshney, 1987). Selanjutnya dikemukakan bahwa penyangga bikar-
bonat lebih sering digunakan dibanding yang lain karena harganya murah, kurang
beracun dan kandungan nutrisi menguntungkan kultur.
Penyangga lain yang digunakan dalam medium kultur adalah Fosfat dan
Hepes. Keuntungan medium yang mengandung kedua penyangga adalah dapat
digunakan untuk manipulasi embrio atau oosit dalam periode singkat pada kondisi
tanpa C02 5% untuk mempertahankan pH medium (Gordon, 1994). Penelitian pada
kultur embrio mencit dengan kondisi tanpa C 0 2 5% menunjukkan bahwa medium
dasar Ilyrode 's yang mengandung Hepes lebih superior dibandingkan dengan
menggunakan medium mengandung penyangga fosfat (Mahadevan et u1.,1986).
Kelemahan penyangga fosfat adalah kemampuan buffer yang lemah untuk pH di
atas 7,5 disamping itu j uga cenderung mengalami presipitasi dengan sebagan besar
kation dan senyawa ini merupakan suatu penghambat (znhzbitor) dalam beberapa
Hepes atau N-2-HydroOryet~zylpperazine-N'-2-ethanesu~fonicaczd (Gambar
1) merupakan penyangga yang sangat efektif pada pH 7,2-7,s (pH fisiologis),
karena itu digunakan dalam medium kultur.
Gambar 1. Struktur kimia penyangga Hepes (Cq H14N204S) (Good et al, 1966)
Hepes umumnya digunakan dalam medium kultur antara 10-20 mM
(Freshney, 1987). Pa