PEMBUATAN GLUKOSAMIN HIDROKLORIDA (GlcN HCl)
DARI KITIN KARAPAS UDANG
DENGAN METODE AUTOKLAF
ELVINA MELATI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pembuatan Glukosamin Hidroklorida (GlcN HCl) dari Kitin Karapas Udang dengan Metode Autoklaf adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2014
Elvina Melati
ABSTRAK
ELVINA MELATI. Pembuatan Glukosamin Hidroklorida (GlcN HCl) dari Kitin Karapas Udang dengan Metode Autoklaf. Dibimbing oleh PIPIH SUPTIJAH dan AGOES MARDIONO JACOEB.
Glukosamin merupakan salah satu senyawa gula amino yang ditemukan pada tulang rawan dan memiliki peranan yang sangat penting untuk kesehatan dan kelenturan sendi. Glukosamin merupakan salah satu jenis suplemen yang banyak dikaji dipasarkan secara luas dalam bentuk klorida maupun sulfat. Glukosamin memproduksi cairan synovial dan mencegah destruksi tulang. Pengolahan glukosamin hidroklorida dari kitin dilakukan melalui reaksi hidrolisis sederhana dan depolimerisasi. Glukosamin dihidrolisis menggunakan tekanan sebesar 0,5.atm dan konsentrasi HCl 10%, 15%, 20% dan 25%. Glukosamin terbaik diperoleh dari perlakuan dengan tekanan 0,5 atm dan konsentrasi HCl 15% dengan waktu pemanasan 120 menit. Glukosamin dari perlakuan ini menunjukkan hasil uji kelarutan paling besar yaitu 60%, rendemen 77,4%, LoD 1% serta titik leleh 190-195°C. Hasil uji FTIR juga menunjukkan bahwa glukosamin memiliki gugus OH, N-H dan C-N
Kata kunci: glukosamin, HCl, hidrolisis, kitin, tekanan
ABSTRACT
ELVINA MELATI. Glucosamine Hidroclorida (GlcN HCl) from Chitin Carapace of Shrimp with Autoclave Methode. Supervised by PIPIH SUPTIJAH and AGOES MARDIONO JACOEB.
Glucosamine is one of the amino sugar compound that found in cartilage and has a very important role for the health and joint flexibility. Glucosamine is a kind of supplements that are marketed extensively in the form of chloride or sulfate. Glucosamine produces sinovyal fluid and prevents bone destruction. Production of glucosamine hydrochloride from chitin was carried out through a simple hydrolysis and depolymerization. Glucosamine was extracted at pressure 0.5 atm with the HCl concentration 10%, 15%, 20% and 25%. The best of Glucosamine was treated using 0.5 atm pressure and HCl 15% for 120 minutes. The Glucosamine from this treatment showed the greatest solubility test result 60%, yield 77.4%, LOD 1 % and the melting point is 190-195°C. FTIR results also showed that glucosamine has -OH, N-H and C-N.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PEMBUATAN GLUKOSAMIN HIDROKLORIDA (GlcN HCl)
DARI KITIN KARAPAS UDANG
DENGAN METODE AUTOKLAF
ELVINA MELATI
skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : Pembuatan Glukosamin Hidroklorida (GlcN HCl) dari Kitin Karapas Udang dengan Metode Autoklaf.
Nama : Elvina Melati
NIM : C34100053
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Dra Pipih Suptijah, MBA. Dr Ir Agoes Mardiono Jacoeb, Dipl.-Biol.
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso, MSi.
Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-NYA sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2013 sampai November 2013 ini ialah pembuatan glukosamin hidroklorida, dengan judul Pembuatan Glukosamin Hidroklorida (GlcN HCl) dari Kitin Karapas Udang dengan Metode Autoklaf
Pada kesempatan kali ini penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan laporan praktek lapang ini, terutama kepada:
1. Dr Dra Pipih Suptijah, MBA. selaku dosen pembimbing I dan Dr Ir Agoes Mardiono Jacoeb, Dipl.-Biol. selaku dosen pembimbing II atas segala bimbingan dan pengarahan yang diberikan kepada penulis.
2. Dr Eng Uju, SPi, MSi selaku dosen penguji hasil penelitian ini.
3. Dr Ir Iriani Setyaningsih MS. selaku ketua program studi Teknologi Hasil Perairan.
4. Dr Desniar, SPi, MSi selaku sekretaris ketua program studi Teknologi Hasil Perairan.
5. Prof Dr Ir Joko Santoso, MSi selaku Ketua Departemen Teknologi Hasil Perairan.
6. Seluruh staf akademik dan administrasi Teknologi Hasil Perairan.
7. Ibu Ema dan Pak Sobar selaku laboran yang telah membantu penyelesaian penelitian ini.
8. Ayah dan Ibu serta keluarga tersayang yang telah memberikan cinta, kasih sayang dan doanya kepada penulis.
9. Teman-teman THP 47 yang telah banyak membantu penulis sehingga laporan ini dapat diselesaikan dengan baik.
Penulis menyadari bahwa tugas akhirmasih jauh dari sempurna oleh karena itu penulis mengharapkan kritik dan saran yang membangun untuk perbaikan laporan ini. Semoga tulisan ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, 27 April 2014
Pembuatan Kitin dari Limbah Karapas Udang (Suptijah 2004) ... 4
Hidrolisis Glukosamin dari Kitin ... 4
Prosedur Analisis ... 5
Penentuan Derajat Deasetilasi Kitin (Czechowska et al. 2012) ... 5
Perhitungan Rendemen ... 5
Uji Kelarutan Total (ASTM 2002) ... 5
Uji Titik Leleh (AOAC 1995) ... 5
Uji Loss on Drying (LoD) (USP 2006) ... 6
HASIL DAN PEMBAHASAN ... 6
Derajat Deasetilasi Kitin Hasil Ekstraksi ... 6
Karakteristik Glukosamin Hidroklorida ... 7
Bentuk Fisik Glukosamin Hidroklorida ... 7
Rendemen Glukosamin Hidroklorida ... 9
Kelarutan Glukosamin Hidroklorida ... 9
Loss on Drying (LOD) Glukosamin Hidroklorida ... 10
Titik Leleh Glukosamin ... 10
Spektrum FTIR Glukosamin Hidroklorida (GlcN HCl) ... 10
KESIMPULAN DAN SARAN ... 11
Kesimpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 12
LAMPIRAN ... 14
DAFTAR RIWAYAT HIDUP ... 17
ii
DAFTAR TABEL
1 Karakteristik glukosamin hasil penelitian ... 7
DAFTAR GAMBAR
1 Diagram alir pembuatan kitin ... 32 Diagram alir hidrolisis dan analisis karakteristik glukosamin ... 4
3 Bentuk fisik glukosamin ... 7
4 Struktur kimia kitin (Mojarrad et al. 2007) ... 8
5 Struktur kimia glukosamin hidroklorida ... 8
DAFTAR LAMPIRAN
1 Spektrum FTIR kitin hasil ekstraksi ... 152 Sprektrum FTIR GlcN HCl hasil hidrolisis HCl 15%, ... 15
3 Sprektrum FTIR GlcN HCl standar ... 16
4 Perhitungan nilai DD kitin dan glukosamin ... 16
PENDAHULUAN
Latar Belakang
Pola hidup yang tidak sehat dapat menyebabkan timbulnya berbagai macam penyakit pada manusia. Konsumsi makanan yang tidak tepat serta kurangnya asupan gizi yang dibutuhkan oleh tubuh akan semakin meningkatkan resiko terkena penyakit kronis, salah satunya adalah penyakit tulang. Menurut
Arthritis Foundation (2006) jumlah penderita arthritis atau gangguan sendi kronis lain di Amerika Serikat terus meningkat. Tahun 1990 terdapat 38 juta penderita dari sebelumnya 35 juta pada tahun 1985. Tahun 1998 memperlihatkan hampir 43 juta atau 1 dari 6 orang di Amerika Serikat menderita gangguan sendi dan pada
tahun 2005 jumlah penderita arthritis sudah mencapai 66 juta atau hampir 1 dari 3 orang menderita gangguan sendi.
Martin (2013) menyatakan bahwa pada tahun 2010-2011 lebih dari 16,7% penduduk di Kanada yang berjumlah 4,6 juta orang berumur lebih dari 15 tahun dan dilaporkan menderita arthritis. Jumlah tersebut diperkirakan akan terus meningkat akan mencapai tujuh juta orang pada tahun 2013. Pada periode yang sama, penduduk Kanada dengan umur diatas 65 tahun menderita arthritis dengan persentase 34,1% laki-laki dan 52,9% perempuan.
Vangsness et al. (2009) menyatakan bahwa glukosamin merupakan komponen yang berada pada matriks ektraseluler tulang rawan. Glukosamin telah banyak digunakan untuk tujuan pengobatan sendi selama kurang lebih 40 tahun. Glukosamin telah digunakan untuk pengobatan arthritis selama 20 tahun terakhir di Eropa dan Asia. Pengolahan glukosamin hidroklorida dari kitin dilakukan melalui reaksi hidrolisis sederhana dan depolimerisasi untuk menjadi glukosamin hidroklorida sebagai hasil dari perendaman didalam larutan asam hidroklorida (Mojarrad et al. 2007). Terjadinya peningkatan permintaan glukosamin tersebut, telah menuntut akan adanya tingkat optimasi metode dalam preparasi glukosamin dengan produktivitas dan kualitas yang tinggi. Industri farmasi biasanya menjual glukosamin murni atau dicampur dengan bahan lain sebagai suplemen makanan.
Konsumsi glukosamin yang disarankan adalah 23,1 mg/kg berat badan (Simanek et al. 2005).
Afridiana (2011) berhasil membuat glukosamin hidroklorida dari kitin udang dengan perlakuan HCl 37% dan suhu pemanasan 900C selama 4 jam. Metode tersebut kurang efektif dan aman, mengingat penggunaan asam dengan konsentrasi yang terlalu tinggi dan pengerjaan dilakukan diruangan terbuka menggunakan suhu pemanasan yang cukup tinggi. Rismawan (2012) berhasil membuat glukosamin dari kitosan dengan rendemen 51,04% pada perlakuan HCl 22% dengan tekanan vakum 1 atm selama 2 jam. Ernawati (2012) berhasil membuat glukosamin dari kitosan dengan rendemen sebesar 69,80% pada perlakuan asam 8% dan tekanan sebesar 1 atm selama 1 jam. Metode tersebut lebih aman dilakukan karena penggunaan asam yang lebih rendah dengan adanya bantuan tekanan serta pengerjaan dilakukan di wadah yang tertutup.
2
biaya produksi yang terjangkau serta memilliki tingkat konsentrasi yang cukup tinggi. Oleh karena itu, penelitian untuk menghasilkan glukosamin hidroklorida dari karapas udang melalui modifikasi hidrolisis kimiawi sebagai sediaan suplemen penyakit osteoarthritis menjadi sangat penting untuk dilakukan. Mengacu pada penelitian yang telah dilakukan Ernawati (2012) maka dilakukan penelitian mengenai pembutan glukosamin dari kitin yang berasal dari limbah karapas udang dengan metode autoklaf.
Tujuan
Tujuan dari penelitian ini adalah mengetahui pengaruh perbedaan konsentrasi asam yang digunakan pada pembuatan glukosamin hidroklorida (GlcN HCl) dengan penerapan tekanan, serta menganalisis karakteristik produk glukosamin hidroklorida (GlcN HCl) hasil penelitian.
METODE PENELITIAN
Waktu dan Tempat
Penelitian telah dilaksanakan pada bulan September hingga November 2013 di Laboratorium Biokimia Hasil Perairan dan Labolatorium Kimia Organik, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan adalah limbah karapas udang, NaOH 3N, HCl 1N, Isoprophyl Alkohol (IPA) 95% dan akuades. Alat yang digunakan dalam penelitian ini adalah Erlemeyer 250 mL, autoklaf, gelas piala 100 mL, alat uji FTIR Perkin Elmer Spektrum One, pemanas listrik titik leleh MelTemp, pipet volumetrik 10 mL, gelas ukur 50 mL, oven, kertas pH, batang pengaduk, kertas saring 1 µm dan timbangan digital.
Prosedur Penelitian
Gambar 1 Diagram alir pembuatan kitin
Limbah karapas udang
Pemanasan
karapas : HCl (1:7) ; 90oC ; 60 menit
Netralisai hingga pH = 7
Filtrasi kertas saring 1 µm Netralisai hingga pH = 7
Kitin Pemanasan
karapas : NaOH (1:10) ; 90oC ; 60 menit
Penentuan nilai DD HCl 1 N
Filtrat
NaOH 3,5 N Akuades
Akuades Filtrat
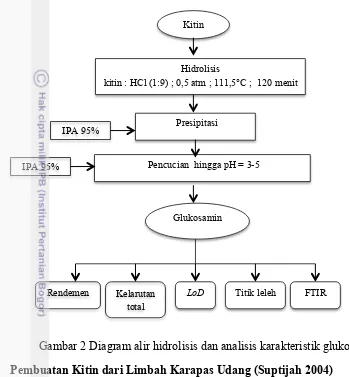
Gambar 2 Diagram alir hidrolisis dan analisis karakteristik glukosamin
Pembuatan Kitin dari Limbah Karapas Udang (Suptijah 2004)
Tahapan pembuatan kitin dimulai dari demineralisasi, netralisasi kemudian dilanjutkan dengan deproteinisasi. Demineralisasi dilakukan dengan memanaskan limbah karapas udang menggunakan HCl 1N sebanyak 1:7 pada suhu 90°C selama 1 jam yang kemudian dicuci menggunakan akuades hingga pH nya netral. Deproteinisasi menggunakan NaOH 3N sebanyak 1:10 pada suhu 90°C selama 1 jam kemudian dicuci kembali hingga pH nya netral, kemudian dikeringkan dan dihasilkan kitin. Kitin yang diperoleh diuji derajat deasetilasinya menggunakan metode FTIR.
Hidrolisis Glukosamin dari Kitin
Prosedur Analisis
Penentuan Derajat Deasetilasi Kitin (Czechowska et al. 2012)
Sampel sebanyak 2 mg dan 200 mg KBr dicampurkan dan dihancurkan dengan mortar. Campuran ini ditempatkan dalam alat pengepresan dan dilakukan pengepresan pada tekanan 800 kg. Kepingan hasil pengepresan diukur menggunakan spektrofotometer Infra Red. Sehingga diperoleh nilai absobansinya. Czechowska et al. (2012) menyatakan bahwa nilai derajat deasetilasi (DD) dapat diketahui dengan membandingkan nilai absorbansi pada bilangan gelombang amida 1650-1500 cm-1 (A1655) dengan bilangan gelombang hidroksil
Perhitungan rendemen dimaksudkan untuk mengetahui kadar efektif sampel kitin atau kitosan yang dapat diubah menjadi glukosamin dengan cara membandingkan bobot glukosamin dengan bobot awal sampel kitin atau kitosan yang digunakan. Rendemen glukosamin yang dihasilkan dihitung dengan menggunakan rumus:
Rendemen (%) = !"!"# !"#$%&'()* !"#$%&
!"!"# !"#"$ � 100%
Uji Kelarutan Total (ASTM 2002)
Pengujian kelarutan total dilakukan dengan mencampurkan glukosamin yang dihasilkan sebanyak 100 mg ke dalam 1 mL akuades, diaduk selama kurang lebih 3 menit, disaring menggunakan kertas saring hingga bagian yang larut dan tidak larut di dalam air terpisahkan. Padatan yang tidak larut dalam air dikeringkan menggunakan oven dengan suhu 105oC selama 3 jam dan kemudian ditimbang bobotnya. Kelarutan total dapat dihitung menggunakan rumus berikut:
Kelarutan total = !"!"# !"#$%& !"!#!!"!"# !"#$%& !"!!"
!!"!# !"#$%& !"!# � 100%
Uji Titik Leleh (AOAC 1995)
6
Cara ini dilakukan berulang kali untuk mendapatkan contoh padat dalam tabung setinggi 1,5-3 mm. Tabung kapiler dimasukkan ke dalam pemanas listrik yang dilengkapai dengan termometer 400oC untuk penetapan titik leleh. Alat dinyalakan dan suhu dinaikkan perlahan sampai titik leleh tercapai.
Uji Loss on Drying (LoD) (USP 2006)
Uji LoD dilakukan dengan cara mengoven sampel kering pada suhu 105 oC selama dua jam. Kondisi sampel dianggap baik jika pengurangan bobot sampel setelah pengovenan nilainya tidak lebih dari 1%. Persentase LoD dihitung dengan rumus
Derajat Deasetilasi Kitin Hasil Ekstraksi
Analisis derajat deasetilasi (DD) terhadap produk kitin dilakukan untuk mengetahui persentase gugus asetil yang dapat dihilangkan dari kulit udang sehingga dihasilkan produk kitin. Nilai derajat deasetilasi kitin dihitung berdasarkan pengukuran menggunakan FTIR. Berdasarkan hasil FTIR dari kitin dapat diketahui bahwa kitin memiliki nilai DD sebesar 71,32%. Nilai DD tersebut hamper mendekati nilai DD yang dimiliki oleh kitin hasil penelitain Suptijah (2004) yaitu sebesar 78,10 %. Erika et al. (2006) menyatakan bahwa semakin tinggi derajat deasetilasi kitin menunjukkan semakin banyak gugus asetil yang dilepaskan dan semakin banyak gugus aktif amida bebas (-NH2) sehingga tingkat kemurniannya semakin tinggi. Tingginya derajat deasetilasi kitin hasil ektraksi diduga dipengaruhi oleh kondisi perlakuan pendahuluan, demineralisasi dan deproteinisasi yang baik. Terlepasnya gugus asetil pada kitin dapat disebabkan adanya interaksi antara basa NaOH selama proses deproteinisasi. Molekul NaOH akan teradisi ke molekul kitin dan menyebabkan gugus asetil lepas. Kemurnian glukosamin tentu akan mempengaruhi glukosamin yang akan dihasilkan. Semakin murni glukosamin yang dihasilkan akan mempermudah depolimerisasi kitin menjadi glukosamin. Hasil FTIR kitin hasil ekstraksi dapat dilihat pada Lampiran 1.
Kitin merupakan biopolimer dari unit polimer N-asetil-D-glukosamin yang saling berikatan dengan ikatan β (1-4). Kitin adalah kristal yang bewarna putih, tidak berasa, tidak berbau, dan tidak larut dalam air, pelarut organik umumnya, asam-asam anorganik dan basa encer. Kitin merupakan senyawa yang tidak berdiri sendiri tetapi bergabung dengan senyawa lain. Pada crustacea kitin
bergabung dengan protein, garam anorganik dan pigmen (Rahayu dan Purnavita 2007). Kitin merupakan bahan organik utama yang
terdapat pada kelompok crustacean, insekta, fungi, mollusca dan arthropoda.
utama, yaitu demineralisasi dan deproteinisasi. Semakin tinggi nilai DD dalam kitin maka kemurnian produk kitin yang dihasilkan semakin bagus (Afridiana 2011).
Karakteristik Glukosamin Hidroklorida
Glukosamin dikarakteristik melalui beberapa uji diantaranya rendemen,
kelarutan, Loss on Drying (LoD), titik leleh dan FTIR. Hasil uji tersebut disajikan pada Tabel 1.
Tabel 1 Karakteristik glukosamin hasil penelitian
Karakteristik
Bentuk Fisik Glukosamin Hidroklorida
Glukosamin hasil ekstraksi memiliki bentuk fisik butiran hingga serbuk
halus dengan warna putih hingga putih kecoklatan. Warna glukosamin berbeda pada setiap perlakuan. Bentuk fisik glukosamin hasil penelitian dapat dilihat pada Gambar 3.
(a) (b) (c) (d)
Gambar 3 Bentuk fisik glukosamin dengan konsentrasi HCl; (a) HCl 10%; (b) HCl 15%; (c) HCl 20%; (d) HCl 25%
Berdasarkan Gambar 3 dapat diketahui bahwa semakin tinggi konsentrasi asam yang digunakan akan menghasilkan warna glukosamin yang semakin gelap atau coklat. Mekanisme perubahan warna tersebut diduga disebabkan oleh terjadi reaksi enolisasi glikosil amino akibat adanya interaksi gula amino dengan asam kuat pada suhu tinggi sehingga terbentuk komponen furfural yang berwarna coklat. Ernawati (2012) juga menambahkan bahwa glukosamin yang baik akan memiliki bentuk fisik serbuk bewarna putih.
8
laut, dan sebagian besar dari proses-proses kimia yang ada pada kerang. Pengolahan glukosamin hidroklorida dari kitin dilakukan melalui reaksi hidrolisis dan depolimerisasi untuk menjadi glukosamin hidroklorida sebagai hasil dari perendaman di dalam larutan asam hidroklorida (Mojarrad et al. 2007).
Glukosamin dibuat dengan menghidrolisis kitin menggunakan asam kuat dan tekanan. Metode ini mengacu pada penelitian sebelumnya yang telah dilakukan oleh Ernawati (2012) yang telah berhasil membuat glukosamin dengan mentode yang sama. Proses yang terjadi selama hidrolisis kitin adalah depolimerisasi dan deasetilasi. Proses deasetilasi terjadi karena hilangnya gugus asetil (CH3CO) sehingga molekul dapat larut dalam asam dan menghasilkan polisakarida dengan gugus amida bebas yaitu NH2 (Rokhati 2006). Sedangkan depolimerisasi adalah pemecahan polimer yaitu dengan pemutusan ikatan glikosidik pada kitin sehingga diperoleh polimer glukosamin yang lebih pendek. Hidrolisis glukosamin dengan metode autoklaf pada dasarnya merupakan sistem kerja yang menggabungkan fungsi tekanan, suhu dalam media asam. Tekanan berperan penting dalam pemotongan ikatan polimer menjadi unit-unit yang lebih kecil. Asam HCl berperan dalam pembentukan ikatan dengan gugus amin –NH2 setelah gugus asetil –COCH3 terlepas. Metode tersebut lebih efektif dan efisien untuk dilakukan bila dibandingkan dengan penelitian Afridiana (2011) yang menggunakan metode pemanasan disertai pengadukan dalam media HCl yang sangat tinggi konsentrasinya hingga mencapai 37%. Proses depolimerisasi kitin menjadi glukosamin menurut Mojarrad et al. (2007) disajikan pada Gambar 4 dan Gambar 5.
Gambar 4 Struktur kimia kitin (Mojarrad et al. 2007)
Gambar 5 Struktur kimia glukosamin hidroklorida (Mojarrad et al. 2007)
Rendemen Glukosamin Hidroklorida
Nilai rendemen dihitung dengan membandingkan jumlah bobot sampel
akhir dengan sampel awal kitin. Glukosamin memiliki rendemen yang berbeda pada setiap perlakuaannya.
Tabel 1 menunjukkan bahwa glukosamin yang memiliki rendemen terbesar adalah glukosamin dengan perlakuan konsentrasi HCl sebesar 10% yaitu sebesar 83,6%. Rendemen terendah terdapat pada glukosamin dengan perlakuan konsentrasi HCl sebesar 25% yaitu sebesar 25,2%. Semakin tinggi konsentrasi asam yang digunakan menghasilkan rendemen glukosamin yang semakin kecil. Hal tersebut dapat terjadi karena pemutusan polimer kitin menjadi glukosamin cenderung lebih cepat pada konsentrasi asam yang lebih tinggi
Adanya perbedaan nilai rendemen glukosamin ini diduga dipengaruhi oleh faktor konsentrasi asam yang digunakan. Mojarrad et al. (2007) menyatakan bahwa perbandingan antara waktu hidrolisis dan konsentrasi asam merupakan faktor yang menentukan nilai rendemen sampel glukosamin. Nilai rendemen GlcN yang dihasilkan menurun seiring dengan peningkatan konsentrasi asam dan waktu reaksi. Penurunan rendemen diduga terjadi karena adanya reaksi berlebih sehingga terjadi kerusakan atau degradasi dan terbentuk zat pengotor sehingga menurunkan nilai rendemen GlcN yang dihasilkan.
Kelarutan Glukosamin Hidroklorida
Indikator pertama yang digunakan untuk menentukan keberhasilan hidrolisis kitin menjadi glukosamin hidroklorida adalah kelarutan total glukosamin dalam air. Tabel 1 menunjukkan bahwa tidak ada sampel glukosamin
yang larut sempurna dalam air. Kelarutan tertinggi terdapat pada glukosamin dengan perlakuan pemberian konsentrasi HCl 15% dengan pemberian tekanan yaitu sebesar 60%. Hal tersebut menunjukkan bahwa kitin belum terhidrolisis sempurna menjadi glukosamin. Kralovec dan Barrow (2008) menyatakan bahwa glukosamin hidroklorida bersifat larut sempurna dalam air bersuhu 20oC dengan konsentrasi 100 mg/mL. Hal tersebut berbeda dengan glukosamin yang dihasilkan dalam penelitian. Kelarutan terbesar hanya mencapai 60%. Hal tersebut dapat disebabkan beberapa faktor, salah satunya faktor konsentrasi asam yang digunakan. Konsentrasi HCl yang digunakan diduga terlalu rendah sehingga belum mampu menghidrolisis kitin menjadi glukosamin secara sempurna. Kralovec dan Barrow (2008) menyatakan bahwa kadar asam yang rendah menyebabkan terjadinya hidrolisis yang tidak sempurna. Hasil tersebut masih lebih baik jika dibandingkan dengan hasil penelitian yang dilakukan oleh Ernawati (2012) kitin yang dihidrolisis menggunakan HCl 18,5%, 12,3% dan 9,2% dengan waktu pemanasan 30, 60, 90 dan 120 menit tidak ada sama sekali yang larut dalam air.
Mekanisme kinerja asam dan tekanan terhadap sampel dapat dijelaskan sebagai berikut: glukosamin hidroklorida dapat larut dalam air karena adanya ikatan gugus –OH dan NH2Cl. Kitin merupakan polimer yang masih mengandung
gugus asetil –COCH3 yang terikat kuat pada gugus amin –NH2. Gugus asetil ini
harus dihilangkan sehingga gugus amin dapat berikatan dengan –Cl dari asam HCl dan membentuk ikatan NH3Cl. Fungsi tekanan pada autoklaf membantu
10
Loss on Drying (LOD) Glukosamin Hidroklorida
Uji LOD atau uji pengurangan bobot dilakukan untuk mengukur jumlah air dan komponen volatil yang mungkin masih terkandung dalam sampel ketika dikeringkan pada kondisi tertentu. Glukosamin dengan bobot 0,1 gram dipanaskan dalam oven pada suhu 105oC selama 2 jam. Data pada Tabel 1 menunjukkan
bahwa hanya glukosamin dengan perlakuan asam 10% dengan tekanan 0,5 atm memiliki nilai LoD sebesar 1,3%. Glukosamin selain perlakuan tersebut memiliki nilai LoD yang sama yaitu sebesar 1%. Nilai LoD tersebut telah sesuai dengan standar yang disyaratkan oleh USP (2006) bahwa nilai LoD glukosamin hidroklorida tidak lebih dari 1%. Uji LoD dilakukan untuk mengetahui jumlah air atau zat lain yang mudah menguap. Glukosamin dianggap baik jika nilai LoD nya tidak lebih dari 1%. Semakin rendah nilai LoD glukosamin, maka semakin tinggi kemurnian glukosamin tersebut.
Titik Leleh Glukosamin
Pengujian titik leleh yang dilakukan bertujuan untuk mengetahui ada atau
tidaknya zat pengotor yang terkandung dalam glukosamin. Data pada Tabel 1 menunjukkan bahwa setiap sampel memiliki kisaran titik leleh yang berbeda. Nilai rata-rata titik leleh terbesar terdapat pada glukosamin dengan perlakuan asam 10% dan 15% yaitu sebesar 190-195°C. Nilai titik leleh terendah terdapat pada glukosamin dengan perlakuan asam 25% dan tekanan sebesat 0,5 atm yaitu sebesar 189-192°C. Idealnya titik leleh berada dalam satu titik, namun glukosamin yang dihasilkan memiliki kisaran titik leleh Hal tersebut dapat disebabkan oleh beberapa faktor diantaranya adalah terdapat zat pengotor yang memiliki perbedaan titik leleh dengan glukosamin. Afridiana (2011) menyatakan bahwa kisaran titik leleh glukosamin disebabkan masih terdapat campuran oligomer kitin sehingga dapat mengurangi tingkat kemurnian dari glukosamin yang ada.
Mojjarad et al. (2007) dapat membuat glukosamin dengan titik leleh 188-189°C, Afridiana (2011) dapat membuat glukosamin dengan titik leleh 182-189°C. Glukosamin dengan perlakuan terbaik (HCl 15%) memiliki nilai titik leleh 190-195°C. Hasil tersebut menunjukkan bahwa glukosamin yang dihasilkan memiliki kisaran titik leleh yang lebih tinggi dari penelitian sebelumnya. Kralovec dan Barrow (2008) menyatakan bahwa glukosamin yang baik memiliki nilai kisaran titik leleh sebesar 190-194 OC.
Spektrum FTIR Glukosamin Hidroklorida (GlcN HCl)
Salah satu cara yang dapat digunakan untuk menentukan tingkat keberhasilan hidrolisis glukosamin hidroklorida ialah dengan menggunakan analisis FTIR. Analisis FTIR memanfaatkan sinar infra merah pada kisaran bilangan gelombang 800-4000 cm-1. Uji FTIR dilakukan terhadap sampel glukosamin yang memiliki nilai kelarutan terbesar yaitu glukosamin hidroklorida dengan perlakuan asam 15%. Hasil pengujian FTIR glukosamin hidroklorida hasil hidrolisis dapat dilihat pada Lampiran 2.
gugus OH- akan semakin mendekati 3450 cm-1. Gugus N-H pada glukosamin hasil hidrolisis ditunjukan pada bilangan gelombang 1582 cm-1. Hasil tersebut mendekati glukosamin hasil penelitian Ernawati (2012) yang memiliki gugus N-H pada 1566 cm-1 serta penelitian Mojarrad et al. (2007) yaitu 1535-1583 cm-1
Pita serapan gugus C-N GlcN HCl hasil hidrolisis ditunjukkan pada bilangan gelombang 1257 cm-1 . Hasil tersebut mendekati glukosamin standar yang memiliki pita serapan C-N 1288 cm-1. Mojarrad et al. (2007) juga menyatakan bahwa glukosamin memiliki pita serapan C-N yang ditunjukkan pada 1394 cm-1. Secara keseluruhan pita serapan gugus khas pada GlcN hasil hidrolisis menunjukkan kemiripan dengan GlcN HCl standar dan hasil penelitian lainnya namun masih terdapat sedikit selisih pada bilangan gelombang yang ditampilkan, hal ini dapat terjadi karena adanya kisaran nilai serapan gelombang setiap gugus fungsi.
Hasil analisis FTIR juga menunjukkan bahwa glukosamin memiliki nilai derajat deasetilasi sebesar 76,72%. Hal tersebut menunjukkan bahwa setelah proses hidrolisis terjadi kenaikan nilai derajat deasetilasi yang semula hanya 71,32% menjadi 76,72%. Rokhati (2006) menyatakan bahwa pada saat hidrolisis terjadi proses deasetilasi dan depolimerisasi. Proses deasetilasi terjadi karena hilangnya gugus asetil (CH3CO) sehingga menghasilkan gugus amida bebas yaitu
NH2 sehingga nilai derajat deasetilasi pun akan meningkat (Rokhati 2006).
KESIMPULAN DAN SARAN
Kesimpulan
Glukosamin terbaik adalah glukosamin dengan perlakuan HCl 15%
dengan tekanan 0,5 atm dan waktu pemanasan 120 menit. Glukosamin dengan perlakuan tersebut menunjukkan hasil uji kelarutan paling besar yaitu 60%, rendemen 77,4%, LoD 1% serta titik leleh 192OC. Hasil uji FTIR menunjukkan bahwa glukosamin memiliki gugus OH- pada bilangan gelombang 3263 cm-1, gugus N-H pada bilangan gelombang 1582 cm-1, serta gugus C-N ditunjukkan pada bilangan gelombang 1257 cm-1.
Saran
[AOAC] Association of Official Analytical and Chemistry. 1995. Officials Methods of Analysis of AOAC Internasional. Virginia (US): Association of Official Analytical and Chemistry Inc.
Afridiana N. 2011. Recovery glukosamin hidroklorida dari cangkang udang melalui hidrolisis kimiawi sebagai bahan sediaan suplemen Osteoarthritis. [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
[ASTM] American Society for Testing and Materials. 2002. D1110 Test Methods for Water Solubility. West Conshohocken: ASTM International.
Brugnerotto J. 2001. An infrared investigation inrealtion with chitin and chitosan characterization. Polymer 42: 3569-3580.
Czechowska-Biskup R, Jarosinska D, Rokita B, Ulanski P, Rosiak JM. 2012. Determination of degree of deacetylation of chitosan-comparision of methods. Progress on Chemistry and Application of Chitin. 17: 5-20.
Erika I, Rojas D, Waldo M, Arguelles M, Inocencio HC, Javier H, Jaime LM, Francisco MG. 2005. Determination of chitin and protein contents during the isolation of chitin from shrimp waste. Macromolecular Bioscience 6: 340–347.
Ernawati. 2012. Pembuatan glukosamin hidroklorida (GlcN HCl) dengan metode autoklaf. [skripsi]. Bogor (ID): Fakultas perikanan dan ilmu Kelautan, Institut Pertanian Bogor.
Kralovec JA, Barrow CJ. 2008. Marine Neutraceticals and Functional Foods. London (US): CRC Press
Kusumaningsih T, Masykur A, Arief U. Pembuatan kitosan dari kitin cangkang bekicot (Achatina fulica). Biofarmasi. 2 (2): 64-68
Martin WC. 2013. Glucosamine and Chondroitin Sulfate for Osteoarthritis. Vancouver (US): Evidence-Based Practice Group.
Merdikoputro, Asri. 2006. Nyeri lutut membatasi mobilitas.
www.suaramerdeka.com. 21 Agustus 2013
Mojarrad JS, Mahboob N, Valizadeh H, Ansarin M, Bourbour S. 2007. Preparation of glucosamine from exoskeleton of shrimp and predicting production by response surface metodhology. Journal of Agricultural and Chemistry. 55:2246-2250.
Rahayu LH, Purnavita S. 2007. Optimasi pembuatan kitosan dari kitin limbah cangkang rajungan (Portunus pelagicus) untuk adsorben ion logam merkuri.
Reaktor. 11 (1): 45-49.
Rifai Nur R. 2010. Isolasi dan identifikasi kitin, kitosan dari cangkang hewan mini (Horseshoe Crab) menggunakan spektrofotometri infra merah.
Alchemy. 2 (1): 104-157
Rismawan. 2012. Rendemen glukosamin dari kitin udang. [skripsi]. Bogor (ID): Fakultas Matematika dan Pengetahuan Alam, Sekolah Tinggi MIPA.
Rokhati N. 2006. Pengaruh dearajat deasetilasi kitosan dari kulit udang terhadap aplikasinya sebagai pengawet makanan. Reaktor. 10 (2): 52-58.
Vangsness CT, Spiker W, Erickson J. 2009. A review of evidence-based medicine for glucosamine and chondroitin sulfate use in knee osteoarthritis.
Arthcoscopy: The Journal of Arthroscopic and Related Surgery. 5 (1): 86-94 Simanek V, Kren V, Ulrichova J, Gallo J. 2005. The efficacy glucosamine and chondroitin sulfate in the treatment of osteoarthritis: are these saccharides drugs or nutraceuticals. Biomed Papers 149 (1): 51-56
Suptijah P. 2004. Tingkatan kualitas kitosan hasil modifikasi proses produksi.
Jurnal Teknologi Hasil Perairan 7 (1): 56-67.
White T, Stegemann JA. 2001. Environmentally preferred materials in advance in
environmental materials. Material Research Society: Singapore 2: 249-260.
14
LAMPIRAN
Lampiran 1 Spektrum FTIR kitin hasil ekstraksi
Lampiran 2 Sprektrum FTIR GlcN HCl hasil hidrolisis HCl 15%,
16
Lampiran 3 Sprektrum FTIR GlcN HCl standar
Lampiran 4 Perhitungan nilai DD kitin dan glukosamin
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Bandung, pada tanggal 8 Januari 1994. Penulis merupakan anak pertama dari dua bersaudara dari Bapak Sunardi dan Ibu Tuti Rohaeti. Penulis memulai pendidikan formal pada bangku taman kanak-kanak di TK Mandala Sakti, Bandung selama 1 tahun. Penulis melanjutkan pendidikan di SDN Jelegong 2, Bandung selama 6 tahun, SMP Al-Ma’some selama 2 tahun
dengan mengikuti kelas akselerasi dan melanjutkan pendidikan di SMA Al-Ma’soem selama 3 tahun. Penulis melanjutkan pendidikan tinggi ke
Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor pada tahun 2010.
Penulis diterima sebagai mahasiswa IPB melalui jalur USMI (Ujian Saringan Masuk IPB). Selama menjadi mahasiswa IPB, penulis pernah aktif di unit kegiatan mahasiswa (UKM) Gentra Kaheman pada tahun 2010-2011, Bendahara Komisi Dewan Perwakilan Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (DPM FPIK) pada tahun 2011-2012 dan Bendahara umum Dewan Perwakilan Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (DPM FPIK) pada tahun 2012-2013.
Penulis telah melaksanakan praktek lapangan di PT Dharma Samudra Fishing Industries (PT DSFI Tbk.), Tanjung priok, Jakarta Utara dari tanggal 4 Juli 2013 hingga 3 Agustus 2013. Penulis melakukan praktek lapangan dengan mengamati proses sanitasi dan higene pada proses produksi fillet ikan kakap (Lutjanus sp.). Pelaksanaan praktek lapangan dilakukan dibawah bimbingan