KINETIKA PARAMETER STABILITAS OKSIDASI
MINYAK SAWIT MERAH
TESIS
FITRIYONO AYUSTANINGWARNO
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kinetika Parameter Stabilitas Oksidasi Minyak Sawit Merah adalah karya saya dengan arahan dan bimbingan dari komisi pembimbing serta belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2010
Fitriyono Ayustaningwarno
Parameter of Red Palm Oil. Under direction of TIEN R. MUCHTADI, NURI ANDARWULAN
Red palm oil is the natural source of valuable minor components such as carotene. Although a highly valued product, carotene unfortunately is destroyed during food processing and storage. This paper describes study of characterization and kinetic modeling of oxidation by the use of heat of neutralized deodorized red palm oil (NDRPO). Heat was used at 60, 75, and 90 o
C. During storage samples were taken and analyzed for some parameters such as
peroxide value, free fatty acids, β-carotene, and fatty acid composition. Acquired parameters were analyzed with statistic tools to get kinetic models, correlations and parameters that influenced the oxidation process. Parameters influenced in overall NDRPO oxidation process wew β-carotene, free fatty acid, C8:0, C18:0, C18:1 cis, C18:2, C18:3, C20:0, C22:0. Peroxide changing kinetic models were acquired with R2 more than 0.7. β-carotene was degraded following 1st order with Ea 5.56 104 J/mol at R2 more than 0.6.FFA content was increased following 0 order with Ea3.95 104 J/mol at R2 0.999986. Fatty acid degradation following 1st order with R2 more than 0.7 with Ea for C8:0, C12:0, C14:0, C16:0, C16:1, C18:0, C18:1 cis, C18:2, C18:3, C20:0, C22:0 were 70494, 538992.5, 116667, 244282, 38493, 163269, 90426, 82808, 44432, 105776, 31472, 33352 J/mol
respectively. Assumed that initial β-carotene content was 500 ppm and minimum
β-carotene content was 370.1 ppm, during 30 oC storage NDRPO shelf life was 8 months.
Minyak Sawit Merah. Dibimbing oleh TIEN R. MUCHTADI, NURI ANDARWULAN.
Minyak sawit memiliki keunggulan terutama kandungan mikronutriennya yang tinggi sehingga memiliki potensi untuk dikembangkan menjadi healthy oil.
Healthy oil merupakan minyak yang diproses dan dimodifikasi sedemikian rupa
sehingga kandungan nutrisi yang ada di dalamnya dapat dimanfaatkan untuk meningkatkan kesehatan. β-karoten telah lama diketahui sebagai provitamin A. Kandungan α-dan β-karoten dalam minyak sawit kasar (CPO) sebesar 500-700 ppm adalah yang tertinggi dibandingkan sumber lainnya. Selama proses penyimpanan NDRPO akan terpapar oleh panas yang akan menyebabkan kerusakan pada minyak. Penelitian ini memiliki tujuan umum untuk mendapatkan kinetika parameter oksidasi NDRPO selama terpapar panas. Penelitian ini dilakukan dalam tiga tahap. Tahap pertama yaitu karakterisasi awal pada NDRPO. Tahap ini bertujuan untuk mendapatkan informasi mengenai karakter NDRPO sebelum dioksidasi seperti kadar air, kadar β-karotena, kadar TBA, bilangan
peroksida, kadar asam lemak bebas, kadar diene terkonjugasi, kadar α-tokoferol dan komposisi asam lemak. Dengan diketahuinya karakter tersebut dapat diketahui kemungkinan prilaku NDRPO selama oksidasi. Tahap kedua yaitu oksidasi NDRPO yang setelah diolah datanya akan menghasilkan model kinetika parameter oksidasi NDRPO. Tahap ke-tiga adalah analisa koreasi antar parameter
oksidasi antara lain bilangan peroksida, kadar β-karotena, kadar asam lemak bebas dan komposisi asam lemak untuk mendapatkan karakteristik oksidasi NDRPO.
Metode percobaan terdiri atas tiga tahap yaitu tahap pertama dilakukan karakterisasi NDRPO. Produk NDRPO dikaraktersisasi sifat-sifat kimianya
dengan analisa kadar tokoferol, kadar β-karotena, kadar air, komposisi asam lemak, asam lemak bebas, uji nilai peroksida, TBA, dan kadar dien terkonjugasi. Pada tahap kedua dilakukan oksidasi pada NDRPO menggunakan panas pada suhu 60, 75, 90 oC. Suhu oksidasi dipilih lebih tinggi dari 60 oC karena kerusakan
β-karotene mulai signifikan pada suhu lebih dari 60 oC (Muchtadi 1992). Kemudian diambil contoh sesuai label untuk dilakukan karakterisasi. Karakterisasi yang dilakukan meliputi komposisi asam lemak, asam lemak bebas,
bilangan peroksida, dan kadar β-karotena. Dari uji asam lemak bebas dapat diketahui asam lemak yang terputus dari rantai gliserolnya. Dari uji nilai peroksida dapat diketahui perubahan jumlah peroksida selama oksidasi. Setelah didapatkan data karakteristik NDRPO selama oksidasi. Dilakukan tahap ketiga yaitu analisa model hubungannya, sehingga akan didapatkan karakteristik oksidasi NDRPO.
Parameter yang memberi pengaruh besar dalam proses oksidasi NDRPO
adalah β-karotena, FFA, C8:0, C18:0, C18:1 cis, C18:2, C18:3, C20:0, C22:0.
memiliki Ea 90426, C18:2 memiliki Ea 82808, C18:3 memiliki Ea 44432, C20:0 memiliki Ea 105776, C20:1, 31472, C22:0 memiliki Ea 33352. Dengan asumsi kandungan maksimum yang dapat diperoleh pada minyak sawit merah adalah 500 ppm dan batas akhir adalah 370.1 ppm pada kondisi penyimpanan 30 oC, dengan rumus Arrhenius dapat diketahui lama penyimpanan NDRPO adalah 5764 jam atau setara dengan 8 bulan.
©
Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar IPB
KINETIKA PARAMETER STABILITAS OKSIDASI
MINYAK SAWIT MERAH
FITRIYONO AYUSTANINGWARNO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Mengetahui
Disetujui Komisi Pembimbing
Prof. Dr. Tien R. Muchtadi, MS. Ketua
Dr. Ir. Nuri Andarwulan, MS. Anggota
Diketahui Ketua Program Studi
Ilmu Pangan
Dr. Ir. Ratih Dewanti-Hariyadi, MSc.
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro, MS.
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga penelitian dan penulisan tesis ini dapat diselesaikan. Tesis ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Pasca Sarjana di Institut Pertanian Bogor.
Penulis mengucapkan terima kasih dan penghargaan setinggi-tingginya kepada:
1. Ibu Prof. Dr. Ir. Tien R. Muchtadi, MS selaku ketua komisi pembimbing, Dr. Ir. Nuri Andarwulan, MS selaku anggota komisi pembimbing yang telah banyak memberikan dukungan, bimbingan, saran dan arahan selama penelitian dan penulisan tesis ini.
2. Dr. Ir. Sugiyono, M.App.Sc selaku dosen penguji luar komisi pembimbing yang telah memberikan masukan dan saran yang sangat berharga untuk menyempurnakan tesis ini.
3. Kementerian Negara Riset dan Teknologi Republik Indonesia atas pendanaan penelitian ini melalui program Riset Unggulan Strategis Nasional (RUSNAS) Industri Hilir Kelapa Sawit.
4. Staf laboratorium Southeast Asia Food and Agricultural Science and
Technology Center (SEAFAST Center) IPB : Pak Sukarna, Pak Deni, Arief,
Ria, dan Sofah atas bantuan dan kerjasamanya selama penelitian.
5. Staf SEAFAST Center IPB : Ria, Abah, Pak Deni, Pak Jun, Mas Arief, Mas Sumarto, Pak Zul, Mbak Virna, Ibu Ani, Ibu Elly, Pak Nana, Ibu Eva, Pak Udin, dan seluruh keluarga besar SEAFAST Center IPB yang tidak dapat disebutkan satu persatu atas kerjasama dan rasa kekeluargaannya.
6. Staf Masyarakat Perkelapasawitan Indonesia (MAKSI) : Pak Ade dan Mbak Yuli atas kerjasamanya.
7. Rekan-rekan di SEAFAST Center IPB : Pak Soenar dan Azis atas kebersamaan dan kerjasamanya.
8. Penghargaan dan terima kasih yang tak terhingga penulis ucapkan kepada ayah, ibu, dan adik-adik atas dorongan moril, kasih sayang, perhatian, kesabaran, serta doa-doa yang tulus. Kasih sayang dan doa-doamu adalah sumber kekuatan bagi penulis.
9. Rektor dan Dekan Sekolah Pascasarjana IPB, Ketua, Pengajar, dan Pegawai Administrasi Program Studi Ilmu Pangan IPB, yang telah memberi perhatian, mengajar, dan memberikan pelayanan administrasi dan akademik kepada penulis selama kuliah di IPB.
10. Teman-teman saya pada Program Studi Ilmu Pangan
11. AMD, WDC, Seagate, Samsung, Team, Cooler Master, Termaltake, Vizo, Benq, SOHO, Creative, Gigabyte, Crosair, Tagan, Vantec, Scythe, Dell, View Sonic, Logitech, Razer, Canon, Sandisk, ICA, dan Chip Online yang telah mendukung dalam penulisan thesis.
Bogor, Febuari 2010
Penulis dilahirkan di Semarang, Jawa Tengah, tanggal 1 Oktober 1984 sebagai anak pertama dari dua bersaudara, dari pasangan Ayah Djoko Bisowarno dan Ibu Nining Maria Eviatie.
Penulis menyelesaikan pendidikan dasar di SD PL Bernardus Semarang tahun 1996, pendidikan menengah pertama di SMP PL Domenico Savio Semarang tahun 1999, dan pendidikan menengah atas di SMU Kolese Loyola Semarang tahun 2002. Selanjutnya pada tahun yang sama, penulis melanjutkan program Sarjana pada Program Studi Teknologi Pangan, UNIKA Soegijapranata Semarang dan selesai tahun 2005.
Pada tahun 2006, penulis berkesempatan mengikuti Program Pascasarjana Institut Pertanian Bogor (IPB) pada Program Studi Ilmu Pangan. Selama menempuh program S2, penulis berkesempatan mengikuti pelatihan auditor sistem HACCP (Hazard Analysis Critical Control Point) yang diselenggarakan pada bulan Mei 2007 oleh M-BRIO Training Body, Bogor. Seminar yang pernah diikuti penulis selama program S2 di antaranya menjadi peserta dalam seminar 7th
National Student Conference Committee pada bulan Juni 2007 di Semarang dan
menghasilkan sebuah artikel berjudul Stability of β-Carotene during Food
Processing diterbitkan dalam prosiding seminar tersebut. Penulis juga pernah
DAFTAR ISI
Halaman
DAFTAR TABEL ... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... iii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
Hipotesis ... 4
TINJAUAN PUSTAKA Kelapa Sawit ... 5
Pengolahan Buah Sawit Menjadi CPO ... 6
Penerimaan TBS ... 7
Perebusan ... 8
Perontokan ... 8
Pelumatan ... 8
Ekstraksi minyak ... 8
Klarifikasi ... 8
Pemurnian CPO ... 9
Pretreatment ... 9
Deodorisasi ... 11
Produksi NDRPO ... 12
Degumming ... 12
Deasidifikasi ... 12
Deodorisasi ... 12
Produk Minyak Sawit Merah Komersial ... 13
Oksidasi Lipida ... 13
Inisiasi ... 12
Propagasi ... 15
Terminasi ... 16
Faktor yang Mempengaruhi Kecepatan Oksidasi ... 17
Suhu ... 17
Komposisi asam lemak ... 18
Karotenoid ... 20
Tokoferol ... 20
Pembentukan dan Degradasi Peroksida Selama Oksidasi Lipida ... 21
Pembentukan Dien Terkonjugasi Selama Oksidasi Lipida ... 22
Pembentukan Malonaldehid Selama Oksidasi Lipida... 23
Degradasi β-Karotena Selama Oksidasi Lipida ... 24
Pembentukan Asam Lemak Bebas Selama Oksidasi Lipida... 25
Teori Tumbukan ... 26
Orodo Reksi ... 27
Reaksi ordo 0 ... 27
Reaksi ordo 1 ... 27
Reaksi ordo 2 ... 27
Reaksi ordo n ... 28
Principal Component Analysis (PCA) ... 29
Principal component dari matrik korelasi atau kovarian ... 29
Identifikasi komponen-komponen penting ... 30
Rotasi PC ... 30
METODOLOGI PENELITIAN Waktu dan Tempat Penelitian ... 30
Bahan dan Alat ... 30
Metode Penelitian ... 30
Analisa Kimiawi ... 31
Analisis Data ... 37
HASIL DAN PEMBAHASAN Karakterisasi NDRPO ... 38
Modeling Perubahan Parameter Oksidasi NDRPO Selama Oksidasi ... 44
Model kinetika perubahan bilangan peroksida selama oksidasi ... 44
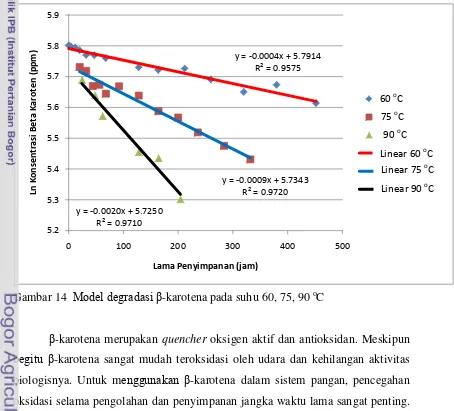
Model kinetika degradasi β-karotena selama oksidasi ... 48
Model pembentukan asam lemak bebas selama oksidasi ... 51
Model degradasi asam lemak selama oksidasi ... 54
Principal Component Analysis (PCA) konstanta kecepatan reaksi antar parameter oksidasi ... 58
Karakterisasi Korelasi Perubahan Antar Parameter Oksidasi NDRPO Selama Oksidasi ... 61
Karakterisasi korelasi perubahan bilangan peroksida selama oksidasi dengan parameter oksidasi lainnya ... 61
Karakterisasi korelasi perubahan β-karotena selama oksidasi dengan parameter oksidasi lainnya ... 63
Karakterisasi korelasi perubahan asam lemak bebas selama oksidasi dengan parameter oksidasi lainnya ... 67
Karakterisasi korelasi degradasi asam lemak selama oksidasi dengan parameter oksidasi lainnya ... 68
KESIMPULAN DAN SARAN Kesimpulan ... 70
Saran ... 71
DAFTAR PUSTAKA ... 72
DAFTAR TABEL
Halaman
1. Standar minyak sawit merah ... 13
2. Energi aktivasi pada tahap-tahap oksidasi lipida ... 15
3. Karakteristik NDRPO sebelum proses oksidasi ... 39
4. Komposisi asam lemak NDRPO sebelum proses oksidasi ... 43
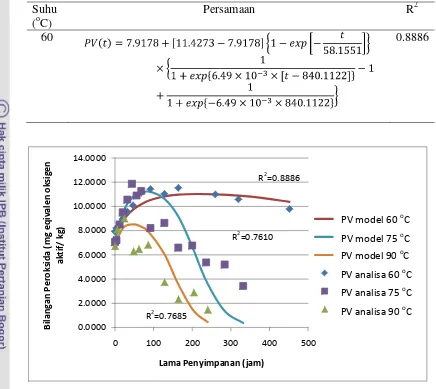
5. Persamaan matematika perubahan bilangan peroksida selama oksidasi pada suhu 60 oC, 75 oC, 90 oC ... 46
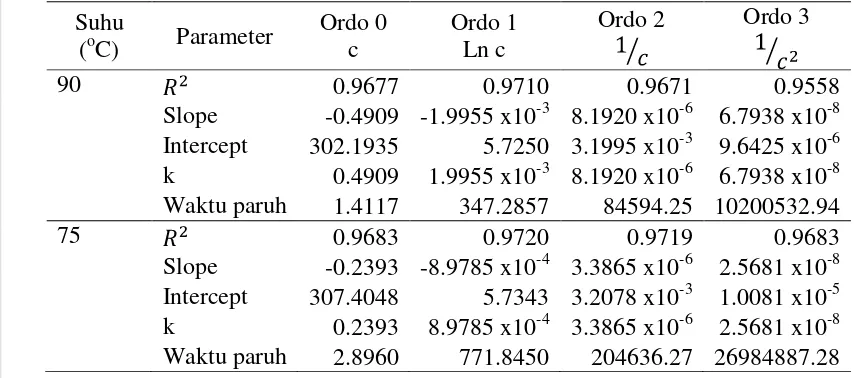
6. Perhitungan ordo reaksi degradasi β-karotena pada suhu 90, 75, 60 oC . 49 7. Perhitungan ordo reaksi pembentukan asam lemak bebas pada suhu 90, 75, 60 oC ... 52
8. Nilai konstanta laju reaksi degradasi asam lemak selama oksidasi pada suhu 90, 75, 60 oC ... 56
9. Nilai energi aktivasi dan persamaan Arrhenius perubahan komposisi asam lemak selama oksidasi pada suhu 90, 75, 60 oC ... 58
10.Akar ciri, dan proporsi variasi komponen PCA ... 59
11.Matrik komponen parameter oksidasi ... 59
12.Matrik komponen parameter oksidasi terrotasi ... 60
13.Perbandingan karakter perubahan peroksida pada NDRPO dan produk minyak bunga matahari... 63
14.Nilai korelasi antar parameter oksidasi selama penyimpanan ... 64
15.Nilai korelasi antar konstanta kecepatan reaksi parameter oksidasi selama penyimpanan ... 65
16.Perbandingan karakteristik oksidasi β-karotena dalam berbagai kondisi .. 66
DAFTAR GAMBAR
Halaman
1. Pohon kelapa sawit beserta buahnya ... 5
2. Penampang melintang buah kelapa sawit ... 6
3. Proses produksi CPO secara umum ... 7
4. Proses pemurnian minyak sawit secara fisik dan kimia ... 10
5. Karakterisasi oksidasi asam oleat selama pemanasan pada suhu Δ333 K, o348 K, □363 K ... 18
6. Karakterisasi konsentrasi hidroperoksida dalam oksidasi asam oleat selama pemanasan pada suhu Δ333 K, o348 K, □363 K ... 18
7. Struktur PUFA ... 22
8. Mekanisme pembentukan MDA ... 23
9. Reaksi hidrolisis trigliserida oleh panas yang menghasilkan asam lemak bebas ... 25
10.Alur metode penelitian ... 31
11.Pembentukan Peroksida pada kondisi isothermal ... 44
12.Proses penguraian peroksida pada kondisi isothermal ... 45
13.Model perubahan bilangan peroksida selama oksidasi pada suhu 60, 75, 90 oC ... 47
14.Model degradasi β-karotena pada suhu 60, 75, 90 oC ... 48
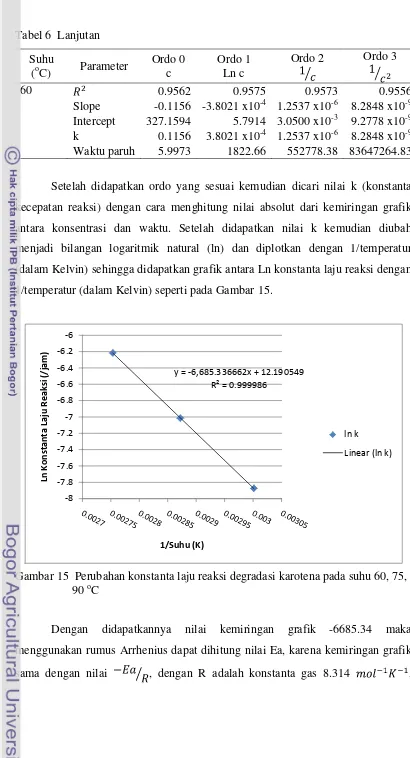
15.Perubahan konstanta laju reaksi degradasi karotena pada suhu 60, 75, 90 oC 50 16.Model pembentukan asam lemak bebas pada suhu 60, 75, 90 oC ... 53
17.Perubahan konstanta laju reaksi pembentukan asam lemak bebas pada suhu 60, 75, 90 oC ... 53
18.Model degradasi asam lemak C16:0 pada suhu 60, 75, 90 oC... 54
19.Model degradasi asam lemak C18:0 pada suhu 60, 75, 90 oC... 55
20.Model degradasi asam lemak C18:1 cis pada suhu 60, 75, 90 oC ... 55
DAFTAR LAMPIRAN
Halaman
1. Hasil uji bilangan peroksida ... 77
2. Hasil uji asam lemak bebas ... 78
3. Hasil uji β-karotena ... 79
4. Hasil uji asam lemak C8 ... 80
5. Hasil uji asam lemak C10 ... 81
6. Hasil uji asam lemak C12 ... 82
7. Hasil uji asam lemak C14 ... 83
8. Hasil uji asam lemak C15 ... 84
9. Hasil uji asam lemak C16:0 ... 85
10.Hasil uji asam lemak C16:1 ... 86
11.Hasil uji asam lemak C18:0 ... 87
12.Hasil uji asam lemak C18:1 cis ... 87
13.Hasil uji asam lemak C18:2 ... 88
14.Hasil uji asam lemak C18:3 ... 89
15.Hasil uji asam lemak C20:0 ... 90
16.Hasil uji asam lemak C20:1 ... 91
17.Hasil uji asam lemak C22 ... 92
PENDAHULUAN
Latar Belakang
Kebutuhan dunia terhadap minyak dan lemak nabati dunia mengalami peningkatan setiap tahun. Produksi minyak dan lemak nabati dunia pada tahun 2006 mencapai 123 juta ton dan diprediksi meningkat menjadi 142 juta ton pada 2010. Dari produksi minyak dan nabati tersebut, sebanyak 45.5 juta ton berasal dari minyak kelapa sawit, dan 22.3 juta ton (46%) berasal dari Indonesia. Pada tahun 2009 Indonesia merupakan produsen minyak sawit terbesar dunia dengan produksi 20 juta ton (Anonim 2010).
Menurut standar WHO (World Health Organization), konsumsi minimal minyak dan lemak per kapita adalah 12 kg/tahun. Kebutuhan konsumsi minyak dan lemak Indonesia sebesar 13 kg/tahun pada tahun 2006, dan meningkat 1% setiap tahunnya (Goi 2008). Menurut Elisabeth (2009) konsumsi CPO dunia selama 2009 diperkirakan meningkat 5.5% dari 42.57 juta ton pada 2008 menjadi 44.90 juta ton tahun 2009. Peningkatan produksi dan konsumsi lemak dan minyak dan CPO ini perlu didukung oleh pengolahan minyak sawit untuk menghasilkan komoditas berbasis sawit yang beraneka ragam, termasuk minyak makan.
Minyak makan adalah minyak yang dikonsumsi langsung dengan minimum pengolahan lebih lanjut. Sebagai bahan baku utama minyak makan, minyak sawit memiliki banyak keunggulan dibanding bahan baku lainnya. Keunggulan utama minyak sawit adalah kandungan mikronutriennya yang tinggi terutama
β-karotena. Tingginya kandungan β-karotena tersebut menyebabkan minyak sawit berwarna merah sehingga sering disebut minyak sawit merah atau disebut dengan
red palm oil (RPO).
Crude Palm Oil (CPO) adalah bahan baku RPO. Kandungan α- dan
β-karotena dalam minyak sawit kasar (Crude Palm Oil, CPO) sebesar 500-1500 ppm adalah yang tertinggi dibandingkan sumber lainnya (Goh et al. 1985). Untuk menghasilkan minyak sawit merah yang tetap memiliki kandungan β-karotena yang tinggi diperlukan suatu proses yang dapat mempertahankan kandungan
Saat ini Malaysia telah berhasil memproduksi RPO kaya karotena dengan merek dagang “Carotino” yang dikembangkan oleh PORIM (Palm Oil Research
Institute of Malaysia) dengan mengadopsi teknologi distilasi molekuler. Akan
tetapi, produk ini menjadi sangat mahal untuk penggunaan secara umum (Ooi et al. 1996; Bonnie dan Choo 2000).
Proses pengolahan minyak sawit menjadi minyak makan memiliki beberapa tahapan pemurnian, yaitu proses degumming, deasidifikasi, deodorisasi, dan fraksinasi. Widarta (2008) dalam penelitiannya telah melakukan proses degumming dan deasidifikasi yang dapat menghasilkan NRPO (Netralized Red
Palm Oil) dengan kadar β-karotena 464.96±11.92 dari CPO dengan β-karotena
460.13±13.58 ppm. Setelah didapatkan NRPO kemudian dilakukan proses deodorisasi, Riyadi (2009) melakukan proses deodorisasi pada suhu 140 oC selama 1 jam dapat menghasilkan NDRPO (Neutralized Deodorized Red Palm Oil) dengan kadar β-karotena 375.33 ppm dari bahan baku NRPO 525.42 ppm.
NDRPO untuk menjadi menjadi minyak makan yang siap konsumsi memerlukan proses fraksinasi untuk memisahkan fraksi cair dari fraksi padatnya yang akan digunakan sebagai minyak makan. Selama proses penyimpanan dan pengolahan, NDRPO akan terpapar oleh panas yang akan menyebabkan kerusakan pada minyak. Perkins (1967) mengungkapkan bahwa selama pemanasan dalam kondisi adanya oksigen akan mengakibatkan rusaknya asam-asam lemak tidak jenuh yang terdapat dalam minyak.
Pada penelitian Takahashi et al. (2000) dalam studi kinetik oksidasi asam oleat diungkapkan bahwa selama oksidasi, asam oleat berubah menjadi produk oksidasi. Dalam penelitian ini diketahui bahwa penurunan asam oleat ini mengikuti fungsi eksponensial. Dengan peningkatan suhu reaksi, kecepatan oksidasi asam oleat akan meningkat.
Dalam penelitian Takahashi et al. (2001) disebutkan bahwa oksidasi
β-karotena dalam asam olein membentuk radikal peroksil yang kemudian akan memacu terjadinya reaksi oksidasi berantai. Dalam penelitian tersebut kurva
deomposisi β-karotena didapati berbentuk sigmoidal. Dengan peningkatan suhu
Menurut Wrolstad (2005) disebutkan bahwa selama oksidasi lipida terbentuk peroksida yang diinisiasi oleh panas. Pada tingkat suhu yang berbeda menurut Aragao et al. (2008) karakteristik perubahan peroksida yang ada dalam lipida selama oksidasi akan berbeda.
Penelitian ini memiliki tujuan umum untuk mendapatkan kinetika parameter oksidasi NDRPO selama terpapar panas. Penelitian ini dilakukan dalam tiga tahap. Tahap pertama yaitu karakterisasi awal pada NDRPO. Tahap ini bertujuan untuk mendapatkan informasi mengenai karakter NDRPO sebelum dioksidasi. Dengan diketahuinya karakter tersebut dapat diketahui kemungkinan prilaku NDRPO selama oksidasi. Tahap kedua yaitu oksidasi NDRPO yang setelah diolah datanya akan menghasilkan model kinetika parameter oksidasi NDRPO. Sedangkan tahap ketiga adalah analisa koreasi antar parameter oksidasi untuk mendapatkan karakteristik oksidasi NDRPO.
Tujuan Penelitian
Penelitian ini memiliki tujuan umum untuk mendapatkan kinetika parameter oksidasi NDRPO selama terpapar panas. Penelitian ini dilakukan dalam tiga tahap. Tahap pertama yaitu karakterisasi awal pada NDRPO. Tahap ini bertujuan untuk mendapatkan informasi mengenai karakter NDRPO sebelum dioksidasi
Manfaat Penelitian
Dengan mengetahui model stabilitas oksidasi NDRPO didapatkan manfaat berupa diketahuinya upaya penyimpanan NDRPO yang tepat.
Hipotesis
TINJAUAN PUSTAKA
Kelapa Sawit
Kelapa sawit (Elaeis guineensis) merupakan tumbuhan hutan hujan tropis di daerah Afrika Barat. Tumbuh terutama di Kamerun, Pantai Gading, Libera, Nigeria, Sirea Lione, Togo, Angola, dan Kongo (Poku 2002). Kelapa sawit termasuk dalam kingdom Plantae, divisi Magnoliophyta, kelas liliopsida, ordo arecales, keluarga arecaceae, dan genus Elaeis. Ditemukan oleh Nicholaas Jacquin pada tahun 1763, sehingga tanaman kelapa sawit diberi nama Elaeis guineensis Jacq (Anonim 2008). Gambar pohon dan dan buah sawit dapat dilihat pada Gambar 1.
Gambar 1 Pohon kelapa sawit beserta buahnya (Anonim 2009)
Indonesia (Gunstone 2002). Kelapa sawit terdiri atas empat varietas, yaitu: 1) Varietas Macro carya, tebal tempurung 5 mm, 2) Varietas Dura, tebal tempurung 2 - 8 mm, 3) Varietas Tenera, tebal tempurung 0.5 – 4 mm, 4) Varietas Pisifera, bagian tempurung tipis (Fauzi et al. 2006).
Buah sawit umumnya memiliki panjang 2 hingga 5 cm dan berat 3 hingga 30 gram, berwarna ungu hitam pada saat muda, kemudian menjadi berwarna kuning merah pada saat tua dan matang (Muchtadi 1992). Daging buah berwarna putih kuning ketika masih muda dan berwarna jingga setelah matang (Ketaren 2005). Penampang melintang dan membujur buah kelapa sawit dapat dilihat pada Gambar 2.
Bagian-bagian buah kelapa sawit terdiri dari : 1.Perikarp, terdiri dari :
a. Epikarpium, yaitu kulit buah yang keras dan licin
b. Mesokarpium, yaitu bagian buah yang berserabut dan mengandung minyak dengan rendemen paling tinggi, menghasilkan minyak sawit kasar/ Crude Palm Oil (CPO)
2.Biji, terdiri dari :
a. Endokarpium (kulit biji = tempurung), berwarna hitam dan keras b. Endosperm (kernel = daging biji) berwarna putih yang menghasilkan
minyak inti sawit/ Palm Kernel Oil (PKO)
Gambar 2 Penampang melintang buah kelapa sawit (Anonim 2006)
Pengolahan Buah Sawit menjadi CPO
ekstraksi minyak dan klarifikasi (Basiron 2005) seperti yang tampak pada Gambar 3.
Penerimaan TBS
TBS (Tandan Buah Segar) ditangani dengan baik untuk menghindari kerusakan pada buah yang dapat menyebabkan rendahnya kualitas minyak yang dihasilkan (Basiron 2005).
Gambar 3 Proses produksi CPO secara umum (Basiron 2005) TBS
Penanganan TBS
Perebusan
Perontokan
Pelumatan
Ekstraksi minyak
Perebusan
Perebusan dilakukan menggunakan uap pada tekanan 3 kg/cm2 pada suhu 143 oC selama 1 jam. Proses ini dilakukan untuk mencegah naiknya asam lemak bebas karena reaksi enzimatik, mempermudah perontokan buah, dan mengkondisikan inti sawit untuk meminimalkan pecahnya inti sawit selama pengolahan berikutnya (Basiron 2005).
Perontokan
Tujuan dari perontokan adalah memisahkan buah yang sudah direbus dari tandannya. Perontokan dilakukan dengan dua cara yaitu penggoyangan dengan cepat dan pemukulan (Basiron 2005).
Pelumatan
Pelumatan dilakukan untuk memanaskan buah kembali, memisahkan perikrap dari inti, dan memecah sel minyak sebelum mengalami ekstraksi. Kondisi terbaik pelumatan ada pada suhu 95-100 oC selama 20 menit (Basiron 2005).
Ekstraksi minyak
Ekstraksi minyak biasanya dilakukan dengan mesin pres akan menghasilkan dua kelompok produk yaitu (1) campuran antara air, minyak dan padatan, (2) cake yang mengandung serat dan inti (Basiron 2005).
Klarifikasi
Selanjutnya didinginkan sebelum disimpan dalam tangki penyimpan (Basiron 2005).
Pemurnian CPO
CPO yang diekstrak secara komersial dari TBS walaupun dalam jumlah kecil mengandung komponen dan pengotor yang tidak diinginkan. Komponen ini termasuk serat mesokrap, kelembaban, bahan-bahan tidak larut, asam lemak bebas, phospholipida, logam, produk oksidasi, dan bahan-bahan yang memiliki bau yang kuat. Sehingga diperlukan proses pemurnian sebelum digunakan (Basiron 2005).
Pemurnian CPO dapat dilakukan dengan dua metode yaitu pemurnian fisik dan pemurnian kimiawi. Perbedaan utama dua jenis pemurnian ini ada pada cara menghilangkan asam lemak bebas. Pemurnian fisik merupakan metode pemurnian yang lebih popular karena lebih efektif dan efisien. Akan tetapi kedua metode dapat menghasilkan refined bleached deodorized palm oil (RBDPO) yang memiliki kualitas dan stabilitas yang diinginkan. Proses pemurnian minyak sawit tersebut dapat diamati pada Gambar 4.
Pretreatment
Pretreatment disebut juga degumming awal CPO. Pretreatment dilakukan
dengan penggunaan asam fosfat dan diikuti oleh pembersihan dengan metode penyerapan menggunakan bleaching earth. Mula-mula pada CPO ditambahkan asam fosfat (konsentrasi 80-85%) dengan perbandingan 0.05-0.2% (dari umpan minyak). Kemudian dipanaskan hingga 90-110 oC, dengan waktu tinggal 15-30 menit sebelum melewati bleacher di mana bleaching earth ditambahkan.
Bleaching earth ditambahkan pada konsentrasi 0.8-2.0%, tergantung pada kualitas
minyak mentah (Basiron 2005).
proses degumming. Warna produk hasil pretreatment tidak menjadi hal yang kritis, akan tetapi kemampuan bleaching earth sebahai bahan penyerap yang lebih penting. Pemisahan asam fosfat secara sempurna sangat penting, karena keberadaan asam fosfat dapat menyebabkan meningkatnya asam lemak bebas minyak yang dihasilkan. Sering kali untuk membantu mengurangi kadar asam fosfat ditambahkan kalsium karbonat (Basiron 2005).
Gambar 4 Proses pemurnian minyak sawit secara fisik dan kimia (Basiron 2005)
Bleaching dilakukan pada kondisi vakum 20-25 mmHg pada suhu 95 hingga
110 oC dengan waktu tinggal 30 hingga 45 menit. Slurry yang mengandung minyak dan bleaching earth kemudian disaring untuk memisahkan minyak yang jernih dan berwarna oranye terang. Untuk alasan kualitas, biasanya minyak dilewatkan pada barisan kantong penyaring untuk menjebak partikel bleaching
keberadaan sisa bleaching earth akan mengurangi stabilitas oksidasi RBDPO yang dihasilkan (Basiron 2005).
Deodorisasi
Minyak yang telah mengalami bleaching kemudian siap dilakukan deasidifikasi dan deodorisasi. Minyak mula-mula dideaerasi kemudian dipanaskan pada suhu 240-270 oC pada tekanan 2-5 mm Hg di dalam alat heat exchanger
eksternal, sebelum dimasukkan ke dalam deodoriser. Biasanya digunakan cairan
thermal sebagai medium pemanas. Akan tetapi untuk menghindari terjadinya
kontaminasi, biasanya digunakan uap superheated dengan tekanan tinggi. Penggunaan suhu di atas 270 oC harus dihindari untuk meminimalkan kehilangan minyak, tokoferol, tokotrienol, dan kemungkinan terjadinya isomerisasi dan reaksi thermokimia yang tidak diinginkan. Pada kondisi tersebut dan dengan penggunaan uap sebagai pelecut, asam lemak bebas yang masih ada dalam minyak hasil penyaringan akan teruapkan bersama bahan bahan berbau tajam dan produk oksidasi seperti aldehid dan keton. Produk oksidasi tersebut dapat menimbulkan rasa dan aroma yang tidak diinginkan dalam minyak. Pada waktu yang sama karotenoid yang tersisa akan terdekomposisi oleh panas, dan akan menghasilkan RBDPO yang berwarna terang dan tidak berasa (Basiron 2005).
Metode kedua adalah refinasi kimiawi, atau yang disebut dengan refinasi kaustik. Proses ini dibagi menjadi tiga tahap. Tahap pertama adalah pengkondisian gum, pada proses ini minyak dipanaskan hingga 80-90 oC, dan ditambahkan asam fosfat untuk mengendapkan fosfolipid. Kemudian ditambahkan laurutan kaustik soda untuk direaksikan dengan asam lemak bebas sehingga membentuk sabun. Sabun tersebut kemudian dibuang dengan cara sentrifugasi. Minyak netral yang dihasilkan kemudian dibilas dengan air panas untuk membuang sabun yang masih tersisa. Tahap kedua yang dilakukan adalah
bleaching dan filtrasi. Pada proses ini hamper mirip dengan yang terjadi pada
Produksi NDRPO
NDRPO (Neutralized Deodorized Palm Oil) merupakan bahan baku pembuatan minyak sawit merah sebagai minyak makan. Untuk menghasilkan
NDRPO dengan kadar β-karotene yang tetap tinggi dilakukan proses pemurnian yang dilakukan dalam kondisi yang dapat menjaga kandungan β-karotene di dalam minyak. Pada penelitian sebelumnya sudah dilakukan proses produksi NDRPO dari CPO dengan tiga tahap.
Degumming
Proses degumming dilakukan untuk memisahkan getah tanpa mereduksi asam lemak yang ada di minyak. proses degumming menurut Widarta (2008) dilakukan dengan memasukkan CPO sebanyak 60 kg ke dalam reactor kemudian dipanaskan mencapai 80 oC, kemudian ditambahkan asam fosfat 85% sebanyak 0.15% dari berat CPO yang digunakan. Minyak kemudian diaduk pada kecepatan 56 RPM selama 15 menit.
Deasidifikasi
Deasidifikasi dilakukan untuk memisahkan asam lemak bebas di dalam minyak. Menurut Widarta (2008) proses deadifikasi untuk menghasilkan NRPO (Neutralized Red Palm Oil) dilakukan dengan menambahkan NaOH 16 oBe berlebih 17.5 % dengan pengadukan selama 26 menit pada suhu 61 oC. Setelah proses deasidifikasi selesai sabun dipisahkan dengan sentrifugasi. Minyak kemudian dicuci dengan air panas pada suhu 5-8 oC di atas suhu minyak. proses pencucian ini bertujuan untuk membantu menghilangkan sabun yang ada dalam minyak. produk kemudian disentrifugasi lagi untuk memisahkan air yang ada.
Pada kondisi degumming dan deadifikasi tersebut dapat diperoleh NRPO dengan reduksi asam lemak bebas sebanyak 96.35% dan recovery β-karotena 87.30% dan rendemen minyak 90.16% (Widarta 2008).
Deodorisasi
dengan menghomogenkan NRPO dengan cara mensirkulasikan NRPO di dalam tangki deodoriser selama 10 menit pada suhu 46±2 oC. selanjutnya proses deodoriasasi dilakukan pada suhu 140 oC pada kondisi vakum 20 mmHg selama 1 jam. Setelah proses deodoriasi selesai, produk kemudian didinginkan hingga bersuhu 60 oC pada kondisi vakum. Setelah dingin NDRPO siap digunakan untuk aplikasi atau proses berikutnya (Riyadi 2009).
Produk Minyak Sawit Merah Komersial
Pada saat ini telah tersedia produk minyak sawit merah komersial yang diproduksi oleh Carotino Sdn.Bhd Malaysia dengan merek dagang “Carotino”. Carotino yang diproduksi secara destilasi molekuler dapat menghasilkan minyak sawit merah dengan kandungan β-karotena yang tinggi seperti pada Tabel 1.
Tabel 1 Standar minyak sawit merah
Parameter Nilai
Asam lemak bebas Maksimum 0.1% Kadar air dan pengotor Maksimum 0.1%
β-karotena 500 ppm
Tokoferol dan tokotrienol 800 ppm Carotino (2010)
Oksidasi Lipida
Kerusakan minyak umumnya disebabkan oleh oksidasi. Secara sederhana, oksidasi lemak dibagi menjadi 3 tahap yaitu inisiasi, propagasi, dan terminasi, di bawah ini secara sederhana Schaich (2005) menjelaskan langkah-langkah oksidasi lipida.
Inisiasi
spontan. Secara thermodinamik, oksigen tidak dapat bereaksi secara langsung dengan ikatan ganda karena spin state nya berbeda (persamaan 2). Ground state
oksigen adalah state triplet (dua elektron bebas di orbital terpisah yang memiliki arah perputaran yang sama, net positiveangular momentum). Mekanika kuantum menyatakan bahwa spin angular momentum dapat terpelihara dalam reaksi, sehingga triplet tidak dapat invert (membalik putaran) menjadi singlet state. Reaksi akan terjadi bila ikatan ganda tereksitasi pada triplet state, yang membutuhkan energi yang cukup (Ea=35-65 kkal/mol). Sehingga tidak terjadi reaksi secara langsung seperti yang terjadi pada persamaan 2 (Schaich 2005).
(1)
(2)
Untuk mengatasi hambatan spin ini, inisiator atau katalis dibutuhkan untuk memulai oksidasi lipida dengan menghilangkan elektron dari lipida atau oksigen atau dengan mengubah perputaran elektron oksigen. Karena hanya katalis dalam jumlah sedikit yang dibutuhkan, banyak kejadian yang terlihat seperti spontan atau tidak terkatalisasi sebenarnya didorong oleh kontaminasi atau kondisi yang tidak terdeteksi atau tidak dipertimbangkan. Selain itu, di sebagian besar pangan, sistem biologi, dan percobaan laboratorium, dikatakan bahwa multiple catalys dan inisiator selalu ada dan bekerja (Schaich 2005).
Suhu tinggi memiliki energi yang cukup untuk memutus ikatan kovalen C-C atau C-H dalam rantai asil yang akan memulai reaksi oksidasi berantai. Suhu sedang akan memiliki energi yang lebih rendah, sehingga pemutusan ikatan O-O pada bagian ROOH atau LOOH akan dilakukan oleh pereaksi lain seperti logam,
lipoxigenase, atau photosensitizer. RO●, LO●, dan ●OH yang akan menarik
hidrogen dari lipid yang lain dan akan membentuk L● dan akan memulai reaksi berantai. Seperti yang ditunjukkan energi aktivasi dari setiap langkah oksidasi lipid, dekomposisi LOOH dan turunannya akan berkontribusi pada propagasi adalah pengaruh utama katalitik utama dari panas. Pengaruh peningkatan dekomposisi LOOH diperkuat dengan peningkatan kecepatan abstraksi H
oksidasi setiap peningkatan suhu 10 oC. Tingkat energi aktivasi pada tiap tahap oksidasi dapat dilihat pada Tabel 2 (Schaich 2005).
Tabel 2 Energi aktivasi pada tahap-tahap oksidasi lipida Reaksi Energi aktivasi (Ea)
L●+O2 0
kp(LOO●+LH) ~5-15
kt(2ROO●) ~4
kt(2R●) 5
kt(R●+ROO●) 1
Schaich (2005)
Propagasi
Berdasarkan reaksi berantai yang disebutkan dalam persamaan 3-9, menunjukkan bahwa propagasi dilakukan secara langsung dan sepenuhnya melalui abstraksi hidrogen. Abstraksi H oleh LOO● terjadi sangat lambat (k=36-62 L mol-1 detik-1) dan terjadi dengan selektif, abstraksi hanya terjadi pada hidrogen dengan energi ikatan yang rendah (seperti pada –CH2-, tiol, dan fenol) sehingga, ada cukup waktu untuk mencari jalur reaksi alternatif untuk berkompetisi dan mengubah arah oksidasi yang kemudian menghasilkan produk yang berbeda nyata dengan kecepatan yang berbeda dan memiliki pengaruh nyata pada komposisi produk akhir. (Schaich 2005).
Reaksi berantai radikal bebas
(3)
(4) (5) Dan seterusnya
LnOOH (Schaich 2005)
Radikal bebas pemutus rantai
(Logam pengoksida) (7)
(panas dan uv) (8)
(9) (Schaich 2005)
Mekanisme yang sangat beragam dapat terjadi. Antara lain: 1. Propagasi berantai oleh LOO●
a. Abstraksi H
b. Rearrangement / cyclization
c. Ikatan silang
d. Disproportionation
e. β-scission
f. rekombinasi g. transfer e
-2. Propagasi oleh radikal alkoxyl, LO● a. Abstraksi H
b. Rearrangement / cyclization
c. Penambahan LO● pada ikatan ganda 3. Propagasi oleh LOOH
(Schaich 2005)
Terminasi
terminasi mengarah pada tiap-tiap radikal, bukan pada reaksi keseluruhan (Schaich 2005).
Terminasi radikal bebas membentuk produk non radikal melalui 4 mekanisme utama:
1. Rekombinasi radikal
(10)
2. Reaksi scission (salah satu produknya adalah malonaldehid yang dapat diuji dengan uji TBA)
3. Co Oksidation dengan molekul non lipida
4. Eliminasi
(11)
(Schaich 2005)
Faktor Yang Mempengaruhi Kecepatan Oksidsi Suhu
Peningkatan suhu menyebabkan reduksi yang hebat pada lama periode induksi. Kecepatan oksidasi meningkat secara exponensial dengan peningkatan suhu (Gordon 2004).
Pada penelitian Takahashi et al. (2000) diungkapkan bahwa selama proses oksidasi konsentrasi asam oleat pada semua kondisi reaksi berkurang dengan pasti. Bentuk kurva yang dihasilkan adalah bentuk sigmoidal, yang menjadi bentuk oksidasi komponen organik. Proses oksidasi juga meningkat dengan cepat saat suhu reaksi dinaikkan seperti yang ditunjukkan pada Gambar 5.
Pada data yang diperoleh Takahashi et al. (2000) juga diungkapkan bahwa konsentrasi hidroperoksida (LOOH) pada semua kondisi mula-mula meningkat, kemudian menurun. Hal ini disebabkan oleh kecepatan dekomposisi hidroperoksida menjadi lebih tinggi dibanding dengan kecepatan
lainnya)
dan
alkana,
alkohol,
keton,
(aldehid,
radikal
-non
produk
2 1→
•
•
ts ts k kLOO
LO
radikal - non monomer produk , polimer 3 2 1 → • • • + • • • t t t k k k n n n n n n OO L O L L OO L O L Lpembentukannya. Puncak menjadi lebih tajam, dan singkat bila suhu dinaikkan seperti yang ditunjukkan pada Gambar 6.
Gambar 5 Karakterisasi oksidasi asam oleat selama pemanasan pada suhu
Δ333 K, o348 K, □363 K (Takahashi et al. 2000)
Gambar 6 Karakterisasi konsentrasi hidroperoksida dalam oksidasi asam oleat selama pemanasan pada suhu Δ333 K, О348 K, □363 K
(Takahashi et al. 2000) Komposisi asam lemak
kecepatan oksidasi dengan bertambahnya ikatan ganda dalam asam lemak secara kasar sebanding dengan jumlah gugus metilena antara pasangan ikatan ganda, sehingga kecepatan oksidasi 1:18, 18:3 dan 20:4 secara kasar adalah 1:2:3 (Gordon 2004).
Selain meningkatkan kecepatan oksidasi, keberadaan PUFA akan menghasilkan senyawa volatil pada saat terjadi oksidasi. Umumnya terjadi pada asam lemak yang memiliki struktur n-3 seperti asam linolenat yang akan menghasilkan zat volatil pada oksidasi dan akan menyebabkan off flavor yang lebih lemah dibanding zat volatil yang dihasilkan oleh asam lemak n-6 seperti asam linoleat (Gordon 2004).
Oksidasi asam lemak tidak jenuh pada khususnya asam oleat termasuk mekanisme reaksi berantai autokatalitik radikal bebas, mirip dengan mekanisme oksidasi hidrokarbon. Mekanisme ini terdiri atas runtutan inisiasi (I), propagasi (P) dan terminasi (T) yang dapat diamati pada persamaan 12-15.
(12)
(13)
(14)
(15)
Pada persamaan tersebut LH adalah asam lemak, L• dan LO2 adalah turunan asam lemak dengan inti C dan radikal peroksil. Hidroperoksida yang dihasilkan pada persamaan 14 diketahui terdekomposisi menjadi radikal bebas yang akan berperan dalam reaksi inisiasi. Sehingga kecepatan inisiasi sebanding dengan jumlah peroksida yang diproduksi oleh oksidasi. Hidroperoksida tersebut beraksi dengan oksigen dan akan terurai seperti yang diamati pada persamaan 23. Hidroperoksida juga diketahui dapat terurai melalui reaksi bimolekuler seperti yang diamati pada persamaan 24. LO• di sini adalah turunan asam lemak radikal
alkoksil. LO• yang terbentuk pada persamaan 23 diketahui beraksi dengan LH untuk membentuk alkohol (LOH) sesuai dengan persamaan 16
Produk sekunder seperti alkohol tersebut dapat teroksidasi menjadi keton atau asam karboksilat seperti digambarkan pada persamaan 17.
(17)
Karotenoid
CPO mengandung 500-700 ppm karotena yang sebagian besar ada dalam bentuk α dan β-karotena, sebagai perkursor vitamin A. Karotena ini apabila tidak diperlakukan khusus selama proses pemurnian minyak akan rusak dalam proses deodorisasi untuk memperoleh warna yang diinginkan. Dalam CPO keberadaan karotenoid ini memberikan perlindungan terhadap oksidasi melalui mekanisme di mana senyawa ini akan teroksidasi terlebih dahulu sebelum trigliserida (Basiron 2005).
Tokoferol
CPO mengandung 600-1000 ppm tokoferol dan tokotrienol. Selama pengolahan konvensional RPO (Refined Palm Oil) akan mempertahankan kadar tokoferol dan tokotrienol hingga 50%. Tokoferol dan tokotrienol merupakan antioksidan dan dapat melindungi minyak dari oksidasi. Kandungan α-tokoferol
dan γ tokotrienol dalam CPO merupakan mayoritas tokoferol dan tokotrienol yang
terdapat pada CPO (Chow 2001).
Vitamin E merupakan antioksidan pemutus rantai yang mencegah propagasi rekasi radikal bebas. Vitamin ini berfungsi sebagai pengusir radikal peroksil dan khususnya melindungi poly unsaturated fatty acid (PUFA) (yang disingkat RH). Gugus fenolik hidroksil tokoferol bereaksi dengan radikal peroksil oraganik membentuk hidroperoksida organik dan tokoferol radikal (Vit E-O•) (Chow 2001).
Radikal tokoferol dapat mengalami berbagai jenis perubahan antara lain: 1. Direduksi oleh antioksidan lain menjadi tokoferol
2. Bereaksi dengan radikal tokoferol lainnya membentuk produk non reaktif seperti dimer tokoferol
3. Mengalami oksidasi lanjutan menjadi quinine tokoferil 4. Mejadi prooksidan dan mengoksidasi lemak yang lain.
Tidak seperti tokoferol bebas, ester tokoferol sangat lebih stabil terhadap oksidasi, dan tidak berfungsi sebagai antioksidan dalam kondisi in vitro (Chow 2001).
Pembentukan dan Degradasi Peroksida Selama Oksidasi Lipida
Bila ada initiator seperti panas, cahaya, atau ion logam, lemak tidek jenuh (LH) akan teroksidais membentuk radikal karbon dengan pusat alkol (L•):
H L
LH initiator → •+ (20)
Radikal ini akan bereaksi dengan cepat dengan oksigen molekuler membentuk radikal peroksil yang tidak stabil (LOO•),
•
→
+
•
O
LOO
L
2 (21)Radikal ini dapat mengabstraksi atom hidrogen dari molekul lipid lainnya untuk membentuk hidroperoxida (LOOH) dan radikal baru:
• + → +
• LH LOOH L
LOO (Wrolstad et al. 2005). (22)
Proses ini terus menerus menghasilkan radikal bebas lipid. Pembentukan produk nonradikal dihasilkan dari kombinasi dua radikal dapat menghentikan reaksi berantai pada proses propagansi ini (Wrolstad et al. 2005).
Selama proses oksidasi peroksida juga terurai menjadi radikal bebas yang akan berperan dalam reaksi inisiasi, sehingga kecepatan reksi dalam tahap inisiasi akan proporsional dengan jumlah peroksida yang terbentuk selama oksidasi. Peroksida bila bereaksi dengan oksigen akan terurai seperti pada reaksi beikut
(23)
Peroksida juga dapat terurai melalui reaksi bimolekuler yang tahap reaksinya dapat dijelaskan sebagai berikut:
Pembentukan Dien Terkonjugasi Selama Oksidasi Lipida
Adanya dien terkonjugasi merupakan salah satu indikator terjadinya oksidasi. Dalam kimia organik, istilah dien terkonjugasi atau conjungated diene
(CD) berarti dua ikatan ganda yang dipisahkan oleh ikatan tunggal. Bentuk ini tidak biasa dalam PUFA, karena PUFA memiliki bentuk struktur divinyilmetana (tidak terkonjugasi). Sehingga bila ada bentuk CD (perpindahan ikatan ganda menjadi terkonjugasi) dalam lemak menandakan terjadinya autoksidasi pada sebagian asam lemak. struktur divinyilmetana menyebabkan PUFA rentan terhadap abstraksi hidrogen oleh serangan radikal bebas. PUFA menjadi
intermediate radikal bebas, di mana akan menyusun ulang ikatan ganda untuk
membentuk CD atau poliene (Gambar 7B). Serangan oksigen molekuler menghasilkan radikal lipid peroksil, dan dapat mengabstraksi atom hidrogen dari sebuah molekul lipid sebelahnya untuk membentuk lipid hidroperoksida (Gambar 7C) atau endoperoksida (Wrolstad et al. 2005).
Gambar 7 Struktur PUFA (A). PUFA, (B). PUFA non hidroperoksida dengan sebuah CD, (C) PUFA hidroperoksida dengan sebuah CD. R1 dan R2 adalah bagian alkil lainnya dari PUFA (Wrolstad et al. 2005)
CD merupakan chromophore yang sangat kuat menyerap UV yang dapat dideteksi secara spektrofotometrik. Bila ada dalam asam lemak, CD akan menunjukkan serapan UV pada panjang gelombang 233 nm dan memiliki puncak yang sangat berbeda. Billa PUFA yang mengandung tiga atau lebih ikatan ganda (seperti asam linolenat) mengalami oksidasi, konjugasi CD dapat semakin parah dengan melibatkan ikatan ganda lainnya sehingga menyebabkan terbentuknya
minyak tung) atau terbentuk selama proses pengolahan (seperti bleaching
menggunakan bleaching earth) (Wrolstad et al, 2005).
Pembentukan Malonaldehid Selama Oksidasi Lipida
Malonaldehid merupakan produk dari proses scission dari five-membered
cyclic hydroperoxyde yang hanya akan terbentuk dari asam lemak linolenat atau
yang lebih tinggi. Reaksi pada Gambar 8 menunjukkan hanya satu posisi isomer dari MDA, meskipun ada 4 kemungkinan struktur peroksida yang dapat terbentuk. Pembentukan MDA ini membutuhkan kondisi yang tepat untuk menghasilkan prekursor cyclic peroksida, seperti internal hidroperoksida, pelarut aprotik (tidak menyumbang proton), konsentrasi lipida rendah, dan tekanan oksigen yang terbatas. Dan juga kondisi pemecahan endoperoksida juga harus ada, biasanya berupa panas dan asam. Mekanisme pembentukan MDA dapat dilihat pada Gambar 8 (Shahidi dan Zhong 2005).
[image:40.595.111.491.548.709.2]Malonaldehid dapat terbentuk dari PUFA dengan ikatan ganda minimal tiga buah. Konsentrasi senyawa ini dapat dianalisa dengan mereaksikan dengan asam thiobarbiturat yang bila bereaksi dengan malonaldehid akan membentuk warna merah yang akan menyerap gelombang pada panjang 532-535 nm dengan penyerapan molar 27.5 satuan penyerapan/µmol. Akan tetapi reaksi yang terjadi tidak spesifik, dan reaksi yang menghasilkan berbagai jenis produk akan mempengaruhi penyerapan (Shahidi dan Zhong 2005).
Degradasi β-Karotena Selama Oksidasi Lipida
Asam lemak seperti asam oleat teroksidasi melalui mekanisme autokatalis
radikal bebas yang mirip dengan oksidasi β-karotena. Radikal peroksil yang memiliki tingkat reaktivitas yang tinggi cenderung bereaksi dengan β-karotena
dibanding dengan asam lemak karena struktur polyene dari β-karotena (Takahashi
et al. 2001).
Oksidasi β-karotena didahului oleh runtutan mekanisme yang dapat dijelaskan dengan persamaan berikut:
(25)
(26)
(27)
(28) (29) (30) (Takahashi et al. 2001)
Persamaan 25 adalah inisiasi, persamaan 26 dan 27 adalah propagasi, persamaan 28 adalah inisiasi sekunder, sedangkan persamaan 29 dan 30 adalah
proses terminasi. AH adalah β-karotena, A• adalah radikal berpusat C turunan β -karotena dan AO2• adalah radikal peroksil turunan dari β-karotena, AOOH adalah hidroperoksida.
(31)
(32)
(33)
(Takahashi et al. 2001)
Kerusakan β-karotena selama pengolahan dapat dinyatakan dengan persentase aktivitas provitamin A. Senyawa β-karotena dalam bentuk isomer trans
mempunyai aktivitas provitamin A 100 persen. Kehilangan aktivitas provitamin A dapat terjadi selama sterilisasi anaerob dan bervariasi dari 5 sampai 50 persen tergantung pada suhu, waktu dan bentuk karotenoid. Apabila terdapat oksigen, kerusakan karotenoid terjadi lebih banyak dan dipacu oleh cahaya, enzim dan
ko-oksidasi dengan hidroperoksida lemak. Oksidasi kimiawi β-karotena menghasilkan 5,6-epoksida yang kemudian berubah menjadi isomernya yaitu 5,8-epoksida yang merupakan mutakrom. Pemecahan lebih lanjut produk-produk oksidasi tersebut menghasilkan senyawa kompleks yang sejenis dengan oksidasi asam lemak. Senyawa hasil oksidasi tersebut tidak mempunyai aktivitas vitamin A lagi (Andarwulan dan Koswara 1992).
Pembentukan Asam Lemak Bebas Selama Oksidasi Lipida
Asam lemak bebas merupakan hasil pemutusan ikatan ester antara asam lemak dan gliserol yang membebaskan asam lemak (Wrolstad et al. 2005). Ilustrasi reaksi pembebasan asam lemak dari gliserolnya dapat diamati pada Gambar 9.
Gambar 9 Reaksi hidrolisis trigliserida oleh panas yang menghasilkan asam lemak bebas (Wrolstad et al. 2005).
Kinetika Reaksi Kimia
Kinetika reaksi kimia adalah pengukuran kecepatan reaksi dan analisis data percobaan untuk memperoleh koleksi informasi sistematik yang dapat menerangkan informasi kinetika reaksi tersebut. Informasi tersebut dapat digunakan untuk mengetahui
• Faktor yang mempengaruhi kecepatan reaksi
• Ketergantungan reaksi pada konsentrasi yang disebut dengan ordo reaksi Triasil gliserida gliserol
• Persamaan yang memberi informasi mengenai ketergantungan kecepatan terhadap konsentrasi produk yang akan mempengaruhi reaksi
• Pengaruh suhu pada kecepatan reaksi. Peningkatan suhu pada umumnya meningkatkan kecepatan reaksi. Informasi mengenai bagaimana tepatnya suhu mempengaruhi konstanta kecepatan reaksi akan memberikan informasi lebih dalam mengenai bagaimana reaksi dapat terjadi
(Wright, 2004)
Teori Tumbukan
Reaksi kimia dapat terjadi apabila terjadi tumbukan antara atom atau molekul yang akan bereaksi, reaksi tersebut memerlukan tiga syarat penting untuk dapat terjadi. Syarat pertama adalah molekul tersebut harus bertumbukan untuk dapat bereaksi, akan tetapi bila hanya terjadi tumbukan saja reaksi tersebut tidak pasti dapat terjadi. Syarat kedua adalah harus ada cukup energi untuk bereksi (energi aktivasi), tingkat energi yang harus dimiliki oleh molekul untuk bereaksi disebut dengan kondisi perpindahan (transition state), di mana bila molekul tersebut tidak dapat melewati kondisi perpindahan tersebut maka molekul yang tadinya akan bereaksi akan kembali memantul. Syarat terakhir adalah molekul tersebut harus memiliki posisi dan arah yang benar untuk dapat bereaksi. Agar reaksi dapat terjadi di antara dua molekul yang bertabrakan, mereka harus bertabrakan pada arah yang benar, dan memiliki energi yang cukup. Saat molekul bergerak saling mendekati, elektron mereka saling menolak. Untuk mengalahkan tolakan tersebut dibutuhkan energi (energi aktivasi), yang biasanya disediakan oleh panas sistem yang didapatkan dari energi transisi, getaran dan rotasi tiap molekul, dan juga dari cahaya dan medan listrik. Apabila ada cukup energi, tolakan tersebut dapat dikalahkan dan molekul tersebut dapat cukup dekat untuk melakukan ikatan (Wright 2004).
meningkatkan jumlah molekul yang memiliki energi lebih dari energi aktivasi sehingga kecepatan reaksi akan meningkat. Biasanya energi aktivasi didevinisikan sebagai energi dalam kilojoule yang dibutuhkan oleh reaktan sebanyak 1 mol untuk bereaksi (Wright 2004).
Ordo Reaksi
Ordo reaksi adalah jumlah eksponen konsentrasi reaktan dalam persamaan kecepatan.
Reaksi ordo 0
Karakteristik dari reaksi dengan ordo 0 adalah hubungan yang linier antara konsentrasi reaktan atau produk dengan waktu reaksi (t) (Toledo 2007).
Reaksi ordo 1
A0 adalah konsentrasi A pada t=0. Reaksi ordo 1 dicirikan dengan perubahan konsentrasi reaktan terhadap waktu berbentuk logaritmik. Sebagian besar reaksi yang terkait dalam pengolahan pangan adalah reaksi ordo 1 (Toledo 2007).
Reaksi ordo 2
terbentuk bila 1/A diplotkan dengan waktu. Reaksi biomolekular ordo 2 akan mengikuti persamaan kecepatan reaksi berikut:
Dimana A dan B adalah reaktan. Differential persamaan dapat diintregralkan dengan member B konstanta untuk mendapatkan:
k’ adalah konstanta kecepatan reaksi ordo pseudo 1: k’=kB
Reaksi biomolekuler ordo 2 akan menghasilkan plot yang serupa dengan plot reaktan dengan waktu pada ordo 1, akan tetapi konstanta kecepatan reaksi akan bervariasi pada berbagai konsentrasi rektan kedua (Toledo 2007).
Reaksi ordo n
Dengan integral
Evaluasi ordo reaksi adalah proses trial and error yang mengandung beberapa asumsi untuk n dan menentukan nilai mana yang akan sesuai dengan ordo n persamaan di atas (Toledo 2007).
Principal Component Analysis (PCA)
Principal component dari matrik korelasi atau kovarian
Matrik korelasi atau kovarian dapat digunakan dalam PCA. Isi dari matrik korelasi (R) adalah jumlah kuadrat dan jumlah produk dari nilai yang dinormalkan. Apabila digunakan matrik korelasi, maka komponen akan diubah menjadi akar ciri dari R. penggunaan matrik R untuk sebuah analisa memerlukan sebuah keputusan untuk menentukan apakah variable tersebut penting (Mazlum et al. 1999).
Principal component (PC) umumnya diubah dengan skala. Dalam arti lain,
Contohnya apabila satu variable memiliki variasi yang lebih tinggi dibanding yang lainnya, maka variabel tersebut akan mendominasi PC pertama dari matrik kovarian (Mazlum et al. 1999).
Identifikasi komponen-komponen penting
Setelah menghitung variasi (akar ciri) dan PC dari matrik korelasi, hal yang perlu dilakukan adalah mencari beberapa komponen pertama yang akan member proporsi besar pada total variasi. Apabila saat menganalisa matrik korelasi di mana jumlah akar ciri sama dengan jumlah variasi, disepakati bahwa akar ciri kurang dari 1 akan diabaikan (Mazlum et al. 1999).
Rotasi PC
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini berlangsung selama 9 bulan, mulai April 2009 hingga Desember 2009 bertempat di Laboratorium SEAFAST IPB. Penelitian dilakukan dengan 2 kali ulangan.
Bahan dan Alat
Bahan utama yang akan digunakan dalam penelitian ini adalah NDRPO yang diperoleh dari SEAFAST CENTER. Bahan-bahan lain yang digunakan adalah bahan kima yang dibutuhkan dalam analisa kadar tokoferol, kadar total β -karotena, kadar air, komposisi asam lemak, asam lemak bebas, uji nilai peroksida, TBA, dan kadar dien terkonjugasi. Alat-alat yang dibutuhkan dalam penelitian ini adalah gas kromatografi, spektrofotometer uv-vis, inkubator, dan alat-alat lainnya yang dibutuhkan dalam analisa kadar kadar tokoferol, kadar total karotena, kadar air, asam lemak bebas, komposisi asam lemak, uji nilai peroksida, TBA, dan kadar dien terkonjugasi.
Metode Penelitian
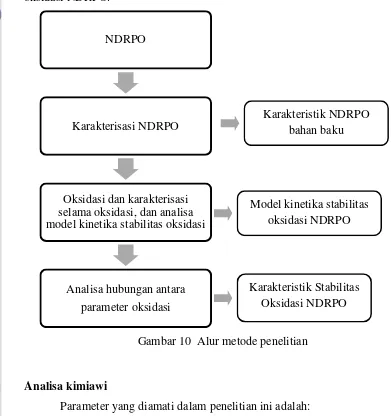
Metode percobaan terdiri atas tiga tahap yang tersaji dalam Gambar 10 yaitu tahap pertama dilakukan karakterisasi NDRPO. Produk NDRPO dikaraktersisasi sifat-sifat kimianya dengan analisa kadar tokoferol, kadar β-karotena, kadar air, komposisi asam lemak, asam lemak bebas, uji nilai peroksida, TBA, dan kadar dien terkonjugasi.
peroksida, dan kadar β-karotena. Dari uji asam lemak bebas dapat diketahui asam lemak yang terputus dari rantai gliserolnya. Dari uji nilai peroksida dapat diketahui perubahan jumlah peroksida selama oksidasi.
[image:48.595.89.480.198.614.2]Setelah didapatkan data model kinetika oksidasi NDRPO, dilakukan tahap ketiga yaitu analisa model hubungannya, sehingga didapatkan karakteristik oksidasi NDRPO.
Gambar 10 Alur metode penelitian
Analisa kimiawi
Parameter yang diamati dalam penelitian ini adalah:
1. Analisa kadar air dan bahan mudah menguap metode modifikasi (AOCS Official Method Ca 2f-93)
Mula-mula contoh ditimbang 15-25 gram contoh ke dalam labu dengan
stirrer yang telah ditare, bila contoh tidak cair, harus dipanaskan, tidak melebihi
10 oC dari titik lelehnya. Kemudian ditambahkan aseton 5 ml. labu ditutup dan diletakkan dalam gliserol, yang dipanaskan dengan hot plate. Dengan pengadukan
NDRPO
Karakterisasi NDRPO
Oksidasi dan karakterisasi selama oksidasi, dan analisa model kinetika stabilitas oksidasi
Analisa hubungan antara parameter oksidasi
Karakteristik Stabilitas Oksidasi NDRPO Model kinetika stabilitas
oksidasi NDRPO Karakteristik NDRPO
yang berkelanjutan, tabung divakum, kemudian dipanaskan maksimum 100 oC, kemudian dipertahankan pada suhu 100 oC selama 20 menit. Labu dipindahkan dari gliserol, kemudian didinginkan hingga suhu ruang dalam water bath, setelah melepaskan vakumnya, labu dikeringkan, diletakkan dalam desikator selama beberapa menit dan ditimbang
Kadar air dan bahan mudah menguap, %=
100
g
contoh,
berat
g
berat,
Kehilangan
×
2. Analisa total tokoferol metode spektrofotometri (Wong 1988)
Mula-mula ditimbang 200±10 mg contoh kemudian dimasukkan kedalam labu ukur 10 ml. Selanjutnya ditambahkan toluena 5 ml, 3.5 ml 2,2 bipiridin (0.07% w/v dalam etanol 95%), 0.5 ml FeCl3 (0.2% w/v dalam etanol), 1 ml etanol lalu didiamkan selama 1 menit dan dibaca dengan spektrofotometer pada panjang gelombang 520 nm. Konsentrasi total tokoferol dihitung dengan membandingkan serapan contoh dengan serapan standar.
3. Penentuan kadar β-karotena metode spektrofotometri (PORIM 1995) Sebanyak 0.1 gram contoh dilarutkan dengan heksan dalam labu ukur 25 ml sampai tanda tera, lalu dikocok hingga benar-benar homogen. Selanjutnya serapan diukur dengan spektrofotometer pada panjang gelombang 446 nm. Total β -karotena dihitung menggunakan rumus :
Kadar β-karotena =
(g)
sampel
berat
x
100
383
x
absorbansi
x
25
4. Analisa komposisi asam lemak dengan gas kromatografi (AOCS Official Method Ce 1-62)
denan gas N2, dipanaskan kembali 15 menit pada suhu 50 oC. selanjutnya ditambahkan 1 ml n-heksan, dihembuskan dengan N2 dan divortek. Selanjutnya ditambahkan NaCl jenuh sebanyak 3 ml dan divortek. Kemudian dibiarkan hingga terpisah menjadi dua fase. Lapisan atas diambil (asam lemak dalam heksan) dan disaring dengan Na2SO4 anhydrous dan ditampung dalam vial. Metil ester siap disuntikkan pada gas kromatografi.
Sebelum dilakukan penyuntikan, gas kromatografi di konsisikan terlebih dahulu. Suhu injector diatur pada suhu 225 oC, suhu detektor 225 oC, dan suhu kolom 100 oC dengan tekanan gas helium 1 kg/cm2. Detector dinyalakan dengan tekanan udara dan tekanan hidrogen masing-masing 0.5 kg/cm2. Suhu diprogram pada 120 oC selama 6 menit kemudian dinaikkan secara gradient linier dengankecepatan kenaikan suhu 3 oC/ menit sehingga suhu mencapai 230 oC dan
ditahan selama 20 menit. Contoh disuntikkan sebanyak 1 μl dengan tehnik split
pada rasio 1:30.
Pengkondisian selesai saat base line yang terbentuk lurus, tanpa terbentuk peak-peak tertentu. Selanjutnya disuntikkan standar eksternal FAME Mix C8-C22 dan contoh yang akan dianalisa.
Kromatogram yang diperoleh dari hasil analisa asam- asam lemak diidentifikasi dengan membandingkan dengan kromatogram standar eksternal. Kemudian dihitung respon faktor dari setiap asam lemak pada standar eksternal dengan rumus:
Asam lemak pada contoh dihitung dengan rumus:
contoh g C area RF C mg AL Area contoh) g / AL (mg lemak asam Kadar 17 17 × × × =
5. Analisa bilangan peroksida metode asam asetat-chloroform (AOCS Official method Cd 8-53)
ditambahkan 30 ml aquadest. Selanjutnya dititrasi dengan sodium tiosulfat 0.1 N. titrasi dilanjutkan hingga warna iod kuning hampir hilang. Kemudian ditambahkan 2 ml indikator pati, titrasi dilanjutkan hingga warna biru baru hilang. Dilakukan titrasi dengan blanko. Titrasi blanko tidak boleh melebihi 0.1 ml dari 0.1N larutan sodium tiosulfat. Kemudian dihitung dengan cara
PV=
B= ml titrasi blanko S= ml titrasi contoh
N=normalitas sodium tiosulfat
Bila titrasi membutuhkan kurang dari 0.5 ml dengan 0.1N sodium tiosulfat, maka digunakan 0.01N sodium tiosulfat
6. Analisa TBA metode langsung dengan spektrofotometer (AOCS Official method Cd 19-90)
Uji TBA yang dilakukan menggunakan metode langsung (direct method). Metode ini dapat dilakukan untuk menentukan kandungan TBARS (TBA Reactive
Substances) dalam lemak dan minyak tanpa isolasi awal dari produk oksidasi
sekunder. Metode ini dapat digunakan bagi minyak dan lemak nabati dan hewani, termasuk sam lemak, ester glikol dan ester parsial.
Bahan dan alat yang digunakan dalam uji ini adalah contoh, 1-Butanol (kadar air <0.5%), ACS kualitas spektrofotometrik, 0.2% (w/v) 2-asam thiobarbiturat (TBA) dalam 1-butanol, kemudian disonifikasi untuk melarutkan TBA dan disimpan paling lama 1 minggu pada suhu 4 oC; 0.2mM TMP dalam 1-butanol, 25 ml labu ukur, tabung reaksi dengan tutup ulir, dan waterbath 95 oC.
Setelah contoh siap reaksi TBA dapat dilakukan mula-mula 5.0 ml contoh dipindahkan ke dalam tabung reaksi bertutup yang kering. Ditambahkan 50 ml 0.2% TBA dalam 1 butanol dan tabung ditutup. Disiapkan juga blanko (5 ml 1-butanol dan 5 ml 0.2% TBA) pada waktu yang sama. Sebagai catatan bahwa contoh harus disiapkan duplo. Kemudian contoh divortek dan diinkubasi selama 2 jam dalam waterbath 95 oC. Setelah selesai tabung diambil dari waterbath dan didinginkan di bawah air mengalir selama 10 menit (sampai mencapai suhu ruang). Kemudian spektrofotometer dihidupkan dan diset panjang gelombang pada 532 nm. Spektrofotometer dipanaskan minimum selama 30 menit sebelum dilakukan pembacaan. Spektrofotometer dinolkan dengan blanko kemudian diukur serapannya menggunakan kuvet. Bila A532 dari contoh >1, harus digunakan contoh yang lebih sedikit, atau dilakukan pengenceran dan uji diulangi.
Nilai TBA dapat dihitung dengan metode AOCS, dengan mengekspresikan hasil sebagai peningkatan penyerapan pada panjang gelombang 532 nm karena reaksi contoh 1 mg eqivalent per 1 ml volume dengan TBA. Nilai TBA dapat dihitung dengan rumus sebagai berikut:
Nilai TBA = (50 x A532)/m
Faktor 50 berdasar pada volume 25 ml dari labu ukur dan panjang kuvet 1 cm. A532 adalah penyerapan contoh (yang telah dikoreksi menggunakan blanko). m adalah berat (mg) dari contoh.
7. Analisa jumlah asam lemak bebas (ALB) metode spektrofotometri (Lowry dan Tinsley, 1975)
8. Analisa dien terkonjugasi metode penyerapan UV (Wrolstad et al. 2005) Uji ini dilakukan untuk mengetahui pembentukan dien terkonjugasi (CD) selama oksidasi minyak. Uji ini dilakukan dengan mengukur perubahan penyerapan UV. Peningkatan penyerapan menadakan adanya oksidasi. Dua metode yang digunakan untuk mengungkapkan hasil pengukuran ini dijelaskan sebagai nilai CD, dinyatakan dalam µmol CD/g contoh, dan sebagai nilai
extinction CD.
Bahan dan alat yang digunakan dalam uji ini adalah contoh, 2,2,4-trimetilpentana (isooctana), ACS spectrophotometric grade (contoh Fisher Scientific), labu ukur 25 ml, spektrofotometer dengan lampu UV, kuvet quartz, dengan panjang jalur 1.00±0.01-cm.
Untuk melakukan uji dien terkonjugasi mula-mula contoh sebanyak 0.01-0.03 ditimbang dengan akurat (dan dicatat) kemudian dimasukkan ke dalam labu ukur 25 ml. Sebagai catatan bahwa setiap contoh harus diuji minimal duplo. Contoh kemudian dilarutkan dalam 2.2.4-trimetilpentana hingga batas tera. Lalu larutan dicampur hingga homogen. Untuk membantu pelarutan contoh dapat dilakukan dengan bantuan ultrasonic bath. Selanjutnya spektrofotometer dihidupkan dengan panjang gelombang 233 nm untuk pengukuran CD. Alat tersebut dipanaskan 30 menit sebelum digunakan untuk pembacaan. Lalu spektrofotometer dikalibrasi dengan larutan blanko (2,2,4-trimetilpentana) menggunakan kuvet quartz. Serapan minyak terlarut diukur menggunakan kuvet quartz, bila A233 contoh >1, contoh harus dilarutkan lagi dengan pelarut yang sama dan diukur lagi.
Nilai CD dihitung menggunakan persamaan berikut
cCD=
(
ε×)
233 Anilai CD= W
)] 10 x(2.5
[cCD × 4
cCD = konsentrasi CD dalam mmol/ml (konsentrasi molar),
A233 = adalah penyerapan larutan lemak pada panjang gelombang 233nm,
ℓ=panjang jalur kuvet dalam cm (1 cm)
2.5x104 = faktor yang menyebabkan 2,2,4-trimetilpentana (25 ml) yang digunakan untuk melarutkan contoh seperti sebuah pengubah satuan (1000 µmol/mmol) sehingga CD dapat dinyatakan dalam µmol
W= berat contoh dalam g
Analisa data
Untuk mengetahui model dan karakteristik perubahan parameter yang digunakan dilakukan analisa data dengan cara:
1. Analisa Model Perubahan Parameter Oksidasi
Perubahan parameter oksidasi seperti jumlah β-karotena, asam lemak bebas, komposisi asam lemak dibuat modelnya menggunakan persamaan Arrhenius dengan software Microsoft Excel 2007. Mula-mula data perubahan parameter oksidasi NDRPO yang diperoleh diolah untuk mendapatkan nilai konstanta kecepatan reaksi. Kemudian dari tiga pasang nilai konstanta kecepatan reaksi-suhu tersebut dibangun persamaan Arrhenius. Untuk membuat persamaan Arrhenius dang mengetahui nilai Ea suatu reaksi dibutuhkan minimal dua set nilai konstanta kecepatan (k) dan suhu (T) (Keii 2004).
Perubahan bilangan peroksida dibuat modelnya menggunakan persamaan Aragao et al. (2008).
2. Analisa Korelasi Perubahan Antar Parameter Oksidasi
Analisa korelasi perubahan antar parameter oksidasi dilakukan dengan analisa korelasi Pearson menggunakan software SPSS 17.
3. Principal Componen Analysis (PCA) Parameter Oksidasi (Mazlum et al
1999)
HASIL DAN PEMBAHASAN
Karakterisasi NDRPO
Karakterisasi sifat kimia NDRPO dalam penelitian ini dilakuka