KINERJA PERTUMBUHAN DAN STATUS ANTIOKSIDAN
IKAN GURAMI
Osphronemus gouramy
Lac. DENGAN
PENAMBAHAN ASTAXANTHIN YANG DIPELIHARA PADA
PADAT TEBAR BERBEDA
SOFIAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kinerja Pertumbuhan dan Status Antioksidan Ikan Gurami Osphronemus gouramy Lac. dengan Penambahan Astaxanthin yang dipelihara pada Padat Tebar Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
RINGKASAN
SOFIAN. Kinerja Pertumbuhan dan Status Antioksidan Ikan Gurami Osphronemus gouramy Lac. dengan Penambahan Astaxanthin yang dipelihara pada Padat Tebar Berbeda. Dibimbing oleh DEDI JUSADI dan SRI NURYATI.
Tujuan penelitian ini adalah untuk mengevaluasi pengaruh penambahan astaxanthin melalui pakan terhadap kinerja pertumbuhan dan status antioksidan ikan gurami pada pemeliharaan kepadatan normal (100 ekor/m3) dan kepadatan tinggi (400 ekor/m3). Penambahan astaxanthin pada pakan dilakukan dengan metode pelapisan (coating). Ikan uji yang digunakan adalah benih ikan gurami dengan bobot rata-rata 3,0 ± 0,12 g. Ikan dipelihara selama 60 hari dalam akuarium (100x50x50 cm3) berisi air 150 liter. Penelitian ini menggunakan rancangan acak lengkap (RAL) dan dilakukan pengulangan sebanyak tiga kali. Perlakuan yang diujikan adalah pakan dengan suplementasi astaxanthin pada dosis yang berbeda yaitu; 0, 100 dan 200 mg/kg pakan. Pakan diberikan sampai kenyang (at satiation) dengan frekuensi pemberian pakan dua kali sehari pada pukul 09.00 dan 17.00 WIB. Parameter uji yang diamati yaitu jumlah konsumsi pakan, laju pertumbuhan harian, efisiensi pakan, kelangsungan hidup, retensi protein, hepatosomatik indeks (HSI), aktivitas antioksidan (malonaldehida dan enzime superoksida dismutase) dan gambaran darah. Parameter yang diuji secara statistik adalah parameter pertumbuhan dan status antioksidan dengan ANOVA (one-way analysis of variance) menggunakan program SPSS 18. Perlakuan yang berbeda nyata diuji lanjut dengan uji lanjut Duncan untuk mengetahui perlakuan terbaik.
Peningkatan kepadatan dari 100 menjadi 400 ekor/m3 menyebabkan penurunan kualitas air terutama amonia dan nitrit, sehingga berdampak terhadap pertumbuhan dan kelangsungan hidup ikan. Pemeliharaan kepadatan tinggi menunjukkan konsumsi pakan, bobot akhir, pertumbuhan dan kelangsungan hidup lebih rendah bila dibandingkan dengan pemeliharaan pada kepadatan rendah. Penambahan astaxanthin sebesar 100 dan 200 mg/kg pakan pada pemeliharaan kepadatan tinggi mampu meningkatkan laju pertumbuhan harian dan tingkat kelangsungan hidup, dan menunjukkan respons yang sama pada ikan kontrol yang dipelihara pada kepadatan rendah. Nilai efisiensi pakan dan hepatosomatik indeks menunjukkan respons yang sama antar perlakuan. Perlakuan kontrol pada kepadatan rendah menunjukkan nilai retensi protein tertinggi. Tetapi menghasilkan nilai retensi protein terendah pada kepadatan tinggi dan kemudian meningkat dengan meningkatnya dosis astaxanthin dalam pakan uji. Penambahan suplemen astaxanthin tidak mempengaruhi kadar malonaldehida plasma dan hati, dan aktivitas enzime superoksida dismutase hati ikan gurami. Penambahan astaxanthin juga menunjukkan respons yang sama terhadap gambaran darah ikan uji. Kesimpulan dari penelitian ini yaitu; penambahan astaxanthin sebesar 100 mg/kg pakan memberikan respons pertumbuhan yang optimal karena dapat meningkatkan laju pertumbuhan harian dan tingkat kelangsungan hidup, tetapi tidak berpengaruh terhadap status antioksidan tubuh ikan gurami.
SUMMARY
SOFIAN. Growth Performances and Antioxidant Status on Giant Gouramy Osphronemus gouramy Lac. with Astaxanthin Supplementation Reared Different Stocking Density. Supervised by DEDI JUSADI and SRI NURYATI.
This study aimed to evaluate the effect of dietary astaxanthin supplementation on growth performance and antioxidant status in giant gouramy under normal (100 fish m-3) and high (400 fish m-3) stocking density. Addition of astaxanthin in the feed was done by coating method. The test fish used were giant gouramy with average weight of 3.0 ± 0.12 g. Fish were reared for 60 days in 100x50x50 cm3-sized-aquariums containing 150 liters. This research was used completely randomized design and be repeated three times. The experimental diets were supplemented astaxanthin with different doses, namely; 0, 100 and 200 mg kg-1 feed. Feed was given by at satiation method twice a day at 09.00 and 17.00 pm. The parameters observed were feed intake, daily growth rate, feed efficiency, survival, protein retention, hepatosomatic index (HSI), antioxidant activity (malondialdehyde and superoxide dismutase enzyme) and blood profile. The data of parameters which were tested statistically were data of growth parameters and antioxidant status analyzed by ANOVA (one-way analysis of variance) using SPSS 18. Significantly different treatments were tested further by Duncan test to determine the best treatment.
The results showed that, an increasing of stocking density of 100 fish m-3 to 400 fish m-3 causing a decrease in water quality (ammonia and nitrite), that impact on growth and survival of fish. Fish reared at high density showed the lower feed intake, weight, daily growth rate and survival rate. However, addition of astaxanthin at dose 100 and 200 mg kg-1 diet on high density treatment increasing daily growth rate and survival rate, and showed the same response with the control fish which were reared at low density. The value of feed efficiency and hepatosomatic index (HSI) showed a similar response between treatments with or without the addition of astaxanthin in the feed trials. Treatment 0 mg astaxanthin kg-1 feed (control) on the low density showed the highest protein retention value. But when the density increased, it was resulted the lower protein retention value and showed improvement with increasing dose of astaxanthin in the feed trials. Astaxanthin supplementation did not affect the levels of plasma and liver malondealdehyde and superoxide dismutase activity of liver on giant gouramy. Addition of astaxanthin also showed the same response to the blood profile of fish. The conclusion of this study are; the addition of 100 mg astaxanthin kg-1 feed, showed the optimal growth response because it can increase the daily growth rate and survival rate, but did not affected on antioxidant status of giant gouramy. Keywords: Osphronemus gouramy Lac, astaxanthin, growth performances,
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
KINERJA PERTUMBUHAN DAN STATUS ANTIOKSIDAN
IKAN GURAMI
Osphronemus gouramy
Lac. DENGAN
PENAMBAHAN ASTAXANTHIN YANG DIPELIHARA PADA
PADAT TEBAR BERBEDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Assalammu‟alaikum wr. wb.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Kinerja Pertumbuhan dan Status Antioksidan Ikan Gurami Osphronemus gouramy Lac. dengan Penambahan Astaxanthin yang dipelihara pada Padat Tebar Berbeda pada Program Studi Ilmu Akuakultur, Program Pascasarjana, Institut Pertanian Bogor.
Banyak pengetahuan yang didapat selama mengerjakan karya ilmiah ini. Untuk itu penulis mengucapkan banyak terima kasih kepada Bapak Dr Dedi Jusadi dan Ibu Dr Sri Nuryati selaku pembimbing atas masukan, saran, nasehat dan kesabarannya sehingga karya ilmiah ini dapat terselesaikan. Penulis juga mengucapkan terimakasih kepada Dr Muhammad Agus Suprayudi, sebagai dosen penguji luar komisi dan Dr Eddy Supriyono sebagai komisi program studi yang telah memberikan saran dalam ujian sidang tesis ini.
Penulis juga mengucapkan terimakasih kepada keluarga besar di Palembang, Bapak Ismi bin Soib (Alm), Ibu Naslah dan saudara-saudara ku (Adi Darmawansyah, Rosianah, Faisal dan bungsu Andrian Syaputra) dan Bapak Mochamad Biardi sekeluarga yang telah mendoakan, memberi semangat, dan perhatian selama masa penyelesaian studi.
Terimakasih juga kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) Kementrian Riset, Teknologi dan Pendidikan Tinggi (KEMENRISTEKDIKTI) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) sehingga penulis dapat menempuh program magister di Sekolah Pascasarjana Institut Pertanian Bogor.
Terimakasih kepada rekan-rekan yang telah membantu serta memberikan masukan dan ide yang membangun, Fazril Saputra, Rudiansyah, Azis Ramdani, teman-teman mahasiswa Program Studi Ilmu Akuakultur Angkatan 2013, keluarga besar Palembang di Bogor (IKAMUSI) dan team Merantau atas kebersamaan dan motivasinya selama ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE 3
Waktu dan Tempat 3
Pakan Uji 3
Pemeliharaan Ikan dan Pengumpulan Data 3
Analisis Data 5
3 HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 8
4 KESIMPULAN 12
Kesimpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 16
DAFTAR TABEL
1 Hasil analisis proksimat pakan uji 3
2 Rataan bobot awal (BO), bobot akhir (Bt), jumlah konsumsi pakan (JKP) individu dan laju pertumbuhan harian (LH) ikan gurami selama
pemeliharaan 6
3 Nilai efisiensi pakan (EP), retensi protein (RP), hepatosomatik indeks (HSI) dan tingkat kelangsungan hidup (TKH) ikan gurami selama
pemeliharaan 6
4 Rataan kadar malonaldehyde (MDA) hati dan plasma darah dan aktivitas enzime superoxide dismutase (SOD) pada jaringan hati ikan
gurami 7
5 Rataan kadar eritrosit (E), leukosit (L), hemoglobin (Hb), hematokrit (Ht) dan aktivitas fagositosis (AF) ikan gurami selama pemeliharaan 7 6 Kisaran parameter kualitas air media pemeliharaan benih ikan gurami
pada setiap wadah perlakuan selama pemeliharaan 8
DAFTAR LAMPIRAN
1 Prosedur analisis proksimat 16
2 Prosedur pengukuran Malonaldehida hati dan plasma darah ikan 19
3 Prosedur pengukuran aktivitas enzim SOD 20
1
PENDAHULUAN
Latar Belakang
Ikan gurami (Osphronemus gouramy Lac.) merupakan salah satu ikan air tawar yang dikembangkan budidayanya secara intensif. Salah satu upaya untuk meningkatkan produktivitas budidaya ikan gurami yaitu dengan meningkatkan padat tebar. Peningkatan padat tebar jika tidak diimbangi dengan lingkungan yang optimal, maka akan menyebabkan kelangsungan hidup dan pertumbuhan turun (Endrawati et al. 2008). Menurut Yuliati et al. (2003) pada kegiatan pendederan ikan nila, umumnya ditebar dengan kepadatan 50-100 ekor/m2. Akan tetapi jika padat tebar ditingkatkan menjadi 200 ekor/m2, maka akan menyebabkan laju pertumbuhan turun yang ditandai dengan waktu panen menjadi lebih lama. Melambatnya laju pertumbuhan pada padat tebar tinggi diduga disebabkan oleh kompetisi ruang gerak, pemanfaatan makanan dan penurunan kualitas air, sehigga menyebabkan stres oksidatif yang ditandai dengan meningkatnya produksi Reactive Oxygen Spesies (ROS) atau yang lebih dikenal sebagai radikal bebas endogen (Ardiansyah dan Indrayani 2007). Radikal bebas merupakan molekul reaktif yang memiliki potensi untuk berinteraksi terhadap molekul biologis dalam tubuh terutama lemak (Assah 2012). Radikal bebas tidak dapat mempertahankan bentuk asli dalam waktu lama dan segera berikatan dengan bahan sekitarnya, dengan cara menyerang molekul stabil terdekat dan mengambil elektron. Zat yang terambil elektronnya akan menjadi radikal bebas sehingga terjadilah suatu reaksi berantai yang pada akhirnya dapat merusak sel (Martinez-Cayuela 1995).
Kerusakan sel akibat reaksi radikal bebas dapat dicegah dengan pemberian suplemen antioksidan (Halliwell 2006). Antioksidan merupakan suatu senyawa yang berperan dalam menunda, memperlambat dan mencegah terjadinya proses oksidasi lipid oleh reaksi radikal bebas. Penambahan suplemen antioksidan seperti vitamin E, vitamin C dan golongan karotenoid berperan penting pada status kesehatan hewan melalui inaktivasi kerusakan sel yang disebabkan oleh radikal bebas yang diproduksi melalui aktivitas seluler normal ataupun dari berbagai stres lainnya (Chew 1995). Fungsi antioksidan sebagai mikronutrien dapat meningkatkan imunitas dengan cara melindungi fungsi dan struktur penting sel imun (Merchie et al. 1998). Sahin et al. (2014) menambahkan lycopene sebanyak 400 mg/kg pakan sebagai sumber antioksidan dari golongan karotenoid dalam formulasi pakan ikan rainbow trout (Onchorhyncus mykiss) yang dipelihara dengan padat tebar tinggi. Hasilnya menunjukkan bahwa pertumbuhan ikan dapat meningkat dibandingkan yang dipelihara pada kepadatan rendah tanpa penambahan lycopene. Selain itu, penambahan lycopene juga meningkatkan aktivitas enzim antioksidan tubuh seperti superoxide dismutase (SOD), catalase (CAT), dan glutathione peroxidase (GSH-Px), serta menurunkan kadar malondialdehyde (MDA). Kadar MDA di dalam tubuh telah digunakan sebagai indikator kerusakan oksidatif akibat reaksi radikal bebas (Assah 2012).
2
Ramamoorthy et al. 2010; Kurnia et al. 2008) dan udang (Pan et al. 2001; Barclay et al. 2006; Ponce-Palafox et al. 2006). Suplementasi astaxanthin mampu meningkatkan kecerahan warna dan retensi karoten dalam tubuh ikan kakap merah (Kurnia et al. 2008; Aslianti et al. 2009). Selain sumber pigmen warna, astaxanthin juga berperan sebagai stimulan sistem imun dan pertumbuhan, memperbaiki performa reproduksi (maturasi, fekunditas dan kualitas telur) dan mampu meningkatkan toleransi ikan salmon terhadap stres lingkungan (Christiansen dan Torrissen 1997; Craik 1985).
Astaxanthin menunjukkan potensi sebagai antioksidan 10 kali lebih tinggi dibandingkan dengan golongan karotenoid lainnya, seperti lutein, canthaxanthin dan β-caroten, dan 100 kali lebih kuat dari golongan α-tocopherol (Miki 1991). Astaxanthin sebagai antioksidan mampu menghambat peroksidasi lipid dan melindungi membran sel dari kerusakan oksidatif pada organisme akuatik (Meyers 1994). Penambahan astaxanthin sebanyak 2% dalam formulasi pakan mampu meningkatkan respons imun pada ikan flounder (Paralichthys olivaceus) terhadap serangan bakteri Edwardsiella tarda (Kim et al. 2012). Sedangkan kombinasi astaxanthin (230 mg/kg pakan) dan vitamin C (3400 mg/kg pakan) juga mampu menurunkan tingkat stres pada postlarva udang windu Panaeus monodon (Merchie et al. 1998). Dengan demikian, penambahan suplemen astaxanthin dalam pakan sebagai sumber antioksidan pada pemeliharaan kepadatan tinggi diharapkan dapat menghasilkan pertumbuhan yang tetap tinggi, serta rendahnya reaksi radikal bebas.
Perumusan Masalah
Padat tebar yang tinggi dapat menurunkan kualitas air budidaya, sehingga konsumsi pakan menurun dan stres oksidatif meningkat. Akibat lanjut dari keadaan ini adalah laju pertumbuhan ikan menurun (Braun et al. 2010). Halliwell (2006) mendefinisikan stres oksidatif sebagai suatu keadaan ketidakseimbangan antara radikal bebas dengan antioksidan, dimana jumlah radikal bebas lebih banyak bila dibandingkan dengan antioksidan di dalam tubuh. Astaxanthin merupakan golongan karotenoid yang diduga berperan sebagai antioksidan kuat dan berpotensi menurunkan stres oksidatif sehingga dapat mencegah terjadinya kerusakan sel (Miki 1991). Penambahan astaxanthin ke dalam pakan diduga dapat mengurangi stres oksidatif, sehingga pertumbuhan ikan pada pemeliharaan kepadatan tinggi tidak terganggu.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengevaluasi efektivitas penambahan astaxanthin dalam pakan terhadap pertumbuhan dan status antioksidan ikan gurami.
Manfaat Penelitian
3
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari hingga bulan Maret 2015 bertempat di Laboratorium Nutrisi Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis proksimat pakan, analisis kualitas air dan gambaran darah dilakukan di Laboratorium Nutrisi Ikan, Laboratorium Lingkungan dan Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis status antioksidan dilakukan di Laboratorium Fisiologi Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Pakan Uji
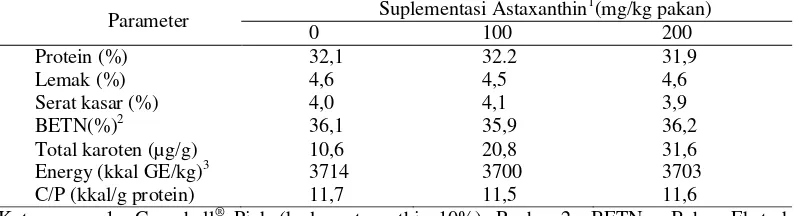
Pakan uji yang digunakan pada penelitian ini adalah pakan komersial berdiameter ± 1 mm. Perlakuan yang diujikan adalah pakan dengan suplementasi astaxanthin pada dosis yang berbeda yaitu: 0, 100, dan 200 mg/kg pakan. Astaxanthin yang digunakan merupakan produk komersial yaitu Carophyll® Pink (kadar astaxanthin 10%). Penambahan astaxanthin pada pakan uji dilakukan dengan metode pelapisan (coating), yaitu dengan melarutkan astaxanthin sesuai dengan dosis perlakuan dalam 100 ml akuades. Larutan tersebut disebar secara merata pada pakan uji dengan alat sprayer. Setelah itu pakan uji disemprot dengan putih telur sebanyak ± 40 ml/kilogram pakan. Hasil analisis pakan uji selengkapnya pada penelitian ini disajikan pada Tabel 1.
Table 1. Hasil analisis proksimat pakan uji
Parameter Suplementasi Astaxanthin Tanpa Nitrogen; 3= GE (Gross Energy), dihitung berdasarkan NRC (1997); Protein: 5,6 kkal/g; Lemak: 9,4 kkal/g; Karbohidrat: 4,1 kkal/g.
Pemeliharaan ikan dan pengumpulan data
1. Pemeliharaan ikan uji
4
09.00 dan 17.00 WIB. Penyiponan dilakukan setiap hari, kemudian dilakukan pergantian air sebanyak 30% setiap 2 hari. Untuk mengetahui kondisi kualitas air pemeliharaan, maka selama penelitian diamati suhu, pH, kandungan oksigen terlarut (DO), amonia dan nitrit. Pengukuran dilakukan pada awal, tengah dan akhir pemeliharaan.
2. Pengumpulan data
a. Data bobot ikan dan pakan
Pada awal dan akhir pemeliharaan dilakukan penimbangan bobot ikan untuk mengetahui pertumbuhan. Penentuan bobot ikan uji dilakukan dengan cara mengambil semua ikan dalam setiap akuarium dan dimasukkan ke dalam suatu wadah tanpa air, kemudian ditimbang. Jumlah pakan yang dihabiskan dicatat untuk mengetahui tingkat konsumsi pakan. Hal ini berguna untuk mengetahui jumlah protein yang dikonsumsi selama penelitian sehingga diperoleh nilai retensi protein.
b. Data proksimat pakan dan tubuh ikan
Analisis proksimat pada pakan uji, meliputi kandungan protein, kandungan lemak, BETN (Bahan Ekstrak Tanpa Nitrogen), kandungan abu, serat kasar, dan kandungan air. Sedangkan pada tubuh ikan dilakukan analisis kandungan protein, lemak dan kadar air di awal dan akhir pemeliharaan. Ikan diambil secara acak sebanyak 5 ekor setiap ulangan, kemudian dicincang hingga halus dan homogen. Analisis proksimat untuk protein kasar dilakukan dengan metode Kjedhal, lemak dengan metode ekstraksi menggunakan alat Soxhlet; abu dengan menggunakan pemanasan dalam tanur pada suhu 400-600oC, serat kasar menggunakan metode pelarutan sampel dengan asam dan basa kuat serta pemanasan dan kadar air dengan menggunakan metode pemanasan dalam oven pada suhu 105-110oC (Takeuchi 1988). Prosedur analisis dapat dilihat pada Lampiran 1.
c. Data status antioksidan
Analisis status antioksidan meliputi kadar malondialdehyde (MDA) dan enzim superoxide dismutase (SOD) dilakukan di akhir pemeliharaan pada 5 ekor ikan setiap ulangan yang kemudian dijadikan satu sampel. Pengukuran kadar MDA hati dan plasma darah dilakukan 24 jam setelah pemberian pakan terakhir mengikuti prosedur Conti et al. (1991) (Lampiran 2). Aktivitas SOD ditentukan berdasarkan metoda yang dikembangkan oleh Sun et al. (1988). Pengukuran kadar SOD hati dilakukan 24 jam setelah pemberian pakan terakhir. Prosedur pengamatan SOD dapat dilihat pada Lampiran 3. Kadar MDA dan aktivitas enzim SOD diukur dengan menggunakan spektrofotometer HITACHI U-2001.
d. Data gambaran darah
5 dilakukan pengamatan di laboratorium. Analisis kadar hemoglobin menggunakan metode Wedemeyer dan Yesutake (1977). Jumlah sel darah merah, aktivitas fagositosis serta hematokrit menggunakan metode Anderson dan Siwicki (1993). Prosedur pengamatan darah dapat dilihat pada Lampiran 4.
Analisis Data
Penelitian ini didesain dengan menggunakan Rancangan Acak Lengkap (RAL). Setiap perlakuan dilakukan pengulangan sebanyak 3 kali. Data yang diperoleh ditabulasi dengan program MS. Office Excel 2007 dan untuk uji ANOVA dianalisis dengan menggunakan program SPSS 18. Perlakuan yang berbeda nyata akan diuji lanjut dengan uji lanjut Duncan untuk mengetahui perlakuan terbaik. Parameter yang diuji secara statistik adalah semua parameter pengukuran pertumbuhan dan status antioksidan. Variabel yang diuji secara statistik adalah laju pertumbuhan harian (Huisman 1987), tingkat kelangsungan hidup, efisiensi pakan dan retensi protein (Watanabe 1988). Demikian juga data mengenai status antioksidan dianalisis secara statistik.
.
3
HASIL DAN PEMBAHASAN
Hasil
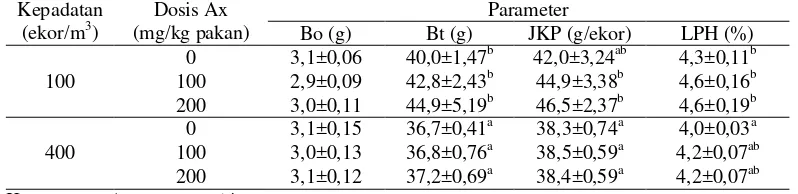
Data bobot awal dan akhir ikan gurami selama pemeliharaan disajikan pada Tabel 2. Di akhir penelitian, ikan yang dipelihara pada padat tebar tinggi memiliki bobot individu yang lebih rendah dari pada ikan yang dipelihara pada padat tebar rendah. Rendahnya bobot ikan di perlakuan kepadatan tinggi ini berkorelasi dengan jumlah konsumsi pakan per individu ikan yang juga lebih rendah. Laju pertumbuhan ikan yang dipelihara pada padat tebar tinggi dan diberi pakan tanpa penambahan astaxanthin lebih rendah dari kelompok ikan yang dipelihara pada padat tebar rendah dan diberi pakan tanpa penambahan astaxanthin. Pemberian pakan yang ditambah astaxanthin pada ikan yang dipelihara pada padat tebar tinggi mampu meningkatkan laju pertumbuhan ikan sehingga sama dengan ikan yang dipelihara pada padat tebar rendah.
6
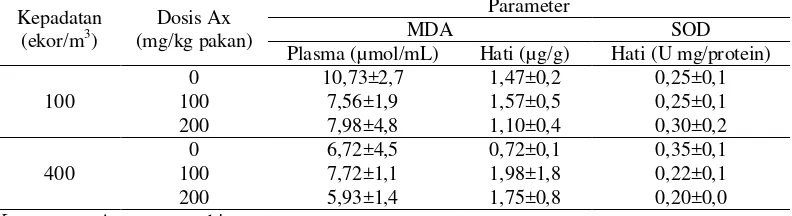
7 Tabel 4. Rataan kadar malonaldehyde (MDA) hati dan plasma darah dan aktivitas
enzim superoxide dismutase (SOD) pada jaringan hati ikan gurami Kepadatan
Plasma (µmol/mL) Hati (µg/g) Hati (U mg/protein)
100 yang tidak diberi suplemen astaxanthin dalam pakan menunjukkan rata-rata kadar eritrosit, leukosit, hemoglobin dan hematokrit terendah pada kelompok kepadatan rendah (100 ekor/m3), sedangkan pada kelompok kepadatan tinggi (400 ekor/m3) menunjukkan nilai rerata yang berfluktuatif. Ikan yang diberi pakan dengan penambahan astaxanthin sebesar 100 mg/kg pakan pada kelompok kepadatan rendah menghasilkan nilai eritrosit, leukosit dan hemoglobin tertinggi, kemudian diikuti oleh perlakuan 200 mg/kg pakan. Nilai kadar hematokrit tertinggi didapatkan pada penambahan 200 mg/kg pakan, kemudian diikuti perlakuan 100 mg/kg pakan. Sedangkan nilai aktivitas fagositosis tertinggi didapatkan pada perlakuan kontrol (tanpa penambahan astaxanthin), kemudian diikuti perlakuan 200 mg/kg pakan dan terendah pada perlakuan 100 mg/kg pakan.
Tabel 5. Rataan kadar eritrosit (E), leukosit (L), hemoglobin (Hb), hematokrit (Ht) dan aktivitas fagositosis (AF) ikan gurami selama pemeliharaan
Kepadatan
Pada kelompok kepadatan tinggi, nilai eritrosit tertinggi diperoleh pada perlakuan kontrol, kemudian diikuti perlakuan 100 mg/kg pakan dan nilai terendah pada perlakuan 200 mg/kg pakan. Sedangkan nilai leukosit, hemoglobin hematokrit dan aktivitas fagositosis tertinggi diperoleh pada perlakuan 100 mg/kg pakan, kemudian diikuti perlakuan kontrol dan nilai terendah pada perlakuan 200 mg/kg pakan.
8
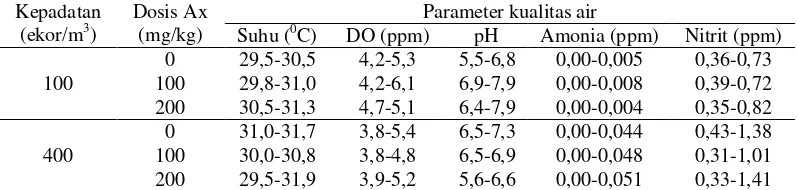
Tabel 6. Kisaran parameter kualitas air media pemeliharaan benih ikan gurami pada setiap wadah perlakuan selama pemeliharaan
Kepadatan terjadinya penurunan kualitas air pemeliharaan sehingga berdampak buruk terhadap ikan uji. Ikan yang dipelihara pada kepadatan tinggi menunjukkan penurunan nafsu makan yang ditandai dengan jumlah konsumsi pakan yang lebih rendah bila dibandingkan pada kepadatan rendah. Jumlah konsumsi pakan yang rendah berdampak terhadap bobot akhir ikan uji. Ikan yang dipelihara pada padat tebar tinggi memiliki bobot akhir lebih rendah bila dibandingkan dengan ikan yang dipelihara pada kepadatan rendah. Terjadinya penurunan nafsu makan ini berkorelasi dengan nilai amonia (NH3) dan nitrit, yakni di perlakuan padat tebar
tinggi yang memiliki rentang nilai lebih tinggi. Semakin meningkatnya padat tebar mengakibatkan semakin banyaknya amonia yang diekskresikan. Konsentrasi amonia yang tinggi dapat meyebabkan nekrosis pada jaringan dan menyebabkan akibat yang buruk terhadap metabolisme energi ikan. Hal tersebut terjadi karena afinitas hemoglobin terhadap amonia lebih tinggi bila dibandingkan afinitas hemoglobin terhadap oksigen sehingga sel tidak mendapat suplai oksigen yang cukup. Peningkatan kadar amonia darah dalam jangka waktu yang lama hingga tingkat kronis secara simultan dapat menyebabkan mobilisasi hormon kortisol. Menurut Joel dan Amajouyi (2010) amonia pada kadar 0,06 ppm dapat menyebabkan kerusakan insang dan ginjal, menurunkan pertumbuhan, terganggunya kerja otak dan menurunkan kapasitas kemampuan pengikatan oksigen. Sedangkan kandungan nitrit yang tinggi dapat menyebabkan terhambatnya pengikatan oksigen oleh darah (El-Shebly dan Gad 2011).
9 tantang dengan Edwardsiella tarda. Diketahui bahwa perlakuan kontrol (tanpa penambahan astaxanthin) menunjukkan kematian tertinggi yaitu 100%, kemudian diikuti perlakuan 1% (75%), perlakuan 2% (70%) dan terendah 40% pada perlakuan 3% astaxanthin dalam formulasi pakan.
Peningkatan padat tebar juga berpengaruh terhadap laju pertumbuhan harian (LPH). Ikan yang dipelihara pada padat tebar tinggi memiliki nilai LPH yang lebih rendah. Akan tetapi, penambahan suplemen astaxanthin sebesar 100 dan 200 mg/kg pakan mampu meningkatkan laju pertumbuhan harian pada pemeliharaan kepadatan tinggi dan menunjukkan respons yang sama pada ikan kontrol yang dipelihara pada kepadatan rendah. Hasil yang sama didapatkan oleh Christiansen et al. (1995) bahwa ikan salmon (Salmo salar L.) yang diberi astaxanthin 60 mg/kg pakan menunjukkan pertumbuhan 110,9% lebih tinggi bila dibandingkan dengan kontrol (tanpa penambahan astaxanthin). Hasil penelitian Jagruthi et al. (2014) juga mendapatkan bahwa ikan mas (Cyprinus carpio) yang diberi astaxanthin 50 mg/kg pakan menunjukkan pertumbuhan yang lebih tinggi bila dibandingkan dengan kontrol. Řehulka (2000) juga membuktikan bahwa penambahan astaxanthin sebanyak 49,8 mg/kg pakan berpengaruh terhadap pertumbuhan dan beberapa parameter darah ikan rainbow trout (Oncorhynchus mykiss) selama 84 hari pemeliharaan. Pakan dengan pemberian astaxanthin menunjukkan pertumbuhan yang lebih baik dibandingkan dengan kontrol (tanpa astaxanthin).
Hati merupakan pusat metabolisme nutrien dalam tubuh dan umumnya digunakan sebagai indikator pertumbuhan. Meningkatnya jumlah nutrien yang diserap akan mempengaruhi bobot hati dan berdampak terhadap pertumbuhan. Berdasarkan pengukuran nilai hepatosomatik indeks (HSI) ikan gurami dengan pemberian astaxanthin pada akhir pemeliharaan diperoleh hasil yang sama antar perlakuan baik pada kepadatan rendah maupun pada kepadatan tinggi. Hal tersebut menjelaskan bahwa ikan gurami mempunyai kemampuan yang sama dalam memanfaatkan nutrien pakan. Hasil tersebut juga didukung oleh data efisiensi pemanfaatan pakan, bahwa pemberian astaxanthin dan peningkatan kepadatan tidak mempengaruhi ikan gurami dalam memanfaatkan nutrien pakan.
Nilai retensi menunjukkan tingkat pemanfaatan nutrien pakan selama pemeliharaan dan nutrien pakan yang disimpan dalam tubuh untuk pertumbuhan. Dalam percobaan ini diketahui bahwa, nilai retensi protein tertinggi diperoleh pada perlakuan tanpa penambahan astaxanthin pada ikan yang dipelihara dalam kepadatan rendah. Penambahan astaxanthin sebesar 100 dan 200 mg/kg pakan pada pemeliharaan kepadatan rendah tidak mempengaruhi pemanfaatan protein lebih baik yang ditandai dengan rendahnya nilai retensi protein. Akan tetapi jika padat tebar ditingkatkan, penambahan astaxanthin dalam pakan menunjukkan peningkatan retensi protein seiring dengan meningkatnya dosis astaxanthin yang diberikan. Kondisi tersebut menjelaskan bahwa penambahan astaxanthin pada kondisi stres lingkungan mampu menstimulasi ikan gurami untuk memanfaatkan protein pakan lebih baik, sehingga diperoleh pertumbuhan yang tetap tinggi.
10
kapasitas antioksidan endogen dalam menangkal radikal bebas sehingga menyebabkan kerusakan sel (Halliwell 2006). Sedangkan SOD merupakan salah satu enzim antioksidan terbanyak yang dihasilkan oleh tubuh, enzim ini sebagian besar terletak di organ hati. Satu unit SOD didefinisikan sebagai jumlah enzim yang dibutuhkan untuk menghambat 50% dismutasi dari radikal superoksida (Sun et al. 1988). Semakin tinggi aktivitas enzim SOD, menunjukkan semakin rendah produk oksidasi lipid yang terjadi. Enzim SOD berperan sangat penting dalam pertahanan sel melawan efek toksik radikal oksigen (Nurhayati et al. 2011).
Berdasarkan hasil penelitian diketahui bahwa penambahan suplemen antioksidan eksogen yaitu astaxanthin melalui pakan, menunjukkan respons yang sama antar perlakuan terhadap status antioksidan tubuh. Kondisi tersebut berbeda dengan hasil penelitian Sahin et al. (2014), dimana terjadi peningkatan aktivitas enzim antioksidan tubuh (superoxide disemutase, catalase dan glutathione peroxidase) dan penurunan kadar MDA dengan penambahan suplemen lycopene sebagai sumber antioksidan eksogen pada ikan rainbow trout (Oncorhynchus mykiss). Hasil penelitian Can et al. (2012) juga menunjukkan bahwa penambahan kefir sebagai antioksidan eksogen dalam pakan juga menunjukkan penurunan kadar MDA dan meningkatkan aktivitas enzim antioksidan tubuh pada ikan coruh trout (Salmo coruhensis).
Pengukuran kadar MDA bertujuan untuk mengetahui tingkat stres oksidatif pada ikan gurami yang diberi stres lingkungan berupa padat tebar tinggi. Berdasarkan hasil pengamatan terhadap nilai MDA diketahui bahwa peningkatan kepadatan dari 100 menjadi 400 ekor/m3 tidak menyebabkan stres oksidatif pada ikan gurami. Begitu juga dengan penambahan astaxanthin dalam pakan tidak mempengaruhi aktivitas enzim superoxide dismustase (SOD). Lewis et al. (2010) menjelaskan bahwa secara alami tubuh mempunyai kemampuan untuk mempertahankan sel dari kerusakan (cell survival) akibat stres lingkungan yang salah satunya ditentukan oleh aktivitas faktor transkripsi Nuclear erythroid related factor 2 (Nrf2). Lebih jauh Belleza et al. (2010) menjelaskan bahwa Nrf2 yang aktif akan masuk ke nukleus dan akan berikatan dengan antioxidant responsive element (ARE). Hal ini menyebabkan transkripsi dari target gennya. Gen yang diaktifkan diantaranya adalah gen-gen yang mengkode enzim-enzim untuk mensintesis antioksidan superoxide dismutase serta gluthathione, seperti glutamate-cystein ligase dan gluthathione-s-transferase (Lewis et al. 2010; Jung dan Kwak 2010).
Penambahan astaxanthin sebesar 100 dan 200 mg/kg pakan memberikan respons yang sama antar perlakuan dalam menurunkan kadar MDA. Kondisi diatas berbeda dengan hasil penelitian Miki (1991), bahwa astaxanthin secara in vitro menunjukkan kemampuan sebagai antioksidan kuat dalam menangkal radikal bebas. Senyawa antioksidan dapat mengeliminasi radikal bebas dan mencegah reaksi berantai lebih lanjut terhadap komponen membran sel sehingga mengurangi pembentukan MDA sebagai produk akhir (Lee et al. 2004). Pada perlakuan kontrol (tanpa penambahan astaxanthin), ikan yang dipelihara pada kepadatan rendah memiliki kadar MDA pada plasma darah sebesar 10,73
mol/mL. Nilai tersebut menggambarkan bahwa pada kondisi normal, tubuh ikan
11 senyawa oksigen reaktif. Hal ini biasanya merupakan respons normal proses biokimia secara intrasel maupun ekstrasel.
Stres dapat menimbulkan gangguan respons imun non-spesifik, diantaranya berupa proliferasi limfosit (pertambahan jumlah sel T dan sel B). Stres juga memacu keluarnya hormon kortisol yang dapat menekan sistem imun (immuno supresif) dan dapat menimbulkan depresi limfosit, makrofage dan leukosit (Vadstein 1997). Hasil pengamatan jumlah eritrosit normal pada ikan teleostei adalah sekitar 1,76 x 106 – 2,29 x 106 sel/mm3. Nilai tersebut masih berada dalam kisaran normal. Hastuti dan Karoror (2007) menyebutkan bahwa kisaran nilai eritrosit normal ikan teleostei adalah sebesar 1,05 x 106 sel/mm3. Nilai eritrosit yang lebih rendah pada perlakuan 100 mg/kg dan 200 mg/kg pakan pada ikan yang dipelihara pada kepadatan tinggi diduga karena adanya perbedaan daya tahan tubuh dan lisisnya sel darah merah. Assah (2012) menjelaskan bahwa pada kondisi stres tubuh akan membentuk spesies oksigen reaktif (SOR) yang mepunyai potensi untuk menimbulkan kerusakan oksidatif berupa lisisnya semua membran sel maupun jaringan tubuh yang mengandung lipid terasuk eritrosit yang memiliki dua lapisan yang tersusun oleh dua molekul padat fosfolipid. Rekativitas SOR mengakibatkan struktur molekul penyusun membran sel yang terdiri atas kolesterol, fosfolipid dan glikolipid (yang keduanya mengandung asam lemak tak jenuh) dan DNA sangat peka terhadap radikal hidroksi, sehingga akan terjadi kerusakan sel dan terbentuknya banyak radikal asam lemak peroksi. Peristiwa peroksidasi lipid pada eritrosit mengakibatkan terjadinya lisis atau yang biasa dikenal dengan peristiwa hemolisis.
Berdasarkan hasil pengukuran leukosit ikan (1,60 x 105 sel/mm3 – 1,78 x 105sel/mm3) menunjukkan bahwa total leukosit masih dalam kisaran normal. Shao et al. (2004) melaporkan bahwa total leukosit ikan normal berkisar antara 20.000 – 150.000 sel/ml darah. Anderson dan Siwicki (1993) menyatakan bahwa peningkatan jumlah leukosit mengindikasikan bahwa ikan dalam kondisi stres, karena leukosit merupakan salah satu komponen sistem pertahanan tubuh yang bekerja secara non-spesifik sebagai respons tubuh terhadap perubahan lingkungan.
Hemoglobin berfungsi mengikat oksigen yang kemudian akan digunakan untuk proses metabolisme sehingga menghasilkan energi. Nilai hemoglobin pada penelitian ini berkisar antara 6,2% - 9,47%. Nilai hemoglobin ikan sehat berkisar antara 6,9% - 8,8% (Minaka et al. 2012). Nilai hemoglobin terendah 6,2% diperoleh pada perlakuan 200 mg/kg pakan pada kepadatan tinggi. Rendahnya nilai tersebut diikuti dengan rendahnya nilai eritrosit. Menurunnya nilai hemoglobin dalam darah berkaitan dengan rendahnya nilai eritrosit yang diduga karena ikan mengalami lisis didalam darah.
Hasil pengamatan nilai hematokrit (Ht) pada ikan gurami adalah sebesar 28,5% – 33,4%. Berdasarkan hasil penelitian, dapat di simpulkan bahwa nilai hematokrit ikan gurami masih berada dalam kisaran normal ikan sehat. Minaka et al. (2012) menyebutkan bahwa nilai hematokrit dibawah 22% menunjukkan bahwa ikan mengalami kondisi anemia atau terinfeksi oleh bakteri. Kemudian Anderson dan Siwicki (1993) menyebutkan bahwa nilai hematokrit yang terlalu tinggi dari batas normal juga dapat digunakan sebagai indikator bahwa ikan berada dalam kondisi stres.
12
Akan tetapi nilai AF pada ikan yang diberi astaxanthin 100 mg/kg pakan pada kelompok kepadatan rendah menghasilkan nilai yang rendah walaupun nilai leukositnya tinggi. Rendahnya nilai AF tersebut diduga bahwa penambahan astaxanthin dalam pakan menekan sistem imun (immuno supresif), sehingga kemampuan tubuh dalam memfagosit bakteri menurun. Pada kondisi lain, pemberian astaxanthin dengan dosis 0% (kontrol), 1%, 2% dan 3% dalam formulasi pakan selama 15 hari pemeliharaan mampu meningkatkan sistem imun ikan flounder Paralichthys olivaceus yang diinfeksi Edwardsiella tarda. Peningkatan sistem imun terlihat dengan meningkatnya aktifitas fagositosis pada perlakuan 1%, 2% dan 3% astaxanthin dalam pakan setelah 24 jam dari pemberian pakan terakhir (Kim et al. 2012).
4
KESIMPULAN
Kesimpulan
Suplementasi astaxanthin sebesar 100 mg/kg pakan memberikan respons pertumbuhan yang optimal karena dapat meningkatkan laju pertumbuhan harian dan tingkat kelangsungan hidup pada pemeliharaan kepadatan tinggi. Akan tetapi penambahan astaxanthin sebesar 100 dan 200 mg/kg pakan tidak mempengaruhi status antioksidan tubuh ikan gurami.
Saran
Untuk mendapatkan hasil pertumbuhan dan sintasan yang optimal pada budidaya ikan gurami dengan padat tebar 400 ekor/m3 (ukuran 3 gram/ekor), dapat ditambahkan suplemen astaxanthin melalui pakan dengan dosis 100 mg/kg pakan.
DAFTAR PUSTAKA
Anderson DP, Siwicki AK. 1993. Basic Hematology and Serology for Fish Health Programs. Paper presented in second symposium on diseases in Asian aquaculture “AquaticAnimal Health and Environment”. Phuket, Thailand. 25-29th October 1993. 17 hlm.
Angka SL. 1990. The pathology of the walking catfish, Clarias batrachus (L) infected intraperitoneally with Aeromonas hydrophila. Asian Fish.Sci. 3:343-351.
Ardiansyah, Indrayani. 2007. Natural antioxidants dietary and lipid oxidation analysis in zebrafish (Brachydanio rerio) tissue. HAYATI Journal of Biosciences. 14(3):87-92.
13 Assah YF. 2012. Pengaruh konsumsi minyak sawit mentah terhadap kadar beta karoten, malonaldehida dan aktivitas enzim xantin oksidase plasma darah serta penerimaan produk oleh responden pra sejahtera di desa dramaga dan babakan, kabupaten bogor. [tesis]. Bogor (ID): Institut Pertanian Bogor. Barclay MC, Irvin SJ, Williams KC, Smith DM. 2006. Comparison of diets for
the tropical spiny lobster Panulirus ornatus: astaxathin-supplemented feeds and mussel flesh. Aquaculture Nutrition. 12(1):117-125.
Belleza I, Mierla AL, Minelli A. 2010. Nrf2 and NF-kB and their concerted modulation in cancer pathogenesis and progression. Cancer. 2:483-497. Braun N, De-Lima RL, Baldisserotto B, Dafre AL, De-Oliveira, Nuner AP. 2010.
Growth, biochemical and physiological responses of Salminus brasiliensis with different stocking densities and handling. Aquaculture. 301:22-30. Buyukcapar HM, Yanar M, Yanar Y. 2007. Pigmentation of rainbow trout
(Oncorhynchus mykiss) with carotenoids from marigold flower (Tagetes erecta) and red pepper (Capsicum annum). Turk. J. Vet. Anim. Sci. 3(1):7-12.
Can E, Kurtoğlu IZ, Benzer F, Erisir M, Kocabas M. 2012. The effects of different dosage of kefir with different duration on growth performances and antioxidant system in the blood and liver tissue of coruh trout (Salmo coruhensis). Turkis Journal of Fisheries and Aquatic Sciences. 12:277-283. Chatzifotis S, Pavlidis M, Jimeno CD, Vardanis G, Sterioti A, Divanach P. 2005.
The effect of different carotenoid source on skin coloration of cultured red porgy (Pagrus pagrus). Aquaculture Research. 36(1):1517-1525.
Chew BP. 1995. Antioxidant vitamins affect food animal immunity and health. Journal of Nutrition. 125:1804S-1808S.
Christiansen R, Glette J, Lie O, Torrissen OJ, Waagbo R. 1995. Antioxidant status and immunity in Atlantic salmon, Salmo salar L. fed semi-purified diets with and without astaxanthin supplementation. J. Fish Dis. 18:317-328. Christiansen R, Torrissen OJ, 1997. Effects of dietary astaxanthin
supplementation on fertilization and egg survival in Atlantic salmon (Salmo salar L.). Aquaculture. 153:51-62.
Conti M, Moramb PC, Lemonnier A. 1991. Improve Fluorometric Determination of Malonaldehyde. J Clin Chem Soc 103: 6472-6477.
Craik JCA. 1985. Egg quality and egg pigment content in salmonid fishes. Aquaculture. 47:61-88.
El-Shebly AA, Gad HAM. 2011. Effect of chronic ammonia exposure on growth performance, serum growth hormone (GH) levels and gill histology of nile tilapia (Oreochromis niloticus). J. Microbiol. Biotech, Res. 1(4):183-197. Endrawati H, Zainuri M, Kusdiyantini E. 2008. Pertumbuhan juvenil ikan kerapu
macan (Epinephelus fuscoguttatus) yang dipelihara dengan padat penebaran berbeda. Ilmu Kelautan. 13(3):133-138.
Halliwell B. 2006. Reactive spesies and antioxidants: Redox biology is a fudamental theme of aerobic life. Plant Physiol. 141:312-322.
14
Huisman EA. 1987. Principle of Fish Production. Deft. of Fish Culture and Fisheries. Wageningen Agriculture University, Wageningen, The Netherland. 170 pp.
Jagruthi C, Yogeshwari G, Anbazahan SM, Mari LSS, Arockiaraj J, Mariappan P, Sudhakar GRL, Balasundaram C, Harikrishnan R. 2014. Effect of dietary astaxanthin againts Aeromonas hydrophila infection in common carp, Cyprinus carpio. Fish & Sehllfish Immunology. 41(1): 674–680.
Joel OF, Amajuoyi CS. 2010. Determination of the concentration of ammonia that could have lethal effect on fish pond. ARPN J. Engineer and Applied Science. 5(2):1-5.
Jung KA, Kwak MK. 2010. The Nrf2 system as the potential target for the development of indirect antioxidants. Molecules. 15:7266-7291.
Khalwan, Irianto A, Rachmawati FN. 2012. Pengaruh suplementasi Bacillus sp. melalui perifiton terhadap jumlah total mikroba intestinal dan gambaran darah ikan gurami (Osphronemus gouramy). Bioteknologi. 9(2):35-40. Kim SS, Song JW, Kim KW, Lee KJ. 2012. Effects of dietary astaxanthin on
innate immunity and disease resistance against Edwardsiella tarda in olive flounder Paralichthys olivaceus. Israeli Journal of Aquaculture. 64: 1–6. Kurnia A, Satoh S, Kudo H, Nakada M, Matsumura H. 2008. Effect of marine
bacteria (Paracoccus sp) as an astaxanthin source in practical red sea bream culture. Aquaculture Indonesia. 9(1):9-15.
Lee J, Renita M, Fioritto RJ, ST.Martin SK, Schwartz SJ, Vodovotz Y. 2004. Isoflavone characterization andantioxidant activity of Ohio soybeans. J Agric Food Chem. 52:2647-1651.
Lewis KT, Mele J, Hayes JD, Buffenstein R. 2010. Nrf2, a guardian of healthspan and gatekeeper of species longevity. Integrated and Comperative Biology. 50(5):829-843.
Martinez-Cayuela M. 1995. Oxygen free radicals and human disease. Biochimie. 77:147-177.
Merchie G, Kontara E, Lavens P, Robles R, Kurmaly K, Sorgeloos P. 1998. Effect of vitamin C and astaxanthin on stress and disease resistance of postlarval tiger shrimp, Penaeus monodon (Fabricius). Aquaculture Research. 29:579-585.
Meyers SP. 1994. Developments in world aquaculture, feed formulations, and role of carotenoids. Pure & Appl. Chem. 66(5):1069-1076.
Miki W. 1991. Biological functions and activities of animal carotenoids. Pure & Appl.Chem. 63: 141-146.
Minaka A, Sarjito, Hastuti S. 2012. Identifikasi agensia penyebab dan profil darah ikan gurami (Osphronemus gouramy) yang terserang penyakit bakteri. Journal of Aquaculture Management and Technology. 1:249-263.
[NRC] National Research Council. 1997. Nutrition requirement or warm water Fishes. Washington D.C. National Academic Press.
Nurhayati S, Kisnanto T, Syaifudin M. 2011. Superoksida dismutase (SOD): apa dan bagaimana peranannya dalam radioterapi. Buletin Alava. 13(2):67-74. Pan CH, Chien YH, Cheng JH. 2001. Effect of light regime, algae in the water,
15 Ponce-Palafox JT, Arredondo-Figueroa JL, Vernon-Carter EJ. 2006. Carotenoids from plants used in diets for the culture of the pacific white shrimp (Litopenaeus vannamei). Revista Mexicana de Ingenieria Quimica. 5(2):157-165.
Ramamoorthy K, Bhuvaneswari S, Sankar G, Sakkaravarthi K. 2010. Proximate composition and carotenoid content of natural carotenoid sources and its colour enhancement on marine ornamental fish Amphiprion ocellaris (Cuveir 1880). World Journal of Fish and Marine Sciences. 2(6):545-550. Řehulka J. 2000. Influence of astaxanthin on growth rate, condition, and some
blood indices of rainbow trout, Oncorhynchus mykiss. Aquaculture. 190:27-47.
Sahin K, Yazlak H, Orhan C, Tuzcu M, Akdemir F, Sahin N. 2014. The effect of lycopene on antioxidant status in rainbow trout (Oncorhynchus mykiss) reared under high stocking density. Aquaculture. 418:132-138.
Shao ZJ, Lin J, Xiang LX. 2004. Aeromonas hydrophila induces apoptosis in Carasius auratus lymphocytes in vitro. Aquaculture. 229:11-23.
Sun Y, Oberley LW, Li Y. 1988. A simple method for clinical assay of superoxide dismutase. Clinical Chemistry. 34(3):497-500.
Takeuchi T. 1988. Laboratory work-chemical evaluation of dietary nutrients. p. 179-233, In Watanabe (Ed) Fish nutrition and mariculture. Kanagawa International Fisheries Training. Japan International Cooperation Agency (JICA), Japan.
Trilaksani W. 2003. Antioksidan: Jenis, sumber, mekanisme kerja dan peran terhadap kesehatan. [disertasi]. Bogor (ID): Institut Pertanian Bogor. Vadstein O. 1997. The use of immunostimulation in marine larviculture:
possibilities and challenges. Aquaculture. 70:123-129.
Watanabe T. 1988. Fish Nutrition and Mariculture. Tokyo, Japan: JICA Textbook the General Aquaculture Course.
Wedemeyer GA, Yasutake WT. 1977. Clinical Methods for the Assessment of the Effect Environmental Stress on Fish Health. Technical Paper of the U.S. Fish and Wildlife Service. US. Depart. Of the Interior Fish and Wildlife Service. 89: 1-17
16
Lampiran 1 Prosedur analisis proksimat A. Prosedur analisis kadar air
1. Cawan porselen dioven pada suhu 110oC selama satu jam dan kemudian ditimbang (X1).
2. Bahan diambil sebanyak 1 g (A) dan dimasukkan pada cawan tadi dan kemudian dipanaskan /dioven pada suhu 110oC selama 2 jam.
3. Setelah dioven, cawan tersebut dipindahkan ke deksikator selama 30 menit. 4. Setelah dingin, cawan tersebut ditimbang dan beratnya dicatat (X2).
5. Kadar air dihitung dengan menggunakan rumus berikut ini :
(X1 + A) – X2
Kadar air = x 100%
A
B. Prosedur analisis kadar abu
1. Cawan porselen dioven pada suhu 110oC selama 1 jam lalu didinginkan dalam eksikator selama 15 sampai 30 menit dan kemudian ditimbang (X1).
2. Bahan diambil 1 g (A) dan dimasukkan dalam cawan porselen tersebut. 3. Cawan yang berisi bahan tadi dipanaskan dalam tanur pada suhu 600oC
sampai bahan menjadi putih semua atau menjadi abu, kemudian dimasukkan ke oven (suhu 100oC sampai 110oC) selama 15 menit untuk menurunkan suhunya.
4. Cawan dipindahkan ke eksikator selama 15 sampai 30 menit dan kemudian ditimbang (X2).
5. Kadar abu dihitung dengan menggunaan rumus berikut ini :
(X1 + A) – X2
Kadar abu = x 100%
A
C. Prosedur analisis protein (Metode Kjedahl) Tahap Oksidasi
1. Bahan ditimbang 1 g (A) dengan menggunakan alumunium foil. Bahan yang telah ditimbang dimasukkan ke dalam labu Kjeldahl.
2. Tiga g katalis dimasukkan dalam labu Kjeldahl bersama dengan 10 ml H2SO4 pekat untuk mempercepat penguraian.
3. Labu Kjeldahl dipanaskan dalam rak oksidasi/digestion selama 3 hingga 4 jam sampai terjadi perubahan warna menjadi hijau bening.
4. Labu Kjeldahl selanjutnya didinginkan dan kemudian diencerkan dalam erlenmeyer hingga 100 ml.
Tahap destilasi
1. Larutan hasil oksidasi diambil sebanyak 5 ml dan dimasukkan ke dalam labu destilasi dan kemudian ditambah dengan beberapa tetes H2SO4.
17 3. Larutan sampel diambil sebanyak 5 ml dan dimasukkan dalam tabung destilasi melalui corong dan kemudian dibilas dengan aquades lalu 10 ml NaOH 30% dimasukkan melalui corong tersebut dan kemudian ditutup. 4. Campuran alkalin dalam labu destilasi disulin menjadi uap air selama 10
menit setelah tejadi pengembungan pada kondensor. Tahap titrasi
1. Hasil destruksi dititrasi dengan larutan NaOH 0,05 N hingga berubah warna. 2. Hasil volume titran dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
4. Persentase protein dicari dengan menggunakan rumus sebagai berikut : 0,0007 x 6,25 x (ml blanko - ml titran) x 20
Kadar protein = x 100%
A
D. Prosedur analisis lemak Metode estraksi dengan Soxhlet
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110oC selama 1 jam kemudian didinginkan dalam deksikator selama 30 menit dan ditimbang (X1).
2. Bahan ditimbang sebanyak 3 g (A) dan dimasukkan dalam selongsong, setelah itu dimasukkan ke soxhlet yang ditekan dengan pemberat pada bagian atasnya.
3. N-hexan sebanyak 100 sampai 150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa hexan dimasukkan ke dalam labu.
4. Labu yang sudah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan dalam Soxhlet berwarna bening.
5. Labu dilepaskan dari soxhlet dan tetap dipanaskan hingga N-hexan menguap semua.
6. Labu dan lemak yang tersisa dipanaskan dalam oven selama 15 sampai 60 menit, kemudian didinginkan dalam eksikator selama 15 hingga 30 menit dan ditimbang (X2).
7. Persentase lemak dihitung dengan menggunakan rumus :
(X1– X2
Kadar lemak = x 100%
A
E. Prosedur analisis serat kasar (Takeuchi 1988)
1. Kertas saring dipanaskan dalam oven selama 1 jam pada suhu 110oC kemudian didinginkan dalam eksikator lalu ditimbang (X1). Kertas saring
tersebut kemudian dipasang pada corong buchner dan dihubungkan pada vacuum pump untuk mempercepat penyaringan.
2. Bahan ditimbang sebanyak 0,5 g dan dimasukkan dalam Erlenmeyer 250 ml, kemudian ditambah dengan 50 ml H2SO4 0,3 N, lalu dipanaskan di atas
18
3. NaOH 1,5 N sebanyak 25 ml ditambahkan ke larutan tadi dan kemudian dipanaskan kembali selama 30 menit.
4. Larutan dan bahan yang sudah dipanaskan disaring dan dituangkan ke dalam corong buchner, kemudian dibilas berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0,3 N dan 50 ml air panas lagi lalu 25 ml aseton.
5. Cawan porselen disiapkan setelah sebelumnya dipanaskan dalam oven bersuhu 105 sampai 110oC selama 1 jam.
6. Kertas saring dimasukkan ke dalam cawan kemudian dipanaskan dalam oven bersuhu 105 sampai 110oC selama 1 jam lalu didinginkan dalam eksikator selama 15 sampai 30 menit dan ditimbang X2.
7. Cawan kemudian dipanaskan dalam tanur yang bersuhu 600oC hingga berwarna putih atau menjadi abu (kurang lebih 4 jam), lalu dimasukkan dalam oven bersuhu 105 sampai 110oC selama 15 menit kemudian didinginkan dalam desikator selama 15 sampai 30 menit dan kemudian ditimbang (X3)
8. Kandungan serat kasar dihitung dengan menggunakan rumus :
(X1– X2– X3)
Kadar lemak = x 100%
19 Lampiran 2 Prosedur pengukuran Malonaldehida hati dan plasma darah ikan
Plasma darah sebanyak 200 µ l ditambahkan 4 ml larutan yang mengandung TCA 15%, TBA 0,37%, HCl 0,25 N dan BHT 0,5%, di vortex kemudian dipanaskan dalam waterbath pada suhu 80oC selama satu jam. Setelah itu dinginkan sampai mencapai suhu ruang, lalu disentrifus pada 2000 rpm selama 10 menit. Supernatan diukur pada panjang gelombang 532 nm.
Sebagai standar malonaldehida digunakan 1,1,3,3 tetraetoksipropana (TEP). Pembuatan standar TEP yaitu dengan membuat larutan induk 2 mmol/l, kemudian dibuat larutan kerja 0,1 µmol/l. pada suasana asam, TEP terhidrolisis dan menghasilkan hemiasetal dan etanol. Hemiasetal yang terbentuk kemudian terdekomposisi menjadi etanol dan malonaldehida. Penentuan kurva standar dilakukan sama dengan penentuan sampel. Perhitungan kadar malonaldehida sampel berdasarkan hasil plotting nilai absorbansi pada kurva standar.
Prinsip metode ini berdasarkan kepada kemampuan pembentukan komplek berwarna merah jambu antara MDA dan Asam Tiobarbiturat (TBA), (Capeyron et al, 2002). Pembuatan larutan campuran (TCA-TBA) untuk dicampurkan pada pemeriksaan kadar MDA, yaitu: 1,78 ml HCl pekat lalu ditambahkan dengan 12 g TCA dan 0,304 g TBA kemudian diaduk dengan 80 ml akuades. Pengadukan dilakukan di atas pemanas air dengan api kecil. Dinginkan pada suhu ruangan sebelum dicampurkan ke dalam larutan pemeriksaan kadar MDA.
20
Lampiran 3 Prosedur pengukuran aktivitas enzim SOD 1. Persiapan sampel
a. Hati ikan diekstraksi dengan larutan buffer fosfat pH 7,0 dengan perbandingan 1:10. Ekstraksi dilakukan dengan menggunakan pipa kapiler yang dilengkapi dengan syiringe 10 mL di kiri dan kanan pipa. Hasil ekstraksi disentrifuse pada 3000 rpm selama 10 menit dalam keadaan dingin. Supernatan (homogenat) disimpan pada suhu -15oC dan siap digunakan untuk pengukuran aktivitas enzim SOD hati. Untuk sampel darah, diambil plasmanya (supernatan) kemudian disimpan pada suhu -15oC dan siap digunakan untuk pengukuran aktivitas enzim SOD darah. b. Satu mL homogenat hati (untuk aktivitas enzim SOD hati) atau satu mL
plasma (untuk aktivitas enzim SOD darah) ditambahkan dengan 1,6 mL campuran kloroform-etanol 96% (3:5), divorteks selama satu menit kemudian disentrifuse pada 3000 rpm selama 10 menit. Supernatan diambil dan disimpan pada suhu -15oC.
2. Pembuatan larutan epinefrin 0,003 M
a. Larutan epinefrin 0,003 M dibuat dengan cara melarutkan 5,496 mg epinefrin ke dalam 10 mL HCl 0,01 N.
b. Larutan tersebut disimpan dalam botol berwarna. c. Larutan ini tahan untuk beberapa hari.
3. Pengukuran serapan dengan alat spektrofotometer
a. Ke dalam kuvet 3000 µL dimasukkan 2800 µL buffer natrium karbonat 0,05 M pH 10,2, 100 µL sampel (supernata) dan 100 µL larutan epinefrin. b. Serapan dibaca pada panjang gelombang 480 nm pada menit ke 1, 2, 3 dan
4 setelah penambahan epinefrin 0,003 M. perubahan absorban permenit tidak boleh lebih dari 0,025. Sebagai blanko digunakan campuran HCl dan air bebas ion.
21 Lampiran 4 Prosedur analisis gambaran darah pada ikan
Penghitungan sel darah merah (eritrosit), (Blaxhall & Daisley 1973)
Penghitungan dilakukan dengan mengencerkan darah dengan larutan Hayem di dalam pipet pencampuran berskala 101. Di dalam pipet ini tedapat bulir berwarna merah yang berfungsi sebagai pengaduk.
Darah dihisap dengan pipet pencampur hingga mencapai skala 101. Pipet kemudian digoyang membentuk angka delapan selama 3-5 menit agar darah tercampur secara merata. Sebelum dilakukan penghitungan, larutan pada bagian ujung pipet yang tidak teraduk dibuang.
Darah yang telah teraduk kemudian diteteskan ke dalam hemasitometer tipe Neubauer Improved yang telah ditutupi gelas penutup melalui bagiannya yang berlekuk hingga memenuhi seluruh bagian yang berskala. Agar volume darah yang dihitung tepat, kelebihan darah dihisap menggunakan kertas tissue.
Penghitungan dilakukan di bawah mikroskop dengan pembesaran 400 kali pada 10 kotak kecil hemasitometer.
∑ SDM = jumlah sel terhitung x x faktor pengenceran
= jumlah sel terhitung x x 200 = ………..sel/mm3
Penghitungan sel darah putih (leukosit)
Penghitungan dilakukan dengan mengencerkan darah dengan larutan Turk‟s di dalam pipet pencampuran berskala 11. Di dalam pipet ini tedapat bulir berwarna putih yang berfungsi sebagai pengaduk.
Darah dihisap dengan pipet pencampur hingga mencapai skala 0.5, kemudian ditambahkan larutan Turk‟s sampai skala 11. Pipet kemudian digoyang membentuk angka delapan selama 3-5 menit agar darah tercampur secara merata. Sebelum dilakukan penghitungan, larutan pada bagian ujung pipet yang tidak teraduk dibuang.
Darah yang telah teraduk kemudian diteteskan ke dalam hemasitometer tipe Neubauer Improved yang telah ditutupi gelas penutup melalui bagiannya yang berlekuk hingga memenuhi seluruh bagian yang berskala. Agar volume darah yang dihitung tepat, kelebihan darah dihisap menggunakan kertas tissue.
Penghitungan dilakukan di bawah mikroskop dengan pembesaran 400 kali pada 5 kotak besar hemasitometer, lalu dikonversikan sehingga didapat jumlah sel darah putih per mili liter.
Penghitungan Kadar Hemoglobin (Hb)
22
Prosedur Pengukuran Kadar Hemoglobin:
1) Darah dihisap dengan pipet sahli sampai skala 20 mm3 atau pada skala 0,2 mL, bersihkan ujung pipet dengan kertas tissue.
2) Pindahkan darah dalam pipet ke dalam tabung Hb-meter yang telah disi HCl 0,1 N sampai skala 10, aduk selama 3 sampai 5 menit.
3) Tambahkan aquades sampai warna darah dan HCl tersebut seperti warna larutan standar yang ada dalam Hb meter tersebut.
4) Baca skala yaitu dengan melihat permukaan cairan dan dicocokkan dengan skala tabung sahli yang dilihat pada skala jalur gr % yang berarti banyaknya hemoglobin dalam gram per 100 ml darah.
Penghitungan Kadar Hematokrit
Prosedur penghitungan kadar Hematokrit:
1) Celupkan salah satu tabung mikrohematokrit ke dalam tabung yang berisi darah sehingga darah akan merambat secara kapiler sampai mencapai ¾ bagian tabung.
2) Tutup ujung tabung tersebut yang telah berisi darah dengan crytoceal dengan cara menancapkan ujung tabung ke dalam crytoceal kira-kira sedalam 1 mm, sehingga terbentuk sumbat crytoceal.
3) Sentrifugasi tabung mikrohematokrit tersebut dengan kecepatan 3000 rpm selama 5 menit dengan posisi tabung yang bervolume sama berhadapan dan yang bersumbat ada di sebelah luar agar putaran sentrifuge seimbang.
4) Nilai kadar hematokrit dengan cara mengukur panjang bagian darah yang mengendap serta panjang total volume darah yang terdapat di dalam tabung. Persentasikan panjang bagian endepan dibanding dengan panjang volume darah dalam tabung tersebut dalam sataun persen (%). Kadar hematokrit ini mencerminkan banyaknya sel darah (digambarkan dengan padatan/endapan) dalam cairan darah.
Aktivitas fagositosis (AF), (Anderson & Siwicki 1993)
Sebanyak 50 µL darah dimasukkan ke dalam tabung eppendorf, ditambahkan 50 µL suspensi Vibrio alginolyticus dalam PBS (107 sel/ml). Larutan tadi dihomogenkan dan diinkubasi pada suhu ruang selama 20 menit. Sebanyak 5 µL dibuat sediaan ulas dan dikeringkan di udara dan difiksasi dengan metanol selama 5 menit dan dikeringkan. Direndam „dalam pewarna giemsa selama 15 menit, kemudian dicuci dengan air mengalir dan dikeringkan dengan tissue. Dihitung jumlah sel yang menunjukkan proses fagositosis dari 100 sel fagosit yang teramati.
23
RIWAYAT HIDUP
Penulis dilahirkan di Palembang, 10 Agustus 1990 dari pasangan suami istri Bapak Ismi Soib (Alm) dan Ibu Naslah. Penulis merupakan anak ketiga dari lima bersaudara.