KARAKTERISASI BIOPLASTIK POLI-HIDROKSIALKANOAT (PHA) DENGAN PENAMBAHAN POLIOKSIETILEN-(20)-SORBITAN
MONOLAURAT SEBAGAI PEMLASTIS
Oleh :
EVA ROSALINA LUMBANRAJA F34102023
2007
EVA ROSALINA LUMBANRAJA. F34102023. Karakterisasi Bioplastik Poli-hidroksialkanoat (PHA) dengan Penambahan Polioksietilen-(20)-Sorbitan Monolaurat sebagai Pemlastis. Dibawah bimbingan Chilwan Pandji dan Khaswar Syamsu. 2007
RINGKASAN
Perkembangan teknologi berlangsung dengan pesat beberapa dekade terakhir ini. Perkembangannya mengarah pada optimasi pemanfaatan sumber daya terbarukan dan minimalisasi sumber daya tak terbarukan. Salah satu penggunaan sumber daya tak terbarukan saat ini adalah dalam produksi plastik komersial. Plastik dari bahan baku tak terbarukan tersebut mempunyai sifat yang sulit diuraikan oleh alam sehingga menimbulkan masalah pencemaran. Salah satu solusinya adalah dengan pemanfaatan biodegradabel polimer (bioplastik).
Poli-hidroksialkanoat (PHA) termasuk jenis bioplastik poliester yang diproduksi oleh berbagai macam mikroorganisme, seperti bakteri dan ganggang. PHA berpotensi dikomersialisasikan di berbagai macam industri, terutama di sektor medis, sektor pertanian dan sektor pengemasan. Karakteristik plastik yang dihasilkan dari bahan baku PHA bersifat kaku dan rapuh. Hal ini menjadi kendala pemanfaatan PHA sebagai pengganti plastik sintesis yang bersifat elastis, fleksibel dan kuat. Peningkatan karakteristik PHA yang dihasilkan dapat dilakukan dengan cara penambahan zat aditif seperti pemlastis. Polioksietilen-(20)-sorbitan monolaurat atau lebih dikenal dengan nama Tween20 merupakan salah satu jenis pemlastis dari golongan asam lemak tersubstitusi. Penelitian ini bertujuan untuk mengetahui pengaruh penambahan pemlastis Tween20 terhadap karakteristik bioplastik PHA, mendapatkan konsentrasi pemlastis Tween20 yang terbaik berdasarkan sifat elastisitas bioplastik PHA, serta memperkirakan aplikasi yang cocok bagi bioplastik yang dihasilkan.
Proses pembuatan bioplastik dilakukan dengan teknik solution casting dan menggunakan konsentrasi Tween20 sebesar 0% (sebagai kontrol), 5%, 10%, dan 15%. Karakterisasi yang dilakukan pada bioplastik yang dihasilkan antara lain karakterisasi densitas, karakterisasi sifat mekanis, analisa gugus fungsi, karakterisasi sifat termal dan derajat kristalinitas.
Hasil analisa gugus fungsi bioplastik Tween20 0% menunjukkan bahwa bioplastik Tween20 0% mempunyai gugus-gugus penyusun struktur rantai PHA yaitu C=O/C-O-C ester, CH2, OH asam karboksilat, CH serta CH3. Terdapatnya gugus CH3 (metil) pada hasil analisa membuktikan bahwa jenis PHA yang dihasilkan selama proses kultivasi adalah jenis poli-hidroksibutirat (PHB). Hasil analisa gugus fungsi bioplastik Tween20 5% memperlihatkan adanya puncak absorbansi (peak) gugus OH ikatan hidrogen. Hal ini membuktikan bahwa perubahan karakteristik bioplastik PHA dengan penambahan pemlastis Tween20 disebabkan oleh terbentuknya ikatan hidrogen. Hasil analisa gugus fungsi bioplastik 5% bioplastik juga memperlihatkan puncak absorbansi (peak) gugus-gugus dominan penyusun molekul Tween20 yaitu gugus-gugus C-O eter serta C=O/C-O-C ester.
Pada analisa sifat termal, terjadi penurunan titik leleh bioplastik dari 168,72oC pada bioplastik Tween20 0% menjadi 163,88oC pada bioplastik Tween20 5%. Penambahan pemlastis Tween20 dengan konsentrasi 5% juga mampu menurunkan derajat kristalinitas bioplastik Tween20 0% dari 50,52 % menjadi 49,86 % pada bioplastik Tween20 5%.
EVA ROSALINA LUMBANRAJA. F34102023. Characterization of Polyhydroxyalkanoates (PHA) Biopolymer with an Addition of Polyoxyethylene-(20)-Sorbitan Monolaurate Plasticizer. Supervised by Chilwan Pandji and Khaswar Syamsu. 2007.
SUMMARY
Technology is growing strongly this decade on exploring natural resources to minimize the usage of non-renewable resources. Plastics are one of the commodities that mainly use non-renewable resources. The accumulation of these petrochemical based plastics in soils, rivers and lakes leads to a serious waste problem because of their hardly degraded characteristic.
Polyhydroxyalkanoate (PHA) biopolymers are polyesters produced by numerous microorganisms in response to nutrient limitation. The commercial potential for PHA spans many industries, such as medical sectors, agricultural sectors and packaging sectors. The PHA films often remain stiff and brittle for many applications. Various methods have been attempted to improve the PHA physical properties such as addition of plasticizers. Polyoxyethylene-(20)-sorbitan monolaurate or commercially known as Tween20 is a substituted fatty acid plasticizer. The purposes of this research are observing the effects of Tween20 plasticizer addition in PHA bioplastic, obtaining the optimum Tween20 concentration based on the bioplastic’s elastic physical properties and to reckon the suitable application for the bioplastics.
Bioplastic films were made by solution casting technique using 0% (control), 5%, 10% and 15% Tween20 concentration. The bioplastic characterization consists of density measurement, mechanical properties measurement, functional group analysis, thermal properties and degree of crystallinity measurement.
The results of density measurement showed that the increasing of Tween20 concentration caused the decrease of bioplastics density value. The decreasing of density value was caused by the addition of Tween20 plasticizer that changed PHA physical properties from stiff and brittle into more flexible character. The density value for bioplastic with 0%, 5%, 10% and 15% Tween20 concentration respectively are 0,67 g/cm3, 0,64 g/cm3, 0,62 g/cm3, and 0,52 g/cm3. The increasing of Tween20 concentration also caused the decreasing of tensile strength value. The tensile strength value for bioplastic with 0%, 5%, 10% and 15% Tween20 concentration respectively are 3,11 MPa, 2,28 MPa, 2,26 MPa, and 1,38 MPa. The addition of 5% Tween20 concentration can increase the bioplastic elongation at break value from 1,06% to 1,22% which indicates the increasing of bioplastic’s elasticity. However the bioplastic elongation at break value decreases at 10% and 15% Tween20 concentration.
addition of Tween20 was caused by the forming of hydrogen bonding. The functional group analysis for 5% Tween20 bioplastic also showed the Tween20 dominant functional group such as C=O/C-O-C ester, and C-O eter.
The addition of 5% Tween20 concentration can decrease the PHA’s melting point from 168,72oC to 163,88oC. The addition of 5% Tween20 concentration can also decrease the PHA’s degree of crystallinity from 50,52 % to 49,86 %.
KARAKTERISASI BIOPLASTIK POLI-HIDROKSIALKANOAT (PHA) DENGAN PENAMBAHAN POLIOKSIETILEN-(20)-SORBITAN
MONOLAURAT SEBAGAI PEMLASTIS
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
EVA ROSALINA LUMBANRAJA F34102023
2007
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
KARAKTERISASI BIOPLASTIK POLI-HIDROKSIALKANOAT (PHA) DENGAN PENAMBAHAN POLIOKSIETILEN-(20)-SORBITAN
MONOLAURAT SEBAGAI PEMLASTIS
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
EVA ROSALINA LUMBANRAJA F34102023
Dilahirkan pada tanggal 4 Januari 1984 Di Bandar Lampung
Tanggal Kelulusan : 31 Januari 2007
Menyetujui, Bogor, Februari 2007
Drs. Chilwan Pandji, Apt. M.Sc. Pembimbing I
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung tanggal 4 Januari 1984. Penulis merupakan anak kedua dari Bapak J. Lumbanraja dan Ibu Rosma Hasibuan. Pada tahun 1991 sampai dengan 1996 penulis mengikuti pendidikan formal di SD Xaverius No.1 Tanjung Karang. Penulis melanjutkan pendidikan tingkat menengah di SLTP Fransiscus Bandar Lampung dan menyelesaikannya pada tahun 1999. Penulis menamatkan pendidikan tingkat atas di SMU Negeri 2 Bandar Lampung pada tahun 2002.
Penulis diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor pada tahun 2002 melalui jalur USMI (Undangan Seleksi Masuk IPB). Penulis aktif di Himpunan Profesi Teknologi Industri (HIMALOGIN) periode 2003-2004. Penulis juga aktif di Unit Kegiatan Mahasiswa (UKM) Persekutuan Mahasiswa Kristen (PMK) pada tahun 2004-2005. Semasa kuliah penulis pernah menjadi asisten praktikum matakuliah Teknologi Minyak Atsiri dan Kosmetika dan Laboratorium Bioproses pada tahun ajaran 2005/2006. Penulis mendapatkan beasiswa Bantuan Belajar Mahasiswa (BBM) untuk periode 2006. Penulis melaksanakan kegiatan Praktek Lapang dengan judul ”Mempelajari Aspek Teknologi Pengolahan Kelapa Sawit (Elaeis guineensis JACQ.) di Unit Usaha Bekri – PTPN VII, Lampung” pada tanggal 1 Juli sampai dengan 27 Agustus 2005.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi yang berjudul “Karakterisasi Bioplastik Poli-hidroksialkanoat (PHA) dengan Penambahan
Polioksietilen-(20)-Sorbitan Monolaurat Sebagai Pemlastis”adalah karya saya sendiri, dengan arahan dosen pembimbing akademik. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2007 Yang Membuat Pernyataan
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa, atas segala berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi ini berjudul “Karakterisasi Bioplastik Poli-hidroksialkanoat (PHA) dengan Penambahan Polioksietilen-(20)-Sorbitan Monolaurat Sebagai Pemlastis” sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian (STP) pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Penulis menyadari selama pelaksanaan penelitian dan penulisan skripsi ini tidak luput dari bantuan berbagai pihak. Pada kesempatan ini penulis mengucapkan terima kasih sebesar-besarnya kepada :
1. Bpk. Drs. Chilwan Pandji, Apt. M.Sc. selaku dosen pembimbing I dan Bpk. Dr. Ir. Khaswar Syamsu, M.Sc. selaku dosen pembimbing II atas segala bimbingan, arahan, serta bantuannya sehingga penulis dapat menyelesaikan skripsi ini.
2. Bpk. Drs. Purwoko, M.Si. selaku dosen penguji atas saran dan masukan bagi perbaikan skripsi ini.
3. Para Laboran PAU (Mba Pepi, Mba Emi, Bu Eni, Pak Mulya dan Laboran PAU lainnya) yang telah memberi bantuan dan dorongan selama penelitian. 4. Staf administrasi dan para Laboran Departemen Teknologi Industri Pertanian
(Bu Sri, Pak Edi, Pak Sugi, Bu Nina, Pak Anwar dan lainnya) yang banyak membantu penulis selama penelitian hingga terselesainya skripsi ini.
5. Orang tua (Daddy dan Mama), saudara (Rosy dan Anggita) dan seluruh keluarga penulis yang telah memberikan dorongan, semangat, serta kasih sayang yang sangat berlimpah.
6. Teman-teman satu perjuangan “Bioplastic team” (Juari, Vico, Dede, Dosi, Iwal, Bana, Evi dan Maria Ulfah) atas kebersamaan dalam suka dan duka selama penelitian serta penyelesaian skripsi.
KARAKTERISASI BIOPLASTIK POLI-HIDROKSIALKANOAT (PHA) DENGAN PENAMBAHAN POLIOKSIETILEN-(20)-SORBITAN
MONOLAURAT SEBAGAI PEMLASTIS
Oleh :
EVA ROSALINA LUMBANRAJA F34102023
2007
EVA ROSALINA LUMBANRAJA. F34102023. Karakterisasi Bioplastik Poli-hidroksialkanoat (PHA) dengan Penambahan Polioksietilen-(20)-Sorbitan Monolaurat sebagai Pemlastis. Dibawah bimbingan Chilwan Pandji dan Khaswar Syamsu. 2007
RINGKASAN
Perkembangan teknologi berlangsung dengan pesat beberapa dekade terakhir ini. Perkembangannya mengarah pada optimasi pemanfaatan sumber daya terbarukan dan minimalisasi sumber daya tak terbarukan. Salah satu penggunaan sumber daya tak terbarukan saat ini adalah dalam produksi plastik komersial. Plastik dari bahan baku tak terbarukan tersebut mempunyai sifat yang sulit diuraikan oleh alam sehingga menimbulkan masalah pencemaran. Salah satu solusinya adalah dengan pemanfaatan biodegradabel polimer (bioplastik).
Poli-hidroksialkanoat (PHA) termasuk jenis bioplastik poliester yang diproduksi oleh berbagai macam mikroorganisme, seperti bakteri dan ganggang. PHA berpotensi dikomersialisasikan di berbagai macam industri, terutama di sektor medis, sektor pertanian dan sektor pengemasan. Karakteristik plastik yang dihasilkan dari bahan baku PHA bersifat kaku dan rapuh. Hal ini menjadi kendala pemanfaatan PHA sebagai pengganti plastik sintesis yang bersifat elastis, fleksibel dan kuat. Peningkatan karakteristik PHA yang dihasilkan dapat dilakukan dengan cara penambahan zat aditif seperti pemlastis. Polioksietilen-(20)-sorbitan monolaurat atau lebih dikenal dengan nama Tween20 merupakan salah satu jenis pemlastis dari golongan asam lemak tersubstitusi. Penelitian ini bertujuan untuk mengetahui pengaruh penambahan pemlastis Tween20 terhadap karakteristik bioplastik PHA, mendapatkan konsentrasi pemlastis Tween20 yang terbaik berdasarkan sifat elastisitas bioplastik PHA, serta memperkirakan aplikasi yang cocok bagi bioplastik yang dihasilkan.
Proses pembuatan bioplastik dilakukan dengan teknik solution casting dan menggunakan konsentrasi Tween20 sebesar 0% (sebagai kontrol), 5%, 10%, dan 15%. Karakterisasi yang dilakukan pada bioplastik yang dihasilkan antara lain karakterisasi densitas, karakterisasi sifat mekanis, analisa gugus fungsi, karakterisasi sifat termal dan derajat kristalinitas.
Hasil analisa gugus fungsi bioplastik Tween20 0% menunjukkan bahwa bioplastik Tween20 0% mempunyai gugus-gugus penyusun struktur rantai PHA yaitu C=O/C-O-C ester, CH2, OH asam karboksilat, CH serta CH3. Terdapatnya gugus CH3 (metil) pada hasil analisa membuktikan bahwa jenis PHA yang dihasilkan selama proses kultivasi adalah jenis poli-hidroksibutirat (PHB). Hasil analisa gugus fungsi bioplastik Tween20 5% memperlihatkan adanya puncak absorbansi (peak) gugus OH ikatan hidrogen. Hal ini membuktikan bahwa perubahan karakteristik bioplastik PHA dengan penambahan pemlastis Tween20 disebabkan oleh terbentuknya ikatan hidrogen. Hasil analisa gugus fungsi bioplastik 5% bioplastik juga memperlihatkan puncak absorbansi (peak) gugus-gugus dominan penyusun molekul Tween20 yaitu gugus-gugus C-O eter serta C=O/C-O-C ester.
Pada analisa sifat termal, terjadi penurunan titik leleh bioplastik dari 168,72oC pada bioplastik Tween20 0% menjadi 163,88oC pada bioplastik Tween20 5%. Penambahan pemlastis Tween20 dengan konsentrasi 5% juga mampu menurunkan derajat kristalinitas bioplastik Tween20 0% dari 50,52 % menjadi 49,86 % pada bioplastik Tween20 5%.
EVA ROSALINA LUMBANRAJA. F34102023. Characterization of Polyhydroxyalkanoates (PHA) Biopolymer with an Addition of Polyoxyethylene-(20)-Sorbitan Monolaurate Plasticizer. Supervised by Chilwan Pandji and Khaswar Syamsu. 2007.
SUMMARY
Technology is growing strongly this decade on exploring natural resources to minimize the usage of non-renewable resources. Plastics are one of the commodities that mainly use non-renewable resources. The accumulation of these petrochemical based plastics in soils, rivers and lakes leads to a serious waste problem because of their hardly degraded characteristic.
Polyhydroxyalkanoate (PHA) biopolymers are polyesters produced by numerous microorganisms in response to nutrient limitation. The commercial potential for PHA spans many industries, such as medical sectors, agricultural sectors and packaging sectors. The PHA films often remain stiff and brittle for many applications. Various methods have been attempted to improve the PHA physical properties such as addition of plasticizers. Polyoxyethylene-(20)-sorbitan monolaurate or commercially known as Tween20 is a substituted fatty acid plasticizer. The purposes of this research are observing the effects of Tween20 plasticizer addition in PHA bioplastic, obtaining the optimum Tween20 concentration based on the bioplastic’s elastic physical properties and to reckon the suitable application for the bioplastics.
Bioplastic films were made by solution casting technique using 0% (control), 5%, 10% and 15% Tween20 concentration. The bioplastic characterization consists of density measurement, mechanical properties measurement, functional group analysis, thermal properties and degree of crystallinity measurement.
The results of density measurement showed that the increasing of Tween20 concentration caused the decrease of bioplastics density value. The decreasing of density value was caused by the addition of Tween20 plasticizer that changed PHA physical properties from stiff and brittle into more flexible character. The density value for bioplastic with 0%, 5%, 10% and 15% Tween20 concentration respectively are 0,67 g/cm3, 0,64 g/cm3, 0,62 g/cm3, and 0,52 g/cm3. The increasing of Tween20 concentration also caused the decreasing of tensile strength value. The tensile strength value for bioplastic with 0%, 5%, 10% and 15% Tween20 concentration respectively are 3,11 MPa, 2,28 MPa, 2,26 MPa, and 1,38 MPa. The addition of 5% Tween20 concentration can increase the bioplastic elongation at break value from 1,06% to 1,22% which indicates the increasing of bioplastic’s elasticity. However the bioplastic elongation at break value decreases at 10% and 15% Tween20 concentration.
addition of Tween20 was caused by the forming of hydrogen bonding. The functional group analysis for 5% Tween20 bioplastic also showed the Tween20 dominant functional group such as C=O/C-O-C ester, and C-O eter.
The addition of 5% Tween20 concentration can decrease the PHA’s melting point from 168,72oC to 163,88oC. The addition of 5% Tween20 concentration can also decrease the PHA’s degree of crystallinity from 50,52 % to 49,86 %.
KARAKTERISASI BIOPLASTIK POLI-HIDROKSIALKANOAT (PHA) DENGAN PENAMBAHAN POLIOKSIETILEN-(20)-SORBITAN
MONOLAURAT SEBAGAI PEMLASTIS
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
EVA ROSALINA LUMBANRAJA F34102023
2007
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
KARAKTERISASI BIOPLASTIK POLI-HIDROKSIALKANOAT (PHA) DENGAN PENAMBAHAN POLIOKSIETILEN-(20)-SORBITAN
MONOLAURAT SEBAGAI PEMLASTIS
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
EVA ROSALINA LUMBANRAJA F34102023
Dilahirkan pada tanggal 4 Januari 1984 Di Bandar Lampung
Tanggal Kelulusan : 31 Januari 2007
Menyetujui, Bogor, Februari 2007
Drs. Chilwan Pandji, Apt. M.Sc. Pembimbing I
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung tanggal 4 Januari 1984. Penulis merupakan anak kedua dari Bapak J. Lumbanraja dan Ibu Rosma Hasibuan. Pada tahun 1991 sampai dengan 1996 penulis mengikuti pendidikan formal di SD Xaverius No.1 Tanjung Karang. Penulis melanjutkan pendidikan tingkat menengah di SLTP Fransiscus Bandar Lampung dan menyelesaikannya pada tahun 1999. Penulis menamatkan pendidikan tingkat atas di SMU Negeri 2 Bandar Lampung pada tahun 2002.
Penulis diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor pada tahun 2002 melalui jalur USMI (Undangan Seleksi Masuk IPB). Penulis aktif di Himpunan Profesi Teknologi Industri (HIMALOGIN) periode 2003-2004. Penulis juga aktif di Unit Kegiatan Mahasiswa (UKM) Persekutuan Mahasiswa Kristen (PMK) pada tahun 2004-2005. Semasa kuliah penulis pernah menjadi asisten praktikum matakuliah Teknologi Minyak Atsiri dan Kosmetika dan Laboratorium Bioproses pada tahun ajaran 2005/2006. Penulis mendapatkan beasiswa Bantuan Belajar Mahasiswa (BBM) untuk periode 2006. Penulis melaksanakan kegiatan Praktek Lapang dengan judul ”Mempelajari Aspek Teknologi Pengolahan Kelapa Sawit (Elaeis guineensis JACQ.) di Unit Usaha Bekri – PTPN VII, Lampung” pada tanggal 1 Juli sampai dengan 27 Agustus 2005.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi yang berjudul “Karakterisasi Bioplastik Poli-hidroksialkanoat (PHA) dengan Penambahan
Polioksietilen-(20)-Sorbitan Monolaurat Sebagai Pemlastis”adalah karya saya sendiri, dengan arahan dosen pembimbing akademik. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2007 Yang Membuat Pernyataan
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa, atas segala berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi ini berjudul “Karakterisasi Bioplastik Poli-hidroksialkanoat (PHA) dengan Penambahan Polioksietilen-(20)-Sorbitan Monolaurat Sebagai Pemlastis” sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian (STP) pada Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Penulis menyadari selama pelaksanaan penelitian dan penulisan skripsi ini tidak luput dari bantuan berbagai pihak. Pada kesempatan ini penulis mengucapkan terima kasih sebesar-besarnya kepada :
1. Bpk. Drs. Chilwan Pandji, Apt. M.Sc. selaku dosen pembimbing I dan Bpk. Dr. Ir. Khaswar Syamsu, M.Sc. selaku dosen pembimbing II atas segala bimbingan, arahan, serta bantuannya sehingga penulis dapat menyelesaikan skripsi ini.
2. Bpk. Drs. Purwoko, M.Si. selaku dosen penguji atas saran dan masukan bagi perbaikan skripsi ini.
3. Para Laboran PAU (Mba Pepi, Mba Emi, Bu Eni, Pak Mulya dan Laboran PAU lainnya) yang telah memberi bantuan dan dorongan selama penelitian. 4. Staf administrasi dan para Laboran Departemen Teknologi Industri Pertanian
(Bu Sri, Pak Edi, Pak Sugi, Bu Nina, Pak Anwar dan lainnya) yang banyak membantu penulis selama penelitian hingga terselesainya skripsi ini.
5. Orang tua (Daddy dan Mama), saudara (Rosy dan Anggita) dan seluruh keluarga penulis yang telah memberikan dorongan, semangat, serta kasih sayang yang sangat berlimpah.
6. Teman-teman satu perjuangan “Bioplastic team” (Juari, Vico, Dede, Dosi, Iwal, Bana, Evi dan Maria Ulfah) atas kebersamaan dalam suka dan duka selama penelitian serta penyelesaian skripsi.
8. Sahabat-sahabat penulis (Fitri, Harti, Fifi, Vico, Yoga dan Santo) atas semua kebersamaan, dorongan, serta bantuan yang telah diberikan.
9. Teman-teman Komisi Kesenian ‘39 (Jimmy, Ico, Risna, Siera, Julia, Aninda, Julian, Benjo, Ochi, Ruth) atas keceriaan dan kebersamaan yang diberikan. 10. Penghuni Ar-riyadhers yang terdahulu maupun masa sekarang, atas segala
kekeluargaan yang diberikan kepada penulis.
11. Teman-teman TIN 39 atas kebersamaannya selama ini. 12. Pihak-pihak lain yang tidak dapat disebutkan satu persatu.
Penulis menyadari skripsi ini masih jauh dari sempurna sehingga kritik dan saran yang membangun senantiasa diharapkan. Semoga skripsi ini memberikan manfaat dan wawasan bagi yang membaca.
Bogor, Januari 2007
DAFTAR ISI
2. Polioksietilen-(20)-sorbitan monolaurat ... 11 E. PENGUJIAN KARAKTERISTIK BIOPLASTIK ... 13 F. APLIKASI BIOPLASTIK PHA ... 17 III METODOLOGI PENELITIANb. Penentuan perbandingan PHA dan kloroform ... 25 c. Penentuan konsentrasi pemlastis Tween20 ... 25 3. Penelitian Utama ... 26 a. Pembuatan bioplastik untuk karakterisasi... 26 b. Karakterisasi bioplastik... 27 4. Analisa Data ... 30 D. TEMPAT DAN WAKTU PENELITIAN ... 31 IV HASIL DAN PEMBAHASAN
DAFTAR TABEL
Halaman Tabel 1. Karakteristik PHB dan polipropilen ... 6 Tabel 2. Daerah spektrum infra merah ... 16 Tabel 3. Komposisi media propagasi dan media kultivasi PHA ... 21 Tabel 4. Komposisi larutan mikroelemen ... 22 Tabel 5. Formulasi bioplastik untuk karakterisasi ... 26 Tabel 6. Hasil penentuan perbandingan PHA dan kloroform ... 33 Tabel 7. Hasil penentuan konsentrasi pemlastis Tween20... 34 Tabel 8. Identifikasi gugus fungsi bioplastik ... 48 Tabel 9. Hasil pengukuran derajat kristalinitas berdasarkan entalpi
DAFTAR GAMBAR
Halaman Gambar 1. Struktur umum poli-hidroksialkanoat (PHA) ... 4 Gambar 2. Struktur model granula PHB ... 5 Gambar 3. Tahap sintesis PHB dengan penggunaan enzim (1)
β-ketothio-lase, (2) asetoasetil-CoA reduktase, (3) PHB polimerase... 8 Gambar 4. Reaksi hidrolisa pati... 9 Gambar 5. Reaksi pembentukan polioksietilen-(20)-sorbitan monolaurat.. 12 Gambar 6. Kurva tegangan-regangan... 14 Gambar 7. Transisi termal polimer ... 15 Gambar 8. Serbuk PHA ... 32 Gambar 9. Lembaran bioplastik dengan konsentrasi Tween20 (a) 6%,
(b) 9%, (c) 13%, (d) 18%... 35 Gambar 10. Lembaran bioplastik PHA dengan konsentrasi Tween20 (a)
0%, (b) 5%, (c) 10%, (d) 15%... 36 Gambar 11. Grafik hubungan densitas dan konsentrasi Tween20 ... 37 Gambar 12. Proses pembentukan (a) ikatan hidrogen antara (b) PHA dan
(c) Tween20 ... 38 Gambar 13. Grafik hubungan kekuatan tarik dan konsentrasi Tween20 ... 39 Gambar 14. Grafik hubungan perpanjangan putus dan konsentrasi
Tween20 ... 40 Gambar 15. Kurva tegangan-regangan bioplastik ... 43 Gambar 16. Karakteristik kurva tegangan-regangan lima tipe bahan
polimer ... 40 Gambar 17. Mekanisme kerja obat lepas lambat (slow release medicine).... 45 Gambar 18. Hasil FTIR pada bioplastik Tween20 0% (a) dan bioplastik
Tween20 5% (b) ... 46 Gambar 19. Hasil analisa termal DSC pada bioplastik Tween20 0% (a)
DAFTAR LAMPIRAN
I. PENDAHULUAN
A. LATAR BELAKANG
Perkembangan teknologi berlangsung dengan pesat beberapa dekade terakhir ini. Perkembangannya mengarah pada optimasi pemanfaatan sumber daya terbarukan dan minimalisasi sumber daya tak terbarukan. Salah satu penggunaan sumber daya tak terbarukan saat ini adalah dalam produksi plastik komersial. Menurut Ren (2002), lebih dari 99% plastik saat ini terbuat dari bahan baku minyak bumi. Plastik dari bahan baku tak terbarukan tersebut mempunyai sifat yang sulit diuraikan oleh alam sehingga menimbulkan masalah pencemaran. Plastik yang memanfaatkan sumber daya terbarukan serta dapat didegradasi secara alami merupakan solusi bagi persoalan tersebut. Jenis plastik yang dapat terdegradasi secara alami oleh alam disebut sebagai polimer biodegradabel (bioplastik). Biro Pusat Statistik (1999) memproyeksikan produksi bioplastik dunia tahun 2010 akan mencapai 1,2 juta ton dan Amerika Serikat merupakan produsen terbesar. Salah satu jenis polimer biodegradabel yang terbuat dari sumber daya terbarukan yaitu poli-hidroksialkanoat (PHA). PHA merupakan poliester alami yang dapat diproduksi oleh mikroorganisme, seperti bakteri dan ganggang.
Polioksietilen-(20)-sorbitan monolaurat atau yang lebih dikenal dengan nama Tween20 merupakan salah satu jenis pemlastis dari golongan asam lemak tersubstitusi. Tween20 bersifat tidak beracun (non toxic) karena terbuat dari bahan alami yaitu minyak kelapa dan bersifat biodegradabel. Penggunaan zat Tween20 sebagai pemlastis diharapkan mampu meningkatkan sifat elastisitas bioplastik PHA yang dihasilkan tanpa mengubah sifat-sifat penting dari bioplastik PHA tersebut yaitu dapat terdegradasi secara alami dan bersifat tidak beracun.
B. TUJUAN
1. Mengetahui pengaruh penambahan pemlastis Tween20 terhadap karakteristik bioplastik PHA yang dihasilkan.
2. Mendapatkan konsentrasi pemlastis Tween20 yang terbaik berdasarkan sifat elastisitas bioplastik PHA yang dihasilkan
II. TINJAUAN PUSTAKA
C. POLIMER BIODEGRADABEL
Menurut Huang dan Edelman di dalam Scott dan Gilead (1995), polimer biodegradabel dapat dibagi menjadi menjadi tiga kelas : (1) polimer alami yang diperoleh dari tanaman maupun hewan (selulosa, pati, protein, kolagen, dan sebagainya), (2) biosintesis polimer yang diproduksi melalui proses kultivasi dengan penggunaan mikroorganisme (poli-hidroksialkanoat), (3) polimer sintetis yang memiliki sifat biodegradabel (polikaprolakton, asam polilaktat). Polimer alami seperti selulosa dan pati tidak dapat diproses secara termal apabila tidak dimodifikasi. Selulosa memiliki suhu degradasi yang lebih rendah dari titik lelehnya sehingga tidak dapat diproses dengan cara pelelehan yang umumnya digunakan dalam pembuatan plastik. Morfologi daerah kristalin yang rumit serta ikatan hidrogen juga menyebabkan selulosa sulit dilarutkan dalam pelarut.
Selulosa termodifikasi, seperti selulosa ester, dapat diproses dengan cara pelelehan seperti polimer termoplastik lainnya karena titik lelehnya dapat diturunkan secara signifikan dibawa suhu degradasinya (Sealey et al, 1996). Pati termodifikasi juga dapat dicampur dengan polimer sintetis untuk mendapatkan sifat biodegradabel dari hasil pencampuran tersebut (Maddever dan Campbell di dalam Barengerg et al, 1990). Poli-hidroksialkanoat (PHA) merupakan substitusi plastik sintetis yang menjanjikan karena sifat polimernya menyebabkannya mampu diproses dengan peralatan konvensional pembuat plastik pada umumnya walaupun tanpa modifikasi polimer (Lee, 1996).
1. Poli-hidroksialkanoat (PHA)
bakteri, dan dapat digunakan sebagai pengganti plastik sintetis pada berbagai aplikasi. Karakteristik fisiknya serupa dengan plastik konvensional dan dapat didaur ulang. Namun karakteristik utama dari PHA yaitu sifat biodegradasinya, dimana dapat didegradasi secara enzimatis menjadi karbondioksida (CO2) dan air (H2O) (Lee, 1996).
Menurut Ojumu et al (2004), sekitar 250 jenis bakteri, baik gram negatif maupun gram positif, dapat memproduksi PHA dalam granula selnya. Namun hanya beberapa jenis bakteri yang mampu memproduksi PHA dalam jumlah yang besar, yaitu jenis Alcaligenes latus, Pseudomonas oleveorans, Ralstonia eutropha, dan rekombinan E. Coli. (Chakrabortyet al, 2004).
PHA terbentuk dari monomer asam lemak 3-hidroksi, dimana gugus karboksil (C=O) dari satu monomer teresterifikasi oleh gugus hidroksil (O-H) dari monomer lainnya (Madison dan Huisman, 1999). Terdapat lebih dari 90 jenis variasi monomer unit pembentuk rantai PHA yang diproduksi dari berbagai jenis bakteri. Struktur umum PHA dapat dilihat pada Gambar 1.
Gambar 1. Struktur umum poli-hidroksialkanoat (PHA) (Ojumuet al, 2004)
2. Poli (3-hidroksibutirat) (PHB)
PHB merupakan polimer linier yang termasuk golongan PHA dengan variasi gugus karboksil dan metil di sepanjang rantai polimernya. Sifat PHB yang tahan terhadap kelembaban serta tidak larut air yang membedakan polimer ini dengan polimer biodegradabel lainnya yang sensitif terhadap kelembaban serta larut dalam air. PHB juga merupakan barier yang baik terhadap oksigen (Holmes di dalam Bassett, 1988).
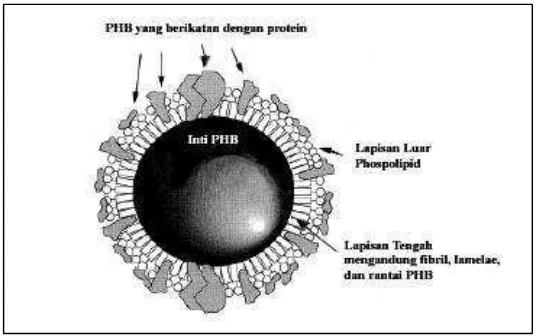
Secara morfologi, ukuran granula PHB di dalam sel bakteri diameternya bervariasi antara 100 nm – 800 nm dan diselubungi oleh lapisan non membran dengan ketebalan 2 – 4 nm. Pada umumnya, komposisi PHB yang terisolasi dari granula yaitu 98% PHB dan 2% protein (Laffertyet aldi dalam Rehm dan Reed, 1988).
Gambar 2. Struktur model granula PHB (Ramachander, 2003)
sel, substrat yang digunakan, serta kondisi kultivasi (suhu, tekanan oksigen parsial) (Laffertyet aldi dalam Rehm dan Reed, 1988).
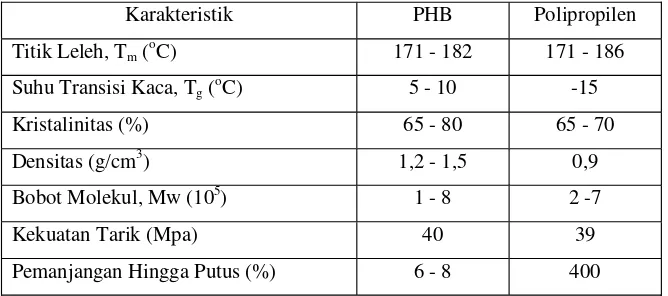
Menurut Lafferty et al di dalam Rehm dan Reed (1988), PHB yang diisolasi dari biomassa sel mempunyai densitas (berat jenis) antara 1,171 -1,260 g/cm3. Nilai densitas yang rendah menunjukkan densitas amorf yang lebih besar daripada nilai densitas kristalin. Karakteristik polimer PHB mirip dengan plastik konvensional seperti polipropilen (Lee, 1996). Tabel 1 menunjukkan perbandingan karakteristik PHB dan polipropilen.
Tabel 1. Karakteristik PHB dan Polipropilen.
Karakteristik PHB Polipropilen
Pemanjangan Hingga Putus (%) 6 - 8 400
Sumber: Brandlet al (1990) di dalam Atkinson dan Mavituna (1991)
Titik leleh (Tm) PHB yang bervariasi di antara 157oC – 188oC, mendekati suhu degradasinya (185oC – 250oC) sehingga menyebabkan beberapa proses PHB dengan menggunakan pemanasan sulit untuk dilakukan (Lafferty et al di dalam Rehm dan Reed 1988; Ojumu et al, 2004). Oleh karena itu banyak penelitian dilakukan untuk menurunkan titik leleh PHB tanpa mengubah suhu degradasinya.
saat proses ekstraksi dari biomassa (Lafferty et al di dalam Rehm dan Reed, 1988).
D. RALSTONIA EUTROPHA DAN SINTESIS PHB
Ralstonia eutropha (sebelumnya dikenal dengan nama Alcaligenes eutrophus) merupakan galur bakteri yang banyak digunakan dalam produksi PHA karena bakteri ini mampu mengakumulasi PHA dalam selnya hingga mencapai 80% dari berat kering sel (Lee, 1996).Ralstonia eutropha termasuk bakteri aerobik gram negatif yang dapat diisolasi dari tanah maupun air. Suhu optimum pertumbuhannya berkisar antara 20-37oC (Chakrabortyet al, 2004).
Lafferty et al di dalam Rehm dan Reed (1988) mengatakan bahwa akumulasi pertumbuhan PHA dapat distimulasi pada kondisi pertumbuhan yang tidak seimbang, yaitu pada saat zat nutrien seperti nitrogen, pospat, dan sulfat dalam jumlah terbatas, sedangkan konsentrasi oksigen rendah, atau pada saat rasio C : N yang tinggi pada substrat umpan. Selain keterbatasan nitrogen, pospat, oksigen dan sulfat, akumulasi PHA juga dapat distimulasi oleh kekurangan zat ferum, magnesium, mangan, potasium dan sodium.
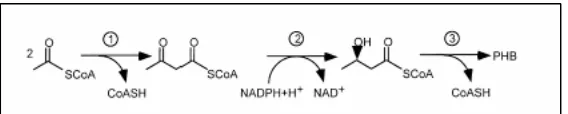
Menurut Doi (1990), saat kondisi pertumbuhan dalam keadaan tidak seimbang, asetil-CoA tidak dapat masuk ke dalam siklus TCA (asam trikarboksilat) karena tingginya konsentrasi NADH. Tingginya konsentrasi NADH merupakan akibat dari kurangnya zat nitrogen sehingga menyebabkan terhentinya sintesis protein. Tingginya konsentrasi NADH menyebabkan terhambatnya enzim sitrat sintase yang merupakan enzim kunci pada siklus TCA, sehingga berakibat pada bertambahnya jumlah asetil-CoA. Asetil-CoA kemudian digunakan sebagai substrat bagi biosintesis PHB dengan menggunakan tiga reaksi enzimatis (Gambar 3).
Enzim β-ketothiolase mengkondensasi asetil-CoA menjadi
Gambar 3. Tahap sintesis PHB dengan penggunaan enzim : (1)β-ketothiolase, (2) asetoasetil-CoA reduktase, (3) PHB polimerase. (Zinnet al, 2001).
Kandungan sel bakteri Ralstonia eutropha antara lain polipospat, glikogen, mesosom, serta PHA sebagai cadangan makanannya. Jenis komposisi polimer yang terbentuk dalam sel bakteri Ralstonia eutropha dipengaruhi oleh substrat yang digunakan (Doi, 1990). Jenis polimer yang diproduksi oleh Ralstonia eutropha adalah homopolimer PHB dengan penggunaan glukosa maupun fruktosa sebagai substrat. Komposisi kopolimer 3-hidroksibutirat dan 3-hidroksivalerat (3HB-3HV) dapat terbentuk dengan penggunaan asam propionik dan glukosa sebagai substrat (Doiet aldi dalam Dawes, 1990).
E. HIDROLISAT PATI SAGU
Produksi polimer biodegradabel dalam skala besar menjadi terbatas karena mahalnya substrat yang digunakan serta rendahnya produksi polimer. Hal ini menyebabkan PHA sebagai polimer biodegradabel tidak mampu bersaing dengan plastik sintesis di pasar komersial (Yamane, 1993). Oleh karena itu dikembangkan berbagai cara untuk mendapatkan PHA dengan produksi yang tinggi namun menggunakan substrat yang murah.
merupakan negara yang sudah memanfaatkan sagu sebagai bahan baku industri plastik biodegradabel (Abner dan Miftahorrahman, 2002).
Menurut Pandji (1988), sirup glukosa adalah suatu larutan kental yang diperoleh dari hidrolisa pati secara tidak sempurna dengan katalis asam atau enzim. Sirup glukosa dapat dihasilkan dari bahan-bahan pertanian yang mengandung pati seperti sagu, singkong, tebu, dan sebagainya. Pembuatan sirup glukosa pada prinsipnya merupakan penguraian polisakarida (pati) menjadi monosakarida. Pati tidak mempunyai rasa manis tetapi apabila unit-unit glukosa dibebaskan dari polimernya maka akan menimbulkan rasa manis. Pelepasan unit glukosa tersebut dilakukan dengan proses hidrolisis. Reaksi selama proses hidrolisa pati dapat dilihat pada Gambar 4.
Gambar 4. Reaksi hidrolisa pati (Pandji, 1988)
Pemecahan polisakarida menjadi glukosa dilakukan dalam beberapa tahap. Tahap tersebut yaitu tahap likuifikasi dan tahap sakarifikasi. Likuifikasi adalah proses pencairan gel pati melalui hidrolisa pati menjadi molekul-molekul oligosakarida atau yang disebut dengan dekstrin. Sakarifikasi merupakan tahap lanjutan dari tahap likuifikasi untuk menghidrolisa pati atau oligosakarida menjadi glukosa yang mempunyai rasa manis. (Pandji, 1988).
keaktifan enzim sangat penting. Enzim α-amilase dari Bacillus subtilis mempunyai pH optimum antara 5,8– 6,0 (Fullbrook di dalam Dzieldzic dan Kearsley, 1984).
Glukoamilase atau amiloglukosidase atau AMG yang digunakan pada tahap sakarifikasi merupakan eksoenzim, yaitu enzim yang bekerja melepaskan unit glukosa secara berturut-turut dari ujung non reduksi pati. AMG mempunyai keaktifan optimal pada pH 4-5 dengan suhu 50-60oC. Pada tahap sakarifikasi ini terjadi hidrolisis oligosakarida atau dekstrin menjadi glukosa. Tidak seperti liquifikasi yang hanya memakan waktu sekitar 60 menit, sakarifikasi biasanya memakan waktu yang lebih lama yaitu 24-96 jam (Fullbrook di dalam Dzieldzic dan Kearsley, 1984).
F. PEMLASTIS 1. Definisi
Menurut Banker (1966) pemlastis adalah substansi non volatil yang mempunyai titik didih yang tinggi dan jika ditambahkan ke dalam materi lain dapat mengubah sifat fisik maupun sifat mekanik materi tersebut. Jika ditambahkan pada suatu polimer, pemlastis dapat menyebabkan penurunan gaya tarik intermolekul sehingga polimer menjadi lebih fleksibel dan lebih mudah untuk diproses (Knapczyk dan Simon di dalam Kent, 1992).
Pemlastis yang ditambahkan ke dalam suatu polimer cenderung menurunkan modulus dan kekuatan tarik polimer tersebut. Namun pada saat yang bersamaan, pemlastis yang ditambahkan dapat meningkatkan perpanjangan putus, kekuatan tubruk, dan kekuatan robek dari produk polimer tersebut. Pemlastis juga menurunkan titik leleh komposisi sehingga dapat dilelehkan pada suhu yang lebih rendah (Figuly, 2004).
pemlastis disebabkan oleh terbentuknya ikatan hidrogen antara molekul polimer dengan molekul pemlastis. Ikatan hidrogen adalah ikatan lemah yang menghubungkan atom hidrogen pada satu molekul dengan atom elektronegatif pada molekul lain. Ikatan hidrogen terjadi pada molekul yang mengandung atom H yang terikat secara kovalen dengan atom yang sangat elektronegatif seperti F, N, atau O (Companion, 1991).
Pada ujung rantai PHA terdapat dua gugus OH, dimana atom H pada gugus tersebut berikatan secara kovalen dengan atom O. Atom O merupakan atom dengan elektronegativitas yang sangat tinggi dan karena jarak yang dekat antara atom O dan atom H, maka atom O akan menarik elektron dari atom H. Kondisi inti hidrogen yang hampa elektron, menyebabkan terbentuknya ujung positif dipol yang kuat (δ+) dan mencari daerah berkerapatan elektron tinggi seperti misalnya atom elektronegatif (mempunyai muatan δ-) yang terdapat pada rantai
tetangganya. Hasilnya adalah tarik menarik antarrantai yang dinamakan ikatan hidrogen antarmolekul. Menurut Syarifuddin (1994), ikatan hidrogen dapat terbentuk antara atom H pada gugus hidroksil (OH) dengan atom O pada gugus hidroksil (OH) maupun gugus karboksil (C=O).
Sifat yang harus dimiliki suatu pemlastis adalah tidak berbau, tidak berasa, tidak beracun serta tidak mudah terbakar. Dalam pemilihan pemlastis hal-hal yang harus diperhatikan antara lain kecocokan dengan resin, permanen atau tidaknya pemlastis tersebut dan efisiensi penggunaannya (Beeler dan Finney di dalam Anonim, 1982).
2. Polioksietilen-(20)-Sorbitan Monolaurat
Polioksietilen dihasilkan dari monomer etilen oksida (oksietilen) melalui reaksi radikal bebas dengan struktur umum -(OCH2CH2)nOH. Sorbitan merupakan produk dehidrogenasi dari gula alkohol alami yaitu sorbitol. Sorbitan dapat diesterifikasi langsung dengan asam lemak dan sorbitan ester yang dihasilkan dapat dikondensasikan langsung dengan polioksietilen membentuk polioksietilen-sorbitan-ester (Taylor, 1980). Reaksi pembentukan polioksietilen-(20)-sorbitan monolaurat dapat dilihat pada Gambar 5.
Gambar 5. Reaksi pembentukan polioksietilen-(20)-sorbitan monolaurat (Taylor, 1980).
dengan batas konsumsi setiap hari sebesar 0-25 mg/kg berat tubuh (Anonimc, 2006).
G. PENGUJIAN KARAKTERISTIK BIOPLASTIK
Polimer banyak digunakan di berbagai aplikasi. Tiap aplikasi umumnya membutuhkan karakteristik plastik yang spesifik. Oleh karena itu perlu dilakukan pengujian terhadap plastik untuk menentukan kelemahan dan kelebihan plastik tersebut (Allcock dan Lampe, 1981).
Pengujian yang penting dari suatu bahan polimer antara lain densitas, titik leleh (Tm),glass transition temperature (Tg), reologi, konduktifitas, kekuatan tarik, permeabilitas gas, ketahanan terhadap radiasi kimia, dan sebagainya (Knapczyk dan Simon di dalam Kent, 1992). Fourier tranform infrared spectrofotometer (FTIR) merupakan analisis penting pada biopolimer untuk mengetahui struktur suatu polimer secara detail. Analisis derajat kristalinitas juga perlu dilakukan karena karakteristik fisik biopolimer seperti PHB sangat dipengaruhi oleh derajat kristalinitasnya (Lafferty et al di dalam Rehm dan Reed, 1988).
1. Densitas
Densitas menunjukkan kerapatan rantai suatu polimer. Polimer dengan struktur yang teratur cenderung mempunyai kerapatan rantai yang tinggi karena rantai mampu berdekatan dalam jarak yang dekat sehingga densitasnya pun tinggi. Polimer dengan struktur yang tidak teratur cenderung mempunyai densitas yang rendah karena jarak rantai yang jauh (Allcock dan Lampe, 1981).
2. Kekuatan Tarik dan Perpanjangan Putus
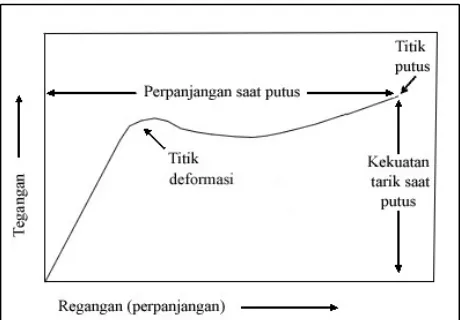
Istilah yang digunakan dalam pengukuran kekuatan tarik antara lain tegangan (stress) yaitu gaya yang diberikan pada sampel dan regangan (strain) yaitu perpanjangan sampel saat ditarik (Allcock dan Lampe, 1981). Menurut Allcock dan Lampe (1981), respon sampel terhadap tegangan maupun regangan tergantung dari rata-rata kecepatan tekanan atau kekuatan yang diberikan kepadanya. Jika ditarik tiba-tiba dengan kekuatan tinggi maka suatu bahan bisa langsung patah. Jika ditarik dengan kecepatan yang lebih lambat maka bisa didapat bahan dengan elongasi dan daya tahan putus yang lebih baik. Hasil kekuatan tarik sampel akan memberikan informasi yang digunakan dalam kurva tegangan-regangan (stress-strain) (Gambar 6).
Gambar 6. Kurva tegangan-regangan (Allcock dan Lampe, 1981).
3. Penentuan Titik Leleh (Tm) dan suhu transisi gelas (Tg)
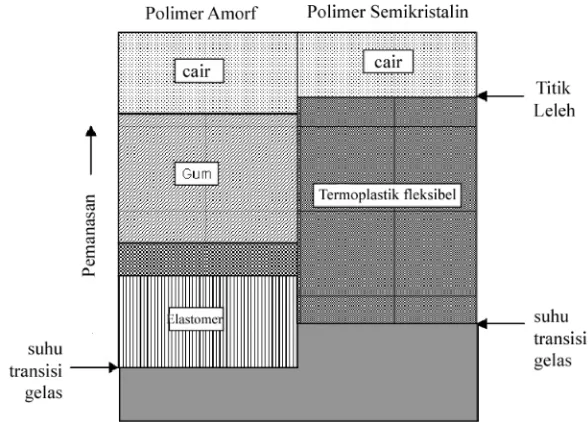
Titik leleh (Tm) merupakan titik perubahan bentuk suatu polimer menjadi cairan (liquid). Suhu transisi gelas (Tg) merupakan titik perubahan dari sifat gelas (kaku padat) menjadi sifat karet (elastis) ataupun termoplastik fleksibel. (Alcock dan Lampe, 1981).
terukur dengan jelas, seperti pada polistiren, polimetil-metakrilat, PVC, dan sebagainya. Namun pada polimer semikristalin, suhu Tg tidak dapat diukur dengan jelas karena suhu Tg hanya terukur pada bagian atau daerah amorf pada polimer semikristalin tersebut. Nilai Tg yang didapatkan tergantung metode pengukuran dan rata-rata kecepatan pengukuran (Rabek, 1983).
Gambar 7. Transisi Termal Polimer (Allcock dan Lampe, 1981)
Suhu Tg bervariasi menurut struktur atom yang tersusun pada polimer tersebut, tipe gugus fungsi, dan penyusunan gugus fungsi tersebut. Karakteristik dari suatu polimer sangat ditentukan oleh suhu Tg (Alcock dan Lampe, 1981).
sampel menyebabkan aliran yang besar. Perubahan panas elektrik dapat dimonitor dengan akurat sehingga DSC dipandang sebagai pengukuran Tm dan Tg yang sensitif (Allcock dan Lampe, 1981).
4. Fourier Transform Infra-Red Spectrofotometer (FTIR)
Spektroskopi infra merah merupakan salah satu teknik indentifikasi struktur baik untuk senyawa organik maupun senyawa anorganik. Analisa ini merupakan metoda semi empirik dimana kombinasi pita serapan yang khas dapat diperoleh untuk menentukan struktur senyawa yang terdapat dalam suatu bahan (Sutiani, 1997).
Energi dari kebanyakan vibrasi molekul berhubungan dengan daerah infra-merah. Vibrasi molekul dapat dideteksi dan diukur pada spektrum infra merah bila vibrasinya menghasilkan perubahan momen dipol. Radiasi infra merah yang penting dalam penentuan struktur atau analisa gugus fungsi terletak pada daerah infra merah sedang yaitu antara 4000-650 cm-1. Daerah di bawah 650 cm-1 dinamakan daerah infra merah jauh, dan daerah di atas 4000 cm-1 dinamakan daerah infra merah dekat (Nur dan Adijuwana, 1989).
Tabel 2. Daerah spektrum Infra Merah
Daerah
Sumber : Nur dan Adijuwana (1989)
5. Derajat Kristalinitas
Derajat kristalinitas menunjukkan besarnya daerah kristalin pada suatu polimer. Rabek (1983) mengatakan bahwa derajat kristalinitas yang absolut dari suatu bahan polimer tidak dapat ditentukan karena adanya cacat pada konfigurasi kristal (crystal defect structure) di daerah kristalin polimer. Pada pengukuran derajat kristalinitas, daerah kristalin diasumsikan sebagai daerah dengan keteraturan yang sempurna tanpa adanya cacat, sedangkan daerah amorf diasumsikan sebagai daerah yang tidak teratur yang menyerupai struktur pada molekul cair.
Derajat kristalinitas dengan satuan (%) dapat diukur dengan menggunakan berbagai metode antara lain spektroskopi inframerah, spektroskopi NMR,inverse chromatography, difraksi sinar-X, pengukuran densitas, metode DTA-DSC. Pengukuran derajat kristalinitas pada berbagai metode akan mendapatkan hasil yang bervariasi. Oleh karena itu perlu diberi keterangan metode pengukuran derajat kristalinitas (Rabek, 1983).
H. APLIKASI BIOPLASTIK PHA
Penelitian dan pengembangan merupakan satu tahap yang dilakukan untuk memperkenalkan kegunaan dari suatu bahan polimer biodegradabel. Desain bahan tersebut biasanya dimulai dengan suatu konsep aplikasi. Bahan tersebut mungkin akan menggantikan bahan yang sudah ada atau berfungsi sebagai pelengkap. Sektor dimana polimer biodegradabel dapat diaplikasikan terpusat pada sektor medis, sektor pengemasan dan penyimpanan, dan sektor pertanian (Lafferty et al di dalam Rehm dan Reed, 1988). Perkembangan pesat penggunaan polimer PHA terjadi pada bidang medis terutama farmasi.
Polimer tersebut mendapat perlakuan tambahan untuk merangsang pertumbuhan sel serta pertumbuhan pembuluh darah di dalam organ baru. Selain sebagai organ buatan, polimer PHA juga dapat digunakan sebagai tulang buatan (artificial bone) yang dapat menyatu dengan tulang lainnya dalam tubuh manusia.Bioglass merupakan salah satu produk yang digunakan dalam aplikasi ini (Kokubo et al, 2003). Aplikasi polimer PHA lainnya yaitu sebagai pengontrol pelepasan obat (controlled release delivery of medicine). Bahan bioaktif yang terdapat dalam obat dilepaskan dalam waktu yang telah ditentukan dengan penggunaan degradasi enzimatik (Sakiyama et al, 2001). Polimer PHA juga digunakan sebagai alat medis seperti jarum bedah, benang jahit untuk operasi (Selin, 2002). Penggunaan bahan biodegradabel akan mengurangi resiko reaksi antara jaringan tubuh dengan alat, mempercepat masa penyembuhan, dan mengurangi jumlah kunjungan pasien ke dokter.
Aplikasi polimer biodegradabel di sektor pertanian yaitu sebagai plastik pelindung tunas muda. Tunas muda perlu dilindungi karena sifatnya yang rentan terhadap penyakit dan perubahan cuaca. Keuntungan penggunaan bioplastik ini yaitu pada akhir musim panen tidak perlu dilakukan pengambilan plastik karena telah terdegradasi di dalam tanah. (Liet al, 1999). Aplikasi polimer PHA lainnya yaitu sebagai pot tanaman, kantung penumbuhan benih, pengontrol pelepasan bahan-bahan aktif pada insektisida, herbisida dan pupuk. (Huanget al, 1990; Lafferty et al di dalam Rehm dan Reed, 1988). Salah satu yang hal yang perlu diperhatikan dari penggunaan polimer biodegradabel di sektor pertanian yaitu hasil degradasi polimer tersebut dapat dimanfaatkan sebagai suplemen tertentu bagi tanah.
II. METODOLOGI PENELITIAN
A. BAHAN
1. Biakan Murni
Biakan murni yang digunakan yaitu bakteri Ralstonia eutropha IAM 12368 yang diperoleh dari IAM Culture Collection, Institute of Molecular and Celular Bioscience, The University of Tokyo.
2. Media
Media yang digunakan antara lain media nutrient broth dan media kultivasi. Media kultivasi berupa hidrolisat pati sagu dan media garam yang terdiri dari (NH4)2HPO4, K2HPO4, KH2PO4, MgSO4 0,1 M, larutan mikroelemen (FeSO4.7H2O, MnCl2.4H2O, CoSO4.7H20, CaCl2.7H2O, CuCl2.2H2O, ZnSO4.7H2O, buffer tri-hidroklorida).
3. Bahan Tambahan
Bahan tambahan yang digunakan dalam penelitian ini antara lain NaOH 4 N dan H3PO4 1,33 M sebagai asam dan basa pada proses kultivasi, antifoam sebagai penghilang busa, NaOCl 0,2% dan metanol yang digunakan pada proses hilir, kloroform yang digunakan pada proses hilir maupun pembuatan bioplastik, serta Tween20 sebagai pemlastis.
B. ALAT
1. Proses Kultivasi dan Proses Hilir PHA
2. Proses Pembuatan Bioplastik
Proses pembuatan bioplastik menggunakan peralatan antara lain alat-alat gelas, neraca analitik, pipet mikro, hotplate stirer, pendingin tegak, termometer, desikator serta plat kaca sebagai cetakan bioplastik.
3. Karakterisasi Bioplastik
Pada proses karakterisasi bioplastik, alat-alat yang digunakan yaitu UTM (Universal Testing Machine) untuk mengetahui kuat tarik dan perpanjangan putus bioplastik, Fourier Transform Infra-Red Spectrofotometer (FTIR) untuk analisa gugus fungsi bioplastik, serta DSC (Differential Scanning Calorimetry) untuk mengetahui Tm(melting point), Tg (glass transition temperature) dan derajat kristalinitas bioplastik.
C. METODE PENELITIAN
1. Persiapan Bahan Baku Biji Bioplastik
Persiapan bahan baku dilakukan untuk memperoleh biji bioplastik PHA yang akan digunakan dalam proses pembuatan lembaran bioplastik. Persiapan bahan baku terdiri dari tiga tahap, yaitu persiapan substrat, kultivasi PHA, dan proses hilir PHA.
a. Persiapan substrat
Sebelum proses kultivasi, dilakukan beberapa tahap propagasi untuk mendapatkan kultur 10% dari volume media kultivasi. Pada propagasi awal, biakan murni Ralstonia eutropa diinokulasi pada media nutrient broth yang kemudian diinkubasi selama 24 jam dalam waterbath shaker pada suhu 34oC dan kecepatan 150 rpm. Kultur hasil propagasi awal kemudian ditumbuhkan pada media propagasi selanjutnya, yang juga diinkubasi selama 24 jam dalam waterbath shaker pada suhu 34oC dan kecepatan 150 rpm. Propagasi ini dilakukan terus menerus hingga didapatkan kultur 10% dari volume media kultivasi. Media propagasi memiliki formulasi yang sama dengan media kultivasi PHA.
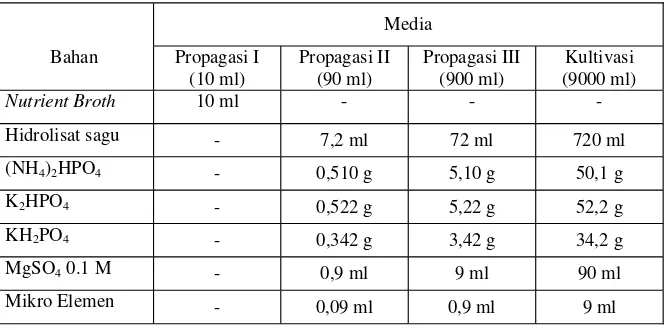
Tabel 3. Komposisi media propagasi dan media kultivasi PHA.
Media
Hidrolisat sagu - 7,2 ml 72 ml 720 ml
(NH4)2HPO4 - 0,510 g 5,10 g 50,1 g
K2HPO4 - 0,522 g 5,22 g 52,2 g
KH2PO4 - 0,342 g 3,42 g 34,2 g
MgSO4 0.1 M - 0,9 ml 9 ml 90 ml
Mikro Elemen - 0,09 ml 0,9 ml 9 ml
Tabel 4. Komposisi Larutan Mikroelemen
b. Proses Kultivasi PHA (Atifah, 2006; Byrom, 1987; Kimet al, 1994) Kultivasi PHA dilakukan secara fed batch dalam bioreaktor berkapasitas 13 liter dengan volume kerja 10 liter selama 96 jam (4 hari). Kultivasi PHA dilakukan secarafed batch, karena dengan sistem ini konsentrasi dan rendemen PHA di dalam sel dapat ditingkatkan hingga dua kali lipat dibandingkan dengan kultivasi sistem curah (Atifah, 2006).
Proses kultivasi PHA dilakukan pada suhu 34oC, aerasi 0,2 vvm, dan agitasi 150 rpm. Selama proses kultivasi PHA, pH dijaga tetap netral (pH 7) dengan penambahan basa (NaOH 4 N) atau asam (H3PO4 1,33 M). Proses pengumpanan dilakukan pada jam ke-48 yaitu pada saat mikroba memasuki fase pertumbuhan stasioner (Byrom, 1987). Pada titik stasioner tersebut jumlah sel bakteri mencapai titik maksimum tetapi konsentrasi gula dalam media kultivasi hampir habis (Atifah, 2006).
c. Proses hilir PHA (Atifah 2006; Hahnet al, 1995; Senioret al, 1982) Proses hilir PHA terdiri dari dua tahap yaitu ekstraksi PHA dari sel bakteri dan tahap pemurnian PHA. Pada tahap pertama, dilakukan sentrifugasi sebanyak lima kali pada cairan hasil kultivasi dengan kecepatan 13.000 rpm, suhu 4oC dan berlangsung selama sepuluh menit.
Sentrifugasi pertama bertujuan untuk memisahkan biomassa dengan fase cair. Endapan yang diperoleh pada sentrifugasi pertama dibilas dengan aquades kemudian dilakukan sentrifugasi yang kedua. Endapan hasil sentrifugasi kedua ditambah NaOCl 0,2% kemudian dilakukan proses pemecahan sel (digest) selama satu jam untuk mengeluarkan PHA dari biomassa sel. Penggunaan larutan NaOCl 0,2% dalam proses pemecahan sel karena kemampuannya yang tinggi untuk memisahkan materi non-PHA (Hahn et al, 1995). Penggunaan konsentrasi NaOCl yang rendah (0,2%) dilakukan untuk mengurangi resiko terjadinya degradasi PHA selama proses pemecahan sel.
Sentrifugasi ketiga dilakukan untuk memisahkan endapan (PHA) dan cairan (larutan NaOCl dan biomassa non-PHA). Endapan hasil sentrifugasi ketiga yang berisi PHA, dibilas dengan aquades kemudian dilakukan sentrifugasi yang keempat. Endapan hasil sentrifugasi keempat kemudian dicampurkan dengan metanol sebanyak 80 ml/200 ml cairan kultivasi kemudian disentrifugasi kembali. Pencampuran endapan dengan metanol dilakukan untuk melarutkan lemak dan pigmen yang terdapat di dalam sel (Senioret al, 1982). Endapan hasil sentrifuge kelima kemudian dikeringkan dalam oven suhu 40OC selama 24 jam. PHA yang telah kering kemudian dihaluskan dengan menggunakan mortar hingga didapatkan serbuk PHA halus.
Penggunaan suhu 50oC karena berada diantara suhu efisien ekstraksi PHA dan dibawah titik didih kloroform (61,7oC).
Banyaknya kloroform yang digunakan didasarkan pada perbandingan PHA : kloroform sebesar 1 : 50 (b/v). Larutan hasil refluks kemudian disaring pada penyaring vakum dengan menggunakan kertas saring whatman 42. Kloroform yang terdapat pada hasil filtrat kemudian diuapkan pada suhu ruang hingga didapatkan lembaran PHA murni. Diagram alir proses hilir dapat dilihat pada Lampiran 3.
2. Penelitian Pendahuluan.
a. Metode pembuatan lembaran bioplastik (Akmaliah, 2003; Allcock dan Lampe, 1981)
Proses pembuatan bioplastik dilakukan dengan teknik solution casting. Metode ini digunakan karena tekniknya yang sederhana dan mudah serta tidak memerlukan banyak bahan baku PHA.
Prinsip dasar teknik ini adalah melarutkan polimer pada pelarut yang sesuai untuk membentuk larutan yang kental (viscous). Larutan tersebut kemudian dituangkan ke wadah yang rata dan permukaannya non-adhesif, lalu pelarutnya diuapkan. Lapisan film yang sudah kering selanjutnya dilepaskan dari permukaan wadah pencetak (Allcock dan Lampe, 1981).
karena sifat kedua bahan yang sama yaitu non-polar. Tingkat pelarutan PHA (PHB) dalam berbagai pelarut dapat dilihat pada Lampiran 5. Diagram alir pembuatan bioplastik dapat dilihat pada Lampiran 4.
b. Penentuan perbandingan PHA dan kloroform
Perbandingan PHA dan kloroform yang digunakan untuk optimasi pelarutan antara lain 1: 15 (b/b), 1: 20 (b/b), 1 : 25 (b/b), 1 : 30 (b/b), 1 : 35 (b/b), 1 : 40 (b/b). Penentuan perbandingan terbaik ditentukan oleh pelarutan yang sempurna dengan waktu penguapan yang cepat. Perbandingan PHA dan kloroform yang terbaik yang akan digunakan dalam penelitian utama.
c. Penentuan konsentrasi pemlastis Tween20
Pemlastis yang digunakan dalam penelitian ini adalah Tween20. Syarat ideal yang harus dimiliki suatu pemlastis yaitu kekocokan pemlastis dengan bahan polimer, permanen atau tidaknya pemlastis tersebut dalam polimer serta efisiensi penggunaannya (Beeler dan Finney di dalam Anonim, 1982). Tween20 memenuhi semua syarat tersebut sehingga layak dijadikan pemlastis PHA.
Konsentrasi pemlastis dihitung berdasarkan jumlah PHA yang digunakan. Penentuan konsentrasi pemlastis Tween20 dibagi menjadi tiga tahap yaitu tahap pertama menggunakan konsentrasi Tween20 10%, 20%, 30%, tahap kedua menggunakan konsentrasi 4%, 6%, 9%, 13%, 18%, dan tahap ketiga menggunakan konsentrasi 14%, 15%, 16%, 17%. Ketiga tahap itu dilakukan untuk menentukan konsentrasi Tween20 yang tidak mampu membentuk lembaran bioplastik.
3. Penelitian Utama.
a. Pembuatan bioplastik untuk karakterisasi
Bioplastik yang diuji untuk proses karakterisasi antara lain bioplastik dengan konsentrasi Tween20 0% (sebagai kontrol), 5%, 10%, dan 15%. Bahan baku PHA sebanyak 0,25 g dilarutkan ke dalam kloroform dengan perbandingan PHA dan (kloroform+Tween20) sebesar 1 : 35 (b/b) kemudian dipanaskan pada suhu 50oC selama 1 jam. Proses pemanasan dilakukan untuk mempercepat proses pelarutan serta proses pengikatan PHA dengan pemlastis. Larutan PHA tersebut kemudian ditambah pemlastis Tween20 dan dipanaskan selama 30 menit pada suhu 50oC. Larutan bioplastik dituang pada cetakan kaca dengan ukuran 45 mm x 150 mm dan dibiarkan selama + 30 menit pada suhu ruang hingga seluruh kloroform menguap dan didapatkan lembaran bioplastik. Formulasi untuk pembuatan bioplastik dengan konsentrasi 0%, 5%, 10%, 15% dapat dilihat pada Tabel 5 dan prosedur perhitungannya dapat dilihat pada Lampiran 7.
Tabel 5. Formulasi bioplastik untuk karakterisasi
Kloroform Tween20 Konsentrasi
Tween20 PHA (g) (g) (ml) (g) (ml)
0% 0,25 8,75 5,952 -
-5% 0,25 8,737 5,943 0,013 0,012
10% 0,25 8,722 5,933 0,028 0,025
b. Karakterisasi Bioplastik. i. Densitas (Rabek, 1983).
Nilai densitas diperoleh dengan cara membagi nilai massa terhadap volume. Nilai massa didapatkan dari hasil penimbangan sampel pada neraca analitik. Nilai volume didapatkan dari hasil perkalian panjang, lebar dan tebal sampel. Ketebalan sampel diukur dengan menggunakan mikrometer sekrup pada 5 titik yang berbeda dan dihitung rata-ratanya. Densitas bioplastik dapat dihitung dengan persamaan berikut :
Г = V m
Keterangan: Г = densitas (g/cm3) m = massa bahan (g) V = volume bahan (cm3)
ii. Kekuatan tarik (ASTM D 882-97).
Proses pengujian kekuatan tarik dilakukan dengan menggunakan alat Universal Testing Machine (UTM) dengan merk Simadzu AGS-10KNG yang terdapat di Sentra Teknologi Polimer (STP), kawasan Puspiptek, Serpong. Pengujian dilakukan berdasarkan standar ASTM D 882-97. Proses pengujian kekuatan tarik dilakukan berdasarkan standar ASTM D 882-97. ASTM D 882-92 merupakan standar pengukuran kekuatan tarik film plastik yang sangat tipis (thin plastic sheeting) dengan ketebalan kurang dari 1 mm. Pengujian dilakukan dengan standar ini karena bioplastik yang dihasilkan mempunyai ketebalan 0,05 mm (kurang dari 1 mm).
dilakukan pencatatan ketebalan dan panjang awal sampel. Tombol start ditekan kemudian alat akan menarik sampel dengan kecepatan 500 mm/menit sampai sampel putus. Nilai kekuatan tarik didapatkan dari hasil pembagian tegangan maksimum dengan luas penampang melintang. Tegangan maksimum didapatkan dari nilai tegangan sampel saat putus. Luas penampang melintang didapatkan dari hasil perkalian panjang awal sampel dengan ketebalan awal sampel. Uji kekuatan tarik dilakukan pada lima sampel bioplastik yang kemudian dihitung rata-ratanya. Kekuatan tarik bioplastik dihitung dengan persamaan berikut:
τ = Fmax / A
Keterangan:
τ = kekuatan tarik (MPa) Fmax = tegangan maksimum (N)
A = luas penampang melintang (mm2)
iii. Perpanjangan putus (ASTM D 882-97)
Pengukuran perpanjangan putus dilakukan dengan cara yang sama dengan pengujian kuat tarik. Perpanjangan dinyatakan dalam persentase, dihitung dengan cara :
Perpanjangan putus (%) = Regangan saat putus (mm) Panjang awal (mm)
iv. Analisa gugus fungsi (Nur dan Adijuwana, 1989)
Analisa gugus fungsi dilakukan di Departemen Teknik Gas dan Petrokimia, Fakultas Teknik, Universitas Indonesia. Alat yang digunakan adalah Fourier Transform Infra-Red Spectroscopy (FTIR) dengan merk ATI Mattson. Sampel film transparan yang
akan diuji, dipotong melingkar dengan diameter 10 mm kemudian dimasukkan ke dalam alat.
Alat dinyalakan kemudian dilakukan pemanasan sumber radiasi hingga suhu antara 1500 dan 2000 K. Senyawa-senyawa pada sampel akan menyerap radiasi infra merah yang dihasilkan kemudian dikonversi ke dalam energi rotasi dan vibrasi molekul. Detektor pada spektrofotometer infra merah akan mengukur besarnya energi tersebut yang kemudian direkam sebagai spektrum infra merah yang menghasilkan puncak-puncak absorbsi dengan intensitas rendah hingga tajam. Spektrum infra merah ini menunjukkan hubungan antara absorbsi dan frekuensi atau bilangan gelombang atau panjang gelombang. Nilai absorbsi pada panjang gelombang tertentu akan menunjukkan gugus fungsi yang terdapat pada sampel tersebut. Identifikasi gugus fungsi dilakukan berdasarkan tabel identifikasi gugus fungsi menurut Nur dan Adijuwana (1989).
v. Sifat Termal (ASTM D3418-99)
Analisa sifat termal meliputi titik leleh (melting point, Tm) dan suhu transisi kaca (glass transition temperature, Tg). Analisa dilakukan di Sentra Teknologi Polimer (STP), kawasan Puspiptek, Serpong. Alat yang digunakan adalah Differential Scanning Calorimetry (DSC) dengan merek Mettler Toledo. Pengujian dilakukan berdasarkan standar ASTM D 3418-99.
Aliran panas ini kemudian direkam sebagai kurva DSC yang menunjukkan puncak-puncak absorbsi panas pada suhu tertentu. Suhu-suhu saat sampel menyerap panas yang akan diidentifikasikan sebagai titik leleh atau suhu transisi gelas sampel. Identifikasi titik leleh dan suhu transisi gelas dilakukan berdasarkan Laffertyet aldi dalam Rehm dan Reed (1988).
vi. Derajat kristalinitas (Barhamet al, 1984 dan Hahnet al, 1995) Pengukuran derajat kristalinitas dilakukan dengan metode pendekatan. Metode ini didasarkan pada perubahan entalpi yang terjadi saat tercapainya suhu pelelehan pada pengukuran titik leleh dengan DSC. PHA dengan derajat kristalinitas 100% akan mempunyai perubahan entalpi titik leleh sebesar 146 J/g (Barham et al, 1984). Dengan melakukan perbandingan perubahan entalpi sampel uji dan PHA dengan kristalinitas 100% maka akan dapat diketahui derajat kristalinitas sampel uji. Menurut Hahn et al (1995), derajat kristalinitas dapat dihitung dengan menggunakan rumus:
Xc =Δ Hf /Δ Ho x 100% Keterangan:
Xc = kristalinitas (%),
Δ Hf = entalpi pelelehan sampel (J/g),
Δ Ho = entalpi pelelehan PHB 100% kristalin (146 J/g)
4. Analisa Data
D. TEMPAT DAN WAKTU PENELITIAN
III. HASIL DAN PEMBAHASAN
A. HASIL PERSIAPAN BIJI BIOPLASTIK
Proses kultivasi PHA yang dilakukan dengan sistem fed batch pada substrat hidrolisat pati sagu menghasilkan biomassa sebesar 3,875 g/l. Hasil ini tidak jauh berbeda dengan biomassa hasil kultivasi Atifah (2006) dengan kondisi kultivasi yang sama yaitu 3,72 g/l. Namun jika dibandingkan dengan hasil biomassa menurut Ryu et al (1997) yang mencapai 281 g/l, hasil kultivasi ini jauh lebih rendah.
Proses hilir PHA dilakukan melalui dua tahap yaitu tahap ekstraksi PHA dan tahap pemurnian PHA. Pada tahap pertama dihasilkan serbuk PHA yang belum murni (Gambar 8). Serbuk PHA yang belum murni tersebut kemudian direfluks dan dihasilkan rendemen PHA murni sebesar 10-30% dari bobot kering biomassa atau 0,55 g/l cairan kultivasi. PHA murni tersebut berupa lembaran bioplastik. Nilai rendemen ini jauh lebih rendah dibandingkan dengan rendemen PHA menurut Choi dan Lee (1999) yang mencapai 77% atau 157 g/l cairan kultivasi. Hasil rendemen yang sangat berbeda ini disebabkan oleh beberapa faktor antara lain perbedaan substrat kultivasi, galur bakteri, metode isolasi PHA serta kondisi kultivasi PHA (Lafferty et al di dalam Rehm dan Reed, 1988).
B. PENELITIAN PENDAHULUAN
d. Hasil Penentuan Perbandingan PHA dan Kloroform
Perbandingan PHA dan kloroform yang digunakan untuk optimasi pelarutan antara lain 1: 15 (b/b) , 1: 20 (b/b), 1 : 25 (b/b), 1 : 30 (b/b), 1 : 35 (b/b), dan 1 : 40 (b/b). Perbandingan PHA dan kloroform 1 : 15, 1 : 20, 1: 25 dan 1 : 30 (b/b) menghasilkan lembaran bioplastik yang tidak sempurna karena jumlah pelarut yang kurang untuk melarutkan PHA yang ada sehingga cetakan tidak seluruhnya tertutupi oleh larutan. Perbandingan 1 : 40 (b/b) menghasilkan lembaran bioplastik yang baik namun memiliki waktu penguapan yang lebih lama daripada perbandingan 1 : 35 karena jumlah kloroform yang lebih banyak. Perbandingan 1 : 35 (b/b) merupakan perbandingan terbaik karena menghasilkan lembaran yang baik dengan waktu penguapan pelarut yang cepat. Hasil penentuan perbandingan PHA dan kloroform dapat dilihat pada Tabel 6.
Tabel 6. Hasil penentuan perbandingan PHA dan kloroform
Perbandingan PHA
Keterangan : (-) = tidak sempurna (+) = sempurna
e. Hasil Penentuan Konsentrasi Pemlastis Tween20
17%. Ketiga tahap itu dilakukan untuk menentukan konsentrasi Tween20 yang tidak mampu membentuk lembaran bioplastik. Hasil penentuan konsentrasi pemlastis Tween20 dapat dilihat pada Tabel 7.
Pada tahap pertama, formulasi dengan konsentrasi Tween 10% dapat membentuk lembaran bioplastik, sedangkan formulasi dengan konsentrasi Tween 20% dan 30 % tidak dapat membentuk lembaran. Pada tahap kedua digunakan konsentrasi Tween 20 sebesar 4%, 6%, 9%, 13%, dan 18%. Formulasi dengan konsentrasi pemlastis Tween20 4%, 6%, 9% dan 13% mampu membentuk lembaran bioplastik yang baik. Namun formulasi dengan konsentrasi 18% tidak mampu membentuk lembaran bioplastik (Gambar 9.d). Pada tahap ketiga digunakan konsentrasi Tween20 14%, 15%, 16%, dan 17%. Formulasi dengan konsentrasi Tween 14%, 15%, 16%, dan 17% dapat membentuk lembaran bioplastik.
Tabel 7. Hasil penentuan konsentrasi pemlastis Tween20
Konsentrasi