Lampiran 1. Hasil Identifikasi/Determinasi Tumbuhan Daun Loning (Pisonia
Lampiran 5. Ekstrak yang digunakan Dalam Uji Aktivitas Antioksidan dan Antibakteri Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
Lampiran 7. Hasil Uji Aktivitas Antioksidan Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.) Perhitungan % Peredaman Ekstrak Metanol Daun Tumbuhan Loning
1. Konsentrasi 20 ppm
2. Konsentrasi 40 ppm
3. Konsentrasi 60 ppm
4. Konsentrasi 80 ppm
Peredaman radikal ekstrak metanol daun tumbuhan loning
Sampel Absorbansi % Peredaman
Blanko 0,942 0
20 0,469 50,2123
40 0,419 55,5201
Perhitungan Nilai IC50Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
X y xy x2
0 0,00 0,00 0
20 50,2123 1004,246 400
40 55,5201 2220,804 1600
60 59,7664 3585,984 3600
80 69,1082 5528,656 6400
∑x = 200 ∑y = 234,607 ∑xy = 12339,69 ∑x2= 12000
Dimana : x = Konsentrasi y = % Peredaman
= 43,41825
Jadi persamaan garis regresi Y = 0,304x + 43,41 Nilai IC50:
50 = 0,304x + 43,41
0,304x = 50–43,41 0,304x = 6,59
x = 21,67
Lampiran 8. Hasil Perhitungan Kadar Air dan Kadar Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.
Kadar air serbuk daun tumbuhan loning diperoleh dari perhitungan sebagai berikut :
Berat sampel = 2 gram
Berat setelah pemanasan = 1,810 gram
Kehilangan bobot = 2 gram–1,810 gram = 0,19 gram
Kadar ekstrak metanol diperoleh dengan perhitungan sebagai berikut : Berat sampel kering = 200 gram
DAFTAR PUSTAKA
Agoes, G. 2007.Teknologi Bahan Alam. Bandung : Penerbit ITB Press.
Apak, R. 2007. Comparative Evaluation of Various Total Antioxidant Capacity Assay Applied to Phenolic Compounds with The CUPPRAC Assay.
Molecules12:1496-1547
Ajizah, A. 2004 . Sensitivitas Salmonella Tyhimurium Terhadap Ekstrak Daun Psidium Guajava L. Jurnal Bioscientiae. Volume 1. Nomor 1. Halaman 36. Andlauer,W. and Furst,P. 2001.Food Research International. Germany : Institute
For Biological Chemistry And Nutrition, University of Honenheim
Artini, P.E.U.D., Astuti,K.W. dan Warditiani, N.K. 2013. Uji Fitokimia Ekstrak Etil Asetat Rimpang Bangle (Zingiber purpureum Roxb.). volume 2.Nomor 4. Jimbaran-Bali: Universitas Udayana
Astarina, N.W.G., Astuti, K.W. dan Warditiani, N.K. 2013. Skrining Fitokimia Ekstrak Rimpang Bangle (Zingiber purpureum Roxb.). Volume 2.Nomor 4. Jimbaran-Bali : Universitas Udayana
Bintang, M. 2010.Biokimia-Teknik Penelitian. Jakarta : Erlangga
Buckle, K.A. 2007. Ilmu Pangan. Penerjemah Hari Purnomo dan Adiono. Jakarta:Universitas Indonesia.
Candra,R.A. 2012. Isolasi dan Uji Aktivitas Antioksidan Senyawa Alkaloid dari Ekstrak Daun Phoebe declinata Nees. [Skripsi]. Depok: Universitas Indonesia, Program Sarjana
Clinical and Laboratory Standars Institue, 2007. Performance Standars for Antimicrobial Disk Susceptibility Testing; Seventeenth Informational Supplement. M100-S17, Vol.27, No.3
Dachriyanus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang : Andalas University Press
Dalimartha, S. 2006. Atlas Tumbuhan Obat Indonesia. Jilid 4. Puspaswara. Jakarta.
Erawati. 2002. Uji Aktivitas Antioksidan Ekstrak Daun Garciniadaedalanthera Pierre Dengan Metode DPPH (1,1-Difenil Pikrilhidrazil) dan Identifikasi Golongan Senyawa Kimia dari Fraksi Paling Aktif, Skripsi Sarjana Farmasi Universitas Indonesia.
Fardiaz, S. 1992.Mikrobiologi Pangan I. Jakarta : PT. Gramedia Pustaka Umum. Gaman,P.M. 1992. Ilmu Pangan. Edisi Kedua. Yogyakarta : Gajah Mada
University Press.
Harborne, J.B. 2003.Metode Fitokimia: Penuntun Cara Modern Menganalisa Tumbuhan. Edisi II. Institut Teknologi Bandung. Bandung
Harborne, J.B. 1987. Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Penerjamah : Kosasih Padmawinata dan Iwang Soediro. Edisi Ketiga. Bandung : ITB Press.
Irianto,K. 2006.Mikrobiologi Menguak Dunia Mikroorganisme. Bandung: Yrama Widya.
Jawetz.,Melnick. dan Adelberg’s.1995.Mikrobiologi Kedokteran. Edisi ke-20, Jakarta : Penerbit Buku Kedokteran EGC.
Jayakumari, S.,Ravichandiran,V and Rao, N. 2014. Antimocrobial Activity of Pisonia grandis R.Br. Leaf Extract and Its Fraction. Vol 3. India : Department of Pharmacognosy, School of Pharmaceuticl Sciences, VELS University Pallavaram.
Kosasih, E. N. 2004.Peran Antioksidan Pada Lanjut Usia. Jakarta : Pusat Kajian Nasional Majalah Lanjut Usia.
Markham, K.R. 1988.Cara Mengidentifikasi Flavonoid. Bandung : ITB. Molyneux, P. 2004. The Use of Stable Free Radical Diphenylpicrylhydrazyl
(DPPH) for Estimating Antioxidant Activity,Journal Science of Technology.
Pokornya, J.N. Yanishlieva and N.Gordon. 2001.Antioxidant in Food. Woodhead Publishing Limited : England.
Pratiwi, S.T. 2008.Mikrobiologi Farmasi. Yogyakarta: Penerbit Erlangga
Purwantoro, R.S., Siregar, H.M., Sudarmono. dan Praptiwi. 2010. Uji Antibakteri Lasianthus ( Rubiceae) Sebagai Tumbuhan Berkhasiat Obat Dan Upaya Perbanyakannya. Bogor : Buletin Kebun Raya volume 13, No. 2.
Robinson, T. 1995.Kandungan Organik Tumbuhan Tinggi. Bandung : ITB. Setyowati, W.A.E., Sri Retno, D.A., Ashadi., Bakti, M., Cici Putri, R. 2014.
Skrining Fitokimia dan Identifikasi Komponen Utama Ekstrak Metanol Kulit Durian ( Durio zibethinus Murr.) Varietas Petruk. Surakarta: Universitas Sebelas Maret
Sirait, M. 2007.Penuntun Fitokimia dalam Farmasi. Bandung : Penerbit ITB Subeki. 1998. Pengaruh Cara Pemasakan Terhadap Kandungan Antioksidan
Beberapa macam Sayuran Serta Daya Serap dan Retensinya pada Tikus Percobaan. Program Pascasarjana. Institut Pertanian Bogor.
Syukur, C. 2001.Budidaya Tanaman Obat Komersial. Jakarta : Penebar Swadaya Tortora, G.J. 2001.Microbiology an Introduction. Edisi Ketujuh. New York :
M Addison Wesley Longman, Inc. Halaman 86-88.
Viljanen, K. 2005.Protein Oxidation and Protein-Lipid Interactions in Different Food Models in the Presence of Berry Phenolics.[Dissertation]. Finland : University of Helsinki, Department of Applied Chemistry and
Microbiology
Widodo, W. 2005. Tanaman Beracun dalam Kehidupan Ternak. Malang : Penerbit Universitas Muhammadiah Malang Press
BAB 3
METODOLOGI PENELITIAN
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini yaitu:
Nama Alat Merek
15. Statif dan Klem
3.2 Bahan-Bahan
Sedangkan bahan-bahan kimia yang digunakan dalam penelitian ini yaitu:
Bahan Merek
1. Daun tumbuhan Loning
-2. Metanol
-12. DPPH (2,2-diphenyl-1-picryl-hydrazil) p.a. Aldrich
13. DMSO (dimetilsulfoksida) p.a. Fisons
14.Mueller Hinton Agar( MHA)
-15.Nutrient Broth(NB) Merck
16.Nutrient Agar(NA) Merck
17. BakteriStaphylococcus aureus
-18. BakteriEscherichia coli
-3.3 Prosedur Penelitian 3.3.1 Penyediaan Sampel
3.3.2 Pembuatan Ekstrak Metanol dari Daun Tumbuhan Loning
( Pisonia umbellifera ( J.R. Forst & G. Forst.) Seem.
Daun tumbuhan loning dipisahkan dari batangnya, lalu dikeringkan dalam ruangan sampai kering, setelah kering diblender. Kemudian diekstraksi dengan menggunakan pelarut metanol, selama 2x24 jam, dilakukan beberapa kali pengulangan hingga larutan berwarna jernih. Kemudian dirotarievaporator dan filtratnya yang dihasilkan diuapkan diatas penangas air sampai dihasilkan ekstrak kering. Ekstrak kering yang dihasilkan diuji skrining fitokimia, aktivitas antioksidan dengan menggunakan DPPH ( 2,2-diphenyl-1-pycril-hydrazil ) dan antibakteri terhadap bakteri Staphylococcus aureusdan Escherichia colidengan menggunakan metode difusi agar.
3.3.3 Uji Skrining Fitokimia 1. Alkaloida
Ekstrak metanol daun tumbuhan loning masing-masing dimasukkan dalam 4 tabung reaksi. Tabung I ditetesi pereaksi Wagner, jika terbentuk endapan jingga, maka positif mengandung alkaloida. Tabung II ditetesi pereaksi Maeyer, jika terbentuk endapan putih, maka positif mengandung alkaloida. Tabung III ditetesi pereaksi Bouchardat, jika terbentuk endapan cokelat, maka positif mengandung alkaloida dan tabung IV ditetesi pereaksi Dragendorf, jika terbentuk endapan jingga, maka positif mengandung alkaloida.
2. Flavonoida
Ekstrak metanol daun tumbuhan loning masing-masing dimasukkan dalam 2 tabung reaksi. Tabung I ditetesi NaOH 10%, jika terbentuk larutan warna biru violet maka positif mengandung flavonoida. Tabung II ditambah serbuk Mg dan HCl pekat, jika terbentuk larutan warna jingga maka positif mengandung flavonoida.
3. Tanin
4. Terpenoida
Ekstrak metanol daun tumbuhan loning masing-masing dimasukkan dalam tabung reaksi kemudian ditambah dengan CeSO41% dalam H2SO4 10%. Jika terbentuk
endapan warna merah kecokelatan maka positif mengandung terpenoida. 5. Saponin
Ekstrak metanol daun tumbuhan loning masing-masing ditambah 10 ml aquades, kemudian dikocok kuat-kuat. Jika muncul busa yang stabil maka positif mengandung saponin.
3.3.4 Uji Aktivitas Antioksidan dengan Metode DPPH (2,2-diphenyl-1-picryl-hydrazil)
3.3.4.1 Pembuatan Larutan DPPH 0,3 mM
Larutan DPPH 0,3 mM dibuat dengan melarutkan 11,85 mg serbuk DPPH dalam etanol p.a dalam labu takar 100 mL, kemudian dihomogenkan.
3.3.4.2 Pembuatan Variasi konsentrasi
Ekstrak metanol dibuat larutan induk 1000 ppm, dengan melarutkan 0,025 g ekstrak metanol dengan pelarut etanol p.a dalam labu takar 25 ml. Kemudian dari larutan induk 1000 ppm dibuat larutan 100 ppm. Kemudian dari larutan 100 ppm dibuat lagi variasi konsentrasi 20, 40, 60, dan 80 ppm.
3.2.4.3 Uji Aktivitas Antioksidan a. Larutan Blanko
Sebanyak 1 ml larutan DPPH 0,3 mM ditambahkan 2,5 ml etanol p.a.
Dihomogenkan dalam tabung reaksi dan dibiarkan selama 30 menit pada ruang gelap. Setelah itu diukur absorbansi dengan panjang gelombang maksimum 515 nm.
b. Uji Aktivitas Antioksidan Sampel
Setelah itu diukur absorbansi dengan panjang gelombang maksimum 515 nm.
3.3.5 Pengujian Aktivitas Antibakteri Ekstrak Metanol
3.3.5.1 Pembuatan Media Nutrien Agar (NA) Miring Dan Sub Kultur Bakteri
Dimasukkan 7 g media NA ke dalam gelas erlenmeyer, dilarutkan dengan 250 ml aquadest yang diikuti dengan pemanasan dan pengadukan, lalu disterilkan di dalam autoklaf pada suhu 1210C selama 15 menit. Kemudian dituangkan kedalam empat tabung reaksi sebanyak 3 ml dibiarkan memadat pada posisi miring membentuk sudut 300-450C. Diambil biakan bakteriStaphylococcus aureusdanEschericia colidari strain utama dengan jarum ose lalu digoreskan pada media NA yang telah memadat. Diinkubasi selama 18-24 jam pada suhu 350C.
3.3.5.2 Pembuatan Media Muller Hinton Agar (MHA)
Dimasukkan 19 g media MHA ke dalam gelas erlenmeyer, dilarutkan dengan 500 ml aquadest yang diikuti dengan pemanasan dan pengadukan, lalu disterilkan di dalam autoklaf pada suhu 1210C selama 15 menit.
3.2.5.3 Pembuatan Media Nutrient Broth (NB)
Sebanyak 3,25 g media NB dilarutkan dengan 250 ml aquades dalam erlemenyer dan dipanaskan hingga semua larut, kemudian disterilkan di autoklaf pada suhu 1210C selama 15 menit.
3.3.5.4 Pembuatan Inokulum Bakteri
3.3.5.5 Uji Aktivitas Antibakteri Ekstrak Metanol
Dimasukkan 0,1 ml inokulum bakteriStaphylococcus aureuskedalam cawan petri kemudian ditambahkan 15 ml media MHA dengan suhu 450-500C dihomogenkan sampai media dan bakteri tercampur rata dibiarkan sampai media memadat. Dimasukkan kertas cakram yang telah direndam dengan masing-masing sampel yang telah berisi bakteri dan diinkubasi pada suhu 350C selama 24 jam dalam inkubator. Setelah itu diukur zona bening yang ada disekitar kertas cakram dengan menggunakan jangka sorong. Dilakukan perlakuan yang sama untuk inokulum dari bakteriEschericia coliuntuk konsentrasi 100,200,300,400,500 mg/ml.
3.3.5.6 Pembuatan Variasi Konsentrasi
Ekstrak Metanol Daun Loning
Alkaloida Flavonoida Tanin Terpenoida Saponin
3.4 Bagan Penelitian
3.4.1 Skrining Fitokimia Ekstrak Metanol Daun Tumbuhan Loning (Pisonia
serbuk daun tumbuhan loning
ditimbang sebanyak 200 g
serbuk daun tumbuhan loning sebanyak 200 g
dimaserasi dengan 2 liter metanol selama 2x24 jam
disaring
dirotarievaporator hingga dihasilkan filtrat
dipekatkan diatas penangas air
ekstrak metanol daun tumbuhan loning
0,025 g Ekstrak Metanol Daun Loning
dimasukkan kedalam labu takar 25 ml
ditambahkan etanol p.a sampai garis batas
dihomogenkan
25 ml larutan 1000 ppm
dipipet sebanyak 5 ml
dimasukkan kedalam labu takar 50 ml
ditambahkan etanol p.a hingga garis batas
dihomogenkan
50 ml larutan 100 ppm
dibuat variasi 20, 40, 60, 80 ppm
dipipet 5 ml dengan 3.4.3 Uji Aktivitas Antioksidan Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
11,85 mg serbuk DPPH
dimasukkan kedalam labu takar 100 ml
ditambahkan etanol p.a sampai garis batas
dihomogenkan
Larutan DPPH 0,3 mM
1 ml larutan DPPH 0,3 mM
dimasukkan kedalam tabung reaksi
ditambahkan 2,5 ml etanol p.a
dihomogenkan
dibiarkan selama 30 menit pada ruang gelap
diukur absorbansi pada panjang gelombang maksimum 515 nm
Hasil
2. Pembuatan Larutan DPPH 0,3 Mm
3. Pengukuran Absorbansi Larutan Blanko dan Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
1 ml larutan DPPH 0,3 mM
dimasukkan kedalam tabung reaksi
ditambahkan 2,5 ml ekstrak metanol daun tumbuhan loning sesuai dengan variasi
konsentrasi 20, 40, 60, dan 80 ppm
dihomogenkan
dibiarkan selama 30 menit pada ruang gelap
diukur absorbansi pada panjang gelombang maksimum 515 nm
Hasil
19 g tepung Mueller Hinton Agar (MHA)
dilarutkan dengan 500 ml aquades dalam erlenmeyer
dipanaskan sambil diaduk hingga larut dan mendidih
disterilkan dalam autoklaf pada suhu 121oC selama 15 menit
b. Pengukuran Absorbansi Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
7 g tepung Nutrien Agar (NA)
dilarutkan dengan 250 ml aquadest
dalam erlenmeyer
dipanaskan sambil diaduk hingga
larut dan mendidih
disterilkan dalam autoklaf pada
suhu 121
oC selama 15 menit
Media Nutrien Agar (NA) steril
dituangkan sebanyak 3ml kedalam
tabung reaksi
dibiarkan pada temperatur kamar sampai
memadat pada posisi miring membentuk
sudut 30-45
odiambil biakan bakteri
Staphylococcus
aureus
dari strain utama dengan jarum ose
lalu digoreskan pada media Nutrien Agar
(NA) yang telah memadat
diinkubasi pada suhu 35
oC selama 18-24 jam
Stok Kultur Bakteri
Staphylococcus aureus
2. Pembuatan Stok Kultur Bakteri3,25 g tepung Nutrien Broth (NB)
dilarutkan dengan 250 ml aquadest dalam erlenmeyer
dipanaskan sambil diaduk hingga larut dan mendidih
disterilkan dalam autoklaf pada suhu 121oC selama 15 menit
Media Nutrien Broth (NB) steril
dimasukkan sebanyak 10 ml kedalam tabung reaksi
diambil koloni bakteriStaphylococcus aureusdari stok kultur bakteri dengan jarum ose
disuspensikan kedalam Nutrien Broth (NB)
diinkubasi pada suhu 35oC selama 18-24 jam
Inokulum Bakteri Staphylococcus aureus
dibandingkan kekeruhannya dengan kekeruhan standar Mcfarland
3. Penyiapan Inokulum Bakteri
0,1 ml inokulum bakteri
dimasukkan kedalam cawan petri steril
ditambah dengan 15 ml media Mueller Hinton Agar (MHA) dengan suhu 45-50oC
dihomogenkan sampai media dan bakteri tercampur rata
dibiarkan sampai media memadat
dimasukkan kertas cakram yang telah direndam dengan ekstrak metanol daun tumbuhan loning dengan
berbagai konsentrasi kedalam cawan petri yang telah berisi bakteri
diinkubasi selama 18 jam pada suhu 35oC
diukur diameter zona bening disekitar cakram dengan jangka sorong
diameter zona bening
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Penentuan Kadar Air Serbuk Daun Tumbuhan Loning (Pisonia
umbellifera J.R. Forst & G. Forst) Seem
Kadar air dalam serbuk daun tumbuhan loning yang diperoleh yaitu sebesar 9,5%.
4.1.2 Ekstraksi Daun Tumbuhan Loning
Kadar ekstrak metanol yang diperoleh yaitu sebesar 10,37 %.
4.1.3 Skrining Fitokimia Ekstrak Metanol
Ekstrak metanol yang diperoleh dan diuji skrining fitokimia untuk mengetahui adanya golongan senyawa alkaloida, flavonoida, tanin dan saponin yang ditunjukkan pada Tabel 4.1.
Tabel 4.1 Skrining Fitokimia Ekstrak Metanol daun tumbuhan loning
Loning (Pisonia umbellifera J.R. Forst & G. Forst) Seem.
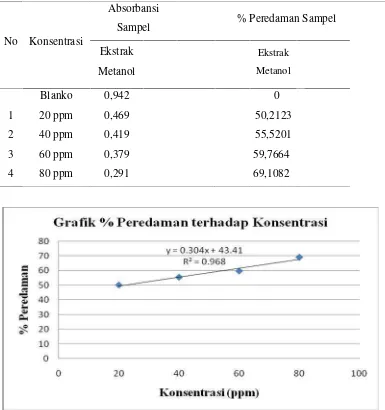
Tabel 4.2 dan Gambar 4.1 menunjukkan hasil pengukuran absorbansi ekstrak metanol daun tumbuhan loning.
Tabel 4.2 Pengukuran Absorbansi Ekstrak Metanol Daun Tumbuhan Loning.
No Konsentrasi
Absorbansi
Sampel % Peredaman Sampel
Ekstrak Metanol
Ekstrak
Metanol
Blanko 0,942 0
1 20 ppm 0,469 50,2123
2 40 ppm 0,419 55,5201
3 60 ppm 0,379 59,7664
4 80 ppm 0,291 69,1082
Persamaan garis regresi dan nilai IC50 yang diperoleh dari ekstrak metanol daun
tumbuhan loning dapat ditunjukkan pada Tabel 4.3 dibawah ini :
Tabel 4.3 Persamaan Garis Regresi dan Nilai IC50 yang diperoleh dari Ekstrak
Metanol daun tumbuhan loning.
No Sampel Persamaan Garis Regresi IC50
1 Ekstrak Metanol y = 0,304x + 43,41
R2= 0,968 21,67 ppm
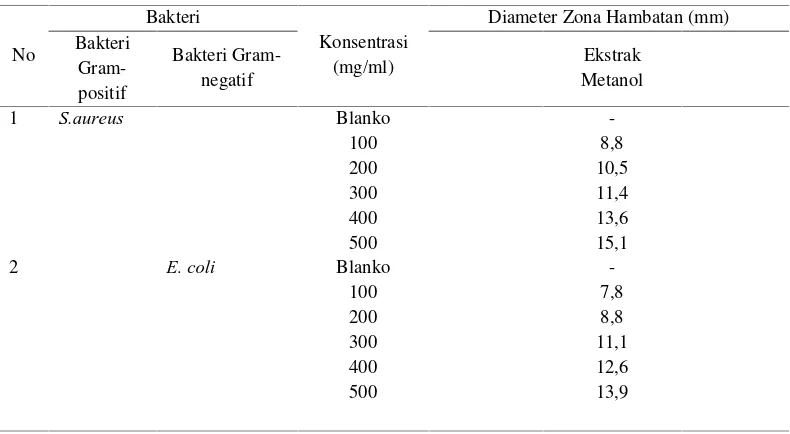
4.1.5 Hasil Uji Aktivitas Antibakteri Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera J.R. Forst & G. Forst) Seem
Hasil uji aktivitas antibakteri ekstrak metanol daun tumbuan loning dapat ditunjukkan pada Tabel 4.4 dibawah ini :
Tabel 4.4Hasil Uji Aktivitas Antibakteri Ekstrak Metanol daun tumbuhan loning.
a. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.
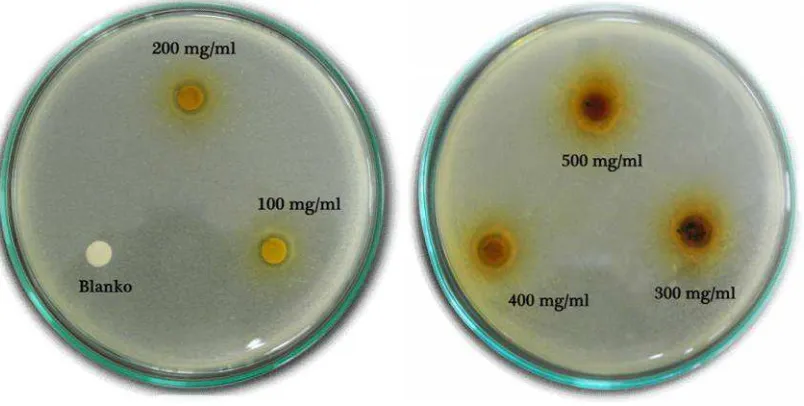
Aktivitas antibakteri ekstrak metanol daun tumbuhan loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem. ditentukan berdasarkan zona hambat yang terbentuk pada pertumbuhan beberapa bakteri yaituStaphylococcus aureusdanEscherichia coliseperti yang ditunjukkan pada Tabel 4.4 dan Gambar 4.2 dan 4.3 dibawah ini
Gambar 4.2 Zona hambat bakteriStaphylococcus aureusekstrak metanol
4.2 Pembahasan
4.2.1 Penentuan Kadar Air Serbuk Daun Tumbuhan Loning ( Pisonia
umbellifera (J.R. Forst & G. Forst) Seem.)
Dari hasil penelitian diperoleh kadar air untuk simplisia serbuk daun tumbuhan loning sebesar 9,5 %. Tujuan dari penentuan kadar air untuk mengetahui batas maksimum tentang besarnya kandungan air dalam bahan. Hal ini terkait dengan kemurnian dan adanya kontaminan dalam simplisia tersebut. Dengan demikian, penghilangan kadar air jumlah tertentu berguna untuk memperpanjang daya tahan bahan selama penyimpanan. Simplisia dinilai cukup aman bila mempunyai kadar air ± 10 %. Secara umum, pengeringan bertujuan untuk mencegah kerusakan kandungan zat aktif yang ada dalam tanaman sehingga dapat disimpan dalam jangka waktu yang lama. Kerusakan tersebut akibat peruraian zat aktif secara enzimatis seperti hidrolisis, oksidasi dan polimerisasi, sehingga rendemennya akan turun. Pada tumbuhan yang masih hidup reaksi enzimatik tidak terjadi karena adanya keseimbangan antara proses-proses metabolisme, yakni proses sintesis, transformasi dan penggunaan isi sel. Pengeringan harus dilakukan secepatnya sebab aktivitas enzim akan naik dengan adanya air dalam simplisia (Harborne, 1987).
4.2.2 Ekstraksi Daun Tumbuhan Loning
4.2.3 Skrining Fitokimia Kandungan Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
Skrining fitokimia dilakukan untuk memberikan gambaran tentang golongan senyawa yang terkandung dalam ekstrak. Hasil skrining fitokimia ekstrak metanol daun tumbuhan loning yang diperoleh dalam penelitian ini menunjukkan bahwa senyawa flavonoid, tannin, terpenoid, saponin dapat tertarik dalam pelarut metanol. Hal ini disebabkan karena metanol merupakan pelarut universal yang memiliki gugus polar (-OH) dan gugus nonpolar (-CH3) sehingga dapat menarik
analit-analit yang bersifat polar dan nonopolar. Flavonoid dan tannin merupakan bagian dari senyawa fenolik. Flavonoid mempunyai tipe yang beragam dan terdapat dalam bentuk bebas (aglikon) maupun terikat sebagai glikosida.
Aglikon polimetoksi bersifat nonpolar, aglikon polihidroksi bersifat semi polar, sedangkan glikosida flavonoid bersifat polar karena mengandung sejumlah gugus hidroksil dan gula ( Harborne, 1987; Markham, 1988). Oleh karena itu flavonoid dapat tertarik dalam pelarut metanol. Tannin ditunjukkan dari adanya perubahan warna setelah penambahan FeCI3 yang bereaksi dengan salah-satu
gugus hidroksil pada senyawa tannin. Penambahan FeCI3 menghasilkan warna
hijau kehitaman yang menunjukkan adanya tannin terkondensasi.
Untuk pereaksi Wagner ditandai dengan terbentuknya endapan coklat muda sampai kuning. Diperkirakan endapan tersebut adalah kalium-alkaloid. Pada uji ini ion logam K+ akan membentuk ikatan kovalen koordinat dengan nitrogen pada alkaloid membentuk kompleks kalium-alkaloid yang mengendap. Untuk pereaksi Mayer yang ditandai dengan terbentuknya endapan putih. Diperkirakan endapan tersebut adalah kompleks kalium-alkaloid. Untuk pereaksi Bouchardat yang ditandai dengan terbentuknya endapan coklat. Pada pengujian terpenoida, analisis senyawa didasarkan pada kemampuan senyawa tersebut membentuk warna dengan penambahan CeSO4 1% dalam H2SO4 10%. Hasil yang diperoleh
menunjukkan hasil positif dengan perubahan warna menjadi merah kecoklatan yang menunjukkan kandungan golongan terpenoida.
4.2.4 Uji Aktivitas Antioksidan Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.
Uji aktivitas antioksidan ekstrak metanol daun tumbuhan loning dapat dilakukan dengan metode DPPH dengan menggunakan alat spektrofotometri UV Visible.
Adapun mekanisme utama peredaman radikal DPPH adalah sebagai berikut :
DPPH + AH DPPH-H + A
Pada uji DPPH, peredaman radikal DPPH diikuti dengan pemantauan penurunan absorbansi pada panjang gelombang maksimum yang terjadi karena pengurangan radikal oleh antioksidan AH atau reaksi dengan spesi radikal (R)* yang ditandai dengan berubahnya warna ungu pada larutan menjadi warna kuning pucat, data yang sering digunakan sebagai IC50 merupakan konsentrasi antioksidan yang
Gambar 4.4 Kestabilan radikal bebas DPPH
Tabel 4.2 dan tabel 4.3 menunjukkan telah terjadi peredaman radikal bebas setelah penambahan ekstrak metanol dimana semakin tinggi konsentrasi maka % peredaman semakin besar yang ditandai dengan menurunnya absorbansi. Dari persamaan Y = ax + b dapat diketahui nilai IC50 dengan memasukkan nilai 50
sebagai sumbu Y, sehingga diperoleh berapa besar nilai x yang akan mempresentasikan besaran IC50 untuk ekstrak metanol daun tumbuhan loning
adalah sebesar 21, 67 ppm.
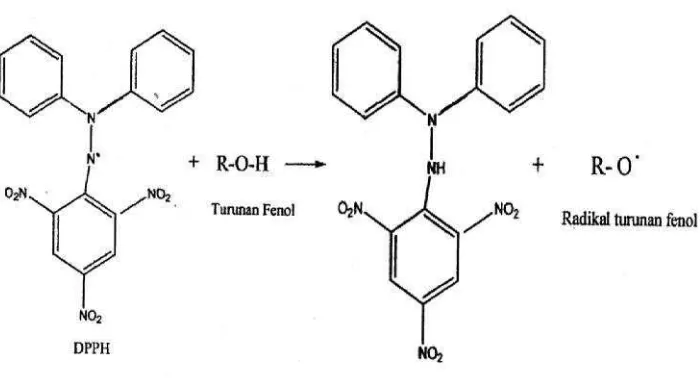
Gambar 4.5 Reaksi DPPH dengan turunan fenol
Pada senyawa polifenol, aktivitas antioksidan berkaitan erat dengan substitusi pada cincin aromatiknya. Kemampuan untuk bereaksi dengan radikal bebas DPPH dapat mempengaruhi urutan kekuatan antioksidannya. Aktivitas peredaman radikal bebas senyawa polifenol diyakini dipengaruhi oleh jumlah dan posisi hidrogen fenolik dalam molekulnya serta adanya gugus karbonil dan ikatan rangkap terkonjugasi pada inti fenolat yang menyebabkan delokalisasi elektron yang stabil. Dengan demikian aktivitas antioksidan yang lebih tinggi akan dihasilkan pada senyawa flavonoid yang mempunyai jumlah gugus hidroksil dan karbonil yang lebih banyak pada inti flavonoidnya. Senyawa fenolik ini mempunyai kemampuan untuk menyumbangkan hidrogen, maka aktivitas antioksidan senyawa fenolik pada reaksi netralisasi radikal bebas yang mengawali proses oksidasi atau pada penghentian reaksi radikal berantai yang terjadi. Hasil dari skrining fitokimia golongan senyawa yang bersifat sebagai antioksidan adalah senyawa flavonoid dan tannin.
Berdasarkan literatur (Ionita, 2005) dapat diketahui bahwa jika nilai IC50
Tingkat kekuatan senyawa antioksidan menggunakan DPPH dapat
4.2.5 Uji Aktivitas Antibakteri Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.
Pengujian aktivitas antibakteri bertujuan untuk mengetahui potensi aktivitas bakteri pada sampel uji. Metode pengujian aktivitas antibakteri yang digunakan dalam penelitian ini adalah metode difusi agar. Pada metode ini aktivitas antibakteri terhadap sampel uji ditunjukkan dengan terbentuknya zona hambat disekitar kertas cakram. Kertas cakram yang berisi agen antimikroba diletakkan pada media Agar yang telah ditanami mikroorganisme yang akan berdifusi pada media Agar tersebut. Area jernih mengindikasikan adanya penghambatan pertumbuhan mikroorganisme oleh agen antimikroba pada permukaan media Agar (Pratiwi, 2008). Pada penelitian ini menggunakan bakteri patogen yang berasal dari bakteri gram positif dan gram negatif yaitu Staphylococcus aureusdanEscherichia coli.
lemah untuk bakteri Escherichia coli dengan zona hambat 13,9 mm. Perbedaan diameter zona hambat pada kedua bakteri menunjukkan bahwa terdapat perbedaan sensitivitas ekstrak pada mikroba uji tersebut. Senyawa yang bersifat antimikroba dapat menyebabkan kerusakan pada dinding sel serta kerusakan pada membrane sel berupa denaturasi protein dan lemak yang menyusun membran sel. Ekstrak metanol daun tumbuhan loning lebih efektif menghambat pertumbuhan bakteri gram positif Staphylococcus aureus dibandingkan dengan bakteri gram negatif Escherichia coli, hal ini kemungkinan disebabkan karena aktivitas antibakteri dipengaruhi oleh beberapa faktor, yaitu konsentrasi ekstrak dan jenis bakteri yang dihambat( Jawetzet al, 2005).
Penelitian ini menunjukkan semakin tinggi konsentrasi ekstrak maka jumlah senyawa antibakteri yang dilepaskan semakin besar, sehingga mempermudah penetrasi senyawa tersebut kedalam sel dengan kata lain semakin tinggi konsentrasi ekstrak dan lama waktu kontak maka aktivitas antibakteri makin aktif, hal ini dinyatakan bahwa bakteri gram positif yang membran luarnya terdiri dari lapisan peptidoglikan yang lebih banyak dibandingkan gram negatif yang membran luarnya terdiri dari lipopolisakarida yaitu lipid, polisakarida dan protein (Pratiwi, 2008).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Berdasarkan uji skrining fitokimia ekstrak metanol daun tumbuhan loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.) mengandung golongan senyawa flavonoid, tannin, terpenoid dan saponin.
2. Hasil uji aktivitas antioksidan ekstrak metanol daun tumbuhan loning termasuk golongan antioksidan yang sangat kuat dimana ekstrak tersebut memiliki nilai IC50sebesar 21,67 ppm.
3. Hasil uji aktivitas antibakteri ekstrak metanol daun tumbuhan loning termasuk kategori sedang terhadap bakteri gram positif Staphylococcus aureus dan termasuk kategori lemah terhadap bakteri gram negatif Escherichia coli pada konsentrasi 500 mg/ml dengan zona hambat masing-masing 15,1 mm dan 13,9 mm.
3.4 Saran
1. Perlu dilakukan penelitian lebih lanjut isolasi dan elusidasi struktur komponen kimia senyawa yang bersifat antioksidan dan antibakteri dari ekstrak metanol daun tumbuhan loning (Pisonia umbellifera(J.R. Forst & G. Forst) Seem.)
BAB 2
TINJAUAN PUSTAKA
2.1. Daun Tumbuhan Loning ( Pisonia umbellifera ( J.R. Forst & G. Forst.) Seem)
Daun Tumbuhan Loning ( Pisonia umbellifera ( J.R. Forst & G. Forst.) Seem) merupakan salah satu tumbuhan dari suku Nyctaginaceae yang tumbuh di sekitar dataran tinggi Kabupaten Karo khususnya di Desa Lau Baleng. Tumbuhan ini dimanfaatkan oleh masyarakat sebagai obat luka pada hewan ternak, dengan cara mencampurkan daun tumbuhan loning ke makanan hewan ternak.
2.1.1 Taksonomi Daun Tumbuhan Loning
Klasifikasi daun tumbuhan loning hasil identifikasi tumbuhan di laboratorium Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi-LIPI Bogor , adalah sebagai berikut :
Kerajaan :Plantae
Divisi :Spermatophyta Kelas :Angiospermae Bangsa :Caryophyllales Familia :Nyctaginaceae Genus :Pisonia
Gambar 2.1 Tumbuhan Loning
2.2 Metabolit Sekunder
Senyawa kimia bermolekul besar merupakan bagian utama dalam organ tanaman kering. Senyawa bermolekul besar ini berfungsi sebagai pembentuk struktur tanaman (selulosa, kitin, lignin, dan pectin), sebagai cadangan makanan (amilum, protein, lipoprotein) atau untuk memenuhi fungsi metabolism penting lainnya ( protein dan enzim). Senyawa kimia dari tanaman yang berbeda-beda dapat diekstrak dengan pelarut umum (air, etanol, eter, benzene, eter minyak bumi) berupa senyawa kimia tanaman dengan molekul kecil. Senyawa kimia tanaman yang jumlahnya paling banyak adalah senyawa kimia bermolekul kecil dari kelompok yang disebut sebagai metabolit sekunder (Sirait, 2007).
Senyawa-senyawa kimia yang merupakan hasil metabolit sekunder pada tumbuhan sangat beragam dan dapat diklasifikasikan dalam beberapa golongan senyawa bahan alam yaitu :
2.2.1 Alkaloid
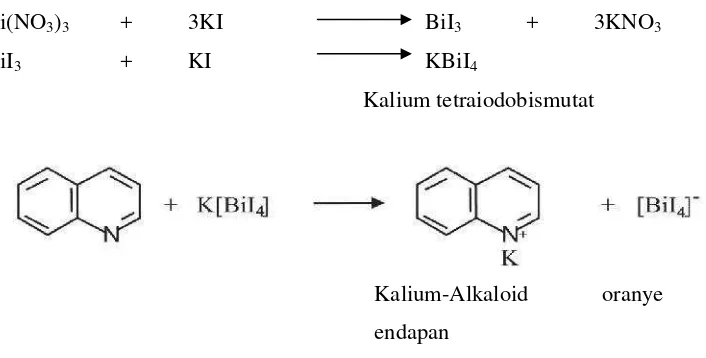
Dalam skrining fitokimia, bukti kualitatif untuk menunjukkan adanya alkaloida dapat diperoleh dengan menggunakan beberapa pereaksi diantaranya pereaksi Dragendorf, Wagner, Mayer, dan pereaksi Bouchardat. Untuk pereaksi Dragendorf yang ditandai dengan terbentuk warna jingga, Pada pembuatan pereaksi Dragendorf, bismut nitrat dilarutkan dalam HCl agar tidak terjadi reaksi hidrolisis karena garam-garam bismut mudah terhidrolisis membentuk ion bismutil (BiO+), pada uji alkaloid dengan dragendorf, nitrogen digunakan untuk membentuk ikatan kovalen koordinat dengan K+ yang merupakan ion logam. Reaksi pada uji Dragendorf ditunjukkan pada gambar 2.2
Bi(NO3)3 + 3KI BiI3 + 3KNO3
BiI3 + KI KBiI4
Kalium tetraiodobismutat
Kalium-Alkaloid oranye endapan
Gambar 2.2 Reaksi Alkaloid dengan Pereaksi Dragendorf ( Setyowatiet al, 2014)
Pada uji wagner ditandai dengan terbentuknya endapan coklat muda sampai kuning. Pada pembuatan pereaksi wagner, iodine bereaksi dengan ion I- dari kalium iodide menghasilkan ion I3- yang berwarna coklat. Pada uji wagner ion logam K+ akan membentuk ikatan kovalen koordinat dengan nitrogen pada alkaloid membentuk kompleks kalium-alkaloid yang mengendap. Reaksi yang terjadi pada uji wagner ditunjukkan pada gambar 2.3
I2 + I- I3
Kalium-Alkaloid Coklat endapan
Gambar 2.3 Reaksi Alkaloid dengan pereaksi Wagner ( Setyowatiet al, 2014)
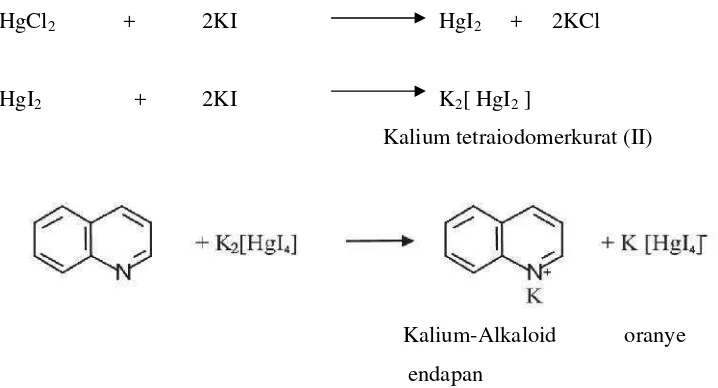
Pada pembuatan pereaksi Mayer, larutan merkurium (II) klorida ditambah kalium iodida akan bereaksi membentuk endapan merah merkurium (II) iodida. Jika kalium iodida yang ditambahkan berlebih maka akan terbentuk kalium tetraiodomerkurat (II). Alkaloid mengandung atom nitrogen yang mempunyai pasangan elektron bebas sehingga dapat digunakan untuk membentuk ikatan kovalen koordinat dengan ion logam. Pada uji alkaloid dengan pereaksi Mayer, diperkirakan nitrogen pada alkaloid akan bereaksi dengan ion logam K+ dari kalium tetraiodomerkurat (II) membentuk kompleks kalium-alkaloid yang mengendap (Setyowati et al, 2014). Reaksi yang terjadi pada uji Mayer ditunjukkan pada gambar 2.4.
HgCl2 + 2KI HgI2 + 2KCl
HgI2 + 2KI K2[ HgI2]
Kalium tetraiodomerkurat (II)
Kalium-Alkaloid oranye endapan
2.2.2 Flavonoid
Beberapa fungsi flavonoid yang terkandung pada tumbuhan ialah pengaturan tumbuh, pengaturan fotosintesis, kerja antimikroba dan antivirus. Efek flavonoid terhadap berbagai macam organisme sangat banyak macamnya dan dapat menjelaskan mengapa tumbuhan yang mengandung flavonoid dipakai dalam pengobatan tradisional. Flavonoid dapat bekerja sebagai inhibitor kuat pernapasan, juga sebagai senyawa pereduksi yang baik, menghambat banyak reaksi oksidasi, baik secara enzim maupun nonenzim. Flavonoid bertindak sebagai penampung yang baik radikal hidroksi dan superoksida dan melindungi membran lipid terhadap reaksi yang merusak ( Robinson, 1995).
Flavonoid adalah senyawa yang terdiri dari C6- C3- C6.Artinya, kerangka
Identifikasi adanya senyawa flavonoid dapat dilihat dengan penambahan serbuk Mg dan HCl pekat, jika terbentuk larutan warna jingga maka positif mengandung flavonoida.reaksinya dapat ditunjukkan pada gambar 2.5
Gambar 2.5 Reaksi Flavonoid dengan Mg dan HCI ( Setyowatiet al, 2014)
2.2.3 Terpenoid
Terpenoid mempunyai beberapa fungsi yang berbeda bagi tumbuhan itu sendiri, antara lain sebagai pengatur tumbuh; dua kelompok regulator pertumbuhan yang penting ialah seskuiterpenoid absisin dan diterpenoid giberelin. Terpenoid adalah senyawa alam yang terbentuk dengan proses biosintesis, terdistribusi luas dalam dunia tumbuhan dan hewan. Terpenoid ditemui tidak saja pada tumbuhan tingkat tinggi namun juga pada terumbu karang dan mikroba. Struktur terpenoiddibangun oleh molekul isoprene, CH2=C(CH3)-CH=CH2,
Karotenoid mempunyai peran penting sebagai senyawa warna tumbuhan dan hampir semua terpenoid C40 juga berperan sebagai pigmen biosintesis ( Sirait, 2007). Identifikasi adanya senyawa terpenoid dapat dilihat dengan penambahan CeSO41% dalam H2SO4 10%. Jika terbentuk endapan warna merah kecokelatan
maka positif mengandung terpenoida. Reaksinya dapat ditunjukkan pada gambar 2.6
Gambar 2.6 Reaksi Terpenoid dengan pereaksi CeSO4 dalam H2SO4 10%
( Setyowatiet al, 2014)
2.2.4 Saponin
Dapat mengiritasi membran mukosa. Saponin dapat membentuk senyawa kompleks dengan kolesterol. Sebagian besar saponin bereaksi netral (larut dalam air), beberapa ada yang bereaksi asam (sukar larut dalam air), sebagian kecil ada yang bereaksi basa. Aglikon dari saponin disebut sapogenin. Sapogenin sukar larut dalam air.
Saponin dapat berupa senyawa yang mempunyai satu rantai gula atau dua rantai gula yang sebagian besar bercabang. Saponin menyebabkan stimulasi pada jaringan tertentu misalnya, pada epitel hidung, bronkus, ginjal, dan sebagainya. Stimulasi pada ginjal diperkirakan menimbulkan efek diuretika. Sifat menurunkan tegangan muka yang ditimbulkan oleh saponin dapat dihubungkan dengan daya ekspektoransia. Dengan sifat ini lendir akan dilunakkan atau dicairkan. Saponin dapat mempertinggi resorpsi berbagai zat oleh aktivitas permukaan. Saponin juga dapat meregang partikel tak larut dan menjadikan partikel tersebut tersebar dan terbagi halus dalam larutan( Sirait, 2007) . Saponin telah dapat diaplikasikan secara industrial maupun secara komersial, seperti digunakan untuk soft drink, shampoo, pemadam kebakaran, sabun dan hormon steroid sintesis karena aglikonnya bersifat non polar. Aglikon pada saponin dikenal sebagai sapogenin sedangkan pada steroid sapogenin disebut saraponin (Widodo, 2005).
2.2.5 Tannin
Tannin merupakan senyawa polifenolik dengan bobot molekul yang tinggi dan mempunyai kemampuan mengikat protein. Tannin terdiri dari katekin, leukoantosiannin dan asam hidroksi yang masing-masing dapat menimbulkan warna bila bereaksi dengan ion logam. Senyawa-senyawa yang dapat bereaksi dalam proses penyamakan kulit kemungkinan besar terdiri dari katekin dengan berat molekul yang sedang, sedangkan katekin dengan berat molekul yang rendah ditemukan pada buah-buahan dan sayuran.
Tannin tidak dapat mengkristal dan berbentuk senyawa koloid. Tannin disebut juga asam tanat dan asam galotanat. Tannin mulai tidak berwarna sampai berwarna kuning atau coklat. Tannin terdiri dari dua kelompok, yaitu condensed tannin dan hydrolizable tannin. Kelompok condensed tannin merupakan tipe tannin yang terkondensasi, tahan terhadap degradasi enzim, tahan terhadap hidrolisa asam, dimetilai dengan penambahan metionin, sering kompleks susunannya dan banyak dijumpai dalam biji-bijian sorghum. Condensed tannin diperoleh dari kondensasi flavanol-flavanol seperti katekin dan epikatekin, tidak mengandung gula dan mengikat protein sangat kuat sehingga menjadi rusak (Widodo, 2005). Pengujian tannin dilakukan dengan penambahan FeCI3. Pada
penambahan ini tannin akan bereaksi dengan ion Fe3+ membentuk senyawa kompleks. Reaksi uji tannin dapat ditunjukkan pada gambar 2.6.
2.3 Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat aktif dari simplisia nabati dan simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang ditetapkan. Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari jaringan tumbuhan atau hewan dengan menggunakan penyari tertentu (Depkes RI, 2000).
Berdasarkan prinsipnya, proses ekstraksi dapat berlangsung bila terdapat kesamaan dalam sifat kepolaran antara senyawa yang diekstraksi dengan senyawa pelarut. Suatu zat memiliki kemampuan terlarut yang berbeda dalam pelarut yang berbeda. Hal ini menunjukkan adanya interaksi antara zat terlarut dengan pelarut. Senyawa polar akan larut dalam pelarut polar, begitu juga sebaliknya. Sifat penting yang harus diperhatikan dalam pemilihan pelarut adalah selekstivitas, kemampuan untuk mengekstrak, toksisitas, kemudahan untuk diuapkan dan harga (Harborne, 1987).
Suatu metode ekstraksi dengan menggunakan pelarut dapat dilakukan dengan beberapa cara yaitu :
1. Cara Dingin 1.1 Maserasi
Maserasi berasal dari kata macerace yang artinya melunakkan. Maserat adalah hasil penarikan simplisia dengan cara maserasi, sedangkan maserasi adalah cara penarikan simplisia dengan merendam simplisia tersebut dalam cairan penyari dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar, sedangkan remaserasi merupakan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama, dan seterusnya (Depkes, 2000). Keuntungan dari metode maserasi adalah prosedur dan peralatannya sederhana, sedangkan kerugiannya adalah pelarut yang digunakan lebih banyak (Agoes, 2007).
1.2 Perkolasi
antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh perkolat yang jumlahnya 1-5 kali bahan (Harborne, 1987).
2. Cara Panas 2.1 Sokletasi
Sokletasi adalah ekstraksi kontinu menggunakan alat soklet, dimana pelarut akan terdestilasi dari labu menuju pendingin, kemudian jatuh membasahi dan merendam sampel yang mengisi bagian tengah alat soklet, setelah pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi, demikian berulang-ulang (Depkes, 2000).
2.2 Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya selama waktu tertentu dan pelarut akan terdestilasi menuju pendingin dan akan terdestilasi menuju pendingin dan akan kembali ke labu (Depkes, 2000).
2.3 Infudasi
Infudasi adalah ekstraksi dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98oC) selama waktu tertentu (15-20 menit) (Depkes RI, 2000).
2.4 Dekoktasi
Dekoktasi adalah infus pada waktu yang lebih lama (30 menit) dan temperatur sampai titik didih air (Depkes RI, 2000).
2.4 Antioksidan
Antioksidan adalah zat penghambat reaksi oksidasi akibat radikal bebas yang dapat menyebabkan kerusakan asam lemak tak jenuh, membran dinding sel, pembuluh darah, basa DNA, dan jaringan lipid sehingga menimbulkan penyakit (Subeki,1998). Suatu tanaman memiliki aktivitas antioksidan apabila mengandung senyawaan yang mampu menangkal radikal bebas seperti fenol dan flavonoid.
Secara alami beberapa jenis tumbuhan merupakan sumber antioksidan, hal ini dapat ditemukan pada beberapa jenis sayuran, buah-buahan segar, beberapa jenis tumbuhan dan rempah-rempah (Dalimarta dan Soedibyo,1998). Selain itu antioksidan juga dapat menetralisir radikal bebas sehingga atom dengan elektron yang tidak berpasangan mendapat pasangan elektron sehingga tidak reaktif lagi (Kosasih et al,2004). Tubuh manusia sebenarnya memproduksi beberapa jenis enzim antioksidan yaitu superperoksida dimutase (SOD), katalase, dan glutation peroksidase. Enzim –enzim antioksidan ini sangat ampuh menetralisir berbagai tipe penyakit yang muncul karena adanya serangan radikal bebas (Kosasihet al,2004).
Berdasarkan mekanisme kerjanya, antioksidan dapat dikelompokkan menjadi 3 kelompok yaitu :
1. Antioksidan primer ( antioksidan endogen atau antioksidan enzimatis). Contohnya enzim Superoside Dismutase, katalase dan Glutation peroksidase. Enzim-enzim ini mampu menekan atau mengambat pembentukan radikal bebas dengan cara memutus reaksi berantai dan mengubahnya menjadi produk lebih stabil.
2. Antioksidan sekunder ( antioksidan eksogen atau antioksidan nonenzimatis). Contoh antioksidan sekunder ialah Vitamin E, Vitamin C, β-karoten, isoflavon, asam urat, bilirubin, dan albumin. Senyawa-senyawa ini dikenal sebagai penangkap radikal bebas, kemudian mencegah amplifikasi radikal.
Gambar 2.9. Mekanisme reaksi senyawa antioksidan dengan DPPH ( Bintang, 2010)
Berdasarkan mekanisme tersebut, maka dapat dikatakan bahwa senyawa antioksidan mempunyai sifat yang relatif stabil dalam bentuk radikalnya. Senyawa-senyawa yang berpotensi sebagai antioksidan dapat diprediksi dari golongan fenolat, flavonoid, dan alkaloid, yang merupakan senyawa polar.
Aktivitas antioksidan merupakan kemampuan suatu senyawa atau ekstrak untuk menghambat reaksi oksidasi yang dapat dinyatakan dengan persen penghambatan. Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah harga konsentrasi efesien atau efficient concentration 50 (EC50) atau inhibition
concentration ( IC50), yaitu konsentrasi suatu zat antioksidan yang dapat
Radikal bebas merupakan suatu molekul yang sangat reaktif karena mempunyai satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif karena kehilangan satu atau lebih elektron yang bermuatan listrik, dan untuk mengembalikan keseimbangannya maka radikal bebas berusaha mendapatkan elektron dari molekul lain atau melepas elektron yang tidak berpasangan tersebut. Radikal bebas dalam jumlah berlebih di dalam tubuh sangat berbahaya karena menyebabkan kerusakan sel, asam nukleat, protein dan jaringan lemak. Radikal bebas terbentuk di dalam tubuh akibat produk sampingan proses metabolisme ataupun karena tubuh terpapar radikal bebas melalui pernapasan (Dalimartha dan Soedibyo, 1998).
Ketika radikal bebas menempel pada molekul yang berpasangan, yang dilakukan hanyalah merusak DNA sel-sel molekul tersebut untuk membentuk keseimbangan elektron agar proses metabolisme tubuh berjalan normal. Tetapi ketika dua radikal bebas yang mencari pasangan bertemu, mereka akan menciptakan hubungan yang stabil.
Pengukuran aktivitas antioksidan dapat dilakukan dengan beberapa metode yaitu CUPRAC, DPPH, dan FRAP :
1. Metode CUPRAC (cupric ion reducing antioxidant capacity)
Prinsip dari uji CUPRAC (Cupric Ion Reducing Antioxidant Capasity) adalah pembentukan kelat oleh bis (neukropin) besi(II) menggunakan pereaksi redoks kromogenik pada pH 7. Absorbansi dari pembentukan kelat Cu(I) merupakan hasil reaksi redoks dengan mereduksi polifenol yang diukur pada panjang gelombang 450 nm. Untuk spektrum Cu(I) Ne diperoleh dengan mereaksikan asam askorbat berbagai konsentrasi reagen, pH dan waktu oksidasi pada suhu kamar dan peningkatan suhu pada percobaan dapat berasal dari sumber lain.
Metode CUPRAC menggunakan bis (neokuproin) tembaga (II) (Cu(Nc)22+
sebagai pereaksi kromogenik. Pereaksi Cu(Nc) 22+ yang berwarna biru akan
mengalami reduksi menjadi Cu(Nc)2+yang berwarna kuning dengan reaksi: nCu(Nc)22+ +AR(OH)n→ nCu(Nc)2++AR(=O)n+nH+
Kelebihan dari metode CUPRAC adalah pereaksi yang digunakan cukup cepat bekerja, selektif, lebih stabil, mudah didapatkan dan mudah untuk diaplikasikan (Erawati, 2002).
2. Metode DPPH (2,2-difenil-1- pikrilhidrazil)
Menggunakan 2,2 difenil-1- pikrilhidrazil sebagai sumber radikal bebas. Prinsipnya adalah reaksi penangkapan hidrogen oleh DPPH dari zat antioksidan. (Apaket al.,2007).
hidrofilik yang terekstrak dalam metanol lebih banyak dibandingkan dalam pelarut etanol. Metode DPPH ini mudah digunakan, cepat, cukup teliti dan baik digunakan dalam pelarut organik, khususnya alkohol. Metode ini juga sensitif untuk menguji aktivitas antioksidan dalam ekstrak tanaman (Widyastuti, 2010).
Gambar 2.10. Reaksi antara antioksidan (flavonoid) dengan radikal DPPH ( Molyneux, 2004)
3. Metode FRAP (ferric reducing antioxidant power)
Metode FRAP menggunakan Fe(TPTZ)23+ kompleks besi-ligan
2,4,6-tripiridil-triazin sebagai pereaksi. Kompleks biru Fe(TPTZ)23+ akan berfungsi
Fe(TPTZ)23+ + AROH→ Fe(TPTZ)22+ + H+ + AR=O
Pengujian antiradikal bebas senyawa-senyawa bahan alam atau hasil sintesis secara UV-Tampak dapat dilakukan secara kimia menggunakan DPPH (difenilpikril hidrazil). DPPH berfungsi sebagai senyawa radikal bebas stabil yang ditetapkan secara spektrofotometri melalui persen peredaman absorbansi. Peredaman warna ungu merah pada panjang gelombang (λ) 517 nm dikaitkan dengan kemampuan metabolit sekunder sebagai antiradikal bebas.
Kereaktifan dari golongan senyawa-senyawa yang berfungsi sebagai antiradikal bebas ditentukan adanya gugus fungsi –OH (hidroksil) bebas dan ikatan rangkap karbon-karbon seperti flavon,flavanon,skualen,tokoferol,βkaroten,Vitamin C dan lain-lain (Widyastuti, 2010).
2.5 Bakteri
Bakteri adalah mikroorganisme bersel tunggal yang tidak terlihat oleh mata, tetapi dapat dilihat dengan bantuan mikroskop. Ukuran bakteri berkisar antara panjang 0,5 sampai 10µ dan lebar 0,5 sampai 2,5µ (µ = 1 mikron = 0,001mm) tergantung dari jenisnya. Bakteri terdapat secara luas dilingkungan alam yang berhubungan dangan hewan,udara,air dan tanah. Bakteri berkembang biak secara aseksual yaitu dengan proses pembelahan diri menjadi dua (Buckle, 2007).
warna kontras, akan berwarna sesuai dengan zat warna kontras. Bakteri yang memperlihatkan reaksi semacam ini dinamakan bakteri Gram negatif (Irianto, 2006).
Kelompok mikroorganisme yang paling penting dan beraneka ragam, yang berhubungan dengan makanan dan manusia adalah bakteri. Adanya bakteri dalam bahan pangan dapat mengakibatkan pembusukan yang tidak diinginkan atau menimbulkan penyakit yang ditularkan melalui makanan. Bakteri adalah mikroorganisme bersel tunggal yang tidak terlihat oleh mata (Buckle, 2007). Berdasarkan perbedaan respons terhadap prosedur pewarnaan gram dan strktur dinding bakteri, bakteri diklasifikasikan menjadi bakteri gram negatif dan bakteri gram positif.
2.5.1 Bakteri gram positif
Bakteri gram positif lebih sensitif terhadap penisilin, tetapi lebih tahan terhadap perlakuan fisik dibandingkan bakteri gram negatif. Bakteri gram positif sering berubah sifat pewarnaannya sehingga menunjukkan reaksi gram variabel. Sebagai contoh, kultur gram positif yang sudah tua dapat kehilangan kemampuannya untuk menyerap pewarna violet kristal sehingga dapat berwarna merah seperti bakteri gram negatif. Perubahan tersebut dapat juga disebabkan oleh perubahan kondisi lingkungan atau modifikasi teknik pewarnaan (Fardiaz, 1992).
Contoh dari bakteri gram positif :
Gambar 2.11. BakteriStaphylococcus aureus
2.5.2 Bakteri gram negatif
Bakteri gram negatif lebih sensitif terhadap antibiotik lainnya seperti streptomisin dan bersifat lebih konstan terhadap reaksi pewarnaan (Fardiaz, 1992). Dinding sel bakteri gram negatif tersusun atas satu lapisan peptidoglikan dan membran luar. Dinding selnya tidak mengandungteichoic acid. Membran luar terususun atas lipopolisakarida, lipoprotein dan pospolipid (Tortora, 2001).
Contoh bakteri gram negatif :
Escherichia berbatang pendek. Habitat utamanya adalah usus manusia dan hewan. Escherichia coli dipakai sebagai organisme indikator, karena jika terdapat dalam jumlah yang banyak menunjukkan bahwa pangan atau air telah mengalami pencemaran (Gaman, 1992).
Untuk mencegah pencemaran ini dapat digunakan senyawa golongan polifenol dimana senyawa ini mampu untuk membentuk kompleks larut dengan protein, mengganggu pemanfaatan protein, efek ini dapat diwujudkan dalam penurunan laju pertumbuhan dan / atau konversi pakan, serta produksi telur yang lebih rendah. Polifenol dikenal untuk mengikat protein dalam bir, anggur dan jus buah, yang mengakibatkan kekeruhan yang tidak diinginkan dan koloid kabut. Fenol teroksidasi dapat bereaksi dengan asam amino dan protein dan menghambat aktivitas enzim seperti tripsin dan lipase. Tanin, yang merupakan polimer dari senyawa fenolik, telah diteliti untuk interaksi dengan protein, banyak penelitian tentang faktor-faktor yang mempengaruhi interaksi tannin-protein, seperti pH, suhu, struktur fenolik, ukuran protein, dan komposisi asam amino. (Viljanen, 2005). Salah-satu contoh reaksi antara protein lisin dengan polifenol ditunjukkan oleh reaksi berikut.
Gambar 2.13. Reaksi antara protein Lisin dengan polifenol (Viljanen, 2005).
2.5 Spektrofotometer UV-VIS
larutan. Spektrum UV-Vis mempunyai bentuk yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari spektrum ini.
Tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Konsentrasi dari analit di dalam larutan bias ditentukan dengan mengukur absorban pada panjang gelombang tertentu dengan menggunakan hukum Lambert-Beer. Hukum Lambert-beer adalah hubungan linearitas antara absorban dengan konsentrasi larutan analit. Hukum Lambert-beer dapat ditulis dengan :
A = ɛ . b . C
A = absorban (serapan)
ɛ = koefisien ekstingsi molar ( M-1cm-1) b = tebal kuvet (cm)
C = konsentrasi (M)
ɛ = A / b . C
BAB I
PENDAHULUAN
1.1. Latar Belakang
Secara umum tanaman menghasilkan senyawa-senyawa metabolit sekunder yang dapat digunakan untuk mengobati berbagai jenis penyakit. Golongan senyawa metabolit sekunder adalah alkaloid, flavonoid, saponin, tannin, steroid dan triterpenoid (Harborne, 1987). Kemampuan yang dimiliki suatu tanaman didukung dari metabolit sekunder yang terkandung di dalamnya. Faktor iklim yang didalamnya termasuk suhu udara, sinar matahari,kelembaban udara dan angin serta keadaan tanah sangat berpengaruh terhadap proses pertumbuhan tanaman hingga variasi metabolit sekunder yang terkandung (Artiniet al. 2013).
Peneliti sebelumnya telah meneliti ekstrak etil asetat daun kol banda (Pisonia alba Span), yang merupakan suku dariNyctaginaceae terhadap bakteri Stapylococcus aureus dan pada bakteri Eschericia coli menunjukkan ekstrak ini dikategorikan sedang (Jayakumariet al, 2014).
1.2. Permasalahan
Permasalahan dalam penelitian ini adalah
3. Bagaimanakah aktivitas antioksidan ekstrak metanol daun tumbuhan loning?
1.3. Pembatasan Masalah
Dalam penelitian ini masalah dibatasi pada :
1. Bagian tanaman yang diekstraksi adalah daun tumbuhan loning
2. Analisa pendahuluan untuk daun tumbuhan loning yaitu uji skrining fitokimia.
3. Bakteri yang digunakan untuk uji aktivitas antibakteri yaitu Staphylococcus aureusdanEscherichia coli
4. Variasi konsentrasi untuk uji aktivitas antibakteri 100, 200, 300, 400, dan 500 mg/ml
5. Variasi konsentrasi untuk uji antioksidan antioksidan 20, 40, 60, dan 80 ppm
6. Pelarut yang digunakan untuk ekstraksi yaitu Metanol
7. Metode yang digunakan untuk uji aktivitas antioksidan yaitu DPPH (2,2-diphenyl- 1-picryl-hydrazil)
1.4. Tujuan Penelitian
1. Golongan senyawa metabolit sekunder apakah yang terdapat didalam daun tumbuhan loning ( Pisonia umbellifera ( J.R. Forst & G. Forst.) Seem) berdasarkan uji skrining fitokimia ?
3. Untuk mengetahui aktivitas antioksidan ekstrak metanol daun tumbuhan loning
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai senyawa metabolit sekunder yang terdapat didalam ekstrak metanol daun tumbuhan loning (Pisonia umbellifera ( J.R. Forst & G. Forst.), aktivitas antioksidan dan aktivitas antibakteri.
1.6. Lokasi Penelitian
Untuk skrining fitokimia daun tumbuhan loning (Pisonia umbellifera (J.R. Forst & G. Forst.) dilakukan di Laboratorium Kimia Organik Bahan Alam FMIPA USU Medan, untuk ekstraksi daun tumbuhan loning dilakukan di Laboratorium Kimia Organik FMIPA USU Medan, untuk uji aktivitas Antioksidan di Laboratorium Kimia Departemen Kimia FMIPA USU dan untuk uji aktivitas Antibakteri dilakukan di Laboratorium Mikrobiologi Fakultas Farmasi USU Medan.
1. Untuk mengetahui golongan senyawa metabolit sekunder yang terdapat di dalam daun tumbuhan loning (Pisonia umbellifera (J.R. Forst & G. Forst.) Seem) berdasarkan uji skrining fitokimia
1.7. Metodologi Penelitian
Ekstrak yang dihasilkan diuji skrining fitokimia, lalu diuji aktivitas antioksidan dengan menggunakan DPPH (2,2-diphenyl-1-pycril-hydrazil) dan antibakteri terhadap bakteri Staphylococcus aureusdan Escherichia colidengan menggunakan metode difusi agar.
UJI AKTIVITAS ANTIOKSIDAN DAN ANTIBAKTERI EKSTRAK METANOL DAUN TUMBUHAN LONING
(Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
ABSTRAK
Skrining fitokimia, uji aktivitas antioksidan dan antibakteri telah dilakukan terhadap ekstrak metanol daun tumbuhan loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.). Serbuk daun tumbuhan loning diekstraksi dengan metanol selama 2 x 24 jam secara maserasi. Kemudian diuji aktivitas antioksidan dengan metode DPPH dan aktivitas antibakteri dengan metode difusi agar. Hasil uji skrining fitokimia ekstrak metanol daun tumbuhan loning terdapat senyawa golongan flavonoid, tannin, terpenoid, dan saponin. Aktivitas antioksidan ekstrak metanol daun tumbuhan loning termasuk kategori sangat kuat dengan nilai IC50
sebesar 21,67 ppm. Aktivitas antibakteri ekstrak metanol daun tumbuhan loning termasuk kategori sedang terhadap bakteri gram positif Staphylococcus aureus pada konsentrasi 500 mg/mL dengan zona hambat 15,1 mm dan termasuk kategori lemah terhadap bakteri gram negatif Escherichia coli pada konsentrasi 500 mg/mL dengan zona hambat 13,9 mm.
THE TESTED ANTIOXIDANT AND ANTIBACTERIAL ACTIVITIES METHANOL EXTRACT FROM LONING LEAVES PLANT
(Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
ABSTRACT
Phytochemical screening, antioxidant and antibacterial test was activity carried out on the methanol extract from loning leaves plant (Pisonia umbellifera(J.R. Forst & G. Forst) Seem.). The powder of loning leaves plant with methanol for 2 x 24 hours by maceration. Then tested with DPPH antioxidant activity and antibacterial activity by the agar diffusion method. The tested phytochemical screening results methanol extract of loning leaves plant contained flavonoids, tannins, terpenoids and saponins. The antioxidant activity methanol extract of loning leaves plant including the category very strong with 21,67 ppm IC50values.
The antibacterial activity methanol extract of loning leaves plant including the category intermediate at gram positive bacteria Staphylococcus aureus with concentration of 500 mg/mL showed activity with 15,1 mm diameters respectively and including the category resistant at gram negative bacteria Eschericia coli with concentration of 500 mg/mL showed activity with 13,9 mm diameters respectively.
UJI AKTIVITAS ANTIOKSIDAN DAN ANTIBAKTERI
EKSTRAK METANOL DAUN TUMBUHAN LONING
(Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
SKRIPSI
SURYA LESMANA
140822023
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
UJI AKTIVITAS ANTIOKSIDAN DAN ANTIBAKTERI
EKSTRAK METANOL DAUN TUMBUHAN LONING
(Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat
mencapai gelar Sarjana Sains
SURYA LESMANA
140822023
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Uji Aktivitas Antioksidan dan Antibakteri
Ekstrak Metanol Daun Tumbuhan Loning (Pisonia Umbellifera(J.R. Forst & G. Forst.) Seem).
Kategori : Skripsi
Nama : Surya Lesmana
Nomor Induk Mahasiswa : 140822023
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui
Medan, Oktober 2016
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dra. Herlince Sihotang, M.Si Dr. Firman Sebayang, MS NIP. 195503251986012002 NIP. 195607261985031001
Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
UJI AKTIVITAS ANTIOKSIDAN DAN ANTIBAKTERI EKSTRAK METANOL DAUN TUMBUHAN LONING
(Pisonia umbellifera (J.R.Forst & G. Forst) Seem.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Oktober 2016
PENGHARGAAN
Puji syukur saya ucapkan kepada Tuhan Yang Maha Esa atas Berkat dan Karunia-Nya yang telah diberikan kepada penulis, sehingga penulis dapat menyelesaikan Skripsi ini dengan baik.
Skripsi ini disusun sebagai salah satu syarat dalam rangka menyelesaikan program Sarjana (S1) Kimia FMIPA USU Medan yang ditulis berdasarkan pengamatan dan analisa penulis dengan judul ”Uji Aktivitas Antioksidan dan Antibakteri Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)”.
Skripsi ini dapat ditulis dan terwujud atas bantuan dan bimbingan dari berbagai pihak secara langsung maupun secara tidak langsung. Oleh karena itu, dengan segala kerendahan hati penulis mengucapkan terima kasih kepada :
1. Bapak Dr. Kerista Sebayang, MS selaku Dekan FMIPA USU.
2. Ibu Dr. Rumondang Bulan Nst, MS selaku Ketua Departemen Kimia FMIPA USU dan bapak Drs. Albert Pasaribu, M.Sc selaku Sekretaris Departemen Kimia FMIPA USU.
3. Bapak Dr. Darwin Yunus Nst, MS, selaku Koordinator Program S1 Kimia Ekstensi
4. Bapak Dr. Firman Sebayang, MS selaku Dosen Pembimbing 1 dan Ibu Dra. Herlince Sihotang, M.Si selaku Dosen Pembimbing 2 penulis yang telah banyak membimbing, memberikan masukan dan petunjuk sehingga penulis dapat menyelesaikan Skripsi ini.
5. Bapak Dr. Lamek Marpaung, M.Sc selaku Kepala Laboratorium Kimia Organik Bahan Alam FMIPA USU yang telah banyak membimbing, memberikan masukan dan petunjuk sehingga penulis dapat menyelesaikan Skripsi ini.
6. Bapak Dr. Panal Sitorus, M.Si. Apt. selaku Kepala Laboratorium Mikrobiologi Fakultas Farmasi USU yang telah banyak membantu penulis dalam menyelesaikan Skripsi ini.
7. Kedua orang tua saya yang sangat saya sayangi, ayah saya Charles Ginting dan ibu saya Rosalina br Surbakti, SH yang telah banyak memberikan bantuan berupa doa dan dukungan moril maupun materil selama penulisan Skripsi ini.
Saya menyadari skripsi ini masih jauh dari kesempurnaan. Oleh karena itu saya mengharapkan kritik dan saran yang bersifat membangun demi perbaikan skripsi ini. Semoga skripsi ini dapat berguna bagi para pembaca umumnya, dan bagi penulis khususnya.
Saya berharap apa yang saya sajikan sekarang ini tidak hanya menjadi sebuah persyaratan saja, tetapi juga bisa menjadi referensi untuk rekan – rekan mahasiswa.
UJI AKTIVITAS ANTIOKSIDAN DAN ANTIBAKTERI EKSTRAK METANOL DAUN TUMBUHAN LONING
(Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
ABSTRAK
Skrining fitokimia, uji aktivitas antioksidan dan antibakteri telah dilakukan terhadap ekstrak metanol daun tumbuhan loning (Pisonia umbellifera (J.R. Forst & G. Forst) Seem.). Serbuk daun tumbuhan loning diekstraksi dengan metanol selama 2 x 24 jam secara maserasi. Kemudian diuji aktivitas antioksidan dengan metode DPPH dan aktivitas antibakteri dengan metode difusi agar. Hasil uji skrining fitokimia ekstrak metanol daun tumbuhan loning terdapat senyawa golongan flavonoid, tannin, terpenoid, dan saponin. Aktivitas antioksidan ekstrak metanol daun tumbuhan loning termasuk kategori sangat kuat dengan nilai IC50
sebesar 21,67 ppm. Aktivitas antibakteri ekstrak metanol daun tumbuhan loning termasuk kategori sedang terhadap bakteri gram positif Staphylococcus aureus pada konsentrasi 500 mg/mL dengan zona hambat 15,1 mm dan termasuk kategori lemah terhadap bakteri gram negatif Escherichia coli pada konsentrasi 500 mg/mL dengan zona hambat 13,9 mm.
THE TESTED ANTIOXIDANT AND ANTIBACTERIAL ACTIVITIES METHANOL EXTRACT FROM LONING LEAVES PLANT
(Pisonia umbellifera (J.R. Forst & G. Forst) Seem.)
ABSTRACT
Phytochemical screening, antioxidant and antibacterial test was activity carried out on the methanol extract from loning leaves plant (Pisonia umbellifera(J.R. Forst & G. Forst) Seem.). The powder of loning leaves plant with methanol for 2 x 24 hours by maceration. Then tested with DPPH antioxidant activity and antibacterial activity by the agar diffusion method. The tested phytochemical screening results methanol extract of loning leaves plant contained flavonoids, tannins, terpenoids and saponins. The antioxidant activity methanol extract of loning leaves plant including the category very strong with 21,67 ppm IC50values.
The antibacterial activity methanol extract of loning leaves plant including the category intermediate at gram positive bacteria Staphylococcus aureus with concentration of 500 mg/mL showed activity with 15,1 mm diameters respectively and including the category resistant at gram negative bacteria Eschericia coli with concentration of 500 mg/mL showed activity with 13,9 mm diameters respectively.
DAFTAR ISI
2.2.2 Flavonoid 2.6 Spektrofotometri UV-Visible
Bab 3. Metodologi Penelitian Daun Tumbuhan Loning (Pisonia
umbellifera(J.R. Forst & G. Forst)Seem. 3.3.3 Uji Skrining Fitokimia
3.3.5 Pengujian aktivitas Antibakteri Ekstrak Metanol
3.3.5.1 Pembuatan Media Nutrien Agar (NA) Miring Dan Sub Kultur Bakteri 3.3.5.2 Pembuatan Media Muller Hinton
Agar (MHA)
3.3.5.3 Pembuatan Media Nutrient Broth (NB)
3.4.1 Skrining Fitokimia Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbellifera(J.R. Forst & G. Forst) Seem.)
3.4.2 Ekstraksi Serbuk Daun Tumbuhan Loning dengan Pelarut Metanol
3.4.3Uji Aktivitas Antioksidan Ekstrak Metanol Daun Tumbuhan Loning
3.4.4 Uji Aktivitas Antibakteri Ekstrak Metanol Daun
Bab 4. Hasil dan Pembahasan 4.1 Hasil Penelitian
4.1.1 Penentuan Kadar Air Serbuk Daun Tumbuhan Loning (P. umbelliferaJ.R. Forst & G. Forst) Seem
4.1.2 Ekstraksi Daun Tumbuhan Loning 4.1.3 Skrining Fitokimia Ekstrak Metanol
4.1.4 Hasil Uji Aktivitas Antioksidan Ekstrak Metanol Daun Tumbuhan Loning (Pisonia umbelliferaJ.R. Forst & G. Forst) Seem 4.1.4 Hasil Uji Aktivitas Antibakteri Ekstrak
Metanol Daun Tumbuhan Loning
4.2 Pembahasan
4.2.1 Penentuan Kadar Air Serbuk Daun Tumbuhan Loning (Pisonia umbelliferaJ.R. Forst & G. Forst) Seem
4.2.2 Ekstraksi Daun Tumbuhan Loning
4.2.3 Skrining Fitokimia Kandungan Ekstrak Metanol Daun Tumbuhan Loning
4.2.5 Uji Aktivitas Antibakteri Ekstrak Metanol Daun Tumbuhan Loning
Bab 5. Kesimpulan dan Saran 5.1 Kesimpulan 5.2 Saran
DaftarPustaka
Lampiran
45
45
46
47
50
53 53 53
54
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1 Skrining Fitokimia Ekstrak Metanol Daun Tumbuhan 41 Loning (Pisonia umbellifera(J.R. Forst & G. Forst) Seem.) 4.2 Pengukuran Absorbansi Ekstrak Metanol Daun Tumbuhan 42
Loning
4.3 Persamaan Garis Regresi dan Nilai IC50yang diperoleh dari 43
Ekstrak Metanol Daun Tumbuhan Loning